Плотность меди в кг м3 в физике
Люди с давних времен используют медь в повседневной жизни. Очень важным параметром для современных людей является ее плотность и удельный вес.
Эти данные применяют в расчетах состава материалов в производстве различных коммуникаций, деталей, изделий и комплектующих в технической отрасли.
Основная информация о меди
Медь является наиболее распространенным цветным металлом. Свое название на латинском языке – Cuprum – она получила в честь острова Кипр. Там ее добывали древние греки тысячи лет назад. Историки даже придумали Медный Век, который длился с IV по V столетие до н. э. В то время люди делали из популярного металла:
В таблице Д.И. Менделеева она занимает 29 место. Этот элемент имеет уникальные свойства -физические, химические и механические. В древние времена в естественной среде можно было найти медь в виде самородков, порой очень больших размеров. Люди нагревали породу на открытом огне, а затем резко охлаждали. В результате она растрескивалась, что позволяло выполнять восстановление металла. Такая нехитрая технология позволила начать освоение популярного элемента.
В результате она растрескивалась, что позволяло выполнять восстановление металла. Такая нехитрая технология позволила начать освоение популярного элемента.
Свойства
Медь — это цветной металл красноватого цвета с розовым отливом, наделенный высокой плотностью. В природе насчитывается более 170 видов минералов, имеющих в своем составе Cuprum. Только из 17 ведется промышленная добыча этого элемента. Основная масса этого химического элемента содержится в составе рудных металлов:
- халькозина — до 80%;
- бронита — до 65%;
- ковелина — до 64%.
Из этих минералов осуществляется обогащение меди и ее выплавка. Высокая теплопроводность и электропроводность являются отличительными свойствами цветного металла. Он начинает плавиться при температуре 1063 о С, а закипает при 2600 о С. Марка Cuprum будет зависеть от способа производства. Металл бывает:
Для каждого типа есть свои специальные параметрические расчеты, характеризующие степень сопротивления сдвигу, деформацию под воздействием нагрузок и сжатия, а также показатель упругости при растяжении материала.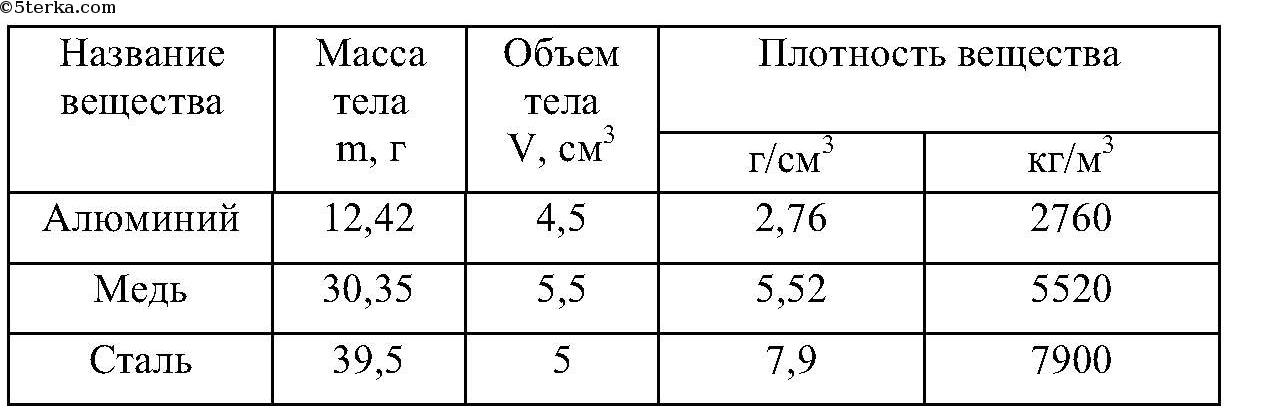
Цветной металл активно окисляется в процессе нагревания. При температуре 385 о С формируется оксид меди. Ее содержание снижает теплопроводность и электропроводность других металлов. При взаимодействии с влагой металл образует куприт, с кислой средой – купорос.
Удельная плотность меди
Благодаря своим свойствам этот химический элемент активно используется в производстве электрических и электронных систем и многих других изделий другого назначения. Важнейшим свойством является его плотность в 1 кг на м 3 , поскольку с помощью этого показателя определяется вес производимого изделия. Плотность показывает отношение массы к общему объему.
Самой распространенной системой измерения единиц плотности является 1 килограмм на м 3 . Этот показатель для меди равняется 8,93 кг/м 3 . В жидком виде плотность будет на уровне 8,0 г/см 3 . Общий показатель плотности может меняться в зависимости от марки металла, имеющего различные примеси. Для этого используется удельный вес вещества.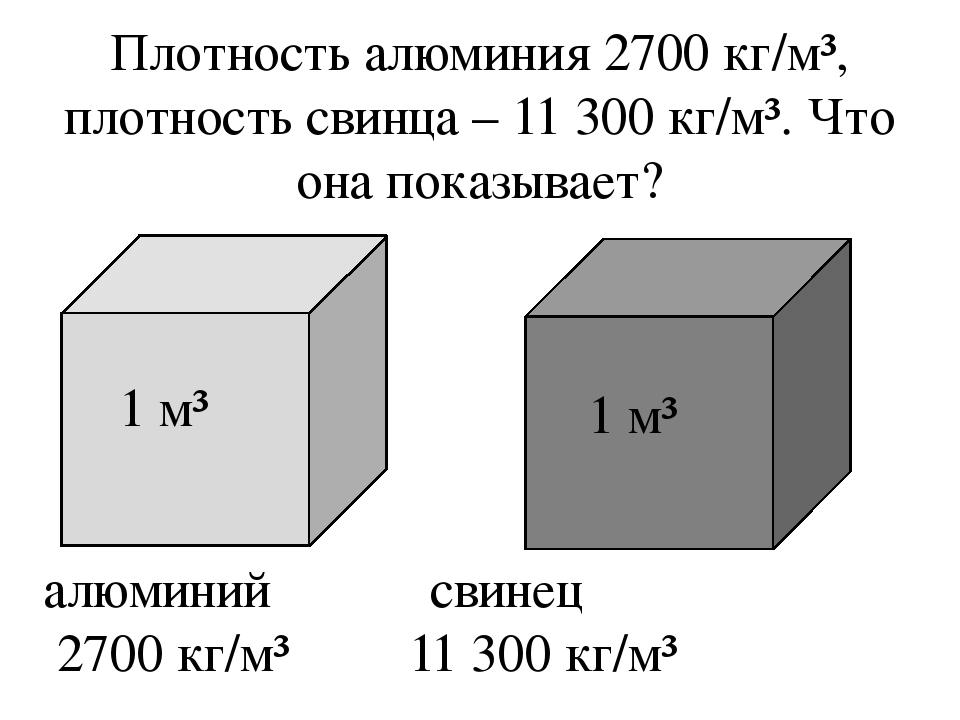 Он является очень важной характеристикой, когда речь идет о производстве материалов, в составе которых есть медь. Удельный вес характеризует отношение массы меди в общем объеме сплава.
Он является очень важной характеристикой, когда речь идет о производстве материалов, в составе которых есть медь. Удельный вес характеризует отношение массы меди в общем объеме сплава.
Удельный вес меди будет равняться 8,94 г/см 3 . Параметры удельной плотности и веса у меди совпадают, однако такое совпадение не характерно для других металлов. Удельная масса очень важна не только при производстве изделий с ее содержанием, но и при переработке лома. Существует много методик, с помощью которых можно рационально подобрать материалы для формирования изделий. В международных системах СИ параметр удельного веса выражается в ньютонах на 1 единицу объема.
Очень важно все расчеты производить в стадии проектирования устройств и механизмов. Удельная плотность и вес являются разными значениями, но они обязательно используются для определения массы заготовок для различных деталей, в составе которых есть Cuprum.
Если сравнить плотность меди и алюминия, мы увидим большую разницу.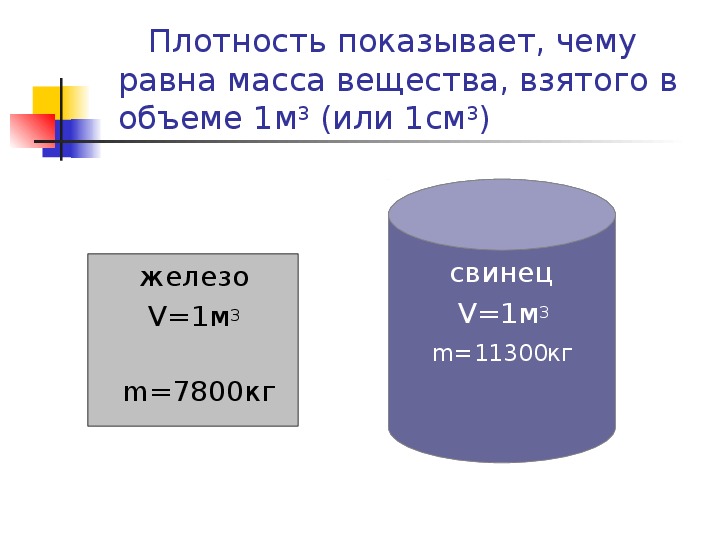 У алюминия этот показатель составляет 2698,72 кг/м 3 в состоянии при комнатной температуре. Однако с повышением температуры параметры становятся другими. При переходе алюминия в жидкое состояние при нагревании плотность у него будет в пределах 2,55−2,34 г/см 3 . Показатель всегда зависит от содержания легирующих элементов в алюминиевых сплавах.
У алюминия этот показатель составляет 2698,72 кг/м 3 в состоянии при комнатной температуре. Однако с повышением температуры параметры становятся другими. При переходе алюминия в жидкое состояние при нагревании плотность у него будет в пределах 2,55−2,34 г/см 3 . Показатель всегда зависит от содержания легирующих элементов в алюминиевых сплавах.
Технические показатели сплавов металлов
Наиболее распространенными сплавами на основе меди считаются латунь и бронза. Их состав формируется также из других элементов:
Все сплавы различаются между собой структурой. Наличие олова в составе позволяет делать бронзовые сплавы отменного качества. В более дешевые сплавы входит никель либо цинк. Производимые материалы на основе Cuprum обладают следующими характеристиками:
- высокая пластичность и износостойкость;
- электропроводность;
- устойчивость к агрессивной среде;
- низкий коэффициент трения.
Сплавы на основе меди находят широкое применение в промышленном произво
Плотность и удельный вес металлов и их сплавов
Во всех сферах человеческой деятельности применяются изделия из металлов. Металлы в научном смысле представляют собой простые вещества, обладающие специфическими свойствами (металлическим блеском, ковкостью, высокой электропроводностью). В быту и на производстве часто используют их сплавы с другими элементами. Эти затвердевшие расплавы также обычно называют металлами.
Металлы в научном смысле представляют собой простые вещества, обладающие специфическими свойствами (металлическим блеском, ковкостью, высокой электропроводностью). В быту и на производстве часто используют их сплавы с другими элементами. Эти затвердевшие расплавы также обычно называют металлами.
Определение и использование плотности
Как известно, чтобы найти плотность вещества, его массу делят на объем. Плотность является физико-химической характеристикой вещества. Она постоянна. Материалы для промышленного производства должны соответствовать этому показателю. Для её обозначения принято использовать греческую букву ρ.
Плотность железа равна 7874 кг/м³, никеля — 8910 кг/м³, хрома — 7190 кг/м³, вольфрама — 19250 кг/м³. Конечно, это относится к твёрдым сплавам. В расплавленном состоянии веществам присущи другие характеристики.
В природе лишь некоторые металлы присутствуют в большом количестве. Удельный вес железа в земной коре 4,6%, алюминия — 8,9%, магния — 2,1%, титана — 0,63%.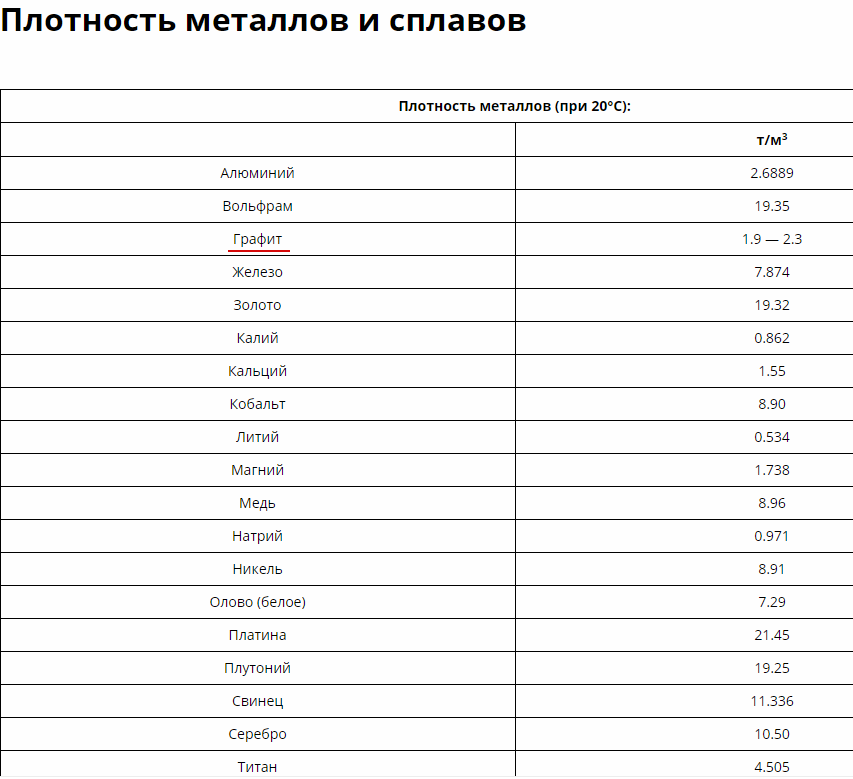 Металлы незаменимы в большинстве сфер человеческой деятельности. Их производство растёт год от года. Для удобства металлы разделены на группы.
Металлы незаменимы в большинстве сфер человеческой деятельности. Их производство растёт год от года. Для удобства металлы разделены на группы.
Железо и его сплавы
Чёрными металлами принято называть стали и чугуны разных марок. Сплав железа и углерода считается сталью, если железа не менее 45%, а содержание углерода 0,1%—2,14%. Чугуны, соответственно, углерода содержат больше.
Для получения необходимых свойств сталям и сплавам их легируют (присаживают при переплаве легирующие добавки). Таким образом плавят заданные марки. Все марки металла строго соответствуют определённым техническим условиям. Свойства каждой марки регламентированы государственными стандартами.
В зависимости от состава плотность стали варьируется в диапазоне 7,6—8,8 (г/см³) в СГС или 7600—8800 (кг/м³) в СИ (это видно из таблицы 1). Конечно, сталь имеет сложную структуру, это не смесь различных веществ. Однако присутствие этих веществ и их соединений изменяют свойства, в частности, плотность. Поэтому самыми большими плотностями обладают быстрорежущие стали с высоким содержанием вольфрама.
Однако присутствие этих веществ и их соединений изменяют свойства, в частности, плотность. Поэтому самыми большими плотностями обладают быстрорежущие стали с высоким содержанием вольфрама.
Цветные металлы и их сплавы
Изделия из бронзы, латуни, меди, алюминия широко применяются на производстве:
- Обычно бронзы это сплавы меди с оловом, алюминием, свинцом и бериллием. Однако в бронзовом веке, когда удельный вес бронзы в общей массе металлических изделий составлял почти 100%, это были сплавы медь — мышьяк.
- Сплавы на основе цинка — латуни. В латуни может присутствовать олово, но его количество меньше, чем цинка. Чтобы получить сыпучую стружку, иногда добавляют свинец. Кроме ювелирных сплавов латуни и бронзы, они нужны для деталей машин и морских судов, скобяных изделий, пружин. Некоторые сорта применяют в авиации и ракетостроении.
- Дюралюминий (дюраль) — сплав алюминия с медью (меди 4,4%) — это высокопрочный сплав.
 Главным образом применяется в авиации.
Главным образом применяется в авиации. - Титан по прочности превосходит многие марки стали. Одновременно он вдвое легче. Эти качества сделали его незаменимым в большинстве отраслей промышленности. А также он широко применяется в медицине (протезировании). Удельный вес титана в производстве летательных аппаратов достигает 70% от всего выплавляемого в мире. Около 15% титана идёт для химического машиностроения.
- Серебро и золото — первые металлы, с которыми познакомился человек. За всю историю существования человечества эти металлы, по большей части, шли на ювелирные изделия. И в настоящее время тенденция сохраняется.
- Вольфрам из-за высокой тугоплавкости незаменим в приборостроении. Большая плотность позволяет применять его, как защиту от радиации.
- Никель и хром образуют нихром — жаропрочный пластичный сплав, очень долговечный и надёжный.
Различные марки сталей и чугунов, бронз и других металлов имеют разный химический состав и разную плотность.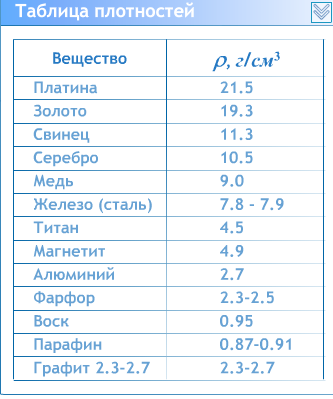 Плотности всех востребованных материалов измерены и систематизированы. Таблицы, содержащие эти данные доступны пользователям. С их помощью можно легко найти массу изделия заданной формы.
Плотности всех востребованных материалов измерены и систематизированы. Таблицы, содержащие эти данные доступны пользователям. С их помощью можно легко найти массу изделия заданной формы.
Определение массы изделия
Все современные справочные материалы, ГОСТ и технические условия предприятий скорректированы в соответствии с международной классификацией.
Пользуясь справочными таблицами плотностей различных материалов, легко определить их массу. Это особенно актуально, когда предметы тяжёлые или отсутствуют соответствующие весы. Для этого требуется знать их геометрические параметры. Чаще всего узнать требуется массу предмета в форме цилиндра, трубы или параллелепипеда:
- Металлические прутки имеют форму цилиндра. Зная диаметр и длину, легко узнать массу. Масса равна плотности, умноженной на объём. Находим объём предмета. Он получается умножением площади сечения на длину.
 Площадь круга, зная диаметр, определить несложно. Диаметр в квадрате умножается на 3,14 (число пи), делится на 4.
Площадь круга, зная диаметр, определить несложно. Диаметр в квадрате умножается на 3,14 (число пи), делится на 4. - Массу трубы получаем аналогично. При нахождении площади берём разницу между внешним и внутренним диаметром сечения.
- Чтобы определить массу листа, блюма, сляба или прутка прямоугольного сечения, определяем объём, перемножая длину, высоту и толщину. Умножаем на плотность из справочника.
При таких вычислениях всегда допускается маленькая погрешность, ведь формы не идеальны. На практике ей можно пренебречь. Производители металлоизделий разработали специальные калькуляторы вычисления массы для пользователей. Достаточно ввести уникальные размеры в соответствующие окна и получить результат.
Что такое удельный вес
Удельным весом называют плотность, умноженную на ускорение свободного падения (силу тяжести) или отношение веса тела к его объёму. Путать его с плотностью недопустимо. Однако часто это происходит из-за смешения понятий массы и веса. Вес тела, а следовательно и удельный вес, изменяется в зависимости от силы тяжести. Он не является постоянной величиной. В зависимости от места, где находится предмет, он имеет разные значения. Эта физическая величина будет разной даже в разных точках Земли. Ускорение свободного падения на экваторе больше, чем на полюсах. Масса и плотность постоянны.
Путать его с плотностью недопустимо. Однако часто это происходит из-за смешения понятий массы и веса. Вес тела, а следовательно и удельный вес, изменяется в зависимости от силы тяжести. Он не является постоянной величиной. В зависимости от места, где находится предмет, он имеет разные значения. Эта физическая величина будет разной даже в разных точках Земли. Ускорение свободного падения на экваторе больше, чем на полюсах. Масса и плотность постоянны.
К примеру, можно вычислить удельный вес серебра. На Земле эта величина будет составлять 10500 кг/м³ (плотность чистого металла). Умножив на 9,81м/с2 (сила тяжести), можно получить 103005 Н/м³. А на Луне 10500 кг/м³ умножается на 1,62м/с2 (сила тяжести на Луне). Результат уже другой — 17,01Н/м³. В кабине корабля, вращающегося вокруг Земли — невесомость, ускорение равно нулю. Следовательно, и вес любого материала здесь ноль.
Все значения будут разными. Самое большое значение будет в первом случае, потому что на Земле ускорение свободного падения имеет самое большое значение. В невесомости вещь не весит ничего. Плотность одного и того же материала в любом месте будет одинаковой. Она является константой.
Для того, чтобы составить таблицы удельного веса металлов на различных планетах (или в других условиях), необходимо знать ускорение свободного падения и плотность.
Перевозки изделий из металлов
В системе грузоперевозок задействовано такое понятие, как «объёмный вес». Если масса предмета в одном кубическом метре 167 кг, то такой вес считается физическим, а если меньше — объёмным. Например, масса куба стали углеродистой — 7750 кг. Другими словами, объёмный вес стали 7750 кг. Эти расчёты нужны, чтобы определить, какой объем займёт перевозимый груз.
Однако в зависимости от того, какие металлические изделия перевозятся, объем будет меняться. Предположим, что есть несколько различных метизов одной и той же марки стали. По идее, они обладают одинаковой плотностью. Однако слитки, крупносортные изделия и бунты проволоки обладают различным объёмом, а следовательно, при их перевозке займут больше или меньше места на транспорте. Таким образом, они обладают разным объёмным весом. При любых условиях кубометр стали больше 167 кг, следовательно, его не назовёшь объёмным.
Предположим, что есть несколько различных метизов одной и той же марки стали. По идее, они обладают одинаковой плотностью. Однако слитки, крупносортные изделия и бунты проволоки обладают различным объёмом, а следовательно, при их перевозке займут больше или меньше места на транспорте. Таким образом, они обладают разным объёмным весом. При любых условиях кубометр стали больше 167 кг, следовательно, его не назовёшь объёмным.
ГОСТ 23862.24-79 Редкоземельные металлы и их окиси. Методы определения железа и меди
Текст ГОСТ 23862.24-79 Редкоземельные металлы и их окиси. Методы определения железа и меди
МЕЖГОСУДАРСТВЕННЫЙ
Группа В59 СТАНДАРТ
РЕДКОЗЕМЕЛЬНЫЕ МЕТАЛЛЫ И ИХ ОКИСИ Методы определения железа и меди
Rare-earth metals and their oxides.
Methods of determination of iron and copper
ГОСТ
23862.24-79
МКС 77.120.99 ОКСТУ 1709
Постановлением Государственного комитета СССР по стандартам от 19 октября 1979 г. № 3989 дата введения установлена
№ 3989 дата введения установлена
01.01.81
Ограничение срока действия снято по протоколу № 7—95 Межгосударственного совета по стандартизации, метрологии и сертификации (ИУС 11—95)
Настоящий стандарт устанавливает экстракционно-фотометрический метод определения железа и меди (при массовой доле от 5 • 10-5 % до 5 • 10-2 %) в редкоземельных металлах и их окисях; экстракционно-фотометрический метод определения меди (при массовой доле от 5 • 10-6 % до 5 • 10_3 %) в лантане и его окиси; фотометрический метод определения железа (при массовой доле от 5 • 10-5 % до 1 • 10-2 %) в лантане, иттрии и их окисях; фотометрический метод определения железа (при массовой доле от 1 • 10-4 % до 1 • 10-2 %) в редкоземельных металлах и их окисях (кроме церия и его двуокиси).
(Измененная редакция, Изм. № 2).
1. ОБЩИЕ ТРЕБОВАНИЯ
1.1. Общие требования к методам анализа — по ГОСТ 23862.0—79.
ЭКСТРАКЦИОННО-ФОТОМЕТРИЧЕСКИЙ МЕТОД ОПРЕДЕЛЕНИЯ ЖЕЛЕЗА И МЕДИ В РЕДКОЗЕМЕЛЬНЫХ МЕТАЛЛАХ И ИХ ОКИСЯХ
Метод основан на экстракционном концентрировании и разделении примесей железа и меди с последующим фотометрическим определением железа в виде роданида, меди в виде диэтилдитио-карбамата.
Массовые доли железа и меди находят по градуировочному графику.
(Измененная редакция, Изм. № 1).
2. АППАРАТУРА, РЕАКТИВЫ И РАСТВОРЫ
Фотоэлектроколориметр ФЭК-56 или аналогичный прибор.
Плитка электрическая.
Аппарат кварцевый для перегонки.
Цилиндры мерные вместимостью 5, 10 и 25 см3.
Колбы мерные вместимостью 100, 500 и 1000 см3.
Воронки делительные вместимостью 50 и 75 см3.
Колбы конические вместимостью 50 см3.
Пипетки вместимостью 1, 2, 5, 10 см3.
Издание официальное Перепечатка воспрещена
Издание с Изменениями № 1, 2, утвержденными в апреле 1985 г., мае 1990 г. (ИУС 7— 85, 8—90).
(ИУС 7— 85, 8—90).
Стаканы стеклянные химические вместимостью 75 см3.
Стекла часовые диаметром 30 мм.
Чашки кварцевые вместимостью 40 см3.
Амиловый эфир уксусной кислоты (амилацетат), ч.
Хлороформ серии 490671, медицинский.
Ацетон по ГОСТ 2603—79, ос. ч.
Аммиак водный по ГОСТ 3760—79, ос. ч.
Кислота соляная по ГОСТ 14261—77, ос.ч. 20—4, плотностью 1,19 г/см3 и разбавленная 4 : 1.
Кислота азотная особой чистоты по ГОСТ 11125—84, плотностью 1,4 г/см3, перегнанная в кварцевом аппарате.
Порошок железный по ГОСТ 9849—86.
Порошок медный электролитический по ГОСТ 4960—75.
Алюминий хлористый по ГОСТ 3759—75, ч. д. а.
Пероксид водорода по ГОСТ 10929—76, ос. ч., 30%-ный раствор.
Аммоний роданистый, х. ч. без железа или х. ч. дополнительно очищенный раствор с концентрацией 600 г/дм3: 200 г роданистого аммония растворяют в 100 см3 воды, добавляют 50 мг хлористого алюминия, несколько капель аммиака (до выпадения гидратов), перемешивают и дают осадку отстояться в течение 2—3 ч. Раствор отфильтровывают через фильтр с синей лентой, отбрасывая первую порцию фильтрата, после чего упаривают до такого состояния, чтобы капля, нанесенная на часовое стекло, застыла. Затем раствор охлаждают, фильтруют и сушат кристаллы при температуре 30-40 °С.
Раствор отфильтровывают через фильтр с синей лентой, отбрасывая первую порцию фильтрата, после чего упаривают до такого состояния, чтобы капля, нанесенная на часовое стекло, застыла. Затем раствор охлаждают, фильтруют и сушат кристаллы при температуре 30-40 °С.
Свинца диэтилдитиокарбаминат, ч., раствор с концентрацией 1,2 г/дм3 в хлороформе.
Вода бидистиллят или деионизованная.
Стандартный раствор железа (запасной), содержащий 0,1 мг/см3 железа: навеску железного порошка массой 0,1 г помещают в стакан вместимостью 100 см3, добавляют 20 см3 концентрированной соляной кислоты и 1 см3 азотной кислоты и нагревают до полного растворения навески. После охлаждения раствор переносят в мерную колбу вместимостью 1000 см3 и разбавляют водой до метки.
Раствор железа, содержащий 0,01 мг/см3 железа, готовят разбавлением стандартного раствора железа водой в 10 раз.
Стандартный раствор меди (запасной), содержащий 0,1 мг/см3 меди: навеску медного порошка массой 0,05 г помещают в стакан вместимостью 50 см3 и добавляют 5 см3 концентрированной азотной кислоты. После полного растворения меди раствор переносят в мерную колбу вместимостью 500 см3 и доводят водой до метки.
После полного растворения меди раствор переносят в мерную колбу вместимостью 500 см3 и доводят водой до метки.
Раствор меди, содержащий 0,01 мг/см3 меди, готовят разбавлением исходного стандартного (запасного) раствора меди водой в 10 раз.
Разд. 2. (Измененная редакция, Изм. № 1).
3. ПРОВЕДЕНИЕ АНАЛИЗА
3.1. Растворение пробы
Навеску анализируемой пробы массой 0,05—2 г (в зависимости от предполагаемого содержания железа и меди) помещают в коническую колбу, приливают 0,1 см3 пероксида водорода, 10 см3 соляной кислоты (4 : 1), накрывают часовым стеклом и растворяют при нагревании.
Навеску двуокиси церия массой 0,1—2 г (в зависимости от содержания железа и меди) помещают в кварцевую чашку, смачивают 0,5 см3 воды, приливают 5 см3 концентрированной азотной кислоты, 7 см3 пероксида водорода, накрывают часовым стеклом и растворяют при нагревании. Раствор упаривают до сиропообразного состояния; приливают три раза по 10 см3 соляной кислоты (4 : 1) и упаривают до сиропообразного состояния.
Затем к полученным растворам приливают по 2—3 капли аммиака и кипятят растворы для разрушения пероксида водорода. Растворы охлаждают до комнатной температуры и добавляют по 10 см3 концентрированной соляной кислоты.
3.2. Определение железа
Раствор пробы переносят в делительную воронку вместимостью 50 см3, приливают 10 см3 амилацетата и встряхивают воронку в течение 0,5 мин. После расслаивания (нижний) водный слой переносят в чистый стакан и оставляют для определения меди (раствор 1).
Органический слой (экстракт железа) дважды промывают соляной кислотой, разбавленной 4:1, порциями по 5 см3, промывные растворы отбрасывают. Затем к экстракту железа добавляют 9 см3 воды и реэкстрагируют железо, встряхивая растворы в делительной воронке в течение 0,5 мин. Водный слой (нижний) переносят в кювету для фотометрирования (/ = 50 мм), добавляют 12 см3 ацетона, 1,5 см3 раствора роданистого аммония и перемешивают стеклянной палочкой.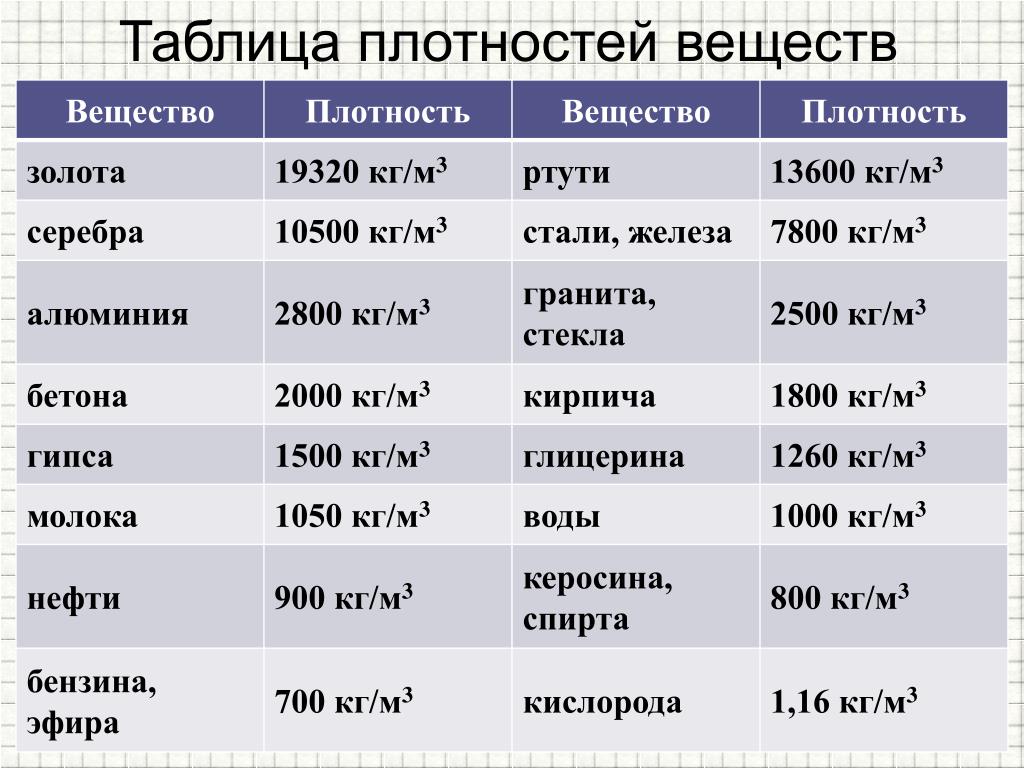 Оптическую плотность раствора измеряют на фотоэлектроколориметре (Лтах = 490 нм). В качестве раствора сравнения применяют воду. Одновременно проводят контрольный опыт через все стадии анализа и вводят на него поправку. Массовую долю железа в пробе определяют по градуировочному графику.
Оптическую плотность раствора измеряют на фотоэлектроколориметре (Лтах = 490 нм). В качестве раствора сравнения применяют воду. Одновременно проводят контрольный опыт через все стадии анализа и вводят на него поправку. Массовую долю железа в пробе определяют по градуировочному графику.
3.3. Определение меди
Раствор 1 разбавляют равным объемом воды, переносят в делительную воронку вместимостью 75 см3, добавляют 13 см3 раствора диэтилдитиокарбамата свинца в хлороформе и встряхивают воронку в течение 1 мин. После расслаивания органический слой (нижний) переносят в сухую кювету для фотометрирования (/ = 30 мм) и измеряют оптическую плотность раствора по сравнению с хлороформом на фотоэлектроколориметре (Лтах g 440 нм). Одновременно проводят контрольный опыт через все стадии анализа и вводят поправку. Массовую долю меди в пробе определяют по градуировочному графику.
3.4. Построение градуировочного графика
В делительную воронку вместимостью 50 см3 вводят по 20 см3 соляной кислоты (4 : 1) и по 0,1; 0,2; 0,5; 0,7; 1,0 см3 растворов железа и меди, что соответствует 1, 2, 5, 7, 10 мкг каждого из элементов. Далее анализ проводят по пп. 3.2 и 3.3. Строят градуировочные графики зависимости оптической плотности от массы железа и меди.
Далее анализ проводят по пп. 3.2 и 3.3. Строят градуировочные графики зависимости оптической плотности от массы железа и меди.
Отдельные точки градуировочного графика проверяют одновременно с проведением анализа проб не реже одного раза в месяц.
4. ОБРАБОТКА РЕЗУЛЬТАТОВ
4.1. Массовую долю железа или меди (X) в процентах вычисляют по формуле
х=щ.жа
т
где т1 — масса железа или меди, найденная по градуировочному графику, мкг; т — масса навески анализируемой пробы, г.
За результат анализа принимают среднеарифметическое значение результатов двух параллельных определений, проведенных из отдельных навесок.
4.2. Расхождения результатов двух параллельных определений или результатов двух анализов не должны превышать значений допускаемых расхождений, указанных в табл. 1.
Таблица 1
Массовая доля железа или меди, % | Допускаемое расхождение, % | Массовая доля железа или меди, % | Допускаемое расхождение, % |
5 • КС5 | 2 • КС5 | 5 • КС3 | 1 • КС3 |
1 • КС4 | 3 • КС5 | 1 • КС2 | 2 • КС3 |
5 • КС4 | 1 • КС4 | 5 • КС2 | 1 • КС2 |
1 • 1 П-з | 9 — 1П 4 |
4а. ЭКСТРАКЦИОННО-ФОТОМЕТРИЧЕСКИЙ МЕТОД ОПРЕДЕЛЕНИЯ МЕДИ
ЭКСТРАКЦИОННО-ФОТОМЕТРИЧЕСКИЙ МЕТОД ОПРЕДЕЛЕНИЯ МЕДИ
В ЛАНТАНЕ И ЕГО ОКИСИ
Метод основан на экстракционном концентрировании меди в виде диэтилдитиокарбамината с последующим его спектрофотометрическим определением.
4а. 1. Аппаратура, реактивы и растворы
Спектрофотометр фирмы «Пай Юникум» модель SP 8—100 или аналогичный прибор. Аппарат кварцевый для перегонки.
Плита электрическая.
Цилиндры мерные вместимостью 10 и 25 см3.
Колбы мерные вместимостью 50, 100, 500 и 1000 см3.
Воронки делительные вместимостью 50 и 75 см3.
Колбы конические вместимостью 50 см3.
Пипетки вместимостью 1, 2, 5, 10 см3.
Стаканы стеклянные химические вместимостью 75 см3.
Стекла часовые диаметром 30 мм.
Кислота соляная особой чистоты по ГОСТ 14261—77, ос. ч. 20—4, плотностью 1,19 г/см3 и разбавленная 4 : 1 и 1 : 1.
Кислота азотная особой чистоты по ГОСТ 11125—84, плотностью 1,4 г/см3, перегнанная в кварцевом аппарате.
Хлороформ медицинский.
Свинца диэтилдитиокарбаминат, ч., раствор с концентрацией 1,2 г/дм3 в хлороформе.
Порошок медный электролитический по ГОСТ 4960—75.
Раствор меди (запасной), содержащий 0,1 мг/см3 меди: навеску медного порошка массой 0,05 г помещают в стакан вместимостью 50 см3 и приливают 5 см3 концентрированной азотной кислоты. После полного растворения меди раствор переносят в мерную колбу вместимостью 500 см3 и доводят водой до метки.
Раствор меди рабочий, содержащий 0,001 мг/см3 меди, готовят разбавлением исходного (запасного) раствора меди водой в 100 раз. Раствор готовят в день употребления.
4а.2. Проведение анализа
4а.2.1. Навеску лантана или его окиси 0,5—3 г (в зависимости от предполагаемого содержания меди) помещают в коническую колбу, приливают 15 см3 соляной кислоты (4 : 1), накрывают часовым стеклом и растворяют при нагревании.
Раствор охлаждают до комнатной температуры и добавляют 20 см3 соляной кислоты (1 : 1).
Раствор переносят в делительную воронку, добавляют 13 см3 диэтилдитиокарбамата свинца в хлороформе и встряхивают воронку в течение 1 мин. После расслаивания органический слой (нижний) переносят в сухую кювету для фотометрирования (/ = 40 мм) и измеряют оптическую плотность раствора по сравнению с хлороформом на спектрофотометре (Лтах = 435). Одновременно проводят контрольный опыт через все стадии анализа и вводят поправку. Массовую долю меди в пробе определяют по градуировочному графику.
4а.2.2. Для построения градуировочного графика в делительные воронки вместимостью 50 см3 вводят по 20 см3 соляной кислоты (4 : 1) и 0,15; 0,3; 0,5; 0,7; 1,0 см3 рабочего раствора меди, что соответствует 0,15, 0,3, 0,5, 0,7 и 1 мкг меди. Добавляют по 13 см3 раствора диэтилдитиокарбамата свинца в хлороформе и встряхивают воронки в течение 1 мин. После расслоения органический слой (нижний) из первой воронки переносят в сухую кювету для фотометрирования (/ = 40 мм) и измеряют оптическую плотность раствора по сравнению с хлороформом на спектрофотометре amax g 435 нм). Си =
Си =
3-10—4
Щ
где т1 — масса меди, найденная по градуировочному графику, мкг; т2 — масса анализируемой пробы, г.
За результат анализа принимают среднеарифметическое значение результатов двух параллельных определений, проведенных из отдельных навесок.
Расхождения результатов двух параллельных определений или результатов двух анализов не должны превышать значений допускаемых расхождений, приведенных в табл. 1а.
Таблица 1а
Массовая доля меди, % | Допускаемое расхождение, % | Массовая доля меди, % | Допускаемое расхождение, % |
5 • 10-6 | 4 • 10-6 | 5 • 10-4 | 1 • ю-4 |
1 • ю-5 | 6 • ю-6 | 1 • ю-3 | 2 • 10-4 |
5 • 10-5 | 2 • 10-5 | 5 • 10-3 | 1 • ю-3 |
1 • ю-4 | з • ю-5 |
Разд. 4а. (Введен дополнительно, Изм. № 2).
4а. (Введен дополнительно, Изм. № 2).
5. ФОТОМЕТРИЧЕСКИЙ МЕТОД ОПРЕДЕЛЕНИЯ ЖЕЛЕЗА В ЛАНТАНЕ, ИТТРИИ
И ИХ ОКИСЯХ
Метод основан на образовании окрашенного комплекса железа с о-фенантролином и измерении его оптической плотности.
5.1. Аппаратура, реактивы и растворы
Весы аналитические АДВ-200 или аналогичные.
Фотоэлектроколориметр ФЭК-56-М или аналогичный прибор.
Ареометр со шкалой 1,25—1,30 г/см3.
Плита электрическая.
Кварцевый перегонный аппарат.
Стаканы стеклянные химические вместимостью 100, 150, 1000 см3.
Колбы мерные вместимостью 50, 1000 см3.
Пипетки вместимостью 1, 2, 5, 10 см3.
Бумага индикаторная «конго».
о-фенантролин, ч., раствор с концентрацией 2 г/дм3.
Вода бидистиллированная.
Кислота соляная по ГОСТ 14261—77, ос.ч. 20—4, плотностью 1,19 г/см3 и разбавленная 1 : 1.
Спирт этиловый ректификованный технический по ГОСТ 18300—87, перегнанный.
Гидроксиламин гидрохлорид по ГОСТ 5456—79, ч. д. а. (перекристаллизованный), раствор с концентрацией 100 г/дм3.
Перекристаллизацию гидроксиламина гидрохлорида проводят следующим образом: готовят при нагревании насыщенный водный раствор, к раствору добавляют двойной объем спирта. Выпавшие кристаллы отфильтровывают отсасыванием маточного раствора на вакуум-фильтре, затем сушат между беззольными фильтратами на воздухе и помещают в склянку с притертой пробкой.
Натрий уксуснокислый 3-водный по ГОСТ 199—78, х. ч., перекристаллизованный, водный раствор с концентрацией 100 г/дм3. Перекристаллизацию проводят следующим образом: растворяют 500 г соли в 350 см3 горячей воды и горячий раствор фильтруют через бумажный фильтр, предварительно промытый перегнанным этиловым спиртом. Фильтрат упаривают на водяной бане при температуре 65—70 °С до плотности 1,27—1,28 г/см3 (контроль с помощью ареометра), охлаждают до температуры 20 °С. Выделившиеся кристаллы отсасывают на воронке Бюхнера, промывают небольшим количеством воды и сушат при комнатной температуре.
Порошок железный по ГОСТ 9849—86.
Стандартный раствор железа (запасной), содержащий 1 мг/см3 железа: навеску железного порошка массой 0,2 г помещают в стакан вместимостью 100 см3, приливают 2—3 см3 дистиллированной воды и 10 см3 соляной кислоты, разбавленной 1:1. Растворение проводят при медленном нагревании. Раствор охлаждают, переносят в мерную колбу вместимостью 200 см3 и доводят до метки дистиллированной водой.
Раствор железа, содержащий 0,01 мг/см3 железа: 1 см3 запасного раствора помещают в мерную колбу вместимостью 100 см3, разбавляют до метки дистиллированной водой и перемешивают.
5.2. Проведение анализа
5.2.1. Навеску пробы массой 0,5—5 г в зависимости от содержания железа помещают в стакан вместимостью 150 см3, приливают 10—20 см3 соляной кислоты (1 : 1) и нагревают до растворения пробы. Раствор упаривают до влажных солей.
Соли растворяют в 10—15 см3 воды и раствор количественно переносят в мерную колбу вместимостью 50 см3. Приливают 2 см3 раствора гидроксиламина, а через 10 мин раствор уксуснокислого натрия до перехода цвета индикаторной бумаги от синей до розовой. Затем приливают 2 см3 натрия уксуснокислого, 5 см3 раствора о-фенантролина, доливают до метки водой, тщательно перемешивают и через 45 мин измеряют оптическую плотность раствора при длине волны 440 нм в кювете с длиной оптического пути 50 мм.
Приливают 2 см3 раствора гидроксиламина, а через 10 мин раствор уксуснокислого натрия до перехода цвета индикаторной бумаги от синей до розовой. Затем приливают 2 см3 натрия уксуснокислого, 5 см3 раствора о-фенантролина, доливают до метки водой, тщательно перемешивают и через 45 мин измеряют оптическую плотность раствора при длине волны 440 нм в кювете с длиной оптического пути 50 мм.
Одновременно через все стадии анализа проводят два параллельных контрольных опыта на чистоту реактивов. Среднее значение оптической плотности контрольного опыта вычитают из оптической плотности растворов сравнения. В качестве раствора сравнения применяют воду.
5.2.2. Для построения градуировочного графика в мерные колбы вместимостью 50 см3 помещают по 0,2; 0,5; 1,0; 1,5; 2,0; 2,5; 3,0; 3,5; 4,0 см3 раствора железа, содержащего 0,01 мг/см3 железа, 10—15 см3 дистиллированной воды, и далее поступают как указано в и. 5.2. 1, начиная со слов: «Приливают 2 см3 раствора гидроксиламина». После прибавления каждого реактива содержимое колбы необходимо перемешивать. По полученным значениям оптических плотностей и соответствующим им массам железа строят градуировочный график.
1, начиная со слов: «Приливают 2 см3 раствора гидроксиламина». После прибавления каждого реактива содержимое колбы необходимо перемешивать. По полученным значениям оптических плотностей и соответствующим им массам железа строят градуировочный график.
5.3. Обработка результатов
5.3.1. Массовую долю железа (й/) в процентах вычисляют по формуле
1щ ■ 100
■М = от 1000 ’
где т — масса навески анализируемой пробы, г;
т1 — масса железа в растворе пробы, найденная по градуировочному графику, мг.
За результат анализа принимают среднеарифметическое значение результатов двух параллельных определений, проведенных из отдельных навесок.
5.3.2. Расхождения результатов двух параллельных определений или результатов анализов не должны превышать значений допускаемых расхождений, приведенных в табл. 2.
Таблица 2
Массовая доля железа, % | Допускаемое расхождение, % | Массовая доля железа, % | Допускаемое расхождение, % |
5 • КП5 | 4 • КП5 | 1 • ю-3 | 0,35 • 10-3 |
1 • КП4 | 0,55 • 10-4 | 1 • ю-2 | 0,25 • 10-2 |
Разд. 5. (Введен дополнительно, Изм. № 1).
5. (Введен дополнительно, Изм. № 1).
5а. ФОТОМЕТРИЧЕСКИЙ МЕТОД ОПРЕДЕЛЕНИЯ ЖЕЛЕЗА В РЕДКОЗЕМЕЛЬНЫХ МЕТАЛЛАХ И ИХ ОКИСЯХ (КРОМЕ ЦЕРИЯ И ЕГО ДВУОКИСИ)
Метод основан на образовании окрашенного комплекса железа и с о-фенантролином и измерении его оптической плотности.
5а. 1. Аппаратура, реактивы и растворы
Спектрофотометр фирмы Пай Юникум модели SP 8—100 или аналогичный прибор.
Весы аналитические.
Ареометр со шкалой 1,25—1,30 г/см3.
Аппарат кварцевый для перегонки.
Плита электрическая.
Колбы мерные вместимостью 50 и 1000 см3.
Пипетки вместимостью 1, 2, 5, 10 см3.
Стаканы стеклянные химические вместимостью 100, 150 и 1000 см3.
Бумага индикаторная «Конго».
о-фенантролин, ч., раствор с концентрацией 2 г/дм3.
Вода бидистиллированная.
Кислота соляная особой чистоты по ГОСТ 14261—77, ос.ч. 20—4, плотностью 1,19 г/см3 и разбавленная 1:1.
Спирт этиловый ректификованный технический по ГОСТ 18300—87, перегнанный.
Гидроксиламин гидрохлорид по ГОСТ 5456—79, ч. д. а. (перекристаллизованный), раствор с концентрацией 100 г/дм3 (приготовление раствора по ГОСТ 23862.24—79, разд. 5).
Натрий уксуснокислый трехводный по ГОСТ 199—78, х. ч., раствор с концентрацией 100 г/дм3 готовят по ГОСТ 23862.24—79, разд. 5.
Порошок железный по ГОСТ 9849—86 (приготовление стандартных растворов железа — по ГОСТ 23862.24-79, разд. 5).
5а.2. Проведение анализа
5а.2.1. Навеску пробы массой 0,5—5 г в зависимости от массовой доли железа помещают в стакан вместимостью 150 см3, приливают 10—20 см3 соляной кислоты (1 : 1) и нагревают до растворения пробы. Раствор упаривают до влажных солей.
Соли растворяют в 10—15 см3 воды и раствор количественно переносят в мерную колбу вместимостью 50 см3.
Приливают 2 см3 раствора гидроксиламина и через 10 мин раствор уксуснокислого натрия до перехода цвета индикаторной бумаги от синей до розовой. Затем приливают 2 см3 раствора натрия уксуснокислого, 5 см3 раствора о-фенантролина, доливают до метки водой, тщательно перемешивают и через 45 мин измеряют оптическую плотность раствора при длине волны 510 нм в кювете с длиной оптического пути 40 мм. Измерение оптической плотности раствора проводят по сравнению с окрашенным раствором, полученным при растворении навески. Одновременно через все стадии анализа проводят два параллельных контрольных опыта на чистоту реактивов. В качестве раствора сравнения в этом случае применяют дистиллированную воду.
Затем приливают 2 см3 раствора натрия уксуснокислого, 5 см3 раствора о-фенантролина, доливают до метки водой, тщательно перемешивают и через 45 мин измеряют оптическую плотность раствора при длине волны 510 нм в кювете с длиной оптического пути 40 мм. Измерение оптической плотности раствора проводят по сравнению с окрашенным раствором, полученным при растворении навески. Одновременно через все стадии анализа проводят два параллельных контрольных опыта на чистоту реактивов. В качестве раствора сравнения в этом случае применяют дистиллированную воду.
5а.2.2. Для построения градуировочного графика в мерные колбы вместимостью 50 см3 помещают по 0,2; 0,5; 1,0; 1,5; 2,0; 2,5; 3,0; 3,5; 4,0 см3 раствора железа, содержащего 0,01 мг/см3 железа, 10—15 см3 дистиллированной воды. Приливают 2 см3 раствора гидроксиламина и через 10 мин раствор уксуснокислого натрия до перехода цвета индикаторной бумаги от синей до розовой. Затем приливают 2 см3 раствора натрия уксуснокислого, 5 см3 раствора о-фенантролина, доливают до метки водой, тщательно перемешивают и через 45 мин измеряют оптическую плотность раствора при длине волны 510 нм в кювете с длиной оптического пути 40 мм.
В качестве раствора сравнения в этом случае применяют дистиллированную воду. По полученным значениям оптических плотностей строят градуировочный график.
5а.З. Обработка результатов
5а.3.1. Массовую долю железа (X) в процентах вычисляют по формуле
(mi — от0) ■ 100 л ~ т-1000 ’
где т1 — масса железа в растворе пробы, найденная по градуировочному графику, мг; т{] — масса железа в растворе контрольного опыта, мг; т — масса навески анализируемой пробы, г.
За результат анализа принимают среднеарифметическое значение результатов двух параллельных определений, проведенных из отдельных навесок.
5а.3.2. Расхождение результатов двух параллельных определений или результатов анализов не должно превышать значений допускаемых расхождений, приведенных в табл. 2а.
Таблица 2а | |
Массовая доля железа, % | Допускаемое расхождение, % |
1 • КП4 | 0,6 • ю-4 |
1 • КП3 | 0,4 • 10-3 |
1 • КП2 | 0,3 • ю-2 |
Разд. 5а. (Введен дополнительно, Изм. № 2).
6. ФОТОМЕТРИЧЕСКИЙ МЕТОД ОПРЕДЕЛЕНИЯ ЖЕЛЕЗА В ЛАНТАНЕ, ГАДОЛИНИИ, ТЕРБИИ, ДИСПРОЗИИ, ГОЛЬМИИ, ТУЛИИ, ИТТЕРБИИ, ЛЮТЕЦИИ,
ИТРИИ И ИХ ОКИСЯХ
Метод основан на образовании окрашенного комплекса железа с роданид-ионом в азотнокислой среде и измерении его оптической плотности.
6.1. Аппаратура, реактивы и растворы
Фотоэлектроколориметр ФЭК-56 или аналогичный.
Плита электрическая.
Стаканы химические вместимостью 50, 250 см3.
Колбы мерные вместимостью 50, 100, 200 см3.
Кислота соляная по ГОСТ 3118—77, х. ч., разбавленная 1 : 1.
Калий роданистый по ГОСТ 4139—75, х. ч., раствор с концентрацией 500 г/дм3.
Кислота серная особой чистоты по ГОСТ 14262—78, разбавленная 1 : 5.
Порошок железный по ГОСТ 9849—86.
Кислота азотная особой чистоты по ГОСТ 11125—84, освобожденная от окислов азота кипячением до обесцвечивания и разбавленная 1:1.
Стандартный раствор железа (запасной), содержащий 1 мг/см3 железа: навеску железного порошка массой 0,2 г помещают в стакан вместимостью 100 см3, приливают 2—3 см3 дистиллированной воды и 10 см3 соляной кислоты, разбавленной 1:1. Растворение проводят при медленном нагревании. Раствор охлаждают, переносят в мерную колбу вместимостью 200 см3 и доводят до метки дистиллированной водой. Раствор железа, содержащий 0,01 мг/см3 железа: 1 см3 запасного раствора помещают в мерную колбу вместимостью 100 см3, добавляют 10—15 капель серной кислоты, разбавленной 1:5, доводят до метки дистиллированной водой, перемешивают.
6.2. Проведение анализа
6.2.1. Навеску металла или окиси РЗЭ массой 0,2—1,0 г помещают в стакан вместимостью 50 см3, смачивают водой, приливают 5 см3 соляной кислоты, разбавленной 1:1, растворяют при нагревании до 70—80 °С, упаривают до влажных солей, охлаждают до комнатной температуры, приливают 4 см3 азотной кислоты, разбавленной 1:1, нагревают до растворения солей, переводят в мерную колбу вместимостью 50 см3, приливают до 40 см3 воды, перемешивают. Перед измерением оптической плотности растворов приливают 2 см3 раствора роданистого калия, доводят водой до метки, перемешивают. Оптическую плотность растворов измеряют при длине волны 490 нм в кювете с длиной оптического пути 50 мм. В качестве раствора сравнения используют воду.
Одновременно через все стадии анализа проводят контрольный опыт на реактивы, значение оптической плотности которого вычитают из значения оптической плотности раствора пробы. Значение оптической плотности раствора контрольного опыта не должно быть более 0,05. В противном случае заменяют реактивы и анализ повторяют. Массу железа находят по градуировочному графику.
6.2.2. Для построения градуировочного графика в мерные колбы вместимостью 50 см3 приливают 0,0; 0,5; 1,0; 2,0; 3,0; 4,0; 5,0 см3 стандартного раствора железа, содержащего 0,01 мг/см3 железа, воды до 40 см3, по 4 см3 раствора азотной кислоты, разбавленной 1:1, перемешивают. Перед измерением оптической плотности растворов приливают 2 см3 раствора роданистого калия, доводят водой до метки, перемешивают. Оптическую плотность растворов измеряют при длине волны 490 нм в кювете с длиной оптического пути 50 мм. В качестве раствора сравнения используют нулевой раствор. По полученным средним значениям оптических плотностей и соответствующим массам железа строят градуированный график, откладывая по оси абсцисс массу железа, выраженную в микрограммах, а по оси ординат — соответствующие им значения оптической плотности.
6.W’где т1 — масса железа, найденная по градуировочному графику, мкг; т — масса навески анализируемой пробы, г.
За ре
Тяжёлые металлы — это… Что такое Тяжёлые металлы?
Тяжёлые мета́ллы — группа химических элементов со свойствами металлов (в том числе и полуметаллы) и значительным атомным весом либо плотностью. Известно около сорока различных определений термина тяжелые металлы, и невозможно указать на одно из них, как наиболее принятое. Соответственно, список тяжелых металлов согласно разным определениям будет включать разные элементы. Используемым критерием может быть атомный вес свыше 50, и тогда в список попадают все металлы, начиная с ванадия, независимо от плотности. Другим часто используемым критерием является плотность, примерно равная или большая плотности железа (8 г/см3), тогда в список попадают такие элементы как свинец, ртуть, медь, кадмий, кобальт, а, например, более легкое олово выпадает из списка. Существуют классификации, основанные и на других значениях пороговой плотности или атомного веса. Некоторые классификации делают исключения для благородных и редких металлов, не относя их к тяжелым, некоторые исключают нецветные металлы (железо, марганец).
Термин тяжелые металлы чаще всего рассматривается не с химической, а с медицинской и природоохранной точек зрения[1] и, таким, образом, при включении в эту категорию учитываются не только химические и физические свойства элемента, но и его биологическая активность и токсичность, а также объем использования в хозяйственной деятельности. [2]
Биологическая роль
Многие тяжелые металлы, такие как железо, медь, цинк, молибден, участвуют в биологических процессах и в определенных количествах являются необходимыми для функционирования растений, животных и человека микроэлементами. С другой стороны, тяжёлые металлы и их соединения могут оказывать вредное воздействие на организм человека, способны накапливаться в тканях, вызывая ряд заболеваний. Не имеющие полезной роли в биологических процессах металлы, такие как свинец и ртуть, определяются как
токсичные металлы. Некоторые элементы, такие как ванадий или кадмий, обычно имеющие токсичное влияние на живые организмы, могут быть полезны для некоторых видов.[3] Загрязнение тяжелыми металлами
Среди разнообразных загрязняющих веществ тяжёлые металлы (в том числе ртуть, свинец, кадмий, цинк, мышьяк) и их соединения выделяются распространенностью, высокой токсичностью, многие из них — также способностью к накоплению в живых организмах. Они широко применяются в различных промышленных производствах, поэтому, несмотря на очистительные мероприятия, содержание соединения
тяжелых металлов в промышленных сточных водах довольно высокое. Они также поступают в окружающую среду с бытовыми стоками, с дымом и пылью промышленных предприятий. Многие металлы образуют стойкие органические соединения, хорошая растворимость этих комплексов способствует миграции тяжелых металлов в природных водах. К тяжелым металлам относят более 40 химических элементов, но при учете токсичности, стойкости, способности накапливаться во внешней среде и масштабов распространения токсичных соединений, контроля требуют значительно меньшее число элементов. Загрязнение океана
Помимо сточных вод, большие массы соединений
тяжелых металлов поступают в океан через атмосферу и с захоронением разнообразных отходов в Мировом океане. Для морских биоценозов наиболее опасны ртуть, свинец и кадмий. Ртуть
Ртуть переносится в океан с материковым стоком (прежде всего — из стока промышленных вод) и через атмосферу. В составе атмосферной пыли содержится около 12 тыс.т. ртути. До трети от этого количества образуется при выветривании пород, содержащих ртуть (киноварь). Ртуть антропогенного происхождения попадает в атмосферу в первую очередь при сжигании угля на электростанциях. Около половины годового промышленного производства этого металла (910 тыс. тонн) попадает в океан. Некоторые бактерии переводят токсичные хлориды ртути в еще более токсичную метилртуть. [4] Соединения ртути накапливается многими морскими и пресноводными организмами в концентрациях, во много раз превышающих содержание ее в воде.
Употребление в пищу рыбы и морепродуктов неоднократно приводило к ртутному отравлению населения. Так, к 1977 году насчитывалось 2800 жертв болезни Минамата, причиной которой послужило поступление в залив Минамата со сточными водами отходов предприятий, на которых в качестве катализатора использовалась хлористая ртуть. Соединения ртути высокотоксичны для человека.
Свинец
Свинец — рассеянный элемент, содержащийся во всех компонентах окружающей среды: в горных породах, почвах, природных водах, атмосфере, живых организмах. Помимо того, свинец поступает в окружающую среду в результате хозяйственной деятельности человека, в том числе с выхлопными газами поступает используемый в топливе тетраэтилсвинец. Через атмосферу океан получает 20-30 тысяч тонн свинца в год с континентальной пылью. [4]
В организм человека свинец попадает как с пищей и водой, так и из воздуха. Свинец может выводиться из организма, однако малая скорость выведения может приводить к накоплению в костях, печени и почках.
Кадмий
Кадмий является относительно редким и рассеянным элементом, в природе концентрируется в минералах цинка. Поступает в природные воды в результате смыва почв, выветривания полиметаллических и медных руд, и со сточными водами рудообогатительных, металлургических и химических производств. Кадмий в норме присутствует в организме человека в микроскопических количествах. При накоплении организмом соединений кадмия поражается нервная система, нарушается фосфорно-кальциевый обмен. Хроническое отравление приводит к анемии и разрушению костей.
Примечания
Ссылки
Литература
- Присутствие макрофитов в водной системе ускоряет снижение концентраций меди, свинца и других тяжелых металлов в воде. // Водное хозяйство России. 2009. No. 2. с. 58 – 67.
Какой цветной металл (сплав на его основе) используется — Студопедия.Нет
Билет №4
«Цветные металлы и сплавы»
Какой металл не является цветным?
А) золото.
Б) медь.
В) вольфрам.
Г) железо.
Железо не относится к цветным металлам. Железо и все его сплавы относится к категории черных металлов. Цветными металлами являются: — золото, серебро, платина (драгоценные металлы)
Какой из перечисленных цветных металлов является
Самым легкоплавким?
А) алюминий.
Б) медь.
В) олово.
Г) свинец.
Наиболее широкое применение среди легкоплавких металлов получили цинк ) Zn (Т пл 419оС), свинец Pb (Тпл 327оС), кадмий Cd (Тпл 321оС), таллийTl (Тпл 303оС), висмут Bi (Тпл 271оС), олово Sn (Тпл 232оС), индийIn (Тпл 157оС), галлий Ga (Тпл 30оС), ртуть Hg (Тпл — 39оС) и другие.
Какой из перечисленных цветных металлов имеет
Наименьшую плотность?
А) магний.
Б) алюминий.
В) медь.
Г)свинец
Плотность металлов:
Магний -1740 кг/м3, алюминий-2700 кг/м3, медь- 8986 кг/м3, свинец- 11400 кг/м3.
Какой из перечисленных цветных металлов имеет
Наилучшую электропроводность?
А) медь.
Б) алюминий.
В) железо.
Г) серебро.
Наибольшая электропроводность у серебра. Медь на втором месте. Массово серебро не используют из-за его высокой стоимости.
5. Сплав меди с цинком называется …
А) бронзой.
Б) латунью.
В) дюралюминием.
Г) баббитом.
Многокомпонентный либо двойной сплав меди с цинком, как известно очень многим, называется латунью
6. В марке латуни Л90 цифра показывает …
А) средний процент олова в сплаве.
Б) средний процент свинца в сплаве.
В) средний процент меди в сплаве.
Г) средний процент алюминия в сплаве.
Медно-цинковые сплавы (латуни) маркируют буквой Л, число 90 — указывает содержание меди в латуни примерно 90%, остальное — цинк.
Сплав меди с различными элементами (кроме цинка)
называется …
А) бронзой.Б) латунью.
В) дюралюминием.
Г) баббитом.
Сплавы меди – первые металлические сплавы, созданные человеком. Их подразделяют на латунь (сплав с цинком), бронзу (сплав с различными элементами, кроме цинка и никеля), медно-никелевые сплавы.
8…
А) азота 9%, железа 4%, меди 80%.
Б) алюминия 9%, железа 4%, меди 87%.
В) железа 9%, алюминия 4%, меди 87%.
Г) алюминия 1%, железа 9%, меди 4%.
Алюминиевый сплав, содержащий в своём составе медь,
кремний и марганец, называется …
А) силумином.
Б) баббитом,
В) дюралюминием.
Г) бронзой.
Дюралюми́н, дюралюминий, дюраль — собирательное обозначение группы высокопрочных сплавов на основе алюминия (алюминиевый сплав) с добавками меди, магния и марганца
Дюралюмины маркируются буквой Д, после которой
стоит цифра, обозначающая …
А) средний процент меди в сплаве.
Б) средний процент кремния в сплаве.
В) условный номер сплава.
Г) средний процент алюминия в сплаве.
Дюралюмины маркируют буквой Д, после которой стоит цифра, обозначающая условный номер сплава.
11. Сплавы на основе алюминия и кремния называются …
А) дюралюминами.
Б) латунями.
В) бронзами.
Г) силуминами.
Силумин — сплав алюминия с кремнием.
Антифрикционные материалы на основе олова и свинца
называются …
А) баббитами.
Б) силуминами.
В) дюралюминами.
Г) латунями.
Баббиты – так называют антифрикционные материалы, созданные на основе свинца или олова
13. В маркировке припоя ПОС-90 цифра обозначает …
А) 90% олова.
Б) 90% свинца.
В) температура плавления припоя.
Г) свинца и олова 90%.
Припой марки ПОС-90 на 90 % состоит из олова и на 10 % из свинца
Медноникелевый сплав, содержащий в своём составе
добавки железа и марганца до 1%, называется …
А) копелью.
Б) мельхиором.
В) бронзой.
Г) латунью.
Копель-еще один специальный сплав. Содержит медь, 43% никеля, немного железа и марганца .
Твёрдые сплавы в своём составе имеют такие цветные
металлы как …
А) вольфрам, титан, тантал, кобальт.
Б) никель, хром, марганец, кремний.
В) ванадий, хром, молибден, никель.
Г) марганец, кремний, медь, ванадий.
Твёрдые сплавы — твёрдые и износостойкие металлические материалы, способные сохранять эти свойства при 900—1150 °C. В основном изготовляются из высокотвердых и тугоплавких материалов на основе карбидов вольфрама, титана, тантала, хрома, связанных кобальтовой металлической связкой, при различном содержании кобальта или никеля
Какой цветной металл (сплав на его основе) используется
научных принципов
научных принципов Структура металлов:
Металлы составляют около двух третей всех элементов и около 24% массы планеты. Они повсюду вокруг нас в таких формах, как стальные конструкции, медная проволока, алюминиевая фольга и золотые украшения. Металлы широко используются благодаря своим свойствам: прочности, пластичности, высокой температуре плавления, тепловой и электрической проводимости и ударной вязкости.
Эти свойства также дают ключ к разгадке структуры металлов.Как и все элементы, металлы состоят из атомов. Прочность металлов предполагает, что эти атомы удерживаются вместе прочными связями. Эти связи также должны позволять атомам двигаться; иначе как металл можно было забивать в листы или вытягивать в проволоку? Разумной моделью будет модель, в которой атомы удерживаются вместе прочными, но делокализованными связями.
Склеивание
Такие связи могут образовываться между атомами металлов, которые имеют низкую электроотрицательность и не сильно притягивают свои валентные электроны.Это позволило бы наиболее удаленным электронам быть общими для всех окружающих атомов, в результате чего положительные ионы ( катионов, ) были окружены морем электронов (иногда называемым электронным облаком).
Рисунок 1: Металлическое соединение . Поскольку эти валентные электроны являются общими для всех атомов, они не считаются связанными с каким-либо одним атомом. Это сильно отличается от ионных или ковалентных связей, где электроны удерживаются одним или двумя атомами.Таким образом, металлическая связь получается прочной и однородной. Поскольку электроны притягиваются ко многим атомам, они обладают значительной подвижностью, что обеспечивает хорошую теплопроводность и электропроводность металлов.
Выше точки плавления металлы являются жидкостями, а их атомы расположены беспорядочно и относительно свободно перемещаются. Однако при охлаждении ниже точки плавления металлы перестраиваются, образуя упорядоченные кристаллические структуры.
Рисунок 2: Расположение атомов в жидкости и твердом теле. Кристаллы
Чтобы сформировать самые прочные металлические связи, металлы упаковываются как можно плотнее. Возможны несколько вариантов упаковки. Вместо атомов представьте шарики, которые нужно упаковать в коробку. Шарики помещали на дно коробки аккуратными упорядоченными рядами, а затем начинали второй слой. Второй слой шариков нельзя размещать непосредственно поверх других шариков, поэтому ряды шариков в этом слое перемещаются в промежутки между шариками на первом слое.Первый слой мрамора может быть обозначен как A, а второй слой как B, давая двум слоям обозначение AB.
Слой «A» Слой «B» AB упаковка
Рисунок 3: AB упаковка сфер. Обратите внимание, что сферы слоя B помещаются в отверстия в слое A. Укладка мрамора в третий слой требует решения. Снова ряды атомов будут гнездиться в полостях между атомами во втором слое, но существуют две возможности.Если ряды мрамора уложены так, что они находятся непосредственно над первым слоем (A), то расположение можно описать как ABA. Такое устройство насадки с чередующимися слоями будет обозначено как ABABAB. Такое расположение ABAB называется гексагональной плотной упаковкой (HCP).
Если ряды атомов упакованы в этом третьем слое так, чтобы они не лежали над атомами в слое A или B, то третий слой называется C. Эта последовательность упаковки будет обозначена ABCABC и также известна как гранецентрированный кубик (ГЦК).Оба устройства обеспечивают максимально плотную упаковку сфер, оставляя пустой лишь около четверти доступного пространства.
Наименьший повторяющийся массив атомов в кристалле называется элементарной ячейкой. Третье распространенное устройство упаковки в металлах, элементарная ячейка с объемно-центрированным кубом (ОЦК), имеет атомы в каждом из восьми углов куба плюс один атом в центре куба. Поскольку каждый из угловых атомов является углом другого куба, угловые атомы в каждой элементарной ячейке будут разделены между восемью элементарными ячейками.Элементарная ячейка ОЦК состоит всего из двух атомов, одного в центре и восьми восьмых от углов.
В схеме FCC, опять же, есть восемь атомов в углах элементарной ячейки и по одному атому в центре на каждой из граней. Атом в грани делится с соседней ячейкой. Элементарные ячейки FCC состоят из четырех атомов, восемь восьмых по углам и шесть половин на гранях. В таблице 1 показаны стабильные кристаллические структуры при комнатной температуре для нескольких элементарных металлов.
Таблица 1: Кристаллическая структура некоторых металлов (при комнатной температуре) Алюминий FCC
Никель FCC Кадмий HCP
Ниобий BCC Хром BCC Platinum
FCC Кобальт HCP
Серебро FCC Медь FCC
Титан HCP Золото
FCC Ванадий BCC Железо BCC
Цинк HCP Свинец FCC
Цирконий HCP Магний HCP 900 40
Структуры элементарных ячеек определяют некоторые свойства металлов.Например, структуры FCC с большей вероятностью будут пластичными, чем BCC (объемно-центрированная кубическая) или HCP (гексагональная плотноупакованная). На рисунке 4 показаны элементарные ячейки FCC и BCC. (См. Активность кристаллической структуры)
Телоцентрированный кубический Лицоцентрированный кубический
Рисунок 4: элементарных ячеек для BCC и FCC. Когда атомы расплавленного металла начинают собираться вместе, образуя кристаллическую решетку в точке замерзания, группы этих атомов образуют крошечные кристаллы.Эти крошечные кристаллы увеличиваются в размере за счет постепенного добавления атомов. В результате получается не один кристалл, а множество более мелких кристаллов, называемых зернами. Эти зерна растут, пока не сталкиваются с соседними растущими кристаллами. Образовавшаяся между ними граница раздела называется границей зерен. Иногда зерна бывают достаточно большими, чтобы их можно было увидеть под обычным световым микроскопом или даже невооруженным глазом. Блестки, которые видны на недавно оцинкованном металле, представляют собой зерна. (См. Модель активности металлов с помощью частиц). На рисунке 5 показан типичный вид металлической поверхности с множеством зерен или кристаллов.
Рисунок 5: зерен и границ зерен для металла. Дефекты кристалла:
Металлические кристаллы не идеальны. Иногда встречаются пустые места, называемые вакансиями, где отсутствует атом. Другой распространенный дефект в металлах - это дислокации, которые представляют собой линии дефектного соединения. На рисунке 6 показан один тип дислокации.
Рисунок 6: Поперечное сечение краевого дислокации, которое распространяется на страницу. Обратите внимание, как плоскость в центре заканчивается внутри кристалла. Эти и другие дефекты, а также наличие зерен и границ зерен определяют многие механические свойства металлов. Когда к металлу прикладывается напряжение, возникают дислокации, которые перемещаются, позволяя металлу деформироваться.
Механические свойства:
Когда к металлам прикладываются небольшие нагрузки (напряжения), они деформируются и возвращаются к своей исходной форме при снятии нагрузки. Сгибание стального листа является примером, когда скрепления изгибаются или растягиваются только на небольшой процент.Это называется упругой деформацией и включает временное растяжение или искривление связей между атомами.
Рисунок 7: Упругая деформация металлического стержня. При приложении более высоких напряжений возникает остаточная (пластическая) деформация. Например, если скрепку сильно согнуть, а затем отпустить, она останется частично согнутой. Эта пластическая деформация включает разрыв связей, часто в результате движения дислокаций. См. Рис. 8. Дислокации легко перемещаются в металлах из-за делокализованной связи, но не перемещаются легко в керамике.Это во многом объясняет, почему металлы пластичны, а керамика - хрупка.
Рисунок 8: Движение дислокации в кристалле. Если поместить под слишком большое напряжение, металл механически разрушится или сломается. Со временем это также может быть результатом множества небольших нагрузок. Самая частая причина (около 80%) выхода металла из строя - усталость. Благодаря приложению и снятию небольших напряжений (до миллионов раз) по мере использования металла в нем образуются и медленно растут небольшие трещины.Со временем металл деформируется или ломается (ломается). (См. Деятельность по обработке металлов)
Обработка:
В промышленности расплавленный металл охлаждают до твердого состояния. Затем твердому металлу механически формируют конкретный продукт. Очень важно, как выполняются эти этапы, поскольку нагрев и пластическая деформация могут сильно повлиять на механические свойства металла.
Влияние размера зерна:
Давно известно, что свойства некоторых металлов можно изменять путем термической обработки.Зерна в металлах имеют тенденцию увеличиваться в размерах по мере нагрева металла. Зерно может увеличиваться в размерах за счет миграции атомов из другого зерна, которые со временем могут исчезнуть. Дислокации не могут легко пересекать границы зерен, поэтому размер зерен определяет, насколько легко дислокации могут перемещаться. Как и ожидалось, металлы с мелкими зернами прочнее, но менее пластичны. На рис. 5 показан пример зеренной структуры металлов.
Закалка и закалка:
Есть много способов термической обработки металлов.Отжиг - это процесс размягчения, при котором металлы нагревают, а затем дают медленно остыть. Большинство сталей можно закалить путем нагрева и закалки (быстрого охлаждения). Этот процесс использовался довольно рано в истории обработки стали. Фактически, считалось, что биологические жидкости лучше всего гасят жидкости, и иногда использовалась моча. В некоторых древних цивилизациях раскаленные лезвия меча иногда вонзались в тела несчастных заключенных! Сегодня металлы закаливают в воде или масле.На самом деле закалка в растворах соленой воды происходит быстрее, поэтому древние не совсем ошибались.
В результате закалки металл становится очень твердым, но при этом хрупким. Осторожно нагревая закаленный металл и давая ему медленно остыть, вы получите металл, который останется твердым, но менее хрупким. Этот процесс известен как отпуск. (См. «Обработка металлов»). Это приводит к появлению большого количества мелких выделений Fe 3 C в стали, которые блокируют движение дислокаций, тем самым обеспечивая упрочнение.
Холодная обработка:
Поскольку пластическая деформация возникает в результате движения дислокаций, металлы можно упрочнять, предотвращая это движение. Когда металл изгибается или приобретает форму, возникают и перемещаются дислокации. По мере увеличения количества дислокаций в кристалле они будут запутываться или скрепляться и не смогут двигаться. Это укрепит металл и усложнит его деформацию. Этот процесс известен как холодная обработка. При более высоких температурах дислокации могут перестраиваться, поэтому упрочнение происходит незначительно.
Можно попробовать со скрепкой. Разогните скрепку и несколько раз согните одну из прямых частей вперед-назад. Представьте себе, что происходит на атомарном уровне. Обратите внимание, что металл сложнее согнуть в одном и том же месте. Вывихи образовались и запутались, увеличивая прочность. Скрепка со временем сломается на изгибе. Очевидно, что холодная обработка работает только до определенной степени! Слишком большая деформация приводит к спутыванию дислокаций, которые не могут двигаться, поэтому металл вместо этого ломается.
Отопление устраняет последствия холодной обработки. При нагревании холоднодеформированных металлов происходит перекристаллизация. Новые зерна образуются и растут, чтобы потреблять холодно обработанную часть. В новых зернах меньше дислокаций, и восстанавливаются первоначальные свойства.
Сплавы:
Наличие в металле других элементов также может изменить его свойства, иногда резко. Расположение и вид связи в металлах позволяет добавлять в структуру другие элементы, образуя смеси металлов, называемые сплавами.Даже если добавленные элементы являются неметаллами, сплавы могут иметь металлические свойства.
Медные сплавы начали производить в самом начале нашей истории. Бронза, сплав меди и олова, была первым известным сплавом. Его было легко получить, просто добавив олово к расплавленной меди. Орудия и оружие из этого сплава были прочнее, чем из чистой меди. Добавление цинка к меди дает еще один сплав - латунь. Хотя латунь труднее производить, чем бронзу, она была известна и в древние времена.(См. «Золотая» Пенни Активность) Типичный состав некоторых сплавов приведен в Таблице 2.
Таблица 2: Состав нескольких сплавов. Сплав Состав Латунь Медь, цинк Бронза Медь, цинк, олово Олово олово, медь Припой Свинец, олово Alnico Алюминий, никель, кобальт, железо Чугун Железо, углерод, марганец, кремний Сталь Железо, углерод (плюс небольшое количество легирующих элементов) Нержавеющая сталь Железо, хром, никель
Сплавы представляют собой смеси, и их процентный состав может варьироваться.Это полезно, потому что свойствами сплавов можно управлять, варьируя состав. Например, электрикам нужен припой с другими свойствами, чем у сантехников. Электрический припой очень быстро затвердевает, образуя почти мгновенное соединение. Это будет непрактично для сантехников, которым нужно время, чтобы установить соединение. Электрический припой содержит около 60% олова, тогда как припой для сантехников - около 30%.
Изначально олово содержало свинец, а поскольку олово использовалось для изготовления тарелок и кубков, вероятно, оно было источником отравления свинцом.Изготовленный сегодня олово не содержит свинца. Расширение знаний о свойствах металлов также приводит к созданию новых сплавов. Некоторые латуни образуют сплавы с памятью формы, которые можно сгибать и возвращать к своей исходной форме при осторожном нагревании. Цинковые сплавы, используемые в качестве покрытия на стали, замедляют коррозию (оцинкованная сталь). Сплавы кадмия находят широкое применение в солнечных элементах. Способность мельхиора противостоять образованию отложений делает его полезным в садках в рыбоводстве.
Чугун и сталь:
Углеродистые стали различаются по процентному содержанию углерода.Количество углерода влияет на свойства стали и ее пригодность для конкретного использования. Стали редко содержат более 1% углерода. Конструкционная сталь содержит около 0,1-0,2% углерода по весу; это делает его немного более пластичным и менее склонным к разрушению во время землетрясений. Сталь, используемая для изготовления инструментов, содержит около 0,5-1% углерода, что делает ее более твердой и износостойкой. Чугун содержит от 2,5 до 4% углерода и находит применение в недорогих приложениях, где его хрупкость не является проблемой. Удивительно, но чистое железо чрезвычайно мягкое и используется редко.Увеличение количества углерода приводит к увеличению твердости металла, как показано на следующем графике. В медленно охлаждаемых сталях углерод увеличивает количество твердого Fe 3 C; в закаленных сталях он также увеличивает твердость и прочность материала.
Рисунок 9: Зависимость твердости стали от% углерода. Рисунок 10: BCC железа, показывающее расположение межузельных атомов углерода. Заколки для бобби и скрепки обрабатываются практически одинаково, но содержат разное количество углерода.Заколки и скрепки изготовлены из холоднокатанной стальной проволоки. Скрепка, содержащая мало углерода, в основном состоит из чистого Fe с некоторым количеством частиц Fe 3 C. Заколка для шкворня имеет больше углерода и, следовательно, содержит большее количество Fe 3 C, что делает ее намного более твердой и прочной.
Свойства стали можно адаптировать для специальных целей путем добавления в сплав других металлов. Титан, ванадий, молибден и марганец входят в число металлов, добавляемых к этим специальным сталям.Нержавеющая сталь содержит минимум 12% хрома, который останавливает дальнейшее окисление, образуя защитный оксид на поверхности.
Коррозия:
Коррозия металлов может быть серьезной проблемой, особенно при долговременных конструкциях, таких как автомобили, мосты и корабли. В большинстве случаев коррозия носит электрохимический (гальванический) характер. Для возникновения коррозии должны присутствовать анод (более легко окисляемая область) и катод (менее легко окисляемая область). Это могут быть разные типы металлов или просто разные участки одного и того же металла.Также должен присутствовать какой-то электролит, который может обеспечивать перенос электронов. Коррозия включает высвобождение электронов на аноде из-за высокого окислительного потенциала атомов на аноде. Когда электроны высвобождаются, образуются катионы металлов, и металл распадается. Одновременно катод, который имеет больший восстановительный потенциал, принимает электроны, либо образуя отрицательные ионы, либо нейтрализуя положительные ионы.
В случае ряда активности или электродвижущей силы металл, такой как цинк, вступает в реакцию с водородом и служит как анодом, так и катодом.(См. Activity Series Activity) Уравнение этой реакции:
2 Zn + 2 H + -> 2 Zn 2+ + H 2 Пузырьки водорода на катоде при разрушении анода. Неровности поверхности, наличие примесей, ориентация зерен, локализованные напряжения и вариации окружающей среды - вот некоторые из факторов, определяющих, почему один кусок металла может служить обоими электродами. Например, головка и острие гвоздя обработаны методом холодной обработки и могут служить анодом, а корпус - катодом.(См. Коррозия от активности железа)
Хотя окисление на аноде и восстановление на катоде являются одновременными процессами, коррозия обычно происходит на аноде. Катод почти никогда не разрушается. В 1824 году Дэви разработал метод защиты корпусов кораблей от коррозии с помощью цинка, который можно периодически заменять. Цинк более активен, чем сталь в корпусе, и будет служить анодом и подвергаться коррозии; им приносят в жертву защиту стальной конструкции. Сталь, которая была бы и анодом, и катодом, обычно служит катодом.Это называется катодной защитой. Трубопроводы также защищены более активным металлическим магнием. Иногда электрические токи поддерживаются в коротких отрезках трубопроводов с такой же металлической проволокой, которая используется в качестве расходуемого анода.
Коррозия - серьезная проблема, которую необходимо решить для эффективного использования металлов. Железо соединяется с кислородом воздуха, образуя оксид железа (ржавчину), что в конечном итоге разрушает полезность металла. (См. Дополнительно: действие химического обогрева рук). К счастью, некоторые металлы, такие как алюминий и хром, образуют защитное оксидное покрытие, предотвращающее дальнейшее окисление (коррозию).Точно так же медь соединяется с серой и кислородом, образуя знакомую зеленую патину.
Понимание химического состава металлов приводит к разработке методов уменьшения и предотвращения коррозии. Атомы хрома примерно того же размера, что и атомы железа, и могут замещать их в кристаллах железа. Хром образует оксидный слой, который позволяет нержавеющей стали противостоять коррозии. Металлы можно окрашивать или покрывать другими металлами; оцинкованная (оцинкованная) сталь является примером. Когда эти два металла используются вместе, более активный цинк корродирует, жертвуя собой ради сохранения стали.
Металлические руды:
Золото, серебро и медь были первыми металлами, которые использовались, поскольку они находятся в свободном или элементарном состоянии. Большинство металлов, встречающихся в природе, сочетаются с другими элементами, такими как кислород и сера. Энергия необходима для извлечения металлов из этих соединений или руд. Исторически сложилось так, что легкость, с которой данный металл может быть извлечена из руды, наряду с доступностью, определялась при его использовании, отсюда и раннее использование меди, олова и железа.Формулы для некоторых руд приведены ниже:
Гематит Fe 2 O 3 Рутил TiO 2 Магнетит Fe 3 O 4 Циркон ZrSiO ZrSiO Пирит FeS 2 Касситерит SnO 2 Халькоцит Cu 2 S Боксит Al 2 O inn 3 Галена PbS
Эти руды представляют собой ионные соединения, в которых металлы существуют в виде положительных ионов.Например, степень окисления железа в гематите +3; степень окисления меди в халькоците +1. Извлечение металлов из их руд представляет собой окислительно-восстановительную (окислительно-восстановительную) реакцию. В элементарном состоянии металлы состоят из атомов, а не ионов. Поскольку у атомов нет общего заряда, ионы металлов в реакции приобретают электроны; они уменьшены.
Общая реакция восстановления меди из халькоцита:
Cu 2 S + O 2 + Энергия -> 2 Cu + SO 2 Это только общая реакция.Весь процесс не так прост. Восстановление металлов из их руд обычно требует ряда химических и механических процессов. Обычно они энергетически дороги, потребляют большое количество тепла и / или электроэнергии. Например, около пяти процентов электроэнергии, потребляемой в Соединенных Штатах, используется для производства алюминия. Изготовление алюминиевой консервной банки, начиная с руды, стоит примерно в сто раз дороже, чем плавление и образование переработанного алюминия. Извлечение металлов из руд может также приводить к образованию загрязняющих веществ, таких как диоксид серы, указанный выше.По возможности, переработка и переработка металлов имеет смысл.
Относительная сложность извлечения металлов из руд указывает на то, что это их предпочтительное состояние. После удаления из руд и в элементарном состоянии большинство металлов проявляют значительную тенденцию реагировать с кислородом и серой и возвращаться в свое естественное состояние; они разъедают! При коррозии металл окисляется. Он теряет электроны, становясь положительным ионом. (См. Раздел "Коррозия металлов")
Сводка по металлам
Металлы обладают полезными свойствами, включая прочность, пластичность, высокие температуры плавления, тепловую и электрическую проводимость и ударную вязкость.Они широко используются в конструкциях и электротехнике. Понимание структуры металлов может помочь нам понять их свойства.
Атомы металлов связаны друг с другом прочными делокализованными связями. Эти связи образованы облаком валентных электронов, которые разделяются между положительными ионами (катионами) металлов в кристаллической решетке. В таком расположении валентные электроны обладают значительной подвижностью и могут легко проводить тепло и электричество. В кристаллической решетке атомы металлов плотно упакованы вместе, чтобы максимизировать прочность связей.Настоящий кусок металла состоит из множества крошечных кристаллов, называемых зернами, которые касаются границ зерен.
Из-за делокализованной природы связей атомы металла могут скользить мимо друг друга, когда металл деформируется, вместо того, чтобы разрушаться, как хрупкий материал. Это движение атомов осуществляется за счет образования и движения дислокаций в решетке. Технологии обработки, которые изменяют связь между атомами или влияют на количество или подвижность дислокаций, могут иметь большое влияние на механические свойства металла.
Упругая деформация металла - это небольшое изменение формы при низком напряжении, которое можно восстановить после снятия напряжения. Этот тип деформации включает растяжение металлических связей, но атомы не скользят друг мимо друга. Пластическая деформация возникает, когда напряжение достаточно для постоянной деформации металла. Этот тип деформации включает разрыв связей, обычно за счет движения дислокаций.
Пластическая деформация приводит к образованию большего количества дислокаций в металлической решетке.Это может привести к снижению подвижности этих дислокаций из-за их тенденции запутываться или скрепляться. Пластическая деформация при температурах, достаточно низких, чтобы атомы не могли перегруппироваться (холодная обработка), может упрочнять металл в результате этого эффекта. Одним из побочных эффектов является то, что металл становится более хрупким. При использовании металла трещины имеют тенденцию к образованию и росту, что в конечном итоге приводит к его разрушению или разрушению.
Дислокации не могут легко пересекать границы зерен. Если металл нагреть, зерна могут стать больше, а материал станет мягче.Нагревание металла и быстрое охлаждение (закалка) с последующим легким нагревом (отпуском) приводит к более твердому материалу из-за образования множества мелких выделений Fe 3 C, которые блокируют дислокации.
Смешивание металлов с другими металлами или неметаллами может привести к получению сплавов с желаемыми свойствами. Сталь, изготовленная из железа и углерода, может существенно различаться по твердости в зависимости от количества добавленного углерода и способа ее обработки. Некоторые сплавы обладают более высокой устойчивостью к коррозии.
Коррозия - основная проблема большинства металлов. Это окислительно-восстановительная реакция, в которой атомы металла образуют ионы, вызывающие ослабление металла. Один из методов, который был разработан для борьбы с коррозией в конструкциях, включает прикрепление расходуемого анода, сделанного из металла с более высоким окислительным потенциалом. В этом случае анод подвергается коррозии, оставляя катод, конструктивную часть, неповрежденным. Образование защитного покрытия на внешней стороне металла также может противостоять коррозии.Стали, содержащие металлический хром, образуют защитное покрытие из оксида хрома. Алюминий также устойчив к коррозии благодаря образованию прочного оксидного покрытия. Медь образует знакомую зеленую патину, реагируя с серой и кислородом в воздухе.
В природе можно найти лишь несколько чистых металлов. Большинство металлов существует в виде руд, соединений металла с кислородом или серой. Для отделения чистого металла от руды часто требуется большое количество энергии в виде тепла и / или электричества. Из-за такого большого расхода энергии имеет смысл по возможности утилизировать металлы.
Вопросы для обсуждения
1. Как руды добываются из земли?
2. Назовите 4 сплава и металлы, из которых они сделаны.
3. Какое влияние оказывает «холодная обработка» на металлы?
4. Какой процесс делает металлы твердыми, но хрупкими?
5. Какой процесс делает металлы более мягкими и удобными в обработке?
6. Назовите три метода уменьшения коррозии.
7. Дайте 2 ценных результата переработки.
Проблема
Предположим, что радиус одного атома железа равен 1,24 ангстрем (1 ангстрем = 1 x 10 -8 см). Какой будет плотность объемно центрированного кубического (ОЦК) железа в граммах на кубический сантиметр? Подсказка: найдите массу и объем одной элементарной ячейки. Не забудьте считать только долю каждого атома в ячейке.
Добавочный номер:
Максимальная растворимость углерода в железе ОЦК составляет один атом на каждые 5000 атомов железа.Какой будет плотность стали при максимальном растворении углерода?
Решение
= m / V = # атомов x (масса / атом) / объем ячейки
В ОЦК-железе на элементарную ячейку приходится два атома железа. (8 х 1/8 + 1)
Один атом железа имеет массу 55,85 а.е.м. или 9,27 x 10 -23 граммов.
Общая масса одной элементарной ячейки составляет 1,85 x 10 -22 граммов.
Пусть (r) будет радиус атома железа.Атомы в углах контактируют с атомом в середине, в результате чего диагональ коробки равна (4r).
Если мы назовем одну сторону коробки (L), диагональ грани куба будет равна (квадратный корень из 2) умноженным на (L).
Одна сторона, диагональ грани куба и диагональ прямоугольника образуют прямоугольный треугольник. Используя теорему Пифагора, (L) 2 + (квадратный корень 2 x (L)) 2 = (4r) 2 .
Решая для L и подставляя для (r), мы находим, что L = 2.86 ангстрем или 2,86 x 10 -8 см.
Объем куба (элементарной ячейки) равен (л) 3 = 2,34 x 10 -23 см 3 . Разделив массу на объем, получим:
Плотность = 7,91 г / см 3 .
Следующая тема: Список литературы
Металлы Содержание
MAST Home Page
Новое исследование показывает, почему оксидазы гем-меди предпочитают медь железу
Предоставлено: Бхаги-Дамодаран и др. (Физ.org) - семейство ферментов, известных как гемоксидазы меди (HCO), играет ключевую роль в восстановлении кислорода в воду во время клеточного дыхания. Одна из загадок, окружающих гем-медные оксидазы, заключается в том, почему негемовый металлический центр, как правило, представляет собой медь, а не железо.
Группа исследователей из Университета Иллинойса, Технологического института Стивенса и Орегонского университета здоровья и науки разработала систему модели биосинтетического белка, которая воспроизводит активные центры и многие структурные особенности встречающихся в природе HCO.С помощью своей модельной системы они рассмотрели различия в восстановлении кислорода до воды, когда негемовым металлом является железо, по сравнению с медью. Они обнаружили, что негемовый металл играет ключевую роль в донорстве электронов и разрыве связи O-O, и что, вероятно, именно d-орбитальная электронная конфигурация меди вызывает ее повышенную активность. Их работа опубликована в журнале « Nature Chemistry ».
«HCO изучаются уже более полувека, но выбор меди по природе в негемовом центре по сравнению с ионами других металлов не был понят», - говорит ведущий автор д-р.Амбика Бхаги-Дамодаран. «Наша работа увлекательна, потому что мы наконец решили этот давний вопрос, касающийся структуры и функции этого очень важного респираторного фермента».
Их синтетический аналог естественной оксидазы гем-меди состоит из миоглобина, небольшого белка, обнаруженного в мышцах, который является двоюродным братом гемоглобина. Миоглобин имеет железосодержащий гемовый центр и обозначается как Fe B Mb (Fe II ), поскольку гемовое железо находится в степени окисления 2+. Fe B Mb (Fe II ) получали и очищали без металла в негемовом участке с использованием ранее описанной процедуры.
Пустой Fe B Mb (Fe II ) титровали Zn II , который не является окислительно-восстановительно-активным и служит экспериментальным контролем, Cu I и Fe II . Спектроскопия в ультрафиолетовой и видимой области подтвердила, что каждый металл включен в негемовый участок. Рентгеновская кристаллография подтвердила, что каждый из этих вариантов металл-Fe B Mb (Fe II ) обнаруживал сходные активные центры. Другими словами, это подтвердило, что идентичность негемового металла не вызывает структурных изменений.
Bhagi-Damodaran et al. затем исследовали различия в каталитической активности железосодержащих и медьсодержащих частиц. Они смотрели на скорость реакции, а также на селективность продукта. Их ферментативный анализ показал, что Fe II -Fe B Mb (Fe II ) и Cu I -Fe B Mb (Fe II ) имели оксидазную активность в 11 и 30 раз выше по сравнению с к контролю Zn II и Fe B Mb (Fe II ) без негемового металла.
Используя электронный парамагнитный резонанс и ближнюю рентгеновскую спектроскопию, они определили, что негемовый Cu I окислен до Cu II , а негемовый Fe II окислен до Fe II , таким образом подтверждая, что негемовый металл играет центральную роль в восстановлении кислорода в качестве донора электронов.Чтобы лучше понять разницу между медью и железом, Bhagi-Damodaran et al. изучили стандартные потенциалы восстановления (E o ') Fe III / Fe II и Cu II / Cu I на участке модельного фермента. (Гемовое железо было заменено редокс-неактивным протопорфирином цинка с использованием ранее описанного протокола.)
Они обнаружили у обоих видов одну обратимую волну, которая соответствовала E o ' 259 ± 20 мВ для железа и E o' 387 ± 25 мВ для меди.Поскольку стандартные восстановительные потенциалы связаны с термодинамической движущей силой реакции, более высокое значение меди означает, что Cu II / Cu I более эффективно принимает электроны для электрохимического восстановления кислорода до воды.
Последний шаг заключался в том, чтобы посмотреть, взаимодействует ли негемовое железо или медь с гемом-связанным O 2 , чтобы помочь в расщеплении связи O-O. С помощью резонансной рамановской спектроскопии авторы изучили колебания связи O-O и обнаружили, что концевой атом кислорода взаимодействует с негемовым металлом, ослабляя связь O-O.Чтобы проверить, влияет ли идентичность негемового металла на длину связи O-O, авторы провели расчеты по теории функциональной плотности и обнаружили, что длина связи O-O была самой длинной в Cu I -Fe B Mb (Fe II ). Эти результаты показали, что негемовый металл играет важную роль в активации молекулы кислорода и облегчении расщепления O-O.
Предпочтение HCO меди, вероятно, связано с более высоким окислительно-восстановительным потенциалом Cu, а также с его d-орбитальной электронной конфигурацией.Медь-II имеет девять d-электронов, а Fe III имеет пять d-электронов. Эта дополнительная электронная плотность дает меди преимущество в орбитальных взаимодействиях с самыми высокими занятыми молекулярными орбиталями кислорода.
В целом, эта работа дает важную информацию о встречающихся в природе комплексах гем-медь. По словам автора-корреспондента профессора И Лу: «Мы ожидаем, что наша работа станет отправной точкой для более целенаправленных усилий по использованию различных ионов металлов в негемовых участках для различных биохимических реакций.Это стремление может помочь в разработке новых катализаторов, необходимых в альтернативных энергетических технологиях и других биотехнологических приложениях ».
Выявлена структура фермента, который патогенные бактерии используют для снижения содержания кислорода
Дополнительная информация: Амбика Бхаги-Дамодаран и др.Почему медь предпочтительнее железа для активации кислорода и восстановления гем-медных оксидаз, Nature Chemistry (2016). DOI: 10.1038 / nchem.2643 Абстракция
Гем-медная оксидаза (HCO) катализирует естественное восстановление кислорода до воды с помощью гем-медного центра. Несмотря на десятилетия исследований HCO, роль негемных металлов и причина того, почему природа выбрала медь перед другими металлами, такими как железо, остаются неясными. Здесь мы используем биосинтетическую модель HCO в миоглобине, которая избирательно связывает различные негемные металлы, чтобы продемонстрировать 30-кратное и 11-кратное повышение оксидазной активности Cu- и Fe-связанных миметиков HCO, соответственно, по сравнению с Zn- связанные мимики.Подробные электрохимические, кинетические и колебательные спектроскопические исследования в тандеме с расчетами теоретической теории функционала плотности демонстрируют, что негемный металл не только отдает электроны кислороду, но и активирует его для эффективного разрыва связи O – O. Кроме того, более высокий окислительно-восстановительный потенциал меди и усиленное ослабление связи O – O из-за более высокой электронной плотности на d-орбитали меди являются ключевыми для ее более высокой оксидазной активности по сравнению с железом. Эта работа решает давний вопрос биоэнергетики и создает химико-биологическую основу для разработки будущих катализаторов восстановления кислорода.
© 2016 Phys.org
Ссылка :
Новое исследование показывает, почему оксидазы гем-меди предпочитают медь железу (2016, 24 ноября)
получено 9 ноября 2020
с https: // физ.org / news / 2016-11-гем-медь-оксидазы-медь-железо.html
Этот документ защищен авторским правом. За исключением честных сделок с целью частного изучения или исследования, никакие
часть может быть воспроизведена без письменного разрешения. Контент предоставляется только в информационных целях.
Quia - Обзор плотности
A B Отрывание куска бумаги Физическое изменение Горение куска бумаги Химическое изменение Растворение поваренной соли 907 в воде Физическое изменение Выпечка торта Химическое изменение Ржавление железного гвоздя Химическое изменение Кипящая вода Физическое изменение Потускнение серебра Химическое изменение6 Смешивание уксуса и пищевой соды Химическое изменение Сжигание древесины Химическое изменение Изгиб медной проволоки Физическое изменение Плавление шоколада Молочная эволюция Физический канал ange Конденсация воды Физические изменения Алюминиевый блок занимает объем 15.0 мл и вес 40,5 г. Какая у него плотность? d = 2,70 г / мл Металлическая ртуть наливается в градуированный цилиндр, вмещающий ровно 22,5 мл. Ртуть, использованная для заполнения цилиндра, весит 306,0 г. По этой информации рассчитайте плотность ртути. d = 13,6 г / мл Каков вес этилового спирта, который точно заполняет емкость 200,0 мл? Плотность этилового спирта 0,789 г / мл. г = (0,789 г / мл) (200.0 мл) = 158 г Прямоугольный блок металлической меди весит 1896 г. Размеры блока 8,4 см на 5,5 см на 4,6 см. Какова плотность меди из этих данных? d = 1896 г / 212,52 см3 = 8,9 г / см3 Колба массой 345,8 г наполнена 225 мл четыреххлористого углерода. Масса колбы и четыреххлористого углерода составляет 703,55 г. Исходя из этой информации, рассчитайте плотность четыреххлористого углерода. d = 357.75 г / 225 мл = 1,59 г / мл Рассчитайте плотность серной кислоты, если 35,4 мл кислоты весит 65,14 г. d = 1,84 г / мл Найдите массу 250,0 мл бензола. Плотность бензола 0,8765 г / мл. г = (0,8765 г / мл) (250,0 мл) = 219,1 г Блок свинца имеет размеры 4,50 см на 5,20 см на 6,00 см. Блок весит 1587 г. По этой информации рассчитайте плотность свинца.
Плотность материалов
Плотность материала определяется как масса материала на единицу объема.
и обозначается символом ρ (rho).Единица плотности в системе СИ - кг / м 3 , а стандартная единица плотности США - фунт / фут 3 . Плотность - важное характеристическое свойство материала, которое зависит от температуры и давления.
Значения плотности при комнатной температуре для некоторых распространенных материалов, включая
алюминий, сталь, бронза, железо, латунь, бетон, медь, золото, серебро, инвар,
магний, никель, древесина, титан и цинк представлены в следующих
диаграмма плотности материалов.
Значения плотности материалов Материал Плотность (ρ) кг / м 3 фунт / фут 3 Алюминий 2700 168.6 Алюминиевый сплав 6061-T6 2710 169,2 Алюминиевый сплав 7075-Т6 2800 174,8 Асфальт 2120 132.3 Латунь, 60-40 8400 524,4 Красная латунь (85% Cu, 15% Zn) 8740 545,6 Желтая латунь (65% Cu, 35% Zn) 8470 528.8 Кирпич обыкновенный 1800 112,4 Олово бронза 8800 549,4 Марганцевая бронза 8360 521.9 Карбон, алмаз 3250 202,9 Углерод, графит 2000–2500 124,9 - 156,1 Уголь 1200–1500 74.9 - 93,6 Бетон 2200 137,3 Медь техническая 8300 518,2 Стекло, 98% кремнезема 2190 136.7 Стекло, тарелка 2500 156,1 Стекло, шерсть 200
Польза для здоровья, рекомендуемое потребление, источники и риски
Медь - важный микроэлемент, необходимый для выживания.Он содержится во всех тканях организма и играет роль в создании красных кровяных телец и поддержании нервных клеток и иммунной системы.
Он также помогает организму образовывать коллаген и усваивать железо, а также играет роль в производстве энергии.
Большая часть меди в организме содержится в печени, мозге, сердце, почках и скелетных мышцах.
Как слишком много, так и слишком мало меди могут повлиять на работу мозга. Нарушения связаны с болезнью Менкеса, Вильсона и Альцгеймера.
Дефицит встречается редко, но может привести к сердечно-сосудистым заболеваниям и другим проблемам.
В этой статье рассматриваются преимущества меди для здоровья, источники и любые потенциальные риски для здоровья.
Краткие сведения о меди:
- Медь необходима для ряда функций организма.
- Дефицит меди встречается редко, за исключением особых состояний, таких как болезнь Менкеса.
- Добавки меди обычно не нужны и могут привести к дисбалансу.
- Дисбаланс меди связывают с болезнью Альцгеймера.
- Любой, кто рассматривает возможность приема добавок меди, должен сначала поговорить с врачом.
Поделиться на Pinterest Медь - полезный материал, но это также ценный минерал, содержащийся в продуктах питания. Медь - важное питательное вещество для организма.
Вместе с железом он позволяет организму образовывать красные кровяные тельца.
Он помогает поддерживать здоровье костей, кровеносных сосудов, нервов и иммунную функцию, а также способствует усвоению железа.
Достаточное количество меди в рационе может помочь предотвратить сердечно-сосудистые заболевания и остеопороз.
Здоровье сердечно-сосудистой системы
Низкий уровень меди связан с высоким уровнем холестерина и высоким кровяным давлением.Одна группа исследователей предположила, что некоторым пациентам с сердечной недостаточностью могут быть полезны добавки с медью.
Исследования на животных связывают низкие уровни меди с сердечно-сосудистыми заболеваниями, но остается неясным, окажет ли дефицит такое же влияние на людей.
Передача нейронных сигналов
В 2016 году профессор Крис Чанг, химик, участвующий в программе Sackler Sabbatical Exchange в Беркли, Калифорния, разработал и использовал флуоресцентный зонд для отслеживания движения меди в нервных клетках и из них.
Профессор Чанг говорит: «Медь подобна переключателю тормоза или диммера, по одному на каждую нервную клетку».
Его команда обнаружила, что если в клетку попадает большое количество меди, это, по-видимому, снижает передачу сигналов нейронов. Когда уровень меди в этой клетке падает, передача сигналов возобновляется.
Иммунная функция
Слишком мало меди может привести к нейтропении. Это недостаток лейкоцитов или нейтрофилов, которые борются с инфекцией.
Человек с низким уровнем нейтрофилов более подвержен инфекционным заболеваниям.
Остеопороз
Тяжелый дефицит меди связан с более низкой минеральной плотностью костей и повышенным риском остеопороза.
Необходимы дополнительные исследования того, как маргинальный дефицит меди может повлиять на здоровье костей и как добавки меди могут помочь предотвратить и лечить остеопороз.
Производство коллагена
Медь играет важную роль в поддержании коллагена и эластина, основных структурных компонентов нашего тела. Ученые выдвинули гипотезу о том, что медь может обладать антиоксидантными свойствами и что полезное для здоровья потребление вместе с другими антиоксидантами может помочь предотвратить старение кожи.
Без достаточного количества меди организм не может заменить поврежденную соединительную ткань или коллаген, составляющий основу кости.
Это может привести к ряду проблем, в том числе к дисфункции суставов, поскольку ткани тела начинают разрушаться.
Артрит
Исследования на животных показали, что медь может помочь предотвратить или замедлить развитие артрита, и для этой цели люди носят медные браслеты. Однако никакие исследования на людях не подтвердили этого.
Антиоксидантное действие
Медь также может иметь антиоксидантную функцию.Это может помочь снизить выработку свободных радикалов.
Свободные радикалы могут повреждать клетки и ДНК, вызывая рак и другие заболевания.
Рекомендуемая суточная доза (RDA) составляет около 900 микрограммов (мкг) в день для подростков и взрослых.
Верхний предел для взрослых в возрасте 19 лет и старше составляет 10 000 мкг или 10 миллиграммов (мг) в день. Потребление выше этого уровня может быть токсичным.
Как дефицит меди, так и токсичность меди в Соединенных Штатах (США) редки.
Хотя дефицит меди встречается редко, некоторые состояния здоровья и другие факторы могут увеличить риск.
К ним относятся:
- генетические дефекты метаболизма меди
- проблемы абсорбции
- слишком высокое потребление добавок цинка или витамина C
- некоторые состояния, такие как демиелинизация центральной нервной системы (ЦНС), полинейропатия, миелопатия и воспаление зрительного нерва
Поскольку медь хранится в печени, ее дефицит со временем развивается медленно.
Цинк и витамин C
Высокое потребление цинка (150 мг в день или больше) и витамина C (более 1500 мг в день) может вызвать дефицит меди, конкурируя с медью за всасывание в кишечнике.
Причины дефицита у младенцев
Дефицит меди был замечен у младенцев, потребляющих коровье молоко вместо смеси. Коровье молоко имеет низкое содержание меди. Детей до 1 года в идеале следует кормить грудью, а в противном случае - искусственными смесями. Коровье молоко не содержит необходимых питательных веществ для младенца.
Низкий уровень меди может привести к:
Болезни обмена веществ могут повлиять на усвоение организмом витаминов и минералов.
Болезнь Менкеса
Болезнь Менкеса, Х-сцепленное рецессивное заболевание, отрицательно влияет на метаболизм меди в головном мозге. Это может привести к нарушению нормального развития и задержке нервного развития у младенцев в возрасте от 6 до 8 недель. Ребенок с этим заболеванием может не дожить до 3-х летнего возраста.
Подкожные инъекции меди могут помочь нормализовать уровень меди в крови, но помогут ли они нормализовать уровень меди в мозге, зависит от типа генетической мутации.
Одно клиническое испытание показало, что лечение младенцев до появления симптомов может помочь улучшить крупную моторику, мелкую моторику и адаптивные навыки, личные и социальные навыки, а также развитие языковой нервной системы у детей. Это также улучшило рост.
Другие эффекты дефицита меди
Дефицит меди также был связан с:
- повышенным риском инфекции
- остеопорозом
- депигментацией волос и кожи
- анемией, поскольку медь способствует образованию красных кровяных телец
Слишком мало или слишком много меди может повредить ткань мозга.
У взрослых наблюдается нейродегенерация в результате дисбаланса меди. Это может быть связано с проблемами с механизмами, участвующими в метаболизме меди для использования в мозге.
Высокий уровень меди может привести к окислительному повреждению мозга. Например, при болезни Вильсона высокие уровни меди накапливаются в печени, головном мозге и других жизненно важных органах.
Возможная связь с болезнью Альцгеймера
Чрезмерное накопление меди также связано с болезнью Альцгеймера.
Профессор Чанг и его коллеги выдвинули гипотезу, что когда медь накапливается необычным образом, это может вызвать образование амилоидных бляшек на нервной клетке.
Накопление амилоидных бляшек может привести к болезни Альцгеймера и другим нейродегенеративным расстройствам.
Медь содержится в самых разных продуктах питания.
Хорошие источники включают:
- устрицы и другие моллюски
- цельнозерновые
- бобы
- картофель
- дрожжи
- темная листовая зелень
- какао
- сушеные фрукты
- черный перец, такие как почки
и печень- орехи, такие как кешью и миндаль
Большинство фруктов и овощей содержат мало меди, но она присутствует в цельнозерновых продуктах, и ее добавляют в некоторые сухие завтраки и другие обогащенные продукты.
Добавки меди доступны, но лучше сначала попытаться получить необходимые витамины и минералы с пищей, чтобы снизить риск дисбаланса. Мало кому нужно принимать медные добавки.
Кроме того, питательные вещества в пище работают вместе, создавая более значительный эффект, чем эффект, достигаемый изолированным приемом отдельных питательных веществ.
Большинство поливитаминных добавок содержат 2 мг меди, что составляет половину безопасного и адекватного диапазона потребления, установленного Советом по пищевым продуктам и питанию (FNB).
Медные добавки могут взаимодействовать со следующим:
- противозачаточные таблетки и гормональная терапия
- нестероидные противовоспалительные средства (НПВП), такие как аспирин и ибупрофен
- пеницилламин, используемый для снижения уровня меди при болезни Вильсона
- аллопуринол, средство для лечения подагры
- циметидин или тагамет, использование при язве желудка и желудочном рефлюксе
- цинковые добавки
Эти продукты могут снижать или повышать уровни меди в крови, что приводит к дисбалансу.
Медь токсичность
Не сообщалось о побочных эффектах от нормального диетического потребления меди, но симптомы могут появиться, если есть:
- чрезмерное потребление
- высокий уровень меди в питьевой воде, например, колодезной или другой воде. хранятся в медных трубах
- воздействие химикатов, содержащих высокие уровни меди
- использование медных кастрюль
Признаки токсичности меди включают:
- тошноту, рвоту, диарею и боль в животе
- головную боль
- головокружение
- слабость
- металлический привкус во рту
Более серьезные эффекты встречаются редко, но они включают:
Повышенный уровень меди в сыворотке связан с более высоким риском сердечно-сосудистых заболеваний.
Вода, содержащая более 6 мг меди на литр, может вызвать проблемы с желудком. Если питьевая вода вызывает симптомы, пациенту следует пройти тестирование.
Дефицит меди может иметь негативные последствия для здоровья, но редко встречается у здоровых людей, соблюдающих сбалансированную диету.
Потребность в питательных веществах сначала должна удовлетворяться за счет пищевых продуктов, а затем добавки могут использоваться как резерв.
Любой, кто рассматривает возможность приема добавки, должен сначала проконсультироваться с врачом.Управление по контролю за продуктами и лекарствами (FDA) не контролирует качество или чистоту пищевых добавок.
WebElements Periodic Table »Железо» свойства свободных атомов
Мн Fe Co TC Ру Rh
- Актиний ☢
- Алюминий
- Алюминий
- Америций ☢
- Сурьма
- Аргон
- Мышьяк
- Астатин ☢
- Барий
- Берклий ☢
- Бериллий
- висмут
- Бориум ☢
- Бор
- Бром
- Кадмий
- Цезий
- Кальций
- Калифорний ☢
- Карбон
- Церий
- Цезий
- Хлор
- Хром
- Кобальт
- Copernicium ☢
- Медь
- Кюрий ☢
- Дармштадтиум ☢
- Дубний ☢
- Диспрозий
- Эйнштейний ☢
- Эрбий
- Европий
- Фермий ☢
- Флеровий ☢
- фтор
- Франций
- Гадолиний
- Галлий
- Германий
- Золото
- Гафний
- Калий ☢
- Гелий
- Гольмий
- Водород
- Индий
- Йод
- Иридий
- Утюг
- Криптон
- Лантан
- Лоуренсий ☢
- Свинец
- Литий
- Ливерморий ☢
- Лютеций
- Магний
- Марганец
- Мейтнерий ☢
- Менделевий ☢
- Меркурий
- молибден
- Московий ☢
- Неодим
- Неон
- Нептуний
- Никель
- Нихоний ☢
- Ниобий
- Азот
- Нобелий
- Оганессон ☢
- Осмий
- Кислород
- Палладий
- фосфор
- Платина
- Плутоний ☢
- Полоний
- Калий
- празеодим
- Прометий ☢
- Протактиний ☢
- Радий ☢
- Радон ☢
- Рений
- Родий
- Рентгений ☢
- Рубидий
- Рутений
- Резерфорд ☢
- Самарий
- Скандий
- Сиборгий ☢
- Селен
- Кремний
- Серебро
- Натрий
.
Плотность металлов:
Platinum
Золото
Металлы Содержание MAST Home Page
Гем-медная оксидаза (HCO) катализирует естественное восстановление кислорода до воды с помощью гем-медного центра. Несмотря на десятилетия исследований HCO, роль негемных металлов и причина того, почему природа выбрала медь перед другими металлами, такими как железо, остаются неясными. Здесь мы используем биосинтетическую модель HCO в миоглобине, которая избирательно связывает различные негемные металлы, чтобы продемонстрировать 30-кратное и 11-кратное повышение оксидазной активности Cu- и Fe-связанных миметиков HCO, соответственно, по сравнению с Zn- связанные мимики.Подробные электрохимические, кинетические и колебательные спектроскопические исследования в тандеме с расчетами теоретической теории функционала плотности демонстрируют, что негемный металл не только отдает электроны кислороду, но и активирует его для эффективного разрыва связи O – O. Кроме того, более высокий окислительно-восстановительный потенциал меди и усиленное ослабление связи O – O из-за более высокой электронной плотности на d-орбитали меди являются ключевыми для ее более высокой оксидазной активности по сравнению с железом. Эта работа решает давний вопрос биоэнергетики и создает химико-биологическую основу для разработки будущих катализаторов восстановления кислорода.
Quia - Обзор плотности
| Мн | Fe | Co |
|---|---|---|
| TC | Ру | Rh |

 Главным образом применяется в авиации.
Главным образом применяется в авиации. Площадь круга, зная диаметр, определить несложно. Диаметр в квадрате умножается на 3,14 (число пи), делится на 4.
Площадь круга, зная диаметр, определить несложно. Диаметр в квадрате умножается на 3,14 (число пи), делится на 4. ЭКСТРАКЦИОННО-ФОТОМЕТРИЧЕСКИЙ МЕТОД ОПРЕДЕЛЕНИЯ МЕДИ
ЭКСТРАКЦИОННО-ФОТОМЕТРИЧЕСКИЙ МЕТОД ОПРЕДЕЛЕНИЯ МЕДИ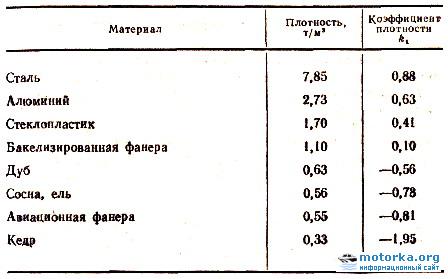 4а. (Введен дополнительно, Изм. № 2).
4а. (Введен дополнительно, Изм. № 2).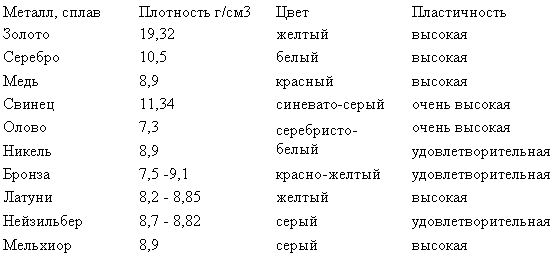 5. (Введен дополнительно, Изм. № 1).
5. (Введен дополнительно, Изм. № 1).