Металлические свойства химических элементов
В настоящий момент науке известно сто пять химических элементов, систематизированных в виде периодической таблицы. Подавляющее большинство из них причисляют к металлам, что подразумевает наличие у этих элементов особых качеств. Это так называемые металлические свойства. К таким характеристикам, в первую очередь, относятся пластичность, повышенная тепло- и электропроводимость, способность к образованию сплавов, низкое значение потенциала ионизации.

Металлические свойства того или иного элемента обусловлены способностью его атомов при возникновении взаимодействия с атомными структурами других элементов смещать в их направлении электронные облака или же «отдавать» им свои свободные электроны. Самыми активными металлами являются те, что имеют низкую энергию ионизации и электроотрицательность. Также ярко выраженные металлические свойства характерны для элементов, имеющих максимально большой радиус атома и предельно малое число внешних (валентных) электронов.
По мере наполнения валентной орбиты количество электронов во внешнем слое атомной структуры возрастает, и радиус, соответственно, уменьшается. В связи с этим атомы начинают стремиться к присоединению свободных электронов, а не к их отдаче. Металлические свойства таких элементов приобретают тенденцию к уменьшению, а их неметаллические свойства – к увеличению. И, наоборот, при увеличении атомного радиуса отмечается усиление металлических свойств. Поэтому характерной общей чертой всех металлов являются, так называемые, восстановительные качества – та самая способность атома отдавать свободные электроны.
Наиболее ярко металлические свойства элементов проявляются у веществ первой, второй групп главных подгрупп периодической таблицы, а также у щелочных и щелочноземельных металлов. Но самые сильные восстановительные качества наблюдаются у франция, а в водной среде – у лития благодаря более высокому показателю энергии гидратации.
Количество элементов, у которых проявляются металлические свойства, в пределах периода возрастает с увеличением номера периода. В периодической таблице металлы от неметаллов отделены диагональной линией, которая тянется от бора к астату. По этой разделительной черте расположены элементы, у которых в равной степени проявляются и те, и другие качества. К таким веществам относятся кремний, мышьяк, бор, германий, астат, сурьма и теллур. Данная группа элементов называется металлоидами.
Каждый период характеризуется наличием своеобразной «пограничной зоны», в которой располагаются элементы с двойственными качествами. Следовательно, переход от ярко выраженного металла к типичному неметаллу осуществляется постепенно, что и нашло отражение в периодической таблице.
Общие свойства металлических элементов (высокая электропроводимость, теплопроводность, ковкость, характерный блеск, пластичность и др.) обусловлены схожестью их внутреннего строения, а точнее – наличием кристаллической решетки. Однако существует немало качеств (плотность, твердость, температура плавления), которые придают всем металлам сугубо индивидуальные физико-химические свойства. Эти характеристики зависят от строения кристаллической решетки каждого конкретного элемента.
Металлические и неметаллические свойства химических элементов.
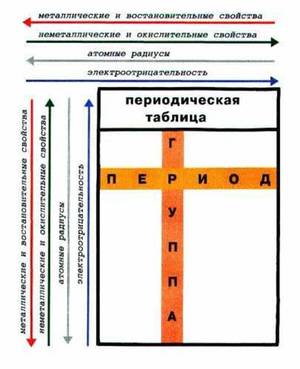
а) Закономерности, связанные с металлическими и неметаллическими свойствами элементов.
1. При перемещении вдоль периода СПРАВА НАЛЕВО металлические свойства элементов УСИЛИВАЮТСЯ. В обратном направлении возрастают неметаллические.
Слева направо в периоде также увеличивается и заряд ядра. Следовательно, увеличивается притяжение к ядру валентных электронов и затрудняется их отдача.
2. При перемещении СВЕРХУ ВНИЗ вдоль групп УСИЛИВАЮТСЯ МЕТАЛЛИЧЕСКИЕ свойства элементов. Это связано с тем, что ниже в группах расположены элементы, имеющие уже довольно много заполненных электронных оболочек. Их внешние оболочки находятся дальше от ядра.
б) Закономерности, связанные с окислительно-восстановительными свойствами. Изменения электроотрицательности элементов.
1. СЛЕВА НАПРАВО УСИЛИВАЮТСЯ ОКИСЛИТЕЛЬНЫЕ свойства, а при движении
2. ЭЛЕКТРООТРИЦАТЕЛЬНОСТЬ ВОЗРАСТАЕТ тоже СЛЕВА НАПРАВО, достигая максимума у галогенов.
3. При перемещении СВЕРХУ ВНИЗ по группам ЭЛЕКТРООТРИЦАТЕЛЬНОСТЬ УМЕНЬШАЕТСЯ. Это связано с возрастанием числа электронных оболочек, на последней из которых электроны притягиваются к ядру все слабее и слабее.
в) Закономерности, связанные с размерами атомов.
1. Размеры атомов (АТОМНЫЕ РАДИУСЫ) при перемещении СЛЕВА НАПРАВО вдоль периода УМЕНЬШАЮТСЯ.
2. При перемещении СВЕРХУ ВНИЗ АТОМНЫЕ РАДИУСЫ элементов РАСТУТ, потому что заполнено больше электронных оболочек.
Вопрос 3.
Строение вещества. Гибридизация орбиталей. Типы химических связей. Потенциал ионизации и электроотрицательность.
Строение вещества
Все тела состоят из отдельных частиц — молекул и атомов. Молекулы — это наименьшие частицы вещества. Молекулы состоят из атомов.
Основные сведения о составе вещества:
1) Все тела состоят из отдельных частиц (молекул и атомов), между которыми есть промежутки.
2) Молекулы непрерывно и хаотично движутся.
3) Молекулы взаимодействуют между собой (притягиваются и отталкиваются).
1) Молекулы одного и того же вещества одинаковы.
2) При нагревании промежутки между молекулами увеличиваются, а при охлаждении — уменьшаются.
3) С увеличением температуры, скорость движения молекул возрастает.
По типу строения все вещества делятся на молекулярные и немолекулярные. Среди органических веществ преобладают молекулярные вещества, среди неорганических — немолекулярные.
По типу химической связи вещества делятся на вещества с ковалентными связями, вещества с ионными связями (ионные вещества) и вещества с металлическими связями (металлы).
Вещества с ковалентными связями могут быть молекулярными и немолекулярными. Это существенно сказывается на их физических свойствах.
Молекулярные вещества состоят из молекул, связанных между собой слабыми межмолекулярными связями, к ним относятся: H2, O2, N2, Cl2, Br2, S8, P4 и другие простые вещества; CO2, SO2, N2O5, H2O, HCl, HF, NH3, CH4, C2H5OH, органические полимеры и многие другие вещества. Эти вещества не обладают высокой прочностью, имеют низкие температуры плавления и кипения, не проводят электрический ток, некоторые из них растворимы в воде или других растворителях.
Немолекулярные вещества с ковалентными связями или атомные вещества (алмаз, графит, Si, SiO2, SiC и другие) образуют очень прочные кристаллы (исключение — слоистый графит), они нерастворимы в воде и других растворителях, имеют высокие температуры плавления и кипения, большинство из них не проводит электрический ток (кроме графита, обладающего электропроводностью, и полупроводников — кремния, германия и пр.)
Все ионные вещества, естественно, являются немолекулярными. Это твердые тугоплавкие вещества, растворы и расплавы которых проводят электрический ток. Многие из них растворимы в воде.
Гибридизация орбиталей — это изменение формы некоторых орбиталей при образовании ковалентной связи для достижения более эффективного перекрывания орбиталей.
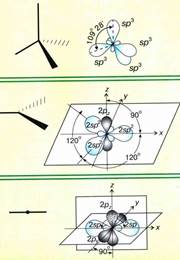 sp3— Гибридизация. Одна s- орбиталь и три p- орбитали превращаются в четыре одинаковые «гибридные» орбитали, угол между осями которых равен 109°28′. Молекулы, в которых осуществляется sp3— гибридизация, имеют тетраэдрическую геометрию (CH4, NH3).
sp3— Гибридизация. Одна s- орбиталь и три p- орбитали превращаются в четыре одинаковые «гибридные» орбитали, угол между осями которых равен 109°28′. Молекулы, в которых осуществляется sp3— гибридизация, имеют тетраэдрическую геометрию (CH4, NH3).
sp2— Гибридизация. Одна s- орбиталь и две p- орбитали превращаются в три одинаковые «гибридные» орбитали, угол между осями которых равен 120°.
sp- Гибридизация. Одна s- орбиталь и одна p- орбиталь превращаются в две одинаковые «гибридные» орбитали, угол между осями которых равен 180°. Молекулы, в которых осуществляется sp- гибридизация, имеют линейную геометрию.
Типы химических связей.
1) Ионная (металл + неметалл)
2) Ковалентная (неметалл + неметалл с помощью общих электронных пар)
Виды: * полярная (разные неметаллы)
* неполярная (одинаковые неметаллы)
* образована донорно-акцепторным механизмом
Обменный механизм — в образовании связи участвуют одноэлектронные атомные орбитали, т.е. Каждый из атомов предоставляет в общее пользование по одному электрону:
Донорно-акцепторный механизм (координационная связь) — химическая связь между двумя атомами или группой атомов, осуществляемая за счет неподеленной пары электронов одного атома (донора) и свободной орбитали другого атома (акцептора) .
3) Металлическая (между атомами металлов, между ионами металлов и общими свободными электронами)
4) Водородная (между водородом одной молекулы и другим более электроотрицательным элементом (O, S, N, F) и с другой молекулой)
Потенциал ионизации атома — минимальная разность потенциалов U, которую должен пройти электрон в ускоряющем электрическом поле, чтобы приобрести кинетическую энергию, достаточную для ионизации атома.
Электроотрицательность (ЭО)– относительная способность атомов притягивать электроны при связывании с другими атомами. Электроотрицательность характеризует способность атома к поляризации химических связей.
Вопрос 4.
Изменение металлических и неметаллических свойств в таблице Менделеева
Периодическая таблица Дмитрия Ивановича Менделеева очень удобна и универсальна в своём использовании. По ней можно определить некоторые характеристики элементов, и что самое удивительное, предсказать некоторые свойства ещё неоткрытых, не обнаруженных учёными, химических элементов (например, мы знаем некоторые свойства предполагаемого унбигексия, хотя его ещё не открыли и не синтезировали).
Что такое металлические и неметаллические свойства
Эти свойства зависят от способности элемента отдавать или притягивать к себе электроны. Важно запомнить одно правило, металлы – отдают электроны, а неметаллы – принимают. Соответственно металлические свойства – это способность определённого химического элемента отдавать свои электроны (с внешнего электронного облака) другому химическому элементу. Для неметаллов всё в точности наоборот. Чем легче неметалл принимает электроны, тем выше его неметаллические свойства.
Металлы никогда не примут электроны другого химического элемента. Такое характерно для следующих элементов;
- натрия;
- калия;
- лития;
- франция и так далее.
С неметаллами дела обстоят похожим образом. Фтор больше всех остальных неметаллов проявляет свои свойства, он может только притянуть к себе частицы другого элемента, но ни при каких условиях не отдаст свои. Он обладает наибольшими неметаллическими свойствами. Кислород (по своим характеристикам) идёт сразу же после фтора. Кислород может образовывать соединение с фтором, отдавая свои электроны, но у других элементов он забирает отрицательные частицы.
Список неметаллов с наиболее выраженными характеристиками:
- фтор;
- кислород;
- азот;
- хлор;
- бром.
Неметаллические и металлические свойства объясняются тем, что все химические вещества стремятся завершить свой энергетический уровень. Для этого на последнем электронном уровне должно быть 8 электронов. У атома фтора на последней электронной оболочке 7 электронов, стремясь завершить ее, он притягивает ещё один электрон. У атома натрия на внешней оболочке один электрон, чтобы получить 8, ему проще отдать 1, и на последнем уровне окажется 8 отрицательно заряженных частиц.
Благородные газы не взаимодействуют с другими веществами именно из-за того, что у них завершён энергетический уровень, им не нужно ни притягивать, ни отдавать электроны.

Как изменяются металлические свойства в периодической системе
Периодическая таблица Менделеева состоит из групп и периодов. Периоды располагаются по горизонтали таким образом, что первый период включает в себя: литий, бериллий, бор, углерод, азот, кислород и так далее. Химические элементы располагаются строго по увеличению порядкового номера.
Группы располагаются по вертикали таким образом, что первая группа включает в себя: литий, натрий, калий, медь, рубидий, серебро и так далее. Номер группы указывает на количество отрицательных частиц на внешнем уровне определённого химического элемента. В то время, как номер периода указывает на количество электронных облаков.
Металлические свойства усиливаются в ряду справа налево или, по-другому, ослабевают в периоде. То есть магний обладает большими металлическими свойствами, чем алюминий, но меньшими, нежели натрий. Это происходит потому, что в периоде количество электронов на внешней оболочке увеличивается, следовательно, химическому элементу сложнее отдавать свои электроны.
В группе все наоборот, металлические свойства усиливаются в ряду сверху вниз. Например, калий проявляется сильнее, чем медь, но слабее, нежели натрий. Объяснение этому очень простое, в группе увеличивается количество электронных оболочек, а чем дальше электрон находится от ядра, тем проще элементу его отдать. Сила притяжения между ядром атома и электроном в первой оболочке больше, чем между ядром и электроном в 4 оболочке.
Сравним два элемента – кальций и барий. Барий в периодической системе стоит ниже, чем кальций. А это значит, что электроны с внешней оболочки кальция расположены ближе к ядру, следовательно, они лучше притягиваются, чем у бария.
Сложнее сравнивать элементы, которые находятся в разных группах и периодах. Возьмём, к примеру, кальций и рубидий. Рубидий будет лучше отдавать отрицательные частицы, чем кальций. Так как он стоит ниже и левее. Но пользуясь только таблицей Менделеева нельзя однозначно ответить на этот вопрос сравнивая магний и скандий (так как один элемент ниже и правее, а другой выше и левее). Для сравнения этих элементов понадобятся специальные таблицы (например, электрохимический ряд напряжений металлов).
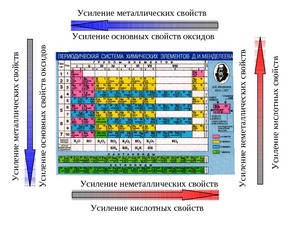
Как изменяются неметаллические свойства в периодической системе
Неметаллические свойства в периодической системе Менделеева изменяются с точностью до наоборот, нежели металлические. По сути, эти два признака являются антагонистами.
Неметаллические свойства усиливаются в периоде (в ряду справа налево). Например, сера способна меньше притягивать к себе электроны, чем хлор, но больше, нежели фосфор. Объяснение этому явлению такое же. Количество отрицательно заряженных частиц на внешнем слое увеличивается, и поэтому элементу легче закончить свой энергетический уровень.
Неметаллические свойства уменьшаются в ряду сверху вниз (в группе). Например, фосфор способен отдавать отрицательно заряженные частицы больше, чем азот, но при этом способен лучше притягивать, нежели мышьяк. Частицы фосфора притягиваются к ядру лучше, чем частицы мышьяка, что даёт ему преимущество окислителя в реакциях на понижение и повышение степени окисления (окислительно-восстановительные реакции).
Сравним, к примеру, серу и мышьяк. Сера находится выше и правее, а это значит, что ей легче завершить свой энергетический уровень. Как и металлы, неметаллы сложно сравнивать, если они находятся в разных группах и периодах. Например, хлор и кислород. Один из этих элементов выше и левее, а другой ниже и правее. Для ответа придётся обратиться к таблице электроотрицательности неметаллов, из которой мы видим, что кислород легче притягивает к себе отрицательные частицы, нежели хлор.
Периодическая таблица Менделеева помогает узнать не только количество протонов в атоме, атомную массу и порядковый номер, но и помогает определить свойства элементов.
Видео
Видео поможет вам разобраться в закономерности свойств химических элементов и их соединений по периодам и группам.
Периодический закон, подготовка к ЕГЭ по химии
Периодический закон был открыт Д.И. Менделеевым в 1868 году. Его современная формулировка: свойства химических элементов и образуемых ими соединений (простых и сложных) находятся в периодической зависимости от величины заряда атомного ядра.
Периодический закон лежит в основе современного учения о строении вещества. Периодическая система Д.И. Менделеева является наглядным отражением периодического закона.
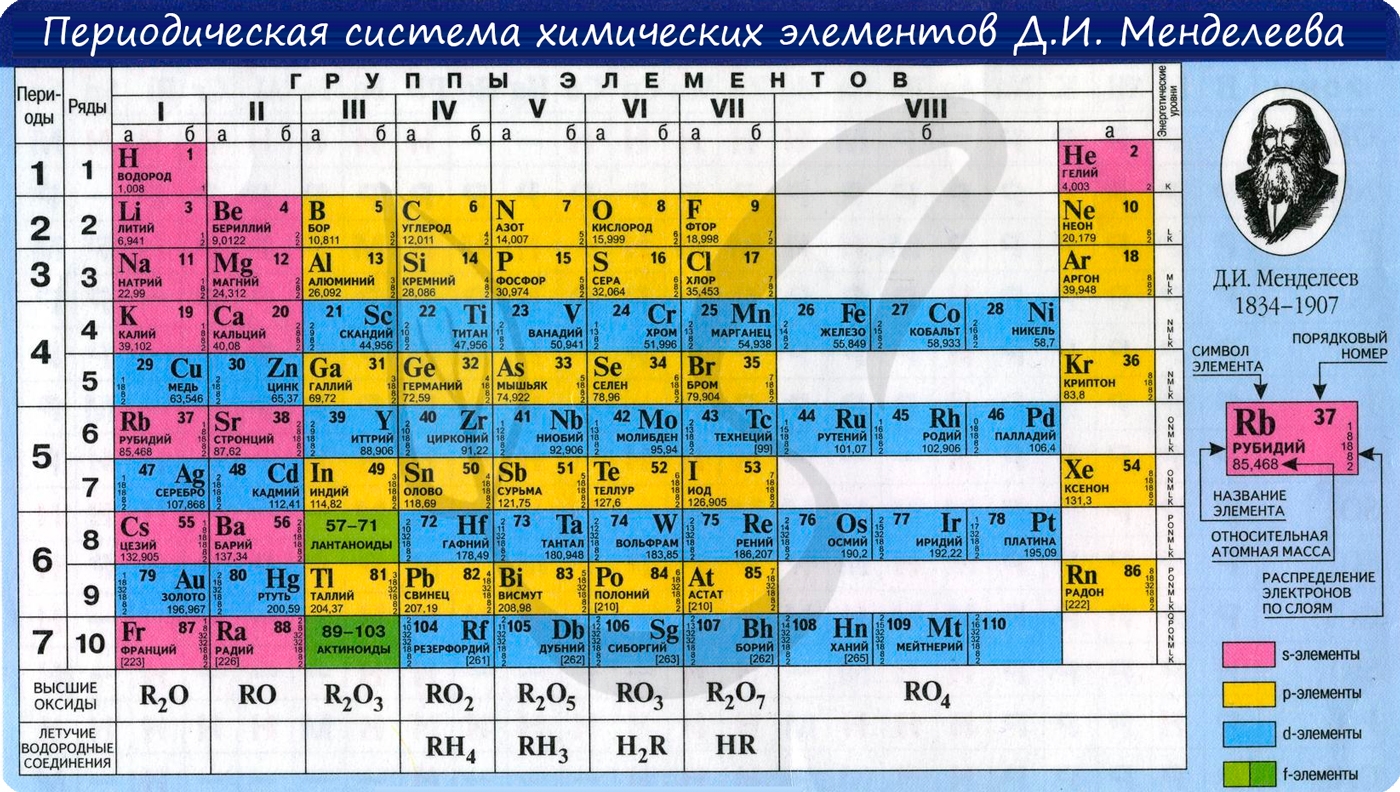
В периодической таблице элементы расположены в порядке увеличения атомного заряда, группируются в «строки и столбцы» — периоды и группы.
Период — ряд горизонтально расположенных химических элементов. 1, 2 и 3 периоды называются малыми, они состоят из одного ряда элементов. 4, 5, 6 — называются большими периодами, они состоят из двух рядов химических элементов.
Группой называют вертикальный ряд химических элементов в периодической таблице. Элементы собраны в группы на основе степени окисления в высшем оксиде. Каждая из восьми групп состоит из главной подгруппы (а) и побочной подгруппы (б).
Периодическая таблица Д.И. Менделеева содержит колоссальное число ответов на самые разные вопросы. При умелом ее использовании вы сможете предполагать строение и свойства веществ, успешно писать химические реакции и решать задачи.

Радиус атома
Радиусом атома называют расстояние между атомным ядром и самой дальней электронной орбиталью. Это не четкая, а условная граница, которая говорит о наиболее вероятном месте нахождения электрона.
В периоде радиус атома уменьшается с увеличением порядкового номера элементов («→» слева направо). Это связано с тем, что с увеличением номера группы увеличивается число электронов на внешнем уровне. Запомните, что для элементов главных подгрупп номер группы равен числу электронов на внешнем уровне.
С увеличением числа электронов они становятся более скученными, так как притягиваются друг к другу сильнее: это и есть причина маленького радиуса атома.
Чем меньше электронов, тем больше у них свободы и больше радиус атома, поэтому радиус увеличивается в периоде «←» справа налево.
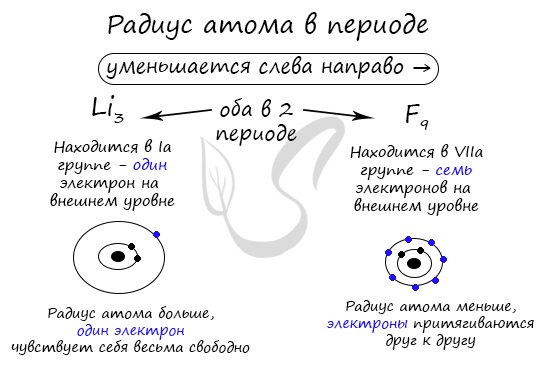
В группе радиус атома увеличивается с увеличением заряда атомных ядер — сверху вниз «↓». Чем больше период, тем больше электронных орбиталей вокруг атома, соответственно, и больше его радиус.
С уменьшением заряда атома в группе радиус атома уменьшается — снизу вверх «↑». Это связано с уменьшением количества электронных орбиталей вокруг атома. Для примера возьмем атомы бора и алюминия, элементов, расположенных в одной группе.

Период, группа и электронная конфигурация
Обратите внимание еще раз на важную деталь: элементы, находящиеся в одной группе (главной подгруппе!), имеют сходную конфигурацию внешнего уровня. Так у бора на внешнем уровне расположены 3 электрона, у алюминия — тоже 3. Оба они в III группе.
Такая закономерность иногда может сильно облегчить жизнь, однако у элементов побочных подгрупп она отсутствует — там нужно считать электроны «вручную», располагая их на электронных орбиталях.
Раз уж мы повели речь об электронных конфигурациях, давайте запишем их для бора и алюминия, чтобы лучше представлять их внешний уровень и увидеть то самое «сходство»:
- B5 — 1s22s22p1
- Al13 — 1s22s22p63s23p1
Общую электронную конфигурацию для элементов III группы главной подгруппы можно записать ns2np1. Это будет работать для бора, внешний уровень которого 2s22p1, алюминия — 3s23p1, галия — 4s24p1, индия — 5s25p1 и таллия — 6s26p1. За «n» мы принимаем номер периода.
Правило составления электронной конфигурации, которое вы только что увидели, универсально. Если вы имеете дело с элементом главной подгруппы, то увидев номер группы вы знаете, сколько электронов у него на внешнем уровне. Посмотрев на период, знаете номер его внешнего уровня.
Вам остается только распределить известное число электронов по s и p ячейкам, а затем подставить номер периода — и вот быстро получена конфигурация внешнего уровня. Предлагаю посмотреть на примере ниже 🙂
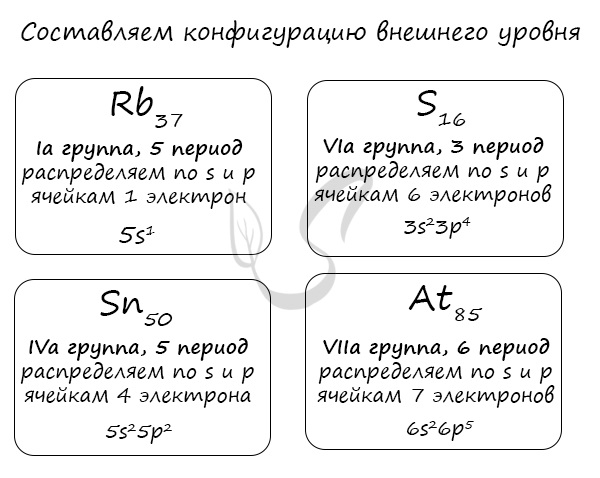
Очень надеюсь, что теперь вы знаете: только глядя на положение элемента в периодической таблице, на группу и период, в которых он расположен, вы уже можете составить конфигурацию его внешнего уровня. Безусловно, это для элементов главных подгрупп. Повторюсь: у побочных — только «вручную».
Длина связи
Длина связи — расстояние между атомами химически связанных элементов. Очевидно, что понятия длины связи и атомного радиуса взаимосвязаны напрямую. Чем больше радиус атома, тем больше длина связи.
Убедимся в этом на наглядном примере, сравнив длину связей в четырех веществах: HF, HCl, HBr, HI.
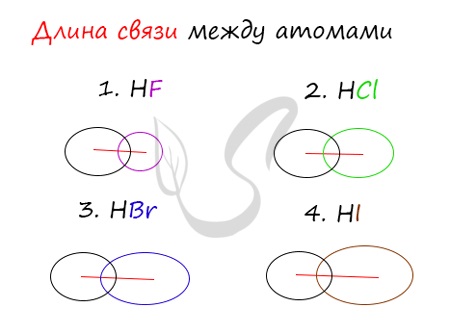
Чем больше радиусы атомов, которые образуют химическую связь, тем больше между ними и длина связи. Радиус атома водорода неизменен во всех трех веществах, а в ряду F → Cl → Br → I происходит увеличение радиуса атома. Наибольшим радиусом обладает йод, поэтому самая длинная связь в молекуле HI.
Металлические и неметаллические свойства
В периоде с увеличением заряда атома металлические свойства ослабевают, неметаллические — усиливаются (слева направо «→»). В группе с увеличением заряда атома металлические свойства усиливаются, а неметаллические — ослабевают (сверху вниз «↓»).

Сравним металлические и неметаллические свойства Rb, Na, Al, S. Натрий, алюминий и сера находятся в одном периоде. Металлические свойства возрастают S → Al → Na. Натрий и рубидий находятся в одной группе, металлические свойства возрастают Na → Rb.
Таким образом, самые сильные металлические свойства проявляет рубидий, но с другой стороны — у него самые слабые неметаллические свойства. Сера обладает самыми слабыми металлическими свойствами, но, если посмотреть по-другому, сера — самый сильный неметалл.
Распределение металлов и неметаллов в периодической таблице также является наглядным отображением этого правила. Если провести условную линию, проходящую от бора до астата, то справа окажутся неметаллы, а слева — металлы.

Основные и кислотные свойства
Основные свойства в периоде с увеличением заряда атома уменьшаются, кислотные — возрастают. В группе с увеличением заряда атома основные свойства усиливаются, а кислотные — ослабевают.
Кислотные и основные свойства противопоставлены друг другу, как противопоставлены металлические и неметаллические. Где первые усиливаются, вторые — убывают. Все аналогично, поэтому смело ассоциируйте одни с другими, так будет гораздо легче запомнить.

Замечу, что здесь есть одно важное исключение. Как и в общем случае: исключения только подтверждают правила. В ряду галогенводородных кислот HF → HCl → HBr → HI происходит усиление кислотных свойств (а не ослабление, как должно быть по логике нашего правила).
Это можно объяснить в темах диссоциации и химических связей. Когда мы дойдем до соответствующей темы, я напомню про HF и водородные связи между молекулами, которые делают эту кислоту самой слабой. Сейчас воспринимайте это как исключение: HF — самая слабая из этих кислот, а HI — самая сильная.

Восстановительные и окислительные свойства
Восстановительные свойства в периоде с увеличением заряда атома ослабевают, окислительные — усиливаются. В группе с увеличением заряда атома восстановительные свойства усиливаются, а окислительные — ослабевают.
Ассоциируйте восстановительные свойства с металлическими и основными, а окислительные — с неметаллическими и кислотными. Так гораздо проще запомнить 😉

Электроотрицательность (ЭО), энергия связи, ионизации и сродства к электрону
Электроотрицательность — способность атома, связанного с другими, приобретать отрицательный заряд (притягивать к себе электроны). Мы уже касались ее в статье, посвященной степени окисления. Это важное свойство, ведь более ЭО-ый атом притягивает к себе электроны и уходит в отрицательную степень окисления со знаком минус «-«.
Все перечисленные в подзаголовке свойства вместе с ЭО усиливаются в периоде с увеличением заряда атома, в группе с увеличением заряда атома они ослабевают. Таким образом, самый электроотрицательный элемент расположен справа вверху таблицы Д.И. Менделеева — это фтор.

Для примера сравним ЭО-ость атомов Te, In, Al, P. Индий расположен в одной группе с алюминием, ЭО-ость In → Al возрастает (снизу вверх). Алюминий расположен в одном периоде с серой, ЭО-ость возрастает Al → S (слева направо). Сравнивая серу и теллур, мы видим, что сера расположена в группе выше теллура, значит и ее электроотрицательность тоже выше.
Энергия связи (а также ее прочность) возрастают с увеличением электроотрицательности атомов, образующих данную связь. Чем сильнее атом тянет на себя электроны (чем больше он ЭО-ый), тем прочнее получается связь, которую он образует.
Понятию ЭО-ости «синонимичны» также понятия сродства к электрону — энергии, выделяющейся при присоединении электрона к атому, и энергии ионизации — количеству энергии, которое необходимо для отщепления электрона от атома. И то, и другое возрастают с увеличением электроотрицательности.
Продемонстрирую на примере. Сравним энергию связи в трех молекулах: H2O, H2S, H2Se.

Высшие оксиды и летучие водородные соединения (ЛВС)
В периодической таблице Д.И. Менделеева ниже 7 периода находится строка, в которой для каждой группы указаны соответствующие высшие оксиды, ниже строка с летучими водородными соединениями.

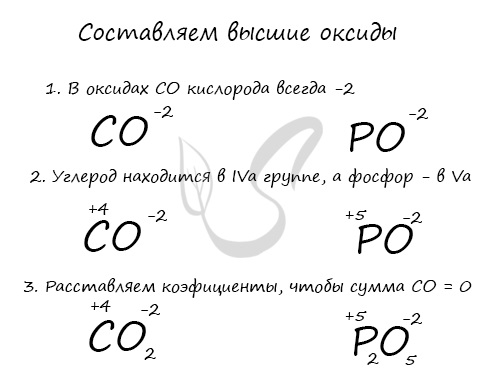
Для элементов главных подгрупп начиная с IV группы (в большинстве случае) максимальная степень окисления (СО) определяется по номеру группы. К примеру, для серы (в VI группе) максимальная СО = +6, которую она проявляет в соединениях: H2SO4, SO3.
В таблице видно, что для VIa группы формула высшего оксида RO3, а, к примеру, для IIIa группы — R2O3. Напишем высшие оксиды для веществ из VIa : SO3, SeO3, TeO3 и IIIa группы: B2O3, Al2O3, Ga2O3.
На экзамене строка с готовыми «высшими» оксидами, как в таблице наверху, может отсутствовать. Считаю важным подготовить вас к этому. Предположим, что эта строчка внезапно исчезла из таблицы, и вам нужно записать высшие оксиды для фосфора и углерода.
С летучими водородными соединениями (ЛВС) ситуация аналогичная: их может не быть в периодической таблице Д.И. Менделеева, которая попадется на экзамене. Я расскажу вам, как легко их запомнить.
ЛВС характерны для IV, V, VI и VII группы. Элементы этих групп более электроотрицательны, чем водород, поэтому ходят в «-» отрицательную СО. Минимальная степень окисления для элементов главных подгрупп, начиная с IV группы, может быть рассчитана так: номер группы — 8.
Например, для углерода минимальная СО = 4-8 = -4; для азота 5-8 = -3; для кислорода 6-8 = -2; для фтора 7-8 = -1. Для того, чтобы запомнить ЛВС, вы должны ассоциировать IV, V, VI и VII группы с хорошо известными вам веществами: метаном, аммиаком, водой и фтороводородом.
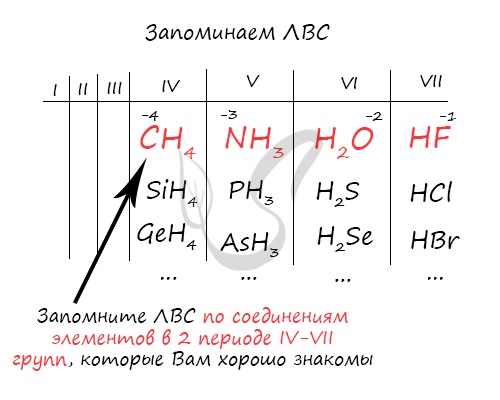
Так как общее строение ЛВС в пределах одной группы сходно, то, вспомнив например H2O для кислорода в VI группе, вы легко найдете формулы других ЛВС VI группы: серы — H2S, H2Se, H2Te, H2Po.
© Беллевич Юрий Сергеевич 2018-2020
Данная статья написана Беллевичем Юрием Сергеевичем и является его интеллектуальной собственностью. Копирование, распространение (в том числе путем копирования на другие сайты и ресурсы в Интернете) или любое иное использование информации и объектов без предварительного согласия правообладателя преследуется по закону. Для получения материалов статьи и разрешения их использования, обратитесь, пожалуйста, к Беллевичу Юрию.
Металлы и неметаллы — урок. Химия, 8–9 класс.
Простые вещества по их свойствам делят на металлы и неметаллы.
Металлы имеют немолекулярное строение и сходные физические свойства. Все металлы (кроме ртути) при обычных условиях представляют собой твёрдые вещества. Их легко узнать по характерному металлическому блеску. Металлы хорошо проводят тепло и электрический ток.
Ртуть
Алюминий
При ударе металлы не разрушаются, а меняют свою форму, т. е. им характерна пластичность. Металлы можно ковать, прокатывать в листы, вытягивать в проволоку.
Неметаллы не имеют общих физических свойств и не похожи на металлы. У них отсутствует металлический блеск. У большинства неметаллов низкие электропроводность и теплопроводность.
Большинство неметаллов имеет молекулярное строение. Такие вещества при обычных условиях являются газами (водород, кислород, азот, озон, фтор, хлор, инертные газы), жидкостями (бром) или хрупкими легкоплавкими твёрдыми веществами (сера, иод, белый фосфор).
Хлор
Бром
Сера
Некоторые неметаллы имеют немолекулярное строение, например, красный фосфор, кремний, алмаз и графит. Такие вещества твёрдые, тугоплавкие, нелетучие.
Красный фосфор
Определить, является простое вещество металлом или неметаллом, можно с помощью периодической таблицы. Химические элементы металлы, образующие простые вещества с металлическими свойствами, располагаются в периодической таблице слева ниже диагонали «водород — бор — кремний — мышьяк — теллур — астат — № \(118\)». Вверху справа располагаются химические элементы неметаллы, которые образуют простые вещества с неметаллическими свойствами.
Элементов металлов больше, чем элементов неметаллов. Значит, и простых веществ с металлическими свойствами существует больше, чем с неметаллическими.
Металлические и неметаллические свойства простых веществ
У атомов металлов малых периодов (I—III) на внешнем электронном слое находится от 1 до 3 электронов, а у атомов неметаллов — от 4 до 8. Исключение составляют атомы водорода — 1 электрон и бора — 3 электрона.
Зная характер изменения радиусов атомов по группам и периодам, а также их электронную структуру, можно объяснить причину изменения металлических и неметаллических свойств атомов элементов, точнее, их простых веществ.
Проявление металлических свойств определяется, прежде всего, способностью атомов данного элемента отдавать электроны с внешнего электронного слоя. Именно наличием у металлов свободных электронов обусловлена их высокая электропроводность.
И наоборот, способность атомов данного элемента присоединять электроны определяет неметаллические свойства его простого вещества.
Усиление металлических свойств щелочных металлов с возрастанием атомного номера элемента связано прежде всего с увеличением радиусов их атомов, т. е. с ростом числа электронных слоев. Электрон на внешнем электронном слое у этих атомов все слабее связан с ядром, поэтому легче отрывается. Одновременно усиливаются основные свойства оксидов и гидроксидов этих элементов, поскольку они определяются металлическими свойствами.
В противоположность этому неметаллические свойства элементов группы галогенов ослабевают с увеличением зарядов ядер их атомов, так как растет число электронных слоев. Внешний слой находится все дальше от ядра, поэтому электроны, находящиеся на этом слое, слабее связаны с ядром. Кислотные свойства у оксидов и гидроксидов этих элементов также ослабляются.
Таким образом, в главных группах (группах А) периодической системы с ростом зарядов ядер атомов химических элементов усиливаются металлические свойства их простых веществ и, соответственно, ослабевают неметаллические. Это особенно наглядно проявляется в группе IVA. В ней свойства простых веществ химических элементов изменяются от неметаллических (у углерода и кремния) к металлическим (у олова и свинца).
Закономерности изменения различных характеристик химических элементов в малых периодах и главных группах периодической системы на примере IVA-группы показаны в таблице ниже.
| Номер периода | Символ элемента | Заряд ядра атома | Число электронных слоев | Число электронов на внешнем слое | Валентность в высших оксидах |
|---|---|---|---|---|---|
| 1 | — | — | — | — | — |
| 2 | C | 6+ | 2 | 4 | IV |
| 3 | Si | 14+ | 3 | 4 | IV |
| 4 | Ge | 32+ | 4 | 4 | IV |
| 5 | Sn | 50+ | 5 | 4 | IV |
| 6 | Pb | 82+ | 6 | 4 | IV |
В малых периодах с ростом зарядов ядер атомов увеличивается и число электронов на внешнем слое. Они сильнее притягиваются к ядру, поэтому атомам все труднее отдавать электроны и легче присоединять их. По этой причине в периоде у атомов химических элементов ослабевают металлические и усиливаются неметаллические свойства. Аналогично в периоде с ростом зарядов ядер атомов свойства оксидов и гидроксидов изменяются от основных к кислотным. Вам необходимо включить JavaScript, чтобы проголосовать
Общая характеристика элементов металлов — урок. Химия, 8–9 класс.
Металлы в природе
Из \(118\) известных на данный момент химических элементов \(96\) образуют простые вещества с металлическими свойствами, поэтому их называют металлическими элементами.
Металлические химические элементы в природе могут встречаться как в виде простых веществ, так и в виде соединений. То, в каком виде встречаются металлические элементы в природе, зависит от химической активности образуемых ими металлов.
Ряд активности металлов
| \(Li, K, Ba, Ca, Na, \) | \(Mg, Al, Mn, Zn, Cr, Fe, Ni, Sn, Pb\) | h3 | \(Cu, Hg, Ag, Pt, Au\) |
активные металлы | металлы средней активности | неактивные металлы |
Металлические элементы, образующие химически активные металлы (Li–Mg), в природе чаще всего встречаются в виде солей (хлоридов, фторидов, сульфатов, фосфатов и других).
Соли, образуемые этими металлами, являются главной составной частью распространённых в земной коре минералов и горных пород.
 |  | |
Сильвин — хлорид калия KCl с примесями | Минерал галит состоит из хлорида натрия NaCl | Минерал кальцит состоит из карбоната кальция CaCO_3 |
В растворённом виде соли натрия, кальция и магния содержатся в природных водах. Кроме того, соли активных металлов — важная составная часть живых организмов. Например, фосфат кальция Ca3(PO4)2 является главной минеральной составной частью костной ткани.
Металлические химические элементы, образующие металлы средней активности (Al–Pb), в природе чаще всего встречаются в виде оксидов и сульфидов.
 |  | |
Минерал корунд состоит из оксида алюминия Al_2O_3 | Оксид железа(\(III\)) Fe_2O_3 образует минерал гематит | Минерал галенит cостоит из сульфида свинца(\(II\)) PbS |
Металлические элементы, образующие химически неактивные металлы (Cu–Au), в природе чаще всего встречаются в виде простых веществ.
 |  |  |
| Самородное золото Au | Самородное серебро Ag | Самородная платина Pt |
Исключение составляют медь и ртуть, которые в природе встречаются также в виде химических соединений.
 |  |  |
Минерал медный блеск состоит из сульфида меди \(I\)) Cu_2S | Гидроксокарбонат меди(\(II\)) (CuOH)_2CO_3 малахит | Минерал киноварь состоит из сульфида ртути(\(II\)) HgS |
Положение элементов металлов в Периодической системе, особенности строения и свойств их атомов
В Периодической системе химических элементов металлы занимают левый нижний угол и находятся в главных (А) и побочных (Б) группах.
Положение металлов в Периодической системе. Знаки металлических химических элементов выделены красным цветом
В электронной оболочке атомов металлов на внешнем энергетическом уровне, как правило, содержится от \(1\) до \(3\) электронов. Исключение составляют только металлы \(IV\)А, \(V\)А и \(VI\)А группы, у которых на наружном энергетическом уровне находятся соответственно четыре, пять или шесть электронов.
Радиусы атомов металлов больше, чем у атомов неметаллов того же периода. В силу отдалённости положительно заряженного ядра атомы металлов слабо удерживают свои валентные электроны (электроны внешнего энергетического уровня).

Характер изменения радиусов атомов химических элементов в периодах и в группах. Радиусы атомов металлов существенно больше, чем радиусы атомов неметаллов, находящихся в том же периоде
Главное отличительное свойство металлов — это их сравнительно невысокая электроотрицательность (ЭО) по сравнению с неметаллами.

Величины относительных электроотрицательностей (ОЭО) некоторых химических элементов (по Л. Полингу). ОЭО металлических химических элементов (выделены красным цветом) уступает соответствующей величине неметаллических химических элементов
Атомы металлов, вступая в химические реакции, способны только отдавать электроны, то есть окисляться, следовательно, в ходе превращений могут проявлять себя в качестве восстановителей.
7.6: Металлы, неметаллы и металлоиды
- Последнее обновление
- Сохранить как PDF
- Металлы
- Физические свойства металлов
- Химические свойства металлов
- Неметаллы
- Физические свойства неметаллов
- Химические свойства неметаллов
- Металлоиды
- Тенденции изменения металлических и неметаллических свойств
Цели обучения
- Чтобы понять основные свойства, отделяющие металлы от неметаллов и металлоидов
Элемент — это простейшая форма материи, которую невозможно разделить на более простые вещества или построить из более простых веществ обычными химическими или физическими методами.Нам известно 118 элементов, из которых 92 встречаются в природе, а остальные были приготовлены искусственно. Элементы далее классифицируются на металлы, неметаллы и металлоиды на основе их свойств, которые коррелируют с их размещением в периодической таблице.
| Металлические элементы | Неметаллические элементы |
|---|---|
| Отличительный блеск (блеск) | Бесцветный, разные цвета |
| Податливый и пластичный (гибкий) в твердом виде | Хрупкое, твердое или мягкое |
| Проводить тепло и электричество | Плохие проводники |
| Оксиды металлов основные, ионные | Неметаллические оксиды кислотные, ковалентные |
| Образует катионы в водном растворе | Образует анионы, оксианионы в водном растворе |
Металлы
За исключением водорода, все элементы, которые образуют положительные ионы, теряя электроны во время химических реакций, называются металлами.Таким образом, металлы являются электроположительными элементами с относительно низкими энергиями ионизации. Они характеризуются ярким блеском, твердостью, способностью резонировать со звуком и отлично проводят тепло и электричество. При нормальных условиях металлы являются твердыми телами, за исключением ртути.
Физические свойства металлов
Металлы блестящие, пластичные, пластичные, хорошо проводят тепло и электричество. Другие свойства включают:
- Состояние : Металлы представляют собой твердые вещества при комнатной температуре, за исключением ртути, которая находится в жидком состоянии при комнатной температуре (в жаркие дни галлий находится в жидком состоянии).
- Блеск : Металлы обладают свойством отражать свет от своей поверхности и могут быть отполированы, например, золотом, серебром и медью.
- Ковкость: Металлы обладают способностью противостоять ударам молотком и могут быть превращены в тонкие листы, известные как фольга. Например, кусок золота размером с кубик сахара можно растолочь в тонкий лист, которым будет покрыто футбольное поле.
- Пластичность: Металлы можно втягивать в проволоку. Например, из 100 г серебра можно натянуть тонкую проволоку длиной около 200 метров.
- Твердость: Все металлы твердые, кроме натрия и калия, которые мягкие и поддаются резке ножом.
- Валентность: Металлы обычно имеют от 1 до 3 электронов на внешней оболочке их атомов.
- Проводимость : Металлы являются хорошими проводниками, потому что у них есть свободные электроны. Серебро и медь — два лучших проводника тепла и электричества. Свинец — самый плохой проводник тепла. Висмут, ртуть и железо также являются плохими проводниками
- Плотность : Металлы имеют высокую плотность и очень тяжелые.Иридий и осмий имеют самую высокую плотность, а литий — самую низкую.
- Точки плавления и кипения : Металлы имеют высокие точки плавления и кипения. Вольфрам имеет самые высокие температуры плавления и кипения, а ртуть — самые низкие. Натрий и калий также имеют низкие температуры плавления.
Химические свойства металлов
Металлы — это электроположительные элементы, которые обычно образуют основных или амфотерных оксидов с кислородом.Другие химические свойства включают:
- Электроположительный характер : Металлы имеют тенденцию к низкой энергии ионизации, и обычно теряют электроны (т.е. окисляются ), когда они подвергаются химическим реакциям реакции Обычно они не принимают электроны. Например:
- Щелочные металлы всегда 1 + (теряют электрон в s подоболочке)
- Щелочноземельные металлы всегда 2 + (теряют оба электрона в подоболочке с )
- Ионы переходных металлов не следуют очевидной схеме, 2 + является обычным (теряют оба электрона в подоболочке s ), и также наблюдаются 1 + и 3 +
\ [\ ce {Na ^ 0 \ rightarrow Na ^ + + e ^ {-}} \ label {1.{-}} \ label {1.3} \ nonumber \]
Соединения металлов с неметаллами имеют тенденцию быть ионными по природе. Большинство оксидов металлов являются основными оксидами и растворяются в воде с образованием гидроксидов металлов :
\ [\ ce {Na2O (s) + h3O (l) \ rightarrow 2NaOH (aq)} \ label {1.4} \ nonumber \]
\ [\ ce {CaO (s) + h3O (l) \ rightarrow Ca (OH) 2 (aq)} \ label {1.5} \ nonumber \]
Оксиды металлов проявляют свою основную химическую природу, реагируя с кислотами с образованием солей металла и воды:
\ [\ ce {MgO (s) + HCl (водн.) \ Rightarrow MgCl2 (водн.) + H3O (l)} \ label {1.{2 -} \), следовательно, \ (Al_2O_3 \).
Пример \ (\ PageIndex {2} \)
Вы ожидаете, что он будет твердым, жидким или газообразным при комнатной температуре?
Решения
Оксиды металлов обычно твердые при комнатной температуре
Пример \ (\ PageIndex {3} \)
Напишите вычисленное химическое уравнение реакции оксида алюминия с азотной кислотой:
Решение
Оксид металла + кислота -> соль + вода
\ [\ ce {Al2O3 (s) + 6HNO3 (вод.) \ Rightarrow 2Al (NO3) 3 (вод.) + 3h3O (l)} \ nonumber \]
Неметаллы
Элементы, которые стремятся получить электроны с образованием анионов в ходе химических реакций, называются неметаллами.Это электроотрицательные элементы с высокими энергиями ионизации. Они не блестящие, хрупкие и плохо проводят тепло и электричество (кроме графита). Неметаллы могут быть газами, жидкостями или твердыми телами.
Физические свойства неметаллов
- Физическое состояние : Большинство неметаллов существует в двух из трех состояний вещества при комнатной температуре: газах (кислород) и твердых телах (углерод). Только бром существует в жидком виде при комнатной температуре.
- Неэластичный и ковкий : Неметаллы очень хрупкие, их нельзя свернуть в проволоку или измельчить в листы.
- Электропроводность : Они плохо проводят тепло и электричество.
- Блеск: Они не имеют металлического блеска и не отражают свет.
- Точки плавления и кипения : Точки плавления неметаллов на обычно на ниже, чем у металлов, но сильно варьируются.
- Семь неметаллов существуют при стандартных условиях в виде двухатомных молекул : \ (\ ce {h3 (g)} \), \ (\ ce {N2 (g)} \), \ (\ ce {O2 (g) } \), \ (\ ce {F2 (g)} \), \ (\ ce {Cl2 (g)} \), \ (\ ce {Br2 (l)} \), \ (\ ce {I2 ( s)} \).
Химические свойства неметаллов
Неметаллы имеют тенденцию приобретать электроны или делиться ими с другими атомами. Они имеют электроотрицательный характер. Неметаллы, вступая в реакцию с металлами, имеют тенденцию приобретать электроны (обычно , достигая электронной конфигурации благородного газа) и становятся анионами :
\ [\ ce {3Br2 (l) + 2Al (s) \ rightarrow 2AlBr3 (s)} \ nonumber \]
Соединения, полностью состоящие из неметаллов, являются ковалентными веществами.Обычно они образуют кислотные или нейтральные оксиды с кислородом, который растворяется в воде с образованием кислот:
\ [\ ce {CO2 (г) + h3O (l)} \ rightarrow \ underset {\ text {углекислота}} {\ ce {h3CO3 (aq)}} \ nonumber \]
Как вы, возможно, знаете, газированная вода имеет слабую кислотность (угольная кислота).
Оксиды неметаллов могут соединяться с основаниями с образованием солей.
\ [\ ce {CO2 (г) + 2NaOH (водн.) \ Rightarrow Na2CO3 (водн.) + H3O (l)} \ nonumber \]
Металлоиды
Металлоиды обладают промежуточными свойствами между металлами и неметаллами.Металлоиды используются в полупроводниковой промышленности. Все металлоиды твердые при комнатной температуре. Они могут образовывать сплавы с другими металлами. Некоторые металлоиды, такие как кремний и германий, при определенных условиях могут действовать как электрические проводники, поэтому их называют полупроводниками. Кремний, например, выглядит блестящим, но не является ни ковким, ни пластичным ( хрупкий, — характеристика некоторых неметаллов). Это гораздо более слабый проводник тепла и электричества, чем металлы.Физические свойства металлоидов, как правило, металлические, но их химические свойства, как правило, неметаллические. Степень окисления элемента в этой группе может варьироваться от +5 до -2, в зависимости от группы, в которой он находится.
| Металлы | Неметаллы | Металлоиды |
|---|---|---|
| Золото | Кислород | Кремний |
| Серебро | Углерод | Бор |
| Медь | Водород | Мышьяк |
| Утюг | Азот | Сурьма |
| Меркурий | Сера | Германий |
| цинк | фосфор |
Тенденции в металлическом и неметаллическом характере
Металлический характер является наиболее сильным для элементов в крайней левой части периодической таблицы и имеет тенденцию к уменьшению по мере того, как мы перемещаемся вправо в любой период (неметаллический характер усиливается с увеличением значений электроотрицательности и энергии ионизации).Внутри любой группы элементов (столбцов) металлический характер увеличивается сверху вниз (значения электроотрицательности и энергии ионизации обычно уменьшаются по мере продвижения вниз по группе). Эта общая тенденция не обязательно наблюдается с переходными металлами.
Авторы и ссылки
.Химические свойства металлов и неметаллов @ BYJU’S
- Классы
- Класс 1–3
- Класс 4–5
- Класс 6–10
- Класс 11–12
- КОНКУРЕНТНЫЙ ЭКЗАМЕН
- BNAT 000 000 NC Книги
- Книги NCERT для класса 5
- Книги NCERT для класса 6
- Книги NCERT для класса 7
- Книги NCERT для класса 8
- Книги NCERT для класса 9
- Книги NCERT для класса 10
- Книги NCERT для класса 11
- Книги NCERT для класса 12
- NCERT Exemplar
- NCERT Exemplar Class 8
- NCERT Exemplar Class 9
- NCERT Exemplar Class 10
- NCERT Exemplar Class 11
- 9000 9000
- NCERT Exemplar Class
- Решения RS Aggarwal, класс 12
- Решения RS Aggarwal, класс 11
- Решения RS Aggarwal, класс 10 90 003 Решения RS Aggarwal класса 9
- Решения RS Aggarwal класса 8
- Решения RS Aggarwal класса 7
- Решения RS Aggarwal класса 6
- Решения RD Sharma
- RD Sharma Class 6 Решения
- Решения RD Sharma Решения RD Sharma класса 8
- Решения RD Sharma класса 9
- Решения RD Sharma класса 10
- Решения RD Sharma класса 11
- Решения RD Sharma класса 12
- BNAT 000 000 NC Книги
- PHYSICS
- Механика
- Оптика
- Термодинамика Электромагнетизм
- ХИМИЯ
- Органическая химия
- Неорганическая химия
- Периодическая таблица
- MATHS
- Теорема Пифагора 0004
- 000300030004
- Простые числа
- Взаимосвязи и функции
- Последовательности и серии
- Таблицы умножения
- Детерминанты и матрицы
- Прибыль и убыток
- Полиномиальные уравнения
- Деление фракций
- Классы
- 000
- 000
- 000
- 000
- 000
- 000 Microology
- 000
- 000 Microology
- 000 BIOG3000
- FORMULAS
- Математические формулы
- Алгебраические формулы
- Тригонометрические формулы
- Геометрические формулы
- КАЛЬКУЛЯТОРЫ
- Математические калькуляторы
- 0003000 PBS4000
- 000300030002 Примеры калькуляторов химии Класс 6
- Образцы бумаги CBSE для класса 7
- Образцы бумаги CBSE для класса 8
- Образцы бумаги CBSE для класса 9
- Образцы бумаги CBSE для класса 10
- Образцы бумаги CBSE для класса 11
- Образцы бумаги CBSE чел для класса 12
- CBSE Контрольный документ за предыдущий год Класс 10
- Контрольный документ за предыдущий год CBSE, класс 12
- HC Verma Solutions Class 11 Physics
- Решения HC Verma, класс 12, физика
- Решения Лакмира Сингха, класс 9
- Решения Лакмира Сингха, класс 10
- Решения Лакмира Сингха, класс 8
- CBSE Notes
- Примечания CBSE класса 7
- Примечания к редакции
- CBSE Class
- Примечания к редакции класса 10 CBSE
- Примечания к редакции класса 11 CBSE 9000 4
- Примечания к пересмотру класса 12 CBSE
- Дополнительные вопросы CBSE
- Дополнительные вопросы по математике класса 8 CBSE
- Дополнительные вопросы по науке класса 8 CBSE
- Дополнительные вопросы по математике класса 9
- CBSE, класс 9
- CBSE Class
7.6: Металлы, неметаллы и металлоиды
- Последнее обновление
- Сохранить как PDF
- Металлы
- Физические свойства металлов
- Химические свойства металлов
- Неметаллы
- Физические свойства неметаллов:
- Химические свойства неметаллов
- Металлоиды
- Тенденции изменения металлических и неметаллических характеристик
Навыки для развития
- Чтобы понять основные свойства, отделяющие металлы от нементалов и металлоидов
Элемент — это простейшая форма материи, которую невозможно разделить на более простые вещества или построить из более простых веществ обычными химическими или физическими методами.Нам известно 110 элементов, из которых 92 встречаются в природе, а остальные были приготовлены искусственно. Элементы далее подразделяются на металлы, неметаллы и металлоиды.
| Металлические элементы | Неметаллические элементы |
|---|---|
| Отличительный блеск (блеск) | Бесцветный, разные цвета |
| Податливый и пластичный (гибкий) в твердом виде | Хрупкое, твердое или мягкое |
| Проводить тепло и электричество | Плохие проводники |
| Оксиды металлов основные, ионные | Неметаллические оксиды кислые, соединения |
| Катионы в водном растворе | Анионы, оксианионы в водном растворе |
Металлы
Все элементы, кроме водорода, которые образуют положительные ионы, теряя электроны во время химических реакций, называются металлами.Таким образом, металлы являются электроположительными элементами. Они характеризуются ярким блеском, твердостью, способностью резонировать со звуком и отлично проводят тепло и электричество. При нормальных условиях металлы являются твердыми телами, за исключением ртути.
Физические свойства металлов
Металлы блестящие, пластичные, пластичные, хорошо проводят тепло и электричество. Другие свойства включают:
- Состояние : Металлы представляют собой твердые вещества при комнатной температуре, за исключением ртути, которая находится в жидком состоянии при комнатной температуре (в жаркие дни галлий находится в жидком состоянии).
- Блеск : Металлы обладают свойством отражать свет от своей поверхности и могут быть отполированы, например, золотом, серебром и медью.
- Ковкость: Металлы обладают способностью противостоять ударам молотком и могут быть превращены в тонкие листы, известные как фольга (кусочек золота в виде кубика сахара можно растолочь в тонкий лист, которым будет покрываться футбольное поле).
- Пластичность: Металлы можно втягивать в проволоку. Из 100 граммов серебра можно сделать тонкую проволоку длиной около 200 метров.
- Твердость: Все металлы твердые, кроме натрия и калия, которые мягкие и поддаются резке ножом.
- Валентность: Металлы имеют от 1 до 3 электронов на внешней оболочке их атомов.
- Проводимость : Металлы являются хорошими проводниками, потому что у них есть свободные электроны. Серебро и медь — два лучших проводника тепла и электричества. Свинец — самый плохой проводник тепла. Висмут, ртуть и железо также являются плохими проводниками
- Плотность : Металлы имеют высокую плотность и очень тяжелые.Иридий и осмий имеют самую высокую плотность, а литий — самую низкую.
- Точки плавления и кипения : Металлы имеют высокие температуры плавления и кипения. Вольфрам имеет самую высокую температуру плавления, тогда как серебро имеет низкую температуру кипения. Натрий и калий имеют низкие температуры плавления.
Химические свойства металлов
Металлы — это электроположительные элементы, которые обычно образуют основной или амфотерный оксиды с кислородом.- \ label {1.3} \]
- Щелочные металлы всегда 1 + (теряют электрон в s подоболочке)
- Щелочноземельные металлы всегда 2 + (теряют оба электрона в s подоболочке)
- Ионы переходных металлов не имеют очевидной закономерности, 2 + — обычное явление, а также наблюдаются 1 + и 3 +
Соединения металлов с неметаллами обычно имеют ионную природу .Большинство оксидов металлов являются основными оксидами и растворяются в воде с образованием гидроксидов металлов :
Оксид металла + вода -> гидроксид металла
\ [Na_2O _ {(s)} + H_2O _ {(l)} \ rightarrow 2NaOH _ {(aq)} \ label {1.4} \]
\ [CaO _ {(s)} + H_2O _ {(l)} \ rightarrow Ca (OH) _ {2 (водн.)} \ Label {1.5} \]
Оксиды металлов проявляют свою основную химическую природу, реагируя с кислотами с образованием солей и воды:
Оксид металла + кислота -> соль + вода
\ [MgO _ {(s)} + HCl _ {(водный раствор)} \ rightarrow MgCl_ {2 (водный раствор)} + H_2O _ {(l)} \ label {1.{2 -} \), следовательно, \ (Al_2O_3 \).
Пример \ (\ PageIndex {2} \)
Вы ожидаете, что он будет твердым, жидким или газообразным при комнатной температуре?
Решения
Оксиды металлов обычно твердые при комнатной температуре
Пример \ (\ PageIndex {3} \)
Напишите вычисленное химическое уравнение реакции оксида алюминия с азотной кислотой:
Решение
Оксид металла + кислота -> соль + вода
\ [Al_2O_ {3 (s)} + 6HNO_ {3 (водн.)} \ Rightarrow 2Al (NO_3) _ {3 (водн.)} + 3H_2O _ {(l)} \]
Неметаллы
Элементы, которые стремятся получить электроны с образованием анионов в ходе химических реакций, называются неметаллами.Это электроотрицательные элементы. Они не блестящие, хрупкие и плохо проводят тепло и электричество (кроме графита). Неметаллы могут быть газообразными, жидкими или твердыми.
Физические свойства неметаллов:
- Физическое состояние : Большинство неметаллов существует в двух из трех состояний вещества при комнатной температуре: газах (кислород) и твердых телах (углерод).
- Неэластичный и ковкий : Неметаллы очень хрупкие, их нельзя свернуть в проволоку или измельчить в листы.
- Электропроводность : Они плохо проводят тепло и электричество.
- Блеск: Они не имеют металлического блеска и не отражают свет
- Электропроводность : Плохие проводники тепла и электричества
- Точки плавления и кипения : Точки плавления неметаллов на обычно на ниже, чем у металлов
- Семь неметаллов существуют в стандартных условиях в виде двухатомных молекул :
- H 2 ( г )
- N 2 ( г )
- O 2 ( г )
- F 2 ( г )
- Класс 2 ( г )
- Br 2 ( л )
- I 2 ( л ) (летучая жидкость — легко испаряется)
Химические свойства неметаллов
- Неметаллы имеют тенденцию приобретать или делиться электронами с другими атомами.Они имеют электроотрицательный характер.
Неметаллы, вступая в реакцию с металлами, имеют тенденцию приобретать электроны (обычно достигают электронной конфигурации благородного газа) и становятся анионами:
Неметалл + металл -> Соль
\ [3Br_ {2 (l)} + 2Al _ {(s)} \ rightarrow 2AlBr_ {3 (s)} \]
Соединения, полностью состоящие из неметаллов, являются молекулярными веществами (не ионными). Обычно они образуют кислые или нейтральные оксиды с кислородом, который, растворяясь в воде, реагирует с образованием кислот:
Оксид неметалла + вода -> кислота
\ [CO_ {2 (g)} + H_2O _ {(l)} \ rightarrow \ underset {\ text {углекислота}} {H_2CO_ {3 (водн.)}} \]
(газированная вода слабокислая)
Оксиды неметаллов могут соединяться с основаниями с образованием солей.
Оксид неметалла + основание -> соль
\ [CO_ {2 (г)} + 2NaOH _ {(водн.)} \ Rightarrow Na_2CO_ {3 (водн.)} + H_2O _ {(l)} \]
Металлоиды
Промежуточные свойства между металлами и неметаллами. Металлоиды используются в полупроводниковой промышленности.
| Металлы | Неметаллы | Металлоиды |
|---|---|---|
| Золото | Кислород | Кремний |
| Серебро | Углерод | Бор |
| Медь | Водород | Мышьяк |
| Утюг | Азот | Сурьма |
| Меркурий | Сера | Германий |
| цинк | фосфор |
Металлоиды все твердые при комнатной температуре.Некоторые металлоиды, такие как кремний и германий, могут действовать как электрические проводники при определенных условиях, поэтому их называют полупроводниками. Кремний , например, выглядит блестящим, но не податливый или пластичный ( хрупкий — характеристика некоторых неметаллов). Это гораздо более слабый проводник тепла и электричества, чем металлы. Они могут образовывать сплавы с другими металлами.
Их физические свойства обычно металлические, но их химические свойства обычно неметаллические.Степень окисления элемента в этой группе может варьироваться от +3 до -2, в зависимости от группы, в которой он находится.
Тенденции в металлическом и неметаллическом характере
Металлический символ — самый сильный для элементов крайней левой части периодической таблицы, и имеет тенденцию к уменьшению на при движении вправо в любой период (неметаллический характер увеличивается с увеличением значений ионизации). Внутри любой группы элементов (столбцов), , металлический характер увеличивается сверху вниз (значения ионизации обычно уменьшаются по мере движения вниз по группе). Эта общая тенденция не обязательно наблюдается у переходных металлов .
.7.6: Металлы, неметаллы и металлоиды
- Последнее обновление
- Сохранить как PDF
- Металлы
- Физические свойства металлов
- Химические свойства металлов
- Неметаллы
- Физические свойства неметаллов:
- Химические свойства неметаллов
- Металлоиды
- Физические свойства металлоидов
- Химические свойства металлоидов
- Тенденции в области металлических и неметаллических характеристик
- Участники
Навыки для развития
- Понимать основные свойства, отделяющие металлы от нементалов и металлоидов
Элемент — это простейшая форма материи, которую невозможно разделить на более простые вещества или построить из более простых веществ обычным химическим или физическим методом.Нам известно 110 элементов, из которых 92 встречаются в природе, а остальные были приготовлены искусственно. Элементы далее подразделяются на металлы, неметаллы и металлоиды.
Металлические элементы | Неметаллические элементы |
Отличительный блеск (блеск) | Бесцветный, разные цвета |
Податливый и пластичный (гибкий) в виде твердых тел | Хрупкий, твердый или мягкий |
Проводят тепло и электричество | Плохие проводники |
Оксиды металлов основные, ионные | Неметаллические оксиды являются кислотными соединениями |
Катионы в водном растворе | Анионы, оксианионы в водном растворе |
Me tals
Все элементы, кроме водорода, которые образуют положительные ионы, теряя электроны во время химических реакций, называются металлами.Таким образом, металлы являются электроположительными элементами. Они характеризуются ярким блеском, твердостью, способностью резонировать со звуком и отлично проводят тепло и электричество. При нормальных условиях металлы являются твердыми телами, за исключением ртути.
Физические свойства металлов
Металлы блестящие, податливые, пластичные, хорошо проводят тепло и электричество. Другие свойства включают:
- Состояние : Металлы представляют собой твердые вещества при комнатной температуре, за исключением ртути, которая находится в жидком состоянии при комнатной температуре (в жаркие дни галлий находится в жидком состоянии).
- Блеск : Металлы обладают свойством отражать свет от своей поверхности и могут быть отполированы, например, золотом, серебром и медью.
- Ковкость: Металлы обладают способностью противостоять ударам молотком и могут быть превращены в тонкие листы, известные как фольга (кусок золота в виде кубика сахара можно растолочь в тонкий лист, которым можно будет покрыть футбольное поле).
- Пластичность: Металлы можно втянуть в проволоку. Из 100 граммов серебра можно сделать тонкую проволоку длиной около 200 метров.
- Твердость: Все металлы твердые, кроме натрия и калия, которые мягкие и поддаются резке ножом.
- Валентность: Металлы имеют от 1 до 3 электронов на внешней оболочке их атомов.
- Проводимость : Металлы являются хорошими проводниками, потому что у них есть свободные электроны. Серебро и медь — два лучших проводника тепла и электричества. Свинец — самый плохой проводник тепла. Висмут, ртуть и железо также являются плохими проводниками.
- Плотность : Металлы имеют высокую плотность и очень тяжелые.Иридий и осмий имеют самую высокую плотность, а литий — самую низкую.
- Точки плавления и кипения : Металлы имеют высокие точки плавления и кипения. Вольфрам имеет самую высокую температуру плавления, тогда как серебро имеет низкую температуру кипения. Натрий и калий имеют низкие температуры плавления.
Химические свойства металлов
Металлы — это электроположительные элементы, которые обычно образуют основные или амфотерные оксиды с кислородом.- \ tag {1.3} \]
- Щелочные металлы всегда равны 1 + (теряют электрон в подоболочке s )
- Щелочноземельные металлы всегда 2 + (теряют оба электрона в подоболочке s )
- Ионы переходных металлов не имеют очевидной закономерности, 2 + является обычным, и также наблюдаются 1 + и 3 +
- Соединения металлов с неметаллами имеют тенденцию быть ионный в природе
- Большинство оксидов металлов являются основными оксидами и растворяются в воде с образованием гидроксидов металлов :
Оксид металла + вода -> гидроксид металла
\ [Na_2O _ {(s)} + H_2O_ { (l)} \ rightarrow 2NaOH _ {(aq)} \ tag {1.4} \]
\ [CaO _ {(s)} + H_2O _ {(l)} \ rightarrow Ca (OH) _ {2 (aq)} \ tag {1.5} \]
- Оксиды металлов проявляют свои свойства основной химическая природа за счет реакции с кислот с образованием солей и воды:
Оксид металла + кислота -> соль + вода
\ [MgO _ {(s)} + HCl _ {(водный )} \ rightarrow MgCl_ {2 (водн.)} + H_2O _ {(l)} \ tag {1.6} \]
\ [NiO _ {(s)} + H_2SO_ {4 (водн.)} \ rightarrow NiSO_ {4 (водн. )} + H_2O _ {(l)} \ tag {1.{2 -} \), следовательно, \ (Al_2O_3 \).
Пример
Ожидаете ли вы, что он будет твердым, жидким или газообразным при комнатной температуре?
Растворы
Оксиды металлов обычно твердые при комнатной температуре
Пример
Напишите сбалансированное химическое уравнение реакции оксида алюминия с азотной кислотой:
Раствор
Оксид металла + кислота -> соль + вода
\ [Al_2O_ {3 (s)} + 6HNO_ {3 (aq)} \ rightarrow 2Al (NO_3) _ {3 (aq)} + 3H_2O _ {(l)} \]
Неметаллы
Элементы, склонные к электроны с образованием анионов в ходе химических реакций называются неметаллами.Это электроотрицательные элементы. Они не блестящие, хрупкие и плохо проводят тепло и электричество (кроме графита). Неметаллы могут быть газообразными, жидкими или твердыми.
Физические свойства неметаллов:
- Физическое состояние : Большинство неметаллов существует в двух из трех состояний вещества при комнатной температуре: газах (кислород) и твердых телах (углерод).
- Не податливые и ковкие : Неметаллы очень хрупкие, их нельзя свернуть в проволоку или растолочь в листы.
- Проводимость : Они плохо проводят тепло и электричество.
- Блеск: Они не имеют металлического блеска и не отражают свет
- Электропроводимость : Плохие проводники тепла и электричества
- Точки плавления и кипения : Точки плавления неметаллов на обычно на ниже, чем металлы
- Семь неметаллов существуют в стандартных условиях как двухатомных молекул :
- H 2 ( г )
- N 2 ( г )
- O 2 ( г )
- F 2 ( г )
- Cl 2 ( г )
- Br 2 ( л )
- I 2 ( л ) (летучая жидкость — легко испаряется)
Химические свойства неметаллов
- Неметаллы имеют тенденцию приобретать или делиться электронами с другими атомами.Они имеют электроотрицательный характер.
- Неметаллы, вступая в реакцию с металлами, имеют тенденцию приобретать электроны (обычно достигают электронной конфигурации благородного газа) и становятся анионами :
Неметалл + металл -> соль
\ [3Br_ {2 (l) } + 2Al _ {(s)} \ rightarrow 2AlBr_ {3 (s)} \]
Оксид неметалла + вода -> кислота
\ [CO_ {2 (g)} + H_2O _ {(l)} \ rightarrow \ underset {\ text {угольная кислота}} {H_2CO_ {3 (aq)}} \]
(газированная вода слабокислая)
- Оксиды неметаллов могут соединяться с основаниями с образованием солей.
Оксид неметалла + основание -> соль
\ [CO_ {2 (g)} + 2NaOH _ {(aq)} \ rightarrow Na_2CO_ {3 (aq)} + H_2O _ {(l)} \]
Металлоиды
Промежуточные свойства между металлами и неметаллами. Металлоиды используются в полупроводниковой промышленности.
| Металлы | Неметаллы | Металлоиды | ||||
|---|---|---|---|---|---|---|
| Золото | Кислород | Кремний | ||||
| Серебро | Углерод | Бор | ||||
| Медь | Водород | Медь Водород | Железо | Азот | Сурьма | |
| Ртуть | Сера | Германий | ||||
| Цинк | Фосфор |
Физические свойства всех металлов:03 : все они твердые. комнатная температура. Проводимость : Некоторые металлоиды, такие как кремний и германий, могут действовать как электрические проводники в определенных условиях, поэтому их называют полупроводниками. Блеск : Кремний , например, выглядит блестящим, но не является ковким или пластичным ( хрупкий — характеристика некоторых неметаллов). Это гораздо более слабый проводник тепла и электричества, чем металлы.
Твердые растворы : они могут образовывать сплавы с другими металлами. Химические свойства металлоидов
- Их физические свойства имеют тенденцию быть металлическими, но их химические свойства имеют тенденцию быть неметаллическими.
- Степень окисления элемента в этой группе может варьироваться от +3 до -2, в зависимости от группы, в которой он находится.
Тенденции в металлическом и неметаллическом характере
Металлический характер — самый сильный для элементов в крайней левой части периодической таблицы и имеет тенденцию к уменьшению по мере продвижения вправо в любой период (неметаллический характер усиливается с увеличением значений ионизации).Внутри любой группы элементов (столбцов) металлический характер увеличивается сверху вниз (значения ионизации обычно уменьшаются по мере продвижения вниз по группе). Эта общая тенденция не обязательно наблюдается с переходными металлами .
.
Блеск : Кремний , например, выглядит блестящим, но не является ковким или пластичным ( хрупкий — характеристика некоторых неметаллов). Это гораздо более слабый проводник тепла и электричества, чем металлы.
Химические свойства металлоидов
- Их физические свойства имеют тенденцию быть металлическими, но их химические свойства имеют тенденцию быть неметаллическими.
- Степень окисления элемента в этой группе может варьироваться от +3 до -2, в зависимости от группы, в которой он находится.
Тенденции в металлическом и неметаллическом характере
Металлический характер — самый сильный для элементов в крайней левой части периодической таблицы и имеет тенденцию к уменьшению по мере продвижения вправо в любой период (неметаллический характер усиливается с увеличением значений ионизации).Внутри любой группы элементов (столбцов) металлический характер увеличивается сверху вниз (значения ионизации обычно уменьшаются по мере продвижения вниз по группе). Эта общая тенденция не обязательно наблюдается с переходными металлами .
.