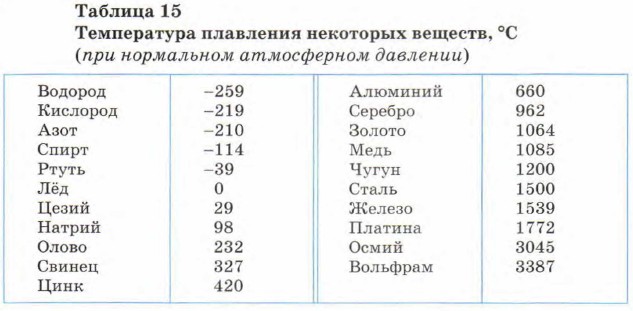
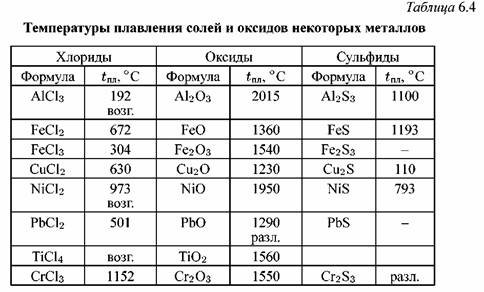
Особенности плавления и парообразования
Особенности плавления и парообразованияКонкурс «Я иду на урок»Г.Л.Савинкова,
школа № 176, г. Самара
Урок по методу проектов, 2 ч. 8-й класс. Базовый курс
Методом проектов называют совокупность учебно-познавательных приемов, которые позволяют решать ту или иную проблему в результате самостоятельных действий учащихся с обязательной презентацией этих результатов. Работа учащихся при этом принципиально меняется: они выступают активными участниками учебного процесса, а не пассивными статистами. Ученик становится субъектом познавательной деятельности, у него формируется конструктивное критическое мышление, которому трудно научить при обычной «урочной» форме. Школьники свободны в выборе способов и видов деятельности. Метод проектов помогает ученикам овладеть целым рядом таких умений, как готовность работать в коллективе, разделять ответственность с членами команды, анализировать результаты деятельности.
Цель проекта:
Творческий продукт: опорный конспект по теме «Особенности плавления и парообразования», который составляется сначала на большом плакате при помощи карточек с текстом, а затем изготавливается и тиражируется с помощью компьютера.
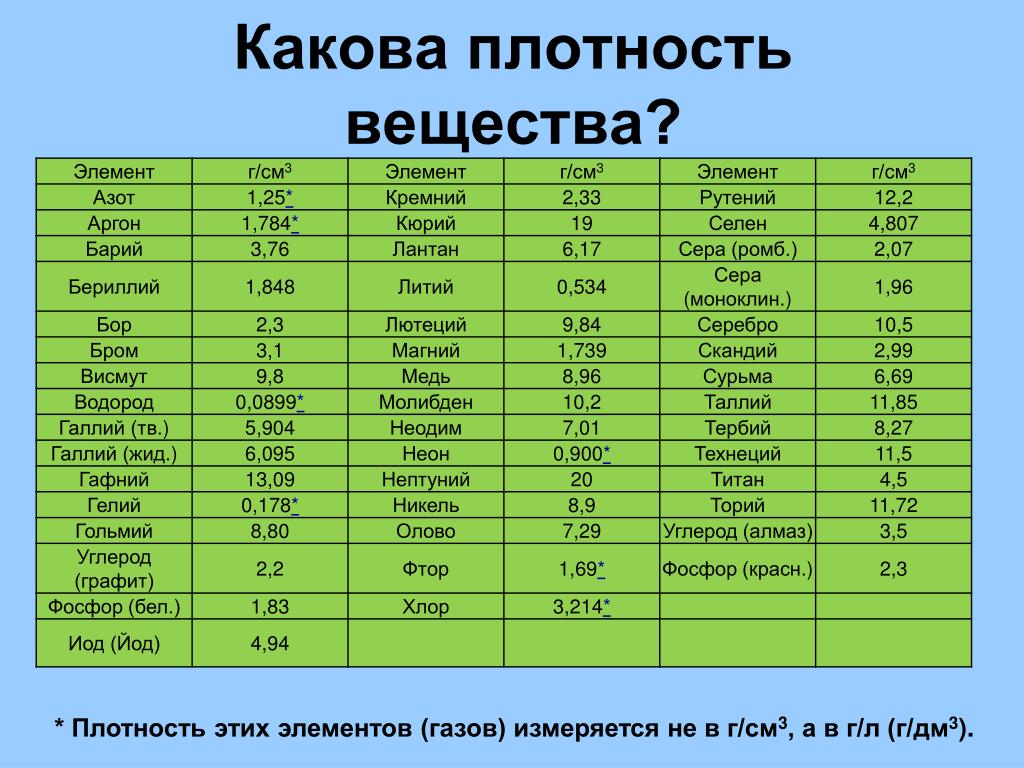
Оборудование и материалы: набор
жидкостей (спирт, вода, масло), пипетки,
предметные стекла, термометры, электрическая
плитка, лабораторная посуда, калориметры, лед,
листы с заданиями. На доске закреплен плакат,
который в ходе урока заполняется карточками,
приготовленными заранее.
Подготовка. В процессе изучения материала по теме «Изменение агрегатных состояний вещества» учитель подводит учеников к мысли о том, что существует множество интересных явлений, связанных с изменением агрегатного состояния вещества, которые остались за страницами учебника. Он предлагает ребятам самостоятельно изучить эти явления. Ученики разбиваются на группы «Плавление», «Кипение», «Испарение» и выбирают себе вид деятельности – теорию или эксперимент. Работу группы координирует руководитель группы. Группы получают листы с заданиями, а руководитель – листок с вопросами, на которые группа должна дать ответ после выполнения экспериментальных заданий.
На подготовку к уроку отводится несколько дней. За это время «теоретики» изучают дополнительную литературу по своей теме, «экспериментаторы» готовят все необходимое для проведения исследований. Ученики могут обращаться за консультацией к учителю.
Практическая работа. Выполнение этого этапа рассчитано на два урока. Каждая группа занимает отдельный ряд, украшенный своей эмблемой. Руководитель садится за первую парту, сразу за ним располагаются «экспериментаторы», а дальше – «теоретики». На столах «экспериментаторов» находятся карточки с исследовательскими заданиями, а также необходимые приборы и материалы. Для «теоретиков» подготовлена «библиотека»: на сдвинутых столах в дальнем конце класса разложена всевозможная литература, которая может понадобиться.
На столах лежат также карточки с названиями процессов, выполненные в форме стрелок, карточки из прозрачного пластика со схематичным изображением молекулярного строения кристалла, жидкости и газа, карточки с символами +Q, –Q, U, UЇ.
На столах руководителей групп разложены карточки с текстом, из которых руководитель, заслушав отчеты своих коллег, выберет верные и прикрепит их к плакату на доске.
Задания
«Плавление»
Задание для группы
1.
Изготовить вымпел «Плавление».
2. Вопросы для подготовки:
- Как tпл зависит от внешнего давления?
- Как tпл льда зависит от внешнего давления?
- Как объяснить зависимость tпл от внешнего давления?
- Одинакова ли tпл у различных веществ?
3. Подготовить демонстрацию «Плавление льда под действием внешнего давления».
4. Во время урока провести экспериментальное исследование и ответить на вопросы:
- Меняется ли температура вещества в процессе плавления?
- Требуется ли подвод энергии при плавлении?
Задание для руководителя
После того как группа проделает работу и отчитается, вам необходимо выбрать правильные ответы на следующие вопросы и установить карточки с ответами на опорный конспект на доске.
1. Требует плавление подвода энергии или нет?
2. Меняется температура в процессе плавления или нет?
3. Зависит температура плавления от внешнего давления или нет? Как?
Задание для группы
1. Изготовить вымпел «Кипение».
2. Вопросы для подготовки:
- Чем отличается парообразование в процессе кипения от испарения?
- Требуется ли подвод энергии при кипении?
- Меняется ли температура вещества при кипении?
- Как зависит температура кипения от внешнего давления?
- Как можно объяснить эту зависимость?
- Каковы условия роста пузырька с паром в кипящей жидкости?
- Каковы условия кипения?
3. Подготовить демонстрацию закипания воды при понижении внешнего давления.
4. Во время урока провести экспериментальное исследование и ответить на вопросы:
- Меняется ли температура вещества в процессе кипения?
- Требуется ли подвод энергии при кипении?
- Как влияет наличие центров парообразования на кипение?
- Понаблюдать за образованием и ростом пузырьков.
Задание для руководителя
После того как группа проделает работу и отчитается, вам необходимо выбрать правильные ответы на следующие вопросы и установить карточки с ответами на опорный конспект на доске.
1. Кипение идет по всему объему или только на поверхности?
2. Требует кипение подвода энергии или нет?
3. Меняется температура в процессе кипения или нет?
4. Зависит температура кипения от внешнего давления или нет?
5. Каковы условия кипения?
«Испарение»
Задание для группы
1. Изготовить вымпел «Испарение».
2. Вопросы для подготовки:
- Чем отличается парообразование в процессе кипения от испарения?
- Требуется ли подвод энергии при испарении?
- Меняется ли температура вещества при испарении?
- Каковы условия выхода молекул из жидкости при испарении?
3. Во время урока провести экспериментальное исследование и ответить на вопросы:
- Меняется ли температура жидкости при испарении?
- Как скорость испарения зависит от температуры жидкости?
- Как скорость испарения зависит от площади поверхности?
- Зависит ли скорость испарения от рода жидкости?
- Зависит ли скорость испарения от наличия ветра?
Задание для руководителя
После того как группа проделает работу и отчитается, вам необходимо выбрать правильные ответы на следующие вопросы и установить карточки с ответами на опорный конспект на доске.
1. Испарение происходит по всему объему или только со свободной поверхности жидкости?
2. При испарении требуется подвод энергии или нет?
3. Остается ли постоянной температура испаряющейся жидкости?
4. При каком условии молекула сможет вырваться из жидкости?
5.От каких условий зависит скорость испарения?
Ход урока
I. Вводная часть (5 мин)
Учитель сообщает тему урока, форму его проведения, цель. Плакат (опорный конспект) на доске содержит только название темы («Особенности плавления и парообразования») и слова «Твердое тело», «Жидкость», «Газ».
II. Повторение пройденного и активизация знаний (10 мин)
В ходе беседы повторяем особенности молекулярного строения кристаллических твердых тел, жидкостей и газов. Учитель задает вопросы:
- У кого на столе есть табличка, изображающая молекулярное строение твердого тела? (Табличка, нарисованная маркером на прозрачной основе, размещается на плакате поверх надписи «Твердое тело».)
- В чем особенности молекулярного строения твердого тела?
- Какими свойствами обладают твердые тела?
- Как объяснить свойства твердых тел, исходя из особенностей их молекулярного строения? И т.д.
Затем вспоминаем названия процессов превращения из одного агрегатного состояния в другое, размещая соответствующие стрелки с названием процесса на плакате.
III. Практическая работа (25 мин)
«Теоретики», работая с литературой, готовят выступления, в которых прозвучат ответы на вопросы, полученные на подготовительном этапе. Выступлениям желательно придать интересную форму: интервью, репортаж, диалог с ученым…
Задания для «экспериментаторов»:
Группа «Плавление»
- Готовят демонстрационный эксперимент по плавлению льда под действием давления. Для этого заранее замораживают воду в пластиковой бутылке с «шейкой». На месте «шейки» пластик срезают, бутылку со льдом закрепляют горизонтально в штативах, через «шейку» перекидывают проволоку с грузом на концах. Со временем проволока прорезает лед, а над ней он снова смерзается;
- Исследуют, требуется ли подвод энергии для
плавления льда.
 Для этого сравнивают процесс
плавления льда в калориметре в двух случаях:
когда оба стакана калориметра, между которыми
имеется воздушная прослойка, имеют одинаковую
температуру и когда во внешний стакан налита
горячая вода. В ходе выполнения работы ученики
пишут отчет по форме: «проделали…»,
«наблюдали…», «вывод…»
Для этого сравнивают процесс
плавления льда в калориметре в двух случаях:
когда оба стакана калориметра, между которыми
имеется воздушная прослойка, имеют одинаковую
температуру и когда во внешний стакан налита
горячая вода. В ходе выполнения работы ученики
пишут отчет по форме: «проделали…»,
«наблюдали…», «вывод…» - Исследуют, меняется ли температура льда в процессе плавления. Для этого измеряют температуру смеси небольшого количества воды и льда и составляют отчет.
Группа «Кипение»
- Готовят к демонстрации эксперимент «Кипение воды при пониженном давлении», используя воздушный колокол и насос.
- Изучают процесс кипения воды, наблюдая за образованием и ростом пузырьков пара и за изменением объема всплывающих пузырьков, при этом измеряют температуру воды. Наблюдают, как меняется характер кипения, если в закипающую воду бросить щепотку мелкой соли. Будет ли продолжаться кипение, если нагреватель отключить?
В ходе работы ученики оформляют отчет.
Группа «Испарение»
- Исследуют, как испаряются различные жидкости, сравнивая время испарения капли спирта, воды и масла.
- Исследуют, как влияет на скорость испарения спирта площадь открытой поверхности жидкости (одну из капель нужно размазать).
- Исследуют зависимость скорости испарения спирта от температуры (одна капля – на холодное стекло, другая – на стекло, покрывающее калориметр с горячей водой).
- Исследуют, как сказывается наличие ветра на скорости испарения (ветер можно «сделать», помахав листом бумаги).
- Исследуют, меняется ли температура испаряющейся жидкости (ватка, закрепленная на конце термометра, смачивается спиртом). Результаты исследований оформляются в форме отчета.
Руководители групп вникают в работу своих
коллег, участвуют в обсуждении, стремятся
получить ответы на поставленные вопросы.
Учитель оказывает помощь, если выполнение работы вызывает затруднение, ненавязчиво направляет ход обсуждения результатов работы в нужное русло.
IV. Обсуждение результатов (30 мин)
Заслушиваются выступления «теоретиков» и отчеты «экспериментаторов» групп. Обсуждаются демонстрационные эксперименты. После этого руководитель зачитывает вопрос и выбирает карточку с правильным ответом, которую закрепляет на плакате в нужном месте. Таким образом, на плакате постепенно формируется опорный конспект.
V. Осмысливание результатов (5 мин)
Еще раз обсуждаем, какие процессы идут с поглощением энергии, какие с выделением, как меняется внутренняя энергия вещества при изменении его агрегатного состояния. На плакат помещаются значки: +Q, –Q, U, UЇ.
Карточки для группы «Плавление»
Карточки для группы «кипение»
Карточки для группы «испарение»
Дополнительные вопросы
- Зачитываю выдержку из статьи В.Пескова «Белая радость», опубликованной в «Комсомольской правде», и прошу объяснить описанное явление: «Лыжники знают: в большой мороз скольжение неважное. И есть температуры, когда скольжения нет вовсе. В Антарктиде для самолетов установлен жесткий предел – минус 60 градусов. Если мороз сильнее (например, в районе станции «Восток»), снег становится, как песок, скольжение по нему невозможно, самолет не взлетит».
- Зачитываю выдержку из воспоминаний
альпинистов-участников восхождения на Эверест и
прошу объяснить, почему высоко в горах вода кипит
при более низкой температуре: «…Разжигаем
примус и начинаем готовить чай и кашу. Это долгое
занятие. Набрать снега, растопить его,
вскипятить. Просто так, без подготовки, ни чай, ни
кашу не сваришь: вода кипит, но там не то что ста,
но и восьмидесяти градусов тепла не наберется.
 ..
Еду можно приготовить только в автоклаве…»
..
Еду можно приготовить только в автоклаве…»
VI. Подведение итогов, оценка работы, объяснение домашнего задания (5 мин)
Практика показывает, что плохих оценок на таких уроках не бывает, как не бывает и учеников, не включившихся в работу.
Домашнее задание: написать сочинение-фантазию на тему «О чем могла бы рассказать нам молекула льда». («Кусок льда лежит в котелке альпинистов, собирающихся пить чай…»)
Что могла бы рассказать молекула воды
Меня зовут Молли. Я молекула льда и живу в маленьком поселке с названием «Снежинка». Я хорошо знаю всех своих соседей, так как молекулярная связь не дает нам сдвинуться с места. Мы все гордимся Дальним порядком, который царит в нашей Снежинке.
Однажды нашу Снежинку подхватил ветер и долго носил над горами. Когда ветер стих и Снежинка опустилась на землю, наш маленький поселок постигла беда. Туристы набрали снега в котел. Огонь был уже разведен и весело потрескивал сухими сучьями. Я очень испугалась, когда вдруг почувствовала, что молекулярная связь не может больше удерживать меня на месте. Снежинка стала рушиться. Дальнего порядка как не бывало! И я с ужасом поняла: вокруг нет ни одной знакомой молекулы!
А температура в котле тем временем все поднималась. Привыкшая к холоду, я стала метаться. Что же делать? Где найти хоть одну знакомую молекулу?
Пока я таким образом перескакивала с места на место в поисках друзей, со дна стали подниматься пузыри. Их становилось все больше и больше. Они поднимались вверх и лопались где-то в вышине. Я догнала один большой пузырь, полагая, что чем пузырь больше, тем он умнее.
– Вы мне не подскажете, что тут происходит? – спросила я.
– Ну и молодежь пошла! Ничего не знают! – презрительно фыркнул пузырь и… лопнул!
Я испугалась, решив, что пузырь лопнул из-за меня, расплакалась и задрожала еще сильнее.
– Что с тобой? – спросила соседка.
Найдя благодарного слушателя, я поделилась
страхами и опасениями.
– Началось кипение, – со знанием дела объяснила та. – А в том, что пузырь лопнул, твоей вины нет. Просто давление пара внутри него оказалось меньше, чем давление воды снаружи. А тебе я посоветую подняться к поверхности. Если повезет – ты свободна! – бросила на прощание молекула.
«Странно!» – подумала я, но стала пробиваться к поверхности. Поначалу меня просто грубо толкали со всех сторон. Но, набравшись смелости и терпения, получив изрядное количество синяков и шишек, я прорвалась наверх. И тут, получив особенно сильный удар в бок, я внезапно взлетела над поверхностью воды, ударилась лбом о крышку и полетела бы обратно в воду, однако тут, по счастью, туристы открыли крышку котелка. Я вырвалась на свободу, меня подхватил ветер.
– Вот она какая, свобода! – восхищенно шептала я, паря над заснеженными горными вершинами, лесами, реками и озерами нашей необъятной Родины.
В.Савинкова,
ученица 8-го кл.
Фазовые переходы: плавление, парообразование, кристаллизация.
Что нам понадобится знать и помнить для решения задач таких типов? То, что температура плавления и кристаллизации – одинаковы, и температура тела остается постоянной в течение всего процесса плавления (кристаллизации), и точно так же температура парообразования и конденсации равны, и температура жидкости в течение данных процессов постоянна.
1. На рисунке показан график зависимости температуры кристаллического вещества от времени его нагревания. Какова температура плавления вещества?
График сначала показывает рост температуры – значит, идет нагрев вещества. Мы знаем, что плавление происходит при постоянной температуре, так как все подводимое тепло идет на разрушение кристаллической решетки, и пока это разрушение не закончится, температура будет сохраняться на одном и том же уровне. На графике такой уровень, очевидно, .
Ответ: 50.
2. Горячая жидкость медленно охлаждалась в стакане.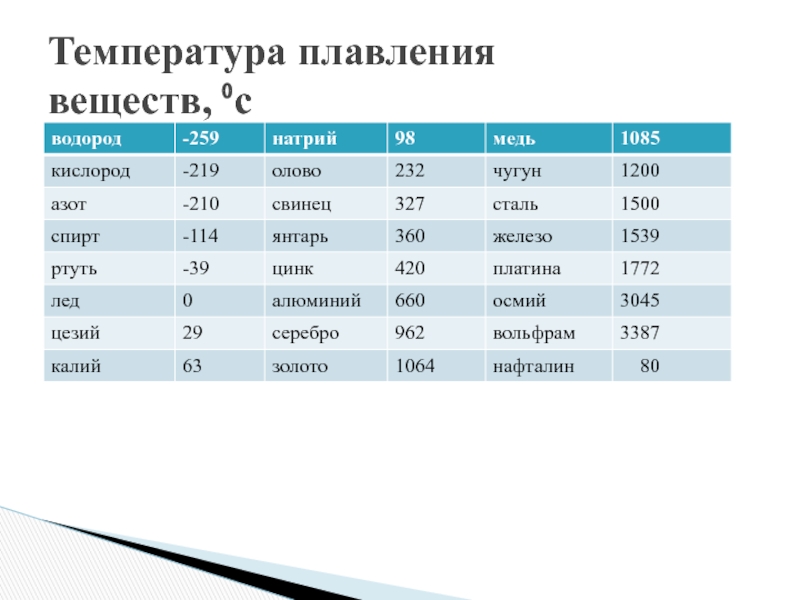 В таблице приведены результаты измерений ее температуры с течением времени.
В таблице приведены результаты измерений ее температуры с течением времени.
| Время, мин | 0 | 2 | 4 | 6 | 8 | 10 | 12 |
| Температура, град. | 96 | 89 | 86 | 84 | 84 | 84 | 79 |
Через семь минут в стакане находилось вещество:
1) только в жидком состоянии;
2) только в твердом состоянии;
3) и в жидком, и в твердом состояниях;
4) и в жидком, и в газообразном состояниях.
По таблице видно, что температура сохраняется постоянной некоторое время, очевидно, что в это время продолжается кристаллизация. Тогда, раз она не закончена, значит, отвердело не все вещество, а только его часть, поэтому вещество будет присутствовать как в твердом, так и в жидком состоянии.
Ответ: 3.
3. На рисунке показан график изменения температуры вещества по мере поглощения теплоты. Масса тела 0,15 кг. Первоначально вещество было в твердом состоянии. Какова удельная теплота плавления вещества?
Удельная теплота плавления – это количество тепла, которое необходимо передать телу, чтобы расплавился 1 кг. Наше тело весит меньше, поэтому для его плавления требуется и тепла меньше, а именно, 15% от того количества, которое потребовалось бы для килограмма. По графику видим, что телу было передано количество тепла Дж, значит, килограмму потребуется Дж/K
4. Вещество массой m находится в твердом состоянии. К нему при постоянной температуре подводят количество теплоты Q, и оно переходит в жидкое состояние . Удельную теплоту плавления можно рассчитать по формуле:
1)
2)
3)
4)
Удельная теплота плавления – количество тепла, необходимое, чтобы расплавить 1 кг вещества, поэтому выбираем формулу 3.
Ответ: 3.
5. На графике показана зависимость температуры Т вещества от времени t.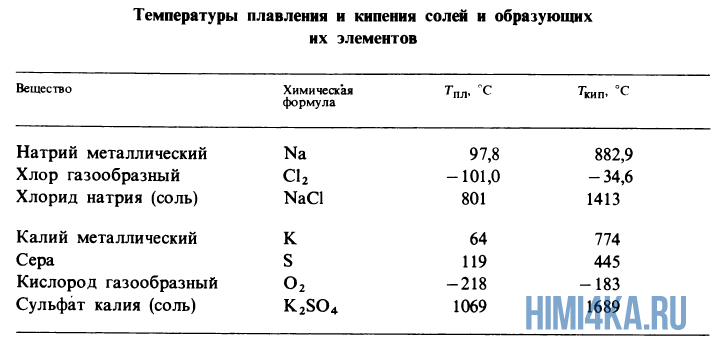 В начальный момент времени вещество находилось в кристаллическом состоянии. Окончанию процесса плавления вещества соответствует точка:
В начальный момент времени вещество находилось в кристаллическом состоянии. Окончанию процесса плавления вещества соответствует точка:
1) 5
2) 2
3) 3
4) 6
Рассмотрим график. На участке 1-2 температура тела изменяется – оно нагревается. Когда тело нагреется до температуры плавления, температура его перестанет меняться, так как теперь тепло идет на разрушение решетки, и так будет, пока тело все не расплавится. После этого температура снова начнет расти, так как будет нагреваться образовавшаяся жидкость. Точка, находящаяся в конце горизонтального участка и в начале наклонного – и есть точка окончания процесса плавления, это точка 3.
Ответ: 3.
6. В печь поместили некоторое количество алюминия. Диаграмма изменения температуры алюминия с течением времени показана на рисунке. Печь при постоянном нагреве передает алюминию 2 кДж энергии в минуту. Какое количество теплоты потребовало плавление алюминия?
1) 15 кДж
2) 40 кДж
3) 20 кДж
4) 30 кДж
Раз в одну минуту передавали 2 кДж тепла, значит, надо определить время, в течение которого происходило плавление – то есть отрезок времени, когда температура не менялась. Это горизонтальный участок, его продолжительность – 20 минут. Тогда количество теплоты будет равно кДж.
Ответ: 2.
7. На графике показаны кривые нагревания двух жидкостей одинаковой массы при постоянной мощности подводимого тепла. Отношение температур кипения первого вещества к температуре кипения второго вещества
Очевидно, что первое вещество (синий график) кипит при . а второе (красный график) при . Тогда отношение будет .
1) 1/3
2) 1/2
3) 2
4) 3
Ответ: 2.
8. На графике показана зависимость температуры воды в чайнике от времени. Такой ход графика возможен, если
1) первые 20 минут чайник стоял на горячей плите, а вторые 20 минут – на столе;
2) первые 20 минут чайник стоял на столе, а вторые 20 минут – на горячей плите;
3) все сорок минут чайник стоял на столе;
4) все сорок минут чайник стоял на горячей плите.
Температура сначала постоянна – так бывает во время кипения, или парообразования. Потом температура снижается – вода остывает. Значит, чайник стоял на плите и кипел, после чего остывал на столе.
Ответ: 1.
9. Некоторое количество воды поместили в закрытый сосуд, в котором находился сухой воздух. Через достаточно продолжительное время после этого относительная влажность в сосуде будет
1) меньше 100%
2) равна 100%
3) больше 100%
4) меньше 100% или равна 100%
Ответ на этот вопрос зависит от того, какое же количество воды находилось в сосуде. Поскольку мы этого не знаем, но знаем точно, что испарение будет происходить, то влажность воздуха не может остаться равной 0%. Но, возможно, воды столько, что относительная влажность достигнет и 100%. Поэтому выбираем ответ 4.
Богданов К.Ю. — учебник по физике для 10 класса
§ 29. КОЛИЧЕСТВО ТЕПЛОТЫ. УДЕЛЬНАЯ ТЕПЛОЁМКОСТЬ, ТЕПЛОТА ПЛАВЛЕНИЯ И ПАРООБРАЗОВАНИЯ.
Количество теплоты – это энергия, получаемая телом, которая приводит к росту его внутренней энергии и температуры. Наоборот, тела, потерявшие какое-то количество теплоты, уменьшают свою внутреннюю энергию и охлаждаются.
Внутреннюю энергию тела
можно изменить либо совершив работу над ним, либо изменив его температуру.
Процесс, при котором внутренняя энергия данного тела изменяется, но при этом
окружающие его тела не совершают над ним никакой работы, называют теплообменом
или теплопередачей. Так, теплообмен происходит между соприкасающимися
неодинаково нагретыми телами, в месте контакта которых молекулы более нагретого
тела передают часть своей кинетической энергии молекулам менее нагретого тела.
В результате теплообмена, часть внутренней энергии более нагретого тела
переходит к менее нагретому, и, в конце концов, их
температуры становятся равными.
Изменение внутренней энергию, произошедшее при теплообмена, называют количеством теплоты. Очевидно, что количество теплоты, Q, необходимое для изменения температуры тела на Dt, должно быть пропорционально его массе, m, что можно записать в виде:
Q = cmDt, (29.1)
где с – удельная теплоёмкость вещества, из которого состоит тело. Удельная теплоёмкость численно равна количеству теплоты, которое необходимо передать 1 кг вещества, чтобы поднять его температуру на 1 оС. Единицей измерения удельной теплоёмкости в СИ является Дж/(кг.град).
Удельная теплоёмкость зависит от свойств вещества. Отметим, что удельная теплоёмкость воды, 4,2 кДж/(кг.град), гораздо выше величин для других веществ. Так, удельная теплоёмкость воздуха – 1,0 кДж/(кг.град), дерева – 2,5 кДж/(кг.град), железа – 0,5 кДж/(кг.град), а песка – 0,8 кДж/(кг.град).
Удельная теплоёмкость зависит не только от типа вещества, но и от того, в каких условиях оно находится. Например, если нагревать тело и давать ему возможность расширяться, то часть количества теплоты, потратится на работу против сил, препятствующих этому расширению. Поэтому удельная теплоёмкость в таких условиях будет больше, чем в случае, когда нагрев тела не будет сопровождаться его расширением.
При плавлении,
кристаллизации, конденсации и парообразовании молекулы или атомы вещества
изменяют положение относительно друг друга, что сопровождается изменением
потенциальной энергии их взаимодействия, а значит, и внутренней энергии тела.
При этом кинетическая энергия молекул вещества остаётся постоянной, и поэтому
температура при переходе из одного агрегатного состояния в другое тоже остаётся
неизменной (см. рис.29). Таким образом, при переходе тела из одного агрегатного
состояния в другое оно либо требует определённое количество теплоты (плавление,
парообразование), либо отдаёт его в окружающую среду (при конденсации и
кристаллизации).
рис.29). Таким образом, при переходе тела из одного агрегатного
состояния в другое оно либо требует определённое количество теплоты (плавление,
парообразование), либо отдаёт его в окружающую среду (при конденсации и
кристаллизации).
Количество теплоты Q, необходимое для того, чтобы расплавить твёрдое кристаллическое тело, должно быть пропорционально массе m тела:
Q = lm , (29.2)
где l — удельная теплота плавления, численно равная количеству теплоты, необходимому для превращения 1 кг твёрдого кристаллического вещества при температуре плавления в жидкость той же температуры. Отметим, что при отвердевании (кристаллизации) выделяется такое же количество теплоты, какое поглощается при плавлении.
Количество теплоты r, необходимое для превращения 1 кг жидкости при температуре кипения в пар той же температуры, называют удельной теплотой парообразования. Поэтому количество теплоты Q, необходимое для испарения жидкости массы m при температуре её кипения равно:
Q = rm . (29.3)
При конденсации (образовании жидкости из пара) выделяется такое же количество теплоты, какое поглощается при парообразовании.
Удельная теплота плавления льда, 334 кДж/кг больше, чем у многих других веществ (у свинца – 23 кДж/кг, золота – 66 кДж/кг). Удельная теплота парообразования воды 2260 кДж/кг тоже в 3-10 раз выше, чем у других жидкостей (спирт, эфир, ртуть, керосин). Вода, обладая такими уникальными свойствами и окружая нас со всех сторон (моря, океаны и пары в атмосфере), стабилизирует климат на планете, сглаживая резкие изменения температуры.
Вопросы для повторения:
· Что такое количество теплоты, и как оно связано с процессом теплообмена между телами?
· Дайте определение удельной теплоёмкости, теплоте плавления и парообразования вещества?
· Как изменяется внутренняя энергия при плавлении, кристаллизации, парообразовании и конденсации?
· Какова роль воды в стабилизации температуры на Земле?
Рис. 29.
Зависимость температуры льда, а потом воды и пара от количества теплоты, подводимого
к телу.
29.
Зависимость температуры льда, а потом воды и пара от количества теплоты, подводимого
к телу.
Точка плавления | Химия для неосновных
Цели обучения
- Определите точку плавления.
- Опишите процесс движения частиц при плавлении.
- Опишите силы, влияющие на температуру плавления материала.
Примеры
Вы когда-нибудь катались на коньках?
Зимой многие люди считают снег и лед прекрасными. Им нравится кататься на лыжах или коньках.Другие не считают это время года таким веселым. Когда тает снег, дороги становятся очень неряшливыми и грязными. Эти люди с нетерпением ждут весны, когда уже не будет снега и льда, а погода станет теплее.
Температура плавления
Твердые тела похожи на жидкости в том, что оба являются конденсированными состояниями с частицами, которые расположены гораздо ближе друг к другу, чем частицы газа. Однако, в то время как жидкости жидкие, твердые тела — нет. Частицы большинства твердых веществ плотно упакованы и упорядочены.Движение отдельных атомов, ионов или молекул в твердом теле ограничено колебательным движением вокруг фиксированной точки. Твердые тела почти полностью несжимаемы и являются наиболее плотными из трех состояний материи.
Когда твердое тело нагревается, его частицы вибрируют быстрее, поскольку твердое тело поглощает кинетическую энергию. В конце концов, организация частиц внутри твердой структуры начинает разрушаться, и твердое тело начинает плавиться. Точка плавления — это температура, при которой твердое вещество превращается в жидкость.В точке плавления разрушительные колебания частиц твердого тела преодолевают силы притяжения, действующие внутри твердого тела. Как и в случае с температурами кипения, температура плавления твердого вещества зависит от силы этих сил притяжения. Хлорид натрия (NaCl) — это ионное соединение, состоящее из множества сильных ионных связей. Хлорид натрия плавится при 801 ° C. Лед (твердый H 2 O) представляет собой молекулярное соединение, молекулы которого удерживаются вместе водородными связями. Хотя водородные связи являются самыми сильными из межмолекулярных сил, прочность водородных связей намного меньше, чем у ионных.Температура плавления льда 0 ° C.
Хлорид натрия плавится при 801 ° C. Лед (твердый H 2 O) представляет собой молекулярное соединение, молекулы которого удерживаются вместе водородными связями. Хотя водородные связи являются самыми сильными из межмолекулярных сил, прочность водородных связей намного меньше, чем у ионных.Температура плавления льда 0 ° C.
Точка плавления твердого вещества такая же, как точка замерзания жидкости. При этой температуре твердое и жидкое состояния вещества находятся в равновесии. Для воды это равновесие происходит при 0 ° C.
Мы склонны думать о твердых телах как о материалах, которые тверды при комнатной температуре. Однако все материалы имеют ту или иную температуру плавления. Газы становятся твердыми при очень низких температурах, а жидкости также становятся твердыми, если температура достаточно низкая.В таблице , приведенной ниже, приведены температуры плавления некоторых распространенных материалов.
| Материал | Точка плавления (° C) |
| водород | -259 |
| кислород | -219 |
| диэтиловый эфир | -116 |
| этанол | -114 |
| вода | 0 |
| чистое серебро | 961 |
| чистое золото | 1063 |
| утюг | 1538 |
Ключевые выводы
Сводка
- Точка плавления — это температура, при которой твердое вещество превращается в жидкость.
- Межмолекулярные силы оказывают сильное влияние на температуру плавления.
Упражнения
Практика
Вопросы
Воспользуйтесь ссылкой ниже, чтобы ответить на следующие вопросы
http://chemwiki.ucdavis.edu/Organic_Chemistry/Organic_Chemistry_With_a_Biological_Emphasis/Chapter__2%3a_Introduction_to_organic_structure_and_bonding_II/Section_2. 4%3a_Solubility%2c_melting_points
4%3a_Solubility%2c_melting_points
- С какой степенью точности можно измерить температуру плавления?
- Как мы можем использовать данные о температуре плавления, чтобы идентифицировать соединение?
- Как мы можем использовать точки плавления для оценки чистоты соединения?
Упражнения
Обзор
Вопросы
- Определите точку плавления.
- Что происходит, когда материал плавится?
- Можно ли ожидать, что этан (C 2 H 6 ) будет иметь более высокую или более низкую температуру плавления, чем вода? Поясните свой ответ.
Глоссарий
- несжимаемый: Невозможно сжать.
- точка плавления: Температура, при которой твердое вещество превращается в жидкость.
- колебательное движение: Возвратно-поступательное движение.
|
|
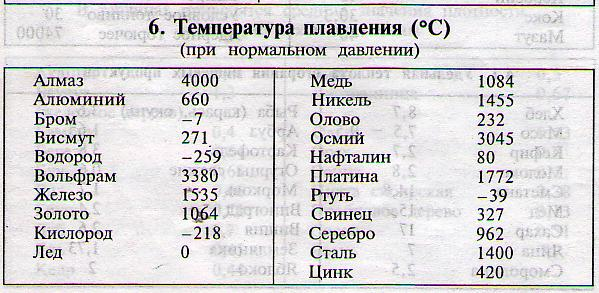
Твердые вещества, жидкости и газы в домашних условиях — точки плавления, точки кипения, твердый или жидкий сахар ?, Смеси состояний
Все окружающие вас материалы можно описать как твердые тела, жидкости или газы.
Точки плавления
Различные материалы плавятся при разных температурах. На диаграмме показаны температуры плавления некоторых известных вам материалов. Вы можете найти некоторые из этих материалов на своей кухне.
Шоколад плавится при температуре около 97 ° F (36 ° C), что чуть ниже температуры тела.Шоколад приятно есть, потому что он тает во рту!
Температура в комнате обычно составляет около 18 ° C (65 ° F). Материал с температурой плавления ниже этой будет жидкостью. Оливковое масло и вода — жидкости при комнатной температуре.
Точки кипения
Различные материалы также кипятят при разной температуре. Жидкости, такие как молоко и фруктовые соки, в основном состоят из воды. Это означает, что они должны кипеть примерно при той же температуре, что и вода. Таким образом, они закипают при температуре около 212 ° F (100 ° C).
ПРИГОТОВЛЕНИЕ
При нагревании сливочного масла оно тает. Он превращается в жидкость. При нагревании яйцо превращается из жидкого в твердое. Это происходит потому, что тепло меняет химические вещества, из которых сделано яйцо. Это не то же самое, что изменение состояния.
Сахар — твердое вещество или жидкость?
Твердые тела имеют фиксированную форму. Жидкости текут и принимают форму емкости, в которую вы их кладете. Поверхность жидкости плоская. Сахар обладает некоторыми из свойств жидкости.Вы можете перелить его из одной емкости в другую. Он примет форму контейнера, в который вы его положили.
Сахар обладает некоторыми свойствами жидкости. Он также обладает некоторыми свойствами твердого тела.
ПОРОШОК ДЛЯ РАСПЫЛЕНИЯ
Некоторые удобрения выпускаются в виде порошка. Их можно перекачивать и распылять, как жидкость.
Сахар также обладает некоторыми свойствами твердого вещества. Можно сделать груду сахара. Но плоской поверхности не получится, если ее не сгладить.
Посмотрите внимательно на сахар. Вы видите, что он состоит из крошечных кристаллов . Кристаллы твердые. Твердые материалы иногда действуют как жидкости, если куски очень маленькие. Другие твердые материалы, которые могут действовать как жидкости, — это соль и песок.
Смесь государств
Многие вещи вокруг вас представляют собой комбинации материалов в разных состояниях.
Некоторый лак для волос выпускается в виде баллончика. Лак для волос представляет собой смесь крошечных капель жидкости и газа. Жидкость — это химическое вещество, которое удерживает волосы на месте.Газ помогает распылять капли жидкости на волосы. Смесь капель жидкости в газе называется аэрозолем .
ОБЛАКА
Облака — это аэрозоли, потому что они представляют собой крошечные капли жидкости (воды), смешанные с газом (воздухом). Туман и туман также являются аэрозолями. Это просто облака, которые достигают земли!
Поролон — это прочная резина с большим количеством пузырьков воздуха. Поролон мягкий и мягкий. Используется для подушек и игрушек.
Пенка (крем) поверх эмульсии (молока).
Некоторые продукты также являются смесями. Молоко представляет собой смесь воды и капель жидкого жира. Смеси двух жидкостей называются эмульсиями. Взбитые сливки — это пена из пузырьков воздуха в жидкости.
Молоко представляет собой смесь воды и капель жидкого жира. Смеси двух жидкостей называются эмульсиями. Взбитые сливки — это пена из пузырьков воздуха в жидкости.
Каждый вид материи обладает рядом свойств, по которым его можно идентифицировать. В разделе 1.2A мы перечислили некоторые свойства, благодаря которым чистое вещество пищевая сода может быть идентифицирована.Эти свойства делятся на две большие категории (1) физические свойства, которые можно наблюдать без изменения состава. образца, и (2) химические свойства, наблюдение которых включает изменение в составе.
Пищевая сода легко растворяется в воде. Если вода испаряется из раствора
пищевой соды восстанавливается в неизменном виде; таким образом, растворимость
физическая собственность. Разложение пищевой соды при нагревании — это химическое вещество.
свойство.Вы можете наблюдать разложение пищевой соды, но после того, как сделаете
Это наблюдение, у вас больше нет пищевой соды. Вместо углекислого газа,
вода и карбонат натрия. Физическое изменение изменяет только физические свойства,
такие как размер и форма. Химическое изменение изменяет химические свойства, такие как
состав (см. рисунок 1.3).
Физические изменения | Химическая замена |
| РИСУНОК 1.3 Физико-химические свойства вещества. Сломать палку физически меняет свой размер, но не свой состав. Горение дерева меняет его химически, превращая его в другие вещества. |
Это обсуждение свойств указывает на другое различие между чистыми веществами и смесями. Смесь можно разделить на компоненты по разным физическим свойствам. Смесь соли и песка можно разделить, потому что соль растворяется в воде, а песок — нет.
 Если мы добавим воду в смесь соли и песка, соль растворится, и песок останется на дне емкости. Если слить воду, останется песок. Если вскипятить воду из солевого раствора, соль получится сама по себе. Мы разделили два компонента смеси по разнице в их способности растворяться в воде. Растворимость — это физическое свойство.
Если мы добавим воду в смесь соли и песка, соль растворится, и песок останется на дне емкости. Если слить воду, останется песок. Если вскипятить воду из солевого раствора, соль получится сама по себе. Мы разделили два компонента смеси по разнице в их способности растворяться в воде. Растворимость — это физическое свойство.
Чистая субстанция,
с другой стороны, их можно разделить на компоненты только путем химических изменений.При добавлении в воду чистое вещество бикарбонат натрия не разделяется на
натрий, водород, углерод и кислород, хотя эти компоненты бикарбоната натрия
сильно различаются по растворимости в воде.
Одним из важных физических свойств вещества является его физическое состояние при комнатной температуре. Три физических состояния материи: твердый, жидкость и газ. Большинство видов материи может существовать во всех трех состояниях.Вы знакомы с водой как с твердым телом (лед), жидкостью и газом (пар) (рис. 1.4). Вы видели воск в твердом состоянии при комнатной температуре и в жидком состоянии при нагревании. Вы, вероятно, видели диоксид углерода в виде твердого вещества (сухой лед) и знали о нем как о бесцветном газе при более высоких температурах. Температуры, при которых данный вид материи превращается из твердого в жидкое (его температура плавления) или из жидкости в газ (его точка кипения) физические свойства.Например, температура плавления льда (0 ° C) и температура кипения воды (100 ° C) являются физическими свойствами вещества вода.
| РИСУНОК 1.4 Три физических состояния воды: лед (твердое тело), вода (жидкость) и пар. (газ). |
Подобно чистым веществам, смеси могут существовать в трех физических состояниях твердого тела:
жидкость и газ. Воздух представляет собой газовую смесь примерно 78% азота, 21%
кислород и различные процентные содержания нескольких других газов.Медицинский спирт — это
жидкая смесь примерно 70% изопропилового спирта и 30% воды. Сталь
твердая смесь железа и других чистых веществ.
Как отделить соль от песка — 3 метода
Одним из практических приложений химии является то, что ее можно использовать для отделения одного вещества от другого. Причины, по которым материалы могут быть отделены друг от друга, заключаются в том, что между ними есть некоторые различия, такие как размер (отделение камней от песка), состояние вещества (отделение воды от льда), растворимость, электрический заряд или температура плавления.
Разделение песка и соли
- Студентов часто просят разделить соль и песок, чтобы узнать о смесях и изучить различия между формами вещества, которые можно использовать для разделения компонентов смеси.
- Для разделения соли и песка используются три метода: физическое разделение (выделение кусков или использование плотности для встряхивания песка до верха), растворение соли в воде или плавление соли.
- Вероятно, самый простой способ разделить два вещества — растворить соль в воде, слить жидкость с песка, а затем выпарить воду для извлечения соли.
Физическое разделение соли и песка
Поскольку и соль, и песок являются твердыми частицами, вы можете взять лупу и пинцет и в конечном итоге выделить частицы соли и песка.
Другой метод физического разделения основан на разной плотности соли и песка. Плотность соли составляет 2,16 г / см³, а плотность песка — 2,65 г / см³. Другими словами, песок немного тяжелее соли. Если встряхнуть кастрюлю с солью и песком, песок в конце концов поднимется наверх.Аналогичный метод используется для сбора золота, поскольку золото имеет более высокую плотность, чем большинство других веществ, и тонет в смеси.
Разделение соли и песка по растворимости
Один из методов разделения соли и песка основан на растворимости. Если вещество растворимое, значит, оно растворяется в растворителе. Соль (хлорид натрия или NaCl) — ионное соединение, растворимое в воде. Песка (в основном диоксида кремния) нет.
- Вылейте смесь соли и песка в кастрюлю.
- Добавьте воды. Не нужно добавлять много воды. Растворимость — это свойство, на которое влияет температура, поэтому в горячей воде растворяется больше соли, чем в холодной. Ничего страшного, если на этом этапе соль не растворяется.
- Нагрейте воду до растворения соли. Если вы дойдете до того места, где вода закипает, а там все еще есть твердая соль, вы можете добавить еще немного воды.
- Снимите сковороду с огня и дайте ей остыть, пока она не станет безопасной в обращении.
- Налейте соленую воду в отдельную емкость.
- Теперь собираем песок.
- Снова налейте соленую воду в пустую кастрюлю.
- Нагрейте соленую воду до кипения. Продолжайте кипятить, пока вода не исчезнет, а соль не останется.
Другой способ отделить соленую воду от песка — это взболтать песок / соленую воду и пропустить ее через кофейный фильтр для улавливания песка.
Разделение компонентов смеси по температуре плавления
Другой метод разделения компонентов смеси основан на температуре плавления.Температура плавления соли составляет 1474 ° F (801 ° C), а у песка — 3110 ° F (1710 ° C). Соль плавится при более низкой температуре, чем песок. Для разделения компонентов смесь соли и песка нагревают выше 801 ° C, но ниже 1710 ° C. Расплав соли можно слить, оставив песок. Обычно это не самый практичный метод разделения, поскольку обе температуры очень высоки. Собранная соль будет чистой, но некоторое количество жидкой соли может загрязнить песок, как если бы вы пытались отделить песок от воды, сливая воду.
Заметки и вопросы
Обратите внимание: вы могли просто дать воде испариться из кастрюли, пока у вас не останется соль. Если бы вы выбрали испарение воды, вы могли бы ускорить процесс, если бы вылили соленую воду в большой неглубокий контейнер. Увеличенная площадь поверхности изменила бы скорость, с которой водяной пар мог проникать в воздух.
Соль не выкипела вместе с водой. Это потому, что температура кипения соли намного выше, чем у воды.Разницу между точками кипения можно использовать для очистки воды дистилляцией. При перегонке воду кипятят, но затем охлаждают, чтобы она конденсировалась из пара обратно в воду и ее можно было собрать. Кипящая вода отделяет его от соли и других соединений, таких как сахар, но его необходимо тщательно контролировать, чтобы отделить его от химикатов с более низкими или аналогичными точками кипения.
Хотя этот метод можно использовать для разделения соли и воды или сахара и воды, он не отделит соль и сахар от смеси соли, сахара и воды.Вы можете придумать, как разделить сахар и соль?
Готовы к чему-то более сложному? Попробуйте очистить соль от каменной соли.
Как разделить песок и соль
Разделите песок и соль, используя разницу в растворимости, плотности или температуре плавления. (фото: Castorly)Вы можете разделить песок и соль либо для получения компонентов, либо для изучения химии разделения. Разделение — это метод очистки, основанный на физических или химических различиях между двумя или более материалами.Вот четыре способа отделить песок от соли и взглянуть на используемые принципы. Это отличный научный проект для учеников любого уровня обучения, потому что он заставляет их задуматься о свойствах материи, используя знакомые материалы. Они могут применить научный метод для тестирования различных методов разделения.
Разделение песка и соли механически
Компоненты любой смеси, такие как песок и соль, разделяются на основе их различий. И песок, и соль представляют собой твердые частицы с частицами одинакового размера.Однако при увеличении частицы выглядят иначе. Один из способов отделить песок от соли — использовать пинцет для механического отделения зерен по частям. Это не эффективный метод разделения, но он работает.
Разделение песка и соли по плотности
Вы можете гораздо быстрее разделить песок и соль, используя различную плотность этих двух веществ. Плотность соли составляет 2,16 г / см³, а плотность песка — 2,65 г / см³. Иными словами, если вы наполните ведро солью, а другое — песком, то ведро с песком будет весить больше.Песок немного тяжелее соли.
Итак, если встряхнуть сковороду с песком и солью, соль поднимется до верха сковороды. Вы можете соскрести верхний слой соли, чтобы отделить его от песка. По такому же принципу мы собираем золото. Золото тяжелее большинства других веществ, поэтому остается на дне кастрюли.
Разделение песка и соли по растворимости
Эти женщины отделяют морскую соль от песка и воды, позволяя солнцу испарить воду. (фото: Куанг Нгуен Винь)Соль растворяется в воде, а песок — нет.Другими словами, соль растворима в воде, а песок — нет. Итак, вы можете использовать разницу в растворимости для разделения смеси песка и соли. Добавляйте в смесь воду, пока соль не растворится. Растворимость увеличивается с повышением температуры, поэтому, если она горячая, вам потребуется меньше воды. Как только соль растворится, можно собирать песок. Один из способов сделать это — пропустить песок и соленую воду через кофейный фильтр или мелкое ситечко. Вы можете восстановить соль, кипятя соленую воду, пока вся вода не испарится.В качестве альтернативы вы можете просто налить соленую воду в кастрюлю и дать воде медленно испариться. Люди получают морскую соль, разливая морскую воду на большой площади и позволяя солнцу испарить воду.
Разделение песка и соли по температуре плавления
Соль (хлорид натрия) и песок (диоксид кремния) имеют разные точки плавления. Температура плавления соли составляет 1474 ° F (801 ° C), а у песка — 3110 ° F (1710 ° C). Итак, если приложить тепло, соль тает раньше, чем песок. Вы можете использовать разницу температур плавления для разделения смеси песка и соли, нагревая смесь выше 801 ° C, но ниже 1710 ° C.Слейте расплавленную соль, оставив песок. Хотя можно разделить компоненты смеси по температуре плавления, это не очень практично. Это связано с высокими температурами, и песок будет загрязнен небольшим количеством соли. Когда вы сливаете жидкую соль, небольшое количество соли загрязняет песок, например, когда вы сливаете воду с песка.
Вопросы и ответы для студентов
Вот несколько вопросов, которые нужно задать студентам, чтобы они задумались о том, как работает разделение:
- Какой метод лучше всего подходит для разделения песка и соли? Ответ: Лучше всего работает растворимость, потому что в соленой воде не остается песка, а на песке остается очень мало соли.Если промыть оставшийся песок водой, его можно вскипятить, чтобы получить оставшуюся соль.
- Извлекает ли из смеси 100% соли и песка каким-либо методом? Ответ: Не совсем. Хотя это происходит медленно, сбор отдельных частиц песка и соли, вероятно, дает лучшее разделение. Однако на молекулярном уровне, вероятно, на поверхности песка есть немного соли. Очищение всегда подразумевает небольшую потерю.
- Как сделать разделение с использованием растворимости более эффективным? Ответ: Используйте кипящую воду для растворения соли, чтобы минимизировать необходимое количество воды.Чтобы извлечь соль, налейте соленую воду тонким слоем, чтобы увеличить площадь поверхности и ускорить испарение.
- Если использовать метод определения растворимости, почему соль не испаряется вместе с водой? Ответ: Вода имеет гораздо более высокое давление пара, чем соль. Вода также имеет гораздо более низкую температуру кипения, чем соль. Использование различных точек кипения является основой метода разделения, называемого дистилляцией.
- Сработает ли какой-либо из этих методов для разделения соли и сахара? Ответ: Вы можете разделить их пинцетом при увеличении (хотя вы бы ненавидели свою жизнь).Кристаллы соли имеют кубическую форму, а кристаллы сахара — гексагональные призмы. Вы можете использовать растворимость. Сахар растворяется в спирте, а соль — нет. Хотя эти два соединения имеют разные точки кипения, вам нужно быть осторожным, чтобы не поджечь сахар.
Список литературы
- Национальные академии наук, инженерии и медицины (2019). Программа исследований для преобразования науки о разделении (отчет). Вашингтон, округ Колумбия: The National Academies Press. DOI: 10.17226 / 25421
- Уилсон, Ян Д.; Адлард, Эдвард Р .; Кук, Майкл; и др., ред. (2000). Энциклопедия науки о разделении . Сан-Диего: Academic Press. ISBN 978-0-12-226770-3.

 Изготовить вымпел «Плавление».
Изготовить вымпел «Плавление».
 От каких условий зависит скорость испарения?
От каких условий зависит скорость испарения?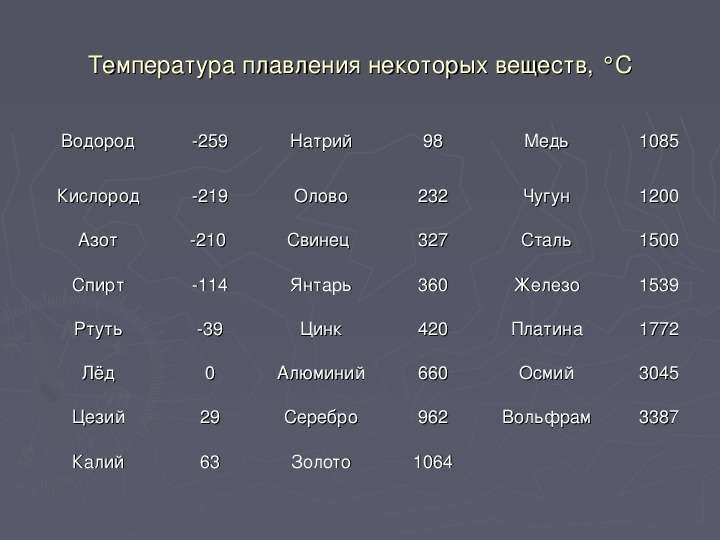 Для этого сравнивают процесс
плавления льда в калориметре в двух случаях:
когда оба стакана калориметра, между которыми
имеется воздушная прослойка, имеют одинаковую
температуру и когда во внешний стакан налита
горячая вода. В ходе выполнения работы ученики
пишут отчет по форме: «проделали…»,
«наблюдали…», «вывод…»
Для этого сравнивают процесс
плавления льда в калориметре в двух случаях:
когда оба стакана калориметра, между которыми
имеется воздушная прослойка, имеют одинаковую
температуру и когда во внешний стакан налита
горячая вода. В ходе выполнения работы ученики
пишут отчет по форме: «проделали…»,
«наблюдали…», «вывод…» ..
Еду можно приготовить только в автоклаве…»
..
Еду можно приготовить только в автоклаве…» Без запаха.
Без запаха.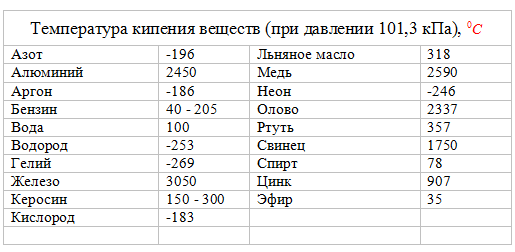 Хранить в прохладном, сухом, хорошо вентилируемом месте вдали от несовместимых веществ. Хранить в защищенном от влаги месте.
Хранить в прохладном, сухом, хорошо вентилируемом месте вдали от несовместимых веществ. Хранить в защищенном от влаги месте.