теплоемкость, теплопроводность и т. д.
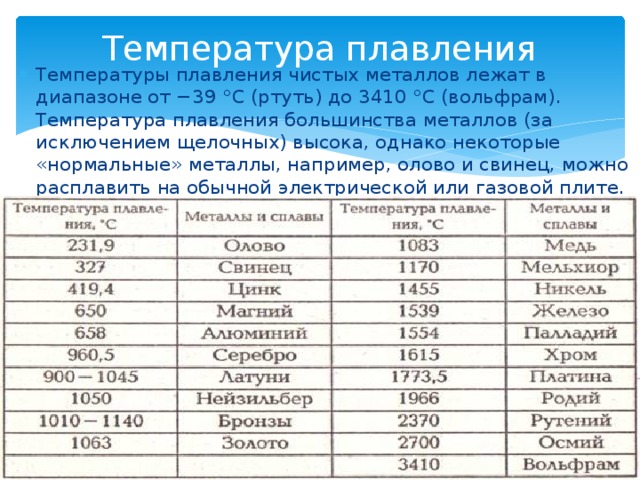
В таблицах представлены плотность вольфрама W, его теплопроводность и удельная теплоемкость, а также другие теплофизические свойства вольфрама при различных температурах (в интервале от 100 до 4000 К).
Металлический вольфрам W — твердый и сложный в механической обработке металл с температурой плавления более 3400°C. По температуре плавления он занимает второе место после углерода (в виде графита или алмаза).
Теплопроводность вольфрама достаточно высока и при комнатной температуре составляет 163 Вт/(м·К), что превышает теплопроводность даже некоторых сплавов алюминия. Вольфрам достаточно тяжелый металл — плотность вольфрама равна 19250 кг/м3 при комнатной температуре.
Удельная теплоемкость вольфрама имеет относительно небольшую величину, как и у других металлов с высокой плотностью. Теплоемкость вольфрама зависит от температуры и изменяется, по данным таблицы, в диапазоне от 87 до 270 Дж/(кг·К) для твердого состояния этого металла.
Вольфрам имеет очень низкий коэффициент теплового линейного расширения (КТЛР), равный 4,43 ·10-6 1/град при комнатной температуре. Этот металл не окисляется при комнатной температуре, но при высоких температурах реагирует с кислородом, образуя триоксид вольфрама WO3 красного цвета.
В таблице ниже представлены следующие теплофизические свойства вольфрама: плотность d, удельная массовая теплоемкость Cp, температуропроводность a, коэффициент теплопроводности λ, удельное электрическое сопротивление ρ, функция Лоренца
Свойства вольфрама даны в таблице в зависимости от температуры — в интервале от 100 до 3695 К для твердого состояния этого металла, а также при температуре до 4000 К для расплавленного (жидкого вольфрама).
Теплопроводность и другие теплофизические свойства вольфрама W чистотой 99,9% представлены в таблице в интервале температуры от 100 до 2700 К. Даны следующие свойства чистого металлического вольфрама: плотность, удельная массовая теплоемкость, теплопроводность, коэффициент теплового расширения (КТР), удельное электрическое сопротивление.
Даны следующие свойства чистого металлического вольфрама: плотность, удельная массовая теплоемкость, теплопроводность, коэффициент теплового расширения (КТР), удельное электрическое сопротивление.
По данным таблицы видно, что плотность вольфрама при нагревании уменьшается из-за его теплового расширения. Кроме того, при нагревании чистого вольфрама его теплопроводность уменьшается, а массовая теплоемкость увеличивается. Например, удельная теплоемкость вольфрама составляет 134,4 Дж/(кг·К) при комнатной температуре, а при его нагревании до 2100°C, его теплоемкость возрастает до величины 175 Дж/(кг·К).
Источники:
- В. Е. Зиновьев. Теплофизические свойства металлов при высоких температурах.
- Чиркин В. С. Теплофизические свойства материалов ядерной техники. М.: Атомиздат, 1967. — 474 с.
Плотность вольфрама (W), значение и примеры
На нашем сайте собрано более 100 бесплатных онлайн калькуляторов по математике, геометрии и физике.
Справочник
Основные формулы, таблицы и теоремы для учащихся. Все что нужно, чтобы сделать домашнее задание!
Заказать решение
Не можете решить контрольную?!
Мы поможем! Более 20 000 авторов выполнят вашу работу от 100 руб!
Плотность вольфрама и другие его физические свойства
На механические свойства вольфрама сильно сильное влияние оказывает наличие примесей: чистый металл – пластичный, а содержащий даже небольшую долю примесей азота и кислорода – хрупкий и ломкий.
Рис. 1. Вольфрам. Внешний вид.
Основные константы вольфрама приведены в таблице ниже.
Таблица 1. Физические свойства и плотность вольфрама.
|
Плотность, г/см3 |
19,30 |
|
Температура плавления, oС |
3410 |
|
Температура кипения, oС |
5700 |
|
Тип кристаллической решетки |
объемно-центрированная кубическая |
Нахождение вольфрама в природе
Вольфрам относят к редким и рассеянным металлам: его содержание в земной коре составляет 1×10-4% (масс. ). Основная форма нахождения вольфрама в природе – полевые шпаты, пироксены. Важнейшие минералы вольфрама – шеелит CaWO4 и вольфрамит (Fe, Mn)WO4, однако среднее содержание вольфрама в рудах крайне низко – не более 0,5% (масс.).
). Основная форма нахождения вольфрама в природе – полевые шпаты, пироксены. Важнейшие минералы вольфрама – шеелит CaWO4 и вольфрамит (Fe, Mn)WO4, однако среднее содержание вольфрама в рудах крайне низко – не более 0,5% (масс.).
Краткое описание химических свойств и плотность вольфрама
Несмотря на то, что вольфрама в ряду напряжений стоит левее водорода, он подобно другим тяжелым переходным металлам не взаимодействует с кислотами-неокислителями. Однако, семь концентрированных азотной и плавиковой кислот переводит его в раствор:
W + 8HF + 2HNO3 = H2WF8 + 2NO↑ + 4H2O.
Вольфрам не растворяется в горячих концентрированных растворах азотной или серной кислоты, а также в царской водке. Он устойчив в щелочных растворах, но в присутствии окислителей (KNO3, KClO3) растворяется в расплавах щелочей:
W + 3KNO3 + 2KOH = K2WO4 + 3KNO2 + H2O (t, oC).
При нагревании вольфрам вступает в реакции с неметаллами: в большинстве случаев вольфрам окисляется до степени окисления +6. Так, порошок металла при нагревании в кислороде примерно до 800oС воспламеняется, сгорая до оксида WO3. В атмосфере фтора вольфрам превращается в высший фторид WF6, при хлорировании образуется MoCl5. Серой вольфрам окисляется до дисульфида WS2. С азотом и углеродом он образует высокотвердые и жаропрочные нитриды (W2N, W5N2, WN и др.) и карбиды (W2C, WC и т.д.).
W + 3F2 = WF6;
2W + 5Cl2 = 2WCl5;
2W + 3O2 = 2WO3;
W + 2S = WS2.
Примеры решения задач
| Понравился сайт? Расскажи друзьям! | |||
Металлический вольфрам (W) Элемент Химические + физические свойства
Справочная информация
Слово вольфрам означает «тяжелый камень» на шведском языке. Химический символ вольфрама — W, что означает вольфрам. Название произошло от средневековых немецких плавильщиков, которые обнаружили, что оловянные руды, содержащие вольфрам, имеют гораздо более низкий выход. Говорили, что вольфрам пожирал олово «как волк». Чистый вольфрам был впервые выделен двумя испанскими химиками, братьями де Эльхуджар, в 1783 году. Вольфрам представляет собой серовато-белый блестящий металл, который при комнатной температуре находится в твердом состоянии. Вольфрам имеет самую высокую температуру плавления и самое низкое давление паров среди всех металлов, а при температурах выше 1650°C имеет самую высокую прочность на растяжение. Он обладает отличной коррозионной стойкостью и лишь незначительно подвергается воздействию большинства минеральных кислот.
Химический символ вольфрама — W, что означает вольфрам. Название произошло от средневековых немецких плавильщиков, которые обнаружили, что оловянные руды, содержащие вольфрам, имеют гораздо более низкий выход. Говорили, что вольфрам пожирал олово «как волк». Чистый вольфрам был впервые выделен двумя испанскими химиками, братьями де Эльхуджар, в 1783 году. Вольфрам представляет собой серовато-белый блестящий металл, который при комнатной температуре находится в твердом состоянии. Вольфрам имеет самую высокую температуру плавления и самое низкое давление паров среди всех металлов, а при температурах выше 1650°C имеет самую высокую прочность на растяжение. Он обладает отличной коррозионной стойкостью и лишь незначительно подвергается воздействию большинства минеральных кислот.
Преимущества вольфрама
- Один из самых плотных металлов с плотностью 19,3 г/см3
- Самая высокая температура плавления среди всех металлов при 3410°C
- Самое низкое давление паров среди всех металлов: 4,27 Па при 3410°C
- Самая высокая прочность на растяжение среди всех металлов при температуре свыше 1650°C
Вольфрам Применение
- подходит для уплотнений стекло-металл, так как тепловое расширение примерно такое же, как у боросиликатного стекла
- Вольфрам и его сплавы широко используются для изготовления нитей накала для электрических ламп, электронных и телевизионных ламп, а также для напыления металлов
- электрические контактные точки для распределителей двигателей
- рентгеновские мишени
- обмотки и нагревательные элементы для электрических печей
- карбид важен для металлообрабатывающей, горнодобывающей и нефтяной промышленности
- вольфраматы кальция и магния широко используются в флуоресцентном освещении
- соли вольфрама применяются в химической и кожевенной промышленности
- дисульфид вольфрама — сухая высокотемпературная смазка, устойчивая до 500°С
- вольфрамовые бронзы и другие соединения вольфрама используются в красках (электронные лампы)
Есть технические вопросы?
Мы готовы ответить на любые вопросы о наших продуктах или услугах и предоставить расценки на индивидуальные проекты. Мы с нетерпением ждем ответа от вас.
Мы с нетерпением ждем ответа от вас.
Свяжитесь с нами
Скачать наш лист данных о безопасности вольфрама
Скачать сейчас
В вольффини -ресурсах
вольфрам и стоит
Средний Запад В вольва Подробнее
Подробнее
Подробнее
Подробнее
Свойства вольфрама
| Atomic Number | 74 |
| Atomic Weight | 183.86 |
| Group Number | 6 |
| Electron Configuration | 1s2 2s2 2p6 3s2 3p6 4s2 3d10 4p6 5s2 4d10 5p6 6s2 4f14 5d4 |
| CAS Registry Number | 7440-33-7 |
| Wire Atomic Volume” | 9.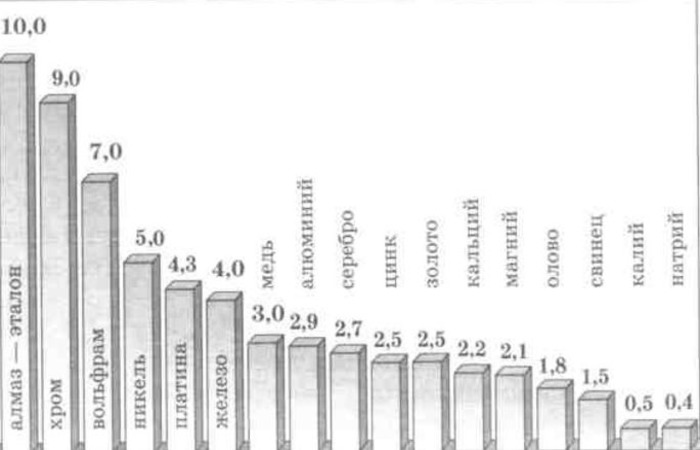 53 53 |
| Lattice Type | Body Centered Cube |
| Lattice Constant at 20C, Angstroms | 3.1585 |
| Natural Isotopes | 180, 182, 183, 184, 186 |
| Плотность при 20 ° С (GM/CC) | 19,3 |
| Плотность при 20 ° С ( фунт ./CU. Дюйм.0094 | 3410 |
| Boiling Point C | 5530 |
| Linear Coefficient of Expansion per C | 4.3 x 10E-6 | ||
| Теплопроводность при 20 C (кал/см/C/сек) | 0,40 | ||
| Удельная теплоемкость при 20 C (кал/грамм/C) | 0,032 | 98 Electronegativity (eV) Pauling | 2. 36 36 |
| Electronegativity (eV) Sanderson | 0.98 | ||
| Electronegativity (eV) Alfred Rochow | 1.40 | ||
| Electronegativity Conductivity, % IACS | 31 | ||
| Удельное электрическое сопротивление при 20C (мкОм-см) | 5,5 | ||
| Удельное электрическое сопротивление при 227C0094 | 10.5 | ||
| Electrical Resistivity @ 727C (microhm-cm) | 24.3 | ||
| Electrical Resistivity @ 1727C (microhm-cm) | 55.7 | ||
| Electrical Resistivity @ 2727C ( microhm-cm) | 90. 4 4 |
| Electrical Resistivity @ 3227 (microhm-cm) | 108.5 |
| Temperature Coefficient of Electrical Resistivity Per C (0-100 C) | 0.0046 |
| Tensile Strength @ Room Temperature, psi | 100,000 — 500,000 |
| Tensile Strength @ 500 C, PSI | 75 000 — 200 000 |
| Прочность на растяжение @ 1000 C, PSI | 50 000 — 75 000 |
| Poisson Ratio | |
| Poisson’s Ratio | |
| Poisson’s Ratio | |
| Poisson’s Ratio | |
| Poisson’s Ratio | |
| Poisson’s Ratio | |
. 0095 0095 0.284 | |
| Hardness (Mineral) | 7.5 |
| Hardness (Vickers) | 343 |
| Hardness (Brinell) | 2570 |
| Отражающая способность | 62% |
| Общая эмиссивность @ 1500 C | 0,23 |
| Всего Эмисс.0094 | 0.28 |
| Working Temperature, C | <1700 |
| Recrystallization Temperature, C | 1300 — 1500 |
Tungsten Products
View Capabilities
Мы с нетерпением ждем вашего ответа.

Midwest Tungsten Service может вырезать или изготовить на заказ любой стержень в соответствии с вашими требованиями. Мы также предлагаем нестандартные сплавы. Пожалуйста, свяжитесь с [email protected], чтобы узнать о нестандартных размерах или размерах, которых нет в наличии.
Заполните форму или напишите нам по адресу [email protected]
Посмотреть возможности
вольфрам | Использование, свойства и факты
вольфрам
Посмотреть все СМИ
- Ключевые люди:
- Фаусто Эльхуяр Ирвинг Ленгмюр Уильям Д. Кулидж
- Связанные темы:
- химический элемент переходный металл обработка вольфрама молибден
Просмотреть весь связанный контент →
Резюме
Прочтите краткий обзор этой темы
вольфрам (W)
Металлический вольфрам был впервые выделен (1783 г.) испанскими химиками и минералогами Хуаном Хосе и Фаусто Эльхуяром путем восстановления оксида углем (WO 3 ), полученный из минерала вольфрамита. Ранее (1781 г.) шведский химик Карл Вильгельм Шееле обнаружил вольфрамовую кислоту в минерале, ныне известном как шеелит, а его соотечественник Торберн Бергман пришел к выводу, что из этой кислоты можно получить новый металл. Названия
Викторина «Британика»
118 Имена и символы Периодической таблицы Викторина
Элементарная викторина по фундаментальным вопросам.
| atomic number | 74 |
|---|---|
| atomic weight | 183. 85 85 |
| melting point | 3,410 °C (6,152 °F) |
| boiling point | 5,660 °C (10 220 °F) |
| плотность | 19,3 г/см 3 при 20 °C (68 °F) |
| степени окисления | +2, +3, +4, +9071 5 | [XE] 4 F 14 5 D 4 6 S 2 |
Количество вольфрама в земной коре оценивается в 1,5 части на миллион, или около 1,5 грамма на тонну породы. Китай является доминирующим производителем вольфрама; в 2016 году он произвел более 80 процентов всего добываемого вольфрама и содержал почти две трети мировых запасов. Вьетнам, Россия, Канада и Боливия производят большую часть остатка. Вольфрам не встречается в виде свободного металла. Его примерно так же много, как олова или молибдена, на которые он похож, и вдвое меньше, чем урана. Хотя вольфрам встречается в виде вольфрамита — дисульфида вольфрама, WS
Вьетнам, Россия, Канада и Боливия производят большую часть остатка. Вольфрам не встречается в виде свободного металла. Его примерно так же много, как олова или молибдена, на которые он похож, и вдвое меньше, чем урана. Хотя вольфрам встречается в виде вольфрамита — дисульфида вольфрама, WS
Для вольфрама руды обогащают магнитными и механическими способами, а затем концентрат сплавляют со щелочью. Неочищенные расплавы выщелачивают водой с получением растворов вольфрамата натрия, из которых при подкислении осаждают водный триоксид вольфрама, затем оксид сушат и восстанавливают до металла водородом.
Вольфрам довольно устойчив к кислотному воздействию, за исключением смесей концентрированных азотной и плавиковой кислот, и может быстро подвергаться воздействию щелочных окислительных расплавов, таких как плавленые смеси нитрата калия и гидроксида натрия или пероксида натрия; водные щелочи, однако, не действуют. Он инертен по отношению к кислороду при нормальной температуре, но легко соединяется с ним при красном калении с образованием триоксидов и подвергается действию фтора при комнатной температуре с образованием гексафторидов.
Он инертен по отношению к кислороду при нормальной температуре, но легко соединяется с ним при красном калении с образованием триоксидов и подвергается действию фтора при комнатной температуре с образованием гексафторидов.
Металлический вольфрам имеет блеск от бело-никелевого до сероватого. Среди металлов он имеет самую высокую температуру плавления при 3410 ° C (6170 ° F), самую высокую прочность на растяжение при температурах более 1650 ° C (3002 ° F) и самый низкий коэффициент линейного теплового расширения (4,43 × 10 ). −6 на °C при 20 °C [68 °F]). Вольфрам обычно хрупкий при комнатной температуре. Однако чистый вольфрам можно сделать пластичным путем механической обработки при высоких температурах, а затем волочить в очень тонкую проволоку. Вольфрам был сначала коммерчески использован в качестве материала накала лампы, а затем использовался во многих электрических и электронных устройствах. Он используется в виде карбида вольфрама для очень твердых и прочных штампов, инструментов, калибров и бит. Много вольфрама идет на производство вольфрамовых сталей, а часть используется в аэрокосмической промышленности для изготовления горловин сопел ракетных двигателей и передних поверхностей входа в атмосферу. (Для получения информации о добыче, восстановлении и применении вольфрама, см. обработка вольфрама.)
Много вольфрама идет на производство вольфрамовых сталей, а часть используется в аэрокосмической промышленности для изготовления горловин сопел ракетных двигателей и передних поверхностей входа в атмосферу. (Для получения информации о добыче, восстановлении и применении вольфрама, см. обработка вольфрама.)
Оформите подписку Britannica Premium и получите доступ к эксклюзивному контенту. Подпишитесь сейчас
Природный вольфрам представляет собой смесь пяти стабильных изотопов: вольфрама-180 (0,12%), вольфрама-182 (26,50%), вольфрама-183 (14,31%), вольфрама-184 (30,64%) и вольфрама-186 (28,43%). ). Кристаллы вольфрама изометричны и, по данным рентгеноструктурного анализа, имеют объемно-центрированную кубическую форму.
Соединения
Химически вольфрам относительно инертен. Однако были получены соединения, в которых элемент имеет степени окисления от 0 до +6. Наиболее распространены состояния выше +2, особенно +6. В состояниях +4, +5 и +6 вольфрам образует множество комплексов.
