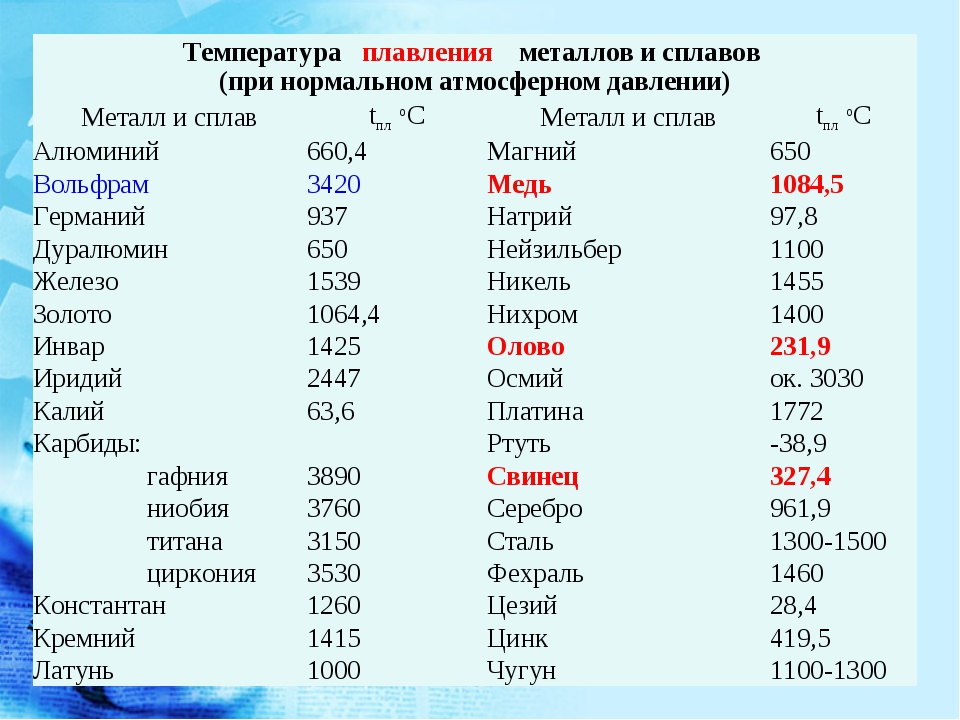
Свинец в электротехнике — Знаешь как
Содержание статьи
Особенно много свинца потребляет кабельная промышленность, где им предохраняют от коррозии телеграфные и электрические провода при подземной или подводной прокладке. Много свинца идет и на изготовление легкоплавких сплавов (с висмутом, оловом и кадмием) для электрических предохранителей, а также для точной пригонки контактирующих деталей. Но главное, видимо,— это использование свинца в химических источниках тока. Свинцовый аккумулятор с момента своего создания претерпел много конструктивных изменений, но основа его осталась той же: две свинцовые пластины, погруженные в сернокислый электролит. На пластины нанесена паста из окиси свинца.
При зарядке аккумулятора на одной из пластин выделяется водород, восстанавливающий окись до металлического свинца, на другой — кислород, переводящий окись в перекись. Вся конструкция превращается в гальванический элемент с электродами из свинца и перекиси свинца. В процессе разрядки перекись раскисляется, а металлический свинец превращается в окись.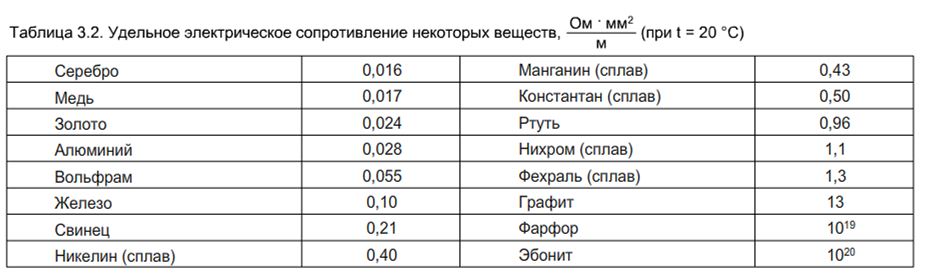 Эти реакции сопровождаются возникновением электрического тока, который будет течь по цепи до тех пор, пока электроды не станут одинаковыми — покрытыми окисью свинца.Производство щелочных аккумуляторов достиглов наше время гигантских размеров, но оно не вытеснило аккумуляторы свинцовые. Последние уступают щелочным в прочности, они тяжелее, но зато дают ток большего напряжения.
Эти реакции сопровождаются возникновением электрического тока, который будет течь по цепи до тех пор, пока электроды не станут одинаковыми — покрытыми окисью свинца.Производство щелочных аккумуляторов достиглов наше время гигантских размеров, но оно не вытеснило аккумуляторы свинцовые. Последние уступают щелочным в прочности, они тяжелее, но зато дают ток большего напряжения.
Так, для питания автостартера нужно пять кадмиево-никелевых аккумуляторов или три свинцовых.Аккумуляторная промышленность — один из самых емких потребителей, свинца.Можно, пожалуй, сказать и то, что свинец находился у истоков современной электронно-вычислительной техника.Свинец был одним из первых металлов, переведенных в состояние сверхпроводимости. Кстати, температура, ниже которой этот металл приобретает способность пропускать электрический ток без малейшего сопротивления, довольно высока — 7,17° К. (Для сравнения укажем, что у олова она равна 3,72, у цинка — 0,82, у титана — всего 0,4°К). Из свинца была сделана обмотка первого сверхпроводящего трансформатора, построенного в 1961 г. На сверхпроводимости свинца основан один из самых эффектных физических «фокусов», впервые продемонстрированный в 30-х годах советским физиком В. К. Аркадьевым.По преданию, гроб с телом Магомета висел в пространстве без опор.
На сверхпроводимости свинца основан один из самых эффектных физических «фокусов», впервые продемонстрированный в 30-х годах советским физиком В. К. Аркадьевым.По преданию, гроб с телом Магомета висел в пространстве без опор.
Из трезвомыслящих людей никто, конечно, этому не верит. Однако в опытах Аркадьева происходило нечто подобное: небольшой магнитик висел без какой-либо опоры над свинцовой пластинкой, находившейся в среде жидкого гелия, т. е. при температуре 4,2° К, намного меньшей, чем критическая для свинца.Известно, что при изменении магнитного поля в любом проводнике возникают вихревые токи (токи Фуко). В обычных условиях они быстро гасятся сопротивлением. Но, если сопротивления нет (сверхпроводимость!), эти токи не затухают и, естественно, сохраняется созданное ими магнитное поле. Магнитик над свинцовой пластинкой имел, разумеется, свое поле и, падая на нее, возбуждая магнитное поле от самой пластинки, направленное навстречу полю магнита, и оно отталкивало магнит. Значит, задача сводилась к тому, чтобы подобрать магнитик такой массы, чтобы его могла удержать на почтительном расстоянии эта сила отталкивания.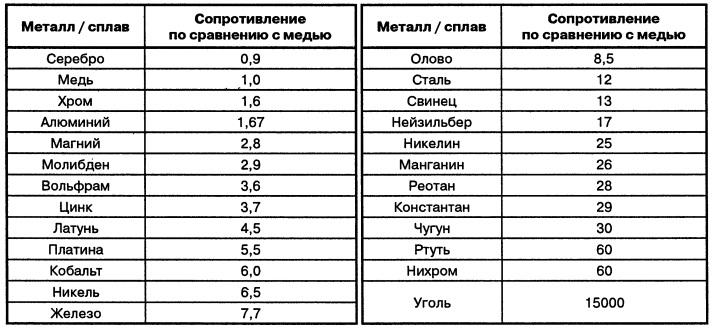 В наше время сверхпроводимость — огромнейшая область научных исследований и практического приложения. Говорить о том, что она связана только со свинцом, конечно нельзя.
В наше время сверхпроводимость — огромнейшая область научных исследований и практического приложения. Говорить о том, что она связана только со свинцом, конечно нельзя.
Но значение свинца в этой области не исчерпывается приведенными примерами.Один из лучших проводников электричества — медь — никак не удается перевести в сверхпроводящее состояние. Почему это так, у ученых еще нет единого мнения. В экспериментах по сверхпроводимости меди отведенароль электроизолятора. Но сплав меди со свинцом используют в сверхпроводниковой технике. В температурном интервале 0,1—5° К этот сплав проявляет линейную зависимость сопротивления от температуры. Поэтому его используют в приборах для измерения исключительно низких температур.
Свинец и транспорт
И эта тема складывается из нескольких аспектов. Первый — это антифрикционные сплавы на основе свинца. Наряду с общеизвестными баббитами и свинцовыми бронзами, антифрикционным сплавом часто служат свидцово-кальциевая лигатура (3—4% кальция). То же назначение имеют и некоторые припои, отличающиеся низким содержанием олова и, в отдельных случаях, добавкой сурьмы. Все более важную роль начинают играть сплавы свинца с таллием. Присутствие последнего повышает теплостойкость подшипников, уменьшает коррозию свинца органическими кислотами, образующимися при физико-химическом разрушении смазочных масел.Второй аспект — борьба с детонацией в двигателях. Процесс детонации сродни процессу горения, но скорость его слишком велика…
То же назначение имеют и некоторые припои, отличающиеся низким содержанием олова и, в отдельных случаях, добавкой сурьмы. Все более важную роль начинают играть сплавы свинца с таллием. Присутствие последнего повышает теплостойкость подшипников, уменьшает коррозию свинца органическими кислотами, образующимися при физико-химическом разрушении смазочных масел.Второй аспект — борьба с детонацией в двигателях. Процесс детонации сродни процессу горения, но скорость его слишком велика…
В двигателях внутреннего сгорания он возникает из-за распада молекул еще не сгоревших углеводородов под влиянием растущих давления и температуры. Распадаясь, эти молекулы присоединяют кислород и образуют перекиси, устойчивые лишь в очень узком интервале температур. Они-то и вызывают детонацию, и топливо воспламеняется раньше, чем достигнуто необходимое сжатие смеси в цилиндре. В результате мотор начинает «барахлить», перегреваться, появляется черный выхлоп (признак неполного сгорания), ускоряется выгорание поршней, сильнее изнашивается шатувно-кривошипный механизм, теряется мощность…Самый распространенный антидетонатор — тетраэтил-свинец (ТЭС) Рb (С2Н5)4—бесцветная ядовитая жидкость.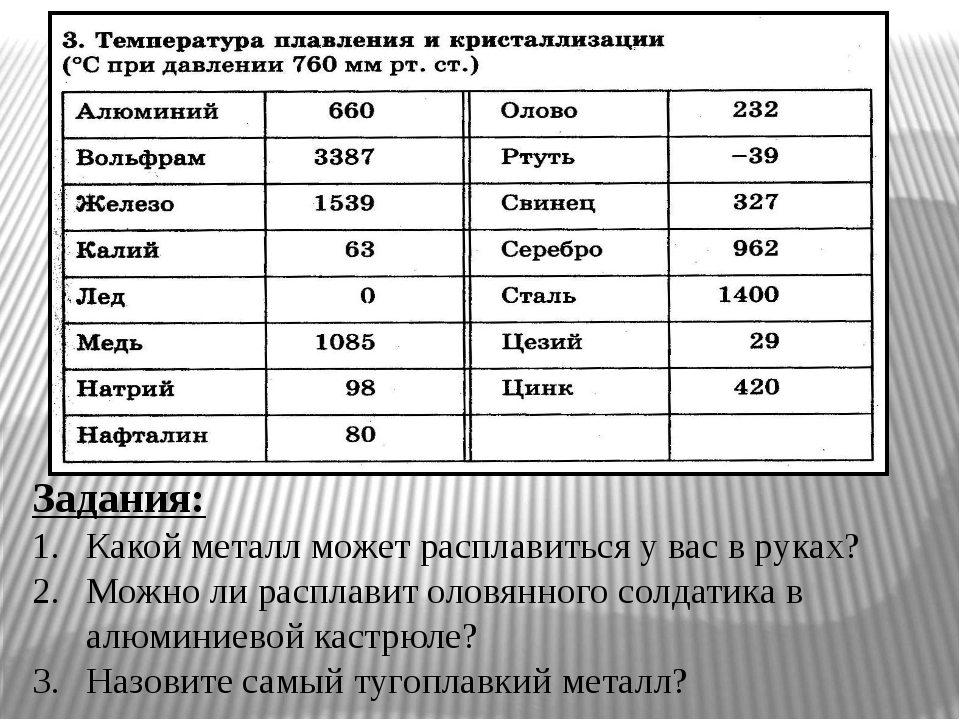 Действие ее (и других металлоорганических антидетонаторов) объясняется тем, что при температуре выше 200°С происходит распад молекул вещества-антидетонатора.
Действие ее (и других металлоорганических антидетонаторов) объясняется тем, что при температуре выше 200°С происходит распад молекул вещества-антидетонатора.
Образуются активные свободные радикалы, которые, реагируя прежде всего с перекисями, уменьшают их концентрацию. Роль металла, образующегося при полном распадететраэтилсвинца, сводится к дезактивации активных частиц — продуктов взрывного распада тех же перекисей.Добавка тетраэтилсвинца к топливу никогда не превышает 4%, но не только из-за токсичности этого вещества. Избыток свободных радикалов может инициировать образование перекисей.
Свинец и война
Свинец — тяжелый металл, его плотность 11,34. Именно это обстоятельство послужило причиной массового использования свинца в огнестрельном оружии. Между прочим, свинцовыми метательными снарядами пользовались еще в древности: пращники армии Ганнибала метали в римлян свинцовые шары. И сейчас пули отливают из свинца, лишь оболочку их делают из других, более твердых металлов. Любая добавка к свинцу увеличивает его твердость, но количественно влияние добавок неравноценно.
Любая добавка к свинцу увеличивает его твердость, но количественно влияние добавок неравноценно.
В свинец, идущий на изготовление шрапнели, добавляют до 12% сурьмы, а в свинец ружейной дроби — не более 1% мышьяка. Без инициирующих взрывчатых веществ ни одно скорострельное оружие действовать не будет. Среди веществ этого класса преобладают соли тяжелых металлов. Используют, в частности, азид свинца PbN6. Ко всем взрывчатым веществам предъявляют очень жесткие требования с точки зрения безопасности обращения с ними, мощности, химической и физической стойкости, чувствительности. Из всех известных инициирующих взрывчатых веществ по всем этим характеристикам «проходят» лишь «гремучая ртуть», азид и тринитрорезорцинат свинца (ТНРС).
Вы читаете, статья на тему свинец в электротехнике
| Радиус атома | 175 пм |
| Энергия ионизации (первый электрон) |
СВИНЕЦ | Энциклопедия Кругосвет
Содержание статьиСВИНЕЦ – химический элемент IV группы периодической таблицы. Относительная атомная масса (Ar = 207,2) является усредненной из масс нескольких изотопов: 204Pb (1,4%), 206Pb (24,1%), 207Pb (22,1%) и 208Pb (52,4%). Последние три нуклида – конечные продукты естественных радиоактивных превращений урана, актиния и тория. Известно также более 20 радиоактивных изотопов свинца, из которых наиболее долгоживущие –
В земной коре свинца немного – 0,0016% по массе, но этот один из самых тяжелых металлов распространен гораздо больше, чем его ближайшие соседи – золото, ртуть и висмут. Это связано с тем, что разные изотопы свинца являются конечными продуктами распада урана и тория, так что содержание свинца в земной коре медленно увеличивалось в течение миллиардов лет.
Известно много рудных месторождений, богатых свинцом, причем металл легко выделяется из минералов. Всего известно более ста свинцовых минералов. Из них основные – галенит (свинцовый блеск) PbS и продукты его химических превращений – англезит (свинцовый купорос) PbSO4 и церуссит («белая свинцовая руда») PbCO3. Реже встречаются пироморфит («зеленая свинцовая руда») PbCl2·3Pb3(PO4)2, миметит PbCl2·3Pb3(AsO4)2, крокоит («красная свинцовая руда») PbCrO
В сильноокислительной щелочной среде степей и пустынь возможно образование диоксида свинца – минерала платтнерита. И исключительно редко встречается самородный металлический свинец. См. также СВИНЦОВАЯ ПРОМЫШЛЕННОСТЬ.
История.
Происхождение слова «свинец» неясно. В старину свинец не всегда четко отличали от олова. В большинстве славянских языков (болгарском, сербскохорватском, чешском, польском) свинец и называется оловом. Наш же «свинец» встречается только в языках балтийской группы: svinas (литовский), svin (латышский). У некоторых горе-переводчиков это приводило к забавным недоразумениям, например, к «оловянным аккумуляторам» в автомобилях. Английское название свинца lead и голландское lood, возможно, связаны с нашим «лудить». Латинское же plumbum (тоже неясного происхождения) дало английское слово plumber – водопроводчик (когда-то трубы зачеканивали мягким свинцом. И еще одна путаница, связанная со свинцом. Древние греки называли свинец «молибдос» (название сохранилось и в новогреческом языке). Отсюда – латинское molibdaena: так в средние века называли и свинцовый блеск PbS, и более редкий молибденовый блеск (MoS
Свинец вместе с золотом, серебром, медью, оловом, железом и ртутью входит в семерку металлов, известных с глубокой древности. Эти металлы сопоставлялись с известными тогда планетами (свинцу соответствовал Сатурн). Считается, что впервые люди выплавили свинец из руд 8 тысяч лет назад. Раскопки в Древнем Египте обнаружили изделия из серебра и свинца в захоронениях до династического периода. К этому же времени относятся аналогичные находки, сделанные в Месопотамии. Совместные находки серебряных и свинцовых изделий не удивительны. Еще в доисторические времена внимание людей привлекли красивые тяжелые кристаллы свинцового блеска. Залежи этого минерала находили в горах Армении, в центральных районах Малой Азии. А минерал галенит часто содержит значительные примеси серебра. Если положить куски этого минерала в костер, то сера выгорит и потечет расплавленный свинец (древесный уголь препятствует окислению свинца). Уже за много тысячелетий до новой эры в Месопотамии, Египте из него отливали статуи.
В VI в. до н.э. богатые залежи галенита были обнаружены в Лаврионе – гористой местности недалеко от Афин. Во времена пунических войн (264–146 до н.э.) на территории современной Испании работали многочисленные свинцовые шахты, которые были заложены греками и финикийцами. Позднее они разрабатывались римлянами; римские инженеры использовали свинец для изготовления труб древнего водопровода. Древнегреческий историк Геродот (V в. до н.э.) писал о методе укрепления железных и бронзовых скоб в каменных плитах путем заливки отверстий легкоплавким свинцом. Позднее при раскопках Микен нашли свинцовые скобы в каменных стенах.
При получении свинца античные металлурги сначала прокаливали руду, при этом шли реакции
2PbS + 3O2 ® 2PbO + 2SO2 и PbS + 2O2 ® PbSO4. Затем температуру повышали, что приводило к выплавке свинца:
PbS + 2PbO ® 3Pb + SO2; PbS + PbSO4 ® 2Pb + 2SO2. Первые плавильные печи, сделанные из глины и камней, были весьма примитивны. Их старались установить на склонах холмов, где дуют ветры, помогающие обжигу. Выплавленный свинец, как правило, содержал серебро – иногда до 0,5% и более. При медленном охлаждении такого расплава сначала кристаллизуется чистый свинец, а жидкость обогащается серебром – примерно до 2%. Для выделения серебра использовали метод купелирования: окисляли расплавленный свинец в пористом глиняном сосуде – купели, а его оксид затем снова восстанавливали до металла. Механизм этого процесса был изучен только в 1833.
Использовали свинец и для очистки золота и серебра методом купелирования. Для этого подлежащий очистке драгоценный металл сплавляли со свинцом. Свинец и другие примеси легко окислялись при высокой температуре; образующиеся оксиды сдувались струей воздуха, а частично впитывались в поры купели, а на дне оставался слиток чистого серебра или золота. Оксид свинца затем снова могли превратить в металл, нагревая его с древесным углем. Археологические находки в Уре и Трое свидетельствуют, что купелирование было известно на северо-западе Малой Азии уже в первой половине III тыс. до н.э. А греческим умельцам из добытого в Лаврионе свинца удавалось извлечь почти все серебро: по современным анализам его оставалось в свинце всего 0,02%! Искусство древних металлургов достойно удивления: ведь у них не было ни возможности контролировать температуру на разных стадиях процесса, ни проводить химических анализов. И все же в отвалах рудников оставалось много неизвлеченного свинца. Еще лучших результатов добились римские металлурги, вдвое снизив остаточное количество серебра. Конечно, их беспокоила не чистота свинца, а полнота извлечения из него драгоценного металла. Более того, как свидетельствует греческий историк Страбон, перерабатывая старые отвалы в Лаврионе, римляне смогли извлечь довольно много и свинца, и серебра, оставив около двух миллионов тонн отработанной руды в отвалах. После этого рудники были заброшены почти на два тысячелетия, но в 1864 отвалы снова начали перерабатывать – теперь уже ради только серебра (его в них оставалось около 0,01%). На современных металлургических предприятиях в свинце оставляют еще в сотни раз меньше серебра.
Древние гончары, размалывая свинцовый блеск с глиной и водой, обливали этой смесью подлежащие обжигу глиняные сосуды. При высокой температуре поверхность сосуда покрывалась легкоплавким свинцовым стеклом. В 1673 английский стекольный мастер Джордж Равенскрофт, добавив в состав стекла оксид свинца, изобрел хрустальное стекло, которое легко плавится, прекрасно поддается обработке и обладает особым блеском, приближающим его к настоящему горному хрусталю. Позднее, сплавив чистый белый песок, поташ и оксид свинца, получили страз (от имени жившего в конце 18 в. ювелира Страсса) – сорт стекла с таким сильным блеском, что оно хорошо имитировало алмаз, а с примесью разных пигментов – другие драгоценные камни.
Тонкими свинцовыми пластинами обшивали деревянные корпуса древних кораблей. Один такой греческий корабль, построенный в III в. до н.э., был найден в 1954 на дне Средиземного моря недалеко от Марселя. Римляне изготовляли также из свинца трубы длиной 3 метра и разного, но строго определенного диаметра (всего было 15 вариантов). Это первый в истории пример стандартизированного промышленного производства. Сначала из свинца отливали пластину, оборачивали ее вокруг деревянного стержня и запаивали шов оловянно-свинцовым припоем (его состав с тех пор практически не изменился). В трубах нередко обнаруживались течи, и их надо было ремонтировать. До сих пор во время раскопок в Италии и в Англии находят такие трубы в очень хорошем состоянии. Римский зодчий и инженер Марк Витрувий Поллион рекомендовал заменить свинцовые трубы керамическими – из обожженной глины. Он обратил внимание на болезненность рабочих, занятых выплавкой свинца и считал, что свинец «лишает кровь ее силы». Однако не все разделяли это мнение. Так, римский государственный деятель, ученый и писатель Плиний, автор знаменитой «Естественной истории», писал о пользе свинцовых препаратов, о том, что свинцовая мазь помогает выводить шрамы, излечивать язвы и глазные болезни.
В средние века крыши церквей и дворцов нередко покрывали свинцовыми пластинами, устойчивыми к атмосферным влияниям. Еще в 669 свинцом покрыли крышу монастырской церкви в Йорке, а в 688 епископ в Нортумберленде приказал обшить свинцовыми пластинами крышу и стены церкви. Знаменитые витражи в соборах собирали с помощью свинцовых рамок с желобками, в которых укрепляли пластинки цветного стекла. Делали из свинца, по примеру римлян, и водопроводные, а также дренажные трубы. Так, в 1532 в Вестминстерском дворце установили свинцовые водосточные трубы квадратного сечения. Все эти изделия в те времена не прокатывали, а отливали в формах, на дно которых насыпали тонко просеянный песок. Со временем на свинцовых изделиях появлялся прочный защитный слой – патина. Некоторые облицованные свинцом средневековые шпили сохранились в течение почти семисот лет. К сожалению, пожар 1561 в Лондоне уничтожил такой шпиль величайшего собора святого Петра.
Когда появилось огнестрельное оружие, большие количества свинца пошли для изготовления пуль и дроби, и свинец начал ассоциироваться также со смертельной опасностью: «Засвищет вокруг меня губительный свинец» (А.Пушкин), «За твой окоп другой боец подставил грудь под злой свинец» (К.Симонов). Сначала дробь отливали в разъемных формах. В 1650 английский принц Руперт изобрел более быстрый и удобный способ. Он обнаружил, что если к свинцу добавить немного мышьяка и лить этот сплав через своего рода большой дуршлаг в бак с водой, то получаются шарики дроби правильной сферической формы. А после того, как в 1436 Иоганн Гутенберг изобрел способ печатать книги с использованием подвижных металлических литер, печатники в течение сотен лет отливали буквы из так называемого типографского сплава на основе свинца (с примесью олова и сурьмы).
Из соединений свинца с древних времен использовали свинцовый сурик Pb3O4 и основной карбонат свинца (свинцовые белила) в качестве красной и белой краски. Почти все картины старых мастеров писаны красками, приготовленными на основе свинцовых белил. Оригинальным был старинный способ их получения: горшки с крепким уксусом ставили в навоз, а над ними подвешивали скрученные в спираль тонкие свинцовые пластины. Разлагаясь, навоз давал тепло (оно необходимо для усиленного испарения уксусной кислоты) и углекислый газ. Совместное действие на свинец этих веществ, а также кислорода воздуха и давало белила. Помимо ядовитости, эти белила темнеют со временем, так как реагируют со следами сероводорода, который всегда присутствует в воздухе: 2PbCO3·Pb(OH)2 + 3H2S ® 3PbS + 2CO2 + 4H2O. При реставрации таких картин потемневшие участки осторожно обрабатывают раствором Н2О2, что переводит черный сульфид в белый сульфат: PbS + 4H2O2 ® PbSO4 + 4H2O. В настоящее время ядовитые свинцовые белила заменены более дорогими, но безвредными титановыми. Ограниченное применение (например, в качестве пигментов для художественных масляных красок) имеют пигменты, содержащих свинец: свинцовый крон лимонный 2PbCrO4·PbSO4, свинцовый крон желтый 13PbCrO4·PbSO4, красного цвета свинцово-молибдатный крон 7PbCrO4·PbSO4·PbMoO4.
Свойства свинца.
Свинец обычно имеет грязно-серый цвет, хотя свежий его разрез имеет синеватый отлив и блестит. Однако блестящий металл быстро покрывается тускло-серой защитной пленкой оксида. Плотность свинца (11,34 г/см3) в полтора раза больше, чем у железа, вчетверо больше, чем у алюминия; даже серебро легче свинца. Недаром в русском языке «свинцовый» – синоним тяжелого: «Ненастной ночи мгла по небу стелется одеждою свинцовой»; «И как свинец пошел ко дну» – эти пушкинские строки напоминают, что со свинцом неразрывно связано понятие гнета, тяжести.
Свинец очень легко плавится – при 327,5° С, кипит при 1751° С и заметно летуч уже при 700° С. Этот факт очень важен для работающих на комбинатах по добыче и переработке свинца. Свинец – один из самых мягких металлов. Он легко царапается ногтем и прокатывается в очень тонкие листы. Свинец сплавляется со многими металлами. С ртутью он дает амальгаму, которая при небольшом содержании свинца жидкая.
По химическим свойствам свинец – малоактивный металл: в электрохимическом ряду напряжений он стоит непосредственно перед водородом. Поэтому свинец легко вытесняется другими металлами из растворов его солей. Если опустить в подкисленный раствор ацетата свинца цинковую палочку, свинец выделяется на ней в виде пушистого налета из мелких кристалликов, имеющего старинного название «сатурнова дерева». Если затормозить реакцию, обернув цинк фильтровальной бумагой, вырастают более крупные кристаллы свинца.
Наиболее типична для свинца степень окисления +2; соединения свинца(IV) значительно менее устойчивы. В разбавленных соляной и серной кислотах свинец практически не растворяется, в том числе из-за образования на поверхности нерастворимой пленки хлорида или сульфата. С крепкой серной кислотой (при концентрации более 80%) свинец реагирует с образованием растворимого гидросульфата Pb(HSO4)2, а в горячей концентрированной соляной кислоте растворение сопровождается образованием комплексного хлорида H4PbCl6. Разбавленной азотной кислотой свинец легко окисляется:
Pb + 4HNO3 ® Pb(NO3)2 + 2NO2 + H2O. Разложение нитрата свинца(II) при нагревании – удобный лабораторный метод получения диоксида азота:
2Pb(NO3)2 ® 2PbO + 4NO2 + O2.
В присутствии кислорода свинец растворяется также в ряде органических кислот. При действии уксусной кислоты образуется легкорастворимый ацетат Pb(CH2COO)2 (старинное название – «свинцовый сахар»). Свинец заметно растворим также в муравьиной, лимонной и винной кислотах. Растворимость свинца в органических кислотах могло раньше приводить к отравлениям, если пищу готовили в посуде, луженной или паянной свинцовым припоем. Растворимые соли свинца (нитрат и ацетат) в воде гидролизуются:
Pb(NO3)2 + H2O Pb(OH)NO3 + HNO3. Взвесь основного ацетата свинца («свинцовая примочка») имеет ограниченное медицинское применение в качестве наружного вяжущего средства.
Свинец медленно растворяется и в концентрированных щелочах с выделением водорода: Pb + 2NaOH + 2H2O ® Na2Pb(OH)4 + H2, что указывает на амфотерные свойства соединений свинца. Белый гидроксид свинца(II), легко осаждаемый из растворов его солей, также растворяется как в кислотах, так и в сильных щелочах:
Pb(OH)2 + 2HNO3 ® Pb(NO3)2 + 2H2O; Pb(OH)2 + 2NaOH ® Na2Pb(OH)4. При стоянии или нагревании Pb(OH)2 разлагается с выделением PbO. При сплавлении PbO со щелочью образуется плюмбит состава Na2PbO2.
Из щелочного раствора тетрагидроксоплюмбата натрия Na2Pb(OH)4 тоже можно вытеснить свинец более активным металлом. Если в такой нагретый раствор положить маленькую гранулу алюминия, быстро образуется серый пушистый шарик, который насыщен мелкими пузырьками выделяющегося водорода и потому всплывает. Если алюминий взять в виде проволоки, выделяющийся на ней свинец превращает ее в серую «змею».
При нагревании свинец реагирует с кислородом, серой и галогенами. Так, в реакции с хлором образуется тетрахлорид PbCl4 – желтая жидкость, дымящая на воздухе из-за гидролиза, а при нагревании разлагающаяся на PbCl2 и Cl2. (Галогениды PbBr4 и PbI4 не существуют, так как Pb(IV) – сильный окислитель, который окислил бы бромид- и иодид-анионы.) Тонкоизмельченный свинец обладает пирофорными свойствами – вспыхивает на воздухе. При продолжительном нагревании расплавленного свинца он постепенно переходит сначала в желтый оксид PbO (свинцовый глет), а затем (при хорошем доступе воздуха) – в красный сурик Pb3O4 или 2PbO·PbO2. Это соединение можно рассматривать также как свинцовую соль ортосвинцовой кислоты Pb2[PbO4]. С помощью сильных окислителей, например, хлорной извести, соединения свинца(II) можно окислить до диоксида:
Pb(CH3COO)2 + Ca(ClO)Cl + H2O ® PbO2 + CaCl2 + 2CH3COOH. Диоксид образуется также при обработке сурика азотной кислотой:
Pb3O4 + 4HNO3 ® PbO2 + 2Pb(NO3)2 + 2H2O. Если сильно нагревать коричневый диоксид, то при температуре около 300° С он превратится в оранжевый Pb2O3 (PbO·PbO2), при 400°С – в красный Pb3O4, а выше 530° С – в желтый PbO (разложение сопровождается выделением кислорода). В смеси с безводным глицерином свинцовый глет медленно, в течение 30–40 минут реагирует с образованием водоупорной и термостойкой твердой замазки, которой можно склеивать металл, стекло и камень.
Диоксид свинца – сильный окислитель. Струя сероводорода, направленная на сухой диоксид, загорается; концентрированная соляная кислота окисляется им до хлора:
PbO2 + 4HCl ® PbCl2 + Cl2 + H2O, сернистый газ – до сульфата: PbO2 + SO2 ® PbSO4, а соли Mn2+ – до перманганат-ионов: 5PbO2 + 2MnSO4 + H2SO4 ® 5PbSO4 + 2HMnO4 + 2H2O. Диоксид свинца образуется, а затем расходуется при зарядке и последующем разряде самых распространенных кислотных аккумуляторов. Соединения свинца(IV) обладают еще более типичными амфотерными свойствами. Так, нерастворимый гидроксид Pb(OH)4 бурого цвета легко растворяется в кислотах и щелочах: Pb(OH)4 + 6HCl ® H2PbCl6; Pb(OH)4 + 2NaOH ® Na2Pb(OH)6. Диоксид свинца, реагируя с щелочью, также образует комплексный плюмбат(IV):
PbO2 + 2NaOH + 2H2O ® Na2[Pb(OH)6]. Если же PbO2 сплавить с твердой щелочью, образуется плюмбат состава Na2PbO3. Из соединений, в которых свинец(IV) входит в состав катиона, наиболее важен тетраацетат. Его можно получить кипячением сурика с безводной уксусной кислотой:
Pb3O4 + 8CH3COOH ® Pb(CH3COO)4 + 2Pb(CH3COO)2 + 4H2O. При охлаждении из раствора выделяются бесцветные кристаллы тетраацетата свинца. Другой способ – окисление ацетата свинца(II) хлором: 2Pb(CH3COO)2 + Cl2 ® Pb(CH3COO)4 + PbCl2. Водой тетраацетат мгновенно гидролизуется до PbO2 и CH3COOH. Тетраацетат свинца находит применение в органической химии в качестве селективного окислителя. Например, он весьма избирательно окисляет только некоторые гидроксильные группы в молекулах целлюлозы, а 5-фенил-1-пентанол под действием тетраацетата свинца окисляется с одновременной циклизацией и образованием 2-бензилфурана.
Органические производные свинца – бесцветные очень ядовитые жидкости. Один из методов их синтеза – действие алкилгалогенидов на сплав свинца с натрием:
4C2H5Cl + 4PbNa ® (C2H5)4Pb + 4NaCl + 3Pb. Действием газообразного HCl можно отщеплять от тетразамещенных свинца один алкильный радикал за другим, заменяя их на хлор. Соединения R4Pb разлагаются при нагревании с образованием тонкой пленки чистого металла. Такое разложение тетраметилсвинца было использовано для определения времени жизни свободных радикалов. Тетраэтилсвинец – антидетонатор моторного топлива.
Получение свинца.
Количество добываемого свинца непрерывно возрастает. Если в 1800 во всем мире его было получено около 30 000 тонн, то в 1850 – 130 000 т, в 1875 – 320 000 т, в 1900 – 850 000 т, 1950 – почти 2 млн. т, а в настоящее время в год добывают около 5 млн. т. По объему производства свинец занимает четвертое место среди цветных металлов – после алюминия, меди и цинка.
Основной источник свинца – сульфидные полиметаллические руды, содержащие от 1 до 5% свинца. Руду концентрируют до содержания свинца 40 – 75%, затем подвергают обжигу: 2PbS + 3O2 ® 2PbO + 2SO2 и восстанавливают свинец коксом и оксидом углерода(II). Более экономичный, так называемый автогенный, способ заключается в проведении реакции PbS + 2PbO ® 3Pb + SO2 (PbO образуется при частичном обжиге PbS). Получаемый из руды свинец содержит от 3 до 7% примесей в виде меди, сурьмы, мышьяка, олова, алюминия, висмута а также золота и серебра. Их удаление (или выделение, если это экономически рентабельно), требует сложных и длительных операций. Очистку свинца можно проводить также методом электрохимического рафинирования. Электролитом служит водный раствор фторосиликата свинца PbSiF6. На катоде оседает чистый свинец, а примеси концентрируются в анодном шламе, содержащем много ценных компонентов, которые затем выделяют.
Свинец в организме человека.
Соединения свинца ядовиты. Но очевидным это стало далеко не сразу. В прошлом покрытия гончарных изделий свинцовой глазурью, изготовление свинцовых водопроводных труб, использование свинцовых белил (особенно в косметических целях), применение свинцовых трубок в конденсаторах паров на винокуренных заводах – все это приводило к накоплению свинца в организме. Древние греки знали, что вино и кислые соки нельзя держать в глазурованных глиняных сосудах (глазурь содержала свинец), а вот римляне этим правилом пренебрегали. Джемс Линд, рекомендовавший в 1753 английскому адмиралтейству лимонный сок как средство против цинги для моряков в дальнем плавании, предостерегал от хранения сока в гончарных глазурованных изделиях. Тем не менее случаи отравления, в том числе и смертельные, наблюдались по той же причине и двести лет спустя.
Свинец проникает в организм через желудочно-кишечный тракт или дыхательную систему и разносится затем кровью по всему организму. Причем вдыхание свинцовой пыли значительно опаснее присутствия свинца в пище. В воздухе городов содержание свинца составляет в среднем от 0,15 до 0,5 мкг/м3. В районах, где расположены предприятия по переработке полиметаллических руд, эта концентрация выше.
Свинец накапливается в костях, частично замещая кальций в фосфате Са3(РО4)2. Попадая в мягкие ткани – мышцы, печень, почки, головной мозг, лимфатические узлы, свинец вызывает заболевание – плюмбизм. Как и многие другие тяжелые металлы, свинец (в виде ионов) блокирует деятельность некоторых ферментов. Было установлено, что их активность снижается в 100 раз при увеличении концентрации свинца в крови в 10 раз – с 10 до 100 микрограммов на 100 мл крови. При этом развивается анемия, поражаются кроветворная система, почки и мозг, снижается интеллект. Признак хронического отравления – серая кайма на деснах, расстройство нервной системы. Особенно опасен свинец для детей, так как он вызывает задержку в развитии. В то же время десятки миллионов детей во всем мире в возрасте до 6 лет имеют свинцовое отравление; основная причина – попадание в рот краски, содержащей свинец. Антидотом при отравлении может служить кальциевая соль этилендиаминтетрауксусной кислоты. В отравленном организме происходит замещение кальция на ионы свинца, которые удерживаются в этой соли очень прочно и в таком виде выводятся.
Свинец легко может попасть в организм с питьевой водой, если она соприкасалась с металлом: в присутствии углекислого газа в раствор медленно переходит растворимый гидрокарбонат Pb(HCO3)2. В Древнем Риме, где для подачи воды использовали свинцовые трубы, такое отравление было весьма распространенным, на что указывают анализы останков римлян. Причем отравлялись, в основном, богатые римляне, пользовавшиеся водопроводом, хранившие вино, оливковое масло и другие продукты в освинцованных сосудах, использовавшие содержащие свинец косметические средства. Достаточно, чтобы в литре воды был всего один миллиграмм свинца – и питье такой воды становится очень опасным. Это количество свинца так малó, что не изменяет ни запаха, ни вкуса воды, и только точные современные приборы могут его обнаружить.
Свинцовым отравлением некоторые историки объясняют и болезненность ряда русских царей. В 1633 в московском Кремле закончили строительство водопровода. Вода в него поступала из колодца в нижнем этаже Свибловой башни, стоявшей на слиянии Неглинной и Москвы-реки. Воду из колодца качали при помощи подъемной машины – взвода (с тех пор эта кремлевская башня называется Водовзводной). Машину приводили в движение лошади. Воду закачивали в большой бак, а оттуда вода сама по трубам текла на царскую кухню, в сады, другие места. Трубы были изготовлены из свинца; бак для воды изнутри тоже был выложен свинцовыми листами, чтобы вода из него не просачивалась в щели. Особенно много свинца накапливалось в воде за ночь, после ее неподвижного стояния в свинцовом баке и трубах.
Кремлевский «свинцовый водопровод» работал чуть больше 100 лет – его уничтожил пожар 1737. И в период действия этого водопровода русские цари жили меньше обычного. Так, царь и великий князь Иван V Алексеевич, сын царя Алексея Михайловича и первой жены его, Милославской, прожил всего 29 лет. Незадолго до смерти он выглядел дряхлым стариком. С детства он был, как писали тогда, «слабый и болезненный, немощен телом и рассудком, заикался, скорбен головою, страдал цингою и глазною болезнью». Из шести братьев царя пятеро не дожили до 20 лет. Некоторые ученые считают, что это последствия свинцового отравления. А вот шестой брат, Петр Алексеевич, будущий Петр I, избежал отравления – детство и отрочество он провел не в Кремле, а в подмосковных селах. Да и позднее он мало бывал в Кремле – много воевал, путешествовал по Европе, а потом и вовсе перенес столицу на берега Невы. Кстати, первый водопровод в Петербурге, который давал воду для дворцов и фонтанов Летнего сада, был деревянным. Его трубы были сделаны из бревен с просверленными в них отверстиями. Свинец же Петр использовал в военных целях – для отливки пуль.
А вот как пишут о свинцовом отравлении современные медицинские справочники: вялость, апатия, потеря памяти, раннее слабоумие, ослабление зрения, больные выглядят старше своих лет. Удивительно напоминает старинное описание царя Ивана Алексеевича!
Травились когда-то не только «свинцовой водой». Свинец широко использовали при изготовлении посуды (свинцовая глазурь), свинцовых белил, которыми окрашивали стены домов. Сейчас такое применение свинца строжайше запрещено. Белила, например, делают цинковые или титановые. Тем не менее у жителей промышленно развитых стран свинца в организме больше, чем у жителей отсталых и развивающихся стран, а у городских жителей больше, чем у сельских. Разница может быть огромной – в сотни раз.
Свинцовое загрязнение приобрело в 20 в. глобальный характер. Даже в снегах Гренландии его содержание за сто лет увеличилось в пять раз, а в центрах крупных городов в почве и растениях свинца в 25 раз больше, чем на окраинах! Загрязнение свинцом наблюдается в районах его добычи, а также в местах переработки и автострад, особенно если еще используется этилированный бензин. Немало свинца оседает на дне озер в виде охотничьей дроби. Каждый год в Мировой океан со сточными водами попадает более полумиллиона тонн этого ядовитого металла. А кто не видел выброшенные в мусорные ящики, а то и просто в канавы отработанные аккумуляторы! Пока свинец дешев, собирание и переработка его отходов невыгодна. Малая растворимость большинства соединений свинца, к счастью, не позволяет ему накапливаться в значительных количествах в воде. В водах Мирового океана его содержится в среднем 0,03 мкг/л (3·10–9%). Мало в среднем свинца и в живом веществе – 10–4%.
Применение свинца.
Несмотря на ядовитость свинца, отказаться от него невозможно. Свинец дешев – вдвое дешевле алюминия, в 11 раз дешевле олова. После того как в 1859 французский физик Гастон Планте изобрел свинцовый аккумулятор, для изготовления аккумуляторных пластин с тех пор израсходовали миллионы тонн свинца; в настоящее время на эти цели уходит в ряде стран до 75% всего добываемого свинца! Постепенно снижается применение свинца для изготовления очень ядовитого антидетонатора – тетраэтилсвинца. Способность тетраэтилсвинца улучшать качество бензина было открыто группой молодых американских инженеров в 1922; в своих поисках они руководствовались периодической таблицей элементов, планомерно приближаясь к наиболее эффективному средству. С тех пор производство тетраэтилсвинца непрерывно росло; максимум приходится на конец 1960-х, когда только в США ежегодно с выхлопами выбрасывались сотни тысяч тонн свинца – по килограмму на каждого жителя! В последние годы применение этилированного бензина запрещено во многих регионах, и его производство снижается.
Мягкий и пластичный свинец, не ржавеющий в присутствии влаги, – незаменимый материал для изготовления оболочек электрических кабелей; на эти цели в мире расходуется до 20% свинца. Малоактивный свинец используют для изготовления кислотоупорной аппаратуры для химической промышленности, например, для облицовки реакторов, в которых получают соляную и серную кислоты. Тяжелый свинец хорошо задерживает губительные для человека излучения и потому свинцовые экраны используются для защиты работников рентгеновских кабинетов, в свинцовых контейнерах хранят и перевозят радиоактивные препараты. Свинец содержат также подшипниковые сплавы баббиты, «мягкие» припои (самый известный – «третник» – сплав свинца с оловом).
В строительстве свинец используют для уплотнения швов и создания сейсмостойких фундаментов. В военной технике – для изготовления шрапнели и сердечников пуль.
Илья Леенсон
Какая температура плавления свинца
Свинец, обозначаемый символом Pb (плюмбум), относится к тем металлам, которые были известны человечеству издавна. Свинцовые находки в виде бусин датируются 6000 лет до нашей эры. В Древнем Риме делали свинцовые водопроводы, посуду, пока не была доказана токсичность свинцовых соединений.
Сейчас это металл стратегический, он используется в оборонной промышленности. Из него делают взрывчатые вещества, источники тока. Производство свинца недорогое, металл добывают из распространенных в природе минералов. Сначала получают черновой сплав, затем чистый.
Расплавить свинец в домашних условиях несложно, температура плавления у свинца и его сплавов не выше +330–450°С, припоев не выше +230°С. Металл не подвержен коррозионным разрушениям, пластичный, ковкий, применяется во многих промышленных сферах. Из него делают бытовые предметы, рыбацкие снасти, припои своими руками, заполняя формы жидким свинцом.
Характеристики и особенности свинца
Металл грязно-серебристого или серебристо-синеватого цвета имеет большой удельный вес – 11,34 г/см3. Прочность на разрыв не более 18 МПа. на сжатие в пределах 50 МПа. Из-за высокой пластичности поддается многим видам механической обработки, его подвергают холодной прокатке до состояния фольги, штампуют, режут, подвергают нагартовке. При волочении свинец рвется, проволоку из него делают продавливанием заготовок в фильерах.
При охлаждении до -266°С свинец становится сверхпроводником, несмотря на невысокую электропроводность при комнатной температуре (удельное сопротивление 0,22 Ом*мм2/м). На воздухе свинец быстро тускнеет на срезе, пассируется, покрывается оксидной пленкой, характеризующейся низкой химической активностью. Сам металл тоже стоек к коррозионным разрушениям, поэтому из свинца и сплавов делают кислотостойкие сосуды, емкости. Pb— последний элемент в периодической таблице Менделеева со стабильными изотопами. Металл способен удерживать радиоактивное излучение.
Кубическая, гранецентрированная структурная решетка обеспечивает вязкость металла, его сложно разломить, но он хорошо режется, его легко исцарапать, смять. При нагревании структура становится текучей, исходная вязкость снижается.
Температура плавления свинца
Плавка предусматривает фазовый переход под термическим влиянием. Легкоплавкие свинцовые сплавы льют при +400–450°С, технологическая температура достигается в домашних условиях на открытом пламени горелки, конфорке электро- или газовой плиты. В справочной литературе указывают температуру плавки свинца равной +327, 4°С. Для сплавов показатели иные, они зависят от физических характеристик компонентов, входящих в состав сплавов. У припоев с оловом и кадмием температура плавления на 40–60 градусов ниже в зависимости от концентрации добавки.
При +700°С свинцовый расплав испаряется, образуя токсичный аэрозоль. Вскипает металл при +1750°С. Оксидный слой претерпевает фазовые изменения из твердого в жидкое состояние только при нагреве до +850°С.
Область применения
Несмотря на токсичность, свинец ценится за коррозионную устойчивость, способность задерживать γ -излучение. Он остается незаменимым во многих отраслях.
До 75% получаемого свинца используется в электротехнике для аккумуляторных пластинок и трансформаторных сверхпроводниковых систем, силового кабеля. Баббит – сталь, легированная Рb, отличается антифрикционными свойствами. Сплавы, содержащие олово и кадмий, используют для припоев.
Плюмбум входит в состав антикоррозионных покрытий, красителей. Из него отливают пули и дробь, печатный шрифт, статуэтки, грузила. Листами металла экранируют рентгеновые установки, атомные реакторы, бункеры на полигонах. Пластины вшивают в фартуки, жилеты, другую защитную одежду. Свинцовые плиты снижают вибрацию, сейсмические толчки. Их используют в строительстве для уплотнения кладки, фундамента, мостовых опор. Из нитрата производят взрывчатые вещества с большой детонацией.
В чем плавить свинец
На заводах в качестве плавильных емкостей используют:
- специальные тигли из огнеупорной керамики или тугоплавких металлов, их помещают в электропечи, обеспечивающие необходимый термальный режим;
- нагревательные ванны, они снабжены встроенными тенами, поддерживают необходимую температуру металла по всему периметру.
Плавить свинец самостоятельно дома, во дворе, гараже или мастерской можно в жестяной банке, она заменит тигель. На одной стороне жестянки делают желоб для заливки металла в форму. Края формы подгибают, чтобы они надежно фиксировались в зажиме. Вместо прихваток горячую емкость надежнее придерживать пассатижами, плавильня не будет прожигать руки по время заполнения формы.
Можно воспользоваться для плавки свинцового лома старой домашней утварью: кастрюлями, сковородами, нержавеющими или эмалированными чайниками, или другой жаропрочной посудой. Шлаковый слой удаляют специальной ложкой с длинной ручкой. Делают это непосредственно перед заливкой металла в подготовленные формочки.
Процесс плавки
В качестве источника тепла для расплавления лома используют:
- костер, над ним устанавливают подставку для плавильни;
- паяльную лампу, ее фиксируют в стационарном положении;
- газовую горелку, ей металл разогревают и снизу, и сверху, попеременно;
- кухонную плиту (газовую или электрическую).
Важно!
Емкость устанавливают так, чтобы языки пламени не выходили за площадь дна.
Плавка свинца начинается с подготовительного этапа: нужно приготовить плавильную емкость, измельчить лом. Его очищают от примесей, возможной влаги, загрязнений. Затем разрезают на небольшие кусочки ножом или ножницами по металлу. Ломать свинцовые куски сложно, они отлично гнутся. Чем мельче будет лом, тем быстрее он расплавится. Его рекомендуют закладывать в плавильную емкость постепенно. Когда кусочки загружают в расплав, снижается риск перегрева расплава до температуры летучести. Не стоит разогревать кусочки до красноватого оттенка, это сигнал, что образуют ядовитые летучие соединения.
Если для расплава используют емкость с толстыми стенками, ее предварительно прогревают. Жесть достаточно просушить. Плавильню заполняют не более, чем на половину, лучше на 1/3. Толстый слой равномерно не прогреется.
Плавильня должна устойчиво стоять на горелке, не шататься. После расплавления лома на поверхности образуется шапка шлака. Ее снимают перед розливом расплава в форму. Ее предварительно прогревают, чтобы не было резкого температурного контраста. В холодную форму расплав заливается неравномерно. На поверхности литья образуются рытвины, складки, другие дефекты.
Техника безопасности
Занимаясь плавлением свинца в изолированном помещении, важно позаботиться:
- о вентиляции, необходимо принудительно нагнетать воздух вентилятором, чтобы концентрация горячего аэрозоля была минимальной, свинцовые соединения пагубно влияют на мозг, печень, почки;
- о защите органов дыхания (нужен респиратор), зрения (стоит надеть рабочие очки), одежде с длинным рукавом из натуральных материалов, синтетика при случайном попадании плавится, увеличивается площадь ожога;
- пожарной безопасности, под руками необходимо держать огнетушитель.
Жидкий свинец обладает высокой текучестью. При попадании на влажную поверхность сильно разбрызгивается. Возможны выплески расплава во время нагрева свинцового лома. В рабочей зоне необходимо убрать или изолировать легко возгораемые предметы.
Производство свинца: как делают свинец
Чтобы разобраться как делают свинец, важно ознакомиться с методами его добычи и производства, а также переработки. Большая часть используемого свинца, является вторсырьем, которое поступает на рынок с заводов по утилизации аккумуляторов. Выгодно купить свинец оптом от производителя в компании «АКБскрап» можно в любое удобное время – организация работает с любыми объемами и клиентами, вне зависимости от их юридического статуса. Приобрести этот металл можно в разном виде, по всем вопросам получить консультацию возможно по контактам компании.
Методы производства свинца
Основными на сегодняшний день, в мировой практике, являются два метода производства свинцового сплава: пирометаллургический и гидрометаллургический. Каждый из способов имеет как свои достоинства, так и недостатки. Добыча свинца производится из залежей этого металла в связанном состоянии. В основном встречаются месторождения сульфидов, карбонатов, сульфатов, хлоридов и хромитов, молибденов, а также других форм свинцовых руд. В чистом виде этот металл в природе не встречается.
Пирометаллургический метод производства
Данный способ изготовления свинца является основным в современной металлургии. Пирометаллургическую методику используют с применением различных видов плавки металла. Применяются обычно следующие ее разновидности:
- Горновая плавка;
- Восстановительная плавка;
- Отражательная плавка;
- Шахтная плавка;
- Осадительная плавка;
- Щелочная плавка.
На сегодняшний день почти весь объем свинца, используемый в металлургической промышленности, получают при помощи пирометаллургической методики производства с использованием восстановительной плавки.
Восстановительная плавка – считается универсальным способом. Она является пригодным методом плавки для руд всех категорий, вне зависимости от количества свинца в ней и с любым составом, добавками. Концентрат свинца, обычно сульфидный, после процесса обогащения, перемешивается с флюсами и окисляются с тем, чтобы из сульфида металла получился оксид – данная стадия получила наименование агломерирующий обжиг. Процессу окислению подвергают другие соли, в итоге полученный агломерат имеет в составе оксиды металлов. Готовый рабочий материал измельчается перед подачей в печь.
Внутри шахтных печей измельченный продукт плавится в восстановительной атмосфере, простым языком, в присутствии угарного газа. Таким способом получают черновой свинец. После восстановительной плавки в составе остаются примеси висмута, меди, золота, серебра и других ценных металлов.
Полученный черновой свинец обрабатывается, подвергаясь рафинированию: повторной плавке с целью получения чистого металла и агломератов, включающих примеси различного характера. Затем состав отправляется на медный завод для извлечения из продукта различных примесей и веществ. В современных технологиях производства встречается практика использования плавки с дополнительными ингредиентами для того, чтобы удалить примеси.
Шахтная разновидность плавки в присутствии угарного газа не всегда эффективна, так не обеспечивает высокого уровня восстановления.Шлак все еще включает изрядное количество свинца. В связи с этим шлак подвергается повторной пирометаллургической обработке для дополнительной добычи металла. Этот процесс называется фьюмингование.
Отражательная плавка на сегодняшний день в мировой практике не применяется, так как устарела.Горновая плавка – тоже старый метод, но продолжает использоваться при работе с богатыми рудами.Здесь восстановительный процесс обжига и плавки производятся одновременно: руда и концентрат загружается со специальными топливными брикетами из антрацита или древесного угля, дополнительно продувается в процессе сжатым воздухом.
Осадительная плавка – используется в металлургии реже, она позволяет получать сплав из руды без производства предварительного обжига. Данная методика сводится к законам химии: способности активных металлов вытеснить менее активные из их солей. С этой целью плавится сульфидный свинец с железом, в итоге происходит отделение свинца и сульфида железа. Этот метод плавки не используется на крупных предприятиях и интересует в основном ученых.
Еще один метод, щелочная плавка, позволяет получить из свинцового концентрата до 98% металла. При этом способе, свинцовый концентрат нагревается в электропечи до температуры в 850 градусов по Цельсию, с щелочным натром. В итоге получаются достаточно чистый сплав свинца, а также небольшое количество щелочного сплава.
Гидрометаллургический метод производства
В настоящий момент практически весь свинец добываемый из сырья получают пирометаллургическими способами, но также и существует гидрометаллургический метод. Данный способ производства подразумевает извлечение свинца из конгломерата при помощи хлорного железа. Метод включает в себя следующие этапы:
- Свинцовые соли растворяют в водном растворе хлорного железа;
- Свинцовые соединения выщелачиваются, в раствор выделяются примеси конгломерата;
- Рабочий раствор очищается;
- Осаждается свинец при помощи технологий кристаллизации, электролиза, цементации и благодаря воздействию растворимых анодов.
Гидрометаллургический метод используется реже пирометаллургического, так как является опасным для живых организмов, человека и рабочих в частности. Из достоинств метода – его дешевизна, плавка в разы дороже.
Важные свойства свинца
Данный металл один из самых известных в мире и распространен в жизнедеятельности человека с древних времен. Многие археологи предполагают, что именно свинец стал первым металлом который расплавил человек. Чтобы понять почему этот сплав цениться и в чем его особенность, следует изучить его основные свойства.
Плотность этого металла колеблется, при высоких температурах падает, при низких повышается. Молекулярная масса химического элемента «свинец» равняется 82 – это высокий показатель. Рабочие температуры для свинца следующие:
- Плавка – 327 градусов по Цельсию;
- Кипение – 1749 градусов по Цельсию;
- Литье – 400 градусов по Цельсию;
- Сверхпроводник – температура ниже 7,26К.
Важным свойством также является то, что свинец легко разрывается, сжимается и видоизменяется. Мягкость металла, основное его достоинство – по Бринеллю твердость составляет 3,2НВ.
Теплопроводность свинцового сплава ниже чем у других металлов – в 2 раза железа и в 11 раз меньше меди. Также обстоит дело и с электропроводностью. Металл имеет достаточно высокую коррозийную стойкость, но из-за высокой активности, способен раствориться в различных кислотах. При этом свинец устойчиво реагирует на воздействие хромовых, плавиковых, сернистых, фосфорных кислот.
Главный недостаток свинца как металла – его токсичность. Данный химический элемент способен нанести непоправимый вред здоровью, уничтожить кости, мозг и почки, а также негативно воздействовать на нервную систему. Именно из-за этого свинец используется сегодня всё реже, в основном внутри герметичных изделий, откуда не испаряются его вредные пары.
Видео о производстве свинца
Электропроводность
Министерство высшего и
Ташкентский Государственный Технический Университет
Факультет: Энергетика
Предмет: «Электротехнические материалы»
Самостоятельная работа №1
На тему: «Электропроводность»
Проверила: Цыпкина В.В.
Ташкент-2013
Электропроводность
Содержание
1. Проводники, полупроводники и диэлектрики
2. Виды электропроводности
3.Электрическая проводимость различных материалов
3.1 Электропроводность металлов
3.2 Электрическая проводимость газов
3.3 Электропроводность электролитов
3.4 Электропроводность плазмы
4. Характер зависимости
Список литературы
Аннотация
Электропроводность –
При подаче на объект разности потенциалов (U) через него потечет электрический ток силой (I), величина которой пропорциональна электропроводности (L):
I = L • U или I = U / R.
Если соединить проволокой два проводника, между которыми была создана разность потенциалов, то потенциалы будут выравниваться, при этом заряды на проводниках перераспределяются, а в соединительной проволоке происходит направленное перемещение зарядов, называемые током. Ток под действием приложений разности потенциалов возникает в любой среде, где имеются свободные электроны.
Электрическая проводимость (э.п.) характеризует способность вещества проводить ток, она обратно пропорциональна электрическому сопротивлению, имеет размерность [1/Ом= См (сименс)].
Проводники, полупроводники и диэлектрики
Все тела в зависимости от электропроводности можно разделить на три группы: проводники, полупроводники и диэлектрики (изоляторы).
Проводником принято называть такое тело, в объёме которого имеется много свободных зарядов. Зарядов, способных перемещаться внутри этого объёма. Различают проводники с электронной проводимостью (проводники первого рода) и проводники с ионной проводимостью (проводники второго рода).
К проводникам первого рода относятся
все металлы и металлические
сплавы. В объёме металлического тела
имеется много свободных
В соответствии с принципом Паули при ограниченном числе электронов, заполненными окажутся лишь несколько наиболее низких энергетических зон. Все остальные зоны будут пусты (свободные зоны).
Наполовину заполненной
Внешние s-электроны полностью заполняют валентную зону, которая перекрывается со следующей, образованной p-орбиталями этого же уровня, например, в Mg (рис. справа).
Диэлектриками называются тела, в объёме которых содержится очень мало свободных электронов. Поэтому они почти не проводят электрический ток и говорят что у них очень низкая электропроводность вещества. К диэлектрикам относятся смолы, лаки, стекло и т.п.
Валентная зона заполнена полностью и отделена от следующей за ней свободной зоны широкой (Eg > 2¸3 эВ) запрещенной зоной – энергетической щелью. Внешнее электрическое поле не создает электрического тока, так как электроны заполненной зоны не могут перейти в свободную. Такие вещества являются диэлектриками:
К полупроводникам относятся
Если валентная зона полностью заполнена и ширина запрещенной зоны Eg < < 2-3 эВ, то такие вещества называются полупроводниками. В полупроводниках за счет тепловой энергии kBT заметное число электронов оказывается переброшенным в свободную зону (зону проводимости). При наложении внешнего электрического поля возникает электрический ток, который много слабее, чем в металлах, из-за низкой концентрации носителей заряда. При очень низких температурах любой полупроводник становится диэлектриком.
Между металлами и диэлектриками
существует качественное различие, а
между диэлектриками и
Виды электропроводности
В зависимости от вида и природы зарядоносителей проводимость бывает электронной, ионной и дырочной.
Электронной проводимостью обладают металлы. Существует такая проводимость и в верхних слоях атмосферы, где плотность вещества невелика, благодаря чему электроны могут свободно перемещаться, не соединяясь с положительно заряженными ионами.
Жидкие электроны обладают ионной проводимостью. Ионы, являющиеся зарядоносителями, при движении перемещают вещество, в результате чего происходит выделение его на электродах.
Возможен механизм проводимости, обусловленный разрывом валентной связи, приводящим к появлению вакантного места с отсутствующей связью. Такое “пустые” место с отсутствующими электронами связи получило название — дырка. Возникновение дырки в кристалле проводника создаёт дополнительную возможность для переноса заряда. Этот процесс, сопровождающийся перемещением электронов, получил название дырочной проводимостью.
Электрическая проводимость различных материалов
Электропроводность металлов
Экспериментально показано, что
в металлах ионы не принимают участия
в перенесении электрических
зарядов, так как в противном
случае электрический ток обязательно
сопровождался бы переносом материала,
что не наблюдалась. В опытах с
инерцией электронов было установлено,
что электрический ток в
Если внутри металла нет электрического тока, то электроны проводимости совершают беспорядочное движение (тепловое): в каждый момент времени они имеют неодинаковые скорости и различные направления.
Суммарный заряд, проходящий через любую площадку внутри металла, в отсутствие внешнего поля равен нулю. Если к концам проводника присоединить разность потенциалов, т.е. создать внутри проводника поле напряженностью Э, то на каждый электрон будет действовать сила, направленная противоположно полю. В результате возникает электрический ток. На основании представлений об электрическом газе легко объясняется большая теплопроводимость металлов. В самом деле, свободные электроны, участвуя в тепловом движении и обладая большой подвижностью, будут способствовать выравниванию различий в температуре тела.
В металлах концентрация электронов
проводимости почти не зависит от
температуры. Существует группа материалов,
в которых электрический ток
также обусловлен перемещением свободных
электронов, однако концентрация этих
электронов зависит от температуры:
удельное сопротивление таких материалов
при понижении температуры
Для того чтобы увеличить концентрацию
свободных электронов в полупроводниках,
необходимо затратить некоторую
энергию для отрыва связанных
электронов. Её называют энергией ионизации.
При повышении температуры
С внешней стороны металлы, как известно, характеризуются прежде всего особым “металлическим” блеском, который обусловливается их способностью сильно отражать лучи света. Однако этот блеск наблюдается обыкновенно только в том случае, когда металл образует сплошную компактную массу. Правда, магний и алюминий сохраняют свой блеск, даже будучи превращенными в порошок, но большинство металлов в мелкораздробленном виде имеет черный или темно-серый цвет. Затем типичные металлы обладают высокой тепло- и электропроводностью, причем по способности проводить тепло и ток располагаются в одном и том же порядке: лучшие проводники — серебро и медь, худшие — свинец и ртуть. С повышением температуры электропроводность падает, при понижении температуры, наоборот, увеличивается.
Очень важным свойством металлов является их сравнительно легкая механическая деформируемость. Металлы пластичны, они хорошо куются, вытягиваются в проволоку, прокатываются в листы и т.п.
Характерные физические свойства металлов
находятся в связи с
Наличием свободных электронов
обусловливается и высокая
Электрическая проводимость газов
В явлениях электрического разряда в газах большую роль играет ионизация атомов электронными ударами. Этот процесс заключается в том, что движущийся электрон, обладающий достаточной кинетической энергией, при соударении с нейтральным атомом выбивает из него один или несколько атомных электронов, в результате чего нейтральный атом превращается в положительный ион, а в газе появляются новые электроны (об этом будет рассмотрено позднее).
Механизм проводимости газов похож на механизм проводимости растворов и расплавов электролитов. При отсутствии внешнего поля заряженные частицы, как и нейтральные молекулы движутся хаотически. Если ионы и свободные электроны оказываются во внешнем электрическом поле, то они приходят в направленное движение и создают электрический ток в газах.
Таким образом, электрический ток
в газе представляет собой направленное
движение положительных ионов к
катоду, а отрицательных ионов
и электронов к аноду. Полный ток
в газе складывается из двух потоков
заряженных частиц: потока, идущего
к аноду, и потока, направленного
к катоду. Процесс прохождения
электрического тока через газ называется
газовым разрядом. Если электропроводность
газа создается внешними ионизаторами,
то электрический ток, возникающий
в нем, называется несамостоятельным
газовым разрядом. С прекращением
действия внешних ионизаторов
Электрический разряд в газе, сохраняющийся после прекращения действия внешнего ионизатора, называется самостоятельным газовым разрядом . Для его осуществления необходимо, чтобы в результате самого разряда в газе непрерывно образовывались свободные заряды. Основным источником их возникновения является ударная ионизация молекул газа.
Если после достижения насыщения продолжать увеличивать разность потенциалов между электродами, то сила тока при достаточно большом напряжении станет резко возрастать.
Это означает, что в газе появляются дополнительные ионы, которые образуются за счет действия ионизатора. Сила тока может возрасти в сотни и тысячи раз, а число заряженных частиц, возникающих в процессе разряда, может стать таким большим, что внешний ионизатор будет уже не нужен для поддержания разряда.
Положительные ионы, образовавшиеся при столкновении электронов с нейтральными атомами, при своем движении к катоду приобретают под действием поля большую кинетическую энергию. При ударах таких быстрых ионов о катод с поверхности катода выбиваются электроны.
БиблиотекаTLP Введение в термическую и электрическую проводимость
Щелкните здесь для просмотра актуальных (непечатаемых) страниц TLP.Примечание. Пакеты обучения и обучения DoITPoMS предназначены для интерактивного использования на компьютере! Эта версия TLP для печати предоставляется для удобства, но не отображает все содержимое TLP. Например, отсутствуют какие-либо видеоклипы и ответы на вопросы. Форматирование (разрывы страниц и т. Д.) Печатной версии непредсказуемо и сильно зависит от вашего браузера.
Содержание
- Цели
- Перед тем, как начать
- Введение
- Введение в проводимость
- Металлы: модель электропроводности по Друде
- Факторы, влияющие на электропроводность
- Металлы теплопроводные
- Электропроводность: неметаллы
- Неметаллы: тепловые фононы
- Приложения
- Сводка
- вопросов
- Дальше
Цели
По завершении этого пакета TLP вам необходимо:
- Понимать основные механизмы и модели теплопроводности и теплопроводности металлов и неметаллов.
- Помните о некоторых факторах, которые влияют на оба типа проводимости.
- Знайте некоторые области применения обоих типов проводников и изоляторов.
Перед тем, как начать
Этот TLP является введением, поэтому никаких специальных знаний не требуется. Однако есть и другие TLP, которые охватывают более сложные темы, такие как полупроводники, ссылки на которые приведены в разделе для дальнейшего чтения.
Введение
Электропроводность охватывает невероятно большой порядок величин (30!) От изоляторов до металлов и даже может быть бесконечным в сверхпроводниках.Знание того, как управлять им, привело к компьютерной революции и постоянно увеличивающейся миниатюризации
Теплопроводность, хотя для известных материалов она составляет всего около 10 порядков величины, по-прежнему имеет решающее значение для многих важных технологических достижений, от реактивных турбин и космических путешествий до USB-холодильников для напитков.
Чтобы по-настоящему оценить эти достижения, важно понимать, как возникает проводимость в материалах. Существуют простые модели, которые можно использовать для прогнозирования поведения многих материалов; между теплопроводностью и электропроводностью в металлах существуют близкие параллели, в то время как механизмы проводимости в неметаллах совершенно разные.
Введение в проводимость
Электропроводность
Важно не запутаться в проводимости, проводимости, сопротивлении и удельном сопротивлении.
Свойства материалов: электропроводность σ и удельное электрическое сопротивление ρ
Электропроводность материала определяется как количество электрического заряда, переносимого в единицу времени через единицу площади под действием единичного градиента потенциала: J = σ E
где J — плотность тока (ток на единицу площади), а E — градиент потенциала.Это еще один способ выражения закона Ома, который чаще выражается как \ (V = I R \).
Для изотропного материала:
\ [\ sigma = \ frac 1 \ rho \]
Единицами измерения удельного электрического сопротивления являются омметр ( Ом · м ), а для удельной проводимости — обратная величина ( Ом -1 м -1 ). Для фактического образца длиной l и площадью поперечного сечения A сопротивление R рассчитывается по формуле:
\ [R = \ rho \ frac l A \]
Электрические сигналы распространяются со скоростью, близкой к скорости света, хотя , а не означает, что сами электроны движутся так быстро.Вместо этого типичная дрейфовая скорость электронов (их средняя скорость) намного ниже: менее 1 мм с -1 . Это подробно описано в разделе моделей Друде.
Еще одно уместное напоминание о потенциале и токе: ток — это поток электронов, а потенциал — это движущая сила, заставляющая их течь. Обладая достаточным потенциалом, электроны могут переносить заряд через любой материал, включая вакуум (см. ЭЛТ), хотя они бессильны без какого-либо чистого тока.
Лучшие электрические проводники (кроме сверхпроводников) — это чистая медь и чистое серебро с удельным сопротивлением 16,78 и 15,87 нОм соответственно. Для сравнения, полистирол имеет удельное сопротивление до 10 28 нОм, что на 27 порядков отличается!
Теплопроводность:
Чтобы понять теплопроводность материалов, важно ознакомиться с концепцией теплопередачи, которая представляет собой движение тепловой энергии от более горячего тела к более холодному.Это происходит при нескольких обстоятельствах:
- Когда объект имеет температуру, отличную от окружающей его температуры;
- Когда объект имеет температуру, отличную от температуры другого объекта, контактирующего с ним;
- Когда внутри объекта существует температурный градиент.
Направление теплопередачи определяется вторым законом термодинамики, который гласит, что энтропия изолированной системы, которая не находится в тепловом равновесии, будет со временем увеличиваться, приближаясь к максимальному значению в состоянии равновесия.Это означает, что передача тепла всегда происходит от тела с более высокой температурой к телу с более низкой температурой и будет продолжаться до тех пор, пока не будет достигнуто тепловое равновесие.
Передача тепловой энергии происходит только через 3 режима: теплопроводность, конвекция и излучение. Каждый режим имеет свой механизм и скорость передачи тепла, и, таким образом, в любой конкретной ситуации скорость передачи тепла зависит от того, насколько преобладает определенный режим.
Проводимость включает передачу тепловой энергии за счет комбинации диффузии электронов и фононных колебаний, что применимо к твердым телам.
Конвекция предполагает передачу тепловой энергии в движущейся среде — горячий газ / жидкость движется через более холодную среду (обычно из-за разницы в плотности).
Излучение включает передачу тепловой энергии электромагнитным излучением. Солнце — хороший пример передачи энергии через (близкий) вакуум.
Этот TLP фокусируется на проводимости в кристаллических твердых телах.
Теплопроводность, Κ, — это свойство материала, которое указывает на способность проводить тепло.Первый закон Фурье определяет тепловой поток, пропорциональный разнице температур, площади поверхности и длине образца:
\ [H = \ frac {\ Delta Q} {\ Delta t} = \ kappa A \ frac {\ Delta T} {l} \]
где ΔQ / Δt — скорость теплопередачи, A — площадь поверхности, l — длина.
Лучшие металлические теплопроводники — это чистая медь и серебро. При комнатной температуре технически чистая медь обычно имеет проводимость около 360 Вт · м -1 K -1 (хотя теплопроводность монокристалла меди была измерена при 12 200 Вт · м -1 K -1 при температура 20.8 К). В металлах движение электронов доминирует над теплопроводностью.
Объемный материал с самой высокой теплопроводностью (помимо сверхтекучего гелия II), что, возможно, удивительно, является неметаллом: чистый монокристаллический алмаз, который имеет теплопроводность при комнатной температуре около 2200 Вт · м -1 K -1 . Высокая проводимость используется даже для проверки подлинности алмаза. Сильные ковалентные связи внутри молекулы ответственны за высокую проводимость, хотя свободных электронов нет, тепло передается фононами.Большинство природных алмазов также содержат атомы бора, которые заменяют атомы углерода в кристаллической матрице, которые также обладают высокой теплопроводностью.
Металлы: модель электропроводности Друде
Из-за квантово-механической природы электронов полное моделирование движения электронов в твердом теле (т. Е. Проводимости) потребует рассмотрения не только всех ядер положительных ионов, взаимодействующих с каждым электроном , но также каждого электрона с каждым другим электроном .Даже с продвинутыми моделями это быстро становится слишком сложным для адекватного моделирования материала макроскопического масштаба.
Модель Друде значительно упрощает ситуацию за счет использования классической механики и рассматривает твердое тело как фиксированный массив ядер в «море» несвязанных электронов. Кроме того, электроны движутся по прямым линиям, не взаимодействуют друг с другом и случайным образом рассеиваются ядрами.
Вместо моделирования всей решетки используются два статистически полученных числа:
τ , среднее время между столкновениями (время рассеяния ) и
l , среднее расстояние, пройденное между столкновениями (среднее свободное расстояние путь )
Под действием поля E электроны испытывают силу –e E, и, таким образом, ускорение от F = m a
Для электрона, выходящего из столкновения со скоростью v 0 , скорость после времени t определяется как:
\ [v = v_ {0} — \ frac {eEt} {m} \]
Конечно, если электроны рассеиваются случайным образом при каждом столкновении, v 0 будет равно нулю.{2} \ tau E} {m} \]
Проводимость σ = n e μ, где μ — подвижность , которая определяется как
\ [\ mu = \ frac {| v |} {E} = \ frac {eE \ tau} {mE} = \ frac {e \ tau} {m} \]
Конечный результат всех этих математических расчетов — разумное приближение проводимости ряда одновалентных металлов. При комнатной температуре, используя кинетическую теорию газов для оценки скорости дрейфа, модель Друде дает σ ~ 10 6 Ом -1 м -1 .Это примерно правильный порядок величины для многих одновалентных металлов, таких как натрий ( σ ~ 2,13 × 10 5 Ом -1 м -1 ).
Модель Друде можно визуализировать с помощью следующего моделирования. В отсутствие приложенного поля видно, что электроны движутся беспорядочно. Используйте ползунок, чтобы применить поле, чтобы увидеть его влияние на движение электронов.
Примечание. Для этой анимации требуется Adobe Flash Player 8 и более поздних версий, который можно скачать здесь.
Однако важно отметить, что для неметаллов, многовалентных металлов и полупроводников модель Друде совершенно не работает. Чтобы иметь возможность более точно предсказать проводимость этих материалов, требуются квантово-механические модели, такие как модель почти свободных электронов. Это выходит за рамки настоящего TLP
. Сверхпроводникитакже не объясняются такими простыми моделями, хотя дополнительную информацию можно найти на сайте Superconductivity TLP.
Факторы, влияющие на электропроводность
Электропроводность большинства металлических проводников (не полупроводников!) Легко определить.Есть три важных случая:
Чистые и почти чистые металлы
Для чистых металлов при температуре около комнатной удельное сопротивление линейно зависит от температуры.
\ [\ rho_2 = \ rho_1 [1 + \ alpha (T_2 — T_1)] \]
Однако при низких температурах проводимость перестает быть линейной (сверхпроводники рассматриваются отдельно), а удельное сопротивление связано с температурой по правилу Маттизена:
\ [\ rho (T) = {\ rho _ {{\ rm {defect}}}} + {\ rho _ {{\ rm {Thermal}}}} \]
Низкотемпературное удельное сопротивление (\ ({\ rho _ {{\ rm {defect}}}} \)) зависит от концентрации дефектов решетки, таких как дислокации, границы зерен, вакансии и межузельные атомы.Следовательно, оно ниже в отожженных металлических образцах с крупными кристаллами и выше в сплавах и закаленных металлах. Вы можете подумать, что при более высоких температурах электроны будут иметь больше энергии, чтобы двигаться через материал, поэтому, возможно, довольно удивительно, что удельное сопротивление увеличивается (и, следовательно, проводимость уменьшается) с увеличением температуры. Причина этого в том, что с повышением температуры электроны чаще рассеиваются на колебаниях решетки или фононах, что вызывает увеличение удельного сопротивления.Этот вклад в удельное сопротивление описывается термином ρ термического .
Температурная зависимость проводимости чистых металлов схематично проиллюстрирована в следующем моделировании. Используйте ползунок, чтобы изменить температуру, чтобы увидеть, как это влияет на движение электронов через решетку. Вы также можете ввести межузельные атомы, щелкнув мышью внутри решетки.
Примечание. Для этой анимации требуется Adobe Flash Player 10 и более поздних версий, который можно скачать здесь.
Сплавы — твердый раствор
Как и раньше, добавление примеси (в данном случае другого элемента) снижает проводимость. Для твердого раствора изменение удельного сопротивления в зависимости от состава определяется правилом Нордхейма:
\ [\ rho = \ chi _ {\ alpha} \ rho _ {\ alpha} + \ chi _ {\ beta} \ rho _ {\ beta} + C \ chi _ {\ alpha} \ chi _ {\ beta} \]
, где C — константа, CA и CB — атомные доли металлов A и B, удельные сопротивления которых равны ρA и ρB соответственно.2 \]
, где ΔZ — разность валентностей растворенного вещества и растворителя.
Таким образом, растворенные атомы с более высоким (или более низким) зарядом, чем решетка, будут иметь большее влияние на удельное сопротивление.
Сплавы — многофазные
Для сплава, в котором есть две или более отдельных фаз, вклады просто линейно влияют на общее удельное сопротивление (хотя влияние многих границ зерен немного увеличивает удельное сопротивление).
\ [\ rho = \ chi_ \ alpha \ rho_ \ alpha + \ chi_ \ beta \ rho_ \ beta \]
Следующая анимация иллюстрирует правило Маттейзена, правило Нордхейма и правило смешения.
Примечание. Для этой анимации требуется Adobe Flash Player 8 и более поздних версий, который можно скачать здесь.
Металлы теплопроводности
Металлы обычно имеют относительно высокую концентрацию свободных электронов проводимости, и они могут передавать тепло при движении через решетку. Фононная проводимость также имеет место, но эффект перекрывается электронной проводимостью.
Следующая симуляция показывает, как электроны могут проводить тепло, сталкиваясь с ядрами и передавая тепловую энергию.Нажмите кнопку «источник», чтобы приложить источник тепла к одной стороне образца. График покажет температурный градиент внутри образца, и вы также можете применить радиатор к противоположной стороне образца, используя кнопку «сток».
Примечание. Для этой анимации требуется Adobe Flash Player 10 и более поздних версий, который можно скачать здесь.
Закон Видеманна-Франца
Так как преобладающий метод теплопроводности у металлов одинаковый для теплопроводности и электропроводности (т.{- 2}} \]
Этот закон можно объяснить тем фактом, что свободные электроны в металле участвуют в механизмах переноса тепла и электричества. Теплопроводность увеличивается со средней скоростью электронов, так как это увеличивает прямой перенос энергии. Однако электрическая проводимость уменьшается с увеличением скорости частиц, поскольку столкновения отвлекают электроны от прямого переноса заряда.
Электропроводность: неметаллы
Хотя модель Друде достаточно хорошо работает для одновалентных металлов, она не предсказывает свойства полупроводников, сверхпроводников или неметаллических проводников.
Сверхпроводники и полупроводники лучше всего объясняются в их собственных TLP.
Ионная проводимость
Для некоторых материалов нет чистого движения электронов, но они по-прежнему проводят электричество.
Это механизм ионной проводимости, при котором некоторые заряженные ионы могут перемещаться через объемную решетку (посредством обычных механизмов диффузии, за исключением движущей силы электрического поля).
Такие ионные проводники используются в твердооксидных топливных элементах — хотя, например, для оксида циркония, стабилизированного оксидом иттрия (YZT), рабочие температуры находятся в диапазоне от 500 до 1000 градусов C.Поскольку они действуют по механизму, подобному диффузии, более высокие температуры приводят к более высокой проводимости, что противоположно тому, что предсказывала бы простая модель Друде.
Напряжение пробоя
Существует важный и потенциально смертельный механизм, благодаря которому изолятор может стать проводящим. В воздухе это обычно распознается как молния. Следует отметить, что механизм может ионизировать «изолятор», временно делая его более проводящим.
Газы обычно ионизируются в бытовых осветительных приборах.Наиболее распространены люминесцентные лампы и неоновые лампы.
Для первоначального возбуждения паров ртути в свете люминесцентной лампы необходим всплеск напряжения, превышающий напряжение пробоя. Это можно заметить при включении такого света, как внезапное возгорание с соответствующим всплеском радиопомех. Неисправная трубка может не полностью ионизироваться, что приводит к слабому свечению на концах.
Под высоким напряжением может проводиться даже оргстекло. Временно ионизированный путь непрозрачен при охлаждении, что в данном случае дает фигуру Лихтенберга. Изображение «Фигура Лихтенберга» от Берт Хикман
Более подробная информация доступна на странице Dielectrics TLP по разбивке
.Неметаллы: тепловые фононы
Как упоминалось ранее, металлы имеют два режима теплопроводности: на основе электронов и на основе фононов. Для неметаллов имеется относительно мало свободных электронов, поэтому доминирует фононный метод.
Тепло можно рассматривать как меру энергии колебаний атомов в материале.Как и все вещи в атомном масштабе, здесь есть квантово-механические соображения; энергия каждой вибрации квантуется (и пропорциональна частоте). Фонон — это квант колебательной энергии, и за счет комбинации (суперпозиции) многих фононов тепло наблюдается макроскопически.
Энергия данного колебания решетки в жесткой кристаллической решетке квантована в квазичастицу, называемую фононом . Это аналог фотона в электромагнитной волне; тепловые колебания в кристаллах можно описать как термически возбужденные фононы, которые можно отнести к термически возбужденным фотонам.Фононы являются основным фактором, определяющим электрическую и теплопроводность материала.
Фонон представляет собой квантово-механическую адаптацию нормальной модальной вибрации в классической механике. Ключевым свойством фононов является дуальность волна-частица; нормальные моды имеют волновые явления в классической механике, но приобретают поведение, подобное частицам в квантовой механике.
Энергия фонона пропорциональна его угловой частоте ω:
\ [\ varepsilon = (n + \ frac {1} {2}) \ hbar \ omega \]
с квантовым числом n .Член \ (\ frac {1} {2} \ hbar \ omega \) — это энергия нулевой точки моды. Это определяется как минимально возможная энергия, которой обладает система, и является энергией основного состояния.
Если твердое тело имеет более одного типа атомов в элементарной ячейке, будет два возможных типа фононов: «акустические» и «оптические» фононы. Частота акустических фононов примерно равна частоте звука, а частота оптических фононов близка к частоте инфракрасного света. Их называют оптическими, потому что в ионных кристаллах они легко возбуждаются электромагнитным излучением.
Если кристаллическая решетка имеет нулевую температуру, она находится в основном состоянии и не содержит фононов. Когда решетка нагревается и поддерживается при ненулевой температуре, ее энергия не является постоянной, а колеблется случайным образом около некоторого среднего значения. Эти флуктуации энергии вызваны случайными колебаниями решетки, которую можно рассматривать как газ фононов. Поскольку температура решетки порождает эти фононы, их иногда называют тепловыми фононами . Тепловые фононы могут создаваться или разрушаться случайными колебаниями энергии.
Принято считать, что фононы тоже обладают импульсом и поэтому могут проводить энергию через решетку. В отличие от электронов, существует чистое движение фононов — от более горячей части решетки к более холодной, где они разрушаются. Электроны должны сохранять нейтральность заряда в решетке, поэтому нет чистого движения электронов во время теплопроводности.
Следующая симуляция показывает схематические оптические и акустические фононы в двумерной решетке и дает возможность анимировать двумерный волновой вектор, определяемый щелчком внутри зеленого поля.
Примечание. Для этой анимации требуется Adobe Flash Player 10 и более поздних версий, который можно скачать здесь.
Рассеяние Umklapp
Когда два фонона сталкиваются, образующийся фонон имеет векторную сумму их импульсов. Способ обработки частиц, движущихся в решетке квантово-механическим способом в рамках схемы редуцированных зон (которая выходит за рамки данной TLP, но более подробно исследуется в TLP зон Бриллюэна), приводит к концептуально странному эффекту. Если импульс слишком велик (за пределами первой зоны Бриллюэна), то образующийся фонон движется почти в противоположном направлении.Это Umklapp scattering , и оно преобладает при более высоких температурах, снижая теплопроводность при повышении температуры.
Приложения
Кремниевые чипы
Поскольку электрические свойства меняются в зависимости от микроструктуры, был разработан тип компьютерной памяти, называемый памятью с произвольным доступом с фазовым переходом (PC-RAM). Используемый материал представляет собой халькогенид, обозначаемый как GST (Ge 2 Sb 2 Te 5 ).
Аморфное состояние является полупроводником, а в (поли) кристаллической форме — металлическим.Нагревание выше точки стеклования, но ниже точки плавления приводит к кристаллизации ранее полупроводниковой аморфной ячейки. Аналогичным образом, полностью расплавившись, а затем быстро охлаждая клетку, она остается в металлическом кристаллическом состоянии.
Это изменение удельного сопротивления в зависимости от микроструктуры имеет решающее значение для работы таких устройств. Варьируя условия нагрева, различная пропорция каждой ячейки GST может быть кристаллической и аморфной — применяется правило смеси, поскольку фактически это две фазы.Это позволяет использовать несколько различимых уровней сопротивления для каждой ячейки, увеличивая плотность хранения и снижая стоимость мегабайта.
Наиболее распространенной проблемой кремниевых устройств является рассеивание тепла.
Современный процессор имеет расчетную тепловую мощность более 70 Вт (Intel i7 3770, процесс 22 нм). Охладитель должен отводить указанное количество тепла с поверхности кристалла, которое обычно составляет менее 10 см. 2 . Обычно радиаторы имеют медный блок, прикрепленный к корпусу микропроцессора с помощью термопасты и давления.Основная часть радиатора обычно делается из гораздо более дешевого алюминия, хотя для интерфейса необходима высокая теплопроводность меди. Термопаста, хотя и является лучшим проводником тепла, чем воздух, намного хуже, чем большинство металлов, поэтому ее используют только в качестве тонкого слоя для замены воздушных зазоров.
Электропроводность — не самый эффективный метод отвода тепла к отдельному радиатору, поэтому можно использовать конвекцию и скрытую теплоту испарения. Тепловые трубки, обычно сделанные из меди, заполнены жидкостью с низкой температурой кипения, которая кипит на горячем конце и конденсируется на холодном конце трубы.Это гораздо более быстрый способ передачи тепла на большие расстояния.
Космос
Теплоизоляторы находят множество применений, и их развитие было связано с попытками улучшить объемные механические свойства при сохранении изоляционных свойств (т.е. не пропускать тепло, но не плавиться)
Особенно известное применение теплоизоляции — это (ныне снятые с производства) плитки космических челноков, которые отвечают за защиту челнока во время повторного входа в атмосферу.Они такие хорошие изоляторы, что снаружи они могут раскалиться докрасна, а внутри шаттла астронавты еще живы.
Одним из лучших теплоизоляторов является кремнеземный аэрогель.
Аэрогель — это твердотельный материал с чрезвычайно низкой плотностью, сделанный из геля, в котором жидкая фаза геля заменена газом. В результате получается твердое тело чрезвычайно низкой плотности, что делает его эффективным теплоизолятором.
Одно применение аэрогелей — легкий коллектор микрометеоритов, аэрогель был использован.Хотя он очень легкий, он достаточно силен, чтобы улавливать микрометеоры.
Спички остаются холодными в миллиметрах от паяльной лампы, большой массив аэрогелевых кирпичей готов к запуску в космос, а образовавшаяся космическая пыль фотографируется по возвращении на Землю
Aerogels могут изготавливаться из различных материалов, но имеют универсальную структуру. (аморфные «нано-пены» с открытыми ячейками). Однако чаще всего используется силикат. Аэрогели кремнезема были впервые открыты в 1931 году.
Аэрогели обладают экстремальной структурой и экстремальными физическими свойствами. Высокопористая природа структуры аэрогеля обеспечивает низкую плотность. Процент открытого пространства в структуре аэрогеля составляет около 94% для геля плотностью 100 кг · м — 3 .
Аэрогели являются хорошими теплоизоляционными материалами, поскольку они исключают три метода передачи тепла (конвекцию, теплопроводность и излучение). Они являются хорошими конвективными изоляторами благодаря тому, что воздух не может циркулировать по решетке.Кремнеземный аэрогель является особенно хорошим проводящим изолятором, потому что диоксид кремния плохо проводит тепло — металлический аэрогель, с другой стороны, был бы менее эффективным изолятором. Углеродный аэрогель является эффективным изолятором излучения, поскольку углерод способен поглощать инфракрасное излучение, которое передает тепло. Следовательно, для максимальной теплоизоляции лучший аэрогель — это кремнезем, легированный углеродом.
Трансмиссия
Одно из самых масштабных применений электрических проводников — передача энергии.
К сожалению, свойства, которые желательны для прочного кабеля, кажутся противоположными свойствам хорошего проводника.
Алюминиевые сплавы могут быть очень прочными из-за своей плотности, но, следуя правилу Нордхейма, они намного хуже проводят.
Существует огромное множество сталей, но, опять же, межузельные атомы углерода увеличивают сопротивление по сравнению с чистым железом. Это означает, что необходим кабель большего диаметра, который из-за плотности стали оказывается очень тяжелым и дорогим.Более тяжелый кабель также означает, что мы должны построить дополнительные пилоны, что составляет большую часть стоимости.
Медь, хотя и подходит для домашней электропроводки, является плотной и все более дорогой.
Примечание. Для этой анимации требуется Adobe Flash Player 10 и более поздних версий, который можно скачать здесь.
Для большинства воздушных силовых кабелей решением является использование двух материалов — стальной жилы, окруженной множеством отдельных алюминиевых жил. Таким образом получаются легкие, высокопрочные кабели с приемлемой проводимостью.
Сверхпроводникибыли испытаны для передачи энергии, но только под землей, и при значительно более высокой стоимости (и эффективности!).
Термоэлектрический эффект
Термоэлектрический эффект — это прямое преобразование разницы температур в электрическое напряжение и наоборот. Проще говоря, термоэлектрическое устройство создает напряжение, когда на каждой стороне устройства разная температура. Он также может работать «в обратном направлении», поэтому, когда на него подается напряжение, создается разница температур.Этот эффект можно использовать для выработки электричества, измерения температуры, охлаждения объектов или их нагрева. Поскольку знак приложенного напряжения определяет направление нагрева и охлаждения, термоэлектрические устройства представляют собой очень удобные регуляторы температуры.
Эффект Пельтье заключается в том, что когда (постоянный) ток течет через переход металл-полупроводник, тепло либо поглощается, либо выделяется. Это связано с тем, что средняя энергия электронов в двух материалах различается, и эту разницу составляет тепло.
Для более полного понимания требуется знание зонной структуры, более подробно рассмотренной в TLP по полупроводникам.
Примечание. Для этой анимации требуется Adobe Flash Player 10 и более поздних версий, который можно скачать здесь.
Сводка
Мы рассмотрели основы электрической и теплопроводности, а также некоторые из наиболее распространенных приложений. Вы должны понимать роль электронов и фононов в теплопроводности, а также то, как взаимодействия между ними приводят к изменению электропроводности с температурой.Вы должны понимать, что металлы имеют больше механизмов теплопередачи, чем их неметаллические аналоги, что объясняет, почему они имеют более высокую теплопроводность. Кроме того, этот TLP должен был затронуть некоторые из основных применений тепловых и электрических проводников и изоляторов. Наконец, была установлена связь между теплопроводностью и электропроводностью металлов, в том числе закон Видемана-Франца.
Суммируя факторы, влияющие на проводимость:
- Температура — при повышении температуры увеличивается средняя энергия, приходящаяся на один фонон, и благодаря механизму рассеяния с перебросом тепла теплопроводность уменьшается.Фононы также больше рассеивают электроны.
- Плотность электронов (в металлах) — если электроны являются проводниками, большее количество (валентных) электронов обычно приводит к лучшей проводимости.
- Легирование — межузельные частицы рассеивают электроны и уменьшают проводимость. Фазовые границы, примеси, дислокации и т. Д. Снижают проводимость даже при низкой температуре.
Вопросы
Быстрые вопросы
Вы сможете без особого труда ответить на эти вопросы после изучения данного TLP.Если нет, то вам следует пройти через это снова!
Для фононов нормальные моды
Каким образом кристаллические решетки влияют на электроны, исходя из предположений модели свободных электронов?
Разброс Umklapp:
Что из следующего верно в соответствии с законом Видемана-Франца?
Какие из следующих утверждений об электропроводности почти чистых материалов верны?
Какой из них является правильным с точки зрения электропроводности от лучшей к худшей (предполагается, что это чистые материалы)?
Nb 3 Sn при 4K, Ag при 300K, Au при 300K, Nb 3 Sn при 300K, Cu при 300K. b Ag при 300K, Cu при 300K, Nb 3 Sn при 4K, Au при 300K, Nb 3 Sn при 300K. с Nb 3 Sn при 4K, Ag при 300K, Cu при 300K, Au при 300K, Nb 3 Sn при 300K. d Nb 3 Sn при 300K, Cu при 300K, Ag при 300K, Au при 300K, Nb 3 Sn при 4K. e Nb 3 Sn при 4K, Cu при 300K, Nb 3 Sn при 300K, Ag при 300K, Au при 300K.
Далее
Книги
Курс химии A NST IB и / или курс физики NST IB также более подробно рассматривают проведение.
Сайты
Академический консультант: Джесс Гвинн (Кембриджский университет)
Разработка контента: Эндрю Витти
Фотография и видео:
Веб-разработка: Лианн Саллоус и Дэвид Брук
DoITPoMS финансируется Великобританией Центр материаловедения и кафедра материаловедения и металлургии, Кембриджский университет
Industrial: Руководство по проектированию — электрическая и теплопроводность
Фото © 1998 AMP INC.Электропроводность — это основная характеристика, отличающая медь от других металлов. Из коммерчески полезных металлов медь уступает только серебру. Но медные сплавы имеют широкий диапазон проводимости. Существуют сотни полосок из медных сплавов, из которых можно выбирать, и некоторые из них имеют такую же низкую проводимость, как у железа. Еще больше усложняет ситуацию то, что вариации термической и механической обработки могут вызывать глубокие изменения проводимости. А металлы с самой высокой прочностью часто имеют самую низкую проводимость.Такие сплавы могут не подходить для применения в сильноточных соединителях.
Электропроводность полосовых металлов из медного сплава измеряется относительно стандартного стержня из «чистой» меди, которому давно присвоено значение 100. Таким образом, когда говорят, что латунь содержит 28% IACS, это означает, что удельная электропроводность составляет 28% от этот стандарт. [«IACS» — это международный стандарт отожженной меди]. Благодаря усовершенствованию технологий рафинирования металлов технически чистая медь сегодня имеет немного лучшую проводимость (101% IACS), чем стандартная.
Единая система нумерации (UNS) не классифицирует медные сплавы напрямую на группы с аналогичной проводимостью. Но он определяет «медь» как «медь, у которой установленное минимальное содержание меди составляет 99,3% или выше». Далее в нем говорится, что «сплавы с высоким содержанием меди» — это «… сплавы с… менее 99,3%, но более 96%…». Содержание меди играет важную роль в проводимости медных сплавов. Однако различные легирующие элементы, добавленные в медь, по-разному влияют на проводимость меди.Серебро, например, не вызывает измеримого эффекта, тогда как незначительное количество фосфора может сильно снизить проводимость.
Теплопроводность также является важным параметром в конструкции разъема. Внутри семейств сплавов теплопроводность связана с электропроводностью. Сплавы с более высокой электропроводностью будут иметь более высокую теплопроводность. Это удобно, поскольку теплопроводность довольно сложно измерить, в то время как электропроводность или обратное ей электрическое сопротивление измерить легко.
Сплавы с более высоким удельным сопротивлением (r) будут тратить больше энергии, так как тепло, выделяемое электрическим током (I), пропорционально I 2 , умноженному на сопротивление. Что еще более важно, выделяемое тепло повысит температуру разъема, что может иметь неблагоприятные последствия для характеристик разъема и его окружения. Сплавы с более высокой теплопроводностью позволяют конструктору рассеивать часть этого тепла, сводя к минимуму повышение температуры. Такая высокая проводимость обычно является востребованным свойством сплавов соединителей.
Есть ли связь между электропроводностью и теплопроводностью?
Спросил: Дарелл Хейс
Ответ
Для металлов существует взаимосвязь, известная как закон Видемана-Франца. Металлы бывают хорошие электрические проводники, потому что в них много бесплатных зарядов.Свобода заряды обычно являются отрицательными электронами, но в некоторых металлах, например, в вольфраме, они положительные «дыры». Для целей обсуждения предположим, что у нас есть заряды свободных электронов.Когда существует разница напряжений между двумя точками в металле, возникает электрический разряд. поле, которое заставляет электроны двигаться, то есть вызывает ток. Конечно, электроны сталкиваются с некоторыми из неподвижных атомов (фактически, «ионными ядрами») металла и это фрикционное «сопротивление» их замедляет.Сопротивление зависит от конкретный тип металла, с которым мы имеем дело. Например, трение в серебре намного меньше, чем это в железе. Чем большее расстояние может пройти электрон, не наткнувшись на ионного сердечника, тем меньше сопротивление, т. е. больше электрическая проводимость. Среднее расстояние, которое электрон может пройти без столкновения, называется ‘длина свободного пробега.’ Но есть еще один фактор. Электроны, которые свободны для реакции на электрическое поле иметь тепловую скорость, составляющую значительный процент от скорости легкий, но поскольку они движутся беспорядочно с такой высокой скоростью, в среднем они никуда не движутся, я.е., эта тепловая скорость сама по себе не создает тока.
Теплопроводность этого металла, как и электрическая проводимость, определяется в основном за счет свободных электронов. Предположим теперь, что металл имеет разные температуры при его концы. Электроны движутся немного быстрее на горячем конце и медленнее на холоде. конец. Более быстрые электроны передают энергию более холодным, более медленные, сталкиваясь с их, и, как и в случае с электропроводностью, чем больше длина свободного пробега, тем быстрее энергия может передаваться, т.е.е., тем больше теплопроводность. Но скорость также определяется очень высокой тепловой скоростью — чем выше скорость, тем быстрее течет ли тепловая энергия (т. е. тем быстрее происходят столкновения). Фактически, тепловая проводимость прямо пропорциональна произведению длины свободного пробега и теплового скорость.
Тепловая и электрическая проводимость одинаковым образом зависят не только от среднего свободного пути, но также и от других свойств, таких как масса электрона и даже количество свободных электронов в единице объема.Но, как мы видели, они по-разному зависят от теплового скорость электропроводности электронов обратно пропорциональна ей, а тепловая электропроводность прямо пропорциональна ему. В итоге соотношение теплового к электропроводность зависит в первую очередь от квадрата тепловой скорости. Но это квадрат пропорционален температуре, поэтому соотношение зависит от температура, T, и две физические константы: постоянная Больцмана, k, и электронная заряд, эл.В этом контексте постоянная Больцмана является мерой того, сколько кинетической энергии электрон имеет на градус температуры.
В совокупности отношение теплопроводности к электрической проводимости составляет:
( 2 /3) * ((к / э) 2 ) * Т
значение постоянной T умножения: 2.45×10 -8 Вт-ом-К-квадрат.
Ответил: Фрэнк Манли, доктор философии, доцент физики, Роанок-колледж
Что такое теплопроводность?
Диаграмма, показывающая передачу тепловой энергии через проводимость.Кредит: БезграничныйТепло — интересный вид энергии. Он не только поддерживает жизнь, делает нас комфортными и помогает готовить пищу, но и понимание его свойств является ключом ко многим областям научных исследований. Например, знание того, как передается тепло и степень, в которой различные материалы могут обмениваться тепловой энергией, управляет всем: от обогревателей здания и понимания сезонных изменений до отправки кораблей в космос.
Тепло может передаваться только тремя способами: теплопроводностью, конвекцией и излучением.Из них кондукция, пожалуй, самая распространенная и регулярно встречается в природе. Короче говоря, это передача тепла посредством физического контакта. Это происходит, когда вы нажимаете рукой на оконное стекло, когда вы ставите кастрюлю с водой на активный элемент и когда вы кладете утюг в огонь.
Эта передача происходит на молекулярном уровне — от одного тела к другому — когда тепловая энергия поглощается поверхностью и заставляет молекулы этой поверхности двигаться быстрее. В процессе они натыкаются на своих соседей и передают им энергию, и этот процесс продолжается, пока добавляется тепло.
Процесс теплопроводности зависит от четырех основных факторов: градиента температуры, поперечного сечения материалов, длины пути и свойств этих материалов.
Температурный градиент — это физическая величина, которая описывает, в каком направлении и с какой скоростью изменяется температура в определенном месте. Температура всегда течет от самого горячего источника к самому холодному, потому что холод — это не что иное, как отсутствие тепловой энергии. Этот переход между телами продолжается до тех пор, пока разница температур не исчезнет и не наступит состояние, известное как тепловое равновесие.
Поперечное сечение и длина пути также являются важными факторами. Чем больше размер материала, участвующего в переносе, тем больше тепла требуется для его нагрева. Кроме того, чем больше площадь поверхности подвергается воздействию открытого воздуха, тем больше вероятность потери тепла. Таким образом, более короткие объекты с меньшим поперечным сечением — лучший способ минимизировать потери тепловой энергии.
Теплопроводность происходит через любой материал, представленный здесь прямоугольным стержнем. Скорость переноса частично зависит от толщины материала (представ.пользователя A). Кредит: БезграничныйИ последнее, но не менее важное, это физические свойства используемых материалов. По сути, когда дело доходит до теплопроводности, не все вещества одинаковы. Металлы и камень считаются хорошими проводниками, поскольку они могут быстро передавать тепло, тогда как такие материалы, как дерево, бумага, воздух и ткань, являются плохими проводниками тепла.
Эти проводящие свойства оцениваются на основе «коэффициента», который измеряется относительно серебра.В этом отношении серебро имеет коэффициент теплопроводности 100, тогда как другие материалы имеют более низкий рейтинг. К ним относятся медь (92), железо (11), вода (0,12) и дерево (0,03). На противоположном конце спектра находится идеальный вакуум, который не может проводить тепло, и поэтому оценивается как нулевой.
Материалы, плохо проводящие тепло, называются изоляторами. Воздух с коэффициентом проводимости 0,006 является исключительным изолятором, поскольку он может удерживаться в замкнутом пространстве.Вот почему в искусственных изоляторах используются воздушные отсеки, такие как окна с двойным остеклением, которые используются для сокращения счетов за отопление. По сути, они действуют как буферы от потерь тепла.
Перо, мех и натуральные волокна — все это примеры натуральных изоляторов. Эти материалы позволяют птицам, млекопитающим и людям оставаться в тепле. Морские выдры, например, живут в океанических водах, которые часто очень холодные, а их роскошный густой мех согревает их. Другие морские млекопитающие, такие как морские львы, киты и пингвины, полагаются на толстый слой жира (он же.жир) — очень плохой проводник — для предотвращения потери тепла через кожу.
Та же самая логика применяется к изоляции домов, зданий и даже космических кораблей. В этих случаях методы включают либо воздушные карманы между стенами, стекловолокно (которое задерживает воздух) или пену высокой плотности. Космические аппараты представляют собой особый случай и используют изоляцию в виде пенопласта, армированного углеродного композитного материала и плиток из кварцевого волокна. Все они являются плохими проводниками тепла и, следовательно, предотвращают потерю тепла в космосе, а также предотвращают попадание экстремальных температур, вызванных атмосферным входом, в кабину экипажа.
Проводимость, как показывает нагрев металлического стержня пламенем. Кредит: Высшее образование Томсона.Законы теплопроводности очень похожи на закон Ома, регулирующий электрическую проводимость. В этом случае хороший проводник — это материал, который позволяет электрическому току (то есть электронам) проходить через него без особых проблем. Электрический изолятор, напротив, представляет собой любой материал, внутренние электрические заряды которого не текут свободно, и поэтому очень трудно проводить электрический ток под действием электрического поля.
В большинстве случаев материалы, которые плохо проводят тепло, также плохо проводят электричество. Например, медь хорошо проводит тепло и электричество, поэтому медные провода так широко используются в производстве электроники. Золото и серебро еще лучше, и там, где цена не является проблемой, эти материалы также используются при строительстве электрических цепей.
И когда кто-то хочет «заземлить» заряд (т.е.е. нейтрализовать его), они отправляют его через физическое соединение с Землей, где теряется заряд. Это обычное явление для электрических цепей, в которых присутствует незащищенный металл, гарантирующий, что люди, случайно вступившие в контакт, не будут поражены электрическим током.
Это вид носовой части космического корабля «Дискавери», построенного из жаропрочных углеродных композитов. Предоставлено: НАСА.Изоляционные материалы, такие как резина на подошвах обуви, используются для защиты людей, работающих с чувствительными материалами или рядом с электрическими источниками, от электрических зарядов.Другие изоляционные материалы, такие как стекло, полимеры или фарфор, обычно используются в линиях электропередач и высоковольтных передатчиках мощности, чтобы энергия передавалась в цепи (и ничего больше!)
Короче говоря, проводимость сводится к передаче тепла или передачи электрического заряда. И то и другое происходит в результате способности вещества позволять молекулам передавать энергию через них.
Разработан теплопроводящий пластик
Ссылка : Что такое теплопроводность? (2014, 9 декабря) получено 16 ноября 2020 с https: // физ.org / news / 2014-12-what-is-heat-constraction.html
Этот документ защищен авторским правом. За исключением честных сделок с целью частного изучения или исследования, никакие часть может быть воспроизведена без письменного разрешения. Контент предоставляется только в информационных целях.
Киберфизика — теплопроводность
Передача энергии веществом без вещества сам движущийся, называется проводимостью.Металлы — очень хорошие проводники. Неметаллы обычно являются плохими проводниками (изоляторами). Газы очень плохие проводники (воздушные карманы делают материалы хорошими изоляторами) ‘
Проводимость — это когда тепло перемещается через твердый объект или от одного объекта к другому, потому что два объекта контактируют друг с другом. Это только режим тепловых перемещений в твердых телах .
Теплопроводность
Возможность передачи тепло внутри объекта называется теплопроводностью ‘k’ (измеренная Вт · м -1 K -1 ).Он варьируется для разных материалов. Золото, серебро и медь обладают высокой теплопроводностью. Эти материалы также являются хорошими проводниками электричества. (Это потому, что электроны участвует как в передаче заряда, так и в передаче тепловой энергии).
Материалы, такие как стекловата и минеральная вата, обладают низкой теплопроводностью. Это потому, что у них очень мало «свободных» электронов, переносящих тепловую энергию внутри твердого тела. Они есть говорят хорошо изоляторы .Скорость передачи тепла (насколько быстро тепловая энергия движется) зависит от теплопроводности, температуры разница и площадь контакта и материал, который объект или структура состоит из. (См. Значения U)
Если материал хороший проводник тепла, тогда тепло будет перемещаться быстро. Металлы широко используются для теплопередачи, поскольку обладают свойствами, позволяющими для распространения (движения по линии) тепла, будучи способным противостоять перепады температур иногда связаны с нагревом.
Поэтому металлы хороши проводники как тепла, так и электричества!
Но будьте осторожны, не перепутайте их и не говорите об электрической проводимости (которая касается заряда электронов), когда вы имеете в виду теплопроводность (который связан с передачей энергии электронов), когда отвечаете на экзаменационные вопросы!
Удерживайте металлический стержень с другой конец в пламени Бунзена, и вскоре вы сделаете замечательное открытие….. Становится ГОРЯЧЕЕ!
Держите деревянную палку другим концом в огне и конец становится таким горячим, что он горит, а конец, который вы держите, остается относительно прохладно.
Тепло не распространяется через структуру стержня, потому что его состава — из чего он сделан — его структура выделяет тепло перенос электронами внутри него сделать очень сложно.
Повседневный опыт говорит вам о том, что дерево не является хорошим проводником тепла.Если вы когда-нибудь видели
микроскопический вид дерева, вы знаете, что причина в том, что дерево сделано
состоит из отдельных ячеек, которые действуют как изоляторы, потому что они не связаны между собой.
Клетки раскиданы камнями в ручье. Путешествовать по
тепло должно «перепрыгивать» с камня на камень (простите за иллюстрацию). Этот
занимает больше времени, чем с металлом, где атомы соединены вместе в
трехмерная «решетка» (связанная трехмерная структура рисунка).
Итак, если тепловая энергия применяется непосредственно к одной части твердого объекта (как на иллюстрации ниже), электроны в объекте возбуждаются. Это вызывает атомные колебания решетки, которые передаются по объекту, повышая его температуру когда они проходят. Чем ближе ссылки внутри твердого тела, тем быстрее теплопередача.
— это может показать эксперимент ниже:
Жара наносится по центру кольца.Он движется по металлическим полосам и плавит воск, удерживающий шарикоподшипник на месте. Они падают на скамейка с громким звуком. Они не все вместе! Тот, что на медная полоса падает первой, показывая, что медь является лучшим проводником высокая температура. Алюминий — худший проводник из четырех, но они ВСЕ металлы и все относящиеся к классу проводников тепла.
Если вы закрепите кубик льда на дне пробирки с водой (для этого нужно использовать груз, иначе он всплывет на поверхность, так как лед менее плотный, чем вода), а затем нагрейте воду на В верхней части трубки вы обнаружите, что вода закипит в верхней части трубки, но кубик льда останется замороженным.
Это потому, что вода плохо проводит тепло. Большая часть тепла будет перемещаться в конвекционном потоке в воде наверху пробирки, лишь небольшая его часть будет проходить вниз к кубику льда.
Сводка
Электропроводность — это метод прохождения тепла через твердое тело, в отличие от того, что происходит во время конвекции, никакого чистого движения вещества не происходит.
Это можно сравнить с цепочкой людей, передающих ведра с водой от источника, чтобы тушить пожар.Индивидуумы остаются неподвижными, более или менее, представляя молекулы или атомы в твердом теле, закрепленные в трехмерном массиве. Движение ведер представляет собой движение тепла.
Электропроводность — Energy Education
Рис. 1. Линии электропередач высокого напряжения изготавливаются из алюминия, так как он обладает высокой электропроводностью. [1]Электропроводность — это свойство материалов, которое определяет, насколько хорошо данный материал будет проводить электричество.Электропроводность тесно связана с удельным сопротивлением (которое используется чаще):
[математика] \ sigma = \ frac {1} {\ rho} [/ математика]где [math] {\ sigma} [/ math] — это проводимость (в м / Ом), а [math] \ rho [/ math] — это удельное сопротивление (в Ом / м). Чтобы определить сопротивление провода (который может быть сделан практически из чего угодно: меди, алюминия; это уравнение работает даже для дерева!), Используйте:
[математика] R = \ rho \ frac {A} {l} = \ frac {A} {\ sigma l} [/ math]где [math] A [/ math] — это площадь поперечного сечения провода (в метрах 2 ), а [math] l [/ math] — это его длина (в метрах).
Электропроводность тесно связана с электропроводностью. Электропроводность — это свойство самого материала (например, серебра), а электрическая проводимость — это свойство определенного электрического компонента (например, определенного провода).
Электропроводность можно определить как напряжение, необходимое для протекания определенного количества электрического тока. Это в значительной степени определяется количеством электронов во внешней оболочке; эти электроны определяют легкость, с которой генерируются подвижные электроны.Другой фактор — но менее важный — это количество атомов в единице объема, которое определяет количество электронов, которые будут легко перемещаться в ответ на электрическое поле. Материалы с высокой проводимостью, такие как медь и алюминий, называются проводниками. Материалы с низкой проводимостью, такие как резина и стекло, называются электрическими изоляторами (или просто изоляторами, когда нет возможности путаницы с теплоизоляцией). Другой особый класс материалов, таких как кремний и германий, находится между ними и называется полупроводниками.
Как правило, большинство металлов обладают высокой проводимостью (это еще один способ сказать, что металлы имеют тенденцию быть проводниками), потому что электроны в их внешней оболочке могут легко перемещаться. Неметаллы имеют низкую проводимость. [2]
Чтобы узнать о физике проводимости, см. Раздел «Гиперфизика».
Для дальнейшего чтения
Для получения дополнительной информации см. Соответствующие страницы ниже:

 Свинец не слишком хорошо проводит тепло и к лучшим проводникам электричества тоже не относится: удельное сопротивление составляет 0,22 Ом-кв. мм/м при сопротивлении той же меди 0,017.
Свинец не слишком хорошо проводит тепло и к лучшим проводникам электричества тоже не относится: удельное сопротивление составляет 0,22 Ом-кв. мм/м при сопротивлении той же меди 0,017.