Плавление и отвердевание кристаллических тел
Передавая телу энергию, можно перевести его из твердого состояния в жидкое (например, расплавить лед), а из жидкого — в газообразное (превратить воду в пар). Отнимая же энергию у газа, можно получить жидкость, а из жидкости — твердое тело.
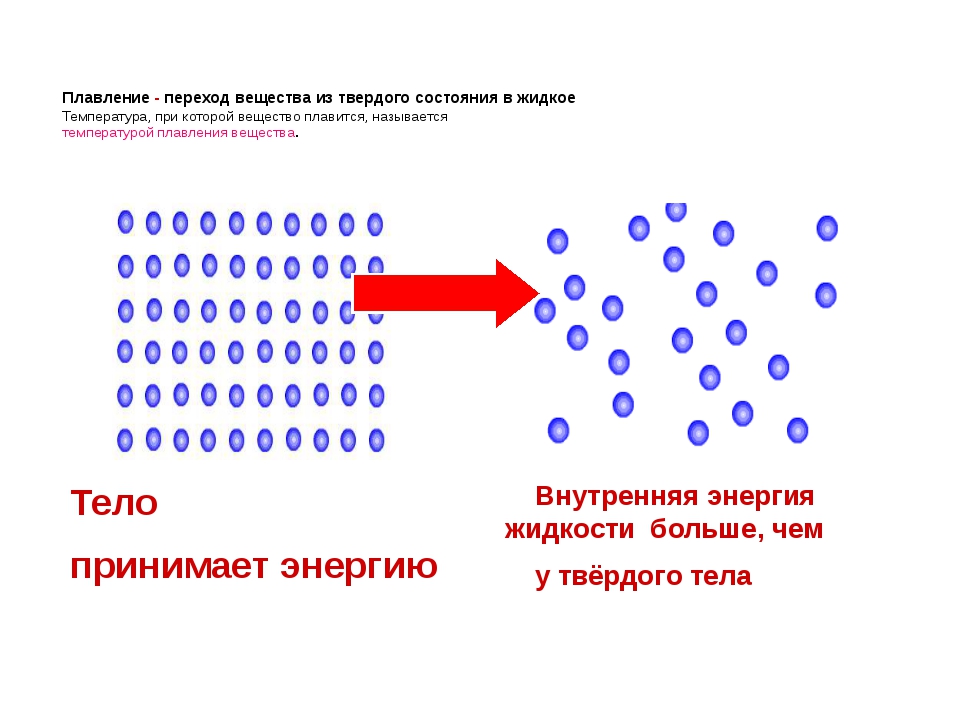
Переход вещества из твердого состояния в жидкое называют плавлением. Чтобы расплавить тело, нужно сначала нагреть его до определенной температуры. Температуру, при которой вещество плавится, называют температурой плавления вещества.
Одни кристаллические тела плавятся при низкой температуре, другие — при высокой. Лед, например, плавится при 0°С, нафталин — при 80 °С. Поместив пробирку с твердым нафталином в кипящую воду, можно получить жидкий нафталин. Кусок олова или свинца можно расплавить в стальной ложке, нагревая ее на спиртовке. Чугун же и сталь плавятся при очень высокой температуре около полутора тысяч градусов.
Переход вещества из жидкого состояния в твердое называют отвердеванием или кристаллизацией.
Чтобы началась кристаллизация расплавленного тела, оно должно остыть до опредёленной температуры.
Температуру, при которой вещество отвердевает (кристаллизуется), называют температурой отвердевания или кристаллизации.
Опыт показывает, что вещества отвердевают при той же температуре, при которой плавятся. Например, вода кристаллизуется (а лед плавится) при 0°С, чистое железо плавится и кристаллизуется при температуре 1539 °С.
Если нагревать какое-либо кристаллическое тело, то можно заметить, что его температура будет повышаться только до момента начала
Из таблицы 8 видно, в каких широких пределах лежат температуры плавления различных веществ.
Вопросы. 1. Какой процесс называют плавлением? 2. Какой процесс называют отвердеванием? 3.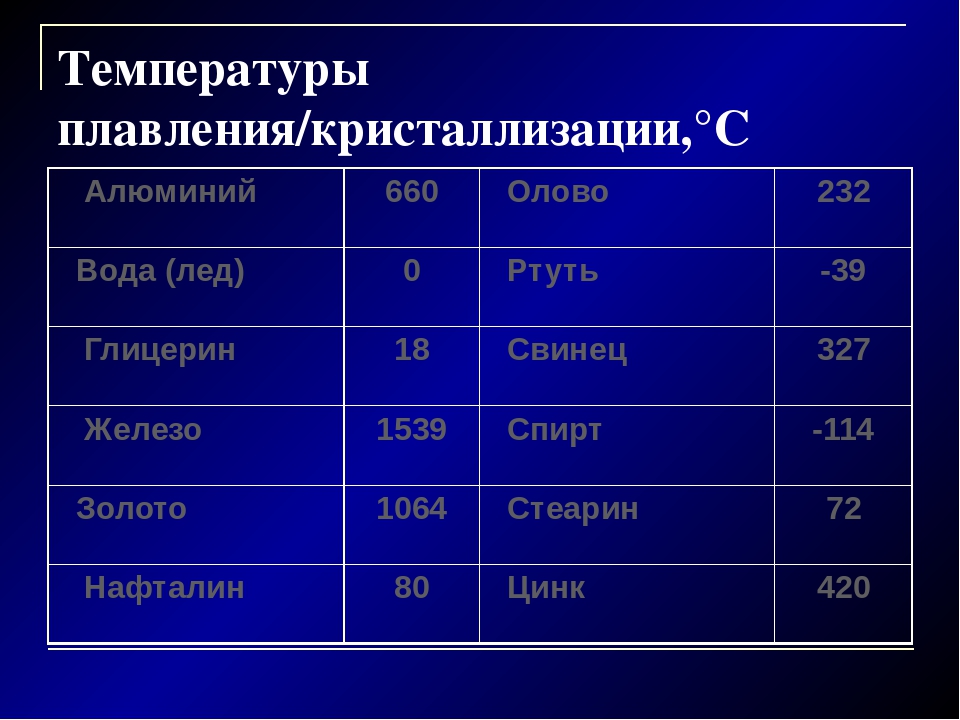 Как называют температуру, при которой вещество плавится и отвердевает?
Как называют температуру, при которой вещество плавится и отвердевает?
Упражнения.
- Сравните температуру плавления твердой ртути и твердого спирта. У какого из этих веществ температура плавления выше?
- Какой из металлов, приведенных в таблице 8, самый легкоплавкий? самый тугоплавкий?
- Будет ли плавиться свинец, если его бросить в расплавленное олово? Ответ обоснуйте. .
- Можно ли в алюминиевом сосуде расплавить цинк? Ответ обоснуйте.
- Почему для измерения температуры наружного воздуха в холодных районах применяют термометры со спиртом, а не с ртутью?
- Прочтите в конце учебника параграф «Аморфные тела. Плавление аморфных тел». Подготовьте по нему доклад.
Какую температуру называют температурой плавления вещества
ТЕМПЕРАТУРА ПЛАВЛЕНИЯ — ТЕМПЕРАТУРА ПЛАВЛЕНИЯ, температура, при которой вещество переходит из ТВЕРДОГО СОСТОЯНИЯ в жидкое. Температура плавления твердого вещества равна температуре замерзания жидкости, например, температура плавления льда, О °С, равна температуре… … Научно-технический энциклопедический словарь
ТЕМПЕРАТУРА ПЛАВЛЕНИЯ — Температура перехода твердого кристаллического тела в жидкое состояние. Температура плавления при нормальном атмосферном давлении (1013,25 гПа, или 760 мм ртутного столба) называют точкой плавления … Большой Энциклопедический словарь
Температура плавления при нормальном атмосферном давлении (1013,25 гПа, или 760 мм ртутного столба) называют точкой плавления … Большой Энциклопедический словарь
ТЕМПЕРАТУРА ПЛАВЛЕНИЯ — (Тпл), температура равновесного фазового перехода крист. (твёрдого) тела в жидкое состояние при пост. внеш. давлении. Т. п. частный случай температуры фазового перехода I рода. В табл. приведены значения Т. п. ряда в в при норм. внеш. давлении… … Физическая энциклопедия
температура плавления — Температура системы «кристаллическое тело — жидкость» в состоянии фазового равновесия. [Сборник рекомендуемых терминов. Выпуск 103. Термодинамика. Академия наук СССР. Комитет научно технической терминологии. 1984 г.] Тематики… … Справочник технического переводчика
температура плавления — температура перехода твердого кристаллического тела в жидкое состояние. Температуру плавления при нормальном атмосферном давлении (1013,25 гПа, или 760 мм рт. ст. ) называют точкой плавления. * * * ТЕМПЕРАТУРА ПЛАВЛЕНИЯ ТЕМПЕРАТУРА ПЛАВЛЕНИЯ,… … Энциклопедический словарь
) называют точкой плавления. * * * ТЕМПЕРАТУРА ПЛАВЛЕНИЯ ТЕМПЕРАТУРА ПЛАВЛЕНИЯ,… … Энциклопедический словарь
температура плавления — [melting (fusion) temperature] (Tпл, tпл) температура равновесного фазового перехода кристаллического (твердого) тела в жидкое при постоянном внешнем давлении. Температура плавления частный случай температуры фазового перехода 1 го рода. Значения … Энциклопедический словарь по металлургии
температура плавления — lydymosi temperatūra statusas T sritis Standartizacija ir metrologija apibrėžtis Temperatūra, kurioje kieta kristalinė medžiaga virsta skysčiu. atitikmenys: angl. fusion point; fusion temperature; melting point; melting temperature vok.… … Penkiakalbis aiškinamasis metrologijos terminų žodynas
температура плавления — lydymosi temperatūra statusas T sritis chemija apibrėžtis Temperatūra, kurioje kieta kristalinė medžiaga virsta skysčiu. atitikmenys: angl. fusion point; fusion temperature; melting point; melting temperature rus. температура плавления; точка… … Chemijos terminų aiškinamasis žodynas
температура плавления; точка… … Chemijos terminų aiškinamasis žodynas
температура плавления — melting temperature, Tm температура плавления. Oдна из основных характеристик данной молекулы ДНК (или гибридного ДНК/РНК дуплекса) температура, при которой происходит диссоциация 50% двойной спирали, специфична для ДНК данного вида организмов, т … Молекулярная биология и генетика. Толковый словарь.
температура плавления — lydymosi temperatūra statusas T sritis fizika atitikmenys: angl. fusion temperature; melting temperature vok. Schmelzpunkttemperatur, f; Schmelztemperatur, f rus. температура плавления, f pranc. température de fusion, f … Fizikos terminų žodynas
ТЕМПЕРАТУРА ЗАТВЕРДЕВАНИЯ (точка затвердевания) – температура, при которой жидкость превращается в твердое вещество. Для чистого вещества совпадает с его температурой плавления, т.е. температурой перехода из твердого состояния в жидкое. Строго определенную температуру затвердевания имеют лишь чистые кристаллические вещества. Аморфные же, т.е. некристаллические вещества (например, стекло, сливочное масло), затвердевают (и плавятся) в некотором интервале температур. Для таких веществ проводят различие между температурами затвердевания и плавления: под температурой затвердевания понимают температуру, при которой в системе при охлаждении появляются первые признаки твердой фазы либо при нагревании исчезают последние ее следы, а под температурой плавления – наинизшую температуру, при которой в процессе охлаждения исчезают последние следы жидкой фазы или при нагревании появляются первые ее признаки. Температура затвердевания большинства веществ немного изменяется при изменении давления: как правило, она повышается с его повышением.
Аморфные же, т.е. некристаллические вещества (например, стекло, сливочное масло), затвердевают (и плавятся) в некотором интервале температур. Для таких веществ проводят различие между температурами затвердевания и плавления: под температурой затвердевания понимают температуру, при которой в системе при охлаждении появляются первые признаки твердой фазы либо при нагревании исчезают последние ее следы, а под температурой плавления – наинизшую температуру, при которой в процессе охлаждения исчезают последние следы жидкой фазы или при нагревании появляются первые ее признаки. Температура затвердевания большинства веществ немного изменяется при изменении давления: как правило, она повышается с его повышением.
Смеси жидкостей, например воды и спиртов, тоже затвердевают (замерзают) в широком интервале температур, причем температура их замерзания всегда ниже, чем у чистого компонента с более высокой точкой замерзания. Поэтому в качестве одного из компонентов антифриза в системе охлаждения автомобилей широко применяются этиловый спирт (температура замерзания -130° С) и этиленгликоль (температура замерзания -25° С).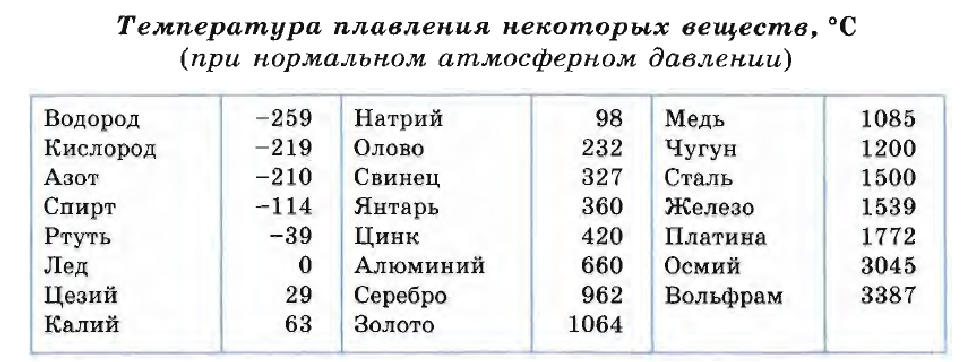 Температура, при которой замерзают последние следы жидкой смеси, может быть гораздо ниже, чем у компонента с более низкой точкой замерзания.
Температура, при которой замерзают последние следы жидкой смеси, может быть гораздо ниже, чем у компонента с более низкой точкой замерзания.
Некоторые вещества, например иод и парадихлорбензол, переходят из твердого состояния сразу в газообразное (сублимируются). У них нет ни температуры плавления, ни температуры затвердевания.
Температура затвердевания (плавления) некоторых веществТЕМПЕРАТУРА ЗАТВЕРДЕВАНИЯ (ПЛАВЛЕНИЯ) НЕКОТОРЫХ ВЕЩЕСТВ
(на уровне моря)
температура плавления – это температура при которлй тело переходит из твёрдого сост. в жидкое
Переход вещества из твердого кристаллического состояния в жидкое называется плавлением. Чтобы расплавить твердое кристаллическое тело, его нужно нагреть до определенной температуры, т. е. подвести тепло. Температура, при которой вещество плавится, называется температурой плавления вещества.
Если ответ по предмету Физика отсутствует или он оказался неправильным, то попробуй воспользоваться поиском других ответов во всей базе сайта.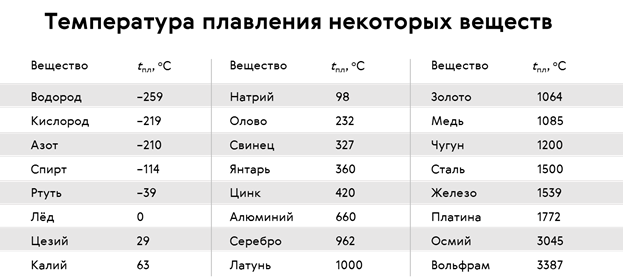
плавление и отвердевание
План урока:
1 Оргмомент
2 Проверка домашнего задания
3 Изучение темы.
4 Закрепление.
5 Д/з.
1. Объявление эпиграфа, целей и плана урока целей. Проверка готовности к уроку
2.Рассказать об агрегатных состояниях вещества. Об особенностях строения веществ в различных агрегатных состояниях. – 1 ученик
физическая разминка:
-Почему в медицинских термометрах используют ртуть, а не спирт или эфир? (у ртути большая теплопроводность и меньшая теплоемкость, а это сокращает время измерения)
-Почему
металлические предметы, находящиеся в комнате, на ощупь
кажутся холоднее, чем деревянные? ( При соприкосновении с
деревянным предметом, нагревается только его небольшой
участок под пальцем.
3. Новая тема: Плавление и отвердевание веществ.
Учитель: Я думаю, что ваш жизненный опыт позволит вам самостоятельно узнать, что такое плавление и отвердевание, а так же выяснить, как происходит плавление и отвердевание на основе знаний о строении веществ.
И сейчас вам предстоит исследовать процесс плавления льда и парафина. Для этого у вас имеются карточки с описанием хода исследования и вопросы, на которые необходимо получить ответы. На данную работу отводится 20 минут.
Содержание карточки:
Исследуйте плавления кристаллического вещества.
Опустите
в калориметр лед (снег). Используя термометр, наблюдайте за
температурой тающего льда.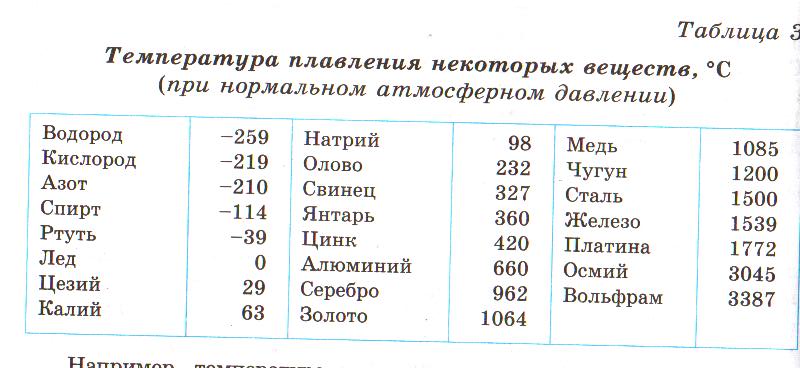 Ответьте на вопросы и заполните
таблицу:
Ответьте на вопросы и заполните
таблицу:
а) определение плавления (отвердевания) вещества.
б) изменяется ли температура в процессе плавлении (отвердевания) кристаллических веществ?
в) как называют температуру, при которой плавится (отвердевает) вещество?
г) объяснить процесс плавления( отвердевания) на основе знаний о строении вещества.
д) как изменяется внутренняя энергия вещества при плавлении (отвердевании)?
е) изучить график плавления и отвердевания вещества.
4. Закрепление.
— упражнение 7 ( вопросы 1,3)
-Построить график плавления и отвердевания ртути.
5. подведение итогов.
6. Д/з п.13,14. упр 7 (2,4,5).
дополнительно:
особенности плавления и отвердевания аморфных веществ.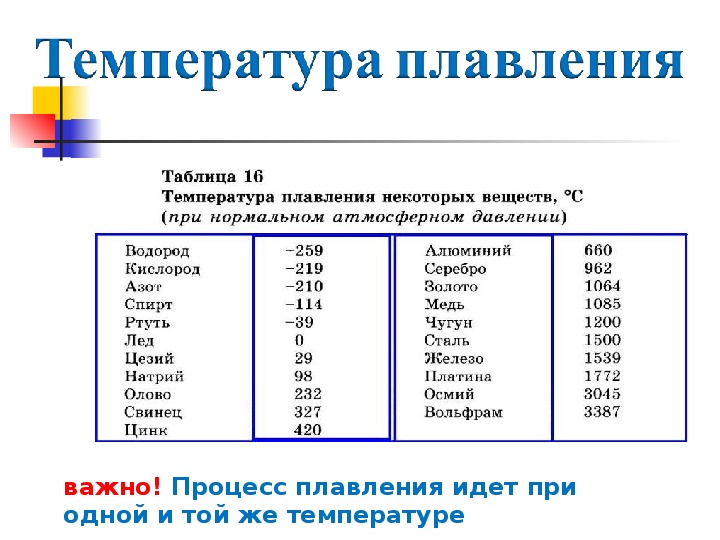
ТЕМПЕРАТУРА ПЛАВЛЕНИЯ — это… Что такое ТЕМПЕРАТУРА ПЛАВЛЕНИЯ?
- ТЕМПЕРАТУРА ПЛАВЛЕНИЯ
ТЕМПЕРАТУРА ПЛАВЛЕНИЯ, температура, при которой вещество переходит из ТВЕРДОГО СОСТОЯНИЯ в жидкое. Температура плавления твердого вещества равна температуре замерзания жидкости, например, температура плавления льда, О °С, равна температуре замерзания воды.
Научно-технический энциклопедический словарь.
- ТЕМПЕРАТУРА КИПЕНИЯ
- ТЕМПЕРАТУРА
Смотреть что такое «ТЕМПЕРАТУРА ПЛАВЛЕНИЯ» в других словарях:
ТЕМПЕРАТУРА ПЛАВЛЕНИЯ — Температура перехода твердого кристаллического тела в жидкое состояние. Температура плавления при нормальном атмосферном давлении (1013,25 гПа, или 760 мм ртутного столба) называют точкой плавления … Большой Энциклопедический словарь
ТЕМПЕРАТУРА ПЛАВЛЕНИЯ — (Тпл), температура равновесного фазового перехода крист.
 (твёрдого) тела в жидкое состояние при пост. внеш. давлении. Т. п. частный случай температуры фазового перехода I рода. В табл. приведены значения Т. п. ряда в в при норм. внеш. давлении… … Физическая энциклопедия
(твёрдого) тела в жидкое состояние при пост. внеш. давлении. Т. п. частный случай температуры фазового перехода I рода. В табл. приведены значения Т. п. ряда в в при норм. внеш. давлении… … Физическая энциклопедиятемпература плавления — Температура системы «кристаллическое тело — жидкость» в состоянии фазового равновесия. [Сборник рекомендуемых терминов. Выпуск 103. Термодинамика. Академия наук СССР. Комитет научно технической терминологии. 1984 г.] Тематики… … Справочник технического переводчика
температура плавления — температура перехода твердого кристаллического тела в жидкое состояние. Температуру плавления при нормальном атмосферном давлении (1013,25 гПа, или 760 мм рт. ст.) называют точкой плавления. * * * ТЕМПЕРАТУРА ПЛАВЛЕНИЯ ТЕМПЕРАТУРА ПЛАВЛЕНИЯ,… … Энциклопедический словарь
температура плавления — [melting (fusion) temperature] (Tпл, tпл) температура равновесного фазового перехода кристаллического (твердого) тела в жидкое при постоянном внешнем давлении.

температура плавления — lydymosi temperatūra statusas T sritis Standartizacija ir metrologija apibrėžtis Temperatūra, kurioje kieta kristalinė medžiaga virsta skysčiu. atitikmenys: angl. fusion point; fusion temperature; melting point; melting temperature vok.… … Penkiakalbis aiškinamasis metrologijos terminų žodynas
температура плавления — lydymosi temperatūra statusas T sritis chemija apibrėžtis Temperatūra, kurioje kieta kristalinė medžiaga virsta skysčiu. atitikmenys: angl. fusion point; fusion temperature; melting point; melting temperature rus. температура плавления; точка… … Chemijos terminų aiškinamasis žodynas
температура плавления — melting temperature, Tm температура плавления. Oдна из основных характеристик данной молекулы ДНК (или гибридного ДНК/РНК дуплекса) температура, при которой происходит диссоциация 50% двойной спирали, специфична для ДНК данного вида организмов, т … Молекулярная биология и генетика.
 Толковый словарь.
Толковый словарь.температура плавления — lydymosi temperatūra statusas T sritis fizika atitikmenys: angl. fusion temperature; melting temperature vok. Schmelzpunkttemperatur, f; Schmelztemperatur, f rus. температура плавления, f pranc. température de fusion, f … Fizikos terminų žodynas
Книги
- Характеристики углеводородов. Анализ численных данных и их рекомендованные значения. Справочное издание, Ю. А. Лебедев, А. Н. Кизин, Т. С. Папина, И. Ш. Сайфуллин, Ю. Е. Мошкин. В настоящей книге представлены важнейшие численные характеристики ряда углеводородов, среди которых рассматриваются следующие физико-химические константы: молекулярная масса, температура… Подробнее Купить за 3578 грн (только Украина)
- Характеристики углеводородов. Анализ численных данных и их рекомендованные значения. Справочное издание, Лебедев Ю.А.. В настоящей книге представлены важнейшие численные характеристики ряда углеводородов, среди которых рассматриваются следующие физико-химические константы: молекулярная масса, температура… Подробнее Купить за 2766 руб
- Характеристики углеводородов.
 Анализ численных данных и их рекомендованные значения. Справочное издание, Юрий Лебедев. В настоящей книге представлены важнейшие численные характеристики ряда углеводородов, среди которых рассматриваются следующие физико-химические константы: молекулярная масса, температура… Подробнее Купить за 2066 грн (только Украина)
Анализ численных данных и их рекомендованные значения. Справочное издание, Юрий Лебедев. В настоящей книге представлены важнейшие численные характеристики ряда углеводородов, среди которых рассматриваются следующие физико-химические константы: молекулярная масса, температура… Подробнее Купить за 2066 грн (только Украина)
Плавление и отвердевание кристаллических тел
Чтобы расплавить твердое кристаллическое тело, ему необходимо передать некоторое количество теплоты.
Проделаем опыт. Наполним коническую колбу мелкими кусочками льда. Вставив в нее термометр и закрыв колбу пробкой, начнем ее нагревать (рис. 78). Мы увидим, что ни при –15 °С, ни при –10 °С, ни при —5 °С со льдом ничего особенного происходить не будет: он по-прежнему будет оставаться твердым. Изменения начнут происходить при 0 °С. С этого момента лед будет плавиться, превращаясь в воду, и, до тех пор пока весь лед не растает, его температура останется неизменной. Температура вещества в колбе вновь начнет повышаться лишь после того, как в ней останется одна вода. Когда эта вода нагреется до 20 °С, выключим горелку.
Температура вещества в колбе вновь начнет повышаться лишь после того, как в ней останется одна вода. Когда эта вода нагреется до 20 °С, выключим горелку.
Если построить график зависимости температуры вещества в колбе от времени, то мы получим линию, изображенную на рисунке 79.
Участок АВ этого графика описывает нагревание льда от —20 до 0 °С. Благодаря контакту с горячей колбой (нагреваемой горелкой) средняя кинетическая энергия молекул льда увеличивается и температура льда повышается.
На участке ВС вся энергия, получаемая содержимым колбы, тратится на разрушение кристаллической решетки льда: его молекулы перестраиваются таким образом, что вещество становится жидким. Средняя кинетическая энергия молекул при этом остается неизменной. Неизменной поэтому оказывается и температура вещества.
Температура, при которой плавится вещество, называется температурой плавления этого вещества.
Участок CD описывает нагревание воды, образовавшейся после плавления льда.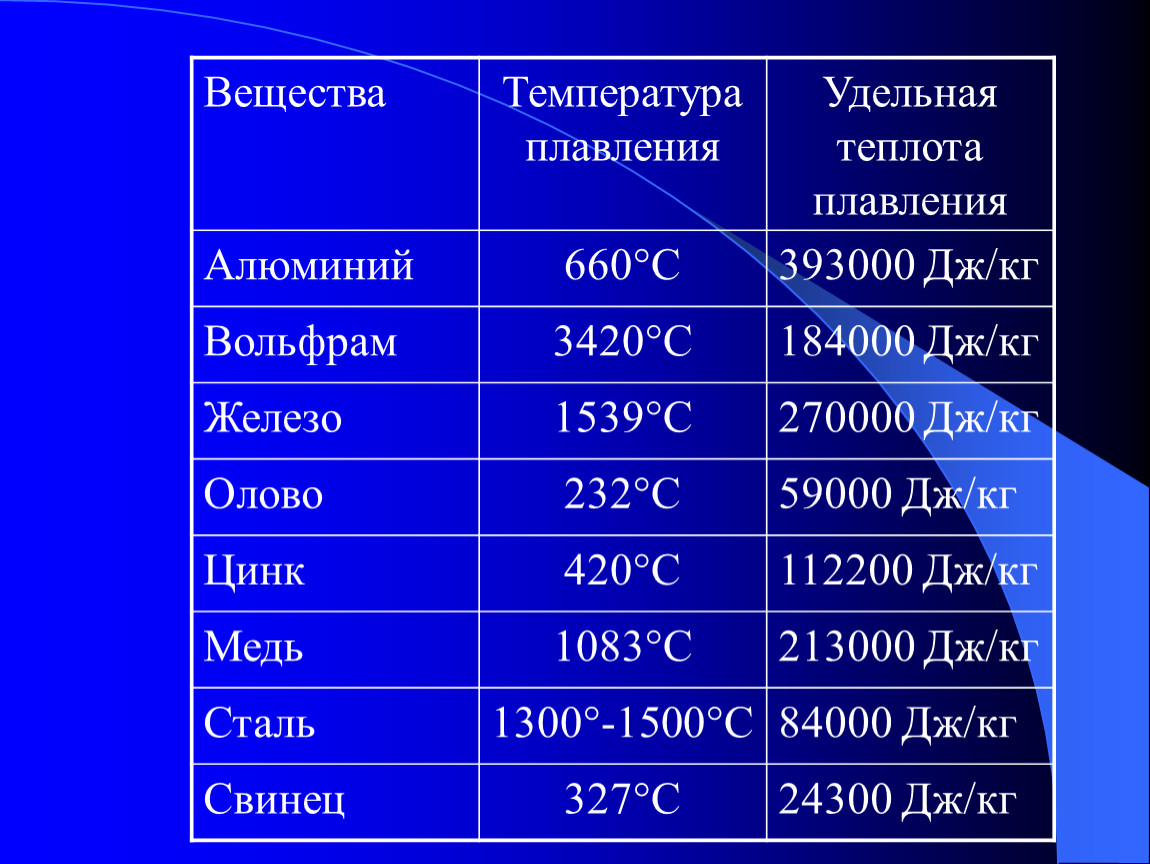 Получая энергию от нагревателя, молекулы воды начинают двигаться все более и более интенсивно. Их средняя кинетическая энергия возрастает, и температура воды повышается.
Получая энергию от нагревателя, молекулы воды начинают двигаться все более и более интенсивно. Их средняя кинетическая энергия возрастает, и температура воды повышается.
На рисунке 80 изображен график обратного процесса. Сначала вода, отдавая энергию, охлаждается от 20 до 0 °С. При этом ее молекулы движутся все менее и менее интенсивно. При 0 °С они начинают выстраиваться в определенном порядке, образуя кристаллическую решетку льда. Пока этот процесс (называемый кристаллизацией) не завершится, температура вещества не изменится.
Температура, при которой вещество отвердевает (кристаллизуется), называется температурой кристаллизации вещества.
Из графика (см. рис. 80) видно, что температура, при которой вода превращается в лед, совпадает с температурой, при которой лед превращается в воду. Это не случайный факт. Опыты показывают, что любое вещество кристаллизуется и плавится при одной и той же температуре.
Температуру плавления (и отвердевания) различных веществ можно найти в таблице 9. Из этой таблицы видно, что одни вещества (например, водород и кислород) плавятся (и отвердевают) при очень низких температурах, другие (например, осмий и вольфрам) — при очень высоких.
Из этой таблицы видно, что одни вещества (например, водород и кислород) плавятся (и отвердевают) при очень низких температурах, другие (например, осмий и вольфрам) — при очень высоких.
Металлы, плавящиеся при температуре выше 1650 °С, называют тугоплавкими (титан, хром, молибден и др.). Самой высокой температурой плавления среди них обладает вольфрам (около 3400 °С). Тугоплавкие металлы и их соединения используют в качестве жаропрочных материалов в самолетостроении, ракетной и космической технике, атомной энергетике и т. д.
При плавлении вещество получает энергию. При кристаллизации оно, наоборот, отдает ее в окружающую среду. Получая количество теплоты, выделяющееся при кристаллизации, среда нагревается. Это хорошо известно многим птицам. Недаром их можно заметить зимой во время мороза сидящими на льду, который покрывает реки и озера. Из-за выделения энергии .при образовании льда воздух над ним оказывается на несколько градусов теплее, чем в лесу на деревьях, и птицы этим пользуются.
1. Какой процесс называют плавлением? 2. Что такое кристаллизация? 3. Что происходит с температурой вещества при плавлении и кристаллизации? 4. Чему равна температура плавления льда? олова? меди? 5. При какой температуре затвердевает жидкий азот? ртуть? расплавленное золото? 6. На что расходуется энергия нагревателя, поглощаемая веществом при плавлении? Почему температура вещества при этом не изменяется? 7. Опишите, что происходит с веществом в отрезки времени, соответствующие различным участкам графиков, изображенных на рисунках 79 и 80. Какие агрегатные состояния соответствуют точкам А, В, С и D? 8. Почему зимой птицы садятся на лед, покрывающий реки и озера?
Схема плавления — Физика — Презентации
« Агрегатные состояния вещества. Плавление и отвердевание кристаллических тел »
Урок физики в 8 классе
Ек молекул «АГРЕГАТНЫЕ СОСТОЯНИЯ ВЕЩЕСТВА
Газообразное
Твердое
Жидкое
Еп » Ек
молекул
Еп « Ек
молекул
Еп Ек
молекул
Плавление — переход вещества из твердого состояния в жидкое
Внутренняя энергия жидкости
больше, чем
у твёрдого тела
Тело
принимает энергию
1. Как изменяется внутренняя энергия вещества?
Как изменяется внутренняя энергия вещества?
2. Как изменяется энергия молекул и их расположение?
3. Как изменяется характер движения молекул?
4. В какой момент тело начнет плавиться?
5. Изменяются ли молекулы вещества при плавлении?
6. Как изменяется температура вещества при плавлении?
7. Сравните внутреннюю энергию твердого тела и жидкости?
нагревание
нагревание
1. При нагревании увеличивается температура тела.
2. Скорость колебания частиц возрастает.
3. Увеличивается внутренняя энергия тела.
4. Когда тело нагревается до температуры плавления, кристаллическая решетка начинает разрушаться.
5. Энергия нагревателя идет на разрушение решетки кристалла.
Поглощение Q
плавление
Температуру, при которой вещество плавится, называют температурой плавления вещества .
Каждое вещество имеет собственную температуру плавления (стр.32).
нагревание
Физическая величина, показывающая какое количество теплоты
необходимо для превращения 1 кг кристаллического вещества,
взятого при температуре плавления, в жидкость той же температуры, называется удельной теплотой плавления
(стр.37)
Поглощение Q
плавление
(«ламбда»)
Обозначается:
Единица измерения:
1
t , ºC
2
t , мин
Кристаллизация — переход вещества из жидкого состояния в твердое
Внутренняя энергия кристалла
меньше, чем
жидкости
Жидкость
отдает энергию
1. Как изменяется внутренняя энергия вещества?
2. Как изменяется энергия молекул и их расположение?
Как изменяется энергия молекул и их расположение?
3. Как изменяется характер движения молекул?
4. Когда тело начнет кристаллизоваться?
5. Изменяются ли молекулы вещества при кристаллизации?
6. Как изменяется температура вещества при отвердевании?
7. Сравните внутреннюю энергию жидкости и твёрдого тела.
охлаждение
охлаждение
1. При охлаждении уменьшается температура жидкости.
2. Скорость движения частиц уменьшается.
3. Уменьшается внутренняя энергия жидкости.
4. Когда тело охлаждается до температуры плавления, кристаллическая решетка начинает восстанавливаться.
Выделение Q
отвердевание
t плавления = t отвердевания
Температуру, при которой вещество отвердевает, называют температурой отвердевания .
Количество теплоты, выделяющееся при отвердевании (кристаллизации), равно количеству теплоты, поглощённому при плавлении.
нагревание
охлаждение
График
плавления и кристаллизации
D
Поглощение Q
Выделение Q
F
B
плавление
отвердевание
C
E
t плавления = t отвердевания
G
А
Как изменялась внутренняя энергия вещества,
характер движения и взаимодействия молекул
на каждом участке графика?
ЗАПОМНИ:
- При плавлении происходит разрушение кристаллической решётки. Расстояние между частицами вещества увеличивается. Соответственно уменьшается потенциальная энергия частиц.
- При отвердевании вещества происходит образование кристаллической решетки, потенциальная энергия частиц увеличивается .
Рассмотрите график и ответьте на вопросы:
1. В какой момент времени начался процесс плавления вещества?
2. В какой момент времени вещество кристаллизовалось?
3. Чему равна температура плавления вещества? Температура кристаллизации?
4. Сколько длилось: а) нагревание твердого тела ;
б) плавление вещества ;
с) остывание жидкости?
ДОМАШНЕЕ ЗАДАНИЕ:
§ 12 – 15, читать, отвечать на вопросы;
Упр.8 № 1 – 3
Доклад ( § 3, стр-182)- Овсянникова Диана
Спасибо за урок!
Желаю успехов!
Литература:
1. Перышкин А.В. Физика 7 кл.- Москва: Дрофа, 2010.
2. Лукашик В.И., Иванова Е.В. Сборник задач по физике 7-9.- Москва: Просвещение, 2008.
3.Источники иллюстраций, Интернет-ресурсы: http://video.yandex.ru/#search?text=%D0%B2%D0%B8%D0%B4%D0%B5%D0%BE%D1%80%D0%BE%D0%BB%D0%B8%D0%BA%D0%B8%20%D0%BF%D0%BE%20%D1%84%D0%B8%D0%B7%D0%B8%D0%BA%D0%B5%208%20%D0%BA%D0%BB%D0%B0%D1%81%D1%81%20%D0%BF%D0%BB%D0%B0%D0%B2%D0%BB%D0%B5%D0%BD%D0%B8%D0%B5%20%D0%B8%20%D0%BA%D1%80%D0%B8%D1%81%D1%82%D0%B0%D0%BB%D0%BB%D0%B8%D0%B7%D0%B0%D1%86%D0%B8%D1%8F&where=all&id=31904860-10-12
http://class-fizika.narod.ru/
Что представляет собой капиллярный метод определения температуры плавления?
Большинство фармакопеи рекомендуют для определения температуры плавления капиллярный метод, однако в терминах «температура плавления», «точка плавления» и «область плавления» остается некоторое различие.
Согласно Британской фармакопее 1968 г., отмечают температуру, при которой вещество плавится, на что указывает образование отчетливого мениска. Исправленная температура рассматривается как точка плавления вещества. Если в монографии указан интервал плавления, точка плавления испытуемого вещества должна находиться в указанных пределах.
По Фармакопее США XVII для фармакопейных целей область плавления или температура плавления твердого вещества определяется как та температура, в пределах которой, или та точка, при которой столбик твердого вещества спадается и полностью расплавляется.
Температура, при которой столбик вещества четко спадается вдоль стенок капилляра в любой его точке, считается началом плавления, и температура, при которой вещество полностью расплавлено, считается концом плавления. Эти две температуры должны находиться в указанных пределах.
Международная фармакопея, Первое издание, рекомендовала отмечать начало плавления по возникновению первых капель расплавленного вещества, а конец плавления по образованию отчетливого мениска.
Во Втором издании Международной фармакопеи внесено изменение в отношении определения окончания плавления: «областью (интервалом) плавления вещества является интервал между исправленной температурой, при которой столбик вещества начинает спадаться или на стенке капилляра образуются капли, и исправленной температурой, при которой все вещество расплавлено, на что указывает отсутствие твердой фазы».
Фармакопея Скандинавских стран, как и Второе издание Международной фармакопеи, определяет «область плавления», указывая одновременно, что термин «точка плавления между с° и д°» для вещества означает, что температура, при которой ‘вещество полностью расплавлено, должна быть не менее с° и не более д°.
Согласно Государственной фармакопее СССР X издания, практически определяют температурный интервал плавления, т. е. интервал между началом плавления — появлением первых капель жидкости, и концом плавления — полным превращением вещества в жидкое состояние. Для большинства фармакопейных препаратов этот интервал не должен превышать 2°.
Некоторые приведенные выше фармакопейные определения температуры плавления в зависимости от изменений вещества при плавлении обобщены в табл. 2.
При выборе определения «температура плавления» по капиллярному методу используются показатели, которые больше всего приближаются к истинной температуре плавления, а также могут содержать определенную информацию о чистоте исследуемого вещества.
Предлагаем рассмотреть с этой точки зрения отдельные стадии (см. табл. 2), наблюдаемые при нагревании в капилляре вещества А, содержащего примесь другого вещества Б, при условии, что смесь этих двух веществ плавится при определенной эвтектической температуре (Т3).
Таблица 2
{mosimage}
БФ 68 — Британская фармакопея 1968 г.
МФ I -Международная фармакопея, Первое издание.
СШАXVII -Фармакопея США, XVII издание.
МФ II -Международная фармакопея, Второе издание.
ГФ X -Государственная фармакопея СССР, X издание.
Сканд. — Фармакопея Скандинавских стран.
ГДР 7 -Фармакопея ГДР, VII издание.
В процессе нагревания при достижении температуры Тэ примесь вещества Б, образующая эвтектическую смесь с веществом А, будет плавиться. Так как содержание примеси незначительно, то это изменение может остаться незамеченным. При повышении температуры частицы вещества начнут плавиться (T1), затем столбик твердого вещества начнет оседать и уменьшаться (Т2). При определенной температуре (Т3) расплавленное вещество образует отчетливый мениск и, наконец, при температуре (Т4), несколько отличающейся от температуры плавления абсолютно чистого вещества (Т), расплавятся последние частицы твердого тела.
Наблюдение начала плавления при температуре Тэ может указывать на содержание примеси, однако, используя капиллярный метод, невозможно получить данные о количественном содержании примеси, тем более что, как было сказано выше, при незначительном содержании примеси эта температура, как правило, остается незамеченной. С другой стороны, начало плавления при температуре Т, указывает на наличие примеси, так как эта температура будет тем ниже, чем больше содержание примеси. Эта температура не имеет определенного физического значения для смеси двух веществ и допускает лишь приблизительную оценку содержания примесей. Тем не менее определение начала плавления по образованию первых капель жидкости имеет практическое преимущество, так как позволяет отмечать изменение состояния вещества. Температура, при которой наблюдается оседание столбика, менее удобна в этом отношении.
Температура Тз, при которой образуется отчетливый мениск, предпочитается некоторыми исследователями, в то время как другие считают, что ее определение не имеет практического значения.
Температура Т4 больше всего приближается к истинной температуре плавления чистого вещества и поэтому имеет определенное значение при испытаниях на подлинность, в то время как разница в температурах Т и Т4 может быть показателем содержания примеси.
Высокоочищенные вещества имеют обычно резко выраженную температуру плавления, т. е. существует небольшая разница (порядка 1° или менее) между началом и концом плавления.
Чистота исходного сырья, наличие изомеров или других химических примесей, образовавшихся в процессе производства, а также присутствие следов растворителей определяют свойства конечного продукта и оказывают влияние на характер плавления.
В фармакопейном анализе при определении температуры плавления капиллярным способом в первую очередь преследуется цель подтверждения подлинности анализируемого вещества. Чистота вещества может быть также приблизительно установлена, если отмечаются начальная температура T1 и конечная температура плавления Т4. Поэтому большинство фармакопеи рекомендует определять температурный интервал плавления, который обозначается термином «температура плавления». В этом случае так называемая исправленная температура плавления обычно должна находиться в определенных указанных пределах.
Простейшим прибором для определения температуры плавления капиллярным способом служит открытый стакан, наполненный подходящей жидкостью и снабженный мешалкой (рис. 5). Некоторые другие приборы, рекомендуемые различными фармакопеями, приведены иа рис 6, 7, 8 и 9.
{mosimage}
Определение температуры плавления по Государственной фармакопее СССР X издания производят в приборе из термостойкого стекла. Прибор (см. рис. 6) состоит из круглодонной колбы емкостью 100-150 мл с горлом длиной 20 см, диаметром 3-4 см и вставленной в него пробиркой диаметром 2-2,5 см, отстоящей от дна колбы на 1 см.
{mosimage}
Колбу заполняют на 3/4 объема шара одной из следующих жидкостей:
а) водой для веществ с температурой плавления ниже 80°,
б) концентрированной серной кислотой для вещества с температурой плавления 80-260°,
в) раствором 30 частей сульфата калия в 70 частях (весовых) концентрированной серной кислоты, для веществ с температурой плавления выше 260°.
Для получения раствора смесь ингредиентов кипятят в течение 5 минут при энергичном перемешивании, так как при недостаточном перемешивании могут образоваться два слоя, в результате чего может произойти взрывообразное закипание смеси.
Вместо концентрированной серной кислоты можно применять вазелиновое масло и жидкие силиконы. Однако некоторые силиконы имеют тенденцию к полимеризации, что может выражаться в увеличении вязкости среды и привести к неравномерному нагреванию. Вазелиновое масло темнеет при многократном использовании.
Прибор снабжают укороченным термометром с ценой деления не менее 0,5°, укрепленным при помощи пробки с прорезом так, чтобы конец его отстоял от дна внутренней пробирки прибора на 1 см.
Методика определения температуры плавления в капилляре (ГФХ).
Метод 1 и 1а — для твердых веществ, легко превращаемых в порошок: устойчивых при нагревании (метод 1) и неустойчивых при нагревании (метод 1а).
Если нет других указаний, тонко измельченное вещество предварительно сушат в вакуум-эксикаторе над серной кислотой |в течение 24 часов или при температуре 100-105° в течение 2 часов. Высушенное вещество помещают в капиллярную трубку диаметром 0,9-1,2 мм, длиной 6-8 см, с толщиной стенки 0,1-0,15 ,мм, запаянную с одного конца. Для уплотнения вещества капилляр многократно бросают в стеклянную трубку высотой 80 см, поставленную вертикально на стекло, или уплотняют с помощью капиллярной палочки. Высота слоя в капиллярной трубке должна быть 3-4 мм. Капиллярную трубку с веществом сохраняют до начала определения в эксикаторе.
Во внутреннюю пробирку прибора помещают термометр так, чтобы его конец отстоял от дна пробирки на 1 см. Нагревание проводят сначала быстро, а затем регулируют его так, чтобы к моменту плавления была достигнута необходимая скорость подъема температуры, указанная ниже.
За 10° до ожидаемого начала плавления капиллярную трубку с веществом вносят в прибор, опуская ее на нитке или другим каким-либо способом, например быстро вынув термометр; прикрепляют к нему капиллярную трубку с веществом с помощью резинового колечка или тонкой проволоки и снова вносят в прибор. Капилляр помещают таким образом, чтобы запаянный конец его находился на уровне середины ртутного шарика термометра.
Продолжают нагревание со скоростью:
для веществ, плавящихся по методу 1, в зависимости от определяемой температуры;
0,5-1° в минуту при определении температуры плавления ниже 100°;
1-1,5° в минуту при определении температуры плавления от 100 до 150°;
1,5-2° в минуту при определении температуры плавления выше 150°.
Для веществ, плавящихся по методу 1а — 3±0,5° в минуту.
Проводят не менее двух определений; за температуру плавления принимают среднее значение нескольких определений, проведенных в одинаковых условиях и отличающихся друг от друга не более чем на 1°.
Метод 2. а) Для мягких веществ. Капиллярную трубку длиной 6 см и внутренним диаметром 1-2 мм, открытую с обоих концов, погружают в вещество так, чтобы оно заполнило нижнюю часть трубки и образовался слой высотой 10 мм.
б) Для твердых веществ. Испытуемое вещество расплавляют на бане при возможно более низкой температуре, хорошо перемешивают и набирают его в капиллярную трубку, как указано выше (см. метод 2а). Капилляр охлаждают при температуре не выше 10° в течение 24 часов или на льду в течение 2 часов. С заполненным тем или другим способом капилляром проводят определение температуры плавления по методу 1.
За температуру плавления принимают ту температуру, при которой столбик вещества становится жидким и поднимается в некоторых случаях по капилляру.
Необходимо проводить два определения и брать средний результат: расхождение между двумя определениями не должно превышать 1°.
Ни колба, ни пробирка во время определения не должны быть закрыты герметически.
Согласно Второму изданию Международной фармакопеи, небольшое количество мелко измельченного вещества сушат в вакуум-эксикаторе над силикагелем или пятиокисью фосфора в течение 24 часов или при температуре, указанной в фармакопейной статье.
Переносят высушенный порошок в капилляр и уплотняют порошок постукиванием капилляра о твердую поверхность таким образом, чтобы получить столбик вещества высотой около 3 мм. Вносят капилляр в баню, нагретую на 5° ниже ожидаемой температуры плавления, и регулируют подъем температуры на 1° в минуту, если это не указано отдельно. Капилляр должен быть помещен в баню таким образом, чтобы его закрытый конец находился посередине шарика ртути термометра.
Если нет специальных указаний, отмечают температуру, при которой вещество начинает образовывать капли или спадаться, и температуру, при которой вещество полностью расплавлено, на что указывает исчезновение твердой фазы.
К показаниям температуры прибавляют поправку на отклонение показаний термометра, применяемого в опыте, от показаний стандартного термометра (см. ниже раздел «Термометр»).
Если термометр, калиброванный на полное погружение, используется в условиях опыта частично погруженным, для определения поправки на выступающий столбик ртути необходим вспомогательный термометр. Эти два термометра должны помещаться в стеклянной трубке, укрепленной над поверхностью нагреваемой бани. В момент плавления вещества отмечают как показания основного, так и показания вспомогательного термометра, прикрепленного таким образом, чтобы шарик ртути его находился на половине расстояния между ожидаемой температурой плавления и поверхностью нагреваемой жидкости. Иногда отмечают среднюю температуру столбика ртути над жидкостью, заполняющей баню, т. е. температуру в средней точке выступающего столбика.
Поправка на выступающий столбик ртути определяется по формуле:
0,00015N(T-t),
где Т — температура основного термометра; t — температура вспомогательного термометра; N — длина столбика в градусах между поверхностью бани и шариком ртути вспомогательного термометра.
Термометры, калиброванные на частичное погружение, следует помещать в прибор точно по метке. Если средняя температура выступающего столбика термометра, используемого в опыте, отличается от температуры, при которой термометр был калиброван, необходимо вносить соответствующую поправку на разность температур. Для этой цели должны быть известны условия калибрования термометра. В этом случае поправку рассчитывают по приведенной выше формуле, в которой значение Т заменено на Тс, что означает среднюю температуру выступающего столбика во время калибрования термометра.
Прибор для определения температуры плавления капиллярном способом по Чехословацкой фармакопее III издания состоит из металлического нагревательного элемента, сделанного преимущественно из алюминия в виде призмы со скошенными углами и с отверстиями для термометра и капилляра, а также с отверстием для наблюдения вещества в капилляре и ручки. Общий вид прибора в нескольких проекциях приведен на рис. 10. Для изоляции тепла прибор обвертывают асбестом.
В качестве источника тепла используют обычную горелку. Вещество в капилляре наблюдают
с помощью увеличительного стекла в проходящем дневном свете или в свете электрической лампы. Пока вещество остается твердым порошком, свет через горизонтальный канал виден очень слабо, но, когда вещество расплавлено, свет становится ярким.
Определение температуры плавления в капилляре используется для идентификации веществ в аптеке и является обязательным. В сомнительных случаях основной является температура, найденная по методу Кофлера под микроскопом и указанная в Чехословацкой фармакопее. В отдельном приложении к этой фармакопее приводится список температур плавления для капиллярного метода.
{mosimage}
Какие факторы влияют на определение температуры плавления капиллярным методом?
Теоретически чистое вещество должно иметь постоянную температуру плавления независимо от того, где и кем проводилось определение. Однако, подобно другим методам, определение температуры плавления подвержено на практике влиянию различных факторов.
Сюда могут относиться:
различие в образце, взятом для анализа, и в обработке, которой подвергается образец,
различие в приборах,
различие среди термометров,
изменение в скорости подъема температуры,
различие в комнатной температуре и, наконец, различие среди персонала, выполняющего определение, их методика и интерпретации температуры плавления.
Учет и оценка степени влияния всех факторов на результаты опыта являются важной частью определения температуры плавления.
26.05.2015
Характеристики твердого, жидкого и газообразного состояний
В разделах 1.3 и 2.5A3, мы отметили, что физические свойства конкретного вещества определяют его состояние при комнатной температуре. Если и его нормальная температура плавления, и его нормальное кипение температура ниже комнатной (20 ° C), при нормальной температуре вещество является газом. условия. Нормальная температура плавления кислорода составляет -218 ° C; его нормальное кипение точка -189 ° C.Кислород — это газ при комнатной температуре. Если нормальное плавление точка вещества ниже комнатной температуры, вещество является жидкостью при комнатная температура. Бензол плавится при 6 ° C и кипит при 80 ° C; это жидкость при комнатной температуре. Если и нормальная температура плавления, и нормальное кипение точки выше комнатной температуры, вещество твердое. Натрия хлорид плавится при 801 ° C и кипит при 1413 ° C. Хлорид натрия — твердое вещество под нормальные условия. Рисунок 9.1 иллюстрирует взаимосвязь между физическими состояние и нормальные температуры плавления и кипения.
| РИСУНОК 9.1 Физическое состояние относительно нормальных точек плавления и кипения. Обратите внимание, что твердые вещества плавятся и кипят выше комнатной температуры, жидкости плавятся ниже комнатной температуры и кипят выше комнатной температуры, а газы плавятся и кипят ниже комнатной температуры. |
A. Форма и объем
Твердое тело имеет фиксированную форму и объем, которые не меняются вместе с формой его контейнера.Рассмотрим камень и его размер и форма, независимо от того, куда вы его положите. Жидкость имеет постоянный объем, но ее форма соответствует форме емкости. Рассмотрим образец молока. Его объем остается неизменным, кладете ли вы его в блюдце для кошки или в стакан для себя; ясно, что его форма меняется, чтобы соответствовать форме контейнера. Газ меняет свою форму и объем, чтобы соответствовать форме и объему своего сосуда. Рассмотрим образец воздуха. Он заполнит пустую комнату, воздушный шар, шину или резиновый плот.Его форма и объем соответствуют форме и объему контейнера, в который он помещен. Рисунок 9.2 иллюстрирует эти моменты.
| РИСУНОК 9.2 Постоянство объема, формы и массы в трех состояниях материи: (а) твердое, (б) жидкое, (в) газообразное. |
Б. Плотность
Плотность жидкостей и твердых веществ измеряется в граммах на миллилитр и граммах на кубический сантиметр, соответственно, и очень мало изменяется при изменении температуры образца.Газы имеют гораздо меньшую плотность, настолько низкую, что плотность газа измеряется в граммах на литр, а не в граммах на миллилитр. Плотность газа значительно меняется при изменении температуры газа. В таблице 9.1 показаны плотности трех обычных веществ, по одному в каждом из трех физических состояний, при двух разных температурах.
| Плотность при 20 ° C | Плотность при 100 ° C | |
|---|---|---|
| твердое вещество: хлорид натрия | 2.16 г / см 3 | 2,16 г / см 3 |
| жидкость: вода | 0,998 г / мл | 0,958 г / мл |
| газ: кислород | 1,33 г / л | 1,05 г / л |
C. Сжимаемость
Объем твердого тела или жидкости не очень сильно меняется под давлением.Ты
не может изменить объем кирпича, сжимая его, ни вы не можете сжать один
литр жидкости в бутылку емкостью 0,5 л. Объем газа действительно сильно меняет
справляться с давлением; Вы можете втиснуть баллон объемом 1,0 л в пространство объемом 0,5 л.
D. Выводы о межмолекулярной структуре
Постоянство формы и объема твердого тела предполагает, что его частицы (атомы,
ионы или молекулы) удерживаются вместе довольно жесткими связями. Изменяемая форма
и постоянный объем жидкости предполагают, что между ее
частицы, но эти связи не жесткие и, вероятно, менее прочны, чем
те в твердом.Тот факт, что газ не имеет ни постоянной формы, ни постоянного
объем предполагает, что нет никаких связей и только очень незначительные взаимодействующие силы
между частицами газа. Разнообразие сжимаемости предполагает другие
гипотезы. Если твердые тела и жидкости нельзя сжать, частицы которых
они должны быть составлены очень близко друг к другу. Высокая сжимаемость
газ подразумевает, что частицы газа очень далеко друг от друга и
пространства между ними.Эта последняя гипотеза подтверждается различием между
плотности твердых тел и жидкостей и плотности газов. Один мл
твердое или жидкое вещество всегда имеет массу намного больше, чем один миллилитр газа.
12,5: плавление, замораживание и сублимация
Цели обучения
- Определите плавление, замораживание и сублимацию.
В зависимости от окружающих условий нормальное вещество обычно существует в виде одной из трех фаз : твердой, жидкой или газовой.
Фазовое изменение — это физический процесс, в котором вещество переходит из одной фазы в другую. Обычно изменение происходит при добавлении или удалении тепла при определенной температуре, известной как точка плавления или точка кипения вещества. Точка плавления — это температура, при которой вещество переходит из твердого состояния в жидкое (или из жидкости в твердое). Точка кипения — это температура, при которой вещество переходит из жидкости в газ (или из газа в жидкость). Характер фазового перехода зависит от направления теплопередачи.Тепло, переходящее в вещество , превращает его из твердого тела в жидкость или из жидкости в газ. Удаление тепла из вещество превращает газ в жидкость или жидкость в твердое тело.
Следует подчеркнуть два ключевых момента. Во-первых, при температуре плавления или кипения вещества могут существовать две фазы одновременно. Возьмем, к примеру, воду (H 2 O). По шкале Цельсия H 2 O имеет точку плавления 0 ° C и точку кипения 100 ° C. При 0 ° C твердая и жидкая фазы H 2 O могут сосуществовать.Однако при добавлении тепла часть твердого H 2 O расплавится и превратится в жидкость H 2 O. Если отвести тепло, произойдет обратное: часть жидкого H 2 O превратится в твердый H 2 O. Аналогичный процесс может происходить при 100 ° C: добавление тепла увеличивает количество газообразного H 2 O, а удаление тепла увеличивает количество жидкого H 2 O (Рисунок \ (\ PageIndex {1} \)).
Рисунок \ (\ PageIndex {1} \): Точка кипения воды. Ядерное кипячение воды над горелкой кухонной плиты.(Источник: Википедия). Вода — хорошее вещество, которое можно использовать в качестве примера, потому что многие люди уже знакомы с ней. Другие вещества также имеют точки плавления и кипения.Во-вторых, температура вещества не меняется при переходе вещества из одной фазы в другую. Другими словами, фазовые переходы являются изотермическими (изотермический означает «постоянная температура»). Снова рассмотрим H 2 O в качестве примера. Твердая вода (лед) может существовать при 0 ° C. Если к льду добавить тепло при 0 ° C, часть твердого вещества изменит фазу, превратившись в жидкость, которая также имеет температуру 0 ° C.Помните, что твердая и жидкая фазы H 2 O могут сосуществовать при 0 ° C. Только после того, как все твердое вещество превратилось в жидкость, добавление тепла изменяет температуру вещества.
Для каждого фазового превращения вещества существует характерное количество тепла, необходимое для выполнения фазового превращения на грамм (или на моль) материала. Теплота плавления (Δ H fus ) — это количество тепла на грамм (или на моль), необходимое для фазового перехода, происходящего при температуре плавления.Теплота парообразования (Δ H vap ) — это количество тепла на грамм (или на моль), необходимое для фазового превращения, которое происходит при температуре кипения. Если вам известно общее количество граммов или молей материала, вы можете использовать Δ H fus или Δ H vap , чтобы определить общее тепло, передаваемое для плавления или затвердевания, используя следующие выражения:
\ [\ text {heat} = n \ times ΔH_ {fus} \ label {Eq1a} \]
, где \ (n \) — количество молей, а \ (ΔH_ {fus} \) выражается в энергии / моль или
\ [\ text {heat} = m \ times ΔH_ {fus} \ label {Eq1b} \]
где \ (m \) — масса в граммах, а \ (ΔH_ {fus} \) выражается в энергии на грамм.
Для кипения или конденсации используйте следующие выражения:
\ [\ text {heat} = n \ times ΔH_ {vap} \ label {Eq2a} \]
, где \ (n \) — количество моль), а \ (ΔH_ {vap} \) выражается в энергии / моль или
\ [\ text {heat} = m \ times ΔH_ {vap} \ label {Eq2b} \]
где \ (m \) — масса в граммах, а \ (ΔH_ {vap} \) выражается в энергии на грамм.
Помните, что фазовый переход зависит от направления теплопередачи. При передаче тепла твердые вещества становятся жидкими, а жидкости становятся твердыми при температурах плавления и кипения соответственно.Если тепло передается, жидкости затвердевают, а газы конденсируются в жидкости.
Пример \ (\ PageIndex {1} \)
Сколько тепла необходимо, чтобы растопить 55,8 г льда (твердый H 2 O) при 0 ° C? Теплота плавления H 2 O составляет 79,9 кал / г.
Решение
Мы можем использовать соотношение между теплотой и теплотой плавления (уравнение \ (\ PageIndex {1} \) b), чтобы определить, сколько джоулей тепла необходимо, чтобы растопить этот лед:
\ [\ begin {align *} \ text {heat} & = m \ times ΔH_ {fus} \\ [4pt] & = (55.8 \: \ cancel {g}) \ left (\ dfrac {79.9 \: cal} {\ cancel {g}} \ right) = 4,460 \: cal} \ end {align *} \]
Упражнение \ (\ PageIndex {1} \)
Сколько тепла необходимо для испарения 685 г H 2 O при 100 ° C? Теплота испарения H 2 O составляет 540 кал / г.
Таблица \ (\ PageIndex {1} \) перечисляет значения теплоты плавления и испарения некоторых распространенных веществ. Обратите внимание на единицы измерения этих величин; Когда вы используете эти значения при решении проблем, убедитесь, что другие переменные в вашем расчете выражены в единицах, соответствующих единицам измерения удельной теплоты или теплоты плавления и испарения.
| Вещество | ΔH fus (кал / г) | ΔH пар (кал / г) |
|---|---|---|
| алюминий (Al) | 94,0 | 2 602 |
| золото (Au) | 15,3 | 409 |
| железо (Fe) | 63.2 | 1 504 |
| вода (H 2 O) | 79,9 | 540 |
| хлорид натрия (NaCl) | 123,5 | 691 |
| этанол (C 2 H 5 OH) | 45,2 | 200,3 |
| бензол (C 6 H 6 ) | 30.4 | 94,1 |
Взгляд поближе: сублимация
Существует также фазовый переход, когда твердое вещество переходит непосредственно в газ:
\ [\ text {solid} \ rightarrow \ text {gas} \ label {Eq3} \]
Это изменение фазы называется сублимацией . Каждое вещество имеет характерную теплоту сублимации, связанную с этим процессом. Например, теплота сублимации (Δ H sub ) H 2 O составляет 620 кал / г.\ circ C} CO_2 (g)} \ label {Eq4} \]
Твердый диоксид углерода называется сухим льдом, потому что он не проходит через жидкую фазу. Вместо этого он идет прямо в газовую фазу. (Углекислый газ может существовать в виде жидкости, но только под высоким давлением.) Сухой лед имеет множество практических применений, включая долгосрочное хранение медицинских образцов.
Даже при температуре ниже 0 ° C твердый H 2 O будет медленно возгоняться. Например, тонкий слой снега или инея на земле может медленно исчезнуть по мере сублимации твердого H 2 O, даже если внешняя температура может быть ниже точки замерзания воды.Точно так же кубики льда в морозильной камере со временем могут стать меньше. Хотя твердая вода заморожена, она медленно сублимируется, оседая на более холодных охлаждающих элементах морозильной камеры, что требует периодического размораживания (морозильные камеры без обледенения минимизируют это повторное отложение). Снижение температуры в морозильной камере уменьшит потребность в частом размораживании.
При аналогичных обстоятельствах вода также выделяется из замороженных продуктов (например, мяса или овощей), придавая им непривлекательный вид с крапинками, называемый ожогом при заморозке.На самом деле это не «ожог», и еда не обязательно испортилась, хотя выглядит неаппетитно. Ожог при замораживании можно свести к минимуму, снизив температуру в морозильной камере и плотно обернув продукты, чтобы у воды не было места для сублимации.
Точка плавления
Твердые тела похожи на жидкости в том, что оба являются конденсированными состояниями с частицами, которые расположены гораздо ближе друг к другу, чем частицы газа. Однако, в то время как жидкости жидкие, твердые тела — нет. Частицы большинства твердых веществ плотно упакованы и упорядочены.Движение отдельных атомов, ионов или молекул в твердом теле ограничено колебательным движением вокруг фиксированной точки. Твердые тела почти полностью несжимаемы и являются наиболее плотными из трех состояний материи.
Когда твердое тело нагревается, его частицы вибрируют быстрее, поскольку твердое тело поглощает кинетическую энергию. В конце концов, организация частиц внутри твердой структуры начинает разрушаться, и твердое тело начинает плавиться. Точка плавления — это температура, при которой твердое вещество превращается в жидкость.\ text {o} \ text {C} \).
\ [\ ce {H_2O} \ left (s \ right) \ rightleftharpoons \ ce {H_2O} \ left (l \ right) \]
Мы склонны думать о твердых телах как о материалах, которые тверды при комнатной температуре. Однако все материалы имеют ту или иную температуру плавления. Газы становятся твердыми при очень низких температурах, а жидкости также становятся твердыми, если температура достаточно низкая. В таблице ниже приведены температуры плавления некоторых распространенных материалов.
| Материалы | Точка плавления (ºC) |
|---|---|
| Водород | -259 |
| Кислород | -219 |
| Диэтиловый эфир | -116 |
| Этанол | -114 |
| Вода | 0 |
| Чистое серебро | 961 |
| Чистое золото | 1063 |
| Утюг | 1538 |
Упражнение \ (\ PageIndex {2} \)
- Объясните, что происходит, когда тепло течет внутрь вещества или выходит из него при его температуре плавления или кипения.
- Как количество тепла, необходимое для фазового перехода, соотносится с массой вещества?
- Ответьте на
На изменение фазы идет энергия, а не температура.
- Ответ б
Количество тепла на грамм вещества постоянно.
Сводка
- Есть изменение энергии, связанное с любым изменением фазы.
- Сублимация — это изменение состояния с твердого на газ без перехода через жидкое состояние.
- Осаждение — это изменение состояния от газа к твердому.
- Двуокись углерода — это пример материала, который легко подвергается сублимации.
- Точка плавления — это температура, при которой твердое вещество превращается в жидкость.
- Межмолекулярные силы оказывают сильное влияние на температуру плавления.
Материалы и авторство
Эта страница была создана на основе содержимого следующими участниками и отредактирована (тематически или всесторонне) командой разработчиков LibreTexts в соответствии со стилем, представлением и качеством платформы:
Фонд CK-12 Шэрон Бьюик, Ричард Парсонс, Тереза Форсайт, Шонна Робинсон и Жан Дюпон.
Изменяющееся состояние — Плавление | Глава 2: Состояния материи
Попросите учащихся посмотреть, как тает небольшой кусок льда.
Покажите студентам видеосюжет «Лед тает на разных поверхностях».
В этом видео лед помещен на две похожие на вид черные поверхности — алюминиевая и пластиковая. Лед на алюминии тает быстрее, потому что он лучше проводит теплоту, чем пластик.
Обсудите наблюдения студентов.
Спросите студентов:
- Как вы думаете, откуда взялась энергия, чтобы растопить лед?
- Энергия исходит от воздуха и от поверхности, на которую кладется лед, и те, и другие имеют комнатную температуру. Поскольку комнатная температура теплее, чем температура льда, энергия передается от поверхности и воздуха ко льду.
- Как вы думаете, что произошло со скоростью молекул льда, когда он нагрелся?
- Молекулы воды двигались быстрее.
Раздайте каждому учащемуся лист с упражнениями.
Учащиеся запишут свои наблюдения и ответят на вопросы о деятельности в листе действий. «Объясни это с помощью атомов и молекул» и «Возьми это». Дальнейшие разделы рабочего листа будут заполнены либо в классе, либо в группах, либо индивидуально в зависимости от ваших инструкций. Посмотрите на версию листа деятельности для учителя, чтобы найти вопросы и ответы.
Дайте студентам время ответить на первые два вопроса в листе задания.
Предложите учащимся узнать, как заставить лед таять быстрее.
Введите вопрос для исследования:
- Как сделать так, чтобы лед таял быстрее?
Помогите учащимся спланировать и провести эксперимент, спросив:
- Как вы могли бы поставить эксперимент для проверки вашего метода?
- Учащиеся могут предложить подышать льдом, держа его в руке, или поместить лед в воду комнатной температуры или в теплую воду.Любой из этих методов хорош, но постарайтесь, чтобы учащиеся подумали о включении элемента управления в эксперимент. В каждом случае им понадобятся два куска льда одинакового размера — один, который они каким-то образом нагревают, а другой — нет.
Вот один метод, который студенты могут попробовать:
Вопрос для расследования
Будет ли лед, помещенный в воду, таять быстрее?
Материалы
- 2 маленьких кусочка льда
- 2 маленьких прозрачных пластиковых стакана
- Вода
Процедура
- Налейте в чашку воду комнатной температуры, пока она не наполнится примерно на ½.
Положите небольшой кусочек льда в воду, а другой — в чашку без воды.
Ожидаемые результаты
Лед, помещенный в воду, тает быстрее, чем лед в воздухе. Поскольку вода и воздух имеют комнатную температуру, может быть неочевидно, почему лед в воде тает быстрее. В воде так много молекул, которые могут контактировать со льдом, что передача тепла льду в воде намного эффективнее и быстрее, чем в воздухе.
Дайте студентам время написать свою процедуру и ответить на вопрос в листе действий.
Показать анимацию таяния льда.
Показать анимацию «Тающий лед».
Обратите внимание на то, что молекулы воды во льду вибрируют, но не проходят друг мимо друга. С повышением температуры они начинают больше вибрировать. В конце концов, их движение преодолевает их привлекательность, и они больше не могут оставаться в своей упорядоченной кристаллической структуре.Когда лед тает, упорядоченная структура разрушается, и молекулы воды движутся мимо друг друга и фактически сближаются, превращаясь в жидкую воду.
Спроецировать изображение Лед и вода
Спросите студентов
- Как изменилось движение и расположение молекул воды при таянии льда?
- Когда энергия передается молекулам воды во льду, движение молекул увеличивается. Движение молекул увеличивается настолько, что преодолевает притяжение молекул воды друг к другу, в результате чего лед тает.
Сравните движение и расположение молекул вещества (не воды) для каждого состояния вещества.
Спроецируйте изображение состояний материи.
Объясните, что диаграмма иллюстрирует движение и расположение атомов или молекул в одном веществе (не в воде), когда оно изменяется между твердым телом, жидкостью и газом.
Попросите учащихся сравнить изменения состояния большинства веществ с изменениями состояния воды.
Спроецировать изображение «Состояния воды».
Скажите студентам, что движение молекул воды в каждом состоянии вещества аналогично тому, что происходит с большинством веществ. Добавление энергии увеличивает движение молекул и заставляет их расходиться дальше друг от друга. Удаление энергии уменьшает движение молекул и заставляет их сближаться. Но вода делает что-то очень необычное, когда замерзает, превращаясь в лед. Молекулы, которые двигались все ближе и ближе друг к другу, отдаляются друг от друга, организуясь в образ разомкнутого кольца, показанный ниже для льда.Вот почему при замерзании лед расширяется.
Спросите студентов:
Подробнее об изменениях энергии и состояния читайте в разделе «Биография учителя».
- Чем изменения состояния воды похожи и отличаются от изменений состояния большинства других веществ?
- Для воды или любого другого вещества движение молекул увеличивается при добавлении энергии и уменьшается при ее удалении. Основное отличие воды от других веществ — это расположение молекул твердого вещества и жидкости.В воде молекулы льда дальше друг от друга, чем в жидкой воде. Это необычно, потому что молекулы твердых тел в большинстве других веществ расположены ближе друг к другу, чем в жидком состоянии.
Предложите группам использовать свои молекулы воды для моделирования замерзания, таяния, испарения и конденсации.
Процедура
- Спроецировать изображение Лед.
- Пусть каждая группа расположит свои молекулы воды в шестигранное кольцо льда.Попросите учащихся осторожно обращаться с моделями, потому что они понадобятся им на других уроках.
- Тает льда
- Попросите учащихся использовать свои модели, чтобы показать, что происходит при таянии льда. Обратите внимание на то, что молекулы воды ближе друг к другу, чем они были, как лед. Студенты могли показать молекулы воды, движущиеся друг мимо друга.
- Испарение воды
- Попросите учащихся использовать свои молекулы, чтобы смоделировать, что произошло бы, если бы вода нагрелась, а молекулы испарились.Студенты должны показать, как молекулы воды движутся быстрее, отделяются от других молекул и попадают в воздух.
- Конденсация водяного пара
- Попросите учащихся использовать свои молекулы, чтобы смоделировать, что произошло бы, если бы водяной пар был достаточно охлажден, чтобы вызвать его конденсацию. Учащиеся должны показать, как молекулы воды в воздухе замедляются и соединяются вместе, но при этом движутся мимо друг друга как жидкая вода.
Соберите молекулы воды.Эти модели будут снова использованы в Главе 5, Урок 1.
Проведите демонстрацию для сравнения таяния обычного льда и сухого льда.
Сообщите учащимся, что сухой лед — это замороженный углекислый газ. Углекислый газ должен быть очень холодным, чтобы стать твердым (около -78 ° C или -109 ° F).
Препарат
Для этой демонстрации вам понадобится немного сухого льда.Если у вас нет сухого льда, покажите видео «Сухой лед».
Вопрос для расследования
Тает ли сухой лед так же, как и обычный лед?
Материалы
- Лед
- Сухой лед
- Бумажное полотенце коричневое
- Холодная вода
- Горячая вода (около 50 ° C)
Процедура
- Положите кусок сухого льда и кусок обычного льда на коричневое бумажное полотенце.
Ожидаемые результаты
Через короткое время лед начнет таять, и бумажное полотенце вокруг льда станет влажным и темнее. Бумажное полотенце вокруг сухого льда останется сухим и не потемнеет. Если вы заметили небольшое темное пятно на бумажном полотенце рядом с сухим льдом, возможно, водяной пар из воздуха сконденсировался на сухом льду и растаял на бумажном полотенце.
Если ученики видят туманный белый туман, исходящий от сухого льда, сообщите им, что это не сам углекислый газ.Двуокись углерода не имеет цвета, запаха и невидима. Туманный дым или туман — это на самом деле водяной пар в воздухе, который становится достаточно холодным, чтобы конденсироваться. Водяной пар охлаждается сухим льдом и холодным углекислым газом. Туман имеет тенденцию дрейфовать вниз, потому что он переносится углекислым газом, который более плотен, чем окружающий его воздух.
Обсудите наблюдения студентов и представьте идею о том, что некоторые вещества могут непосредственно превращаться из твердого тела в газ.
Спросите студентов:
- Тает ли обычный лед и сухой лед одинаково?
- Нет. Обычный лед превращается в жидкость, которую вы видите на коричневом бумажном полотенце. Сухой лед не превращается в жидкость.
Объясните студентам: причина того, что сухой лед не делает бумажное полотенце влажным, заключается в том, что оно не тает. Когда энергия передается на сухой лед, твердая двуокись углерода не плавится до жидкой двуокиси углерода.Вместо этого твердое вещество превращается непосредственно в газ. Этот процесс называется сублимацией. Сублимация происходит, когда молекулы твердого тела движутся достаточно быстро, чтобы преодолеть притяжение других молекул и стать газом. Поскольку замороженный углекислый газ никогда не становится жидкостью при нормальном давлении, его называют сухим льдом.
Покажите студентам, что происходит, когда сухой лед помещается в воду.
Поместите кусок сухого льда в воду, а затем добавьте немного средства для мытья посуды или посмотрите видео «Сухой лед в воде».
Ожидаемые результаты
Сформируются пузыри и образуется туманный белый туман. Поскольку вода намного теплее, чем сухой лед, энергия передается от воды к сухому льду, в результате чего он превращается из твердого вещества в газ и пузырится через воду. После добавления моющего средства образуется холмик из пузырьков.
Студентам будет интересно узнать, какой туман выходит из чашки. Скажите им, что некоторая вода превращается в водяной пар в пузырьках углекислого газа, а затем конденсируется.Это вызывает туман внутри пузырьков, который улетучивается, когда пузырь лопается.
Спросите студентов:
- Вы видели, что сухой лед очень быстро сублимируется в воде. Что можно сделать, чтобы сухой лед сублимировался еще быстрее?
- Есть несколько способов ускорить возгонку сухого льда. Один из вариантов — положить сухой лед в горячую воду.
Поместите кусок сухого льда в стакана холодной воды, а другой кусок — в стакана горячей воды.Или покажите видео «Сухой лед в горячей и холодной воде».
Ожидаемые результаты:
Намного больше тумана будет образовывать чаша с горячей водой.
Сообщите учащимся, что при помещении сухого льда в горячую воду образуется больше тумана, поскольку передача энергии и сублимация происходят быстрее. Это приводит к более быстрому образованию тумана.
Таяние — Энциклопедия Нового Света
Эти кубики льда, помещенные в стакан выше точки плавления, начинают таятьВ физике и химии плавление — это процесс преобразования твердого вещества в жидкую форму, обычно путем нагревание вещества до температуры, называемой его точкой плавления .В обратном процессе, называемом замораживание , жидкое вещество охлаждается до температуры, называемой точкой замерзания , когда оно переходит в твердую форму. Температура плавления и точка замерзания обычно совпадают.
Плавление или замерзание вещества известно как фазовый переход или фазовый переход . Химически вещество остается прежним, но его физическое состояние (или «фаза») изменяется. В отличие от точки кипения вещества, его точка плавления относительно нечувствительна к давлению.
Наши знания о плавлении и замораживании можно применять по-разному. Например, чистоту многих твердых соединений можно определить, проверив их температуры плавления. Кроме того, замораживание — это знакомый метод сохранения продуктов. Плавление твердого вещества, такого как кусок металла или пластмассы, является чрезвычайно ценным средством придания ему желаемой формы. Приготовление сплавов включает соединение металлов после их плавления. Учитывая смесь нескольких веществ в твердом состоянии, плавление — это способ, с помощью которого некоторые из этих веществ могут быть отделены от других (с более высокими температурами плавления).Материалы с высокими температурами плавления ценны для изготовления продуктов, которые должны выдерживать высокие температуры.
Сравнение плавления и замерзания
В большинстве случаев точка плавления вещества равна его температуре замерзания. Например, точка плавления и точка замерзания элемента ртути составляет 234,32 Кельвина (K) (-38,83 ° C или -37,89 ° F).
Некоторые вещества, напротив, обладают разными температурами перехода твердое тело-жидкость. Например, агар плавится при 85 ° C (185 ° F) и затвердевает от 32 ° C до 40 ° C (89.От 6 ° F до 104 ° F) — этот процесс известен как «гистерезис». Некоторые материалы, такие как стекло, могут затвердевать без кристаллизации; они называются «аморфными» твердыми телами.
Температура плавления воды при давлении в 1 атмосферу составляет 0 ° C (32 ° F, 273,15 K), также известная как точка льда . В присутствии зародышеобразователей [1] , таких как частицы пыли, точка замерзания воды совпадает с точкой плавления. С другой стороны, в отсутствие таких агентов вода может быть переохлаждена до -42 ° C (-43.6 ° F, 231 K), прежде чем он замерзнет. Поскольку зародышеобразователи обычно присутствуют в окружающей среде, дождевая вода и водопроводная вода обычно замерзают при температуре плавления чистой воды (или близкой к ней).
Кроме того, если вещество быстро охлаждается под воздействием криогенных (чрезвычайно низких) температур, оно замерзнет ниже точки плавления. Этот процесс известен как «мгновенное замораживание».
Примеси влияют на точку плавления
Если вещество содержит небольшое количество примесей, его точка плавления (и точка замерзания) становится ниже, чем у чистого вещества.Чем больше количество примесей, тем ниже температура плавления. В конце концов, при определенном составе смеси будет достигнута минимальная температура плавления. На этой стадии говорят, что смесь находится в «эвтектической точке», или ее называют «эвтектической смесью».
Некоторые примеры
- Углерод не плавится при атмосферном давлении, но сублимируется (переходит из твердого состояния непосредственно в газообразное) примерно при 4000 К. Жидкая фаза существует только при давлениях выше 10 мегапаскалей (МПа) и давлении расчетная температура 4300–4700 К.
- Карбид гафния тантала (Ta 4 HfC 5 ) представляет собой тугоплавкое соединение с очень высокой температурой плавления 4488 K (4215 ° C, 7619 ° F). [2]
- С другой стороны, гелий вообще не замерзает при нормальном давлении, даже при температурах бесконечно близких к абсолютному нулю (0 K). Для его замерзания необходимо давление, превышающее нормальное атмосферное давление более чем в 20 раз.
Скрытая теплота плавления
Если твердое вещество нагреть, его температура будет повышаться до тех пор, пока оно не достигнет точки плавления.При подаче дополнительного тепла вещество начинает плавиться, а температура остается прежней, пока материал не расплавится полностью.
Количество тепла, поглощаемое 1 граммом вещества при его температуре плавления при переходе из твердого состояния в жидкое, называется скрытой теплотой плавления или энтальпией плавления (символ: ΔfusH {\ displaystyle \ Delta {} _ {fus} H}). Например, скрытая теплота плавления льда составляет примерно 80 калорий на грамм.Это означает, что 1 грамм льда при температуре плавления (0 ° C) поглотит 80 калорий тепла, прежде чем полностью растает.
Для обратного процесса, когда 1 грамм того же вещества в жидком состоянии замораживается до твердого состояния, выделяется такое же количество тепла.
Приложения
- Точки плавления часто используются для характеристики соединений и определения их чистоты.
- Учитывая, что лед имеет относительно высокую скрытую теплоту плавления (отмеченную выше), он полезен для охлаждения, то есть для охлаждения теплых предметов и поддержания их при низкой температуре.
- Плавление твердого вещества — чрезвычайно ценный способ изменения формы твердого тела. Это часто происходит, когда металлам и пластмассам придают новые формы.
- Если имеется смесь нескольких твердых веществ, плавление — это способ, с помощью которого одни вещества (с более низкими температурами плавления) могут быть отделены от других (с более высокими температурами плавления).
- Приготовление сплавов включает плавление металлов, их комбинирование, когда они находятся в расплавленном состоянии, а затем предоставление им возможности затвердеть.
- Материалы с высокой температурой плавления ценны для изготовления продуктов, которые должны выдерживать высокие температуры. Например, вольфрам с его чрезвычайно высокой температурой плавления используется в нити для ламп накаливания.
Другие значения плавления и замораживания
- В генетике плавление ДНК означает разделение двухцепочечной ДНК на две одноцепочечные цепи путем нагревания или воздействия химических веществ.
- В биологии замораживание — это реакция животного на вызывающую страх ситуацию, позволяющую ему оставаться незамеченным хищником и готовить реакцию «бей или беги».
Справочные значения
Теплота плавления воды составляет 79,72 калорий на грамм или 334,5 джоулей на грамм. Теплота плавления некоторых других распространенных веществ приведена в таблице ниже.
9 : CRC Справочник по химии и физике , 62-е издание. [3]См. Также
Примечания
- ↑ Зародышевый агент для замораживания или кристаллизации — это то, что дает крошечные «зародыши» (такие как частицы пыли или мельчайшие кристаллы), которые способствуют началу процесса фазового перехода .
- ↑ Запись о гафнии на Britannica.com
- ↑ Лиде, Дэвид Р. (ред.). CRC Справочник по химии и физике , 62-е издание. Обновленное 85-е издание, 2005 г. Бока-Ратон, Флорида: CRC Press. ISBN 0849304865
Ссылки
- Kleinert, Hagen. Калибровочные поля в конденсированных средах , Vol. II, «Напряжения и дефекты; дифференциальная геометрия, плавление кристаллов», стр. 743-1456. Сингапур: World Scientific, 1989. ISBN 9971502100. онлайн. Проверено 13 октября 2014 года.
- Лиде, Дэвид Р. (ред.). CRC Справочник по химии и физике . Бока-Ратон, Флорида: CRC Press, 2005. ISBN 0849304865
Кредиты
Энциклопедия Нового Света Писатели и редакторы переписали и завершили статью Википедия в соответствии со стандартами New World Encyclopedia . Эта статья соответствует условиям лицензии Creative Commons CC-by-sa 3.0 (CC-by-sa), которая может использоваться и распространяться с указанием авторства.Кредит предоставляется в соответствии с условиями этой лицензии, которая может ссылаться как на участников Энциклопедии Нового Света, участников, так и на самоотверженных добровольцев Фонда Викимедиа. Чтобы процитировать эту статью, щелкните здесь, чтобы просмотреть список допустимых форматов цитирования. История более ранних вкладов википедистов доступна для исследователей здесь:
История этой статьи с момента ее импорта в Энциклопедия Нового Света :
Примечание. могут применяться ограничения на использование отдельных изображений, на которые распространяется отдельная лицензия.
Chemistry Online @ UTSC
Определение точки плавления
Точка плавления вещества — это температура, при которой кристаллический вещества переходят из твердого в жидкое состояние. В процессе плавления вся энергия, добавленная к веществу, расходуется в виде теплоты плавления, и температура остается постоянной. Чистое вещество плавится при точно определенной температура, характерная для каждого кристаллического вещества.С чистым вещества, температура плавления — самый быстрый и доступный метод для химик-органик для подтверждения идентичности соединения. Кроме того, он может также может использоваться как способ оценки чистоты продукта путем сравнения измеренных температуры плавления до известных литературных значений. В точке плавления твердая и жидкая фаза находятся в равновесии. Таким образом, температура плавления зависит от по давлению и обычно сообщается при стандартном давлении.
Инструкции:
В УТСК оборудование Используемая для измерения температуры плавления называется «Система точки плавления MP50». В Аппарат состоит из четырех прорезей для пробирок, в которых вещества могут быть проверены как а также экран, на котором люди могут настраивать ключевые критерии в отношении их сущность.
Прежде всего, вы бы возьмите образец твердого вещества из мешка для образцов или из неизвестного образца, который было дано вам вашим TA, и, используя капиллярную трубку, получите небольшой количество мелкого порошка, осторожно прокручивая трубку через вещество.
Если ваш продукт частицы слишком велики, чтобы поместиться в капиллярную трубку, поместите их в ступку и растолочь в мелкий порошок.
Во-вторых, чтобы понизить вещества на дно пробирки, либо постучите по закрытому концу капилляра. энергично поставьте трубку на стол или опустите трубку в длинный прозрачный пластик. трубку и позвольте ей подпрыгивать на скамейке.Убедитесь, что есть примерно 3 мм образца внутри пробирки.
Затем нажмите метод значок на машине MP50 в соответствии с указаниями вашего технического специалиста.
Затем вставить капиллярную трубку в держатель образца машины. Нажми на старт и дождитесь появления на экране точки плавления.Вы можете просмотреть ваш капилляр и твердое тело тают на экране машины.
Запись плавления точку вашего вещества в записной книжке и очистите экран, нажав кнопку «Домой» для следующего ученика. Найдя значение точки плавления, перейти к сравнению с задокументированными известными значениями температуры плавления.Это поможет вы в определении того, какое соединение у вас есть. Машина обычно дает вам диапазон температуры плавления, с начальным значением, когда твердое вещество начинает расплав, и конечное значение, когда все твердое тело расплавится. Обязательно записать эти числа как диапазон для определения вашей точки плавления.
Как только у вас будет точку плавления и определить, какое у вас соединение, вы можете продолжить завершите анализ лаборатории.Исходя из полученной температуры плавления, вы можете определите, есть ли в вашем образце какие-либо примеси. Если ваша точка плавления намного ниже и в более широком диапазоне, чем литературные значения, примеси присутствуют в ваш образец. Это может быть связано с экспериментальными ошибками, которые произошли в вашем эксперимент. Обязательно обратите внимание на эти наблюдения при обсуждении в вашей лаборатории. ноутбук.
фазовых переходов: плавление, кипение и сублимация
10.2-фазные переходы: плавление, кипение и сублимация
Цели обучения
- Опишите, что происходит во время смены фазы.
- Рассчитайте изменение энергии, необходимое для изменения фазы.
Вещества могут менять фазу — часто из-за изменения температуры. При низких температурах большинство веществ твердые; при повышении температуры они становятся жидкими; еще при более высоких температурах они становятся газообразными.
Процесс превращения твердого тела в жидкость называется плавлением. Процесс превращения твердого тела в жидкость. (более старый термин, который вы иногда можете встретить, — fusion ). Противоположный процесс, когда жидкость становится твердым телом, называется отверждением. Процесс превращения жидкости в твердое тело. Для любого чистого вещества температура, при которой происходит плавление, известная как точка плавления. Характерная температура, при которой твердое вещество становится жидкостью. является характеристикой этого вещества. Чтобы твердое вещество превратилось в жидкость, требуется энергия.Каждое чистое вещество имеет определенное количество энергии, необходимое для перехода из твердого состояния в жидкое. Это количество называется энтальпией плавления (или теплотой плавления). Количество энергии, необходимое для перехода от твердого тела к жидкости или от жидкости к твердому. вещества, представленного как Δ H fus . Некоторые значения Δ H fus перечислены в таблице 10.2 «Энтальпии плавления различных веществ»; предполагается, что эти значения относятся к температуре плавления вещества.Обратите внимание, что единица измерения Δ H fus — килоджоули на моль, поэтому нам нужно знать количество материала, чтобы знать, сколько энергии задействовано. Δ H fus всегда указывается в таблице как положительное число. Однако его можно использовать как для процессов плавления, так и для процессов затвердевания, если вы помните, что плавление всегда эндотермическое (поэтому Δ H будет положительным), в то время как затвердевание всегда будет экзотермическим (поэтому Δ H будет отрицательный).
Таблица 10.2 Энтальпии плавления различных веществ
| Вещество | Теплота плавления (кал / г) | Теплота плавления (кДж / кг) | |
|---|---|---|---|
| метан: | 13,96 | 58,41 | |
| этан: | 22,73 | 95,10 | |
| пропан: | 19.11 | 79,96 | |
| метанол: | 23,70 | 99,16 | |
| этанол: | 26,05 | 108,99 | |
| глицерин: | 47,95 | 200,62 | |
| 66 муравьиная кислота: | 276,35 | ||
| уксусная кислота: | 45,91 | 192,09 | |
| ацетон: | 23,42 | 97,99 | |
| бензол: | 30.45 | 127,40 | |
| миристиновая кислота: | 47,49 | 198,70 | |
| пальмитиновая кислота: | 39,18 | 163,93 | |
| стеариновая кислота: | 47,54 | 198,93 |
| Вещество (точка плавления) | Δ H фус (кДж / моль) |
|---|---|
| Вода (0 ° C) | 6.01 |
| Алюминий (660 ° C) | 10,7 |
| Бензол (5,5 ° C) | 9.95 |
| Этанол (-114,3 ° C) | 5,02 |
| Ртуть (-38,8 ° C) | 2,29 |
Пример 2
Каково изменение энергии при плавлении 45,7 г H 2 O при 0 ° C?
Решение
Δ H fus H 2 O составляет 6,01 кДж / моль.Однако наше количество дано в граммах, а не в молях, поэтому первым шагом является преобразование граммов в моль, используя молярную массу H 2 O, которая составляет 18,0 г / моль. Тогда мы можем использовать Δ H fus в качестве коэффициента преобразования. Поскольку вещество плавится, процесс эндотермический, поэтому изменение энергии будет иметь положительный знак.
45,7 г h3O × 1 моль h3O 18,0 г × 6,01 кДж моль = 15,3 кДжБез знака число считается положительным.
Проверьте себя
Каково изменение энергии, когда 108 г C 6 H 6 замерзают при 5.5 ° С?
Ответ
−13,8 кДж
При плавлении энергия идет исключительно на изменение фазы вещества; это не влияет на изменение температуры вещества. Следовательно, плавление — это изотермический процесс, который не изменяет температуру. процесс, потому что вещество остается при той же температуре. Только когда все вещество расплавлено, дополнительная энергия уходит на изменение его температуры.
Что происходит, когда твердое вещество становится жидкостью? В твердом теле отдельные частицы застревают на месте, потому что межмолекулярные силы не могут быть преодолены за счет энергии частиц.Когда подается больше энергии (например, за счет повышения температуры), наступает момент, когда частицы имеют достаточно энергии, чтобы двигаться, но недостаточно энергии, чтобы разделиться. Это жидкая фаза: частицы все еще контактируют, но могут перемещаться друг вокруг друга. Это объясняет, почему жидкости могут принимать форму своих контейнеров: частицы перемещаются и под действием силы тяжести заполняют минимально возможный объем (если жидкость не находится в условиях невесомости — см. Рисунок 10.3 «Жидкости и гравитация»).
Фазовый переход между жидкостью и газом имеет некоторое сходство с фазовым переходом между твердым телом и жидкостью. При определенной температуре частицы в жидкости обладают достаточной энергией, чтобы стать газом. Процесс превращения жидкости в газ называется кипением (или испарением). Процесс превращения жидкости в газ., В то время как процесс превращения газа в жидкость называется конденсацией. Процесс превращения газа в жидкость. На процесс преобразования твердое тело / жидкость на процесс преобразования жидкость / газ заметно влияет окружающее давление на жидкость, потому что на газы сильно влияет давление.Это означает, что температура, при которой жидкость становится газом, точка кипения, характеристическая температура, при которой жидкость становится газом, может изменяться в зависимости от давления окружающей среды. Поэтому мы определяем нормальную точку кипения — характеристическую температуру, при которой жидкость становится газом, когда окружающее давление составляет ровно 1 атм. как температура, при которой жидкость превращается в газ, когда окружающее давление составляет ровно 1 атм, или 760 торр. Если не указано иное, предполагается, что точка кипения соответствует давлению 1 атм.
Подобно переходу между твердой / жидкой фазой, переход жидкость / газ включает в себя энергию. Количество энергии, необходимое для преобразования жидкости в газ, называется энтальпией испарения. Количество энергии, необходимое для перехода от жидкости к газу или от газа к жидкости. (или теплота испарения), представленная как Δ H vap . Некоторые значения Δ H vap перечислены в таблице 10.3 «Энтальпии испарения для различных веществ»; предполагается, что эти значения относятся к нормальной температуре кипения вещества, которая также указана в таблице.Единица измерения Δ H vap — это также килоджоули на моль, поэтому нам нужно знать количество материала, чтобы знать, сколько энергии требуется. Δ H vap также всегда указывается в таблице как положительное число. Его можно использовать как для процессов кипения, так и для процессов конденсации, если вы помните, что кипение всегда эндотермическое (поэтому Δ H будет положительным), в то время как конденсация всегда будет экзотермической (поэтому Δ H будет отрицательным). .
Таблица 10.3 энтальпии испарения различных веществ
| Вещество (нормальная точка кипения) | Δ H пар (кДж / моль) |
|---|---|
| Вода (100 ° C) | 40,68 |
| Бром (59,5 ° C) | 15,4 |
| Бензол (80,1 ° C) | 30.8 |
| Этанол (78,3 ° C) | 38,6 |
| Ртуть (357 ° C) | 59,23 |
Пример 3
Каково изменение энергии при конденсации 66,7 г Br 2 (г) в жидкость при 59,5 ° C?
Решение
Δ H vap Br 2 составляет 15.4 кДж / моль. Несмотря на то, что это процесс конденсации, мы все равно можем использовать числовое значение Δ H vap , если мы понимаем, что мы должны отнимать энергию, поэтому значение Δ H будет отрицательным. Чтобы определить величину изменения энергии, мы должны сначала преобразовать количество Br 2 в моль. Тогда мы можем использовать Δ H vap в качестве коэффициента преобразования.
66,7 г Br2 × 1 моль Br2159,8 г × 15,4 кДж моль = 6,43 кДжПоскольку процесс является экзотермическим, фактическое значение будет отрицательным: Δ H = −6.43 кДж.
Проверьте себя
Каково изменение энергии при кипении 822 г C 2 H 5 OH (ℓ) при нормальной температуре кипения 78,3 ° C?
Ответ
689 кДж
Как и при плавлении, энергия при кипении идет исключительно на изменение фазы вещества; это не влияет на изменение температуры вещества. Так что кипячение — это тоже изотермический процесс. Только когда все вещество закипело, дополнительная энергия уходит на изменение его температуры.
Что происходит, когда жидкость становится газом? Мы уже установили, что жидкость состоит из соприкасающихся друг с другом частиц. Когда жидкость становится газом, частицы отделяются друг от друга, и каждая частица движется в космосе своим путем. Вот как газы наполняют свои контейнеры. Действительно, в газовой фазе большая часть объема — это пустое пространство; только около 1/1000 объема фактически занято веществом (Рисунок 10.4 «Жидкости и газы»). Именно это свойство газов объясняет, почему они могут сжиматься, и этот факт рассматривается в главе 6 «Газы».
Рисунок 10.4 Жидкости и газы
В (а) частицы представляют собой жидкость; частицы контактируют, но также могут перемещаться друг вокруг друга. В (b) частицы представляют собой газ, и большая часть объема фактически представляет собой пустое пространство. Частицы не соответствуют масштабу; в действительности, точки, представляющие частицы, будут иметь размер примерно 1/100 от изображенного.
При некоторых обстоятельствах твердая фаза может переходить непосредственно в газовую фазу, минуя жидкую фазу, а газ может непосредственно становиться твердым.Преобразование твердого вещества в газ называется сублимацией. Процесс превращения твердого вещества в газ., В то время как обратный процесс называется осаждением. Процесс превращения газа в твердое тело. Сублимация является изотермической, как и другие фазовые переходы. Во время сублимации наблюдается измеримое изменение энергии; это изменение энергии называется энтальпией сублимации. Количество энергии, необходимое для перехода от твердого тела к газу или от газа к твердому телу, представлено как Δ H sub . Соотношение между Δ H sub и другими изменениями энтальпии выглядит следующим образом:
Δ H переходник = Δ H fus + Δ H vapТаким образом, Δ H sub не всегда табулируется, потому что его можно просто вычислить из Δ H fus и Δ H vap .
Есть несколько распространенных примеров сублимации. Хорошо известный продукт — сухой лед — на самом деле представляет собой твердый CO 2 . Сухой лед является сухим, потому что он возгоняется, при этом твердое вещество, минуя жидкую фазу, переходит прямо в газовую фазу. Сублимация происходит при температуре −77 ° C, поэтому с ней нужно обращаться осторожно. Если вы когда-нибудь замечали, что кубики льда в морозильной камере со временем становятся меньше, это связано с тем, что твердая вода очень медленно сублимируется. «Морозный ожог» на самом деле не ожог; это происходит, когда определенные продукты, такие как мясо, медленно теряют твердую воду из-за сублимации.Еда по-прежнему хорошая, но выглядит неаппетитно. Уменьшение температуры морозильной камеры замедлит сублимацию твердой воды.
Химические уравнения можно использовать для представления фазового перехода. В таких случаях крайне важно использовать метки фаз на веществах. Например, химическое уравнение таяния льда с образованием жидкой воды выглядит следующим образом:
H 2 O (т) → H 2 O (ℓ)Никаких химических изменений не происходит; однако происходят физические изменения.
Ключевые выводы
- Фазовые изменения могут происходить между любыми двумя фазами материи.
- Все фазовые изменения происходят с одновременным изменением энергии.
- Все фазовые переходы изотермические.
Упражнения
В чем разница между плавлением и затвердеванием ?
В чем разница между кипящим и конденсационным ?
Опишите молекулярные изменения, когда твердое вещество становится жидкостью.
Опишите молекулярные изменения, когда жидкость становится газом.
Каково изменение энергии при плавлении 78,0 г Hg при -38,8 ° C?
Каково изменение энергии, когда 30,8 г алюминия затвердевают при 660 ° C?
Каково изменение энергии при кипении 111 г Br 2 при температуре 59 ° C.5 ° С?
Каково изменение энергии при конденсации 98,6 г H 2 O при 100 ° C?
Каждое из следующих утверждений неверно. Перепишите их, чтобы они были правильными.
- Изменение температуры при смене фазы.
- Процесс превращения жидкости в газ называется сублимацией.
Каждое из следующих утверждений неверно. Перепишите их, чтобы они были правильными.
- Объем газа содержит только около 10% вещества, а остальное — пустое пространство.
- Δ H sub равно Δ H vap .
Напишите химическое уравнение плавления элементарного натрия.
Напишите химическое уравнение затвердевания бензола (C 6 H 6 ).
Напишите химическое уравнение сублимации CO 2 .
Напишите химическое уравнение кипения пропанола (C 3 H 7 OH).
Δ H sub I 2 составляет 60,46 кДж / моль, в то время как его Δ H пара составляет 41,71 кДж / моль. Что такое Δ H fus I 2 ?
ответов
Плавление — это фазовый переход из твердого состояния в жидкое, тогда как затвердевание — это фазовый переход из жидкого состояния в твердое.
У молекул достаточно энергии, чтобы двигаться друг относительно друга, но недостаточно, чтобы полностью отделиться друг от друга.
- Температура не меняется при смене фазы.
- Процесс превращения жидкости в газ называется кипением; процесс превращения твердого тела в газ называется сублимацией.
Точка плавления — обзор
3.16.4.2.2 Статистические методы
МП являлась целью моделирования в течение долгого времени. Уже в 1881 году Миллс разработал модели QSPR для углеводородной цепи следующим образом: 138
(34) MPK = βx / 1 + gx,
, где β и g являются константами для данного класса для достижения точности. предсказания менее 1 K и x — количество метильных групп. Этот результат указывает на то, что для некоторых конкретных классов химических веществ может быть достигнута высокая точность прогноза MP.К сожалению, высокая точность уравнения. (34) был очень частным случаем, и даже после 140 лет исследований такие высокоточные модели для различных соединений не существуют и фактически не могут быть разработаны, как анализируется позже.
Во второй половине прошлого столетия появилось большое количество статей, посвященных анализу других химических рядов, которые хорошо рассмотрел Дирден. 44 В таких исследованиях часто участвовали несколько десятков, а иногда и несколько сотен соединений, сгруппированных по химическому классу, например, алканы, углеводороды, ПАУ (полициклические ароматические углеводороды), спирты, анилины и т. Д.Средние ошибки для неароматических соединений составляли ~ 20 К и увеличивались до ~ 30 К для ароматических углеводородов, то есть, указывая на то, что предсказание последних соединений было более трудным. Дескрипторы, используемые для химических рядов, часто включали несколько топологических индексов или других дескрипторов (например, физико-химические, квантово-химические и структурные), в то время как для больших разнообразных наборов, содержащих более тысячи соединений, использовались GC, структурные и часто поправочные коэффициенты. тоже.
Методы GC предполагают аддитивность моделируемого свойства по отношению к группам.Поскольку это предположение действительно не выполняется для MP, исследователи часто использовали поправочные коэффициенты для учета нелинейности. Например, Симамора и Ялковски использовали поправочные коэффициенты, учитывающие образование водородной связи и нарушение планарности бифенила присутствием заместителя (ей) в положениях 2,2 ‘, 6 или 6’, чтобы получить STDE = 38 K для 90 · 102 n. = 1690 соединений. Такая стратегия и развитие функциональных групп, нацеленных на МП, позволили авторам рассчитать гораздо более высокую точность по сравнению с методом ГХ Джобака и Рейда, 121 STDE = 69 K.Последний метод использовал одни и те же группы для нескольких свойств.
Комплексный ГХ, включающий три уровня описания молекул, был разработан Маернго и Гани. 139 Группы первого порядка покрывают всю молекулу и не перекрываются. Группы второго и третьего порядка перекрывались и охватывали только определенные части молекул, таким образом улавливая взаимодействия внутри более крупных молекулярных фрагментов, чтобы лучше покрывать сложные полифункциональные молекулы. Фактически такие сложные группы играют роль корректирующих факторов.Этот метод позволил авторам рассчитать STDE = 28 K для n = 1547 соединений.
Есть только несколько исследований, опубликованных с большим набором данных о МП. Картикеян и др. 123 проанализировал разнообразный набор с n = 4173 с использованием NN и различных наборов дескрипторов. Авторы обнаружили, что модели, разработанные с использованием 2D-дескрипторов, обеспечивают лучшую точность прогноза (RMSE = 48–50 K) по сравнению с моделями, основанными на 3D-индексах (RMSE = 55–56 K). Попытка улучшить модель за счет комбинации обоих наборов не улучшила результатов.Использование 3D-дескрипторов также не дало преимущества перед 2D для анализа МП ИЖ 717 бромидов азотсодержащих органических катионов. 140 В этом исследовании несколько методов, таких как MLRA, частичные наименьшие квадраты (PLS), k-ближайшие соседи (kNN), NN и SVM, были проанализированы с использованием дескрипторов на основе фрагментов, 88 индексов E-состояния, 141 и дескрипторы Dragon. 25 При анализе производительности моделей для отдельных наборов более высокие ошибки вычислялись для более разнообразных.В то же время результаты зависели от использования методов машинного обучения: нелинейные методы, такие как NN и SVM, обеспечивали неизменно лучшие возможности прогнозирования.
При разработке модели важно также понимать, какие молекулярные свойства ответственны за снижение / увеличение MP. Исчерпывающий анализ с использованием MMP был выполнен для общедоступного набора Karthikeyan, а также для внутренних данных n = 746 соединений Schultes et al. 142 Авторы определили четыре основных фактора, влияющих на MP: количество доноров и акцепторов водородных связей, а также количество вращающихся связей и атомов галогена (I, Br и Cl).Чтобы исключить взаимные корреляции, анализ ММП проводился только для пар молекул, когда изменялся только один фактор. Количество водородных связей оказало наибольшее влияние, увеличивая MP примерно на 50 (30) К для домашнего (общественного) набора, соответственно. Увеличение количества акцепторов водорода на один способствовало увеличению MP на 22 (9) K, а увеличение количества вращающихся связей приводит к уменьшению MP на -17 (- 10) K. Это также интересно. что эффекты были более выражены для в данных , что показывает их более высокую согласованность.Добавление одного атома Br увеличивало MP на 47 (24) K. Значительное увеличение MP из-за добавления I (39) и Cl (7) также наблюдалось для общедоступного набора, но не могло быть сделано для внутреннего данные, из-за ограниченного количества MMP.
Две самые крупные модели прогнозирования МП были опубликованы Tetko et al. 143 , 144 Первая модель была основана на n = 47 000 соединений, собранных из базы данных OCHEM, 99 химических соединений, предоставленных Enamine, набором данных Bergstrom MP для лекарств, 145 и “Bradley ”Набор данных 146 , содержащий дважды курируемые данные, собранные членами научного сообщества Open Notebook.Важным результатом этой статьи было обнаружение, что большинство данных о МП, имеющих фармацевтическое значение,> 90%, имеют МП в интервале от 50 ° C (323,15 K) до 250 ° C (523,15 K) (диапазон значений MP для лекарственных препаратов, Рис.16 ). Таким образом, в принципе, при разработке и тестировании моделей для использования в фармацевтике можно сосредоточиться на их характеристиках для этого температурного диапазона. Как и в исследовании Varnek et al. 140 было продемонстрировано, что MP является нелинейным свойством: использование ассоциативных нейронных сетей и SVM позволило вычислить значительно меньшие ошибки по сравнению с использованием линейных методов.Этот набор был расширен за счет n = 225 000 соединений, добытых по патентам. Эти соединения также имели около 90% своих данных в подобной лекарственному средству области MP.
Рис. 16. Экспериментальные и расчетные ошибки модели консенсуса в зависимости от температуры MP для различных подмножеств. Линия экспериментальной точности построена на основе N = 18 058 разностей температур МП.
Воспроизведено с разрешения Tetko, I.V .; Lowe, D .; Уильямс, А. Дж. Разработка моделей для прогнозирования данных о точках плавления и пиролиза, связанных с несколькими сотнями тысяч соединений, добытых на основе ПАТЕНТОВ. Дж. Хеминформ . 2016 , 8 , 2. Международная лицензия Creative Commons Attribution 4.0 (http://creativecommons.org/licenses/by/4.0/).Ошибка окончательной модели консенсуса для данных о патентах точно соответствовала расчетной экспериментальной ошибке данных. Эта ошибка составила 33 K для диапазона MP, подобного лекарственному средству, и идеально соответствовала STDE = 32 K, рассчитанному с использованием экспериментальных данных. Для MP <50 ° C (323,15 K) та же модель рассчитала RMSE = 47 K и RMSE = 28 K для данных, полученных из патентов и набора Брэдли, соответственно.Опять же, большая разница в обеих ошибках связана с более высокой точностью данных в последнем наборе. Этот результат показал, что использованный подход (консенсусное моделирование) и дескрипторы были достаточными для прогнозирования MP до уровня точности экспериментальных данных. Таким образом, это противоречит заключению Hughes et al., 147 , который объяснил низкую точность моделей для прогнозирования MP недостатком используемых дескрипторов.
Экспериментальная ошибка 33 К выглядит очень большой. Большинство экспериментальных измерений в патентах были представлены в виде интервалов со стандартным отклонением STDE = 3 K между обоими измерениями, которые можно использовать в качестве оценки заявленной экспериментальной точности измерений для отдельных экспериментов.Есть еще много аспектов, способствующих изменению измерений MP из-за подготовки образцов того же соединения, которые были хорошо резюмированы Preiss et al. 148 в их анализе МП органических солей. Автор указал, что такие факторы, как загрязнение, полиморфизм, присутствие жидких и пластичных кристаллов и разложение, могут легко вносить изменения в десять градусов. Например, чистота соединений для скрининга HTS обычно составляет около 85–90%. Влияние загрязнения можно рассчитать следующим образом: 148
(35) ΔMP = −MPmRΔSfus,
, где R — постоянная Авогадро, м — молярное количество загрязнителя, Δ S fus — энтропия плавления целевого соединения.Уравнение показывает, что загрязнение сильнее влияет не только на соединения с более высоким MP, но и на соединения с более высокой молекулярной массой при том же массовом% загрязнения. Учитывая, что MP увеличивается с увеличением MW соединений, более высокие экспериментальные ошибки (снижение MP) можно ожидать для высоких значений MP. Более того, загрязняющие вещества с меньшей массой будут оказывать более сильное воздействие.

 (твёрдого) тела в жидкое состояние при пост. внеш. давлении. Т. п. частный случай температуры фазового перехода I рода. В табл. приведены значения Т. п. ряда в в при норм. внеш. давлении… … Физическая энциклопедия
(твёрдого) тела в жидкое состояние при пост. внеш. давлении. Т. п. частный случай температуры фазового перехода I рода. В табл. приведены значения Т. п. ряда в в при норм. внеш. давлении… … Физическая энциклопедия
 Толковый словарь.
Толковый словарь. Анализ численных данных и их рекомендованные значения. Справочное издание, Юрий Лебедев. В настоящей книге представлены важнейшие численные характеристики ряда углеводородов, среди которых рассматриваются следующие физико-химические константы: молекулярная масса, температура… Подробнее Купить за 2066 грн (только Украина)
Анализ численных данных и их рекомендованные значения. Справочное издание, Юрий Лебедев. В настоящей книге представлены важнейшие численные характеристики ряда углеводородов, среди которых рассматриваются следующие физико-химические константы: молекулярная масса, температура… Подробнее Купить за 2066 грн (только Украина)