METTLER TOLEDO Весы для лаборатории, производства и торговли
Измерительные приборы — это оборудование, используемое для точного определения различных параметров исследуемых объектов. Наша компания занимается …
Измерительные приборы — это оборудование, используемое для точного определения различных параметров исследуемых объектов. Наша компания занимается производством и обслуживанием контрольно-измерительных приборов и весового оборудования для различных отраслей промышленности.
Предлагаем купить измерительные приборы для оптимизации технологических процессов, повышения производительности и снижения затрат. Точные инструменты позволят установить соответствие нормативным требованиям.
Мы осуществляем продажу измерительных приборов, предназначенных для исследовательской деятельности и научных разработок, производства продукции и контроля качества, логистики и розничной торговли. МЕТТЛЕР ТОЛЕДО предлагает следующие измерительные приборы для различных областей применения:
Лабораторное оборудование
Для научных и лабораторных исследований требуются высокоточные измерительные и аналитические приборы и системы.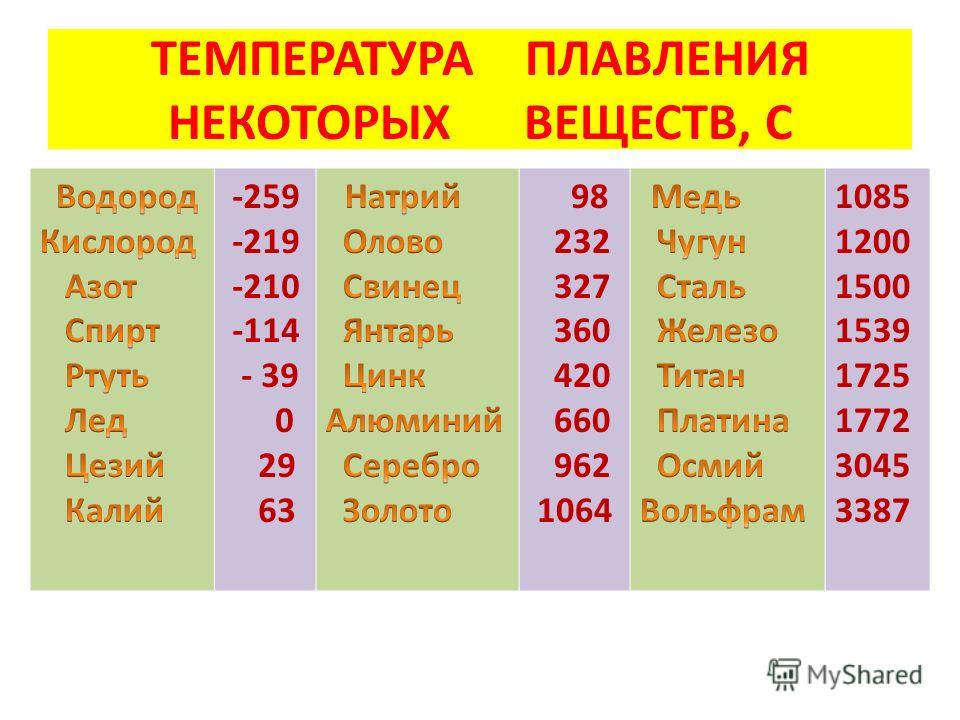 Они используются для взвешивания, анализа, дозирования, автоматизации химических процессов, измерения физических и химических свойств, концентрации газов, плотности, спектрального анализа веществ и рефрактометрии, химического синтеза, подготовки проб, реакционной калориметрии, анализа размеров и формы частиц. Специализированное программное обеспечение позволяет управлять процессами и получать наглядное отображение данных.
Они используются для взвешивания, анализа, дозирования, автоматизации химических процессов, измерения физических и химических свойств, концентрации газов, плотности, спектрального анализа веществ и рефрактометрии, химического синтеза, подготовки проб, реакционной калориметрии, анализа размеров и формы частиц. Специализированное программное обеспечение позволяет управлять процессами и получать наглядное отображение данных.
Лабораторное оборудование включают следующие системы:
Промышленное оборудование
Если вас интересуют промышленное измерительное оборудование, предлагаем купить подходящие системы для взвешивания, контроля продукции, решения логистических задач и транспортировки грузов. Используйте точные приборы для стандартного и сложного дозирования, взвешивания в сложных условиях и взрывоопасной среде. Обеспечьте точность результатов с помощью поверочных гирь и тестовых образцов. Подключение периферийных устройств к приборам позволит регистрировать результаты и параметры взвешивания. Программное обеспечение с понятным интерфейсом оптимизирует процессы посредством управления оборудованием с ПК.
Программное обеспечение с понятным интерфейсом оптимизирует процессы посредством управления оборудованием с ПК.
Ассортимент промышленных контрольно-измерительных приборов и инструментов включает:
Весы для магазинов и оборудование для розничной торговли
В сфере розничной торговли продовольственными товарами необходимы измерительные приборы и оборудование для взвешивания и маркировки товаров. Используйте весы для решения типовых задач, печати чеков и быстрого взвешивания, разгружающего поток покупателей. В сложных ситуациях пригодятся специализированные весовые системы с нетребовательным обслуживанием и уходом. ПО и документация упростят настройку системы и обучение персонала.
Вниманию покупателей предлагаются следующее оборудование для торговли:
Как купить весы МЕТТЛЕР ТОЛЕДО?
Чтобы купить оборудование на нашем сайте, оформите запрос в режиме онлайн в соответствующем разделе. Уточните задачу, которая должна быть решена с помощью требуемого прибора. Укажите контактные данные: страну, город, адрес, телефон, e-mail, название предприятия. Заполненная форма направляется специалисту компании, который свяжется с вами для уточнения ключевых моментов.
Укажите контактные данные: страну, город, адрес, телефон, e-mail, название предприятия. Заполненная форма направляется специалисту компании, который свяжется с вами для уточнения ключевых моментов.
Сеть представительств METTLER TOLEDO для обслуживания и сервисной поддержки распространена по всему миру. В России отдел продаж и сервиса расположен в Москве. Региональные представительства по продажам находятся также в Казани, Ростове-на-Дону, Самаре, Екатеринбурге, Красноярске, Уфе, Хабаровске, Новосибирске.
Отправьте отзыв, задайте вопрос специалисту, свяжитесь с конкретным отделом. Воспользуйтесь онлайн-формой обратной связи или позвоните по указанному телефону офиса в выбранном регионе. Консультанты ответят на каждое обращение и вышлют коммерческое предложение по индивидуальному запросу.
Физики определили самое тугоплавкое вещество
Дендритная структура, возникшая в месте плавления карбида тантала-гафния
Omar Cedillos-Barraza et al.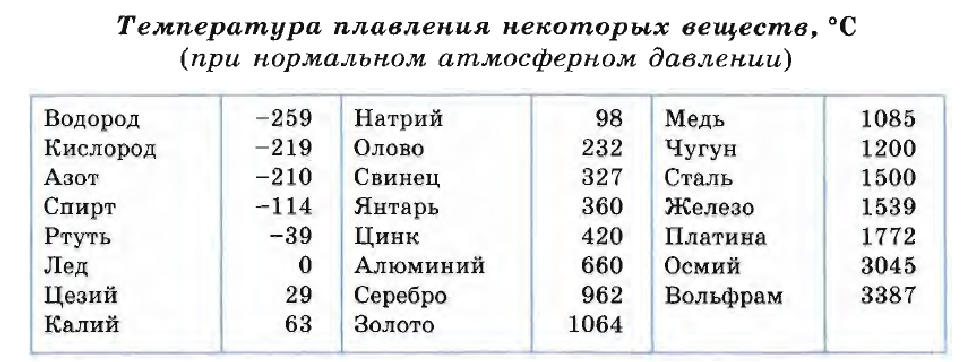 / Scientific Reports, 2016
/ Scientific Reports, 2016
Физики из Имперского колледжа Лондона, Института трансурановых элементов (Карлсруэ) и Университета Лондона уточнили температуры плавления карбидов гафния и тантала. С помощью лазерных методов плавки ученые показали, что наибольшей температурой плавления обладает чистый карбид гафния — HfC
Исследования температуры плавления карбидов гафния и тантала датируются еще первой половиной XX века.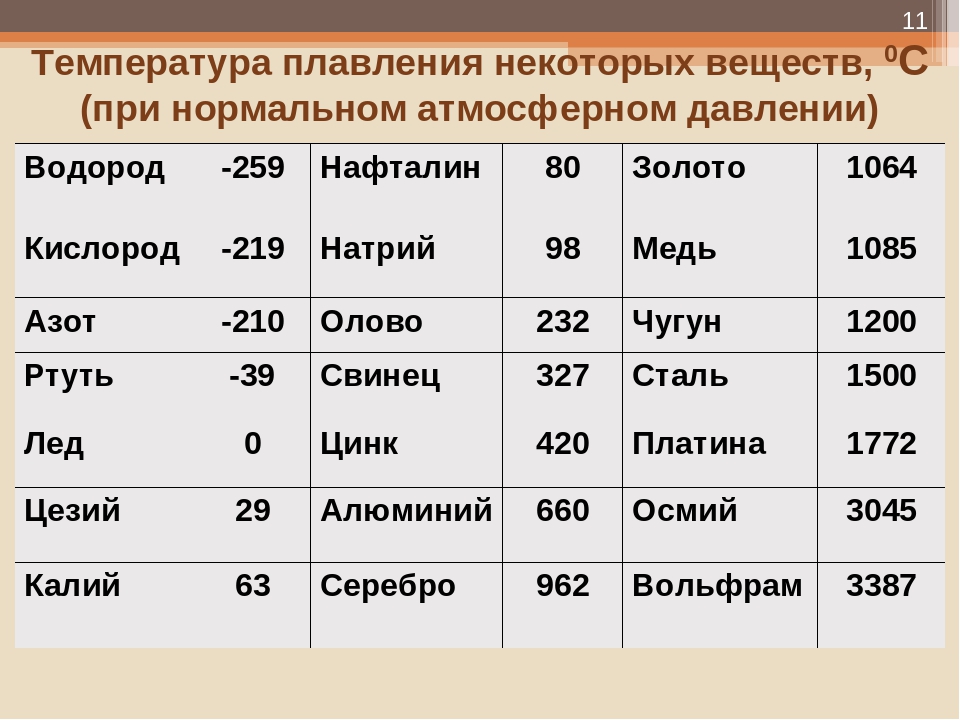 Для этого использовался метод Пирани-Алтертума: с помощью электрического тока нагревалась пластинка материала с отверстием в центре. За пластинкой следили с помощью пирометра. В момент плавления отверстие оказывалось заполнено материалом и изменяло свое свечение. Разброс температур плавления, определенных этим методом для карбида гафния составил почти двести градусов, и по результатам измерений трудно было однозначно определить, какой из карбидов гафния и тантала является самым тугоплавким.
Для этого использовался метод Пирани-Алтертума: с помощью электрического тока нагревалась пластинка материала с отверстием в центре. За пластинкой следили с помощью пирометра. В момент плавления отверстие оказывалось заполнено материалом и изменяло свое свечение. Разброс температур плавления, определенных этим методом для карбида гафния составил почти двести градусов, и по результатам измерений трудно было однозначно определить, какой из карбидов гафния и тантала является самым тугоплавким.
Образцы карбидов после плавления лазером. Слева-направо: кабрид тантала, карбид тантала-гафния, карбид гафния
Omar Cedillos-Barraza et al. / Scientific Reports, 2016
Авторы новой работы, отметив несовершенство ранних пирометров и методик, предложили использовать новый подход для определения температуры плавления. В ней образец керамики плавился под действием мощного 4,5-киловаттного лазера, после чего исследователи следили за его свечением. Момент плавления определялся по изменению отражения от поверхности. После этого лазер отключался, а температура плавления определялась по плато на графике остывания образца: в момент затвердевания отводимая от образца теплота не меняет его температуры.
В ней образец керамики плавился под действием мощного 4,5-киловаттного лазера, после чего исследователи следили за его свечением. Момент плавления определялся по изменению отражения от поверхности. После этого лазер отключался, а температура плавления определялась по плато на графике остывания образца: в момент затвердевания отводимая от образца теплота не меняет его температуры.
Слева: кривая температурной зависимости карбида гафния (черная) и производная сигнала отраженного света. Справа: температурные кривые для карбида тантала, гафния и тантала-гафния.
Omar Cedillos-Barraza et al. / Scientific Reports, 2016
В результате оказалось, что наименьшей температурой плавления обладает карбид тантала — она соответствует 3768 ± 77 градусам Цельсия.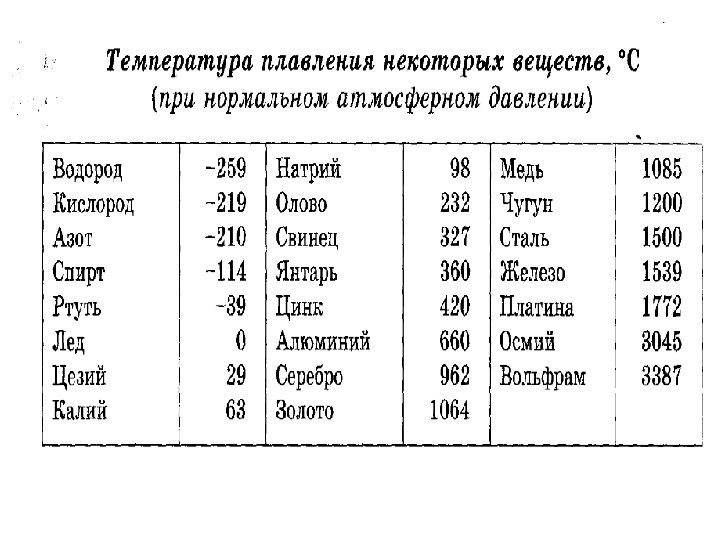
Считается, что карбидные керамики могут найти применение при строительстве гиперзвуковых самолетов. При движении в атмосфере на скорости свыше пяти чисел Маха теплозащита должна выдерживать температуры в 2200 кельвин и выше.
Ранее химики из Университета Брауна (Провиденс) теоретически предсказали существование фазы смешанного карбида-нитрида гафния с рекордно высокой температурой плавления — свыше 4400 кельвин. Ее состав отвечает формуле HfN0.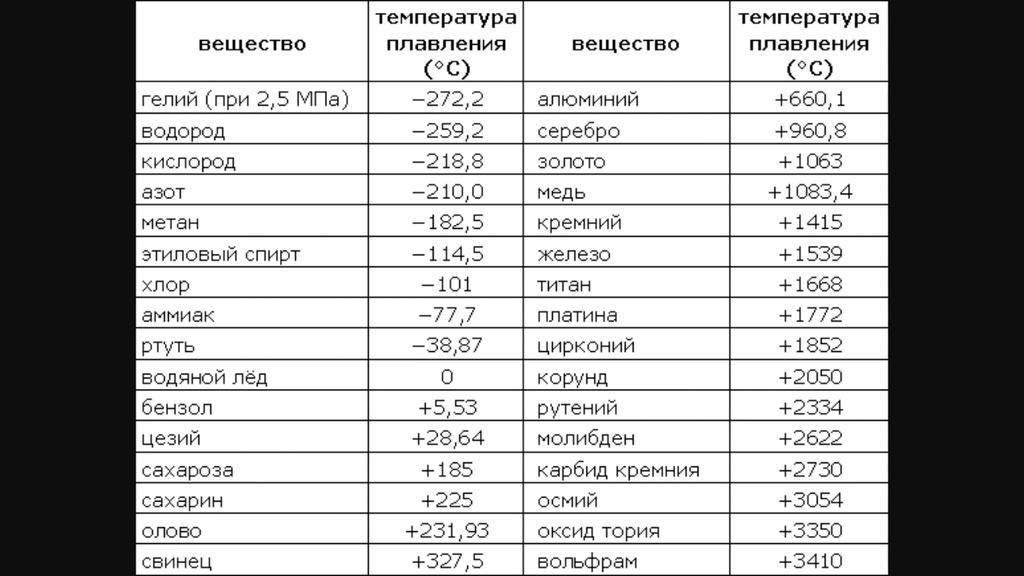 38C0.51.
38C0.51.
Владимир Королёв
Температура плавления твердых веществ — Морской флот
Температура – плавление – твердое вещество
Температура плавления твердых веществ и ее постоянство при плавлении, так же как и температура кипения жидкостей, служит признаком чистоты или загрязненности исследуемого продукта и является вполне определенной и характерной величиной для каждого твердого вещества. Примеси посторонних веществ изменяют температуру плавления данного вещества. Постоянство температуры при плавлении твердого вещества, однако, не всегда является специфическим свойством химически чистого вещества, так как известны такие смеси веществ, взятых в определенном соотношении, которые имеют постоянную температуру плавления. [1]
Температура плавления твердых веществ обычно служит критерием их чистоты. Чистые кристаллические органические вещества имеют, как правило, строго определенную температуру плавления. Присутствие примесей делает температуру плавления неточной и вызывает ее понижение. Известны некоторые исключения, но на практике вещество считается чистым, если после повторной перекристаллизации оно имеет вполне определенную температуру плавления, которая остается постоянной. [2]
Чистые кристаллические органические вещества имеют, как правило, строго определенную температуру плавления. Присутствие примесей делает температуру плавления неточной и вызывает ее понижение. Известны некоторые исключения, но на практике вещество считается чистым, если после повторной перекристаллизации оно имеет вполне определенную температуру плавления, которая остается постоянной. [2]
Температура плавления твердого вещества служит признаком чистоты или загрязненности исследуемого продукта. [3]
Температура плавления твердых веществ и ее постоянство при плавлении, так же как и температура кипения жидкостей, служит признаком чистоты или загрязненности исследуемого продукта и является вполне определенной и характерной величиной для каждого чистого твердого вещества. Примеси посторонних веществ изменяют температуру плавления данного вещества. [4]
Температура плавления твердого вещества – это та температура, при которой твердое вещество превращается в жидкость. Чистые кристаллические твердые вещества обычно имеют резко выраженные температуры плавления, так что превращение совершается в температурных пределах 1 или менее.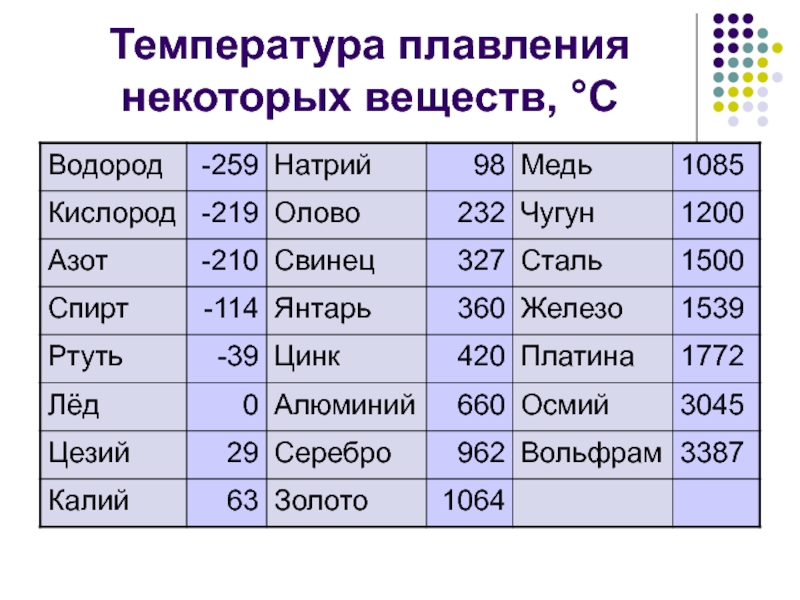 С другой стороны, твердые кристаллические вещества, содержащие примеси, обычно плавятся в гораздо более широком температурном диапазоне. Лишь незначительные изменения объема сопровождают переход от твердого состояния в жидкое, и, следовательно, температуры плавления в очень малой степени зависят от давления. Большинство кристаллических органических соединений имеют характерные температуры плавления, которые легко определить и воспроизвести. Благодаря этому температура плавления служит наиболее широко используемой физической константой. [5]
С другой стороны, твердые кристаллические вещества, содержащие примеси, обычно плавятся в гораздо более широком температурном диапазоне. Лишь незначительные изменения объема сопровождают переход от твердого состояния в жидкое, и, следовательно, температуры плавления в очень малой степени зависят от давления. Большинство кристаллических органических соединений имеют характерные температуры плавления, которые легко определить и воспроизвести. Благодаря этому температура плавления служит наиболее широко используемой физической константой. [5]
Температура плавления твердых веществ и ее постоянство при плавлении, так же как и температура кипения жидкостей, служит признаком чистоты или загрязненности исследуемого продукта и является вполне определенной и характерной величиной для каждого чистого твердого вещества. Примеси посторонних веществ изменяют температуру плавления данного вещества. [6]
Температурой плавления твердого вещества называется температура, при которой вещество из твердого состояния переходит в жидкое.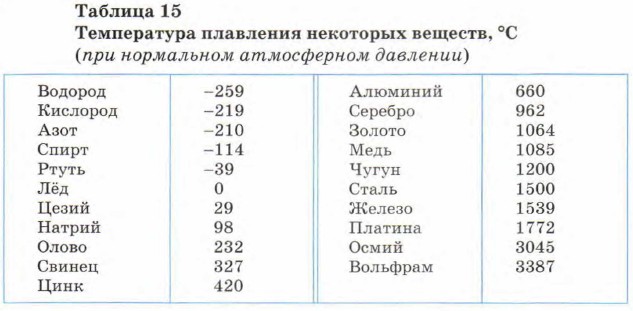 Температура плавления характеризует степень чистоты продукта и для смол может колебаться в значительных пределах. Так, например, температура плавления природных копалов и янтаря доходит до 300 С, для остальных тропических смол – от 75 до 145 С, а для синтетических – ниже или несколько выше 100 С. [8]
Температура плавления характеризует степень чистоты продукта и для смол может колебаться в значительных пределах. Так, например, температура плавления природных копалов и янтаря доходит до 300 С, для остальных тропических смол – от 75 до 145 С, а для синтетических – ниже или несколько выше 100 С. [8]
Определяют температуру плавления твердого вещества . [10]
Определяют температуру плавления твердого вещества ( стр. Слегка смазывают Апиезоном М шлифы в продольном направлении, собирают прибор, присоединяют его к вакуумной линии ( стр. Через внутреннюю часть прибора пропускают воду. [11]
Под температурой плавления твердого вещества понимают ту температуру, при которой оно превращается в жидкость. [12]
Тпп – температура плавления твердого вещества , К; Т – температура, при которой производился опыт, К; R – газовая постоянная. [13]
Кривая плавления ХС выражает ( влияние давления н-а температуру плавления твердого вещества . Температура плавления может либо повышаться, либо понижаться с повышением давления, но это влияние так мало, что линия ХС только слегка отклоняется от вертикали. [15]
[15]
Температурой плавления вещества называют температуру равновесия фаз твердое вещество – жидкость во время процесса плавления. Определить эту температуру можно в процессе плавления или в процессе застывания расплава, так как, если исключено переохлаждение, то температура застывания совпадает с температурой плавления. Различные наименования применяют для того, чтобы показать, каким методом было проведено определение температуры равновесия фаз твердое тело – жидкость: при нагревании наблюдают температуру плавления, при охлаждении – температуру затвердевания.
Точное определение фазового равновесия может быть успешным лишь тогда, когда нагревание или охлаждение идет настолько медленно, что действительно устанавливается необходимое равновесие. Определение точки плавления имеет особо важное значение при работе с органическими веществами, однако им пользуются также и при работе с неорганическими препаратами.
В связи с высокими температурами плавления неорганических веществ, определение обычными методами с капиллярами, погружаемыми в нагретые до определенной температуры бани, в большинстве случаев не удается.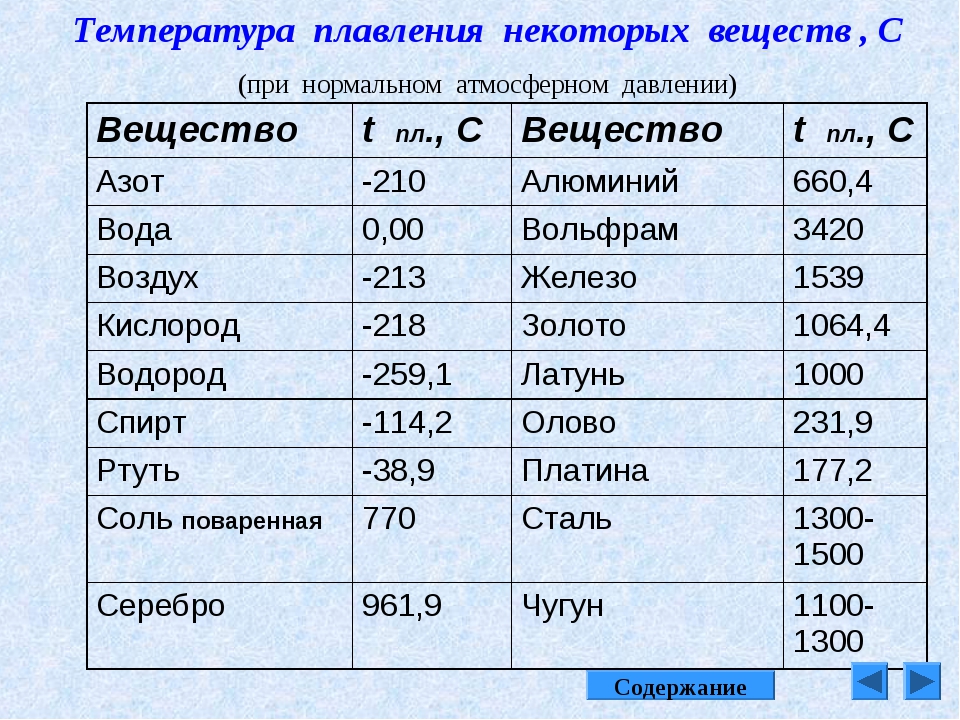 Определение температуры плавления неорганических веществ выполняют большей частью так называемым тигельным методом, наблюдая скорость охлаждения расплава при помощи погруженной в него термопары.
Определение температуры плавления неорганических веществ выполняют большей частью так называемым тигельным методом, наблюдая скорость охлаждения расплава при помощи погруженной в него термопары.
Одни исследователи считают, что температуре плавления отвечает момент появления жидкой фазы. По мнению других, точкой плавления следует считать момент полного исчезновения твердой фазы, то есть наступление полной прозрачности расплава при условии медленного нагревания.
Часто под температурой плавления подразумевают интервал температур между появлением первых капель жидкости и полным переходом твердого вещества в жидкое состояние. Для чистых индивидуальных веществ этот интервал измеряется долями градуса. Точнее определить температурный интервал плавления можно путем повторного расплавления образца после его застывания. О приближении расплавления узнают по стеканию расплавившихся частиц, которые обыкновенно при застывании высоко поднимаются по стенкам капилляра под действием капиллярных сил.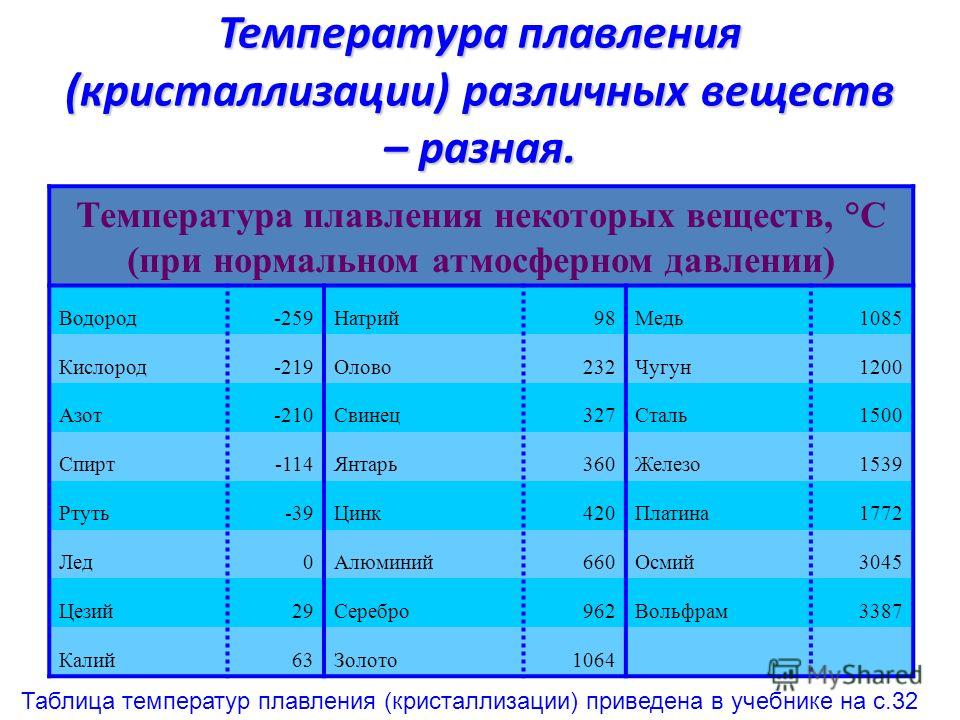
При наличии примеси точка плавления вещества понижается. Это дало повод предположить, что смеси веществ должны плавиться при более низкой температуре, чем составляющие их индивидуальные вещества. Отсутствие депрессии температуры плавления смеси исследуемого вещества со стандартными рассматривается как доказательство их идентичности (или их полной взаимной нерастворимости). Этим пользуются для идентификации химических соединений. Для этого смешивают в равных количествах (по 0,05 или 0,1 г) исследуемое вещество и химически чистое стандартное вещество (вещество сравнения) и определяют температуру плавления смеси. Если проба смешения плавится при той же температуре, что и каждый компонент в отдельности, то идентичность исследуемого вещества со стандартными считается доказанной. Если же проба смешения плавится при более низкой температуре, чем каждый компонент в отдельности, то это значит, что исследуемое вещество не идентично стандартному.
Определение температуры плавления пробы смешения – наиболее широко используемый и легко применимый критерий идентичности, которым, однако, следует пользоваться с осторожностью.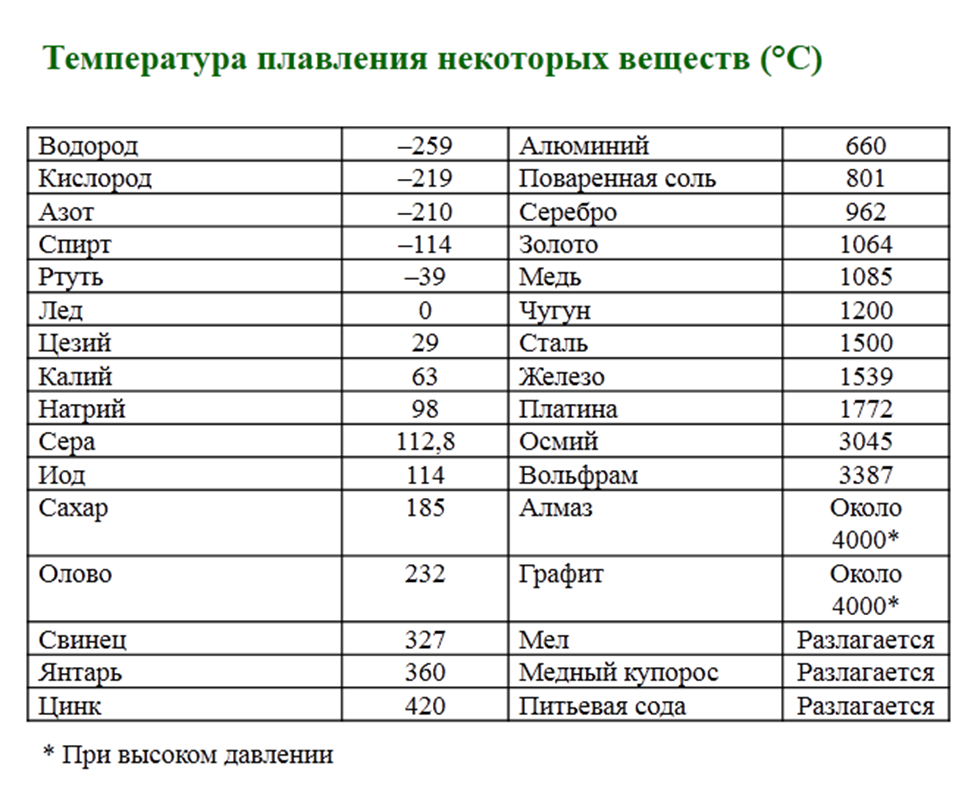 Наличие депрессии указывает на различие веществ, но отсутствие депрессии не всегда является свидетельством их идентичности. Отсутствие депрессии наблюдается иногда в случае двух сравнительно сложных соединений, имеющих незначительные структурные различия. Полезные сведения по определению температуры плавления можно найти в литературе.
Наличие депрессии указывает на различие веществ, но отсутствие депрессии не всегда является свидетельством их идентичности. Отсутствие депрессии наблюдается иногда в случае двух сравнительно сложных соединений, имеющих незначительные структурные различия. Полезные сведения по определению температуры плавления можно найти в литературе.
Определение температуры плавления в капилляре
Из всех методов определения температуры плавления органических соединений этот – наиболее распространенный. Техника его исполнения несложна. Небольшое количество тонко растертого и хорошо высушенного препарата помещают в запаянный с одного конца тонкостенный стеклянный капилляр длиной 45-50 мм и диаметром 1,0-1,2 мм для бесцветных и 0,8-1,0 мм для окрашенных веществ. (Для воскообразных и волокнистых веществ можно брать капиллярные трубки несколько большего размера.) Наполненный капилляр осторожно бросают 10-15 раз в стеклянную трубку высотой 800 мм и диаметром 15-20 мм, поставленную вертикально на часовое стекло, до уплотнения вещества в слой высотой около 2 мм.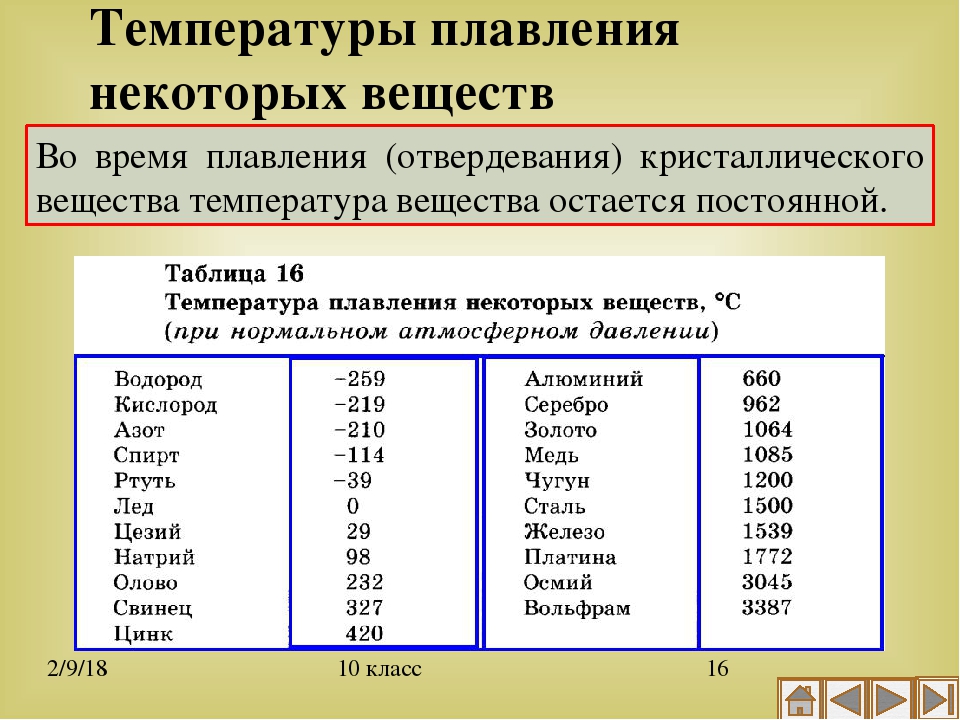 В случае определения трудно уплотняемого вещества капилляр набивают при помощи другого капилляра, меньшего диаметра. Оплавлять открытый конец капилляра недопустимо, так как при этом попадает внутрь конденсационная вода.
В случае определения трудно уплотняемого вещества капилляр набивают при помощи другого капилляра, меньшего диаметра. Оплавлять открытый конец капилляра недопустимо, так как при этом попадает внутрь конденсационная вода.
Температуру плавления гигроскопических и возгоняющихся веществ определяют в капиллярах, запаянных с обоих концов; при этом капиллярная часть должна быть целиком погружена в нагревательную баню (нагревательный блок).
Капилляр закрепляют на термометре резиновым колечком (кольцо отрезают от подходящего по размерам резинового шланга), медной проволокой или приклеивают верхний конец каплей серной кислоты. Проба вещества должна находиться на уровне шарика термометра.
При переходе из твердого состояния в жидкое в обычных условиях нагревания в капилляре можно наблюдать следующие явления: усадка вещества – столбик вещества меняет свою форму, сжимаясь и отставая от стенок капилляра, без видимого перехода в жидкое состояние; отпотевание – на внутренней поверхности капиллярной трубочки появляются капельки жидкости, вещество спекается, не теряя своей связности; частичное плавление – в капилляре наряду с твердыми частицами образуется мениск жидкости по всему сечению капилляра. После этого при несколько более высокой температуре наступает состояние полного расплавления.
После этого при несколько более высокой температуре наступает состояние полного расплавления.
Температуру плавления большей частью считывают с термометра, когда вещество полностью расплавилось, образовав прозрачный расплав.
Чтобы избежать довольно больших и порой недостаточно надежных поправок на выступающий столбик ртути, рекомендуется применять укороченные термометры из набора ТЛ-6 (по Аншютцу).
Многие органические вещества плавятся с разложением (появление окраски, выделение газа). Температура разложения обычно не резко выражена и часто не может быть точно воспроизведена.
Определение температуры плавления в капиллярах может быть выполнено очень точно, если в предварительном опыте определить приблизительно температуру плавления вещества и затем капилляр с веществом поместить в прибор, нагретый до температуры на несколько градусов ниже этого приблизительного значения.
В качестве обогревательной жидкости (теплоносителя) используют концентрированную серную кислоту, парафиновое масло, силиконовое масло. Серную кислоту, применение которой требует большой осторожности, можно использовать при определении температуры плавления вплоть до 250 °С. Смесь конц. h3SO4 (7 масс, ч) и K2SO4 (3 ч.) после 5-минутного кипячения при энергичном перемешивании образуют прозрачную жидкость, которую можно использовать в качестве теплоносителя до 320°С (смесь гигроскопична, и ее следует предохранять от увлажнения).
Серную кислоту, применение которой требует большой осторожности, можно использовать при определении температуры плавления вплоть до 250 °С. Смесь конц. h3SO4 (7 масс, ч) и K2SO4 (3 ч.) после 5-минутного кипячения при энергичном перемешивании образуют прозрачную жидкость, которую можно использовать в качестве теплоносителя до 320°С (смесь гигроскопична, и ее следует предохранять от увлажнения).
Предложено много конструкций приборов для определения температуры плавления капиллярным методом. Отечественная промышленность выпускает два типа таких приборов.
Прибор ПТОП. Этот прибор (рис. 206) состоит из круглодонной колбы 1 вместимостью 100-150 мл с горлом длиной 90 мм и диаметром 30 мм. В колбу наливают на 2/3 ее объема бесцветной конц. h3SO4 или бесцветного силиконового масла. В горло колбы вставляют специальную пробирку 3 длиной 150 мм и диаметром около 15 мм с приплавленными к ней четырьмя отростками 4 на расстоянии 30 мм от ее верхнего края. Над одним из отростков в пробирке имеется отверстие 5 диаметром 2-3 мм.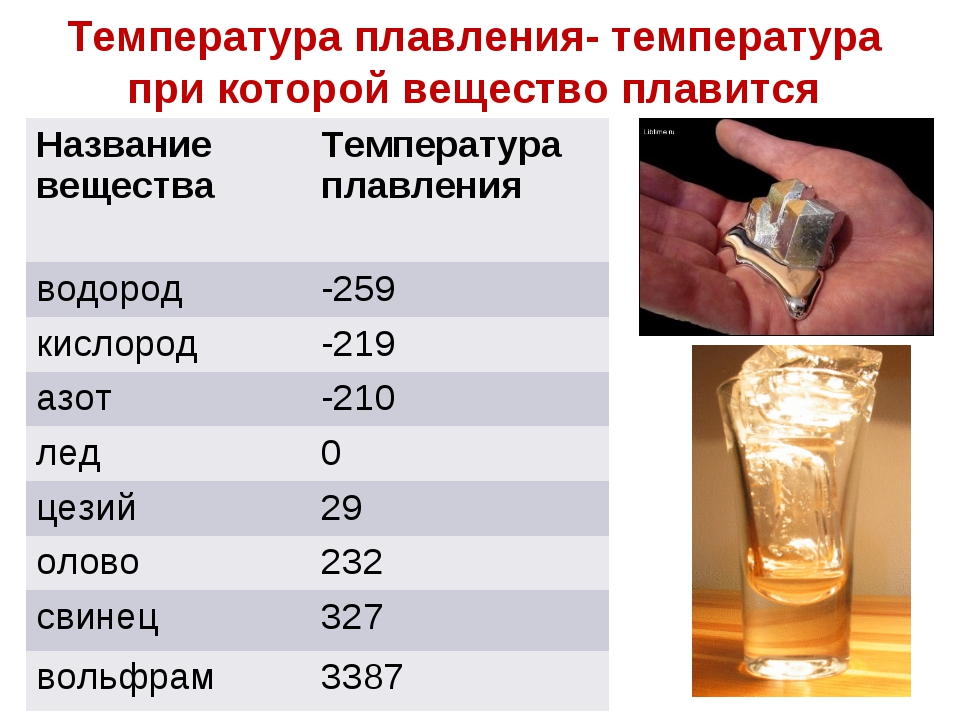
Пробирку вставляют в колбу так, чтобы между дном пробирки и колбы оставалось 10-15 мм. Пробирку закрывают корковой пробкой 6 со вставленным в нее укороченным термометром, из набора ТЛ-6 (по Аншютцу), нижний конец которого должен находиться на несколько миллиметров выше дна пробирки. При определении температуры плавления веществ, плавящихся ниже 170 °С, применяют порожнюю пробирку; для веществ с температурой плавления выше 170 °С в пробирку наливают конц. h3SO4 или силиконовое масло так, чтобы ртутный резервуар термометра был погружен в нее. Для веществ с температурой плавления 250-320 °С пробирку и колбу наполняют упомянутой выше смесью h3SO4 и K2SO4.
Содержимое колбы нагревают до температуры на 10-15 °С ниже предполагаемой температуры плавления препарата, измеряя температуру в колбе термометром, после чего в пробирку помещают укороченный термометр с капилляром так, чтобы ни термометр, ни капилляр не касались дна и стенок пробирки. Затем продолжают нагревать прибор, повышая температуру со скоростью 0,5 °С в минуту.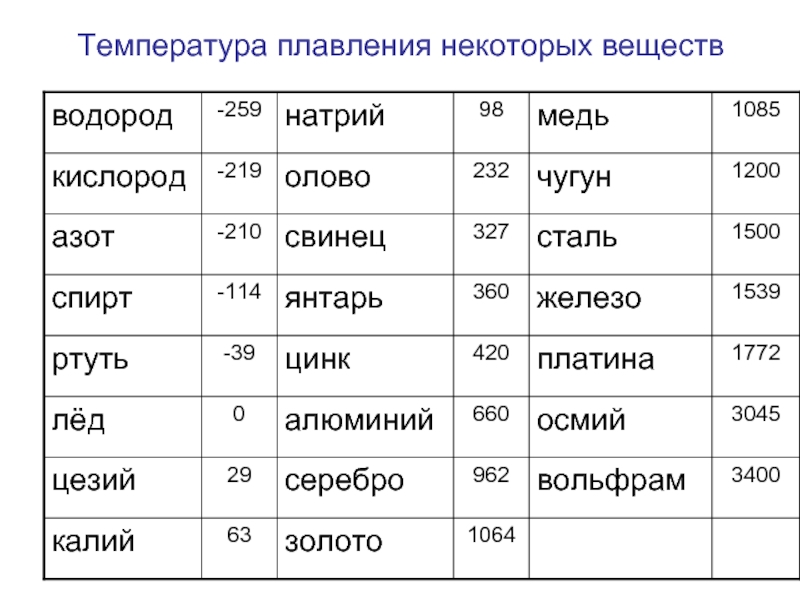 Если вещество в процессе определения температуры плавления разлагается, то скорость нагрева увеличивают до 2-3°С в минуту или капилляр с препаратом перемещают в прибор, предварительно нагретый до температуры приблизительно на 5°С ниже предполагаемой температуры плавления.
Если вещество в процессе определения температуры плавления разлагается, то скорость нагрева увеличивают до 2-3°С в минуту или капилляр с препаратом перемещают в прибор, предварительно нагретый до температуры приблизительно на 5°С ниже предполагаемой температуры плавления.
Началом плавления считают появление первой капли расплавленного препарата или появление мениска в капилляре, а концом – момент полного расплавления препарата. Обе температуры отмечают и считают интервалом температуры плавления препарата.
Прибор ПТП. В отличие от описанного выше, в приборе ПТП (рис. 207) предусмотрен электронагрев капилляра с пробой. Прибор предназначен для определения температуры плавления веществ в диапазоне 20-360 °С при регулируемых скоростях нагрева 1, 2, 4, 6, 8 и 10 °С в минуту.
Основной частью прибора является блок-нагреватель 6; он состоит из двух сосудов из термостойкого стекла, вставленных один в другой. На внутренний сосуд навита бифилярно константановая спираль 5.
В блок-нагреватель устанавливают термометр 8, к которому крепят капилляры 8.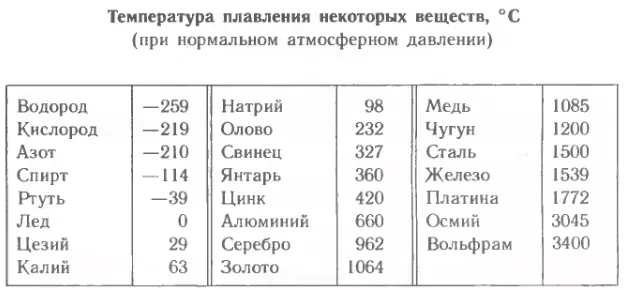
Прибор снабжен номограммой 1, позволяющей при определенной фиксированной глубине погружения термометров установить напряжение, необходимое для заданной скорости нагревания.
Для удобства наблюдения за плавлением вещества и шкалой термометра на приборе установлены оптическое приспособление 9 с фокусировкой н два осветителя 4 с рефлекторами.
Исследуемый образец тонкоизмельченного сухого вещества помещают в капиллярную трубку 8, запаянную с одного конца, которая устанавливается так, чтобы столбик вещества находился на уровне середины ртутного резервуара термометра. Затем включают прибор в сеть.
По номограмме 1 определяют напряжение, соответствующее необходимой скорости нагрева; включают нагреватель 6 и осветители. При помощи ручки регулятора 10, следя за показанием вольтметра 3, устанавливают необходимое напряжение. За процессом плавления наблюдают при помощи оптического приспособления 9, а за показаниями термометра – с помощью дополнительной лупы.
В виду некоторого влияния температуры окружающей среды и движения воздуха вокруг блока-нагревателя 6, необходима дополнительная коррекция скорости нагрева, которая осуществляется вручную регулятором напряжения 10.
Медные блоки. Температуру плавления высокоплавких веществ (>300 °С) лучше всего определять нагреванием капилляров в медных блоках. Термометр помещают в горизонтальный канал блока, на поверхности которого находится ряд углублений, расположенных на равных расстояниях. Система каналов под острым углом друг к другу позволяет рассматривать капилляр как в проходящем, так и в отраженном свете от источника, установленного за отверстием канала. Выходные отверстия каналов во избежание движения воздуха закрыты стеклом. После предварительного грубого определения температуры плавления образца термометр выдвигают из блока настолько, чтобы можно было только отсчитать ожидаемую температуру. Проба вещества устанавливается в углублении, ближайшем к шарику термометра.
Определение температуры плавления на нагреваемой поверхности
При определении температуры плавления легко разлагающихся при нагревании веществ наиболее точные результаты могут быть получены при максимальном сокращении времени от момента начала нагревания вещества до его плавления. Это достигается применением различного типа блоков для плавления на открытой поверхности. Одним из таких блоков является нагреватель Кофлера.
Это достигается применением различного типа блоков для плавления на открытой поверхности. Одним из таких блоков является нагреватель Кофлера.
Нагреватель представляет собой металлический брусок длиной около 370 мм и шириной около 40 мм, в котором посредством одностороннего электрического обогрева создан перепад температур. Благодаря форме бруска и использованию двух металлов с различной теплопроводностью его температурный градиент приближается к линейному. При помощи этого нагревателя можно определять температуру плавления веществ в интервале 50-250 °С. Для отсчета температур служит металлическая шкала с ценой деления 2 °С. Вмонтированный в прибор стабилизатор исключает влияние колебаний напряжения в сети и обеспечивает всегда одинаковое нагревание.
Исследуемое вещество насыпают непосредственно на хромированную поверхность нагревателя. Вскоре можно увидеть более или менее четкую границу жидкой и твердой фазами. Пределы точности определения 1-2°С.
Криоскопический метод
Очень точно определить температуру плавления можно криоскопическим методом – по кривым охлаждения.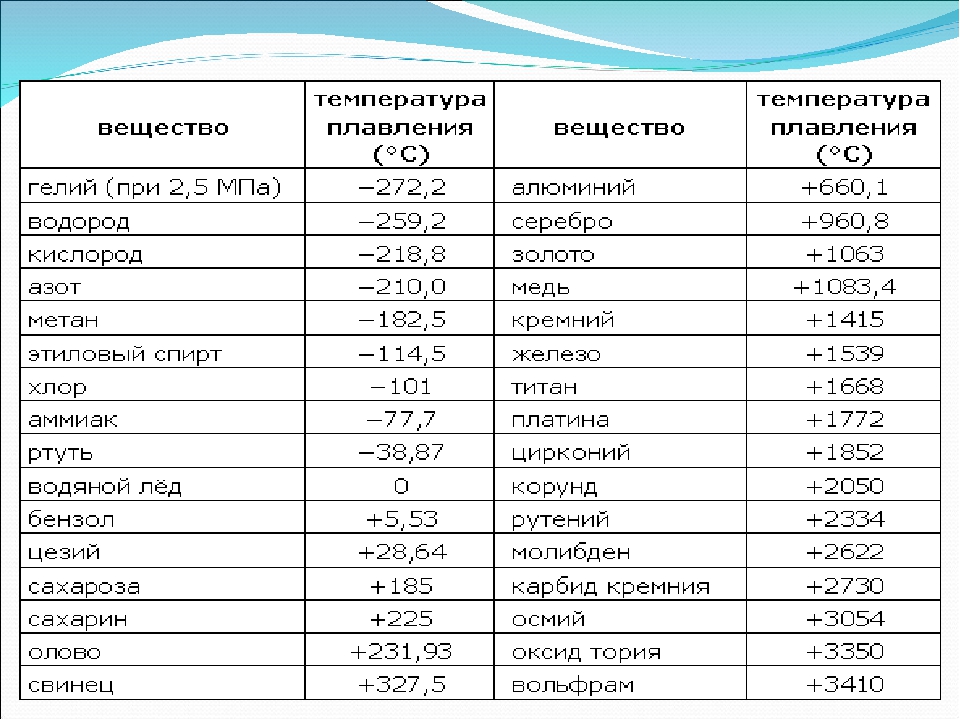 Этот метод позволяет установить не только температуру плавления, но и процентное содержание примеси. При кристаллизации расплавленного вещества в отсутствие переохлаждения температура остается почти постоянной, что связано с выделением скрытой теплоты кристаллизации.
Этот метод позволяет установить не только температуру плавления, но и процентное содержание примеси. При кристаллизации расплавленного вещества в отсутствие переохлаждения температура остается почти постоянной, что связано с выделением скрытой теплоты кристаллизации.
Недостатком этого метода является то, что для этого требуется значительно больше испытуемого вещества, чем при определении в капиллярах.
Определение температуры кристаллизации органических реактивов и препаратов в пределах 20-100 °С по кривой охлаждения проводят в приборе Баумана-Фрома (рис. 208).
Прибор Баумана-Фрома состоит из стеклянного толстостенного сосуда 3, нижняя часть которого имеет диаметр 20 мм, а верхняя – 50 мм. В верхнюю часть помещают насадку 1 в виде стаканчика. В дне насадки имеются два отверстия для термометра 4 и мешалки 5. Последние свободно подвешены в отверстиях на пробковых пластинках 2. Цилиндрический сосуд с насадкой помещают в широкую пробирку 6 диаметром 40-45 мм. Весь прибор помещают в стакан вместимостью 500 мл.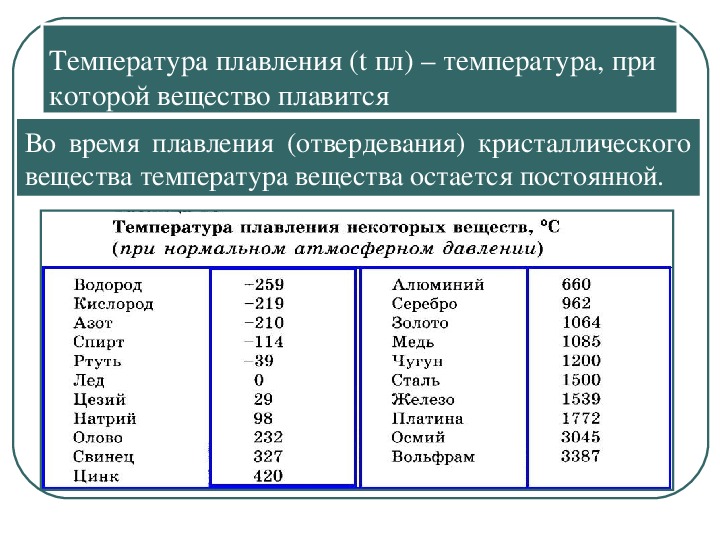
Испытуемый препарат помещают в сосуд 3 и расплавляют, погружая в стакан с водой, нагретой до температуры на 15-20 °С выше предполагаемой температуры кристаллизации. Слой расплавленного препарата должен быть высотой 25-30 мм.
Сосуд с расплавленным препаратом вынимают из воды, насухо вытирают, вставляют в пробирку 6 и закрепляют на штативе. В расплавленный препарат погружают термометр 4 и мешалку 5 так, чтобы они не касались ни дна, ни стенок сосуда 3 и чтобы ртутный резервуар термометра был полностью погружен в испытуемое вещество.
Испытуемое вещество в приборе охлаждают на 2-3°С ниже предполагаемой температуры кристаллизации и осторожно помешивают, не касаясь дна и стенок прибора.
В момент кристаллизации вещества температура самопроизвольно повышается (в этот момент прекращают перемешивание) и, достигнув определенного максимума, остается на этом уровне в течение некоторого времени, а затем вновь начинает понижаться. Высшую точку подъема температуры принимают за температуру кристаллизации.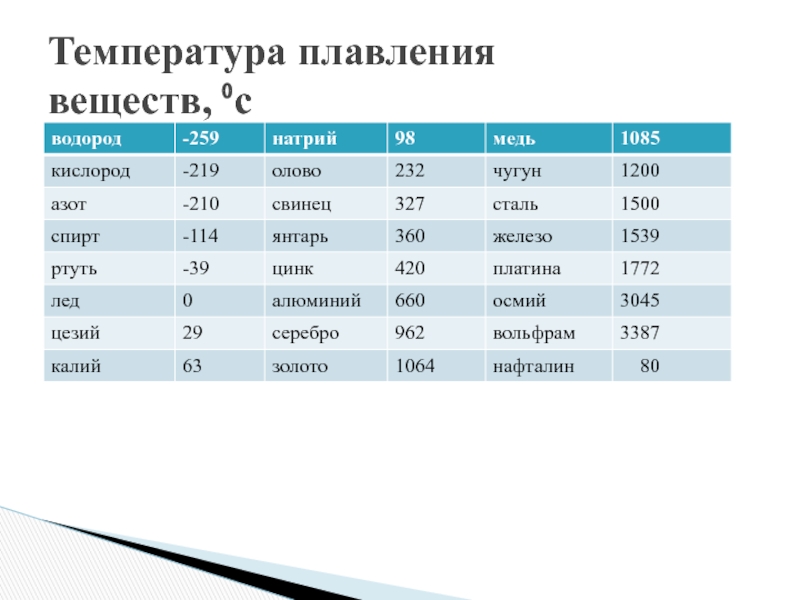
Примером фазового перехода первого рода являются плавление и кристаллизация твердых тел. Процесс плавления играет важную роль в природе (плавление снега и льда на поверхности Земли, плавление минералов в её недрах и т.д.) и в технике (производство металлов и сплавов, литьё в формы и др.).
Плавление — это процесс перехода тела из кристаллического твёрдого состояния в жидкое.
Главными характеристиками плавления чистых веществ являются температура плавления (Тпл) и теплота (теплота плавления Qпл), которая необходима для осуществления процесса плавления.
В процессе плавления температура кристалла остается постоянной. Эта температура и называется температурой плавления Тпл.. У каждого вещества своя температура плавления. Температура плавления для данного вещества зависит от атмосферного давления. Самую высокую температуру плавления среди чистых металлов имеет вольфрам (3410 °С), самую низкую –
ртуть (–38,9 °С).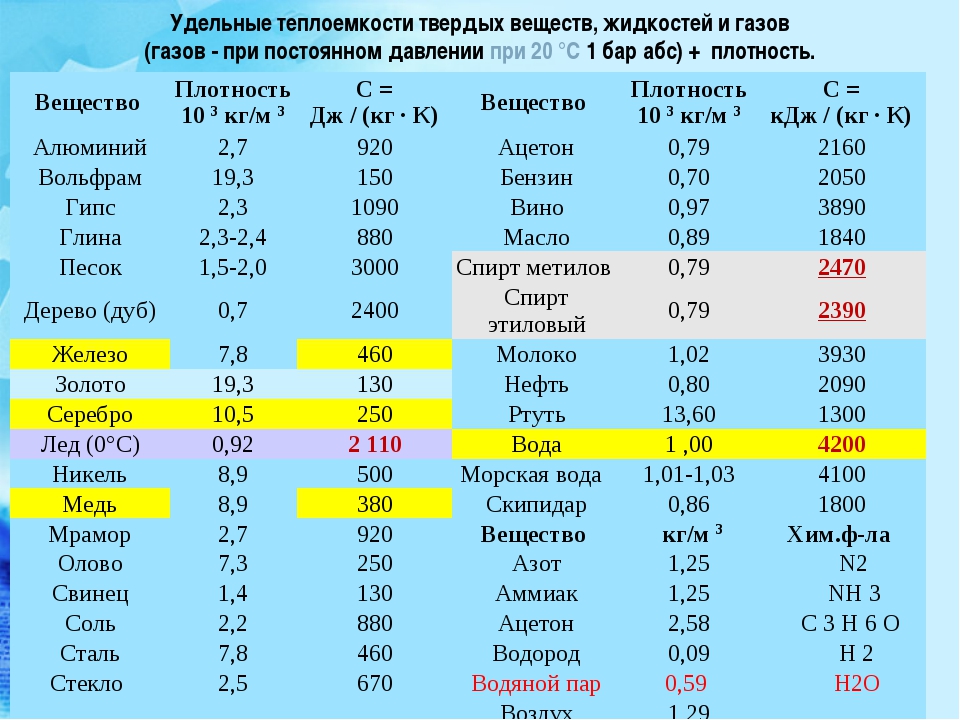
Постоянство температуры объясняется тем, что при плавлении вся подводимая теплота идет на разупорядочение регулярного пространственного расположения атомов (молекул) в кристаллической решетке. Для большинства кристаллов (кроме воды, и некоторых сплавов) температура плавления растет с увеличением внешнего давления, так как для отдаления атомов друг от друга при большем давлении требуется большая энергия тепловых движений, т. е. более высокая температура.
Расплавленное вещество обладает большим запасом внутренней энергии, чем в твердом состоянии. Оставшаяся часть теплоты плавления расходуется на совершение работы по изменению объема тела при его плавлении. При плавлении объем большинства кристаллических тел увеличивается (на 3-6%), а при отвердевании уменьшается. Но, существуют вещества, у которых при плавлении объем уменьшается, а при отвердевании – увеличивается. К ним относятся, например, вода и чугун, кремний и некоторые другие. Именно поэтому лёд плавает на поверхности воды, а твердый чугун – в собственном расплаве.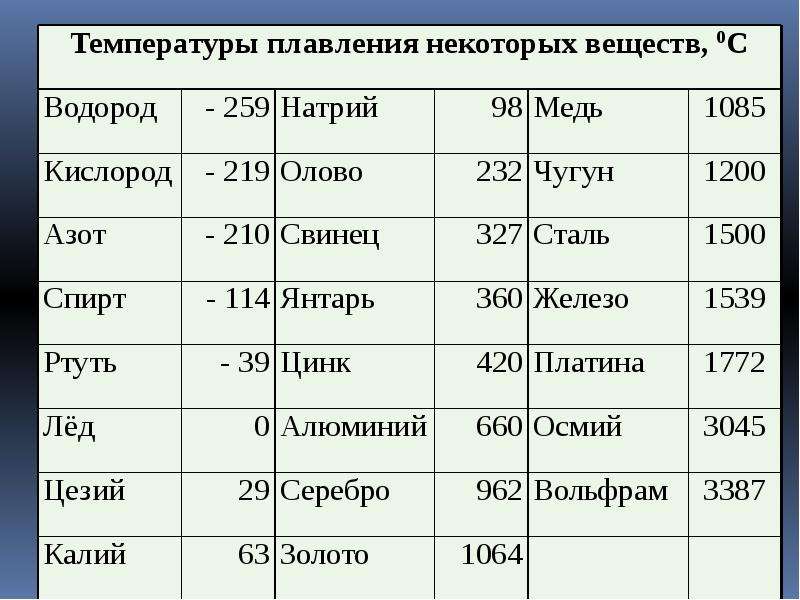
Плавление начинается при достижении кристаллическим веществом Тпл. С начала плавления до его завершения температура вещества остаётся постоянной и равной Тпл, несмотря на сообщение веществу теплоты (рис. 1). Нагреть кристалл до Т > Тпл в обычных условиях не удаётся, тогда как при кристаллизации сравнительно легко достигается значительное переохлаждение расплава.
Плавление происходит с поглощением скрытой теплоты фазового перехода – теплоты плавления Qпл..
Удельная теплота плавления qпл. показывает, какое количество теплоты необходимо для полного превращения 1 кг вещества из твердого состояния в жидкое, взятого при температуре плавления: qпл. = Qпл./m, Дж/кг.
Плавление сопровождается изменением физических свойств вещества: увеличением энтропии, что отражает разупорядочение кристаллической структуры вещества; ростом теплоёмкости, электрического сопротивления.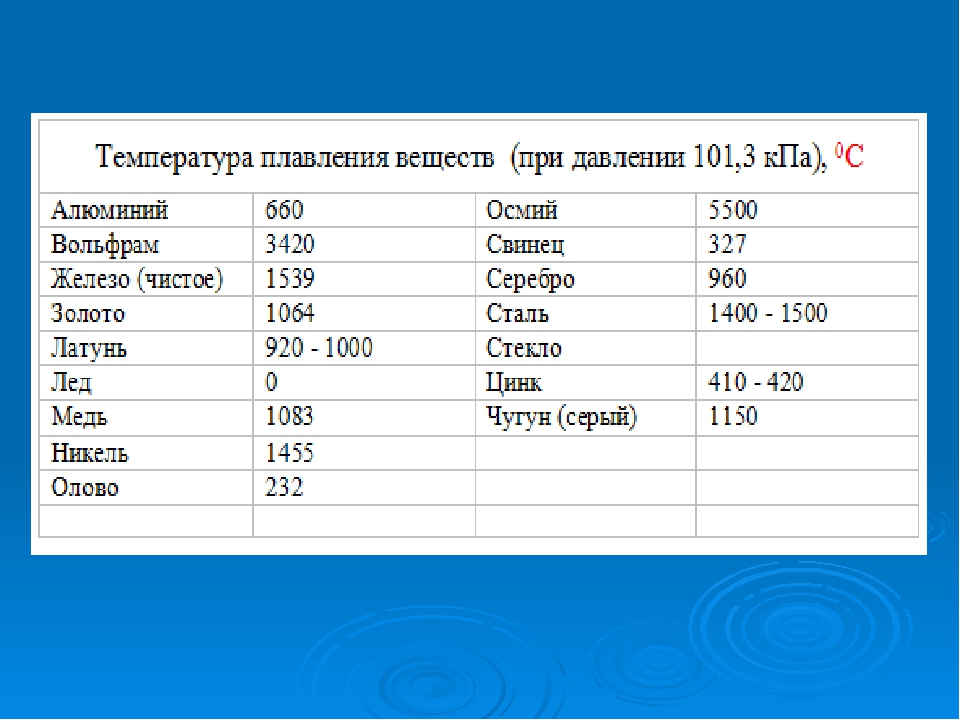 Практически до нуля падает при плавлении сопротивление сдвигу, уменьшается скорость распространения звука (продольных волн) и т.д.
Практически до нуля падает при плавлении сопротивление сдвигу, уменьшается скорость распространения звука (продольных волн) и т.д.
Рис. 1. Остановка температуры при плавлении кристаллического тела.
По оси абсцисс отложено время τ, пропорциональное равномерно подводимому к телу количеству теплоты.
Согласно молекулярно-кинетическим представлениям, плавление осуществляется следующим образом. При подведении к кристаллическому телу теплоты увеличивается энергия колебаний (амплитуда колебаний) его атомов, что приводит к повышению температуры тела и способствует образованию в кристалле различного рода дефектов (незаполненных узлов кристаллической решётки — вакансий; нарушений периодичности решётки атомами, внедрившимися между её узлами, и др. В молекулярных кристаллах может происходить частичное разупорядочение взаимной ориентации осей молекул, если молекулы не обладают сферической формой. Постепенный рост числа дефектов и их объединение характеризуют стадию предплавления. С достижением Тпл в кристалле создаётся критическая концентрация дефектов, начинается плавление— кристаллическая решётка распадается на легкоподвижные субмикроскопические области. Подводимая при плавлении теплота идёт не на нагрев тела, а на разрыв межатомных связей и разрушение дальнего порядка в кристаллах. В самих же субмикроскопических областях ближний порядок в расположении атомов при плавлении существенно не меняется. Этим объясняются меньшие значения теплот плавления Qпл по сравнению с теплотами парообразования и сравнительно небольшое изменение ряда физических свойств веществ при их плавлении. По мере возрастания температуры молекулы движутся все интенсивнее. При нагревании возрастает не только молекулярно-кинетическая энергия тела, но и потенциальная энергия взаимодействия его атомов, поскольку при увеличении амплитуды колебаний атомы отходят друг от друга на большее расстояние и сближаются на меньшее расстояние, благодаря чему энергия взаимодействия их электрических зарядов возрастает.
С достижением Тпл в кристалле создаётся критическая концентрация дефектов, начинается плавление— кристаллическая решётка распадается на легкоподвижные субмикроскопические области. Подводимая при плавлении теплота идёт не на нагрев тела, а на разрыв межатомных связей и разрушение дальнего порядка в кристаллах. В самих же субмикроскопических областях ближний порядок в расположении атомов при плавлении существенно не меняется. Этим объясняются меньшие значения теплот плавления Qпл по сравнению с теплотами парообразования и сравнительно небольшое изменение ряда физических свойств веществ при их плавлении. По мере возрастания температуры молекулы движутся все интенсивнее. При нагревании возрастает не только молекулярно-кинетическая энергия тела, но и потенциальная энергия взаимодействия его атомов, поскольку при увеличении амплитуды колебаний атомы отходят друг от друга на большее расстояние и сближаются на меньшее расстояние, благодаря чему энергия взаимодействия их электрических зарядов возрастает. С повышением температуры наступает, наконец, такой момент, когда поддержание порядка среди сильно раскачивающихся атомов становится невозможным, и с этого момента начинается разрушение кристаллической решетки, в результате чего исчезает и дальний порядок. Твердое тело плавится.
С повышением температуры наступает, наконец, такой момент, когда поддержание порядка среди сильно раскачивающихся атомов становится невозможным, и с этого момента начинается разрушение кристаллической решетки, в результате чего исчезает и дальний порядок. Твердое тело плавится.
У аморфных тел изменение температуры со временем не имеет участка с постоянной температурой, а только точку перегиба. Увеличение температуры твердого аморфного тела сопровождается непрерывным уменьшением его вязкости.
Обратный переход вещества в твердое состояние возможен как из жидкого, так и из газообразного состояния. И в том и в другом случае такой переход осуществляется из состояния, лишенного симметрии, в состояние, в котором симметрия существует (это относится к дальнему порядку, который имеет место в кристаллах и которого нет ни в жидкостях, ни в газах). Поэтому переход в твердое состояние должен происходить скачком при определенной температуре, в отличие от перехода жидкость–пар, который может происходить непрерывно.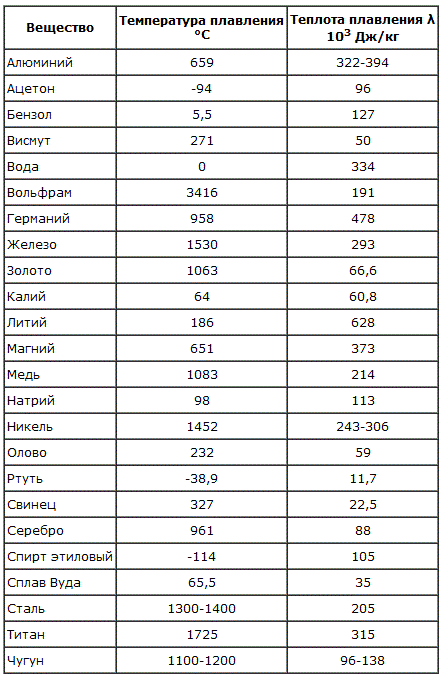 Процесс образования твердого тела при охлаждении жидкости есть процесс образования кристалла (кристаллизация) и происходит он при определенной температуре – температуре кристаллизации. Так как при таком превращении энергия системы уменьшается, то такой переход должен сопровождаться выделением энергии в виде теплоты кристаллизации. Из закона сохранения энергии следует, что теплота плавления и теплота кристаллизации должны быть равны друг другу.
Процесс образования твердого тела при охлаждении жидкости есть процесс образования кристалла (кристаллизация) и происходит он при определенной температуре – температуре кристаллизации. Так как при таком превращении энергия системы уменьшается, то такой переход должен сопровождаться выделением энергии в виде теплоты кристаллизации. Из закона сохранения энергии следует, что теплота плавления и теплота кристаллизации должны быть равны друг другу.
Не нашли то, что искали? Воспользуйтесь поиском:
ГОСТ 18995.4-73 Продукты химические органические. Методы определения интервала температуры плавления / 18995 4 73
|
ПРОДУКТЫ ХИМИЧЕСКИЕ ОРГАНИЧЕСКИЕ Методы определения интервала температуры плавления Organic chemical products. Methods for determination of melting point interval |
ГОСТ |
Дата введения 01.07.74
Настоящий стандарт распространяется на органические химические продукты (реактивы, особо чистые вещества и технические продукты) и устанавливает капиллярный и термомикрометоды определения интервала температуры плавления твердых кристаллических продуктов, которые плавятся при температуре до 350 °С.
Сущность капиллярного метода заключается в измерении температуры, при которой визуально наблюдается момент перехода пробы, помещенной в стеклянный капилляр и нагреваемой с регулируемой скоростью, в расплавленное состояние.
Сущность термомикрометода заключается в нагревании пробы с регулируемой скоростью на предметном столике микроскопа и измерении температуры начала и конца плавления.
1.1. Для определения температуры плавления капиллярным методом применяют:
прибор с электрообогревом, безжидкостный, тип ПТП;
прибор с жидким теплоносителем (чертеж), состоящий из
круглодонной колбы 1 из термостойкого стекла, вместимостью 150-180 см3
с высотой горла не менее 65 мм, диаметром горла (29 ± 1) мм и пробирки из
термостойкого стекла 2 высотой (150 ± 2) мм и диаметром (19 ± 1) мм с
шаровидным расширением в верхней части. В верхней части пробирки и колбы
имеется по одному отверстию
В верхней части пробирки и колбы
имеется по одному отверстию
Допускается применение пробирки без шаровидного расширения таких же размеров с четырьмя отростками, припаянными к пробирке для ее крепления в колбе.
Пробирку помещают в колбу так, чтобы расстояние между дном пробирки и дном колбы было 15-20 мм. Колбу наполняют жидким теплоносителем на 4/5 объема. Такой же теплоноситель наливают и в пробирку так, чтобы ртутный резервуар термометра и капилляра находился в середине слоя жидкости.
Для исключения влияния колебаний воздуха на скорость нагревания и в целях безопасности прибор помещают в жестяной или алюминиевый кожух, в котором имеется застекленное смотровое окно или двухслойный экран из силикатного и органического стекла.
Допускается применять другие приборы, обеспечивающие
проведение определения в том же режиме нагрева.
Термометры ртутные стеклянные лабораторные укороченные (не более 300 мм) с ценой деления 0,05; 0,1 или 0,2 °С и установленной температурной поправкой. Допускается использование термометров с ценой деления 0,5 °С и установленной температурной поправкой.
Термометр с ценой деления 1,0 °С (вспомогательный).
Эксикаторы по ГОСТ 25336.
Теплоносители:
для нагрева до 200 °С:
масло вазелиновое по ГОСТ 20799,
глицерин по ГОСТ 6259,
масло парафиновое синтетическое,
кислота серная по ГОСТ 4204.
При потемнении серной кислоты следует добавить в нее несколько кристаллов азотнокислого калия (ГОСТ 4217).
для нагрева до 300 °С:
жидкость кремнийорганическая ПФМС-4 по ГОСТ 15866,
смесь калия сернокислого (ГОСТ 4145) и серной кислоты;
готовят следующим образом: смешивают семь весовых частей серной кислоты и три весовые
части сернокислого калия в стакане из термостойкого стекла (ГОСТ
25336).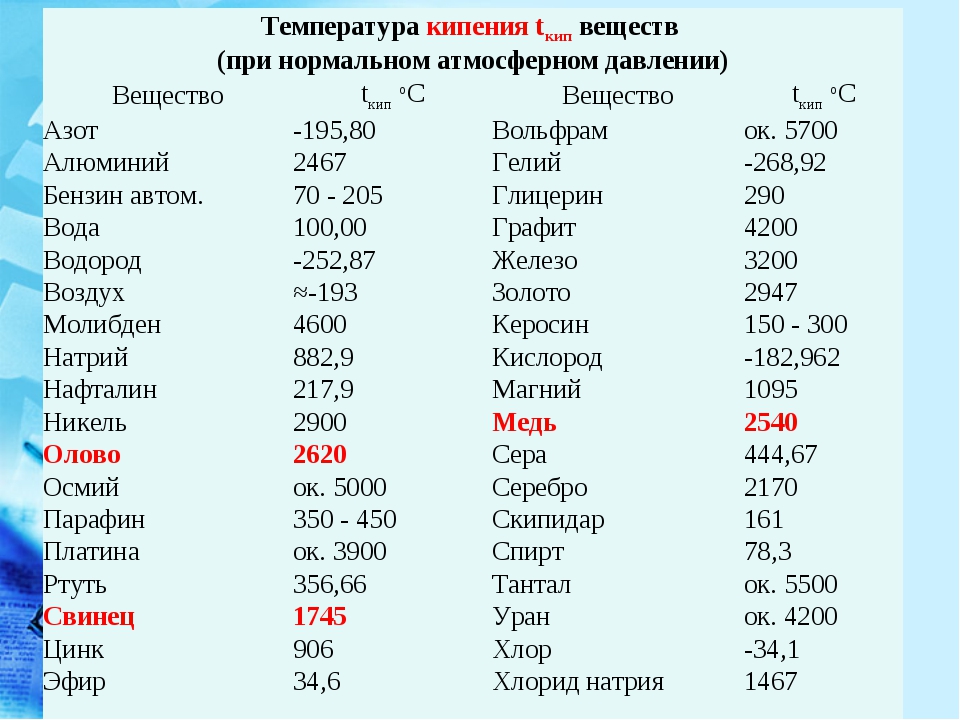
Капилляры.
Секундомер механический.
(Измененная редакция, Изм. № 1, 2, 3).
1.2. Для определения температуры плавления термомикрометодом применяют:
блок электрический нагревательный с термометром и микроскопом;
термометры калиброванные ртутные с ценой деления шкалы, которая должна быть указана в нормативно-технической документации на испытуемый продукт;
стекла подкладочные (стеклянное основание толщиной от 0,5 до 1,2 мм).
(Измененная редакция, Изм. № 2, 3).
1 — круглодонная колба; 2 — пробирка; 3 — корковая
пробка;
4 — вспомогательный термометр для измерения температуры
выступающей части столбика ртути;
5 — термометр; 6- отверстия; 7-капилляр с пробкой
А.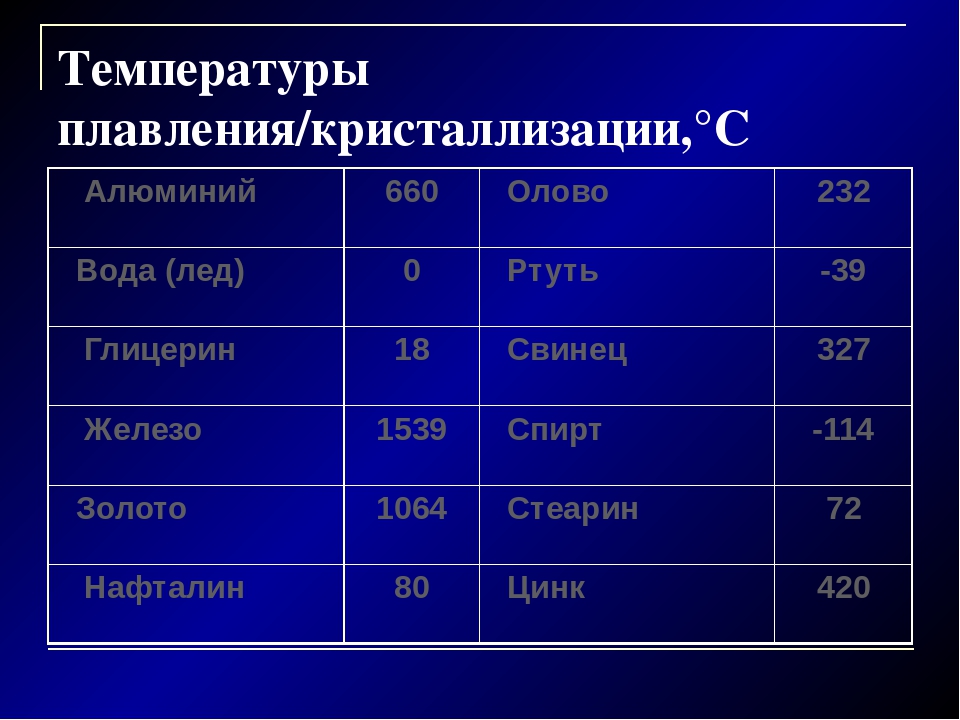 Капиллярный метод
Капиллярный метод
2.1. Для приготовления капилляров применяют стеклянные трубки, предварительно очищенные хромовой смесью, затем тщательно промытые дистиллированной водой (ГОСТ 6709) и высушенные. Из трубки вытягивают в пламени равномерные капилляры с внутренним диаметром 0,8 — 1,2 мм; толщина стенки капилляра не должна превышать 0,2 мм. Вытянутые капилляры разделяют в пламени горелки на отдельные капилляры длиной 70 — 100 мм. Запаянные с двух сторон капилляры хранят в сухих чистых банках. Перед применением запаянный конец с одной стороны обламывают так, чтобы длина капилляра была 45 — 50 мм. Запаянное дно капилляра должно быть толщиной не более 1 мм.
2.2. Температуру плавления разлагающихся, гигроскопичных или сублимирующихся веществ определяют в капилляре, запаянном с обоих концов.
2.3. Небольшое количество препарата растирают в чистой сухой
агатовой из органического стекла или стеклянной ступке. При указании в
нормативно-технической документации на испытуемое вещество его высушивают в
эксикаторе над соответствующим обезвоживающим веществом или в термостате.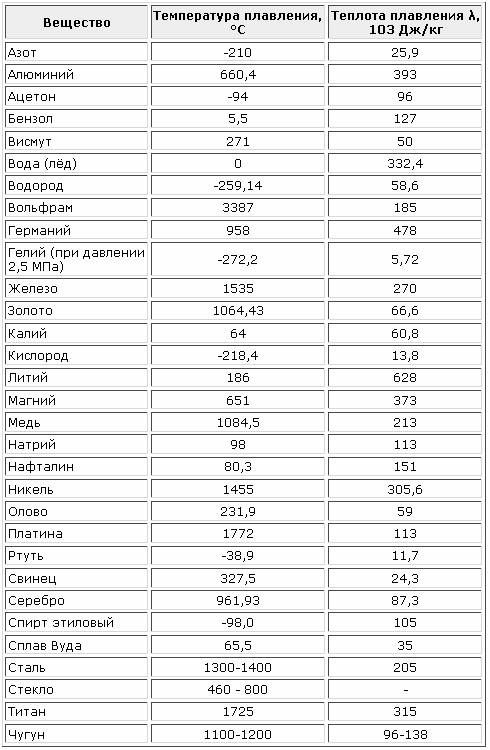
2.4. Испытуемую пробу помещают в капилляр следующим образом: открытым концом набирают часть растертого вещества, поворачивают капилляр заплавленным концом вниз и бросают его 10 — 15 раз через стеклянную трубку длиной 800 — 1000 мм диаметром 15 — 20 мм, поставленную вертикально на часовое или любое другое стекло до уплотнения порошка в капилляре. Операцию повторяют до получения столбика пробы высотой 2 — 3 мм.
При определении температуры плавления трудноуплотняющихся веществ небольшие порции их уплотняют вторым капилляром меньшего диаметра, запаянным с одного конца.
Капилляр с испытуемым веществом прикрепляют к термометру резиновым кольцом или проволокой, или специальной ячейкой с гнездами так, чтобы середина слоя препарата в капилляре и середина ртутного резервуара термометра находились на одном уровне.
2.3, 2.4. (Измененная редакция, Изм. № 3).
2.5. Если одним и тем же прибором нужно провести
последовательно несколько определений температуры плавления, то перед каждым
следующим определением прибор необходимо охладить до температуры на 30 — 40 °С
ниже ожидаемой температуры плавления.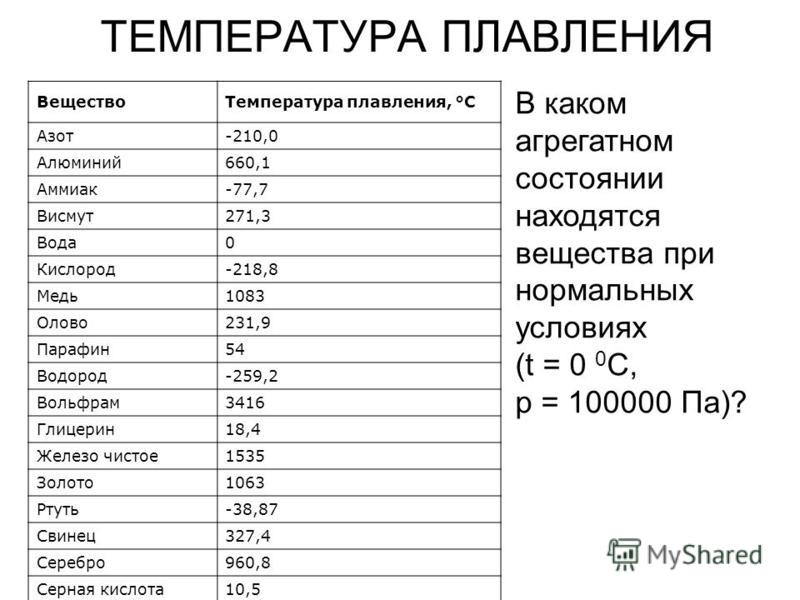
2.6. Для веществ, у которых результаты определения температуры плавления одинаковые при использовании пустой внутренней пробирки и пробирки, содержащей жидкий теплоноситель, допускается проводить определение в приборе с пустой внутренней пробиркой, о чем должно быть указано в нормативно-технической документации на соответствующее вещество.
2.7. Определение температуры плавления веществ, плавящихся при температуре выше 250 °С, можно проводить на приборе, не содержащем жидкого теплоносителя.
Б. Термомикрометод
Пробы высушивают или измельчают только при необходимости. Указание о высушивании или измельчении и условия их приводят в нормативно-технической документации на испытуемый продукт. Пробу помещают между двумя подкладочными стеклами, которые должны плотно прилегать друг к другу.
(Измененная редакция, Изм. № 2, 3).
А. Капиллярный метод
3.1.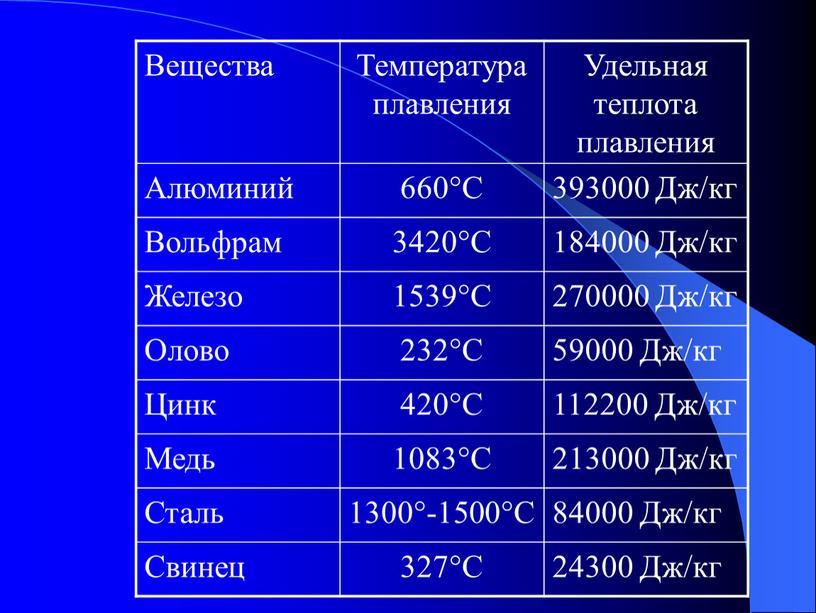 Определение в приборе ПТП
проводят по инструкции, прилагаемой к прибору. При этом, пользуясь
вспомогательным термометром, доводят блок-нагреватель прибора до температуры на
20 — 30 °С ниже ожидаемой температуры плавления испытуемого вещества. Затем
вспомогательный термометр заменяют на термометр с капилляром так, чтобы глубина
погружения термометра с капилляром соответствовала глубине погружения
вспомогательного термометра.
Определение в приборе ПТП
проводят по инструкции, прилагаемой к прибору. При этом, пользуясь
вспомогательным термометром, доводят блок-нагреватель прибора до температуры на
20 — 30 °С ниже ожидаемой температуры плавления испытуемого вещества. Затем
вспомогательный термометр заменяют на термометр с капилляром так, чтобы глубина
погружения термометра с капилляром соответствовала глубине погружения
вспомогательного термометра.
(Измененная редакция, Изм. № 1, 3).
3.2. При проведении определения в приборе
с жидким теплоносителем колбу со вставленной в нее пробиркой со вспомогательным
термометром нагревают газовой горелкой с регулируемым пламенем или регулируемым
электронагревателем до температуры на 20 — 30 °С ниже ожидаемой температуры
плавления испытуемого вещества. После этого в пробирку помещают вместо
вспомогательного термометра термометр с капилляром так, чтобы ни термометр, ни
капилляр не касались дна и стенок пробирки. При этом ртутный резервуар
термометра и слой веществ в капилляре должны находиться в слое жидкого
теплоносителя, а резиновое кольцо или проволока должны быть выше и не
смачиваться им.
При этом ртутный резервуар
термометра и слой веществ в капилляре должны находиться в слое жидкого
теплоносителя, а резиновое кольцо или проволока должны быть выше и не
смачиваться им.
3.3. После погружения термометров с капилляром (пп. 3.1 и 3.2) продолжают нагревание в интервале температур следующих 10 — 20 °С, повышая температуру со скоростью 2 °С в минуту, в интервале следующих 5 °С — со скоростью 1 °С в минуту и, наконец, в пределах последних 5 °С — со скоростью 0,5 °С в минуту.
Если вещество в процессе нагревания разлагается, то скорость нагревания устанавливают в пределах последних 10 — 15 °С до 2 — 4 °С в минуту. Скорость нагревания для разлагающихся веществ и некоторых технических продуктов должна быть указана в нормативно-технической документации на соответствующее вещество.
3.2, 3.3. (Измененная редакция, Изм. № 3).
3.4. При переходе от твердого состояния к
жидкому в капилляре с тонко измельченным веществом можно наблюдать три момента:
вначале происходит усадка вещества, затем спекание и, наконец, плавление. При
усадке вещество отстает от стенок капилляра, причем расплавление еще не
наблюдается. При дальнейшем нагревании вещество спекается, причем на стекле
часто появляются мельчайшие капельки жидкости. После этого наступает собственно
плавление, при котором в капилляре, наряду с жидкостью, находятся еще и твердые
частички.
При
усадке вещество отстает от стенок капилляра, причем расплавление еще не
наблюдается. При дальнейшем нагревании вещество спекается, причем на стекле
часто появляются мельчайшие капельки жидкости. После этого наступает собственно
плавление, при котором в капилляре, наряду с жидкостью, находятся еще и твердые
частички.
3.5. За начало плавления принимают первое появление жидкой фазы, образующей мениск, за конец плавления — момент полного расплавления вещества (исчезновение последних твердых частиц в расплавленной пробе). Обе температуры отмечают.
Б. Термомикрометод
Подкладочное стекло с пробой и покрывающим стеклом помещают на нагретый до комнатной температуры нагревательный блок и накрывают стеклянным диском, находящимся в подвижной рамке с ручкой. Затем нагревательный блок накрывают еще одним стеклянным диском, который удерживается с помощью рамки.
Нагрев блока регулируют так, чтобы при температуре на 15 -
20 °С ниже ожидаемой температуры плавления температура повышалась не более 1 °С
в минуту.
(Измененная редакция, Изм. № 2).
4.1. За результат испытания принимают две температуры: среднеарифметическое значение температур двух параллельных определений начала плавления и среднеарифметическое значение температур тех же параллельных определений конца плавления. При необходимости допускается принимать за результат испытания только начало или только конец плавления, о чем должно быть указано в нормативно-технической документации на испытуемый продукт.
(Введен дополнительно, Изм. № 2).
4.2. Температуры начала и конца плавления (Т) в градусах Цельсия (по капиллярному методу) вычисляют по формуле
Т= t + 0,00016(t — t1) × h,
где t — температура, определенная по основному термометру, °С;
t1 — температура, определенная по вспомогательному термометру, °С;
h — высота столбика ртути термометра, выступающего над уровнем жидкости, °С;
0,00016 — коэффициент расширения ртути.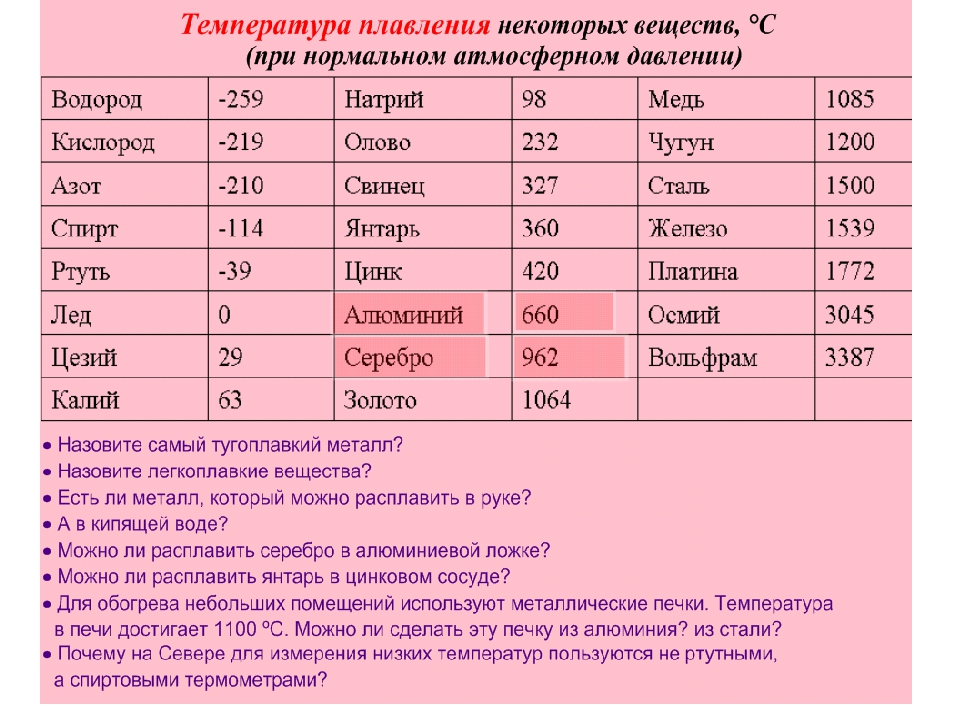
4.3. За результат анализа принимают среднеарифметическое результатов двух параллельных определений, абсолютное расхождение между которыми не превышает допускаемое расхождение, равное 0,5 °С для термометров с ценой деления 0,1 и 0,2 °С и 1 °С для термометров с ценой деления 0,5 °С.
Допускаемая абсолютная суммарная погрешность определения ± 0,3 °С для термометров с ценой деления 0,1 и 0,2 °С и ± 1 °С для термометров с ценой деления 0,5 °С при доверительной вероятности Р = 0,95.
4.2, 4.3. (Измененная редакция, Изм. № 3).
4.4. Для продуктов, обладающих специфическими свойствами, допускаемые расхождения результатов параллельных определений могут превышать 0,5 °С, при этом допускаемые расхождения между результатами параллельных определений и суммарную погрешность определения указывают в нормативно-технической документации на испытуемый продукт.
(Введен дополнительно, Изм. № 3).
ИНФОРМАЦИОННЫЕ ДАННЫЕ
1. РАЗРАБОТАН И ВНЕСЕН Министерством химической промышленности СССР
РАЗРАБОТАН И ВНЕСЕН Министерством химической промышленности СССР
2. УТВЕРЖДЕН И ВВЕДЕН В ДЕЙСТВИЕ Постановлением Государственного комитета стандартов Совета Министров СССР от 17.07.73 № 1740
3. ВЗАМЕН ГОСТ 9884-61 в части разд. 4 и ГОСТ 9390-60 в части разд. 2
4. Содержит все требования СТ СЭВ 2335-80
5. В стандарт введен международный стандарт ИСО 6353-1-82 (GM 5.25.2)
6. ССЫЛОЧНЫЕ НОРМАТИВНО-ТЕХНИЧЕСКИЕ ДОКУМЕНТЫ
7. Ограничение срока действия снято по протоколу № 5-94 Межгосударственного совета по стандартизации, метрологии и сертификации (ИУС 11-12-94)
8. ИЗДАНИЕ (август 2009 г.) с Изменениями № 1, 2, 3, утвержденными в сентябре 1976 г., июне 1981 г., мае 1990 г. (ИУС 10-76, 9-81, 8-90)
СОДЕРЖАНИЕ
Физика 8 класс. Плавление кристаллических тел. Удельная теплота плавления :: Класс!ная физика
Физика 8 класс.
 ПЛАВЛЕНИЕ КРИСТАЛЛИЧЕСКИХ ТЕЛ
ПЛАВЛЕНИЕ КРИСТАЛЛИЧЕСКИХ ТЕЛПлавление — переход вещества из твердого состояния в жидкое.
При нагревании увеличивается температура вещества, и возрастает скорость теплового движения частиц , при этом увеличивается внутренняя энергия тела.
Когда температура твердого тело достигает температуры плавления , кристаллическая решетка твердого вещества начинает разрушаться.
Таким образом, основная часть энергия нагревателя, пдводимая к твердому телу, идет на уменьшение связей между частицами вещества, т. е. на разрушение кристаллической решетки.
При этом возрастает энергия взаимодействия между частицами.
Расплавленное вещество обладает большим запасом внутренней энергии, чем в твердом состоянии.
Оставшаяся часть теплоты плавления расходуется на совершение работы по изменению объема тела при его плавлении.
При плавлении объем большинства кристаллических тел увеличивается (на 3-6%), а при отвердевании уменьшается.
Но, существуют вещества, у которых при плавлении объем уменьшается, а при отвердевании — увеличивается.
К ним относятся, например, вода и чугун, кремний и некоторые другие. . Именно поэтому лёд плавает на поверхности воды, а твердый чугун — в собственном расплаве.
Твердые тела, называемые аморфными ( янтарь, смола, стекло) не имеют определенной температуры плавления.
Количество теплоты, необходимой для плавления вещества, равно произведению удельной теплоты плавления на массу данного вещества.
Удельная теплота плавления показывает, какое кол теплоты необходимо для полного превращения 1 кг вещества из твердого состояния в жидкое, взятого при темп плавления.
Единицей удельной теплоты плавления в СИ служит 1Дж/кг.
В процессе плавления температура кристалла остается постоянной. Эта температура называется температурой плавления. У каждого вещества своя температура плавления.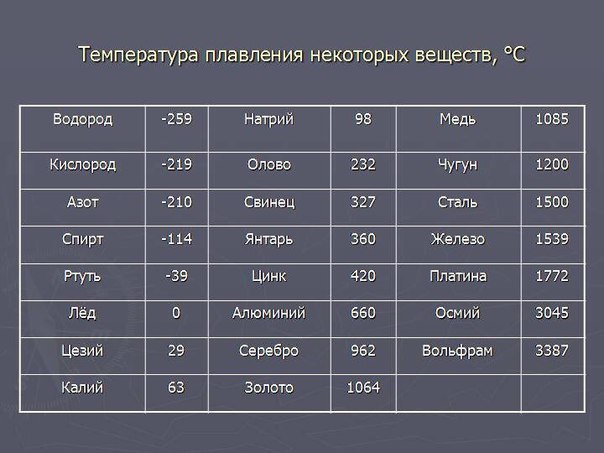
Температура плавления для данного вещества зависит от атмосферного давления.
У кристаллических тел при температуре плавления можно наблюдать вещество одновременно
в твердом и жидком состояниях.
ДА или НЕТ ?
Если два одинаковых сосуда из полиэтилена заполнить водой при 0 градусов C, и один сосуд поместить в воду при 0 градусов C, а другой—в измельченный лёд при 0 градусов C, то замерзнет ли вода в каком—нибудь из этих сосудов?
КНИЖНАЯ ПОЛКА
Мороз, а лёд-то плавится!
ИНТЕРЕСНО О ПЛАВЛЕНИИ
Ледяные зёрна и звезды.
Устали? — Отдыхаем!
Конспект урока «Описывать свойства вещества
Вступительное слово
Учитель: «Из чего состоят вещества и почему они все в разных агрегатных состояниях? Вещества могут находиться в трех основных агрегатных состояниях: твердое, жидкое и газообразное.
Состояние вещества зависит от температуры. Например, когда твердое вещество нагревают, оно начинает плавиться (превращаться в жидкость), если же нагревание продолжают, то образовавшаяся жидкость начинает испаряться, превращаясь в газ.
Когда твердое вещество нагревают, частицы приобретают энергию, и, следовательно, начинают двигаться быстрее. Скорость, при которой частицы вибрируют продолжает расти при повышении температуры. Если нагревание продолжается, то в итоге частицы вибрируют настолько сильно, что освобождаются от тесной связи с друг другом и могут двигаться теперь свободно. Этот процесс называется плавлением (таянием), т.е. переход из твердого вещества в жидкое.
Когда жидкость нагревают, энергия подается к частицам, заставляя их двигаться быстрее, скорость движения частиц продолжает расти при повышении температуры. Если нагревание продолжать, то многие частицы в жидкости в итоге будут двигаться настолько быстро, что исчезнут (оторвутся) от жидкости. Этот процесс называется кипением»
Этот процесс называется кипением»
Задание№ 1
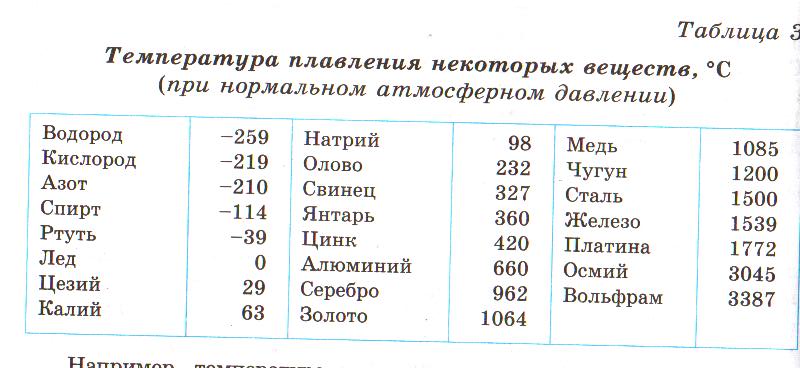
Посмотрите данные температуры плавления некоторых металлов. Напишите в тетради, какой из металлов имеет самую низкую и высокую температуру плавления. Предположите, в каком агрегатном состоянии металлы находятся? Приложение 1
Задание 2
Перед вами список из 15 веществ. Определите агрегатное состояние веществ (твердое, жидкое, газообразное), по имеющимся температурам кипения и плавления. Сделайте вывод. Приложение 2
Задание 3
Посмотрите внимательно на рисунок. Укажите цифру, которая показывает процесс плавления. Подчеркните буквы, которые показывают процесс кипения (А→С, А→В, В→С, С→А, С→В, В→А). Приложение 3
Задание 4
Дополните предложения. Приложение 4
Поменяйтесь тетрадями и проверьте друг друга. Ошибки исправьте зеленой ручкой, если они имеются.
После чего учитель показывает слайд с правильными ответами, и каждый учащийся проверяет себя сам.
Задание 5 «Разгадай-ка»
Учащимся предлагаются вопросы, на которые они должны устно ответить:
1)Что произошло с героиней сказки «Снегурочка», когда она прыгнула через костёр?
Какая, примерно, температура плавления льда? (растаяла, плавление, 00С).
2) Какие процессы есть в этих сказках?
a) Из древнегреческой легенды «Икар».
Сильно взмахнув крыльями, взлетел Икар высоко в небо, ближе к лучезарному солнцу. Палящие лучи расплавили воск, скреплявший крылья.
Что означает слова «и лучи расплавили воск»?
b) Какой тепловой процесс упоминается в пословице.
Когда вода кипит, пар идет горячий.
c) Прослушайте сказку и ответьте на вопрос:
Сказка:
Жил-был царь.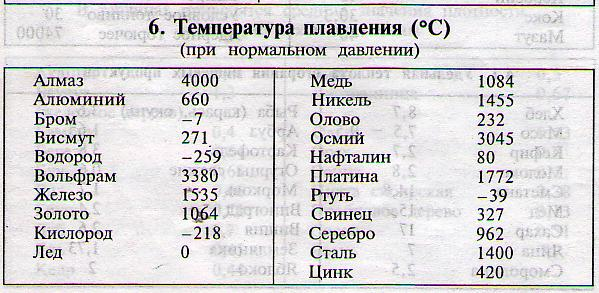 У него были три дочери: старшая, средняя и младшая. Младшая была самая красивая, самая любимая. Царь был стар и умен. Он давно издал указ, по которому первая дочь, выходящая замуж получит пол — царства. Зная указ, средняя и старшая дочери очень хотели замуж, и часто из-за этого ссорились. Младшая дочь замуж не собиралась. Чтобы разрешить все вопросы с замужеством и уладить ссоры, царь предложил провести такое соревнование.
У него были три дочери: старшая, средняя и младшая. Младшая была самая красивая, самая любимая. Царь был стар и умен. Он давно издал указ, по которому первая дочь, выходящая замуж получит пол — царства. Зная указ, средняя и старшая дочери очень хотели замуж, и часто из-за этого ссорились. Младшая дочь замуж не собиралась. Чтобы разрешить все вопросы с замужеством и уладить ссоры, царь предложил провести такое соревнование.
Он поставил на стол три чайника. Они были совершенно одинаковы, как по внешнему виду, так и по вместимости. Царь налил в каждый чайник равное количество воды из ведра.
«Мои любимые дочери, — начал свою речь царь, — сейчас каждая из вас возьмет по чайнику и отправиться вместе со мной на кухню. Там вы поставите чайники на плиту и дождетесь, пока они закипят. Та дочь, у которой закипит чайник раньше, выйдет замуж первой».
Закипит ли чайник у сестер? Если да, то у какой из сестер чайник закипит быстрее? Почему?
Ответ: Старшая и средняя дочери очень хотели, чтоб их чайники закипели быстрее, и часто поднимали крышки чайников, проверяя, не кипит ли в них вода. Младшая дочь замуж не хотела и в чайник не заглядывала!
Младшая дочь замуж не хотела и в чайник не заглядывала!
разбираем график на примере льда
Одно и тоже вещество в реальном мире в зависимости от окружающих условий может находиться в различных состояниях. Например, вода может быть в виде жидкости, в идее твердого тела – лед, в виде газа – водяной пар.
- Эти состояния называются агрегатными состояниями вещества.
Молекулы вещества в различных агрегатных состояниях ничем не отличаются друг от друга. Конкретное агрегатное состояние определяется расположением молекул, а так же характером их движения и взаимодействия между собой.
Газ – расстояние между молекулами значительно больше размеров самих молекул. Молекулы в жидкости и в твердом теле расположены достаточно близко друг к другу. В твердых телах еще ближе.
Чтобы изменить агрегатное состояние тела, ему необходимо сообщить некоторую энергию. Например, чтобы перевести воду в пар её надо нагреть.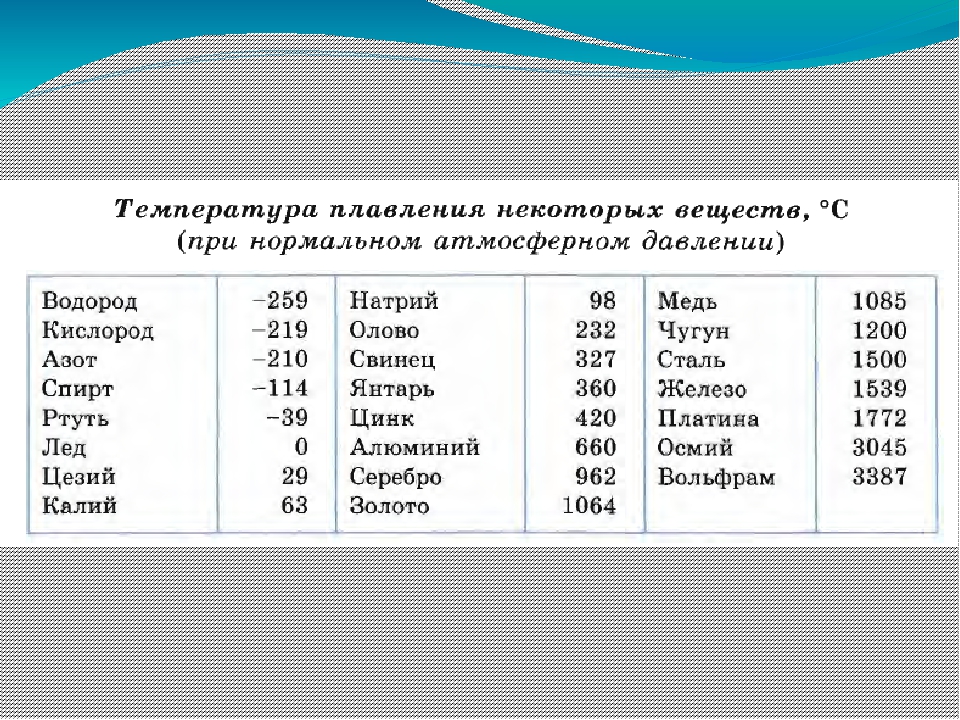 Чтобы пар снова стал водой, он должен отдать энергию.
Чтобы пар снова стал водой, он должен отдать энергию.
Переход из твердого состояния в жидкое
Переход вещества из твердого состояние в жидкое называется плавлением. Для того чтобы тело начало плавиться, его необходимо нагреть до определенной температуры. Температура, при которой вещество плавится, называют температурой плавления вещества.
Каждое вещество имеет свою температуру плавления. У каких-то тел она очень низкая, например, у льда. А у каких-то тел температура плавления очень высокая, например, железо. Вообще, плавление кристаллического тела это сложный процесс.
График плавления льда
Ниже на рисунке представлен график плавления кристаллического тела, в данном случае льда.
- График показывает зависимость температуры льда от времени, которое его нагревают. На вертикально оси отложена температура, по горизонтальной — время.
Из графика, что изначально температура льда была -20 градусов. Потом его начали нагревать. Температура начала расти. Участок АВ это участок нагревания льда. С течением времени, температура увеличилась до 0 градусов. Эта температура считается температурой плавления льда. При этой температуре лед начал плавиться, но при этом перестала возрастать его температура, хотя при этом лед также продолжали нагревать. Участку плавления соответствует участок ВС на графике.
Потом его начали нагревать. Температура начала расти. Участок АВ это участок нагревания льда. С течением времени, температура увеличилась до 0 градусов. Эта температура считается температурой плавления льда. При этой температуре лед начал плавиться, но при этом перестала возрастать его температура, хотя при этом лед также продолжали нагревать. Участку плавления соответствует участок ВС на графике.
Затем, когда весь лед расплавился и превратился в жидкость, температура воды снова стала увеличиваться. Это показано на графике лучом C. То есть делаем вывод, что во время плавления температура тела не изменяется, вся поступающая энергия идет на плвление.
Нужна помощь в учебе?
Предыдущая тема: Агрегатное состояние вещества
Следующая тема:   Удельная теплота плавления
Теория частиц — изменения состояния
Теория частиц — изменения состоянияВы научный центр / Я Ресурсы для изучения / Теория частиц — Введение
Охваченные темы
Плавка
Испарение
Кипячение
Изменения состояния
Кинетическая теория материи может быть использована для объяснения того, как твердые тела, жидкости и
газы взаимозаменяемы в результате увеличения или уменьшения тепловой энергии. Когда объект нагревается, движение частиц увеличивается по мере того, как частицы
стать более энергичным.Если его охладить, движение частиц уменьшается.
поскольку они теряют энергию.
Когда объект нагревается, движение частиц увеличивается по мере того, как частицы
стать более энергичным.Если его охладить, движение частиц уменьшается.
поскольку они теряют энергию.
Плавка
В твердом теле сильное притяжение между частицами крепко удерживает их
упакованы вместе. Даже если они вибрируют, этого недостаточно, чтобы нарушить
структура. Когда твердое тело нагревается, частицы получают энергию и начинают
вибрировать все быстрее и быстрее. Вначале структура постепенно ослабевает, что
имеет эффект расширения твердого тела.Дальнейшее нагревание дает больше энергии
пока частицы не начнут вырываться из структуры. Хотя частицы
все еще слабо связаны, они могут передвигаться. На данный момент
твердое тело тает, образуя жидкость. Частицы в жидкости такие же
как в твердом теле, но у них больше энергии. Чтобы растопить твердую энергию, требуется
преодолеть притяжение между частицами и позволить им тянуть их
Кроме.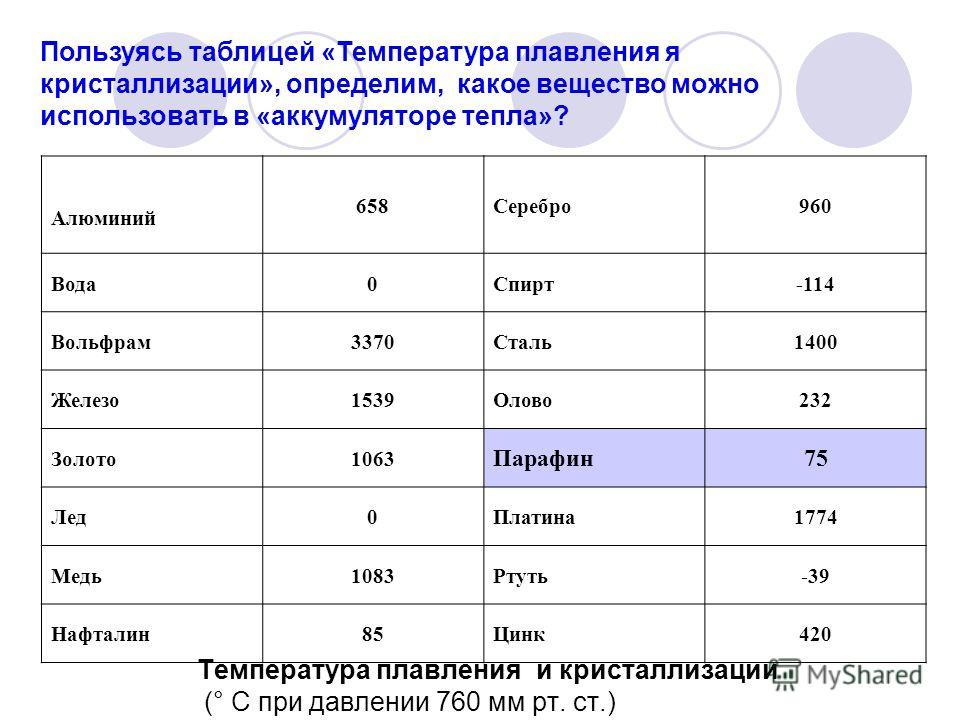 Энергия поступает, когда твердое тело нагревается.Температура на
что-то плавится, называется его «точкой плавления» или температурой плавления.
При комнатной температуре материал представляет собой твердое тело, жидкость или газ в зависимости от его плавления.
температура. Все, что имеет температуру плавления выше 20 ° C, вероятно
быть твердым при нормальных условиях. Материалы имеют самые разные плавки.
температуры например ртуть -39oC, лед 0oC, соль 1081oC, алюминий 660oC и сталь
1535oC. Обычные материалы, такие как лед, масло и воск, имеют разную температуру плавления.
температуры и может использоваться в качестве примера с детьми.
Энергия поступает, когда твердое тело нагревается.Температура на
что-то плавится, называется его «точкой плавления» или температурой плавления.
При комнатной температуре материал представляет собой твердое тело, жидкость или газ в зависимости от его плавления.
температура. Все, что имеет температуру плавления выше 20 ° C, вероятно
быть твердым при нормальных условиях. Материалы имеют самые разные плавки.
температуры например ртуть -39oC, лед 0oC, соль 1081oC, алюминий 660oC и сталь
1535oC. Обычные материалы, такие как лед, масло и воск, имеют разную температуру плавления.
температуры и может использоваться в качестве примера с детьми.
Лед — это, вероятно, тающее вещество, знакомое большинству детей. Может
быть проблематичным, пытаясь развить понимание таяния, как оно
им часто кажется, что они тают без какого-либо источника тепла. Лед тает при комнатной температуре
потому что окружающий воздух теплее льда и имеет температуру выше
температура плавления. Тепловая энергия, необходимая для плавления льда, поступает от
окружающий воздух, который в результате станет немного прохладнее.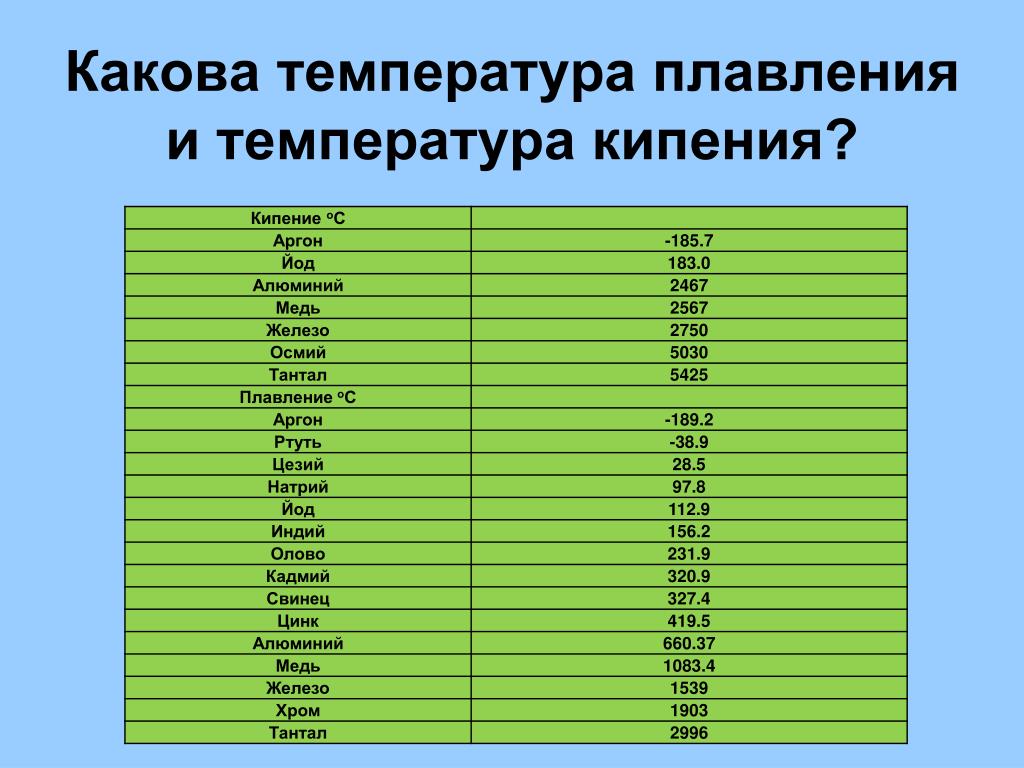
Не все твердые вещества плавятся при нагревании.Некоторые могут претерпевать химические изменения
в результате нагрева. Например, бумага горит, а не тает.
Испарение
В жидкости одни частицы обладают большей энергией, чем другие. Эти «более
энергичные частицы «могут обладать достаточной энергией, чтобы покинуть поверхность
жидкости в виде газа или пара. Этот процесс называется испарением, и в результате
испарения обычно наблюдается при высыхании луж или одежды. Испарение
происходит при комнатной температуре, которая часто намного ниже точки кипения
жидкости.Испарение происходит с поверхности жидкости. Поскольку температура
увеличивается скорость испарения, увеличивается. Испарению также способствует
ветреные условия, которые помогают удалить частицы пара из жидкости, чтобы
что больше побега.
Испарение — сложная идея для детей по ряду причин. Процесс
включает в себя очевидное исчезновение жидкости, что затрудняет процесс
чтобы они поняли.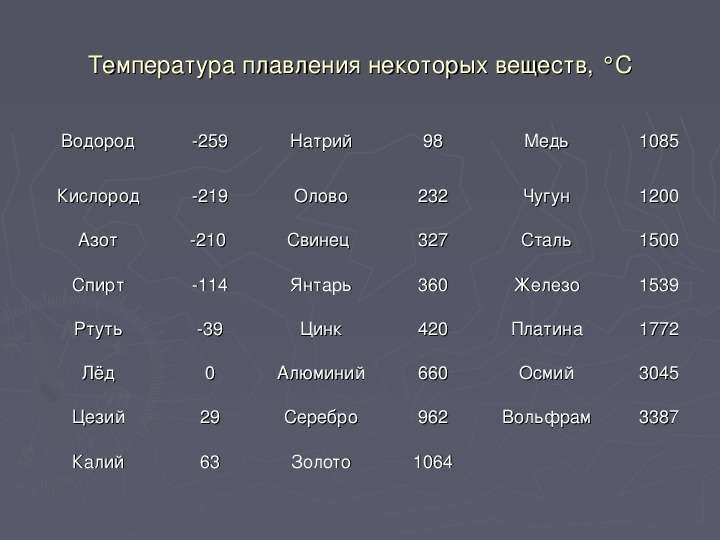 Нелегко увидеть частицы воды в воздухе.Кроме того, испарение происходит в самых разных ситуациях, например,
из лужи или миски с водой, где количество жидкости явно меняется,
в ситуациях, когда жидкость менее заметна — например, при сушке одежды или даже
те, в которых нет видимой жидкости для начала — например, хлеб
Высыхать. Еще одна сложность заключается в том, что при испарении может происходить испарение растворителя из
решение, например вода, испаряющаяся из соленой воды, оставляет соль. Эти ситуации
совершенно разные, но все они связаны с испарением.
Нелегко увидеть частицы воды в воздухе.Кроме того, испарение происходит в самых разных ситуациях, например,
из лужи или миски с водой, где количество жидкости явно меняется,
в ситуациях, когда жидкость менее заметна — например, при сушке одежды или даже
те, в которых нет видимой жидкости для начала — например, хлеб
Высыхать. Еще одна сложность заключается в том, что при испарении может происходить испарение растворителя из
решение, например вода, испаряющаяся из соленой воды, оставляет соль. Эти ситуации
совершенно разные, но все они связаны с испарением.
При испарении могут также использоваться другие жидкости, кроме воды, например духи, бензин,
Освежители воздуха. Модель частиц можно использовать, чтобы объяснить, как это возможно.
для обнаружения запахов на некотором расстоянии от источника.
Вернуться к началу страницы
Кипячение
Если жидкость нагревается, частицы получают больше энергии и движутся быстрее
и быстрее расширяет жидкость. Самые энергичные частицы на поверхности
улетучиваются с поверхности жидкости в виде пара, когда она становится теплее.Жидкости
испаряются быстрее по мере нагрева, и у большего количества частиц достаточно энергии для разрушения
далеко. Частицам нужна энергия, чтобы преодолеть притяжение между ними. Так как
жидкость становится теплее, у большего количества частиц энергии достаточно, чтобы покинуть ее
жидкость. В конце концов даже частицы в середине жидкости образуют пузыри.
газа в жидкости. В этот момент жидкость закипает и превращается в газ.
Частицы в газе такие же, как и в жидкости.
больше энергии.При нормальном атмосферном давлении все материалы имеют определенную температуру.
при котором происходит кипение. Это называется «точкой кипения» или кипением.
температура. Как и в случае с точкой плавления, температура кипения материалов сильно различается.
например азот -210oC, спирт 78oC, алюминий 459oC.
Самые энергичные частицы на поверхности
улетучиваются с поверхности жидкости в виде пара, когда она становится теплее.Жидкости
испаряются быстрее по мере нагрева, и у большего количества частиц достаточно энергии для разрушения
далеко. Частицам нужна энергия, чтобы преодолеть притяжение между ними. Так как
жидкость становится теплее, у большего количества частиц энергии достаточно, чтобы покинуть ее
жидкость. В конце концов даже частицы в середине жидкости образуют пузыри.
газа в жидкости. В этот момент жидкость закипает и превращается в газ.
Частицы в газе такие же, как и в жидкости.
больше энергии.При нормальном атмосферном давлении все материалы имеют определенную температуру.
при котором происходит кипение. Это называется «точкой кипения» или кипением.
температура. Как и в случае с точкой плавления, температура кипения материалов сильно различается.
например азот -210oC, спирт 78oC, алюминий 459oC.
Любой материал с температурой кипения ниже 20 ° C может быть газом при
комнатная температура.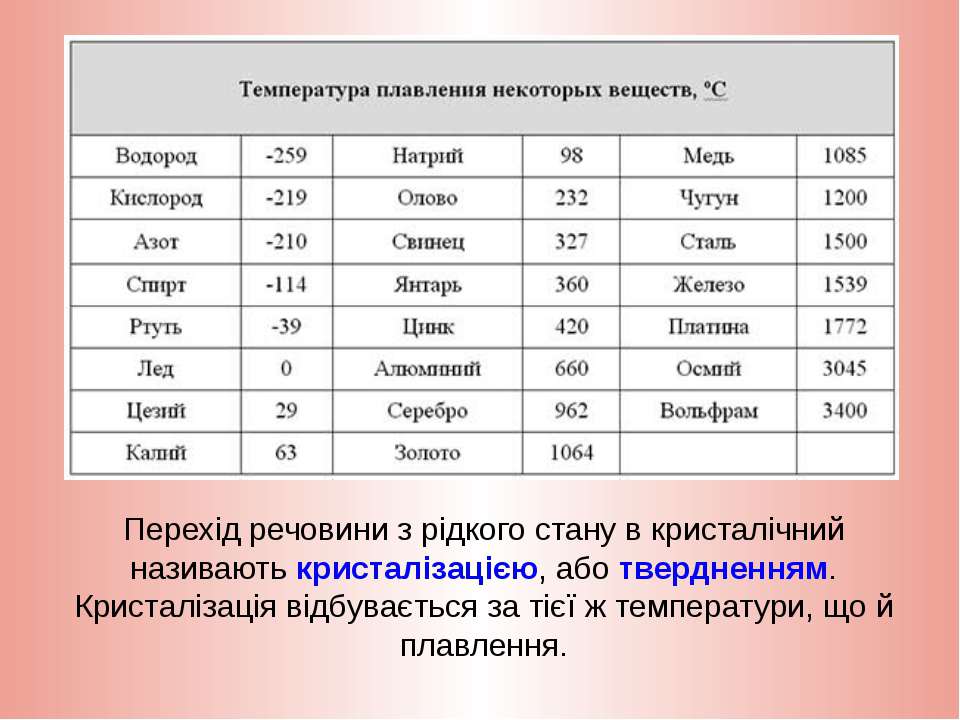 Когда жидкость закипает, частицы должны обладать достаточной энергией.
отрываться от жидкости и диффундировать через частицы окружающего воздуха.Когда эти частицы остывают и теряют энергию, они конденсируются и возвращаются обратно.
в жидкость. Когда пар образуется из воды, кипящей при 100 ° C, частицы быстро
конденсироваться, так как температура окружающего воздуха, вероятно, будет намного ниже 100oC
поэтому частицы быстро остывают. Фактически «пар» выходит из
кипящий котел можно увидеть только потому, что некоторые частицы газа сконденсировались
образовывать маленькие капельки воды.
Когда жидкость закипает, частицы должны обладать достаточной энергией.
отрываться от жидкости и диффундировать через частицы окружающего воздуха.Когда эти частицы остывают и теряют энергию, они конденсируются и возвращаются обратно.
в жидкость. Когда пар образуется из воды, кипящей при 100 ° C, частицы быстро
конденсироваться, так как температура окружающего воздуха, вероятно, будет намного ниже 100oC
поэтому частицы быстро остывают. Фактически «пар» выходит из
кипящий котел можно увидеть только потому, что некоторые частицы газа сконденсировались
образовывать маленькие капельки воды.
Когда газ превращается в жидкость (конденсируется) или жидкость превращается в твердое тело (затвердевает)
частицы теряют энергию в окружающую среду.
Вернуться к началу страницы
Сопровождающий веб-сайт: Р. Джонс Обновлено: 13 ноября 2000 г.
Изменения состояния — Три состояния вещества — AQA — GCSE Chemistry (Single Science) Revision — AQA
1t3g705sthy.0.0.0.1:0.1.0.$0.$2.$0″> Объяснение изменения состоянияПлавление, испарение и кипение
Для этих целей энергия должна передаваться веществу путем нагревания изменения состояния произойти. Во время этих изменений частицы получают энергию, которая используется для:
При испарении частицы покидают жидкость только с ее поверхности.При кипении по всей жидкости образуются пузырьки газа. Они поднимаются на поверхность и уходят в окружающую среду, образуя газ.
Количество энергии, необходимое для изменения состояния с твердого на жидкое и с жидкости на газ, зависит от силы сил между частицами вещества. Чем сильнее силы притяжения, тем больше требуется энергии.
У каждого вещества своя точка плавления и точка кипения. Чем сильнее силы между частицами, тем выше его температуры плавления и кипения.
Чем сильнее силы между частицами, тем выше его температуры плавления и кипения.
Сила сил между частицами зависит от участвующих частиц. Например, силы между ионами в ионном твердом теле сильнее, чем силы между молекулами в воде или водороде. Это объясняет данные по температуре плавления и кипения в таблице.
| Вещество | Тип склеивания | Точка плавления | Точка кипения |
|---|---|---|---|
| Хлорид натрия | Ионный | 801 ° C | 1413 ° C |
| Вода | Мелкие молекулы | 0 ° C | 100 ° C |
| Водород | Мелкие молекулы | -259 ° C | -252 ° C |
Испарение может происходить ниже точки кипения вещества.
Конденсация и замораживание
Энергия передается от вещества к окружающей среде, когда вещество конденсируется или замерзает. Это потому, что силы притяжения между частицами становятся сильнее.
Замораживание и плавление | Encyclopedia.com
Замерзание — это изменение, которое происходит, когда жидкость превращается в твердое тело при понижении температуры . Плавление — это противоположный переход от твердого тела к жидкому при повышении температуры. Это оба примера изменения состояния вещества веществ.
Плавление — это противоположный переход от твердого тела к жидкому при повышении температуры. Это оба примера изменения состояния вещества веществ.
Вещества замерзают при той же температуре, что и плавятся. Как следствие, температура, при которой — при определенном давлении — жидкость и твердое тело находятся в равновесии, определяется как точка плавления или замерзания. Когда давление составляет одну атмосферу, эта температура называется нормальной точкой замерзания (или плавления). Изменение давления изменит температуру, при которой происходит изменение состояния вещества. Снижение давления приведет к снижению температуры, при которой это происходит, а повышение давления увеличит требуемую температуру.
На фундаментальном уровне замораживание и плавление представляют собой изменения уровней энергии молекул рассматриваемого вещества. Замораживание — это переход от состояния с высокой энергией к состоянию с более низкой энергией, при этом молекулы двигаются меньше при понижении их температуры.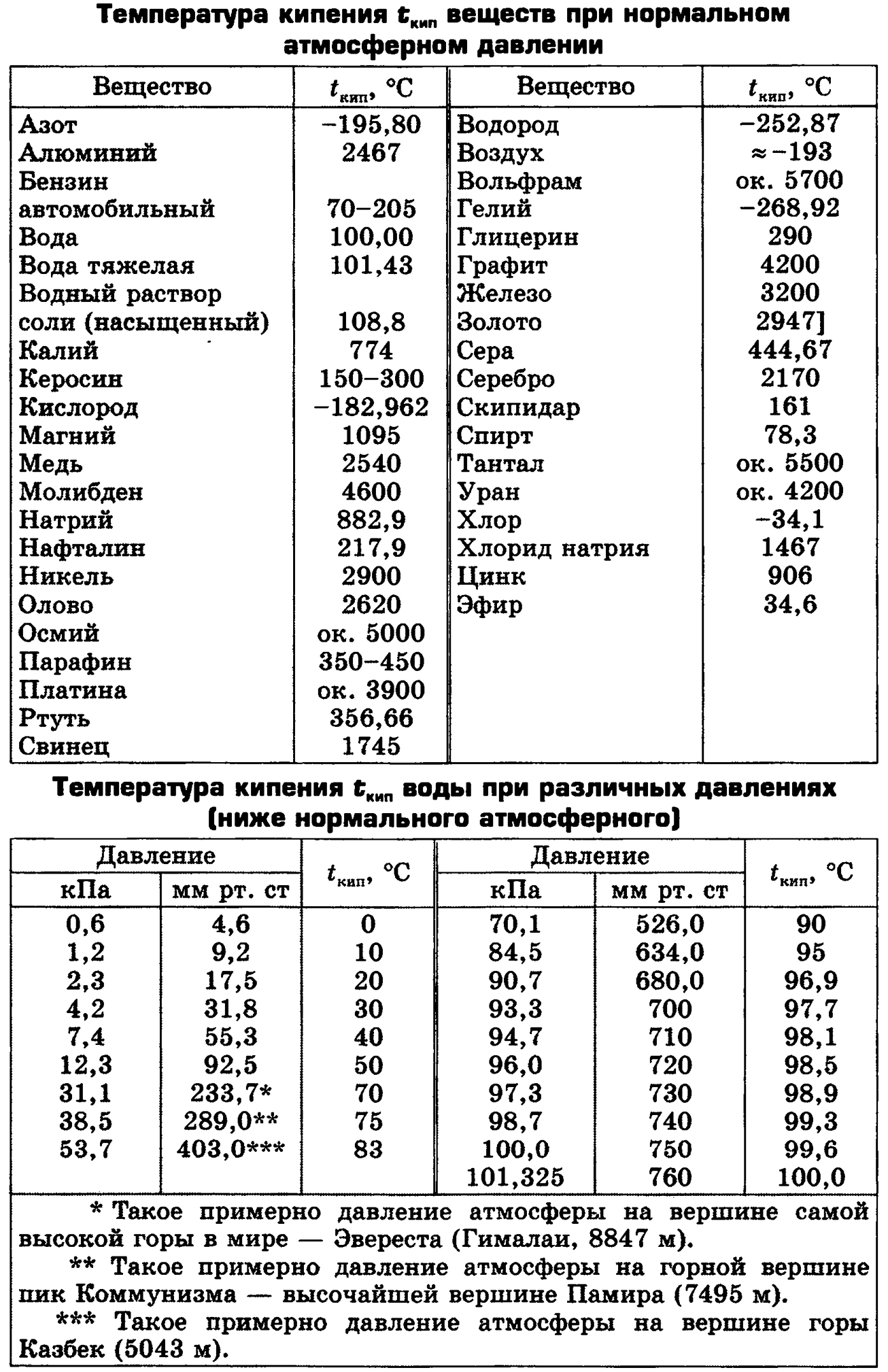 Они становятся более упорядоченными и фиксированными по форме. Когда вещество плавится, средний уровень энергии составляющих его молекул увеличивается. Молекулы в жидкости движутся быстрее и менее упорядоченно, чем в твердом теле.Именно эта большая свобода движения позволяет жидкости течь, касаясь стенок контейнера, в то время как твердое тело фиксируется в жесткой форме. Такое рассмотрение энергии молекул известно как кинетическая молекулярная теория.
Они становятся более упорядоченными и фиксированными по форме. Когда вещество плавится, средний уровень энергии составляющих его молекул увеличивается. Молекулы в жидкости движутся быстрее и менее упорядоченно, чем в твердом теле.Именно эта большая свобода движения позволяет жидкости течь, касаясь стенок контейнера, в то время как твердое тело фиксируется в жесткой форме. Такое рассмотрение энергии молекул известно как кинетическая молекулярная теория.
Температура, при которой вещества замерзают и плавятся, различна для разных химикатов. Химическая формула вещества не обязательно является истинным показателем точки замерзания или плавления. Изомеры веществ могут иметь разные физические свойства, включая температуры замерзания и плавления.Точно так же наличие водородных связей и других сил притяжения, таких как силы Ван-дер-Ваальса, может влиять на связывание внутри вещества и, следовательно, на точки замерзания и плавления. Если присутствуют какие-либо межмолекулярные силы, в систему необходимо добавить больше энергии, чтобы она превратилась из твердого тела в жидкость.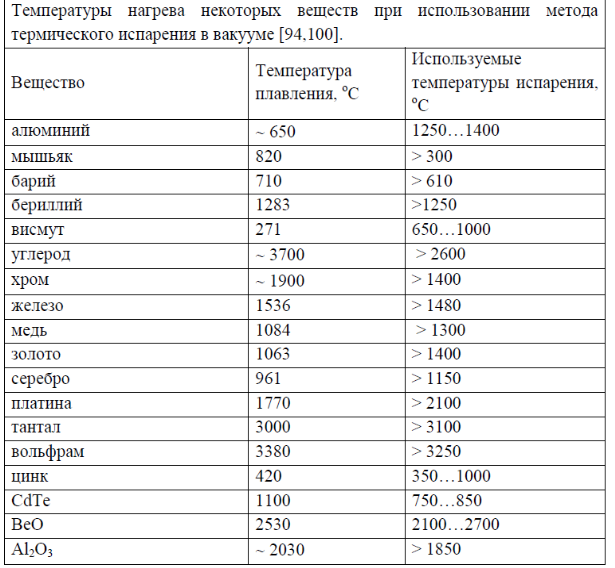 Это связано с тем, что необходимо преодолеть межмолекулярные связи, чтобы молекулы могли двигаться более свободно. Это меньшее изменение, чем при переходе от жидкости к газу, потому что молекулы все еще соприкасаются друг с другом как в жидкостях, так и в твердых телах.
Это связано с тем, что необходимо преодолеть межмолекулярные связи, чтобы молекулы могли двигаться более свободно. Это меньшее изменение, чем при переходе от жидкости к газу, потому что молекулы все еще соприкасаются друг с другом как в жидкостях, так и в твердых телах.
Чистота соединения может влиять на температуру, при которой происходит переход твердого вещества в жидкое. Например, добавление хлорида натрия (поваренная соль) или другой соли к воде снижает точку замерзания, поэтому на дороги кладут соль, чтобы предотвратить их обледенение. Чистое вещество имеет определенную точку плавления или замерзания, добавление примеси снижает эту температуру, а также расширяет ее, так что точка плавления или замерзания становится менее определенной, более диффузной.Это означает, что мы можем использовать температуру замерзания или плавления в качестве индикатора чистоты вещества. Когда твердое тело плавится при нагревании или жидкость замораживается при охлаждении, температура остается постоянной. Таким образом, если построить график зависимости температуры от добавляемого тепла, будет видно плечо или плато, которые представляют температуру замерзания или плавления. С нечистой субстанцией это плечо не будет таким точным. Такой график называют кривой нагрева. Превращение твердого вещества в жидкость происходит при постоянной температуре.
Таким образом, если построить график зависимости температуры от добавляемого тепла, будет видно плечо или плато, которые представляют температуру замерзания или плавления. С нечистой субстанцией это плечо не будет таким точным. Такой график называют кривой нагрева. Превращение твердого вещества в жидкость происходит при постоянной температуре.
У большинства веществ твердая фаза более плотная, чем жидкая фаза. В результате этого при замерзании твердое вещество опускается на дно жидкости. Вода не ведет себя подобным образом. Лед менее плотен, чем вода, и поэтому лед будет плавать по воде. Вода имеет максимальную плотность при 39 ° F (4 ° C). Это вызвано водородными связями, которые в жидкой фазе неупорядочены. Когда вода замерзает, образуя лед, молекулы принимают открытую упорядоченную структуру, которая допускает максимальное количество водородных связей.Эта характеристика оказала глубокое влияние на жизнь на Земле (например, она позволяет озерам, и ручьям замерзать на поверхности и обеспечивать изоляцию жизни подо льдом в холодные зимние месяцы) и приводит к активному агенту геологических изменений.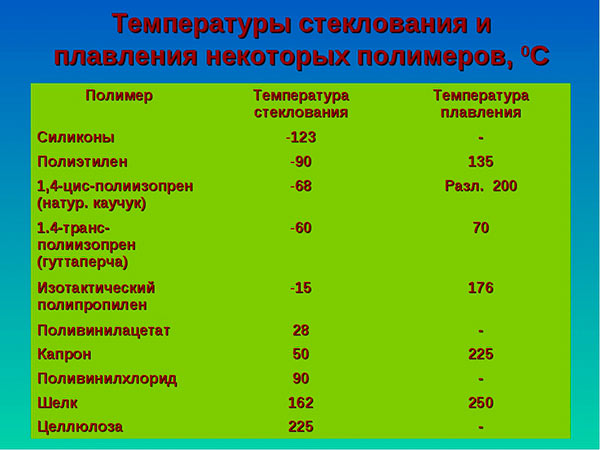 Поскольку вода при замерзании расширяется, она способна расколоть породу ; Циклическое замораживание и повторное замораживание воды является важным агентом выветривания .
Поскольку вода при замерзании расширяется, она способна расколоть породу ; Циклическое замораживание и повторное замораживание воды является важным агентом выветривания .
Обычно, когда мы говорим о веществе, являющемся твердым или жидким, мы имеем в виду его внешний вид при стандартной температуре и давлении, это давление в одну атмосферу и температуру 68 ° F (20 ° C).Если точка плавления ниже этой температуры, а точка кипения выше, тогда химическое вещество является жидкостью при стандартной температуре и давлении.
Можно охладить жидкость ниже точки замерзания и при этом оставить ее в жидком состоянии. Это известно как переохлажденная жидкость. Это представляет собой неустойчивое равновесие, и со временем жидкость замерзает. Очень легко переохладить воду до 12 ° F (-11,1 ° C) и при этом оставить ее жидкой. Переохлажденная жидкость не начнет замерзать до тех пор, пока не наступит точка для образования льда.Это может быть один кусок пыли, который действует как точка зарождения льда, чтобы начать образование.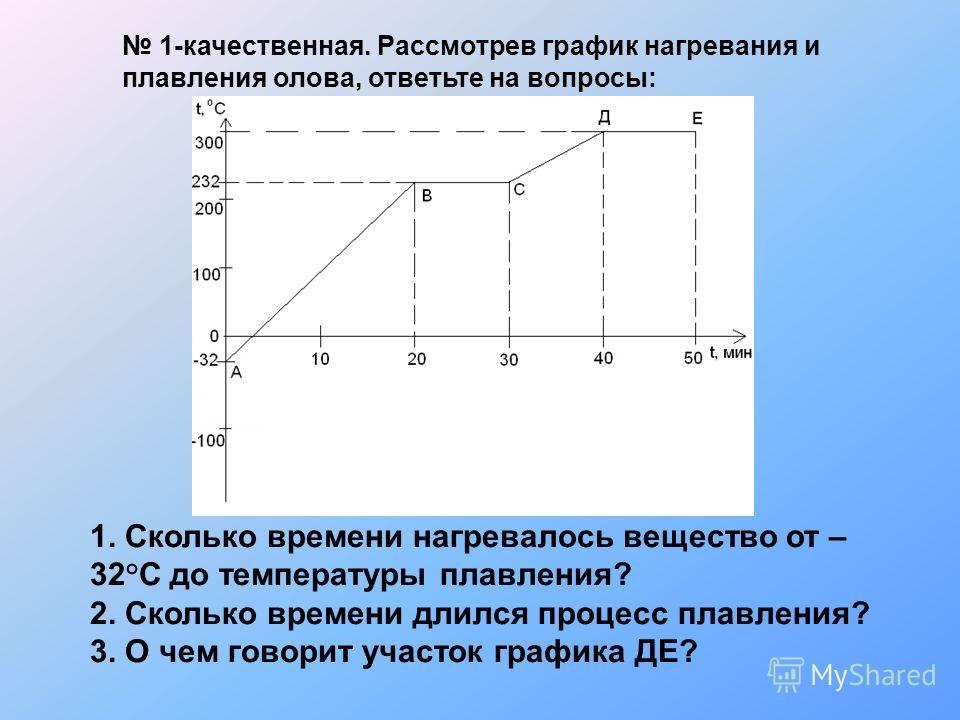 Переохлажденная вода не встречается в природе, потому что в атмосфере слишком много твердых частиц. Если какая-либо из этих частиц попадет в переохлажденную жидкость, она мгновенно превратится в твердую форму.
Переохлажденная вода не встречается в природе, потому что в атмосфере слишком много твердых частиц. Если какая-либо из этих частиц попадет в переохлажденную жидкость, она мгновенно превратится в твердую форму.
Некоторые химические вещества не имеют точки, в которой они превращаются из твердого тела в жидкость — они могут непосредственно переходить из твердого состояния в газообразное, и это свойство называется сублимацией. Сухой лед, твердый диоксид углерода , демонстрирует это.Подобно плавлению и замораживанию, это также происходит при одной определенной температуре.
Твердые и жидкие вещества плотно упакованы на молекулярном уровне. Одно различие в отношении молекул состоит в том, что в жидкости молекулы легче скользят друг по другу. Именно это свойство позволяет легче наливать жидкость. Молекулы в жидкости по-прежнему касаются каждой соседней молекулы (как в твердом теле), хотя удерживаются менее свободно.
Ионные соединения обычно имеют более высокую температуру плавления, чем ковалентные соединения.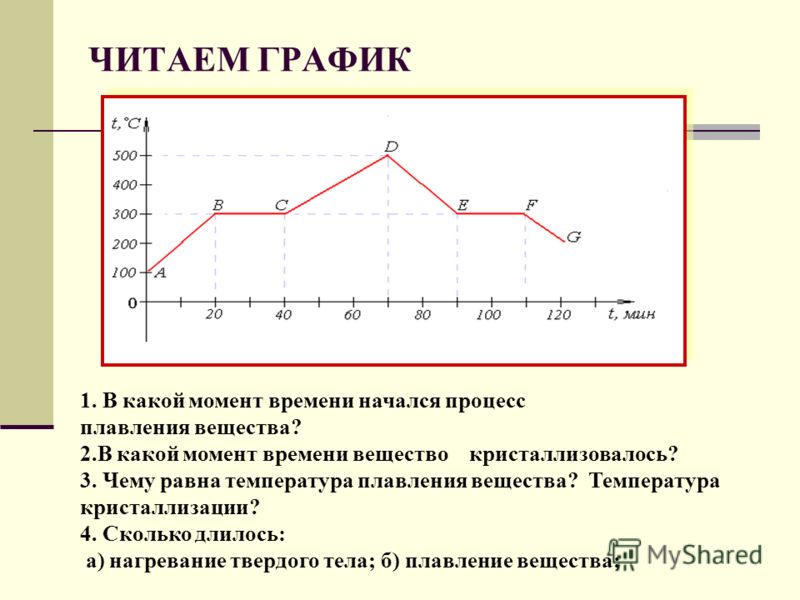 Это связано с тем, что межмолекулярные силы в ионном соединении намного сильнее. Если давление увеличивается, молекулы прижимаются ближе друг к другу, и это означает, что межмолекулярные силы удерживают частицы ближе друг к другу и более плотно, поэтому для расплавления материала требуется более высокая температура.
Это связано с тем, что межмолекулярные силы в ионном соединении намного сильнее. Если давление увеличивается, молекулы прижимаются ближе друг к другу, и это означает, что межмолекулярные силы удерживают частицы ближе друг к другу и более плотно, поэтому для расплавления материала требуется более высокая температура.
Плавление также называется плавлением, а энергия, необходимая для изменения состояния, называется теплотой плавления или энтальпией плавления. Чтобы лед превратился в жидкую воду, теплота плавления равна 6.01 кДж / моль. Плавление и сублимация являются эндотермическими процессами, а замораживание — экзотермическим процессом. Каждый раз, когда материал переходит из одного состояния в другое, в системе происходит изменение энергии. Для плавления порядок системы уменьшается, поэтому необходимо подводить энергию для увеличения хаотичности молекул. При замораживании молекулы становятся более упорядоченными, поэтому из системы теряется энергия.
Замораживание и плавление — это изменение состояния с жидкого на твердое и с твердого на жидкое.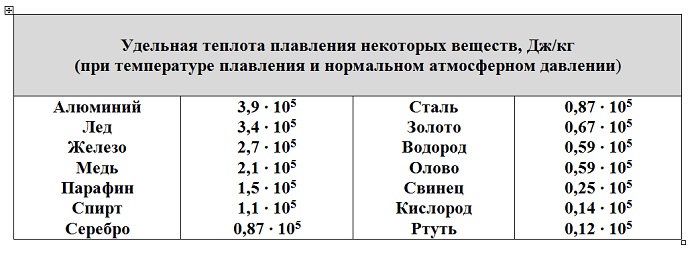 Для любого данного чистого химического вещества они происходят при определенной температуре, которая одинакова для замораживания и плавления.
Для любого данного чистого химического вещества они происходят при определенной температуре, которая одинакова для замораживания и плавления.
См. Также Химические связи и физические свойства; Химические элементы; Испарение; Разломы и переломы; Ледниковые формы рельефа; Оледенение; Ледники; Стекло; Пучка и расклинивание льда; Лед
Свойства вещества: твердые тела | Живая наука
Твердое тело — одно из трех основных состояний материи, наряду с жидкостью и газом. Материя — это «вещество» Вселенной, атомы, молекулы и ионы, из которых состоят все физические вещества.В твердом теле эти частицы плотно упакованы вместе и не могут свободно перемещаться внутри вещества. Молекулярное движение частиц в твердом теле ограничивается очень небольшими колебаниями атомов вокруг их фиксированных положений; поэтому твердые тела имеют фиксированную форму, которую трудно изменить. Твердые тела тоже имеют определенный объем; то есть они сохраняют свой размер, как бы вы их ни пытались изменить.
Твердые вещества делятся на две основные категории, кристаллические твердые вещества и аморфные твердые вещества, в зависимости от того, как расположены частицы.
Кристаллические твердые вещества
Кристаллические твердых веществ или кристаллов считаются «истинными твердыми телами». Минералы представляют собой твердые кристаллические вещества. Поваренная соль является одним из примеров такого твердого вещества. В кристаллических твердых телах атомы, ионы или молекулы расположены в упорядоченном и симметричном порядке, который повторяется по всему кристаллу. Самая маленькая повторяющаяся структура твердого тела называется элементарной ячейкой, которая похожа на кирпич в стене. Элементарные ячейки объединяются, образуя сеть, называемую кристаллической решеткой.Существует 14 типов решеток, называемых решетками Браве (названных в честь Огюста Браве, французского физика 19-го века), и они подразделяются на семь кристаллических систем в зависимости от расположения атомов.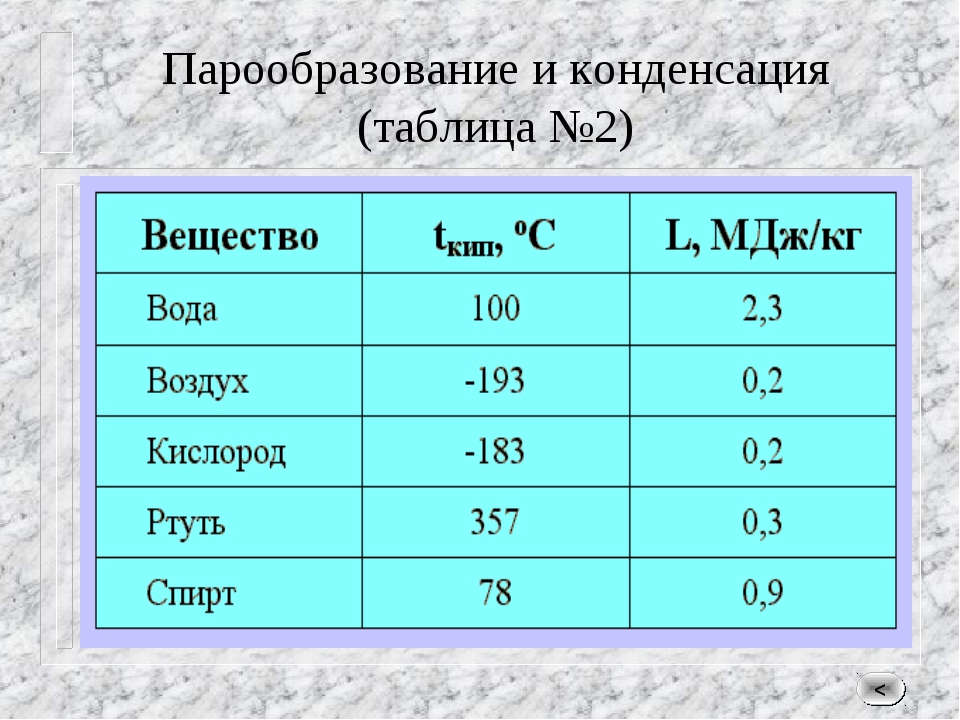 На странице ChemWiki в Калифорнийском университете в Дэвисе эти системы перечислены как кубические, гексагональные, тетрагональные, ромбоэдрические, ромбические, моноклинные и триклинические.
На странице ChemWiki в Калифорнийском университете в Дэвисе эти системы перечислены как кубические, гексагональные, тетрагональные, ромбоэдрические, ромбические, моноклинные и триклинические.
Помимо регулярного расположения частиц, кристаллические твердые частицы обладают рядом других характерных свойств.Обычно они несжимаемы, то есть их нельзя сжать до более мелких форм. Из-за повторяющейся геометрической структуры кристалла все связи между частицами имеют одинаковую прочность. Это означает, что кристаллическое твердое вещество будет иметь определенную точку плавления, потому что нагревание разорвет все связи одновременно.
Кристаллические твердые тела также обладают анизотропией . Это означает, что такие свойства, как показатель преломления (насколько свет изгибается при прохождении через вещество), проводимость (насколько хорошо он проводит электричество) и прочность на разрыв (сила, необходимая для его разрыва), будут варьироваться в зависимости от направления, с которого действует сила. применяется.Кристаллические твердые вещества также демонстрируют расщепление ; в случае разрушения части будут иметь строганную поверхность или прямые края.
применяется.Кристаллические твердые вещества также демонстрируют расщепление ; в случае разрушения части будут иметь строганную поверхность или прямые края.
Типы кристаллических твердых веществ
Существуют четыре типа кристаллических твердых веществ: ионные твердые вещества, молекулярные твердые вещества, сетчатые ковалентные твердые тела и металлические твердые тела.
Ионные твердые вещества
Ионные соединения образуют кристаллы, состоящие из противоположно заряженных ионов: положительно заряженного катиона и отрицательно заряженного аниона . Из-за сильного притяжения между противоположными зарядами требуется много энергии, чтобы преодолеть ионные связи. Это означает, что ионные соединения имеют очень высокие температуры плавления, часто от 300 до 1000 градусов по Цельсию (от 572 до 1832 градусов по Фаренгейту).
Хотя сами кристаллы твердые, хрупкие и непроводящие, большинство ионных соединений могут растворяться в воде, образуя раствор свободных ионов, который будет проводить электричество.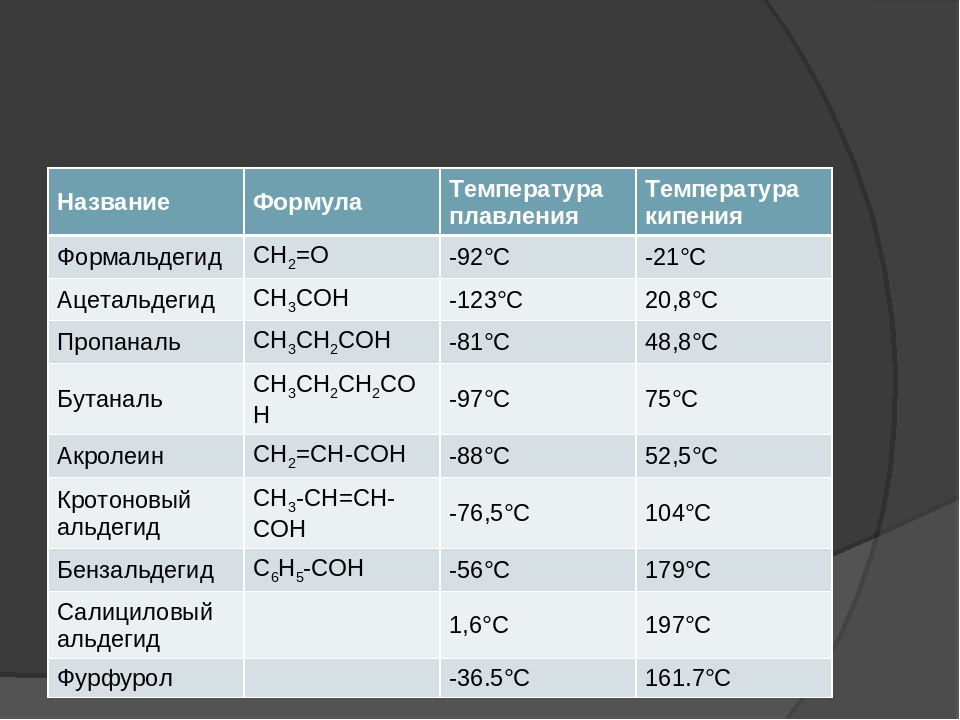 Они могут быть простыми бинарными солями, такими как хлорид натрия (NaCl) или поваренная соль, где один атом металлического элемента (натрия) связан с одним атомом неметаллического элемента (хлора).Они также могут состоять из многоатомных ионов, таких как NH 4 NO 3 (нитрат аммония). Многоатомные ионы — это группы атомов, которые имеют общие электроны (называемые ковалентными связями ) и функционируют в соединении, как если бы они составляли один заряженный ион.
Они могут быть простыми бинарными солями, такими как хлорид натрия (NaCl) или поваренная соль, где один атом металлического элемента (натрия) связан с одним атомом неметаллического элемента (хлора).Они также могут состоять из многоатомных ионов, таких как NH 4 NO 3 (нитрат аммония). Многоатомные ионы — это группы атомов, которые имеют общие электроны (называемые ковалентными связями ) и функционируют в соединении, как если бы они составляли один заряженный ион.
Молекулярные твердые тела
Молекулярные твердые тела состоят из ковалентно связанных молекул, притягиваемых друг к другу электростатическими силами (называемыми силами Ван-дер-Ваальса, согласно веб-сайту HyperPhysics).Поскольку ковалентная связь включает в себя совместное использование электронов, а не прямой перенос этих частиц, общие электроны могут проводить больше времени в электронном облаке более крупного атома, вызывая слабую или смещающуюся полярность. Это электростатическое притяжение между двумя полюсами (диполями) намного слабее, чем ионная или ковалентная связь, поэтому молекулярные твердые частицы, как правило, мягче, чем ионные кристаллы, и имеют более низкие температуры плавления (многие будут плавиться при температуре менее 100 C или 212 F). Большинство молекулярных твердых веществ неполярны. Эти неполярные молекулярные твердые вещества не растворяются в воде, но растворяются в неполярном растворителе, таком как бензол и октан.Полярные молекулярные твердые вещества, такие как сахар, легко растворяются в воде. Молекулярные твердые вещества не проводят ток.
Это электростатическое притяжение между двумя полюсами (диполями) намного слабее, чем ионная или ковалентная связь, поэтому молекулярные твердые частицы, как правило, мягче, чем ионные кристаллы, и имеют более низкие температуры плавления (многие будут плавиться при температуре менее 100 C или 212 F). Большинство молекулярных твердых веществ неполярны. Эти неполярные молекулярные твердые вещества не растворяются в воде, но растворяются в неполярном растворителе, таком как бензол и октан.Полярные молекулярные твердые вещества, такие как сахар, легко растворяются в воде. Молекулярные твердые вещества не проводят ток.
Примеры молекулярных твердых веществ включают лед, сахар, галогены, такие как твердый хлор (Cl 2 ), и соединения, состоящие из галогена и водорода, такие как хлористый водород (HCl). «Бакиболлы» фуллерена также являются твердыми молекулярными телами.
Сетчатые ковалентные твердые тела
В сетчатых твердых телах нет отдельных молекул. Атомы ковалентно связаны в непрерывную сеть, в результате чего образуются огромные кристаллы.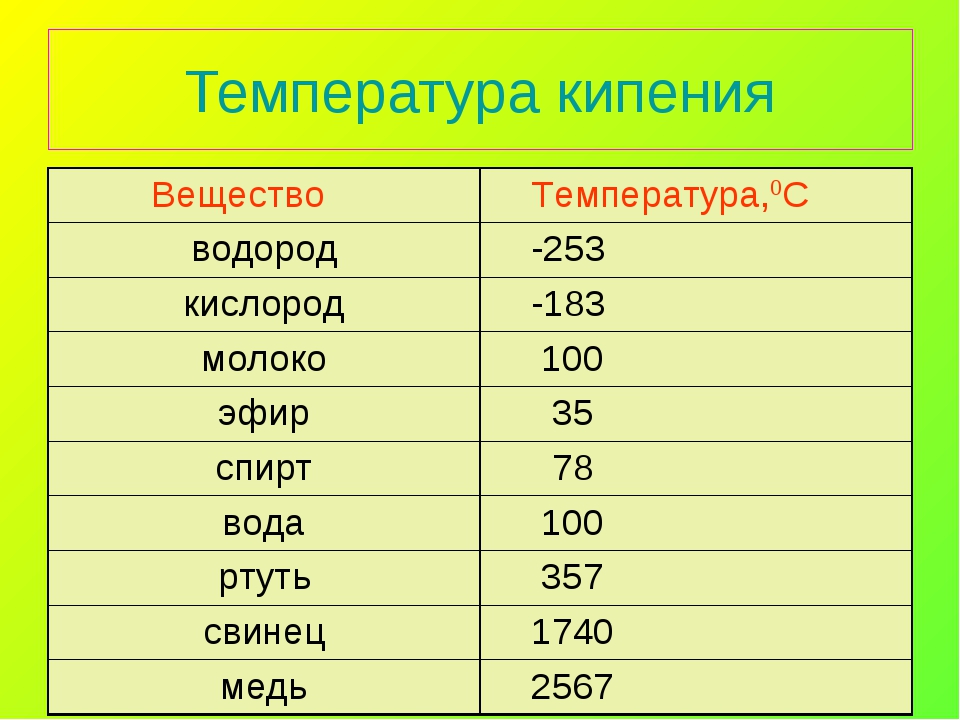 В сетчатом твердом теле каждый атом ковалентно связан со всеми окружающими атомами. Сетевые твердые тела имеют аналогичные свойства с ионными твердыми телами. Это очень твердые, несколько хрупкие твердые вещества с чрезвычайно высокими температурами плавления (выше 1000 ° C или 1800 ° F). В отличие от ионных соединений они не растворяются в воде и не проводят электричество.
В сетчатом твердом теле каждый атом ковалентно связан со всеми окружающими атомами. Сетевые твердые тела имеют аналогичные свойства с ионными твердыми телами. Это очень твердые, несколько хрупкие твердые вещества с чрезвычайно высокими температурами плавления (выше 1000 ° C или 1800 ° F). В отличие от ионных соединений они не растворяются в воде и не проводят электричество.
Примеры сетчатых тел включают алмазы, аметисты и рубины.
Металлы представляют собой непрозрачные, блестящие твердые вещества, которые являются ковкими и пластичными.Под гибкостью подразумевается, что они мягкие, и их можно формовать или прессовать в тонкие листы, а под пластичностью — их можно вытягивать в проволоку. В металлической связи валентные электроны не передаются и не разделяются, как при ионной и ковалентной связи. Скорее, электронные облака соседних атомов перекрываются, так что электроны становятся делокализованными. Электроны относительно свободно перемещаются от одного атома к другому по всему кристаллу.
Металл можно описать как решетку положительных катионов в «море» отрицательных электронов.Эта подвижность электронов означает, что металлы обладают высокой проводимостью тепла и электричества. Металлы, как правило, имеют высокие температуры плавления, хотя заметным исключением являются ртуть с температурой плавления минус 37,84 градусов по Фаренгейту (минус 38,8 по Цельсию) и фосфор с температурой плавления 111,2 F (44 ° C).
Сплав — это твердая смесь металлического элемента с другим веществом. В то время как чистые металлы могут быть слишком ковкими и тяжелыми, сплавы более податливы. Бронза — это сплав меди и олова, а сталь — это сплав железа, углерода и других добавок.
Аморфные твердые тела
В аморфных твердых телах (буквально «твердые тела без формы») частицы не имеют повторяющегося узора решетки. Их еще называют «псевдотвердыми телами». Примеры аморфных твердых веществ включают стекло, резину, гели и большинство пластиков. Аморфное твердое вещество не имеет определенной температуры плавления; вместо этого он плавится постепенно в диапазоне температур, потому что связи не разрываются сразу. Это означает, что аморфное твердое вещество будет плавиться до мягкого, податливого состояния (например, воск свечи или расплавленного стекла), прежде чем полностью превратиться в жидкость.
Это означает, что аморфное твердое вещество будет плавиться до мягкого, податливого состояния (например, воск свечи или расплавленного стекла), прежде чем полностью превратиться в жидкость.
Аморфные твердые тела не обладают характерной симметрией, поэтому они не имеют правильных плоскостей спайности при разрезании; края могут быть изогнутыми. Их называют изотропными , потому что такие свойства, как показатель преломления, проводимость и предел прочности на разрыв, равны независимо от направления приложения силы.
Дополнительные ресурсы
| Состояния вещества | Мы говорим, что существует три состояния материи: газ, жидкость и твердое тело.Их также называют «фазами». Азот и кислород — газы, вода и спирт — жидкости, железо и серебро — твердые вещества. Мы также знаем, что данное вещество может существовать в разных фазах при разных температурах. Вода — твердое тело (лед) при температуре ниже 0 o C, газ (водяной пар) выше 100 90 252 o 90 253 C.  Железо становится жидкостью, когда мы нагреваем его до температуры 1535 o C; это его точка плавления. Если нагреть жидкость до 3000 o C, она закипит; железо — это газ при температуре выше этой. Железо становится жидкостью, когда мы нагреваем его до температуры 1535 o C; это его точка плавления. Если нагреть жидкость до 3000 o C, она закипит; железо — это газ при температуре выше этой. |
| Материя существует в окружающей среде | Если задуматься точнее, интересующее нас вещество находится в среде . Если окружающая среда имеет температуру T, вещество может не сразу достичь этой температуры, но в конечном итоге оно достигнет этой температуры. Например, предположим, что кубик льда берется из морозильной камеры с температурой -10 o ° C и помещается в комнату с температурой воздуха 20 ° ° C.Некоторое время он будет оставаться льдом, но через какое-то время нагреется до 0 o C и тает. По прошествии большего времени вода нагревается до 20 o C. Внутри морозильной камеры температура окружающей среды -10 o C. Если мы снова поместим воду в морозильную камеру, она должна вернуться в твердое состояние — лед. |
| Фаза определяется температурой и давлением | Причина, по которой делается акцент на окружающей среде, заключается в том, что на самом деле существует два параметра, которые характеризуют среду: один — температура, другой — давление .Чаще всего среда, в которой мы наблюдаем материалы, — это атмосфера земли у поверхности земли. В этой среде давление не сильно меняется. Давление, измеренное высотой столбика ртути в барометре, обычно составляет около 76 см. Оно может варьироваться от 75 см до 76,5 см или около того, но — за исключением экстремальных погодных условий — не намного больше. Поэтому мы меньше осознаем тот факт, что фаза вещества зависит как от температуры, так и от давления окружающей среды. |
| Точки плавления и кипения зависят от давления | При нормальном атмосферном давлении и температуре 99 o C вода является жидкой. Но при давлении 71 см и температуре 99 o C вода представляет собой газ. Некоторые примеры: |
| Пониженная точка кипения H 2 O | Атмосферное давление значительно ниже на больших высотах, например. на горе.Если пища готовится путем опускания ее в кипящую воду, температура этой кипящей воды будет ниже 100 o C на большой высоте. Таким образом, вы увидите инструкции, скажем, относительно сублимированных продуктов, чтобы готовить их дольше, если вы находитесь на большой высоте.  Более яркой иллюстрацией того же явления является демонстрация, которую часто проводят на курсах естественных наук в средней школе или колледже: поместите стакан с водой в большую банку, прикрепленную к вакуумному насосу. Насос удаляет воздух из банки, и давление воздуха внутри банки становится довольно низким.Очень быстро вода закипает, хотя температура невысокая. Вода имеет комнатную температуру, скажем, 20 o C, а температура кипения была снижена до значения ниже 20 o C. |
| Вода под давлением в реакторе | В ядерном реакторе с водяным охлаждением происходит обратное. Вода, протекающая через реактор, поддерживается при высоком давлении , так что ее температура кипения выше нормальной, возможно, 400, o ° C или выше.Таким образом, сама вода может быть повышена до температуры 300, — ° C за счет тепла в урановых топливных стержнях; но он остается в жидкой фазе.  |
| Опыт с таянием льда | При переходе жидкость / твердое тело H 2 O вот простой эксперимент, который можно провести дома. Положите кубик льда на небольшую платформу (перевернутую кружку) и протяните через него проволоку. Прикрепите грузы к концам проволоки так, чтобы грузы свисали по бокам платформы.Проволока создает высокое давление на кубик льда — не на весь кубик льда, а на ту часть, которая находится непосредственно под проволокой. Это значение понижает температуру плавления этого льда до значения ниже 0 o ° C, и поэтому лед тает легче (легче, чем остальной кубик льда, для которого температура плавления все еще равна 0 ° ° C). ). Вы увидите, как проволока опускается в углубление во льду. Если вы подождете некоторое время (20 или 30 минут), вы можете увидеть, как лед снова замерзнет над проволокой, так что проволока вонзится в твердый лед, как меч короля Артура в камне.Проволока продолжает опускаться.  |
| Расплавленное железо в недрах земли | Глубоко внутри Земли температура становится очень высокой, скажем, около 2000 o C. Ядро Земли в основном состоит из железа, температура плавления которого составляет 1535 o C. Но это температура плавления при атмосферном давлении. Глубоко внутри материя находится под высоким давлением из-за веса земли над ней. Это делает температуру плавления железа выше 1535 o ° C — скажем, 1800 ° ° C.Железо по-прежнему находится в окружающей среде с температурой 2000 o ° C, что выше его точки плавления. Итак, утюг находится в жидком состоянии. Это состояние так называемого «внешнего ядра» (от глубины 2900 км под поверхностью до глубины около 4000 км). [Для сравнения, расстояние до центра Земли около 6400 км; это радиус Земли.] |
| Твердое ядро | Если пойти еще глубже, ближе к центру Земли, давление еще выше. Земля имеет твердое внутреннее ядро и жидкое внешнее ядро. Конечно, там никого не было. Но ученые могут многое узнать о недрах Земли, изучая сейсмические волны. Таким образом, в 1906 году Ричард Олдхэм открыл расплавленное внешнее ядро.Внутреннее ядро было обнаружено в 1930 году Инге Леманн. . |
Новый материал имеет более высокую температуру плавления, чем любое известное вещество
30 июля 2015 г.
Источник: ASM International
Расчеты показывают, что материал, изготовленный только с нужным количеством гафния, азота и углерода, будет иметь температура плавления более 4400 К (7460 ° F). Это примерно на две трети температуры на поверхности Солнца и на 200 К выше самой высокой точки плавления, когда-либо зарегистрированной экспериментально.
Экспериментальный рекордсмен — вещество, состоящее из элементов гафния, тантала и углерода (Hf-Ta-C). Но эти новые расчеты показывают, что оптимальный состав гафния, азота и углерода — HfN0,38C0,51 — является многообещающим кандидатом для установки новой отметки. Следующим шагом, который предпринимают исследователи сейчас, является синтез материала и подтверждение результатов в лаборатории.
«Преимущество начала с вычислительного подхода в том, что мы можем очень недорого попробовать множество различных комбинаций и найти те, с которыми, возможно, стоит поэкспериментировать в лаборатории», — говорит Аксель ван де Валле, доцент инженерных наук Университета Брауна.«Иначе мы бы просто снимали в темноте. Теперь мы знаем, что у нас есть кое-что, что стоит попробовать».
Исследователи использовали вычислительную технику, которая определяет точки плавления путем моделирования физических процессов на атомном уровне в соответствии с законом квантовой механики. Этот метод рассматривает динамику плавления в наномасштабе блоками по 100 или около того атомов.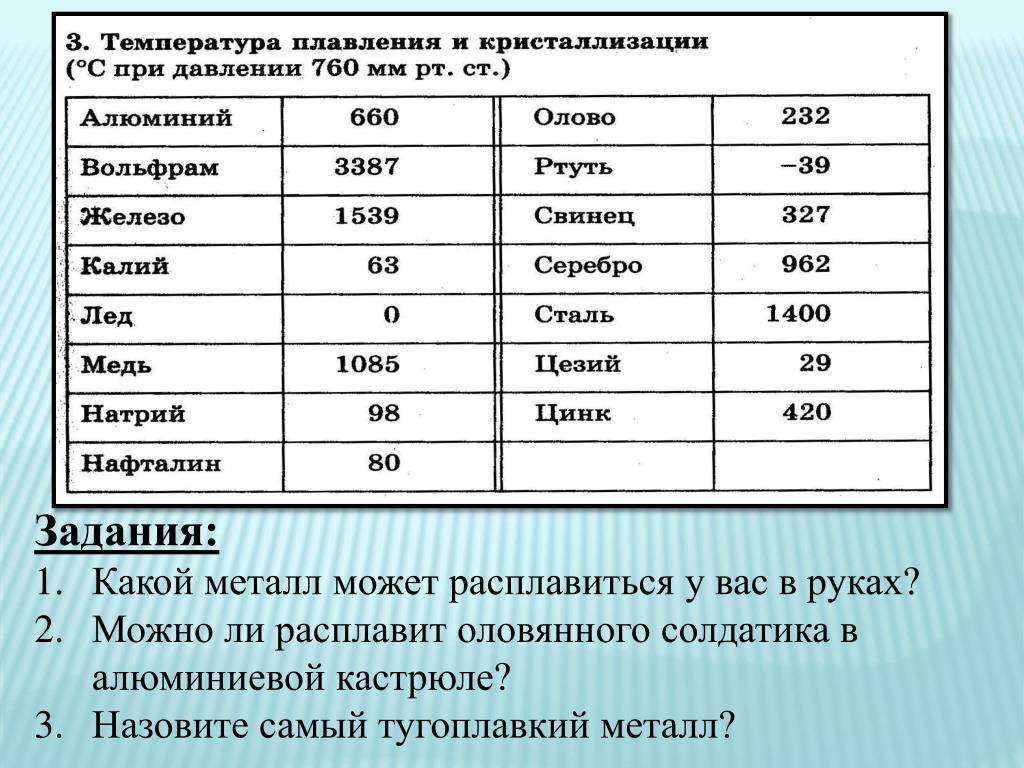 Это более эффективно, чем традиционные методы, но по-прежнему требует больших вычислительных ресурсов из-за большого количества потенциальных соединений для тестирования.Работа была выполнена с использованием компьютерной сети XSEDE Национального научного фонда и высокопроизводительного компьютерного кластера Брауна «Оскар».
Это более эффективно, чем традиционные методы, но по-прежнему требует больших вычислительных ресурсов из-за большого количества потенциальных соединений для тестирования.Работа была выполнена с использованием компьютерной сети XSEDE Национального научного фонда и высокопроизводительного компьютерного кластера Брауна «Оскар».
Команда проанализировала материал Hf-Ta-C, температура плавления которого уже была экспериментально определена. Моделирование позволило выявить некоторые факторы, влияющие на замечательную термостойкость материала.
Работа показывает, что Hf-Ta-C сочетает в себе высокую теплоту плавления (энергия, выделяемая или поглощаемая при переходе из твердого состояния в жидкое) с небольшой разницей между энтропиями (беспорядком) твердой и жидкой фаз.«Что-то заставляет плавиться, так это энтропия, полученная в процессе фазового превращения», — объясняет ван де Валле. «Итак, если энтропия твердого вещества уже очень высока, это имеет тенденцию стабилизировать твердое тело и повысить температуру плавления».
Затем исследователи использовали эти результаты для поиска соединений, которые могли бы максимизировать эти свойства. Они обнаружили, что соединение с гафнием, азотом и углеродом будет иметь такую же высокую теплоту плавления, но меньшую разницу между энтропиями твердого тела и жидкости.Когда они вычислили температуру плавления, используя свой вычислительный подход, она оказалась на 200 К выше экспериментального рекорда.
В настоящее время группа сотрудничает с лабораторией Александры Навроцки в Калифорнийском университете в Дэвисе, чтобы синтезировать соединение и провести эксперименты по определению температуры плавления. Лаборатория Навроцкого оборудована для проведения таких высокотемпературных экспериментов.
Возможное использование?
Работа может в конечном итоге указать на новые высокоэффективные материалы для множества применений, от покрытия газовых турбин до теплозащитных экранов на высокоскоростных самолетах.Но, по словам ван де Валле, неясно, будет ли само соединение HfN0,38C0,51 полезным материалом.
«Температура плавления — не единственное важное свойство [в применении к материалам]», — говорит он. «Вам нужно будет учесть такие вещи, как механические свойства, стойкость к окислению и всевозможные другие свойства. Поэтому, принимая во внимание эти вещи, вы можете захотеть смешать с этим другие вещи, которые могут снизить температуру плавления. Но поскольку вы уже начинаете так высокий, у вас больше свободы действий для настройки других свойств.Так что я думаю, что это дает людям представление о том, что можно сделать ».
Работа также демонстрирует мощь этого относительно нового вычислительного метода, говорит ван де Валле. В последние годы интерес к использованию вычислений для исследования свойств материала увеличилось количество соединений-кандидатов, но большая часть этой работы была сосредоточена на свойствах, которые гораздо проще вычислить, чем точку плавления. «Точка плавления — это действительно сложная задача для прогнозирования по сравнению с тем, что было сделано раньше», — говорит ван де Валле. .«Для модельного сообщества я думаю, что это особенное в этом».
.«Для модельного сообщества я думаю, что это особенное в этом».
Финансирование поступило от Управления военно-морских исследований США и Университета Брауна за счет использования помещений в его Центре вычислений и визуализации. Среда обнаружения экстремальных наук и инженерии (XSEDE), которая использовалась в этом исследовании, поддерживается Национальным научным фондом.
Предметные классификации
Свойства и рабочие характеристики материалов
Свойства и рабочие характеристики материалов | Тепловые свойства
Испытания и оценка материалов | Вычислительная инженерия материалов
Испытания и оценка материалов | Выбор материала
Что такое температура плавления? И бытовые применения в процессе плавки
Температура плавленияТемпература плавления
Материя существует в трех состояниях: твердое, жидкое и газообразное, и материя может переходить из одного состояния в другое при нагревании. Переход вещества из твердого состояния в жидкое состояние называется плавлением, а температура точка плавления называется точкой плавления.
Переход вещества из твердого состояния в жидкое состояние называется плавлением, а температура точка плавления называется точкой плавления.
Точка плавления — это температура, при которой вещество начинает переходить из состояния в жидкое состояние. Точка плавления льда равна нулю градуса Цельсия, когда лед начинает превращаться в воду.
Каждое вещество имеет определенную точку плавления, которая используется для различения различных веществ. Различные твердые вещества имеют разные точки плавления, в то время как некоторые твердые вещества, такие как воск, масло и лед, имеют низкие температуры плавления.
Некоторые твердые вещества, такие как железо, медь, алюминий и поваренная соль, имеют высокую температуру плавления. Температура плавления вещества зависит от давления и обычно указывается при стандартном давлении.
Измерения температуры плавления твердого вещества могут предоставить информацию о чистоте вещества, при этом смеси имеют тенденцию плавиться при температурах ниже точек плавления чистых твердых веществ.
Рабочие плавят твердые металлы, чтобы их было легче смешивать и формировать при производстве сплавов. Сплавы, такие как сплавы меди с золотом и сплавы хрома с никелем, очень важны в нашей жизни.
Медно-золотой сплав — это сплав, используемый для изготовления ювелирных изделий, используемых для украшения, а никель-хромовый сплав — это сплав, используемый для изготовления нагревательных спиралей. Материалы с высокими температурами плавления ценны для изготовления изделий, которые должны сопротивляться. высокая температура.
Вольфрам имеет чрезвычайно высокую температуру плавления и используется в нити для ламп накаливания. Если у вас смесь нескольких твердых веществ, плавление — это способ, с помощью которого некоторые вещества (с более низкими температурами плавления) могут быть отделены от другие (с более высокими температурами плавления).
Физические и химические свойства вещества (плотность, точка плавления, точка кипения, твердость, электрическая и теплопроводность)
Материя, свойства и виды молекул, процессы плавления и испарения
Атомная структура вещества, уровни энергии, электронное распределение и химическая активность
.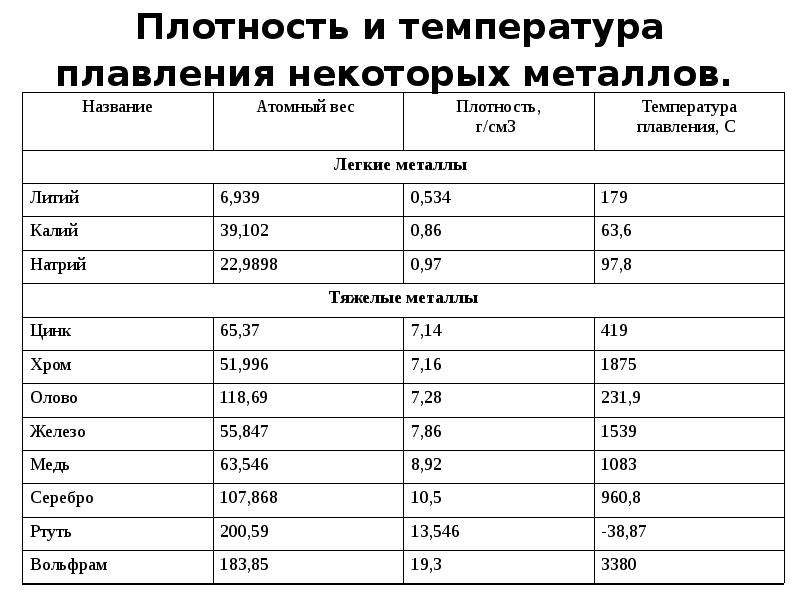

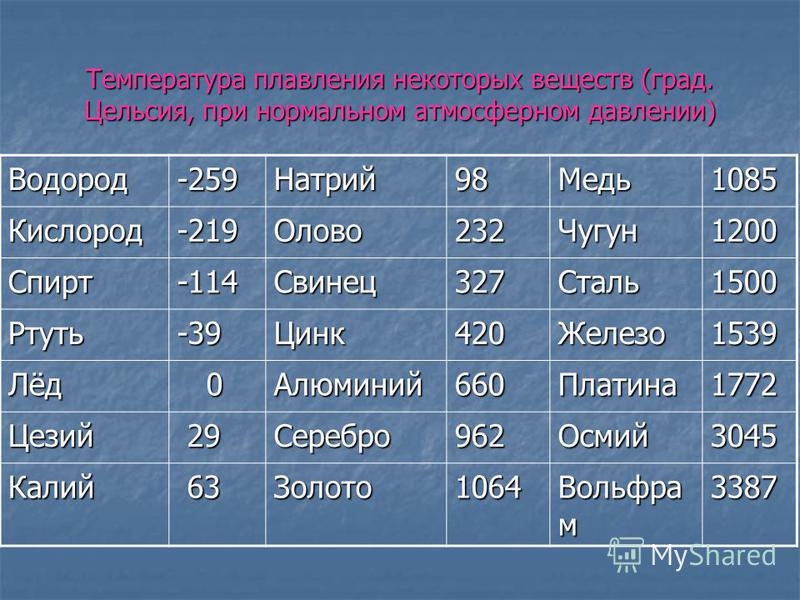 4-73
4-73
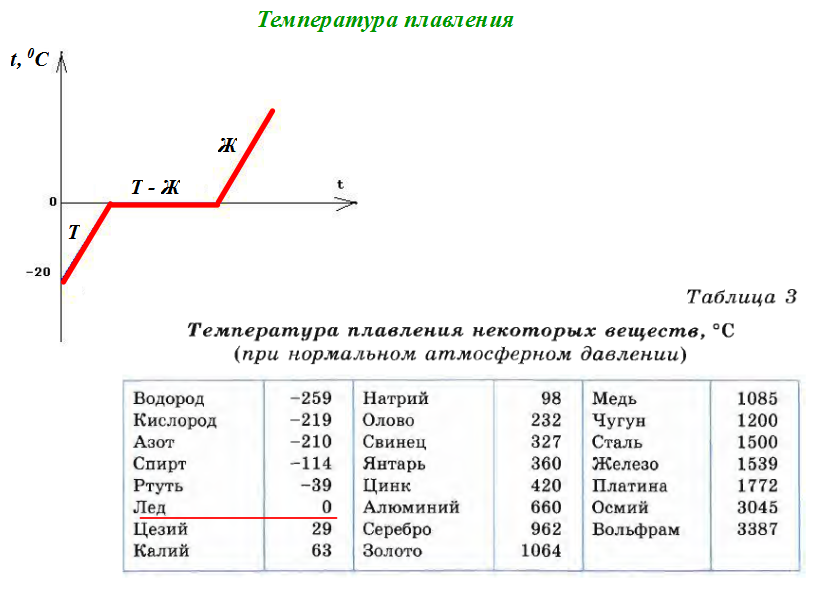 Другими словами, точка кипения (переход от жидкости к газу) зависит от давления. При нормальных условиях температура кипения воды составляет 100 o ° C, но при низком давлении температура кипения ниже, фактически менее 99 ° ° C.Правило для большинства веществ состоит в том, что точка кипения понижается при понижении давления и температура плавления понижается при понижении давления. Температура плавления воды — исключение из этого правила. Чем выше давление, тем ниже он становится.
Другими словами, точка кипения (переход от жидкости к газу) зависит от давления. При нормальных условиях температура кипения воды составляет 100 o ° C, но при низком давлении температура кипения ниже, фактически менее 99 ° ° C.Правило для большинства веществ состоит в том, что точка кипения понижается при понижении давления и температура плавления понижается при понижении давления. Температура плавления воды — исключение из этого правила. Чем выше давление, тем ниже он становится. Это делает температуру плавления железа еще выше, скажем, до 2200 o ° C. В этой области температура окружающей среды (при условии, что она все еще составляет 2000 ° ° C) на ниже точки плавления на ° C. Здесь железо должно быть твердым. Этот регион называется «внутренним ядром».
Это делает температуру плавления железа еще выше, скажем, до 2200 o ° C. В этой области температура окружающей среды (при условии, что она все еще составляет 2000 ° ° C) на ниже точки плавления на ° C. Здесь железо должно быть твердым. Этот регион называется «внутренним ядром».