Температура плавления цинка, химические и физические свойства
Цинк — важный элемент, входящий в периодическую таблицу Менделеева. Его обозначение —Zn. Используется в разных отраслях промышленности. Людям, работающим с этим материалом, важно знать температуру плавления цинка, его химический, механические свойства.
Плавление цинкаЧто такое цинк
Цинк — металл сине-белого цвета. Стоит под тридцатым номером в таблице Менделеева. При взаимодействии поверхности материала с кислородом, на ней образуется оксидная плёнка. Она скрывает естественный блеск металла, защищает его от окисления.
Структура и состав
В природе цинк нельзя найти в чистом виде. Он будет состоять по большей части из основного металла, дополнительно иметь примеси. К ним относится серебро, кадмий, свинец, медь, железо. Зависимо от процентного содержания дополнительных элементов проводится маркировка материала.
Свойства и характеристики
Характеристики металла зависят от его состава. Зависимо от физических и химических свойств мастера металлургии определяют, где лучше использовать материал, чтобы добиться наилучшей эффективности.
Зависимо от физических и химических свойств мастера металлургии определяют, где лучше использовать материал, чтобы добиться наилучшей эффективности.
Физические
Физические свойства материала определяют его возможности изменения под воздействием сторонних сил. К ним относятся:
- Легко растворяется в щелочах и кислотах.
- Температура плавления — 419 градусов по Цельсию. Особенности плавления могут изменяться зависимо от присадок в составе цинка. Высокой пластичности материал достигает при нагревании до 100 градусов.
- Температура закипания — 906 градусов.
- Имеет средний показатель твердости.
- Во время охлаждения металл крошится.
- Плотность — 7,133 г/см3.
Механические свойства цинка не подходят для изготовления из него износоустойчивых деталей. Относительно нормальных условий эксплуатации он легко ломается, не устойчив к ударам, большим физическим нагрузкам.
Химические
На химические свойства материала влияют примеси, содержащиеся в его составе.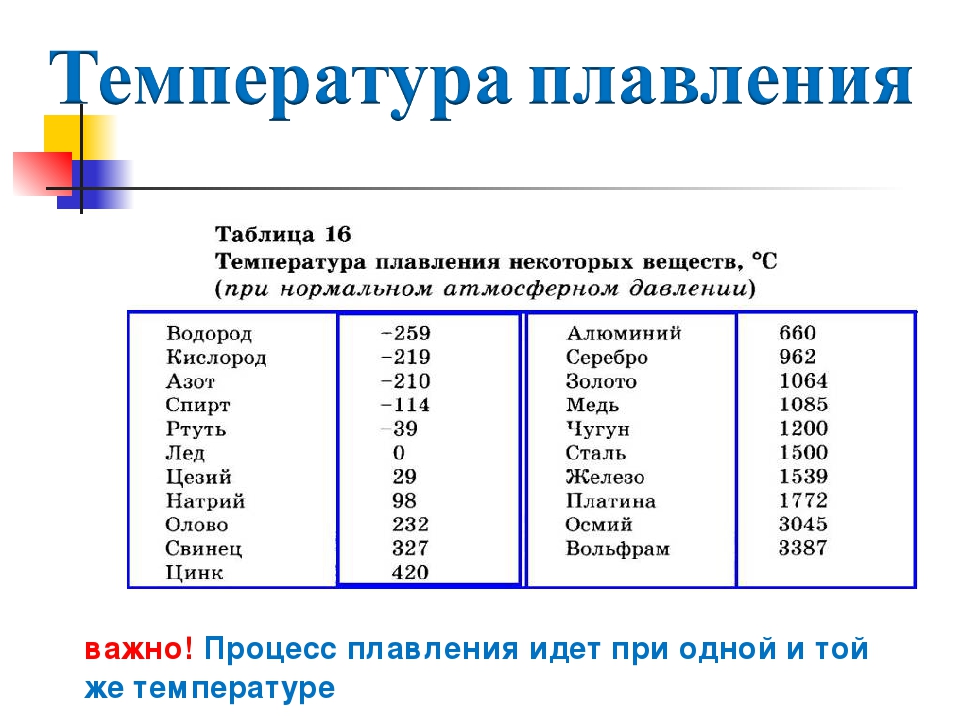 Средние параметры:
Средние параметры:
- При снижении температур теряет блеск, покрывается оксидной плёнкой.
- Разрушается при длительном воздействии влажного воздуха.
- Активный металл, который относится к энергетическим восстановителям.
- Гидроизолируется при нагревании металла в воде. Во время этого процесса образуется белый осадок.
- Растворяется в мощных минеральных кислотах.
От процентного содержание примесей сторонних металлов зависит воздействие щелочей, кислот на материал.
Области применения
Используют цинк в различных сферах промышленности. Говоря о популярности этого материала относительно мирового масштаба, он стоит на третьем место по добыче среди других цветных металлов. Сферы применения:
- Металлургия — используется как защитное покрытие от коррозий для металлоконструкций. Защищает основу первым контактируя с агрессивными факторами окружающей среды. Используется при производстве стали.
- Ювелирное дело — применяется для восстановления золота и серебра после их добычи.

- Пиротехника — применяется при создании красителей для фейерверков.
- Используется при печати изображений в типографии.
- Медицина — цинк считается качественным антисептиком, добавляется в разные мази, зубные пасты.
Содержится в организме человека, продуктах питания.
МеталлургияС помощью цинка синтезируются различные гормоны, улучшается метаболизм витаминов, расщепляются остатки алкоголя в организме, улучшается работу простаты.
Содержание в природе
В природе нельзя найти чистый цинк. Его добывают из руд, которые содержат примеси других металлов. Основными месторождениями материала являются Россия, Иран, Боливия, Австралия, Казахстан.
Историческая справка
Сплавы на основе цинка с добавлением латуни, меди известны давно. Они применялись в Древнем Египте, Индии, Древней Греции. Только к 1738 году люди научились получать более чистый металл. Для этого применялся дистилляционный способ. К 19 веку мастера металлургии научились получать чистый цинк с помощью технологического процесса прокатки.
Производство
Чтобы получить чистый материал, применяется две технологии:
- Электролитический метод. Масса, полученная из руды, помещается в ёмкость, заполненную серной кислотой. Через раствор пропускают ток. Металл отделяется от примесей. Далее его запекают с помощью промышленных печей.
- Пирометаллургический метод. Сначала проводится обжиг. Далее применяется коксовый уголь для восстановления готовой массы. Последний этапом является процесс отстаивания.
Во время обжига руды выделяется газ, который содержит большое количество серы. Его используют для создания серной кислоты.
Цинк — популярный цветной металл. Он уступает алюминию, меди по количеству добычи. Слабые механические свойства не делают его плохим. Материал нашёл своё применение в разных направлениях промышленности.
Цинковый сплав: свойства, применение, изготовление
В 4 тысячелетии до н.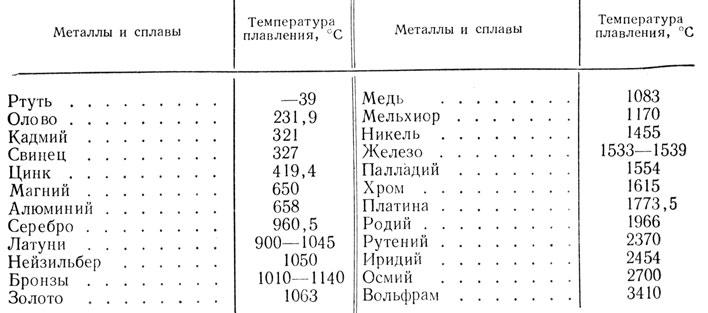 э. человек впервые познакомился с самородками из металла. В дальнейшем он научился его обрабатывать и изготавливать инструменты для решения бытовых задач и оружие. С тех пор человек продолжает знакомиться и совершенствоваться в способах добычи и обработки металлов. Ключевую роль в истории сыграл цинк и цинковый сплав.
э. человек впервые познакомился с самородками из металла. В дальнейшем он научился его обрабатывать и изготавливать инструменты для решения бытовых задач и оружие. С тех пор человек продолжает знакомиться и совершенствоваться в способах добычи и обработки металлов. Ключевую роль в истории сыграл цинк и цинковый сплав.
Свойства цинковых сплавов
Чтобы понимать какими свойствами должны обладать цинковые сплавы, необходимо знать характеристики цинка. Литейные качества, температура плавления, твердость и другие параметры напрямую зависят от химических и физических свойств цинка. Он представляет собой голубоватый металл. Это вещество не встречается в природных месторождениях в чистом виде. В процессе длительной обработки получается оксид цинка, из которого можно получить чистый металл.
Характеристики и свойства цинка
Перед описанием цинковых сплавов и их применения в различных направлениях производства требуется разобраться со свойствами цинка.
Химические свойства:
- При длительном нагревании может вступать в реакции с Н2О и сероводородом.
 В ее процессе выделяется водород.
В ее процессе выделяется водород. - Не вступает в контакт с углеродом и азотом.
- Смешивается с различными неметаллами — кислородом, фосфором и серой.
- При соединении с щелочами, образуются цинкаты (это соли цинковой кислоты).
- Если смешивать металл с серной кислотой, могут образовываться различные вещества. Все зависит от количества кислоты.
- При очень высокой температуре металл может контактировать с различными газами (йод в газообразном состоянии, хлор и фтор).
Физические свойства:
- Представляет собой прочный металл. При нагревании до 100–150°С он становится пластичным. При разогревании более 210 °С металл изменяет свою форму. В сравнении с другими металлами цинк плавится при низкой температуре.
- Обладает хорошей теплопроводностью — 116 Вт/м К.
- Кипение материала при температуре — 906°С.
- Плотность — 7.133 гр./см куб.
- Плавление материала — 419°С.
- Максимальная прочность при растяжении — 200–250 МН/м2.

- Удельная теплота испарения — 114.8 КДж/моль.
Количество примесей в составе металла напрямую зависит от способа добычи, обработки и изначальной породы материала. Часто встречающиеся примеси, содержащиеся в цинке — никель, фтор, хлор и свинец.
Необработанный металлСвинец и цинк называют неразлучной парой. Хоть свинец и является примесью, содержащейся в цинке, в месторождениях они совместно встречаются не очень часто. Большое количество свинца, содержащееся в изначальном материале, ухудшает его свойства. Быстрее развивается межкристальная коррозия. Чтобы удалить примеси посторонних металлов, используется дистилляционный способ.
Как примеси изменяют свойства цинка
Посторонние примеси, содержащиеся в цинке, ухудшают характеристики этого металла (при большом содержании). Первостепенная задача производителей — снизить количество свинца, кадмия и олова в этом металле, чтобы избежать межкристаллической коррозии.
Воздействие примесей на цинк:
- Свинец — усиливает растворимость металла в воде.

- Медь — ухудшает показатель пластичности. Металл становится более уязвимым для коррозии, однако улучшается его прочность.
- Мышьяк — ухудшает прочность и пластичность цинка даже при минимальном содержании.
- Олово — увеличивает ломкость готовых отливок.
- Кадмий — снижает пластичность металла.
- Сурьма — в процессе прокатки при больших температурах, увеличивает прочность и ухудшает пластичность цинка.
Практически все примеси считаются вредными для готовых заготовок. Из-за этого производители в первую очередь проводят ряд процедур, чтобы содержание цинка в готовой отливке было наиболее высоким.
Виды сплавов
В процессе развития технологий появились различные сплавы цинка. Соединение двух металлов может быть гораздо лучше по характеристикам, чем чистое сырье, очищенное и переплавленное в заготовки. Поговорим о самых известных сплавах цинка с другими металлами.
Медь и цинк
Производная смесь меди и цинка — латунь. Сплав известен с древних времен. Изначально он изготавливался в процессе сплавки цинковой руды и меди. В XVIII в. был впервые изготовлен сплав с добавлением металлического цинка. Существует 3 вида латуни:
Изначально он изготавливался в процессе сплавки цинковой руды и меди. В XVIII в. был впервые изготовлен сплав с добавлением металлического цинка. Существует 3 вида латуни:
- Зеленая — 60% меди.
- Золотистая — 75% меди.
- Желтая — 67% меди.
Раньше латунь использовалась при производстве монет и украшений.
Сталь и цинк
Оцинкованную сталь знает каждый человек. Ее можно встретить в любой квартире или на производстве. Эту смесь неразумно называть сплавом. На лист стали наносится слой цинкового напыления. При температуре в 400°С, жидкий цинк наносится на стальную поверхность. При такой температуре атомы двух металлов плотно связываются между друг другом и образуют железоцинковый сплав. Оцинкованные поверхности не ржавеют.
Олово и цинк
Сплав олова и цинка популярен в электропромышленности. Благодаря высокому показателю теплоемкости этот сплав использовался при изготовлении сосудов для хранения жидкости. Напитки длительное время оставались теплыми.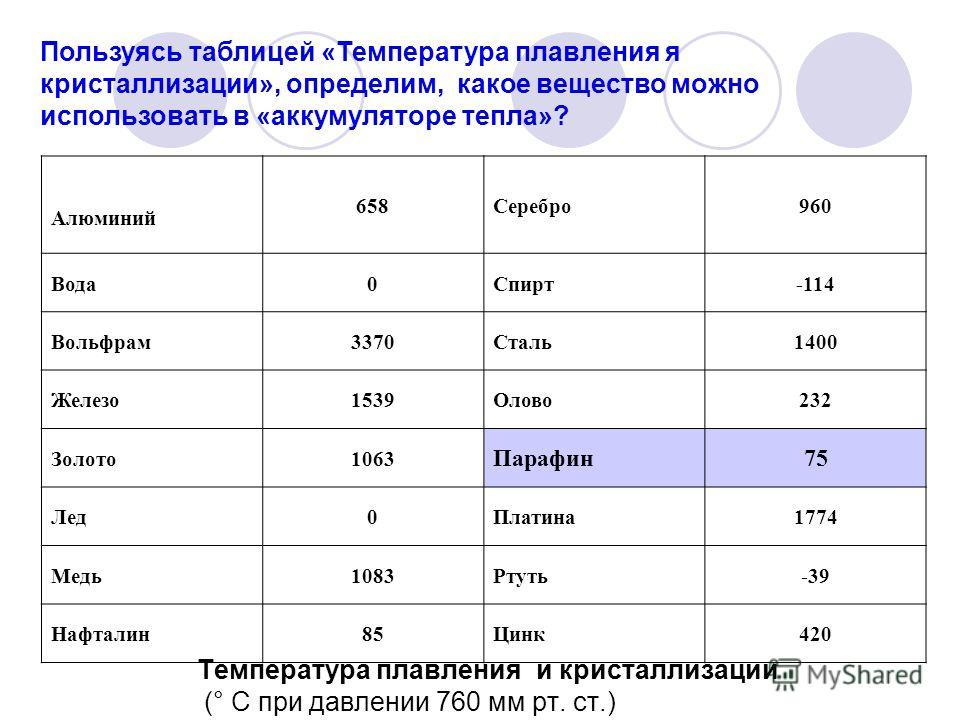
Алюминий и цинк
Сплавы алюминия и цинка с добавлением других металлов используются в литейном производстве. Получаемая смесь обладает хорошими литейными параметрами благодаря низкой температуре плавления.
Плавление металлаВреден ли цинковый сплав
С современным оборудованием производители добились снижения количества свинца и никеля в составе сплавов до минимума. Эти металлы несли в себе ключевую опасность для человеческого организма. Благодаря их уменьшению в составе готовый изделий бижутерия из цинковых сплавов считается безопасной для здоровья.
Применение
В нынешнее время применение сплавов цинка с другими металлами можно увидеть в различных отраслях производства.
Для защиты металлов от коррозии
Чтобы защитить другие металлы от развития коррозии, используется чистый материал, которым покрывается уязвимая поверхность. Процесс покрытия называется металлизация.
В автомобильной отрасли
Цинк и сплавы с его добавлением получили большую популярность в автомобильной отрасли. Смеси металлов используют для декоративного покрытия отдельных элементов автомобиля (ручки, бампера, решетки, зеркала). Зубчатые механизмы, рычажные механизмы, покрышки, аккумуляторах — содержат это вещество.
Смеси металлов используют для декоративного покрытия отдельных элементов автомобиля (ручки, бампера, решетки, зеркала). Зубчатые механизмы, рычажные механизмы, покрышки, аккумуляторах — содержат это вещество.
В производстве ювелирных украшений
Бижутерия и украшения из цинковых сплавов известны уже длительное время. Цинк часто смешивается с золотом. Для изготовления белого золота также используют этот металл. Он осветляет готовое изделие.
В строительстве
В строительстве широкое применение получили сплавы из цинка и других металлов. Например, их используют при производстве кровли. Из оцинковки изготавливается не только кровельное покрытие, но и различные трубы, желоба, ветровые планки, подшивка для свесов крыши.
В медицине
Если говорить о медицине, окись цинка часто используется в качестве антисептического средства. Также ее добавляют в составы использующиеся для ускорения регенерации.
Применение цинка в медицинеКак происходит изготовление сплавов
Перед тем как разбираться с изготовлением сплавов, требуется понять, как получают чистый металл.
Самым известным способом считается дистилляционный. В первую очередь, концентрированный состав обжигается. Затем он разогревается до тех пор, пока не получится зернистая структура. После этого концентрированное вещество восстанавливается с помощью угля при нагревании до 1300°С. Пары, получаемые в этом процессе, конденсируют и разливают по формам. Далее жидкий металл отстаивается при температуре в 500°С. Из него выходит свинец и железо. После процесса дистилляции получается материал чистотой в 98–99%.
Также существует более сложный и дорогой способ обработки — ректификация. Во время этого процесса происходит теплообмен между жидкостью и паром. Теплообмен разделяет смеси и исключает примеси. На выходе получается материал чистотой в — 99–99.9%.
Есть еще один метод изготовления чистого материала — электролитический. После обжига концентрата его обрабатывают серной кислотой. Получившееся вещество подвергается очистке от примесей и проходит процесс электролиза (производится в свинцовых ваннах). В ваннах остается металл, который переплавляют с помощью индукционных печей. На выходе получается материал чистотой в 99.95%.
В ваннах остается металл, который переплавляют с помощью индукционных печей. На выходе получается материал чистотой в 99.95%.
После получения чистого материала его расплавляют. В жидкий металл добавляют другие вещества для улучшения его технических характеристик. Чем лучше будет разогрет металл, тем лучше он будет заполнять литейные формы.
Цинковые сплавы используются в различных отраслях производства, изготовлении украшений и медицине (оксид). Оцинкованные листы и изготовленные из них материалы популярны в строительстве. При покупке сплава важно уточнить о содержании свинца и никеля в его составе. Эти 2 вещества вредны для здоровья человека.
ГОСТ, температура плавления, свойства, применение :: SYL.ru
Цинк – это металл синевато-белого цвета, в чистом виде который не могли получить долгое время.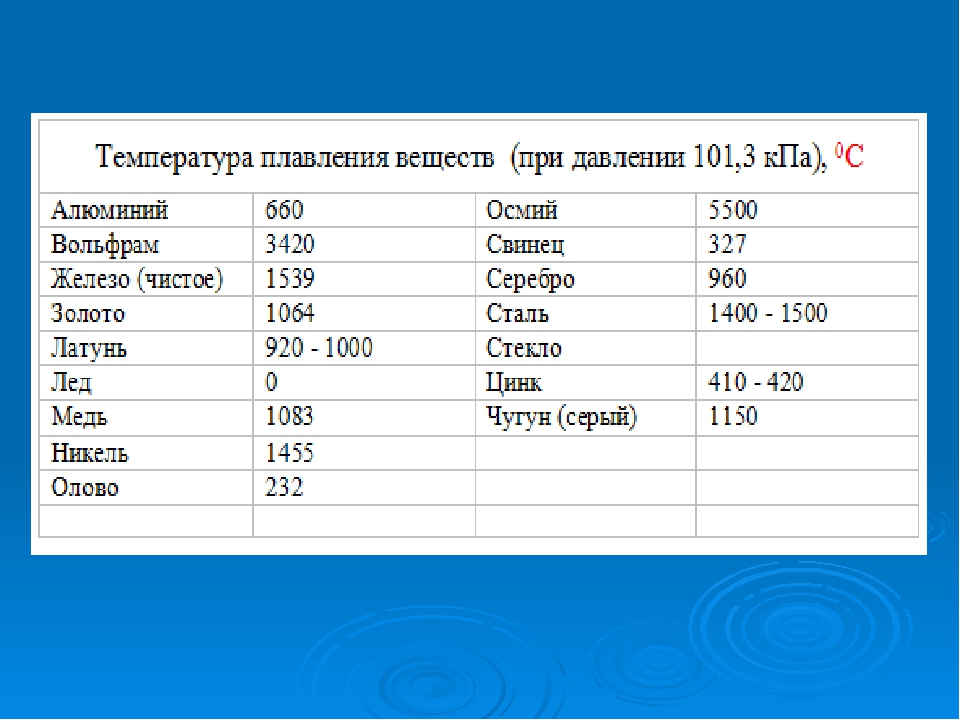 Только англичанин Дж. Чемпион в 1738 году приобрел патент на его производство. А через пять лет в Европе появился первый цинковый завод в Бристоле. Его производительность составляла ежегодно всего 200 тонн. По использованию этот популярный цветной металл уступает только меди и алюминию. Выплавляют его в мире миллионы тонн в год.
Только англичанин Дж. Чемпион в 1738 году приобрел патент на его производство. А через пять лет в Европе появился первый цинковый завод в Бристоле. Его производительность составляла ежегодно всего 200 тонн. По использованию этот популярный цветной металл уступает только меди и алюминию. Выплавляют его в мире миллионы тонн в год.
Свойства цинка
Металл имеет слабые механические свойства. Он ломкий и хрупкий при нормальной температуре, а при повышении ее до 100–150 градусов по Цельсию приобретает тягучесть и легко деформируется: его куют и раскатывают в листы. Для увеличения прочности и температуры плавления в цинк добавляют медь, свинец, олово, алюминий, магний.
Это химически активный металл. На открытом воздухе при температуре 100 градусов Цельсия на поверхности появляется пленка и цинк приобретает тусклый вид. Повышенная влажность и углекислый газ способствуют разрушению элемента. Он легко разъедается кислотами и щелочами, поэтому для промышленного использования применяются только сплавы.
Свойства цинковых сплавов
Отмечаются отличные литейные свойства сплавов. Благодаря высокой пластичности в горячем виде, металлы используют для отливок деталей, имеющих сложную форму, глубокие полости, резьбу и тонкой толщины стенки. Они не прилипают к пресс-форме, потому что не вступают в реакцию с железом. Литые детали имеют высокую точность и чистую поверхность. Сплавы обладают отменными механическими свойствами: достаточным пределом прочности, твердостью и хорошо обрабатываются. Их можно паять и сваривать.
Из недостатков следует отметить склонность к старению, большую плотность и коррозию. При использовании цинковых сплавов происходит их естественный процесс старения, в результате детали уменьшаются в размерах. Самая большая усадка происходит в первые 5 недель, а последующая – на протяжении очень длительного периода времени. Для компенсации размеров деталей их подвергают термической обработке – отжигу. Для уменьшения коррозии в сплавах ограничивают содержание магния до 0,1 %. Для увеличения долговечности деталей их подвергают защитным покрытиям: никелируют, хромируют, кадмируют.
Для увеличения долговечности деталей их подвергают защитным покрытиям: никелируют, хромируют, кадмируют.
Виды сплавов
По назначению цинковые сплавы делятся на:
- Деформируемые. Основу этих сплавов составляет цинк. По свойствам они подобны латуням. Методом литья получают слитки, а из них изготовляют прутки, полосы, листы.
- Литейные. Имеют высокую текучесть. Отлично заполняют форму, не прилипая к ней. Получаются качественные отливки сложной конфигурации литьем под давлением.
- Антифрикционные. Сплавы обладают низким коэффициентом трения и хорошей прирабатываемостью подшипника к шейке вала.
- Припои. Применяются для пайки изделий, обладают хорошей пластичностью и прочностью.
- Типографские. Используют для отливки шрифтов ручного и машинного набора. Заменяют токсичные свинцовые сплавы. Стойкие к истиранию.
- Протекторные. Защищают внутренние и внешние части морских судов от коррозии. Используют их со специальным лакокрасочным покрытием.

Характеристика и свойства латуни
Медно-цинковый сплав, в котором медь является основным компонентом, а цинк – легирующим, называется латунью. Цвет металла находится в зависимости от состава и изменяется от светло-желтых тонов до красноватых оттенков. Такие сплавы характеризуются устойчивостью к коррозии и обладают высокой прочностью. Они хорошо поддаются разным методам обработки. Текучесть латуни позволяет изготовлять детали, используя метод литья. Применяя пластическую деформацию сплава, из него производят проволоку, листы, ленты, разные профили методом прокатки. Содержание цинка в сплаве может быть различным и составлять от 5 до 45 %. Кроме этого, туда входят и дополнительные легирующие компоненты, которые используются для улучшения свойств латуней:
- Никель. Способствует увеличению коррозийности и прочности.
- Кремний. Улучшает антифрикционные свойства.
- Олово. Влияет на прочность и устойчивость к соленой воде.
- Свинец. Совершенствует обрабатываемость.

- Марганец. Воздействует на прочность и коррозийную устойчивость.
При различном комбинировании легирующими компонентами получают латуни с необходимыми качествами и характеристиками. Изделия из таких сплавов не подвергаются влиянию окружающей среды, имеют высокую износостойкость.
Применение сплавов
Без цинка и его сплавов не способны существовать многие отрасли от машиностроения до медицины.
Применение цинковых сплавов в различных сферах и отраслях:
- машиностроительная – для производства бензобаков, крышек багажников, корпусов карбюраторов, глушителей, бензонасосов, радиаторов, насосов, фурнитуры;
- литейная – затворы оружия;
- электротехническая – изготовление аккумуляторов, батареек;
- полиграфическая – для набора текстов и печати иллюстраций;
- обрабатывание металлоконструкций – металлизация и оцинковка различных поверхностей от разрушения и коррозии металла;
- медицина – антисептические и противовоспалительные средства, получение радионуклидов для диагностики и лечения ряда заболеваний;
- производство краски – изготовление цинковых белил;
- строительная – для кровли, облицовки стен, водосточных труб, желобов;
- искусство – чеканка монет, графика;
- ювелирная – личные украшения, шкатулки, пуговицы, молнии, декоративные накладки;
- бытовая – для кухонного оборудования, карнизов.

Цинковые литейные сплавы
К сплавам для литья под давлением предъявляются следующие требования. Они должны:
- обладать отличной жидкотекучестью;
- не вступать в реакцию и не привариваться к пресс-форме;
- иметь небольшой интервал кристаллизации;
- располагать прочностью при высоких температурах.
Такие сплавы используются в следующих случаях:
- Для отливки под давлением деталей, имеющих сложную конфигурацию и тонкие стенки. Так получают детали тормозной аппаратуры, насосы, используя свойства сплавов, как устойчивость к растрескиванию, жидкотекучесть, низкая температура плавления.
- Для изготовления литых декоративных изделий. После гальванизации на поверхности устанавливается красивое и прочное покрытие. Оно может оказаться не совсем качественным при пористой поверхности или излишнем содержании алюминия.
- Для получения антифрикционных цинковых сплавов, используемых в машиностроении.
- Для литья типографских шрифтов.
 С изменением технологий отпадает необходимость их изготовления.
С изменением технологий отпадает необходимость их изготовления.
Автомобилестроение
Автомобильная промышленность – это одна из передовых областей машиностроения. Здесь стабильно проводятся исследования по использованию новейших материалов и сплавов, которые обладают значительными эксплуатационными и технологическими свойствами. К ним можно отнести и цинковые сплавы по ГОСТ 21437-75.
К нему принадлежат четыре марки сплавов, две из которых относятся к литейным, а другие – к обрабатываемым давлением. Данные материалы используются для производства деталей автомобиля (втулок и подшипников), обладающих антифрикционными свойствами. Литые сплавы из цинка ГОСТ 19424-74 и 25140-82 применяют для изготовления карбюраторов, имеющих сложную форму, и бензонасосов методом литья под давлением, используя их свойство высокой жидкотекучести. Недостаток сплавов – детали практически не подлежат ремонту.
Вместо заключения
Латуни – цинковые сплавы — находят широкое применение в машиностроительной промышленности.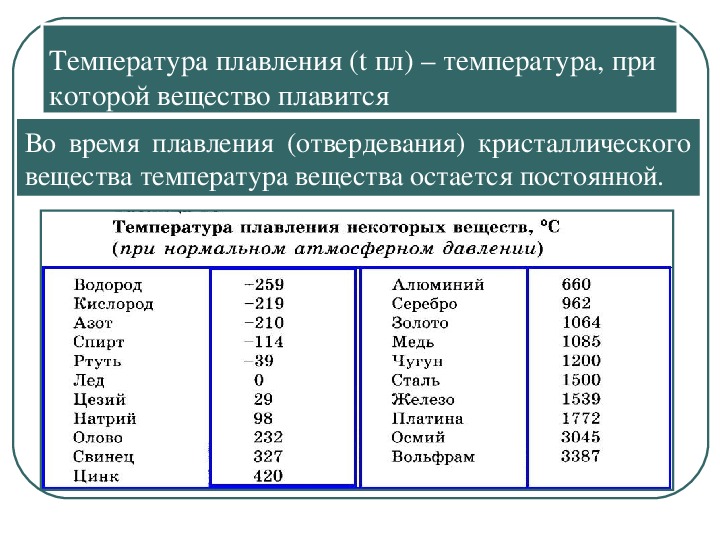 Их используют для производства особо прочных деталей, где требуются точные отливки. Большая часть вырабатываемого в мире цинка идет на изготовление оцинкованной стали, потому что он образует защитную пленку, предотвращая их от коррозии. Незаменимы сплавы при изготовлении различных источников электрического тока. Являясь компонентом в припоях, этот цветной металл снижает температуру плавления. Медицинские препараты, содержащие окиси цинка, обладают противовоспалительными и антисептическими свойствами.
Их используют для производства особо прочных деталей, где требуются точные отливки. Большая часть вырабатываемого в мире цинка идет на изготовление оцинкованной стали, потому что он образует защитную пленку, предотвращая их от коррозии. Незаменимы сплавы при изготовлении различных источников электрического тока. Являясь компонентом в припоях, этот цветной металл снижает температуру плавления. Медицинские препараты, содержащие окиси цинка, обладают противовоспалительными и антисептическими свойствами.
Недостаточное количество содержания цинкового микроэлемента в организме человека приводит к возникновению серьезных заболеваний: язвы желудка, цирроза печени, атеросклероза.
Литейные алюминиевые сплавы с цинком и магнием
Алюминиевые сплавы бывают деформируемыми и литейными. Исходные слитки деформируемых сплавов подвергают обработке методами обработки металлов давлением – прокатки, прессования (экструзии) или ковки.
И деформируемые, и литейные алюминиевые сплавы имеют, в принципе, одни и те же легирующие элементы. Однако в деформируемых сплавах их содержание намного меньше, чем в литейных. Основными легирующими элементами являются магний, медь, кремний и цинк. Другие легирующие элементы – вспомогательные и модифицирующие – применяют для улучшения физических и механических свойств отливок из литейных алюминиевых сплавов.
Литейные сплавы алюминий-цинк-магний
Алюминиевые литейные сплавы, легированные цинком и магнием, термически упрочняются в процессе обычного вылеживания, то есть естественного старенения. При этом максимальная прочность достигается через 20-30 суток после разливки и при выдержке при комнатной температуре. Это процесс упрочнения может быть ускорен искусственным старением.
Алюминиевые литейные сплавы серии 7хх.х
По американской классификации эти сплавы относятся к серии 7хх.х. Они имеют прочностные свойства от средних до высоких. Путем отжига обеспечивается хорошая стабильность размеров. Эвтектическая точка сплавов этой группы является высокой, что благоприятно для деталей, которые подвергаются пайке. Эти сплавы имеют хорошую механическую обрабатываемость. Для них характерна высокая коррозионная стойкость при некоторой склонности к коррозии под напряжением. Их не рекомендуют для применения при повышенных температурах. Прочностные свойства этих сплавов повышаются при комнатной в течение нескольких недель после разливки в результате упрочнения по механизму выделения вторичной фазы. Этот процесс продолжается и после нескольких недель, но уже с уменьшающейся скоростью. К сплавам 707.0, 771.0 и 772.0 могут применяться термические обработки типа Т6 и Т7.
Литейные свойства
Литейные свойства литейных алюминиевых сплавов системы алюминий-цинк-магний весьма посредственные. Поэтому для получения хороших отливок требуется жесткий контроль условий затвердевания. Чтобы предотвратить усадочные дефекты применяют охлаждение с умеренными и высокими температурными градиентами. Чаще для этих сплавов применяют литье в песчаные формы, а при литье в постоянные формы можно столкнуться со значительными трудностями.
Литейный алюминиевый сплав 771.0
Химический состав
Формула сплава: 7Zn-0,9Mg-0,13Cr
Химический состав:
- медь: 0,10 % макс.;
- магний: 0,8-1,0 %;
- марганец: 0,10 % макс.;
- кремний: 0,15 % макс.;
- железо: 0,15 % макс.;
- хром: 0,06-0,20 %;
- цинк: 6,5-7,5 %;
- олово: 3,5 % макс.;
- титан: 0,10-0,20 %;
- другие: 0,05 % каждого, 0,15 % в сумме макс.;
- алюминий: остальное.
Свойства: механические и физические
Типичные механические свойства (Т5):
- прочность на растяжение: 290 МПа;
- предел текучести: 260 МПа;
- относительное удлинение: 1,5 %;
- модуль упругости: 71,0 ГПа.
Физические свойства:
- плотность: 2,823 г/см3;
- температура ликвидус: 645 ºС;
- температура солидус: 605 ºС.
Термическая обработка
Этот сплав можно термически обрабатывать на состояния Т2, Т5, Т51, Т52 и Т71
Термическая обработка на состояние Т5:
- выдержка при 180 ºС в течение 3-5 часов;
- охлаждение вне печи на спокойном воздухе.
Термическая обработка на состояние Т51:
- выдержка при 205 ºС в течение 6 часов;
Термическая обработка на состояние Т6:
- выдержка при 580-595 ºС в течение 6 часов;
- охлаждение вне печи на спокойном воздухе до комнатной температуры;
- старение путем выдержки в течение 3 часов при температуре 130 ºС;
- охлаждение на спокойном воздухе.
Механическая обработка
Сплав 771.0 в состоянии Т5 имеет хорошую стабильность и обрабатываемость резанием. Его можно фрезеровать в 5 раз быстрее, а сверлить в 2 раза быстрее, чем такие сплавы как 356.0 и 319.0.
Сварка
Может свариваться газовой дуговой сваркой вольфрамовым или металлическим электродом с применением алюминиевого сварочного сплава 5356. В зависимости от термического состояния отливки после сварки может возникнуть необходимость специальной термической обработки.
В состоянии Т5 сварку не производят. Для последующей сварки производят термическую обработку на состояние Т51.
Фазовая диаграмма алюминий-цинк
Источник: Aluminum and Aluminum Alloys, ASM International, 1996
Литейные алюминиевые сплавы: алюминий-медь-кремний
В отличие от деформируемых алюминиевых сплавов, литейные сплавы имеют намного большее содержание легирующих элементов.
Медь и кремний в алюминии
Из всех литейных алюминиевых сплавов сплавы системы алюминий-медь-кремний имеют самое широкое применение. Эти сплавы обладают хорошими литейными свойствами. Сочетание кремния и меди позволяет применять термическую обработку для повышения механических свойств.
Количество в этих сплавах как меди, так и кремния изменяется очень широко. Поэтому в одних сплавах алюминий-медь-кремний преобладает медь, а в других – кремний.
В этих сплавах:
- медь обеспечивает прочность, а
- кремний повышает литейные свойства и снижает горячее растрескивание.
Сплавы алюминий-медь-кремний с содержанием меди более чем 3-4 % являются термически упрочняемыми. Однако обычно термическую обработку применяют только, если эти сплавы содержат также магний, который повышает их восприимчивость к термической обработке.
Сплавы с большим содержанием кремния (более 10 %) имеют низкое термическое расширение, что является преимуществом для изделий, работающих при повышенных температурах. Когда содержание кремния превышает 12-13 %, вплоть до 22 %, в сплаве присутствуют кристаллы первичного кремния. Когда эти кристаллы должным образом распределены, они обеспечивают сплаву высокую износостойкость. Из этих заэвтектических сплавов изготавливают, например, автомобильные блоки цилиндров двигателей.
Влияние магния
Многие сплавы системы Al-Si-Cu содержат также магний: АЛ3, АЛ4М, АК5М2, АЛ5, АЛ5-1, АЛ6, АК7М2, Ак4М4, АЛ32. Это дает им высокую жаростойкость с рабочими температурами 250-275 ºС. Эти сплавы уступают сплавам Al-Si и Al-Si-Mg по литейным свойствам, коррозионной стойкости и герметичности. Не требуют модифицирования и кристаллизации под давлением.
Литейный алюминиевый сплав 380.0
Формула сплава: 8,5Si-3,5Cu
Химический состав:
- медь: 3,0-4,0 %;
- магний: 0,10 % макс.;
- марганец: 0,50 % макс.;
- кремний: 7,5-9,5 %;
- железо: 2,0 % макс.$
- никель: 0,50 % макс;
- цинк: 3,0 % макс.;
- олово: 3,5 % макс.;
- другие: 0,50 % макс.;
- алюминий: остальное.
Влияние примесей
Высокое содержание железа снижает пластичность. Содержание примесей может достигать относительно высоких значений прежде чем начнет проявляться их серьезное влияние.
Типичные механические свойства:
- прочность на растяжение: 330 МПа;
- предел текучести: 165 МПа;
- относительное удлинение: 3 %;
- коэффициент Пуассона: 0,33;
- модуль упругости: 71,0 ГПа.
Физические свойства:
- плотность: 2,71 г/см3;
- температура ликвидус: 595 ºС;
- температура солидус: 540 ºС.
Технологические свойства:
- температура плавления: от 650 до 760 ºС;
- температура разливки: от 635 до 705 ºС;
- температура отжига для повышения пластичности: 260-370 ºС,
выдержка – 8 часов, охлаждение с печью или на спокойном воздухе; - температура отпуска для снятия внутренних напряжений: 175-260 ºС,
выдержка – 4-6 часов, охлаждение на спокойном воздухе.
Фазовые диаграммы алюминий-кремний и алюминий-медь
Фазовая диаграмма алюминий-кремний
Фазовая диаграмма алюминий-медь
Источник: Aluminum and Aluminum Alloys, ASM International, 1996
Цинк. Химия цинка и его соединений
1. Положение цинка в периодической системе химических элементов
2. Электронное строение цинка
3. Физические свойства
4. Нахождение в природе
5. Способы получения
6. Качественные реакции
7. Химические свойства
7.1. Взаимодействие с простыми веществами
7.1.1. Взаимодействие с галогенами
7.1.2. Взаимодействие с серой
7.1.3. Взаимодействие с фосфором
7.1.4. Взаимодействие с азотом
7.1.5. Взаимодействие с углеродом
7.1.6. Горение
7.2. Взаимодействие со сложными веществами
7.2.1. Взаимодействие с водой
7.2.2. Взаимодействие с минеральными кислотами
7.2.4. Взаимодействие с азотной кислотой
7.2.5. Взаимодействие с щелочами
7.2.6. Взаимодействие с окислителями
Оксид цинка
1. Способы получения
2. Химические свойства
2.1. Взаимодействие с основными оксидами
2.2. Взаимодействие с основаниями
2.3. Взаимодействие с водой
2.4. Взаимодействие с кислотными оксидами
2.5. Взаимодействие с кислотами
2.6. Взаимодействие с восстановителями
2.7. Вытеснение более летучих оксидов из солей
Гидроксид цинка
1. Способы получения
2. Химические свойства
2.1. Взаимодействие с кислотами
2.3. Взаимодействие с щелочами
2.4. Разложение при нагревании
Соли алюминия
Бинарные соединения алюминия
Цинк
Положение в периодической системе химических элементов
Цинк расположены в побочной подгруппе II группы (или в 12 группе в современной форме ПСХЭ) и в четвертом периоде периодической системы химических элементов Д.И. Менделеева.
Электронное строение цинка и свойства
Электронная конфигурация цинка в основном состоянии:
+30Zn 1s22s22p63s23p63d104s2
1s
2s 2p
3s 3p 3d
4s
Характерная степень окисления цинка в соединениях +2.
Физические свойства
Цинк при нормальных условиях — хрупкий переходный металл голубовато-белого цвета (быстро тускнеет на воздухе, покрываясь тонким слоем оксида цинка).
Температура плавления цинка 420°С, температура кипения 906°С, плотность 7,13 г/см3.
Нахождение в природе
Среднее содержание цинка в земной коре 8,3·10-3 мас.%. Основной минерал цинка: сфалерит (цинковая обманка) ZnS..
Цинк играет важную роль в процессах, протекающих в живых организмах.
В природе цинк как самородный металл не встречается.
Способы получения
Цинк получают из сульфидной руды. На первом этапе руду обогащают, повышая концентрацию сульфидов металлов. Сульфид цинка обжигают в печи кипящего слоя:
2ZnS + 3O2 → 2ZnO + 2SO2
Чистый цинк из оксида получают двумя способами.
При пирометаллургическом способе, который использовался издавна, оксид цинка восстанавливают углём или коксом при 1200—1300 °C:
ZnO + С → Zn + CO
Далее цинк очищают от примесей.
В настоящее время основной способ получения цинка — электролитический (гидрометаллургический). При этом сульфид цинка обрабатывают серной кислотой:
ZnO + H2SO4 → ZnSO4 + H2O
При это получаемый раствор сульфата цинка очищают от примесей (осаждением их цинковой пылью) и подвергают электролизу.
При электролизе чистый цинк осаждается на алюминиевых катодах, с которых его удаляют и подвергают плавлению в индукционных печах. Таким образом можно получить цинк с высокой чистотой (до 99,95 %).
Качественные реакции
Качественная реакция на ионы цинка — взаимодействие избытка солей цинка с щелочами. При этом образуется белый осадок гидроксида цинка.
Например, хлорид цинка взаимодействует с гидроксидом натрия:
ZnCl2 + 2NaOH → Zn(OH)2 + 2NaCl
При дальнейшем добавлении щелочи амфотерный гидроксид цинка растворяется с образованием комплексной соли тетрагидроксоцинката:
Zn(OH)2 + 2NaOH = Na2[Zn(OH)4]
Обратите внимание, если мы поместим соль цинка в избыток раствора щелочи, то белый осадок гидроксида цинка не образуется, т.к. в избытке щелочи соединения цинка сразу переходят в комплекс:
ZnCl2 + 4NaOH = Na2[Zn(OH)4] + 2NaCl
Химические свойства
1. Цинк – сильный восстановитель. Цинк – довольно активный металл, но на воздухе он устойчив, так как покрывается тонким слоем оксида, предохраняющим его от дальнейшего окисления. При нагревании цинк реагирует со многими неметаллами.
1.1. Цинк реагируют с галогенами с образованием галогенидов:
Zn + I2 → ZnI2
Реакция цинка с иодом при добавлении воды:
1.2. Цинк реагирует с серой с образованием сульфидов:
Zn + S → ZnS
1.3. Цинк реагируют с фосфором. При этом образуется бинарное соединение — фосфид:
3Zn + 2P → Zn3P2
1.4. С азотом цинк непосредственно не реагирует.
1.5. Цинк непосредственно не реагирует с водородом, углеродом, кремнием и бором.
1.6. Цинк взаимодействует с кислородом с образованием оксида:
2Zn + O2 → 2ZnO
2. Цинк взаимодействует со сложными веществами:
2.1. Цинк реагирует с парами воды при температуре красного каления с образованием оксида цинка и водорода:
Zn0 + H2+O → Zn+2O + H20
2.2. Цинк взаимодействуют с минеральными кислотами (с соляной, фосфорной и разбавленной серной кислотой и др.). При этом образуются соль и водород.
Например, цинк реагирует с соляной кислотой:
Zn + 2HCl → ZnCl2 + H2↑
Демонстрация количества выделения водорода при реакции цинка с кислотой:
Цинк реагирует с разбавленной серной кислотой:
Zn + H2SO4 → ZnSO4 + H2
2.3. Цинк реагирует с концентрированной серной кислотой. В зависимости от условий возможно образование различных продуктов. При нагревании гранулированного цинка с концентрированной серной кислотой образуются оксид серы (IV), сульфат цинка и вода:
Zn + 2H2SO4(конц.) → ZnSO4 + SO2 + 2H2O
Порошковый цинк реагирует с концентрированной серной кислотой с образованием сероводорода, сульфата цинка и воды:
4Zn + 5H2SO4(конц.) → 4ZnSO4 + H2S + 4H2O
2.4. Аналогично: при нагревании гранулированного цинка с концентрированной азотной кислотой образуются оксид азота (IV), нитрат цинка и вода:
Zn + 4HNO3(конц.)→ Zn(NO4)2 + 2NO2 + 2H2O
При нагревании цинка с очень разбавленной азотной кислотой образуются нитрат аммония, нитрат цинка и вода:
4Zn + 10HNO3(оч. разб.) = 4Zn(NO3)2 + NH4NO3 + 3H2O
2.5. Цинк – амфотерный металл, он взаимодействует с щелочами. При взаимодействии алюминия с раствором щелочи образуется тетрагидроксоалюминат и водород:
Zn + 2KOH + 2H2O = K2[Zn(OH)4] + H2
Цинк реагирует с расплавом щелочи с образованием цинката и водорода:
Zn + 2NаОН(крист.) Nа2ZnО2 + Н2
В отличие от алюминия, цинк растворяется и в водном растворе аммиака:
Zn + 4NH3 + 2H2O → [Zn(NH3)4](OH)2 + H2
2.6. Цинк вытесняет менее активные металлы из оксидов и солей.
Например, цинк вытесняет медь из оксида меди (II):
Zn + CuO → Cu + ZnO
Еще пример: цинк восстанавливает медь из раствора сульфата меди (II):
CuSO4 + Zn = ZnSO4 + Cu
И свинец из раствора нитрата свинца (II):
Pb(NO3)2 + Zn = Zn(NO3)2 + Pb
Восстановительные свойства цинка также проявляются при взаимодействии его с сильными окислителями: нитратами и сульфитами в щелочной среде, перманганатами, соединениями хрома (VI):
4Zn + KNO3 + 7KOH = NН3 + 4K2ZnO2 + 2H2O
4Zn + 7NaOH + 6H2O + NaNO3 = 4Na2[Zn(OH)4] + NH3
3Zn + Na2SO3 + 8HCl = 3ZnCl2 + H2S + 2NaCl + 3H2O
Zn + NaNO3 + 2HCl = ZnCl2 + NaNO2 + H2O
Оксид цинка
Способы получения
Оксид цинка можно получить различными методами:
1. Окислением цинка кислородом:
2Zn + O2 → 2ZnO
2. Разложением гидроксида цинка при нагревании:
Zn(OН)2 → ZnO + H2O
3. Оксид цинка можно получить разложением нитрата цинка:
2Zn(NO3)2 → 2ZnO + 4NO2 + O2
Химические свойства
Оксид цинка — типичный амфотерный оксид. Взаимодействует с кислотными и основными оксидами, кислотами, щелочами.
1. При взаимодействии оксида цинка с основными оксидами образуются соли-цинкаты.
Например, оксид цинка взаимодействует с оксидом натрия:
ZnO + Na2O → Na2ZnO2
2. Оксид цинка взаимодействует с растворимыми основаниями (щелочами). При этом в расплаве образуются соли—цинкаты, а в растворе – комплексные соли. При этом оксид цинка проявляет кислотные свойства.
Например, оксид цинка взаимодействует с гидроксидом натрия в расплаве с образованием цинката натрия и воды:
ZnO + 2NaOH → Na2ZnO2 + H2O
Оксид цинка растворяется в избытке раствора щелочи с образованием тетрагидроксоцинката:
ZnO + 2NaOH + H2O = Na2[Zn(OH)4]
3. Оксид цинка не взаимодействует с водой.
ZnO + H2O ≠
4. Оксид цинка взаимодействует с кислотными оксидами. При этом образуются соли цинка. В этих реакциях оксид цинка проявляет основные свойства.
Например, оксид цинка взаимодействует с оксидом серы (VI) с образованием сульфата цинка:
ZnO + SO3 → ZnSO4
5. Оксид цинка взаимодействует с растворимыми кислотами с образованием солей.
Например, оксид цинка реагирует с соляной кислотой:
ZnO + 2HCl = ZnCl2 + H2O
6. Оксид цинка проявляет слабые окислительные свойства.
Например, оксид цинка при нагревании реагирует с водородом и угарным газом:
ZnO + С(кокс) → Zn + СО
ZnO + СО → Zn + СО2
7. Оксид цинка — твердый, нелетучий. А следовательно, он вытесняет более летучие оксиды (как правило, углекислый газ) из солей при сплавлении.
Например, из карбоната бария:
ZnO + BaCO3 → BaZnO2 + СО2
Гидроксид цинка
Способы получения
1. Гидроксид цинка можно получить пропусканием углекислого газа, сернистого газа или сероводорода через раствор тетрагидроксоцинката натрия:
Na2[Zn(OH)4] + 2СО2 = Zn(OH)2 + 2NaНCO3
Чтобы понять, как протекает эта реакция, можно использовать несложный прием: мысленно разбить исходное вещество Na2[Zn(OH)4] на составные части: NaOH и Zn(OH)2. Далее мы определяем, как реагирует углекислый газ с каждым из этих веществ, и записываем продукты их взаимодействия. Т.к. Zn(OH)2 не реагирует с СО2, то мы записываем справа Zn(OH)2 без изменения.
2. Гидроксид цинка можно получить действием недостатка щелочи на избыток соли цинка.
Например, хлорид цинка реагирует с недостатком гидроксида калия с образованием гидроксида цинка и хлорида калия:
ZnCl2 + 2KOH(недост.) = Zn(OH)2↓+ 2KCl
Химические свойства
1. Гидроксид цинка реагирует с растворимыми кислотами.
Например, гидроксид цинка взаимодействует с азотной кислотой с образованием нитрата цинка:
Zn(OН)2 + 2HNO3 → Zn(NO3)2 + 2H2O
Zn(OН)2 + 2HCl = ZnCl2 + 2H2O
Zn(OН)2 + H2SO4 → ZnSO4 + 2H2O
Zn(OН)2 + 2HBr → ZnBr2 + 2H2O
2. Гидроксид цинка взаимодействует с кислотными оксидами.
Например, гидроксид цинка взаимодействует с оксидом серы (VI) с образованием сульфата цинка:
Zn(OH)2 + SO3 → ZnSO4 + H2O
3. Гидроксид цинка взаимодействует с растворимыми основаниями (щелочами). При этом в расплаве образуются соли—цинкаты, а в растворе – комплексные соли. При этом гидроксид цинка проявляет кислотные свойства.
Например, гидроксид цинка взаимодействует с гидроксидом калия в расплаве с образованием цинката калия и воды:
2KOH + Zn(OН)2 → 2KZnO2 + 2H2O
Гидроксид цинка растворяется в избытке щелочи с образованием тетрагидроксоцинката:
Zn(OН)2 + 2NaOH = Na2[Zn(OH)4]
4. Гидроксид цинка разлагается при нагревании:
Zn(OH)2 → ZnO + H2O
Соли цинка
Нитрат и сульфат цинка
Нитрат цинка при нагревании разлагается на оксид цинка, оксид азота (IV) и кислород:
2Zn(NO3)2 → 2ZnO + 4NO2 + O2
Сульфат цинка при сильном нагревании разлагается аналогично — на оксид цинка, сернистый газ и кислород:
2ZnSO4→ 2ZnO + 2SO2 + O2
Комплексные соли цинка
Для описания свойств комплексных солей цинка — гидроксоцинкатов, удобно использоваться следующий прием: мысленно разбейте тетрагидроксоцинкат на две отдельные частицы — гидроксид цинка и гидроксид щелочного металла.
Например, тетрагидроксоцинкат натрия разбиваем на гидроксид цинка и гидроксид натрия:
Na2[Zn(OH)4] разбиваем на NaOH и Zn(OH)2
Свойства всего комплекса можно определять, как свойства этих отдельных соединений.
Таким образом, гидроксокомплексы цинка реагируют с кислотными оксидами.
Например, гидроксокомплекс разрушается под действием избытка углекислого газа. При этом с СО2 реагирует NaOH с образованием кислой соли (при избытке СО2), а амфотерный гидроксид цинка не реагирует с углекислым газом, следовательно, просто выпадает в осадок:
Na2[Zn(OH)4] + 2CO2 = Zn(OH)2 + 2NaHCO3
Аналогично тетрагидроксоцинкат калия реагирует с углекислым газом:
K2[Zn(OH)4] + 2CO2 = Zn(OH)2 + 2KHCO3
А вот под действием избытка сильной кислоты осадок не выпадает, т.к. амфотерный гидроксид цинка реагирует с сильными кислотами.
Например, с соляной кислотой:
Na2[Zn(OH)4] + 4HCl(избыток) → 2NaCl + ZnCl2 + 4H2O
Правда, под действием небольшого количества (недостатка) сильной кислоты осадок все-таки выпадет, для растворения гидроксида цинка кислоты не будет хватать:
Na2[Zn(OH)4] + 2НCl(недостаток) → Zn(OH)2↓ + 2NaCl + 2H2O
Аналогично с недостатком азотной кислоты выпадает гидроксид цинка:
Na2[Zn(OH)4] + 2HNO3(недостаток) → Zn(OH)2↓ + 2NaNO3 + 2H2O
Если выпарить воду из раствора комплексной соли и нагреть образующееся вещество, то останется обычная соль-цинкат:
Na2[Zn(OH)4] → Na2ZnO2 + 2H2O↑
K2[Zn(OH)4] → K2ZnO2 + 2H2O↑
Гидролиз солей цинка
Растворимые соли цинка и сильных кислот гидролизуются по катиону. Гидролиз протекает ступенчато и обратимо, т.е. чуть-чуть:
I ступень: Zn2+ + H2O = ZnOH+ + H+
II ступень: ZnOH+ + H2O = Zn(OH)2 + H+
Более подробно про гидролиз можно прочитать в соответствующей статье.
Цинкаты
Соли, в которых цинк образует кислотный остаток (цинкаты) — образуются из оксида цинка при сплавлении с щелочами и основными оксидами:
ZnO + Na2O → Na2ZnO2
Для понимания свойств цинкатов их также можно мысленно разбить на два отдельных вещества.
Например, цинкат натрия мы разделим мысленно на два вещества: оксид цинка и оксид натрия.
Na2ZnO2 разбиваем на Na2O и ZnO
Тогда нам станет очевидно, что цинкаты реагируют с кислотами с образованием солей цинка:
K2ZnO2 + 4HCl (избыток) → 2KCl + ZnCl2 + 2H2O
СaZnO2 + 4HCl (избыток) = CaCl2 + ZnCl2 + 2H2O
Na2ZnO2 + 4HNO3 → Zn(NO3)2 + 2NaNO3 + 2H2O
Na2ZnO2 + 2H2SO4 → ZnSO4 + Na2SO4 + 2H2O
Под действием избытка воды цинкаты переходят в комплексные соли:
K2ZnO2 + 2H2O = K2[Zn(OH)4]
Na2ZnO2 + 2H2O = Na2[Zn(OH)4]
Сульфид цинка
Сульфид цинка — так называемый «белый сульфид». В воде сульфид цинка нерастворим, зато минеральные кислоты вытесняют из сульфида цинка сероводород (например, соляная кислота):
ZnS + 2HCl → ZnCl2 + H2S
Под действием азотной кислоты сульфид цинка окисляется до сульфата:
ZnS + 8HNO3(конц.) → ZnSO4 + 8NO2 + 4H2O
(в продуктах также можно записать нитрат цинка и серную кислоту).
Концентрированная серная кислота также окисляет сульфид цинка:
ZnS + 4H2SO4(конц.) = ZnSO4 + 4SO2 + 4H2O
При окислении сульфида цинка сильными окислителями в щелочной среде образуется комплексная соль:
ZnS + 4NaOH + Br2 = Na2[Zn(OH)4] + S + 2NaBr
Упражнения типа «мысленный эксперимент» по химии цинка (тренажер задания 32 ЕГЭ по химии)
- Оксид цинка растворили в растворе хлороводородной кислоты и раствор нейтрализовали, добавляя едкий натр. Выделившееся студенистое вещество белого цвета отделили и обработали избытком раствора щелочи, при этом осадок полностью растворился. нейтрализация полученного раствора кислотой, например, азотной, приводит к повторному образованию студенистого осадка. Напишите уравнения описанных реакций.
- Цинк растворили в очень разбавленной азотной кислоте и в полученный раствор добавили избыток щелочи, получив прозрачный раствор. Напишите уравнения описанных реакций.
- Соль, полученную при взаимодействии оксида цинка с серной кислотой, прокалили при температуре 800°С. Твердый продукт реакции обработали концентрированным раствором щелочи, и через полученный раствор пропустили углекислый газ. Напишите уравнения описанных реакций.
- Нитрат цинка прокалили, продукт реакции при нагревании обработали раствором едкого натра. Через образовавшийся раствор пропустили углекислый газ до прекращения выделения осадка, после чего обработали избытком концентрированного нашатырного спирта, при этом осадок растворился. Напишите уравнения описанных реакций.
- Цинк растворили в очень разбавленной азотной кислоте, полученный раствор осторожно выпарили и остаток прокалили. Продукты реакции смешали с коксом и нагрели. Напишите уравнения описанных реакций.
- Несколько гранул цинка растворили при нагревании в растворе едкого натра. В полученный раствор небольшими порциями добавляли азотную кислоту до образования осадка. Осадок отделили, растворили в разбавленной азотной кислоте, раствор осторожно выпарили и остаток прокалили. Напишите уравнения описанных реакций.
- В концентрированную серную кислоту добавили металлический цинк. образовавшуюся соль выделили, растворили в воде и в раствор добавили нитрат бария. После отделения осадка в раствор внесли магниевую стружку, раствор профильтровали, фильтрат выпарили и прокалили. Напишите уравнения описанных реакций.
- Сульфид цинка подвергли обжигу. Полученное твердое вещество полностью прореагировало с раствором гидроксида калия. Через полученный раствор пропустили углекислый газ до выпадения осадка. Осадок растворили в соляной кислоте. Напишите уравнения описанных реакций.
- Некоторое количество сульфида цинка разделили на две части. Одну из них обработали соляной кислотой, а другую подвергли обжигу на воздухе. При взаимодействии выделившихся газов образовалось простое вещество. Это вещество нагрели с концентрированной азотной кислотой, причем выделился бурый газ. Напишите уравнения описанных реакций.
- Цинк растворили в растворе гидроксида калия. Выделившийся газ прореагировал с литием, а к полученному раствору по каплям добавили соляную кислоту до прекращения выпадения осадка. Его отфильтровали и прокалили. Напишите уравнения описанных реакций.
1) ZnO + 2HCl = ZnCl2 + H2O
ZnCl2 + 2NaOH = Zn(OH)2↓ + 2NaCl
Zn(OH)2 + 2NaOH = Na2[Zn(OH)4]
Na2[Zn(OH)4] + 2HNO3(недостаток) = Zn(OH)2↓ + 2NaNO3 + 2H2O
2) 4Zn + 10HNO3 = 4Zn(NO3)2 + NH4NO3 + 3H2O
HNO3 + NaOH = NaNO3 + H2O
NH4NO3 + NaOH = NaNO3 + NH3↑ + H2O
Zn(NO3)2 + 4NaOH = Na2[Zn(OH)4] + 2NaNO3
3) ZnO + H2SO4 = ZnSO4 + H2O
2ZnSO4 2ZnO + 2SO2 + O2
ZnO + 2NaOH + H2O = Na2[Zn(OH)4]
Na2[Zn(OH)4] + 2CO2 = Zn(OH)2↓ + 2NaHCO3
4) 2Zn(NO3)2 2ZnO + 4NO2 + O2
ZnO + 2NaOH + H2O = Na2[Zn(OH)4]
Na2[Zn(OH)4] + 2CO2 = Zn(OH)2↓ + 2NaHCO3
Zn(OH)2 + 4(NH3 · H2O) = [Zn(NH3)4](OH)2 + 4H2O
5) 4Zn + 10HNO3 = 4Zn(NO3)2 + NH4NO3 + 3H2O
2Zn(NO3)2 2ZnO + 4NO2 + O2
NH4NO3 N2O + 2H2O
ZnO + C Zn + CO
6) Zn + 2NaOH + 2H2O = Na2[Zn(OH)4] + H2↑
Na2[Zn(OH)4] + 2HNO3 = Zn(OH)2↓ + 2NaNO3 + 2H2O
Zn(OH)2 + 2HNO3 = Zn(NO3)2 + 2H2O
2Zn(NO3)2 2ZnO + 4NO2 + O2
7) 4Zn + 5H2SO4 = 4ZnSO4 + H2S↑ + 4H2O
ZnSO4 + Ba(NO3)2 = Zn(NO3)2 + BaSO4
Zn(NO3)2 + Mg = Zn + Mg(NO3)2
2Mg(NO3)2 → 2MgO + 4NO2 + O2↑
8) 2ZnS + 3O2 = 2ZnO + 2SO2↑
ZnO + 2NaOH + H2O = Na2[Zn(OH)4]
Na2[Zn(OH)4] + CO2 = Zn(OH)2 + Na2CO3 + H2O
Zn(OH)2 + 2HCl = ZnCl2 + 2H2O
9) ZnS + 2HCl = ZnCl2 + H2S↑
2ZnS + 3O2 = 2ZnO + 2SO2↑
2H2S + SO2 = 3S + 2H2O
S + 6HNO3 = H2SO4 + 6NO2 + 2H2O
10) Zn + 2KOH + 2H2O = K2[Zn(OH)4] + H2
H2 + 2Li = 2LiH
K2[Zn(OH)4] + 2HCl = 2KCl + Zn(OH)2↓
Zn(OH)2 ZnO + H2O
Точка плавления металлов
- Локации
- Внутренняя Империя
- Лос-Анджелес
- Orange County
- Сан Диего
- Феникс
- Tucson
- Обслуживание клиентов
- Связаться со службой поддержки клиентов
- Подать заявку на кредит
- Политика возврата
- Насчет нас
- История
- События
- Партнеры
- Магазин Тур
- Новости и пресса
- Условия и положения
- Предложение 65 Калифорнии
- Экспорт металла
- Качество и соответствие
- Ресурсы
- Калькуляторы металла
- Калькулятор веса металла
- Калькуляторы конверсии
- Блог
- Глоссарий
- FAQs
- Металлические вопросы
- Вопросы по IMS
- Инфографика
- Направляющая из нержавеющей стали
- Суточная доза металла
- Строительство Трофейного Грузовика
- Джесси Комбс: Настоящая сделка
- Свойства и наиболее распространенное использование алюминия
- Алюминий 6061 vs.Алюминий 6063
- Литература по продукту
- Калькуляторы металла
- Сервисы
- Запрос цены на услуги
- Вырезать по размеру
- Плазменная резка Hi-Def
- Планшетная лазерная резка
- Трубка лазера
- Гидравлическая резка
- Услуги по резке и распиловке металла
- Экспорт металла
- Индивидуальные экструзии
- Запрос цены на индивидуальные экструзии
- Карьера
точек плавления металлов — Руководство по плавлению металлов
№от CGM Findings от 3 октября 2012 г.
Для тех, кто интересуется плавкой металлов — теперь вы знаете.Разные температуры плавления для разных драгоценных металлов.
Есть над чем подумать при пайке, плавке, ковке горячего металла.
Мы не включали это. Спасибо кому-то из сети ювелирных художников, кто это сделал.
Это ценная информация, заслуживающая упоминания.
Посмотрите на разницу между алюминием и железом. Что-то думать о. Хотя у вас, возможно, даже не будет возможности поработать с ними, конечно, неплохо иметь приблизительное представление о том, с чем вы имеете дело.
Мы действительно удивлены, что латунь, серебро и золото на самом деле выше, чем мы могли подумать, глядя на цифры.
«Обратите внимание, что точки плавления варьируются от ресурса к ресурсу — эта диаграмма была составлена с использованием многочисленных источников и перекрестных подтверждений».
Температура плавления металлов
| Металл | Температура плавления Цельсия | Температура плавления по Фаренгейту |
| Алюминий | 659 | 1218 |
| Латунь (85 Cu 15 Zn) | 900-940 | 1652-1724 |
| Бронза (90 Cu 10 Sn) | 850-1000 | 1562-832 |
| Чугун | 1260 | 2300 |
| Медь | 1083 | 1981 |
| Золото (24k) | 1063 | 1946 |
| Утюг | 1530 | 2786 |
| Свинец | 327 | 621 |
| Никель | 1452 | 2646 |
| Палладий | 1555 | 2831 |
| Платина | 1770 | 3220 |
| Красная латунь | 990–1025 | 1810–1880 |
| Серебро (чистое) | 961 | 1762 |
| Серебро (серебро) | 893 | 1640 |
| Нержавеющая сталь | 1363 | 2550 |
| Сталь с высоким содержанием углерода | 1353 | 2500 |
| Средний углерод | 1427 | 2600 |
| Низкоуглеродистый | 1464 | 2700 |
| Олово | 232 | 450 |
| Титан | 1795 | 3263 |
| Желтая латунь | 905–932 | 1660–1710 |
| цинк | 419 | 786 |
Эта информация взята из: Сеть художников-ювелирных художников [посмотрите и скажите им спасибо]
также у них есть версия в формате PDF, так что вы можете скачать эту таблицу!
http: // www.jewelryartistsnetwork.com/index/metals-melting-temperatures/
Сеть художников-ювелирных художников — Что это?
«Сеть — это онлайн-сообщество художников, которые хотят делиться, учиться и расти.
Мы говорим о технике, дизайне, бизнесе и многом другом.
Здесь есть информационные статьи, учебные пособия, интервью с художниками, вдохновляющая галерея, видео, а также случайные вызовы и раздачи призов.
Цель — информировать, вдохновлять и поощрять рост ».
Цинк
Химический элемент цинк относится к переходным металлам.Это известно с давних времен. Его первооткрыватель и дата открытия неизвестны.
Зона данных
| Классификация: | Цинк — переходный металл |
| Цвет: | голубовато-серебристый |
| Атомный вес: | 65,41 |
| Состояние: | цельный |
| Температура плавления: | 419,53 o C, 692,68 K |
| Температура кипения: | 910 o C, 1183 K |
| Электронов: | 30 |
| Протонов: | 30 |
| Нейтроны в наиболее распространенном изотопе: | 34 |
| Электронные оболочки: | 2,8,18,2 |
| Электронная конфигурация: | [Ar] 3d 10 4s 2 |
| Плотность при 20 o C: | 7.14 г / см 3 |
Реакции, Соединения, Радиусы, Проводимости
| Атомный объем: | 9,2 см 3 / моль |
| Состав: | hcp: гексагональный плотно упакованный |
| Твердость: | 2,5 МОС |
| Удельная теплоемкость | 0,39 Дж г -1 K -1 |
| Теплота плавления | 7.322 кДж моль -1 |
| Теплота распыления | 131 кДж моль -1 |
| Теплота испарения | 115,30 кДж моль -1 |
| 1 st энергия ионизации | 906,4 кДж моль -1 > |
| 2 nd энергия ионизации | 1733,2 кДж моль -1 |
| 3 rd энергия ионизации | 3832.6 кДж моль -1 |
| Сродство к электрону | – |
| Минимальная степень окисления | 0 |
| Мин. общее окисление нет. | 0 |
| Максимальное число окисления | 2 |
| Макс. общее окисление нет. | 2 |
| Электроотрицательность (шкала Полинга) | 1,65 |
| Объем поляризуемости | 6.4 Å 3 |
| Реакция с воздухом | сильнодействующий, ⇒ ZnO |
| Реакция с 15 M HNO 3 | сильнодействующий, ⇒ Zn (NO 3 ) 2 , NO x |
| Реакция с 6 M HCl | мягкий, ⇒ H 2 , ZnCl 2 |
| Реакция с 6 М NaOH | мягкий, ⇒ [Zn (OH 4 )] 2- , H 2 |
| Оксид (ов) | ZnO, ZnO 2 (пероксид цинка) |
| Гидрид (ы) | ZnH 2 |
| Хлорид (ы) | ZnCl 2 |
| Атомный радиус | 135 вечера |
| Ионный радиус (1+ ион) | – |
| Ионный радиус (2+ ионов) | 88 вечера |
| Ионный радиус (3+ ионов) | – |
| Ионный радиус (1-ионный) | – |
| Ионный радиус (2-ионный) | – |
| Ионный радиус (3-ионный) | – |
| Теплопроводность | 116 Вт м -1 К -1 |
| Электропроводность | 16.9 x 10 6 S м -1 |
| Температура замерзания / плавления: | 419,53 o C, 692,68 K |
Батареи — внешняя сторона этих батарей сделана из цинка — цинк действует как электрод батареи и контейнер.
Цинк очень активно реагирует с серой. Вот пробный пуск серо-цинковой ракеты.
Реакция цинка с йодом.
Открытие цинка
Цинковые руды использовались для изготовления латуни (смеси меди и цинка) и других сплавов с древних времен.
Цинковый сплав, содержащий 87,5% цинка, был обнаружен на древнем месте в Трансильвании.
Плавка цинка началась в 12 веке в Индии с восстановления каламина (карбонат цинка, ZnCO 3 ) шерстью и другими органическими материалами.
Название элемента, как сообщается, произошло от старого немецкого слова «zinke», означающего «заостренный»; ссылка на остроконечные кристаллы, образовавшиеся после плавки.
Кредит за изоляцию металла обычно приписывается Андреасу Маргграфу в 1746 году в Берлине.Он нагрел смесь каламиновой руды и углерода в закрытом сосуде без меди, чтобы получить металл.
Внешний вид и характеристики
Вредные воздействия:
Цинк не считается особо токсичным.
Z
Цинк — Информация об элементе, свойства и применение
Расшифровка:
Химия в ее элементе: цинк
(Promo)
Вы слушаете Химию в ее стихии, представленную вам журналом Chemistry World , журналом Королевского химического общества.
(Конец промо)
Chris Smith
На этой неделе химический лосьон с каламином для зудящей кожи, шампунь против перхоти для шелушащейся кожи головы и дезодорант для подмышек — ну, я думаю, мы все стоял рядом с кем-то, кто, как нам хотелось бы, знал немного больше о химии цинка. Вот Брайан Клегг.
Брайан Клегг
Не так много элементов со звукоподражательными названиями. Скажите «кислород» или «йод», и в звучании слова нет ключа к природе элемента.Но с цинком все иначе. Цинк — цинк — цинк — вы почти можете услышать, как набор монет падает в старомодную ванну. Это просто должен быть твердый металл.
При использовании цинк часто спрятан, почти скрыт. Он предотвращает ржавление железа, успокаивает солнечные ожоги, защищает от перхоти, соединяется с медью, образуя очень знакомый сплав золотого цвета и сохраняет нам жизнь, но мы этого почти не замечаем. Этот сине-серый металл, известный как спелтер, совсем не кричащий и привлекающий внимание. Даже происхождение этого вызывающего воспоминания имени неясно.
Словарь говорит нам, что слово цинк происходит от немецкого (с буквой K в конце вместо C), но как это название возникло, неизвестно. Самое раннее упоминание о цинке относится к 1651 году. Вещество было известно и раньше — предметы с цинком в них датируются более 2500 лет назад, и римляне использовали этот сплав золотого цвета, — но цинк не был идентифицирован как отдельный материал на западе до семнадцатый век.
Цинк, представленный в периодической таблице как Zn, является переходным металлом, сгруппированным с кадмием и ртутью.Со средним атомным номером 30 он имеет пять стабильных изотопов с атомным весом от доминирующего цинка 64 до цинка 70, плюс еще 25 радиоизотопов.
Из-за туманного происхождения трудно определить одного человека как первооткрывателя элемента. Хотя кажется, что он был очищен в Индии еще в двенадцатом веке, первое конкретное заявление о том, что он произвел этот металл, было сделано еще в 1668 году, а процесс извлечения цинка из его оксида был запатентован в Великобритании в 1738 году торговцем металлами Уильямом. Чемпион.Но, как правило, немецкий химик Андреас Маргграф получает лавры как «первооткрыватель» за свой эксперимент 1746 года по выделению цинка.
Хотя история цинка более чем туманна, нет никаких сомнений в его полезности. Достаточно взглянуть на оцинкованную металлическую крышу или ведро, чтобы увидеть, как работает цинк. Гальванизация названа в честь Луиджи Гальвани, человека, который заставлял лягушачьи лапки подергиваться электрическим током, но гальванизация не имеет ничего общего с электрическим зрелищем. На самом деле роль электричества на удивление тонка.
Наиболее распространенной формой цинкования является горячее цинкование, при котором железо или сталь пропускают через ванну с жидким цинком при температуре около 460 градусов по Цельсию, что на 40 градусов выше его точки плавления. Покрытие предохраняет обрабатываемый объект от ржавчины. Первоначально цинк просто предотвращает попадание воздуха в железо, но позже цинк подвергается коррозии, а не железу, в электрохимическом процессе, действуя как так называемый жертвенный анод. Здесь и появляется «гальваническая» часть названия. Некоторая гальваника носит более буквальный характер — например, автомобильные кузова гальванизируют цинком, чтобы нанести тонкий ровный слой.
Электрические возможности цинка распространяются также на самые популярные батареи. Традиционный сухой элемент имеет внешний цинковый кожух, действующий как анод (что сбивает с толку, анод, обычно считающийся положительным, является отрицательным концом батареи), в то время как угольный стержень обеспечивает катод, положительный электрод. В щелочных батареях с более длительным сроком службы анод состоит из порошкообразного цинка (что дает большую площадь поверхности для реакции), а катод — из сложного диоксида марганца.
Но самый видимый пример цинка в действии не дает никаких указаний на этот сероватый металл — вместо этого он находится в сплаве, который смешивает блеск золота с обычным оттенком.Когда расплавленный цинк и медь смешиваются вместе, результат становится жирным, как латунь. На самом деле это латунь. Из этого гибкого сплава изготовлено все, от дверных креплений до декоративных накладок для конских ошейников. Любой оркестр был бы намного беднее без медных духовых инструментов. Он даже может застегнуть молнию на вашей одежде.
Хорошо отполированная латунь имеет приятный блеск, но самый тесный контакт с цинком, а точнее оксидом цинка, часто возникает, когда мы имеем дело с нежелательным сиянием солнечных ожогов.Когда я был молод, и солнцезащитных кремов было мало, загорелую кожу щедро покрывали успокаивающим розовым лосьоном с каламином. Основным ингредиентом этого вещества является оксид цинка, который имеет белый цвет — его цвет придают небольшие количества оксида железа. Даже сейчас, когда мы можем избежать потребности в каламине, оксид цинка играет свою роль. Оксид цинка, называемый китайским белым, когда его используют в красках, является хорошим поглотителем ультрафиолетового света, поэтому солнцезащитный крем часто содержит суспензию крошечных частиц оксида цинка — как и большинство косметических средств на минеральной основе.
И это только начало для этого универсального оксида. Вы найдете его в антипирене и пищевых продуктах, где он обогащает сухие завтраки, в стекле и керамике, в клеях и резине. Это неожиданное появление на столе для завтрака отражает еще одну важную сторону цинка. Он нужен нам, чтобы оставаться здоровыми. Это один из микроэлементов, питательных веществ, в которых наш организм нуждается в небольших количествах для нормальной работы. Он часто присутствует в витаминных добавках, хотя большинство из нас получает много из мяса и яиц.Цинк попадает в различные белки, особенно в ферменты, участвующие в развитии организма, пищеварении и плодовитости. Недостаток цинка в рационе может привести к замедленному заживлению, раздражению кожи и потере вкусовых ощущений, а также к развитию многих хронических заболеваний.
Поскольку цинк также присутствует в шампунях против перхоти в виде пиритиона цинка и в дезодорантах для подмышек в виде хлорида цинка, этот элемент даже делает нас более привлекательными для противоположного пола. Цинк — скрытая звезда.Мы редко осознаем это, в отличие от более ярких соседей в таблице периодов, но цинк — это элемент рабочей лошадки, который помогает всем нам.
Крис Смит
Научный писатель из Бристоля Брайан Клегг со звукоподражательным элементом, цинком. На следующей неделе, что таится в вашем подвале.
Кэтрин Холт
Первые сообщения о проблемах, связанных с газообразным радоном в жилых зданиях, были в Соединенных Штатах в 1984 году, когда служащий на атомной электростанции начал подавать сигналы тревоги детектора излучения по пути на работу .В конечном итоге проблема была обнаружена в его доме, где уровень газа радона в подвале оказался аномально высоким.
Крис Смит
Но откуда это взялось и каков риск для его здоровья. Кэтрин Холт будет здесь со всеми ответами и остальной частью рассказа Радона о химии в ее элементе на следующей неделе. Я действительно надеюсь, что вы присоединитесь к нам. Я Крис Смит, спасибо за внимание и до свидания.
(промо)
(конец промо)
Обработка цинка | Британника
Обработка цинка , извлечение цинка из его руд и подготовка металлического цинка или химических соединений для использования в различных продуктах.
Цинк (Zn) представляет собой металлический элемент с гексагональной плотноупакованной (ГПУ) кристаллической структурой и плотностью 7,13 грамма на кубический сантиметр. Он имеет умеренную твердость, его можно сделать пластичным и легко обрабатывать при температурах, немного превышающих температуру окружающей среды. В твердом виде он серовато-белый из-за образования оксидной пленки на его поверхности, но в свежем виде или после резки он имеет яркий серебристый вид. Его наиболее важное применение в качестве защитного покрытия для железа, известное как гальваника, связано с двумя его выдающимися характеристиками: оно обладает высокой устойчивостью к коррозии и при контакте с железом обеспечивает защиту от коррозии вместо железа.
Нелегированный цинк с низкой температурой плавления 420 ° C (788 ° F) имеет плохие технические характеристики, но в легированной форме металл широко используется. Добавление до 45 процентов цинка в медь образует ряд латунных сплавов, в то время как с добавками алюминия цинк образует коммерчески значимые сплавы для литья под давлением и литья под давлением. В виде листа цинк используется для изготовления банок для сухих аккумуляторных батарей, а из легированного небольшими количествами меди и титана формируется лист повышенной прочности, который применяется в кровле и облицовке многих зданий.
Химические соединения цинка, в частности оксид цинка, имеют важное промышленное и фармацевтическое применение.
Получите эксклюзивный доступ к контенту из нашего первого издания 1768 с вашей подпиской. Подпишитесь сегодняИстория
Отделение металлического цинка от его руд пирометаллургическим способом намного сложнее, чем с другими обычными металлами, такими как медь, свинец и железо, потому что восстановление оксида цинка углеродом (C) происходит самопроизвольно только выше температуры кипения цинка 907 ° С (1665 ° F).Эффективные методы конденсации пара в жидкий металл не были обнаружены до 14 века. Однако в качестве компонента сплава цинк использовался задолго до этого. Латунь, сплав меди и цинка, была произведена римлянами еще в 200 г. до н. Э. Путем нагревания меди, оксида цинка (ZnO) и углерода вместе. Цинк, образовавшийся при восстановлении его оксида, абсорбировался медью и не выделялся в виде отдельной фазы.
Данные свидетельствуют о том, что цинк сначала производили в больших количествах в Индии и Китае.В Заваре в Раджастане, Индия, были найдены остатки плавильного производства XIV века. Хотя письменных свидетельств не существует, процесс, похоже, включал большое количество небольших глиняных реторт, в которые загружали оксид цинка и древесный уголь, помещали в установку и нагревали. О точном методе конденсации и сбора цинка можно только догадываться.
Все последующие коммерческие процессы производства цинка включали ретортные процессы, при этом основная общая реакция инициировалась внешним нагревом и включала восстановление ZnO до паров цинка углеродом, который сам окислялся до монооксида углерода (CO).Важные успехи были сделаны Уильямом Чемпионом в Бристоле, Англия, в середине 18 века, Иоганном Рубергом в Силезии в конце 18 века и Жан-Жаком-Даниэлем Дони в Льеже, Бельгия, в начале 19 века. Горизонтальные реторты бельгийского типа использовались в Великобритании в качестве основного процесса производства цинка около 100 лет, начиная с середины XIX века. Ежедневная производительность каждой реторты составляла около 40 килограммов (90 фунтов), и несколько сотен реторт были собраны вместе и запитаны газом.Этот процесс был чрезвычайно трудным с физической точки зрения и имел все недостатки, связанные с мелкомасштабной периодической работой с высокими затратами энергии и труда.
В конце 1920-х годов в США был разработан процесс непрерывной вертикальной реторты. Реторта была построена из кирпича из карбида кремния, обеспечивающего высокую теплопроводность, с прямоугольным поперечным сечением два метра (шесть футов) на одну треть метра и высотой 11 метров. Шихта обожженного сульфидного концентрата и антрацитового угля была отсортирована, брикетирована и предварительно нагрета в коксовой печи перед загрузкой в нагретую реторту.Пары цинка, удаленные с помощью CO в верхней части реторты, конденсировали в ванне с перемешиваемым расплавом цинка. Производительность каждой реторты составляла около восьми тонн в день, а типичный завод работал около 20 реторт.
Примерно в то же время в США был разработан вариант вертикальной реторты, известный как электротермическая печь. В этом процессе тепло подводилось за счет прямого электрического сопротивления кокса в шихте.
Наиболее серьезным недостатком усовершенствованных процессов реторты было то, что они ограничивались рудными концентратами с низким содержанием железа, поскольку высокое содержание железа в сырье приводило к образованию пластин железа в ретортах.По этой причине производство цинка таким способом сейчас устарело.
Ранние попытки разработать доменный процесс для производства цинка потерпели неудачу из-за сложности конденсации паров цинка из газа, содержащего значительные количества диоксида углерода. Эта трудность была окончательно преодолена в середине 20-го века с разработкой конденсатора брызг свинца, средства ударного охлаждения печных газов и поглощения паров цинка в раствор в расплавленном свинце. Это позволило цинковой доменной печи стать основным пирометаллургическим способом производства цинка.
Цинковую доменную печь на самом деле следует называть цинк-свинцовой доменной печью, поскольку, начиная с первой успешной рециркуляции свинцовых шлаков из конденсатора, доменная печь превратилась в переработку смешанных цинк-свинцовых исходных материалов вплоть до соотношение цинка к свинцу 2: 1.
Основной процесс восстановления цинка, электролиз, неуклонно развивался после того, как промышленная эксплуатация началась примерно в 1915–18 годах. До этого были предприняты многочисленные, но безуспешные попытки, следуя запатентованному методу сульфатного электролиза французом Леоном Летранжем в 1881 году.Открытие того, что требуется сульфатный электролит высокой чистоты, привело в конечном итоге к успеху процесса.
Использование цинка | Предложение, спрос, производство, ресурсы
На главную »Металлы» Применение цинка
Металл, который играет ключевую роль в предотвращении коррозии
Переиздано из Информационного бюллетеня Геологической службы США 2011-3016, S.J. Кропшот и Джефф Л. Добрих,
Цинк: Рафинированный металлический цинк имеет голубовато-белый цвет в свежем виде; он твердый и хрупкий при большинстве температур и имеет относительно низкие температуры плавления и кипения.Правообладатель иллюстрации iStockphoto / Svengine.
Историческое использование цинка
За века до того, как цинк был идентифицирован как элемент, цинк использовался для производства латуни (сплава цинка). и медь) и в лечебных целях. Металлический цинк и оксид цинка когда-то производились в Индии. между 11 и 14 веками и в Китае в 17 веке, хотя открытие чистого Металлический цинк приписывают немецкому химику Андреасу Маргграфу, который выделил этот элемент в 1746 году.
Сфалерит: первичная руда
Сфалерит (сульфид цинка) является основным рудным минералом, из которого производится большая часть цинка в мире. производятся, но ряд других минералов, не содержащих сульфидов, содержат цинк в качестве основного компонента. Большая часть раннего производства цинка была из несульфидных месторождений; однако, поскольку эти ресурсы были истощились, добыча переместилась на сульфидные месторождения. За последние 30 лет достижения в добывающей металлургии привели к возобновлению интереса к месторождениям несульфидного цинка.
Цинковое цинкование: Около половины производимого цинка используется в цинковании, которое представляет собой процесс добавления тонких слоев цинка в железо или сталь для предотвращения ржавления. На этом фото показана поверхность металлического листа с гальваническим цинковым покрытием. Разные цветовые домены на листе вызваны кристаллами цинка в разной кристаллографической ориентации, отражающими разное количество света. Правообладатель иллюстрации iStockphoto / Стивен Суит.
Металлический очищенный цинк
Рафинированный металлический цинк после литья приобретает голубовато-белый цвет; он твердый и хрупкий при большинстве температур и имеет относительно низкие температуры плавления и кипения.Цинк легко сплавляется с другими металлами и химически активный. При контакте с воздухом образуется тонкая серая оксидная пленка (патина), препятствующая более глубокому окислению. (коррозия) металла. Устойчивость металла к коррозии — важная характеристика при его использовании.
Цинковые сплавы: На втором месте цинк используется в качестве сплава; цинк соединяется с медью (с образованием латуни) и с другими металлами с образованием материалов, которые используются в автомобилях, электрических компонентах и бытовой технике.Светильник из латуни изображение авторских прав iStockphoto / Вова Калина.
Использование цинка сегодня
Цинк в настоящее время является четвертым по потреблению металлом в мире после железа, алюминия и меди. Обладает сильными антикоррозионными свойствами и хорошо сцепляется с другими металлами. Следовательно, около половины Полученный цинк используется в цинковании, которое представляет собой процесс добавления тонких слоев цинка к железу или сталь для предотвращения ржавчины.
Следующее лидирующее применение цинка — это сплав; цинк соединяется с медью (для образования латуни) и с другими металлами для образования материалов которые используются в автомобилях, электрических компонентах и бытовой технике.Третье важное применение цинка в производстве оксида цинка (наиболее важного цинкового химического вещества по объему производства), который используется в производство резины и как защитная мазь для кожи.
Цинк также важен для здоровья. Это необходимый элемент для правильного роста и развития люди, животные и растения. В организме взрослого человека содержится от 2 до 3 граммов цинка, который является количество, необходимое для нормального функционирования ферментов и иммунной системы организма.Также важно для вкуса, запах, и для заживления ран. Незначительное количество цинка содержится во многих продуктах, таких как устрицы, говядина и арахис.
Оксид цинка: Третье важное применение цинка — это производство оксида цинка (наиболее важного химического вещества цинка по объему производства), который используется в производстве резины и в качестве защитной мази для кожи. Право на изображения оксида цинка принадлежит iStockphoto / Demiren.
Откуда цинк?
Исследования для лучшего понимания геологических процессов, образующих месторождения полезных ископаемых, в том числе цинка, является важным компонентом программы минеральных ресурсов Геологической службы США.Цинк обычно встречается в месторождениях полезных ископаемых вместе с другими цветными металлами, такими как медь и свинец. Цинковые месторождения широко распространены. классифицируются на основании того, как они сформированы. Цинк добывается в основном из трех типов месторождений: осадочный эксгаляционный (Sedex), тип долины Миссисипи (MVT) и вулканогенный массивный сульфид (VMS).
Карта производства цинка: Крупнейшие мировые производители цинка в процентах от мирового предложения, произведенного в 2010 году. Изображение основано на данных, приведенных в Обзоре минерального сырья Геологической службы США, январь 2011 года.
Осадочные отложения при выдыхании
Депозиты Sedex составляют более 50 процентов мировых запасов цинка и формируются когда богатые металлами гидротермальные жидкости попадают в заполненный водой бассейн (обычно океан), в результате чего в осадках рудоносного материала в донных отложениях бассейна. Самый большой в мире цинковый рудник, Рудник Red Dog на Аляске разрабатывается на месторождении Седекс.
Типовые месторождения долины Миссисипи
депозитов MVT обнаружены по всему миру и получили свое название от депозитов, которые происходят в Долина Миссисипи в США.Месторождения характеризуются рудно-минеральным замещением карбонатная вмещающая порода; они часто приурочены к одному стратиграфическому слою и простираются на сотни квадратных километров. Месторождения MVT были основным источником цинка в Соединенных Штатах из 19 век до середины 20 века.
Вулканогенные массивные сульфидные месторождения
В отличие от депозитов Sedex и MVT, депозиты VMS имеют четкую связь с подводными вулканические процессы.Они также могут содержать значительное количество меди, золота и серебра в дополнение к цинк и свинец. Морские жерла «черного курильщика», обнаруженные во время глубоководных экспедиций, являются примерами В настоящее время на морском дне формируются отложения ЗМС.
Производство цинка и запасы | |||
| Страна | Производство | Запасы | |
| США | 720 | 12,000 | |
| Боливия | 430 | 6000 | |
| Канада | 670 | 6000 | |
| Китай | 3,500 | 42000 | |
| 2,000 | |||
| Казахстан | 480 | 16,000 | |
| Мексика | 550 | 15,000 | |
| Перу | 1,520 | 23,000 9095 9095 Страны 1,580 | 62,000 |
| Итого (округлено) | 12,000 | 250,000 | |
| Данные в тысячах метрических тонн.Данные USGS Mineral Commodity Summary, январь 2011 г. | |||
Мировое предложение и спрос на цинк
В 2009 году цинк добывался в шести различных штатах; однако Соединенные Штаты импортировали 76 процентов очищенного цинка, используемого внутри страны, в основном из Канады, Мексики, Казахстана и Республики Корея в порядке убывания. Согласно статистическим данным International Lead and Zinc Study Group, мировое потребление цинка в 2008 году оставалось стабильным, поскольку рост потребления в странах с формирующимися рынками (таких как Китай, Бразилия и Индия) компенсировал снижение потребления в Европе и США.
Хотя многие элементы могут использоваться вместо цинка в химической, электронной и пигментной промышленности, спрос на цинкованные изделия остается высоким, особенно в регионах, где разрабатываются важные инфраструктурные проекты. Резкое увеличение мирового производство (предложение) и потребление (спрос) цинка за последние 35 лет отражает спрос в секторах транспорта и связи на такие вещи, как автомобильные кузова, дорожные ограждения и конструкции из оцинкованного железа.
Обеспечение достаточных запасов цинка на будущее
Чтобы помочь предсказать, где могут быть расположены будущие поставки цинка, ученые Геологической службы США изучить, как и где выявленные ресурсы цинка сосредоточены в земной коре и использовать эти знания для оценки вероятности того, что неизведанные ресурсы цинка существовать. Были разработаны методы оценки потенциала минеральных ресурсов и доработан Геологической службой США для поддержки управления федеральными землями и улучшения оценить доступность минеральных ресурсов в глобальном контексте.
В 1990-х Геологическая служба США провела оценку запасов цинка в США. и пришел к выводу, что осталось найти в два раза больше цинка, чем уже было обнаружил. В частности, Геологическая служба США обнаружила, что менее 100 миллионов метрических тонн цинк был обнаружен в Соединенных Штатах, и, по оценкам, около 210 миллионов метрические тонны цинка остались неоткрытыми.
Оценка минеральных ресурсов носит динамический характер. Потому что они предоставляют снимок в определенное время и на определенном уровне знаний, оценки должны обновляться как становятся доступными более качественные данные и разрабатываются новые концепции.Например, во время геологические изыскания в конце 1960-х годов, отметили геологи Геологической службы США. наличие широко распространенного окрашивания оксидами железа в дренаже западных Брукс Рэйндж, Аляска.
Свинцово-цинковое месторождение Red Dog
Последующие исследования привели к открытию красной собаки свинцово-цинковое месторождение. В конце 1990 г., после 10 лет разведки и разработки шахта Red Dog на Аляске была запущена в эксплуатацию и с тех пор внесла свой вклад значительно повлияет на мировые поставки цинка.Последующие исследования местности привели к лучшему пониманию комплексных факторов, которые контролировали формирование Red Dog и других отложений и обеспечивают основу для оценка аналогичных месторождений в аналогичных геологических средах в других местах.

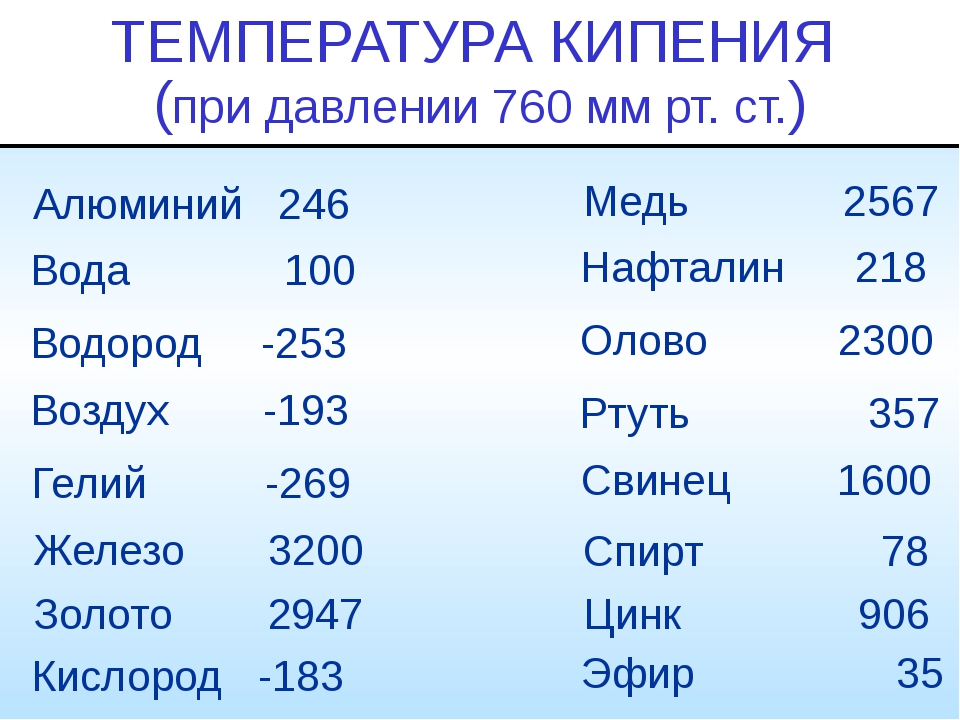
 В ее процессе выделяется водород.
В ее процессе выделяется водород.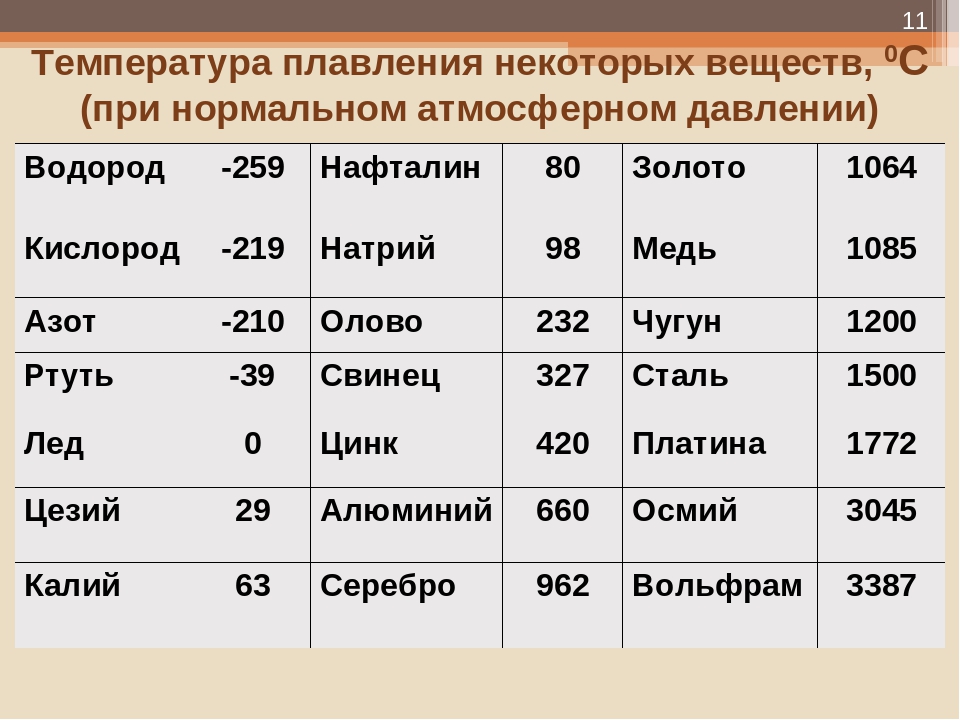

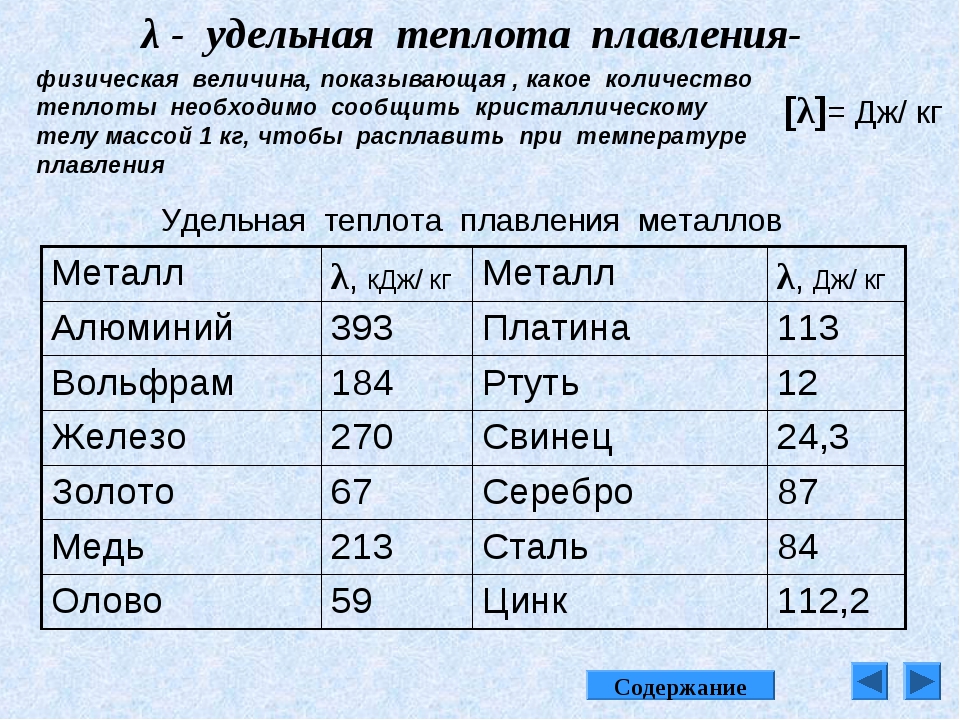


 С изменением технологий отпадает необходимость их изготовления.
С изменением технологий отпадает необходимость их изготовления.