Железо | справочник Пестициды.ru
Если попросить любого человека назвать ценный, редкий и дорогой металл, он наверняка вспомнит о золоте, и будет совершенно прав. Тем не менее, благородное золото не всегда находилось на своем заслуженном месте. Например, когда люди только научились получать алюминий, предметы из него могли себе позволить лишь очень состоятельные слои населения, а дефицитные алюминиевые столовые приборы подавались на званых ужинах только самым дорогим и уважаемым гостям. Остальные, бросая на них завистливые взгляды, были «вынуждены» орудовать золотыми вилками и ложками, которые тогда представлялись не настолько прекрасными, как блестящие, легкие, гнущиеся изделия из божественного алюминия.
Есть и другие примеры подобной исторической несправедливости. Так, во времена Гомера самой распространенной крупной валютой были рабы, бычьи шкуры и железо. Даже будучи неочищенным, плохо кующимся и не качественным по всем другим показателям, железо ценилось аж в десять раз выше, чем золото, ведь тогда оно было самым прочным из всех известных материалов, и, к тому же, добывалось с большим трудом.
Прошли столетия. Сыродутный способ получения металла оказался забыт, ему на смену пришло использование современных доменных печей. Качество получаемого железа в разы улучшилось, люди познакомились со сталью, однако, наряду с повышением прочности и ковкости, стоимость железа все больше падала, так, что сейчас его уже нельзя назвать дорогим. Тем не менее, если говорить о ценности этого металла, то кое-где он по-прежнему остался необходимым, незаменимым и востребованным. Все золото мира не заменит того небольшого количества железа, которое содержится в каждом организме и поддерживает его жизнь…
Железная руда
Использовано изображение:[10]
Физические и химические свойства
Железо (Ferrum) Fe – химический элемент побочной подгруппы VIII группы периодической системы Менделеева. Атомный номер – 26. Атомная масса – 55,85. Строение атома железа типично для переходных элементов. Это определяет переменную валентность и ярко выраженную способность к комплексообразованию у данного металла.
Атомный номер – 26. Атомная масса – 55,85. Строение атома железа типично для переходных элементов. Это определяет переменную валентность и ярко выраженную способность к комплексообразованию у данного металла.
Для железа характерны двухвалентные и трехвалентные соединения. Известны также соли железистой кислоты, где железо шестивалентно.
Железо – пластичный металл серебристого цвета, хорошо поддается ковке, прокатке и прочим видам механической обработки.
- Плотность – 7,87 г/см3,
- Температура плавления – 1539°С,
- Температура кипения – 2870°С.
Твердое железо растворяет в себе многие элементы, в частности, углерод. На влажном воздухе железо ржавеет, то есть покрывается налетом гидратированного оксида железа бурого цвета. Данный оксид рыхлый и от дальнейшей коррозии железо не защищает. В воде данный металл интенсивно корродирует. При обильном доступе кислорода формируются гидратные формы оксида трехвалентного железа.
Металл легко растворяется в соляной кислоте любой концентрации, в разбавленной серной кислоте, в азотной кислоте. К концентрированным серной и азотной кислотам железо пассивно.[3]
Содержание в природе
Железо – самый распространенный после алюминия металл на земле. Его масса составляет 4 % от массы земной коры. В природе оно встречается в виде самых разнообразных соединений: сульфидов, оксидов, силикатов. В свободном состоянии железо можно встретить только в метеоритах.
Важнейшие руды железа – магнитный железняк, красный железняк, бурый железняк, шпатовый железняк. В больших количествах встречается железный колчедан.[3]
Железо концентрируется преимущественно в основных сериях магматических пород. Глобальная распространенность железа составляет 45 %.
Геохимия соединений Fe в окружающей среде имеет сложный характер, определяется способностью элемента легко менять валентность в зависимости от физико-химических условий среды и тесно связана с циклами углерода, кислорода и серы.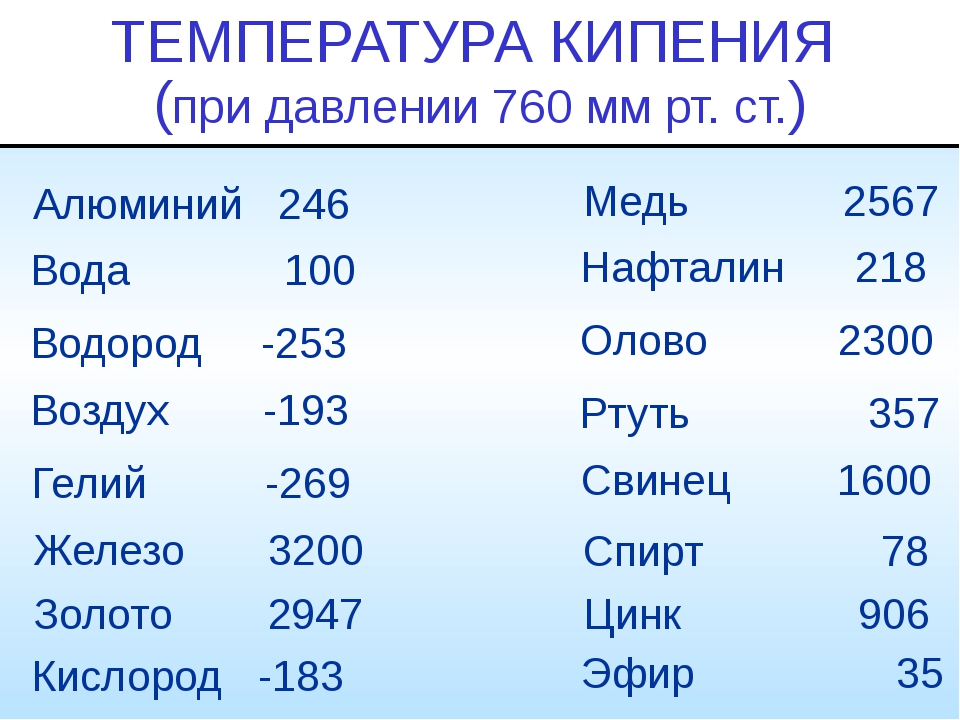
Обычно окислительные и щелочные условия среды способствуют осаждению железа, а восстановительные и кислые растворяют его соединения. Свободное железо быстро фиксируется в виде гидроксидов и оксидов, замещает магний и алюминий и образует комплексы с химическими лигандами.[4]
В почвах железо присутствует в основном в виде оксидов и гидроксидов и находится либо в виде небольших частиц, либо связано с поверхностью минералов. В богатых органикой горизонтах железо присутствует в форме хелатов.
К почвообразующим минералам железа относят:
- Гематит. Встречается в почвах аридных, семиаридных и тропических районов. Наследуется от материнских пород.
- Маггемит. Образуется в сильно выветрелых почвах тропических зон и чаще всего присутствует в скоплениях гематита, магнетита, гетита.
- Магнетит. Унаследован от материнских пород. Тесно связан с маггемитом.
- Ферригидрит.
 Широко распространен, но очень нестабилен, легко переходит в гематит в районах с умеренными гумидами.
Широко распространен, но очень нестабилен, легко переходит в гематит в районах с умеренными гумидами. - Гетит. Распространенный в почвах всех климатических зон минерал железа.
- Лепидокрокит. Типичен для плохо дренируемых почв (рисовых полей) и почв умеренных гумидных районов. Образование данного минерала осуществляется при низких значениях pH, низкой температуре и в отсутствии трехвалентного железа.
- Ильменит. В почвах обычно не встречается. К выветриванию устойчив. Унаследован от материнских пород.
- Пирит, сульфид железа и ярозит. Серосодержащие минералы. Широко распространены в затопляемых почвах с содержанием серы, например, в кислых сульфатных.
И минералы, и органические соединения железа легко преобразуются в почвах. При этом органическое вещество оказывает большое влияние на образование оксидов железа.
Соединения железа с органикой почвы является важным резервом доступных соединений данного металла для растений.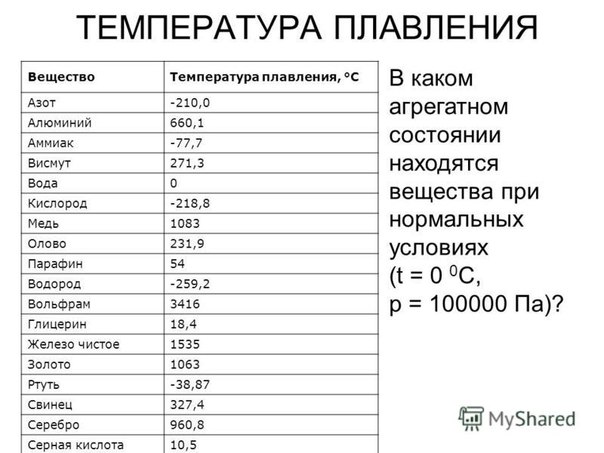
Взаимодействие железа с гуминовыми веществами сопровождается образованием водорастворимых и малорастворимых в воде соединений. На растворимость комплексов влияют многие факторы, в частности, химическая природа, соотношение компонентов, а также реакция среды. Как правило, гуминовые кислоты характеризуются большей склонностью к образованию нерастворимых соединений с металлами, чем фульвокислоты. В этой связи фульватные комплексы железа рассматривают как важный фактор, определяющий и миграцию этого металла по почвенному профилю, и его доступность растениям.
Преобразование железа осуществляется и микроорганизмами. Некоторые виды бактерий вовлечены в круговорот данного элемента и аккумулируют его на поверхности живых клеток.[4]
Содержание железа в различных типах почв Украины, согласно данным:[2] | |
Почва | Железо, % |
Чернозем на мергеле (Крым) | 0,8-1,9 |
Южный чернозем | 1,5 -2,1 |
Перегнойно-карбонатная | 2,5 |
Среднеподзолистая | 0,2 |
Содержание железа в различных типах почв
Содержание железа в почвах СНГ составляет около 3,11 % и зависит от типа почвообразующей породы.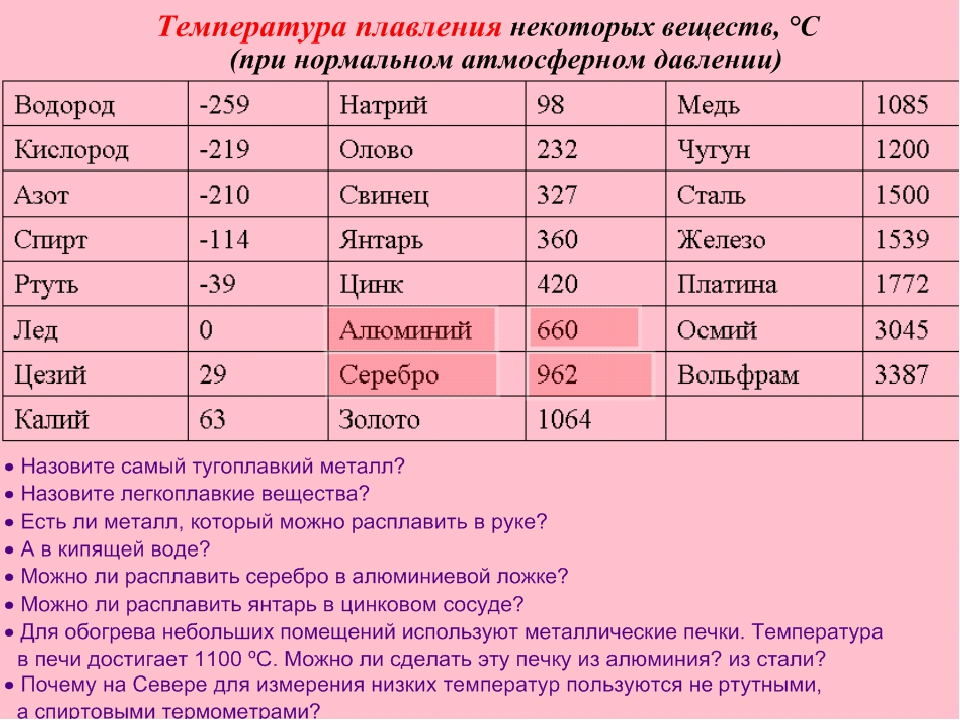 Установлено, что колебания в содержании железа в пахотном горизонте различных почв достигают значительных величин.
Установлено, что колебания в содержании железа в пахотном горизонте различных почв достигают значительных величин.
 Устраняется это известкованием почв.[5]
Устраняется это известкованием почв.[5]Признаки дефицита железа, согласно данным:[6] | |
Культура | Симптомы недостатка |
Картофель | Верхушки и края молодых листьев зеленые, середина – белесая |
Томаты | Растения угнетены; Хлороз проявляется на молодых листьях, но даже мелкие жилки сохраняют зеленый цвет; Усиление – мелкие жилки утрачивают зеленый цвет, пластинка становится желто-белой |
Огурцы | Хлороз – на молодых листьях основного и бокового побегов; Зеленые только основные и боковые жилки; Пластинка листа – от светло-зеленой до желто-белой; В дальнейшем на листьях появляются некротические пятна, а хлороз распространяется на старые листья |
Малина |
Молодые листья на верхушечных побегах – желтоватые, около краев появляются коричневые пятна отмершей ткани. |
Черная смородина | Хлороз на молодых листьях верхушечных побегов. |
Яблоня | Молодые листья на побегах – хлоротичные, почти белые с коричневыми пятнышками на краях; Хлороз на листьях уменьшается сверху вниз; При длительном дефиците отдельные ветви отмирают; Плоды палево-землистого цвета |
Роль в растении
Биохимические функции
Железо играет активную роль в окислительно-восстановительных реакциях хлоропластов, митохондрий и пероксисомы, а также выполняет многие другие функции в растениях.
Участие железа в окислительно-восстановительных реакциях определяется легкой переменой валентности и высокой способностью к комплексообразованию.
Важная роль железа в биохимии растений подтверждается следующими факторами:
- Железо обнаруживается в геме и негемовых белках и концентрируется в хлоропластах.

- Органические комплексы железа участвуют в переносе электронов в процессе фотосинтеза.
- Негемовые железосодержащие белки участвуют в восстановлении нитритов и сульфатов.
- Процесс образования хлорофилла осуществляется с участием железа.
- Железо вовлекается в метаболизм нуклеиновой кислоты.
- Известна каталитическая и структурная роль двухвалентного и трехвалентного железа.[4]
Формы и соединения железа в тканях и органеллах клеток растений
В растение железо поступает в двухвалентной форме. В дальнейшем восстановленная форма железа проходит через реакции реокисления, и в тканях уже содержится и Fe (II), и Fe (III), в большей части в комплексах с различными органическими соединениями.
железо запасается в виде фитоферритина, который состоит из соединений трехвалентного железа и белковой оболочки. Фитоферритин чаще всего находится в кристаллической форме. Его содержание велико в листьях, выращенных в темноте, но в процессе зеленения на свету фитоферритин быстро исчезает.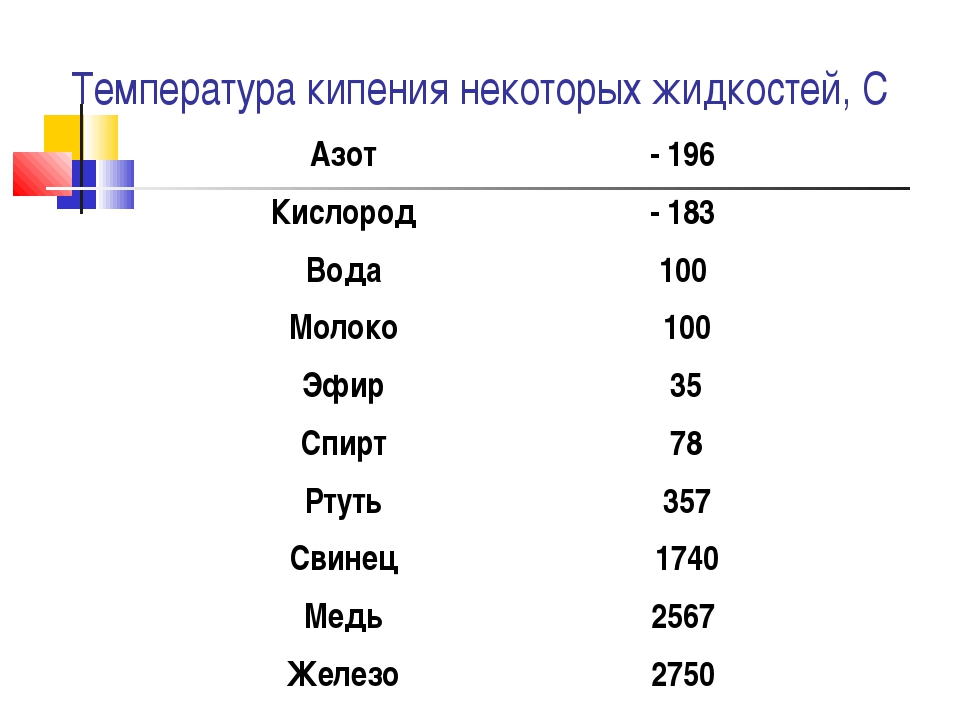 Он локализуется также в ксилеме и флоэме, кроме того, встречается в клубеньках бобовых и в семенах.
значительная часть железа находится в физиологически неактивной форме и сосредоточена в виде малорастворимых соединений.
Он локализуется также в ксилеме и флоэме, кроме того, встречается в клубеньках бобовых и в семенах.
значительная часть железа находится в физиологически неактивной форме и сосредоточена в виде малорастворимых соединений.Большая часть железа в растениях находится в трехвалентном состоянии, тогда как физиологически важной является фракция Fe (II)/Fe (III), поскольку именно эта фракция подвержена обратимым окислительно-восстановительным превращениям.
– основная форма транспорта железа из корней в побеги растений, который осуществляется по ксилеме. Подвижность данного элемента во флоэме средняя. Она ниже, чем у калия, азота, фосфора и серы, но выше, чем у кальция и марганца. железо встречается как в гемовой, так и в негемовой форме.Гем – это железопорфириновый комплекс. Атом железа в нем координируется четырьмя атомами азота пиррольных колец протопорфирина. Последний придает стабильность белковой глобуле гемсодержащих ферментов.
Как простетическая группа, гемовое железо включено в состав многих белковых соединений. Это цитохромы, нитратредуктаза, нитритредуктаза, пероксидаза и каталаза, леггемоглобин, ферредоксин, нитрогеназа, супероксиддисмутаза, аконитаза, липоксигеназы и многие другие.[1]
Это цитохромы, нитратредуктаза, нитритредуктаза, пероксидаза и каталаза, леггемоглобин, ферредоксин, нитрогеназа, супероксиддисмутаза, аконитаза, липоксигеназы и многие другие.[1]
Недостаток железа
Недостаток железа – хлороз листьев фасоли
Использовано изображение:[9]
Недостаток (дефицит) железа в растениях
Дефицит железа – проблема для многих сельскохозяйственных культур. Причина недостатка данного элемента в растениях – низкое содержание доступных форм железа в окультуренных почвах. Недостаточность железа оказывает отрицательное влияние на многие физиологические процессы в тканях растений и приводит к ослаблению роста их и развития и, как следствие, снижению урожайности.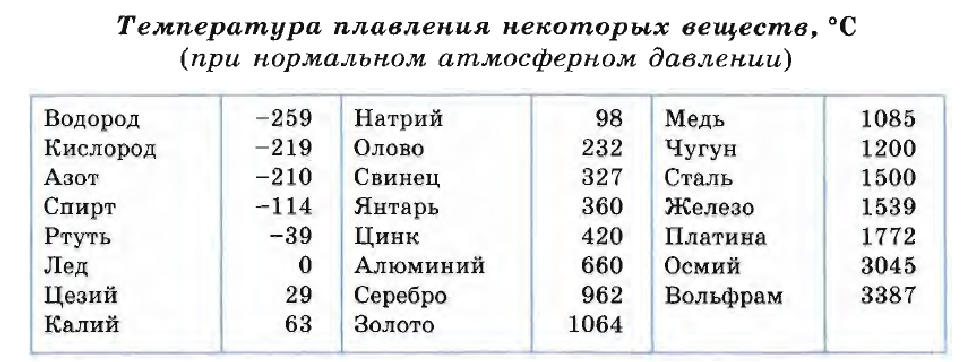 [4]
[4]
Дефицит железа широко представлен в регионах распространения карбонатных почв (30 % поверхности земли). Недостаток подвижных форм железа в данном типе почв приводит к возникновению опасного заболевания – железистого (карбонатного, известкового) хлороза. Это заболевание при развитии может привести к гибели растения.
Дефицит железа проявляется также при высоком содержании в почве марганца, цинка, меди.
На рост листьев дефицит железа влияет в меньшей степени. Деление клеток и замедление роста проявляются только при острой недостаточности железа. Наиболее значительные изменения проходят в пластидном аппарате листьев. Пластиды уменьшаются в размерах, система тилакоидов редуцирована. Синтез белка в хлоропластах и цитоплазме подавляется, причем, в первых – сильнее.
Недостаток железа сказывается на снижении содержания в листьях хлорофилла и подавлении активности фотосистем. Изменения фотосинтеза отражаются на углеводном обмене растений, в частности, наблюдается снижение содержания сахаров и крахмала в листьях. [1]
[1]
Симптоматика железистой недостаточности проявляется в растениях при различных уровнях содержания железа в тканях растения. Характер симптомов различен в зависимости от почвенных, растительных, питательных и климатических факторов. Наиболее типичный симптом – межжилковый хлороз молодых листьев. К недостатку железа очень чувствительны некоторые фруктовые деревья, овес и рис.[4]
Визуально симптомы недостатка железа проявляются следующим образом: становится заметна белесая, бледно-зеленая или желтая окраска тканей листа между жилками.
При усиливающемся дефиците железа жилки листьев бледнеют, а ткани отмирают.
Первые признаки проявляются на молодой листве, поскольку по причине слабой реутилизации железа старые листья дольше остаются зелеными.
У травянистых растений верхние молодые листья приобретают желтый цвет, формируются мелкие, слабые соцветия. У плодовых деревьев отмечается усыхание кончиков ветвей и побегов.[1]
Избыток железаИзбыток железа
Избыток железа – рисовое поле после уборки урожая.
Использовано изображение:[8]
Избыток железа
На почве, обогащенной растворимыми формами железа, может наблюдаться токсическое воздействие данного элемента на растения. Обычно это происходит на сильнокислых почвах, кислых сульфатных и пойменных почвах. Токсичность железа часто бывает связана с засоленностью почв и низким содержанием в них фосфора и оснований.
Установлено, что:
- растения, хорошо обеспеченные питательными веществами, выдерживают воздействие очень высоких концентраций железа;
- корни риса обладают способностью окислять железо и откладывать его на своей поверхности;
- повреждение корней сводит к минимуму их окислительную способность, что увеличивает токсичность железа.[4]
В целом избыток закисных соединений железа отрицательно влияет на рост растений. Характерными признаками токсического воздействия железа на растения являются отсутствие некротической ткани, развитие хлороза между жилками молодых листьев, при котором жилки остаются зелеными; позднее весь лист становится беловатым или желтым (сходно с признаками дефицита железа). [6]
[6]
Содержание железа в удобрениях, %, согласно данным:[1] | |
Удобрение | Содержание железа, % |
Комплексные органические соединения железа | 10 — 17 |
Пиритные огарки | 46 — 47 |
Железный купорос | 0,05 |
Хлорное железо Лимоннокислое железо | Слабый раствор |
Содержание железа в различных соединениях
Широко распространено использование комплексонов железа и некоторых из отходов промышленности, содержащих данный элемент.
Для устранения и предотвращения симптомов недостаточности железа используются также железный купорос, хлорное и лимоннокислое железо. [5]
[5]
Удобрения, содержащие Железо
Показать все удобрения »
Способы применения
применяют для внесения в почву и опрыскивания растений 0,1%-ным раствором.[5]применяются путем внесения в почву. Медленно действующее удобрение. Эффект достигается при непосредственном контакте корней растений с очагом внесения пиритных огарков.[1] применяют в виде опрыскиваний растений слабым раствором.[5] – опрыскивание растений слабыми растворами.[5]Эффект от применения железосодержащих удобрений
Своевременное применение железосодержащих удобрений устраняет симптомы известкового хлороза и положительно влияет на урожайность сельскохозяйственных культур.[5]
Статья составлена с использованием следующих материалов:
Литературные источники:
1.
Битюцкий Н.П. Микроэлементы и растение. Учебное пособие. – СПб.: Издательство Санкт-петербургского университета, 1999. – 232 с.
2.Власюк П.А. Биологические элементы в жизнедеятельности растений. Издательство «Наукова Думка», Киев, 1969
3.Глинка Н.Л. Общая химия. Учебник для ВУЗов. Изд: Л: Химия, 1985 г, с 731
4.Кабата-Пендиас А., Пендиас Х. Микроэлементы в почвах и растениях: Перевод с англиского.– М.: Мир, 1989.– 439 с., ил.
5.Минеев В.Г. Агрохимия: Учебник.– 2-е издание, переработанное и дополненное.– М.: Издательство МГУ, Издательство «КолосС», 2004.– 720 с., [16] л. ил.: ил. – (Классический университетский учебник).
6.Петров Б.А., Селиверстов Н.Ф. Минеральное питание растений. Справочное пособие для студентов и огородников. Екатеринбург, 1998. 79 с.
7.Энциклопедия для детей. Том 17. Химия. / Глав. ред. В.А. Володин. – М.: Аванта +, 2000. – 640 с., ил.
Изображения (переработаны):
8.9.Iron deficiency, by Howard F. Schwartz, Colorado State University, Bugwood. org, по лицензии CC BY
org, по лицензии CC BY
металлов высокой температурой плавления
Таблица температур плавления различных металлов, и при …
May 16, 2017 Увеличивается давление — увеличится величина плавления. Уменьшается давление — уменьшается величина плавления. Таблица легкоплавких металлов
MoreТемпература плавления металлов
Температура плавления металлов – показатель температуры нагреваемого металла, при достижении которой начинается процесс фазового перехода (плавления). Сам процесс обратный кристаллизации и неразрывно связан с ней.
MoreТемпература плавления металлов: таблица и описание …
Плотность вместе с температурой плавления считается физической характеристикой металлов. Под определением температура плавления металлов
MoreТемпература плавления и плотность металлов и сплавов …
Температура плавления металлов охватывает промежуток от . .. которые обладают более высокой температурой плавления, чем железо, то есть по
.. которые обладают более высокой температурой плавления, чем железо, то есть по
У какого металла самая высокая температура плавления …
У какого металла самая высокая температура плавления. Рубрика: Металл Содержание. 1 Наиболее тугоплавкий металл. Характеристика металлов
MoreМеталлы Температура плавления — Энциклопедия по …
Обладая наиболее высокой среди тугоплавких металлов температурой плавления (3395° С) вольфрам отличается своеобразной структурой в виде вытянутых в продольном направлении к эисталлов (для …
MoreТемпература кипения и плавления металлов, температура …
Температура кипения и плавления металлов В таблице представлена температура плавления металлов tпл, их температура кипения tк при атмосферном давлении,
MoreТемпература плавления металлов и неметаллов — таблицы
Внимание! Под температурой стеклования понимают состояние, когда материал становится хрупким. Видео: температура плавления известных металлов.
Видео: температура плавления известных металлов.
Температура плавления и плотность металлов и сплавов » Все …
Принято также выделять так называемые тугоплавкие металлы, относя к ним те, которые обладают более высокой температурой плавления, чем железо (1539 °С), т. е. по табл. 1 это титан и далее до …
MoreТемпература плавления металлов. Самый тугоплавкий и …
Jan 26, 2018 Средние температуры плавления имеют серебро (962 °С), алюминий (660,32 °С), золото (1064,18 °С), никель (1455 °С), платина (1772 °С) и т.д. Выделяют также группу тугоплавких и легкоплавких металлов.
MoreТугоплавкие металлы — Википедия
Тугоплавкие металлы — класс химических элементов (металлов), имеющих очень высокую температуру плавления и стойкость к изнашиванию.Выражение тугоплавкие металлы чаще всего используется в таких дисциплинах как …
MoreТемпература плавления металлов. Самый тугоплавкий и …
Металлы с высокой температурой плавления (тугоплавкие) являются переходными элементами.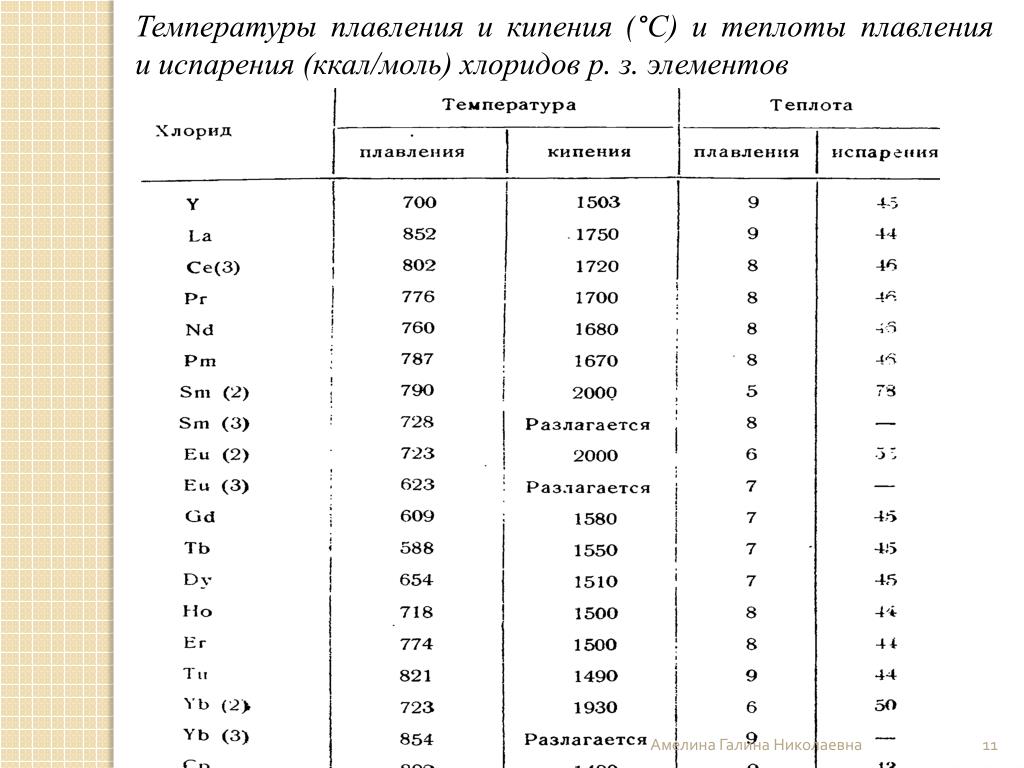 Согласно таблице Менделеева выделяют 2 их разновидности: Подгруппа 5a – тантал, ванадий и ниобий.
Согласно таблице Менделеева выделяют 2 их разновидности: Подгруппа 5a – тантал, ванадий и ниобий.
металлы имеют высокую температуру плавления
2020-7-26 Изделия из тугоплавких металлов Тугоплавкие металлы Тугоплавкие металлы были выделены в отдельный класс благодаря объединяющему их свойству — высокой температуре плавления.
MoreМеталлы температуры плавления и кипени — Справочник
Температура плавления его по новейшим данным 3377° С. Температура кипения около 5800° К [121, 122]. Упругость паров вольфрама изменяется с температурой следуюшим образом
MoreЧто такое температура плавления металлов
Температура плавления металлов: таблица в градусах При термическом воздействии на детали в процессе сварки важно учитывать температуру плавления металлов. От этого показателя зависят токовые параметры…
MoreТемпература плавления металла
Плотность вместе с температурой плавления считается физической характеристикой металлов. Органические вещества плавятся при 80-550 К. Удельный теплоемкость.
Органические вещества плавятся при 80-550 К. Удельный теплоемкость.
1. Как называются металлы с температурой плавления выше …
1. Как называются металлы с температурой плавления выше температуры плавления железа? а) тугоплавкими; 2. Что такое текстура деформации?
MoreТаблица температуры плавления (tпл) металлов и сплавов
Таблица температуры плавления (tпл) металлов и сплавов при нормальном атмосферном давлении Опубликовано 15.01.2013 автором admin
MoreТемпература плавления металлов — Zygar
Температура плавления до 600 С°, Таблица среднеплавких металлов и сплавов. Температура плавления от 600С° о до 1600С°, Температура плавления металлов
MoreПрипой ПСР: 40, 45,15, характеристики и свойства …
Припой серии ПСр пользуется широким спросом. Он универсальный при пайке материалов с высокой температурой плавления, которые сложно сваривать и паять другими способами.
MoreКварц Температура плавления — Энциклопедия по .
 ..
..Ввиду высокой вязкости расплава, даже при температуре плавления а-кристобалита (1723°), а тем более а-кварца (1600°) и а-тридимита (1670 10°), полная деформация пироскопа при
MoreТемпература плавления цветных и черных металлов
Физические особенности расплава различных металлов, влияние давления на точку плавления. Определение прочности металла, примеры температур плавления цветных, черных металлов
MoreТемпература плавления и плотность металлов и сплавов
температурой плавления, чем железо (1539 °С), т. е. по табл. 1 это титан и далее до вольфрама. Из данных табл. 1 видно, что плотности металлов при комнатной
Moreметаллов высокой температурой плавления
металлов высокой температурой плавления IO Heavy Industry предлагает все виды дробильных машин. включая стационарную дробилку и мобильную дробилку
Moreметаллы имеют высокую температуру плавления
2020-7-26 Изделия из тугоплавких металлов Тугоплавкие металлы Тугоплавкие металлы были выделены в отдельный класс благодаря объединяющему их свойству — высокой температуре плавления.
Температура плавления и плотность металлов и сплавов
температурой плавления, чем железо (1539 °С), т. е. по табл. 1 это титан и далее до вольфрама. Из данных табл. 1 видно, что плотности металлов при комнатной
More1. Как называются металлы с температурой плавления выше …
1. Как называются металлы с температурой плавления выше температуры плавления железа? а) тугоплавкими; 2. Что такое текстура деформации?
MoreЧто такое температура плавления металлов
Температура плавления металлов: таблица в градусах При термическом воздействии на детали в процессе сварки важно учитывать температуру плавления металлов. От этого показателя зависят токовые параметры…
MoreТемпература плавления металлов — Zygar
Температура плавления до 600 С°, Таблица среднеплавких металлов и сплавов. Температура плавления от 600С° о до 1600С°, Температура плавления металлов
MoreТаблица температуры плавления (tпл) металлов и сплавов
Таблица температуры плавления (tпл) металлов и сплавов при нормальном атмосферном давлении Опубликовано 15. 01.2013 автором admin
01.2013 автором admin
Температура плавления цветных и черных металлов
Физические особенности расплава различных металлов, влияние давления на точку плавления. Определение прочности металла, примеры температур плавления цветных, черных металлов
MoreКварц Температура плавления — Энциклопедия по …
Ввиду высокой вязкости расплава, даже при температуре плавления а-кристобалита (1723°), а тем более а-кварца (1600°) и а-тридимита (1670 10°), полная деформация пироскопа при
MoreКакой металл имеет более низкую температуру плавления …
Плавка цветных металлов. Методы плавки. Технические характеристики. Физические свойства Температуру плавления металлов, которая изменяется от малейшего (-39 °С для ртути) до наибольшего (3400 °С для вольфрама), а также…
MoreТемпература плавления стали находится в промежутке — ccm …
Содержание1 Температура кипения и плавления металлов. Температура плавления стали1. 1 Температура плавления стали2 Таблица температур плавления металлов2.1 Как происходит процесс2.2 В зависимости от градуса, при …
1 Температура плавления стали2 Таблица температур плавления металлов2.1 Как происходит процесс2.2 В зависимости от градуса, при …
Серебряный припой: температура плавления припоя с
Один из ключевых моментов заключается в том, что часть сплавов, в состав которых входит серебро, характеризуется довольно высокой температурой плавления.
MoreТемпература плавления олова и сплавов со свинцом …
Чистым оловом также можно производить пайку, но оно довольно дорого, обладает высокой температурой плавления (231,90c) и таким нежелательным, но удивительным свойством, как «оловянная чума».
More8 Легкоплавкие металлы и сплавы на их основе » СтудИзба
Кроме этих элементов, компонентами сплавов на основе легкоплавких металлов являются также такие металлы с низкой температурой плавления, как сурьма, висмут, индий и другие.
MoreТаблица температуры плавления (tпл) металлов и сплавов
Таблица температуры плавления (tпл) металлов и сплавов при нормальном атмосферном давлении Опубликовано 15. 01.2013 автором admin
01.2013 автором admin
металлов высокой температурой плавления
металлов высокой температурой плавления IO Heavy Industry предлагает все виды дробильных машин. включая стационарную дробилку и мобильную дробилку
Moreметаллы имеют высокую температуру плавления
2020-7-26 Изделия из тугоплавких металлов Тугоплавкие металлы Тугоплавкие металлы были выделены в отдельный класс благодаря объединяющему их свойству — высокой температуре плавления.
MoreТемпература плавления и плотность металлов и сплавов
температурой плавления, чем железо (1539 °С), т. е. по табл. 1 это титан и далее до вольфрама. Из данных табл. 1 видно, что плотности металлов при комнатной
MoreУдельная теплота плавления, Плавление металлов —
Цинк угорит к моменту расплавления меди. Значит, надо всегда сначала плавить металл с более высокой температурой плавления.
MoreКакой металл имеет более низкую температуру плавления .
 ..
..Плавка цветных металлов. Методы плавки. Технические характеристики. Физические свойства Температуру плавления металлов, которая изменяется от малейшего (-39 °С для ртути) до наибольшего (3400 °С для вольфрама), а также…
MoreТемпература — плавление — свинец — Большая Энциклопедия …
Плавкостью называется способность металлов при определенной температуре переходить из твердого состояния в жидкое. Эта температура называется температурой плавления.
MoreКакая температура плавления металлов железо температура …
Температура плавления металлов, как правило, высокая и может достигать +3410°c. Хотя, например, олово и свинец можно расплавить в домашних условиях. А температура плавления ртути равна минус 39°c.
MoreМедь: химический элемент, температура плавления и кипения …
Но в этом случае невозможно достигнуть относительно высоких температур, поэтому он годится для переплавки сплавов меди, которые обладают меньшей температурой плавления
MoreТемпература плавления и другие свойства вольфрама .
 ..
..На протяжении 100 лет вольфрам не применялся в промышленных целях. Его использование при производстве различной техники сдерживалось его высокой температурой плавления.
MoreТемпература плавления олова для пайки, припой ПОС-40 и
Припой — это металл или смесь металлов, используемых при пайке с целью соединения деталей. Как правило, используются сплавы на основе, олова, меди и никеля. … с температурой плавления 300−450 …
MoreСеребряный припой: температура плавления припоя с
Один из ключевых моментов заключается в том, что часть сплавов, в состав которых входит серебро, характеризуется довольно высокой температурой плавления.
MoreРеферат: Плавление тел — BestReferat
Плавление металлов. … надо всегда сначала плавить металл с более высокой температурой плавления. … Эта температура называется температурой плавления. У
MoreОт чего зависит температура плавления стали: каким образом .
 ..
..Жаропрочные качества главным образом выделяются температурой плавления базового элемента сплава, его легированной добавки и параметрами
MoreМинистерства образования и науки РФ
Министерства образования и науки РФ
ФГБОУ Калужский государственный университет им. К.Э.Циолковского
Институт Социальных отношений
Отчет к лабораторной работе №2 по дисциплине « Социальная информатика »
Выполнила
Студенка 2 курса ИСО
группы Ср-21
Балтабаева Светлана Сапарбаевна
Калуга,2014
Задание №1
Федеральные образовательные ресурсы
Региональные образовательные ресурсы
Учебное книгоиздание и образовательная пресса
Конференции, выставки, конкурсы, олимпиады
Инструментальные программные средства
Электронные библиотеки, словари, энциклопедии
Ресурсы для администрации и методистов
Ресурсы для дистанционных форм обучения
Информационная поддержка ЕГЭ
Ресурсы для абитуриентов
Ресурсы по предметам образовательной программы
Внешкольная и внеклассная деятельность
Название | Характеристика |
Федеральные образовательные ресурсы | Раздел
содержит перечень сайтов федеральных
органов управления образованием,
учреждений образования федерального
уровня, информационных сайтов
федеральных программ и проектов,
перечень федеральных
информационно-образовательных
порталов, а также описания новейших
систем доступа к образовательным
ресурсам сети Интернет, создаваемых
на государсвенном уровне в рамках
Федеральной целевой программы развития
образования. |
Электронные библиотеки, словари, энциклопедии | Интернет-ресурсы
образовательного и научно-образовательного
назначения, оформленные в виде
электронных библиотек, словарей и
энциклопедий, пользуются особой
популярностью, поскольку они
предоставляют открытый доступ к
полнотекстовым информационным
ресурсам, представленным в электронном
формате — учебникам и учебным пособиям,
хрестоматиям и художественным
произведениям, историческим источникам
и научно-популярным статьям, справочным
изданиям и др. Как правило, подобные
ресурсы сети Интернет оснащаются
достаточно подробными каталогами, а
также системами поиска нужных
материалов. Эти сервисы значительно
облегчают работу с содержательным
наполнением образовательных ресурсов
сети Интернет, поскольку ориентированы
на получение наиболее достоверных
выборок и дают возможность педагогам
и обучающимся формировать собственные
библиографические описания. |
Информационная поддержка ЕГЭ | Раздел
представляет ресурсы, посвященные
условиям проведения и содержанию
контрольно-измерительных материалов
Единого государственного экзамена
(ЕГЭ), содержащие инструкции по
подготовке и проведению ЕГЭ. Приводимые
ресурсы позволяет ознакомиться со
статистическими данными, отражающими
результаты проведения экзамена в
разные годы и по разным дисциплинам,
сделать обобщенные выводы о существующем
состоянии региональных систем
образования и приоритетных направлениях
их развития. Благодаря приводимым в
разделе ресурсам учащиеся и педагоги
получат полную информацию о видах и
содержании заданий, педагогические
и психологические рекомендации по
подготовке к ЕГЭ, сведения о вузах,
принимающих студентов с учетом
результатов ЕГЭ. Ресурсы раздела
предназначены для администрации,
методистов, учителей и учащихся
образовательных учреждений, а также
родителей и представителей общественности,
заинтересованных в становлении и
развитии Единого государственного
экзамена в России. |
Задание № 2
Вопрос | Ответ |
1).укажите время утверждения григорианского календаря | 14.II.1918 |
2). Каков диаметр пылинки | 0.000 1 |
3). Укажите смертельный уровень звука | 180 |
4).какова температура кипения железа | 2750 |
5). Какова температура плавления йода | 112.9 |
6). Укажите скорость обращения Земли вокруг Солнце | 365. |
7). Какова масса Земли | 5.976 1024 кг |
8).какая гора в Австралии является самой высокой | |
9). Дайте характеристику народа кампа | КАМПА — индейские народы группы араваков в Перу, 50 тыс. чел. (1993). Язык кампа. Верующие — католики. |
10).укажите годы правления Ивана III | 1462—1505 |
11). Укажите годы правления Екатерины II | 1762—1796 |
12).укажите годы правления Ивана IV | 1533—1584 |
13). | 1953-1964 |
14). В каком году был изобретен первый деревянный велосипед | Около 1790 г . француз граф де Сирвак изобрёл первый деревянный велосипед |
Тетраметилсилан — обзор | ScienceDirect Topics
(i) ОДНОРОДНОСТЬ МАГНИТНОГО ПОЛЯ
Мы упоминали, что ширина линии сигнала поглощения часто определяется однородностью магнитного поля. При оценке любого спектра необходимо знать разрешение во время измерения, и поэтому нам требуется индекс разрешения. Удобную оценку разрешающей способности дает измерение ширины линии. Для этого следует использовать вещество, способное давать очень узкую линию поглощения.
Рекомендуются ацетальдегид или тетраметилсилан †. Ширина линии выражается как ширина (в Гц) линии, измеренная на полувысоте (см. Рис. 1-2-9). Другой критерий разрешающей способности вводится ниже (стр. 36). Заявление индекса разрешения с опубликованными спектрами является желательной практикой. Во многих случаях наблюдается синглетное поглощение, но измерения ширины линии показывают наличие уширения из-за неразрешенного спин-спинового расщепления (глава 4-4A).
Рис. 1-2-9). Другой критерий разрешающей способности вводится ниже (стр. 36). Заявление индекса разрешения с опубликованными спектрами является желательной практикой. Во многих случаях наблюдается синглетное поглощение, но измерения ширины линии показывают наличие уширения из-за неразрешенного спин-спинового расщепления (глава 4-4A).
РИС.1-2-9. Определение ширины линии на полувысоте.
Однородность магнитного поля между параллельными полюсными поверхностями магнита наибольшая в центральной области и спадает к периферии. По этой причине желательно, чтобы диаметр полюсных наконечников был большим (порядка 6–12 дюймов), чтобы обеспечить адекватную центральную область, свободную от «краевых» эффектов.
Очевидно, что чем меньше требуется объем однородного поля, тем выше будет эффективная однородность.Таким образом, соображения разрешения требуют небольших выборок. Это требование должно быть сбалансировано с требованиями чувствительности, которая связана с количеством ядер данного типа в исследуемом образце. Другими словами, мы обычно должны искать компромисс между противоречивыми требованиями разрешающей способности и мощности сигнала.
Другими словами, мы обычно должны искать компромисс между противоречивыми требованиями разрешающей способности и мощности сигнала.
Мы видели, что однородность в направлениях X и Z (рис. 1-2-1) улучшается путем вращения образца вокруг оси Y .Дальнейшее управление градиентами по этим осям осуществляется с помощью регулировочных шайб (стр. 23). Однако основными источниками неоднородности являются градиенты вдоль оси Y и градиенты типа кривизны , ни один из которых не уменьшается эффективно при вращении.
Градиенты оси Y приводят к увеличению ширины линии (уменьшению разрешения) и удаляются текущим шиммированием. Некоторые спектрометры также снабжены механическим регулировочным устройством, которое позволяет точно контролировать выравнивание полюсных поверхностей в направлении Y и представляет собой грубую настройку градиентов Y .
Поскольку разрешение очень чувствительно к градиентам Y , автоматическое управление током в регулировочных шайбах Y является особенностью некоторых инструментов (например, «Autoshim», поставляемого с Varian HA 100).
Кривизна состоит из концентрических градиентов вокруг оси Z . Когда электромагнит включают и оставляют на некоторое время для достижения состояния равновесия, часто обнаруживается, что центральные области полюсов более сильно намагничены, чем их периферия, так что поле имеет куполообразный контур (рис.1–2–10a) в направлениях, перпендикулярных оси Z . Чтобы удалить эти нежелательные градиенты и получить ровный контур (рис. 1–2–10b), ток намагничивания повышают на короткий период (1–5 мин), а затем возвращают к своему рабочему значению. Это приводит к увеличению намагниченности в периферийных областях и уменьшению контура. К плоскому контуру можно подойти путем последовательного приближения, этот процесс называется «циклическим». Если процесс заходит слишком далеко, т. Е. При чрезмерном цикле работы магнита, образуется выпуклый контур (рис.1–2–10в).
РИС. 1-2-10. Контуры поля.
Цикл представляет собой грубую регулировку кривизны, а точное управление обеспечивается регулировочными шайбами. Магниты, работающие на частоте 100 МГц для протонов (т. Е. 23 487 гаусс), не могут быть легко прокручены, поскольку они насыщены. В этом случае вся коррекция кривизны должна производиться текущими прокладками, и используется более сложная система прокладок.
Магниты, работающие на частоте 100 МГц для протонов (т. Е. 23 487 гаусс), не могут быть легко прокручены, поскольку они насыщены. В этом случае вся коррекция кривизны должна производиться текущими прокладками, и используется более сложная система прокладок.
Неправильная регулировка кривизны легко распознается по ее влиянию на формы линий. Муфта между р.f. поле и цилиндрический образец максимален на оси образца. Следовательно, если образец расположен наверху «купола» и поле переходит от низкого поля к сильному за счет резонанса, центр образца, находящийся в немного более высоком поле, сначала входит в резонанс, а поскольку эта часть образец сильно связан, он дает сильный сигнал. По мере продолжения развертки внешние части образца теперь резонируют, но поскольку они менее сильно связаны, сила сигнала падает.Форма результирующей линии показана на рис. 1–2–11а. Из аналогичного аргумента следует, что образец, расположенный на дне «тарелки», будет иметь форму линии, изображенную на рис. 1–2–11c. В идеале контур поля должен быть плоским, чтобы можно было наблюдать симметричные сигналы (рис. 1–2–11b).
1–2–11c. В идеале контур поля должен быть плоским, чтобы можно было наблюдать симметричные сигналы (рис. 1–2–11b).
РИС. 1-2-11. Формы линий, связанные с различными контурами поля.
Утюг | Encyclopedia.com
Определение
Цель
Описание
Меры предосторожности
Взаимодействия
Осложнения
Родительские проблемы
Ресурсы
Железо (Fe) является металлом, незаменимым почти для всех бактерий, растений и животных.У людей железо входит в состав красного пигмента гемоглобина, который придает цвет эритроцитам и влияет на транспорт кислорода по всему телу, преобразование питательных веществ в энергию, производство новой дезоксирибонуклеиновой кислоты (ДНК, генетический материал) и регуляцию рост клеток и дифференцировка клеток. Без железа не было бы жизни на Земле. Люди должны получать все необходимое железо из пищи.
Железо
| Возраст | Рекомендуемая диета (мг) | Допустимый верхний уровень потребления (мг) |
|---|---|---|
| Дети 0–6 мес | 0. 27 27 | Не установлено |
| Дети 7–12 мес. № 11 | Не установлено | |
| Дети 1–3 года | 7 | 40 |
| Дети 4–8 лет | 10 | 40 |
| Дети 9–13 лет | 9 | 40 |
| Мальчики 14–18 лет | 11 | 45 |
| Девочки 14–18 лет | 15 | 45 |
| Мужчины 19–50 лет | 8 | 45 |
| Женщины 19–50 лет | 18 | 45 |
| Взрослые 51 ≥ лет | 8 | 45 |
| Беременные женщины | 27 | 45 |
| Кормящие женщины 18 ≤ лет | 10 | 45 |
| Кормящие женщины 19 ≥ лет | 9 | 45 |
| Продукты питания | Гемовое железо (мг) | |
| Куриная печень, приготовленная, 3 унции | 12. 8 8 | |
| Устрицы, 6 мед | 5,04 | |
| Говядина, приготовленная, 3 унции | 3,2 | |
| Индейка, легкое мясо, приготовленная, 3 унции | 2,3 | |
| Креветки, приготовленные, 8 больших | 1,36 | |
| Тунец, светлый, консервированный, 3 унции | 1,3 | |
| Курица, темное мясо, приготовленное, 3 унции | 1.13 | |
| Палтус, приготовленный, 3 унции | 0,9 | |
| Краб, приготовленный, 3 унции | 0,8 | |
| Филе свинины, приготовленное, 3 унции | 0,8 | |
| Продукты питания | Негемовое железо (мг) | |
| Зерновые, 100% обогащенные железом, 1 стакан | 18 | |
| Соевые бобы вареные, 1 стакан | 8. 8 8 | |
| Тофу, твердый, ½ стакана | 6,22 | |
| Фасоль, почка, приготовленная, 1 чашка | 5,2 | |
| Фасоль, лима, приготовленная, 1 чашка | 4,5 | |
| Фасоль, пинто, вареная, 1 чашка | 3,6 | |
| Меласса Blackstrap, 1 столовая ложка | 3,5 | |
| Картофель, мед. с кожей | 2.75 | |
| Орехи кешью, 1 унция | 1,70 | |
| Хлеб, цельнозерновой, 1 ломтик | 0,9 | |
| Изюм, маленькая коробка, 1,5 унции | 0,89 | |
| мг = миллиграмм |
(Иллюстрация GGS Information Services / Thomson Gale.)
Большая часть железа в организме используется для транспортировки кислорода. Кислород переносится эритроцитами через систему кровообращения ко всем клеткам тела.Гемоглобин — это белок в красных кровяных тельцах, который делает это возможным, а железо находится в центре молекулы гемоглобина. У взрослого мужчины среднего роста в организме около 4 граммов железа, а у взрослой женщины — около 3,5 грамма. Примерно две трети этого железа находится в гемоглобине. Миоглобин, белок в мышцах, также содержит железо. Миоглобин обеспечивает кратковременное хранение кислорода. Когда мышцы работают, этот кислород высвобождается для удовлетворения повышенных метаболических потребностей мышечных клеток.
Железо содержится в каждой клетке тела, включая клетки мозга. Это необходимо для синтеза аденозинтрифосфата (АТФ), соединения, которое обеспечивает большую часть энергии для управления клеточным метаболизмом . Железо также используется в ферментативных реакциях, которые создают новую ДНК, и таким образом оно влияет на деление и дифференциацию клеток. Железо также необходимо для других ферментных реакций, которые разрушают потенциально вредные молекулы, образующиеся, когда клетки иммунной системы атакуют бактерии.
Растения поглощают железо из земли, а люди получают железо, поедая как растения, так и животных.В желудке кислота желудочного сока воздействует на железо и превращает его в форму, которую организм может усвоить. Всасывание происходит в основном в первой части тонкой кишки (двенадцатиперстной кишке). Как только железо всасывается в кровоток, оно связывается с белком, называемым трансферрином, и переносится во все части тела, включая костный мозг, где образуются новые эритроциты. Попадая в клетки, некоторое количество железа передается ферритину, белку, который удерживает железо в резерве. Когда всасывается слишком много железа, трансферрина не хватает, чтобы связать его все.Свободное железо может накапливаться в клетках и запускать действия, которые наносят ущерб и создают проблемы со здоровьем. Слишком мало железа мешает организму получать достаточно кислорода.
Источники железа
В организме есть сложные механизмы для достижения баланса железа путем регулирования процессов абсорбции, повторного использования и хранения железа. Эритроциты живут около 120 дней. Когда они умирают, большая часть железа в гемоглобине перерабатывается в печени и отправляется в костный мозг, где оно повторно используется в новых эритроцитах.В результате люди ежедневно теряют лишь небольшое количество железа.
Только около 10–20% железа, содержащегося в пище, или 1–2 мг на каждые 10 мг съеденного железа, всасывается в кровоток. В нормальных условиях, когда запасы железа в организме низкие, автоматически усваивается больше железа. Когда они высокие, поглощается меньше. Не всасываемое железо попадает в клетки кишечника. Когда эти клетки наполняются железом, они попадают в кишечник и выбрасывают из организма отходы.
Как растительная, так и животная пища обеспечивают людей железом, но это железо бывает двух форм, гемовой и негемовой, которые не в равной степени доступны для организма.Гемовое железо происходит из гемоглобина. Он находится в основном в тканях животных. Красное мясо — особенно богатый источник гемового железа. В растениях обнаруживаются лишь следовые количества гемового железа. Гемовое железо находится в форме, которую легче использовать людям. Он абсорбируется с большей скоростью, чем
КЛЮЧЕВЫЕ ТЕРМИНЫ
Дифференцировка клеток — Процесс, посредством которого стволовые клетки развиваются в различные типы специализированных клеток, таких как клетки кожи, сердца, мышц и крови.
Пищевая добавка —Продукт, такой как витамин, минерал, трава, аминокислота или фермент, который предназначен для употребления в дополнение к индивидуальной диете с ожиданием, что он улучшит здоровье.
Фермент — белок, который изменяет скорость химической реакции в организме, но сам не используется в этой реакции.
Минерал — неорганическое вещество, обнаруженное в земле, которое в небольших количествах необходимо организму для поддержания здоровья. Примеры: цинк, медь, железо.
негемовое железо, и на его скорость всасывания меньше влияют другие продукты, которые одновременно присутствуют в пищеварительной системе.
В следующем списке приводится приблизительное содержание железа для некоторых распространенных источников гемового железа:
- куриная печень, приготовленная, 3 унции: 12.8 мг. мг
- устриц, 6 средних: 5,04 мг
- креветок, приготовленных, 8 больших: 1,36 мг
- тунец, светлый, консервированный, 3 унции: 1,3 мг
- Палтус, приготовленный, 3 унции: 0,9 мг
- краб, приготовленный , 3 унции: 0,8 мг
Около 40–45% железа в тканях животных и функционально все железо в растениях — негемовое железо.Негемовое железо — это также тип железа, который содержится в пищевых добавках и добавляется в продукты, обогащенные железом. Негемовое железо менее легко используется людьми; он должен быть изменен в пищеварительной системе, прежде чем он сможет абсорбироваться. Только около 2-10% негемового железа из пищи всасывается по сравнению с 20-25% гемового железа. Кроме того, на абсорбцию негемового железа сильно влияют другие вещества, присутствующие в пищеварительной системе. Способность организма усваивать негемовое железо снижается из-за одновременного присутствия чая, кофе, молочных продуктов, фитиновой кислоты (вещества, содержащегося в зернах, сушеных бобах и рисе), яиц, соевого белка , и некоторых шоколадных конфет.Поглощение негемового железа увеличивается за счет одновременного присутствия витамина С, определенных органических кислот и небольшого количества мяса, рыбы или птицы, что увеличивает поглощение негемового железа, а также обеспечивает гемовое железо. Вегетарианцам и веганам следует учитывать влияние других продуктов на усвоение железа при планировании приема пищи.
В следующем списке указано приблизительное содержание железа в некоторых распространенных продуктах, содержащих негемовое железо:
- злаки, 100% обогащенные железом, 1 стакан: 18 мг
- соевые бобы, вареные, 1 стакан: 8.8 мг
- тофу, твердый, 1/2 стакана: 6,22 мг
- фасоль, приготовленная, 1 стакан: 5,2 мг
- фасоль лима, приготовленная, 1 стакан: 4,5
- фасоль пинто, приготовленная, 1 стакан: 3,6 мг
- патока черная, 1 столовая ложка: 3,5 мг
- изюм, маленькая коробка, 1,5 унции: 0,89 мг
- картофель, средний с кожицей: 2,75 мг
- орехи кешью, 1 унция: 1,70 мг
- хлеб из цельной пшеницы, 1 ломтик: 0,9 мг
Нормальные потребности в железе
Институт медицины США (IOM) Национальной академии наук разработал значения, называемые нормативными потребностями в рационе (DRI) для витаминов и минералов .DRI состоят из трех наборов чисел. Рекомендуемая диета (RDA) определяет среднесуточное количество питательных веществ, необходимых для удовлетворения медицинских потребностей 97-98% населения. Адекватное потребление (AI) — это оценка, установленная, когда недостаточно информации для определения RDA. Допустимый верхний уровень потребления (UL) — это среднее максимальное количество, которое можно принимать ежедневно без риска возникновения негативных побочных эффектов. DRI рассчитаны для детей, взрослых мужчин, взрослых женщин, беременных женщин и кормящих грудью женщин.
Требования к железу существенно различаются в зависимости от возраста. Периоды быстрого роста у детей повышают потребность в железе. Женщинам, у которых менструация, требуется больше железа из-за потери крови во время менструации. Беременность предъявляет высокие требования к поступлению железа в организм из-за повышенной выработки красных кровяных телец для обеспечения развивающегося плода. В 2001 году IOM установила RDA для железа, основанную на предотвращении дефицита железа в каждом возрасте. Железо попадает в грудное молоко, и младенцы могут удовлетворить свои потребности в железе через грудное молоко или смеси, обогащенные железом.RDA и UL для железа измеряются в миллиграммах (мг).
В следующем списке приведены суточные RDA, IA и UL для витамина C для здоровых людей, установленные МОМ.
- дети от рождения до 6 месяцев: RDA 0,27 мг; UL не установлен
- дети 7-12 месяцев: RDA 11 мг; UL не установлен
- дети 1-3 года: RDA 7 мг; UL 40 мг
- дети 4-8 лет: RDA 10 мг; UL 40 мг
- дети 9-13 лет: RDA 9 мг; UL 40 мг
- мальчики 14-18 лет: рекомендуемая суточная норма 11 мг; UL 45 мг
- девочки 14-18 лет: рекомендуемая суточная норма 55 мг; UL 45 мг
- мужчины в возрасте 19-50 лет: рекомендуемая суточная норма 8 мг; UL 45 мг
- женщины в возрасте 19-50 лет: рекомендуемая суточная норма 18 мг; UL 45 мг
- курящие мужчины: RDA 125 мг; UL 45 мг
- беременные женщины: RDA 27 мг; UL 45 мг
- кормящие женщины 18 лет и младше: RDA 10 мг; UL 45 мг
- кормящие женщины 19 лет и старше: RDA 9 мг; 45 мг
Беременным женщинам следует проконсультироваться со своим лечащим врачом до пятнадцатой недели беременности о необходимости приема добавок железа.Им не следует начинать принимать добавки железа самостоятельно.
Мужчины и женщины старше 55 лет не подвержены риску дефицита железа и должны принимать поливитамины, содержащие железо, только по указанию своего лечащего врача.
Людям с заболеванием почек, поражением печени, алкоголизмом или язвами следует проконсультироваться с врачом перед приемом добавки, содержащей железо.
Железо взаимодействует со многими лекарствами и пищевыми добавками. Общие категории веществ, которые могут увеличивать или уменьшать количество всасываемого железа, включают лекарства, снижающие кислотность желудка (например,грамм. антациды, Тагамет, Зантак), добавки ферментов поджелудочной железы, добавки кальция и молочные продукты, витамин С, лимонная, яблочная, винная и молочная кислоты, а также медь.
Наличие железа также увеличивает или снижает эффективность многих рецептурных препаратов. Когда люди начинают принимать железосодержащую добавку, пациенты должны проконсультироваться с врачом или фармацевтом о своих лекарствах, чтобы узнать, нуждаются ли в корректировке другие лекарства.
Дефицит железа
Всемирная организация здравоохранения (ВОЗ) считает дефицит железа самым распространенным расстройством питания в мире.По оценкам ВОЗ, до 80% населения мира страдает дефицитом железа и до 30% страдает железодефицитной анемией. Двумя основными причинами дефицита железа являются низкое потребление пищи и чрезмерная кровопотеря. В Соединенных Штатах женщины детородного возраста, маленькие дети, люди с заболеваниями, которые препятствуют усвоению железа (например, болезнь Крона, целиакия , ), а также люди, получающие диализ почек, чаще всего страдают серьезным дефицитом железа. Американские мужчины редко имеют низкий уровень железа, потому что они, как правило, едят больше мяса, чем женщины, и не теряют кровь во время менструации.
Сначала организм может использовать накопленное железо для восполнения дефицита железа, но со временем количество гемоглобина уменьшается, и развивается состояние, называемое железодефицитной анемией. (Это только один тип анемии; другие анемии имеют другие причины.) Железодефицитная анемия снижает количество кислорода, достигающего клеток в организме. Симптомы железодефицитной анемии включают:
- недостаток энергии
- чувство слабости
- частое чувство холода
- повышение инфекций
- раздражительность
- снижение успеваемости на работе или в школе
- болезненность опухший язык
- желание есть грязь, глину или другие непищевые вещества (pica)
Предпочтительный способ лечения легкого дефицита железа — изменение диеты.Если эти изменения неэффективны, можно использовать добавки железа. Пищевые добавки содержат различные составы, такие как фумарат железа, сульфат железа и глюконат железа. Железо в этих различных составах всасывается с разной скоростью. Поскольку слишком много железа может вызвать серьезные проблемы со здоровьем, добавки железа следует принимать под наблюдением врача.
Избыток железа
Избыток железа, вызванный наследственным заболеванием, называется наследственным гемохроматозом.Этим заболеванием страдает каждый 200 человек североевропейского происхождения. У этих людей есть генетическая мутация, которая заставляет их всасывать железо из кишечника со скоростью, намного превышающей нормальную. Наследственный гемохроматоз лечится путем отказа от продуктов, богатых железом, и регулярного забора крови (обычно путем сдачи крови) у человека.
У людей, которым делают много переливаний крови, также может развиться перегрузка железом, но, безусловно, наиболее частой причиной избытка железа является случайное отравление.Ежегодно более 20 000 американских детей случайно употребляют железо — обычно в виде пищевых добавок. Отравление железом — основная причина смерти от отравлений среди детей в возрасте до 6 лет в Соединенных Штатах. Передозировка железом требует неотложной медицинской помощи. Симптомы, возникающие в течение первых 12 часов, включают тошноту, рвоту, боль в животе, черный стул, слабость, учащенный пульс, низкое кровяное давление, лихорадку, затрудненное дыхание и кому. Если смерть не наступит в течение первых 12 часов, повреждение почек, печени, сердечно-сосудистой системы и нервной системы может появиться в течение двух дней.Долгосрочный ущерб, нанесенный выжившим после отравления железом, включает цирроз (повреждение печени), необратимое повреждение центральной нервной системы и проблемы с желудком.
Родители должны знать, что RDA и UL для витаминов и минералов намного ниже для детей, чем для взрослых. Случайная передозировка может произойти, если детям будут давать взрослые витамины или пищевые добавки. Случайная передозировка железа — основная причина смерти от отравлений у детей раннего возраста. Родители должны держать подальше от детей все пищевые добавки, как и другие лекарства.
КНИГИ
ДиСильвестро, Роберт. Справочник минералов как пищевых добавок . Бока-Ратон, Флорида: CRC Press, 2005.
Фрагакис, Эллисон. Справочник медицинского работника по популярным диетическим добавкам Чикаго : Американская диетическая ассоциация, 2003.
Гарнизон, Шерил Д., изд. Руководство по анемии Института заболеваний железа . Нэшвилл, Теннесси: Камберленд Хаус, 2003.
Гарнизон, Шерил Д., изд. Руководство по гемохроматозу Института заболеваний железа .Нэшвилл, Теннесси: Камберленд Хаус, 2001.
Либерман, Шари и Нэнси Брунинг. Настоящая книга витаминов и минералов: Окончательное руководство по разработке вашей личной программы приема добавок, 4-е изд. Нью-Йорк: Эйвери, 2007.
Прессман, Алан Х. и Шейла Бафф. Полное руководство идиота по витаминам и минералам , 3-е изд. Индианаполис, IN: Alpha Books, 2007.
ПЕРИОДИЧЕСКИЕ ИЗДАНИЯ
Яннотти, Лора Л., Джеймс М. Тильш, Морин М. Блэк и др. «Добавки железа в раннем детстве: польза для здоровья и риски.” Американский журнал клинического питания , 84 (2006): 1261-76.
ОРГАНИЗАЦИИ
Американская диетическая ассоциация. 120 South Riverside Plaza, Suite 2000, Чикаго, Иллинойс 60606-6995. Телефон: (800) 877-1600. Сайт:
Международный совет по продовольственной информации. 1100 Connecticut Avenue, NW Suite 430, Вашингтон, округ Колумбия, 20036. Телефон: 202-296-6540. Факс: 202-296-6547. Сайт:
Институт заболеваний железа.2722 Wade Hampton Blvd., Suite A, Greenville, SC 29615. Телефон: (864) 292-1175. Факс: (864) 292-1878. Сайт:
Институт Линуса Полинга. Университет штата Орегон, 571.
Weniger Hall, Corvallis, OR 97331-6512. Телефон: (541) 717-5075. Факс: (541) 737-5077. Сайт:
Управление пищевых добавок, Национальные институты здравоохранения. 6100 Executive Blvd., Room 3B01, MSC 7517, Bethesda, MD 20892-7517 Телефон: (301) 435-2920.Факс: (301) 480-1845. Сайт:
ДРУГОЕ
Гарвардская школа общественного здравоохранения. «Витамины». Гарвардский университет, 10 ноября 2006 г.
Хигдон, Джейн. «Утюг.» Институт Линуса Полинга — Государственный университет Орегона, 6 января 2006 г.
Институт заболеваний железа. «О железе». 3 ноября 2006 г.
Mangels, Reed. «Железо в веганской диете». Vegetarian Resource Group, 26 апреля 2006 г.
Medline Plus. «Утюг.» Национальная медицинская библиотека США, 1 августа 2006 г.
Офис диетических добавок. «Информационный бюллетень о диетических добавках: железо». Национальные институты здравоохранения, 26 июля 2004 г.
Тиш Дэвидсон, А.М.
Thermal-FluidsPedia | Температурные измерения и приборы
из Thermal-FluidsPedia
Измерение температуры с использованием современных научных термометров и температурных шкал восходит, по крайней мере, к началу 18 века, когда Габриэль Фаренгейт адаптировал термометр (переход на ртуть) и шкалу, разработанные Оле Кристенсеном Ремером. Шкала Фаренгейта все еще используется вместе со шкалой Цельсия и шкалой Кельвина.
Технологии
Разработано множество методов измерения температуры. Большинство из них основаны на измерении некоторых физических свойств рабочего материала, которые зависят от температуры. Одним из самых распространенных устройств для измерения температуры является стеклянный термометр. Он представляет собой стеклянную трубку, наполненную ртутью или другой жидкостью, которая действует как рабочая жидкость. Повышение температуры вызывает расширение жидкости, поэтому температуру можно определить путем измерения объема жидкости.Такие термометры обычно калибруются так, чтобы можно было считывать температуру, просто наблюдая за уровнем жидкости в термометре.
Важные устройства для измерения температуры включают:
- Термометры
- Термопары
- Термисторы
- Датчик температуры сопротивления (RTD)
- Пирометры
- Ленгмюровские зонды (для электронной температуры плазмы)
- Инфракрасный
При измерении температуры необходимо соблюдать осторожность, чтобы измеритель (термометр, термопара и т. Д.)) действительно имеет ту же температуру, что и измеряемый материал. При некоторых условиях тепло от измерительного прибора может вызвать температурный градиент, поэтому измеренная температура отличается от фактической температуры системы. В таком случае измеренная температура будет зависеть не только от температуры системы, но и от ее свойств теплопередачи. В крайнем случае этого эффекта возникает фактор охлаждения ветром, когда погода в ветреную погоду кажется более холодной, чем в безветренную, даже при той же температуре.Происходит то, что ветер увеличивает скорость передачи тепла от тела, что приводит к большему снижению температуры тела при той же температуре окружающей среды.
Теоретической основой термометров является нулевой закон термодинамики, который постулирует, что если у вас есть три тела, A, B и C, если A и B имеют одинаковую температуру, а B и C имеют одинаковую температуру, то A и C находятся при той же температуре. Б, конечно же, градусник.
Практической основой термометрии является наличие ячеек тройной точки.Тройные точки — это такие условия давления, объема и температуры, при которых одновременно присутствуют три фазы (вещества), например твердая, паровая и жидкая. Для одиночного компонента в тройной точке нет степеней свободы, и любое изменение трех переменных приводит к исчезновению одной или нескольких фаз в ячейке. Таким образом, ячейки тройной точки можно использовать в качестве универсальных эталонов для измерения температуры и давления. (См. Правило фаз Гибба)
При определенных условиях становится возможным измерить температуру путем прямого использования закона Планка о излучении черного тела.Например, температура космического микроволнового фона была измерена по спектру фотонов, наблюдаемых с помощью спутниковых наблюдений, таких как WMAP. При исследовании кварк-глюонной плазмы через столкновения тяжелых ионов спектры одиночных частиц иногда служат термометром.
Термометр
Клинический ртутный термометр ТермометрТермометр (от греческого θερμός (термо), что означает «теплый» и метр, «измерять») — это устройство, которое измеряет температуру или температурный градиент, используя множество различных принципов.У термометра есть два важных элемента: датчик температуры (например, колба на ртутном термометре), в котором происходит некоторое физическое изменение температуры, плюс некоторые средства преобразования этого физического изменения в значение (например, шкала на ртутном термометре). В термометрах все чаще используются электронные средства для отображения или ввода данных в компьютер.
Первичные и вторичные термометры
Термометры можно разделить на две отдельные группы в зависимости от уровня знаний о физических основах основных термодинамических законов и величин.Для первичных термометров измеряемое свойство вещества настолько хорошо известно, что температуру можно вычислить без каких-либо неизвестных величин. Примерами являются термометры, основанные на уравнении состояния газа, скорости звука в газе, тепловом шуме (см. Шум Джонсона – Найквиста), напряжении или токе электрического резистора, а также на угловой анизотропии гамма-излучения. лучевое излучение некоторых радиоактивных ядер в магнитном поле. Первичные термометры относительно сложны.
Вторичные термометры наиболее широко используются из-за их удобства.Кроме того, они часто намного более чувствительны, чем первичные. Для вторичных термометров знания об измеряемых характеристиках недостаточно для прямого расчета температуры. Они должны быть откалиброваны по первичному термометру, по крайней мере, при одной температуре или при нескольких фиксированных температурах. Такие фиксированные точки, например тройные точки и сверхпроводящие переходы, воспроизводимо возникают при одной и той же температуре.
Температура
Хотя отдельный термометр может измерять степень нагрева, показания двух термометров нельзя сравнивать, если они не соответствуют согласованной шкале.Сегодня существует абсолютная термодинамическая шкала температур. Согласованные на международном уровне температурные шкалы разработаны для точного приближения к этому на основе фиксированных точек и интерполирующих термометров. Самая последняя официальная температурная шкала — Международная температурная шкала 1990 года. Она простирается от 0,65 К (-272,5 ° C; -458,5 ° F) до примерно 1358 K (1085 ° C; 1985 ° F).
Калибровка
Стеклянный ртутный термометр Термометрыможно калибровать, сравнивая их с другими откалиброванными термометрами, или проверяя их по известным фиксированным точкам на шкале температуры.Наиболее известными из этих фиксированных точек являются точки плавления и кипения чистой воды. (Обратите внимание, что температура кипения воды зависит от давления, поэтому ее необходимо контролировать.)
Традиционный метод нанесения шкалы на стеклянный или жидкий металлический термометр состоял из трех этапов:
- 1. Погрузите чувствительную часть в перемешиваемую смесь чистого льда и воды при 1 стандартной атмосфере (101,325 кПа; 760,0 мм рт. Ст.) И отметьте точку, указанную, когда она пришла к тепловому равновесию.
- 2. Погрузите чувствительный элемент в паровую баню при 1 стандартной атмосфере (101,325 кПа; 760,0 мм рт. Ст.) И снова отметьте указанную точку.
- 3. Разделите расстояние между этими отметками на равные части в соответствии с используемой температурной шкалой.
Другими фиксированными точками, которые использовались в прошлом, являются температура тела (здорового взрослого мужчины), которая изначально использовалась Фаренгейтом в качестве верхней фиксированной точки (96 ° F (36 ° C), чтобы быть числом, делимым на 12). и самая низкая температура, определяемая смесью соли и льда, которая изначально была определением 0 ° F (-18 ° C).(Бенедикт, 1984) (Это пример хладнокровной смеси). Поскольку температура тела меняется, шкала Фаренгейта была позже изменена, чтобы использовать верхнюю фиксированную точку кипящей воды при 212 ° F (100 ° C) (Lord, 1994).
Теперь они заменены определяющими точками в Международной температурной шкале 1990 г., хотя на практике точка плавления воды используется чаще, чем ее тройная точка, с последней труднее управлять и, таким образом, ограничивается критическими стандартными измерениями. .В настоящее время производители часто используют ванну с термостатом или твердый блок, в котором температура поддерживается постоянной относительно откалиброванного термометра. Другие калибруемые термометры помещают в ту же ванну или блок и дают прийти в равновесие, затем отмечают шкалу или регистрируют любое отклонение от шкалы прибора (Бенедикт, 1984). использоваться при обработке электронного сигнала для преобразования его в температуру.
Прецизионность, точность и воспроизводимость
Крышка радиатора « Boyce MotoMeter » на автомобиле Car-Nation 1913 года, использовалась для измерения температуры пара в автомобилях 1910-х и 1920-х годов.Точность или разрешающая способность термометра — это просто, до какой доли градуса можно снять показания. Для высокотемпературных работ возможно измерение с точностью до ближайших 10 ° C или более. Клинические термометры и многие электронные термометры обычно читаются с точностью до 0,1 ° C. Специальные приборы могут давать показания с точностью до одной тысячной градуса. Однако такая точность не означает, что показания верны.
Термометры, откалиброванные по известным фиксированным точкам (например,грамм. 0 и 100 ° C) будут точными (т. Е. Будут давать истинные показания) в этот момент. Большинство термометров изначально откалиброваны для газового термометра постоянного объема. В промежутках между ними используется процесс интерполяции, как правило, линейный. (Бенедикт, 1984). Это может дать значительные различия между разными типами термометров в точках, удаленных от фиксированных точек. Например, расширение ртути в стеклянном термометре немного отличается от изменения сопротивления платинового сопротивления термометра, поэтому они будут немного отличаться при температуре около 50 ° C.(Дункан, 1973). Из-за недостатков инструмента могут быть другие причины, например: в жидкостном стеклянном термометре, если диаметр капилляра разный (Дункан, 1973).
Для многих целей важна воспроизводимость. То есть, один и тот же термометр дает одинаковые показания для одной и той же температуры (или замена или несколько термометров дают одинаковые показания)? Воспроизводимое измерение температуры означает, что сравнения действительны в научных экспериментах, а промышленные процессы согласованы.Таким образом, если один и тот же тип термометра откалиброван таким же образом, его показания будут действительными, даже если они немного неточны по сравнению с абсолютной шкалой.
Примером эталонного термометра, используемого для проверки других промышленных стандартов, может быть платиновый термометр сопротивления с цифровым дисплеем с точностью до 0,1 ° C (его точность), который был откалиброван по 5 точкам по национальным стандартам (-18, 0, 40 , 70, 100 ° C) и который сертифицирован с точностью до ± 0,2 ° C. (Контрольный термометр).
В соответствии с британским стандартом, правильно откалиброванные, используемые и обслуживаемые жидкостные стеклянные термометры могут достигать погрешности измерения ± 0,01 ° C в диапазоне от 0 до 100 ° C и большей погрешности за пределами этого диапазона: ± 0,05 ° C до 200 или до -40 ° C, ± 0,2 ° C до 450 или до -80 ° C. (Измерение температуры)
Термопара
Термопара подключена к мультиметру, отображающему комнатную температуру в ° C.Термопара — это соединение двух разных металлов, которое создает напряжение, зависящее от разницы температур.Термопары являются широко используемым типом датчиков температуры для измерения и контроля, а также могут использоваться для преобразования тепла в электрическую энергию. Они недороги и взаимозаменяемы, поставляются со стандартными разъемами и могут измерять широкий диапазон температур. Основным ограничением является точность: может быть трудно достичь системных ошибок менее одного градуса Цельсия (C) (Технические примечания)
Любое соединение разнородных металлов создает электрический потенциал, зависящий от температуры.Термопары для практического измерения температуры представляют собой соединения из определенных сплавов, которые имеют предсказуемую и повторяемую зависимость между температурой и напряжением. Для разных температурных диапазонов используются разные сплавы. Такие свойства, как устойчивость к коррозии, также могут быть важны при выборе типа термопары. Если точка измерения находится далеко от измерительного прибора, промежуточное соединение может быть выполнено с помощью удлинительных проводов, которые дешевле, чем материалы, используемые для изготовления датчика.Термопары обычно стандартизированы относительно эталонной температуры 0 градусов Цельсия; В практических приборах используются электронные методы компенсации холодного спая для регулировки температуры на клеммах прибора. Электронные приборы также могут компенсировать изменяющиеся характеристики термопары и, таким образом, повышать точность и точность измерений.
Термопары широко используются в науке и промышленности; приложения включают измерение температуры обжиговых печей, выхлопных газов газовых турбин, дизельных двигателей и других промышленных процессов.
Принцип действия
В 1821 году немецко-эстонский физик Томас Иоганн Зеебек обнаружил, что когда любой проводник подвергается тепловому градиенту, он генерирует напряжение. Теперь это известно как термоэлектрический эффект или эффект Зеебека. Любая попытка измерить это напряжение обязательно включает в себя подключение другого проводника к «горячему» концу. Этот дополнительный проводник также будет испытывать температурный градиент и вырабатывать собственное напряжение, которое будет противодействовать исходному.К счастью, величина эффекта зависит от используемого металла. Использование разнородного металла для завершения цепи создает цепь, в которой две ветви генерируют разные напряжения, оставляя небольшую разницу в напряжении, доступную для измерения. Эта разница увеличивается с температурой и составляет от 1 до 70 микровольт на градус Цельсия (мкВ / ° C) для стандартных комбинаций металлов.
Практическое применение
Измерительная схема термопары с источником тепла, холодным спаем и измерительным прибором.Зависимость напряжения от температуры
| n | Тип K | |
| 1 | 25.08355 | |
| 2 | 7,860106×10 −2 | |
| 3 | -2,503131×10 −1 | |
| 4 | 8,315270×10 −2 | |
| 5 | −2 | |
| 6 | 9.804036×10 −4 | |
| 7 | -4.413030×10 −5 | |
| 8 | 1.057734×10 −6 | |
| 9 | -1,0527755 |
Для типичных металлов, используемых в термопарах, выходное напряжение увеличивается почти линейно с разностью температур (ΔT) в ограниченном диапазоне температур. Для точных измерений или измерений за пределами линейного температурного диапазона необходимо скорректировать нелинейность.Нелинейную зависимость между разностью температур (ΔT) и выходным напряжением (мВ) термопары можно аппроксимировать полиномом:
Коэффициенты a n даны для n от 0 до 5 и 13 в зависимости от металлов. В некоторых случаях лучшая точность достигается за счет дополнительных неполиномиальных членов (база данных термопар). База данных напряжения как функции температуры и коэффициентов для вычисления температуры из напряжения и наоборот для многих типов термопар доступна в Интернете (База данных термопар).
В современном оборудовании уравнение обычно реализуется в цифровом контроллере или сохраняется в справочной таблице; в старых устройствах используются аналоговые схемы.
Кусочно-линейные аппроксимации являются альтернативой полиномиальным поправкам (калибровка термопары).
Компенсация холодного спая
Термопары измеряют разницу температур между двумя точками, а не абсолютную температуру. Для измерения одной температуры один из спаев — обычно холодный спай — поддерживается при известной эталонной температуре, а другой спай — при температуре, которую необходимо измерить.
Наличие спая с известной температурой, хотя и полезно для лабораторной калибровки, неудобно для большинства приложений измерения и управления. Вместо этого они включают искусственный холодный спай с использованием термочувствительного устройства, такого как термистор или диод, для измерения температуры входных соединений на приборе, с особым вниманием к минимизации любого температурного градиента между клеммами. Следовательно, можно смоделировать напряжение от известного холодного спая и применить соответствующую поправку.Это называется компенсацией холодного спая.
Стоит отметить, что ЭДС (или напряжение) генерируется НЕ на стыке двух металлов термопары, а скорее на той части длины двух разнородных металлов, которая подвергается температурному градиенту.
В качестве альтернативы компенсация холодного спая может быть выполнена путем вычисления с использованием справочных таблиц (Бейкер) и полиномиальной интерполяции.
Производство электроэнергии
Термопара может вырабатывать ток, что означает, что ее можно использовать для непосредственного управления некоторыми процессами без необходимости в дополнительных схемах и источниках питания.Например, мощность от термопары может активировать клапан при возникновении разницы температур. Электрическая энергия, генерируемая термопарой, преобразуется из тепловой энергии, которая должна подаваться на горячую сторону для поддержания электрического потенциала. Непрерывный поток тепла необходим, потому что ток, протекающий через термопару, имеет тенденцию вызывать охлаждение горячей стороны и нагревание холодной стороны (эффект Пельтье).
Термопары могут быть соединены последовательно, образуя термобатарею, где все горячие спаи подвергаются более высокой температуре, а все холодные спаи — более низкой температуре.Выходной сигнал представляет собой сумму напряжений на отдельных переходах, что дает большее напряжение и выходную мощность. Используя радиоактивный распад трансурановых элементов в качестве источника тепла, эта схема использовалась для питания космических кораблей в миссиях, слишком далеких от Солнца, чтобы использовать солнечную энергию.
классы
Проволока для термопардоступна в нескольких различных металлургических составах для каждого типа, как правило, с пониженными уровнями точности и стоимости: специальные пределы погрешности, стандартные классы и классы удлинения.
Удлинительный провод
Удлинительные провода, изготовленные из тех же металлов, что и термопары более высокого класса, используются для подключения их к измерительному прибору на некотором расстоянии без создания дополнительных переходов между разнородными материалами, которые могли бы генерировать нежелательные напряжения; соединения с удлинительными проводами, изготовленные из аналогичных металлов, не генерируют напряжение. В случае платиновых термопар удлинительный провод представляет собой медный сплав, поскольку использование платины для удлинительных проводов было бы чрезмерно дорогим.Удлинительный провод должен иметь такой же тепловой коэффициент ЭДС, что и термопара, но только в узком диапазоне температур; это значительно снижает стоимость.
Прибор для измерения температуры должен иметь высокое входное сопротивление, чтобы предотвратить значительное потребление тока от термопары, чтобы предотвратить резистивное падение напряжения на проводе. Изменения в металлургии по длине термопары (такие как контактные полоски или замена провода термопары) приведут к появлению еще одного спая термопары, что повлияет на точность измерения.
Типы
Некоторые комбинации сплавов стали популярными в качестве промышленных стандартов. Выбор комбинации определяется стоимостью, доступностью, удобством, температурой плавления, химическими свойствами, стабильностью и производительностью. Разные типы лучше всего подходят для разных приложений. Их обычно выбирают в зависимости от необходимого температурного диапазона и чувствительности. Термопары с низкой чувствительностью (типы B, R и S) имеют соответственно более низкое разрешение. Другие критерии выбора включают инертность материала термопары и то, является ли он магнитным или нет.Стандартные типы термопар перечислены ниже, сначала положительный электрод, а затем отрицательный электрод.
К
Тип K (хромель – алюмель) является наиболее распространенной термопарой общего назначения с чувствительностью приблизительно 41 мкВ / ° C, положительной по хромелю относительно алюмеля (ASTM, 1974). Это недорогое устройство, и широкий выбор датчиков доступен в его диапазон от -200 ° C до +1350 ° C / от -328 ° F до +2462 ° F. Тип K был определен в то время, когда металлургия была менее развита, чем сегодня, и, следовательно, характеристики значительно различаются между образцами.Один из составляющих металлов, никель, является магнитным; Характерной чертой термопар, изготовленных из магнитного материала, является то, что они претерпевают ступенчатое изменение выходной мощности, когда магнитный материал достигает точки Кюри (около 354 ° C для термопар типа K).
E
Тип E (хромель-константан) имеет высокий выход (68 мкВ / ° C), что делает его хорошо подходящим для криогенного использования. Кроме того, он немагнитный.
Дж
Тип J (железо-константан) имеет более ограниченный диапазон, чем тип K (от -40 до +750 ° C), но более высокую чувствительность, около 55 мкВ / ° C.Точка Кюри утюга (770 ° C) (Бушоу) вызывает резкое изменение характеристики, определяющей верхний предел температуры.
N
Термопарытипа N (Nicrosil – Nisil) (никель-хром-кремний / никель-кремний) подходят для использования при высоких температурах, превышающих 1200 ° C, благодаря своей стабильности и способности противостоять высокотемпературному окислению. Чувствительность составляет около 39 мкВ / ° C при 900 ° C, что немного ниже, чем у типа K. Разработанный как улучшенный тип K, он становится все более популярным.
Платина типов B, R и S
В термопарахтипов B, R и S для каждого проводника используется платина или сплав платины с родием. Это одни из самых стабильных термопар, но они имеют более низкую чувствительность, чем другие типы, примерно 10 мкВ / ° C. Термопары типов B, R и S обычно используются только для высокотемпературных измерений из-за их высокой стоимости и низкой чувствительности.
В
Термопары типа B используют сплав платины с родием для каждого проводника. Один проводник содержит 30% родия, а другой проводник — 6% родия.Эти термопары подходят для использования при температуре до 1800 ° C. Термопары типа B производят такой же выходной сигнал при 0 ° C и 42 ° C, что ограничивает их использование ниже примерно 50 ° C.
R
В термопарах типа R используется платино-родиевый сплав, содержащий 13% родия для одного проводника и чистую платину для другого проводника. Термопары типа R используются до 1600 ° C.
ю.
Термопары типа S состоят из одного провода из 90% платины и 10% родия (положительный или «+») и второго провода из 100% платины (отрицательный или «-»).Как и тип R, термопары типа S используются до 1600 ° C. В частности, тип S используется в качестве эталона для калибровки температуры плавления золота (1064,43 ° C).
Т
Термопарытипа T (медь – константан) подходят для измерений в диапазоне от –200 до 350 ° C. Часто используется в качестве дифференциального измерения, так как к зондам соприкасается только медный провод. Поскольку оба проводника немагнитны, точка Кюри отсутствует и, следовательно, нет резкого изменения характеристик. Термопары типа T имеют чувствительность около 43 мкВ / ° C.
С
Термопары типа C (вольфрам 5% рения — вольфрам 26% рений) подходят для измерений в диапазоне от 0 ° C до 2320 ° C. Эта термопара хорошо подходит для вакуумных печей при чрезвычайно высоких температурах. Запрещается использовать его в присутствии кислорода при температуре выше 260 ° C.
M
В термопарахтипа M для каждой проволоки используется никелевый сплав. Положительный провод содержит 18% молибдена, а отрицательный провод содержит 0,8% кобальта. Эти термопары используются в вакуумных печах по тем же причинам, что и термопары типа C.Верхняя температура ограничена 1400 ° C. Он используется реже, чем другие типы.
Хромель-золото / железо
В термопарах хромель-золото / железо положительный провод выполнен из хромеля, а отрицательный провод — из золота с небольшой долей (0,03–0,15 атомных процента) железа. Его можно использовать в криогенных приложениях (1,2–300 К и даже до 600 К). И чувствительность, и диапазон температур зависят от концентрации железа. Чувствительность обычно составляет около 15 мкВ / К при низких температурах, а самая низкая используемая температура колеблется в пределах 1.2 и 4,2 К.
Сравнение термопар
В таблице ниже описаны свойства нескольких различных типов термопар. В столбцах допусков T представляет собой температуру горячего спая в градусах Цельсия. Например, термопара с допуском ± 0,0025 × T будет иметь допуск ± 2,5 ° C при 1000 ° C.
Термистор
Термистор NTC, шариковый, изолированные проводаТермистор — это тип резистора, сопротивление которого зависит от температуры.Слово представляет собой сумку из терморезистора и резистора . Термисторы широко используются в качестве ограничителей пускового тока, датчиков температуры, самовосстанавливающихся устройств защиты от перегрузки по току и саморегулирующихся нагревательных элементов.
Термисторы отличаются от резистивных датчиков температуры (RTD) тем, что в термисторе обычно используется керамика или полимер, а в RTD используются чистые металлы. Температурный отклик также отличается; RTD полезны в более широких диапазонах температур, тогда как термисторы обычно обеспечивают более высокую точность в ограниченном диапазоне температур [обычно от -90 ° C до 130 ° C].
Обозначение термистораЕсли предположить в качестве приближения первого порядка, что зависимость между сопротивлением и температурой является линейной, тогда:
где
- Δ R = изменение сопротивления
- Δ T = изменение температуры
- k = температурный коэффициент сопротивления первого порядка
Термисторы можно разделить на два типа, в зависимости от знака k .Если k положительный, сопротивление увеличивается с повышением температуры, и устройство называется термистором с положительным температурным коэффициентом ( PTC ) или позистором . Если k отрицательное, сопротивление уменьшается с повышением температуры, и устройство называется термистором с отрицательным температурным коэффициентом ( NTC ). Резисторы, которые не являются термисторами, имеют k как можно ближе к нулю (наименьшее возможное k), так что их сопротивление остается почти постоянным в широком диапазоне температур.
Вместо температурного коэффициента k иногда используется температурный коэффициент сопротивления α (альфа) или T . Он определяется как (США, датчик)
Например, для обычного датчика PT100 α = 0,00385 или 0,385% / ° C. Этот коэффициент α T не следует путать с параметром α ниже.
Уравнение Стейнхарта-Харта
На практике линейное приближение (см. Выше) работает только в небольшом диапазоне температур.Для точных измерений температуры необходимо более подробно описать кривую сопротивления / температуры устройства. Уравнение Стейнхарта-Харта — широко используемое приближение третьего порядка:
, где a , b и c называются параметрами Стейнхарта-Харта и должны указываться для каждого устройства. T — температура в кельвинах, а R — сопротивление в омах. Чтобы дать сопротивление как функцию температуры, приведенное выше можно преобразовать в:
где
- и
Ошибка в уравнении Стейнхарта-Харта обычно меньше 0.02 ° C при измерении температуры. Например, типичные значения термистора с сопротивлением 3000 Ом при комнатной температуре (25 ° C = 298,15 K) следующие:
Уравнение параметра B
ТермисторыNTC также можно охарактеризовать уравнением параметра B , которое по сути является уравнением Стейнхарта-Харта с c = 0 и B = 1/ b .
, где температуры указаны в кельвинах, а R 0 — сопротивление при температуре T 0 (обычно 25 ° C = 298.15 К). Решение относительно R дает:
или, альтернативно,
где. Это можно решить для температуры:
Уравнение B-параметра также можно записать в виде. Это можно использовать для преобразования зависимости сопротивления от температуры термистора в линейную функцию ln R от 1/ T . Затем средний наклон этой функции даст оценку значения параметра B .
Модель проводимости
Многие термисторы NTC изготавливаются из прессованного диска или литого кристалла полупроводника, такого как спеченный оксид металла. Они работают, потому что повышение температуры полупроводника увеличивает количество электронов, способных перемещаться и переносить заряд — это продвигает их в зону проводимости . Чем больше носителей заряда доступно, тем больший ток может проводить материал. Это описано в формуле:
I = электрический ток (амперы)
n = плотность носителей заряда (кол / м³)
A = площадь поперечного сечения материала (м²)
v = скорость носителей заряда (м / с)
e = заряд электрона (кулон)
Ток измеряется амперметром.При больших изменениях температуры необходима калибровка. При небольших изменениях температуры, если используется правильный полупроводник, сопротивление материала линейно пропорционально температуре. Существует множество различных полупроводниковых термисторов с диапазоном температур от 0,01 до 2000 кельвинов (от -273,14 до 1700 ° C).
Большинство термисторов PTC относятся к «переключающемуся», что означает, что их сопротивление внезапно возрастает при определенной критической температуре. Устройства изготовлены из легированной поликристаллической керамики, содержащей титанат бария (BaTiO 3 ) и другие соединения.Диэлектрическая проницаемость этого сегнетоэлектрического материала зависит от температуры. Ниже температуры точки Кюри высокая диэлектрическая проницаемость предотвращает образование потенциальных барьеров между зернами кристалла, что приводит к низкому сопротивлению. В этой области устройство имеет небольшой отрицательный температурный коэффициент. При температуре точки Кюри диэлектрическая проницаемость падает настолько, чтобы позволить образование потенциальных барьеров на границах зерен, и сопротивление резко возрастает.При еще более высоких температурах материал возвращается к NTC-поведению. Уравнения, используемые для моделирования этого поведения, были выведены У. Хейвангом и Г. Х. Джонкером в 1960-х годах.
Другой тип термистора PTC — это полимерный PTC, который продается под торговыми марками, такими как «Polyswitch», «Semifuse» и «Multifuse». Он состоит из пластика с вкрапленными в него частицами углерода. Когда пластик остынет, все зерна углерода контактируют друг с другом, образуя токопроводящий путь через устройство.Когда пластик нагревается, он расширяется, раздвигая зерна углерода и вызывая быстрое повышение сопротивления устройства. Как и термистор BaTiO 3 , это устройство имеет сильно нелинейный отклик сопротивления / температуры и используется для переключения, а не для пропорционального измерения температуры.
Еще одним типом термистора является силистор , термочувствительный кремниевый резистор. Силисторы сконструированы аналогично и работают по тем же принципам, что и другие термисторы, но в качестве материала полупроводниковых компонентов используется кремний.
Эффекты самонагрева
Когда через термистор протекает ток, он выделяет тепло, которое поднимает температуру термистора выше температуры окружающей среды. Если термистор используется для измерения температуры окружающей среды, этот электрический нагрев может привести к значительной погрешности, если не будет произведена коррекция. В качестве альтернативы можно использовать сам этот эффект. Он может, например, сделать чувствительное устройство для измерения расхода воздуха, используемое в приборе для измерения скорости набора планера, электронном вариометре или служить в качестве таймера для реле, как это раньше делалось на телефонных станциях.
Входная электрическая мощность термистора равна:
где I — ток, а В, — падение напряжения на термисторе. Эта энергия преобразуется в тепло, и эта тепловая энергия передается в окружающую среду. Скорость переноса хорошо описывается законом охлаждения Ньютона:
где T (R) — температура термистора как функция его сопротивления R , T 0 — температура окружающей среды, а K — постоянная рассеяния , обычно выражается в милливаттах на градус Цельсия.В состоянии равновесия две ставки должны быть равны.
Ток и напряжение на термисторе будут зависеть от конкретной конфигурации схемы. В качестве простого примера, если напряжение на термисторе остается фиксированным, то по закону Ома мы имеем I = В / R и уравнение равновесия может быть решено для температуры окружающей среды как функции измеренного сопротивления. термистора:
Константа рассеяния — это мера теплового соединения термистора с окружающей средой.Обычно он применяется для термистора в неподвижном воздухе и в хорошо перемешанном масле. Типичные значения для небольшого термистора со стеклянными шариками составляют 1,5 мВт / ° C в неподвижном воздухе и 6,0 мВт / ° C в перемешиваемом масле. Если температура окружающей среды известна заранее, то можно использовать термистор для измерения значения постоянной рассеяния. Например, термистор можно использовать в качестве датчика расхода, поскольку постоянная рассеяния увеличивается с увеличением скорости потока жидкости мимо термистора.
Приложения
- Термисторы PTC могут использоваться как токоограничивающие устройства для защиты цепей, как замена предохранителей.Ток через устройство вызывает небольшое резистивное нагревание. Если сила тока достаточно велика, чтобы генерировать больше тепла, чем устройство может потерять в окружающей среде, устройство нагревается, что приводит к увеличению его сопротивления и, следовательно, вызывает еще больший нагрев. Это создает эффект самоусиливания, который увеличивает сопротивление, уменьшая ток и напряжение, доступные устройству.
- Термисторы PTC используются в качестве таймеров в цепи катушки размагничивания ЭЛТ-дисплеев и телевизоров.При первоначальном включении устройства ток течет через термистор и катушку размагничивания. Катушка и термистор намеренно подобраны таким образом, чтобы протекающий ток нагревал термистор до точки, при которой катушка размагничивания отключилась менее чем за секунду.
- Термисторы NTC используются в качестве термометров сопротивления при низкотемпературных измерениях порядка 10 К.
- Термисторы NTC могут использоваться как устройства ограничения пускового тока в цепях питания. Первоначально они имеют более высокое сопротивление, что предотвращает протекание больших токов при включении, а затем нагреваются и становятся гораздо более низкими, чтобы обеспечить протекание более высокого тока во время нормальной работы.Эти термисторы обычно намного больше, чем термисторы измерительного типа, и специально предназначены для этого применения.
- Термисторы NTC регулярно используются в автомобильной промышленности. Например, они контролируют такие вещи, как температура охлаждающей жидкости и / или температура масла внутри двигателя, и передают данные в ЭБУ и, косвенно, на приборную панель. Их также можно использовать для контроля температуры инкубатора.
- Термисторы также широко используются в современных цифровых термостатах и для контроля температуры аккумуляторных блоков во время зарядки.
История
Первый термистор NTC был открыт в 1833 году Майклом Фарадеем, который сообщил о полупроводниковых свойствах сульфида серебра. Фарадей заметил, что сопротивление сульфида серебра резко снижается при повышении температуры. Поскольку первые термисторы было трудно производить, а применение этой технологии было ограниченным, коммерческое производство термисторов началось только в 1930-х годах (McGee, 1988).
Пирометр
Оптический пирометр Моряк проверяет температуру в вентиляционной системеПирометр — это бесконтактное устройство, которое улавливает и измеряет тепловое излучение, процесс, известный как пирометрия.Это устройство можно использовать для определения температуры поверхности объекта.
Слово пирометр происходит от греческого слова «πυρ» (пиро), обозначающего огонь, и «метр», означающего «измерять». Первоначально пирометр был придуман для обозначения устройства, способного измерять температуру объектов выше накала (то есть объектов, ярких для человеческого глаза).
Принцип действия
Пирометр имеет оптическую систему и детектор. Оптическая система фокусирует тепловое излучение на детектор.Выходной сигнал детектора (Температура T) связан с тепловым излучением или энергетической освещенностью j * целевого объекта через закон Стефана-Больцмана, константу пропорциональности σ, называемую постоянной Стефана-Больцмана и излучательной способностью. ε объекта.
Эти выходные данные используются для определения температуры объекта. Таким образом, нет необходимости в прямом контакте между пирометром и объектом, как в случае с термопарой и резистивным датчиком температуры (RTD).
Список литературы
- Р. П. Бенедикт (1984) Основы измерения температуры, давления и расхода , 3-е изд., ISBN 0-471-89383-8, стр. 5
- J. Lord (1994) Размеры ISBN 0 06 273228 5 стр. 293
- Т. Дункан (1973) Продвинутая физика: материалы и механика (Джон Мюррей, Лодон) ISBN 0 7195 2844 5
- Пиковые датчики эталонного термометра
- Измерение температуры — Часть 2: Термометры расширения. Раздел 2.1 Руководство по выбору и использованию жидкостного стеклянного термометра
- Технические примечания: Точность термопары. http://www.microlink.co.uk/tctable.html, accessdate = 2010-04-28.
- http://srdata.nist.gov/its90/main/|title=NIST ITS-90 — База данных термопар
- « Калибровка термопары , Microstar Laboratories»
- Бейкер, Бонни С. Проектирование встроенного температурного контура в соответствии с требованиями системы, Датчики. http://www.sensorsmag.com/sensors/tempera/designing-embedded-tempera-circuit-meet-system039s-requi-1089?print=1, 26.04.2010.
- Руководство по использованию термопар для измерения температуры. ASTM, 1974 г.
- Бушоу, К. Х. Дж. Энциклопедия материалов: наука и техника , Elsevier, 2001 ISBN 0-08-043152-6 стр. 5021 таблица 1
- Терминология термистора. Датчик США
- Томас, МакГи. Принципы и методы измерения температуры, глава 9. 1988 г.
Это запись из Википедии, ведущей энциклопедии, созданной пользователями. Возможно, он не был рецензирован профессиональными редакторами (см. Полный отказ от ответственности).
% PDF-1.5 % 165 0 obj> эндобдж xref 165 151 0000000016 00000 н. 0000004052 00000 н. 0000004254 00000 н. 0000003316 00000 н. 0000004305 00000 н. 0000004529 00000 н. 0000006101 00000 п. 0000007157 00000 н. 0000007397 00000 н. 0000008463 00000 н. 0000009652 00000 н. 0000009835 00000 н. 0000011014 00000 п. 0000012193 00000 п. 0000012368 00000 п. 0000012439 00000 п. 0000012523 00000 п. 0000012612 00000 п. 0000012712 00000 п. 0000012764 00000 п. 0000012878 00000 п. 0000012930 00000 п. 0000013047 00000 п. 0000013098 00000 п. 0000013208 00000 п. 0000013259 00000 п. 0000013368 00000 п. 0000013419 00000 п. 0000013509 00000 п. 0000013560 00000 п. 0000013688 00000 п. 0000013739 00000 п. 0000013877 00000 п. 0000013928 00000 п. 0000014064 00000 п. 0000014171 00000 п. 0000014345 00000 п. 0000014396 00000 п. 0000014487 00000 п. 0000014582 00000 п. 0000014682 00000 п. 0000014733 00000 п. 0000014907 00000 п. 0000014958 00000 п. 0000015044 00000 п. 0000015190 00000 п. 0000015377 00000 п. 0000015428 00000 п. 0000015512 00000 п. 0000015661 00000 п. 0000015712 00000 п. 0000015803 00000 п. 0000015888 00000 н. 0000016078 00000 п. 0000016129 00000 п. 0000016276 00000 п. 0000016395 00000 п. 0000016557 00000 п. 0000016608 00000 п. 0000016710 00000 п. 0000016805 00000 п. 0000016906 00000 п. 0000016964 00000 н. 0000017088 00000 п. 0000017145 00000 п. 0000017245 00000 п. 0000017303 00000 п. 0000017411 00000 п. 0000017469 00000 п. 0000017557 00000 п. 0000017614 00000 п. 0000017671 00000 п. 0000017795 00000 п. 0000017846 00000 п. 0000017931 00000 п. 0000018019 00000 п. 0000018160 00000 п. 0000018211 00000 п. 0000018296 00000 п. 0000018384 00000 п. 0000018435 00000 п. 0000018486 00000 п. 0000018537 00000 п. 0000018588 00000 п. 0000018639 00000 п. 0000018690 00000 п. 0000018775 00000 п. 0000018863 00000 п. 0000018997 00000 п. 0000019048 00000 н. 0000019133 00000 п. 0000019221 00000 п. 0000019272 00000 п. 0000019323 00000 п. 0000019374 00000 п. 0000019425 00000 п. 0000019476 00000 п. 0000019561 00000 п. 0000019649 00000 п. 0000019700 00000 п. 0000019751 00000 п. 0000019802 00000 п. 0000019853 00000 п. 0000019904 00000 п. 0000019955 00000 п. 0000020037 00000 н. 0000020183 00000 п. 0000020338 00000 п. 0000020389 00000 п. 0000020474 00000 п. 0000020562 00000 п. 0000020700 00000 п. 0000020751 00000 п. 0000020843 00000 п. 0000020983 00000 п. 0000021122 00000 п. 0000021173 00000 п. 0000021259 00000 п. 0000021347 00000 п. 0000021495 00000 п. 0000021546 00000 п. 0000021631 00000 п. 0000021719 00000 п. 0000021770 00000 п. 0000021821 00000 п. 0000021872 00000 п. 0000021977 00000 п. 0000022028 00000 п. 0000022079 00000 п. 0000022130 00000 п. 0000022252 00000 п. 0000022303 00000 п. 0000022354 00000 п. 0000022405 00000 п. 0000022456 00000 п. 0000022507 00000 п. 0000022615 00000 п. 0000022666 00000 п. 0000022717 00000 п. 0000022768 00000 п. 0000022819 00000 п. 0000022870 00000 п. 0000022921 00000 п. 0000022972 00000 п. 0000023096 00000 п. 0000023198 00000 п. 0000023249 00000 п. 0000023430 00000 п. 0000023481 00000 п. 0000023532 00000 п. 0000023583 00000 п. трейлер ] >> startxref 0 %% EOF 168 0 obj> поток xb«b` | bl @
Цинк (произносится / ˈzɪŋk /, от немецкого: Zink ) представляет собой металлический химический элемент с символом Zn и атомным номером 30.В некоторых исторических и скульптурных контекстах он известен (или был) как spelter . Рекомендуемые дополнительные знанияИзвестные характеристикиЦинк — это металл серо-голубого цвета с умеренной реакционной способностью, который тускнеет на влажном воздухе и горит на воздухе ярким голубовато-зеленым пламенем, выделяя шлейфы оксида цинка. Реагирует с кислотами, щелочами и другими неметаллами.Если цинк не является полностью чистым, он реагирует с разбавленными кислотами с выделением водорода. Обычная степень окисления цинка +2. При температуре от 100 ° C до 210 ° C (от 212 ° F до 410 ° F) металлический цинк является ковким и легко поддается обработке в различных формах. При температуре выше 210 ° C (410 ° F) металл становится хрупким и превращается в порошок при ударах. Цинк немагнитен. ИсторияВ древней Индии производство металлического цинка было очень распространенным явлением. Многие рудники Заварских рудников, недалеко от Удайпура, Раджастхан; -Завармаала были активны даже в течение 1300–1000 гг. До н.э.В Чарака Самхите (300 г. до н.э.) есть упоминания о лечебном использовании цинка. Rasaratna Samuccaya (800 г. н.э.) объясняет существование двух типов руд металлического цинка, одна из которых идеальна для добычи металла, а другая используется в лечебных целях. [ необходима ссылка ] Цинковые сплавы использовались веками, поскольку изделия из латуни, датируемые 1400–1000 гг. До н.э., были найдены в Израиле, а предметы из цинка с 87% цинком были найдены в доисторической Трансильвании. Из-за низкой температуры кипения и высокой химической активности этого металла (изолированный цинк будет скорее подниматься по дымоходу, чем захватываться), истинная природа этого металла не была понята в древние времена. Производство латуни было известно Эби примерно в 30 г. до н.э., при этом использовалась технология, при которой каламин и медь нагревались вместе в тигле. Оксиды цинка в каламине были восстановлены, а свободный металлический цинк был захвачен медью, образуя сплав. Полученная в результате каламиновая латунь была отлита или откована в форме. Плавка и извлечение нечистых форм цинка были осуществлены еще в 1000 году нашей эры в Индии и Китае. На Западе нечистый цинк как остаток в плавильных печах был известен с древних времен, но обычно выбрасывался как бесполезный.Страбон упоминает его как псевдоаргуро — «имитация серебра». Таблетка из цинка в Берне — вотивная табличка, датируемая римской Галлией, вероятно, сделанная из таких остатков цинка. Металлический цинк на ЗападеМеталлург Андреас Либавиус получил в 1597 году количество металлического цинка в чистом виде, ранее неизвестного на Западе. Либавиус определил, что это индийский / малабарский свинец. Парацельсу (1516 г.) приписывают название цинк . Его регулярно ввозили в Европу с Востока в 17 веке, но иногда он был очень дорогим. Выделение металлического цинка на Западе могло быть достигнуто независимо несколькими людьми:
До открытия технологии флотации сульфида цинка каламин был минеральным источником металлического цинка. Биологическая рольЦинк — важный элемент, необходимый для поддержания жизни.Подсчитано, что 3000 из сотен тысяч белков человеческого тела содержат цинковые простетические группы, одним из видов которых является так называемый цинковый палец. Кроме того, в организме человека существует более десятка типов клеток, которые выделяют ионы цинка, и роль этих секретируемых сигналов цинка в медицине и здоровье в настоящее время активно изучается. Ионы цинка теперь считаются нейротрансмиттерами. Клетки слюнной железы, простаты, иммунной системы и кишечника — это другие типы клеток, которые выделяют цинк. [ необходимая ссылка ] Цинк является активатором некоторых ферментов, таких как карбоангидраза. Карбоангидраза играет важную роль в транспортировке углекислого газа в крови позвоночных. Он также необходим растениям для формирования листьев, синтеза индолуксусной кислоты (ауксина) и анаэробного дыхания (спиртового брожения). [ необходима ссылка ] Источники питанияЦинк содержится в устрицах и в гораздо меньшей степени в большинстве белков животного происхождения, бобах, орехах, миндале, цельнозерновых, тыквенных и подсолнечных семенах. [2] Шея индейки и говяжий патрон или голень также содержат хорошее количество цинка. Известно, что фитаты, содержащиеся в цельнозерновом хлебе, крупах, бобовых и других продуктах, снижают абсорбцию цинка. Клинические исследования показали, что цинк в сочетании с антиоксидантами может замедлить прогрессирование возрастной дегенерации желтого пятна. [3] Также недавно было показано, что значительное потребление цинка с пищей препятствует возникновению гриппа. [ необходима ссылка ] «Сохранение почвы» анализирует поглощение естественным цинком растениями во многих типах почв. Рекомендуемая (США) доза цинка в период полового созревания составляет 11 мг для мужчин и 8 мг для женщин, при этом более высокие дозы рекомендуются во время беременности и кормления грудью. Дефицит цинка
Дефицит цинка возникает в результате недостаточного потребления цинка или недостаточного усвоения цинка организмом.Признаки дефицита цинка включают выпадение волос, поражения кожи, диарею и истощение тканей тела. Зрение, вкус, запах и память также связаны с цинком. Недостаток цинка может вызвать сбои в работе этих органов и функций. Врожденные аномалии, вызывающие дефицит цинка, могут привести к заболеванию, называемому энтеропатическим акродерматитом. Получение достаточного количества цинка во время беременности и у детей младшего возраста является очень реальной проблемой, особенно для тех, кто не может позволить себе хорошее и разнообразное питание.Развитие мозга задерживается из-за недостаточности цинка в утробе матери и в молодости. Редко признается, что недостаток цинка может способствовать появлению прыщей. Лейконихия, пурпурные пятна на ногтях, часто являются признаком дефицита цинка. Недостаток цинка как причина нервной анорексии
Дефицит цинка вызывает снижение аппетита, что может перерасти в нервную анорексию (НА).Нарушения аппетита, в свою очередь, вызывают недоедание и, в частности, недостаточное потребление цинка. Бакан пропагандирует использование цинка для лечения нервной анорексии с 1979 года. По крайней мере, 15 исследований показали, что цинк улучшает набор веса при анорексии. Рандомизированное двойное слепое плацебо-контролируемое исследование 1994 года показало, что цинк (14 мг в день) удваивал скорость увеличения массы тела при лечении нервной анорексии (НА). Дефицит других питательных веществ, таких как тирозин и триптофан (предшественники нейромедиаторов моноаминов, норэпинефрина и серотонина, соответственно), а также витамина B1 (тиамин) могут способствовать этому явлению недоедания, вызванного недоеданием. [4] Токсичность цинкаНесмотря на то, что цинк является важным требованием для здорового организма, слишком много цинка может быть вредным. Чрезмерное всасывание цинка также может подавлять всасывание меди и железа. Свободный ион цинка в растворе очень токсичен для растений, беспозвоночных и даже позвоночных рыб. Модель активности свободных ионов (FIAM) хорошо известна в литературе и показывает, что только микромолярные количества свободных ионов убивают некоторые организмы. Недавний пример показал, что 6 микромолей убивают 93% всех дафний в воде. [5] Проглатывание одного цента США после 1982 года (97,5% цинка) также может вызвать повреждение слизистой оболочки желудка из-за высокой растворимости иона цинка в кислой среде желудка. [6] Отравление цинком, в основном в виде проглатывания грошей США, отчеканенных после 1982 года, обычно приводит к летальному исходу у собак, вызывая тяжелую гемолитическую анемию. [7] Для домашних попугаев цинк очень токсичен, и отравление часто может быть смертельным [8] . Имеются свидетельства индуцированного дефицита меди при низком потреблении 100–300 мг Zn / сут.Рекомендуемая суточная норма USDA составляет 15 мг Zn / сут. Даже более низкие уровни, близкие к рекомендуемой суточной норме, могут препятствовать использованию меди и железа или отрицательно влиять на холестерин. [9] . Иммунная система
Соли цинка эффективны против патогенов при прямом применении. Гастроэнтерит сильно ослабляется при приеме цинка внутрь, и этот эффект может быть вызван прямым антимикробным действием ионов цинка в желудочно-кишечном тракте или абсорбцией цинка и его повторным высвобождением из иммунных клеток (все гранулоциты выделяют цинк), или и тем, и другим. . [10] [11] В клинических испытаниях было показано, что и глюконат цинка, и глюконат глицин (состав, используемый в лепешках) сокращают продолжительность симптомов простуды. [12] Количество глицина может варьироваться от двух до двадцати моль на моль глюконата цинка. Изобилие
Цинк — 23-й по содержанию элемент в земной коре. Наиболее интенсивно добываемые руды (сфалерит) обычно содержат примерно 10% железа, а также 40–50% цинка.Минералы, из которых извлекается цинк, включают сфалерит (сульфид цинка), смитсонит (карбонат цинка), гемиморфит (силикат цинка) и франклинит (цинковая шпинель). По оценкам, на Земле имеется 46-летний запас цинка. [13] Добыча и переработка цинкаВо всем мире есть цинковые рудники, крупнейшими производителями которых являются Китай, Австралия и Перу. По данным Британской геологической службы, в 2005 году Китай произвел почти четверть мирового производства цинка.Горнодобывающие и нефтеперерабатывающие заводы в Европе включают Umicore в Бельгии, Tara, Galmoy и Lisheen в Ирландии и Zinkgruvan в Швеции. Металлический цинк получают с помощью экстрактивной металлургии. Минералы сульфида цинка (сфалерита) концентрируются с использованием метода пенной флотации, а затем обычно обжигаются с использованием пирометаллургии для окисления сульфида цинка до оксида цинка. Оксид цинка выщелачивается до сульфата цинка (ZnSO 4 ) в несколько стадий с повышением концентрации серной кислоты (H 2 SO 4 ).Железо обычно отвергают как ярозит или гетит, одновременно удаляя другие примеси. При окончательной очистке используется цинковая пыль для удаления меди, кадмия и кобальта на двух-трех различных стадиях. Затем металл извлекается из очищенного раствора сульфата цинка электролитическим извлечением в виде катодных отложений на алюминиевых листах. Цинковые катоды могут быть непосредственно отлиты или легированы алюминием. Электролитные растворы сульфата цинка должны быть очень чистыми, чтобы электролитическое извлечение было хоть сколько-нибудь эффективным.Примеси могут настолько изменить напряжение разложения, что электролизная ячейка производит в основном газообразный водород, а не металлический цинк. [14] Существует два общих процесса электролитического извлечения металла: процесс с низкой плотностью тока и процесс Tainton с высокой плотностью тока . В первом в качестве электолита используется 10% раствор серной кислоты с плотностью тока 270–325 ампер на квадратный метр. Последний использует в качестве электролита 22–28% раствор серной кислоты с плотностью тока около 1000 ампер на квадратный метр.Последний дает лучшую чистоту и имеет более высокую производительность на единицу объема электролита, но имеет тот недостаток, что он более горячий и вызывает большую коррозию емкости, в которой это делается. В любом из электролитических процессов каждая метрическая тонна производства цинка расходует около 3900 кВт · ч (14 МДж) электроэнергии. [14] Существует также несколько пирометаллургических процессов, которые восстанавливают оксид цинка с использованием углерода, а затем отгоняют металлический цинк из полученной смеси в атмосфере моноксида углерода.К ним относятся процесс с горизонтальной ретортой бельгийского типа , процесс с непрерывной вертикальной ретортой New Jersey Zinc и электротермический процесс компании St. Joseph Lead Company . Бельгийский процесс требует повторной дистилляции для удаления примесей свинца, кадмия, железа, меди и мышьяка. В процессе в Нью-Джерси используется ректификационная колонна, которая отсутствует в бельгийском процессе, которая отделяет отдельные примеси, где они могут быть проданы в качестве побочных продуктов. Св.В процессе компании Joseph Lead Company смесь оксида цинка и кокса нагревается за счет пропускания через нее электрического тока, а не путем сжигания угля или газа. [14] Другой пирометаллургический процесс — это взвешенная плавка. Затем получают оксид цинка, который обычно дает цинк более низкого качества, чем при гидрометаллургическом процессе. Обработка оксидом цинка имеет гораздо меньше применений, но высокосортные месторождения были успешными в производстве цинка из оксидов цинка и карбонатов цинка с использованием гидрометаллургии. СплавыНаиболее широко используемым сплавом цинка является латунь, в которой медь легирована цинком от 9% до 45%, в зависимости от типа латуни, а также гораздо меньшими количествами свинца и олова. Сплавы из 85–88% цинка, 4–10% меди и 2–8% алюминия находят ограниченное применение в определенных типах подшипников машин. Сплавы, состоящие в основном из цинка с небольшими количествами меди, алюминия и магния, используются при литье под давлением. Примером этого является цинк-алюминий. Подобные сплавы с добавлением небольшого количества свинца можно холоднокатать в листы.Сплав, состоящий из 96% цинка и 4% алюминия, используется для изготовления штампов для небольших производственных циклов, когда штампы из черных металлов были бы слишком дорогими. [14] Соединения
Оксид цинка, пожалуй, самое известное и наиболее широко используемое соединение цинка, поскольку оно является хорошей основой для белых пигментов в краске. Он также находит промышленное применение в резиновой промышленности и продается как непрозрачный солнцезащитный крем. Множество других соединений цинка находят промышленное применение, например хлорид цинка (в дезодорантах), пиритион цинка (шампуни от перхоти), сульфид цинка (в люминесцентных красках) и метил цинка или диэтил цинка в органических лабораториях.Примерно четверть всего производимого цинка потребляется в виде соединений цинка. Изотопы
Встречающийся в природе цинк состоит из 5 стабильных изотопов 64 Zn, 66 Zn, 67 Zn, 68 Zn и 70 Zn, из которых 64 Zn является наиболее распространенным (48,6% естественное изобилие). Был охарактеризован 21 радиоизотоп, наиболее распространенный и стабильный — это 65 Zn с периодом полураспада 244.26 дней и 72 Zn с периодом полураспада 46,5 часов. Все оставшиеся радиоактивные изотопы имеют период полураспада менее 14 часов, а у большинства из них период полураспада менее 1 секунды. Этот элемент также имеет 4 мета состояния. Цинк был предложен в качестве «соляного» материала для ядерного оружия (кобальт — еще один, более известный солевой материал). Оболочка из обогащенного изотопами 64 Zn, облученная интенсивным потоком нейтронов высокой энергии от взрывающегося термоядерного оружия, преобразуется в радиоактивный изотоп Zn-65 с периодом полураспада 244 дня и производит приблизительно 2.27 МэВ гамма-излучения, что на несколько дней значительно увеличивает радиоактивность радиоактивных осадков. Неизвестно, что такое оружие когда-либо было построено, испытано или использовано. Меры предосторожностиМеталлический цинк не считается токсичным, но свободные ионы цинка в растворе (например, ионы меди или железа) очень токсичны. Существует также состояние, называемое цинковые встряски или цинковые озноб (см. Лихорадка от дыма металла), которое может быть вызвано вдыханием свежеобразованного оксида цинка, образовавшегося во время сварки оцинкованных материалов. a b c d Samans, Carl H .: Engineering Metals and их сплавов MacMillan 1949 | ||||||||||||||||||||||||||||||||||||||||||||||||||||
Организация военной экономики | Международная энциклопедия Первой мировой войны (WW1)
Введение ↑
С началом войны в 1914 году глобальное экономическое развитие и интеграция были прерваны и отброшены назад, а региональные модели были серьезно искажены боевыми действиями, миграциями и перекройкой границ.Глобальная экономика стала фрагментированной, и ее национальные единицы начали движение к самостоятельности и автаркии. Европейские страны, основные воюющие стороны в конфликте, претерпели масштабные преобразования, включая широкое государственное регулирование, замену рыночных механизмов администрацией государственных чиновников и рост технократии. Эти изменения предвосхитили появление управляемой государством экономики коммунистического и фашистского типов, а также множества новых демократий в межвоенный период.Когда война закончилась в 1918 году, институциональная структура экономики большинства европейских стран резко отличалась от того, что существовало до войны.
Первоначально, однако, начало военных действий не оказало немедленного воздействия на структуры европейских экономик. Несмотря на мобилизацию большого контингента новобранцев и прекращение внешней торговли между воюющими странами, экономика большинства европейских стран продолжала работать, как прежде, приспосабливаясь к реалиям военного времени.Правительства расширили свои уставные полномочия; но, за исключением нескольких чрезвычайных мер, большинство государственных органов не заявили о намерении нарушить повседневную экономическую жизнь. Многие европейцы (но не все), как государственные деятели, так и простые люди, думали, что война может закончиться через два-три месяца или самое позднее к Рождеству. Мало кто предвидел масштабные изменения в экономике и обществе, к которым в конечном итоге приведет война, хотя люди во внутренних кругах власти могли быть лучше информированы.
В преддверии столетия появилось много новых исследований экономической истории, анализирующих войну, в частности, The Economics of World War I , под редакцией Стивена Бродберри и Марка Харрисона. [1] Здесь мы объединим многие выводы из недавней литературы и введем наши собственные научные работы в повествование о Великой войне. Более того, в этой статье мы сначала обсудим мобилизацию различных народов на войну. Затем мы обсуждаем пример Германии как способ анализа специфики и ограничений мобилизации.В качестве примера мы выбрали опыт Германии, поскольку здесь легко узнать соответствующие экономические механизмы; мобилизация отозвала значительную часть рабочей силы, а производство вооружений потребовало значительных производственных мощностей в секторе капитала и потребительских товаров. В отличие от своих врагов, Германия и ее союзники были почти полностью окружены своими врагами, а королевский флот блокировал морские торговые пути, что делало невозможной компенсацию производственных потерь.Анализ завершается обсуждением роли экономических ресурсов в исходе и стоимости этого конфликта.
Мобилизация на войну ↑
Мобилизация для Первой мировой войны на начальном этапе включала мобилизацию войск и основных институтов для ведения войны. Для Германии, считавшейся главным зачинщиком конфликта, последовательные кампании против Франции и России представляли единственную стратегию, которая могла принести победу в ситуации геополитического окружения враждебными державами.Возможность того, что конфликт затянется и Германии и ее союзнику Австро-Венгрии придется вести войну на истощение на двух фронтах, не принималась во внимание. Германский император Вильгельм II (1859-1941) и его окружение считали, что такого исхода можно избежать. [2]
Однако с самого начала дела Центральных держав пошли не так. Первой политической неудачей стало вступление Великобритании 4 августа в войну на стороне союзников. Хотя было известно, что Великобритания не примет нарушение немцами бельгийского нейтралитета в случае войны, немецкие правители не верили, что британцы будут сражаться против них.Вмешательство Великобритании в войну на стороне союзников серьезно помешало планам Германии. Это имело два основных последствия для последующих экономических преобразований.
Во-первых, быстрое развертывание британского экспедиционного корпуса на континенте помогло французской армии противостоять немецкому наступлению. В битве при Марне в сентябре 1914 года союзники остановили продвижение немецких войск, заставив их отступить. После нескольких недель «гонки к морю», в которой обе стороны пытались обойти друг друга, войска укрылись в окопах, и Западный фронт стабилизировался.Ожидаемая короткая война не материализовалась; конфликт превратился из маневренной войны в позиционную.
Во-вторых, уже в августе 1914 года британское правительство объявило морскую блокаду немецких портов. Если на первом этапе войны блокада ограничивалась поиском и конфискацией «абсолютной контрабанды» (оружия и боеприпасов), в начале следующего года союзники решили прекратить все поставки в порты Центральных держав и из них. включая «условную контрабанду» (продукты питания, фураж, топливо, одежда) и даже товары из так называемого «бесплатного списка» (сырье, такое как руда, хлопок и удобрения).Был принят широкий спектр мер по минимизации поставок из Германии через нейтральные страны (Нидерланды, Швеция, Норвегия, Дания и Швейцария). В ответ германское правительство прибегло к неограниченной подводной войне против торговых судов союзников. Эти события наложили серьезные ограничения на поставку ресурсов, доступных воюющим странам. [3]
Однако наиболее выдающиеся изменения произошли в требованиях современной войны. К 1914 году военная техника, доступная армиям, значительно продвинулась вперед.Введение скорострельной артиллерии и пулеметов в конце 19 -го века привело к революционным изменениям в логистике. Одиночный пулемет «Виккерс» стрелял патронами со скоростью 600 патронов в минуту, количество боеприпасов, которые ранее были выпущены половиной батальона военнослужащих. Общий объем необходимых ежедневных запасов увеличился в двенадцать раз. [4] Запасы боеприпасов, накопленные до войны, были исчерпаны за считанные месяцы. Одна за другой европейские страны столкнулись с задачей масштабной экономической реорганизации своих экономик для военного производства.Спрос можно было удовлетворить только за счет большего производства, большего импорта и меньшего потребления. [5]
Экономическая мобилизация европейских стран развернулась на четырех основных аренах. Первой и самой неотложной экономической проблемой было производство оружия и боеприпасов. В ранний период войны все крупные европейские армии испытывали катастрофическую нехватку боеприпасов или «снарядный кризис». В последующие месяцы спрос на боеприпасы продолжал расти. Властям пришлось принять чрезвычайные меры для организации крупномасштабного производства боеприпасов.Вторая задача заключалась в получении необходимого сырья для производства боеприпасов. Экспоненциальный рост производства боеприпасов и материалов пропорционально увеличил спрос на сырье. В некоторых странах производители полагались на внутренние ресурсы, тогда как в других странах производители привлекали значительную часть ресурсов с международных рынков. В любом случае производители и власти должны были обеспечить бесперебойные поставки связанного с войной сырья, что было нелегкой задачей.Третья задача заключалась в мобилизации промышленной рабочей силы. С началом войны большинство рабочих было мобилизовано в армию. Война привела к серьезным перебоям в трудовых ресурсах и создала дополнительную нагрузку на трудовые отношения. По мере того, как рыночные механизмы стали неэффективными, властям пришлось прибегнуть к административным методам распределения рабочей силы, включая (в некоторых случаях) промышленную тягу. Четвертой задачей было распределение еды. Задача заготовки для армии и городского населения оказалась серьезнейшим вызовом для государственных менеджеров в большинстве стран.Продолжающиеся боевые действия привели к уменьшению количества продуктов на рынках. По мере развития войны государственным властям приходилось использовать централизованные методы мобилизации и распределения продовольствия, такие как реквизиция провизии и нормирование основных продуктов питания.
К концу войны большинство экономических институтов европейских стран приобрели государственнический и коллективистский характер. Тотальная война создала современное национальное государство, занимающее центральное место на этапе экономических, социальных, идеологических и других отношений.Представления о государстве, экономике и обществе как об отдельных и независимых институтах устарели. Государство регулирования стало охватывать почти все в общественной жизни многих европейских стран. Если и существовала разница в интеграции государства, экономики и общества в разных странах, то это была вариация на верхнем уровне шкалы. [6]
Великобритания продемонстрировала хороший пример управляемой государством промышленной мобилизации. Здесь государственный контроль преобразовал экономический порядок из либеральной экономики свободной торговли в регулируемое государство всеобщего благосостояния.Тем не менее, в Великобритании массовое государственное вмешательство не могло и не имело целью подорвать преимущественно рыночную структуру управления. Бюрократы в Министерстве боеприпасов, которое стало центральным агентством, управляющим экономической мобилизацией, создали горы правил, но они не контролировали повседневную деятельность частных фирм. Основными формами государственного вмешательства были кооптация и координация, а не командование и принуждение. Привлекая новых производителей к военному производству, строя новые общественные предприятия и закупая боеприпасы за рубежом, правительство непреднамеренно способствовало децентрализации отрасли и спонсировало конкуренцию между производителями.Точно так же не исчез рыночный механизм операций с сырьем; Государственный контроль в этой сфере был воспринят как вынужденная и временная мера. По возможности правительство избегало прямого принуждения в трудовых отношениях. Он не вводил ничего похожего на австрийскую или немецкую систему обязательной государственной службы. В течение первых двух лет войны правительство практически воздерживалось от вмешательства в продовольственные вопросы. В отличие от всех основных континентальных стран, Великобритания никогда не устанавливала полную монополию на зерно.Нормирование некоторых других продуктов было введено всего за пять месяцев до окончания войны. Подводя итог, можно сказать, что британская промышленность функционировала как капиталистическая рыночная экономика, а не как управляемая экономика. [7]
Многие из этих остаточных капиталистических черт полностью применимы к французской экономике военного времени. Французская экономика больше, чем любая другая экономическая система, продемонстрировала пример самомобилизации и самоорганизации капиталистического класса. Хотя мобилизация промышленности спонсировалась правительством, сами промышленники стали играть главную роль в организации массового производства оружия и боеприпасов.Французские институты распределения ресурсов, консорциумы, представляли собой слабую и временную версию корпоративной организации. По инициативе иностранных агентств (британских и американских экспортеров) консорциумы просуществовали очень недолго. Французский рынок труда сохранил «свободу заключения контрактов» (за исключением отозванных рабочих и военнопленных). Рабочие могли уйти с предприятия по своему желанию. Они также могут требовать более высокого вознаграждения и лучших условий труда (хотя и индивидуально, но не коллективно).В течение примерно трех лет войны французские власти ограничивались очень немногими мерами регулирования пищевых продуктов, в основном регулированием цен на некоторые продукты питания. Из-за большого импорта продуктов питания из-за границы не представлялось необходимости в более решительных мерах по контролю за продуктами питания. Только в конце 1917 года правительство ввело монополию на зерно и нормирование хлеба. [8]
Если Франция и Великобритания оставались в значительной степени либеральными государствами, несмотря на войну, институты таких государств, как Германия, Австро-Венгрия и Россия, приняли гораздо более отчетливый этатистский дизайн.В области производства и распределения продуктов питания Германия была преобразована в Zwangswirtschaft (принудительную экономику), в которой рыночные силы полностью подчинялись власти менеджеров. В целом, в 1916-1918 годах промышленная экономика Германии действовала скорее как командная система, чем как рыночная экономика. [9] В Австро-Венгрии все основные мастерские по производству боеприпасов и горнодобывающие предприятия контролировались военными директорами. Эти директора, в свою очередь, контролировались инспекторами военного министерства.По инициативе немецких властей австро-венгерское правительство разработало централизованную систему распределения сырья, хотя, в отличие от немецких сырьевых корпораций, австрийцы не имели юридических и финансовых гарантий со стороны государства. Правительство Австро-Венгрии ввело промышленный призыв мужского населения (хотя и с многочисленными исключениями) в первые дни войны. По сравнению с Германией, австрийская акция произошла намного раньше и, по словам Джеймса Р.Вегс, это была более эффективная договоренность. [10] Рыночный механизм распределения продуктов питания также в значительной степени был заменен административной системой. Правительство ввело монополию на зерно, а также установило нормирование на хлеб и другие основные продукты питания. В последние два года войны армия сама начала реквизицию продуктов питания в сельской местности. Тем не менее к 1918 году массовый голод стал реальностью. [11]
В России процесс институционального слияния монополий и государства достиг своей конечной фазы: в некоторых секторах не только государство взяло на себя распределение материальных средств, но, будучи единственным покупателем продукции, государство начало управлять всем процессом. производства.С другой стороны, российская система государственно-корпоративного регулирования была менее развита в организационном плане и была менее комплексной, чем немецкая модель. Как руководители промышленной мобилизации, российское военно-бюрократическое государство и класс национальных капиталистов оказались одновременно слабыми и неэффективными. Из-за слабости государства и широкой оппозиции общества о милитаризации рабочей силы не могло быть и речи. Несмотря на серьезные усилия по установлению контролируемой государством экономики в сфере снабжения продовольствием, эти усилия, по сравнению с аналогичными мерами, введенными в Германии и Австро-Венгрии, были предприняты слишком поздно, были плохо реализованы и оказались совершенно неэффективными.В конечном итоге эти регулятивные усилия привели к институциональному ступору. Война укрепила существующие тенденции к командной экономике, но произвела на свет командира. [12] В конце концов, российская система функционировала как командная экономика, но с плохо функционирующей и распадающейся структурой. [13]
Экономическая система Соединенных Штатов, страны, которая оставалась нейтральной на протяжении большей части боевых действий, представляет собой интересный контрастный случай. Хотя Америка служила «арсеналу демократии», она не претерпела столь радикальных изменений в своей экономической структуре, как европейские страны.Из-за удаленности от поля боя и короткой продолжительности военного вмешательства (с апреля 1917 г. по ноябрь 1918 г.) его экономическая мобилизация не имела ощущения срочности и надлежащей организации. Большинство организационных нововведений военного времени, внесенных федеральным правительством (например, национализация железных дорог), были политически противоречивыми и явно предназначались как временные. Тем не менее, попытки регулировать экономику с использованием централизованного контроля цен и производства, предпринятые Советом по военной промышленности и Управлением по продовольствию, ознаменовали значительный сдвиг в сторону корпоративизма в экономических отношениях Америки.Из-за потока федеральных расходов, финансируемых за счет выпуска «облигаций свободы», повышения налогов и печатания денег, вступление страны в войну вызвало бум в американской экономике. От конфликта выиграли крупный бизнес и большое количество мелких предпринимателей. Война поставила Соединенные Штаты в положение ведущей экономической державы мира. В результате Соединенные Штаты также стали страной-кредитором, финансируя часть военных действий союзников за счет займов и материальной помощи. [14]
Мобилизация сельского хозяйства и промышленности в Германии во время войны ↑
Для более подробного изучения результатов перераспределения ресурсов и общей нехватки ресурсов мы более внимательно рассмотрим пример Германии, который, возможно, наиболее четко отображает эти характеристики. В течение десятилетия, предшествовавшего Первой мировой войне, Германия пережила стремительную трансформацию своей экономики. В период с 1871 по 1913 год доход на душу населения в Германии вырос более чем на 70 процентов, а городское население увеличилось с 11.От 8 до 35,9 процента. [15] Чтобы идти в ногу с растущим спросом на продукты питания, особенно на такие высококачественные продукты, как мясо и молочные продукты, сельское хозяйство Германии впоследствии отказалось от производства продуктов питания и превратилось в переработку продуктов питания. Все больше и больше кормов для животных, удобрений и других промежуточных продуктов, а также продуктов питания для людей импортировалось для удовлетворения растущего спроса. Основными импортируемыми товарами были российский ячмень, зерно из США и норвежская рыбная мука.Кроме того, сырье, такое как чилийская селитра, было важным сырьем как для военной промышленности, так и для сельского хозяйства. [16] Однако, несмотря на все технические и технологические усовершенствования, доля занятых в сельском хозяйстве Германии составляла 56 и 47 процентов в 1849 и 1890 годах, соответственно, и снизилась примерно до 35 процентов в 1913 году. Накануне Первой мировой войны сельское хозяйство Германии все еще зависело от огромной рабочей силы по сравнению с более современной экономикой.Соответствующие британские данные показывают, что только 8,1 процента рабочей силы было занято в сельском хозяйстве, что свидетельствует о том, что другие более развитые страны заменили рабочую силу машинами и другими капитальными вложениями. [18]
Британская военно-морская блокада не помешала полностью германской внешней торговле, но ввоз продуктов питания, удобрений, сезонных рабочих и кормов для животных через Северное и Балтийское моря был ограничен, поскольку многие соседние европейские страны стали врагами.Помимо блокады, важные торговые партнеры прекратили или сократили свои поставки, поскольку столкнулись с аналогичными проблемами, как Германия, или стали противниками. [19] Таблица 1 иллюстрирует импорт товаров с 1916 по 1918 год. Немецкий импорт молочных продуктов снизился примерно на 80 процентов, импорт мяса упал на 87-96 процентов, а импорт муки — на 95 и 80 процентов, соответственно. [20]
| 1918 | ||||||||
| 1916 | 1917 | янв.по июнь | с июля по ноябрь г. | |||||
| Импорт | Экспорт | Импорт | Экспорт | Импорт | Экспорт | Импорт | Экспорт | |
| Зерна | 20 063 | 617 | 3089 | 492 | 989 | 694 | 7 333 | 153 |
| Мука | 682 | 9 018 | 229 | 2 069 | 138 | 3 090 | 279 | 298 |
| Крупный рогатый скот (количество) | 29 686 | 48 | 19 699 | 79 | 9 690 | 35 | 14 502 | 43 |
| Свиньи (количество) | 322 | 114 | 116 | 216 | 33 | 3.3 | 549 | 32 |
| Мясо | 5,778 | 853 | 1848 | 557 | 244 | 450 | 260 | 6 |
| Сливочное масло | 7 978 | 158 | 3 513 | 118 | 1 492 | 45 | 1239 | 38 |
| Масло и жиры растительные | 791 | 23 | 148 | 17 | 19 | 7.7 | 37,2 | 1,7 |
| Маргарин | 555 | 22 | 106 | 78 | 2,1 | 0,1 | 0,4 | 0,4 |
| Сыр | 6 553 | 20 | 3 187 | 21 | 1 258 | 23 | 1269 | 55 |
| Рыба | 17 573 | 300 | 5 416 | 115 | 2,278 | 192 | 2229 | 99 |
Таблица 1: Германский импорт и экспорт сельскохозяйственной продукции, 1916-1918 гг. [21]
Огромное крестьянское население Германии оказалось препятствием для производства продуктов питания в военной экономике.Усилия по мобилизации перенаправляли ресурсы из сельского хозяйства, и фермеры предпочитали накапливать продукты питания, а не продавать их по низким ценам, и откладывали важные инвестиции в свой основной капитал из-за роста цен на капитальные товары и неопределенности в отношении ожидаемых доходов. [22] Оставшиеся ресурсы были впоследствии перераспределены в соответствии с изменениями спроса военной экономики. Например, общая мобилизация отвлекла примерно 40 процентов мужской рабочей силы из сельскохозяйственного сектора Германии.Кроме того, количество сезонных рабочих упало с примерно 0,44 миллиона в 1913 году до примерно 0,15 миллиона в 1918 году. Власти пытались пополнить оставшуюся рабочую силу женщинами, детьми, военнопленными и рабочими из других отраслей. Число военнопленных выросло с 0,7 миллиона в 1916 году до 0,9 миллиона в 1918 году, но из-за организационных проблем и необходимости надзора за заключенными эти трудозатраты очень мало способствовали преодолению нехватки рабочей силы. Более того, военнопленные, женщины, подростки и дети практически не обучались, а военнопленным особенно не хватало мотивации.Ситуация стала настолько сложной, что немецким властям пришлось отправить сельскохозяйственных рабочих и землевладельцев в отпуск на родину, чтобы они могли помочь с уборкой урожая. Одна из стратегий предусматривала перераспределение промышленных рабочих из городских районов в сельскохозяйственный сектор. Однако земледельцы не решались воспользоваться этой возможностью, поскольку горожане, как правило, не имели навыков, необходимых в сельском хозяйстве, и опасались посягательств профсоюзов. [23] Число безработных характеризует нехватку рабочей силы в военной экономике: после первоначального повышения уровня безработицы после начала войны безработица снизилась до 3.2 процента в 1915 году, 2,2 в 1916 году, 1,0 в 1917 году и 0,8 процента в январе и октябре 1918 года. [24] Помимо нехватки рабочей силы, большое количество рабочих животных, таких как крупный рогатый скот и лошади, направлялось на военные поставки и могло нельзя использовать для производства или потребления. [25]
Помимо нехватки рабочей силы, было несколько секторов, конкурирующих за один из самых важных ресурсов войны: азот. Азот использовался как удобрение в сельском хозяйстве и как основа для взрывчатых веществ в военной промышленности.Когда началась война, немецкие власти, очевидно, ожидали, что конфликт продлится всего недели или несколько месяцев. Когда власти осознали свою неспособность достичь этой цели, они были вынуждены перераспределить запасы азота на производство взрывчатых веществ. Эта дискриминация в отношении сельского хозяйства была одним из решающих факторов, объясняющих глубокий спад сельскохозяйственного производства в Германии. [26]
График 1: Оценки экономической активности (ВВП, ВНП) в Германии, 1913–1918 гг. [27]
На диаграмме 1 представлен обзор ряда оценок ВВП Германии за период с 1913 по 1918 год.В среднем ВВП, похоже, снизился примерно на 20–30 процентов, при этом наиболее благоприятная оценка указывает на 12-процентное сокращение между 1913 и 1918 годами. Менее благоприятная оценка предполагает, что ВВП Германии упал на 43 процента во время войны. За тот же период доля государственных расходов по отношению к ВВП выросла с 10 до 59 процентов, оставив меньшую долю от общего ВВП для негосударственного потребления. [28]
Нехватка ресурсов в целом и потери военных ресурсов во время боевых действий в 1916 году привели к разработке программы Hindenburg-Programm .В августе 1916 года новое Верховное главнокомандование под руководством Пауля фон Гинденбурга (1847–1934) и Эриха Людендорфа (1865–1937) начало масштабную кампанию по военному производству, известную как программа «тотальной мобилизации». К власти пришли новые командиры, полные решимости идти в ногу с Антантой «человек за человека и ружье за ружье». [29] Взяв за основу уровень августа 1916 г., Гинденбург потребовал, чтобы к маю 1917 г. промышленность удвоила ежемесячный выпуск пороха до 12 000 тонн, легкой артиллерии до 3 000 штук и утроила производство пулеметов до 7 000.Планы по производству самолетов, в которых Германия сильно отставала от Великобритании и Франции, позже были установлены на уровне 1000 двигателей и 1000 самолетов в месяц. [30] Закон о вспомогательной службе от 5 декабря установил призыв всех мужчин в возрасте от семнадцати до шестидесяти лет для гражданской военной службы. Недавно созданное Верховное военное министерство, которому было поручено реализовать программу, было поручено продвигать ее с пониманием того, что «финансовые и другие оговорки больше не могут рассматриваться». [31] Правительство покрывает производственные затраты и выплачивает промышленникам фиксированную норму прибыли. Эта договоренность, известная как система «затраты плюс прибыль», знаменует собой заметный отход от операционных схем, принятых в рыночных производственных отношениях. Такие договоренности обычно ассоциируются с постоянными переговорами и экономией на мягких бюджетных ограничениях, характерных для государственно-социалистических стран. Хотя экономика Германии все еще была далека от этих преобразований, введение системы «затраты плюс прибыль» и всеобщий призыв рабочей силы представляли собой решающие шаги на пути к контролируемой государством командной экономике.
Что касается распределения этих истощающихся ресурсов, несколько показателей подтверждают, что производственные ресурсы были перераспределены в пользу отраслей, связанных с войной, за счет гражданской промышленности. Если исследовать отрасли по их важности для военных действий, станет ясно, что производство в отраслях, связанных с войной, снижалось только временно до 1916 года. В 1917 и 1918 годах производство в отраслях, связанных с войной, превышало довоенный уровень; горнодобывающая промышленность, производство чугуна и стали, а также производство цветных металлов снизились незначительно или даже увеличились.Менее жизнеспособные отрасли, способствующие усилению военных действий Германии, резко сократились: производство зерновых и строительных материалов упало до 57 и 35 процентов от довоенного уровня, а текстильное производство сократилось только до 17 процентов от довоенного уровня. Количество работников по секторам и соответствующий уровень заработной платы также свидетельствуют о быстро меняющемся спросе на рабочую силу. Общая занятость в промышленности снизилась примерно на 10 процентов; с 7,4 до 6,6 миллиона с 1913 по 1918 год. Предложение мужской рабочей силы испытало самое сильное сокращение (-25.8 процентов), а занятость женщин увеличилась на 45,6 процента. Гражданская промышленность потеряла примерно 40 процентов своей рабочей силы, промежуточные отрасли потеряли примерно 21 процент, в то время как отрасли, связанные с войной, увеличили свою рабочую силу примерно на 44,1 процента во время войны. [32]
Ввиду этой нехватки потребность в дополнительной рабочей силе была высокой, что отражается в заработной плате, выплачиваемой в соответствующих отраслях. Заработная плата, отражающая предельную производительность труда, может помочь получить обзор благосостояния работников в отдельных отраслях.Работодатели были готовы повышать заработную плату не только для того, чтобы перевесить инфляцию, но, главным образом, для преодоления нехватки рабочей силы. Абсолютная заработная плата увеличилась во всех отраслях, перечисленных в Графике 2, а это означает, что интерпретировать рост заработной платы как индикатор перераспределения ресурсов было бы слишком просто. Более подходящим показателем для получения обзора различий между отраслями будет относительная динамика заработной платы, а именно заработная плата, выплачиваемая в определенной отрасли, относительно динамики заработной платы в целом. Заработная плата в отраслях, производящих товары в основном для гражданского потребления, такие как текстиль, кожа, резина, напитки, продукты питания и табак, росла пропорционально меньше, в то время как заработная плата в отраслях, связанных с войной, росла непропорционально высокими темпами. [33]
График 2: Относительная заработная плата в Германии по отраслям по сравнению со средним показателем по стране, 1914-1918 гг. [34]
Аналогичная информация была получена Йоргом Батеном и Райнером Шульцем [35] , которые отслеживают реальную прибыль корпораций в период с 1913 по 1917 год. Их результаты показывают, что по сравнению с довоенным уровнем прибыль в отраслях, связанных с войной, увеличилась на 27 процентов. до 1916 года и 14 процентов до 1917 года. В отличие от результатов [36] Альбрехта Ритшля, эти авторы обнаружили, что отрасли, относящиеся к войне со средним значением, сократились на 59 процентов, в то время как прибыль «гражданских» отраслей снизилась только на 49 процентов. [37] Связанные с войной отрасли, такие как химическая, металлургическая и машиностроительная отрасли, испытали значительный рост прибыли, в то время как прибыль в пищевой (включая табак) и текстильной промышленности упала почти вдвое по сравнению с 1913 годом. В свою очередь, инфляция была безудержной. (см. график 3).
График 3: Оценки (официальной) продовольственной инфляции в Германии с 1914 по 1918 год [38]
25 января 1915 года в Германии была введена всеобъемлющая государственная система снабжения и распределения продуктов питания. Бундесрат объявил государственную монополию на все зерновые в стране. Он приказал, чтобы все существующие склады пшеницы, ржи и других злаков находились в ведении Imperial Grain Corporation. Лишь небольшие количества зерна менее 100 кг и посевной материал могли оставаться в частной собственности. К 5 февраля 1915 года все владельцы зерна были обязаны декларировать и сдавать свои запасы местным властям. Любой, кто отказывался или был признан виновным в даче ложных или неполных заявлений, был бы наказан шестимесячным тюремным заключением или штрафом в размере 1500 марок.
Правительство обещало заплатить фиксированную цену за все экспроприированное зерно. Все мельницы должны были перемалывать зерно, которое корпорация отправляла им. Мука, находившаяся в собственности корпорации, будет поставляться муниципальным властям, армейским и военно-морским управлениям и только им. Стоимость доставки муки была установлена административным органом района, в котором находилась мельница, с учетом первоначальной цены плюс цена за помол.Мельница была обязана доставлять муку в пункты назначения, определенные властями. Регулирование распределения зерна было передано Имперскому распределительному центру ( Reichsverteilungsstelle ), который был уполномочен распределять зерно по местным муниципалитетам в соответствии с их населением до следующего урожая. Была запрещена свободная торговля зерном и мукой. Нормирование хлеба было введено в Берлине в январе 1915 года и распространено на остальную часть страны в июне. [39] В карточке на хлеб разрешалось выпивать два килограмма хлеба на человека в неделю. [40] Впоследствии были введены системы нормирования на большинство продуктов питания. В 1916 году недельное пособие на человека составляло примерно следующее: 3,5 килограмма картофеля, 160-220 граммов муки, 100-250 граммов мяса, от шестидесяти до семидесяти пяти граммов жиров, семь литров молока, 200 граммов сахара. 270 граммов пасты, содержащей сахар, одно яйцо и 120 граммов рыбы. [41]
Некоторые данные свидетельствуют о том, что на рационы приходилась только часть продуктов питания, потребляемых в период введения системы нормирования.Во-первых, в зависимости от индивидуальных характеристик и рабочей нагрузки калории, поступающие через систему нормирования, обеспечивали от 49 до 74 процентов потребности в энергии. [42] Черные рынки были важным источником дополнительных продуктов питания и оставшейся территории, где рыночные механизмы могли координировать спрос и предложение. В таблице 2 представлены свидетельства из города Эссен. Динамика цен на ряд товаров предполагает, что как официальные, так и неофициальные цены на продукты питания значительно выросли с 1916 по 1918 год.Также на каждый год указывается соотношение неофициальных цен на продукты питания к официальным. Это соотношение свидетельствует о том, что в целом неофициальные цены выросли больше, чем официальные цены, ограниченные ценовыми потолками, что создало стимулы для фермеров продавать свою продукцию нелегально через черные рынки вместо того, чтобы продавать ее через официальные каналы. В сельских районах в непосредственной близости от ферм было лучше, поскольку потребители в сельской местности имели лучший и более дешевый доступ к продуктам питания. Регионам вдоль основных водных путей пришлось столкнуться с ограниченными возможностями импорта. [43]
| 1916 | 1917 | 1918 | ||||||||
| Продукт | Агрегат | официальный | неофициально | соотношение | официальный | неофициально | соотношение | официальный | неофициально | передаточное отношение |
| Пшеничная мука | кг | 0.57 | 5,35 | 9,38 | 0,58 | 8,02 | 13,82 | 0,65 | 11,76 | 18,09 |
| Картофель | кг | 0,14 | 0,64 | 4,58 | 0,22 | 0,96 | 4,37 | 0,28 | 1,82 | 6.49 |
| Говядина | кг | 5,12 | 10,69 | 2,09 | 4,75 | 17,10 | 3,60 | 4,67 | 21,38 | 4,58 |
| Маргарин | кг | 4,03 | 10,69 | 2,65 | 4,00 | 27.79 | 6,95 | 4,00 | 27,79 | 6,95 |
| Сахар | кг | 0,64 | 2,67 | 4,18 | 0,68 | 9,62 | 14,15 | 0,90 | 16,04 | 17,82 |
| Яйца | за штуку | 0.30 | 0,96 | 3,21 | 0,36 | 3,74 | 10,39 | 0,42 | 5,35 | 12,73 |
| Молоко | Литр | 0,31 | 1,07 | 3,45 | 0,41 | 2,14 | 5,21 | 0,53 | 5,35 | 10.09 |
Таблица 2: Динамика официальных и неофициальных цен на продовольствие в городе Эссен, 1916-18 гг. (В марках) [44]
График 4 показывает реальную заработную плату в Германии за период 1900-1918 гг. Номинальная заработная плата и стоимость жизни в Германии до 1914 года развивались параллельно, что привело к латеральной тенденции реальной заработной платы за этот период. В результате нехватки рабочей силы и необходимости компенсировать рабочим инфляцию продовольствия, номинальная заработная плата увеличилась в ходе войны.Валовая заработная плата увеличилась в нескольких секторах, при этом транспорт, металлургия и химическая промышленность являются наиболее прибыльными для рабочих. [45] Однако, несмотря на общую тенденцию к росту номинальной заработной платы, покупательная способность, измеряемая реальной заработной платой, не увеличивалась, а, скорее, постоянно снижалась из-за непропорциональной продовольственной инфляции.
График 4: Реальная заработная плата в Германии, 1900-1918 гг. [46]
Экономические ресурсы и исход войны ↑
В конечном счете, Первая мировая война была определена экономическими ресурсами.Как указал Найл Фергюсон, Германия не обязательно неправильно распорядилась всеми своими ресурсами и, таким образом, проиграла войну. [47] Напротив; у союзников было огромное преимущество с точки зрения общего ВВП, населения, военного персонала, производства вооружений и поставок продовольствия на протяжении всего конфликта; ситуация, которая стала еще более очевидной, когда Соединенные Штаты, наконец, вступили в войну на их стороне. В ноябре 1914 года под контролем союзников находилось 793 миллиона человек по сравнению с 151 миллионом человек в Центральных державах.К концу войны общая численность населения союзников составляла 1,272 миллиона человек (70 процентов от общей численности населения мира), в то время как общая численность населения Центральных держав все еще составляла менее 200 миллионов человек. Более того, с точки зрения совокупного ВВП союзники обладали совокупным ВВП в 1,761 миллиарда на конец войны, что намного превосходило менее чем 400 миллиардов, которые имели центральные державы в 1915 году. [48] Это преимущество стало даже равным. более непропорционально, поскольку война продолжалась. [49]
Великие державы союзников в конечном итоге смогли более эффективно мобилизовать свои ресурсы во время войны.Несмотря на то, что центральные державы изначально неплохо справлялись с имеющимися у них ограниченными ресурсами, союзники смогли лучше мобилизовать свои намного превосходящие ресурсы как в тылу, так и на передовой. Их более демократические институты поддерживали требования тотальной войны лучше, чем их авторитарные коллеги. Таким образом, более богатые страны мобилизовали больше людей и техники для войны, и их военная промышленность оказалась способной адаптироваться к потребностям военной машины. Более того, наличие большого крестьянского населения оказалось препятствием для производства продуктов питания в условиях военного времени.Как мы показали, в более бедных странах и даже в богатой Германии мобилизационные усилия выкачивали ресурсы из сельского хозяйства, и фермеры предпочитали накапливать продукты питания, а не продавать их по низким ценам. Как утверждал Авнер Оффер, еда (или ее отсутствие) сыграла решающую роль в крахе Германии. [50] Как видно из таблицы 3, проблема Германии заключалась не столько в том, что она не могла мобилизовать ресурсы для войны, сколько в том, что ее главный союзник, Австро-Венгрия, была бедной страной с ограниченными ресурсами и страдала от бедствий. из-за неспособности эффективно мобилизоваться.Коллективная мобилизация ресурсов союзниками была слишком большим препятствием, которое Германия не могла преодолеть.
| Год и переменная | Германия | Великобритания | Франция | Австро-Венгрия | Россия | США |
| ВВП на душу населения | ||||||
| 1914 | 3 059 | 4.927 | 3 236 | 2 876 | 1,488 * | 4 799 |
| 1918 г. | 2 983 | 5,459 | 2396 | 2,555 | .. | 5 659 |
| Военная нагрузка | ||||||
| 1914 | 14,90 | 14,15 | 10.36 | 30,2 | .. | 0,90 |
| 1918 г. | 38,80 | 27,00 | 59,39 | 17,2 * | .. | 8,05 |
| Доля защиты | ||||||
| 1914 | 54,86 | 64,62 | 60,10 | .. | .. | 47,97 |
| 1918 г. | 51,61 | 54,89 | 77,65 | .. | .. | 48,50 |
| Военнослужащие (в% от населения) | ||||||
| 1914 | 1,30 | 1,16 | 1,99 | 1,60 | 0,78 | 0.17 |
| 1918 г. | 13,70 | 9,10 | 13,59 | 1,54 | 6,12 * | 2,81 |
Таблица 3: Экономический потенциал и военная мобилизация великих держав в 1914 и 1918 годах [51]
* В отсутствие данных, показатель за предыдущий год использовался для иллюстрации уровня мобилизации. Военная нагрузка = военные расходы ВВП, в процентах. Доля обороны = военные расходы центрального / федерального государственного бюджета, в процентах
Одно из измерений, которое иллюстрирует важность ресурсов в войне, касается общих масштабов конфликта.Было подсчитано, что около 9 миллионов комбатантов и 12 миллионов мирных жителей погибли во время так называемой Великой войны, при этом был нанесен значительный материальный ущерб, особенно во Франции, Бельгии и Польше. На нижнем уровне, по оценкам Рондо Кэмерона и Ларри Нила, прямые финансовые потери, возникшие в результате Великой войны, составили 180-230 миллиардов (1914 долларов США), тогда как косвенные потери собственности и капитала выросли до более чем 150 миллиардов долларов. [52] Согласно некоторым более поздним оценкам, общие экономические потери от войны могли достигать 525 миллиардов 1914 долларов США. [53] Страны, потерявшие больше всего жизней, были непосредственно вовлечены в боевые действия. Например, небольшие страны, такие как Сербия-Черногория и Румыния, потеряли в результате конфликта 5,7 и 3,3 процента своего населения. Турция, Франция и Германия также потеряли более трех процентов своего населения. Наибольшее количество боевых смертей в абсолютном выражении пришлось на Россию, всего 1,8 миллиона человек. Потери союзников были более существенными, чем потери центральных держав, 5,4 миллиона против четырех миллионов.
Таким образом, экономические процессы, способность нести потери и мобилизация оказали решающее влияние на исход войны. Экономическая дезорганизация в России, Австро-Венгрии и Германии в конечном итоге привела к падению этих государств. Экономическая дезорганизация, вызванная войной, проявилась в серьезных перебоях в снабжении продовольствием и в кризисах, связанных с существованием. Во «внутренних» странах, которые оказались в условиях экономической блокады (например, в России, Австро-Венгрии и Германии) условия жизни были хуже, чем в «внешних» странах, которые сохранили свободный доступ к мировой экономике и импорту из-за рубежа (Великобритания и Франция).В этих странах экономические протесты на завершающем этапе войны превратились в массовые движения против войны и существующих политических режимов. Под воздействием ухудшения экономических и социальных условий значительные слои правящих классов и армии отказались от поддержки правителей и встали на сторону оппозиции.
Россия была первой европейской державой, потерпевшей крах во время войны. Тем не менее, в процессе социально-экономической дезинтеграции, вызвавшей этот распад, мало что было конкретно русским.За два года войны экономическая система России смогла относительно хорошо справиться с многочисленными проблемами и узкими местами в экономической мобилизации. [54] Однако зимой 1916-1917 гг. Система снабжения продовольствием развалилась. Он сломался, потому что правительство не смогло создать эффективный механизм мобилизации и распределения сельскохозяйственных ресурсов. В Петрограде, как и в других крупных городах, удручающее положение с хлебом, возможно, можно было бы временно облегчить, если бы власти установили систему нормирования продуктов питания.Однако поставки хлеба сокращались так быстро, что власти не успели принять необходимые меры. Тяжелые социальные условия вызвали забастовки, продовольственные бунты и протесты в Петрограде и других крупных городах. В конце февраля 1917 г. в столице прошли массовые демонстрации. К восставшим присоединились солдаты петроградского гарнизона. Когда регулярная армия отказалась подавить восстание, царское самодержавие пало. Временное правительство, сформированное из депутатов Государственной Думы, оказалось неспособным остановить войну из-за обязательств России перед союзниками.Это не могло решить и сложные экономические проблемы страны. В конце концов, в октябре 1917 года она была свергнута большевиками, радикальной социалистической партией, которая всего за год до этого была практически неизвестна большинству россиян. Большевистской диктатуре пришлось пройти критическое испытание на выживание в опустошенной стране в условиях гражданской войны, внешней изоляции и постоянного страха перед агрессией и восстановлением старого режима. [55]
Как и ее главный герой, Россия, Германия оказалась в условиях экономической блокады, которая серьезно ограничила ее способность привлекать ресурсы, в том числе продовольствие, из-за границы. [56] Внутренние возможности для увеличения производства и компенсации потерь импорта были ограничены. Как и в других странах, находящихся в условиях блокады, зимой 1916-17 годов в немецких городах обрушился серьезный экономический кризис. К тому времени уже не хватало хлеба. Продовольственный кризис усугублялся очень плохим урожаем картофеля, который традиционно составлял большую часть немецкого рациона, особенно среди рабочего класса. Качество большей части еды было очень плохим.Различные Ersatzprodukte (продукты-заменители) заменили привычный рацион. Хлеб Ersatz ( K-brot ), приготовленный с большим добавлением картофельной муки, стал основным продуктом питания. Кофе готовили из коры дерева; перец содержал 85 процентов золы; молоко и пиво разбавляли водой. К концу войны насчитывалось около 11000 эрзаца, продуктов. [57]
Ключевым отличием немецкого Kaiserreich от России было то, что немецкое военно-бюрократическое государство было более эффективно в административном отношении, чем коррумпированное и бездействующее российское самодержавие.К концу войны военно-бюрократическая диктатура Гинденбурга и Людендорфа преуспела в подавлении и подчинении рабочего класса и маргинализации политической оппозиции. Следовательно, распад государства мог быть возможен только с распадом военного учреждения. Военные поражения Германии на Западном фронте летом и осенью 1918 года стали решающими событиями, вызвавшими процессы дезинтеграции. Как только авторитет Верховного Главнокомандования был подорван, социальные протесты стали неконтролируемыми.На флоте началось антивоенное восстание, но вскоре его поддержали рабочие и обнищавшее, измученное войной гражданское население. Учитывая масштабы ноябрьского восстания и затруднительное положение армии, военное подавление было исключено. Как только монарх потерял поддержку армии, он был вынужден уйти в отставку. Временное правительство, как и в России 1917 года, столкнулось с серьезным политическим вызовом со стороны левых радикалов. Однако тотальный крах государства, как и в России, был предотвращен соглашением между новым правительством и военным командованием.В начале 1919 года, опираясь на помощь военизированных формирований ( Freikorps ), правительство Фридриха Эберта (1871-1925) смогло подавить радикальные революционные силы, рецентрализовать немецкое государство, принять новую конституцию и заложить основы институциональные основы новой экономической и политической системы. [58]
Заключение ↑
Способность эффективно мобилизоваться для затяжного конфликта и возможность командовать значительными ресурсами были ключевыми факторами в победе в войне.Таким образом, у союзников было преимущество, которое в конечном итоге принесло им победу. Что касается последствий, отдельные участники Первой мировой войны разработали различные решения, чтобы заплатить за огромное бремя войны. Германия и Франция были менее склонны облагать налогом свое население, чтобы платить за военные усилия. Однако Великобритания финансировала конфликт, используя различные налоги в дополнение к другим средствам (а именно, заимствованиям). Война стала огромным потрясением, в частности, для западных экономик, поскольку она подорвала международную торговую систему и золотой стандарт.Инфляция также была большой проблемой, и большинство участников ввели контроль над ценами и заработной платой, а также системы нормирования. [59]
Чтобы максимизировать военное производство, как только стало очевидно, что война продлится намного дольше, чем первоначально предполагали генералы, большинство стран пригласили бизнесменов на государственную службу, обычно для надзора за цепочками поставок и планами мобилизации. Корпоративный подход, который зародился в 1920-х годах в Италии Бенито Муссолини (1883-1945), был введен уже во время войны, хотя и в более ограниченной форме, и крупный бизнес на некоторое время закрепился в государственных закупках.Таким образом, это было началом так называемого военно-промышленного комплекса в его современном виде. [60] Первая мировая война стала переломным моментом для европейских обществ и военных учреждений во многих отношениях, по крайней мере, до Второй мировой войны.
Маттиас Блюм, Королевский университет Белфаста
Яри Элоранта, Государственный университет Аппалачей и Университет Ювяскюля
Павел Осинский, Аппалачский государственный университет
Редактор раздела: Пьер Пурсигль
серповидно-клеточных тестов | Лабораторные тесты онлайн
Источники, использованные в текущем обзоре
Гемоглобин S, Скрининг, Клиническая информация крови.Клиника Мэйо, Медицинские лаборатории Мэйо. Доступно в Интернете по адресу http://www.mayomedicallaboratories.com/interpretive-guide/?alpha=H&unit_code=9180. По состоянию на январь 2017 г.
Лихтин, А.Е. (октябрь 2013 г.). Серповидно-клеточная анемия. Руководство Merck Professional Version. Доступно в Интернете по адресу http://www.merckmanuals.com/professional/hemology-and-oncology/anemias-caused-by-hemolysis/sickle-cell-disease. По состоянию на январь 2017 г.
Герстен Т. (Обновлено 1 февраля 2016 г.). Серповидноклеточная анемия.Медицинская энциклопедия MedlinePlus. Доступно в Интернете по адресу http://www.nlm.nih.gov/medlineplus/ency/article/000527.htm. По состоянию на январь 2017 г.
Герстен Т. (Обновлено 11 февраля 2016 г.). Серповидноклеточный тест. Медицинская энциклопедия MedlinePlus. Доступно в Интернете по адресу http://www.nlm.nih.gov/medlineplus/ency/article/003666.htm. По состоянию на январь 2017 г.
(обновлено 31 августа 2016 г.). Серповидно-клеточная анемия. Центры по контролю и профилактике заболеваний. Доступно в Интернете по адресу http://www.cdc.gov/ncbddd/sicklecell/treatments.html. По состоянию на январь 2017 г.
Maakaron, J.E. (обновлено 3 октября 2016 г.). Обследование при серповидно-клеточной анемии. Medscape. Доступно в Интернете по адресу http://emedicine.medscape.com/article/205926-workup. По состоянию на январь 2017 г.
Персонал клиники Мэйо. (2016 29 декабря). Серповидноклеточная анемия. Диагностика. Доступно в Интернете по адресу http://www.mayoclinic.org/diseases-conditions/sickle-cell-anemia/diagnosis-treatment/diagnosis/dxc-20303501. По состоянию на январь 2017 г.
(обновлено в январе 2017 г.). Гемоглобинопатии.Аруп Консалт. Доступно в Интернете по адресу https://arupconsult.com/content/hemoglobinopathies?tab=tab_item-2. По состоянию на январь 2017 г.
Источники, использованные в предыдущих обзорах
(май 2006 г.). Что такое серповидноклеточная анемия. Информационный центр Национального института сердца, легких и крови [Он-лайн информация]. Доступно в Интернете по адресу http://www.nhlbi.nih.gov/health/dci/Diseases/Sca/SCA_WhatIs.html.
Бендер, М.А. (7 марта 2006 г., обновлено). Серповидно-клеточная анемия. GeneReviews [Он-лайн информация].Доступно в Интернете по адресу http://www.genetests.org.
(© 2006). Оценка гемоглобина. Руководство ARUP по клиническим лабораторным исследованиям [он-лайн информация]. Доступно в Интернете по адресу http://www.aruplab.com/guides/clt/tests/clt_a307.jsp#1150784.
(2004). Интерпретация результатов скрининга гемоглобина новорожденных. Департамент общественного здравоохранения штата Мичиган [Он-лайн информация]. Доступно на сайте http://www.michigan.gov.
(август 2004 г.). Серповидно-клеточная анемия. Марш десятицентовиков, Краткие справочные информационные бюллетени [он-лайн информация].Доступно в Интернете по адресу http://www.marchofdimes.com/professionals/681_1221.asp.
Радж А. и Бертолоне С. (Обновлено 9 июля 2009 г.). Серповидноклеточная анемия. eMedicine [Он-лайн информация]. Доступно в Интернете по адресу http://emedicine.medscape.com/article/958614-overview. По состоянию на сентябрь 2009 г.
Бендер М. А. и Хоббс В. (Обновлено 6 августа 2009 г.). GeneReviews по серповидно-клеточной болезни [Он-лайн информация]. Доступно в Интернете по адресу http://www.ncbi.nlm.nih.gov/bookshelf/br.fcgi?book=gene∂=sickle.По состоянию на сентябрь 2009 г.
Hildreth, C. et. al. (10 декабря 2008 г.). Серповидно-клеточная васкулопатия. ДЖАМА. 2008; 300 (22): 2690 [Он-лайн информация]. PDF-файл доступен для загрузки по адресу http://jama.ama-assn.org/cgi/reprint/300/22/2690.pdf. По состоянию на сентябрь 2009 г.
Персонал клиники Мэйо (1 апреля 2009 г.). Серповидноклеточная анемия. MayoClinic.com [Он-лайн информация]. Доступно в Интернете по адресу http://www.mayoclinic.com/health/sickle-cell-anemia/DS00324/METHOD=print. По состоянию на сентябрь 2009 г.
(февраль 2008 г.).Серповидно-клеточная анемия. Информационные бюллетени March of Dimes [Он-лайн информация]. Доступно в Интернете по адресу http://www.marchofdimes.com/professionals/14332_1221.asp. По состоянию на сентябрь 2009 г.
(проверено 9 июня 2009 г.). Серповидноклеточная болезнь: 10 вещей, которые вам нужно знать. CDC [Он-лайн информация]. Доступно в Интернете по адресу http://www.cdc.gov/Features/Sicklecell/. По состоянию на сентябрь 2009 г.
(август 2008 г.). Серповидноклеточная анемия. Национальный институт сердца, легких и крови [Он-лайн информация]. Доступно в Интернете по адресу http: // www.nhlbi.nih.gov/health/dci/Diseases/Sca/SCA_WhatIs.html. По состоянию на сентябрь 2009 г.
Пагана, К. Д. и Пагана, Т. Дж. (© 2007). Справочник по диагностическим и лабораторным испытаниям Мосби, 8-е издание: Mosby, Inc., Сент-Луис, Миссури. С. 523-525.
Кларк В. и Дюфур Д. Р., редакторы (© 2006). Современная практика клинической химии: AACC Press, Вашингтон, округ Колумбия. С. 219-223.
Ву, А. (© 2006). Клиническое руководство Tietz по лабораторным испытаниям, 4-е издание: Saunders Elsevier, Сент-Луис, Миссури.Стр. 518-521.
(5 октября 2009 г.) National Guideline Clearinghouse. Скрининг на серповидно-клеточную анемию у новорожденных: рекомендация Целевой группы по профилактическим службам США. Доступно в Интернете по адресу http://www.guideline.gov/summary/summary.aspx?doc_id=11371&nbr=005908&string=sickle+AND+cell+AND+anemia. По состоянию на октябрь 2009 г.
Серповидноклеточная анемия. (Обновлено 7 февраля 2012 г.). Медицинская энциклопедия MedlinePlus. Доступно в Интернете по адресу http://www.nlm.nih.gov/medlineplus/ency/article/000527.htm. По состоянию на август 2013 г.
Серповидноклеточная болезнь. (Обновлено 15 сентября 2011 г.). Центры по контролю и профилактике заболеваний. Доступно в Интернете по адресу http://www.cdc.gov/ncbddd/sicklecell/treatments.html. По состоянию на август 2013 г.
Серповидноклеточный тест. (Обновлено 28 февраля 2011 г.). Медицинская энциклопедия MedlinePlus. Доступно в Интернете по адресу http://www.nlm.nih.gov/medlineplus/ency/article/003666.

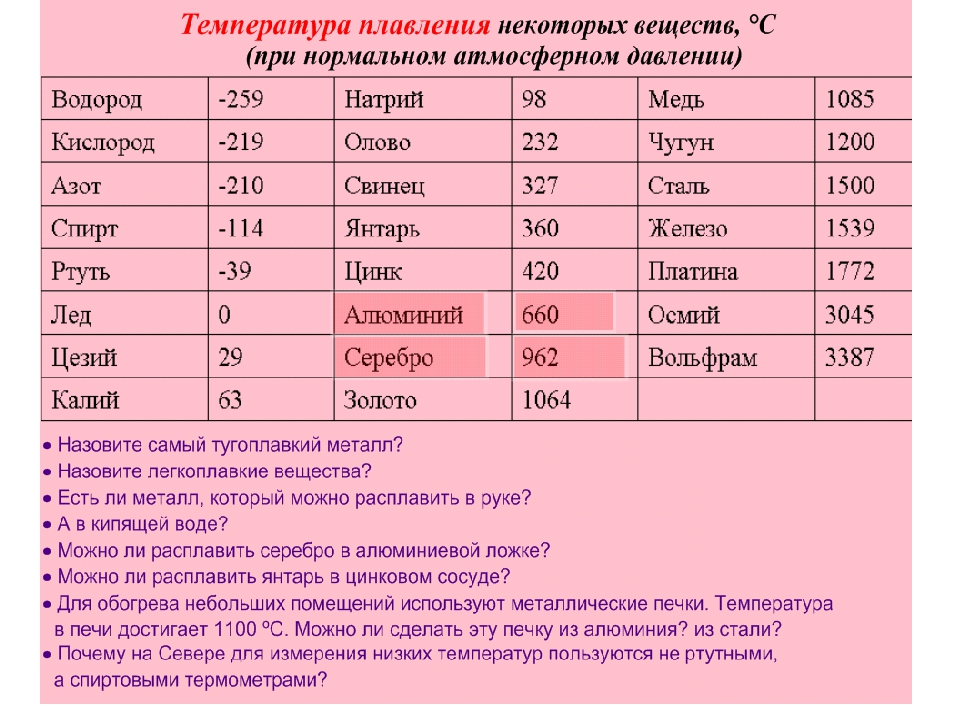 Широко распространен, но очень нестабилен, легко переходит в гематит в районах с умеренными гумидами.
Широко распространен, но очень нестабилен, легко переходит в гематит в районах с умеренными гумидами.
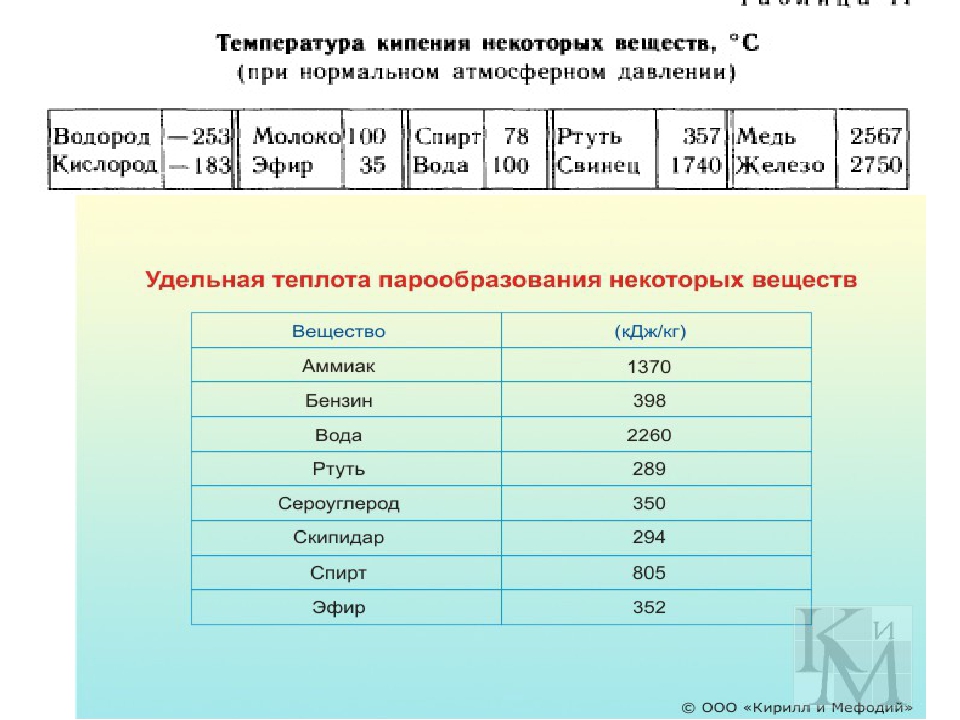
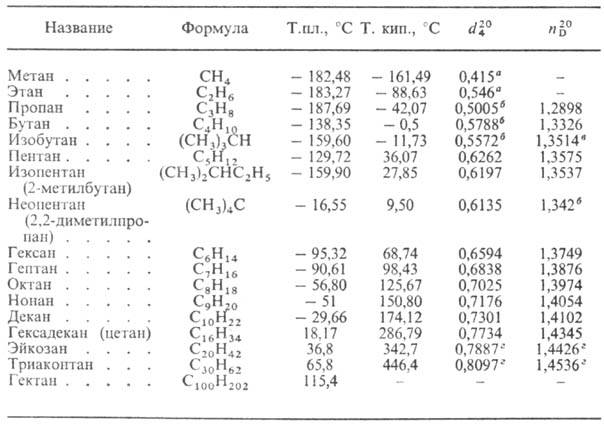


 26
сут
26
сут укажите
годы правления Хрущева Н.С.
укажите
годы правления Хрущева Н.С.