Температура плавления металлов таблица по возрастанию
Каждый металл или сплав обладает уникальными свойствами, в число которых входит температура плавления. При этом объект переходит из одного состояния в другое, в конкретном случае становится из твёрдого жидким. Чтобы его расплавить, необходимо подвести к нему тепло и нагревать до достижения нужной температуры. В момент, когда достигается нужная точка температуры данного сплава, он ещё может остаться в твёрдом состоянии. При продолжении воздействия начинает плавиться.
Наиболее низкая температура плавления у ртути — она плавится даже при -39 °C, самая высокая у вольфрама — 3422 °C. Для сплавов (стали и других) определить точную цифру крайне сложно. Все зависит от соотношения компонентов в них. У сплавов она записывается как числовой промежуток.
Как происходит процесс
Элементы, какими бы они ни были: золото, железо, чугун, сталь или любой другой — плавятся примерно одинаково. Это происходит при внешнем или внутреннем нагревании.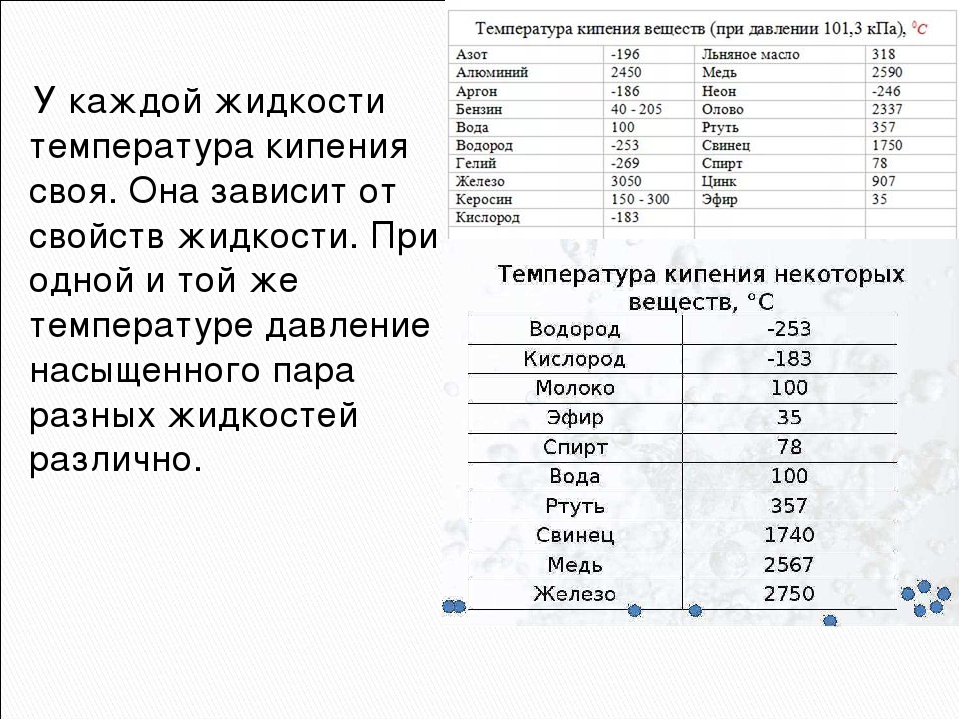 Внешнее нагревание осуществляется в термической печи. Для внутреннего применяют резистивный нагрев, пропуская электрический ток или индукционный нагрев в электромагнитном поле высокой частоты. Воздействие при этом примерно одинаковое.
Внешнее нагревание осуществляется в термической печи. Для внутреннего применяют резистивный нагрев, пропуская электрический ток или индукционный нагрев в электромагнитном поле высокой частоты. Воздействие при этом примерно одинаковое.
Когда происходит нагревание, усиливается амплитуда тепловых колебаний молекул. Появляются структурные дефекты решётки, сопровождаемые разрывом межатомных связей. Период разрушения решётки и скопления дефектов и называется плавлением.
В зависимости от градуса, при котором плавятся металлы, они разделяются на:
- легкоплавкие — до 600 °C: свинец, цинк, олово;
- среднеплавкие — от 600 °C до 1600 °C: золото, медь, алюминий, чугун, железо и большая часть всех элементов и соединений;
- тугоплавкие — от 1600 °C: хром, вольфрам, молибден, титан.
В зависимости от того, каков максимальный градус, подбирается и плавильный аппарат.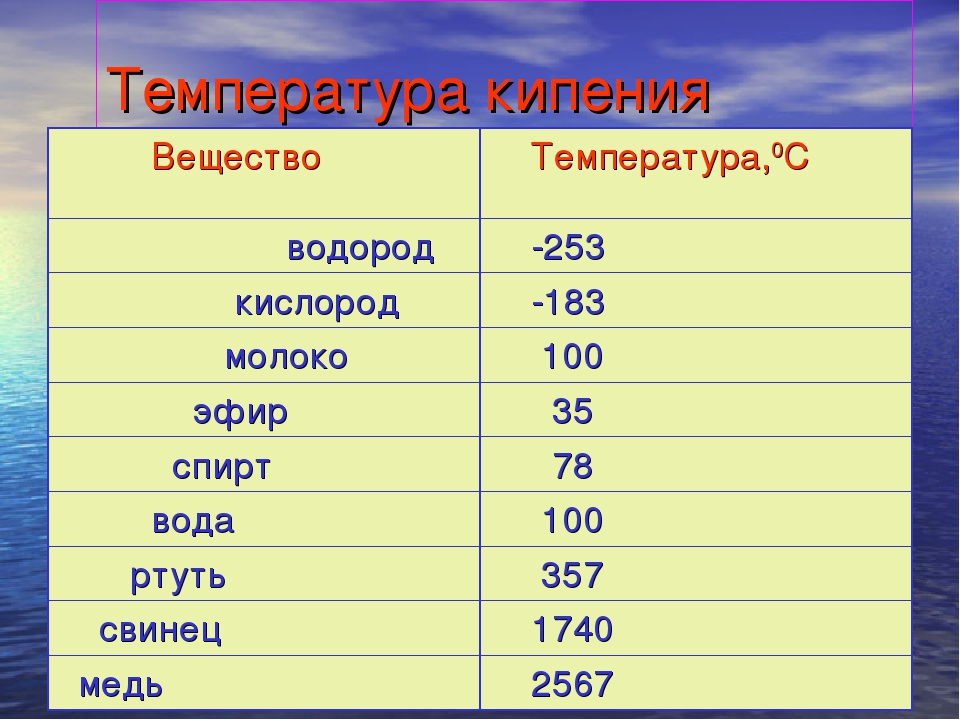 Он должен быть тем прочнее, чем сильнее будет нагревание.
Он должен быть тем прочнее, чем сильнее будет нагревание.
Вторая важная величина — градус кипения. Это параметр, при достижении которого начинается кипение жидкостей. Как правило, она в два раза выше градуса плавления. Эти величины прямо пропорциональны между собой и обычно их приводят при нормальном давлении.
Если давление увеличивается, величина плавления тоже увеличивается. Если давление уменьшается, то и она уменьшается.
Таблица характеристик
Металлы и сплавы — непременная основа для ковки, литейного производства, ювелирной продукции и многих других сфер производства. Чтобы не делал мастер (ювелирные украшения из золота, ограды из чугуна, ножи из стали или браслеты из меди), для правильной работы ему необходимо знать температуры, при которых плавится тот или иной элемент.
Чтобы узнать этот параметр, нужно обратиться к таблице. В таблице также можно найти и градус кипения.
Среди наиболее часто применяемых в быту элементов показатели температуры плавления такие:
- алюминий — 660 °C;
- температура плавления меди — 1083 °C;
- температура плавления золота — 1063 °C;
- серебро — 960 °C;
- олово — 232 °C.
 Олово часто используют при пайке, так как температура работающего паяльника составляет как раз 250–400 градусов;
Олово часто используют при пайке, так как температура работающего паяльника составляет как раз 250–400 градусов; - свинец — 327 °C;
- температура плавления железо — 1539 °C;
- температура плавления стали (сплав железа и углерода) — от 1300 °C до 1500 °C. Она колеблется в зависимости от насыщенности стали компонентами;
- температура плавления чугуна (также сплав железа и углерода) — от 1100 °C до 1300 °C;
- ртуть — -38,9 °C.
Как понятно из этой части таблицы, самый легкоплавкий металл — ртуть, которая при плюсовых температурах уже находится в жидком состоянии.
Градус кипения всех этих элементов почти вдвое, а иногда и ещё выше градуса плавления. Например, у золота он 2660 °C, у алюминия — 2519 °C, у железа — 2900 °C, у меди — 2580 °C, у ртути — 356,73 °C.
У сплавов типа стали, чугуна и прочих металлов расчёт примерно такой же и зависит от соотношения компонентов в сплаве.
Максимальная температура кипения у металлов — у рения — 5596 °C.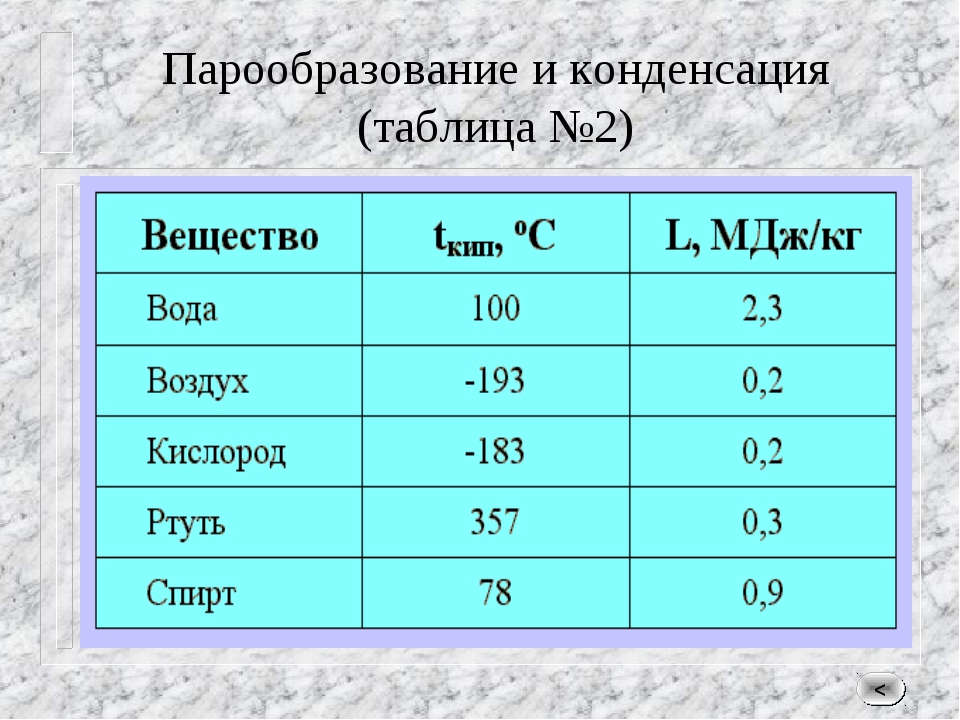 Наибольшая температура кипения — у наиболее тугоплавящихся материалов.
Наибольшая температура кипения — у наиболее тугоплавящихся материалов.
Бывают таблицы, в которых также указана плотность металлов. Самым лёгким металлом является литий, самым тяжёлым — осмий. У осмия плотность выше, чем у урана и плутония, если рассматривать её при комнатной температуре. К лёгким металлам относятся: магний, алюминий, титан. К тяжёлым относится большинство распространённых металлов: железо, медь, цинк, олово и многие другие. Последняя группа — очень тяжёлые металлы, к ним относятся: вольфрам, золото, свинец и другие.
Ещё один показатель, встречающийся в таблицах — это теплопроводность металлов. Хуже всего тепло проводит нептуний, а лучший по теплопроводности металл — серебро. Золото, сталь, железо, чугун и прочие элементы находится посередине между этими двумя крайностями. Чёткие характеристики для каждого можно найти в нужной таблице.
Каждый металл или сплав обладает уникальными свойствами, в число которых входит температура плавления.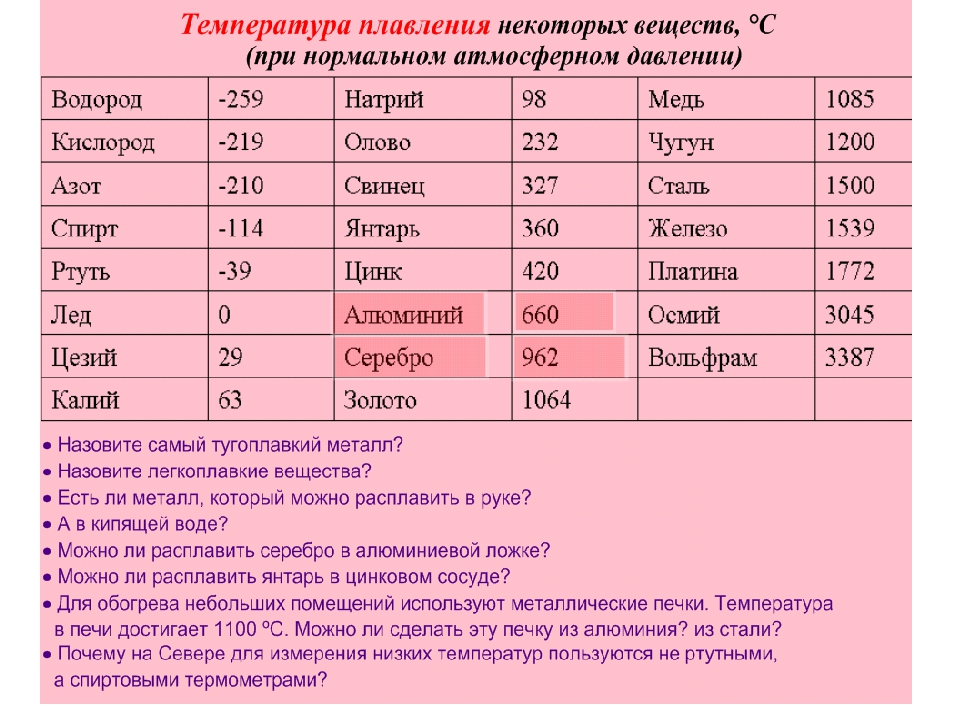 При этом объект переходит из одного состояния в другое, в конкретном случае становится из твёрдого жидким. Чтобы его расплавить, необходимо подвести к нему тепло и нагревать до достижения нужной температуры. В момент, когда достигается нужная точка температуры данного сплава, он ещё может остаться в твёрдом состоянии. При продолжении воздействия начинает плавиться.
При этом объект переходит из одного состояния в другое, в конкретном случае становится из твёрдого жидким. Чтобы его расплавить, необходимо подвести к нему тепло и нагревать до достижения нужной температуры. В момент, когда достигается нужная точка температуры данного сплава, он ещё может остаться в твёрдом состоянии. При продолжении воздействия начинает плавиться.
Наиболее низкая температура плавления у ртути – она плавится даже при -39 °C, самая высокая у вольфрама – 3422 °C. Для сплавов (стали и других) определить точную цифру крайне сложно. Все зависит от соотношения компонентов в них. У сплавов она записывается как числовой промежуток.
Как происходит процесс
Элементы, какими бы они ни были: золото, железо, чугун, сталь или любой другой – плавятся примерно одинаково. Это происходит при внешнем или внутреннем нагревании. Внешнее нагревание осуществляется в термической печи. Для внутреннего применяют резистивный нагрев, пропуская электрический ток или индукционный нагрев в электромагнитном поле высокой частоты .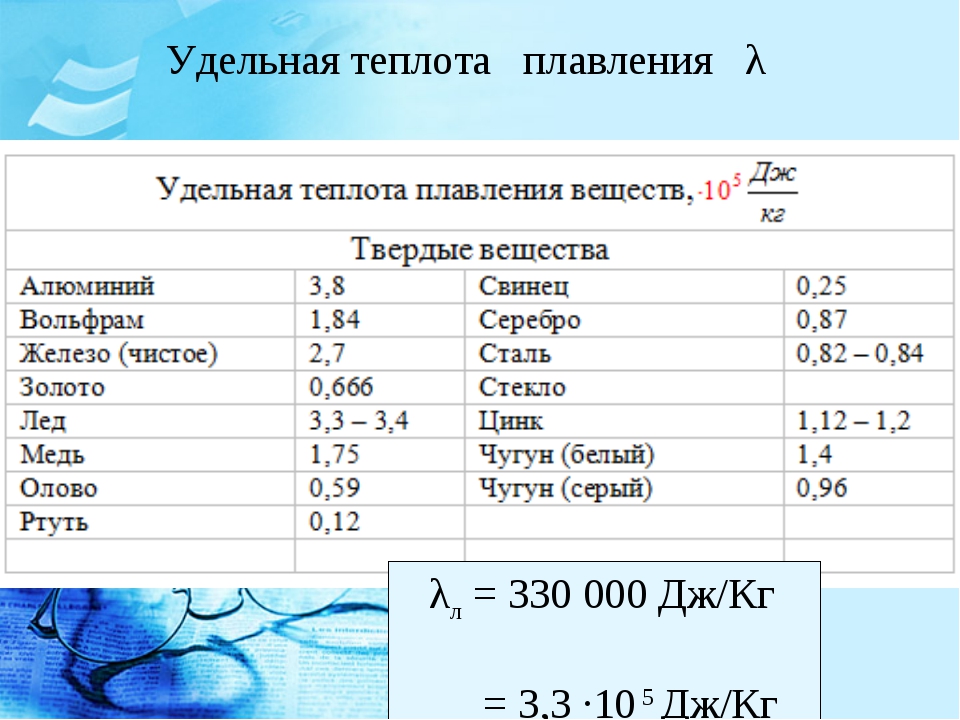 Воздействие при этом примерно одинаковое.
Воздействие при этом примерно одинаковое.
Когда происходит нагревание , усиливается амплитуда тепловых колебаний молекул. Появляются структурные дефекты решётки , сопровождаемые разрывом межатомных связей. Период разрушения решётки и скопления дефектов и называется плавлением.
В зависимости от градуса, при котором плавятся металлы, они разделяются на:
- легкоплавкие – до 600 °C: свинец, цинк, олово;
- среднеплавкие – от 600 °C до 1600 °C: золото, медь, алюминий, чугун, железо и большая часть всех элементов и соединений;
- тугоплавкие – от 1600 °C: хром, вольфрам, молибден, титан.
В зависимости от того, каков максимальный градус, подбирается и плавильный аппарат. Он должен быть тем прочнее, чем сильнее будет нагревание.
Вторая важная величина – градус кипения. Это параметр, при достижении которого начинается кипение жидкостей. Как правило, она в два раза выше градуса плавления. Эти величины прямо пропорциональны между собой и обычно их приводят при нормальном давлении.
Если давление увеличивается, величина плавления тоже увеличивается. Если давление уменьшается, то и она уменьшается.
Таблица характеристик
Металлы и сплавы – непременная основа для ковки , литейного производства, ювелирной продукции и многих других сфер производства. Чтобы не делал мастер (ювелирные украшения из золота , ограды из чугуна, ножи из стали или браслеты из меди) , для правильной работы ему необходимо знать температуры, при которых плавится тот или иной элемент.
Чтобы узнать этот параметр, нужно обратиться к таблице. В таблице также можно найти и градус кипения.
Среди наиболее часто применяемых в быту элементов показатели температуры плавления такие:
- алюминий – 660 °C;
- температура плавления меди – 1083 °C;
- температура плавления золота – 1063 °C;
- серебро – 960 °C;
- олово – 232 °C. Олово часто используют при пайке, так как температура работающего паяльника составляет как раз 250–400 градусов;
- свинец – 327 °C;
- температура плавления железо – 1539 °C;
- температура плавления стали (сплав железа и углерода) – от 1300 °C до 1500 °C.
 Она колеблется в зависимости от насыщенности стали компонентами;
Она колеблется в зависимости от насыщенности стали компонентами; - температура плавления чугуна (также сплав железа и углерода) – от 1100 °C до 1300 °C;
- ртуть – -38,9 °C.
Как понятно из этой части таблицы, самый легкоплавкий металл – ртуть, которая при плюсовых температурах уже находится в жидком состоянии.
Градус кипения всех этих элементов почти вдвое, а иногда и ещё выше градуса плавления. Например, у золота он 2660 °C, у алюминия – 2519 °C , у железа – 2900 °C, у меди – 2580 °C, у ртути – 356,73 °C.
У сплавов типа стали, чугуна и прочих металлов расчёт примерно такой же и зависит от соотношения компонентов в сплаве.
Максимальная температура кипения у металлов – у рения – 5596 °C . Наибольшая температура кипения – у наиболее тугоплавящихся материалов.
Бывают таблицы, в которых также указана плотность металлов . Самым лёгким металлом является литий, самым тяжёлым – осмий. У осмия плотность выше, чем у урана и плутония, если рассматривать её при комнатной температуре. К лёгким металлам относятся: магний, алюминий, титан. К тяжёлым относится большинство распространённых металлов: железо, медь, цинк, олово и многие другие. Последняя группа – очень тяжёлые металлы, к ним относятся: вольфрам, золото, свинец и другие.
К лёгким металлам относятся: магний, алюминий, титан. К тяжёлым относится большинство распространённых металлов: железо, медь, цинк, олово и многие другие. Последняя группа – очень тяжёлые металлы, к ним относятся: вольфрам, золото, свинец и другие.
Ещё один показатель, встречающийся в таблицах – это теплопроводность металлов . Хуже всего тепло проводит нептуний, а лучший по теплопроводности металл – серебро. Золото, сталь, железо, чугун и прочие элементы находится посередине между этими двумя крайностями. Чёткие характеристики для каждого можно найти в нужной таблице.
Температура плавления, наряду с плотностью, относится к физическим характеристикам металлов . Температура плавления металла – температура, при которой металл переходит из твердого состояния, в котором находится в нормальном состоянии (кроме ртути), в жидкое состояние при нагревании. При плавлении объем металла практически не изменяется, поэтому на температуру плавления нормальное атмосферное давление не влияет .
Температура плавления металлов находится в диапазоне от -39 градусов Цельсия до +3410 градусов . Для большинства металлов температура плавления высокая, однако, некоторые металлы можно расплавить в домашних условиях при нагревании на обычной горелке (олово, свинец).
Классификация металлов по температуре плавления
- Легкоплавкие металлы , температура плавления которых колеблется до 600 градусов Цельсия, например цинк, олово, висмут .
- Среднеплавкие металлы , которые плавятся при температуре от 600 до 1600 градусов Цельсия: такие как алюминий, медь, олово, железо .
- Тугоплавкие металлы , температура плавления которых достигает более 1600 градусов Цельсия – вольфрам, титан, хром и др.
- – единственный металл, находящийся при обычных условиях (нормальное атмосферное давление, средняя температура окружающей среды) в жидком состоянии. Температура плавления ртути составляет порядка -39 градусов по Цельсию.

Таблица температур плавления металлов и сплавов
| Металл | |
| Алюминий | 660,4 |
| Вольфрам | 3420 |
| Дюралюмин | |
| Железо | 1539 |
| Золото | 1063 |
| Иридий | 2447 |
| Калий | 63,6 |
| Кремний | 1415 |
| Латунь | |
| Легкоплавкий сплав | 60,5 |
| Магний | 650 |
| Медь | 1084,5 |
| Натрий | 97,8 |
| Никель | 1455 |
| Олово | 231,9 |
| Платина | 1769,3 |
| Ртуть | –38,9 |
| Свинец | 327,4 |
| Серебро | 961,9 |
| Сталь | 1300-1500 |
| Цинк | 419,5 |
| Чугун | 1100-1300 |
При плавлении металла для изготовления металлических изделий-отливок от температуры плавления зависит выбор оборудования, материала для формовки металла и др.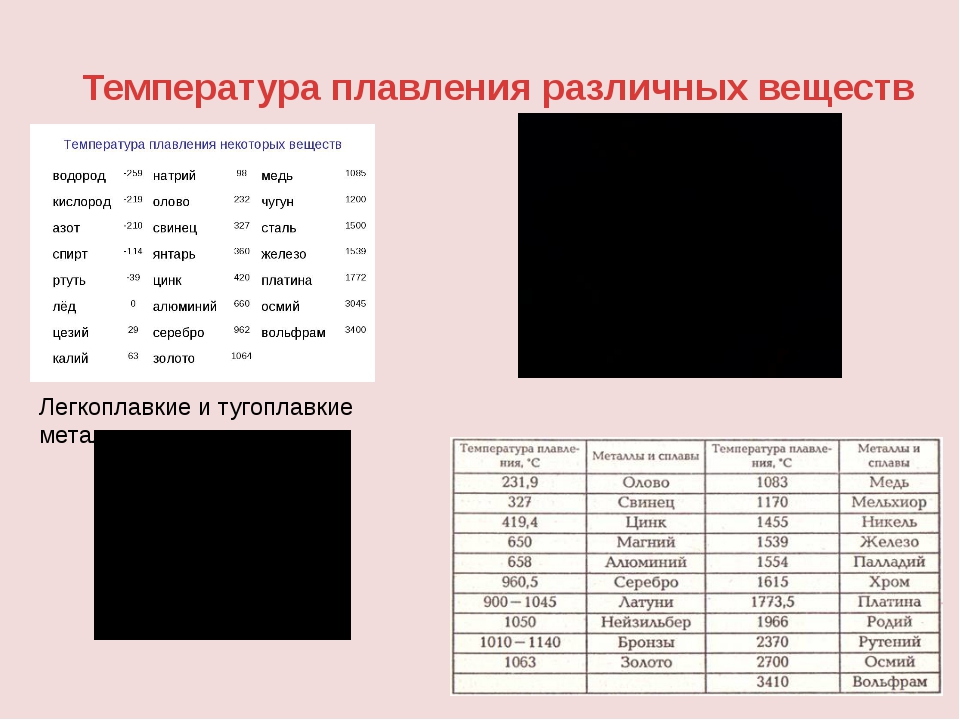 Следует также помнить, что при легировании металла другими элементами температура плавления чаще всего снижается .
Следует также помнить, что при легировании металла другими элементами температура плавления чаще всего снижается .
Не стоит путать понятия «температура плавления металла» и «температура кипения металла» – для многих металлов эти характеристики существенно отличаются: так, серебро плавится при температуре 961 градус по Цельсию, а закипает только при достижении нагрева до 2180 градусов.
Температура плавления металла – это минимальная температура, при которой он переходит из твердого состояния в жидкое. При плавлении его объем практически не изменяется. Металлы классифицируют по температуре плавления в зависимости от степени нагревания.
Легкоплавкие металлы
Легкоплавкие металлы имеют температуру плавления ниже 600°C. Это цинк, олово, висмут. Такие металлы можно расплавить в домашних условиях , разогрев их на плите, или с помощью паяльника. Легкоплавкие металлы используются в электронике и технике для соединения металлических элементов и проводов для движения электрического тока. Температура плавления олова составляет 232 градуса, а цинка – 419.
Температура плавления олова составляет 232 градуса, а цинка – 419.
Среднеплавкие металлы
Среднеплавкие металлы начинают переходить из твердого в жидкое состояние при температуре от 600°C до 1600°C. Они используются для изготовления плит, арматур, блоков и других металлических конструкций, пригодных для строительства. К этой группе металлов относятся железо, медь, алюминий, они также входят в состав многих сплавов. Медь добавляют в сплавы драгоценных металлов, таких как золото, серебро, платина. Золото 750 пробы на 25% состоит из лигатурных металлов, в том числе и меди, которая придает ему красноватый оттенок. Температура плавления этого материала равна 1084 °C. А алюминий начинает плавиться при относительно низкой температуре, составляющей 660 градусов Цельсия. Это легкий пластичный и недорогой металл, который не окисляется и не ржавеет, поэтому широко используется при изготовлении посуды. Температура плавления железа равна 1539 градусов. Это один из самых популярных и доступных металлов, его применение распространено в строительстве и автомобильной промышленности. Но ввиду того, что железо подвергается коррозии, его нужно дополнительно обрабатывать и покрывать защитным слоем краски, олифы или не допускать попадания влаги.
Но ввиду того, что железо подвергается коррозии, его нужно дополнительно обрабатывать и покрывать защитным слоем краски, олифы или не допускать попадания влаги.
Тугоплавкие металлы
Температура тугоплавких металлов выше 1600°C. Это вольфрам, титан, платина, хром и другие. Их используют в качестве источников света, машинных деталей, смазочных материалов, а также в ядерной промышленности. Из них изготавливают проволоки, высоковольтные провода и используют для расплавки других металлов с более низкой температурой плавления. Платина начинает переходить из твердого в жидкое состояние при температуре 1769 градусов, а вольфрам – при температуре 3420°C.
Ртуть – единственный металл, находящийся в жидком состоянии при обычных условиях, а именно, нормальном атмосферном давлении и средней температуре окружающей среды. Температура плавления ртути составляет минус 39°C. Этот металл и его пары являются ядовитыми, поэтому он используется только в закрытых емкостях или в лабораториях. Распространенное применение ртути – градусник для измерения температуры тела.
Распространенное применение ртути – градусник для измерения температуры тела.
Каждый металл и сплав имеет собственный уникальный набор физических и химических свойств, среди которых не последнее место занимает температура плавления. Сам процесс означает переход тела из одного агрегатного состояния в другое, в данном случае, из твердого кристаллического состояния в жидкое. Чтобы расплавить металл, необходимо подводить к нему тепло до достижения температуры плавления. При ней он все еще может оставаться в твердом состоянии, но при дальнейшем воздействии и повышении тепла металл начинает плавиться. Если температуру понизить, то есть отвести часть тепла, элемент затвердеет.
Самая высокая температура плавления среди металлов принадлежит вольфраму: она составляет 3422С о , самая низкая — у ртути: элемент плавится уже при — 39С о . Определить точное значение для сплавов, как правило, не представляет возможности: оно может значительно колебаться в зависимости от процентного соотношения компонентов. Их обычно записывают в виде числового промежутка.
Их обычно записывают в виде числового промежутка.
Как происходит
Плавление всех металлов происходит примерно одинаково — при помощи внешнего или внутреннего нагревания. Первый осуществляется в термической печи, для второго используют резистивный нагрев при пропускании электрического тока или индукционный нагрев в высокочастотном электромагнитном поле. Оба варианта воздействуют на металл примерно одинаково.
При увеличении температуры увеличивается и амплитуда тепловых колебаний молекул, возникают структурные дефекты решетки, выражающиеся в росте дислокаций, перескоке атомов и других нарушениях. Это сопровождается разрывом межатомных связей и требует определенного количества энергии. В это же время происходит образование квази-жидкого слоя на поверхности тела. Период разрушения решетки и накопления дефектов называется плавлением.
Разделение металлов
В зависимости от температуры плавления металлы делятся на:
- Легкоплавкие: им необходимо не более 600С о .
 Это цинк, свинец, виснут, олово.
Это цинк, свинец, виснут, олово. - Среднеплавкие: температура плавления колеблется от 600С о до 1600С о . Это золото, медь, алюминий, магний, железо, никель и большая половина всех элементов.
- Тугоплавкие: требуется температура свыше 1600С о , чтобы сделать металл жидким. Сюда относятся хром, вольфрам, молибден, титан.
В зависимости от температуры плавления выбирают и плавильный аппарат. Чем выше показатель, тем прочнее он должен быть. Узнать температуру нужного вам элемента можно из таблицы.
Еще одной немаловажной величиной является температура кипения. Это величина, при которой начинается процесс кипения жидкостей, она соответствует температуре насыщенного пара, который образуется над плоской поверхностью кипящей жидкости. Обычно она почти в два раза больше, чем температура плавления.
Обе величины принято приводить при нормальном давлении. Между собой они прямопропорциональны.
ICSC 1715 — ДВУХЛОРИСТОЕ ЖЕЛЕЗО
ICSC 1715 — ДВУХЛОРИСТОЕ ЖЕЛЕЗО| ДВУХЛОРИСТОЕ ЖЕЛЕЗО | ICSC: 1715 |
| ХЛОРИД ЖЕЛЕЗА (II) | Март 2009 |
| CAS #: 7758-94-3 | |
| UN #: 3260 |
|
| EINECS #: 231-843-4 |
| ОСОБЫЕ ОПАСНОСТИ | ПРОФИЛАКТИЧЕСКИЕ МЕРЫ | ТУШЕНИЕ ПОЖАРА | |
|---|---|---|---|
| ПОЖАР И ВЗРЫВ | Не горючее. |
В случае возникновения пожара в рабочей зоне, использовать надлежащие средства пожаротушения. |
| НЕ ДОПУСКАТЬ ОБРАЗОВАНИЕ ПЫЛИ! | |||
|---|---|---|---|
| СИМПТОМЫ | ПРОФИЛАКТИЧЕСКИЕ МЕРЫ | ПЕРВАЯ ПОМОЩЬ | |
| Вдыхание | Боли в горле. Ощущения жжения. | Применять местную вытяжку или средства защиты органов дыхания. | Свежий воздух, покой. Обратиться за медицинской помощью, если чувствуете недомогание. |
| Кожа | Покраснение. | Защитные перчатки. Защитная одежда. | Промыть кожу большим количеством воды или принять душ. |
| Глаза | Покраснение. Боль. Помутнение зрения. Ожоги. | Использовать защитные очки. |
Прежде всего промыть большим количеством воды (снять контактные линзы, если это возможно сделать без затруднений), затем обратится за медицинской помощью. Немедленно обратиться за медицинской помощью. |
| Проглатывание | Боль в горле. Боль в животе. Тошнота. Рвота. Диарея. | Не принимать пищу, напитки и не курить во время работы. | Прополоскать рот. Дать выпить один или два стакана воды. НЕ вызывать рвоту. Обратиться за медицинской помощью . |
| ЛИКВИДАЦИЯ УТЕЧЕК | КЛАССИФИКАЦИЯ И МАРКИРОВКА |
|---|---|
Индивидуальная защита: Респиратор с сажевым фильтром, подходящий для концентрации вещества в воздухе. НЕ допускать попадания этого химического вещества в окружающую среду. НеметаллическиеСмести просыпанное вещество в закрытые контейнеры. |
Согласно критериям СГС ООН ОПАСНО Вредно при проглатыванииВызывает серьезные повреждения глаз Может вызвать раздражение дыхательных путей Вредно для водной флоры и фауны Транспортировка Класс опасности по ООН: 8; Группа упаковки по ООН: III |
| ХРАНЕНИЕ | |
| Хранить сухим. Хорошо закрывать. Отдельно от сильных окислителей, спиртов и сильных восстановителей. Хранить в местах не имеющих сливов или доступа к канализации | |
| УПАКОВКА | |
Исходная информация на английском языке подготовлена группой международных экспертов, работающих от имени МОТ и ВОЗ при финансовой поддержке Европейского Союза. © МОТ и ВОЗ 2018 |
| ДВУХЛОРИСТОЕ ЖЕЛЕЗО | ICSC: 1715 |
| ФИЗИЧЕСКИЕ И ХИМИЧЕСКИЕ СВОЙСТВА | |
|---|---|
|
Агрегатное Состояние; Внешний Вид
Физические опасности Нет данных. Химические опасности
|
Формула: FeCl2 |
| ВОЗДЕЙСТВИЕ НА ОРГАНИЗМ И ЭФФЕКТЫ ОТ ВОЗДЕЙСТВИЯ | |
|---|---|
|
Пути воздействия
Эффекты от кратковременного воздействия
|
Риск вдыхания Вредная концентрация частиц в воздухе может достигаться быстро при распылении, особенно в виде порошка. Эффекты от длительного или повторяющегося воздействия
|
| Предельно-допустимые концентрации |
|---|
| TLV: 1 mg/m3, как TWA |
| ОКРУЖАЮЩАЯ СРЕДА |
|---|
Вещество опасно для водных организмов. |
| ДОПОЛНИТЕЛЬНАЯ ИНФОРМАЦИЯ |
|---|
|
Классификация ЕС |
| (ru) | Ни МОТ, ни ВОЗ, ни Европейский Союз не несут ответственности за качество и точность перевода или за возможное использование данной информации. © Версия на русском языке, 2018 |
Какова температура плавления железа
Железо – первый по значимости и распространенности конструкционный материал. Известен он с глубокой древности, а свойства его таковы, что когда железо научились выплавлять в значимом количестве, металл вытеснил все остальные сплавы. Наступил век железа и, судя по области его применения, время это закончится нескоро. Данная статья расскажет вам, какова удельная плотность железа, какая у него температура плавления в чистом виде.
Состав и структура железа
Железо – типичный металл, причем химически активный. Вещество вступает в реакцию при нормальной температуре, а нагрев или повышение влажности значительно увеличивают его реакционноспособность. Железо корродирует на воздухе, горит в атмосфере чистого кислорода, а в виде мелкой пыли способно воспламениться и на воздухе.
Чистому железу присуща ковкость, однако в таком виде металл встречается очень редко. На деле под железом подразумевают сплав с небольшими долями примесей – до 0,8%, которому присущи мягкость и ковкость чистого вещества. Значение для народного хозяйства имеет сплавы с углеродом – сталь, чугун, нержавеющая сталь.
Железу присущ полиморфизм: выделяют целых 4 модификации, отличающиеся структурой и параметрами решетки:
- α-Fe – существует от нуля до +769 С. Имеет объемно-центрированную кубическую решетку и является ферромагнетиком, то есть, сохраняет намагниченность в отсутствие внешнего магнитного поля.

- от +769 до +917 С появляется β-Fe. От α-фазы она отличается лишь параметрами решетки. Практически все физические свойства при этом сохраняются за исключением магнитных: железо становится парамагнетиком, то есть, способность намагничиваться оно утрачивает и втягивается в магнитное поле. Металловедение β-фазу как отдельную модификацию не рассматривает. Поскольку переход не влияет на значимые физические характеристики;
- в диапазоне от 917 до 1394 С существует γ-модификация, которой присуща гранецентрированная кубическая решетка;
- при температуре выше +1394 С появляется δ-фаза, для которой характерна объемно-центрированная кубическая решетка.
Температура фазовых переходов заметно изменяется при легировании тем же углеродом. Собственно, сама способность железа образовать столько модификаций служит основой обработки стали в разных температурных режимах. Без таких переходов металл не получил бы столь широкого распространения.
Теперь настал черед свойств металла железа.
О структуре железа рассказывает этот видеосюжет:
Железо – достаточно легкий, умеренно тугоплавкий металл, серебристо-серого цвета. Легко реагирует с разбавленными кислотами и поэтому считается элементом средней активности. На воздухе – сухом, металл постепенно покрывается пленкой оксида, которая препятствует дальнейшей реакции.
Но при самой небольшой влажности вместо пленки появляется ржавчина – рыхлая и неоднородная по составу. Ржавчина дальнейшей коррозии железа не препятствует. Однако физические свойства металла, а, главное, его сплавов с углеродом таковы, что, несмотря на низкую коррозийную стойкость, использование железа более чем оправдано.
Далее вы узнаете, чему равна плотность железа (в кг на м3) в сравнении, например, с медью или алюминием.
Масса и плотность
Молекулярная масса железа составляет 55,8, что указывает на относительную легкость вещества.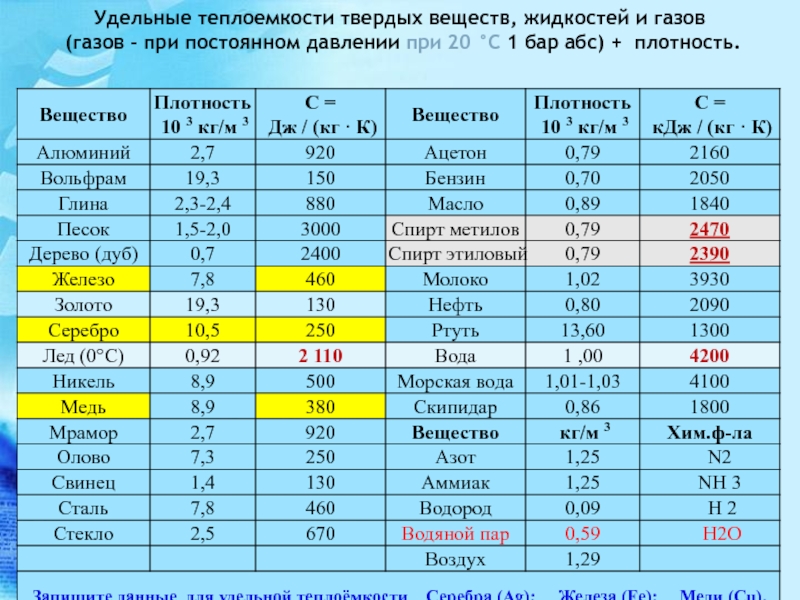 А какая же у железа плотность? Такой показатель определяется фазовой модификацией:
А какая же у железа плотность? Такой показатель определяется фазовой модификацией:
- α-Fe – 7,87 г/куб. см при 20 С, и 7,67 г/куб. см при 600 С;
- γ-фаза отличается еще более низкой плотностью – 7,59 г/куб см при 1000С;
- плотность δ-фазы составляет 7,409 г/куб см.
С повышением температуры плотность железа закономерно падает.
А теперь давайте узнаем, какова температура плавления железа по Цельсию, сравнивая ее, например, с медью или чугуном.
Температурный диапазон
Металл относится к умеренно тугоплавким, что означает сравнительно невысокую температуру изменения агрегатного состояния:
Благодаря тому, что температура плавления меди достаточно невысокая, этот металл стал одним из первых, которые древние люди начали использовать для изготовления различных инструментов, посуды, украшений и оружия. Самородки меди или медную руду можно было расплавить на костре, что, собственно, и делали наши далекие предки.
Несмотря на активное применение человечеством с древних времен, медь не является самым распространенным природным металлом. В этом отношении она значительно уступает остальным элементам и занимает в их ряду только 23-е место.
В этом отношении она значительно уступает остальным элементам и занимает в их ряду только 23-е место.
Как плавили медь наши предки
Благодаря невысокой температуре , составляющей 1083 градуса Цельсия, наши далекие предки не только успешно получали из руды чистый металл, но и изготавливали различные сплавы на его основе. Чтобы получить такие сплавы, медь нагревали и доводили до жидкого расплавленного состояния. Затем в такой расплав просто добавляли олово или выполняли его восстановление на поверхности расплавленной меди, для чего использовалась оловосодержащая руда (касситерит). По такой технологии получали бронзу – сплав, обладающий высокой прочностью, который использовали для изготовления оружия.
Какие процессы происходят при плавлении меди
Что характерно, температуры плавления меди и сплавов, полученных на ее основе, отличаются. При , имеющего меньшую температуру плавления, получают бронзу с температурой плавления 930–1140 градусов Цельсия. А сплав меди с цинком (латунь) плавится при 900–10500 Цельсия.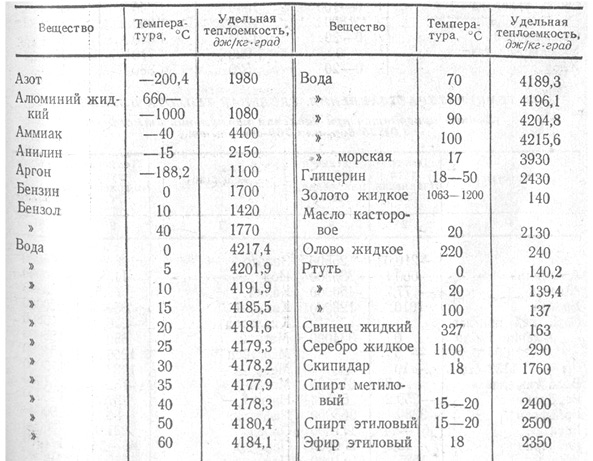
Во всех металлах в процессе плавления происходят одинаковые процессы. При получении достаточного количества теплоты при нагревании кристаллическая решетка металла начинает разрушаться. В тот момент, когда он переходит в расплавленное состояние, его температура не повышается, хотя процесс передачи ему теплоты при помощи нагрева не прекращается. Температура металла начинает вновь повышаться только тогда, когда он весь перейдет в расплавленное состояние.
При охлаждении происходит противоположный процесс: сначала температура резко снижается, затем на некоторое время останавливается на постоянной отметке. После того, как весь металл перейдет в твердую фазу, температура снова начинает снижаться до полного его остывания.
Как плавление, так и обратная кристаллизация меди, связаны с параметром удельной теплоты. Данный параметр характеризует удельное количество теплоты, которая требуется для того, чтобы перевести металл из твердого состояния в жидкое. При кристаллизации металла такой параметр характеризует количество теплоты, которое он отдает при остывании.
Более подробно узнать о плавлении меди помогает фазовая диаграмма, показывающая зависимость состояния металла от температуры. Такие диаграммы, которые можно составить для любых металлов, помогают изучать их свойства, определять температуры, при которых они кардинально меняют свои свойства и текущее состояние.
Кроме температуры плавления, у меди есть и температура кипения, при которой расплавленный металл начинает выделять пузырьки, наполненные газом. На самом деле никакого кипения меди не происходит, просто этот процесс внешне очень его напоминает. Довести до такого состояния ее можно, если нагреть до температуры 2560 градусов.
Как понятно из всего вышесказанного, именно невысокую температуру плавления меди можно назвать одной из основных причин того, что сегодня мы можем использовать этот металл, обладающий многими уникальными характеристиками.
Сегодня медь является одним из самых востребованных металлов. Высокий спрос объясняется отличительными характеристиками, присущими этому металлу. Медь проводит электроток лучше любых других металлов, кроме серебра, благодаря этому ее используют в производстве кабелей и электропроводов. Температура плавления меди не высокая, металл пластичный и легко поддается обработке, благодаря этому качеству стало возможным ее применение в строительстве в качестве водопроводных тр. Этот металл имеет высокое сопротивление к внешним раздражающим факторам, поэтому долговечен и может быть использован несколько раз, после переплавки. Это качество меди высоко ценят экологи, поскольку при повторной обработке металла тратится значительно меньшее количество энергии, чем при добыче и обработки руды, к тому же сохраняются земные недра. Добыча медной руды не проходит бесследно, на месте отработанных рудников появляются токсичные озера, наиболее известное во всем мире такое озеро – Беркли-Пит в штате Монтана в США.
Медь проводит электроток лучше любых других металлов, кроме серебра, благодаря этому ее используют в производстве кабелей и электропроводов. Температура плавления меди не высокая, металл пластичный и легко поддается обработке, благодаря этому качеству стало возможным ее применение в строительстве в качестве водопроводных тр. Этот металл имеет высокое сопротивление к внешним раздражающим факторам, поэтому долговечен и может быть использован несколько раз, после переплавки. Это качество меди высоко ценят экологи, поскольку при повторной обработке металла тратится значительно меньшее количество энергии, чем при добыче и обработки руды, к тому же сохраняются земные недра. Добыча медной руды не проходит бесследно, на месте отработанных рудников появляются токсичные озера, наиболее известное во всем мире такое озеро – Беркли-Пит в штате Монтана в США.
Необходимая температура для плавления меди
Медь не является легкоплавким металлом
Люди нашли применение меди еще в древние времена, тогда ее добывали в виде самородков. Ввиду низкой температуры, необходимой для осуществления процесса плавления ее стали широко применять для изготовления орудий труда и охоты, самородки можно плавить на костре. В наши дни технология получения металла мало чем отличается от придуманной в древние времена, совершенствуются лишь печи, увеличена скорость обжига и объемы обработки. Здесь возникает уместный вопрос — какая температура плавления меди? Ответ на него можно найти в любом учебнике по физике и химии – медь начинает плавиться при температуре нагрева до 1083 о С.
Ввиду низкой температуры, необходимой для осуществления процесса плавления ее стали широко применять для изготовления орудий труда и охоты, самородки можно плавить на костре. В наши дни технология получения металла мало чем отличается от придуманной в древние времена, совершенствуются лишь печи, увеличена скорость обжига и объемы обработки. Здесь возникает уместный вопрос — какая температура плавления меди? Ответ на него можно найти в любом учебнике по физике и химии – медь начинает плавиться при температуре нагрева до 1083 о С.
Кипение меди уменьшает ее прочность
В процессе термического воздействия на металл происходит разрушение его кристаллической решетки, это достигается при определенной температуре, которая в течение некоторого времени остается постоянной. В этот момент и происходит плавка металла. Когда процесс разрушения кристаллов полностью завершен, температура металла снова начинает подниматься, и он переходит в жидкую форму и начинает кипеть. Температура плавления меди значительно ниже, чем та, при которой металл кипит. Процесс кипения начинается с появлением пузырьков, по аналогии с водой. На этом этапе любой металл, в том числе и медь, начинает терять свои характеристики, в основном это отражается на прочности и упругости. Температура кипения меди составляет 2560 о С. Во время остывания металла происходит похожая картина, как и при нагреве – сначала температура опускается до определенного градуса, в этот момент происходит затвердевание, которое длится некоторое время, затем продолжается остывание до обычного состояния.
Процесс кипения начинается с появлением пузырьков, по аналогии с водой. На этом этапе любой металл, в том числе и медь, начинает терять свои характеристики, в основном это отражается на прочности и упругости. Температура кипения меди составляет 2560 о С. Во время остывания металла происходит похожая картина, как и при нагреве – сначала температура опускается до определенного градуса, в этот момент происходит затвердевание, которое длится некоторое время, затем продолжается остывание до обычного состояния.
Любой нагрев меди влечет за собой изменение ее характеристик, наиболее значимой является величина ее удельного сопротивления. Медь является проводником электрического тока, при этом металл оказывает сопротивление движению носителям заряда. Отношение площади сечения проводника к оказываемому движению и называется удельным сопротивлением.
Так вот, эта величина для чистой меди составляет 0,0172 ОМ мм 2 /м при 20 о С. Этот показатель может измениться после термической обработки, а также вследствие добавления в состав различных примесей и добавок. Здесь наблюдается обратная зависимость сопротивления меди от температуры – чем выше была температура обработки металла, тем ниже будет ее сопротивление электрическому току. Для обеспечения наилучших электролитических характеристик медной проволоки, ее обрабатывают при 500 о С.
Здесь наблюдается обратная зависимость сопротивления меди от температуры – чем выше была температура обработки металла, тем ниже будет ее сопротивление электрическому току. Для обеспечения наилучших электролитических характеристик медной проволоки, ее обрабатывают при 500 о С.
Во время термической обработки можно не только придавать металлу нужную форму и размер, но и создавать различные сплавы. Самыми распространёнными медными сплавами является бронза и латунь. Бронза получается путем смешивания меди с оловом, а латунь – с цинком. Добавление алюминия и стали увеличивает прочность материала, а добавление никеля повышает антикоррозийные свойства. Но стоит заметить, что любая примесь снижает главное свойство – электропроводность, поэтому для изготовления жил электрокабеля используют чистый состав металла.
Отжиг меди
Под отжигом меди следует понимать процесс ее нагрева с целью дальнейшей обработки и приданию необходимых форм изделию. В ходе отжига металл становится более пластичным и мягким, поддающимся различным трансформациям. При отжиге меди температура достигает 550 о С, она приобретает темно-красный оттенок. После нагрева желательно быстро производить ковку и оправлять изделие на охлаждение.
При отжиге меди температура достигает 550 о С, она приобретает темно-красный оттенок. После нагрева желательно быстро производить ковку и оправлять изделие на охлаждение.
Если подвергать материал медленному, естественному охлаждению, то возможно образование наклепа, поэтому чаще применяют мгновенное охлаждение путем помещения заготовки в холодную воду. Если превысить допустимую величину нагрева, металл может стать более хрупким и ломким.
Во время отжига осуществляется процесс рекристаллизации меди, в ходе которого образуются новые зерна или кристаллы металла, которые не искажены решеткой и отделены от прежних зерен угловыми границами. Новые зерна по размеру могут сильно отличаться от предшественников, при их образовании высвобождается большое количество энергии, увеличивается плотность и появляется наклеп. Рекристаллизация осуществляется только после деформации изделия, и только после достижения ее определенного уровня. Для меди критический уровень деформации составляет 5%, если он не достигнут процесс формирования новых зерен не начнется. Температура рекристаллизации меди составляет 270 о С. Следует отметить, что при этой температуре процесс роста кристаллов только начинается, но он достаточно медленный, поэтому для достижения необходимого результата медь необходимо нагреть до 500 о С, тогда времени для остывания хватит для завершения процесса рекристаллизации.
Температура рекристаллизации меди составляет 270 о С. Следует отметить, что при этой температуре процесс роста кристаллов только начинается, но он достаточно медленный, поэтому для достижения необходимого результата медь необходимо нагреть до 500 о С, тогда времени для остывания хватит для завершения процесса рекристаллизации.
Видео: Плавление меди в микроволновке
Предметы из меди, а также различные изделия, в состав которых она входит, получили широкое распространение в бытовых условиях. Поэтому многие задаются вполне стандартным вопросом: «Как расплавить медь самостоятельно?»
Имея представление о такой технологии, люди научились изготавливать разные предметы из чистого металла, а также получаемых из него сплавов – бронзы и латуни.
Плавление – это процесс, характеризующий постепенный переход металла из стандартного твердого состояния в жидкую консистенцию. Каждому металлическому соединению или металлу в чистом виде свойственная своя температура, под воздействием которой он начинает плавиться.
Немаловажным фактором в данном случае является то, какие примеси входят в состав расплавляемого соединения.
Так, медь начинает плавиться при температуре 1083 градусов по Цельсию. Если к ней добавить олово, то температура плавления снизится и составит примерно 930-1140 градусов по Цельсию.
В данном случае такое колебание обусловлено количеством олова, входящего в сплав. Соединение из меди и цинка плавится при еще более низкой температуре – 900-1050 градусов. Нагревание любых металлов связано с постепенным разрушением решетки, образованной из множества кристаллов.
С нагреванием температура плавления поднимается до максимально необходимой отметки, затем ее рост останавливается и сохраняется на достигнутом уровне до того момента, пока не расплавится весь металл, после чего начинает снижаться.
Остывание – обратный процесс изменения температуры. По мере охлаждения она падает и «замирает» на определенном уровне до тех пор, пока металл полностью не затвердеет.
Медь, разогретая до максимально возможной отметки, закипает при температуре, достигшей отметки в 2560 градусов. По внешнему виду ее кипение схоже с кипением любых жидких веществ, на поверхности которых по мере нагревания появляются пузырьки, и выделяется газ. Так, из меди в процессе кипения выходит углерод, образовавшийся в результате окисления и ее тесного контакта с воздухом.
Технология плавления меди получила широкое применение с древних времен, когда люди с помощью костра расплавляли металл для изготовления стрел, наконечников и другого оружия, и предметов быта.
Плавка меди в домашних условиях также возможна. Для этого понадобятся:
- Тигель, где будет плавиться медь, и щипцы, необходимые для того, чтобы извлечь тигель из печи или снять его с огня.
- Древесный уголь.
- Муфельная печь (лучше, если в ней будет регулироваться температура нагрева).
- Горн.
- Обычный пылесос.
- Форма, в которую выливается расплавленная жидкость.

- Крюк, изготовленный из стальной проволоки.
- Газовая горелка, если нет муфельной печи.
Алгоритм плавления включает несколько поэтапных шагов:
- Металл измельчить и пересыпать в тигель . Причем чем более мелкие фрагменты будут, тем скорее он достигнет расплавленного состояния. Тигель поставить в печь, раскаленную до максимально высокой температуры, необходимой для начала процесса плавления (здесь кстати придется регулятор температур). Во многих муфельных печах на двери вырезано окошко. Через него можно безопасно осуществлять наблюдение за процессом.
- По достижении медью жидкого окончательно расплавленного состояния, тигель с помощью щипцов нужно постараться как можно аккуратнее и скорее вынуть из печи . На поверхности жидкого вещества будет образована пленка, ее подвинуть к краю тигля, используя крюк из проволоки. Очищенный от пленки металл максимально быстро перелить в заранее подготовленную форму.
- Если муфельная печь отсутствует, осуществить плавку меди можно с применением обычной газовой горелки . Но тогда медь будет находиться в тесном контакте с воздухом, а сам процесс окисления пройдет значительно быстрее. Поэтому для предотвращения образования толстой пленки на поверхности металла, медь, когда она достигнет жидкого состояния, присыпают растолченным древесным углем.
- Расплавить медь и ее сплавы можно также с помощью горна . Для этого древесный уголь нужно хорошо раскалить и поместить на него тигель с металлом (предварительно измельчить медь). Для ускорения нагревательного процесса на уголь направить пылесос, включенный на режиме выдувания. Особое внимание стоит уделить наконечнику трубы. Она должна быть металлической, поскольку пластик расплавится под воздействием высокой температуры.
У чистой меди, в состав которой не входят другие соединения, достаточно плохая текучесть. Поэтому делать из нее сложное литье или мелкие детали не рекомендуется.
Тогда стоит использовать сплавы. Например, латунь, оттенок которой светлее остальных. Это говорит о том, что для ее плавления нужны менее высокие температуры.
Температура плавления латуни, бронзы и меди примерно одинаковая. Во всяком случае значения этой характеристики для всех трех данных цветных металлов находятся в одном узком диапазоне температур. Это обусловлено тем, что бронза и латунь являются сплавами меди, свойства которой в значительной степени влияют на их физические характеристики.
Для твердых кристаллических материалов, к коим относятся и металлы, состоящие из чистого (без примесей) вещества, температурой плавления является такой показатель их нагревания, при котором они переходят в другое состояние – жидкое. Причем при этой же температуре чистые вещества (металлы) и застывают. То есть для них такой показатель нагрева является температурой одновременно и плавления, и кристаллизации. А сами металлы, нагретые до температуры их плавления, могут находиться не только в жидком, но и твердом состоянии. Это зависит от того, продолжить подводить к ним дополнительное тепло или дать начать остывать.
Вообще, по достижении температуры плавления чистое вещество сначала все еще остается твердым. Если продолжить нагрев, то оно станет жидким. Но температура вещества не будет повышаться (меняться) до тех пор, пока оно все полностью не расплавится в рассматриваемой системе (изделии, теле). А когда расплавленное вещество остывает до температуры кристаллизации (плавления), то оно сначала все еще остается жидким. И только если начать дополнительное отведение от него тепла, тогда оно станет переходить в кристаллическое твердое состояние (застывать). Но температура вещества, опять же, не будет меняться (понижаться), пока оно полностью не затвердеет.
У смесей веществ (в том числе и у различных сплавов металлов) нет температуры плавления/кристаллизации. Они совершают переход из одного состояния в другое (из твердого в жидкое и обратно) в некотором определенном интервале степени своего нагрева, граничные значения диапазона которого имеют соответствующее название. Температуру, при которой смеси веществ и сплавы металлов начинают переходить в жидкую фазу (или полностью затвердевают), называют «точкой солидуса». Степень нагрева, при котором происходит полное расплавление (или начинается кристаллизация при остывании), называют «точкой ликвидуса». Но в обиходе чаще говорят: температура солидуса и ликвидуса.
Точно замерить эти температуры как для смесей веществ, так и для сплавов металлов невозможно. Их определяют по специальным расчетным методикам, в которых учитывается точное процентное соотношение в смеси каждого элемента и ряд других параметров.
То есть относительно рассматриваемых металлов можно сделать следующие выводы. Температура плавления есть . Причем, только у чистой. У всех остальных металлов (латуни, бронзы и различных марок меди) ее нет, а есть температуры солидус и ликвидус. Для латуни и бронзы это так, потому что они являются сплавами меди, в которых в зависимости от марки добавлены различные легирующие добавки (другие металлы или иные вещества) и еще есть какие-то примеси. А производимые металлургической промышленностью для различных нужд имеют такие характеристики плавления, так как они тоже производятся легированными и с примесями. Чистую медь изготавливать нецелесообразно, и она уступает по своим характеристикам, требуемым для народного и промышленного ее использования, свойствам выпускаемых из нее марок.
Температура плавления металлов
Очевидно, что величина температуры ликвидус рассматриваемых металлов будет зависеть от их химического состава. В первую очередь от процентного содержания меди, так как ее в них всегда больше 50 %. И, соответственно, точка ликвидус марок этих металлов будет тем ближе к температуре плавления самой меди, чем ее больше в сплаве. А легирующие металлы или другие вещества и примеси, в зависимости от своего процентного содержания и температуры плавления, будут вносить соответствующую корректировку в сторону понижения либо повышения точки ликвидус у марок меди, бронзы и латуни. Понижать, если своя температура плавления ниже, чем у меди, и повышать, когда выше.
Так, ознакомившись, можно самому догадаться, в какую сторону будет отличаться у них точка ликвидус от температуры плавления чистой меди. Сам подскажет его влияние на эту и другие характеристики данного сплава. А даст возможность судить об отклонениях ее точки ликвидус от температуры плавления меди. С марками меди то же самое, но влияние легирующих добавок и примесей на их точку ликвидус будет рассмотрено отдельно ниже.
Температура плавления чистой меди – 1084,5 °C. А выпускаемые марки меди содержат ничтожно малое по отношению к самому этому металлу количество других веществ. Такое, что даже легирующие элементы, как, например, серебро и никель, наравне с прочими «случайными» веществами, относят в составе марок меди к примесям. Самого этого металла – от 99,93 до 99,99 %. И поэтому точки солидус и ликвидус выпускаемых марок меди очень близки к температуре плавления самого этого металла. Температуры полного расплавления в зависимости от марки: меди – 1083–1084 °C, латуни – 880–1050 °C, а бронзы – 900–1140 °C.
Изделия из меди
Температурные главным образом зависят от содержания меди и гораздо менее тугоплавкого цинка, являющегося в латунных сплавах основным легирующим элементом. А относительно бронзы следует отметить, что ее так называемые оловянные марки, с легированием оловом, полностью плавятся при температуре 900–950 °C, а не содержащие этот металл, безоловянные – при 950–1140 °C.
Прям совсем уж в домашних условиях плавить эти металлы, да еще потом и отливать из них какие-то заготовки, а тем более изделия, не получится. Надо будет сначала предварительно соответствующим образом подготовить подходящее помещение, обзавестись необходимым оборудованием и инструментом или смастерить самому что-то из требуемого для плавки и литья оснащения. И, разумеется, желательно поточнее выяснить характеристики сплава, с которым предполагается работать. А именно, его состав и температуру ликвидус.
Плавление в домашних условиях
А какие именно необходимо создать условия для работы, подготовить оборудование, оснащение и инструменты, а также технология плавки и литья перечислены и описаны в одной из публикаций сайта. Это статья: . Так как у этого сплава и у марок меди с латунью точки ликвидус близки по своим значениям, а другие свойства, влияющие на процессы плавки и литья, относительно сопоставимы, то и вся технология в кустарных условий для этих металлов идентична. То есть для меди и латуни можно воспользоваться инструкциями-рекомендациями по плавке бронзы из этой статьи.
Железом человек начал владеть (ковать, плавить) спустя несколько тысячелетий после освоения работ с медью. Первое самородное железо в виде комков было найдено на Ближнем Востоке в 3000 году до нашей эры. А металлургия железа, по мнению специалистов, возникла в нескольких местах планеты, разные народы осваивали этот процесс в разное время. Благодаря этому железо как материал для изготовления орудий труда, охоты и войны вытеснило камень и бронзу.
Первые процессы изготовления железа назывались сыродутными. Суть заключалась в том, что в яму засыпалась железная руда с древесным углем, который разжигали и плотно закупоривали, оставляя дутьевое отверстие, через которое подавался свежий воздух для дутья. В процессе такого нагрева температура плавления железа, конечно, не могла быть достигнута, получалась размягченная масса (крица), в которой находился шлак (зола от топлива, окислы руды и породы).
Далее полученную крицу несколько раз проковывали, удаляя шлак и другие не нужные включения, этот трудоемкий процесс производился по несколько раз, в результате чего из общей массы до финишной операции доходила пятая часть. С изобретением водяного колеса появилась возможность подавать значительное количество воздуха. Благодаря такому дутью температура плавления железа стала достижимой, появился металл в жидком виде.
Этим металлом был чугун, который не ковался, но было замечено, что он хорошо заполняет форму. Это были первые опыты по чугунному литью, которое с некоторыми усовершенствованиями и изменениями дошло до наших дней. Со временем был найден способ переработки чугуна в сварочное железо. Куски чугуна загружались с древесным углем, в ходе этого процесса чугун размягчался, происходило окисление примесей, в том числе углерода. В результате чего металл становился густым, температура плавления железа повышалась, т.е. получалось сварочное железо.
Таким образом, металлурги того времени смогли разделить единый процесс на две ступени. Этот двухступенчатый процесс в самой идее сохранился до настоящего времени, изменения в большей степени касаются появлению процессов, происходящих на втором этапе. Чистое железо или металл, имеющий минимум примесей, практического применения почти не имеет. Температура плавления железа по диаграмме железо – углерод находится в точке А, что соответствует 1535 градусам.
Температура кипения железа наступает при достижении отметки 3200 градусов.
На открытом воздухе железо со временем покрывается оксидной пленкой, во влажной среде появляется рыхлый слой ржавчины. Железо с момента его появления и по сегодняшний день является одним из главных металлов. Используется железо, главным образом, в виде сплавов, которые различаются по свойствам и составу.
При какой температуре плавится железо, зависит от содержания углерода и других компонентов, входящих в состав сплава. Наибольшее применение имеют углеродистые сплавы – чугун и сталь. Сплавы, содержащие углерод более 2%, называют чугуном, менее 2% относятся к стали. Чугун получают в доменных печах, путем переплава обогащенных на аглофабрике руд.
Сталь выплавляют в мартеновских, электрических и индукционных печах, в конвертерах.
В качестве шихты применяется металлический лом и чугун. Путем окислительных процессов из шихты удаляется лишний углерод и вредные примеси, а добавки легирующих материалов позволяют получить нужную марку стали. Для получения стали и других сплавов современные металлургия использует технологии электрошлакового переплава, вакуумные, электронно-лучевые и плазменные плавки.
В разработке находятся новые методы плавления стали, предусматривающие автоматизацию процесса и обеспечивающие получение высококачественного металла.
Научные разработки достигли такого уровня, когда можно получать материалы, выдерживающие вакуум и большое давление, большие температурные перепады, агрессивную среду, радиационные излучения и т.п.
Железо
| Железо | |
|---|---|
| Атомный номер | 26 |
| Внешний вид простого вещества | ковкий, вязкий металл серебристо-белого цвета |
| Свойства атома | |
|
Атомная масса (молярная масса) |
55,847 а. е. м. (г/моль) |
| Радиус атома | 126 пм |
|
Энергия ионизации (первый электрон) |
759,1 (7,87) кДж/моль (эВ) |
| Электронная конфигурация | [Ar] 3d6 4s2 |
| Химические свойства | |
| Ковалентный радиус | 117 пм |
| Радиус иона | (+3e) 64 (+2e) 74 пм |
|
Электроотрицательность (по Полингу) |
1,83 |
| Электродный потенциал |
Fe←Fe3+ −0,04 В Fe←Fe2+ −0,44 В |
| Степени окисления | 6, 3, 2, 0, −2 |
| Термодинамические свойства простого вещества | |
| Плотность | 7,874 г/см³ |
| Молярная теплоёмкость | 25,14[1]Дж/(K·моль) |
| Теплопроводность | 80,4 Вт/(м·K) |
| Температура плавления | 1812 K |
| Теплота плавления | 247,1 кДж/кг 13,8 кДж/моль |
| Температура кипения | 3134 K |
| Теплота испарения | ~6088 кДж/кг ~340 кДж/моль |
| Молярный объём | 7,1 см³/моль |
| Кристаллическая решётка простого вещества | |
| Структура решётки | кубическая объёмноцентрированная |
| Параметры решётки | 2,866 Å |
| Отношение c/a | — |
| Температура Дебая | 460 K |
| Fe | 26 |
| 55,847 | |
| [Ar]3d64s2 | |
| Железо | |
Железо — элемент побочной подгруппы восьмой группы четвёртого периода периодической системы химических элементов Д. И. Менделеева, атомный номер 26. Обозначается символом Fe (Ferrum). Один из самых распространённых в земной коре металлов (второе место после алюминия).
Простое вещество железо (CAS-номер: 7439-89-6) — ковкий металл серебристо-белого цвета с высокой химической реакционной способностью: железо быстро корродирует при высоких температурах или при высокой влажности на воздухе. В чистом кислороде железо горит, а в мелкодисперсном состоянии самовозгорается и на воздухе.
На самом деле железом обычно называют его сплавы с малым содержанием примесей (до 0,8 %), которые сохраняют мягкость и пластичность чистого металла. Но на практике чаще применяются сплавы железа с углеродом: сталь (до 2 % углерода) и чугун (более 2 % углерода), а также нержавеющая (легированная) сталь с добавками легирующих металлов (хром, марганец, никель и др.). Совокупность специфических свойств железа и его сплавов делают его «металлом № 1» по важности для человека.
В природе железо редко встречается в чистом виде, чаще всего оно встречается в составе железо-никелевых метеоритов. Распространённость железа в земной коре — 4,65 % (4-е место после O, Si, Al). Считается также, что железо составляет бо́льшую часть земного ядра.
История
Железо как инструментальный материал известно с древнейших времён, самые древние изделия из железа, найденные при археологических раскопках, датируются 4-м тысячелетием до н. э. и относятся к древнешумерской и древнеегипетской цивилизациям. Это наконечники для стрел и украшения из метеоритного железа, то есть, сплава железа и никеля (содержание последнего колеблется от 5 до 30 %), из которого состоят метеориты. От их небесного происхождения идёт, видимо, одно из наименований железа в греческом языке: «сидер» (а на латыни это слово значит «звёздный»).
Изделия из железа, полученного искусственно, известны со времени расселения арийских племён из Европы в Азию и острова Средиземного моря (4—3-е тысячелетие до н. э.). Самый древний железный инструмент из известных — стальное долото, найденное в каменной кладке пирамиды Хеопса в Египте (построена около 2550 года до н. э.). Железо часто упоминается в древнейших (3-е тысячелетие до н. э.) текстах хеттов, основавших свою империю на территории современной Анатолии в Турции. Например, в тексте хеттского царя Анитты (около 1800 года до н. э.) говорится:
Когда на город Пурусханду в поход я пошел, человек из города Пурусханды ко мне поклониться пришел (…?) и он мне 1 железный трон и 1 железный скипетр (?) в знак покорности (?) преподнес.
В этом тексте железо обозначается словом «par-zi-lum» (сравните латинское «ferrum» и русское «железо»), что, скорее всего, значит «олово всадников» — от древнеарийских слов «PARSA» или «FERSY» (всадник — сравните этноним «персы», отсюда же шахматная фигура «ферзь», и латинские слова «persona» и «partia»), и корня «ZIL» (олово, и вообще белый металл).
В древности мастерами железных изделий слыли халибы, которых Геродот перечисляет в числе эллинских племён Малой Азии, подвластных Крезу. Халибы жили на севере державы Хеттов, у побережья Чёрного моря возле устья реки Галис (современный г. Самсун в Турции), и от их имени происходит греч. Χάλυβας — «сталь». Аристотель описал их способ получения стали: халибы несколько раз промывали речной песок их страны — видимо, таким способом (теперь это называют флотацией) выделяли тяжёлую железосодержащую фракцию породы, добавляли какое-то огнеупорное вещество, и плавили в печах особой конструкции; полученный таким образом металл имел серебристый цвет и был нержавеющим. Из этого процесса, видимо, возникло и название «руда», которое на латыни значит «мокрый» — то есть, «вымытый».
В качестве сырья для выплавки стали использовались магнетитовые пески, которые часто встречаются по всему побережью Чёрного моря: эти магнетитовые пески состоят из смеси мелких зёрен магнетита, титано-магнетита или ильменита, и обломков других пород, так что выплавляемая халибами сталь была легированной, и обладала отличными свойствами. Такой своеобразный способ получения железа не из руды говорит о том, что халибы, в основном, распространили железо как технологический материал, но их способ не мог быть методом повсеместного промышленного производства железных изделий. Однако их производство послужило толчком для дальнейшего развития металлургии железа.
Судя по греческому названию инструментальных металлов χαλκός (это слово обозначает и бронзу, и железо), можно понять, что арийские племена нашли способ выделки железа во время перехода в Азию через Кавказ, а именно — в Колхиде (др.-греч. Κολχίς), так как другого удобного сухопутного пути из Европы в Азию не было. Пройдя степи Причерноморья, они оставили многочисленные памятники культуры бронзового века (так называемая «пахотно-скотоводческая культура»), и двинулись дальше — на юг. Конечно же, по пути они искали сырьё для изготовления бронзовых орудий, и так обнаружили свойства причерноморских песков, дающих новый твёрдый металл — железо. Видимо, сперва они приняли его за олово (первые металлурги плохо различали металлы), и это подтверждается также тем, что название «сталь» в языках северных арийцев (романских, германских, славянских) явно происходит от слова «STANN» через аберрацию N-L, а у римлян это слово обозначало олово. То есть, пытаясь найти олово для бронзы, они обнаружили металл, который оказался крепким и без сплавления с медью, и стали называть его по аналогии с оловом. Найденный тогда способ выплавки стальных изделий не позволял получать их в больших количествах, однако использовался более тысячи лет, пока не была разработана технология выплавки железа из руды, добываемой в копях.
Климент Александрийский в своём энциклопедическом труде «Строматы» упоминает, что по греческим преданиям железо (видимо, выплавка его из руды) было открыто на горе Иде — так называлась горная цепь возле Трои (в Илиаде она упоминается как гора Ида, с которой Зевс наблюдал за битвой греков с троянцами). Произошло это через 73 года после Девкалионова потопа, а этот потоп, согласно Паросской хронике, был в 1528 году до нашей эры, то есть метод выплавки железа из руды был открыт примерно в 1455 году до н. э. Однако из описания Климента не ясно, говорит ли он именно об этой горе в Передней Азии (Ида Фригийская у Вергилия), или же о горе Ида на острове Крит, о которой римский поэт Вергилий в Энеиде пишет:
Остров Юпитера, Крета, лежит средь широкого моря,
Нашего племени там колыбель, где высится Ида …
А римляне, как известно, были потомками малоазиатских троянцев, переселившихся в Италию после разрушения Трои. Могила их предводителя Энея до сих пор существует в местечке Пратика-ди-Маре возле Рима, и в ней был обнаружен железный жезл — символ власти, и другие предметы из железа и бронзы.
Более вероятно, что Климент Александрийский говорит именно о фригийской Иде возле Трои, так как там были найдены древние железные копи и очаги железоделательного производства. Видимо, ознакомившись с методом халибов, древние троянцы развили свой способ выплавки стали из руды, оказавшийся более производительным.
В самой глубокой древности железо ценилось дороже золота, и по описанию Страбона, у африканских племён за 1 фунт железа давали 10 фунтов золота, а по исследованиям историка Г. Арешяна стоимости меди, серебра, золота и железа у древних хеттов были в соотношении 1 : 160 : 1280 : 6400. В те времена железо использовалось как ювелирный металл, из него делали троны и другие регалии царской власти: например, в библейской книге Второзаконие 3,11 описан «одр железный» рефаимского царя Ога. В гробнице Тутанхамона (около 1350 года до н. э.) был найден кинжал из железа в золотой оправе — возможно, подаренный хеттами в дипломатических целях. Но хетты не стремились к широкому распространению железа и его технологий, что видно и из дошедшей до нас переписки египетского фараона и его тестя — царя Хеттов. Фараон просит прислать побольше железа, а царь хеттов уклончиво отвечает, что запасы железа иссякли, а кузнецы заняты на сельскохозяйственных работах, поэтому он не может выполнить просьбу царственного зятя. Как видно, хетты старались использовать свои знания для достижения военных преимуществ, и не давали другим возможности сравняться с ними. Видимо, поэтому железные изделия получили широкое распространение только после Троянской войны и падения державы хеттов, когда благодаря торговой активности греков технология железа стала известной многим, и были открыты железные месторождения и рудники. Так на смену «Бронзовому» веку настал век «Железный».
По описаниям Гомера, хотя во время Троянской войны (примерно 1250 год до н. э.) оружие было в основном из меди и бронзы, но железо уже было хорошо известно и пользовалось большим спросом, хотя больше как драгоценный металл. Например, в 23-й песне «Илиады» Гомер рассказывает, что Ахилл наградил диском из железной крицы победителя в соревновании по метанию диска. Это железо ахейцы добывали у троянцев и сопредельных народов (Илиада 7,473), в том числе у халибов, которые воевали на стороне троянцев:
Прочие мужи ахейские меной вино покупали,
Те за звенящую медь, за седое железо меняли,
Те за воловые кожи или волов круторогих,
Те за своих полоненых. И пир уготовлен веселый…
Возможно, железо было одной из причин, побудивших греков-ахейцев двинуться в Малую Азию, где они узнали секреты его производства. А раскопки в Афинах показали, что уже около 1100 года до н. э. и позднее уже широко были распространены железные мечи, копья, топоры, и даже железные гвозди. В библейской книге Иисуса Навина 17,16 (ср. Судей 14,4) описывается, что филистимляне (библейские «PILISTIM», а это были протогреческие племена, родственные позднейшим эллинам, в основном пеласги) имели множество железных колесниц, то есть, в это время железо уже стало широко применяться в больших количествах.
Гомер в «Илиаде» и «Одиссее» называет железо «многотрудный металл», и описывает закалку орудий:
Расторопный ковач, изготовив топор иль секиру,
В воду металл, раскаливши его, чтоб двойную
Он крепость имел, погружает…
Гомер называет железо многотрудным, потому что в древности основным методом его получения был сыродутный процесс: перемежающиеся слои железной руды и древесного угля прокаливались в специальных печах (горнах — от древнего «Horn» — рог, труба, первоначально это была просто труба, вырытая в земле, обычно горизонтально в склоне оврага). В горне окислы железа восстанавливаются до металла раскалённым углём, который отбирает кислород, окисляясь до окиси углерода, и в результате такого прокаливания руды с углём получалось тестообразное кричное (губчатое) железо. Крицу очищали от шлаков ковкой, выдавливая примеси сильными ударами молота. Первые горны имели сравнительно низкую температуру — заметно меньше температуры плавления чугуна, поэтому железо получалось сравнительно малоуглеродистым. Чтобы получить крепкую сталь приходилось много раз прокаливать и проковывать железную крицу с углём, при этом поверхностный слой металла дополнительно насыщался углеродом и упрочнялся. И хотя это требовало больших трудов, изделия, полученные таким способом, были существенно более крепкими, чем бронзовые.
В дальнейшем научились делать более эффективные печи (в русском языке — домна, домница) для производства стали, и применили меха для подачи воздуха в горн. Уже римляне умели доводить температуру в печи до плавления стали (около 1400 градусов, а чистое железо плавится при 1535 градусах). При этом образуется чугун с температурой плавления 1100—1200 градусов, очень хрупкий в твёрдом состоянии (даже не поддающийся ковке), и не обладающий упругостью стали. Первоначально его считали вредным побочным продуктом (англ. pig iron, по-русски, свинское железо, чушки, откуда, собственно, и происходит слово чугун), но потом обнаружилось, что при повторном прожигании в печи с усиленным продуванием воздуха чугун превращается в сталь хорошего качества, так как лишний углерод выгорает. Такой двухстадийный процесс производства стали из чугуна оказался более простым и выгодным, чем кричный, и этот принцип используется без особых изменений многие века, оставаясь и до наших дней основным способом производства железных материалов.
Происхождение названия
Схема атома железа (условно)Версии происхождения славянского слова «железо» (белор. жалеза, болг. желязо, укр. залізо, польск. Żelazo, словен. Železo).
Наиболее вероятно, что это название происходит от древнеарийского корня «ZIL», которым обозначали олово и вообще белые металлы (в том числе серебро — «zilber», и название «цинк» получилось из этого же слова аберрацией L-N). От него же, видимо, происходит и санскритское «жальжа», что означает «металл, руда». Другая версия усматривает в слове славянский корень «лез», тот же, что и в слове «лезвие» (так как железо в основном употреблялось на изготовление оружия), третье связывает с греческим словом χαλκός, что означало железо и медь. Есть также связь между словом «желе» и студнеобразной консистенцией «болотной руды», из которой некоторое время добывался металл.
Название природного карбоната железа (сидерита) происходит от sidereus — звёздный; действительно, первое железо, попавшее в руки людям, было метеоритного происхождения. Возможно, это совпадение не случайно. В частности древнегреческое слово сидерос (σίδηρος) для железа и латинское sidus, означающее «звезда», вероятно, имеют общее происхождение.
Изотопы железа
Изотоп железа 56Fe относится к наиболее стабильным ядрам: все следующие элементы могут уменьшить энергию связи на нуклон путём распада, а все предыдущие элементы, в принципе, могли бы уменьшить энергию связи на нуклон за счёт синтеза. Полагают, что железом оканчивается ряд синтеза элементов в ядрах нормальных звёзд, а все последующие элементы могут образоваться только в результате взрывов сверхновых.
Геохимия железа
Гидротермальный источник с железистой водой. Окислы железа окрашивают воду в бурый цветЖелезо — один из самых распространённых элементов в Солнечной системе, особенно на планетах земной группы, в частности, на Земле. Значительная часть железа планет земной группы находится в ядрах планет, где его содержание, по оценкам, около 90 %. Содержание железа в земной коре составляет 5 %, а в мантии около 12 %. Из металлов железо уступает по распространённости в коре только алюминию. При этом в ядре находится около 86 % всего железа, а в мантии 14 %.
Геохимические свойства железа
Важнейшая геохимическая особенность железа — наличие у него нескольких степеней окисления. Железо в нейтральной форме — металлическое — слагает ядро земли, возможно, присутствует в мантии и очень редко встречается в земной коре. Закисное железо FeO — основная форма нахождения железа в мантии и земной коре. Окисное железо Fe2O3 характерно для самых верхних, наиболее окисленных, частей земной коры, в частности, осадочных пород.
По кристаллохимическим свойствам ион Fe2+ близок к ионам Mg2+ и Ca2+ — другим главным элементам, составляющим значительную часть всех земных пород. В силу кристаллохимического сходства железо замещает магний и, частично, кальций во многих силикатах. При этом содержание железа в минералах переменного состава обычно увеличивается с уменьшением температуры.
Минералы железа
В земной коре железо распространено достаточно широко — на его долю приходится около 4,1 % массы земной коры (4-е место среди всех элементов, 2-е среди металлов). В мантии и земной коре железо сосредоточено главным образом в силикатах, при этом его содержание значительно в основных и ультраосновных породах, и мало — в кислых и средних породах.
Известно большое число руд и минералов, содержащих железо. Наибольшее практическое значение имеют красный железняк (гематит, Fe2O3; содержит до 70 % Fe), магнитный железняк (магнетит, FeFe2O4, Fe3O4; содержит 72,4 % Fe), бурый железняк или лимонит (гётит и гидрогётит, соответственно FeOOH и FeOOH·nH2O), а также шпатовый железняк (сидерит, карбонат железа(II), FeCO3; содержит около 48 % Fe). Гётит и гидрогётит чаще всего встречаются в корах выветривания, образуя так называемые «железные шляпы», мощность которых достигает несколько сотен метров. Также они могут иметь осадочное происхождение, выпадая из коллоидных растворов в озёрах или прибрежных зонах морей. При этом образуются оолитовые, или бобовые, железные руды. В них часто встречается вивианит Fe(3PO4)2·8H2O, образующий чёрные удлинённые кристаллы и радиально-лучистые агрегаты.
В природе также широко распространены сульфиды железа — пирит FeS2 (серный или железный колчедан) и пирротин. Они не являются железной рудой — пирит используют для получения серной кислоты, а пирротин часто содержит никель и кобальт.
По запасам железных руд Россия занимает первое место в мире. Содержание железа в морской воде — 1×10−5—1×10−8 %.
Получение
В промышленности железо получают из железной руды, в основном из гематита (Fe2O3) и магнетита (Fe3O4).
Существуют различные способы извлечения железа из руд. Наиболее распространённым является доменный процесс.
Первый этап производства — восстановление железа углеродом в доменной печи при температуре 2000 °C. В доменной печи углерод в виде кокса, железная руда в виде агломерата или окатышей и флюс (например, известняк) подаются сверху, а снизу их встречает поток нагнетаемого горячего воздуха.
В печи углерод кокса окисляется до монооксида углерода (угарного газа) кислородом воздуха:
2C + O2 → 2CO↑.В свою очередь, угарный газ восстанавливает железо из руды:
3CO + Fe2O3 → 2Fe + 3CO2↑.Флюс добавляется для извлечения нежелательных примесей из руды, в первую очередь силикатов, таких как кварц (диоксид кремния). Типичный флюс содержит известняк (карбонат кальция) и доломит (карбонат магния). Против других примесей используют другие флюсы.
Действие флюса: карбонат кальция под действием тепла разлагается до оксида кальция (негашёная известь):
CaCO3 → CaO + CO2↑.Оксид кальция соединяется с диоксидом кремния, образуя шлак:
CaO + SiO2 → CaSiO3.Шлак, в отличие от диоксида кремния, плавится в печи. Более лёгкий, чем железо, шлак плавает на поверхности, и его можно сливать отдельно от металла. Шлак затем употребляется в строительстве и сельском хозяйстве. Расплав железа, полученный в доменной печи, содержит довольно много углерода (чугун). Кроме случаев, когда чугун используется непосредственно, он требует дальнейшей переработки.
Излишний углерод и другие примеси (сера, фосфор) удаляют из чугуна окислением в мартеновских печах или в конвертерах. Электрические печи используют и для выплавки легированных сталей.
Кроме доменного процесса, распространён процесс прямого получения железа. В этом случае предварительно измельчённую руду смешивают с особой глиной, формируя окатыши. Окатыши обжигают, и обрабатывают в шахтной печи горячими продуктами конверсии метана, содержащими водород. Водород легко восстанавливает железо, при этом не происходит загрязнения железа такими примесями как сера и фосфор — обычными примесями в каменном угле. Железо получается в твёрдом виде, и в дальнейшем переплавляется в электрических печах.
Химически чистое железо получается электролизом растворов его солей.
Физические свойства
Железо — типичный металл, в свободном состоянии — серебристо-белого цвета с сероватым оттенком. Чистый металл пластичен, различные примеси (в частности — углерод) повышают его твёрдость и хрупкость. Обладает ярко выраженными магнитными свойствами. Часто выделяют так называемую «триаду железа» — группу трёх металлов (железо Fe, кобальт Co, никель Ni), обладающих схожими физическими свойствами, атомными радиусами и значениями электроотрицательности.
Для железа характерен полиморфизм, он имеет четыре кристаллические модификации:
Металловедение не выделяет β-Fe как отдельную фазу[4], и рассматривает её как разновидность α-Fe. При нагреве железа или стали выше точки Кюри (769 °C ≈ 1043 K) тепловое движение ионов расстраивает ориентацию спиновых магнитных моментов электронов, ферромагнетик становится парамагнетиком — происходит фазовый переход второго рода, но фазового перехода первого рода с изменением основных физических параметров кристаллов не происходит.
Для чистого железа при нормальном давлении, с точки зрения металловедения, существуют следующие устойчивые модификации:
- От абсолютного нуля до 910 °C устойчива α-модификация с объёмноцентрированной кубической (ОЦК) кристаллической решёткой. Твёрдый раствор углерода в α-железе называется ферритом.
- От 910 до 1400 °C устойчива γ-модификация с гранецентрированной кубической (ГЦК) кристаллической решёткой. Твёрдый раствор углерода в γ-железе называется аустенитом.
- От 910 до 1539 °C устойчива δ-модификация с объёмноцентрированной кубической (ОЦК) кристаллической решёткой. Твёрдый раствор углерода в δ-железе (также как и в α-железе) называется ферритом. Иногда различают высокотемпературный δ-феррит и низкотемпературный α-феррит (или просто феррит), хотя их атомные структуры одинаковы.
Наличие в стали углерода и легирующих элементов существенным образом изменяет температуры фазовых переходов (см. фазовую диаграмму железо — углерод).
- В области высоких давлений (свыше 104 МПа, 100 тыс. атм.) возникает модификация ε-железа с гексагональной плотноупакованной (ГПУ) решёткой.
Явление полиморфизма чрезвычайно важно для металлургии стали. Именно благодаря α—γ переходам кристаллической решётки происходит термообработка стали. Без этого явления железо как основа стали не получило бы такого широкого применения.
Железо тугоплавко, относится к металлам средней активности. Температура плавления железа 1539 °C, температура кипения — 2862 °C.
Химические свойства
Основные степени окисления железа — +2 и +3.
При хранении на воздухе при температуре до 200 °C железо постепенно покрывается плотной плёнкой оксида, препятствующего дальнейшему окислению металла. Во влажном воздухе железо покрывается рыхлым слоем ржавчины, который не препятствует доступу кислорода и влаги к металлу и его разрушению. Ржавчина не имеет постоянного химического состава, приближённо её химическую формулу можно записать как Fe2O3·xH2O.
С кислородом железо реагирует при нагревании. При сгорании железа на воздухе образуется оксид Fe3O4, при сгорании в чистом кислороде — оксид Fe2O3. Если кислород или воздух пропускать через расплавленное железо, то образуется оксид FeO. При нагревании порошка серы и железа образуется сульфид, приближённую формулу которого можно записать как FeS.
Железо при нагревании реагирует с галогенами. Так как FeF3 нелетуч, железо устойчиво к действию фтора до температуры 200—300 °C. При хлорировании железа (при температуре около 200 °C) образуется летучий FeCl3. Если взаимодействие железа и брома протекает при комнатной температуре или при нагревании и повышенном давлении паров брома, то образуется FeBr3. При нагревании FeCl3 и, особенно, FeBr3 отщепляют галоген и превращаются в галогениды железа(II). При взаимодействии железа и иода образуется иодид Fe3I8.
При нагревании железо реагирует с азотом, образуя нитрид железа Fe3N, с фосфором, образуя фосфиды FeP, Fe2P и Fe3P, с углеродом, образуя карбид Fe3C, с кремнием, образуя несколько силицидов, например, FeSi.
При повышенном давлении металлическое железо реагирует с оксидом углерода(II) CO, причём образуется жидкий, при обычных условиях легко летучий пентакарбонил железа Fe(CO)5. Известны также карбонилы железа составов Fe2(CO)9 и Fe3(CO)12. Карбонилы железа служат исходными веществами при синтезе железоорганических соединений, в том числе и ферроцена состава (η5-C5H5)2Fe.
Чистое металлическое железо устойчиво в воде и в разбавленных растворах щелочей. В концентрированной серной и азотной кислотах железо не растворяется, так как прочная оксидная плёнка пассивирует его поверхность.
С соляной и разбавленной (приблизительно 20%-й) серной кислотами железо реагирует с образованием солей железа(II):
Fe + 2HCl → FeCl2 + H2↑;
Fe + H2SO4 → FeSO4 + H2↑.
При взаимодействии железа с приблизительно 70%-й серной кислотой реакция протекает с образованием сульфата железа(III):
2Fe + 6H2SO4 → Fe2(SO4)3 + 3SO2↑ + 6H2O.
Оксид железа(II) FeO обладает основными свойствами, ему отвечает основание Fe(OH)2. Оксид железа(III) Fe2O3 слабо амфотерен, ему отвечает ещё более слабое, чем Fe(OH)2, основание Fe(OH)3, которое реагирует с кислотами:
2Fe(OH)3 + 3H2SO4 → Fe2(SO4)3 + 6H2O.
Гидроксид железа(III) Fe(OH)3 проявляет слабо амфотерные свойства, он способен реагировать только с концентрированными растворами щелочей:
Fe(OH)3 + 3КОН → K3[Fe(OH)6].
Образующиеся при этом гидроксокомплексы железа(III) устойчивы в сильно щелочных растворах. При разбавлении растворов водой они разрушаются, причём в осадок выпадает Fe(OH)3.
Соединения железа(III) в растворах восстанавливаются металлическим железом:
Fe + 2FeCl3 → 3FeCl2.
При хранении водных растворов солей железа(II) наблюдается окисление железа(II) до железа(III):
4FeCl2 + O2 + 2H2O → 4Fe(OH)Cl2.
Из солей железа(II) в водных растворах устойчива соль Мора — двойной сульфат аммония и железа(II) (NH4)2Fe(SO4)2·6Н2O.
Железо(III) способно образовывать двойные сульфаты с однозарядными катионами типа квасцов, например, KFe(SO4)2 — железокалиевые квасцы, (NH4)Fe(SO4)2 — железоаммонийные квасцы и т. д.
При действии газообразного хлора или озона на щелочные растворы соединений железа(III) образуются соединения железа(VI) — ферраты, например, феррат(VI) калия K2FeO4. Имеются сообщения о получении под действием сильных окислителей соединений железа(VIII).
Для обнаружения в растворе соединений железа(III) используют качественную реакцию ионов Fe3+ с тиоцианат-ионами SCN—. При взаимодействии ионов Fe3+ с анионами SCN— образуется ярко-красный роданид железа Fe(SCN)3. Другим реактивом на ионы Fe3+ служит гексацианоферрат(II) калия K4[Fe(CN)6] (жёлтой кровяная соль). При взаимодействии ионов Fe3+ и [Fe(CN)6]4− выпадает ярко-синий осадок берлинской лазури:
4K4[Fe(CN)6] + 4Fe3+ → 4KFeIII[FeII(CN)6]↓ + 12K+.
Реактивом на ионы Fe2+ в растворе может служить гексацианоферрат(III) калия K3[Fe(CN)6] (красная кровяная соль). При взаимодействии ионов Fe2+ и [Fe(CN)6]3− выпадает осадок турнбулевой сини:
3K3[Fe(CN)6] + 3Fe2+ → 3KFeII[FeIII(CN)6]↓ + 6K+.
Интересно, что берлинская лазурь и турнбулева синь — две формы одного и того же вещества, так как в растворе устанавливается равновесие:
KFeIII[FeII(CN)6] ↔ KFeII[FeIII(CN)6].
Применение
Железная рудаЖелезо — один из самых используемых металлов, на него приходится до 95 % мирового металлургического производства.
-
Железо является основным компонентом сталей и чугунов — важнейших конструкционных материалов.
Железо может входить в состав сплавов на основе других металлов — например, никелевых.
Магнитная окись железа (магнетит) — важный материал в производстве устройств долговременной компьютерной памяти: жёстких дисков, дискет и т. п.
Ультрадисперсный порошок магнетита используется в черно-белых лазерных принтерах в качестве тонера.
Уникальные ферромагнитные свойства ряда сплавов на основе железа способствуют их широкому применению в электротехнике для магнитопроводов трансформаторов и электродвигателей.
Хлорид железа(III) (хлорное железо) используется в радиолюбительской практике для травления печатных плат.
Семиводный сульфат железа (железный купорос) в смеси с медным купоросом используется для борьбы с вредными грибками в садоводстве и строительстве.
Железо применяется в качестве анода в железо-никелевых аккумуляторах, железо-воздушных аккумуляторах.
Биологическое значение железа
В живых организмах железо является важным микроэлементом, катализирующим процессы обмена кислородом (дыхания). В организме взрослого человека содержится около 3,5 грамма железа (около 0,02 %), из которых 75 % являются главным действующим элементом гемоглобина крови, остальное входит в состав ферментов других клеток, катализируя процессы дыхания в клетках. Недостаток железа проявляется как болезнь организма (хлороз у растений и анемия у животных).
Обычно железо входит в ферменты в виде комплекса, называемого гемом. В частности, этот комплекс присутствует в гемоглобине — важнейшем белке, обеспечивающем транспорт кислорода с кровью ко всем органам человека и животных. И именно он окрашивает кровь в характерный красный цвет.
Комплексы железа, отличные от гема, встречаются, например, в ферменте метан-моноксигеназе, окисляющем метан в метанол, в важном ферменте рибонуклеотид-редуктазе, который участвует в синтезе ДНК.
Неорганические соединения железа встречается в некоторых бактериях, иногда используется ими для связывания азота воздуха.
В организм животных и человека железо поступает с пищей (наиболее богаты им печень, мясо, яйца, бобовые, хлеб, крупы, свёкла). Интересно, что некогда шпинат ошибочно был внесён в этот список (из-за опечатки в результатах анализа — был потерян «лишний» ноль после запятой).
Суточная потребность человека в железе следующая: дети — от 4 до 18 мг, взрослые мужчины — 10 мг, взрослые женщины — 18 мг, беременные женщины во второй половине беременности — 33 мг. У женщин потребность несколько выше, чем у мужчин. Как правило, железа, поступающего с пищей, вполне достаточно, но в некоторых специальных случаях (анемия, а также при донорстве крови) необходимо применять железосодержащие препараты и пищевые добавки (гематоген, ферроплекс).
Содержание железа в воде больше 1—2 мг/л значительно ухудшает её органолептические свойства, придавая ей неприятный вяжущий вкус, и делает воду малопригодной для использования, вызывает у человека аллергические реакции, может стать причиной болезни крови и печени (гемохроматоз). ПДК железа в воде 0,3 мг/л.
Избыточная доза железа (200 мг и выше) может оказывать токсическое действие. Передозировка железа угнетает антиоксидантную систему организма, поэтому употреблять препараты железа здоровым людям не рекомендуется.
Соединения железа
Оксиды железа
Гидроксиды железа
Железнение
Железо самородное
Какова температура плавления железа. При каких температурах плавятся различные металлы и неметаллы? Температура плавления неметаллов
Температура плавления химически чистого железа составляет 1539 о С. Технически чистое железо, полученное в результате окислительного рафинирования, содержит некоторое количество растворенного в металле кислорода. По этой причине температура его плавления понижается до 1530 о С.
Температура плавления стали всегда ниже температуры плавления железа в связи с наличием в ней примесей. Растворенные в железе металлы (Mn, Cr, Ni. Co, Mo, V и др.) понижают температуру плавления металла на 1 – 3 о С на 1% введенного элемента, а элементы из группы металлоидов (C, O, S, P и др.) на 30 – 80 о С.
На протяжении большей части общей продолжительности плавки температура плавления металла изменяется главным образом в результате изменения содержания углерода. При концентрации углерода 0,1 – 1,2%, которая характерна для доводки плавки в сталеплавильных агрегатах, температуру плавления металла с достаточной для практических целей точностью можно оценить из уравнения
Теплота плавления железа составляет 15200 Дж/моль или 271,7 кДж/кг.
Температура кипения железа в изданиях последних лет приводится равной 2735 о С. Однако, опубликованы результаты исследований, согласно которым температура кипения железа значительно выше (до 3230 о С).
Теплота испарения железа составляет 352,5 кДж/моль или 6300 кДж/кг.
Давление насыщенного пара железа (P Fe , Па) можно оценить при помощи уравнения
где Т – температура металла, К.
Результаты расчета давления насыщенного пара железа при различных температурах, а также содержания пыли в окислительной газовой фазе над металлом (X , г/м 3) представлены в таблице 1.1.
Таблица 1.1 – Давление насыщенного пара железа и запыленность газов при разных температурах
Согласно существующим санитарным нормам содержание пыли в газах, которые выбрасываются в атмосферу, не должно превышать 0,1 г/м 3 . Из данных таблицы 1.1 видно, что при 1600 о С запыленность газов над открытой поверхностью металла выше допустимых значений. Поэтому обязательно требуется очистка газов от пыли, состоящей в основном из оксидов железа.
Динамическая вязкость . Коэффициент динамической вязкости жидкости () определяется из соотношения
где F – сила взаимодействия двух движущихся слоев, Н;
S – площадь соприкосновения слоев, м 2 ;
– градиент скорости слоев жидкости по нормали к направлению потока, с -1 .
Динамическая вязкость сплавов железа обычно изменяется в пределах 0,001 – 0,005 Па с. Ее величина зависит от температуры и содержания примесей, главным образом углерода. При перегреве металла над температурой плавления выше 25 – 30 о С влияние температуры не существенно.
Кинематическая вязкость жидкости представляет собой скорость передачи импульса в потоке единичной массы. Ее величина определяется из уравнения
где – плотность жидкости, кг/м 3 .
Величина динамической вязкости жидкого железа близка к 6 10 -7 м 2 /с.
Плотность железа при 1550 – 1650 о С равна 6700 – 6800 кг/м 3 . При температуре кристаллизации плотность жидкого металла близка к 6850 кг/м 3 . Плотность твердого железа при температуре кристаллизации равна 7450 кг/м 3 , при комнатной температуре – 7800 кг/м 3 .
Из обычных примесей наибольшее влияние на плотность расплавов железа оказывают углерод и кремний, понижая ее. Поэтому обычного состава жидкий чугун имеет плотность 6200 – 6400 кг/м 3 , твердый при комнатной температуре – 7000 – 7200 кг/м 3 .
Плотность жидкой и твердой стали занимает промежуточное положение между плотностями железа и чугуна и составляет соответственно 6500 – 6600 и 7500 – 7600 кг/м 3 .
Удельная теплоемкость жидкого металла практически не зависит от температуры. В оценочных расчетах величину ее можно принимать равной 0,88 кДж/(кг К) для чугуна и 0,84 кДж/(кг К) для стали.
Поверхностное натяжение железа имеет максимальное значение при температуре около 1550 о С. В области более высоких и низких температур величина его уменьшается. Это отличает железо от большинства металлов, для которых характерно понижение поверхностного натяжения при повышении температуры.
Поверхностное натяжение жидких сплавов железа существенно меняется в зависимости от химического состава и температуры. Обычно оно изменяется в пределах 1000 – 1800 мДж/м 2 (рисунок 1.1).
Железом человек начал владеть (ковать, плавить) спустя несколько тысячелетий после освоения работ с медью. Первое самородное железо в виде комков было найдено на Ближнем Востоке в 3000 году А металлургия железа, по мнению специалистов, возникла в нескольких местах планеты, разные народы осваивали этот процесс в разное время. Благодаря этому железо как материал для изготовления орудий труда, охоты и войны вытеснило камень и бронзу.
Первые процессы изготовления железа назывались сыродутными. Суть заключалась в том, что в яму засыпалась железная руда с древесным углем, который разжигали и плотно закупоривали, оставляя дутьевое отверстие, через которое подавался свежий воздух для дутья. В процессе такого нагрева температура плавления железа, конечно, не могла быть достигнута, получалась размягченная масса (крица), в которой находился шлак (зола от топлива, окислы руды и породы).
Далее полученную крицу несколько раз проковывали, удаляя шлак и другие не нужные включения, этот трудоемкий процесс производился по несколько раз, в результате чего из общей массы до финишной операции доходила пятая часть. С изобретением водяного колеса появилась возможность подавать значительное количество воздуха. Благодаря такому дутью температура плавления железа стала достижимой, появился металл в жидком виде.
Этим металлом был чугун, который не ковался, но было замечено, что он хорошо заполняет форму. Это были первые опыты по которое с некоторыми усовершенствованиями и изменениями дошло до наших дней. Со временем был найден способ переработки чугуна в сварочное железо. Куски чугуна загружались с древесным углем, в ходе этого процесса чугун размягчался, происходило окисление примесей, в том числе углерода. В результате чего металл становился густым, температура плавления железа повышалась, т.е. получалось сварочное железо.
Таким образом, металлурги того времени смогли разделить единый процесс на две ступени. Этот двухступенчатый процесс в самой идее сохранился до настоящего времени, изменения в большей степени касаются появлению процессов, происходящих на втором этапе. Чистое железо или металл, имеющий минимум примесей, практического применения почти не имеет. Температура плавления железа по диаграмме железо — углерод находится в точке А, что соответствует 1535 градусам.
Железа наступает при достижении отметки 3200 градусов.
На открытом воздухе железо со временем покрывается оксидной пленкой, во влажной среде появляется рыхлый слой ржавчины. Железо с момента его появления и по сегодняшний день является одним из главных металлов. Используется железо, главным образом, в виде сплавов, которые различаются по свойствам и составу.
При какой температуре плавится железо, зависит от содержания углерода и других компонентов, входящих в состав сплава. Наибольшее применение имеют углеродистые сплавы — чугун и сталь. Сплавы, содержащие углерод более 2%, называют чугуном, менее 2% относятся к стали. Чугун получают в доменных печах, путем переплава обогащенных на аглофабрике руд.
В мартеновских, электрических и индукционных печах, в конвертерах.
В качестве шихты применяется металлический лом и чугун. Путем окислительных процессов из шихты удаляется лишний углерод и вредные примеси, а добавки легирующих материалов позволяют получить нужную Для получения стали и других сплавов современные металлургия использует технологии электрошлакового переплава, вакуумные, электронно-лучевые и плазменные плавки.
В разработке находятся новые методы плавления стали, предусматривающие автоматизацию процесса и обеспечивающие получение высококачественного металла.
Научные разработки достигли такого уровня, когда можно получать материалы, выдерживающие вакуум и большое давление, большие температурные перепады, агрессивную среду, радиационные излучения и т.п.
Ковкий металл серебристо-белого цвета с высокой химической реакционной способностью: железо быстро корродирует при высоких температурах или при высокой влажности на воздухе. В чистом кислороде железо горит, а в мелкодисперсном состоянии самовозгорается и на воздухе. Обозначается символом Fe (лат. Ferrum). Один из самых распространённых в земной коре металлов (второе место после ).
Смотрите так же:
СТРУКТУРА
Для железа установлено несколько полиморфных модификаций, из которых высокотемпературная модификация — γ-Fe(выше 906°) образует решетку гранецентрированного куба типа Сu (а 0 = 3,63), а низкотемпературная — α-Fe-решетку центрированного куба типа α-Fe (a 0 = 2,86).
В зависимости от температуры нагрева железо может находиться в трех модификациях, характеризующихся различным строением кристаллической решетки:
- В интервале температур от самых низких до 910°С -а-феррит (альфа-феррит), имеющий строение кристаллической решетки в виде центрированного куба;
- В интервале температур от 910 до 1390°С — аустенит, кристаллическая решетка которого имеет строение гранецентрированного куба;
- В интервале температур от 1390 до 1535°С (температура плавления) — д-феррит (дельта-феррит). Кристаллическая решетка д-феррита такая же, как и а-феррита. Различие между ними только в иных (для д-феррита больших) расстояниях между атомами.
При охлаждении жидкого железа первичные кристаллы (центры кристаллизации) возникают одновременно во многих точках охлаждаемого объема. При последующем охлаждении вокруг каждого центра надстраиваются новые кристаллические ячейки, пока не будет исчерпан весь запас жидкого металла.
В результате получается зернистое строение металла. Каждое зерно имеет кристаллическую решетку с определенным направлением его осей.
При последующем охлаждении твердого железа при переходах д-феррита в аустенит и аустенита в а-феррит могут возникать новые центры кристаллизации с соответствующим изменением величины зерна
СВОЙСТВА
В чистом виде при нормальных условиях это твердое вещество. Оно обладает серебристо-серым цветом и ярко выраженным металлическим блеском. Механические свойства железа включают в себя уровень твердости по шкале Мооса. Она равна четырем (средняя). Железо обладает хорошей электропроводностью и теплопроводностью. Последнюю особенность можно ощутить, дотронувшись до железного предмета в холодном помещении. Так как этот материал быстро проводит тепло, он за короткий промежуток времени забирает большую его часть из вашей кожи, и поэтому вы ощущаете холод.
Дотронувшись, к примеру, до дерева, можно отметить, что его теплопроводность намного ниже. Физические свойства железа — это и его температуры плавления и кипения. Первая составляет 1539 градусов по шкале Цельсия, вторая — 2860 градусов по Цельсию. Можно сделать вывод, что характерные свойства железа — хорошая пластичность и легкоплавкость. Но и это еще далеко не все. Также в физические свойства железа входит и его ферромагнитность. Что это такое? Железо, магнитные свойства которого мы можем наблюдать на практических примерах каждый день, — единственный металл, обладающий такой уникальной отличительной чертой. Это объясняется тем, что данный материал способен намагничиваться под действием магнитного поля. А по прекращении действия последнего железо, магнитные свойства которого только что сформировались, еще надолго само остается магнитом. Такой феномен можно объяснить тем, что в структуре данного металла присутствует множество свободных электронов, которые способны передвигаться.
ЗАПАСЫ И ДОБЫЧА
Железо — один из самых распространённых элементов в Солнечной системе, особенно на планетах земной группы, в частности, на Земле. Значительная часть железа планет земной группы находится в ядрах планет, где его содержание, по оценкам, около 90 %. Содержание железа в земной коре составляет 5 %, а в мантии около 12 %.
В земной коре железо распространено достаточно широко — на его долю приходится около 4,1 % массы земной коры (4-е место среди всех элементов, 2-е среди металлов). В мантии и земной коре железо сосредоточено главным образом в силикатах, при этом его содержание значительно в основных и ультраосновных породах, и мало — в кислых и средних породах.
Известно большое число руд и минералов, содержащих железо. Наибольшее практическое значение имеют красный железняк (гематит, Fe2O3; содержит до 70 % Fe), магнитный железняк (магнетит, FeFe 2 O 4 , Fe 3 O 4 ; содержит 72,4 % Fe), бурый железняк или лимонит (гётит и гидрогётит, соответственно FeOOH и FeOOH·nH 2 O). Гётит и гидрогётит чаще всего встречаются в корах выветривания, образуя так называемые «железные шляпы», мощность которых достигает несколько сотен метров. Также они могут иметь осадочное происхождение, выпадая из коллоидных растворов в озёрах или прибрежных зонах морей. При этом образуются оолитовые, или бобовые, железные руды. В них часто встречается вивианит Fe 3 (PO 4) 2 ·8H 2 O, образующий чёрные удлинённые кристаллы и радиально-лучистые агрегаты.
Содержание железа в морской воде — 1·10 −5 -1·10 −8 %
В промышленности железо получают из железной руды, в основном из гематита (Fe 2 O 3) и магнетита (FeO·Fe 2 O 3).
Существуют различные способы извлечения железа из руд. Наиболее распространённым является доменный процесс.
Первый этап производства — восстановление железа углеродом в доменной печи при температуре 2000 °C. В доменной печи углерод в виде кокса, железная руда в виде агломерата или окатышей и флюс (например, известняк) подаются сверху, а снизу их встречает поток нагнетаемого горячего воздуха.
Кроме доменного процесса, распространён процесс прямого получения железа. В этом случае предварительно измельчённую руду смешивают с особой глиной, формируя окатыши. Окатыши обжигают, и обрабатывают в шахтной печи горячими продуктами конверсии метана, которые содержат водород. Водород легко восстанавливает железо, при этом не происходит загрязнения железа такими примесями, как сера и фосфор, которые являются обычными примесями в каменном угле. Железо получается в твёрдом виде, и в дальнейшем переплавляется в электрических печах. Химически чистое железо получается электролизом растворов его солей.
ПРОИСХОЖДЕНИЕ
Происхождение теллурическое (земное) железо редко встречается в базальтовыхлавах (Уифак, о. Диско, у западного берега Гренландии, вблизи г. Касселя Германия). В обоих пунктах с ним ассоциируют пирротин (Fe 1-x S) и когенит (Fe 3 C), что объясняют как восстановление углеродом (в том числе и из вмещающих пород), так и распадом карбонильных комплексов типа Fe(CO) n . В микроскопических зернах оно не раз устанавливалось в измененных (серпентинизированных) ультраосновных породах также в парагенезисе с пирротином, иногда с магнетитом, за счет которых оно и возникает при восстановительных реакциях. Очень редко встречается в зоне окисления рудных месторождений, при образовании болотных руд. Зарегистрированы находки в осадочных породах, связываемые с восстановлением соединений железа водородом и углеводородами.
Почти чистое железо найдено в лунном грунте, что связывают как с падениями метеоритов, так и с магматическими процессами. Наконец, два класса метеоритов — железокаменные и железные содержат природные сплавы железа в качестве породообразующего компонента.
ПРИМЕНЕНИЕ
Железо — один из самых используемых металлов, на него приходится до 95 % мирового металлургического производства.
Железо является основным компонентом сталей и чугунов — важнейших конструкционных материалов.
Железо может входить в состав сплавов на основе других металлов — например, никелевых.
Магнитная окись железа (магнетит) — важный материал в производстве устройств долговременной компьютерной памяти: жёстких дисков, дискет и т. п.
Ультрадисперсный порошок магнетита используется во многих чёрно-белых лазерных принтерах в смеси с полимерными гранулами в качестве тонера. Здесь одновременно используется чёрный цвет магнетита и его способность прилипать к намагниченному валику переноса.
Уникальные ферромагнитные свойства ряда сплавов на основе железа способствуют их широкому применению в электротехнике для магнитопроводов трансформаторов и электродвигателей.
Хлорид железа(III) (хлорное железо) используется в радиолюбительской практике для травления печатных плат.
Семиводный сульфат железа (железный купорос) в смеси с медным купоросом используется для борьбы с вредными грибками в садоводстве и строительстве.
Железо применяется в качестве анода в железо-никелевых аккумуляторах, железо-воздушных аккумуляторах.
Водные растворы хлоридов двухвалентного и трёхвалентного железа, а также его сульфатов используются в качестве коагулянтов в процессах очистки природных и сточных вод на водоподготовке промышленных предприятий.
Железо (англ. Iron) — Fe
КЛАССИФИКАЦИЯ
Hey’s CIM Ref1.57
| Strunz (8-ое издание) | 1/A.07-10 |
| Nickel-Strunz (10-ое издание) | 1.AE.05 |
| Dana (7-ое издание) | 1.1.17.1 |
Температура плавления металла – это минимальная температура, при которой он переходит из твердого состояния в жидкое. При плавлении его объем практически не изменяется. Металлы классифицируют по температуре плавления в зависимости от степени нагревания.
Легкоплавкие металлы
Легкоплавкие металлы имеют температуру плавления ниже 600°C. Это цинк, олово, висмут. Такие металлы можно расплавить в , разогрев их на плите, или с помощью паяльника. Легкоплавкие металлы используются в электронике и технике для соединения металлических элементов и проводов для движения электрического тока. Температура составляет 232 градуса, а цинка – 419.
Среднеплавкие металлы
Среднеплавкие металлы начинают переходить из твердого в жидкое состояние при температуре от 600°C до 1600°C. Они используются для изготовления плит, арматур, блоков и других металлических конструкций, пригодных для строительства. К этой группе металлов относятся железо, медь, алюминий, они также входят в состав многих сплавов. Медь добавляют в сплавы драгоценных металлов, таких как золото, серебро, платина. Золото 750 пробы на 25% состоит из лигатурных металлов, в том числе и меди, которая придает ему красноватый оттенок. Температура плавления этого материала равна 1084 °C. А алюминий начинает плавиться при относительно низкой температуре, составляющей 660 градусов Цельсия. Это легкий пластичный и недорогой металл, который не окисляется и не ржавеет, поэтому широко используется при изготовлении посуды. Температура равна 1539 градусов. Это один из самых популярных и доступных металлов, его применение распространено в строительстве и автомобильной промышленности. Но ввиду того, что железо подвергается коррозии, его нужно дополнительно обрабатывать и покрывать защитным слоем краски, олифы или не допускать попадания влаги.
Тугоплавкие металлы
Температура тугоплавких металлов выше 1600°C. Это вольфрам, титан, платина, хром и другие. Их используют в качестве источников света, машинных деталей, смазочных материалов, а также в ядерной промышленности. Из них изготавливают проволоки, высоковольтные провода и используют для расплавки других металлов с более низкой температурой плавления. Платина начинает переходить из твердого в жидкое состояние при температуре 1769 градусов, а вольфрам – при температуре 3420°C.
Ртуть – единственный металл, находящийся в жидком состоянии при обычных условиях, а именно, нормальном атмосферном давлении и средней температуре окружающей среды. Температура плавления ртути составляет минус 39°C. Этот металл и его пары являются ядовитыми, поэтому он используется только в закрытых емкостях или в лабораториях. Распространенное применение ртути – градусник для измерения температуры тела.
Почти все металлы при нормальных условиях представляют собой твердые вещества. Но при определенных температурах они могут изменять свое агрегатное состояние и становиться жидкими. Давайте узнаем, какая температура плавления металла самая высокая? Какая самая низкая?
Температура плавления металлов
Большая часть элементов периодической таблицы относится к металлам. В настоящее время их насчитывается примерно 96. Всем им необходимы разные условия, чтобы превратиться в жидкость.
Порог нагревания твердых кристаллических веществ, превысив который они становятся жидкими, называется температурой плавления. У металлов она колеблется в пределах нескольких тысяч градусов. Многие из них переходят в жидкость при относительно большом нагревании. Благодаря этому они являются распространенным материалом для производства кастрюль, сковородок и других кухонных приборов.
Средние температуры плавления имеют серебро (962 °С), алюминий (660,32 °С), золото (1064,18 °С), никель (1455 °С), платина (1772 °С) и т.д. Выделяют также группу тугоплавких и легкоплавких металлов. Первым, чтобы превратиться в жидкость, нужно больше 2000 градусов Цельсия, вторым — меньше 500 градусов.
К легкоплавким металлам обычно относят олово (232 °C), цинк (419 °C), свинец (327 °C). Однако у некоторых из них температуры могут быть еще ниже. Например, франций и галлий плавятся уже в руке, а цезий можно греть только в ампуле, ведь от кислорода он воспламеняется.
Самые низкие и высокие температуры плавления металлов представлены в таблице:
Вольфрам
Самая высокая температура плавления — у металла вольфрама. Выше него по этому показателю стоит только неметалл углерод. Вольфрам представляет собой светло-серое блестящее вещество, очень плотное и тяжелое. Он кипит при 5555 °C, что почти приравнивается к температуре фотосферы Солнца.
При комнатных условиях он слабо реагирует с кислородом и не подвергается коррозии. Несмотря на свою тугоплавкость, он довольно пластичен и поддается ковке уже при нагревании до 1600 °C. Эти свойства вольфрама используют для нитей накаливания в лампах и кинескопах электродов для сварки. Большую часть добытого металла сплавляют со сталью, чтобы повысить ее прочность и твердость.
Широкое применение вольфрам имеет в военной сфере и технике. Он незаменим для изготовления боеприпасов, брони, двигателей и наиболее важных частей военного транспорта и самолетов. Из него также делают хирургические инструменты, ящики для хранения радиоактивных веществ.
Ртуть
Ртуть — единственный металл, температура плавления которого имеет минусовое значение. К тому же это один из двух химических элементов, простые вещества которых при нормальных условиях, существуют в виде жидкостей. Интересно, что кипит металл при нагревании до 356,73 °C, а это намного выше температуры его плавления.
Имеет серебристо-белый цвет и ярко выраженный блеск. Она испаряется уже при комнатных условиях, конденсируясь в небольшие шарики. Металл очень токсичен. Он способен накапливается во внутренних органах человека, вызывая болезни головного мозга, селезенки, почек и печени.
Ртуть — один из семи первых металлов, о которых узнал человек. В Средние века она считалась главным алхимическим элементом. Несмотря на ядовитость, когда-то ее применяли в медицине в составе зубных пломб, а также как лекарство от сифилиса. Сейчас ртуть почти полностью исключили из медицинских препаратов, но широко используют ее в измерительных приборах (барометрах, манометрах), для изготовления ламп, переключателей, дверных звонков.
Сплавы
Чтобы изменить свойства того или иного металла, его сплавляют с другими веществами. Так, он может не только приобрести большую плотность, прочность, но и снизить или повысить температуру плавления.
Сплав может состоять из двух или больше химических элементов, но хотя бы один из них должен быть металлом. Такие «смеси» очень часто используют в промышленности, ведь они позволяют получить именно те качества материалов, которые необходимы.
Температура плавления металлов и сплавов зависит от чистоты первых, а также от пропорций и состава вторых. Для получения легкоплавких сплавов чаще всего используют свинец, ртуть, таллий, олово, кадмий, индий. Те, в составе которых находится ртуть, называются амальгамами. Соединение натрия, калия и цезия в соотношении 12%/47%/41% становится жидкостью уже при минус 78 °C , амальгама ртути и таллия — при минус 61°C. Самым тугоплавким материалом является сплав тантала и карбидов гафния в пропорциях 1:1 с температурой плавления 4115 °C.
Температура плавления и кипения металлов и неметаллов
В металлургической промышленности одним из основных направлений считается литье металлов и их сплавов по причине дешевизны и относительной простоты процесса. Отливаться могут формы с любыми очертаниями различных габаритов, от мелких до крупных; это подходит как для массового, так и для индивидуального производства.
Литье является одним из древнейших направлений работы с металлами, и начинается примерно с бронзового века: 7−3 тысячелетия до н. э. С тех пор было открыто множество материалов, что приводило к развитию технологии и повышению требований к литейной промышленности.
В наши дни существует много направлений и видов литья, различающихся по технологическому процессу. Одно остается неизменным — физическое свойство металлов переходить из твердого состояния в жидкое, и важно знать то, при какой температуре начинается плавление разных видов металлов и их сплавов.
Процесс плавления металла
Данный процесс обозначает собой переход вещества из твердого состояния в жидкое. При достижении точки плавления металл может находиться как в твердом, так и в жидком состоянии, дальнейшее возрастание приведет к полному переходу материала в жидкость.
То же самое происходит и при застывании — при достижении границы плавления вещество начнет переходить из жидкого состояния в твердое, и температура не изменится до полной кристаллизации.
При этом следует помнить, что данное правило применимо только для чистого металла. Сплавы не имеют четкой границы температур и совершают переход состояний в некотором диапазоне:
- Солидус — линия температуры, при которой начинает плавиться самый легкоплавкий компонент сплава.
- Ликвидус — окончательная точка плавления всех компонентов, ниже которой начинают появляться первые кристаллы сплава.
Точно измерить температуру плавления таких веществ невозможно, точкой перехода состояний указывается числовой промежуток.
В зависимости от температуры, при которой начинается плавление металлов, их принято разделять на:
- Легкоплавкие, до 600 °C. К ним относятся олово, цинк, свинец и другие.
- Среднеплавкие, до 1600 °C. Большинство распространенных сплавов, и такие металлы как золото, серебро, медь, железо, алюминий.
- Тугоплавкие, свыше 1600 °C. Титан, молибден, вольфрам, хром.
Также существует и температура кипения — точка, при достижении которой расплавленный металл начнет переход в газообразное состояние. Это очень высокая температура, как правило, в 2 раза превышающая точку расплава.
Влияние давления
Температура плавления и равная ей температура затвердевания зависят от давления, возрастая с его повышением. Это обусловлено тем, что при повышении давления атомы сближаются между собой, а для разрушения кристаллической решетки их нужно отдалить. При повышенном давлении требуется большая энергия теплового движения и соответствующая ей температура плавления увеличивается.
Существуют исключения, когда температура, необходимая для перехода в жидкое состояние, при повышенном давлении уменьшается. К таким веществам относят лёд, висмут, германий и сурьма.
Таблица температур плавления
Любому человеку, связанному с металлургической промышленностью, будь то сварщик, литейщик, плавильщик или ювелир, важно знать температуры, при которых происходит расплав материалов, с которыми он работает. В нижеприведенной таблице указаны точки плавления наиболее распространенных веществ.
Таблица температур плавления металлов и сплавов
| Название | T пл, °C |
|---|---|
| Алюминий | 660,4 |
| Медь | 1084,5 |
| Олово | 231,9 |
| Цинк | 419,5 |
| Вольфрам | 3420 |
| Никель | 1455 |
| Серебро | 960 |
| Золото | 1064,4 |
| Платина | 1768 |
| Титан | 1668 |
| Дюралюминий | 650 |
| Углеродистая сталь | 1100−1500 |
| Чугун | 1110−1400 |
| Железо | 1539 |
| Ртуть | -38,9 |
| Мельхиор | 1170 |
| Цирконий | 3530 |
| Кремний | 1414 |
| Нихром | 1400 |
| Висмут | 271,4 |
| Германий | 938,2 |
| Жесть | 1300−1500 |
| Бронза | 930−1140 |
| Кобальт | 1494 |
| Калий | 63 |
| Натрий | 93,8 |
| Латунь | 1000 |
| Магний | 650 |
| Марганец | 1246 |
| Хром | 2130 |
| Молибден | 2890 |
| Свинец | 327,4 |
| Бериллий | 1287 |
| Победит | 3150 |
| Фехраль | 1460 |
| Сурьма | 630,6 |
| карбид титана | 3150 |
| карбид циркония | 3530 |
| Галлий | 29,76 |
Помимо таблицы плавления, существует много других вспомогательных материалов. Например, ответ на вопрос, какова температура кипения железа лежит в таблице кипения веществ. Помимо кипения, у металлов есть ряд других физических свойств, как прочность.
Прочность металлов
Помимо способности перехода из твердого в жидкое состояние, одним из важных свойств материала является его прочность — возможность твердого тела сопротивлению разрушению и необратимым изменениям формы. Основным показателем прочности считается сопротивление возникающее при разрыве заготовки, предварительно отожженной. Понятие прочности не применимо к ртути, поскольку она находится в жидком состоянии. Обозначение прочности принято в МПа — Мега Паскалях.
Существуют следующие группы прочности металлов:
- Непрочные. Их сопротивление не превышает 50МПа. К ним относят олово, свинец, мягкощелочные металлы
- Прочные, 50−500МПа. Медь, алюминий, железо, титан. Материалы этой группы являются основой многих конструкционных сплавов.
- Высокопрочные, свыше 500МПа. Например, молибден и вольфрам.
Таблица прочности металлов
| Металл | Сопротивление, МПа |
|---|---|
| Медь | 200−250 |
| Серебро | 150 |
| Олово | 27 |
| Золото | 120 |
| Свинец | 18 |
| Цинк | 120−140 |
| Магний | 120−200 |
| Железо | 200−300 |
| Алюминий | 120 |
| Титан | 580 |
Наиболее распространенные в быту сплавы
Как видно из таблицы, точки плавления элементов сильно разнятся даже у часто встречающихся в быту материалов.
Так, минимальная температура плавления у ртути -38,9 °C, поэтому в условиях комнатной температуры она уже в жидком состоянии. Именно этим объясняется то, что бытовые термометры имеют нижнюю отметку в -39 градусов Цельсия: ниже этого показателя ртуть переходит в твердое состояние.
Припои, наиболее распространенные в бытовом применении, имеют в своем составе значительный процент содержания олова, имеющего точку плавления 231.9 °C, поэтому большая часть припоев плавится при рабочей температуре паяльника 250−400°C.
Помимо этого, существуют легкоплавкие припои с более низкой границей расплава, до 30 °C и применяются тогда, когда опасен перегрев спаиваемых материалов. Для этих целей существуют припои с висмутом, и плавка данных материалов лежит в интервале от 29,7 — 120 °C.
Расплавление высокоуглеродистых материалов в зависимости от легирующих компонентов лежит в границах от 1100 до 1500 °C.
Точки плавления металлов и их сплавов находятся в очень широком температурном диапазоне, от очень низких температур (ртуть) до границы в несколько тысяч градусов. Знание этих показателей, а так же других физических свойств очень важно для людей, которые работают в металлургической сфере. Например, знание того, при какой температуре плавится золото и другие металлы пригодятся ювелирам, литейщикам и плавильщикам.
Каждый металл или сплав обладает уникальными свойствами, в число которых входит температура плавления. При этом объект переходит из одного состояния в другое, в конкретном случае становится из твёрдого жидким. Чтобы его расплавить, необходимо подвести к нему тепло и нагревать до достижения нужной температуры. В момент, когда достигается нужная точка температуры данного сплава, он ещё может остаться в твёрдом состоянии. При продолжении воздействия начинает плавиться.
Наиболее низкая температура плавления у ртути — она плавится даже при -39 °C, самая высокая у вольфрама — 3422 °C. Для сплавов (стали и других) определить точную цифру крайне сложно. Все зависит от соотношения компонентов в них. У сплавов она записывается как числовой промежуток.
Как происходит процесс
Элементы, какими бы они ни были: золото, железо, чугун, сталь или любой другой — плавятся примерно одинаково. Это происходит при внешнем или внутреннем нагревании. Внешнее нагревание осуществляется в термической печи. Для внутреннего применяют резистивный нагрев, пропуская электрический ток или индукционный нагрев в электромагнитном поле высокой частоты. Воздействие при этом примерно одинаковое.
Когда происходит нагревание, усиливается амплитуда тепловых колебаний молекул. Появляются структурные дефекты решётки, сопровождаемые разрывом межатомных связей. Период разрушения решётки и скопления дефектов и называется плавлением.
В зависимости от градуса, при котором плавятся металлы, они разделяются на:
- легкоплавкие — до 600 °C: свинец, цинк, олово;
- среднеплавкие — от 600 °C до 1600 °C: золото, медь, алюминий, чугун, железо и большая часть всех элементов и соединений;
- тугоплавкие — от 1600 °C: хром, вольфрам, молибден, титан.
В зависимости от того, каков максимальный градус, подбирается и плавильный аппарат. Он должен быть тем прочнее, чем сильнее будет нагревание.
Вторая важная величина — градус кипения. Это параметр, при достижении которого начинается кипение жидкостей. Как правило, она в два раза выше градуса плавления. Эти величины прямо пропорциональны между собой и обычно их приводят при нормальном давлении.
Если давление увеличивается, величина плавления тоже увеличивается. Если давление уменьшается, то и она уменьшается.
Таблица характеристик
Металлы и сплавы — непременная основа для ковки, литейного производства, ювелирной продукции и многих других сфер производства. Чтобы не делал мастер (ювелирные украшения из золота, ограды из чугуна, ножи из стали или браслеты из меди), для правильной работы ему необходимо знать температуры, при которых плавится тот или иной элемент.
Чтобы узнать этот параметр, нужно обратиться к таблице. В таблице также можно найти и градус кипения.
Среди наиболее часто применяемых в быту элементов показатели температуры плавления такие:
- алюминий — 660 °C;
- температура плавления меди — 1083 °C;
- температура плавления золота — 1063 °C;
- серебро — 960 °C;
- олово — 232 °C. Олово часто используют при пайке, так как температура работающего паяльника составляет как раз 250–400 градусов;
- свинец — 327 °C;
- температура плавления железо — 1539 °C;
- температура плавления стали (сплав железа и углерода) — от 1300 °C до 1500 °C. Она колеблется в зависимости от насыщенности стали компонентами;
- температура плавления чугуна (также сплав железа и углерода) — от 1100 °C до 1300 °C;
- ртуть — -38,9 °C.
Как понятно из этой части таблицы, самый легкоплавкий металл — ртуть, которая при плюсовых температурах уже находится в жидком состоянии.
Градус кипения всех этих элементов почти вдвое, а иногда и ещё выше градуса плавления. Например, у золота он 2660 °C, у алюминия — 2519 °C, у железа — 2900 °C, у меди — 2580 °C, у ртути — 356,73 °C.
У сплавов типа стали, чугуна и прочих металлов расчёт примерно такой же и зависит от соотношения компонентов в сплаве.
Максимальная температура кипения у металлов — у рения — 5596 °C. Наибольшая температура кипения — у наиболее тугоплавящихся материалов.
Бывают таблицы, в которых также указана плотность металлов. Самым лёгким металлом является литий, самым тяжёлым — осмий. У осмия плотность выше, чем у урана и плутония, если рассматривать её при комнатной температуре. К лёгким металлам относятся: магний, алюминий, титан. К тяжёлым относится большинство распространённых металлов: железо, медь, цинк, олово и многие другие. Последняя группа — очень тяжёлые металлы, к ним относятся: вольфрам, золото, свинец и другие.
Ещё один показатель, встречающийся в таблицах — это теплопроводность металлов. Хуже всего тепло проводит нептуний, а лучший по теплопроводности металл — серебро. Золото, сталь, железо, чугун и прочие элементы находится посередине между этими двумя крайностями. Чёткие характеристики для каждого можно найти в нужной таблице.
Ответ
- Комментарии
- Отметить нарушение
Ответ
Неметаллы: атомы и простые вещества. Кислород, озон, воздух
Температуры плавления неметаллов также лежат в очень широком интервале: от 3800 °С у графита до -210 °С у азота. Эта особенность свойств неметаллов является следствием образования ими двух типов кристаллических решеток: молекулярной (O2, N2, галогены, белый фосфор и др.) и атомной (алмаз, графит, кремний, бор и др.)
Неметаллы: атомы и простые вещества. Кислород, озон, воздух
Гипермаркет знаний>>Химия>>Химия 9 класс>> Химия: Неметаллы: атомы и простые вещества. Кислород, озон, воздух
Все химические элементы разделяют на металлы и неметаллы в зависимости от строения и свойств их атомов. Также на металлы и неметаллы классифицируют образуемые элементами простые вещества, исходя из их физических и химических свойств.
С металлами вы познакомились в предыдущей главе. Теперь перейдем к рассмотрению неметаллов.
Само слово «неметаллы» указывает, что свойства неметаллических элементов и соответствующих им простых веществ противоположны свойствам металлов.
Если для атомов металлов характерны сравнительно большие радиусы и небольшое число электронов на внешнем уровне (1е-, З- ), атомам неметаллов, наоборот, свойственны небольшие радиусы атомов и число электронов на внешнем энергетическом уровне от 4 до 8 (у бора этих электронов 3, но атомы этого элемента имеют очень небольшой радиус). Отсюда и стремление атомов металлов к отдаче внешних электронов, т. е. восстановительные свойства, а для атомов неметаллов — стремление к приему недостающих до заветной восьмерки электронов, т. е. окислительные свойства.
Среди 109 известных сегодня химических элементов (из них 88 элементов найдено в природе) к неметаллам относят 22 элемента. О расположении металлов и неметаллов в периодической системе элементов мы уже рассказывали в предыдущей главе. Здесь еще раз отметим, что металлы в периодической системе расположены в основном под диагональю В—Аt, а неметаллы — по этой диагонали и над ней.
Свойства простых веществ, образуемых неметаллами, отличаются большим разнообразием. Хотя по сравнению с металлами неметаллов гораздо меньше, для них трудно выделить общие характерные признаки. Судите сами: водород Н2, кислород и озон 02 и 03, фтор F2, хлор Сl2, азот — газы при обычных условиях, бром Вr2 — жидкость, а бор, углерод (алмаз, графит), кремний, фосфор (красный и белый), сера (пластическая и ромбическая), селен, теллур, иод 12, астат — твердые вещества.
Если для подавляющего большинства металлов характерен серебристо-белый цвет, то окраска неметаллов — простых веществ охватывает все цвета спектра: красный (красный фосфор, красно-бурый жидкий бром), желтый (сера), зеленый (хлор — желто-зеленый газ), фиолетовый (пары иода).
Температуры плавления неметаллов также лежат в очень широком интервале: от 3800 °С у графита до -210 °С у азота. Эта особенность свойств неметаллов является следствием образования ими двух типов кристаллических решеток: молекулярной (O2, N2, галогены, белый фосфор и др.) и атомной (алмаз, графит, кремний, бор и др.). Разным строением кристаллических решеток объясняется и явление аллотропии (вспомните, что это такое). Например, элемент фосфор образует простое вещество с молекулярной кристаллической решеткой — белый фосфор, молекулы которого имеют состав Р4, и простое вещество с атомной кристаллической решеткой — красный фосфор Р.
Вторая причина аллотропии связана с разным числом атомов в молекулах простых веществ. Типичный пример — простые вещества, образуемые кислородом: обычный кислород 02 и озон O3.
В отличие от бесцветного кислорода О2, не имеющего запаха, озон — это светло-синий газ с сильным запахом. Вы уже знаете из курса прошлого года, что примесь озона в воздухе, появляющаяся после грозы, дает ощущение приятной свежести; содержится озон и в воздухе сосновых лесов и морского побережья.
В природе озон образуется при электрических разрядах или окислении органических смолистых веществ, а также при действии ультрафиолетовых лучей на кислород. В лаборатории его получают в специальных приборах — озонаторах при действии на кислород тихим (без искр) электрическим разрядом (рис. 16).
озонатор
Озон — гораздо более сильный окислитель, чем кислород. Его молекулы распадаются при обычной температуре с отщеплением атомарного кислорода:
Металлы Температура плавления — Энциклопедия по машиностроению XXL
Тугоплавкие металлы, температура плавления которых выше, чем железа (т. е. выше 1539°С). Применяют как добавки к легированным сталям, а также в качестве основы для соответствующих сплавов. [c.16]К тугоплавким относят металлы, температура плавления которых выше температуры плавления железа (1539°С), кроме металлов платиновой и урановой групп и некоторых редкоземельных. [c.521]
Титан — тугоплавкий металл [температура плавления (1665 5) С], плотность 4500 кг/м . Временное сопротивление чистого титана = 250 МПа, относительное удлинение б =70 %, он обладает высокой коррозионной стойкостью. Удельная прочность титана выше, чем у многих легированных конструкционных сталей. Поэтому при замене сталей титановыми сплавами можно при равной прочности уменьшить массу детали на 40 %. Одпако титан имеет низкую жаропрочность, так как при температурах выше 550— 600 °С легко окисляется и поглощает водород. Титан хорошо обрабатывается давлением, сваривается, из него изготовляют сложные отливки, но обработка его резанием затруднительна. [c.19]
Тугоплавкими являются металлы, температура плавления которых выше 1855° С 2г (1855° С), Сг (1875° С), V (1900° С), Н1 (1975° С), N5 (2415° С), Мо (2610° С), Та (2996° С), Re (3180° С), (3410° С). [c.225]
Физические свойства сварочных шлаковых систем. Температура плавления сварочных шлаков должна быть, как правило, ниже, чем температура кристаллизации свариваемого металла. Температура плавления в сложных системах представляет собой функцию состава и определяется соответствующими диаграммами плавкости (состав — свойство). Сплавы силикатов и алюмосиликатов обладают способностью к переохлаждению и образованию стекловидных шлаков, а это обстоятельство осложняет задачу экспериментального исследования. [c.355]
Металл Температура плавления, °С Температура рекристаллизации, С [c.28]
К жидким проводникам относятся расплавленные металлы н различные электролиты. Для большинства металлов температура плавления высока (см. табл. 7-1, в которой приведены приблизительные значения важнейших физических параметров металлов, представляющих интерес для электротехники) только ртуть, имеющая температуру плавления около минус 39°С, может быть использована в качестве жидкого металлического проводника при нормальной температуре. Другие металлы являются жидкими проводниками при повышенных температурах. [c.187]
Металл Температура плавления, С Температура кипения, °С Плотность, Мг/м [c.188]
Металл Температура плавления, °с Плотность, КГ/мЗ Электрическая проводимость, 10 (Ом м) Коэффициент теплового излучения [c.94]
К тугоплавким металлам относят металлы, температура плавления которых выше температуры плавления железа (1539°С), кроме металлов платиновой и урановой групп и некоторых редкоземельных, которые ш этому признаку (температуре плавления) также можно отнести к тугоплавким. [c.3]
Тугоплавкие металлы, а также графит весьма успешно противостоят как тепловому, так и механическому воздействию высокотемпературного газового потока, однако быстро разрушаются при окислении. К числу тугоплавких относят двенадцать металлов, температура плавления которых превышает температуру плавления хрома (2150 К). Некоторые из них вполне доступны (вольфрам, молибден, ниобий), другие относятся к числу редких. [c.163]
Порошок урана (температура плавления 1130°С) получают электролизом фторидных расплавов, кальцие- или магниетермическим восстановлением триоксида или диоксида урана и другими методами. Порошок плутония может быть получен измельчением плавленого металла (температура плавления плутония 640 °С), например по методу гидрирование — дегидрирование (насыщение компактного плутония водородом при 150 °С и разложение РиН при температуре > 420 °С в высоком вакууме). [c.230]
Деталь с нанесенной шихтой вводят в индуктор ТВЧ установки. Конструкция индуктора и расположение детали зависят от конфигурации наплавляемой поверхности. При прохождении ТВЧ через контур индуктора в поверхностных слоях детали возникают токи Фуко и наружный слой основного металла нагревается. Шихта, расположенная между индуктором и нагреваемой поверхностью детали, вследствие большого электрического сопротивления и мелких размеров частиц слабо реагирует на воздействие переменного электромагнитного поля. Она нагревается главным образом за счет теплопередачи от основного металла. Температура плавления шихты на 100..,150 К ниже температуры плавления основного металла, а скорость нагрева поверхности детали — выше скорости теплоотвода в глубину детали. [c.319]
К тугоплавким относят металлы, температура плавления которых превышает 1800°С. Наибольшее значение в технике имеют следующие тугоплавкие металлы Nb, Мо, Сг, W. [c.198]
Металлы Температура плавления, С [c.167]
Ионный проектор позволяет различать отдельные атомы в решетке, но пока применяется для исследования молибдена, вольфрама и других металлов, температура плавления которых не ниже, чем у железа. [c.91]
Вольфрам — тугоплавкий металл, температура плавления 3410 С, температура кипения 5930 С, плотность прй 20 °С 19 300 кг/м , при температуре плавления — 17 600 кг/м . [c.146]
Третий вид сварки — пайка — не требует высоких температур. Пайку осуществляют вводом между соединяемыми частями легкоплавкого сплава — припоя. Распространенные в промышленности серебряные припои отличаются прочностью, вязкостью, ковкостью и могут применяться для пайки стали и цветных металлов температура плавления серебряных припоев 630—820° С. Температура плавления припоя обычно ниже точки плавления основного материала соединяемых частей. Соединение происходит за счет сплавления жидкого припоя с твердым основным металлом. Для облегчения сплавления припоя с основным металлом и защиты припоя и основного металла or окисления применяются так называемые флюсы, к которым относятся хлористый цинк, хлористый аммоний, канифоль, бура и др.Основным преимуществом пайки является сравнительно незначительный нагрев металла, позволяющий сохранить неизменным его химический состав и структуру. Пайка имеет большое применение в промышленности при производстве радио- и электроаппаратуры и применяется главным образом для сравнительно тонких пластинчатых материалов и проводов. Однако в настоящее время получила распространение скоростная пайка медью с нагревом токами высокой частоты эта пайка обеспечивает прочность среза спая до 30 кГ/мл1 , что позволяет использовать ее для соединения деталей, находящихся под нагрузкой. [c.64]
Металл, температура плавления которого выше температуры плавления металла покрытия [c.74]
Паяние — процесс неразъемного соединения металлических поверхностей, находящихся в твердом состоянии, с помощью дополнительно вводимого металла или сплава, называемого припоем и имеющего меньшую, чем соединяемые металлы, температуру плавления. Паяние имеет некоторое сходство со сваркой плавлением. Отличие состоит главным образом в том, что при паянии участвующие в соединении поверхности не расплавляются. Паяное соединение образуется в результате растекания расплавленного припоя по нагретым соприкасающимся поверхностям и затвердевания его после охлаждения. [c.353]
Сернистые соединения металлов, температура плавления 1—219 Сернистый газ, содержание в воздухе 2—8 Серое тело 3 — 165 [c.518]
Металл Температура плавления, К Динамическая вязкость, мПа- с н is X «ч ags 0) . и (U О о я С я я Металл Температура плавленая, К Динамическая вязкость, мПа- 0 Hi [c.43]
Кристаллический порошок белого цвета с желтоватым оттенком, растворимый в воде (4. .. 5 %). Малотоксичен. Относится к летучим ингибиторам атмосферной коррозии металлов. Температура плавления 129. .. 134 °С. Защищает от атмосферной коррозии серебро, никель, олово, алюминий. Не полностью защищает оксидированный магний, кадмий, цинк, медь, железо. На упаковочные материалы, деревянную тару, краски, органические покрытия, текстиль, кожу отрицательного действия не оказывает [c.581]
Имея самую низкую из всех тугоплавких металлов температуру плавления (1900° С), ванадий может быть основой сплавов, работающих при низких и средних температурах (600—800° С). [c.277]
К физическим свойствам относятся удельный вес металла, температура плавления, удельная теплоемкость, теплопроводность, способность изменять размеры при нагревании и пр. [c.25]
Технология горячей обработки тугоплавких металлов температура плавления выше 1875° С) и сплавов на их основе имеет много общего. Тугоплавкие металлы и сплавы при комнатной температуре весьма пластичны. Загрязнения их поверхностей при нагреве в обычной атмосфере кислородом, азотом, водородом очень снижают пластичность. Тугоплавкие металлы и сплавы интенсивно окисляются на воздухе уже при 600—800° С. Переработка тугоплавких металлов и сплавов при более высоких температурах без применения специальных мер защиты от окисления практически невозможна. [c.206]
Испаряемый металл Температура плавления °С Температура, при которой давление пара равно 10 мм рт. ст., °С Материалы, пригодные для испарителя [c.645]
Сплавы на медной основе. При получении медных сплавов широко применяют лигатуры в виде двойных сплавов Си — Мп Си—N1 Си—81 Си—А1 Си—Р и др. Лигатурами называются сплавы металлов, температура плавления которых ниже температуры плавления тугоплавкого компонента, входящего в состав сплава. [c.222]
Ниобий обладает высокой кислотостойкостью, он чрезвычайно пластичен, его можно обрабатывать на холоде, температура плавления ниобия 2500° С. Из сплава ниобия с цезием изготовляют центральную часть атомного реактора. Тантал — тугоплавкий металл, температура плавления 2996° С, коррозионно стоек, применяется в виде пластинок и проволоки в костной и пластической хирургии. Осмий — самый тяжелый и твердый металл, очень износоустойчив, наплавляется на хирургический инструмент, золотые перья, долгоиграющие иглы, оси и опоры точных измерительных приборов и часовых механизмов. [c.6]
Тугоплавкие металлы и сплавы. Тугоплавкими называют металлы, температура плавления которых выше 1700°С. Наиболее тугоплавки вольфрам (3410 °С), молибден (2620 °С), тантал (2996 °С), хром (1875°С), рутений, гафний и др. Тугоплавкие металлы и их сплавы широко применяют как жаропрочные при строительстве ракет, космических кораблей. Эти металлы получают из порошков, путем прессования и последующего их спека- [c.108]
Вольфрам—тугоплавкий металл, температура плавления 3380—3600°, температура кипения 5900°, обладает высокой коррозийной стойкостью, применяется в виде прутков диаметром от 1 до 8 мм. [c.172]
Наименование металла Температура плавления, град Наименование окисла металла Температура плав-ления, град [c.426]
Вольфрам. Обладая наиболее высокой среди тугоплавких металлов температурой плавления (3395° С) вольфрам отличается своеобразной структурой в виде вытянутых в продольном направлении к эисталлов (для проволоки, ленты). Получению прочности и формоустойчивости металла при высоких температурах способствуют вводимые присадки — [c.300]
Элвктроэрозионный износ электродов. Одним из решающих факторов, определяющих стойкость электродов при длительной работе электроимпульсных установок, является электроэрозионный износ. Имеется большое количество работ, посвященных электроэрозионным процессам в связи с широким его внедрением в металлообрабатывающую промышленность. Сложность протекающих процессов, экспериментальные трудности являются причиной большого разнообразия точек зрения на природу и механизм данного явления. Большинство исследователей придерживаются электротермической (тепловой) природы электрической эрозии. Величина эрозионного износа зависит от числа импульсов и их параметров, от химического состава материала электродов и межэлектродной среды, от длины рабочего промежутка и т.д. Все материалы при электроискровой обработке по своей эрозионной устойчивости образуют определенный ряд, связанный с тепловыми константами металла (температурой плавления, скрытой теплотой плавления и испарения, теплопроводностью и теплоемкостью) /111,112/. Предложено /113/ эрозионную стойкость металла оценивать из выражения [c.168]
Металл Температура плавления металла. С Температура плавления эвтектики с угле родим. °С Разн сть температур плавления, С Содержание углерод 1, ат. % [c.81]
Гидроокись лития гораздо менее гигроскопична, чем едкий натр и едкое кали. Из водного раствора она кристаллизуется в виде гидрата LiOH Н2О, который может быть топко измельчен. Растворимость гидроокиси лития в воде примерно в 5 раз (по весу) меньше растворимости едкого натра и едкого кали. С другой стороны, гидроокись лития примерно в 100 раз более растворима, чем гидроокись кальция, и почти в 4 раза более растворима, чем гидроокись бария. Подобно едкому натру и едкому кали, гидроокись лития может быть расплавлена. Склонность к разложению при нагревании выражена у нее не так резко, как в случае гидроокисей щелочноземельных металлов. Температура плавления гидроокиси лития, равная 445°, намного превышает температуры плавления гидроокисей остальных щелочных металлов. Однако давление пара расплавленной гидроокиси лития значительно выше, чем давления паров гидроокисей других щелочных металлов, и составляет 760 мм рт. ст. при температуре около 925°, в то время как температуры кипения едкого натра и едкого кали лежат между 1300 и 1400°. [c.359]
Свойства плутония и его соединений. Чистый плутоний — низкоплавкий, очень плотный металл серебристо-белого цвета, напоминающий железо или никель, весьмаТхимически активный и радиационно токсичный. По структуре и свойствам плутоний сильно отличается от урана и других металлов. Температура плавления 640 °С, кипения 3235 °С. Плотность твердого металлического а-плу-тония 19,816 г/см при 25 °С, жидкого (655 °С) 16,5 г/см , теплота плавления 12 Дж/г, что в 30 раз ниже, чем алюминия, и в 25 раз ниже, чем железа. [c.156]
Кроме того, следует отметить действие серы и фосфора, которые относятся к вредным примесям в стали. Сера образует в металле сернистое железо FeS, которое имеет более низкую температуру плавления (1193 °С) чем свариваемая сталь, и малую растворимость в жидком металле (температура плавления [c.36]
Оксиды этих металлов, как правило, более тугоплавкие, чем сам металл (температуры плавления СигО — 1235 °С, СиО — 1336 °С, MgO -2500 °С, AljOj — 2050 °С, NiO — 2090 °С, ZrOa — 2800 °С) и могут засорять металл сварного шва. В тех случаях когда оксиды более легкоплавкие (температура плавления МоОг — 1480 °С), возможно образование кристаллизационных трещин. [c.437]
Металл Температу pa плавления, К Динами- ческая вязкость, МПа-0 ЙЕЧ aS S (U м fi OJ ф ° о S С я Ш Металл Температура плавления, К Динами- ческая вязкость. иПа-о 1 н ф Я 0) . й в> я о X с а и [c.44]
Титан существует в двух аллотропических модификациях. Ниже 882 С существует а-титан, обладающий ГПУ кристаллической рещеткой. При более высоких температурах вплоть до температуры плавления (1665 С) Ti существует в модификации р с ОЦК решеткой. Титан может бьггь отнесен как к тугоплавким металлам (температура плавления выше, чем у Fe), так и к легким (плотность Ti 4500 кг/м ). По химической стойкости он не уступает корозионно-стойким (нержавеющим) сталям, а в ряде случаев превосходит их. [c.109]
Под тугоплавкими условно понимают металлы, температура плавления которых превышает температуру плавления хрома (1875° С). Таким образом, к тугонлавким металлам в порядке возрастания температур плавления следует отнести хром, ванадий, родий, гафний, рутений, иридий, молибден, тантал, ниобий, осмий, рений и вольфрам. [c.460]
Примером таких металлов, температура плавления которых значительно ниже температуры плавления их окислов, могут служить высокохромистые и хромоникелевые стали с температурой плавления около 2000°, сплавы алюминия, образующие окись алюмшшя с температурой плавления 2020°, и др. Все эти металлы и сплавы обычному процессу кислородной резки не поддаются. [c.425]
Железо — Точка плавления — Точка кипения
Железо — точка плавления и точка кипения
Температура плавления железа 1538 ° C .
Температура кипения железа 2861 ° C .
Обратите внимание, что эти точки связаны со стандартным атмосферным давлением.
Точка кипения — насыщение
В термодинамике термин насыщение определяет состояние, при котором смесь пара и жидкости может существовать вместе при заданных температуре и давлении.Температура, при которой начинается испарение (кипение) для данного давления, называется температурой насыщения или точкой кипения . Давление, при котором начинается испарение (кипение) для данной температуры, называется давлением насыщения. Если рассматривать температуру обратного перехода от пара к жидкости, ее называют точкой конденсации.
Точка плавления — насыщение
В термодинамике точка плавления определяет состояние, при котором твердое вещество и жидкость могут находиться в равновесии.Добавление тепла превратит твердое вещество в жидкость без изменения температуры. Температура плавления вещества зависит от давления и обычно указывается при стандартном давлении. Когда рассматривается как температура обратного перехода от жидкости к твердому телу, она упоминается как точка замерзания или точка кристаллизации.
Утюг — Свойства
| Элемент | Утюг |
|---|---|
| Атомный номер | 26 |
| Символ | Fe |
| Категория элемента | Переходный металл |
| Фаза на STP | Цельный |
| Атомная масса [а.е.м.] | 55.845 |
| Плотность при стандартном давлении [г / см3] | 7,874 |
| Электронная конфигурация | [Ar] 3d6 4s2 |
| Возможные состояния окисления | +2,3 |
| Сродство к электрону [кДж / моль] | 15,7 |
| Электроотрицательность [шкала Полинга] | 1,83 |
| Энергия первой ионизации [эВ] | 7,9024 |
| Год открытия | неизвестно |
| Первооткрыватель | неизвестно |
| Тепловые свойства | |
| Точка плавления [шкала Цельсия] | 1538 |
| Точка кипения [шкала Цельсия] | 2861 |
| Теплопроводность [Вт / м · К] | 80.2 |
| Удельная теплоемкость [Дж / г К] | 0,44 |
| Теплота плавления [кДж / моль] | 13,8 |
| Теплота испарения [кДж / моль] | 349,6 |
–
–
–
Экстремальные изменения состояния — низкие температуры кипения — плавление, жидкость, железо и углерод
Металлы, такие как железо и сталь, могут иметь различную форму. Некоторые формы железа изготавливаются путем плавления железа.Затем жидкое железо выливают в форму. Когда он остывает, он снова становится твердым. Твердое тело принимает форму формы.
Заливка расплавленного чугуна в форму.
Некоторые предметы при использовании становятся очень горячими, поэтому они должны быть изготовлены из материалов с высокой температурой плавления. Таким образом, они не плавятся и не изменяют форму во время использования. Температура плавления материала должна быть выше, чем температура, которую может достичь объект.
| Металл | Температура плавления |
|---|---|
| алюминий | 1220 ° F (660 ° C) |
| золото | 1,947 ° F (1064 ° C) |
| утюг | 2,795 ° F (1,535 ° C) |
| серебро | 1764 ° F (962 ° C) |
| сталь | 1371 ° C (2500 ° F) |
| титан | 3020 ° F (1660 ° C) |
Температура реактивного двигателя может достигать 2800 ° F (1538 ° C).Двигатель должен быть изготовлен из материалов с высокой температурой плавления. Один из таких материалов — титан.
Низкая температура кипения
Воздух вокруг вас представляет собой смесь газов. Эти газы включают азота , кислорода и диоксида углерода . Все эти вещества имеют очень низкие температуры кипения. Это означает, что даже в самую холодную погоду температура не становится настолько низкой, чтобы они могли конденсироваться в жидкости.
| Газ | Точка кипения |
|---|---|
| диоксид углерода | −108 ° F (−78 ° C) |
| метан | −263 ° F (−164 ° C) |
| кислород | −297 ° F (−183 ° C) |
| азот | −321 ° F (−196 ° C) |
ЗАМОРОЖЕННЫЕ ТЕЛА
В Швеции мертвое тело можно заморозить с помощью жидкого азота.Тело становится очень ломким. Затем он вибрирует, что превращает его в порошок. Порошок закапывают. Из него образуется компост, который растения могут использовать менее чем за год.
Ученые используют жидкий азот для замораживания клеток для использования в исследованиях.
СУХОЙ ЛЕД
Углекислый газ — необычное химическое вещество. Если нагреть твердый углекислый газ, он не станет жидким. Он сразу превращается в газ. Это изменение называется сублимированием. Твердый диоксид углерода известен как «сухой лед».«Его используют для создания на сцене эффектов дыма.
Некоторые газы являются жидкостями в других местах солнечной системы. Титан — одна из лун Сатурна. Температура на его поверхности составляет около -289 ° F (-178 ° C). Этого достаточно, чтобы метан превратился в жидкость. На поверхности Луны видны лужи жидкого метана.
Железо (элемент) — факты, история, где оно найдено и как используется
Железо — от важнейшего строительного элемента из стали до питательных растений и помощи в переносе кислорода в кровь — оно всегда помогает поддерживать жизнь на Земле.
Железо — хрупкое твердое вещество, классифицируемое как металл группы 8 Периодической таблицы элементов. Самый распространенный из всех металлов, его чистая форма быстро корродирует от воздействия влажного воздуха и высоких температур. Железо также является четвертым по весу элементом земной коры, и большая часть ядра Земли, как полагают, состоит из железа. По данным Лос-Аламосской национальной лаборатории, помимо того, что он обычно встречается на Земле, его много на Солнце и звездах. Согласно лаборатории Джефферсона, железо имеет решающее значение для выживания живых организмов.У растений он играет роль в производстве хлорофилла. У животных это компонент гемоглобина — белка крови, который переносит кислород из легких в ткани организма.
По данным Королевского химического общества, 90 процентов всего металла, который очищается в наши дни, составляет железо. Большая часть его используется для производства стали — сплава железа и углерода — которая, в свою очередь, используется в производстве и гражданском строительстве, например, для изготовления железобетона. Нержавеющая сталь, содержащая не менее 10.5 процентов хрома, обладает высокой устойчивостью к коррозии. Он используется в кухонных столовых приборах, бытовой технике и посуде, такой как сковороды и сковороды из нержавеющей стали. Добавление других элементов может придать стали другие полезные качества. Например, никель увеличивает его прочность и делает его более устойчивым к нагреванию и кислотам; По данным лаборатории Джефферсона, марганец делает его более долговечным, а вольфрам помогает сохранять твердость при высоких температурах.
Только факты
- Атомный номер (количество протонов в ядре): 26
- Атомный символ (в Периодической таблице элементов): Fe
- Атомный вес (средняя масса атома): 55.845
- Плотность: 7,874 грамма на кубический сантиметр
- Фаза при комнатной температуре: твердый один и тот же элемент с другим числом нейтронов): (укажите количество стабильных изотопов): 33 Стабильные изотопы: 4
- Наиболее распространенные изотопы: Железо-56 (естественное содержание: 91,754 процента)
История и свойства железа
По данным Jefferson Lab, археологи подсчитали, что люди использовали железо более 5000 лет.Фактически, оказывается, что часть самого древнего железа, известного человеку, буквально упала с неба. В исследовании, опубликованном в 2013 году в Journal of Archeological Science, исследователи изучили древнеегипетские железные бусины, датируемые примерно 3200 годом до нашей эры. и обнаружил, что они были сделаны из железных метеоритов. По данным Лос-Аламосской национальной лаборатории, Ветхий Завет в Библии также неоднократно упоминает железо.
Железо получают в основном из минералов гематита и магнетита. По данным лаборатории Джефферсона, в меньшей степени его также можно получить из минералов таконита, лимонита и сидерита.По данным Лос-Аламосской национальной лаборатории, у железа есть четыре различных аллотропных формы, что означает, что оно имеет четыре разные структурные формы, в которых атомы связываются по-разному. Эти формы называются ферритами, известными как альфа (магнитная), бета, гамма и омега.
Железо — важное питательное вещество в нашем рационе. Дефицит железа, наиболее распространенный дефицит питательных веществ, может вызывать анемию и усталость, которые влияют на способность выполнять физическую работу у взрослых. По данным Центров по контролю и профилактике заболеваний, он также может ухудшить память и другие психические функции у подростков.CDC предупреждает, что женщины, у которых наблюдается дефицит железа во время беременности, подвергаются повышенному риску рождения маленьких и ранних детей.
Существует два типа диетического железа: гемовое и негемовое. Гемовое железо, которое является наиболее легко усваиваемым типом железа, содержится в мясе, рыбе и птице, тогда как негемовое железо, которое также усваивается, но в меньшей степени, чем гемовое железо, содержится в обеих растительных продуктах (например, шпинат, капуста и брокколи) и мясо, согласно данным Американского Красного Креста. Люди поглощают до 30 процентов гемового железа по сравнению с 2-10 процентами негемового железа, сообщает ARC, добавляя, что продукты, богатые витамином С, такие как помидоры или цитрусовые, могут помочь людям усваивать негемовое железо.
Кто знал?
- По данным Калифорнийского университета в Санта-Барбаре, кровь имеет красный цвет из-за взаимодействия железа и кислорода. Кровь выглядит красной из-за того, как химические связи между двумя элементами отражают свет.
- По данным Денверского университета, чистое железо на самом деле мягкое и податливое.
- В 2007 году исследователи обнаружили огромный шлейф богатой железом воды, исходящей из гидротермальных жерл в южной части Атлантического океана.
- Железо необходимо для роста фитопланктона — крошечных морских бактерий, которые используют углекислый газ из атмосферы в качестве топлива для фотосинтеза. Поэтому некоторые исследователи утверждали, что удобрение океанов дополнительным количеством железа может помочь поглотить избыток углекислого газа. Но исследование, опубликованное в Интернете в ноябре 2010 года в Proceedings of the National Academy of Sciences, показало, что это может быть не такой уж и хорошей идеей, поскольку все это дополнительное железо могло фактически вызвать рост токсин-продуцирующих водорослей, которые способствуют загрязнению морской среды. дикая природа.
- По данным Королевского химического общества, около 90 процентов всего металла, который сегодня очищается, составляет железо.
- По данным Лос-Аламосской национальной лаборатории, железо является важным компонентом метеоритов, известных как сидериты.
- По данным Лос-Аламосской национальной лаборатории, железный столб, датируемый примерно 400 годом нашей эры, до сих пор стоит в Дели, Индия. Высота столба составляет около 23,75 футов (7,25 метра), а диаметр — 15,75 дюйма (40 сантиметров). Несмотря на воздействие погодных условий, столб не сильно корродировал благодаря уникальному составу металлов.
- Примеры продуктов, богатых железом, включают мясо, такое как говядина, индейка, курица и свинина; морепродукты, такие как креветки, моллюски, устрицы и тунец; овощи, такие как шпинат, горох, брокколи, сладкий картофель и стручковая фасоль; хлеб и крупы, такие как хлопья с отрубями, цельнозерновой хлеб и обогащенный рис; другие продукты, такие как бобы, чечевица, томатная паста, тофу и патока, по данным американского Красного Креста.
- По данным Nature, поверхность Марса имеет красный цвет из-за большого количества оксида железа (ржавчины) на ее поверхности.В коре Марса более чем в два раза больше оксида железа, чем на Земле.
- Твердое внутреннее и жидкое внешнее ядра Земли в основном состоят из железа (примерно 85 процентов и 80 процентов по весу, соответственно). По данным НАСА, электрический ток, генерируемый жидким железом, создает магнитное поле, защищающее Землю. Железо также содержится в ядрах всех планет Солнечной системы.
- Согласно JPL, железо — самый тяжелый элемент, образующийся в ядрах звезд.Элементы тяжелее железа могут быть созданы только при взрыве звезд большой массы (сверхновых).
- Латинское название железа — ferrum, которое является источником его атомного символа Fe.
- Слово железо происходит от англосаксонского слова iren. Слово «железо», возможно, произошло от более ранних слов, означающих «святой металл», потому что оно использовалось для изготовления мечей, используемых в крестовых походах, согласно WebElements.
Текущее исследование
Железо было предметом многочисленных медицинских исследований, некоторые из которых показывают, что высокий уровень железа в крови может быть связан с повышенным риском сердечно-сосудистых заболеваний.«Некоторые исследования показывают, что люди, у которых больше ферритина в системе крови и маркеры повышенного содержания железа в организме, могут быть более подвержены риску некоторых сердечно-сосудистых заболеваний», — сказала Джудит Вайли-Розетт, профессор кафедры эпидемиологии. здоровье населения и медицинский факультет Медицинского колледжа Альберта Эйнштейна Университета Иешива в Нью-Йорке. «И вызывает ли это риск или это биомаркер чего-то еще, неясно», — сказала Уайли-Розетт Live Science.(Ферритин — это тип белка, который накапливает железо, а тест на ферритин измеряет количество железа в крови.)
В исследовании, проведенном с участием более 1900 финских мужчин в возрасте от 42 до 60 лет, опубликованном в 1992 году в журнале Circulation. , исследователи обнаружили связь между высоким уровнем железа и повышенным риском сердечного приступа. В более недавнем исследовании, опубликованном в январе 2014 года в журнале Journal of Nutrition, исследователи обнаружили, что гемовое железо, обнаруженное в мясе, увеличивает риск ишемической болезни сердца на 57 процентов, но такой связи между негемовым железом и риск ишемической болезни сердца.
Интересно, что недавние исследования также связали накопление железа в головном мозге с болезнью Альцгеймера. В исследовании, опубликованном в августе 2013 года в Журнале болезни Альцгеймера, исследователи обнаружили, что количество железа в гиппокампе — области мозга, связанной с формированием воспоминаний — было увеличено и связано с повреждением тканей в области гиппокампа у людей. с болезнью Альцгеймера, но не у здоровых пожилых людей.
«Накопление железа в головном мозге может зависеть от изменения факторов окружающей среды, таких как количество потребляемого нами красного мяса и пищевых добавок с железом, а у женщин, перенесших гистерэктомию перед менопаузой», — автор исследования д-р.Джордж Барцокис, профессор психиатрии в Институте неврологии и поведения человека им. Семела при Калифорнийском университете в Лос-Анджелесе, заявил в своем заявлении.
Дефицит железа также связан с депрессией, согласно исследованию 2017 года, опубликованному в Journal of Psychiatric Research группой австралийских исследователей, которые пытались найти связь между генетикой, уровнем железа и депрессией, особенно у подростков. Исследователи обнаружили, что, хотя существует связь между уровнем железа в кровотоке и степенью депрессии, нет никаких доказательств генетической связи между ними.Исследователи использовали данные, полученные из исследований близнецов, и рассмотрели множество факторов при сравнении близнецов-подростков со взрослыми близнецами. Связь между уровнем железа и депрессией, скорее всего, будет наблюдаться в периоды времени, когда организму требуется большее количество железа, например, во время всплесков роста.
В статье 2017 года, опубликованной в European Journal of Nutrition исследовательской группой из Ирана, описывается исследование, в котором препараты железа давали новым, не страдающим анемией матерям с послеродовой депрессией (PPD).Группа из 70 женщин начала двойное слепое исследование через неделю после родов, и через шесть недель сравнили симптомы PPD. Группа, принимавшая добавку железа, испытала значительно большее улучшение симптомов PPD, чем группа, принимавшая плацебо.
Дополнительный отчет Рэйчел Росс, участника Live Science
Удельная теплоемкость жидкого железа от точки плавления до точки кипения
Вертман А.А. , Самарин А.М., Свойства расплавов железа, , М .: Наука, 1969.
Google Scholar
Уилсон Дж. Р. Структура жидких металлов и сплавов, Металл. Ред. , 1965, т. 10, стр. 381.
Google Scholar
Регель А.Р. Ю., Глазов В.М., Физические свойства электронных расплавов, , М .: Наука, 1980.
. Google Scholar
Хиксон, Р.С., Винклер М.А., Ходждон М.Л., Phys. Ред. B: Конденс. Matter Mater. Phys. , 1990, т. 42, нет. 10, стр. 6485.
ADS Статья Google Scholar
Бейтл, М., Поттлахер, Г., и Ягер, Х., Int. J. Thermophys. , 1994, т. 15, стр. 1323.
ADS Статья Google Scholar
Латиев Л.Н., Петров В.А., Чеховской В.Я., Шестаков Е.Н., Излучательные свойства твердых материалов, , Под ред. А.Е. Шейндлина, М .: Энергия, 1974.
. Google Scholar
Онуфриев С.В., Савватимский А.И., Кондратьев А.М., High Temp. — High Pressure , 2014, vol. 43, стр. 217.
Google Scholar
Кондратьев А., Мубояян С., Онуфриев С., Савватимский А., J. Alloys Compd. , 2015, т. 631, стр. 52.
Статья Google Scholar
Савватимский А.И., Онуфриев С.В., Мубояджян С.А., Середкин Н.Н., Конюхов С.А. ТВТ. , 2017, т. 55, нет. 5, стр. 825.
Статья Google Scholar
Савватимский, А.И. , Онуфриев С.В., Phys.Атом. Nucl. , 2016, т. 79, № 14, с. 1637.
ADS Статья Google Scholar
Онуфриев С.В., Бюл. Русь. Акад. Науки: Phys. , 2018, т. 82, нет. 4, стр. 372.
Статья Google Scholar
Физические величины. Справочник, , Григорьев И.С. и Мейлихов Э.З., Ред. М .: Энергоатомиздат, 1991.
Онуфриев С.В. , Савватимский А.И., High Temp. , 2018, т. 56, нет. 5, стр. 678.
| Вернуться к содержанию |
| 【Внешний вид】 Серый блестящий порошок. | |
| 【Растворимость в воде】 Нерастворимый | |
| 【Точка плавления】 1535 | |
| 【Точка кипения】 3000 | |
| 【Плотность 86 г / см ) | |
| 【Использование】 При производстве отливок из чугуна и стали (чушкового чугуна), сплавов с углеродом, хромом и другими металлами в качестве материала для увеличения плотности буровых растворов для нефтяных скважин. | |
| Меры первой помощи | Вернуться к содержанию |
| 【Проглатывание】 Если пострадавший находится в сознании и бодрствует, дайте ему 2–4 чашки молока или воды.Немедленно обратитесь за медицинской помощью. | |
| 【Вдыхание】 Немедленно прекратить попадание на свежий воздух. Обратитесь за медицинской помощью при появлении кашля или других симптомов. | |
| 【Кожа】 Обратитесь за медицинской помощью, если раздражение не проходит. Промойте кожу большим количеством воды с мылом. | |
| 【Глаза】 Немедленно промойте глаза большим количеством воды в течение не менее 15 минут, периодически приподнимая верхнее и нижнее веко. Немедленно обратитесь за медицинской помощью. | |
| Обращение и хранение | Назад к содержанию |
| 【Хранение】 Не допускать контакта с окисляющими материалами. Хранить в прохладном, сухом, хорошо вентилируемом месте вдали от несовместимых веществ. | |
| 【Обращение】 Тщательно вымыть после работы. Используйте при соответствующей вентиляции. Сведите к минимуму образование и накопление пыли. Избегайте попадания в глаза, на кожу и одежду. Хранить контейнер плотно закрытым. Избегайте проглатывания и вдыхания. | |
| Идентификация опасностей | Назад к содержанию |
| 【Вдыхание】 Вдыхание паров может вызвать лихорадку от металлического дыма, которая характеризуется гриппоподобными симптомами с металлическим привкусом, лихорадкой, ознобом, кашлем, слабостью , боль в груди, мышечная боль и увеличение количества лейкоцитов. | |
| 【Кожа】 Пыль может вызвать механическое раздражение. | |
| 【Глаза】 Воздействие твердых частиц или раствора может вызвать конъюнктивит, язвы и аномалии роговицы.Осаждение частиц может вызвать обесцвечивание роговицы. | |
| 【Проглатывание】 Может вызывать раздражение желудочно-кишечного тракта с тошнотой, рвотой и диареей. Могут развиться отсроченные симптомы, такие как ацидоз, шок, учащенное дыхание, повреждение печени и возможная смерть. | |
| 【Опасности】 Оксиды от металлических пожаров представляют серьезную опасность для здоровья. При пожаре могут выделяться раздражающие, едкие и / или токсичные газы. | |
| 【Фраза риска ЕС】 R 11 | |
| 【Фраза безопасности ЕС】 S 16 | |
| 【UN (DOT)】 3089 | |
| Персональный контроль воздействия Защита | Назад к содержанию |
| 【Персональная защита】 Глаза: Используйте соответствующие защитные очки или очки химической защиты, как описано в правилах OSHA по защите глаз и лица в 29 CFR 1910.133 или европейский стандарт EN166. Кожа: Носите непроницаемые перчатки. Одежда: Носите соответствующую защитную одежду для предотвращения контакта с кожей. | |
| 【Респираторы】 Следуйте правилам OSHA в отношении респираторов, изложенным в 29CFR 1910.134 или европейском стандарте EN 149. При необходимости всегда используйте респиратор, одобренный NIOSH или европейским стандартом EN 149. | |
| 【Воздействие воздействия】 Хроническое воздействие может привести к повреждению печени и легких. Повторяющееся воздействие может вызвать повреждение поджелудочной железы, диабет и сердечные аномалии. | |
| 【Класс отравления】 — | |
| Меры пожаротушения | Вернуться к содержанию |
| 【Самовозгорание】 > 100 | |
| Самостоятельное тушение пожара содержал дыхательный аппарат, работающий под давлением, MSHA / NIOSH (одобренный или эквивалентный) и полный комплект защитного снаряжения. Пыль при достаточной концентрации может образовывать взрывоопасные смеси с воздухом. Во время пожара в результате термического разложения или сгорания могут образовываться раздражающие и высокотоксичные газы.Средства пожаротушения: Используйте только графитовый порошок, кальцинированную соду, порошкообразный хлорид натрия или соответствующий сухой порошок для металлического пожаротушения. | |
| 【Пожароопасность】 Умеренная в виде пыли при воздействии тепла или пламени. | |
| Меры при случайной утечке | Назад к содержанию |
| 【Небольшие разливы / утечки】 Собрать пылесосом или собрать материал и поместить в подходящий контейнер для утилизации. Избегайте создания пыльных условий.Удалить все источники возгорания. Удалите остатки материала, промыв участок 2-5% раствором кальцинированной соды. | |
| Стабильность и реакционная способность | Вернуться к содержанию |
| 【Несовместимость】 Ацетальдегид, пероксодисульфат аммония, хлорформамидин, хлорноватая кислота, нитрат аммония, галогены, фторсодержащий азотистый натрий, нитрилстиловый эфир натрия дихромат, пероксиформиновая кислота, нитрилфторид, серная кислота, карбид натрия. | |
| 【Стабильность】 Разлагается при нагревании. Окисляется при контакте с воздухом. | |
| 【Разложение】 Оксиды железа. | |
| Название компании: | J&K SCIENTIFIC LTD. |
| Тел .: | 010-82848833-; 010-82848833- |
| Факс: | 86-10-82849933 |
| Веб-сайт: | http: // www.jkchemical.com |
| Название компании: | Alfa Aesar |
| Тел .: | 400-610-6006; 021-67582000 |
| Факс: | 021-67582001 / 03/05 |
| Веб-сайт: | http://chemicals.thermofisher.cn |
Железо — Термические свойства — Температура плавления — Теплопроводность
Характеристики теплопередачи твердого материала измеряются свойством, называемым теплопроводностью , k (или λ), измеряемой в Вт / м.К . Это мера способности вещества передавать тепло через материал за счет теплопроводности. Обратите внимание, что закон Фурье применяется ко всем веществам, независимо от их состояния (твердое, жидкое или газообразное), поэтому он также определен для жидкостей и газов.
Коэффициент теплопроводности большинства жидкостей и твердых тел зависит от температуры. Для паров это также зависит от давления. Всего:
Большинство материалов почти однородны, поэтому обычно можно записать k = k (T) .Подобные определения связаны с теплопроводностью в направлениях y и z (ky, kz), но для изотропного материала теплопроводность не зависит от направления переноса, kx = ky = kz = k.
Теплопроводность металлов
Перенос тепловой энергии в твердых телах обычно может происходить из-за двух эффектов:
- миграция свободных электронов
- колебательные волны решетки (фононы)
Когда электроны и фононы переносят тепловую энергию, приводящую к теплопроводности в твердом теле, теплопроводность может быть выражена как:
k = k e + k фаза
Металлы являются твердыми телами и, как таковые, обладают кристаллической структурой, в которой ионы (ядра с окружающими их оболочками из остовных электронов) занимают трансляционно эквивалентные позиции в кристаллической решетке. Металлы в целом имеют высокую электропроводность , высокую теплопроводность и высокую плотность. Соответственно, перенос тепловой энергии может быть вызван двумя эффектами:
- миграция свободных электронов
- решеточных колебательных волн (фононов).
Когда электроны и фононы переносят тепловую энергию, приводящую к теплопроводности в твердом теле, теплопроводность может быть выражена как:
k = k e + k фаза
Уникальной особенностью металлов с точки зрения их структуры является наличие носителей заряда, а именно электронов .Электропроводность и теплопроводность металлов проистекают из из-за того, что их внешних электронов делокализованы . Их вклад в теплопроводность обозначается как электронная теплопроводность , k e . Фактически, в чистых металлах, таких как золото, серебро, медь и алюминий, тепловой ток, связанный с потоком электронов, намного превышает небольшой вклад, связанный с потоком фононов. Напротив, для сплавов вклад k ph в k больше не является незначительным.
Теплопроводность неметаллов
Для неметаллических твердых тел , k в основном определяется величиной k ph , которая увеличивается с уменьшением частоты взаимодействий между атомами и решеткой. Фактически, решеточная теплопроводность является доминирующим механизмом теплопроводности в неметаллах, если не единственным. В твердых телах атомы колеблются около своего положения равновесия (кристаллической решетки). Колебания атомов не независимы друг от друга, а довольно сильно связаны с соседними атомами.Регулярность расположения решетки имеет важное значение для k ph , с кристаллическими (хорошо упорядоченными) материалами, такими как кварц , имеющими более высокую теплопроводность, чем аморфные материалы, такие как стекло. При достаточно высоких температурах k ph ∝ 1 / T.
квантов колебательного поля кристалла называются « фононов ». Фонон — это коллективное возбуждение в периодическом упругом расположении атомов или молекул в конденсированных средах, таких как твердые тела и некоторые жидкости.Фононы играют важную роль во многих физических свойствах конденсированных сред, таких как теплопроводность и электропроводность. Фактически, для кристаллических неметаллических твердых тел, таких как алмаз, k ph может быть довольно большим, превышая значения k, связанные с хорошими проводниками, такими как алюминий. В частности, алмаз имеет самую высокую твердость и теплопроводность (k = 1000 Вт / м · К) из всех сыпучих материалов.
Теплопроводность жидкостей и газов
В физике жидкость — это вещество, которое постоянно деформируется (течет) под действием приложенного напряжения сдвига. Жидкости представляют собой подмножество фаз материи и включают жидкостей , газов , плазмы и, в некоторой степени, пластичных твердых тел. Поскольку межмолекулярное расстояние намного больше, а движение молекул более хаотично для жидкого состояния, чем для твердого состояния, перенос тепловой энергии менее эффективен. Следовательно, теплопроводность газов и жидкостей обычно меньше, чем у твердых тел. В жидкостях теплопроводность вызвана атомной или молекулярной диффузией.В газах теплопроводность вызвана диффузией молекул с более высокого энергетического уровня на более низкий уровень.
Теплопроводность газов
Влияние температуры, давления и химических веществ на теплопроводность газа можно объяснить с помощью кинетической теории газов . При отсутствии конвекции воздух и другие газы обычно являются хорошими изоляторами. Следовательно, многие изоляционные материалы (например, полистирол) функционируют просто за счет наличия большого количества газонаполненных карманов , которые предотвращают крупномасштабную конвекцию .Чередование газового кармана и твердого материала приводит к тому, что тепло должно передаваться через множество поверхностей раздела, что приводит к быстрому снижению коэффициента теплопередачи.
Теплопроводность газов прямо пропорциональна плотности газа, средней скорости молекул и особенно средней длины свободного пробега молекулы. Длина свободного пробега также зависит от диаметра молекулы, при этом более крупные молекулы с большей вероятностью будут испытывать столкновения, чем небольшие молекулы, что представляет собой среднее расстояние, которое проходит носитель энергии (молекула) до столкновения.Легкие газы, такие как водород и гелий , обычно имеют высокую теплопроводность . Плотные газы, такие как ксенон и дихлордифторметан, обладают низкой теплопроводностью.
Обычно теплопроводность газов увеличивается с повышением температуры.
Теплопроводность жидкостей
Как уже было написано, в жидкостях теплопроводность вызвана атомной или молекулярной диффузией, но физические механизмы, объясняющие теплопроводность жидкостей, не совсем понятны.Жидкости, как правило, имеют лучшую теплопроводность, чем газы, а способность течь делает жидкость пригодной для отвода избыточного тепла от механических компонентов. Тепло можно отвести, направив жидкость через теплообменник. Теплоносители, используемые в ядерных реакторах, включают воду или жидкие металлы, такие как натрий или свинец.
Теплопроводность неметаллических жидкостей обычно уменьшается с повышением температуры.
Железо — Точка плавления — Точка кипения
Железо — Точка плавления и точка кипения
Точка плавления железа 1538 ° C .
Температура кипения железа 2861 ° C .
Обратите внимание, что эти точки связаны со стандартным атмосферным давлением.
Точка кипения — насыщение
В термодинамике термин насыщение определяет состояние, при котором смесь пара и жидкости может существовать вместе при заданной температуре и давлении. Температура, при которой начинается испарение (кипение) для данного давления, называется температурой насыщения или точкой кипения .Давление, при котором начинается испарение (кипение) для данной температуры, называется давлением насыщения. Если рассматривать температуру обратного перехода от пара к жидкости, ее называют точкой конденсации.
Точка плавления — насыщение
В термодинамике точка плавления определяет состояние, при котором твердое вещество и жидкость могут находиться в равновесии. Добавление тепла превратит твердое вещество в жидкость без изменения температуры.Температура плавления вещества зависит от давления и обычно указывается при стандартном давлении. Когда рассматривается как температура обратного перехода от жидкости к твердому телу, она упоминается как точка замерзания или точка кристаллизации.
Железо — Свойства
| Элемент | Железо |
|---|---|
| Атомный номер | 26 |
| Символ | Fe |
| Категория элемента | Переходный металл |
| Фаза на STP | Твердое тело |
| Атомная масса [а.е.м.] | 55.845 |
| Плотность при STP [г / см3] | 7,874 |
| Электронная конфигурация | [Ar] 3d6 4s2 |
| Возможные состояния окисления | +2,3 |
| Сродство к электрону [кДж / моль] | 15,7 |
| Электроотрицательность [шкала Полинга] | 1,83 |
| Энергия первой ионизации [эВ] | 7,9024 |
| Год открытия | неизвестно |
| Discoverer | неизвестно |
| Тепловые свойства | |
| Точка плавления [шкала Цельсия] | 1538 |
| Точка кипения [шкала Цельсия] | 2861 |
| Теплопроводность [Вт / м · К] | 80.2 |
| Удельная теплоемкость [Дж / г К] | 0,44 |
| Теплота плавления [кДж / моль] | 13,8 |
| Теплота испарения [кДж / моль] | 349,6 |
—
—
—

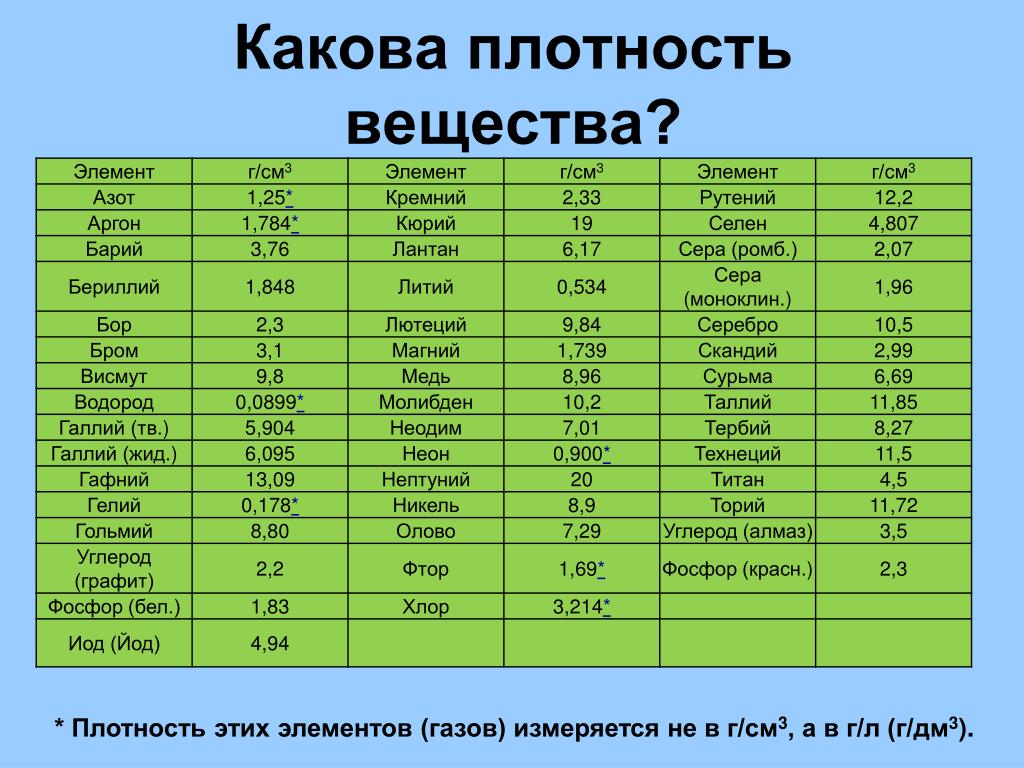 Олово часто используют при пайке, так как температура работающего паяльника составляет как раз 250–400 градусов;
Олово часто используют при пайке, так как температура работающего паяльника составляет как раз 250–400 градусов; Она колеблется в зависимости от насыщенности стали компонентами;
Она колеблется в зависимости от насыщенности стали компонентами;
 Это цинк, свинец, виснут, олово.
Это цинк, свинец, виснут, олово.
 8
8

