Тематический тест на свойства соединений серы (часть 2).
Задание №1
Из предложенного списка соединений выберите те, которые содержат атомы серы в степени окисления +4. Число верных ответов может бы любым.
- 1. H2S
- 2. FeS2
- 3. Cu2S
- 4. SO3
- 5. NaHSO3
Задание №2
Из предложенного списка соединений выберите те, которые содержат атомы серы в степени окисления +6. Число верных ответов может бы любым.
- 1. H2S2O7
- 2. SOCl2
- 3. SO2
- 4. Na2SO3
- 5. CuSO4
Задание №3
Из предложенного списка частиц выберите те, которые проявляют только окислительные свойства. Число верных ответов может бы любым.
- 1. SO32-
- 2. SO42-
- 3. S2-
- 4.
 S2O72-
S2O72- - 5. S2O52-
Задание №4
Из предложенного списка частиц выберите те, которые проявляют только восстановительные свойства. Число верных ответов может бы любым.
- 1. S2-
- 2. SO32-
- 3. SO42-
- 4. NO2—
- 5. Cl—
Задание №5
Из предложенного списка частиц выберите те, которые проявляют как окислительные, так и восстановительные свойства. Число верных ответов может бы любым.
- 1. SO42-
- 2. SO32-
- 3. NO3—
- 4. NO2—
- 5. Br—
Задание №6
Из предложенного списка частиц выберите те, которые не проявляют окислительные свойства. Число верных ответов может бы любым.
- 1.
 F—
F— - 2. S2-
- 3. I—
- 4. SO42-
- 5. CO32-
Задание №7
Из предложенного списка веществ выберите те, которые реагируют с сернистым газом. Число верных ответов может бы любым.
1) сероводород
2) водород
3) кислород
4) едкий натр
5) негашеная известь
РешениеЗадание №8
Из предложенного списка веществ выберите те, которые реагируют с серным ангидридом. Число верных ответов может бы любым.
1) хлор
2) вода
3) азот
4) гашеная известь
5) аргон
РешениеЗадание №9
Из предложенного списка веществ выберите те, которые не реагируют с сернистым газом. Число верных ответов может бы любым.
1) угарный газ
2) сероводород
3) хлороводород
4) водород
5) кислород
РешениеЗадание №10
Из предложенного списка веществ выберите те, которые не реагируют с оксидом серы(VI). Число верных ответов может бы любым.
Число верных ответов может бы любым.
1) перекись водорода
2) вода
3) кислород
4) азот
5) бром
РешениеЗадание №11
Из предложенного списка веществ выберите те, которые при обычных условиях реагируют только с разбавленной серной кислотой. Число верных ответов может бы любым.
1) оксид алюминия
2) гидроксид железа(III)
3) хром
4) нитрат бария
5) мел
РешениеЗадание №12
Из предложенного списка веществ выберите те, которые при обычных условиях реагируют только с концентрированной серной кислотой. Число верных ответов может бы любым.
1) медь
2) калий
3) серебро
4) цинк
5) железо
РешениеЗадание №13
Из предложенного списка веществ выберите те, которые при обычных условиях не реагируют с разбавленной серной кислотой. Число верных ответов может бы любым.
1) железная окалина
2) алюминий
3) гидроксид цинка
4) фосфор
5) сода
РешениеЗадание №14
Из предложенного списка веществ выберите те, которые при обычных условиях не реагируют с концентрированной серной кислотой. Число верных ответов может бы любым.
Число верных ответов может бы любым.
1) железо
2) медь
3) сера
4) алюминий
5) цинк
РешениеЗадание №15
Из предложенного списка веществ выберите те, которые при обычных условиях реагируют как с концентрированной, так и с разбавленной серной кислотой. Число верных ответов может бы любым.
1) поташ
2) железная окалина
3) гидроксид свинца
4) нитрат бария
5) серебро
РешениеЗадание №16
Из предложенного списка веществ выберите те, которые при обычных условиях реагируют с сульфитом натрия. Число верных ответов может бы любым.
1) мел
2) перекись водорода
3) свинец
4) соляная кислота
5) азотная кислота
РешениеЗадание №17
Из предложенного списка веществ выберите те, которые при обычных условиях не реагируют с сульфитом натрия. Число верных ответов может бы любым.
1) нитрат калия
2) нитрат бария
3) серная кислота
4) водород
5) поташ
РешениеЗадание №18
Из предложенного списка веществ выберите те, которые при обычных условиях реагируют с сульфатом калия. Число верных ответов может бы любым.
Число верных ответов может бы любым.
1) нитрат натрия
2) водород
3) нитрат стронция
4) песок
5) карбонат свинца
РешениеЗадание №19
Из предложенного списка веществ выберите те, которые при обычных условиях не реагируют с сульфатом цезия. Число верных ответов может бы любым.
1) хлорид рубидия
2) сульфат меди
3) бромид стронция
4) нитрат серебра
5) хлорид аммония
РешениеЗадание №20
Из предложенного списка веществ выберите те, которые при обычных условиях реагируют с сульфатом меди. Число верных ответов может бы любым.
1) соляная кислота
2) сера
3) сероводород
4) углекислый газ
5) сульфит калия
РешениеЗадание №21
Из предложенного списка веществ выберите те, которые при обычных условиях реагируют с олеумом. Число верных ответов может бы любым.
1) цинк
2) железо
3) поташ
4) вода
5) перекись водорода
РешениеЗадание №22
Из предложенного списка веществ выберите те, которые при обычных условиях не реагируют с олеумом. Число верных ответов может бы любым.
Число верных ответов может бы любым.
1) кислород
2) азот
3) калий
4) золото
5) песок
РешениеЗадание №23
Какие из приведенных реакций приводят к образованию сернистого газа? Число верных ответов может быть любым.
1) сульфат калия + соляная кислота
2) сульфид натрия + бромоводородная кислота
3) сульфид цинка + кислород
4) сульфит цезия + йодоводородная кислота
5) сульфид свинца + перекись водорода
РешениеЗадание №24
Какие из приведенных реакций приводят к образованию серной кислоты? Число верных ответов может быть любым.
1) сера + кислород
2) серный ангидрид + водород
3) сульфат натрия + азотная кислота
4) сульфат меди + сероводород
5) сернистый газ + вода
РешениеЗадание №25
Из предложенного списка реакций выберите те, которые приводят к образованию сероводорода. Число верных ответов может бы любым.
1) сульфид цинка + водород
2) сульфид свинца + соляная кислота
3) сульфид калия + бромоводородная кислота
4) серная кислота + поташ
5) пирит + кислород
РешениеЗадание №26
Из предложенного списка реакций выберите те, которые приводят к образованию водорода. Число верных ответов может бы любым.
Число верных ответов может бы любым.
1) сероводород + кислород
2) сера + натрий
3) серная кислота (разб.) + цинк
4) серная кислота (конц.) + магний
5) сернистый газ + негашеная известь
РешениеЗадание №27
Из предложенного списка реакций выберите те, которые не приводят к образованию сероводорода. Число верных ответов может бы любым.
1) сера + хлороводород
2) сульфид натрия + бромоводородная кислота
3) сульфид натрия + хлорид железа(III)
4) сульфид меди(II) + соляная кислота
5) серная кислота (конц.) + йодид натрия
РешениеЗадание №28
Из предложенного списка реакций выберите те, которые приводят к образованию водорода. Число верных ответов может бы любым.
1) сера + цинк
2) серная кислота (разб.) + гидроксид алюминия
3) сернистый газ + сероводород
4) сульфат натрия + кислород
5) серная кислота (разб.) + цинк
РешениеЗадание №29
Из предложенного списка реакций выберите те, которые не приводят к образованию сернистого газа. Число верных ответов может бы любым.
Число верных ответов может бы любым.
1) серная кислота (разб.) + сульфит натрия
2) серная кислота (конц.) + медь
3) серная кислота (разб.) + сульфид лития
4) серная кислота (конц.) + цинк
5) серная кислота (конц.) + бромид калия
РешениеЗадание №30
Какие из приведенных металлов пассивируются в присутствии концентрированной серной кислоты? Число верных ответов может быть любым.
1) серебро
2) хром
3) магний
4) железо
5) алюминий
РешениеЗадание №31
Из приведенных пар веществ выберите те, между которыми возможно химическое взаимодействие. В поле ответа запишите уравнение реакции, используя в качестве разделителя левой и правой части знак равенства.
1) медь + разбавленная серная кислота
2) азот + концентрированная серная кислота
3) цинк + разбавленная серная кислота
4) серебро + разбавленная серная кислота
5) хлор + концентрированная серная кислота
РешениеОтвет: Zn + H2SO4 = ZnSO4 + H2
Задание №32
Из приведенных пар веществ выберите те, между которыми возможно химическое взаимодействие. В поле ответа запишите уравнение реакции, используя в качестве разделителя левой и правой части знак равенства.
В поле ответа запишите уравнение реакции, используя в качестве разделителя левой и правой части знак равенства.
1) сульфит натрия + карбонат цезия
2) сульфид лития + фосфат калия
3) сульфат аммония + поваренная соль
4) сульфид меди + соляная кислота
5) сульфат бария + карбонат натрия
РешениеОтвет: 3Li2S + 2K3PO4 = 2Li3PO4 + 3K2S
Задание №33
Из приведенных пар веществ выберите те, между которыми возможно химическое взаимодействие. В поле ответа запишите уравнение реакции, используя в качестве разделителя левой и правой части знак равенства.
1) сернистый газ + угарный газ
2) сернистый газ + углекислый газ
3) сернистый газ + азот
4) сернистый газ + аргон
5) сернистый газ + сероводород
РешениеОтвет: SO2 + 2H2S = 3S + 2H2O
Задание №34
Из приведенных пар веществ выберите те, между которыми возможно химическое взаимодействие. В поле ответа запишите уравнение реакции, используя в качестве разделителя левой и правой части знак равенства.
В поле ответа запишите уравнение реакции, используя в качестве разделителя левой и правой части знак равенства.
1) сера + соляная кислота
2) серная кислота + плавиковая кислота
3) сера + гидроксид натрия
4) серная кислота + азот
5) сернистый газ + оксид алюминия
РешениеОтвет: 3S + 6NaOH = 2Na2S + Na2SO3 + 3H2O
Задание №35
Из приведенных пар веществ выберите те, между которыми возможно химическое взаимодействие. В поле ответа запишите уравнение реакции, используя в качестве разделителя левой и правой части знак равенства.
1) сульфат аммония + сероводород
2) сульфит калия + аммиачная селитра
3) сульфид серебра + соляная кислота
4) сульфит натрия + хлорид алюминия
5) сульфат цинка + сероводород
РешениеОтвет: 3Na2SO3 + 2AlCl3 + 3H2O = 6NaCl + 2Al(OH)3 + 3SO2
Задание №36
В заданной схеме превращений
KOH X Y
Веществами X и Y являются соответственно
1) сульфид калия
2) сульфит калия
3) сульфат калия
4) серная кислота
5) гидросульфит калия
Первым укажите вещество X, вторым вещество Y
РешениеЗадание №37
В заданной схеме превращений
SO2 H2SO4 CuSO4
Веществами X и Y являются соответственно
1) сульфид меди
2) нитрат меди
3) оксид меди
4) перекись водорода
5) вода
Первым укажите вещество X, вторым вещество Y
РешениеЗадание №38
В заданной схеме превращений
H2SO4(конц. ) X KHSO3
) X KHSO3
Веществами X и Y являются соответственно
1) едкое кали
2) поваренная соль
3) сульфат меди
4) водород
5) сернистый газ
Первым укажите вещество X, вторым вещество Y
РешениеЗадание №39
В заданной схеме превращений
SO3 X Y
Веществами X и Y являются соответственно
1) сульфит меди
2) сульфат меди
3) сернистый газ
4) серная кислота
5) сера
Первым укажите вещество X, вторым вещество Y
РешениеЗадание №40
В заданной схеме превращений
X SO2 Y
Веществами X и Y являются соответственно
1) водород
2) сернистый газ
3) серная кислота
4) сероводород
5) серный ангидрид
РешениеЗадание №41
В заданной схеме превращений
AlBr3(р-р) X Y
Веществами X и Y являются соответственно
1) сера
2) сернистый газ
3) сульфит алюминия
4) сульфит калия
5) сульфит натрия
Первым укажите вещество X, вторым вещество Y
РешениеЗадание №42
В заданной схеме превращений
H2S S SO2
Веществами X и Y являются соответственно
1) бром
2) йод
3) серная кислота
4) хлороводород
5) цинк
Первым укажите вещество X, вторым вещество Y
РешениеЗадание №43
В заданной схеме превращений
CuSO4 X SO2
Веществами X и Y являются соответственно
1) сульфит меди
2) кислород
3) бромоводородная кислота
4) оксид меди (II)
5) сульфид меди (II)
Первым укажите вещество X, вторым вещество Y
РешениеЗадание №44
В заданной схеме превращений
SO3 X Y
Веществами X и Y являются соответственно
1) олеум
2) сульфид фосфора(V)
3) сернистая кислота
4) серная кислота
5) сернистый газ
РешениеЗадание №45
В заданной схеме превращений
X H2S Y
Веществами X и Y являются соответственно
1) хлорид лития
2) бромид натрия
3) иодид калия
4) серная кислота
5) сера
РешениеЗадание №46
Запишите уравнение реакции каталитического окисления сернистого газа кислородом.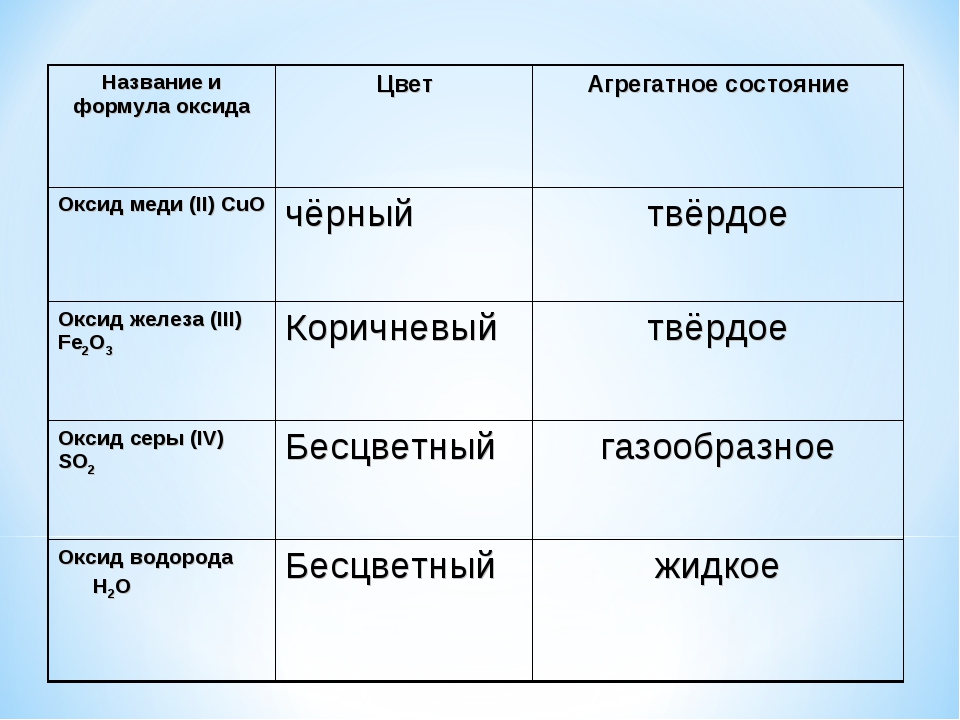
Ответ: 2SO2 + O2 = 2SO3
Задание №47
Запишите уравнение взаимодействия едкого кали с избытком сернистого газа.
РешениеОтвет: SO2 + KOH = KHSO3
Задание №48
Запишите уравнение взаимодействия избытка гидроксида натрия с избытком сернистого газа.
РешениеОтвет: SO2 + 2NaOH = Na2SO3 + H2O
Задание №49
Запишите уравнение взаимодействия сернистого газа с водной суспензией сульфита бария.
РешениеОтвет: SO2 + BaSO3 + H2O = Ba(HSO3)2
Задание №50
Запишите уравнение взаимодействия сернистого газа и сероводорода.
РешениеОтвет: SO2 + 2H2S = 3S + 2H2O
Задание №51
Запишите уравнение взаимодействия сернистого газа с хлорной водой.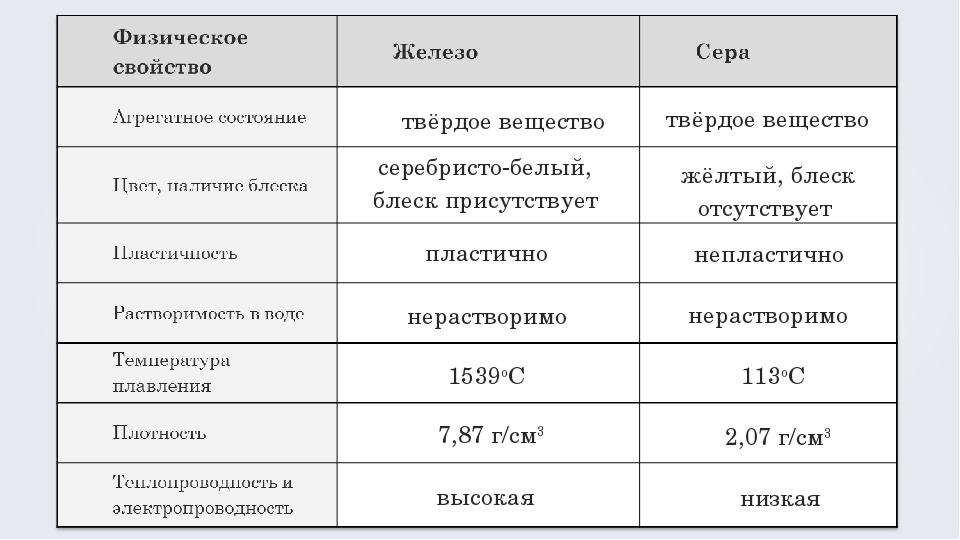
Ответ: SO2 + Cl2 + 2H2O = H2SO4 + 2HCl
Задание №52
Запишите уравнение взаимодействия сернистого газа с раствором перекиси водорода.
РешениеОтвет: SO2 + H2O2 = H2SO4
Задание №53
Запишите уравнение взаимодействия сернистого газа с раствором перманганата калия.
РешениеОтвет: 5SO2 + 2KMnO4 + 2H2O = K2SO4 + 2MnSO4 + 2H2SO4
Задание №54
Запишите уравнение взаимодействия соляной кислоты и сульфита натрия.
РешениеОтвет: Na2SO3 + 2HCl = 2NaCl + SO2 + H2O
Задание №55
Запишите уравнение взаимодействия растворов сульфита калия и хлорида алюминия.
РешениеОтвет: 3K2SO3 + 2AlCl3 + 3H2O = 6KCl + 2Al(OH)3 + 3SO2
Задание №56
Запишите уравнение термического разложения гидросульфита натрия.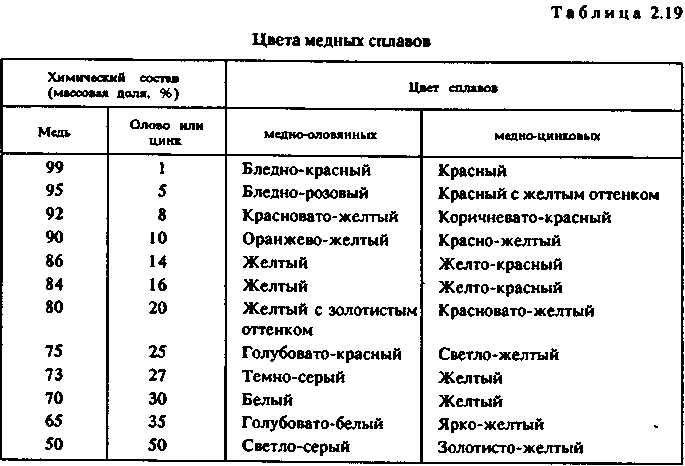
Ответ: 2NaHSO3 = Na2SO3 + SO2 + H2O
Задание №57
Запишите уравнение взаимодействия перекиси водорода и сульфита калия.
РешениеОтвет: K2SO3 + H2O2 = K2SO4 + H2O
Задание №58
Запишите уравнение взаимодействия сульфита натрия с водным раствором сульфата железа (III).
РешениеОтвет: Na2SO3 + Fe2(SO4)3 + H2O = 2FeSO4 + Na2SO4 + H2SO4
Задание №59
Запишите уравнение взаимодействия серного ангидрида с водой.
РешениеОтвет: SO3 + H2O = H2SO4
Задание №60
Запишите уравнение взаимодействия сернистого газа с негашеной известью.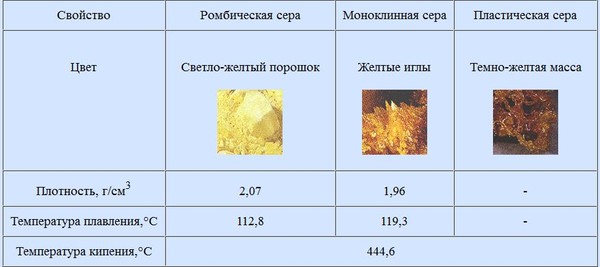
Ответ: SO2 + CaO = CaSO3
Задание №61
Запишите уравнение взаимодействия оксида серы(VI) с оксидом бария.
РешениеОтвет: SO3 + BaO = BaSO4
Задание №62
Запишите уравнение взаимодействия алюминия с разбавленной серной кислотой.
РешениеОтвет: 2Al + 3H2SO4 = Al2(SO4)3 + 3H2
Задание №63
Запишите уравнение взаимодействия алюминия с горячей концентрированной серной кислотой.
РешениеОтвет: 8Al + 15H2SO4 = 4Al2(SO4)3 + 3H2S + 12H2O
Задание №64
Запишите уравнение взаимодействия железного порошка с разбавленной серной кислотой.
РешениеОтвет: Fe + H2SO4 = FeSO4 + H2
Задание №65
Запишите уравнение взаимодействия железных опилок с горячей концентрированной серной кислотой.
Ответ: 2Fe + 6H2SO4 = Fe2(SO4)3 + 3SO2 + 6H2O
Задание №66
Запишите уравнение взаимодействия меди с концентрированной серной кислотой.
РешениеОтвет: Cu + 2H2SO4 = CuSO4 + SO2 + 2H2O
Задание №67
Запишите уравнение взаимодействия серы и концентрированной серной кислоты.
РешениеОтвет: S + 2H2SO4 = 3SO2 + 2H2O
Задание №68
Запишите уравнение взаимодействия углерода с концентрированной серной кислотой.
РешениеОтвет: C + 2H2SO4 = CO2 + 2SO2 + 2H2O
Задание №69
Запишите уравнение взаимодействия фосфора и концентрированной серной кислоты.
РешениеОтвет: 2P + 5H2SO4 = 2H3PO4 + 5SO2 + 2H2O
Задание №70
Запишите уравнение взаимодействия твердой поваренной соли и концентрированной серной кислоты.
Ответ:
2NaCl + H2SO4 = Na2SO4 + 2HCl
или
NaCl + H2SO4 = NaHSO4 + HCl
Задание №71
Запишите уравнение взаимодействия твердого бромида калия с концентрированной серной кислотой.
РешениеОтвет:
2KBr + 2H2SO4 = K2SO4 + SO2 + Br2 + 2H2O
или
2KBr + 3H2SO4 = 2KHSO4 + Br2 + SO2 + 2H2O
Задание №72
Запишите уравнение взаимодействия твердого иодида рубидия и концентрированной серной кислоты.
РешениеОтвет:
8RbI + 5H2SO4 = 4Rb2SO4 + 4I2 + H2S + 4H2O
или
8RbI + 9H2SO4 = 8RbHSO4 + 4I2 + H2S + 4H2O
Задание №73
Запишите уравнение взаимодействия сульфата железа(II) и концентрированной серной кислоты.
Ответ: 2FeSO4 + 2H2SO4 = Fe2(SO4)3 + SO2 + 2H2O
Задание №74
Запишите уравнение взаимодействия гидросульфата калия и едкого кали.
РешениеОтвет: KHSO4 + KOH = K2SO4 + H2O
Задание №75
Запишите уравнение взаимодействия гидросульфита натрия и гидроксида натрия. В качестве разделителя левой и правой частей уравнения используйте знак равенства.
РешениеОтвет: NaHSO3 + NaOH = Na2SO3 + H2O
Задание №76
Установите соответствие между веществом и набором реагентов, с каждым из которых оно может взаимодействовать.
| ВЕЩЕСТВО | РЕАГЕНТЫ |
А) сульфид натрия Б) гидросульфит натрия В) сульфид меди (II) | 1) HNO3, O2, Cu 2) KOH, HCl, Ar 3) NaOH, Ca(OH)2, CsOH 4) AgNO3, H2S, H2O2 |
Запишите в таблицу выбранные цифры под соответствующими буквами.
Задание №77
Установите соответствие между веществом и набором реагентов, с каждым из которых оно может взаимодействовать.
| ВЕЩЕСТВО | РЕАГЕНТЫ |
А) сульфит калия Б) серный ангидрид В) оксид цинка | 1) Ca(OH)2, BaO, H2O 2) BaO, SrO, H2 3) CaO, Na2O, N2 4) BaCl2, HCl, HI |
Запишите в таблицу выбранные цифры под соответствующими буквами.
РешениеЗадание №78
Установите соответствие между веществом и набором реагентов, с каждым из которых оно может взаимодействовать.
| ВЕЩЕСТВО | РЕАГЕНТЫ |
А) сульфат железа(II) Б) серная кислота (конц.) В) фосфат калия | 1) NaOH, BaCl2, P 2) KOH, HNO3, H2O2 3) LiOH, LiCl, CuSO4 4) CsOH, H2O2, Ar |
Запишите в таблицу выбранные цифры под соответствующими буквами.
Задание №79
Установите соответствие между веществом и набором реагентов, с каждым из которых оно может взаимодействовать.
| ВЕЩЕСТВО | РЕАГЕНТЫ |
А) сероводород Б) серная кислота В) оксид серы (VI) | 1) Al2O3, CaO, H2O 2) Ba(OH)2, H2O, Pt 3) ZnO, CaCO3, BaCl2 4) NaOH, CuSO4, AgNO3 |
Запишите в таблицу выбранные цифры под соответствующими буквами.
РешениеЗадание №80
Установите соответствие между веществом и набором реагентов, с каждым из которых оно может взаимодействовать.
| ВЕЩЕСТВО | РЕАГЕНТЫ |
А) негашеная известь Б) сернистый газ В) сульфат калия | 1) LiOH, H2S, H2O2 2) H2O, HCl, HBr 3) NaOH, H2O, S 4) Ba(OH)2, SrCl2, Ca(NO3)2 |
Запишите в таблицу выбранные цифры под соответствующими буквами.
Задание №81
Установите соответствие между веществом и набором реагентов, с каждым из которых оно может взаимодействовать.
| ВЕЩЕСТВО | РЕАГЕНТЫ |
А) HBr Б) H2S В) CuSO4 | 1) сернистый газ, хлор, едкий натр 2) едкое кали, хлор, сульфид цинка 3) гашеная известь, сероводород, хлорид бария 4) нитрат свинца, сернистый газ, водород |
Запишите в таблицу выбранные цифры под соответствующими буквами.
РешениеЗадание №82
Установите соответствие между веществом и набором реагентов, с каждым из которых оно может взаимодействовать.
| ВЕЩЕСТВО | РЕАГЕНТЫ |
А) Na2SO3 Б) SO3 В) Pb(NO3)2 | 1) сероводород, иодид натрия, хлорид калия 2) гидроксид лития, вода, оксид бария 3) вода, железо, оксид фосфора(V) 4) хлорид бария, перекись водорода, хлор |
Запишите в таблицу выбранные цифры под соответствующими буквами.
Задание №83
Установите соответствие между веществом и набором реагентов, с каждым из которых оно может взаимодействовать.
| ВЕЩЕСТВО | РЕАГЕНТЫ |
А) NaHSO3 Б) KOH В) H2S | 1) кислород, сернистый газ, едкий натр 2) соляная кислота, едкое кали, бром 3) серная кислота, магний, вода 4) углекислый газ, хлор, сера |
Запишите в таблицу выбранные цифры под соответствующими буквами.
РешениеЗадание №84
Установите соответствие между веществом и набором реагентов, с каждым из которых оно может взаимодействовать.
| ВЕЩЕСТВО | РЕАГЕНТЫ |
А) серная кислота (конц.) Б) сернистый газ В) гидроксид бериллия | 1) едкий натр, соляная кислота, оксид бария 2) кислород, едкий натр, водород 3) оксид стронция, фосфор, цинк 4) гашеная известь, сероводород, перекись водорода |
Запишите в таблицу выбранные цифры под соответствующими буквами.
Задание №85
Установите соответствие между веществом и набором реагентов, с каждым из которых оно может взаимодействовать.
| ВЕЩЕСТВО | РЕАГЕНТЫ |
А) сульфат магния Б) сульфид лития В) оксид кремния | 1) KOH, CaCO3, HF 2) NaOH, K2CO3, BaCl2 3) H2O2, HCl, K3PO4 4) CsOH, Na2O, CO2 |
Запишите в таблицу выбранные цифры под соответствующими буквами.
РешениеЗадание №86
Вычислите объем газа (в л), который может образоваться при взаимодействии 13 г цинкового порошка и избытка разбавленной серной кислоты.
РешениеЗадание №87
Рассчитайте массу твердого вещества, полученного при взаимодействии 11,2 л сероводорода и 16 г сернистого газа. Ответ приведите в граммах и округлите до целых.
Задание №88
Определите массовую долю соли в растворе, полученном при взаимодействии 200 мл 5%-ного раствора серной кислоты (плотность 1,05 г/мл) и 540 мг порошка алюминия. Ответ приведите в процентах и округлите до сотых.
РешениеЗадание №89
Рассчитайте массовую долю щелочи в растворе, полученном при пропускании 1,12 л сернистого газа в 84 г 10%-ного раствора едкого кали. Ответ приведите в процентах и округлите до сотых.
РешениеЗадание №90
Вычислите массу 100%-ной серной кислоты, необходимой для полного окисления 3,1 г фосфора. Ответ приведите в граммах и округлите до десятых.
РешениеЗадание №91
Определите объем воды, который может прореагировать с 15 г 20%-ного олеума. Ответ приведите в миллилитрах и округлите до тысячных.
РешениеЗадание №92
Навеску железных опилок растворили в избытке горячего концентрированного раствора серной кислоты. Полученный газ пропустили через раствор перекиси водорода. Масса кислоты в образовавшемся растворе составила 9,8 г. Определите массу исходной навески. Ответ приведите в граммах и округлите до сотых.
Масса кислоты в образовавшемся растворе составила 9,8 г. Определите массу исходной навески. Ответ приведите в граммах и округлите до сотых.
Задание №93
Образец 14% олеума массой 11,4 г растворили в 300 г 10% раствора гидроксида натрия. Рассчитайте массовую долю щелочи в образовавшемся растворе. Ответ приведите в процентах и округлите до десятых.
РешениеОтвет: 6,6
Пояснение:
H2SO4 + 2NaOH = Na2SO4 + 2H2O (I)
SO3 + 2NaOH = Na2SO4 + H2O (II)
Рассчитаем массу SO3 в олеуме:
m(SO3) = 11,4 г ⋅ 0,14 = 1,596 г
Рассчитаем его количество вещества:
n(SO3) = m/M = 1,596 г / 80 г/моль = 0,01995 моль
Рассчитаем массу серной кислоты:
m(H2SO4) = m(олеума) — m(SO3) = 11,4 — 1,596 г = 9,804 г
Рассчитаем количество вещества серной кислоты:
m(H2SO4) = m/M = 9,804/98 = 0,1 моль
Гидроксид натрия прореагировал как с серной кислотой, так и с SO3.
Исходя из уравнения реакции (I):
nI(NaOH) = 2n(H2SO4) = 2⋅0,1 = 0,2 моль
Исходя из уравнения реакции (II):
nII(NaOH) = 2n(SO3) = 2⋅0,01995 = 0,0399 моль
Тогда общее количество гидроксида натрия, вступившего в обе реакции, будет составлять:
nобщ.реаг.(NaOH) = nI(NaOH) + nII(NaOH) = 0,2 + 0,0399 = 0,2399 моль
Рассчитаем массу NaOH, вступившего в реакцию:
mобщ.реаг.(NaOH) = nобщ.реаг.(NaOH)⋅M(NaOH) = 0,2399⋅40 = 9,596 г
Рассчитаем массу исходного гидроксида натрия:
mисх.(NaOH) = 300 г ⋅0,1 = 30 г
Тогда, масса оставшегося гидроксида натрия будет равна:
mост.(NaOH) = 30 г — 9,596 г = 20,404 г
Конечная масса полученного раствора будет равна сумме масс олеума и раствора щелочи:
m(конечн.р-ра) = 11,4 + 300 = 311,4 г
Тогда массовая доля щелочи в конечном растворе будет составлять:
wконечн. (NaOH) = 100% ⋅ 20,404 г/311,4 г = 6,6 %
(NaOH) = 100% ⋅ 20,404 г/311,4 г = 6,6 %
Задание №94
При кипячении раствора гидросульфита натрия выделился газ, а масса раствора составила 90 г. Порцию полученного раствора массой 10 г добавили к избытку раствора хлорида бария, что привело к выпадению 2,17 г белого осадка. Определите массовую долю соли в исходном растворе. Ответ приведите в процентах и округлите до сотых.
РешениеЗадание №95
Навеску смеси хлорида натрия и поташа обработали избытком горячей концентрированной серной кислоты. При этом выделилось 11,2 л газа. Если обработать такую же навеску избытком соляной кислоты, то выделяется 4,48 л газа. Определите массовую долю поташа в исходной смеси. Ответ приведите в процентах и округлите до десятых.
РешениеЗадание №96
Образец олеума массой 9 г растворили в необходимом для полной нейтрализации количестве раствора едкого натра. Полученный раствор выпарили досуха. Масса полученного остатка составила 14,2 г. Определите массовую долю серы в исходном образце.
Ответ: 35,6
Пояснение:
Уравнения реакций:
H2SO4 + 2NaOH = Na2SO4 + 2H2O (I)
SO3 + 2NaOH = Na2SO4 + H2O (II)
Как мы видим твердый остаток после упаривания – это сульфат натрия. Рассчитаем его количество вещества:
n(Na2SO4) = m(Na2SO4)/M(Na2SO4) = 14,2/142 = 0,1 моль
Из формулы сульфата натрия мы видим, что в одной его структурной единице содержится 1 атом серы. Поэтому, мы можем записать, что:
n(S) = n(Na2SO4) = 0,1 моль
m(S) = M(S) ⋅ n(S) = 32⋅0,1 = 3,2 г
Вся сера, которая входит в состав сульфата натрия, изначально содержалась в олеуме. Поэтому:
ω(S) = 100% ⋅ m(S) / m(олеума) = 100% ⋅ 3,2 / 9 = 35,6%
Задание №97
При обработке смеси железных и медных опилок разбавленной серной кислотой выделилось 4,48 л газа. Определите массовую долю меди в смеси, если известно, что такая же навеска может прореагировать с 22,4 л хлора. Ответ приведите в процентах и округлите до целых.
Определите массовую долю меди в смеси, если известно, что такая же навеска может прореагировать с 22,4 л хлора. Ответ приведите в процентах и округлите до целых.
Задание №98
К 100 г 9,8%-ного раствора серной кислоты добавили 5 г 2%-ного олеума. Полученный раствор полностью нейтрализовали необходимым количеством поташа. Определите массовую долю соли в образовавшемся растворе.
РешениеЗадание №99
Навеску смеси карбоната магния и сульфата натрия массой 10 г и прокалили до постоянной массы. Полученный твердый остаток обработали водой и отделили осадок. При добавлении к полученному раствору избытка раствора хлорида бария выпало 2,33 г осадка. Определите массовую долю карбоната магния в исходной смеси.
РешениеЗадание №100
Навеску смеси песка и медного порошка общей массой 7 г обработали избытком концентрированной серной кислоты. Определите массовую долю песка в смеси, если известно, что для поглощения выделившегося газа необходимо минимум 100 мл 4%-ного раствора едкого натра (плотность 1,02 г/мл).
Сера. Химия серы и ее соединений
1. Положение серы в периодической системе химических элементов
2. Электронное строение атома серы
3. Физические свойства и нахождение в природе
4. Соединения серы
5. Способы получения
6. Химические свойства
6.1. Взаимодействие с простыми веществами
6.1.1. Взаимодействие с кислородом
6.1.2. Взаимодействие с галогенами
6.1.3. Взаимодействие с серой и фосфором
6.1.4. Взаимодействие с металлами
6.1.5. Взаимодействие с водородом
6.2. Взаимодействие со сложными веществами
6.2.1. Взаимодействие с окислителями
6.2.2. Взаимодействие с щелочами
Сероводород
1. Строение молекулы и физические свойства
2. Способы получения
3. Химические свойства
3.1. Кислотные свойства
3.2. Взаимодействие с кислородом
3.3. Восстановительные свойства
3.4. Взаимодействие с солями тяжелых металлов
Сульфиды
Химические свойства сульфидов
Оксиды серы
1. Оксид серы (IV)
Оксид серы (IV)
2. Оксид серы (VI)
Серная кислота
1. Строение молекулы и физические свойства
2. Способы получения
3. Химические свойства
3.1. Диссоциация серной кислоты
3.2. Основные свойства серной кислоты
3.3. Взаимодействие с солями более слабых кислот
3.4. Разложение при нагревании
3.5. Взаимодействие с солями
3.6. Качественная реакция на сульфат-ионы
3.7. Окислительные свойства серной кислоты
Сернистая кислота
Соли серной кислоты – сульфаты
Сера
Положение в периодической системе химических элементов
Сера расположена в главной подгруппе VI группы (или в 15 группе в современной форме ПСХЭ) и в третьем периоде периодической системы химических элементов Д.И. Менделеева.
Электронное строение серы
Электронная конфигурация серы в основном состоянии:
Атом серы содержит на внешнем энергетическом уровне 2 неспаренных электрона и две неподеленные электронные пары в основном энергетическом состоянии. Следовательно, атом серы может образовывать 2 связи по обменному механизму, как и кислород. Однако, в отличие от кислорода, за счет вакантной 3d орбитали атом серы может переходить в
Следовательно, атом серы может образовывать 2 связи по обменному механизму, как и кислород. Однако, в отличие от кислорода, за счет вакантной 3d орбитали атом серы может переходить в
Электронная конфигурация серы во втором возбужденном состоянии:
Таким образом, максимальная валентность серы в соединениях равна VI (в отличие от кислорода). Также для серы характерна валентность — IV.
Степени окисления
Физические свойства и нахождение в природе
Сера образует различные простые вещества (аллотропные модификации).
Наиболее устойчивая модификация серы – ромбическая сера S8. Это хрупкое вещество желтого цвета.
Моноклинная сера – это аллотропная модификация серы, в которой атомы соединены в циклы в виде «короны». Это твердое вещество, состоящее из темно-желтых игл, устойчивое при температуре более 96оС, а при обычной температуре превращающееся в ромбическую серу.
Пластическая сера – это вещество, состоящее из длинных полимерных цепей. Коричневая резиноподобная аморфная масса, нерастворимая в воде.
В природе сера встречается:
- в самородном виде;
- в составе сульфидов (сульфид цинка ZnS, пирит FeS2, сульфид ртути HgS — киноварь и др.)
- в составе сульфатов (CaSO4·2H2O гипс, Na2SO4·10H2O — глауберова соль)
Соединения серы
Типичные соединения серы:
| Степень окисления | Типичные соединения |
| +6 | Оксид серы(VI) SO Серная кислота H2SO4 Сульфаты MeSO4 Галогенангидриды: SО2Cl2 |
| +4 | Оксид серы (IV) SO2 Сернистая кислота H2SO3 Сульфиты MeSO3 Гидросульфиты MeHSO3 Галогенангидриды: SOCl2 |
| –2 | Сероводород H2S Сульфиды металлов MeS |
Способы получения серы
1. В промышленных масштабах серу получают открытым способом на месторождениях самородной серы, либо из вулканов. Из серной руды серу получают также пароводяными, фильтрационными, термическими, центрифугальными и экстракционными методами. Пароводяной метод — это выплавление из руды
2. Способ получения серы в лаборатории – неполное окисление сероводорода.
2H2S + O2 → 2S + 2H2O
3. Еще один способ получения серы – взаимодействие сероводорода с оксидом серы (IV):
2H2S + SO2 → 3S + 2H2O
Химические свойства серы
В нормальных условиях химическая активность серы невелика: при нагревании сера активна, и может быть как
1. Сера проявляет свойства окислителя (при взаимодействии с элементами, которые расположены ниже и левее в Периодической системе) и свойства восстановителя (с элементами, расположенными выше и правее). Поэтому сера реагирует с металлами и неметаллами.
1.1. При горении серы на воздухе образуется оксид серы (IV):
S + O2 → SO2
1.2. При взаимодействии серы с галогенами (со всеми, кроме йода) образуются галогениды серы:
S + Cl2 → SCl2 (S2Cl2)
S + 3F2 → SF6
1.3. При взаимодействии фосфора и углерода с серой образуются сульфиды фосфора и сероуглерод:
2P + 3S → P2S3
2P + 5S → P2S5
2S + C → CS2
Например, железо и ртуть реагируют с серой с образованием сульфидов железа (II) и ртути:
S + Fe → FeS
S + Hg → HgS
Еще пример: алюминий взаимодействует с серой с образованием сульфида алюминия:
3S + 2Al → Al2S3
1.5.
S + H2 → H2S
2. Со сложными веществами сера реагирует, также проявляя окислительные и восстановительные свойства. Сера диспропорционирует при взаимодействии с некоторыми веществами.
2.1. При взаимодействии с окислителями сера окисляется до оксида серы (IV) или до серной кислоты (если реакция протекает в растворе).
Например, азотная кислота окисляет серу до серной кислоты:
S + 6HNO3 → H2SO4 + 6NO2 + 2H2O
Серная кислота также окисляет серу. Но, поскольку S+6 не может окислить серу же до степени окисления +6, образуется оксид серы (IV):
S + 2H2SO4 → 3SO2 + 2H2O
Соединения хлора, например, бертолетова соль, также окисляют серу до +4:
S + 2KClO3 → 3SO2 + 2KCl
Взаимодействие серы с сульфитами (при кипячении) приводит к образованию тиосульфатов
S + Na2SO3 → Na2S2O3
2.2. При растворении в щелочах сера диспропорционирует до сульфита и сульфида.
Например, сера реагирует с гидроксидом натрия:
S + NaOH → Na2SO3 + Na2S + H2O
При взаимодействии с перегретым паром сера диспропорционирует:
S + H2O (пар) → 2H2S + SO2
Сероводород
Строение молекулы и физические свойства
Сероводород H2S – это бинарное соединение водорода с серой, относится к летучим водородным соединениям. Следовательно, сероводород бесцветный ядовитый газ, с запахом тухлых яиц. Образуется при гниении. В твердом состоянии имеет молекулярную кристаллическую решетку.
Геометрическая форма молекулы сероводорода похожа на структуру воды — уголковая молекула. Но валентный угол H-S-H меньше, чем угол H-O-H в воде и составляет 92,1о.
Способы получения сероводорода
В лаборатории сероводород получают действием минеральных кислот на сульфиды металлов, расположенных в ряду напряжений левее железа.
Например, при действии соляной кислоты на сульфид железа (II):
FeS + 2HCl → FeCl2 + H2S↑
Еще один способ получения сероводорода – прямой синтез из водорода и серы:
S + H2 → H2S
Еще один лабораторный способ получения сероводорода – нагревание парафина с серой.
Видеоопыт получения и обнаружения сероводорода можно посмотреть здесь.
Химические свойства сероводорода
1. В водном растворе сероводород проявляет слабые кислотные свойства. Взаимодействует с сильными основаниями, образуя сульфиды и гидросульфиды:
Например, сероводород реагирует с гидроксидом натрия:
H2S + 2NaOH → Na2S + 2H2O
H2S + NaOH → NaНS + H2O
2. Сероводород H2S – очень сильный восстановитель за счет серы в степени окисления -2. При недостатке кислорода и в растворе H2S окисляется до свободной серы (раствор мутнеет):
2H2S + O2 → 2S + 2H2O
В избытке кислорода:
2H2S + 3O2 → 2SO2 + 2H2O
3. Как сильный восстановитель, сероводород легко окисляется под действием окислителей.
Например, бром и хлор окисляют сероводород до молекулярной серы:
H2S + Br2 → 2HBr + S↓
H2S + Cl2 → 2HCl + S↓
Под действием избытка хлора в водном растворе сероводород окисляется до серной кислоты:
H2S + 4Cl2 + 4H2O → H2SO4 + 8HCl
Например, азотная кислота окисляет сероводород до молекулярной серы:
H2S + 2HNO3(конц.) → S + 2NO2 + 2H2O
При кипячении сера окисляется до серной кислоты:
H2S + 8HNO3(конц.) → H2SO4 + 8NO2 + 4H2O
Прочие окислители окисляют сероводород, как правило, до молекулярной серы.
Например, оксид серы (IV) окисляет сероводород:
2H2S + SO2 → 3S + 2H2O
Соединения железа (III) также окисляют сероводород:
H2S + 2FeCl3 → 2FeCl2 + S + 2HCl
Бихроматы, хроматы и прочие окислители также окисляют сероводород до молекулярной серы:
3H2S + K2Cr2O7 + 4H2SO4 → 3S + Cr2(SO4)3 + K2SO4 + 7H2O
2H2S + 4Ag + O2 → 2Ag2S + 2H2O
Серная кислота окисляет сероводород либо до молекулярной серы:
H2S + H2SO4(конц.) → S + SO2 + 2H2O
Либо до оксида серы (IV):
H2S + 3H2SO4(конц.) → 4SO2 + 4H2O
4. Сероводород в растворе реагирует с растворимыми солями тяжелых металлов: меди, серебра, свинца, ртути, образуя черные сульфиды, нерастворимые ни в воде, ни в минеральных кислотах.
Например, сероводород реагирует в растворе с нитратом свинца (II). при этом образуется темно-коричневый (почти черный) осадок, нерастворимый ни в воде, ни в минеральных кислотах:
H2S + Pb(NO3)2 → PbS + 2HNO3
Взаимодействие с нитратом свинца в растворе – это качественная реакция на сероводород и сульфид-ионы.
Видеоопыт взаимодействия сероводорода с нитратом свинца можно посмотреть здесь.
Сульфиды
Сульфиды – это бинарные соединения серы и металлов или некоторых неметаллов, соли сероводородной кислоты.
По растворимости в воде и кислотах сульфиды разделяют на растворимые в воде, нерастворимые в воде, но растворимые в минеральных кислотах, нерастворимые ни в воде, ни в минеральных кислотах, гидролизуемые водой.
| Растворимые в воде | Нерастворимые в воде, но растворимые в минеральных кислотах | Нерастворимые ни в воде, ни в минеральных кислотах (только в азотной и серной конц.) | Разлагаемые водой, в растворе не существуют |
| Сульфиды щелочных металлов и аммония | Сульфиды прочих металлов, расположенных до железа в ряду активности. Белые и цветные сульфиды (ZnS, MnS, FeS, CdS) | Черные сульфиды (CuS, HgS, PbS, Ag2S, NiS, CoS) | Сульфиды трехвалентных металлов (алюминия и хрома (III)) |
| Реагируют с минеральными кислотами с образованием сероводорода | Не реагируют с минеральными кислотами, сероводород получить напрямую нельзя | Разлагаются водой
| |
| ZnS + 2HCl → ZnCl2 + H2S | Al2S3 + 6H2O → 2Al(OH)3 + 3H2S | ||
Способы получения сульфидов
1. Сульфиды получают при взаимодействии серы с металлами. При этом сера проявляет свойства окислителя.
Например, сера взаимодействует с магнием и кальцием:
S + Mg → MgS
S + Ca → CaS
Сера взаимодействует с натрием:
S + 2Na → Na2S
2. Растворимые сульфиды можно получить при взаимодействии сероводорода и щелочей.
Например, гидроксида калия с сероводородом:
H2S + 2KOH → K2S + 2H2O
3. Нерастворимые сульфиды получают взаимодействием растворимых сульфидов с солями (любые сульфиды) или взаимодействием сероводорода с солями (только черные сульфиды).
Например, при взаимодействии нитрата меди и сероводорода:
Pb(NO3)2 + Н2S → 2НNO3 + PbS
Еще пример: взаимодействие сульфата цинка с сульфидом натрия:
ZnSO4 + Na2S → Na2SO4 + ZnS
Химические свойства сульфидов
1. Растворимые сульфиды гидролизуются по аниону, среда водных растворов сульфидов щелочная:
K2S + H2O ⇄ KHS + KOH
S2– + H2O ⇄ HS– + OH–
2. Сульфиды металлов, расположенных в ряду напряжений левее железа (включительно), растворяются в сильных минеральных кислотах.
Например, сульфид кальция растворяется в соляной кислоте:
CaS + 2HCl → CaCl2 + H2S
А сульфид никеля, например, не растворяется:
NiS + HСl ≠
3. Нерастворимые сульфиды растворяются в концентрированной азотной кислоте или концентрированной серной кислоте. При этом сера окисляется либо до простого вещества, либо до сульфата.
Например, сульфид меди (II) растворяется в горячей концентрированной азотной кислоте:
CuS + 8HNO3 → CuSO4 + 8NO2 + 4H2O
или горячей концентрированной серной кислоте:
CuS + 4H2SO4(конц. гор.) → CuSO4 + 4SO2 + 4H2O
4. Сульфиды проявляют восстановительные свойства и окисляются пероксидом водорода, хлором и другими окислителями.
Например, сульфид свинца (II) окисляется пероксидом водорода до сульфата свинца (II):
PbS + 4H2O2 → PbSO4 + 4H2O
Еще пример: сульфид меди (II) окисляется хлором:
СuS + Cl2 → CuCl2 + S
5. Сульфиды горят (обжиг сульфидов). При этом образуются оксиды металла и серы (IV).
Например, сульфид меди (II) окисляется кислородом до оксида меди (II) и оксида серы (IV):
2CuS + 3O2 → 2CuO + 2SO2
Аналогично сульфид хрома (III) и сульфид цинка:
2Cr2S3 + 9O2 → 2Cr2O3 + 6SO2
2ZnS + 3O2 → 2SO2 + ZnO
6. Реакции сульфидов с растворимыми солями свинца, серебра, меди используют как качественные на ион S2−.
Сульфиды свинца, серебра и меди — черные осадки, нерастворимые в воде и минеральных кислотах:
Na2S + Pb(NO3)2 → PbS↓ + 2NaNO3
Na2S + 2AgNO3 → Ag2S↓ + 2NaNO3
Na2S + Cu(NO3)2 → CuS↓ + 2NaNO3
7. Сульфиды трехвалентных металлов (алюминия и хрома) разлагаются водой (необратимый гидролиз).
Например, сульфид алюминия разлагается до гидроксида алюминия и сероводорода:
Al2S3 + 6H2O → 2Al(OH)3 + 3H2S
Разложение происходит и взаимодействии солей трехвалентных металлов с сульфидами щелочных металлов.
Например, сульфид натрия реагирует с хлоридом алюминия в растворе. Но сульфид алюминия не образуется, а сразу же необратимо гидролизуется (разлагается) водой:
3Na2S + 2AlCl3 + 6H2O → 2Al(OH)3 + 3H2S + 6NaCl
Оксиды серы
| Оксиды серы | Цвет | Фаза | Характер оксида |
| SO2 Оксид сера (IV), сернистый газ | бесцветный | газ | кислотный |
| SO3 Оксид серы (VI), серный ангидрид | бесцветный | жидкость | кислотный |
Оксид серы (IV)
Оксид серы (IV) – это кислотный оксид. Бесцветный газ с резким запахом, хорошо растворимый в воде.
Cпособы получения оксида серы (IV):
1. Сжигание серы на воздухе:
S + O2 → SO2
2. Горение сульфидов и сероводорода:
2H2S + 3O2 → 2SO2 + 2H2O
2CuS + 3O2 → 2SO2 + 2CuO
3. Взаимодействие сульфитов с более сильными кислотами:
Например, сульфит натрия взаимодействует с серной кислотой:
Na2SO3 + H2SO4 → Na2SO4 + SO2 + H2O
4. Обработка концентрированной серной кислотой неактивных металлов.
Например, взаимодействие меди с концентрированной серной кислотой:
Cu + 2H2SO4 → CuSO4 + SO2 + 2H2O
Химические свойства оксида серы (IV):
Оксид серы (IV) – это типичный кислотный оксид. За счет серы в степени окисления +4 проявляет свойства окислителя и восстановителя.
1. Как кислотный оксид, сернистый газ реагирует с щелочами и оксидами щелочных и щелочноземельных металлов.
Например, оксид серы (IV) реагирует с гидроксидом натрия. При этом образуется либо кислая соль (при избытке сернистого газа), либо средняя соль (при избытке щелочи):
SO2 + 2NaOH(изб) → Na2SO3 + H2O
SO2(изб) + NaOH → NaHSO3
Еще пример: оксид серы (IV) реагирует с основным оксидом натрия:
SO2 + Na2O → Na2SO3
2. При взаимодействии с водой SO2 образует сернистую кислоту. Реакция обратимая, т.к. сернистая кислота в водном растворе в значительной степени распадается на оксид и воду.
SO2 + H2O ↔ H2SO3
3. Наиболее ярко выражены восстановительные свойства SO2. При взаимодействии с окислителями степень окисления серы повышается.
Например, оксид серы окисляется кислородом на катализаторе в жестких условиях. Реакция также сильно обратимая:
2SO2 + O2 ↔ 2SO3
Сернистый ангидрид обесцвечивает бромную воду:
SO2 + Br2 + 2H2O → H2SO4 + 2HBr
Азотная кислота очень легко окисляет сернистый газ:
SO2 + 2HNO3 → H2SO4 + 2NO2
Озон также окисляет оксид серы (IV):
SO2 + O3 → SO3 + O2
Качественная реакция на сернистый газ и на сульфит-ион – обесцвечивание раствора перманганата калия:
5SO2 + 2H2O + 2KMnO4 → 2H2SO4 + 2MnSO4 + K2SO4
Оксид свинца (IV) также окисляет сернистый газ:
SO2 + PbO2 → PbSO4
4. В присутствии сильных восстановителей SO2 способен проявлять окислительные свойства.
Например, при взаимодействии с сероводородом сернистый газ восстанавливается до молекулярной серы:
SO2 + 2Н2S → 3S + 2H2O
Оксид серы (IV) окисляет угарный газ и углерод:
SO2 + 2CO → 2СО2 + S
SO2 + С → S + СO2
Оксид серы (VI)
Оксид серы (VI) – это кислотный оксид. При обычных условиях – бесцветная ядовитая жидкость. На воздухе «дымит», сильно поглощает влагу.
Способы получения. Оксид серы (VI) получают каталитическим окислением оксида серы (IV) кислородом.
2SO2 + O2 ↔ 2SO3
Сернистый газ окисляют и другие окислители, например, озон или оксид азота (IV):
SO2 + O3 → SO3 + O2
SO2 + NO2 → SO3 + NO
Еще один способ получения оксида серы (VI) – разложение сульфата железа (III):
Fe2(SO4)3 → Fe2O3 + 3SO3
Химические свойства оксида серы (VI)
1. Оксид серы (VI) активно поглощает влагу и реагирует с водой с образованием серной кислоты:
SO3 + H2O → H2SO4
2. Серный ангидрид является типичным кислотным оксидом, взаимодействует с щелочами и основными оксидами.
Например, оксид серы (VI) взаимодействует с гидроксидом натрия. При этом образуются средние или кислые соли:
SO3 + 2NaOH(избыток) → Na2SO4 + H2O
SO3 + NaOH(избыток) → NaHSO4
Еще пример: оксид серы (VI) взаимодействует с оксидом оксидом (при сплавлении):
SO3 + MgO → MgSO4
3. Серный ангидрид – очень сильный окислитель, так как сера в нем имеет максимальную степень окисления (+6). Он энергично взаимодействует с такими восстановителями, как иодид калия, сероводород или фосфор:
SO3 + 2KI → I2 + K2SO3
3SO3 + H2S → 4SO2 + H2O
5SO3 + 2P → P2O5 + 5SO2
4. Растворяется в концентрированной серной кислоте, образуя олеум – раствор SO3 в H2SO4.
Серная кислота
Строение молекулы и физические свойства
Серная кислота H2SO4 – это сильная кислота, двухосновная, прочная и нелетучая. При обычных условиях серная кислота – тяжелая маслянистая жидкость, хорошо растворимая в воде.
Растворение серной кислоты в воде сопровождается выделением значительного количества кислоты. Поэтому по правилам безопасности в лаборатории при смешивании серной кислоты и воды мы добавляем серную кислоту в воду небольшими порциями при постоянном перемешивании.
Валентность серы в серной кислоте равна VI.
Способы получения
1. Серную кислоту в промышленности производят из серы, сульфидов металлов, сероводорода и др. Один из вариантов — производство серной кислоты из пирита FeS2.
Основные стадии получения серной кислоты :
- Сжигание или обжиг серосодержащего сырья в кислороде с получением сернистого газа.
- Очистка полученного газа от примесей.
- Окисление сернистого газа в серный ангидрид.
- Взаимодействие серного ангидрида с водой.
Рассмотрим основные аппараты, используемые при производстве серной кислоты из пирита (контактный метод):
| Аппарат | Назначение и уравненяи реакций |
| Печь для обжига | 4FeS2 + 11O2 → 2Fe2O3 + 8SO2 + Q Измельченный очищенный пирит сверху засыпают в печь для обжига в «кипящем слое». Снизу (принцип противотока) пропускают воздух, обогащенный кислородом, для более полного обжига пирита. Температура в печи для обжига достигает 800оС |
| Циклон | Из печи выходит печной газ, который состоит из SO2, кислорода, паров воды и мельчайших частиц оксида железа. Такой печной газ очищают от примесей. Очистку печного газа проводят в два этапа. Первый этап — очистка газа в циклоне. При этом за счет центробежной силы твердые частички ссыпаются вниз. |
| Электрофильтр | Второй этап очистки газа проводится в электрофильтрах. При этом используется электростатическое притяжение, частицы огарка прилипают к наэлектризованным пластинам электрофильтра). |
| Сушильная башня | Осушку печного газа проводят в сушильной башне – снизу вверх поднимается печной газ, а сверху вниз льется концентрированная серная кислота. |
| Теплообменник | Очищенный обжиговый газ перед поступлением в контактный аппарат нагревают за счет теплоты газов, выходящих из контактного аппарата. |
| Контактный аппарат | 2SO2 + O2 ↔ 2SO3 + Q В контактном аппарате производится окисление сернистого газа до серного ангидрида. Процесс является обратимым. Поэтому необходимо выбрать оптимальные условия протекания прямой реакции (получения SO3):
Как только смесь оксида серы и кислорода достигнет слоев катализатора, начинается процесс окисления SO2 в SO3. Образовавшийся оксид серы SO3 выходит из контактного аппарата и через теплообменник попадает в поглотительную башню. |
| Поглотительная башня | Получение H2SO4 протекает в поглотительной башне. Однако, если для поглощения оксида серы использовать воду, то образуется серная кислота в виде тумана, состоящего из мельчайших капелек серной кислоты. Для того, чтобы не образовывался сернокислотный туман, используют 98%-ную концентрированную серную кислоту. Оксид серы очень хорошо растворяется в такой кислоте, образуя олеум: H2SO4·nSO3. nSO3 + H2SO4 → H2SO4·nSO3 Образовавшийся олеум сливают в металлические резервуары и отправляют на склад. Затем олеумом заполняют цистерны, формируют железнодорожные составы и отправляют потребителю. |
Общие научные принципы химического производства:
- Непрерывность.
- Противоток
- Катализ
- Увеличение площади соприкосновения реагирующих веществ.
- Теплообмен
- Рациональное использование сырья
Химические свойства
Серная кислота – это сильная двухосновная кислота.
1. Серная кислота практически полностью диссоциирует в разбавленном в растворе по первой ступени:
H2SO4 ⇄ H+ + HSO4–
По второй ступени серная кислота диссоциирует частично, ведет себя, как кислота средней силы:
HSO4– ⇄ H+ + SO42–
2. Серная кислота реагирует с основными оксидами, основаниями, амфотерными оксидами и амфотерными гидроксидами.
Например, серная кислота взаимодействует с оксидом магния:
H2SO4 + MgO → MgSO4 + H2O
Еще пример: при взаимодействии серной кислоты с гидроксидом калия образуются сульфаты или гидросульфаты:
H2SO4 + КОН → KHSО4 + H2O
H2SO4 + 2КОН → К2SО4 + 2H2O
Серная кислота взаимодействует с амфотерным гидроксидом алюминия:
3H2SO4 + 2Al(OH)3 → Al2(SO4)3 + 6H2O
3. Серная кислота вытесняет более слабые из солей в растворе (карбонаты, сульфиды и др.). Также серная кислота вытесняет летучие кислоты из их солей (кроме солей HBr и HI).
Например, серная кислота взаимодействует с гидрокарбонатом натрия:
Н2SO4 + 2NaHCO3 → Na2SO4 + CO2 + H2O
Или с силикатом натрия:
H2SO4 + Na2SiO3 → Na2SO4 + H2SiO3
Концентрированная серная кислота реагирует с твердым нитратом натрия. При этом менее летучая серная кислота вытесняет азотную кислоту:
NaNO3(тв.) + H2SO4 → NaHSO4 + HNO3
Аналогично – концентрированная серная кислота вытесняет хлороводород из твердых хлоридов, например, хлорида натрия:
NaCl(тв.) + H2SO4 → NaHSO4 + HCl
4. Также серная кислота вступает в обменные реакции с солями.
Например, серная кислота взаимодействует с хлоридом бария:
H2SO4 + BaCl2 → BaSO4 + 2HCl
5. Разбавленная серная кислота взаимодействует с металлами, которые расположены в ряду активности металлов до водорода. При этом образуются соль и водород.
Например, серная кислота реагирует с железом. При этом образуется сульфат железа (II):
H2SO4(разб.) + Fe → FeSO4 + H2
Серная кислота взаимодействует с аммиаком с образованием солей аммония:
H2SO4 + NH3 → NH4HSO4
Концентрированная серная кислота является сильным окислителем. При этом она обычно восстанавливается до сернистого газа SO2. С активными металлами может восстанавливаться до серы S, или сероводорода Н2S.
Железо Fe, алюминий Al, хром Cr пассивируются концентрированной серной кислотой на холоде. При нагревании реакция возможна.
6H2SO4(конц.) + 2Fe → Fe2(SO4)3 + 3SO2 + 6H2O
6H2SO4(конц.) + 2Al → Al2(SO4)3 + 3SO2 + 6H2O
При взаимодействии с неактивными металлами концентрированная серная кислота восстанавливается до сернистого газа:
2H2SO4(конц.) + Cu → CuSO4 + SO2 ↑ + 2H2O
2H2SO4(конц.) + Hg → HgSO4 + SO2 ↑ + 2H2O
2H2SO4(конц.) + 2Ag → Ag2SO4 + SO2↑+ 2H2O
При взаимодействии с щелочноземельными металлами и магнием концентрированная серная кислота восстанавливается до серы:
3Mg + 4H2SO4 → 3MgSO4 + S + 4H2O
При взаимодействии с щелочными металлами и цинком концентрированная серная кислота восстанавливается до сероводорода:
5H2SO4(конц.) + 4Zn → 4ZnSO4 + H2S↑ + 4H2O
6. Качественная реакция на сульфат-ионы – взаимодействие с растворимыми солями бария. При этом образуется белый кристаллический осадок сульфата бария:
BaCl2 + Na2SO4 → BaSO4↓ + 2NaCl
Видеоопыт взаимодействия хлорида бария и сульфата натрия в растворе (качественная реакция на сульфат-ион) можно посмотреть здесь.
7. Окислительные свойства концентрированной серной кислоты проявляются и при взаимодействии с неметаллами.
Например, концентрированная серная кислота окисляет фосфор, углерод, серу. При этом серная кислота восстанавливается до оксида серы (IV):
5H2SO4(конц.) + 2P → 2H3PO4 + 5SO2↑ + 2H2O
2H2SO4(конц.) + С → СО2↑ + 2SO2↑ + 2H2O
2H2SO4(конц.) + S → 3SO2 ↑ + 2H2O
Уже при комнатной температуре концентрированная серная кислота окисляет галогеноводороды и сероводород:
3H2SO4(конц.) + 2KBr → Br2↓ + SO2↑ + 2KHSO4 + 2H2O
5H2SO4(конц.) + 8KI → 4I2↓ + H2S↑ + K2SO4 + 4H2O
H2SO4(конц.) + 3H2S → 4S↓ + 4H2O
Сернистая кислота
Сернистая кислота H2SO3 – это двухосновная кислородсодержащая кислота. При нормальных условиях — неустойчивое вещество, которое распадается на диоксид серы и воду.
Валентность серы в сернистой кислоте равна IV, а степень окисления +4.
Химические свойства
1. Сернистая кислота H2SO3 в водном растворе – двухосновная кислота средней силы. Частично диссоциирует по двум ступеням:
H2SO3 ↔ HSO3– + H+
HSO3– ↔ SO32– + H+
2. Сернистая кислота самопроизвольно распадается на диоксид серы и воду:
H2SO3 ↔ SO2 + H2O
Соли серной кислоты – сульфаты
Серная кислота образует два типа солей: средние – сульфаты, кислые – гидросульфаты.
1. Качественная реакция на сульфат-ионы – взаимодействие с растворимыми солями бария. При этом образуется белый кристаллический осадок сульфата бария:
BaCl2 + Na2SO4 → BaSO4↓ + 2NaCl
Видеоопыт взаимодействия хлорида бария и сульфата натрия в растворе (качественная реакция на сульфат-ион) можно посмотреть здесь.
2. Сульфаты таких металлов, как медь Cu, алюминий Al, цинк Zn, хром Cr, железо (II) Fe подвергаются термическому разложению на оксид металла, диоксид серы SO2 и кислород O2;
2CuSO4 → 2CuO + SO2 + O2 (SO3)
2Al2(SO4)3 → 2Al2O3 + 6SO2 + 3O2
2ZnSO4 → 2ZnO + SO2 + O2
2Cr2(SO4)3 → 2Cr2O3 + 6SO2 + 3O2
При разложении сульфата железа (II) в FeSO4 Fe (II) окисляется до Fe (III)
4FeSO4 → 2Fe2O3 + 4SO2 + O2
Сульфаты самых тяжелых металлов разлагаются до металла.
3. За счет серы со степенью окисления +6 сульфаты проявляют окислительные свойства и могут взаимодействовать с восстановителями.
Например, сульфат кальция при сплавлении реагирует с углеродом с образованием сульфида кальция и угарного газа:
CaSO4 + 4C → CaS + 4CO
4. Многие средние сульфаты образуют устойчивые кристаллогидраты:
Na2SO4 ∙ 10H2O − глауберова соль
CaSO4 ∙ 2H2O − гипс
CuSO4 ∙ 5H2O − медный купорос
FeSO4 ∙ 7H2O − железный купорос
ZnSO4 ∙ 7H2O − цинковый купорос
Na2CO3 ∙ 10H2O − кристаллическая сода
Опыты по химии. Сера и её соединения
Взаимодействие серы с медью
Медь — неактивный металл. Но при повышенных температурах она активно взаимодействует с серой. Нагреем серу в пробирке до кипения. Сера плавится и постепенно закипает. Пробирка наполняется бурыми парами серы. Опустим медную проволоку в пробирку. В парах серы медь загорается. Продукт взаимодействия – черный сульфид меди.
Cu + S = CuS
Оборудование: штатив, пробирка, горелка, тигельные щипцы.
Техника безопасности. Опыт следует проводить под тягой. Соблюдать правила работы с горючими веществами и нагревательными приборами.
Постановка опыта и текст – к.п.н. Павел Беспалов.
Взаимодействие серы с натрием
Натрий — активный щелочной металл. Во избежание окисления и взаимодействия с парами воды натрий хранят в керосине. Небольшой кусочек натрия помещает в ступку с порошком серы. Осторожно растираем натрий. Он активно взаимодействует с серой. Продукт реакции – сульфид натрия.
Na + S = Na2S
Оборудование: ступка фарфоровая с пестиком, шпатель, скальпель, пинцет, фильтровальная бумага.
Техника безопасности. Опыт следует проводить под тягой. Соблюдать правила работы со щелочными металлами. Во избежании химических ожогов обернуть руку полотенцем.
Постановка опыта и текст – к.п.н. Павел Беспалов.
Взаимодействие серы с цинком
Цинк менее активен по сравнению с натрием. Для протекания реакции с серой необходимо нагревание. Смесь порошков серы и цинка поджигаем. Смесь энергично сгорает с образованием сульфида цинка.
Zn + S = ZnS
Оборудование: шпатель, огнезащитная прокладка, горелка, лучина.
Техника безопасности. Соблюдать правила работы с нагревательными приборами. Опыт проводить под тягой.
Постановка опыта и текст – к.п.н. Павел Беспалов.
Получение пластической серы
Сера – кристаллическое вещество. В кристаллах молекулы всегда расположены в строгом порядке. Сера, измельченная в порошок, сохраняет кристаллическую структуру. Нагреем порошок серы. Сера плавится при температуре 120 градусов и становится легко подвижной желтой жидкостью. При дальнейшем повышении температуры сера начинает темнеть, превращается в темно-бурую, вязкую жидкость – пластическую серу. При быстром охлаждении в воде сера сохраняет пластические свойства. Пластическая сера с течением времени кристаллизуется и твердеет.
Оборудование: пробирка, штатив для пробирок, шпатель, химический стакан, спиртовка, держатель для пробирок.
Техника безопасности. Соблюдать правила обращения с нагревательными приборами. Не допускать попадания расплавленной серы на поверхность стола. При возгорании серы тушить пламя речным песком.
Постановка опыта – Елена Махиненко, текст – к.п.н. Павел Беспалов.
Получение сероводорода и изучение его свойств
Сероводород – токсичный бесцветный газ с запахом тухлых яиц. Сероводород (H2S) в лаборатории можно получить нагреванием смеси парафина с серой. В пробирку помещаем кусочек парафина и желтый порошок серы, закрываем пробкой с газоотводной трубкой и нагреваем на пламени спиртовки. Выделяющийся сероводород можно обнаружить с помощью влажной универсальной индикаторной бумаги: под действием сероводорода она краснеет. Раствор сероводорода в воде – очень слабая кислота. Пропускаем сероводород через холодную дистиллированную воду. Сероводород частично растворяется, образуется сероводородная вода. Лакмус краснеет в сероводородной воде, это действительно слабая кислота. Качественная реакция на сульфид ион – реакция с ионами свинца, мы проведем похожую ‑ реакцию с ионами меди. При добавлении сульфата меди к сероводородной воде выпадает черный осадок сульфида меди.
CuSO4 + H2S = CuS ↓+ H2SO4
Так же выглядит осадок сульфида свинца. По черному осадку сульфида свинца можно обнаружить сульфид-ион.
Оборудование: пробирки, газоотводная трубка, штатив, штатив для пробирок, шпатель, щипцы, фарфоровые тигли, спиртовка, держатель для пробирок.
Техника безопасности. Следует соблюдать правила обращения с ядовитыми газами. Опыт необходимо проводить в вытяжном шкафу. Соблюдать правила обращения с нагревательными приборами.
Постановка опыта – Елена Махиненко, текст – к.п.н. Павел Беспалов.
Получение сернистой кислоты
Сернистую кислоту можно получить растворением сернистого газа в воде. Для получения сернистого газа понадобится концентрированная серная кислота и медь: в пробирку с концентрированной серной кислотой поместим кусочек меди и нагреем раствор.
Cu + 2H2SO4 = CuSO4 + SO2↑ + H2O
Направим ток сернистого газа в пробирку с водой. При растворении сернистого газа частично происходит реакция с водой, и образуется слабая сернистая кислота.
SO2 + H2O = H2SO3
Пропуская сернистый газ через воду, мы получили сернистую кислоту. Сернистый газ в огромных количествах выделяется из недр Земли у действующих вулканов. Сернистый газ раздражает слизистые оболочки дыхательных путей, вызывает их воспаление, потерю аппетита, в больших концентрациях ‑ потерю сознания. Поэтому обращаться с сернистым газом нужно, соблюдая все меры предосторожности.
Оборудование: пробирки, газоотводная трубка, штатив, штатив для пробирок, пинцет, спиртовка.
Техника безопасности. Опыт необходимо проводить под тягой. Соблюдать правила обращения с нагревательными приборами. Необходима особая осторожность при работе с концентрированной серной кислотой. Следует соблюдать правила работы с концентрированными кислотами.
Недопустимо вдыхание выделяющегося сернистого газа.
Постановка опыта – Елена Махиненко, текст – к.п.н. Павел Беспалов.
Свойства сернистой кислоты
Раствор сернистой кислоты H2SO3 обладает восстановительными свойствами. Сернистая кислота взаимодействует с раствором йода, обесцвечивая его. При этом образуются йодоводородная и серная кислоты.
H2SO3 + I2 + H2O = H2SO4 + 2НI
Как и все кислоты, сернистая кислота меняет цвет растворов индикаторов. Метиловый оранжевый в растворе кислоты становится красным. В старину дамские соломенные шляпки отбеливали сернистой кислотой. Раствор сернистой кислоты отбеливает ткани из растительного материала, шерсти, шелка.
Оборудование: пробирки, газоотводная трубка, штатив, штатив для пробирок, пинцет, спиртовка.
Техника безопасности. Опыт необходимо проводить под тягой. Соблюдать правила обращения с нагревательными приборами. Недопустимо вдыхание выделяющегося сернистого газа.
Постановка опыта – Елена Махиненко, текст – к.п.н. Павел Беспалов .
Сера — химические и физические свойства
Сера – важнейший элемент в современной промышленности.
Особые свойства серы (антисептические и антипаразитарные) делают её незаменимым компонентном многих лекарственных препаратов.
Что такое сера и как она выглядит
Сера – химический элемент, находящийся по 16 номером в таблице Д. И. Менделеева и обозначающийся буквой S (по первой букве латинского названия Sulphur).
Молярная масса серы равна 32, 065 г/моль, атомная масса — 32,066 а. е. м. Это вещество может быть как ярко-желтого, так и коричневого цвета.
Различают порошкообразную (молотую) и жидкую серу.
Характеристика серы
Сера – вещество с переменной степенью окисления. На внешней электронной орбитали серы находятся шесть валентных электронов, для заполнения не хватает ещё двух, поэтому в соединениях с металлами и водородом она проявляет валентность -2.
При взаимодействии с кислородом и галогенами, т. е. с элементами с большей электроотрицательностью, сера может проявлять положительную валентность, например, +4 и +6.
Физические свойства
Как простое вещество, сера образует несколько аллотропных модификаций:
- Ромбическая – то, что мы привыкли называть обычной серой. Она устойчива при обычных условиях, встречается чаще всего недалеко от действующих или потухших вулканов.
- Пластическая – представляет собой замкнутые или открытые цепочки соединяющейся между собой серы, получаемые обычно при её сжигании. Имеет самую большую молекулярную массу среди всех разновидностей серы.
- Моноклинная (S8) – соединение серы, которое в молекулярном виде представляет собой восьмиугольник с атомами серы в вершинах. Выглядит как множество цилиндров, похожих на иглы. При комнатной температуре быстро превращается в ромбическую.
Приблизительная молярная масса одной молекулы моноклинной серы – 256 г/моль. В России сера, в основном, бывает только двух товарных видов: гранулированная и комовая.
Сера – легкоплавкое вещество, температура плавления около 120 градусов. Нерастворима в воде и не намокает про соприкосновении с ней.
Не обладает электролитическими свойствами и теплопроводностью. Плотность серы — 2,070 г/см³.
Химические свойства
В соединениях с водородом образует серную (химическая формула h3SO4) со степенью окисления серы +6 и сернистую (h3SO3) со степенью окисления +4 кислоты, которые дают соответственно сульфаты и сульфиты.
В нормальных условиях реагируют с активными металлами и ртутью, образуя сульфиды:
Hg + S = HgS
Na + S = Na2S
Также образует сульфиды при нагревании с большинством неактивных металлов, кроме платины и золота:
Fe + S (t) = Fe2S3
Проявляет восстановительные свойства в реакции с кислородом при нагревании, образуя кислотный оксид:
S + O2 = SO2
В реакциях с водородом образует сернистый газ, летучее бесцветное вещество с неприятным запахом тухлых яиц:
h3 + S = h3S
Области применения
Широко применяется в медицине, обладает антисептическими и антипаразитарными свойствами, используется для дезинфекции помещений и избавления от паразитов.
В низких концентрациях способствует формированию новых клеток эпидермиса, из-за чего её часто используют для лечения воспалений. Помимо этого сера имеет слабительное действие, а при приеме внутрь оказывает отхаркивающий эффект.
Благодаря легковоспламеняемости и горючим свойствам, сера хорошо горит. Например, самое простое, где можно взять серу, это открыть полный спичечный коробок — сера входит в состав спичечной головки.
При трении головка касается шероховатой поверхности (например, наждачной бумаги), и спичка легко загорается.
Серная кислота (h3SO4) – важнейший продукт химической промышленности, используется в качестве электролита в свинцовых аккумуляторах, применяется для получения соляной, азотной, борной и других кислот.
Серная кислота является необходимым сульфирующим средством при получении многих лекарственных веществ и красок.
Сероводород (h3S) используется для выделения чистой серы, сульфитов и серной кислоты из растворов.
Оксиды серы (SO2 и SO3) находят применения в производстве серной и азотной кислот, а также используются в бытовой химии: входят в состав отбеливателей, дезинфицирующих средств.
Нахождение серы в природе
Чаще всего в природе находится самородная сера (S), однако встречаются и её соединения с другими элементами: FeS2 (сульфат железа (II), пирит), ZnS (сульфат цинка, цинковая обманка), CaSO4*2h3O (гипс), PbS (сульфат свинца, свинцовый блеск) и другие.
Биологическая роль серы
Сера содержится в живых организмах, особенно много её в белках ногтей, волос, копыт. Общая масса серы в человеческом организме составляет около 130 грамм. Также это вещество встречается в составе некоторых витаминов и гормонов.
Сера обладает уникальными химическими и физическими свойствами, благодаря чему является важнейшим компонентом промышленности и незаменима при создании лекарственных препаратов.
Сернистые соединения сульфиды — Знаешь как
Сернистые соединения сульфиды минераллов
Содержание статьи
Минералы этой группы являются производными главным образом сероводорода. В некоторых минералах место серы занимает селен или теллур. Такие минералы называют селенидами или теллуридами. По аналогии с сульфидами выделены также арсениды и антимониды.
Здесь рассматриваются только сернистые соединения.
Сернистые соединения, по подсчетам В. И. Вернадского, составляют 0,15% по весу от земной коры. Их общее количество — более 300. По количеству минералов (после силикатов) сернистые соединения занимают второе место. Более 40 химических элементов дают соединения с серой, большинство из них представлено металлами. Для минералов, относящихся к сульфидам, характерно изоморфное замещение одних элементов другими. В сульфидах часто наблюдаются примеси ряда редких элементов: кадмия, галлия, индия, таллия, рения и др.
По типу химических связей сульфиды и им подобные соединения относятся к типу ионных. Однако в связи с большими радиусами ионов серы, теллура, селена, мышьяка, сурьмы при взаимодействии их с крупными катионами металлов наблюдается явление поляризации. Вследствие поляризации появляются общие электронные оболочки и возникают ионно-ковалентные, а иногда и чисто ковалентные связи. Все это определяет и характерные физические свойства минералов данной группы — большинство сульфидов характеризуется металлическим блеском, отличается электро- и теплопроводностью, большим удельным весом и невысокой твердостью. Происхождение основной массы сульфидов — гидротермальное, для некоторых — магматическое. Большинство сульфидов в приповерхностной зоне земной коры неустойчиво, разлагается с образованием вторичных минералов: карбонатов, сульфатов, окислов, силикатов.
Нередко в зоне окисления сульфидных месторождений вторичные минералы, в частности гётит и гидрогётит, создают своеобразные «железные шляпы» охряно-желтого цвета, которые иногда служат хорошим поисковым признаком на скрытые на глубине сульфидные руды. Сульфиды имеют большое промышленное значение. Они являются источником свинца, цинка, меди, никеля, кобальта, молибдена и других элементов. Сернистые соединения, или сульфиды, подразделяются на две большие группы: простые сульфиды и сложные сульфиды, называемые также сульфосолями. В группе сульфидов иногда выделяют двойные сульфиды, когда в соединениях с серой участвуют два или три катиона (например, халькопирит CuFeS2), и дисульфиды — соединения катиона с анионной группой [S2]2- где атомы серы сближены в одну группу (как у пирита FeS2, где железо двухвалентное).
Простые сульфиды
Галенит (свинцовый блеск) — PbS
Название происходит от латинского слова «галена» — свинцовая руда. Химический состав: Рb — 86,60%, S — 13,40%. Сера может изоморфно замещаться селеном. Часто содержит примеси серебра (от 0,1 до 1%) и других элементов. Сингония кубическая. Твердость 2—3. Уд. вес 7,4—7,6. Морфология. Зернистые агрегаты, плотные массы, кристаллы, друзы. Нередко наблюдаются крупные кристаллы (до нескольких см). Облик кристаллов кубический, кубооктаэдрический, октаэдрический (см. рис. 22, 1, 2). Встречаются двойники срастания и прорастания. Спайность по {100} весьма совершенная. Из-л о м мелкоступенчатый, в плотных массах плоскораковистый, неровный. Блеск металлический, матовый (у плотных разностей). Цвет свинцово-серый.
Черта серовато-черная. Разновидности: свинчак (тонкозернистые плотные разности), селенистый галенит (содержание селена от 0,5 до 1,2%). Особые свойства. Электропроводен. Диамагнитен : В азотной кислоте растворяется с выделением серы и сульфата свинца. Из азотнокислого раствора при взаимодействии с соляной кислотой выпадает белый осадок хлористого свинца, растворяющийся в горячей воде. Насыщенным раствором йода в 5% йодистом калии при кипячении галенит окрашивается в желто-зеленый цвет, т. пл. 1112°С. Происхождение. Гидротермальное в форме залежей и жил. Встречается в скарнах в виде вкрапленности и зернистых агрегатов. Реже — как гипергенный минерал в осадочных породах. Парагенезис. В гидротермальных образованиях ассоциирует со сфалеритом, пиритом, халькопиритом, образуя вместе с ними так называемые поли-металлические руды. Часто с галенитом присутствуют арсенопирит, блеклые руды и другие сложные сульфиды, содержащие серебро, свинец, медь, мышьяк, никель. Из нерудных — кварц, кальцит, барит, флюорит. В скарнах вместе с галенитом встречаются сфалерит, халькопирит, пирротин и типичные минералы скарнов (пироксены, гранаты и др.). Месторождения. В СССР: Рудный Алтай (Заводинское, Лениногорское, Зыряновское и др.), ДВК (Дальнегорск, бывш. Тетюхе), Средняя Азия, Казахстан, Кавказ (Садон), Забайкалье (Нерчинск). За рубежом: Австралия (Брокен-Хилл), Чехословакия, Канада, США, ГДР (Фрайберг) и др. Значение. Важнейшая руда на свинец. Извлечение серебра. Получение свинцовых белил, глазури и др.
Сфалерит (цинковая обманка) ZnS
Название происходит от греческого слова «сфалерос» — обманчивый (по-видимому, за его резкое отличие от других сульфидов металлов). Химический состав: Zn— 67,06%, S — 32,94%. Содержит изоморфную примесь железа (до 26%), кадмия (до 0,8%), иногда марганца (до 5,8%) и других элементов. Известно несколько полиморфных модификаций ZnS — сфалерит, вюртцит и его разновидности. Сингония кубическая. Твердость 3,5—4. Уд. вес 3,9—4,1. Морфология. Зернистые выделения, вкрапленники, кристаллы. Почковидные и скрытокри-сталлические образования. Редко — землистые. Кристаллы имеют тетраэдрический или кубооктаэдрический облик, реже додекаэдрический (см. рис. 22,6). Часты двойники. Спайность совершенная по {110}. Излом раковистый.
Блеск алмазный, жирный. Полупрозрачен. Цвет меняется от светлых тонов желтого, коричневого до темно-бурого и черного. При отсутствии примеси железа— бесцветный. Реже — красноватый, зеленый. Черта от светлого до коричневого цвета. Разновидности: клейофан — светлоокрашенный, бесцветный, почти без примеси железа и марганца, марматит — черный, богатый железом. Особые свойства. Хрупок. На гранях обычно наблюдается штриховка. Плохой проводник электричества. Люминесцирует в ультрафиолетовых лучах. Иногда светится при ударе или царапании. Растворяется в концентрированной азотной кислоте с выделением серы, в соляной кислоте — с выделением сероводорода. Происхождение. Гидротермальное. Встречается в скарнах в той же ассоциации, что и галенит. Редко — гипергенное. Парагенезис. Встречается в ассоциации с галенитом, халькопиритом, блеклыми рудами, пиритом в полиметаллических месторождениях. Характерна ассоциация с арсенопиритом, кубанитом, магнетитом, касситеритом. Из жильных минералов с ним выделяются: кварц, кальцит, барит. Месторождения.
В СССР: Рудный Алтай, Средняя Азия, Забайкалье, Урал (с колчеданными рудами), Приморье (Дальнегорск, бывшем Тетюхе). За границей: США, Швеция, Испания, Польша, Чехословакия. Значение-основная руда на цинк Для извлечения редких элементов: кадмия, индия, германия. Для изготовления цинковых белил.
Халькозин (медный блеск) — Cu2S
Название происходит от греческого слова «халькос» — медь. Химический состав: Сu —79,86%, S—20,14%- Имеются примеси серебра, железа, кобальта, никеля, мышьяка и золота. Имеются две модификации: низкотемпературная (устойчивая в обычных условиях) и высокотемпературная. Сингония ромбическая. Твердость 2,5—3. Уд. вес 5,5—5,8. Мор фол о г и я. Сплошные тонкозернистые массы, вкрапленники, псевдоморфозы по борниту, халькопириту, ковеллину. Кристаллы редки. Спайность несовершенная. Излом раковистый. Блеск металлический. Непрозрачен. Цвет свинцово-серый. Черта темно-серая. О с о б ы е свойства. Очень хрупок. При царапании ножом остается блестящий след, чем отличается от похожей на него блеклой руды. Хороший проводник электричества. Хорошо растворяется в азотной кислоте с выделением серы и окрашиванием раствора в зеленый цвет. Происхождение. Выделяется при низких температурах из гидротермальных растворов. Основная масса образуется в экзогенных условиях в зонах, медных сульфидных месторождений в качестве вторичного минерала по борниту, халькопириту, галениту, сфалериту и другим сульфидам. Парагенезис. Выделяется совместно с первичным борнитом. При окислении переходит в малахит, куприт, самородную медь. Месторождения. Казахстан (Джезказган, Коунрад), Великобритания (Корнуэлл), США (Бьютт). Значение. Главнейшая медная руда.
Ковеллин (медное индиго) CuS или Cu2S • CuS2
Назван в честь итальянского минералога Ковелли. Химический состав: Сu — 66,48%, S — 33,52%. Содержит примеси железа, селена, серебра и свинца. Сингония гексагональная. Твердость 1,5—2. Уд. вес 4,6. Морфология. Тонкие примазки ярко-синего цвета, порошковатые и сажистые землистые массы. Кристаллы очень редки. Спайность весьма совершенная. Блеск матовый, смолистый. Черта серая до черной. Происхождение. Характерный вторичный минерал в меднорудных месторождениях. Развивается метасоматическим путем по сульфидам меди: халькопириту, борниту, халькозину. Месторождения. Самостоятельных месторождений не образует. В больших массах был встречен в Новой Зеландии. Значение. Совместно с халькозином составляет наиболее богатые медные руды.
Пирит (серный колчедан, железный колчедан) FeS2
Название происходит от греческого слова «пир» — огонь (при ударе дает искры). Химический состав: Fe— 46,55%, S — 53,45%- В составе пирита железо изоморфно замещается кобальтом и никелем, в состав пирита может входить мышьяк до 2,7%, часто — примеси золота. Сингония кубическая. Твердость 6—6,5. Уд. вес 4,9—5,2. Морфология. Зернистые агрегаты, конкреции с концентрическим и радиально-лучистым строением, почковидные агрегаты, кристаллы. Кристаллы кубического, пентагон-додекаэдрического, реже октаэдрического облика. Спайность весьма несовершенная. Излом раковистый, неровный. Блеск металлический. Непрозрачен. Цвет светло-желтый, латунно-желтый. Черта буровато-черная. Разновидности: никелистый пирит, кобальтпирит. Особые свойства. На гранях наблюдается штриховка (см. рис. 6). Иногда наблюдается желтовато-бурая побежалость. Происхождение. Имеет различный генезис: в магматических породах в виде вкрапленности, в скарнах, в гидротермальных (наибольшие скопления) и осадочных месторождениях. Парагенезис: ассоциирует с галенитом, сфалеритом, халькопиритом, марказитом, кварцем в гидротермальных месторождениях, в колчеданных месторождениях, где пирит слагает крупные залежи на 80—90% с подчиненным количеством халькопирита, сфалерита и кварца. Месторождения. Урал (Карабаш, Блява), Башкирия (Сибай), Рудный Алтай (Змеиногорское, Белоусовское, Березовское), Закавказье. За границей: Норвегия, Испания, Чехословакия. Значение. Сырье для получения серы и серной кислоты. Золото и никельсодержащие пириты служат источником золота и никеля.
Марказит (лучистый колчедан) FeS2
Химический состав: тот же, что и.у пирита. Часто содержит примесь мышьяка, а также никель, кобальт, висмут, сурьму, медь. Сингония ромбическая. Твердость 6—6,5. Уд. вес 4,8—4,9. Морфология. Конкреции, почки, натечные агрегаты, сплошные массы, кристаллы копьевидной и таблитчатой формы. Сп айность несовершенная. Излом неровный. Блеск металлический. Непрозрачен.Цвет серовато-желтый. Черта черная, зёленовато-черная. Разновидности: мельниковит-марказит — порошковатая разность. Происхождение. Образуется на конечных стадиях гидротермального процесса и как экзогенный минерал в виде конкреций, зерен и псевдоморфоз по органическим остаткам. Парахенезис. Ассоциирует с пиритом, халькопиритом, галенитом, сфалеритом, пирротином и другими сульфидами, с кварцем. Иногда — с реальгаром и аурипигментом. Месторождения. Наряду с пиритом образует значительные скопления на Ю. Урале (Блявинское). Самостоятельных месторождений не образует. Значение. Для производства серной кислоты и серы.
Пирротин (магнитный колчедан) FeS или Fe1_xS, где х от 0 до 0,2
Название происходит от греческого слова «пирротес» — красноватый (по оттенку окраски). Химический состав: Fe — 63,53%, S — 36,47%. Содержит примеси никеля, кобальта, меди, иногда марганца и цинка. Сингония гексагональная. Твердость 3,5— 4,5. Уд. вес 4,6—4,7. Морфология. Встречается в виде мелкозернистых агрегатов, сплошных масс, вкраплений. Кристаллы редки. Спайность несовершенная. Излом неровный, раковистый. Блеск металлический. Непрозрачен. Цвет темный, бронзово-желтый, иногда коричневатый. Черта серо-черная. Особые свойства. Магнитен. Хрупок. Обладает бурой побежалостью. Хороший проводник электричества. Происхождение. Магматическое в связи с основными горными породами. Образуется также контактово-метасоматическим путем (скарны) и гидротермальным путем.
Парагенезис.Встречается с пентландитом, халькопиритом, магнетитом, ильменитом, пиритом в медно-никелевых месторождениях и в ассоциации с галенитом, сфалеритом, халькопиритом, касситеритом, арсенопиритом, хлоритом, карбонатами, кварцем в свинцово-цинковых, сульфидно-касситеритовых и золоторудных месторождениях. Месторождения. Норильское, Монче-тундра (Мурманская область), Урал (Турьинские месторождения), Дальнегорск, бывш. Тетюхе (Приморский край). За рубежом: Сэдбери (Канада), Бушвельд (Ю. Африка), Норвегия. Значение. Сырье для сернокислотного производства.
Пентландит (железо-никелевый колчедан) — (Fe, Ni)9S8
Назван в честь Д. Б. Пентланда, открывшего минерал. Химический состав при соотношении Fe:Ni=1, Fe-32,55% Ni-34,22%, S-33,23%. Присутствует изоморфная примесь кобальта (0,4—3%), часто селена и теллура. Сингония кубическая. Твердость 3—4. Уд. вес 4,5—5. Морфология. Агрегаты зерен и отдельные включения неправильной формы. Спайность совершенная по октаэдру. Излом раковистый. Блеск металлический. Непрозрачен. Цвет бронзово-желтый. Черта светлая бронзово-бурая. Разновидности — кобальт-пентландит (содержит до 49% кобальта). Особые свойства. Хрупок. Немагнитен (в отличие от похожего на него пирротина). Хороший проводник электричества. В азотной кислоте растворяется, окрашивая раствор в зеленый цвет. При добавлении раствора аммиака и порошка диметилгли-оксима наблюдается карминно-красное окрашивание с образованием осадка. Происхождение и парагенезис. Возникает в тесной ассоциации с пирротином, халькопиритом в медно-никелевых сульфидных рудах, связанных с основными и ультраосновными породами. В небольших количествах с пентландитом встречаются магнетит и минералы группы платины. Месторождения. Норильское, Монче-тундра, Канада, Норвегия, Ю. Африка. Значение. Основная руда на никель. Источник получения кобальта, металлов платиновой группы, селена и теллура.
Молибденит (молибденовый блеск) — MoS2
Название происходит от греческого слова «молибдос» — свинец, за сходство со свинцом. Химический состав: Мо—59,94%, S — 40,06%. Обычно химически чистый. Наблюдается изоморфная примесь рения (до 0,3%). Сингонии я гексагональная. Твердость 1. Уд. вес 4,7—4,8. М о р ф о л о г и я. Листоватые, чешуйчатые агрегаты, сферолцты, оторочки и рассеянная вкрапленность в кварцевых жилах. Кристаллы гексагональной формы, таблитчатые, иногда бочонковидные. Спайность весьма совершенная. Блеск металлический. Непрозрачен, Цвет и черта голубовато-серые, свинцово-серые. Особые свойства. Гибок, но не упруг. Жирен на ощупь. Легко чертится и сминается ногтем. Разлагается горячей серной кислотой. При выпаривании сернокислого раствора молибденита появляется синее пятно. Происхождение и парагенезис. Гидротермальное: совместно с кварцем и небольшим количеством пирита.
Иногда с вольфрамитом, бериллом, турмалином, касситеритом, рутилом. Генетически связан с кислыми изверженными горными породами (гранитами, гранодиоритами и др.). Пегматитовое — в ассоциации с вольфрамитом, касситеритом, висмутином. В скарнах — с шеелитом, кварцем. Месторождения. Тырны-ауз (Кавказ), Забайкалье, Казахстан (Коунрад, Караоба), Удокан (Читинская обл.). За границей: Клаймакс (США), Мексика, ГДР. Значение. Важнейшая руда на молибден, используемый для специальных сортов стали, в электротехнике, в химическом производстве. Извлекается рений.
Антимонит (сурьмяный блеск, стибнит) — Sb2S3
Название происходит от латинского слова «антимониум» — сурьма. Химический состав: Sb — 71,38%, S — 28,62%. Содержит примеси мышьяка, висмута, свинца, железа, меди, иногда — серебро и золото. Сингония ромбическая. Твердость 2. Уд. вес 4,5—4,6. Морфология. Агрегаты призматических и игольчатых кристаллов, зернистые массы. Кристаллы столбчатые, призматические, игольчатые. Спайность совершенная по {010}. Излом неровный, раковистый. Блеск металлический. Непрозрачен. Цвет и черта свинцово-серые, стально-серые. Разновидности: метастибнит — аморфный антимонит в виде красных корочек и стяжений. Особые свойства. Радужная или синеватая побежалость. В тонких сколах просвечивает желтовато-красным цветом. Имеет вертикальную штриховку, на изломах — мелкую поперечную. Вдоль удлинения при чиркании зажигаются спички. Капля едкого калия оставляет на антимоните буровато-коричневое пятно, чем отличает его от похожего висмутина, где пятна не возникает. Происхождение. Гидротермальное при нзких температурах. Парагенезис. Ассоциирует с киноварью, пиритом, реальгаром, аурипигментом, галенитом, арсенопиритом, флюоритом, кальцитом, кварцем, баритом и халцедоном. Месторождения. Хайдар-кан, Кадамджай (Киргизия), Никитовка (УССР), Грузия. За рубежом: Япония, КНР, Румыния. Значение. Главный источник сурьмы, изготовление сплавов.
Висмутин (висмутовый блеск) — Bi2S3
Название дано по составу. Химический состав: Bi — 81,3%, S—18,7%. Примеси — свинец, медь, сурьма, железо, селен, реже — мышьяк, теллур, золото, серебро. Сингония ромбическая. Твердость 2—2,5. Уд. вес 6,7—6,8. Морфология. Зернистые агрегаты. Призматические и игольчатые кристаллы, лучистые сростки.
Спайность совершенная по {010}. Излом неровный. Блеск металлический. Непрозрачен. Цвет свинцово-серый до оловянно-белого. Черта свинцово-серая. Разновидности: селено-висмутин (содержит до 8,8% селена), стибиовисмутин (содержит до 8% сурьмы), ау-ровисмутин (золота до 12%). Особые свойства. Имеет желтоватую и синюю побежалость. От антимонита отличается отрицательной реакцией с КОН. Происхождение и парагенезис. Образуется в гидротермальных условиях, в грейзенах, в парагенезисе с касси -теритом, вольфрамитом, молибденитом, самородным висмутом, арсенопиритом, пиритом, топазом, бериллом, халькопиритом, сфалеритом, галенитом и др. Из жильных минералов с ним ассоциирует кварц, кальцит, актинолит. Месторождения. Средняя Азия, Забайкалье, Казахстан, Боливия, Перу. Значение. Главная руда на висмут, используемый для получения сплавов, в химической промышленности, для изготовления специальных стекол.
Киноварь (циннабарит, ртутная обманка) — HgS
Название произошло от индийского слова, обозначающего красную смолу, «кровь дракона». Химический состав: Hg — 86,21 %, S — 13,79 % . Иногда отмечаются примеси селена и теллура. Сингония тригональная. Твердость 2—2,5. Уд. вес 8,0—8,2. Мор фол о-г и я. Зернистые массы, вкрапленники, налеты, реже кристаллы. Форма кристаллов — ромбоэдрические, таблитчатые, иногда — столбчатые. Часты двойники. Спайность совершенная. Излом раковистый, иногда занозистый. Блеск алмазный, иногда матовый. Цвет карминно-красный, коричневато-красный. Черта ярко-красная. Разновидности: скрытокристаллические массы — «печенковая ртутная руда» — с органическими и землистыми примесями. Особые свойства. Диамагнитна. Хрупка. Нередко обладает свинцово-сероп побежалостью, При нагревании в закрытой трубке с железными опилками возгоняется ртуть в виде капелек. Устойчива в поверхностных условиях — встречается в россыпях. Происхождение. Гидротермальное — возникает при низких температурах. Парагенезис: антимонит, пирит, марказит, реже — с реальгаром, арсе-нопиритом, иногда с халькопиритом, сфалеритом. Нерудные минералы — кварц, кальцит, флюорит, барит, иногда гипс. Месторождения. Никитовка, Хайдаркан, Закарпатье, Альмаден (Испания), Идрия (Италия). Значение. Основная руда на ртуть.
Реальгар (красная мышьяковая обманка)—As4S4 или AsS
Название происходит от арабских слов, обозначающих «пыль рудника». Химический состав: As —70,08%, S —29,92%. Сингония моноклинная. Твердость 1,5—2. У д. вес 3,6. Морфология. Зернистые и плотные агрегаты, налеты, кристаллы (мелкие, коротко- или длиннопризматические, часто игольчатые). Спайность совершенная. Излом полураковистый. Блеск смолистый до жирного. Прозрачен до просвечивающего. Цвет огненно-красный, оранжево-желтый. Черта оранжево-красная до огненно-красной. Особые свойства. Разрушается на свету, превращаясь в порошок оранжевого цвета. Штриховка вдоль вытянутости кристаллов. Электричество не проводит. Происхождение и парагенезис. Возникает при низких температурах во время гидротермального процесса в ассоциации с аурипигментом, антимонитом, пиритом, марказитом, кварцем, кальцитом. Месторождения. Грузия, Якутия, Греция, Венгрия. Значение. Используется как руда на мышьяк.
Аурипигмент (желтая мышьяковая обманка) —As2S3
Название происходит от золотисто-желтого цвета. Химический состав: As —60,91%, S —30,09%. Иногда содержит примеси ртути, германия и др. Сингония моноклинная. Твердость 1,5—2. Уд. вес 3,5. Морфология. Зернистые и порошковатые агрегаты, столбчатые, волокнистые и почковидные массы, чешуйчатые и слюдоподобные образования. Кристаллы короткопризматические. Спайность весьма совершенная. Блеск перламутровый (на плоскостях спайности), жирный, смоляной (на изломе). Просвечивающий. Цвет золотисто-желтый, лимонно-желтый, иногда буроватый. Черта светло-желтая. Особые свойства. Диамагнитен. Не проводит электричества. Листочки пибки, но не упруги. Под действием лучей ртутно-кварцевой лампы золотисто-желтый аурипигмент приобретает зеленовато-желтый цвет. Происхождение, месторождения и парагенезис общие с реальгаром. Значение. Руда на мышьяк.
Сложные сульфиды
Халькопирит (медный колчедан) — CuFeS2
Назван по двум греческим словам: «халькос» — медь, «пир» — огонь. Химический состав: Сu — 34,56%, Fe — 30,52%, S-34,92%. Обычно присутствуют примеси: серебро, золото, таллий, селен, теллур. Сингония тетрагональная. Твердость 3—4. Уд. вес 4,1—4,3. Морфология. Сплошные зернистые массы, отдельные зерна, редко — кристаллы. Спайность несовершенная. Излом раковистый, неровный. Блеск металлический. Непрозрачен. Цвет латунно-желтый, золотисто-желтый. Черта зеленовато-черная. Разновидности — талнахит (кубическая модификация халькопирита). Особые свойства. Характерна радужно-пестрая побежалость. Хороший проводник электричества. Хрупок. Происхождение и парагенезис. Магматическое в ассоциации с пирротином, пентландитом и магнетитом в медно-никелевых месторождениях, связанных с основными и ультраосновными породами, в парагенезисе с борнитом во вкрапленных медных рудах. Наиболее широко развит в гидротермальных (жильных и ме-тасоматических) месторождениях в ассоциации с пиритом, пирротином, сфалеритом, галенитом, блеклыми рудами. Из нерудных минералов встречаются кварц, кальцит, барит, различные силикаты. Месторождения. Урал, Рудный Алтай, Казахстан, Чили, США, Испания, Катанга и Ю. Родезия в Африке. Значение. Один из главных источников меди.
Борнит (пестрая медная руда) — Cu5FeS4
Назван по имени австрийского минералога И. Борна. Химический состав: Сu-63,33%, Fe — 11,22%, S-25,55%. В качестве примеси часто содержит серебро. Сингония. Известны две модификации — кубическая и ромбическая. Твердость 3. Уд. вес 4,9—5,3. Морфолог и я. Сплошные массы или зерна неправильной формы. Кристаллы редки. Спайность несовершенная. Излом мелкораковистый. Блеск полуметаллический. Непрозрачен. Цвет темный медно-красный на свежем изломе. Черта серовато-черная. О с о б ы е свойства. Часто наблюдается пестрая побежалость, обычно с преобладанием ярко-синего цвета. Хрупок. Происхождение и парагенезис. Возникает гидротермальным путем в ассоциации с халькопиритом, пиритом, сфалеритом, блеклой рудой, галенитом, халькозином, иногда с молибденитом и золотом. Часто наблюдается в колчеданных месторождениях. Как вторичный минерал возникает на меднорудных месторождениях за счет халькозина, сфалерита, пирита и других минералов. Известны псевдоморфозы по органическим остаткам. Месторождения. Казахстан (Джезказган, Успенское), Кавказ (Кафан, Алаверды), Тува, США (Быотт), Болгария, ГДР (Мансфельд). Значение. Важнейшая медная руда.
Арсенопирит (мышьяковый колчедан)—FeAsS
Назван по составу «мышьяковый пирит». Химический состав: Fe —34,30%, As —46,01%, S — 19,69%. Часто содержит в качестве изоморфной примеси кобальт (до 12%). Иногда золото. Сингония моноклинная. Ранее считался ромбическим. Твердость 5,5—6. Уд. вес 5,9—6,3. Морфология. Зернистые и шестова-тые агрегаты. Кристаллы и звездчатые сростки (см. рис. 26,9,10). Спайность средняя. Излом неровный. Блеск металлический. Непрозрачен. Цвет серебряно и оловянно-белый до стально-серого в изломе. Черта серо-черная, иногда со слабо фиолетовым или бурым оттенком. Разновидности: данаит (содержит кобальт от 3 до 12%). Особые свойства. Наблюдается продольная штриховка. Часто — желтая побежалость. Чесночный запах при трении. Происхождение гидра-термальное. Парагенезис. Наблюдается в ассоциации с кварцем, пиритом, турмалином, бериллом, топазом, вольфрамитом, сфалеритом, халькопиритом, галенитом и др. Месторождения. Урал (Кочкарское), Забайкалье (Дарасун), Кавказ (Ценское, Дашкесан), Таджикистан (Такели), Швеция. Значение. Для получения соединений мышьяка, используемых в сельском хозяйстве, медицине, кожевенном и красочном производствах. Для попутного извлечения кобальта и золота.
Кобальтин (кобальтовый блеск) — CoAsS
Название дано по составу. Химический состав: Со — 35,41 %, As— 45,26%, S—19,33%. Часть кобальта замещается железом и никелем. Сингония кубическая. Твердость 5,5. Уд. вес 6,1—6,4. Морфология. Зернистые агрегаты, кристаллы октаэдрической, кубической и пентагон-додекаэдрической формы. Спайность совершенная по кубу. Излом неровный, раковистый. Блеск металлический. Непрозрачен. Цвет белый с розоватым оттенком. При повышении содержания никеля— стально-серый с фиолетовым оттенком. Примеси железа окрашивают минерал в серовато-черный цвет. Черта серовато-черная. Разновидности. Ферро-кобальтин (содержит железа по 22%), никелистый кобальтин (никеля до 13,8%). Особые свойства. Хрупок. Хороший проводник электричества. В азотной кислоте разлагается с выделением серы и AS2O3 с розовым окрашиванием раствора. Происхождение. Гидротермальное и контактово-метасоматическое (скарновое). Парагенезис. Встречается с пирротином, арсенопиритом, халькопиритом, пиритом, сфалеритом, молибденитом, самородным висмутом, кварцем, кальцитом и др. Месторождения. Азербайджан (Дашкесан), Казахстан, Урал, Норвегия, Швеция, Канада. Значение. Кобальтовая руда.
Блеклые руды — Cu12(Sb, As)4S13
Название дано из-за тусклого блеска на несвежем изломе. Блеклые руды представляют собой изоморфный ряд минералов, где крайними членами являются — теннантит Cu12As4S13 — мышьяковая блеклая руда и тетраэдрит Cu12Sb4S13— сурьмянистая блеклая руда. Химический состав теннантита: Сu —51,57%, As — 20,26%; S —28,17%; тетраэдрита: Сu —45,77%, Sb —29,22%, S —25,01%.тетраэдрита). Уд. вес 4,4—5,1. Морфология. Сплошные массы, мелко- и среднезернистые до плотных. Вкрапленность в рудах. Кристаллы, двойники. Спайность отсутствует. Излом раковистый, неровный. Блеск металлический или металловидный. Непрозрачный. Цвет и черта стально-серые до железно-черных. У теннантита черта с вишнево-красным оттенком. Разновидности. Мышьяковая блеклая руда — теннантит Cu12AS4S13 и сурьмянистая блеклая руда — тетраэдрит Сu12Sb4S13 Особые свойства. При царапании проявляется хрупкость — черта «пылится» и не оставляет блестящего следа, как у халькозина, похожего на блеклые руды. Происхождение. Гидротермальное. Парагенезис. Ассоциирует с халькопиритом, сфалеритом, галенитом, пиритом, арсенопиритом. Месторождения. Самостоятельные крупные скопления образуют редко. Ассоциируют с медными и свинцово-цинковыми, а также с сурьмяно-ртутными рудами. Значение. Источник меди и мышьяка.
Станнин (оловянный колчедан) — Cu2FeSnS4
Название происходит от латинского слова «станнум» — олово. Химический состав: Сu — 29,58%, Fe—12,99%,
Sn — 27,61%, S — 29,82%. Сингония тетрагональная. Твердость 3—4. Уд. вес 4,3—4,5. Морфология. Зернистые массы, мелкие включения, редко — кристаллы. Спайность несовершенная. Излом неровный. Блеск металлический. Непрозрачен. Цвет стально-серый с оливково-зеленым оттенком, иногда железно-черный. Черта черная. Разновидности. Кестерит— цинксодержащий станнин (до 11 % цинка). Особые свойства. Хрупок. Имеет зеленоватый оттенок в свежем изломе, чем отличается от блеклых руд. Синеватая побежалость. В азотной кислоте разлагается, выделяя серу и двуокись олова; раствор окрашивается в синий цвет, что является отличительным признаком от блеклых руд. Происхождение. Гидротермальное. Парагенезис. Встречается совместно с касситеритом, халькопиритом, сфалеритом, пиритом, арсенопиритом, пирротином, блеклой рудой, висмутином и др. Месторождения. Забайкалье, Приморский край, Боливия, Тасмания, Великобритания, Чехословакия. Значение. Руда на олово.
Статья на тему Сернистые соединения
Сера — урок. Химия, 8–9 класс.
Химический элемент
Сера — химический элемент № \(16\). Она расположена в VIА группе третьем периоде Периодической системы.
S16+16)2e)8e)6e
На внешнем слое атома серы содержатся шесть валентных электронов. До завершения внешнего слоя не хватает двух электронов. Поэтому в соединениях с металлами и водородом сера проявляет степень окисления \(–2\). При взаимодействии с более электроотрицательными элементами (кислородом, галогенами) сера образует соединения, в которых её степень окисления положительная (\(+4\) или \(+6\)).
В земной коре сера встречается в самородном виде или в виде минералов и горных пород: (пирит — FeS2, цинковая обманка — ZnS, свинцовый блеск — PbS, гипс — CaSO4⋅2h3O, глауберова соль — Na2SO4⋅10h3O).
Самородная сера
Свинцовый блеск
Сера относится к макроэлементам живых организмов. Она содержится в белках. Особенно много серы в белках волос, рогов, шерсти. Входит она также в состав некоторых витаминов и гормонов.
Простое вещество
Сера образует несколько аллотропных модификаций. Обычно мы имеем дело с кристаллической серой, которая состоит из восьмиатомных циклических молекул.
Молекулы образуют кристаллы разного строения, и поэтому существуют аллотропные видоизменения: ромбическая и моноклинная сера. Обе модификации представляют собой жёлтые легкоплавкие вещества. Температуры плавления их несколько различаются (\(+112,8\) °С и \(+119,3\) °С).
При нагревании сера плавится, превращается в лёгкую жидкость, а затем начинает темнеть и становится вязкой. Образуется пластическая сера, состоящая из длинных линейных молекул.
В воде сера не растворяется и ею не смачивается. Поэтому порошок серы не тонет в воде, несмотря на более высокую плотность (\(2,07\) г/см³). Такое явление называется флотацией.
Подожжённая сера реагирует с кислородом, и образуется сернистый газ. Сера в этой реакции — восстановитель.
S0+O20=tS+4O2−2.
Окислительные свойства сера проявляет в реакциях с металлами и водородом.
С активными металлами и ртутью реагирует при комнатной температуре:
Hg0+S0=Hg+2S−2.
При нагревании сера вступает в реакцию с большинством металлов — железом, алюминием, цинком и другими, кроме золота и платины.
2Al0+3S0=tAl+32S−23.
В реакциях с металлами образуются сульфиды.
При повышенной температуре сера реагирует с водородом. Образуется сероводород:
h30+S0=th3+1S−2.
Применение серы
- Используется в химической промышленности для производства серной кислоты;
- находит применение в сельском хозяйстве для обеззараживания помещений;
- входит в состав некоторых мазей;
- используется в производстве спичек и бумаги;
- с её помощью каучук превращают в резину;
- входит в состав взрывчатых веществ.
Свойства серы — Каковы физические свойства серы?
* Аллотропный — Аллотропы представляют собой формы элемента с разными физическими и химическими свойствами, присутствующие в двух или более кристаллических формах в одном физическом состоянии. Свойства серы — Каковы химические свойства серы?
Факты и информация о свойствах серы | |
Стандарты и свойства: Металлургия сплавов на медной основе
Уильям Д.Нильсен, мл.
Western Reserve Manufacturing Co., Inc.
На основные свойства медных сплавов во многом влияют свойства самой меди. Известно, что медь обладает определенными уникальными качествами, которые делают ее лучшим инженерным материалом для подшипников. Это:
- Высокая теплопроводность
- Превосходная пластичность и вязкость в широком диапазоне температур
- Превосходная коррозионная стойкость в различных средах
Атомная структура меди
Все три перечисленных выше качества напрямую связаны со структурой и поведением структуры меди в атомном масштабе.
Рис. 1. Модель гранецентрированной кубической кристаллической структуры меди, показывающая одну элементарную ячейку. Расстояние между центрами угловых атомов составляет 3,6 ангстрем (ссылка 1). Атом меди очень похож на атом золота или серебра, которые вместе с медью составляют группу в периодической таблице элементов. Всем известна прекрасная электропроводность меди, которая является следствием атомной структуры меди. Внутри решетки атомов меди облако свободных электронов является единственным доступным для передачи электрического тока.Это же облако электронов также увеличивает эффективную передачу тепловой энергии.Твердая медь может быть описана как расположение атомов меди в гранецентрированной кубической (ГЦК) конфигурации. Атом меди находится в каждом углу и в центре каждой грани куба, как показано на рис. 1 . Это элементарная ячейка, которая повторяется в трехмерном пространстве и составляет кристаллическую структуру металла.
Атомы удерживаются на месте в структуре за счет энергии атомного притяжения между ними.Именно это гранецентрированное кубическое расположение атомов придает меди ее высокую пластичность и прочность. Все металлы деформируются за счет механизма, называемого скольжением. Когда происходит скольжение, сила, действующая на металл, заставляет атомы скользить друг мимо друга группами. В медной ГЦК-структуре это движение происходит предпочтительно в любом или во всех трех направлениях вдоль определенной геометрической плоскости атомов в решетке, как показано на Рис. 2 .
Рис. 2. Элемент ГЦК меди с удаленным угловым атомом, чтобы показать плоскость скольжения, на которой происходит преимущественная деформация.Это место воплощает самую плотную упаковку атомов, которая возможна геометрически (Ссылка 1). В медной ячейке таких плоскостей четыре. Если движение может происходить в трех направлениях на всех четырех плоскостях, существует двенадцать возможностей возникновения скольжения. Оказывается, это максимальное количество возможностей скольжения в любой металлической конструкции. Чем больше вероятность того, что металл может подвергнуться значительному скольжению, тем больше вероятность его деформации, а не разрушения и разрушения. Следовательно, медь обладает превосходной пластичностью и вязкостью, а также устойчива к усталости и ползучести.Дополнительным преимуществом является то, что медь, поскольку это гранецентрированная структура, не страдает охрупчиванием при низких (минусовых) температурах; явление, обычное для других кристаллических структур.Сочетание электронных и кристаллографических структур меди придает ей превосходную устойчивость к коррозии. Облако свободных электронов легко доступно для образования когерентных пленок на поверхности металла, которые защищают решетку от дальнейшей коррозии.
ГЦК-структура, образующая плоскости скольжения, придает этим самым плоскостям еще одну характеристику.Атомы на плоскостях скольжения упакованы настолько близко друг к другу, насколько это возможно в любой металлической системе ( Рисунок 2 ). Такое эффективное расположение атомов упаковывает большую часть материи в данное пространство (что, кажется, знают пчелы, когда строят соты). Ионам водорода очень трудно найти свой путь через небольшие промежутки между атомами и вызвать коррозионное растрескивание под напряжением, за исключением наиболее агрессивных сред.
Мы видели, как медь, основной металл для литой бронзы, в атомном масштабе придает важные характеристики качественным материалам подшипников.Но подшипники изготавливаются не из чистой меди, а из широкого диапазона медных сплавов, которые сейчас доступны. Каждый из этих сплавов улучшает характеристики чистой меди и дополнительно адаптирует новый материал к конкретным условиям окружающей среды. Давайте рассмотрим некоторые из наиболее распространенных систем сплавов в отношении металлургии материала и его назначения в конструкции подшипников.
Литые бронзовые сплавы
Подшипниковые марки литой бронзы металлургически можно разделить на три категории:
- Однофазные твердые сплавы
- Полифазные сплавы
- Композиционные материалы
Чтобы понять характеристики различных сплавов, мы должны сначала понять, что происходит с основной структурой меди при добавлении небольших количеств легирующих металлов.Реакции происходят во время затвердевания и охлаждения сплавов из их расплавленного состояния.
Проще говоря, окончательное расположение легирующих металлов относительно нормальной ГЦК-решетки меди определяет свойства материала сплава.
Легирующие металлы находят свое место в решетке меди тремя основными способами:
- Замещают атомы меди в ГЦК решетке.
- Они соединяются с медью и образуют локализованные области (фазы), в которых кристаллическая структура имеет форму, отличную от кристалла меди с ГЦК-решеткой.
- Они отклоняются затвердевающей решеткой меди, но остаются в кристаллах сплава, когда они замерзают и растут.
Исследования привели к графическому представлению реакции простых бинарных систем сплавов. Такое представление называется фазовой диаграммой. Фазовые диаграммы некоторых двойных систем, относящихся к бронзе, показывают поведение легирующих элементов, которое обычно приводит к одному из трех упомянутых ранее случаев. На диаграмме равновесия медь-олово (, рис. 3, ) показаны случаи (1) и (2).
Рис. 3. Фазовая диаграмма равновесия медь-олово (ссылка 2).Дело (1) — Замена
Рис. 4. Микроструктура однофазного (альфа) сплава медь-олово (88Cu-8Sn-4Zn). Структура показывает линии скольжения. Обратите внимание также на следы дельта-фазы (более темные острова) (ссылка 2). Ссылаясь на Фигуру 3, при содержании олова менее 11% (например, при 8% олова) видно, что сплав при охлаждении затвердевает в определенном диапазоне температур, становясь полностью твердым, когда температура падает ниже примерно 850 ° C.В равновесных условиях медленного охлаждения образующаяся твердая фаза представляет собой гранецентрированный кубический кристалл (альфа-фаза). Атомы олова замещают непосредственно в решетке атомы меди. Атомы олова фактически усиливают чистую медь, потому что они деформируют решетку, то есть изменяют обычное расстояние между атомами меди. В промышленных условиях довольно медленного затвердевания почти весь металл затвердевает в виде альфа-фазы (, рис. 4, ).Это явление замещения приводит к однофазному твердому раствору олова в меди. Кристаллическая структура, хотя и прочнее чистой меди из-за деформации решетки, все же имеет ГЦК-структуру. Следовательно, характеристики скольжения остаются очень хорошими. Таким образом, однофазные твердые сплавы меди сохраняют высокую пластичность, несмотря на очень значительное увеличение прочности. Такие материалы находят широкое применение в условиях, когда материал может подвергаться значительному напряжению, но разрушение может быть катастрофическим (например, арматура в системах морской воды ядерных реакторов).Примером такого однофазного промышленного сплава является сплав C, свойства которого сравниваются с медью в таблице ниже.
| C | ||
|---|---|---|
| Cu | 99,9 | 88,0 |
| Sn | – | 8,0 |
| Zn | – | 4,0 |
| Т.С., тыс. Фунтов стерлингов | 28 | 45 |
| г.С., кси | 8 | 23 |
| Удлинение,% в 2 дюйма | 45 | 25 |
| Твердость, BHN | 40 | 77 |
| (Значения указаны для непрерывно литого материала диаметром менее 3 дюймов) | ||
Корпус (2) — Полифазный
Если содержание олова увеличивается до 11% или более, некоторая часть альфа-фазы преобразуется при охлаждении металла ниже 400 ° C. Появляется новая фаза, вкрапленная в нормальные альфа-кристаллы с ГЦК.Эта фаза, называемая дельта, может быть сохранена в материале при довольно быстром охлаждении ( Рисунок 5 ).
Рисунок 5 . Микроструктура непрерывнолитого сплава оловянной бронзы С. Указывается дельта-фаза (Ссылка 3).Дельта-фаза (хотя все еще в основном ГЦК) содержит намного больше олова по сравнению с медью, чем в альфа-фазе, и она очень твердая и прочная, но не обладает большой пластичностью. В лучших условиях он выглядит как мелкодисперсные островки по всей микроструктуре материала.Влияние этой второй фазы на механизм скольжения является драматическим, так как происходит закрепление плоскостей скольжения после небольшого движения. Но дельта-фаза также значительно увеличивает износостойкость материала, о чем свидетельствует значительное увеличение твердости. Популярные алюминиевые бронзовые сплавы (C95400 и C95500) и марганцевые бронзы (C86300 и C86400) приобретают высокую прочность и твердость аналогичным образом, хотя акторы различны. Тем не менее, эти свойства являются результатом дисперсии другой фазы (или фаз) в основной ГЦК решетке, причем почти во всех случаях дисперсная фаза намного тверже и прочнее, чем основная масса материала окружающей матрицы.Эти «искусственные неоднородности» в материале служат для закрепления плоскостей скольжения и ограничения их движения.
Эти материалы известны как многофазные сплавы и характеризуются более высокой прочностью, твердостью и износостойкостью, чем альфа-сплавы; но они обладают гораздо меньшей пластичностью, как показано в таблице ниже. В результате они лучше всего подходят для деталей поверхности управления, где размерная целостность наиболее важна, и для тяжелых нагрузок и ударных нагрузок на малых скоростях, например, подшипников шасси самолетов.
Дополнительной характеристикой многофазных сплавов является то, что их свойства могут значительно изменяться в зависимости от температуры по сравнению с однофазными материалами. Такие сплавы часто подвергаются термической обработке. Путем манипулирования микроструктурой сплава, как показано на диаграмме состояния равновесия, путем «замыкания» равновесия можно получить определенные свойства, которые отсутствуют в состоянии литья.
| Однофазный | Полифазный | |||
|---|---|---|---|---|
| C | C | C | C95400 | |
| Cu | 88 | 89 | 87 | 85 |
| Sn | 8 | 11 | 11 | |
| Pb | 1 | |||
| Zn | 4 | |||
| Al | 11 | |||
| Ni | 1 | |||
| Fe | 4 | |||
| т.С., кси | 49 | 52 | 50 | 85 |
| Ю.С., тыс. Фунтов стерлингов | 23 | 29 | 25 | 35 |
| Удлинение,% в 2 дюйма | 25 | 18 | 20 | 18 |
| Твердость, BHN | 77 | 95 | 83 | 170 |
| (Значения приведены для непрерывнолитого материала менее 3 дюймов.диаметра, за исключением C95400, которые являются литыми.) | ||||
В любом случае, многофазные материалы, не содержащие значительного количества свинца, следует использовать только в качестве подшипников против стальных сопрягаемых поверхностей, которые сами были закалены термической обработкой. В случае применения алюминиевой бронзы или марганцевой бронзы часто рекомендуется, чтобы вал был хромированным или изготовлен из биметаллического материала, аналогичного тому, который используется для валков сталелитейных станов.
Ящик (3) — Композитные смеси
Рисунок 6. Равновесная фазовая диаграмма медь-свинец (ссылка 2). Наиболее широко используемые материалы для подшипников — это действительно композиты. По сути, они могут иметь однофазные или многофазные структуры, служащие матрицей вокруг частиц или глобул свободного свинца. Взгляд на фазовую диаграмму равновесия медь-свинец (, рис. 6, ) показывает, что свинец почти полностью отвергается решеткой меди при замерзании. Тем не менее инженеры-металлурги и литейщики в равной степени приложили огромные усилия для улавливания свинца между кристаллами материала на основе меди, поскольку эти кристаллы замерзают и растут, потому что полученный сплав создает очень тонкие подшипники.Типичная микроструктура, показывающая диспергированный свинец, показана на Фиг.7 .Сегодня можно производить материал на основе меди с содержанием свинца более 30%, при этом размер свинцовых частиц микроскопичен. С другой стороны, если применение подшипника указывает на то, что более желательны более крупные частицы свинца, можно также производить сплав в такой форме.
Рисунок 7. Микроструктура непрерывнолитого сплава свинцовой оловянной бронзы C94100 (20% Pb).Указаны частицы свинца (ссылка 3).Свинец выполняет три важные функции подшипника, каждая из которых служит для защиты вала и повышения производительности оборудования. Первостепенное значение имеет способность частиц свинца уменьшать коэффициент трения между подшипником и валом. Механизм, с помощью которого это достигается, весьма интересен. Частицы свинца могут быть срезаны с поверхности подшипника за счет микроскопических шероховатостей на поверхности вала. Стальной вал покрывается свинцом, который постепенно перераспределяется, заполняя углубления на валу.Как только это будет выполнено, коэффициент трения снова повысится лишь незначительно, как указано в таблице ниже (ссылка 4). Это же явление имеет дополнительное преимущество в том, что температура, развиваемая в точках контакта между подшипником и сопряженной частью, ограничивается температурой плавления провода 327, ° C). Очевидно, что это свойство свинцовых сплавов очень ценно при отсутствии смазки (запланированной или случайной) или если рабочая среда машины сама подвержена значительным перепадам температур, например, на самолетах или оборудовании арктических нефтяных месторождений.
| Коэффициент трения (скольжение) | |
|---|---|
| Сталь на меди | 0,9 |
| Сталь на основе C94300 (23% Pb) | 0,18 |
| Сталь на C94300 после длительного использования | 0,30 |
| Сталь на стали | 1,00 |
Вторая важная функция свинца — поглощать грязь, которая попадает в границу раздела, хотя этой проблемы можно избежать, разработав надлежащим образом герметизированные подшипники, когда это возможно.
В-третьих, свинцовые сплавы, имеющие несколько более низкую прочность, чем сплавы медь-олово без свинца, и гораздо меньшую прочность, чем сплавы медь-алюминий или медь-цинк, демонстрируют высокую степень совместимости. То есть подшипник отрегулирует свою форму, чтобы допустить плохую центровку или вибрацию. Эта характеристика в сочетании с характеристиками, описанными ранее, позволяет утверждать, что свинцовые сплавы очень хорошо «изнашиваются», что особенно желательно для червячных передач, чтобы назвать один пример.Свинецсодержащие бронзы также легко обрабатываются.
Инженер должен напоминать себе, что эти сплавы не так прочны, как неэтилированные материалы, и при этом они не обладают таким большим сопротивлением ударам и последующей усталости, ведущей к разрушению. Однако одно утешительное соображение заключается в том, что полный отказ подшипника вряд ли приведет к разрушению вала или заклиниванию машины из-за «мягкости» этих сплавов.
Выбрав подходящую матрицу, в которую будут отливаться частицы свинца, инженер может выбрать из довольно широкого диапазона прочности материала, совместимого с умеренными и легкими нагрузками и высокими скоростями, как показано в таблице ниже.Значения указаны для непрерывного литья диаметром менее 3 дюймов.
| C83600 | C | C93700 | C93800 | C94300 | |
|---|---|---|---|---|---|
| Cu | 85 | 83 | 80 | 78 | 70 |
| Sn | 5 | 7 | 10 | 7 | 5 |
| Pb | 5 | 7 | 10 | 15 | 25 |
| Zn | 5 | 3 | |||
| т.С., кси | 45 | 45 | 41 | 34 | 27 |
| Ю.С., тыс. Фунтов стерлингов | 21 | 24 | 24 | 23 | 13 |
| Удлинение,% в 2 дюйма | 28 | 16 | 10 | 12 | 15 |
| Твердость, BHN | 72 | 72 | 80 | 62 | 48 |
Свойства литой бронзы
Давайте теперь рассмотрим семейства подшипниковых бронзовых сплавов с помощью двух таблиц, в которых сравниваются некоторые из их наиболее важных инженерных свойств. Таблица 1 обобщает химический состав и свойства применения. В таблице 2 указаны наиболее распространенные применения этих материалов и их рабочие характеристики в тех областях применения, в которых они находят наибольшее применение.
| Состав% | |||||||||
|---|---|---|---|---|---|---|---|---|---|
| Семейство сплавов | Cu | Sn | Пб, | Zn | Ni | Fe | Mn | Al | |
| Красная латунь | |||||||||
| C84400 | 81 | 3 | 7 | 9 | |||||
| C83600 | 85 | 5 | 5 | 5 | |||||
| Олово-свинцовая бронза | |||||||||
| C | 83 | 7 | 7 | 3 | |||||
| C93700 | 80 | 10 | 10 | ||||||
| Олово бронза с высоким содержанием свинца | |||||||||
| C93800 | 78 | 7 | 15 | ||||||
| C94300 | 70 | 5 | 25 | ||||||
| Олово бронза | |||||||||
| C | 88 | 8 | 4 | ||||||
| C | 88 | 10 | 2 | ||||||
| C | 89 | 11 | |||||||
| C | 87 | 11 | 1 | 1 | |||||
| C | 88 | 10 | 2 | ||||||
| C | 84 | 10 | 2.5 | 3,5 | |||||
| C94700-HT ** | 88 | 5 | 2 | 5 | |||||
| Алюминиевая бронза | |||||||||
| C95400 | 85 | 4 | 11 | ||||||
| C95400-HT | 85 | 4 | 11 | ||||||
| C95500 | 81 | 4 | 4 | 11 | |||||
| C95500-HT | 81 | 4 | 4 | 11 | |||||
| Марганцевые бронзы | |||||||||
| C86300 | 63 | 25 | 3 | 3 | 6 | ||||
| C86400 | 59 | 1 | 40 | ||||||
| * БТЕ / фут2 / фут / час / фут ** HT — термообработанный | |||||||||
| Свойства непрерывного литья (типовые) | ||||||||
|---|---|---|---|---|---|---|---|---|
| Семейство сплавов | Т.С., тыс. Фунтов | Ю.С., тыс. Фунтов стерлингов | Удлин., % | BHN | Обрабатываемость Индекс | Компрессионный Y.S., тыс. Фунтов на квадратный дюйм | Тепловой Проводимость * | |
| Красная латунь | ||||||||
| C84400 | 37 | 16 | 23 | 55 | 90 | 28 | 41 | |
| C83600 | 45 | 21 | 18 | 72 | 100 | 34 | 41 | |
| Олово-свинцовая бронза | ||||||||
| C | 45 | 24 | 16 | 72 | 100 | 30 | 33 | |
| C93700 | 41 | 24 | 10 | 80 | 100 | 25 | 27 | |
| Олово бронза с высоким содержанием свинца | ||||||||
| C93800 | 34 | 23 | 12 | 62 | 100 | 23 | 30 | |
| C94300 | 27 | 13 | 15 | 48 | 100 | 20 | 36 | |
| Оловянная бронза | ||||||||
| C | 49 | 23 | 25 | 77 | 25 | 36 | 43 | |
| C | 51 | 29 | 18 | 92 | 25 | 29 | 43 | |
| C | 51 | 29 | 18 | 95 | 20 | 38 | 41 | |
| C | 49 | 26 | 17 | 80 | 30 | 32 | 42 | |
| C | 48 | 20 | 18 | 80 | 80 | 28 | 40 | |
| C | 53 | 31 | 15 | 100 | 85 | 38 | 34 | |
| C94700-HT ** | 90 | 66 | 9 | 180 | 20 | 71 | 31 | |
| Свойства после литья | ||||||||
| Алюминиевая бронза | ||||||||
| C95400 | 85 | 35 | 18 | 170 | 60 | 50 | 34 | |
| C95400-HT | 105 | 54 | 8 | 195 | 20 | 75 | 34 | |
| C95500 | 100 | 44 | 12 | 195 | 50 | 60 | 24 | |
| C95500-HT | 120 | 68 | 10 | 230 | 15 | 80 | 24 | |
| Марганцевые бронзы | ||||||||
| C86300 | 115 | 70 | 15 | 225 | 8 | 80 | 20 | |
| C86400 | 65 | 25 | 20 | 90 | 65 | 40 | 51 | |
| * БТЕ / фут2 / фут / час / фут ** HT — термообработанный | ||||||||
| Условия эксплуатации качественных подшипников | |||||
|---|---|---|---|---|---|
| Сплав № | Скорость | Нагрузка | Окружающая среда | Твердость вала | Типичные приложения |
| C94300 | (низкий) (высокий) | (нижний) | (более абразивный) (менее абразивный) | (низкий) | Топливные насосы для самолетов |
| C93800 | Шахтный водяной насос, изнашиваемые пластины | ||||
| C93700 | Высоконагруженные высокоскоростные подшипники | ||||
| C | Подшипники общего назначения | ||||
| C83600 | Подшипники вала линейного насоса для глубоких скважин, легкие шестерни | ||||
| C | Кольца поршневые | ||||
| C | Шестерни, направляющие клапана, рабочие колеса насоса | ||||
| C | Шестерни, направляющие клапана, заменитель стальной задней стенки | ||||
| C | Компоненты клапана, паровая арматура | ||||
| C | Шестерни | ||||
| C95400 | Панели управления | ||||
| C95500 | Панели управления | ||||
| C86300 | Винтовые гайки для прокатных станов | ||||
Все сплавы, представленные в таблицах, по существу являются вариациями основных материалов, которые обсуждались.В некоторых случаях свинец мог быть добавлен для улучшения обрабатываемости (C против C). Возможно, никель был добавлен для повышения прочности или коррозионной стойкости (C95500 против 95400). Содержание марганца и железа можно варьировать для стабилизации определенных структур (C86300 против C86400). Цинк мог быть заменен оловом из соображений экономии (C против C). Один сплав был создан из-за преобладающей доступности металлолома (C от C83600 и C93700) и в настоящее время является, пожалуй, наиболее широко используемым сплавом для подшипников.Это очень хороший компромисс. Тем не менее, каждый материал обладает уникальным набором свойств, которые лучше всего подходят для определенных целей.
Экономика
Несколько слов об относительной экономии материалов сплава. Все компоненты сплава подвержены влиянию мировых рынков, где их уровень цен определяется предложением, спросом, государственным контролем и спекулятивным интересом. Колебания на мировом рынке этих компонентов в конечном итоге сказываются на стоимости композитного металла для сплавов, и это также влияет на стоимость металлолома, когда он выводится из эксплуатации. Таблица 3 показывает приблизительные общие относительные значения меди и основных легирующих материалов на момент написания.
| Приблизительная Относительная стоимость | Приблизительная Относительная стоимость | ||
|---|---|---|---|
| Первичные металлы | Вторичный лом | ||
| Медь | 1.0 | Свинец Олово бронза | 0,9 |
| Олово | 7,8 | Олово бронза | 1.0 |
| Свинец | 0,2 | Алюминиевая бронза | 0,3 |
| цинк | 0,5 | Марганцевая бронза | 0,3 |
| Никель | 4,0 | ||
| Алюминий | 0,9 | Предварительно легированный слиток | |
| C | 1.2 | ||
| C | 2,0 | ||
| C98400 | 1,2 |
Методы производства
Сплавы меди для подшипников доступны во многих формах, производимых различными методами производства. Методы производства литья подытожены в Таблице 4 .
Продукты для песка и охлаждения
| Метод производства | |||||
|---|---|---|---|---|---|
| Семейство сплавов | Песок | Охладитель Форма | Центробежный | Непрерывный | Кованые |
| Красная латунь | х | х | х | х | НЕТ |
| Олово-свинцовая бронза | х | х | х | х | х * |
| Олово-бронза с высоким содержанием свинца S = сегрегация свинца может быть проблемой | S | S | S | х | НЕТ |
| Олово бронза | х | х | х | х | х ** |
| Алюминиевая бронза | х | х | х | х | х |
| Марганцевая бронза | х | х | х | х | х |
| * Ограничено примерно 4% Pb ** Деформируемые сплавы C51000, C52100, C52400. | |||||
Литье в песчаные формы или кокильные формы — идеальные методы производства, идеально подходящие для очень малых серий или очень мелких деталей, а иногда и обязательные для очень больших деталей, таких как гребные винты судов.
Все обсуждаемые сплавы доступны в этих формах, хотя могут возникнуть проблемы с серьезной сегрегацией свинца, когда содержание свинца приближается к 16%. Можно отливать широкий диапазон размеров и сложных форм. Красные латуни, которые очень популярны в качестве материалов для сантехнического оборудования, производятся этими методами, в основном в виде корпусов клапанов и фитингов.
Изделия центробежного литья
Опять же, все рассматриваемые сплавы легко производятся методом центробежного литья, за исключением оловянных бронз с высоким содержанием свинца, в которых содержание свинца приближается к 20%. Проблемы сегрегации свинца зависят от размера отливки. Этим методом изготавливаются втулки очень большого размера. Вероятно, что большинство вводов с наружным диаметром более 14 дюймов и примерно до 100 дюймов. центробежные отливки. Такие отливки могут быть длиной более 100 дюймов.Тем не менее, небольшие центробежные отливки также являются предметами больших объемов. Многие из более крупных фланцевых подшипников или зубчатых колес изготавливаются этим методом. Несмотря на то, что они чувствительны к количеству продукции, небольшие тиражи могут быть очень экономичными. Дистрибьюторы складских запасов поддерживают запасы полуфабрикатов центробежного литья, в основном стандартных размеров и особенно из сплавов C95400 и C.
Продукция непрерывного литья
Все сплавы доступны в виде непрерывнолитых прутков; сегрегация свинца обычно не является проблемой.Может потребоваться снятие напряжений с некоторых отливок с очень тонкими стенками, особенно если используется сплав C95400, C95500 или C86300, чтобы предотвратить потерю зазора или допусков при изготовлении и использовании. Доступен широкий диапазон размеров сплошных, трубчатых и изготавливаемых на заказ стержней поперечного сечения. Диаметр варьируется от менее 0,500 дюйма до примерно 14 дюймов по внешнему диаметру, длина — примерно до 13 футов. Возможно изготовление стержней с очень тонкими стенками, иногда менее 1/4 дюйма, в зависимости от внешнего диаметра. Эти изделия идеально подходят для дальнейшего изготовления на автоматических станках.
Большие партии изделий непрерывного литья значительно более экономичны, но опять же дистрибьюторы складских запасов берут на себя большую часть этой нагрузки, особенно когда речь идет о сплавах C95400, C и C.
Кованые изделия
Деформируемые сплавы фосфористой бронзы (C51000, C52100, C52400, C54400) иногда используются в подшипниках. Эти сплавы также доступны в виде непрерывных отливок в отожженном состоянии. Кованая фосфористая бронза обычно ограничивается размером около 3 дюймов.О. и под. C54400 имеет самое высокое доступное содержание свинца, около 4%. Сплавы с более высоким содержанием свинца экструдируются или прокатываются.
Сплавы алюминия и марганцевой бронзы также имеют кованые аналоги. Деформируемые сплавы обладают очень хорошими механическими свойствами, подвергались тяжелой обработке посредством экструзии, волочения, прокатки или ковки и широко используются в аэрокосмической промышленности. Некоторые из этих сплавов используются в качестве сварочных материалов. Эти сплавы также доступны в различных экструдированных формах, хотя их разнообразие зависит от количества.Термическая обработка литых сплавов дает механические свойства, аналогичные деформируемым материалам, как и при непрерывной разливке алюминиевых бронз. Вообще говоря, для обеспечения экономичности кованых изделий требуются большие объемы производства, хотя дистрибьюторы, занимающиеся складскими запасами, взяли на себя эту нагрузку для конечного пользователя меньших объемов.
Готовые подшипники
Некоторые производители, а также многие дистрибьюторы на складе и подшипниковые центры имеют запасы стандартных готовых втулок, особенно из сплава C.Эти детали выпускаются серийно и легко доступны.
Специальные подшипники
Ряд механических цехов специализируется на производстве подшипников, в частности подшипников нестандартных конструкций и критических сплавов на заказ. В этих цехах работают сложные обрабатывающие центры. Используя лучшее доступное оборудование, они обеспечивают высочайшую степень точности при производстве деталей и поддерживают высокие стандарты контроля качества материалов. Такие предприятия обслуживают те OEM-предприятия и отделы технического обслуживания крупных корпораций, которые предпочитают не производить свои собственные подшипники.Они обеспечивают экономичное обслуживание и хорошо осведомлены о технологии и источниках сплавов для подшипников, которые лучше всего подходят для производства данного подшипника.
Сводка
Металлургическое машиностроение — это в большей степени наука, но и искусство. Исследования, обширный опыт и глубокое понимание свойств, которые легирующие элементы могут придавать медному основному металлу, необходимы для хорошего дизайна материала. Не менее важно понимание экономики, связанной с материалами, производством деталей и эксплуатацией конечного оборудования.Замечательные свойства меди, латуни и бронзы принесли пользу отраслям во всем мире благодаря их надежной работе, общедоступности и экономическому качеству.
Список литературы
- Р.А. Флинн , Отливки из меди, латуни и бронзы, Общество основателей цветных металлов, Кливленд (1961).
- R. Hultgren и P.D. Desai , Избранные термодинамические значения и фазовые диаграммы для меди и некоторых из ее бинарных сплавов, Монография Инкры I, Международная ассоциация исследований меди, Inc., Нью-Йорк (1971).
- W.A. Glaeser и K.F. Дюфран , Конструкция подшипников из литой бронзы с граничной смазкой, Институт подшипников из литой бронзы, Inc. (1978).
- F. Bowden и D. Tabor , Трение и смазывание твердых тел, Clarendon Press, Oxford (1950).
Физические свойства меди — исследование
Медь — это металл, который часто встречается и используется в нашей повседневной жизни. Прочтите следующие параграфы, чтобы получить некоторую информацию о физических свойствах этого элемента.
В повседневной жизни мы используем различные изделия из меди. С научной точки зрения, это элемент, который представлен в периодической таблице как «Cu» с атомным номером 29. Медь была очень полезным металлом с древних времен, и люди использовали ее различными способами для изготовления посуды. , валюта монеты, конструкции и др.
Физические свойства
Хотите написать для нас? Что ж, мы ищем хороших писателей, которые хотят распространять информацию. Свяжитесь с нами, и мы поговорим…
Давайте работать вместе!
При добыче чистой меди она имеет красновато-оранжевый цвет, но может реагировать с кислородом, обеспечивая уникальное изменение цвета. Медь также может изменять свой цвет из-за тенденции отражать свет в красном спектре.
Ковкость
Одно из важнейших свойств меди — ее пластичность. Хотя оба эти свойства не одинаковы, они могут быть до некоторой степени коррелированы. Ковкость определяется как свойство металла или твердого тела подвергаться ударам и сгибанию различной формы без разрушения или растрескивания.Благодаря этой характеристике можно изготавливать тонкие листы меди.
Пластичность
Это относится к степени, до которой металл можно деформировать без напряжения и без разрушения. Таким образом можно изготавливать тонкие проволоки из этого металла. Медь можно скручивать и формовать в любом направлении. Температура плавления меди составляет 1083 градуса Цельсия (1982 градуса F), а температура кипения — 2595 градусов Цельсия (4703 градуса F). Он присутствует во всех трех состояниях металла.
Электропроводность
Медь отличается превосходной теплопроводностью и электропроводностью.После серебра это второй лучший электрический проводник, встречающийся в природе. В чистом виде его проводимость еще более эффективна, а значит, из этого элемента лучше всего делать посуду и провода. Он также используется в холодильниках и радиаторах, поскольку передача электричества и тепла может происходить очень быстро.
Коррозионностойкий
Медь может противостоять изменениям окружающей среды, которые приводят к ржавлению и коррозии. Если его оставить на очень долгое время в контакте с влагой, его цвет изменится от обычного красновато-оранжевого до красновато-коричневого.Когда медь окисляется, она становится зеленой, и эта пленка предотвращает дальнейшую коррозию. Следовательно, это также очень прочный металл.
Формирование сплава
Медь обладает очень хорошей способностью соединяться с другими металлами с образованием сплавов. Он также имеет максимальное количество сплавов с различными металлами, и все они используются для тех или иных целей. Эти сплавы обладают высочайшей устойчивостью к коррозии и очень эффективны в своих изделиях. Бронза и латунь — два самых традиционных медных сплава, которые используются на протяжении многих веков.Медь используется не только в чистом виде, но и в производстве сплавов.
9.2: Металлы и неметаллы и их ионы
За исключением водорода, все элементы, которые образуют положительные ионы, теряя электроны во время химических реакций, называются металлами. Таким образом, металлы являются электроположительными элементами с относительно низкими энергиями ионизации. Они характеризуются ярким блеском, твердостью, способностью резонировать со звуком и отлично проводят тепло и электричество. В нормальных условиях металлы являются твердыми телами, за исключением ртути.
Физические свойства металлов
Металлы блестящие, пластичные, пластичные, хорошо проводят тепло и электричество. Другие свойства включают:
- Состояние : Металлы представляют собой твердые вещества при комнатной температуре, за исключением ртути, которая находится в жидком состоянии при комнатной температуре (в жаркие дни галлий находится в жидком состоянии).
- Блеск : Металлы обладают свойством отражать свет от своей поверхности и могут быть отполированы, например, золотом, серебром и медью.
- Ковкость: Металлы обладают способностью противостоять ударам молотком и могут быть превращены в тонкие листы, известные как фольга. Например, кусок золота размером с кубик сахара можно растолочь в тонкий лист, которым будет покрыто футбольное поле.
- Пластичность: Металлы можно втянуть в проволоку. Например, из 100 г серебра можно натянуть тонкую проволоку длиной около 200 метров.
- Твердость: Все металлы твердые, кроме натрия и калия, которые мягкие и поддаются резке ножом.
- Валентность: Металлы обычно имеют от 1 до 3 электронов на внешней оболочке их атомов.
- Проводимость : Металлы являются хорошими проводниками, потому что у них есть свободные электроны. Серебро и медь — два лучших проводника тепла и электричества. Свинец — самый плохой проводник тепла. Висмут, ртуть и железо также являются плохими проводниками
- Плотность : Металлы имеют высокую плотность и очень тяжелые. Иридий и осмий имеют самую высокую плотность, а литий — самую низкую.
- Точки плавления и кипения : Металлы имеют высокие точки плавления и кипения. Вольфрам имеет самые высокие температуры плавления и кипения, а ртуть — самые низкие. Натрий и калий также имеют низкие температуры плавления.
Химические свойства металлов
Металлы — это электроположительные элементы, которые обычно образуют основных или амфотерных оксидов с кислородом. Другие химические свойства включают:
- Электроположительный характер : Металлы, как правило, имеют низкую энергию ионизации, а обычно теряют электроны (т.е.е. окисляются ) когда они вступают в химические реакции реакции Обычно они не принимают электроны. {-}} \ label {1.{-}} \ label {1.3} \ nonumber \]
Соединения металлов с неметаллами имеют тенденцию к ионной природе . Большинство оксидов металлов являются основными оксидами и растворяются в воде с образованием гидроксидов металлов :
\ [\ ce {Na2O (s) + h3O (l) \ rightarrow 2NaOH (aq)} \ label {1.4} \ nonumber \]
\ [\ ce {CaO (s) + h3O (l) \ rightarrow Ca (OH) 2 (aq)} \ label {1.5} \ nonumber \]
Оксиды металлов проявляют свою основную химическую природу за счет реакции с кислотами с образованием солей металла и воды:
\ [\ ce {MgO (s) + HCl (водн.) \ Rightarrow MgCl2 (водн.) + H3O (l)} \ label {1.{2 -} \), следовательно, \ (Al_2O_3 \).
Пример \ (\ PageIndex {2} \)
Вы ожидаете, что он будет твердым, жидким или газообразным при комнатной температуре?
Решения
Оксиды металлов обычно твердые при комнатной температуре
Пример \ (\ PageIndex {3} \)
Напишите вычисленное химическое уравнение реакции оксида алюминия с азотной кислотой:
Раствор
Оксид металла + кислота -> соль + вода
\ [\ ce {Al2O3 (s) + 6HNO3 (вод.) \ Rightarrow 2Al (NO3) 3 (вод.) + 3h3O (l)} \ nonumber \]
Оценка технологий обессеривания для удаления серы из жидкого топлива
DOI: 10.1039 / C1RA00309G (Обзорная статья) RSC Adv., 2012, 2 , 759-783Поступила 14 июня 2011 г. Принято 18 октября 2011 г.
Впервые опубликовано 5 декабря 2011 г.
Соединения серы представляют собой одну из наиболее распространенных примесей, присутствующих в сырой нефти. Сера в жидком топливе напрямую ведет к выбросам SO 2 и сульфатных твердых частиц (SPM), которые ставят под угрозу здоровье людей и общественное имущество; и сокращает срок службы двигателя из-за коррозии.Кроме того, соединения серы в выхлопных газах дизельных двигателей могут значительно ухудшить технологию контроля выбросов, разработанную в соответствии со стандартами выбросов NO x и SPM. Усиливаются исследования по разработке традиционных методов гидрообессеривания и альтернативных методов обессеривания, таких как селективная адсорбция, биодесульфуризация, окисление / экстракция (окислительное обессеривание) и т.д., для удаления этих тугоплавких соединений серы из нефтепродуктов.Исследовательские лаборатории и нефтеперерабатывающие заводы тратят огромные деньги на поиск жизнеспособного и осуществимого решения для снижения концентрации серы до концентрации менее 10 мг. Л -1 . В этом документе подробно рассматривается текущее состояние различных технологий десульфуризации, изучаемых во всем мире. В нем представлен обзор новейших технологий сверхглубокой сероочистки с целью производства топлива со сверхнизким содержанием серы.
1. Введение
Производство энергии — одна из самых актуальных проблем современности.Экономическая деятельность и потребление энергии тесно связаны. Производство полезных товаров и услуг требует энергии. Ископаемые виды топлива — наиболее широко используемые источники энергии в мире. Хотя процент энергии, получаемой из ископаемого топлива, снизился за последние годы, доля мировой энергии из ископаемого топлива по-прежнему превышает 82%, половина из которых приходится на нефть. 1 Сырая нефть, сложная смесь органических жидкостей, является крупнейшим источником энергии. Основная часть сырой нефти используется в качестве транспортного топлива, такого как бензин, дизельное и реактивное топливо.Он естественным образом встречается в земле и образовался миллионы лет назад. Содержание серы и плотность Американского института нефти (API) — это два свойства, которые имеют большое влияние на стоимость сырой нефти. Содержание серы выражается в процентах от серы по массе и варьируется от менее 0,1% до более 5% в зависимости от типа и источника сырой нефти. 2 Соединения серы существуют в различных формах и могут быть разделены на четыре основные группы: меркаптаны, сульфиды, дисульфиды и тиофены (THs).Соединения серы нежелательны в процессе нефтепереработки, поскольку они имеют тенденцию дезактивировать некоторые катализаторы, используемые при переработке сырой нефти, и вызывают проблемы с коррозией в трубопроводе, насосном и нефтеперерабатывающем оборудовании. Таблица 1 показывает уровень серы в мировых поставках сырой нефти. Встречающиеся в природе соединения серы, оставшиеся в топливе, приводят к выбросу газов оксида серы. Эти газы вступают в реакцию с водой в атмосфере с образованием сульфатов и кислотных дождей, которые повреждают здания, разрушают лакокрасочное покрытие автомобилей, подкисляют почву и, в конечном итоге, приводят к потере лесов и различных других экосистем. 3 Выбросы серы также вызывают респираторные заболевания, усугубляют сердечные заболевания, вызывают астму и способствуют образованию твердых частиц в атмосфере. 4 На автомобили также отрицательно влияет присутствие соединений серы в жидком топливе. Уровни содержания серы в автомобильном топливе сильно влияют на эффективность каталитических нейтрализаторов.
Таблица 1 Уровни серы в мировых запасах сырой нефти 10Современный промышленный метод удаления серы из топлива — это гидрообессеривание (HDS), которое представляет собой каталитический процесс при высоких температурах и давлении.Это делает HDS очень дорогим вариантом для глубокого обессеривания. Более того, HDS не эффективен для удаления гетероциклических соединений серы, таких как дибензотиофен (DBT) и его производные, особенно 4,6-диметилдибензотиофен (4,6-DMDBT). Глубокое обессеривание бензина (от 500 до <10 ppm серы) в значительной степени ограничивается DMDBT, который является наименее химически активным соединением серы. Окислительное обессеривание (ODS), окислительно-экстракционное обессеривание (OEDS), адсорбционное обессеривание и биодесульфуризация (BDS) - это другие методы обессеривания, с помощью которых можно получить сверхчистое топливо.В ОРВ серосодержащие соединения окисляются до сульфона химической реакцией с использованием окислителя, а именно. H 2 O 2 , H 2 SO 4 и т. Д. Сульфоновое соединение затем легко извлекается из топлива благодаря его более высокой полярности. В процессе адсорбции адсорбенты, используемые в процессе, избирательно захватывают серу. Активный адсорбент помещен на пористую нереакционноспособную подложку, которая обеспечивает наибольшую площадь поверхности для адсорбции.Адсорбция происходит, когда молекулы серы прикрепляются к адсорбенту на подложке и остаются там отдельно от топлива. В последнее время BDS привлекла к себе широкое внимание из-за экологически чистой переработки ископаемого топлива. Однако медленность процесса удаления является серьезным препятствием для использования процесса BDS.
Сегодня самая сильная мотивация для сокращения содержания серы в топливе связана с экологическими нормативами, которые устанавливают строгие ограничения на содержание серы в топливе для транспортных средств.Требуются новые методы удаления серы из сырья более низкого качества, чтобы обеспечить доступность энергии по разумной цене. В этом документе содержится обзор текущего состояния и деталей различных методов десульфуризации, изучаемых во всем мире для удаления соединений серы из жидкого топлива, и направлена на выявление пробелов в исследованиях этих методов.
2. Влияние серы на окружающую среду
Загрязнение, выбрасываемое автомобильными двигателями, сильно влияет на качество воздуха.Соединения серы превращаются в оксиды серы при горении, что в конечном итоге приводит к кислотным дождям. 5–7 Двуокись серы и другие загрязнители, связанные с горением, из топлива, содержащего соединения серы, вызывают экологические проблемы, такие как смог, глобальное потепление и загрязнение воды. 8 Даже при более строгих стандартах для двигателей большой мощности, эти двигатели будут продолжать выделять большое количество оксидов азота (NO x ) и твердых частиц (ТЧ), которые способствуют серьезным проблемам со здоровьем населения.ТЧ, присутствующие в выхлопных газах дизельных двигателей, могут вызывать высокий уровень рака легких у людей. Другие последствия для здоровья включают обострение респираторных и сердечно-сосудистых заболеваний, обострение существующей астмы, хронический бронхит и снижение функции легких. Следовательно, обессеривание топлива чрезвычайно важно в нефтяной промышленности.Удаление серы из нефти также необходимо с промышленной точки зрения. Производители автомобилей требуют удаления серосодержащих соединений из нефти, чтобы снизить общие выбросы от транспортных средств.Это связано с тем, что соединения серы отравляют каталитические нейтрализаторы, уменьшающие выбросы твердых частиц и NO x . 9 Сера влияет на эти устройства контроля выбросов, сильно адсорбируя катализаторы из драгоценных металлов, предотвращая адсорбцию и реакцию углеводородов, NO x и монооксида углерода. 10
Кроме того, соединения серы в нефти также вызывают коррозию деталей двигателей внутреннего сгорания и нефтеперерабатывающих заводов из-за образования кислородных кислот серы из продуктов сгорания. 11 Кроме того, соединения серы нежелательны в процессах нефтепереработки, потому что они имеют тенденцию дезактивировать некоторые катализаторы, используемые ниже по потоку и для повышения качества углеводородов. 12 Кроме того, соединения серы способствуют образованию смолистых отложений в жидких нефтепродуктах.
3. Стандарты
Агентство по охране окружающей среды США (US EPA) обязало снизить содержание серы в дизельном топливе и бензине. В 2006 году EPA установило максимальное содержание серы в дизельном топливе на уровне 15 частей на миллион. 10 В таблице 2 показано, как действуют стандарты выбросов в мире. 13 Согласно нормам Евро V в ближайшем будущем содержание серы в топливе должно быть снижено до 10 ppm. Правила по сере, вступившие в силу в Канаде и США с 1 июня 2006 года, снизили содержание серы в дорожном дизельном топливе и бензине с 500 мг кг -1 и 350 мг кг -1 до 15 мг. кг −1 и 30 мг кг −1 соответственно. 14,15 В настоящее время максимально допустимое содержание серы в дизельном топливе в США и Европе составляет 10 мг / кг -1 . 16,17 Таблица 2 Дорожная карта мировых стандартов выбросов. Изменено из CAI-Asia 13Страна 96 97 98 99 00 01 02 03 04 05 06 07 08 09 10 Калифорния (США) CARB (90 частей на миллион) CARB (80 частей на миллион) CARB (15 частей на миллион) США EPA (500 частей на миллион) 300 частей на миллион 80 страниц в минуту 15 (частей на миллион) Евросоюз Euro II (500 частей на миллион) E III (150 частей на миллион) E IV 50 частей на миллион E V 10 частей на миллион Китай (H) E I Евро II Евро III Евро IV Таиланд Евро I E II Евро III E IV Сингапур Евро I E II Евро III E IV Малайзия Евро I Евро II E III Индия (метро) E I Евро II Евро III E IV Индия Евро I Евро II E III Непал Евро I Филиппины Евро I Индонезия Евро II Последний нормативный акт в Индии, который был принят в 2010 году для крупных городов Индии, снизил содержание серы в бензине со 150 до 50 частей на миллион и содержание серы в дизельном топливе с 350 до 50 частей на миллион.Нефтеперерабатывающие заводы в Индии сталкиваются с серьезными проблемами, связанными с соблюдением требований по содержанию серы в топливе наряду с необходимым снижением содержания ароматических углеводородов. 18 В следующих разделах обсуждаются детали различных технологий удаления серы, таких как HDS, ODS, OEDS, адсорбционное удаление и BDS.
4. Гидрообессеривание
4.1. Введение
HDS традиционно используется на нефтеперерабатывающих заводах для снижения содержания серы в топливе. Первоначально интерес к HDS был стимулирован доступностью водорода из установок каталитического риформинга. 19 Как правило, процесс HDS включает каталитическую обработку водородом для преобразования различных соединений серы в H 2 S и органические соединения, не содержащие серы, при высокой температуре и парциальном давлении водорода. 20–21 Обычный каталитический метод HDS для снижения содержания серы требует жестких условий эксплуатации. На нефтеперерабатывающих заводах H 2 S, образующийся в результате реакции HDS, в конечном итоге превращается в элементарную серу с помощью модифицированной версии процесса Клауса. 224.2. Условия проведения реакции HDS
Реакция HDS на нефтеперерабатывающих заводах осуществляется в реакторах с тонким струйным слоем. Эти реакторы обычно работают при температурах в диапазоне 300–450 ° C и при H 2 давлениях 3,0–5,0 МПа, обычно с CoMo / Al 2 O 3 или NiMo / A1 2 O 3 катализаторов. 7,23 В этих суровых условиях олефины гидрируются, что приводит к потере октанового числа и избыточному расходу водорода.В мягких условиях HDS H 2 S может реагировать с олефинами в реакторе с образованием рекомбинантных меркаптанов, которые представляют собой линейные или разветвленные тиолы, обычно содержащие 5–12 атомов углерода. Образование рекомбинантных меркаптанов вызывает удержание серы в продукте, что ограничивает эффективность процесса HDS. Дальнейшие исследования в области HDS-катализа и разработки технологических процессов проводятся с тем, чтобы увеличить удаление серы и при этом сохранить качество топлива на уровне некоторых минимальных требований.В системах топливных элементов реакции HDS предпочтительно проводить при атмосферном давлении. Поскольку водород является ценным реагентом в топливном элементе, желательно проводить реакцию HDS с низким соотношением H 2 / топливо. HDS адаптирован для систем топливных элементов на основе фосфорной кислоты (PAFC), которые работают на природном газе. 24 HDS также был исследован для использования в сочетании с прямым карбонатным топливным элементом. 25 Механизм HDS обсуждается в следующем разделе.При атмосферном давлении реакция HDS протекает только по маршруту гидрогенолиза, а не по маршруту 26 гидрирования (HYD), который считается эффективным путем обессеривания тугоплавких соединений серы, таких как 4,6-DMDBT.
При атмосферном давлении и температуре> 300 ° C гидрирование ароматических колец термодинамически ограничено. Это выгодно тем, что активные центры катализатора не заняты для гидрирования ароматических соединений.Однако было замечено ингибирование в присутствии ароматических углеводородов, даже если они не гидрогенизированы. Поэтому исследования по определению оптимального рабочего давления для блока HDS для топливных элементов представляют интерес для дальнейших исследований.
4.3. Механизм HDS
Принято считать, что HDS проходит через реакционную сеть, предложенную Houalla et al. 27–28 В целом, механизм реакции DBT и 4,6-DMDBT через процесс HDS, как предполагается, осуществляется двумя основными путями.Один из них — это DDS или путь гидрогенолиза, при котором сера удаляется, не затрагивая ароматические кольца. Другой — через путь гидрогенизационной десульфуризации (HYD), в котором ароматические кольца соединений DBT предпочтительно гидрируются до промежуточных соединений 4H- или 6H-DBT, а затем десульфуризируются. 20Механизм реакции HDS DBT при 300 ° C и 102 атм показан на рис. 1. 28 Реакция водорода с DBT дает бифенил (BiPh) в качестве преобладающего органического продукта.В механизме пути HYD первичными продуктами реакции, образующимися непосредственно из DBT, являются тетрагидродибензотиофен (THDBT) и / или гексагидродибензотиофен (HHDBT). И THDBT, и HHDBT являются очень реактивными промежуточными продуктами, и их трудно выделить для обнаружения. Эти соединения дополнительно обессериваются с образованием циклогексилбензола (ЦГБ) в качестве вторичного продукта. Этот путь называется путем HYD, так как соединение серы гидрируется перед десульфуризацией. Гидрогенолиз ДБТ по прямой связи C – S дает бифенил по пути DDS.Последовательное гидрирование бифенила дает CHB. Бициклогексил (BiCh) — это третичный продукт, образующийся в следовых количествах в результате медленного гидрирования CHB, образованного любым из двух путей.
Рис.1 Пути HDS ДБТ при 300 ° C и 102 атм в присутствии CoMo / Al 2 O 3 . 28 Реакция DDS быстрее, чем HYD.Однако путь HYD становится относительно быстрым с увеличением концентрации H 2 S и / или H 2 в реакционной смеси; с увеличением метильных групп в 4 или 4 и 6 положениях; и с более активным катализатором гидрирования e. грамм. NiMo / Al 2 O 3 в сравнении с CoMo / Al 2 O 3 . 27–29 Houalla et al. 27–28 обнаружил, что активность катализатора NiMo / Al 2 O 3 (на единицу площади поверхности) была примерно вдвое выше, чем активность CoMo / Al 2 O 3 .Выход CHB при данной конверсии был примерно в три раза выше с катализаторами NiMo / Al 2 O 3 , чем с CoMo / Al 2 O 3 . Это указывает на то, что HYD является лучшим способом увеличения степени обессеривания тугоплавких соединений. Скорость обессеривания затрудненных соединений значительно увеличивается при использовании HYD-метода. Без одного или обоих колец молекула серы становится намного более гибкой, и атом серы намного легче приближается к поверхности катализатора и удаляется.
В общем, когда неспаренные электроны серы могут резонировать с пи-электронами органической структуры, энергия связи углерод-сера (C – S) становится практически идентичной энергии связи углерод-углерод (C – C). облигация. 30 Это приводит к снижению селективности процесса HDS и происходит гидрирование углерод-углеродных связей. Насыщенные углеводороды приводят к получению топлива более низкого качества и требуют дополнительных стадий обработки.
4.4. Влияние тугоплавких сероорганических соединений на HDS
. Эффективность процесса HDS зависит от типа соединения серы. Nag et al. 31 провели ГДС различных сероорганических соединений с использованием сульфидированного CoO – MoO 3 / γ – Al 2 O 3 в качестве катализатора. Они обнаружили, что следующий порядок реакционной способности для HDS: TH> BTH> бензонафтотиофен> тетрагидробензонафтотиофен> DBT. Замещение этих соединений циклическим алкилированием дополнительно влияет на реакционную способность.Килановски и др. 32 провели ГДС метилзамещенных ДБТ (ДБТ) при атмосферном давлении с использованием сульфидов CoMo / γ – A1 2 O 3 . Они показали, что реакционная способность ДБТ с замещением метила в разных положениях уменьшается в следующем порядке: 2,8-диметилДБТ (2, 8-DMDBT)> DBT (DBT)> 4-метилдибентотиофен (4-MDBT)> 4, 6-диметилДБТ (4,6-ДМДБТ). Было обнаружено, что тенденции реакционной способности для DBT, 4-MDBT и 4,6-DMDBT в промышленных условиях с сульфидированным CoMo / Al 2 O 3 , 27 CoMo / Al 2 O 3 — цеолит, 33 и NiMo / Al 2 O 3 . 34 Присутствие ароматических соединений в топливе дополнительно подавляло активность по отношению к HDS. Также известно, что полярные соединения, такие как азот- и кислородсодержащие соединения, оказывают сильное ингибирующее действие на реакции HDS. 35–36 Егорова и ПринсВлияние ионов меди и железа на сульфидную флотацию оксида меди в медеплавильном шлаке
В настоящее время большое внимание уделяется обработке плавильного шлака. В этом исследовании исследуется влияние Na 2 S, CuSO 4 и FeCl 3 на сульфидную флотацию оксида меди.Результаты показывают, что правильная концентрация Cu 2+ может увеличить сульфидирующий эффект оксида меди, тогда как Fe 3+ ингибирует сульфидирующий эффект. Дальнейший анализ показывает, что ионы Cu 2+ могут снижать поверхностный потенциал, увеличивать адсорбцию S 2-, затем генерировать больше полисульфида и, следовательно, способствовать сульфидирующей флотации. Однако ионы Fe 3+ увеличивают поверхностный потенциал, снижают адсорбцию S 2-, генерируют больше серного элемента и, следовательно, ингибируют сульфидирующую флотацию.
1. Введение
В настоящее время более 97% меди в мире производится пирометаллургической плавкой, и одновременно производится большое количество плавильного шлака. Медеплавильный шлак в основном состоит из продуктов, кристаллизованных из высокотемпературного расплава, и их состав очень сложен. Отделить шлак довольно сложно, и обедненный остаток все еще может содержать определенное количество соединений тяжелых металлов [1–4]. Если эти отходы не будут должным образом обработаны и напрямую сброшены в природную среду, они вызовут не только расточительство ресурсов, но и серьезное загрязнение окружающей среды.
Шлак Руоланда в основном состоит из штейна [5, 6], а также небольшого количества оксида меди, меди и следов диффузных солей меди. Основными компонентами, которые необходимо утилизировать, являются штейн, оксид меди и медь, а наиболее часто используемым методом утилизации является флотация [7, 8]. В прошлом большинство исследований по рециркуляции и утилизации медного шлака проводилось с целью оптимизации флотационных агентов, процессов и процедур во флотационном процессе рециркуляции меди [9–11].Однако состав медного шлака отличается от состава обычных медных минералов, а о механизме флотации оксида меди и меди в процессе редко сообщалось в опубликованной литературе.
Исследования механизма флотации в основном сосредоточены на взаимодействии между ионами и минералами в пульпе и адсорбционном поведении между ионами металлов и минералами [12–14]. Wei et al. изучили влияние ионов металлов (таких как Ca 2+ , Mg 2+ , Fe 2+ , Fe 3+ , Cu 2+ , Zn 2+ и Al 3+ ) в пульпе на флотируемость халькопирита и галенита [15].Юань и др. исследовали влияние и механизм ионов металлов на флотацию молибденита с помощью флотационных экспериментов и измерений дзета-потенциала [16]. В пульпе медеплавильного шлака также присутствует множество неизбежных ионов металлов, в основном состоящих из ионов железа и меди. Ионы разных металлов по-разному воздействуют на различные цели флотации, активацию или ингибирование. Deng et al. [17]. исследовали адсорбционное поведение ионов меди на поверхности халькопирита и нашли новую точку зрения на самоактивацию ионов меди.Эта же группа исследовала типы, структуру и состав природного чистого халькопирита и измерила общие концентрации Cu (C CuT ) и Fe (C FeT ), высвобождаемых из включений [18, 19]. Zhang et al. исследовали влияние ионов Fe (III) на флотацию минералов сподумена, альбита и кварца с использованием олеата натрия (NaOL) и обнаружили Fe (III) в качестве активатора флотации [20].
В этой работе систематически исследуется влияние Cu 2+ и Fe 3+ на сульфидирование и флотацию оксида меди в медеплавильном шлаке на основе анализа химического состава и фазового состояния медеплавильного шлака.Изучен механизм взаимодействия Cu 2+ и Fe 3+ на поверхности оксида меди.
2. Экспериментальная
2.1. Приготовление материала
Сырьем, используемым в этом эксперименте, является медно-охлаждающий шлак Руоланды. Основной состав шлака показан в таблице 1. Процентное содержание соединений меди показано в таблице 2.
Cu Fe S Zn Pb SiO 2 Al 2 O 3 CaO MgO Прочие 4.07 42,14 1,71 0,57 0,09 23,38 2,52 5,25 2,74 17,53 920 920 900 Сульфид меди Медь Оксид меди Диффлюентная соль меди Прочие соединения меди Всего 3.003 0,827 0,204 0,002 0,0334 4,07 Сырой шлак был раздроблен и измельчен, а частицы размером от 0,1 до 0,074 мм были отфильтрованы . Оксид меди с относительно высокой чистотой был выбран с помощью микроскопа, и образцы были исследованы с помощью дифракции рентгеновских лучей (XRD). На рис. 1 показана рентгенограмма выбранных частиц. Основные пики на рентгенограммах частиц были идентифицированы как оксид меди в соответствии с картами JCPDS.Хотя материал содержит и другие примеси, их концентрация была относительно низкой. Химический тест подтверждает, что содержание меди составляет 76,28%, а процент оксида меди должен быть более 95%. Результаты определения с помощью XRF (PANalytical Axios Advanced) показаны в таблице 3. Полученный оксид меди использовали в следующих экспериментах.
Образцы CuO Fe 3 O 4 Fe 2 O 3 Cu Cu 2 SiO 2 Al 2 O 3 CaO MgO 1 95.622 0,319 0,334 — 3,324 0,032 0,085 0,020 0,084 2 96,176 0,419 0,164 0,091 2,928 0,1200 — 0,073 0,049 3 96,038 0,481 0,282 0,153 2,722 0,217 0.031 — 0,076 4 95,811 0,241 0,091 0,103 3,216. 0,282 — 0,061 0,195 2.2. Эксперименты по флотации
Эксперименты по флотации проводили с использованием флотомашины с желобом RK / FGC-35 мл. 2 г CuO добавляли в 25 мл Na 2 S (0.156 г / л) водного раствора при различных значениях pH. Температура флотации была комнатной. Скорость перемешивания составляла 1000 об / мин, а концентрация собирающего бутилксантата и соединения высших спиртов пенообразователя 2 # сосновое камфорное масло составляла 0,167 г / л и 0,027 г / л, соответственно. Технологическая схема процесса флотации показана на рисунке 2. Значение pH, обеспечивающее наибольшее извлечение, применялось в следующих экспериментах. Конечные концентраты и хвосты фильтровали, сушили, а затем взвешивали и тестировали для расчета степени извлечения.
2.3. Измерение дзета-потенциала
Дзета-потенциал поверхности минерала измеряли с помощью анализатора размера частиц с дзета-потенциалом BDL-B в водном растворе 0,025 г / л CuSO 4 , 0,156 г / л Na 2 S и 0,0162 г / л FeCl 3 . Частицы CuO измельчали до размера менее 38 мкм мкм. В стакан на 100 мл добавляли 0,05 г частиц. Деионизированную воду, CuSO 4 , Na 2 S и FeCl 3 добавляли, как указано в таблице 4, и разбавляли деионизированной водой до 50 мл.Растворы HCl и NaOH использовали для корректировки значения pH. После этого растворы перемешивали на магнитной мешалке в течение примерно 5 минут, а затем проводили измерения дзета-потенциала.
Состояние 1 2 3 4 5 6 Агенты Нет 20 Na S Cu 2+ Na 2 S Fe 3+ Na 2 S Cu 2+ Fe 3+ 920 2.4. Измерения методом ICP и XPS
Частицы CuO измельчали до мелких частиц размером менее 74 мкм мкм. 2,5 г частиц добавляли к 100 мл раствора для проведения экспериментов по выщелачиванию. Скорость перемешивания составляла 100 об / мин. После завершения процесса выщелачивания смешанный раствор отделяли центрифугированием. Надосадочную жидкость собирали для измерения концентрации ионов с использованием эмиссионного спектрометра с индуктивно связанной плазмой (ICP, Optima 4300DV), а твердую часть сушили и хранили.
Время равновесия выщелачивания и растворения иона меди, t , определенное из тестов концентрации ионов ICP, было установлено как время реакции для эксперимента по адсорбции ионов. 2,5 г частиц CuO размером менее 74 мкм мкм добавляли в различные растворы (100 мл, как показано в таблице 3) со скоростью перемешивания 100 об / мин. После реакции в течение ± минут твердую фазу и жидкую фазу разделяли. Жидкую фазу герметично закрывали, а затем тестировали с помощью ICP на концентрацию ионов.Твердую часть сушили, а затем характеризовали с помощью рентгеновской фотоэлектронной спектроскопии (XPS) вместе с предыдущей твердой частью, которую выщелачивали в течение ± минут.
3. Результаты и обсуждение
3.1. Флотационный анализ
Для изучения влияния ионов S 2–, Cu 2+ и Fe 3+ на флотацию оксида меди были проведены эксперименты по флотации с различными значениями pH и различным количеством Na . 2 S, CuSO 4 и FeCl 3 .
Результаты флотации оксида меди показаны на рисунке 3. Извлечение CuO при различных условиях pH показано на рисунке 3 (а). Как показано на Рисунке 3 (a), извлечение оксида меди обычно увеличивается с увеличением значения pH и достигает наивысшего значения около 84,8%, когда значение pH равно 10. Извлечение немного уменьшается, когда значение pH достигает 11. Оптимальный pH. значение 10 применялось для следующих экспериментов по флотации. Как показано на Рисунке 3 (b), извлечение достигло наивысшего значения, когда концентрация Na 2 S была равна 0.156 г / л, что указывает на то, что правильная концентрация Na 2 S может улучшить процесс флотации. Na 2 S широко используется в качестве активатора сульфидирования оксидных минералов [21], поэтому недостаточное сульфидирование на поверхности минерала не может привести к адекватному сульфидированию поверхности CuO. Но избыток Na 2 S может замедлить флотацию, поскольку сульфид-ионы обладают сильной восстанавливающей способностью [22], таким образом, потенциал границы раздела минерал / вода должен быть уменьшен, с чем будет происходить образование разновидностей ксантогената меди на сульфидированной минеральной поверхности. затронуты.Кроме того, избыточные частицы сульфид-иона могут занимать место образующихся частиц ксантогената меди на сульфидированной поверхности CuO из-за более низкой константы произведения его растворимости. Рисунок 3 (c) показывает, что максимальное извлечение 91,2% было получено, когда концентрация CuSO 4 составляла 0,025 г / л, что позволяет предположить, что соответствующая концентрация Cu 2+ может увеличить сульфидирующий эффект Na 2 S. С другой стороны, как показано на Фигуре 3 (d), Fe 3+ имеет довольно очевидный эффект ингибирования восстановления CuO.Извлечение CuO значительно снизилось с увеличением Fe 3+ и в конечном итоге достигло примерно 0%.
3.2. Анализ дзета-потенциала
Каждый ион может прикрепляться к поверхности детали и, следовательно, изменять ее плавучесть. Поверхностный электрокинетический потенциал может отражать плавучесть материала. Следовательно, влияние ионов меди и железа на сульфидирование и плавучесть оксида меди может быть исследовано путем измерения поверхностного электрокинетического потенциала.
На фиг. 4 показано влияние различных концентраций Cu 2+ и Fe 3+ на зависимость дзета-потенциала от значений pH CuO. Когда чистый оксид меди выщелачивали в чистой воде, значение pH раствора составляло около 6,5. Из рисунка 4 видно, что дзета-потенциал CuO отрицателен в области pH 3–12, а изоэлектрическая точка (IEP) составляет около 2,5, но максимальное изменение наблюдалось, когда pH составлял около 9, и он внезапно повышался, когда Извлечение CuO флотацией было почти максимальным.После добавления Cu 2+ потенциал CuO в растворе снижается (менее отрицательно) и даже становится положительным при pH около 10, а IEP также сдвигается почти до 3,5; это может быть связано с тем, что ковалентная адсорбция между ионом Cu 2+ и поверхностью CuO увеличивает потенциал CuO. Когда в раствор был добавлен Fe 3+ , потенциал становится более положительным и остается постоянным с pH до pH 10. Это можно приписать большой адсорбции гидроксида железа на поверхности CuO [23].Дзета-потенциал чистого CuO был отрицательным, но дзета-потенциал гидроксида железа был положительным, поэтому должна происходить специфическая адсорбция, которая делает дзета-потенциал положительным. Гидроксид железа начинает выпадать в осадок при pH около 2,9 [23], и он может выпадать в осадок на поверхности CuO раньше, чем осаждение в растворе, поэтому специфическая адсорбция будет продолжаться, и дзета-потенциал останется положительным, пока pH не достигнет IEP собственно гидроксид железа (около 8).
Влияние Cu 2+ и Fe 3+ на дзета-потенциал сульфидированного CuO показано на рисунке 5.Как видно из Фиг.5, в присутствии Na 2 S дзета-потенциал становится еще более отрицательным, что указывает на то, что произошла реакция сульфидизации. Это связано с тем, что S 2- и HS- в результате гидролиза [24] Na 2 S адсорбируются на поверхности CuO за счет химической адсорбции, а не электростатического притяжения [25]. Как показано на рисунке 5, из-за добавления Na 2 S вместе с ионами Cu 2+ потенциал CuO значительно увеличился (стал более отрицательным) по сравнению с CuO, но уменьшился (стал менее отрицательным) по отношению к CuO + Na 2 S.Оно увеличивалось (становилось более отрицательным) при pH> 9. Это явление продемонстрировало, что Cu 2+ приводит к лучшему сульфидированию в области от 9 до 11,5, и на поверхности CuO образуется больше пленок сульфида меди. Напротив, ионы Fe 3+ по-разному влияют на адсорбцию ионов серы на поверхности CuO. Он увеличился (стал более отрицательным) по сравнению с CuO, но уменьшился (стал менее отрицательным) по отношению к CuO + Na 2 S.
3.3. Адсорбция Cu 2+ и Fe 3+
Растворимость CuO в воде относительно низкая. Обычно CuO достигает равновесия растворения в течение нескольких часов или даже дней. Также с увеличением времени растворения скорость растворения постепенно снижается. Скорость растворения CuO измеряли для определения времени достижения равновесия растворения, которое затем выбирали в качестве времени реакции для эксперимента по адсорбции.
Зависимая от времени растворимость CuO в чистой воде показана на рисунке 6.Из рисунка 6 видно, что концентрация Cu 2+ в растворе CuO увеличивалась со временем, и скорость растворения становилась относительно низкой после растворения в течение 30 минут, что указывает на то, что растворение имеет тенденцию к равновесию. Концентрация Cu 2+ через 60 минут аналогична концентрации через 1440 минут, поэтому время реакции 30-60 минут является приемлемым.
Результаты ИСП для раствора CuO с адсорбированными ионами показаны на рисунке 7.По результатам ИСП можно сделать вывод, что фактическая растворимость CuO выше теоретического справочного значения [26]. Это потому, что чистота CuO трудно достичь 100%. Следы веществ и CO 2 в воздухе могут вызывать эффект растворимости соли, который увеличивает растворимость и скорость растворения [27, 28].
Как показано на Фигуре 7, при добавлении Na 2 S в раствор CuO содержание S в растворе снизилось примерно на 86,2%, что указывает на то, что S хорошо адсорбируется на твердой поверхности.В присутствии Cu 2+ и Fe 3+ концентрация S еще больше снизилась, что указывает на то, что Cu 2+ и Fe 3+ потребляли S или способствовали адсорбции S на поверхности образца. , а ион Fe 3+ имел большее влияние, чем ион Cu 2+ . Необходимо провести дополнительные измерения XPS, чтобы подтвердить, было ли это потребление или адсорбция. Что касается Cu, концентрация Cu была снижена на 83,4% при добавлении Na 2 S в раствор CuO, что указывает на существование ковалентной адсорбции.При дальнейшем добавлении Na 2 S происходило увеличение концентрации Cu 2+ , что позволяет предположить, что Na 2 S может потреблять часть Cu 2+ и снижать адсорбцию Cu 2+ на CuO. Кроме того, содержание Fe 3+ в растворе CuO было значительно снижено примерно на 89,8%. Восстановление Fe 3+ можно приписать не только адсорбции Fe 3+ на твердой поверхности, но и потреблению Fe 3+ из окислительно-восстановительной реакции.При дальнейшем добавлении Na 2 S концентрация Fe 3+ была дополнительно снижена почти до нуля. Окислительно-восстановительная реакция между Fe 3+ и S 2- увеличила потребление Fe 3+ .
3.4. Анализ XPS
На рисунке 8 показаны полные XPS-спектры поверхности CuO с различными добавками и без них. Спектр C1s используется в качестве данных калибровки в этом анализе. Как показано в таблице 5, добавление Na 2 S увеличивало молярный процент S2p и уменьшало молярный процент Cu2p и O1s из-за адсорбции S2p.После добавления CuSO 4 Cu2p адсорбировался на поверхности CuO, и поэтому мольный процент Cu2p увеличивался. После добавления как CuSO 4 , так и Na 2 S адсорбция S и Cu увеличилась, что указывает на то, что Cu может способствовать адсорбции S на CuO. При добавлении FeCl 3 можно отчетливо наблюдать адсорбцию Fe. Когда были добавлены Na 2 S и FeCl 3 , адсорбция S снизилась, и много Fe адсорбировалось на твердой поверхности, возможно, потому что Fe 3+ был частично окислен [29] и соединения Fe-S были произведены.Результаты полных спектров XPS предполагают, что ионы меди могут способствовать адсорбции и сульфидированию сульфида натрия, в то время как ионы железа действуют наоборот, что согласуется с выводом, сделанным на основе экспериментов по флотации.

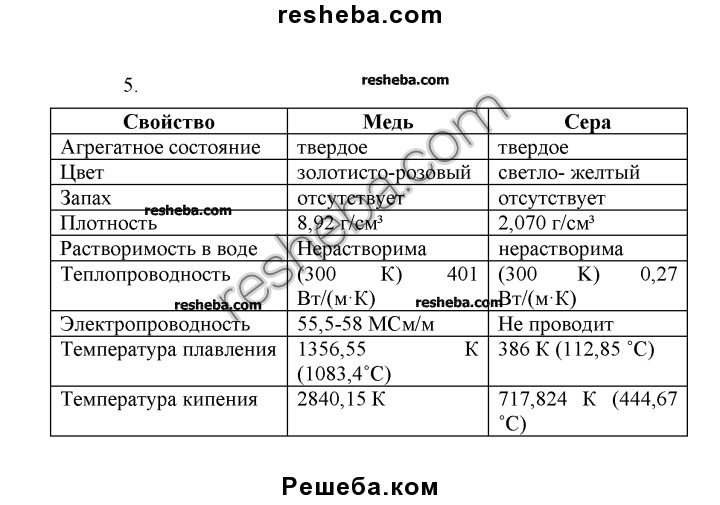 S2O72-
S2O72-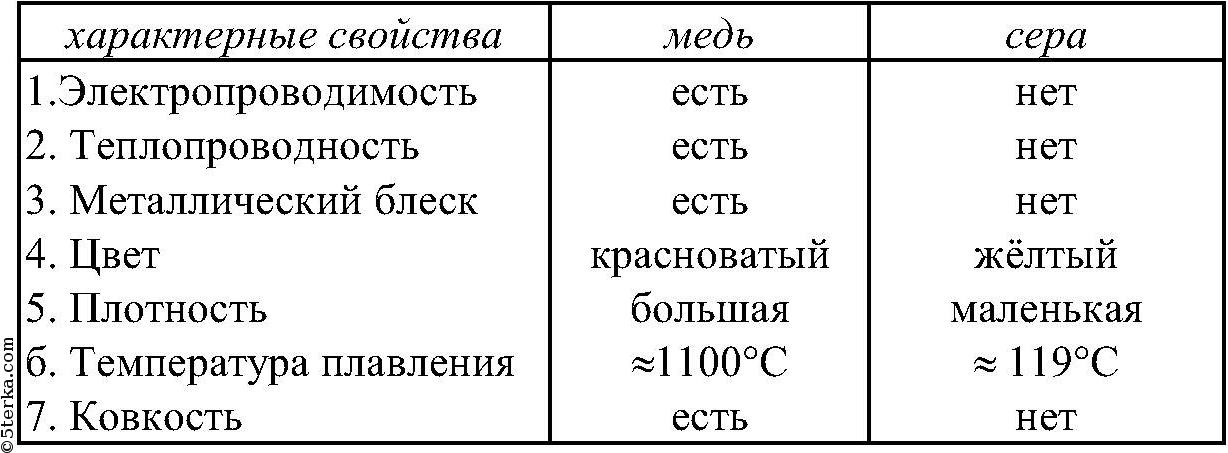 F—
F—