Олово — Описание | Электрод-Сервис
Олово (лат. Stannum; обозначается символом Sn) — элемент 14-й группы периодической таблицы химических элементов (по устаревшей классификации — элемент главной подгруппы IV группы), пятого периода, с атомным номером 50. Относится к группе лёгких металлов. При нормальных условиях простое вещество олово — пластичный, ковкий и легкоплавкий блестящий металл серебристо-белого цвета. Олово образует две аллотропические модификации: ниже 13,2 °C устойчиво α-олово (серое олово) с кубической решёткой типа алмаза, выше 13,2 °C устойчиво β-олово (белое олово) с тетрагональной кристаллической решеткой.
- О1пч — Применение: для производства консервной жести и приготовления химических реактивов
- О1 — Применение: для производства жести, изготовления прутков, проволоки, ленты и других изделий для электротехнических целей; для изготовления сплавов и припоев
- О2 — Применение: для изготовления баббитов, сплавов, припоев, оловянного порошка, труб, фольги, лужения
- О3 — Применение: для изготовления припоев и солей
- О4 — Применение: для изготовления припоев, баббитов и сплавов, модифицирования серого чугуна
- ОВЧ000 — Применение: для полупроводниковой техники
- Олово – относительно мягкий металл, используется в основном как безопасное, нетоксичное, коррозионностойкое покрытие в чистом виде или в сплавах с другими металлами.
 Главные промышленные применения олова – в белой жести (луженое железо) для изготовления тары, в припоях для электроники, в домовых трубопроводах, в подшипниковых сплавах и в покрытиях из олова и его сплавов. Олово образует различные соединения, многие из которых находят промышленное применение. Наиболее экономически важный оловосодержащий минерал – касситерит (оксид олова). Мировые месторождения касситерита разрабатывают в Юго-Восточной Азии, в основном в Индонезии, Малайзии и Таиланде. Другие важные месторождения касситерита находятся в Южной Америке (Бразилия и Боливия), Китае и Австралии.
Главные промышленные применения олова – в белой жести (луженое железо) для изготовления тары, в припоях для электроники, в домовых трубопроводах, в подшипниковых сплавах и в покрытиях из олова и его сплавов. Олово образует различные соединения, многие из которых находят промышленное применение. Наиболее экономически важный оловосодержащий минерал – касситерит (оксид олова). Мировые месторождения касситерита разрабатывают в Юго-Восточной Азии, в основном в Индонезии, Малайзии и Таиланде. Другие важные месторождения касситерита находятся в Южной Америке (Бразилия и Боливия), Китае и Австралии.Компонетнты
Марка
ОВЧ-000 О1 пч О1 О2 О3 О4 Sn, не менее 99,999 99,915 99,9 99,565 98,49 96,43 As, не более 0,0001 0,01 0,01 0,015 0,03 0,05 Fe, не более 0,0001 0,009 0,009 0,02 0,02 0,02 Cu, не более 0,00001 0,01 0,01 0,03 0,1 0,1 Pb, не более 0,00001 0,025 0,04 0,25 1 3 Bi, не более 0,000005 0,01 0,015 0,05 0,06 0,1 Sb, не более 0,00005 0,015 0,015 0,05 0,3 0,3 S, не более — 0,008 0,007 0,016 0,02 0,02 Zn, не более 0,00003 0,002 0,002 0,002 — — Al, не более 0,0003 0,002 0,002 0,002 — — Ga, не более 0,00005 — — — — — Ag, не более 0,000005 — — — — — Au, не более 0,00001 — — — — — Co, не более 0,00001 — — — — — Ni, не более 0,00001 — — — — — Примесей 0,001 0,085 0,1 0,435 1,51 3,51 Форма поставки изделий из олова:
Олово марок О1пч, О1, О2, О3, О4 изготовляют в чушках массой 24-26 кг, марки ОВЧ-000 — в чушках массой 5-6 кг или прутках массой 0,25 кг.
Области применения различных марок олова:
ОВЧ-000 — особо чистое, для полупроводниковой техники О1 пч — для пищевой промышленности, для лужения жести О1 — для лужения жести, изготовления припоев О2-О4 — для изготовления баббитов, припоев, труб, фольги, лужения кухонной утвариСВОЙСТВА b -ОЛОВА Атомный номер 50 Атомная масса 118,710 Изотопы стабильные 112, 114–120, 122, 124 нестабильные 108–111, 113, 121, 123, 125–127 Температура плавления, ° С 231,9 Температура кипения, ° С 2625 Плотность, г/см 3 7,29 Твердость (по Бринеллю) 3,9 Содержание в земной коре, % (масс.  )
)0,0004 Степени окисления 6 Физические свойства олова:
Олово – мягкий серебристо-белый пластичный металл (может быть прокатан в очень тонкую фольгу – станиоль) с невысокой температурой плавления (легко выплавляется из руд), но высокой температурой кипения. Олово имеет две аллотропные модификации: a -Sn (серое олово) с гранецентрированной кубической кристаллической решеткой и b -Sn (обычное белое олово) с объемноцентрированной тетрагональной кристаллической решеткой. Фазовый переход b -> a ускоряется при низких температурах (–30 0 С) и в присутствии зародышей кристаллов серого олова. Чистое олово обладает низкой механической прочностью при комнатной температуре (можно согнуть оловянную палочку, при этом слышится характерный треск, обусловленный трением отдельных кристаллов друг о друга) и поэтому редко используется. Однако оно легко образует сплавы с большинством других черных и цветных металлов.
Химические свойства олова:
При комнатной температуре олово химически инертно к кислороду и воде. На воздухе олово постепенно покрывается защитной оксидной пленкой, которая повышает его коррозионную стойкость. С химической инертностью олова и его оксидной пленки в обычных условиях связано использование его в покрытии жестяной тары для продуктов питания, прежде всего – консервных банок. Олово легко наносится на сталь и продукты его коррозии безвредны. В соединениях олово проявляет две степени окисления: +2 и +4, причем соединения олова(II) в большинстве своем относительно нестабильны в разбавленных водных растворах и окисляются до соединений олова(IV) (их используют иногда как восстановители, например SnCl 2 ). Разбавленные соляная и серная кислоты действуют на олово очень медленно, а концентрированные, особенно при нагревании, растворяют его, причем в соляной кислоте получается хлорид олова(II), а в серной – сульфат олова(IV).

Применение олова:
В современном мире более трети добываемого олова расходуется на изготовление пищевой жести и емкостей для напитков. Жесть в основном состоит из стали, но имеет покрытие из олова обычно толщиной менее 0,4 мкм.Сплавы: Одна треть олова идет на изготовление припоев. Припои – это сплавы олова в основном со свинцом в разных пропорциях в зависимости от назначения. Сплав, содержащий 62% Sn и 38% Pb, называется эвтектическим и имеет самую низкую температуру плавления среди сплавов системы Sn – Pb. Он входит в составы, используемые в электронике и электротехнике. Другие свинцово-оловянные сплавы, например 30% Sn + 70% Pb, имеющие широкую область затвердевания, используются для пайки трубопроводов и как присадочный материал. Применяются и оловянные припои без свинца. Сплавы олова с сурьмой и медью используются как антифрикционные сплавы (баббиты, бронзы) в технологии подшипников для различных механизмов.
 Современные оловянно-свинцовые сплавы содержат 90–97% Sn и небольшие добавки меди и сурьмы для увеличения твердости и прочности. В отличие от ранних и средневековых свинецсодержащих сплавов, современная посуда из cплавов олова безопасна для использования.
Современные оловянно-свинцовые сплавы содержат 90–97% Sn и небольшие добавки меди и сурьмы для увеличения твердости и прочности. В отличие от ранних и средневековых свинецсодержащих сплавов, современная посуда из cплавов олова безопасна для использования.Покрытия из олова и его сплавов: Олово легко образует сплавы со многими металлами. Оловянные покрытия имеют хорошее сцепление с основой, обеспечивают хорошую коррозионную защиту и красивый внешний вид. Оловянные и оловянно-свинцовые покрытия можно наносить, погружая специально приготовленный предмет в ванну с расплавом, однако большинство оловянных покрытий и сплавов олова со свинцом, медью, никелем, цинком и кобальтом осаждают электролитически из водных растворов. Наличие большого диапазона составов для покрытий из олова и его сплавов позволяет решать многообразные задачи промышленного и декоративного характера.
Соединения: Олово образует различные химические соединения, многие из которых находят важное промышленное применение.
 Кроме многочисленных неорганических соединений, атом олова способен к образованию химической связи с углеродом, что позволяет получать металлоорганические соединения, известные как оловоорганические. Водные растворы хлоридов, сульфатов и фтороборатов олова служат электролитами для осаждения олова и его сплавов. Оксид олова применяют в составе глазури для керамики; он придает глазури непрозрачность и служит красящим пигментом. Оксид олова можно также осаждать из растворов в виде тонкой пленки на различных изделиях, что придает прочность стеклянным изделиям (или уменьшает вес сосудов, сохраняя их прочность). Введение станната цинка и других производных олова в пластические и синтетические материалы уменьшает их возгораемость и препятствует образованию токсичного дыма, и эта область применения становится важнейшей для соединений олова. Огромное количество оловоорганических соединений расходуется в качестве стабилизаторов поливинилхлорида – вещества, используемого для изготовления тары, трубопроводов, прозрачного кровельного материала, оконных рам, водостоков и др.
Кроме многочисленных неорганических соединений, атом олова способен к образованию химической связи с углеродом, что позволяет получать металлоорганические соединения, известные как оловоорганические. Водные растворы хлоридов, сульфатов и фтороборатов олова служат электролитами для осаждения олова и его сплавов. Оксид олова применяют в составе глазури для керамики; он придает глазури непрозрачность и служит красящим пигментом. Оксид олова можно также осаждать из растворов в виде тонкой пленки на различных изделиях, что придает прочность стеклянным изделиям (или уменьшает вес сосудов, сохраняя их прочность). Введение станната цинка и других производных олова в пластические и синтетические материалы уменьшает их возгораемость и препятствует образованию токсичного дыма, и эта область применения становится важнейшей для соединений олова. Огромное количество оловоорганических соединений расходуется в качестве стабилизаторов поливинилхлорида – вещества, используемого для изготовления тары, трубопроводов, прозрачного кровельного материала, оконных рам, водостоков и др. Другие оловоорганические соединения используются как сел
Другие оловоорганические соединения используются как сел
Оловянный куб
ГОСТы и ТУ
Полезная информация
Олово О2 ГОСТ 860-75 — цена и характеристики
Главная > Чистые металлы > О2
Цена и сортамент
Чушка
Чушка – большой слиток весом 20-30кг. Размер и формы отгрузки соответствуют ГОСТ 860-75.
Цена от 1830,00 руб/кг*
*Цена указана при покупке партии не менее 100кг.
Чтобы узнать подробную информацию или купить чушку олово О2 нажмите кнопку «ЗАКАЗАТЬ»
Пруток
Изделия изготавливаемое методом прессования. Имеет длину 400мм и круглое сечение 8мм. ГОСТ 860-75.
Цена от 1850,00 руб/кг*
*Цена указана при покупке партии не менее 100кг диаметром 8 мм.
Чтобы узнать подробную информацию или купить олово О2 нажмите кнопку «ЗАКАЗАТЬ»
Анод
Прямоугольная форма выпуска олова используемая в гальванических целях. Изготавливается отливанием в формы различных размеров.
Изготавливается отливанием в формы различных размеров.
Цена от 1830,00 руб/кг*
*Цена указана при покупке партии не менее 100кг.
Чтобы узнать подробную информацию или купить анод олово О2 нажмите кнопку «ЗАКАЗАТЬ»
Проволока
Тонкий вид изделия олова в види нити. Диаметр до 6мм. Производится по ГОСТ 860-75.
Цена от 1860,00 руб/кг*
*Цена указана при покупке партии не менее 100кг
Чтобы узнать подробную информацию или купить проволоку олово О2 нажмите кнопку «ЗАКАЗАТЬ»
Порошок
Рассыпчетое мелкодисперсное вещество. Используется для распыления и покрытия поверхностей.
Цена договорная*
*Цена формируется в зависимости от объема.
Чтобы узнать подробную информацию или купить порошок олова нажмите кнопку «ЗАКАЗАТЬ»
Фольга
Сплав прокатанный до тончайшего слоя не превышающего 1мм. Форма листов прямоугольная или квадратная.
Цена договорная*
*Цена формируется в зависимости от размера и объема.
Чтобы узнать подробную информацию или купить оловянную фольгу нажмите кнопку «ЗАКАЗАТЬ»
ГОСТ
В соответствии с нормами ГОСТ 860-75 олово марки О2 включает в себя повышенный процент примесей, в связи с чем процент чистого металла в продукте снижается до 99,565 %. В некоторых случаях это ограничивает применение данного металла, но одновременно и снижает затраты на его приобретение.
Химический состав
Помимо олова, в состав металла описываемой марки входят (в порядке уменьшения процентного состава) свинец, висмут, сурьма, медь, железо, мышьяк, сера. На уровне следов присутствуют также цинк и алюминий. Наличие большинства из указанных примесей обусловлено составом исходного сырья, из которого производится выплавка олова О2.
ГОСТ предусматривает ограничение процентного содержания таких химических элементов как свинец и сера по причине повышенной токсичности, а висмута – вследствие увеличения хрупкости олова. Вместе с тем для специфических отраслей применения (например, производства баббитов, когда исключается постоянный контакт человека с данными сплавами) процентное содержание сурьмы, свинца и меди может возрастать, при соответствующем снижении процента олова. Допускаемая суммарная доля примесей в олове марки О2 не должна превышать 0,435 %.
Допускаемая суммарная доля примесей в олове марки О2 не должна превышать 0,435 %.
Технические характеристики
Олово О2 представляет собой мягкий, высокопластичный (особенно при нагреве до температур 100…150°С) металл переходной группы. На воздухе проявляет высокую коррозионную стойкость, однако активно взаимодействует с концентрированными кислотами и щёлочами.
Исходный вид поставки олова О2 – литые призмы (чушки), также есть возможность заказывать прокатный сортамент данного металла – прутки, проволока, аноды. Катаный прокат олова отличается отличной технологической пластичностью, хорошо обрабатывается давлением в холодном и горячем состоянии. Температурный интервал стабильного существования расплава весьма широк, и может легко поддерживаться на требуемом уровне температур.
Упругие показатели олова О2 невелики, а при деформировании наблюдается заметное искажение параметров кристаллической решётки, что выражается в характерном поскрипывании материала. Температура плавления — 231,9°С.
Области применения
Олово марки О2 используется в следующих отраслях:
• Материал в основном применяется для изготовления различных сплавов и припоев;
• Радио- и электротехническая промышленность: металл используется в технологических процессах пайки деталей и узлов различных приборов как основная составляющая припоев;
• Машиностроение: металл используется при изготовлении баббитов – подшипниковых сплавов.
Олово марки О2 нетоксично, но требовательно к условиям своего хранения. При внешних температурах менее 12°С резко возрастает риск аллотропического превращения белого олова в серое. Последнее отличается высокой хрупкостью и при малейших нагрузках превращается в порошок. Использовать такое олово недопустимо, а материал подлежит переплавке.
Заказ и доставка
На нашем сайте вы можете заказать олово О2 с доставкой по всей России. Срок производства изделий в среднем занимает 5 дней. Готовый продукт отгружается в офисе компании или отправляется транспортной компанией.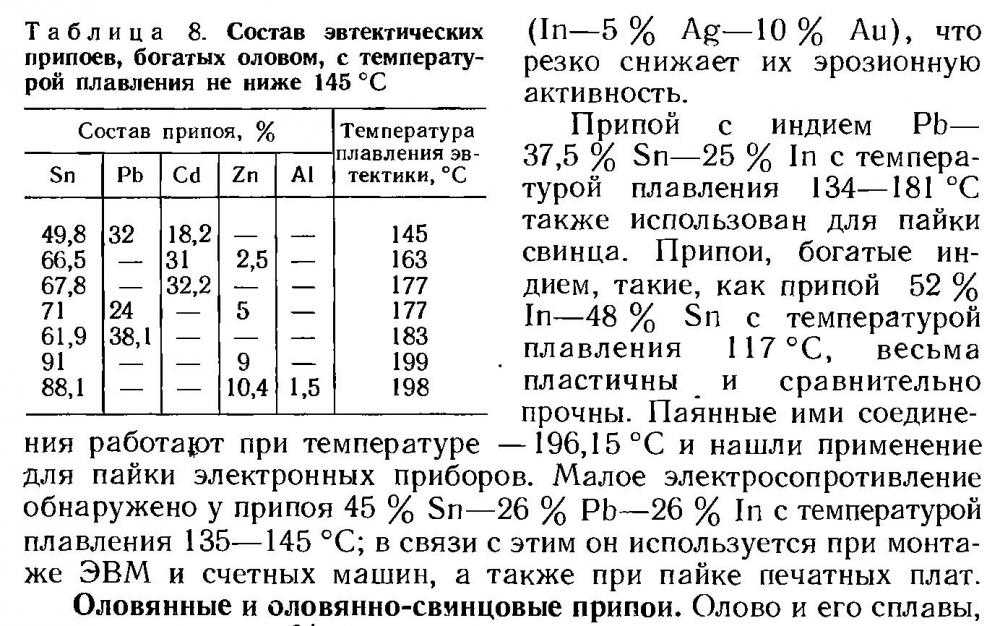
Формула, характеристики, сравнение, использование, аллотропы и вредные эффекты
Олово является элементом, принадлежащим р-блоку. Он присутствует в четырнадцатой группе в пятом периоде. В этой статье мы подробно обсудим олово и рассмотрим все важные моменты, касающиеся элемента олова, такие как формула олова, латинское название олова, химическое название Sn, научное название олова, аллотропы олова и химический состав сплавов олова.
Формула олова
[Изображение скоро будет загружено]
Формула Олова представляет собой символ Олова. Его символ «Sn». Латинское название олова – stannum. Химическое название Sn — олово. Научное название олова совпадает с химическим названием олова. Химический состав оловянных сплавов включает около 92% олова, 7% сурьмы и 1–2% меди, иногда с добавками висмута или серебра. Олово в природе встречается в двух формах; органическое олово и неорганическое олово. Естественно олово содержится в земной коре. Органическое олово составляет основной вклад в антропогенно созданную категорию олова.
Органическое олово составляет основной вклад в антропогенно созданную категорию олова.
Органическое олово более токсично, чем неорганическая форма олова. Токсичность органической формы олова зависит от длины цепи алкильной группы. Чем длиннее цепь алкильной группы, тем больше гидрофобная природа и больше токсичность соединения олова. Олово не выступает в качестве необходимого элемента для человеческого организма. Путь выведения олова зависит от типа соединения и режима воздействия. Обычно нерастворимые неорганические соединения олова нетоксичны по своей природе. Токсичность, вызванная органической формой олова, вызывает потерю памяти или умственную отсталость.
Характеристики олова
Атомная масса олова 118,71 ед.
Атомный номер олова 50.
Электронная конфигурация олова [Kr]5S24d105p2.

Его атомный радиус составляет 217 пм.
Обычная степень окисления олова +4 и +2.
Плотность 7,287 г/см3.
Температура плавления 505,08 К.
Температура кипения 2875 К.
Существует в твердом состоянии при нормальной температуре.
Серебристо-белого цвета.
Сравнение олова с другими элементами 14-й группы
Углерод, кремний, германий, олово и свинец являются элементами четырнадцатой группы. Все эти элементы не реагируют с водой. Углерод при нагревании пара образует монооксид углерода и газообразный водород.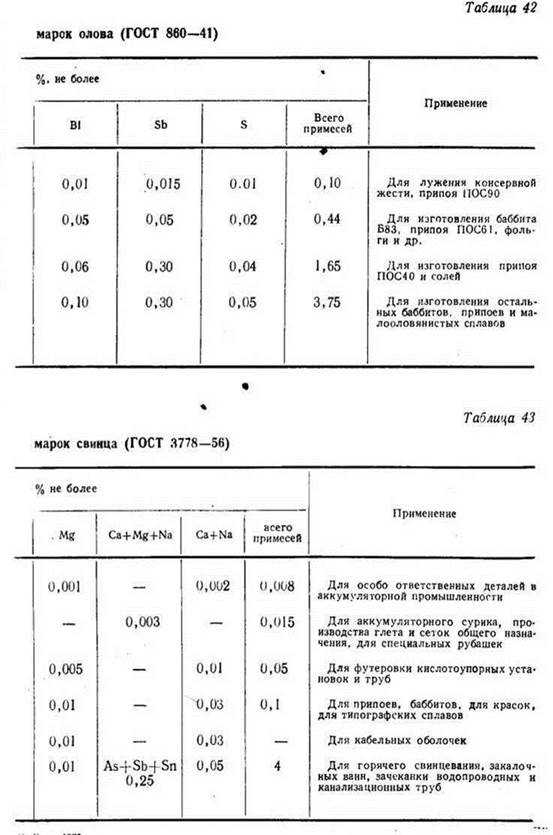 Хлорид олова представляет собой соединение олова. Хлорид олова реагирует с перманганатом калия (KMnO4) и образует в качестве продукта тетрахлорид олова. В этой реакции дихлорид олова окисляется из степени окисления +2 в степень окисления +4. Дихлорид олова реагирует с дихроматом калия с образованием тетрахлорида олова и катиона Cr+3 (зеленый цвет). Дихлорид олова реагирует с сулемой, образуя белый осадок сулемы. Когда этот хлорид ртути снова реагирует с дихлоридом олова, образуется серо-черный осадок ртути. Дихлорид олова реагирует с хлоридом золота с образованием тетрахлорида олова и осадка золота.
Хлорид олова представляет собой соединение олова. Хлорид олова реагирует с перманганатом калия (KMnO4) и образует в качестве продукта тетрахлорид олова. В этой реакции дихлорид олова окисляется из степени окисления +2 в степень окисления +4. Дихлорид олова реагирует с дихроматом калия с образованием тетрахлорида олова и катиона Cr+3 (зеленый цвет). Дихлорид олова реагирует с сулемой, образуя белый осадок сулемы. Когда этот хлорид ртути снова реагирует с дихлоридом олова, образуется серо-черный осадок ртути. Дихлорид олова реагирует с хлоридом золота с образованием тетрахлорида олова и осадка золота.
C, Si, Ge, Sn, Pb + h3O→ Нет реакции.
C + пар → CO + h3
SnCl2 + KMnO4 → SnCl4 + Mn+2
SnCl2 + K2CrO7 → SnCl4 + Cr+3 (зеленый цвет)
SnCl2 + HgCl2 → Hg2Cl2 (белый ppt) → Hg (серый черный ppt)
SnCl2 + AuCl3 → SnCl4 + Au (осадок)
Использование олова
Используется для покрытия металлов для предотвращения коррозии.

Используется для изготовления жестяных банок.
Используется в производстве оконного стекла.
Олово, используемое при формовании сплавов.
Сплавы олова используются для изготовления сверхпроводящих проводов.
Соли олова распыляют на стекло для получения электропроводящих покрытий.
Фторид двухвалентного олова используется в зубных пастах.
Аллотропы олова
Олово существует в трех аллотропных формах
Серое олово.
Белая олово (тетрагональная).

Белая олово (ромбическая).
Белое олово имеет тетрагональную кристаллическую структуру. Серое олово существует в гранецентрированной кубической структуре. Аллотропы олова могут переходить из одной кристаллической формы в другую при определенной температуре.
[Изображение будет загружено в ближайшее время]
Серое олово также известно как альфа-олово. Он может превратиться в белое олово при 13,2 градусах Цельсия. Белое олово может превратиться в хрупкое олово (ромбические кристаллы) при 161 градусе Цельсия.
Вредное воздействие олова
Олово вызывает проблемы с дыханием при вдыхании.
Олово проявляет свойства раздражителя. Поэтому при попадании на кожу вызывает раздражение глаз и кожи.
Олово вызывает тошноту, рвоту, кашель и одышку.

Олово может вызвать боль. Усталость и тремор.
Высокое потребление неорганической формы олова вызывает анемию.
Потребление олова вызывает проблемы с сердцем и почками.
Знаете ли вы?
Олово — редкий элемент, встречающийся в земной коре.
Олово составляет 2 части на миллион в составе земной коры.
Олово при смешивании с медью образует бронзу (сплав).
Олово (Sn) — Химические свойства, влияние на здоровье человека и окружающую среду
- Дом
- Периодическая таблица
- Elements
- Tin
|

 Главные промышленные применения олова – в белой жести (луженое железо) для изготовления тары, в припоях для электроники, в домовых трубопроводах, в подшипниковых сплавах и в покрытиях из олова и его сплавов. Олово образует различные соединения, многие из которых находят промышленное применение. Наиболее экономически важный оловосодержащий минерал – касситерит (оксид олова). Мировые месторождения касситерита разрабатывают в Юго-Восточной Азии, в основном в Индонезии, Малайзии и Таиланде. Другие важные месторождения касситерита находятся в Южной Америке (Бразилия и Боливия), Китае и Австралии.
Главные промышленные применения олова – в белой жести (луженое железо) для изготовления тары, в припоях для электроники, в домовых трубопроводах, в подшипниковых сплавах и в покрытиях из олова и его сплавов. Олово образует различные соединения, многие из которых находят промышленное применение. Наиболее экономически важный оловосодержащий минерал – касситерит (оксид олова). Мировые месторождения касситерита разрабатывают в Юго-Восточной Азии, в основном в Индонезии, Малайзии и Таиланде. Другие важные месторождения касситерита находятся в Южной Америке (Бразилия и Боливия), Китае и Австралии.
 )
)


 Современные оловянно-свинцовые сплавы содержат 90–97% Sn и небольшие добавки меди и сурьмы для увеличения твердости и прочности. В отличие от ранних и средневековых свинецсодержащих сплавов, современная посуда из cплавов олова безопасна для использования.
Современные оловянно-свинцовые сплавы содержат 90–97% Sn и небольшие добавки меди и сурьмы для увеличения твердости и прочности. В отличие от ранних и средневековых свинецсодержащих сплавов, современная посуда из cплавов олова безопасна для использования. Кроме многочисленных неорганических соединений, атом олова способен к образованию химической связи с углеродом, что позволяет получать металлоорганические соединения, известные как оловоорганические. Водные растворы хлоридов, сульфатов и фтороборатов олова служат электролитами для осаждения олова и его сплавов. Оксид олова применяют в составе глазури для керамики; он придает глазури непрозрачность и служит красящим пигментом. Оксид олова можно также осаждать из растворов в виде тонкой пленки на различных изделиях, что придает прочность стеклянным изделиям (или уменьшает вес сосудов, сохраняя их прочность). Введение станната цинка и других производных олова в пластические и синтетические материалы уменьшает их возгораемость и препятствует образованию токсичного дыма, и эта область применения становится важнейшей для соединений олова. Огромное количество оловоорганических соединений расходуется в качестве стабилизаторов поливинилхлорида – вещества, используемого для изготовления тары, трубопроводов, прозрачного кровельного материала, оконных рам, водостоков и др.
Кроме многочисленных неорганических соединений, атом олова способен к образованию химической связи с углеродом, что позволяет получать металлоорганические соединения, известные как оловоорганические. Водные растворы хлоридов, сульфатов и фтороборатов олова служат электролитами для осаждения олова и его сплавов. Оксид олова применяют в составе глазури для керамики; он придает глазури непрозрачность и служит красящим пигментом. Оксид олова можно также осаждать из растворов в виде тонкой пленки на различных изделиях, что придает прочность стеклянным изделиям (или уменьшает вес сосудов, сохраняя их прочность). Введение станната цинка и других производных олова в пластические и синтетические материалы уменьшает их возгораемость и препятствует образованию токсичного дыма, и эта область применения становится важнейшей для соединений олова. Огромное количество оловоорганических соединений расходуется в качестве стабилизаторов поливинилхлорида – вещества, используемого для изготовления тары, трубопроводов, прозрачного кровельного материала, оконных рам, водостоков и др. Другие оловоорганические соединения используются как сел
Другие оловоорганические соединения используются как сел



 69 g.mol -1
69 g.mol -1  моль -1
моль -1  Оловянные сплавы используются по-разному: в качестве припоя для соединения труб или электрических цепей, олова, колокольного металла, баббита и стоматологических амальгам. Сплав ниобий-олово используется в сверхпроводящих магнитах, оксид олова используется в керамике и в газовых сенсорах (по мере того как он поглощает газ, его электропроводность увеличивается, и это можно контролировать). Оловянная фольга когда-то была распространенным материалом для упаковки пищевых продуктов и лекарств, но теперь ее заменила алюминиевая фольга.
Оловянные сплавы используются по-разному: в качестве припоя для соединения труб или электрических цепей, олова, колокольного металла, баббита и стоматологических амальгам. Сплав ниобий-олово используется в сверхпроводящих магнитах, оксид олова используется в керамике и в газовых сенсорах (по мере того как он поглощает газ, его электропроводность увеличивается, и это можно контролировать). Оловянная фольга когда-то была распространенным материалом для упаковки пищевых продуктов и лекарств, но теперь ее заменила алюминиевая фольга. Основной район добычи находится в оловянном поясе , который идет из Китая через Таиланд, Бриму и Малайзию на острова Индонезии. Малайзия производит 40% олова в мире. Другими важными районами добычи олова являются Боливия и Бразилия. Мировая добыча превышает 140 000 тонн в год, а извлекаемые запасы составляют более 4 миллионов тонн. Оловянные концентраты производятся в объеме около 130 000 тонн в год.
Основной район добычи находится в оловянном поясе , который идет из Китая через Таиланд, Бриму и Малайзию на острова Индонезии. Малайзия производит 40% олова в мире. Другими важными районами добычи олова являются Боливия и Бразилия. Мировая добыча превышает 140 000 тонн в год, а извлекаемые запасы составляют более 4 миллионов тонн. Оловянные концентраты производятся в объеме около 130 000 тонн в год. Триэтилолово — самое опасное органическое оловосодержащее вещество для человека. Он имеет относительно короткие водородные связи. Когда водородные связи станут длиннее, оловянное вещество станет менее опасным для здоровья человека. Люди могут поглощать оловянные связи через пищу, дыхание и кожу.
Триэтилолово — самое опасное органическое оловосодержащее вещество для человека. Он имеет относительно короткие водородные связи. Когда водородные связи станут длиннее, оловянное вещество станет менее опасным для здоровья человека. Люди могут поглощать оловянные связи через пищу, дыхание и кожу.  Органические компоненты олова могут сохраняться в окружающей среде в течение длительного периода времени. Они очень стойкие и плохо поддаются биологическому разложению. Микроорганизмы с большим трудом расщепляют органические соединения олова, накопившиеся на водных почвах в течение многих лет. Из-за этого концентрации органических оловов все еще растут.
Органические компоненты олова могут сохраняться в окружающей среде в течение длительного периода времени. Они очень стойкие и плохо поддаются биологическому разложению. Микроорганизмы с большим трудом расщепляют органические соединения олова, накопившиеся на водных почвах в течение многих лет. Из-за этого концентрации органических оловов все еще растут.