Гальваника. Рецепт электролита и работа с блоком питания. Часть 2
Эта публикация является продолжением моей первой статьи по гальванике. Сегодня мы рассмотрим еще один рецепт электролита, а также работу с блоком питания.
Этот электролит я называю электролитом гладкого меднения. Методика его приготовления такая же, как любого сернокислого электролита и об этом я писала в предыдущей статье. Во всех моих рецептах количество серной кислоты указано в расчете на использование автомобильного аккумуляторного электролита.
Итак, рецепт:
- 200 г медного купороса;
- 140 -145 мл серной кислоты;
- 0,07 г тиомочевины;
- 0,07 г повареной соли (мелкой «экстра»).
Плюсы данного электролита:
1) Хорошее, ровное, досточно блестящее покрытие.
2) Хорошая скорость закрытия и наращивания меди (экономит элетричество).
3) Отлично поддается любой полировке.
Минусы:
1) Достаточно чувствителен к силе тока.
2) Покрытие не слишком пластично, при попытке изменить форму может дать трещины.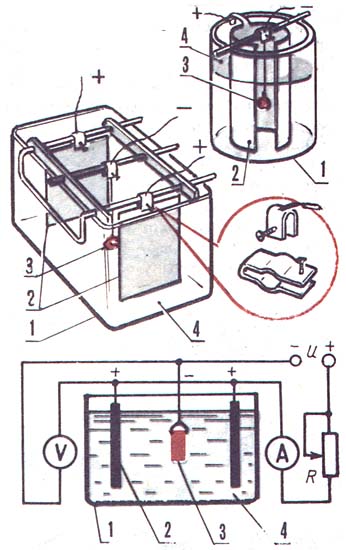
При достаточном количестве тиомочевины и правильно выбранной силе тока должен получиться вот такой листик, гладкий, но имеющий на поверхности тонкую матовую пленку.
Пленка быстро убирается любой полировальной пастой
Если тиомочевины в электролите недостаточно — мы можем получить вот такую интересную мелкокрупитчатую поверхность изделия. Она чуть более блестящая, чем при матовом меднении и лучше поддается полировке. При патинировке на такой поверхности можно добиться интересного слегка перламутрового эффекта. Фото до и после полировки.
А теперь поговорим о самом, пожалуй, важном — ТЕХНИКЕ БЕЗОПАСНОСТИ.
Любые работы с электролитом ОБЯЗАТЕЛЬНО, ВСЕГДА, БЕЗ ИСКЛЮЧЕНИЙ проводятся в перчатках, очках и фартуке. Сейчас буду пугать!
1. Перчатки — тонкие латексные. Буквально через несколько дней работы без перчаток начинают слоиться ногти и сглаживаться папиллярные линии на подушечках пальцев из за чего пальцы теряют чувствительность.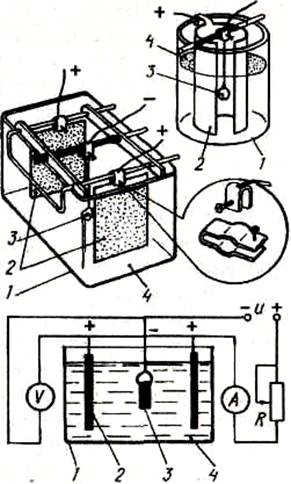 Нам, рукодельницам, это надо?
Нам, рукодельницам, это надо?
2. Очки — строительные, плотно прилегающие к лицу. Поверьте, не раз и не два у вас будет случаться ПЛЮХ!. Кошка под ногу подвернулась, проволочка оборвалась… Химический ожог роговицы — не самое приятное переживание в жизни.
3. Фартук — прорезиненный или клеенчатый, покупается в магазине спецодежды. Электролит очень быстро прожигает дыры в одежде. За первые 2 месяца гальванических работ (еще без фартука) я потратила на домашнюю одежду больше, чем за 10 предыдущих лет. Не думайте, что вам удасться избежать случайного попадания электролита на одежду!
При смешивании электролита очень желательно надеть респиратор или хотя бы влажную марлевую повязку во избежание попадания пыли медного купороса в дыхательные пути.
Гальваническую ванну лучше всего поставить на большой лист пластика. Рядом обязательно должна быть миска с водой. Вынимаем изделие, прополаскиваем в воде и прямо так, в миске, несем к раковине. Не стоит капать кислотой на ламинат.
Даже небольшая ванночка (1-2 л) должна находиться в хорошо проветриваемом помещении. Подоконник отлично подойдет.
Пожалуйста, всегда будьте внимательны и осторожны!!!! Помните, что вы работаете с опасными реактивами!!!
Ну, и в завершение, несколько слов о работе с блоком питания. Иногда люди жалуются, что изготовив по моему рецепту электролит электрохимической полировки, не получают блестящего изделия. Или что при использовании электролита матового меднения структура меди на поверхности получается крупитчатой и осыпается. Это все — ошибки в работе с блоком питания.
Самое главное — у нас должен быть блок питания с вольтметром и амперметром.
Итак, начинаем: сначала мы наш листочек покрыли графитовым лаком в 3 слоя (не экономьте на лаке) и обратили внимание на то, что проволочная намотка на черешке листа тоже покрыта лаком.
Погружаем листочек в ванну и выставляем на БП 0,8-0,9 вольт. Ждем пока на амперметре на появится 0.13-0,15 Ампер и повышаем вольтаж до 1,1 Вольт. Опять ждем, пока на амперметре не покажется 0,35 А. Теперь повышаем вольтаж до рабочей величины.
Опять ждем, пока на амперметре не покажется 0,35 А. Теперь повышаем вольтаж до рабочей величины.
А вот эту саму рабочую величину мы определяем эмпирически. Например, на достаточно крупный березовый лист, опущенный в электролит гладкого меднения нужно подать около 1,6 Вольт.
За полностью закрытым листом внимательно следим.
Изделие блестящее по краям, но матовое в центре — прибавить силу тока. Наоборот: изделие, блестящее в центре, но матовое по краям — силу тока убавить.
При чрезмерной силе тока изделие начинает «пригорать» по краям. На кончиках листьев возникают утолщения и наплывы меди.
Можно использовать этот эффект в декоративных целях, например при изготовлении шапочек для бусин, меднении кристаллов или лэмпворка и т.д. Можно, добившись нужного эффекта, убавить силу тока, чтобы эти наплывы покрылись слоем гладкой меди, для дальнейшей полировки.
А теперь скажите мне, пожалуйста, какая тема вас больше всего интересует (чтобы я знала, о чем писать следующую статью):
1) Восстановление электролита.
2) Полировка и химическое оксидирование.
3) Электрохимическое оксидирование.
Мастер-класс смотреть онлайн: Гальванопластика подручными средствами: часть2. Электролит
Итак, поскольку было немало желающих узнать больше о том, как просто и бюджетно попробовать себя в гальванопластике, пишу продолжение этого мастер-класса: часть 1. В этот раз я расскажу о приготовлении электролита. Мы занимаемся меднением, так что наш электролит состоит из: медного купороса, серной кислоты, воды.
Купить купорос можно в хозяйственных/цветочных/садовых магазинах. Для более серьезного занятия лучше купить химически чистый медный купорос и чистую серную кислоту или готовый сернокислый электролит. При нормальной эксплуатации одного литра (для мелких предметов) вам хватит очень надолго.
Скажу сразу, во избежание вопросов. Да, медный купорос — это отрава. Но для насекомых. Он практически безвреден для млекопитающих, коими, надеюсь, являются читатели сего МК 🙂 . Конечно, руки надо мыть хорошо.
Конечно, руки надо мыть хорошо.
Классический рецепт сернокислой медной ванны (грамм на литр воды):
Серная кислота ……….. 50—70
Растворимость медного купороса снижается по мере увеличения концентрации серной кислоты. То есть концентрацию нужно примерно выжерживать, это не «допуски», это значит что надо стараться делать 200-50 или 250-70.
Это все теория. На практике, искать химически чистые вещества и работать с чистой кислотой — неохота. Так что мы идем в хозяйственный за медным купоросом, а потом в автомагазин за автомобильным электролитом — это вода с серной кислотой. Будьте осторожны! Не прижимайте к себе банку с электролитом, я так однажды лишилась куртки — верхний слой разъело. Можете капнуть электролит на бумажку и посмотреть, как ее сожжет кислота — она почернеет, а может даже рассыпется. После этого вам уже не нужно будет напоминать о технике безопасности 🙂
Итак — в топку теорию — к практике! Когда я первый раз разводила электролит, я сделала так (на 1л):
— разводим 200 г. медного купороса (пачка) в 0.5 л воды
медного купороса (пачка) в 0.5 л воды
— фильтруем полученный раствор (важно!!!!)
— доливаем 134 мл. автомобильного электролита (это две маленькие баночки из-под детского питания по 80 г)
— доводим дистиллированной водой до 1 л. и хорошо перемешиваем.
Теперь, если вы все-таки взяли где-то чистую серную кислоту. ПОМНИТЕ! Наливать только кислоту в воду, а никак не наоборот!!! И ооочень медленно. Иначе вода закипит и все это начнет брызгаться и разбегаться. Но, если у вас готовый автомобильный электролит, то вам это уже не грозит — он достаточно разбавлен. Медный купорос, для лучшего растворения, разводите в теплой воде.
Теперь о фильтрации — это очень важно!. Ведь купорос из хозяйственного магазина очень грязный, содержит примеси различных нерастворимых веществ. Потому профильтровать нужно хорошо. Можно это делать с помощью специальной фильтр-бумаги, если есть. Я делаю так: сначала фильтрую через вату, положенную на влажную салфетку, сверную вдвое. Салфетку нужно сначала выполоскать — она вся в креме или еще неизвестно в чем.
примерно 700 мл раствора (остальное слилось),
примерно 100 мл (93мл) автоэлектролита.
В процессе гальванизации электролит будет испаряться — это испаряется вода. Ее нужно просто иногда понемногу доливать.
Совет: возле вашей установки поставьте миску или банку с водой. Если вам нужно достать-посмотреть изделие, или вы на себя или еще куда-то случайно капнули — вы сможете быстренько ополоснуть это в банке, а потом уже промыть под краном как следует.
Еще совет: если у вас старая облупленная ванна — лучше не занимайтесь приготовлением электролита в ней, а выберете железную, или просто более новую эмалированную раковину. Поверхность без эмали замечательно красится в трогательный голубой цвет медным купоросом. Оттереть можно, но долго, нудно, и неохота.
Тот электролит, что не влезет к вам в емкость, просто налейте в банку, закройте, уберите в шкаф. Может пригодится потом.
Так или иначе — электролит в вашей установке будет загрязняться — его надо фильтровать, например раз в две недели. Пыль нападает, муха залетит, на вашей заготовке что-нибудь налипнет, да мало ли. Наличие примесей приведет к неравномерному осаждению меди.
И последнее на этот раз: существуют «присадки» для придания блеска или «блескообразователи». Они делают металл более хрупким, но изделие получается сразу блестящим, или, по крайней мере, с матовым блеском. Я, к сожалению, пока не могу посоветовать ничего конкретного — еще не разобралась чего и сколько. Но советую вам поискать, как ищу сейчас я. Шкурить столь сложную и тонкую поверхность (например листики) без бормашинки тяжко — блескообразователи могли бы помочь.
Постараюсь в ближайшие дни написать заключение — подготовка образца и сам процесс.
P.S.: По просьбе в комментариях, пишу дополнительно про меры безопасности: кислота хоть и разбавлена, но оставить легкий ожог и испортить любимую рубашку хватит. А вот если еще в глаз попадет…
А вот если еще в глаз попадет…
Так что лучше работать хотябы в очках и перчатках, хотябы при смешивании электролита. Еще неплохо бы фартук, ну, и, разумеется, убрать подальше от детей!! Предлагаю вам просто попробовать действие электролита на разные материалы — капните по капельке, посмотрите что будет. Представьте себя на месте образца. Тогда Вам уже не нужно будет что-то объяснять. 🙂
Приготовление и восстановление электролита меднения для гальваники
Приготовление электролита для осаждения меди
Сернокислые электролиты для меднения делятся на кислые и медные. Кислые это те, в которых кислоты по рецепту больше чем медного купороса. Медные наоборот, кислоты меньше чем медного купороса. Пропорции кислоты и медного купороса выбираются в зависимости от используемого блеска.
Кислые сернокислые электролиты
К кислым относятся добавки Cupracid-TP и J-Plate Cu-400, рецепты электролитов для них описаны ниже.
Рецепты кислых растворов
1. J-Plate Cu-400
J-Plate Cu-400
CuSO4*5h30 — 90 гр./л.
h3SO4 плотность 1,84 гр./см3 — 200 гр./л. или автомобильный аккумуляторный электролит плотностью 1,27 гр./см3 — 540 гр./л. (взвешиваем на весах).
NaCL — 0,125 гр./л.
Добавка J-PLATE CU 400 — 6 мл./л.
Вода до 1 литра.
Плотность тока 0,1-8 А/дм.кв, оптимальное 2-3 А/дм.кв.
Температура 20-30 градусов, скорость осаждения при плотности тока 3 А/дм.кв. равна 0,66 мкм/мин.
2. Cupracid TP
CuSO4*5h30 — 60 гр./л.
h3SO4 плотность 1,84 гр./см3 — 230 гр./л. или автомобильный аккумуляторный электролит плотностью 1,27 гр./см3 — 621 гр./л. (взвешиваем на весах).
NaCL — 0,120 гр./л.
Cupracid TP Leveller / Купрацид ТП выравниватель — 20 мл./л.
Cupracid Brightener / Купрацид ТП блескообразователь — 2 мл./л.
Cupracid Starter / Купрацид стартёр — 2 мл./л.
Вода до 1 литра.
Плотность тока 1,4-3,5 А/дм.кв, оптимальное 2 А/дм.кв.
Температура 20-26 градусов, скорость осаждения при плотности тока 2 А/дм. кв. равна 0.6 мкм/мин.
кв. равна 0.6 мкм/мин.
Медные сернокислые электролиты
К медным относятся добавки Chemeta RV-T, ЦКН-74, Cupracid 210, составы электролитов для них описаны ниже.
Рецепты медных растворов
1. Chemeta RV-T
CuSO4*5h30 — 220 гр./л.
h3SO4 плотность 1,84 гр./см3 — 60 гр./л. или автомобильный аккумуляторный электролит плотностью 1,27 гр./см3 — 162 гр./л. (взвешиваем на весах).
NaCL — 0,09 гр./л.
Добавка Chemeta RV-T — 4 мл./л.
Вода до 1 литра.
Плотность тока 2-8 А/дм.кв, оптимальное 4,5 А/дм.кв.
Температура 20-28 градусов, скорость осаждения при плотности тока 4,5 А/дм.кв. равна 1 мкм/мин.
2. ЦКН-74
CuSO4*5h30 — 150 гр./л.
h3SO4 плотность 1,84 гр./см3 — 80 гр./л. или автомобильный аккумуляторный электролит плотностью 1,27 гр./см3 — 216 гр./л. (взвешиваем на весах).
NaCL — 0,09 гр./л.
Добавка ЦКН-74 — 5-7 мл./л.
Вода до 1 литра.
Плотность тока 1-4 А/дм. кв, оптимальное 3 А/дм.кв.
кв, оптимальное 3 А/дм.кв.
Температура 18-28 градусов, скорость осаждения при плотности тока 3 А/дм.кв. равна 0,6 мкм/мин.
3. Cupracid 210
CuSO4*5h30 — 220 гр./л.
h3SO4 плотность 1,84 гр./см3 — 63 гр./л. или автомобильный аккумуляторный электролит плотностью 1,27 гр./см3 — 170 гр./л. (взвешиваем на весах).
NaCL — 0,12 гр./л.
Добавка Купрацид 210 — 10 мл./л.
Добавка 210 A — 0,5 мл./л.
Добавка 210 Б — 0,5 мл./л.
Вода до 1 литра.
Плотность тока 1-6 А/дм.кв, оптимальное 3 А/дм.кв.
Температура 20-30 градусов, скорость осаждения при плотности тока 3 А/дм.кв. равна 0,7 мкм/мин.
Приготовление электролита меднения с добавкой J-PLATE CU-400
Далее для примера посмотрим приготовление самодельного электролита с добавкой J-PLATE CU-400 на 10 литров.
J-Plate Cu-400 рецепт на 1 литр.
CuSO4*5h30 — 90 гр./л.
h3SO4 плотность 1,84 гр./см3 — 200 гр./л. или автомобильный аккумуляторный электролит плотностью 1,27 гр./см3 — 540 гр./л. (взвешиваем на весах).
NaCL — 0,125 гр./л.
Добавка J-PLATE CU 400 — 6 мл./л.
Вода до 1 литра.
Пересчитаем количество реактивов на 10 литров, получим следующий рецепт для приготовления своими руками электролита гальванического меднения.
CuSO4*5h30 — 900 гр.
h3SO4 плотность 1,84 гр./см3 — 2 кг. или автомобильный аккумуляторный электролит плотностью 1,27 гр./см3 — 5,4 кг. (взвешиваем на весах).
NaCL — 1,25 гр.
Добавка J-PLATE CU 400 — 60 мл.
Вода до 10 литров.
Взвешиваем медный купорос 900 грамм и пересыпаем его в канистру.
Взвешиваем аккумуляторный электролит 5,4 кг и переливаем его в емкость с медным купоросом.
Доливаем в емкость воду до уровня 10 литров.
Данная статья опубликована на сайте whoby.ru. Постоянная ссылка на эту статью находится по этому адресу http://whoby.ru/page/elektrolit-dlja-galvaniki
Читайте статьи на сайте первоисточнике, не поддерживайте воров.
Растворяем полностью медный купорос, путем бултыхания канистры и затем добавляем туда 1,25 грамм соли NaCl.
Далее нужно добавить в раствор активированный уголь из аптеки, из расчета 3 грамм на 1 литр. В нашем случае добавляем 30 грамм, это 12 пачек по 10 таблеток весом 0,25 грамм (фото данного процесса нет).
Хорошо перемешиваем и даем постоять электролиту меднения 2 часа. В течении этого времени нужно изредка перемешивать раствор с интервалом примерно 15 минут.
После того, как пройдет 2 часа, отфильтровать электролит от угля через фильтр.
После фильтрации прирабатываем электролит. Для этого берем фольгированный текстолит (если не жалко) или латунную или медную пластину.
Предварительную приработку электролита меднения нужно проводить в течении 5 часов на плотности тока 0.2 А/дм.кв. В моем случае фольга имела размеры 150х120 мм, площадь которой равна 1,8 дм.кв.
У фольги 4 стороны, значит общая площадь равна 1.8*4 = 7.2 дм. кв. На источнике выставляем ток 7.2*0.2 = 1,44 ампера, опускаем в ванну заготовку и держим там ее в течении 5 часов используя качалку (заготовка поствоянно движется в электролите).
кв. На источнике выставляем ток 7.2*0.2 = 1,44 ампера, опускаем в ванну заготовку и держим там ее в течении 5 часов используя качалку (заготовка поствоянно движется в электролите).
После 5 часов приработки, добавляем в ванну 60 мл блескообразующей добавки J-PLATE CU-400. После тщательного перемешивания прирабатываем электролит меднения на плотности тока 1 А/дм.кв. в течниии 1 часа. На источнике выставляем ток 7.2*1 = 7.2 ампера.
После приработки электролита, проверим его на реальной плате. Для этого активируем текстолит и покрываем его химической медью. Это можно не делать, взять обычный фольгированный текстолит и провести тест на нем (мне жалко портить текстолит для этого, поэтому я сделал так, как описано ниже).
Обезжириваем, затем активируем текстолит.
Покрываем химической медью текстолит.
Погружаем плату в ванну для гальваники, и держим там 50 минут. В результате получаем вот такое покрытием. Если учесть, что это первая гальваника в данном электролите и используемый текстолит не первой свежести (весь поцарапанный), то считаю результат отличный.
Результат работы электролита для гальваники с блеском J-Plate Cu-400
Хочу предоставить несколько фото плат, гальваника медью которых была проведена в этом кислом электролите меднения. Данные фото предоставил mial пользователь форума радиокот, за что ему отдельная благодарность.
Очистка (восстановление) электролита гальванического меднения
В результате работы ванны гальваники, в электролит меднения попадает органика, что приводит к ухудшению работы электролита и появлению некачественных покрытий.
Чтобы избавиться от органики, электролит меднения нужно обработать перекисью водорода и активированным углем.
Делается это так, электролит нагревается до 50 градусов, затем в него добавляется 30% перекись водорода из расчета 3 мл на 1 литр раствора. Все хорошо перемешивается и выдерживается 1 час.
Потом в электролит меднения добавляется активированный уголь из аптеки из расчета 3 грамма на 1 литр раствора. Все перемешивается и выдерживается 1 час, затем электролит фильтруется от угля.
После фильтрации прирабатываем раствор на плотности тока 0,2 А/дм.кв. в течении 2 часов. После добавляем необходимое рецептурное количество блеска и прирабатываем еще раз электролит на плотности тока 1 А/дм.кв в течении 1 часа.
Хочу отметить, что данная процедура восстановления применима для всех рецептов сернокислых электролитов для гальваники.
На этом все, желаю не дырявых штанов и качественных плат.
Статью написал: Admin Whoby.Ru
Еще записи по теме
Самодельная ванна и электролит для гальваники
Способы изготовления печатных плат
Буквально несколько лет назад радиолюбители делали печатные платы на любительском уровне, то есть рисовали проводники будущих дорожек краской с помощью рейсфедеров, спичек и всевозможных приспособлений. Качество печатных плат в итоге было на низком уровне.
Недавно в мир радиолюбительского творчества пришли технологии, ЛУТ (лазерно-утюжная технология) и фоторезист, с помощью которых уровень печатных плат поднялся почти до качества сделанных на производстве.
Но радиолюбителям этого мало и они осваивают методы металлизации отверстий для двухсторонних печатных плат, например технология металлорезиста93 (и тентование, тут будет ссылка на раздел). Что бы заниматься качественной металлизацией печатных плат, нужна хорошая ванна для гальваники, об изготовлении которой пойдет дальше речь.
Ванна для гальваники
Для того чтобы сделать ванну дома:
Покупаем 10 литровый пластиковый контейнер для сыпучих продуктов. Выгибаем из медного прутка крепление для анодов, вставляем его в пазы.
Из медных прутков нарезаем стержни и изгибаем их на концах, затем вешаем их на заранее вставленную анодную рамку.
Качалка
Далее вырезаем из акрила или оргстекла крышку подходящего размера, вырезаем в ней прямоугольный паз для катодной штанги. Чтобы крышка не ездила по ванне, снизу приклеиваем буртики с четырех сторон.
С внешней стороны крышки крепим привод катодной штанги. В данном случае использовался двигатель от микроволновки на 220 вольт, который крутит чашку в камере микроволновки. На него был установлен эксцентрик из алюминия, который будет обеспечивать поступательные движения катодной штанги в процессе работы гальванической ванны.
В данном случае использовался двигатель от микроволновки на 220 вольт, который крутит чашку в камере микроволновки. На него был установлен эксцентрик из алюминия, который будет обеспечивать поступательные движения катодной штанги в процессе работы гальванической ванны.
Также приклеиваем упоры для крепления катодной штанги, которые будут надежно ее удерживать во время работы.
Как все приклеили и собрали, ставим крышку на место.
Катодная штанга
Делаем катодную штангу, вырезаем из того же акрила или оргстекла две заготовки по размеру вырезанного окна в крышке ванны. Затем клеим к каждой фольгированный текстолит, и припаиваем провода, сверлим отверстия под болты.
На одной заготовке сверлим два отверстия по бокам и вкручиваем туда винты диаметром 3 мм., затем обрезаем у них шляпки — это будет ось для движения катодной штанги.
На этой же заготовке сверлим сверху посередине отверстие и также вкручиваем туда винт на 3 мм. — это будет кронштейн для крепления тяги привода.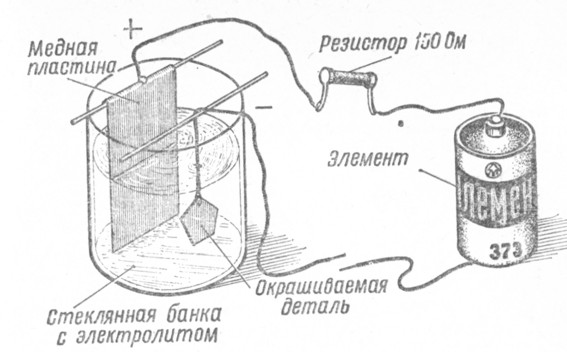
Устанавливаем все на место, в результате получается вот такая компактная ванна для гальваники.
Металлизация отверстий в печатных платах
Прим металлизации отверстий, плату сначала нужно покрыть слоем химической меди, затем нанести слой гальванической меди. Об этом и пойдет речь ниже.
Процесс металлизации отверстий
Сверлим и обрабатываем отверстия, затем обезжириваем плату.
Промываем плату, делаем микротравление в персульфате аммония, затем промываем печатную плату.
После промывки платы опускаем ее в раствор предактивации (NaCl и вода). После предактивации, не промывая плату, опускаем ее в раствор палладиевого активатора на 5..10 минут. После активации промываем плату в проточной воде 1..2 минуты.
Как приготовить такой активатор, написано в этой статье.
После промывки платы делаем ускорение в растворе NaOH 30 сек.. 1 мин, потом промываем плату в проточной воде 1..2 минуты и опускаем плату в раствор химического меднения.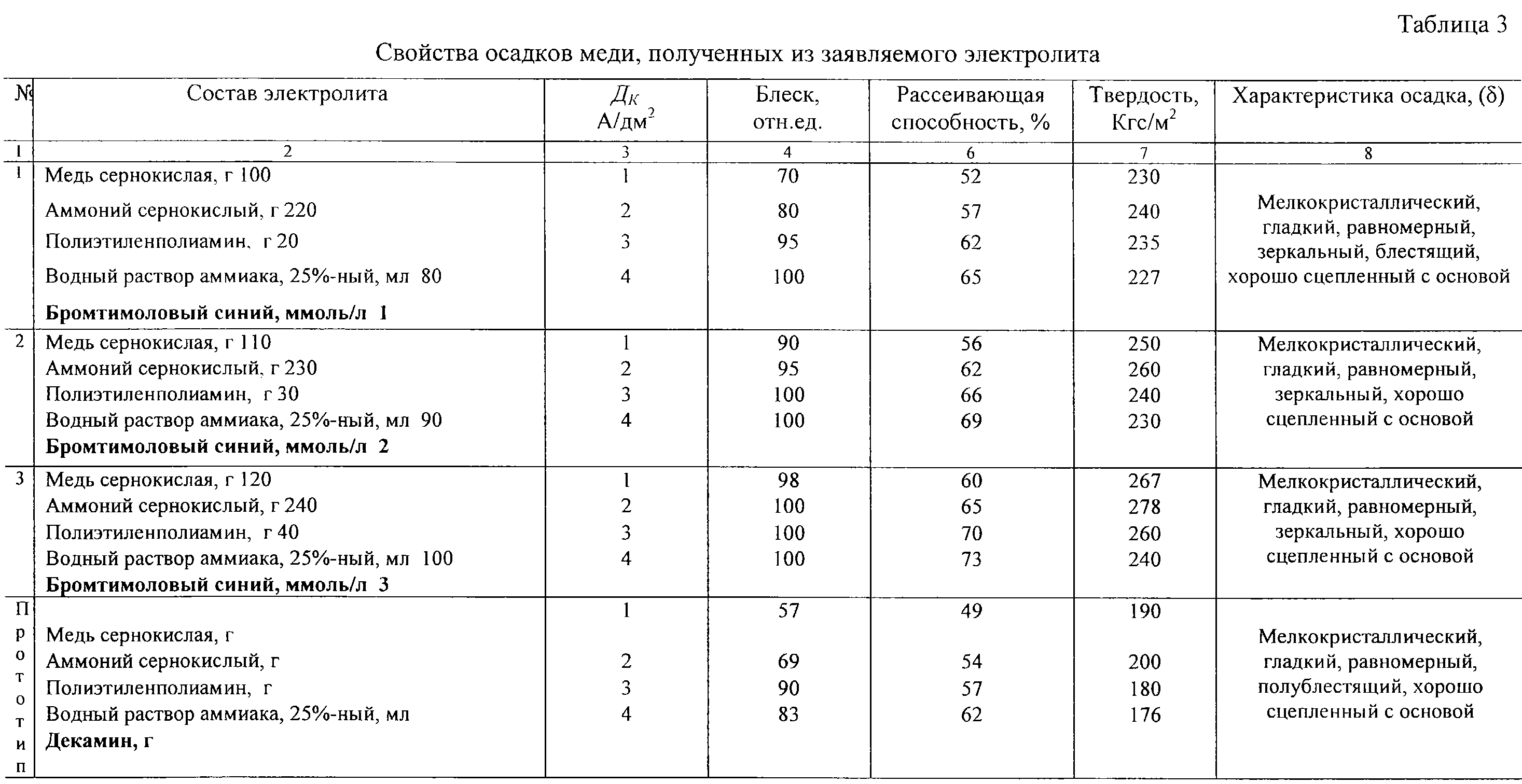 В результате получаем плату с металлизированными отверстиями.
В результате получаем плату с металлизированными отверстиями.
Рецепт раствора для хим. меднения (усиление отверстий) и порядок работы с ним, описан этой статье.
Толщины слоя химической меди недостаточно, для усиления отверстий делаем гальванику медью.
Данная статья опубликована на сайте whoby.ru. Постоянная ссылка на эту статью находится по этому адресу http://whoby.ru/page/vannagalvanik
Читайте статьи на сайте первоисточнике, не поддерживайте воров.
Практические испытания ванны для гальваники
Крепим с помощью болтов печатную плату, подключаем ее к минусу источника, плюс подаем на аноды и начинаем процесс гальваники (металлизацию печатной платы).
Видео работы ванны гальваники.
Электролит для гальваники
Электролит для гальваники готовится по следующему рецепту:
Количество реактивов из расчета на 1 литр раствора.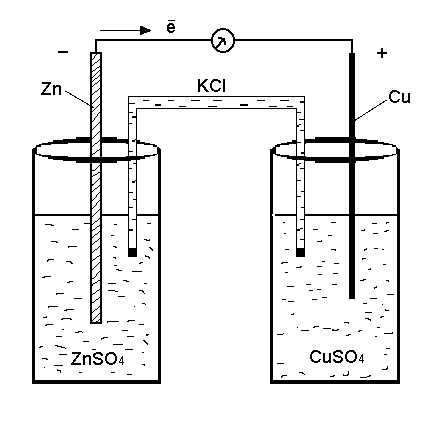 .
.
Медный купорос — 220 гр.
Автомобильный аккумуляторный электролит плотностью 1,27..1,28 — 156 гр. (взвешиваем на весах).
Соль NaCl — 0,09 гр.
Аптечный активированный уголь — 1 пачка.
Блескообразователь Chemeta RV-T — 4 мл.
Готовится электролит следующим образом:
В автомобильный электролит добавляем медный купорос, добавляем соль NaCl и доводим объем раствора до нужного горячей (90 градусов) дистиллированной водой. Растворяем медный купорос, как только растворится, добавляем в этот раствор активированный уголь и оставляем раствор на 1 час, периодически перемешивая. Затем фильтруем его от активированного угля. Как только отфильтровали, добавляем блескообразователь, электролит для гальваники готов. Температура электролита при работе 18..25 градусов.
Например: Нужно приготовить 10 литров раствора для гальваники, для этого берем 156*10 = 1,56 кг. автомобильного электролита, добавляем туда 220*10 = 2,2 кг.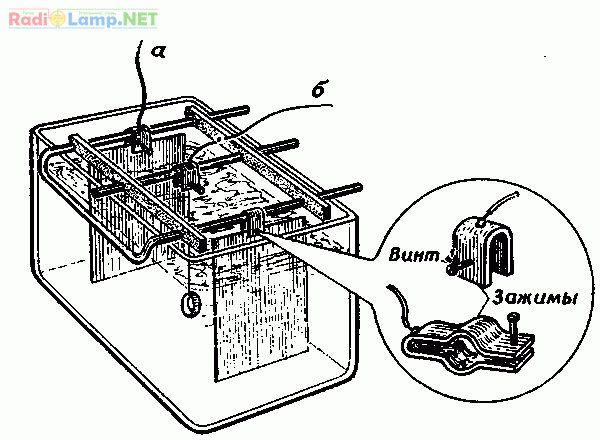 медного купороса и 10*0,09 = 0,9 грамма хлорида натрия (NaCl). Доводим объем раствора до 10 литров дистиллированной водой (вода горячая 90..100 градусов для лучшего растворения медного купороса, важно: не добавляем 10 литров воды, а доводим до 10 литров объем раствора).
медного купороса и 10*0,09 = 0,9 грамма хлорида натрия (NaCl). Доводим объем раствора до 10 литров дистиллированной водой (вода горячая 90..100 градусов для лучшего растворения медного купороса, важно: не добавляем 10 литров воды, а доводим до 10 литров объем раствора).
Затем растворяем медный купорос, как только растворилось, добавляем туда активированный уголь 1*10 = 10 пачек и хорошо перемешиваем. Оставляем раствор на 1 час, периодически перемешивая. Фильтруем от угля и добавляем блескообразователь 4*10 = 40 мл. Электролит готов к применению.
Уголь здесь нужен для удаления органики из раствора, если им не очищать раствор, то блескообразователь быстро испортится в приготовленном растворе и придется добавлять его по новой, с предварительной очитской углем.
В качестве блескообразователя можно использовать желатин или этиловый спирт (сколько нужно добавлять, ищите в интернете, рецептов много), но качество блеска и покрытия будет немного хуже.
Процесс гальваники длился ровно 1 час.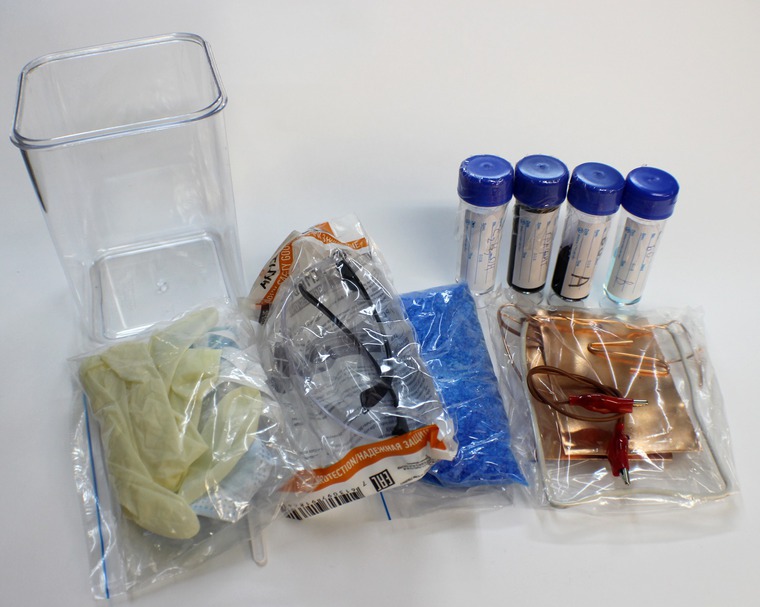
После чего снимаем плату с катода, промываем от электролита меднения водой. Затем, чтобы медь не окислялась, опускаем плату на 20..30 секунд в слабый раствор серной кислоты, также можно использовать для этого автомобильный аккумуляторный электролит.
Итоги металлизации отверстий
Фотки платы с обеих сторон где видно качество покрытия металлизации отверстий.
Как видите результат металлизации печатной платы для домашних условий отличный. Ванна для гальваники и электролит гальванического меднения справились со своей задачей на пятерку.
В данной статье также были использованы изыскания пользователя mial по теме Металлизации отверстий с форума Радиокот.
Всем зеркальных дорожек.
Автор статьи: Admin Whoby.Ru
Еще записи по теме
Процесс химической металлизации печатных плат и диэлектриков
Рецепт раствора для активации диэлектриков
В этой статье я вам расскажу вам как приготовить простой раствор для активации печатных плат или каких либо других диэлектриков. Также покажу на примере порядок работы с данным активатором диэлектриков.
Также покажу на примере порядок работы с данным активатором диэлектриков.
Приготовление активатора
Рецепт раствора на 0,5 литра
Серебро — 0,1..0,2 гр
Кальцинированная сода — 1,5..2 гр
Азотная кислота (конц.) — 1 мл
Аммиак 25% — 5 мл (или аптечный 10% — 15 мл)
Дистиллированная вода — 500 мл
Берем серебро, так как я взял ювелирную цепочку, то в ней содержится медь, поэтому было взято 0,24 грамма. Если серебро чистое, то берите 0,1..0,2 грамма. На весах не отображается 0, поэтому кажется что взято 7,24 грамма, не обращайте внимания.
Растворяем серебро в разбавленной 1:1 азотной кислоте (1 мл кислоты + 1 мл воды).
Взвешиваем 1,5 грамма кальцинированной соды.
Растворяем кальцинированную соду в 5 мл воды, затем набираем раствор в шприц и добавляем его к раствору растворенного серебра в азотке. Добавляем потихоньку, так как в результате реакции выделяется углекислый газ и происходить бурное шипение.
После добавления кальцинированный соды к серебру, получаем вот такой мутный раствор. К данному раствору приливаем 5 мл 25% аммиака или 15 мл аптечного 10% аммиака.
В результате реакции с аммиаком, раствор станет прозрачным и бесцветным (если использовалось чистое серебро). Из за того было применено ювелирное серебро, то в составе его присутствует медь, она то и дала раствору этот синий оттенок. Присутствие меди в растворе, никак не влияет на его активирующие способности, можно не обращать на это внимание.
Наливаем в емкость 500 мл воды и переливаем туда получившийся аммиачный комплекс серебра. Хорошо перемешиваем и активатор готов к применению.
Приготовление раствора сенсибилизации
Сенсибилизатор — это неотъемлемая часть процесса химической металлизации. Раствор сенсибилизации приготавливается на основе хлорида олова и соляной кислоты.
Так как раствор хлорида олова долго не живет, в нем двухвалентное хлорное олово окисляется до четырехвалентного буквально за короткое время, то его нужно модернизировать и исключить процесс окисления.
Для этого в раствор хлорида олова добавляется соль NaCL с избытком.
Рецепт устойчивого раствора сенсибилизации:
SnCl2*2h3O (хлорид олова) — 25 гр
NaCL — 110 гр
HCL (конц) — 25 мл
Дистиллированная вода — 500 мл
Взвешиваем 110 грамм хлорида натрия (NaCL) и растворяем его в 500 мл воды.
Берем 25 грамм хлорида олова, растворяем его в 25 мл соляной кислоты. Ставим раствор на водяную баню и держим на ней до того момента, когда он станет прозрачным.
Затем смешиваем оба раствора и получаем стабильный раствор сенсибилизации, который будет использоваться в процессе химической металлизации при изготовлении печатных плат или металлизации каких либо диэлектриков, пластмасс и т.д. Время жизни этого раствора 3 года и более.
На следующих фото видно две емкости, одна с активатором на основе аммиачного комплекса серебра и вторая это раствор сенсибилизации. В растворе сенсибилизации на дне видно не растворившуюся соль NaCL. Избыток соли в растворе как раз и способствует прекращению окислению хлорида олова и долгой жизни данного раствора.
Избыток соли в растворе как раз и способствует прекращению окислению хлорида олова и долгой жизни данного раствора.
Данная статья опубликована на сайте whoby.ru. Постоянная ссылка на эту статью находится по этому адресу http://whoby.ru/page/aktivacija-dielektrika
Читайте статьи на сайте первоисточнике, не поддерживайте воров.
Процесс химической и гальванической металлизации
Чтобы правильно сделать металлизацию отверстий в печатных платах или покрыть диэлектрик металлом, нужно придерживаться определенного порядка выполнения всех процедур в процессе металлизации, о котором пойдет речь ниже.
Химическая металлизация или металлизация диэлектриков включает в себя:
- Обезжиривание
- Сенсибилизация
- Активация
- Ускорение
- Химическое меднение
- Гальваническое меднение
Обезжиривание поверхности печатной платы
Обезжириваем печатную плату в растворе обезжиривания, как пользоваться и рецепт которого можно посмотреть в этой статье по этой ссылке
Сенсибилизация поверхности
После обезжиривания, промываем плату в воде и делаем микротравление меди в растворе персульфата аммония и серной кислоты. Это делается для того, чтобы после гальваники медью, была хорошая адгезия гальванической меди к меди, которая была на текстолите.
Это делается для того, чтобы после гальваники медью, была хорошая адгезия гальванической меди к меди, которая была на текстолите.
После сенсибилизации промываем плату в проточной воде.
Активация и ускорение поверхности печатной платы
После промывки в воде, погружаем плату в раствор активации, затем промываем в воде и погружаем в раствор ускорения.
Состав раствора ускорения:
NaOH — 20 гр
Дистиллированная вода — 1 литр
После ускорения промываем плату в проточной воде. На этом этап активации диэлектрика можно считать завершенным.
Химическое меднение и гальваническое меднение
После активации диэлектрика, нужно сделать химическое меднение, рецепт раствора можно посмотреть в этой статье.
Затем нужно сделать гальваническое меднение в специальном электролите. Как сделать такой раствор можно посмотреть по этой ссылке.
Ванну для гальваники можно сделать самому, посмотреть как ее сделать можно тут.
В данном видео показан процесс химического и гальванического меднения печатной платы после ее активации в аммиачном комплексе серебра.
Фото после химического меднения, декапирование в 10% серной кислоте перед гальваникой и плата после гальванического меднения.
Несколько фото, демонстрирующее качество металлизации отверстий
Общий вид печатной платы с металлизацией отверстий, тест на отслоение меди (адгезию) и увеличенный вид отверстий диаметром 0,4 мм.
Контактное выделение серебра на меди
В данном видео показано как серебро контактно выделяется (осаждается) на поверхность меди. Многие боятся этого, мотивируя тем, что потом серебро будет мигрировать в диэлектрик и тем самым уменьшать сопротивление переходов.
Решать вам, делать платы этим активатором или нет, но я нигде не нашел обширного исследования подобной миграции серебра и ухудшение качества печатной платы из за этого. Тем более, платы (медь) покрывают серебром и ни чего никуда не мигрирует и это при том, что слой серебра там намного толще.
Тем более, платы (медь) покрывают серебром и ни чего никуда не мигрирует и это при том, что слой серебра там намного толще.
Активация и химическая металлизация диэлектриков
В этом видео показано как можно металлизировать диэлектрик (в данном случае текстолит) используя данный раствор активации. Если по каким то причинам вы все таки решили не использовать серебро для металлизации отверстий в печатных платах, то этот раствор подойдет для активации, химической, затем гальванической металлизации любых диэлектриков, металлизировать которые вы захотите.
Пишите что вы думаете о таком активаторе на серебре? Планируете ли вы его использовать для печатных плат? Боитесь ли вы миграции серебра? Если у вас положительный или отрицательный опыт использования активатора на аммиачном комплексе серебра?
На этом заканчиваю, всем переходов без миграции и качественных металлизированных покрытий.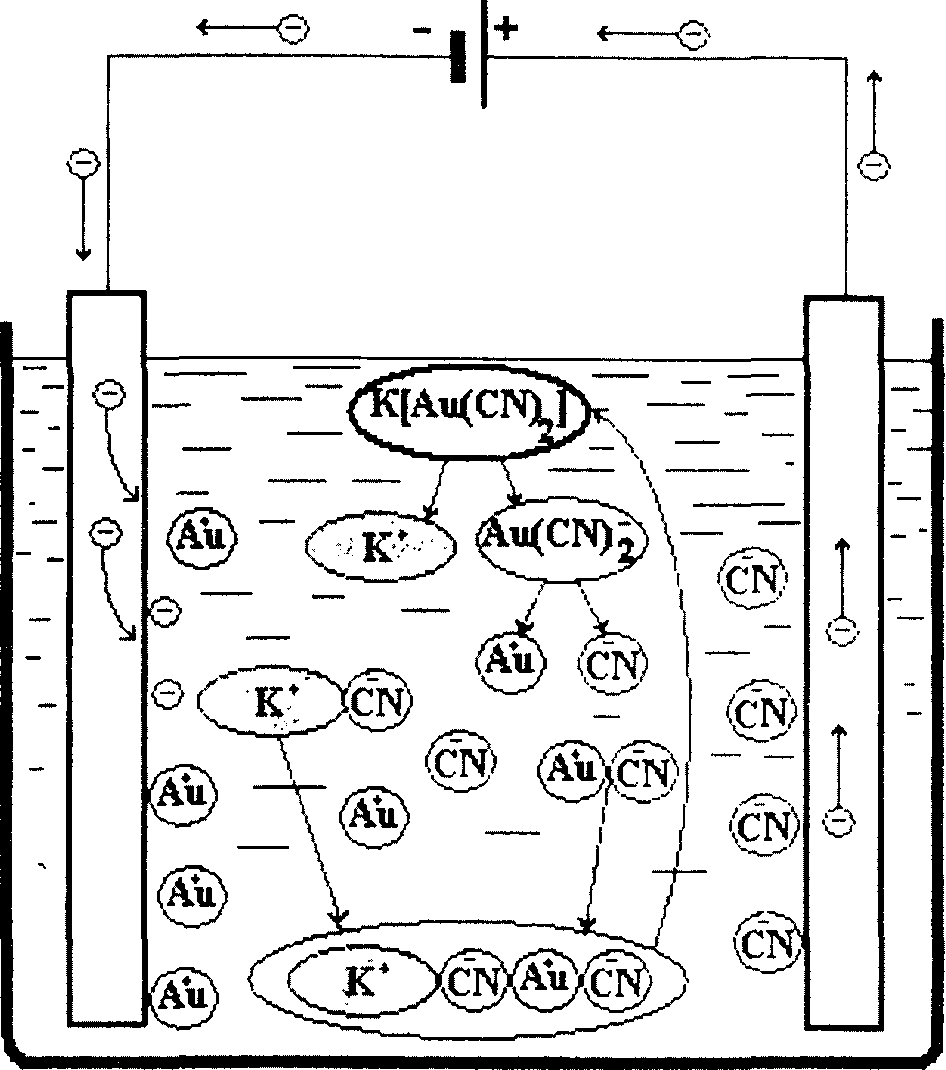
Автор статьи: Admin Whoby.Ru
Еще записи по теме
Гальваника дома. Советы и рецепты
Гальваникой часто занимаются мастера хендмейда, делающие сувениры для души или на продажу. Распространено омеднение неметаллических предметов: керамических поделок, ракушек, птичьих перышек, листиков, веточек с деревьев, цветов, желудей и т.п.
Советы
Для того, чтобы загальванизировать неметаллический предмет, его следует покрыть токопроводящим слоем. Для бытовых условий лучше всего подходит графитовый лак в форме спрея. Для создания графитового слоя достаточно обрызгать предмет со всех сторон, высушить в течение 15-30 минут и несколько раз повторить процедуру.
Для создания двустороннего равномерного покрытия нужно использовать два анода, разместив предмет для гальванизации между анодами. Толщина покрытия зависит от времени, в течение которого предмет будет находиться в электролите. Чем дольше длится гальванирование, тем толще получится слой металла на поверхности.
Перед гальванированием металлической детали ее нужно тщательно очистить от пыли, мелких заусенцев, тщательно обезжирить и высушить.
После того, как предмет загальванизирован, его нужно промыть в чистой воде, после чего можно брать в руки.
Рецепты электролитов
Для омеднения чаще всего применяют серный электролит, состоящий из медного купороса и серной кислоты. Серная кислота улучшает электропроводимость раствора. Дополнительно вводятся различные добавки, которые стабилизируют электролит, делают покрытие более блестящим (если нужно). Ввод блескообразователей позволяет получить зеркальную глянцевую поверхность без последующей механической обработки готового покрытия. Но одновременно, делает покрытие хрупким, не эластичным.
Все используемые реактивы должны быть максимальной химической чистоты, т. к. примеси могут ухудшить процесс гальванирования и качество получаемого покрытия.
- Для матового эластичного покрытия на 1 л раствора потребуется:
- 200 г сухого порошка медного купороса (желательно очищенного, категории ч или хч)
- 160 г серной кислоты
- 1,5 мл этанола (можно отмерить шприцом) или фенола
- 2-4 крупинки гранулированного желатина
Для приготовления электролита сначала нагревается пол литра дистиллированной воды до температуры около +80 °С, в воде растворяется медный купорос, раствор процеживается. В него добавляется серная кислота, потом объем раствора доводится до 1 л. Добавляются все остальные ингредиенты, затем раствор на несколько часов ставится остывать и отстаиваться.
В него добавляется серная кислота, потом объем раствора доводится до 1 л. Добавляются все остальные ингредиенты, затем раствор на несколько часов ставится остывать и отстаиваться.
Омеднение по данному рецепту будет матовым, но зато перышко или листик с дерева можно гнуть или придать ему нужную форму, нагрев изделие. Если хочется, то изделию можно придать глянцевый блеск тщательной шлифовкой, но иногда это сделать сложно, нужны специальные приспособления, например, гравер.
- Рецепт для получения блестящего медного покрытия. На 1 л раствора надо:
- 200 г медного купороса
- 130 г серной кислоты
- 1 капля унитиола (продается в аптеках)
- примерно 0,07 г тиомочевины
- 0,05 г поваренной соли
Покрытие получится блестящим, но не подходит для гнущихся предметов. Этот вид электролита можно использовать для получения полированного финишного покрытия не только для сувениров, но и для технических деталей.
Гальваническое травление. Безопасный способ
С помощью гальванического процесса можно не только покрывать поверхность детали тонкой металлической пленкой, но и вытравливать рисунки на металлической поверхности (лезвие ножа, столовый прибор, что-либо другое). Гальваническое травление позволяет получить рисунки с четкими очертаниями, гладкими краями и глубиной одинаковой величины. Для этого потребуется тоже самое оборудование, что и для гальванирования, но в данном процессе анодом будет выступать протравливаемая деталь. Обычно таким способом вытравливают поверхности из нержавеющей, устойчивой к кислотам стали, которую сложно или даже невозможно травить химическим способом.
Процесс травления:
- деталь тщательно отполировать, промыть, обезжирить (например, спиртом), слегка нагреть, нанести на нее слой воска; по воску выполнить желаемый рисунок, процарапывая воск до металла;
- предмет и медную пластину укрепить на штангах в гальванической ванне так, чтобы рисунок был обращен к медной пластине; расстояние между деталью и пластиной — около двух сантиметров;
- залить в емкость насыщенный раствор поваренной соли (4 столовые ложки на 1 л дистиллированной воды), подключить источник тока (например, зарядное устройство от мобильного телефона), плюсовый контакт на деталь, минусовый — на медную пластину;
- подождать примерно 40 минут;
- вынуть деталь, промыть в воде, нагреть и удалить воск.
Вместо воска можно использовать лак для ногтей, битумный лак или специальную грунтовку. Вместо соли — химически чистый медный купорос. Вместо медной пластины можно взять предмет из стали или железа, например, саморез, гвоздь.
Эта технология подходит не только для стальных поверхностей, но и для предметов из цинка, никеля, меди, латуни. Но для них требуются другие химикаты, гораздо более вредные, поэтому в домашних условиях их не используют.
Руководство по избирательному нанесению гальванических покрытий и гальванических покрытий
Бесплатная цитата 717.767.6702- Преимущества
- Покрытия
- Сплав
- Анодирование и покрытие подложки
- Медь
- Золото
- Никель
- Услуги по нанесению никель-бора
- Никель, нанесенный химическим способом
- Черный никель, нанесенный методом химического восстановления
- Покрытие иммерсионным никелем, нанесенное методом химического восстановления
- Палладий
- Палладий Никель
- Платина
- Драгоценные металлы
- Родий
- Рутений
- Серебро
- Олово
- цинк
- Цинк-никель
- Основные материалы
- Керамика и стекло
- Медь
- Экзотические материалы
- Легкие металлы
- Алюминий
- Магний
- Титан
- PH Нержавеющая сталь
- Пластмассы
- АБС-пластик
- АБС-пластик пластик
- PPA Пластмассы
- Пластмасса SLS
- SLA Пластмассы
- Огнеупорные металлы
- молибден
- Ниобий
- Вольфрам
- Нержавеющая сталь
- Сталь
- Методы покрытия
- Обшивка ствола
- Никелирование методом химического восстановления
- Стоимость электрохимического никелирования
- Гальваника стойки
- Услуги по нанесению покрытий на тяжелые конструкции
- Дополнительные услуги
- Подготовка поверхности
- Абразивоструйные системы
- Очистка содой
- Взрывная струя
- Вибрационное удаление заусенцев
- Дробеструйная очистка стали
- Абразивоструйные системы
- Консультации
- Погружная мойка
- Массовая чистовая обработка
- Микропроизводство
- Пассивный
- Очистка деталей
- Ультразвуковые шайбы
- Мойки непрерывного действия
- Разработка процессов
- Прототипирование
- Тестирование
- Испытания на изгиб
- Поперечное сечение
- Тепловые испытания
- Услуги по вакуумной пропитке
- Подготовка поверхности
- Около
Гальваника на непроводящие материалы | SPC
Бесплатная цитата 717.767,6702- Преимущества
- Покрытия
- Сплав
- Анодирование и покрытие подложки
- Медь
- Золото
- Никель
- Услуги по нанесению никель-бора
- Никель, нанесенный химическим способом
- Черный никель, нанесенный методом химического восстановления
- Покрытие иммерсионным никелем, нанесенное методом химического восстановления
- Палладий
- Палладий Никель
- Платина
- Драгоценные металлы
- Родий
- Рутений
- Серебро
- Олово
- цинк
- Цинк-никель
- Основные материалы
- Керамика и стекло
- Медь
- Экзотические материалы
- Легкие металлы
Рекомендации по сточным водам при гальванике | Нормы сброса
EPA обнародовало правила по нанесению гальванических покрытий (40 CFR Part 413) в 1974 году и внесло в него поправки в 1977, 1979, 1981 и 1983 годах.Регламент применяется к определенным предприятиям, которые сбрасывают свои отходы в POTW . Требования включены в разрешения или другие механизмы контроля для косвенных выбросов (см. Программу предварительной обработки).На этой странице:
Что такое гальваника?
Гальваника: нанесение покрытия на поверхность (обычно электроосаждением) для обеспечения защиты от коррозии, износостойкости или эрозионной стойкости, антифрикционных характеристик или в декоративных целях.Гальваника обычных металлов включает процессы, в которых основной материал из черных или цветных металлов наносят гальваническим покрытием из меди, никеля, хрома, цинка, олова, свинца, кадмия, железа, алюминия или их комбинаций. Гальваника на драгоценные металлы включает процессы, в которых основной материал из черных или цветных металлов покрывается золотом, серебром, палладием, платиной, родием или их комбинациями.
обслуживаемых объектов
Регламент применяется к процессам нанесения металлических покрытий на поверхности путем электроосаждения, которые применялись до 15 июля 1983 г. на предприятиях, которые сбрасывают свои отходы в POTW.Это включает в себя как независимые (рабочие) производители пластин, так и вспомогательные операции, связанные с изготовлением и сборкой продукта.
Покрытие металлов в соответствии с директивами по сбросам
— Нажмите, чтобы увеличить Примечание: Процессы, которые начали работать в эту дату или после этой даты, на косвенных сбросах косвенных сбросах Сооружение, сбрасывающее загрязнители на государственные очистные сооружения (муниципальные очистные сооружения) ., подпадают под категорию «Обработка металлов», 40 CFR Part 433.Все с прямым сбросом с прямым сбросом Точечный источник, сбрасывающий загрязняющие вещества в воды США, такие как ручьи, озера или океаны. гальваники также входят в категорию «Обработка металлов».
Заводы, подпадающие под действие правил по нанесению гальванических покрытий, расположены по всей территории Соединенных Штатов, но сосредоточены в промышленно развитых регионах. Стандарты предварительной обработки применяются к объектам семи подкатегорий:
- Обычные металлы
- Драгоценные металлы
- Анодирование
- Покрытия
- Химическое травление и фрезерование
- Электролитическое нанесение покрытия
- Печатная плата
Регулируемые загрязнители
Стандарты имеют определенные числовые ограничения для каждой подкатегории и налагаются на загрязнители, которые могут мешать, проходить или иным образом быть несовместимыми с POTW.Для заводов с суточным расходом 38 000 литров (10 000 галлонов) в день или более стандарты предварительной обработки конкретно ограничивают косвенные выбросы цианида и следующих металлов: свинца, кадмия, меди, никеля, хрома, цинка и серебра. Кроме того, эти правила ограничивают «общий выброс металла», который определяется как сумма индивидуальных концентраций меди, никеля, хрома и цинка. Для предприятий с ежедневным расходом технологических сточных вод менее 38 000 литров (10 000 галлонов) эти стандарты ограничивают только свинец, кадмий и цианид.
Начало страницы
Руководство и сопутствующие документы
- Скачать публикации
- Нормативное определение процесса подготовки поверхности PreKote (апрель 2003 г.)
- Информация о злоупотреблении диметилдитиокарбаматом натрия (Меморандум, июнь 2000 г.)
- Руководство по внедрению стандартов предварительной обработки токсичных органических веществ (Сентябрь 1985 г.)
- Руководство по стандартам предварительной обработки гальванических покрытий и металлической отделки (февраль 1984 г.)
Руководство полезно контролирующим органам при ответе на большинство обычных запросов от регулируемых производителей, включая запросы на определение категории.В нем обсуждается формула комбинированного потока отходов применительно к интегрированным объектам.
История соответствия нормам
1983 Поправка
- Документы, в том числе:
- Окончательное правило: Категории металлической отделки и гальваники (15 июля 1983 г.)
- Предлагаемое правило: Категории металлической отделки и гальваники (31 августа 1982 г.)
1981 Поправка
Исправленный PSES
- Документы, в том числе:
- Окончательное решение (28 января 1981 г.)
- Предлагаемое правило (3 июля 1980 г.)
1979 Поправка
Исправленный PSES
- Документы, в том числе:
- Окончательное правило (7 сентября 1979 г.)
- Документ для разработки
Описание отрасли, характеристика сточных вод, технологии очистки, оценка затрат на соответствие нормативным требованиям и нагрузки загрязняющих веществ для окончательного правила
- Документ для разработки
- Приостановление работы PSES (4 мая 1979 г.)
- Предлагаемое правило (14 февраля 1978 г.)
- Окончательное правило (7 сентября 1979 г.)
Поправка 1977 г.
Установленные требования PSES
- Документы, в том числе:
- Временное окончательное правило (12 июля 1977 г.)
- Предлагаемое правило (24 апреля 1975 г.)
- Предлагаемое правило (28 марта 1974 г.)
1976 Подвеска
- Приостановление действия BPT (3 декабря 1976 г.)
Поправка 1975 г. («Этап II»)
Пересмотренный BPT для Подчасти A; установлен BPT для подразделений B, D, E, F
- Временное окончательное правило (24 апреля 1974 г.)
1974 Первоначальное нормотворчество («Фаза I»)
Установленные требования BPT, BAT, NSPS и PSNS для Подчасти A
- Окончательное решение (28 марта 1974 г.)
- Предлагаемое правило (5 октября 1973 г.)
Дополнительная информация
Для получения дополнительной информации о правилах очистки сточных вод при гальванике, пожалуйста, свяжитесь с Ахмаром Сиддики ([email protected]) или 202-566-1044.
Начало страницы
Электролиз / Электрохимия — —— GCE Study Buddy ——
| Неэлектролиты | Слабые электролиты | Сильные электролиты |
| Органические жидкости или растворы | Слабые кислоты и щелочи | Сильные кислоты, щелочи и растворы солей |
| этанол C 2 H 5 OH тетрахлорметан CCl 4 трихлорметан 2 CHCl 3 чистая вода раствор сахара C 12 H 22 O 11 расплавленная сера S | известковая вода Ca (OH) 2 раствор аммиака NH 3 водный раствор этаноновой кислоты CH 3 COOH водная сернистая кислота 2 SO 3 водный раствор угольной кислоты H 2 CO 3 | водный раствор серной кислоты H 2 SO 4 905 29 водная азотная кислота HNO3 водная соляная кислота HCl водный гидроксид калия KOH водный раствор гидроксида натрия NAOH раствор сульфата меди (II) Cu S O 4 |
Электролиз 975 расплавленных соединений / Водные ионные соединения проводят электричество, потому что ионы могут свободно перемещаться.
В твердом состоянии эти ионы удерживаются в фиксированном положении в кристаллической решетке.
Следовательно, твердые ионные соединения не проводят электричество. При электролизе расплавленного бинарного соединения на катоде образуется металл, а на аноде — неметалл. Пример
Электролиз расплавленного PbBr 2 Для получения расплавленного бромида свинца (II), PbBr 2 , твердое вещество сильно нагревают до плавления.Для его электролиза пропустите ток через расплавленный PbBr 2 .
Что происходит:
Присутствующие ионы: Pb 2+ и Br —
Реакция на аноде
Br- теряет электроны на аноде, превращаясь в атомы Br. Атомы Br образуют связь вместе, образуя газ Br2.
2Br — (водн.) -> Br 2 (г) + 2e —
Реакция на катоде
Pb 2+ получает электроны на катоде, превращаясь в атомы Pb, превращаясь в жидкий свинец ( II).
Pb 2+ (водн.) + 2e — -> Pb (l)
Общее уравнение
PbBr 2 (l) -> Pb (l) + Br 2 (г )
Электролиз водного раствора
- Водные растворы содержат дополнительные ионы H + и OH — воды, всего 4 иона в растворе:
- 2 из электролита, 2 из воды.
- Только 2 из них разряжены.
- Электролиз водных растворов использует теорию селективного разряда .
На катоде
- В растворах соединения никель / свинец КОНЦЕНТРИРОВАННЫЕ никель / свинец будет выделяться вместо ионов водорода воды, которая менее реактивна, чем никель / свинец.
- В растворах ОЧЕНЬ РАЗБАВЛЕННЫЙ предпочтительно отводить ионы водорода, меди и серебра, поскольку они легко выводятся.
- Реактивные ионы (калий, натрий, кальций, магний, алюминий) НИКОГДА НЕ ВЫПУСКАЮТСЯ ни в концентрированном, ни в разбавленном состоянии.Вместо этого ионы водорода из воды будут выводиться на катод.
На аноде
- В растворах КОНЦЕНТРИРОВАННЫХ предпочтительно отводить ионы йода / хлора / брома, хотя отводить их труднее по сравнению с ионами гидроксида.
- В растворах VERY DILUTE , содержащих иодид / хлорид / бромид-ионы, гидроксид-ионы воды будут выделяться вместо иодида / хлорида / бромида, в зависимости от легкости разряда.
- Сульфат и нитрат НИКОГДА НЕ ВЫПУСКАЙТЕ в концентрированных / разбавленных растворах.
Примеры
A. Концентрированные растворы
Электролиз концентрированного NaCl Что происходит:
Присутствие ионов: Na + , H 906 + 23, —
Реакция на аноде
- Cl — теряет электроны на аноде, превращаясь в атомы Cl, хотя OH — легче разряжается.
- Атомы Cl образуют ковалентную связь вместе, образуя газ Cl 2 .
- 2Cl — (водн.) -> Cl 2 (г) + 2e —
Реакция на катоде
- H + получает электроны на катоде, превращаясь в атомы водорода, превращаясь в газообразный водород
- 2H + (вод.) + 2e — -> H 2 (л)
Общее уравнение 2HCl (л) -> H 2 (л) + Cl 2 (g)
Примечание: любые катионы и анионы, оставшиеся не разряженными в растворе, образуют новые связи между собой.
Например. в приведенном выше примере остатки Na + и OH — объединяются с образованием NaOH.
B. Сильно разбавленные растворы
Электролиз разбавленного h3SO4
Что происходит:
Присутствие ионов: H + , OH 90 SO622
423 и 90-90
Реакция на аноде
- OH- теряет электроны на аноде, превращаясь в O 2 и H 2 O.
- 4OH — (водный) -> O 2 (г) + 2H 2 O (l) + 4e —
Реакция на катоде
- H + получает электроны на катоде превращается в атомы H, превращаясь в газообразный водород.
- 2H + (вод.) + 2e — -> H 2 (g)
Общее уравнение
- Сначала необходимо сбалансировать оба уравнения.
- Уравнение катода короткое 2 электрона.Следовательно, мы должны сначала выровнять их, умножив уравнение катода на 2.
- (2H + (aq) + 2e — -> H 2 (g)) x 2 = 4H + (aq ) + 4e — -> 2H 2 (g)
- Теперь мы можем объединить уравнения, образуя:
- 4H + (водн.) + 4OH + (водн.) -> 2H 2 (г) + O 2 (г) + 2H 2 O (л)
- Ионы 4H + и 4OH + , однако, объединяются с образованием молекул 4H 2 O.
- Отсюда: 4H 2 O (л) -> 2H 2 (г) + O 2 (г) + 2H 2 O (л)
- H 2 молекул O формируются с двух сторон.
- Следовательно, они отменяют коэффициенты: 2H 2 O (l) -> 2H 2 (g) + O 2 (g)
- Поскольку электролизуется только вода, серная кислота теперь только становится сосредоточенным.
Электролиз с использованием различных типов электродов
- Инертные электроды — это электроды, которые не вступают в реакцию с электролитом или продуктами во время электролиза.
- Напр. платина и графит.
- Активные электроды — это электроды, которые реагируют с продуктами электролиза, влияя на ход электролиза.
A. Электролиз CuSO 4 с использованием инертных электродов (например, угля)
Что происходит:
Присутствие ионов : Cu 2+ , H + , OH — и SO 4 2- Реакция на аноде
- OH — теряет электроны на аноде, превращаясь в O 2 и H 2 O.
- 4OH — (вод.) -> O 2 (г) + 2H 2 O (л) + 4e —
Реакция на катоде
- Cu 2+ прирост электроны на катоде превращаются в атомы меди, превращаясь в жидкую медь.
- Ионы водорода не разряжаются, потому что медь легче разряжается.
- Cu 2+ (вод.) + 2e — -> Cu (s)
Общее уравнение
- Сначала необходимо сбалансировать оба уравнения.
- Уравнение катода короткое 2 электрона. Следовательно, мы должны сначала выровнять их, умножив уравнение катода на 2.
- (Cu 2+ (водный) + 2e — -> Cu (s)) x 2 = 2Cu 2+ (водный) + 4e — -> 2Cu (s)
- Теперь мы можем объединить уравнения, образуя:
- 2Cu (OH) 2 (aq) -> 2Cu (s) + O 2 ( g) + 2H 2 O (l)
- Поскольку ионы меди в растворе расходуются, синий цвет тускнеет.
- Оставшиеся ионы водорода и сульфата образуют серную кислоту.
B. Электролиз CuSO 4 с использованием активных электродов (например, меди)
Присутствие ионов : Cu 2+ , H + , OH — и SO 4 2-
Реакция на аноде
- И SO 4 2- , и OH — притягиваются сюда, но не выводятся. Вместо этого медный анод разряжается за счет потери электронов с образованием Cu 2+ .Таким образом, размер электрода уменьшается.
- Cu (s) -> Cu 2+ (вод. медь. Следовательно, здесь осаждается медь и электрод растет.
- Cu 2+ (водн.) + 2e — -> Cu (s)
Общее изменение
- Нет изменений в содержании раствора при каждой потере Cu 2+ ионов на катоде замещается ионами Cu 2+ , высвобождаемыми растворяющимся анодом.
- Только катод увеличивает размер за счет увеличения меди, а анод уменьшает размер за счет потери меди.
- Мы можем использовать этот метод для создания чистой меди на катоде, используя чистую медь на катоде и грязную медь на аноде.
- Под него попадают примеси анода.
Гальваника
- Гальваника — это покрытие объекта тонким слоем металла путем электролиза. Это делает объект защищенным и более привлекательным.
- Объект, подлежащий нанесению покрытия, выполнен в виде катода, а металл покрытия выполнен в виде анода.
- Электролит ДОЛЖЕН содержать катион металла покрытия.
Металлический железный объект никелем Реакция на аноде
- Ni 2+ , выведенный из анода в раствор. Таким образом, размер электрода уменьшается.
- Ni (s) -> Ni 2+ (водн.) + 2e —
Реакция на катоде
- Ni 2+ , полученный на аноде, получает электроны на катоде, превращаясь в атомы Ni никель.Следовательно, здесь осаждается никель и электрод растет.
- Ni 2+ (водн.) + 2e — -> Ni (s)
Общее изменение
- Содержание раствора не меняется, пока железный объект получает осадок никеля.
- Использование гальванических покрытий
Создание электрических элементов с помощью электролиза
- Простой элемент или электрический элемент — это устройство, преобразующее химическую энергию в электрическую энергию, и оно состоит из 2 электродов, изготовленных из 2 металлов с разной реакционной способностью.
- В простом элементе БОЛЕЕ РЕАКТИВНЫЙ металл / электрод ВСЕГДА обозначается ОТРИЦАТЕЛЬНЫМ электродом.
- Анод (отрицательный электрод) сделан из более химически активного металла. Это потому, что они более склонны терять электроны.
- Катод (положительный электрод) изготовлен из менее химически активного металла.
- Чем дальше друг от друга металлы в ряду реактивности, тем выше создаваемое напряжение.
- Электроны в простой ячейке ВСЕГДА будут течь от ОТРИЦАТЕЛЬНОГО электрода (сделанного из БОЛЕЕ химически активного металла) на ПОЛОЖИТЕЛЬНЫЙ электрод.
Напр. Простой электрический элемент с использованием цинка и меди
Наблюдение: на медном стержне появляются пузырьки газообразного водорода.
Объяснение : Цинк более активен, чем медь. Таким образом, он более электроположителен, чем медь, а это означает, что цинк легче теряет электроны, чем медь. В результате на цинковом стержне (аноде) происходит окисление , и металлический цинк теряет электроны, превращаясь в ионы цинка, то есть Zn (s) — 2e — -> Zn 2+ (водн.)
Затем электроны текут от цинкового стержня к медному стержню через внешнюю цепь.В медном стержне происходит восстановление — ионы водорода в растворе принимают эти электроны с образованием газообразного водорода;
2H + (вод.) + 2e — -> H 2 (г)
Это объясняет, почему пузырьки газа образуются на медном стержне когда два стержня соединены проволокой.
Величина напряжения (разность потенциалов) связана с положением двух металлов в ряду реактивности.Чем дальше друг от друга два металла, тем больше будет создаваемая разность потенциалов (напряжение). Электролитическая ячейка и электрохимическая ячейка
Электролитическая ячейка Электрохимическая ячейка Преобразует химическую энергию в электрическую Преобразует электрическую энергию в химическую энергию, ответственную за для производства электроэнергии Окислительно-восстановительная реакция не является спонтанной, и для ее инициирования необходимо подавать электрическую энергию Две полуячейки размещены в разных контейнерах, которые соединены через солевой мостик или пористую перегородку Оба электрода помещены в одну емкость в растворе расплавленного электролита. Анод является отрицательным электродом , а катод является положительным электродом .
Реакция на аноде — это окисление , а реакция на катоде — это восстановление . Анод является положительным электродом , а катод является отрицательным электродом .
Реакция на аноде — это окисление , а реакция на катоде — это восстановление . Электроны поставляются окисляющимися частицами.
Они перемещаются от анода к катоду во внешней цепи. Внешняя батарея питает электроны, которые входят через катод и выходят через анод .
Факторы, влияющие на электролиз
- Концентрация
- Тип электрода
Концентрация
- Если концентрация того или иного иона высока, то это может повлиять на разряд4
разбавленная соляная кислота подвергается электролизу, газообразный водород выделяется на катоде, а газообразный кислород — на аноде.Однако при электролизе соляной кислоты с концентрацией газообразный водород по-прежнему выделяется на катоде, а газообразный хлор и выделяется на аноде.- Это связано с тем, что, хотя ион хлорида сложнее разрядить, чем ион гидроксида, его высокая концентрация увеличивает вероятность его разрядки.
Тип электрода
Напр. электролиз водного раствора сульфата меди (II)
Используйте угольные электроды:
- Угольные электроды инертны на и поэтому не влияют на электролиз
- На аноде у нас есть выбор из сульфатных или гидроксид-ионов , и гидроксид Ионы легче разряжать, поэтому кислород газ подается на анод
- 4OH — (вод.) + O 2 (г) —> O 2 (г) + 2H 2 O (l) + 4e —
- На катоде у нас есть выбор ионов меди или водорода. Ионы меди легче разряжать, поэтому мы увидим отложение розового металла меди на угольном электроде
- Cu 2+ (водн.) + 2e — —> Cu (s )
Используйте медные электроды
- Медные электроды активны и влияют на электролиз
- На аноде медный электрод растворяет003 в растворе (9000 s)
- -> Cu 2+ (водн.) + 2e —
- На катоде ионы меди осаждаются в виде металлической розовой меди
- Cu 2+ (водн.) + 2e — —> Cu (s)
Вопросы MCQ
1.Электричество может проходить через расплавленный бромид свинца (II) из-за присутствия
a. свободные электроны
б. подвижные ионы
c. подвижные атомы
d. металлический свинец 2. При электролизе разбавленной соленой воды на аноде выделяется бесцветный газ. Газ —
а. водород
б. steam
c. кислород
d. хлор
3.
Раствор сульфата меди (II) подвергается электролизу с использованием угля.
электроды. На одном из электродов образуется розоватый налет
a.медь
б. оксид меди (I)
c. оксид меди (II)
d. сульфид меди (III)
4. Раствор сульфата меди (II) подвергают электролизу с помощью медных электродов. Что из следующего могло бы произойти?
а. анод теряет вес
б. катод теряет в весе
гр. раствор темнеет на цвет
d. раствор становится светлее
5. Электролит всегда
a. кислота или щелочь
b. водный раствор
c. жидкость
д.расплав твердого тела
6. Анионы образованы
a. металлы приобретают электроны
б. металлы теряют электроны
c. неметаллы, приобретающие электроны
d. неметаллы, теряющие электроны
7. Какой из этих анионов никогда не разряжается на положительном электроде во время электролиза?
а. НЕТ 3 —
б. ОН —
с. И —
г. O 2-
8. Из чего делают анод при электролитическом производстве алюминия?
а.медь
б. графит
гр. платина
г. сталь
9. В каком электролите углеродный катод увеличится в массе во время электролиза?
а. водный сульфат меди (II)
b. концентрированная соляная кислота
c. концентрированный водный раствор хлорида натрия
d. разбавленная серная кислота
10. Хлор промышленно производится путем электролиза водного хлорида натрия (рассола). Какие еще важные продукты производятся в процессе?
а.соляная кислота и водород
b. водород и натрий
c. водород и гидроксид натрия
d. натрия и гидроксид натрия
11. Электрический ток пропускается через водный сульфат калия, K 2 SO 4 .
Что образуется на катоде (отрицательном электроде)?
а. водород
б. кислород
c. калий
г. сера 12. Что происходит при электролизе расплавленного хлорида свинца (II)?
а.ионы хлора приобретают электроны на катоде
b ионы хлора теряют электроны на аноде
c. ионы свинца (II) теряют электроны на катоде
d. ионы свинца (II) движутся к аноду
13. Какой элемент высвобождается на угольном катоде при электролизе водного хлорида натрия?
а. хлор
б. водород
c. кислород
d. натрия
14. Какое изменение всегда имеет место при электролизе водного сульфата меди (II)?
а.медь осаждается на отрицательном электроде
b. кислород выделяется на положительном электроде
c. ионы сульфата движутся к отрицательному электроду
d. цвет раствора тускнеет
15. Какой элемент высвобождается на катоде при электролизе водного раствора, содержащего его ионы?
а. бром
б. хлор
c. водород
d. кислород
16. Водный сульфат меди (II) подвергается электролизу с использованием медных электродов. Какие наблюдения будут сделаны?
Реакция на аноде
Br- теряет электроны на аноде, превращаясь в атомы Br. Атомы Br образуют связь вместе, образуя газ Br2.
Реакция на катоде
Pb 2+ (водн.) + 2e — -> Pb (l)
- 2 из электролита, 2 из воды.
- Только 2 из них разряжены.
Реакция на аноде
Например. в приведенном выше примере остатки Na + и OH — объединяются с образованием NaOH.
B. Сильно разбавленные растворы
Электролиз разбавленного h3SO4
Что происходит:
Присутствие ионов: H + , OH 90 SO622
423 и 90-90
Реакция на аноде
- (2H + (aq) + 2e — -> H 2 (g)) x 2 = 4H + (aq ) + 4e — -> 2H 2 (g)
- 4H + (водн.) + 4OH + (водн.) -> 2H 2 (г) + O 2 (г) + 2H 2 O (л)
- Отсюда: 4H 2 O (л) -> 2H 2 (г) + O 2 (г) + 2H 2 O (л)
- Следовательно, они отменяют коэффициенты: 2H 2 O (l) -> 2H 2 (g) + O 2 (g)
- Напр. платина и графит.
- (Cu 2+ (водный) + 2e — -> Cu (s)) x 2 = 2Cu 2+ (водный) + 4e — -> 2Cu (s)
- 2Cu (OH) 2 (aq) -> 2Cu (s) + O 2 ( g) + 2H 2 O (l)
Затем электроны текут от цинкового стержня к медному стержню через внешнюю цепь.В медном стержне происходит восстановление — ионы водорода в растворе принимают эти электроны с образованием газообразного водорода;
Реакция на аноде — это окисление , а реакция на катоде — это восстановление .
Реакция на аноде — это окисление , а реакция на катоде — это восстановление .
Они перемещаются от анода к катоду во внешней цепи.
а. водород
б. steam
c. кислород
d. хлор
a.медь
б. оксид меди (I)
c. оксид меди (II)
d. сульфид меди (III)
а. анод теряет вес
б. катод теряет в весе
гр. раствор темнеет на цвет
d. раствор становится светлее
a. кислота или щелочь
b. водный раствор
c. жидкость
д.расплав твердого тела
a. металлы приобретают электроны
б. металлы теряют электроны
c. неметаллы, приобретающие электроны
d. неметаллы, теряющие электроны
а. НЕТ 3 —
б. ОН —
с. И —
г. O 2-
а.медь
б. графит
гр. платина
г. сталь
а. водный сульфат меди (II)
b. концентрированная соляная кислота
c. концентрированный водный раствор хлорида натрия
d. разбавленная серная кислота
а.соляная кислота и водород
b. водород и натрий
c. водород и гидроксид натрия
d. натрия и гидроксид натрия
а.ионы хлора приобретают электроны на катоде
b ионы хлора теряют электроны на аноде
c. ионы свинца (II) теряют электроны на катоде
d. ионы свинца (II) движутся к аноду
а. хлор
б. водород
c. кислород
d. натрия
а.медь осаждается на отрицательном электроде
b. кислород выделяется на положительном электроде
c. ионы сульфата движутся к отрицательному электроду
d. цвет раствора тускнеет
а. бром
б. хлор
c. водород
d. кислород

 /см3 — 540 гр./л. (взвешиваем на весах).
/см3 — 540 гр./л. (взвешиваем на весах).