Как замерить плотность электролита в аккумуляторе
Устройство аккумулятора
В целом описать устройство аккумулятора можно следующим образом:
- Корпус из инертного пластика, устойчивого к агрессивным воздействиям электролита.
- Внутри корпуса располагается некоторое количество герметичных модулей, называемых банками, обычно их шесть, соединенных между собой плюсовой и минусовой шинами. По своей сути, каждая банка — это небольшой аккумулятор, а АКБ их блок, собирающий и выдающий их общее напряжение.
- В каждой банке находятся пакеты, которые состоят из последовательно отделенных диэлектрическими разделителями катода и анода, обычно из свинцово-кальциевого сплава, которые залиты электролитом.
- На крышке находятся газоотводное отверстие, ручки для переноски, клеммы. В случае обслуживаемого аккумулятора заливные отверстия, закрытые пробками. Необслуживаемого — только глазок индикатора уровня электролита.
Зачем измерять плотность электролита в АКБ?
Некоторые автолюбители не понимают важности поддержания оптимальной плотности электролита внутри аккумулятора.
!Важно При длительном использовании разряженной АКБ зачастую происходит сульфитация пластин. Решить это проблему восстановлением плотности невозможно и придется отправлять аккумулятор на восстановление.
Таким образом, проводя измерение плотности электролита, выявляют возникшие проблемы и препятствуют выходу аккумулятора из строя.
Какие значения плотности электролита считают нормой?
Прежде чем приступать к замерам плотности электролита необходимо знать ее нормальное значение для полноценного функционирования аккумулятора. При изготовлении АКБ на заводах их заполняют электролитом со средней плотностью 1,26-1,27 г/см3. В целом этого достаточно для начала его эксплуатации. Но следует учитывать, что со временем этот показатель меняется и его приходится возвращать к оптимальным значениям. Основным фактором, определяющим величину плотности электролита, являются температурные условия эксплуатации автомобиля. Если это регионы с холодным макроклиматом, то она должна составлять 1,27–1,29 г/см3, если речь идет о средней полосе, то значение снижается до 1,25 – 1,27 г/см3, в теплых регионах 1,23 – 1,25 г/см3. Четко прослеживается закономерность, что чем ниже температура, при которой работает аккумулятор, тем выше необходимая для его нормальной работы плотность электролита.
При изготовлении АКБ на заводах их заполняют электролитом со средней плотностью 1,26-1,27 г/см3. В целом этого достаточно для начала его эксплуатации. Но следует учитывать, что со временем этот показатель меняется и его приходится возвращать к оптимальным значениям. Основным фактором, определяющим величину плотности электролита, являются температурные условия эксплуатации автомобиля. Если это регионы с холодным макроклиматом, то она должна составлять 1,27–1,29 г/см3, если речь идет о средней полосе, то значение снижается до 1,25 – 1,27 г/см3, в теплых регионах 1,23 – 1,25 г/см3. Четко прослеживается закономерность, что чем ниже температура, при которой работает аккумулятор, тем выше необходимая для его нормальной работы плотность электролита.
!Справка При изготовлении состава для заливки рекомендуют отталкиваться от нижних значений допустимого диапазона. Также учитывают, что есть натриевые и калиевые электролиты и они используются в разных пропорциях.
Проверка плотности электролита – приборы и их действие
Перед тем как проверить концентрацию, необходимо убедится в том, что уровень раствора соответствует необходимому. Делается это так:
Делается это так:
Берут специальную стеклянную трубку (пипетку), опускают ее в аккумуляторную банку до упора и закрывают верхнее отверстие трубки пальцем. Трубку вынимают и замеряют высоту находящейся в ней жидкости. Она должна колебаться в пределах 10 — 15 см. Проводят это измерение для каждой банки. В случае если количество жидкости не совпадает с оптимальными значениями, электролит либо убирают, либо добавляют. После чего можно приступать непосредственно к измерению концентрации. Для этого необходимо соблюдать несколько простых правил:
- замеры проводят для каждой банки;
- крышка аккумулятора и пробки должны быть очищены от любых загрязнений;
- для получения максимально корректных результатов АКБ должна быть заряжена.
- непосредственно перед измерением аккумулятор выдерживают в комнатной температуре при 20 — 30 градусах.
Для измерения концентрации используют ареометр или, как его еще называют, денсиметр. Состоящий из:
- наконечника, который опускают в банки для забора жидкости;
- колбы, в которой будет находится ареометр;
- резиновой груши;
- ареометра.

Итак, сам процесс измерения. Наконечник ареометра протирают и погружают в открытое заливное отверстие. Используя грушу, набирают в колбу некоторое количество раствора кислоты. Для определения значения плотности денсиметр держат на уровне глаз, при этом сам ареометр должен быть в состоянии покоя и свободно плавать в растворе, не соприкасаясь ни с одной из стенок колбы. Как только эти условия будут достигнуты, отмечают число со шкалы ареометра, определяемое по уровню жидкости.
В том случае, если нет возможности использовать ареометр, проверку проводят используя вольтметр автотестера. Его подключают к клеммам батареи и измеряют напряжение. В норме оно должно колебаться в пределах 11,9 — 12,5 вольт. После этого заводят двигатель и набирают 2500 оборотов. По достижении этой отметки напряжение должно быть в пределах 13,9 — 14,4 вольта. Если значения соответствуют рекомендуемым, то и значение плотности должно быть в норме.
Как повысить плотность рабочего электролита
В том случае, если в результате измерений было выяснено, что концентрация кислоты ниже требуемой, возникает необходимость в её повышении. Для это есть несколько способов:
Для это есть несколько способов:
- перезарядка аккумулятора;
- полная замена раствора электролита на новый;
- добавление более концентрированного раствора;
- добавление кислоты.
Для работы могут понадобится: мерная емкость, груша, паяльник, дрель. Весь инструментарий должен быть вымыт и высушен. Также нужно держать под рукой дистиллированную воду и электролит.
Если после набора оборотов вольтаж не изменился как описано выше, то начинать стоит с попытки перезарядить аккумулятор. 10 часов батарею заряжают с силой тока в 10 раз меньше чем его емкость. После этого её понижают вдвое и продолжают заряжать еще 2 часа.
В случае если изначальное напряжение после набора оборотов будет выше 14,4 вольта, то в АКБ заливается вода и её ставят на зарядку.
В случае если аккумулятор все равно быстро разряжается, то приходит время полной замены раствора. Чтобы это сделать, нужно выкачать из каждой банки максимально возможное количество жидкости, а её остаток аккуратно слить. Для этого все отверстия устройства в корпусе полностью герметично закрывают. Затем его кладут на бок и сверлят отверстия для слива для каждой банки. После чего жидкость из них сливают.
Для этого все отверстия устройства в корпусе полностью герметично закрывают. Затем его кладут на бок и сверлят отверстия для слива для каждой банки. После чего жидкость из них сливают.
!Важно Категорически запрещено устанавливать АКБ на крышку. В противном случае может произойти короткое замыкание. И это приведет к осыпанию поверхностей пластин. После того как старый электролит будет удален, внутренности батареи тщательно промывают дистиллятом. Затем паяльником запаивают просверленные отверстия, до полной герметичности и заливают новый раствор через предназначенные для этого отверстия.
В целом, повысить или понизить плотность для каждой отдельно взятой банки можно доливая раствор электролита высокой концентрации или дистиллированной воды.
Если плотность выше чем 1,18 г/см3, то добавляют концентрированный раствор. Из банки выбирают столько жидкости, сколько возможно и заменяют половину на концентрат. Его плотность должна быть выше, чем та, которая нужна для нормальной работы.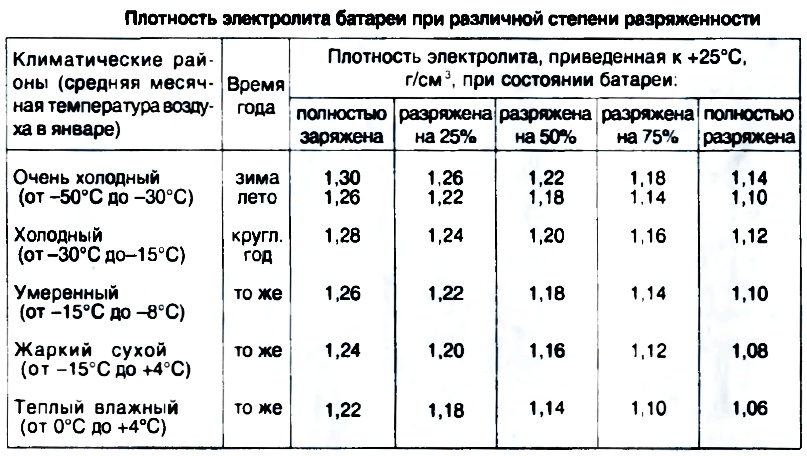
Если же измерения показали значения ниже 1,18 г/см3, то используют кислоту. Проводят те же действия, что и при разбавлении концентратом, но подменяют меньшую часть, чтобы не превысить норму уже в первом цикле.
При приготовлении растворов кислота вливается в воду, в противном случае высок риск разбрызгивания концентрата. Все работы проводятся в рабочей робе с защищенными руками и глазами.
Что делать если аккумулятор необслуживаемый
На таком типе аккумуляторов отсутствуют пробки для залива жидкости и, соответственно, доступ к банкам, поэтому проверить плотность электролита можно только одним способом.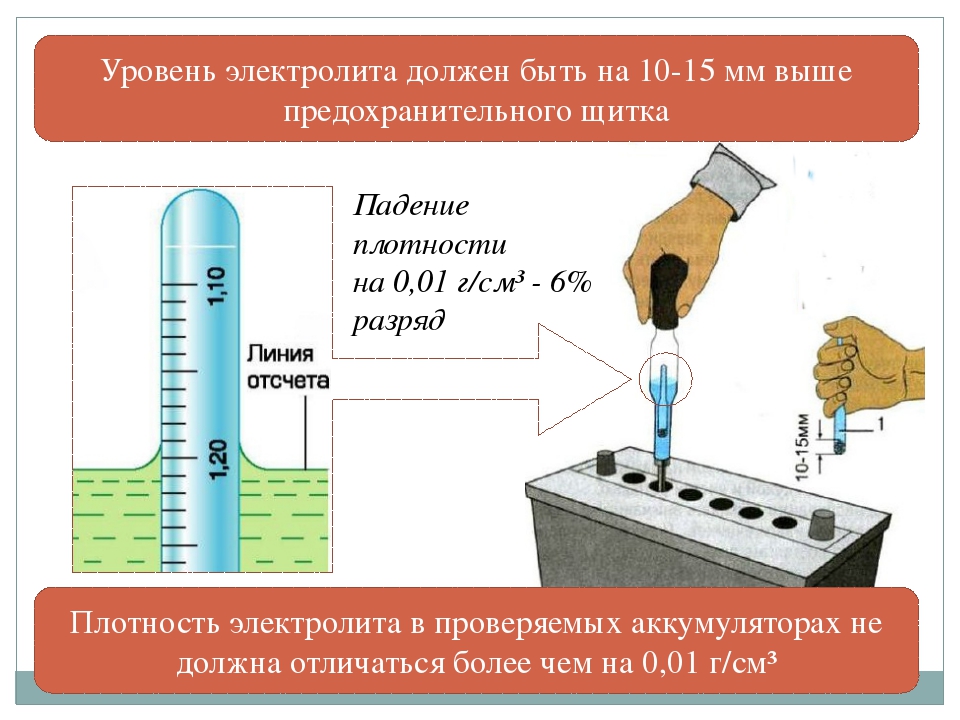 Для это выкручивают находящийся на крышке глазок индикатора электролита и через отверстие для его крепления проводят замеры. Нужно помнить, что полученные показатели будут точными только для одной банки, так сказать эмпирически усредненными для всего устройства. Самостоятельно их повысить не представляется возможным из-за конструктивных особенностей аккумулятора.
Для это выкручивают находящийся на крышке глазок индикатора электролита и через отверстие для его крепления проводят замеры. Нужно помнить, что полученные показатели будут точными только для одной банки, так сказать эмпирически усредненными для всего устройства. Самостоятельно их повысить не представляется возможным из-за конструктивных особенностей аккумулятора.
Можно подытожить, что проверка плотности аккумулятора — это необходимые сервисные действия для его нормальной работы и длительности сохранения заряда. Если отказываться это делать, то вполне возможно, что вместо несложных придется приобретать новый аккумулятор взамен ставшего непригодным к эксплуатации.
Как поднять плотность в аккумуляторе в домашних условиях
В автомобильных аккумуляторах, которые находятся в активной эксплуатации со временем происходит падение плотности. Это может происходить по ряду причин. Сервисы предлагают услуги по корректировке плотности АКБ. Также проблему можно решить самостоятельно. Но прежде всего стоит ознакомиться с тем, как поднять плотность в аккумуляторе в домашних условиях.
Но прежде всего стоит ознакомиться с тем, как поднять плотность в аккумуляторе в домашних условиях.По каким причинам происходит падение плотности
Прежде чем сразу же приступать к исправлению проблемы стоит разобраться в причине ее возникновения. Для АКБ явление падения плотности — это естественное явление. При разряде она показатели снижаются, при заряде повышаются.
Низкие показатели в АКБ говорят о следующем:
- Батарея просто разряжена.
- Аккумулятор перенес перезарядку, из-за чего раствор просто выкипел.
- Дистиллированная вода просто доливалась без замера показателей.
В первом случае падение — это естественное явление. Во втором, когда батарея перенесла перезарядку произошло частичное выкипание, что сильно повлияло на параметры жидкости. В третьем, упала плотность электролита в аккумуляторе из-за большого содержания воды.
Важно! Плотность электролита прямо влияет на качество батареи.
А самое главное на то как она будет держать заряд.
Рекомендуется постоянно производить замеры показателя плотности электролита при первых признаках. К ним можно отнести быструю разрядку АКБ. В противном случае при долгой работе с некорректными показателями пластины внутри батареи будут разрушены. Исправить такое можно будет только полностью заменив батарею.
Способы повышения плотности
Повысить плотность электролита в АКБ можно поднять несколькими способами. Они различаются своей сложностью исполнения и длительностью.
Корректирующий электролит
Повышение плотности электролита в аккумуляторе происходит в несколько этапов. В этом действии важно соблюдать последовательность, только в этом случае можно получить достоверные результаты.
Также потребуются следующие инструменты и продукты:
- ареометр;
- стеклянные емкости;
- груша для извлечения лишней жидкости;
- перчатки для защиты;
- пластмассовые защитные очки;
- корректирующий электролит;
- дистиллированная вода.

Важно! Перед тем как приступить к работе необходимо убедится, что батарея находилась несколько часов в помещении с температурой 20-25 градусов.
Чтобы реанимировать батарею и поднять плотность электролита в аккумуляторе требуется выполнить следующие действия:
- Зарядить АКБ, в котором предположительно упала плотность электролита. Важно чтобы батарея заряжалась около 8-12 часов. Необходимо чтобы она стала именно полностью заряженной, так как этот момент сильно влияет на показатели.
- После зарядки требуется замерить параметр ареометром в каждой банке АКБ. Показатели должны быть в пределах 1.25-1.27 г/см в кубе. Отклонение в показателях между банками допускается до 0.01.
- Если результат оказался ниже нормы, требуется откачать часть электролита из банок с недопустимыми параметрами.
- В банку заливается корректирующий электролит, в объеме в двое меньше откаченного.
 Далее заливают дистиллированную воду для закрытия пластин.
Далее заливают дистиллированную воду для закрытия пластин. - Как только была произведена частичная замена электролита необходимо поставить АКБ на подзарядку. Достаточно 30-60 минут. После требуется оставить батарею на 2 часа чтобы жидкость смешалась.
- По истечению времени производится повторный замер. Если она все также ниже нормального действия повторяются.
Важно! Если планируется самостоятельно делать корректирующий электролит стоит заливать кислоту в воду, а не наоборот. В противном случае произойдет реакция, в ходе которой вода вскипит, и кислота расплескаться.
Выравнивание с помощью зарядки
Для этого метода потребуется зарядное устройство для АКБ с возможностью регулировать выходное напряжение. Простая зарядка, которая уменьшает силу тока при полном заряде не подойдет.
Корректировка плотности электролита в аккумуляторе происходит по следующей схеме:
- Батарея полностью заряжается.

- Когда электролит начинает кипеть силу тока снижается до 1-2 А.
- Пока электролит кипит вода из него испаряется и плотность постепенно повышается.
- После падения уровня необходимо долить электролит, и замерить плотность.
Выпариваться жидкость будет очень медленно и может понадобится более 24 часов. Этот способ наиболее безопасен. За счет естественного испарения замена производится без выкачивания химического раствора.
Полная замена
В случае если хоть в одной банке показатели ниже чем 1.18 г/м в квадрате, то поможет только полная замена электролита. Это действие стоит проводить очень аккуратно так как при ошибке вся батарея может выйти из строя.
Замена производится следующим образом:
- Из банок в АКБ выкачивается максимально возможное количество жидкости при помощи груши.
- После чего необходимо аккуратно перевернуть батарею на бок и просверлить отверстия в каждой банки. С них необходимо слить остатки электролита.

- После чего все емкости осторожно промываются дистиллятом. Отверстия запаиваются пластиком, который устойчив к кислоте.
- В свежевымытые банки заливается раствор электролита с необходимой плотностью. Далее батарея заряжается и проверяется на работоспособность.
Можно залить готовый корректирующий раствор, а после нормализовать параметры просто доливая дистиллированную воду.
Важно! Батарею требуется перевернуть очень аккуратно и медленно. Дело в том, что на дне остается осадок из свинца и при резком перевороте он может застрять между пластин тем самым их закоротив. После этого, как правило, батарея становится не дееспособной.
Как понизить
В некоторых случаях плотность не падает, а наоборот увеличивается. Такой исход также негативно сказывается на общем состоянии аккумулятора. Понижение происходит следующим образом:
- Из банок откачивается некоторое количество электролита.

- После чего заливается дистиллированная вода.
- Измеряется плотность, и в случае если она выше 1.27 необходимо добавить воды.
Желательно вводит воду постепенно. Это поможет избежать слишком сильного понижения показателей.
Чем опасна высокая или низкая плотность
Высокая плотность электролита в аккумуляторе приводит к быстрому разрушению пластин. С течением времени пластины будут съедены кислотой, и аккумулятор выйдет из строя.
Низкая плотность электролита в аккумуляторе не дает батареи держать заряд так как значительно падает емкость. Также повышенная концентрация именно воды увеличивает вероятность того что зимой такая батарея просто заледенеет из-за кристаллизации при низких температурах.
Также плотность рекомендуется выбирать исходя из времени года и региона. Разброс в параметрах не сильный, но это поможет избежать многих проблем с обслуживанием аккумулятора.
Советы и рекомендации
Для того, чтобы корректировка плотности прошла успешно, и батарея не была повреждена стоит следовать некоторым рекомендациям:
- Замер производить только при температуре 20-25 градусов;
- Все параметры измеряются у полностью заряженного аккумулятора;
- Для корректировки использовать специальный раствор с плотностью 1.
 4. Нельзя заливать более насыщенный раствор кислоты, это приведет к разогреву электролита в батарее;
4. Нельзя заливать более насыщенный раствор кислоты, это приведет к разогреву электролита в батарее; - Корректируется жидкость в каждой банке, главное, чтобы между значениями отдельных емкостей не разнилось больше чем на 0.01;
- Жидкость должна покрывать пластины на 1-2 см.
Совет! Если после всех манипуляций показатели падают за короткое время и не приходит в норму после зарядки батарею следует заменить.
Иногда выровнять плотность электролита в банках аккумулятора невозможно. Это, как правило, происходит по причине того, что батарея не исправна и аккумулятор не может держать плотность.
Заключение
Плотность электролита и его уровень оказывают сильное влияние на работоспособность и эффективность аккумулятора. Своевременная корректировка позволяет увеличить срок службы АКБ. Главное совершать все действия правильно в соответствие с нормами безопасности.
проверка и методы повышения плотности
Владельцы автомобилей часто сталкиваются с проблемой отказа двигателя от запуска. Подобное случается из-за разрядки аккумулятора и ухудшения свойств электролита. Перед тем как поднять плотность в аккумуляторе, нужно выяснить причину ухудшения качества кислотного раствора. После этого можно приступать к восстановлению батареи. Действия не представляют особых сложностей.
В процессе эксплуатации снижение плотности аккумулятора обычное явление, особенно при несвоевременной замены старого электролита.
Почему снижается плотность электролита
Снижению плотности способствуют такие факторы:
- Разряд.
 При потере заряда снижается и плотность наполнителя. Во процессе зарядки этот параметр постепенно увеличивается. Если батарея утрачивает большую часть емкости, речь идет о падении концентрации кислоты.
При потере заряда снижается и плотность наполнителя. Во процессе зарядки этот параметр постепенно увеличивается. Если батарея утрачивает большую часть емкости, речь идет о падении концентрации кислоты. - Длительная эксплуатация или хранение в условиях низких температур.
- Выкипание электролита при перезаряде. Если зарядное устройство подает слишком высокое напряжение, жидкий электролит переходит в газообразное состояние и выводится наружу через имеющиеся на корпусе отверстия.
- Частое добавление воды. Водители добавляют жидкость для поддержания стабильного уровня электролита. Не все пользуются ареометром, измеряющим плотность. Вместе с водой выкипает и кислота, что приводит к снижению концентрации.
Пример сульфатации пластин автомобильного аккумулятора.
Опасности низкой и высокой концентрации кислоты
Повышенная концентрация электролита становится причиной преждевременного выхода батареи из строя. Кислота разрушает металлические пластины. К воздействию составов на основе серной кислоты чувствительна даже сталь.
К воздействию составов на основе серной кислоты чувствительна даже сталь.
Низкая концентрация приводит к таким проблемам:
- Сульфатация. На пластинах появляется налет, состоящий из сульфата свинца. Аккумуляторная батарея становится неспособной принимать заряд.
- Повышение порога замерзания. Жидкость кристаллизуется уже при -5°С. Лед сдвигает и повреждает металлические детали. При деформации пластин и коротком замыкании емкостей батарею восстановить невозможно. При плотности 1,28 г/см³ электролит замерзнет только при -58°С.
- Проблемы при запуске двигателя. Наиболее выражен этот признак в зимний период.
Для проверки плотности электролита используют денсиметр (справа).
Проверка плотности электролита
Определить плотность электролита можно в домашних условиях. Процедуру рекомендуется проводить при комнатной температуре.
Перед началом работы подготавливают такие инструменты:
- Защитные перчатки, костюм и очки. В состав наполнителя аккумулятора входит кислота.
 При попадании на кожу вещество вызывает химический ожог. Опасными являются и пары кислоты, поэтому работают только в хорошо проветриваемом помещении.
При попадании на кожу вещество вызывает химический ожог. Опасными являются и пары кислоты, поэтому работают только в хорошо проветриваемом помещении. - Денсиметр. Прибор используется для измерения плотности. Имеет вид стеклянной трубки с грушей и встроенным ареометром.
Самостоятельно измерение плотности выполняют так:
Для проверки плотности электролита конец денсиметра погружают в ёмкость аккумулятора.
- Аккумулятор вынимают из посадочного гнезда. Защитный кожух демонтируют, вывинчивают пробки.
- Проверяют уровень электролита. В свинцово-кальциевых батареях раствор должен на 1,5 см закрывать пластины.
- Батарею полностью заряжают. Проверку плотности начинают через 5-6 часов после завершения зарядки. При нормальном уровне электролита трубку денсиметра погружают в банки, выкачивая небольшое количество жидкого наполнителя.
- Оценивают показатели прибора. Ареометр должен свободно плавать в растворе. Соприкосновение прибора со стенками емкости не допускается.
 Показания оценивают с учетом температуры окружающей среды.
Показания оценивают с учетом температуры окружающей среды. - Проверяют плотность электролита в остальных банках. Показания записывают и сравнивают с нормальной плотностью.
Такой способ проверки подходит только для разборной батареи, когда имеется доступ к электролиту. Необслуживаемый аккумулятор снабжен индикатором, цвет которого меняется в зависимости от плотности наполнителя.
Как откорректировать плотность раствора
Нормальное показание лежит в диапазоне 1,25-1,29 г/см³. Если при температуре +25°С отмечается более низкое значение, его нужно повышать. Падение концентрации в одной из банок свидетельствует о коротком замыкании.
Высокие значения выявляются после зарядки мощным током, сопровождающейся кипением электролита. Повысить плотность можно путем добавления кислоты, заправки готового состава или использования зарядного устройства.
Плотность раствора в холодный период
В холодное время года плотность наполнителя заряженного аккумулятора должна составлять 1,27 г/см³. Дополнительная корректировка в регионах с суровым климатом при смене сезона не проводится.
Дополнительная корректировка в регионах с суровым климатом при смене сезона не проводится.
Таблица зависимости плотности электролита в аккумуляторе от температуры.
Подготовка к восстановлению батареи
На этапе подготовки выполняют такие действия:
- Зарядка батареи. Нельзя начинать восстановление при низком заряде. Добавление электролита способствует резкому повышению концентрации кислоты. Это приводит к разрушению металлических пластин, при котором батарею утилизируют.
- Нормализация температуры электролита. Показатель лежит в пределах +20…+25°С. Уровень электролита в каждой банке должен быть нормальным.
- Осмотр батареи. Корпус не должен иметь трещин и сколов, особенно возле выводов. Повреждению способствует раскачивание при попытке снять прикипевшую клемму.
Повышение плотности электролита
Если плотность составляет более 1,18, доливают готовый состав с нормальной концентрацией серной кислоты.
Процедура включает такие этапы:
- Разрядка батареи. Долив электролита проводится только при полном разряде. Для этого АКБ подключают к мощной лампе или другому потребителю энергии.
- Подготовка корректирующего компонента. Уровень кислоты в таком средстве должен составлять не менее 1,4 г/см³.
- Добавление корректирующего состава. Предварительно откачивают часть имеющегося электролита. Густота раствора должна повыситься до 1,25. Действие выполняется для каждой банки. Объем доливаемой жидкости должен составлять не более 50% от откачанного. После добавления жидкости АКБ встряхивают, давая наполнителю перемешаться.
- Зарядка батареи. Аккумулятор оставляют на полчаса, что позволяет концентрации в банках выровняться. Элемент питания подключают к зарядному устройству на 30 минут. Сила тока должна быть минимальной. Через 2 часа после прекращения зарядки замеряют плотность и количество наполнителя. Если концентрация не поднимается, вышеуказанные действия повторяют.

Можно ли повысить минимальную плотность
Когда плотность падает до отметки ниже 1,18, добавление кислоты оказывается неэффективным. Для восстановления батареи используют раствор, содержащий большее, чем электролит, количество действующего вещества.
Перед заливкой нового электролита старый нужно слить.
Для замены наполнителя выполняют такие действия:
- Слив содержимого. Максимальное количество жидкости выкачивают грушей. Затем аккумулятор помещают в большую емкость и переворачивают на бок. В дне каждой банке формируют небольшое отверстие. Батарею возвращают в прежнее положение и дожидаются вытекания жидкого наполнителя.
- Добавление воды. Жидкость заливается через крышки банок для удаления остатков старого наполнителя. Сделанные ранее отверстия закрываются полимерным материалом, устойчивым к воздействию кислот.
- Заправка батареи новым раствором. Если все действия выполнены правильно, АКБ становится готовой к использованию. Недостатком метода является снижение срока эксплуатации аккумулятора.
 Несколько недель устройство проработает, однако потом придется покупать новое.
Несколько недель устройство проработает, однако потом придется покупать новое.
Как повысить при помощи зарядного устройства
Если концентрация кислоты упала за зиму, ее можно восстановить путем подачи слабого тока. Зарядка занимает не менее 3 суток, она считается эффективной при невозможности восстановления АКБ другими методами. Содержимое набравшей полную мощность батареи при зарядке начинает кипеть. Признаком испарения воды является образование мелких пузырьков на поверхности.
Избыток жидкости испарится, концентрация кислоты увеличится. Общий уровень наполнителя станет маленьким, поэтому придется добавлять готовый аккумуляторный раствор. После завершения процедуры пользуются ареометром. Если показатели прибора слишком низкие, зарядку и добавление электролита повторяют.
Как поднять плотность электролита в аккумуляторе?
Многим этот вопрос кажется простым, а ответ очевидным. Слить электролит с низкой плотностью и залить с более высокой. Или слить только часть, а вместо неё добавить концентрированный раствор. Но перед тем как это делать, стоит задуматься, а надо ли? Такой подход требуется в единичных случаях. Есть ещё один более правильный вариант – это поднятие плотности электролита с помощью зарядки. Чаще всего именно так и следует повышать плотность. В этой заметке речь пойдёт о том, как правильно поднять плотность электролита, зарядкой или заменой. Рассмотрим, что более уместно в той или иной ситуации.
Содержание статьи
А какая плотность нормальная?
Как известно, электролит в свинцово-кислотном аккумуляторе является раствором серной кислоты (H2SO4) в воде (используется дистиллированная вода без примесей). В рамках этого материала мы не будет рассказывать о сортах серной кислоты, её плотности и т. п. Если интересно, можете прочитать это в отдельном материале про электролит.
п. Если интересно, можете прочитать это в отдельном материале про электролит.
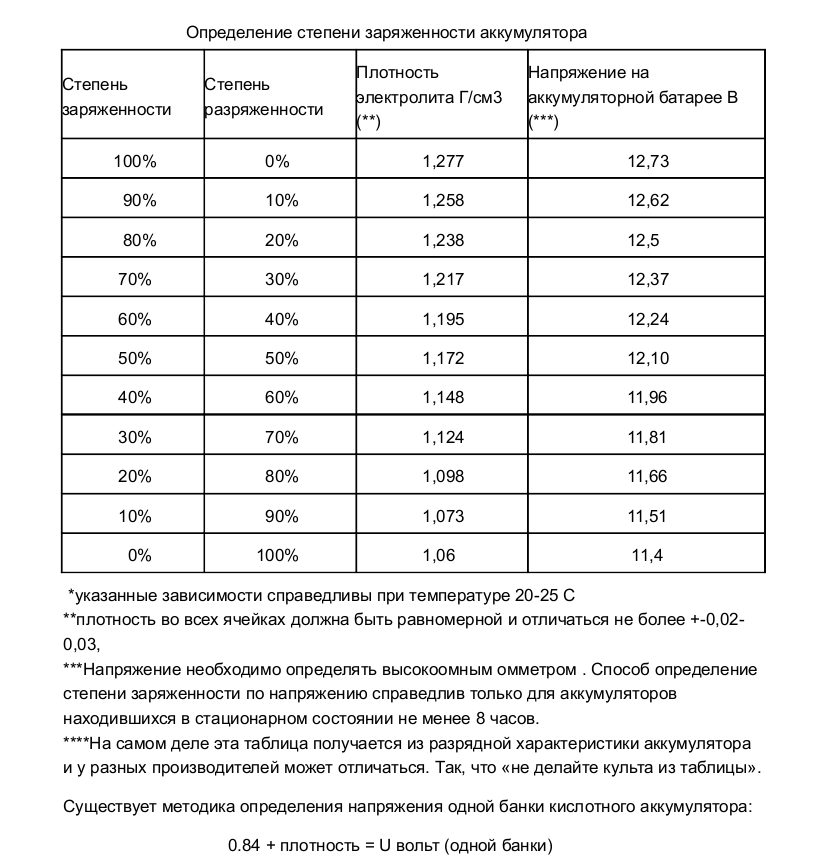
Плотность электролита полностью заряженного аккумулятора должна быть на отметке 1,27 гр/см3. Обычно в разных банках она лежит в интервале 1,25─1,27 гр/см3. При этом ЭДС на выводах аккумуляторной батареи 12,6─12,9 вольта. В таблице ниже можно посмотреть зависимость плотности, напряжения, степени заряженности и температуры замерзания электролита.
| Плотность электролита, г/см. куб. (+15 гр. Цельсия) | Напряжение, В (в отсутствии нагрузки) | Напряжение, В (с нагрузкой 100 А) | Степень заряда АКБ, % | Температура замерзания электролита, гр. Цельсия |
|---|---|---|---|---|
| 1,11 | 11,7 | 8,4 | 0 | -7 |
| 1,12 | 11,76 | 8,54 | 6 | -8 |
| 1,13 | 11,82 | 8,68 | 12,56 | -9 |
| 1,14 | 11,88 | 8,84 | 19 | -11 |
| 1,15 | 11,94 | 9 | 25 | -13 |
| 1,16 | 12 | 9,14 | 31 | -14 |
| 1,17 | 12,06 | 9,3 | 37,5 | -16 |
| 1,18 | 12,12 | 9,46 | 44 | -18 |
| 1,19 | 12,18 | 9,6 | 50 | -24 |
| 1,2 | 12,24 | 9,74 | 56 | -27 |
| 1,21 | 12,3 | 9,9 | 62,5 | -32 |
| 1,22 | 12,36 | 10,06 | 69 | -37 |
| 1,23 | 12,42 | 10,2 | 75 | -42 |
| 1,24 | 12,48 | 10,34 | 81 | -46 |
| 1,25 | 12,54 | 10,5 | 87,5 | -50 |
| 1,26 | 12,6 | 10,66 | 94 | -55 |
| 1,27 | 12,66 | 10,8 | 100 | -60 |
Плотность электролита, г/см.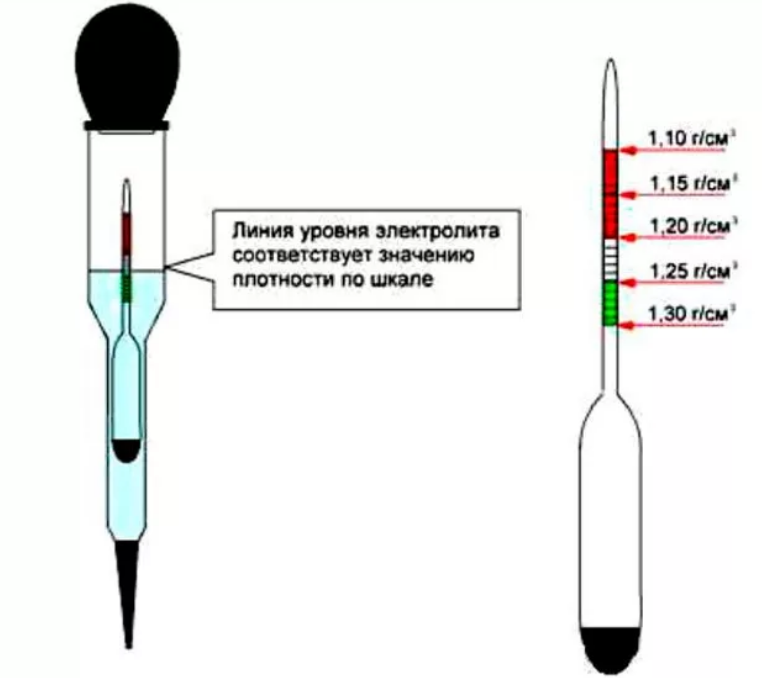 куб. (+15 гр. Цельсия) куб. (+15 гр. Цельсия) | Напряжение, В (в отсутствии нагрузки) | Напряжение, В (с нагрузкой 100 А) | Степень заряда АКБ, % | Температура замерзания электролита, гр. Цельсия |
Падение плотности ниже 1,15 гр/см3 (ЭДС ниже 12 В) рекомендуется не допускать. Это приводит к необратимым последствиям для аккумулятора. Если автомобиль эксплуатируется в холодном климате, то плотность допускается увеличивать до 1,29─1,3 гр/см3. От себя могу добавить, что в последнее время часто встречаю новые аккумуляторы типа Ca/Ca, у которых электролит в заряженном состоянии (ЭДС > 12,6 В) имеет плотность 1,24─1,25 гр/см3. Об таких фактах можно найти немало отзывов в сети. С чем это связано? Мне кажется, причина может быть только в сульфатации во время хранения.
Вернуться к содержанию
А нужно ли поднимать плотность?
Если коротко, то далеко не всех случаях требуется повышение плотности.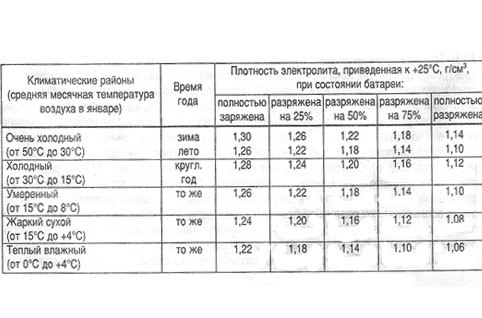 Точнее не требуется её повышение неестественными способами. Чтобы пояснить мысль, нужно обратиться к процессам, происходящим в свинцово-кислотной электрохимической системе.
Точнее не требуется её повышение неестественными способами. Чтобы пояснить мысль, нужно обратиться к процессам, происходящим в свинцово-кислотной электрохимической системе.
Аккумуляторная батарея состоит из наборов положительных и отрицательных электродов, погруженных в раствор серной кислоты. Чтобы исключить замыкание, электроды помещены в изолирующие конверт-сепараторы. Электрод состоит из решётки и обмазки.
Решётки изготавливаются по различным технологиям из разных сплавов и это тема отдельного разговора. А в качестве обмазки на отрицательных электродах присутствует порошкообразный свинец (Pb), а на положительных – паста диоксида свинца (PbO2). Последний имеет красно-коричневый цвет.
В процессе разряда АКБ на электродах протекают следующие реакции при непосредственном участии электролита.
Положительный электрод (анод)
PbO2 + SO42- + 4H+ + 2e— => PbSO4 + 2H2O
Отрицательный электрод (катод)
Pb + SO42- — 2e— => PbSO4
Общая реакция в электрохимической системе описывается уравнением
Pb + 2H2SO4 + PbO2 => 2PbSO4 + 2H2O
Как видите, в процессе разряда серная кислота из электролита взаимодействует как с диоксидом свинца на аноде и металлическим свинцом на катоде с образованием сульфата свинца (PbSO4) и воды (H2O). Ток течёт от анода к катоду. В результате реакции постепенно падает плотность электролита. Обычно нижний предел 1,1─1,15 гр/см3. К этому моменту поры обмазки забиваются сульфатом свинца и реакция сходит на нет. Напряжение на выводах к этому моменту падает до 12 вольт и ниже.
Ток течёт от анода к катоду. В результате реакции постепенно падает плотность электролита. Обычно нижний предел 1,1─1,15 гр/см3. К этому моменту поры обмазки забиваются сульфатом свинца и реакция сходит на нет. Напряжение на выводах к этому моменту падает до 12 вольт и ниже.
При заряде указанные реакции идут в обратном направлении. То есть, сульфат свинца растворяется с расходом воды и образованием Pb, PbO2 и серной кислоты. Концентрация электролита растёт и плотность увеличивается.
К чему все это было сказано? Дело в том, что плотность электролита должна повышаться «естественным путём» в результате зарядки. Если к моменту окончания заряда плотность не достигла 1,27 гр/см3, то причина проблемы не электролит, а система в целом. Конечно, это условии, что зарядное устройство (ЗУ) работает исправно и плотность вы измеряете исправным ареометром.
Итак, в чём причина пониженной плотности к моменту окончания заряда? Это процесс сульфатации, подробнее о котором можно прочитать здесь. Постепенно в процессе эксплуатации часть PbSO4 не растворяется до конца во время зарядки и накапливается на активной массе электродов. Это значит (см. реакции выше), что процессы при зарядке прошли не до конца. Поскольку растворился не весь сульфат свинца, то восстановилась не вся серная кислота и осталось больше воды. Результат – концентрация электролита меньше, как и его плотность.
Постепенно в процессе эксплуатации часть PbSO4 не растворяется до конца во время зарядки и накапливается на активной массе электродов. Это значит (см. реакции выше), что процессы при зарядке прошли не до конца. Поскольку растворился не весь сульфат свинца, то восстановилась не вся серная кислота и осталось больше воды. Результат – концентрация электролита меньше, как и его плотность.
Отсюда вывод. Чтобы поднять плотность электролита в аккумуляторе, нужно в первую очередь заниматься десульфатацией и максимально полной зарядкой АКБ. Если пониженная плотность вызвана сульфатацией, то не следует повышать её увеличением концентрации электролита. Это только усугубит ситуацию.
Даже если плотность ниже 1,27 гр/см3, все вещества остаются в электрохимической системе. Если вы искусственно увеличиваете плотность электролита, то равновесие нарушается и концентрация PbSO4 будет ещё больше. При разряде из электролита выделится сульфат свинца, который уже точно не растворится при заряде, поскольку теперь он в избытке.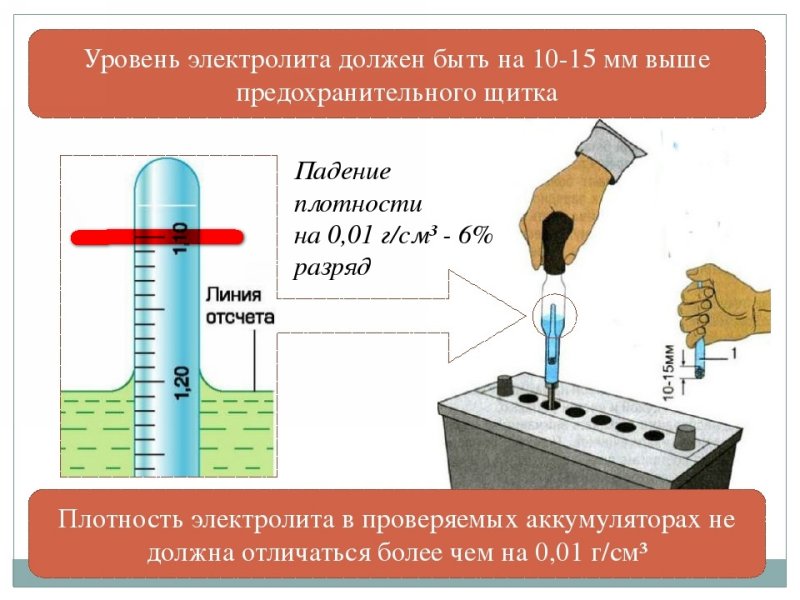 А плотность по окончании заряда снова будет ниже нормы. И так далее.
А плотность по окончании заряда снова будет ниже нормы. И так далее.
Что делать? Никому не навязываю своё мнение, но, мне кажется замена электролита (или изменение его плотности «вручную») для увеличения плотности уместна в следующих случаях.
- Перелили воды или она попала туда в результате ЧП. В результате этого снизилась плотность.
- Нужно повысить плотность электролита для использования в холодном климате.
Я менял электролит в АКБ только один раз из-за непредвиденной ситуации. Заряжал его как-то даче рядом с домом под открытым небом. Зарядил, отключил, но пробки закрывать не стал, чтобы газы вышли он отстоялся немного. Занялся другими делами и забыл про него. Пошёл ливень и все залило с верхом. Пришлось выбирать оттуда старый и заливать новый покупной электролит с нормальной плотностью. Если же просто упала плотность в результате эксплуатации, это не повод увеличивать его концентрацию.
Вернуться к содержанию
Как повысить плотность электролита в Pb аккумуляторе?
Итак, вы всё же решили поднять плотность раствора в аккумуляторной батарее. Как это сделать? Вам потребуется электролит (продаётся в автомобильных магазинах с плотностью 1,27─1,29 гр/см3), ёмкость для откачиваемого электролита, резиновая «груша», длинная гибкая трубка из материала стойкого к серной кислоте, пластиковая воронка (удобно заливать электролит обратно в банки), зарядное устройство.
Как это сделать? Вам потребуется электролит (продаётся в автомобильных магазинах с плотностью 1,27─1,29 гр/см3), ёмкость для откачиваемого электролита, резиновая «груша», длинная гибкая трубка из материала стойкого к серной кислоте, пластиковая воронка (удобно заливать электролит обратно в банки), зарядное устройство.
Внимание! Электролит является едким веществом! При попадании на кожу и слизистые вызывает сильный химический ожог! Поэтому при работе обязательно используйте очки для защиты глаз, а также резиновые перчатки для защиты рук. Если будете разводить концентрированную кислоту, помните, что нужно наливать кислоту в воду, а не наоборот. При падании электролита на кожу или слизистые нужно обратиться в больницу.
Процесс выглядит примерно так.
- Зарядили аккумулятор по максимуму.
- Выбрали старый электролит. Именно так, выбрали, откачали и т. п. С помощью гибкой трубки из материала, стойкого к кислоте и обычной резиновой «груши».
 Не допускается переворачивать АКБ для слива. В этом случае осыпавшиеся частицы со дна могут замкнуть пластины. Или электроды деформируются, порвут сепаратор и будет замыкание. В случае замыкания банки аккумулятор можно смело идти сдавать в приёмку.
Не допускается переворачивать АКБ для слива. В этом случае осыпавшиеся частицы со дна могут замкнуть пластины. Или электроды деформируются, порвут сепаратор и будет замыкание. В случае замыкания банки аккумулятор можно смело идти сдавать в приёмку. - Затем заливаете покупной или самостоятельно приготовленный электролит с плотностью 1,27─1,29 гр/см3.
- Даёте отстояться немного. При необходимости заряжаете.
Это если нужна полная замена электролита, когда он испорчен. Если же нужно увеличить концентрацию, то можно частично отобрать электролит из банок. Я для этого использую колбу от старого ареометра. Поплавок давно разбился, а колбу я оставил и использую вместо «груши».
Затем в банки заливаете такое же по объёму количество раствора более высокой концентрации. Можно использовать аккумуляторную кислоту (92─94%) плотностью 1,835 гр/см3. После этого можно поставить АКБ на зарядку для выравнивания концентрации.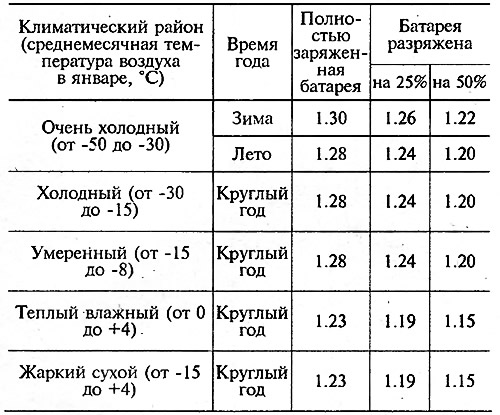 Не нужно трясти и бултыхать батарею для перемешивания. Иначе могут быть те же последствия, что и при переворачивании.
Не нужно трясти и бултыхать батарею для перемешивания. Иначе могут быть те же последствия, что и при переворачивании.
Вернуться к содержанию
Опрос
Примите участие в опросе!
Загрузка …Если статья оказалась для вас полезной, распространите ссылку на неё в социальных сетях. Это поможет развитию сайта. Исправления и дополнения к материалу, а также ваше мнение о повышении плотности электролита в свинцово-кислотном аккумуляторе, оставляйте в комментариях ниже. Голосуйте в опросе и оценивайте статью.
Вернуться к содержанию
Какая плотность должна быть в аккумуляторе зимой: оптимальные значения
Плотность электролита – главный параметр всех свинцово-кислотных электрических аккумуляторов, потому что он оказывает влияние на срок эксплуатации и ёмкость прибора.
Необходимо удерживать оптимальное значение показателя, чтобы гарантировать правильную работу АКБ. Оно зависит не только от климатических характеристик региона, в котором находится автомобиль, но и от времени года. К примеру, если плотность аккумулятора в зимний период составляет 1,25 г/см3, то это свидетельствует о критическом уровне, при котором транспортное средство не сможет завестись. Особенно речь идёт о районах, в которых температура может опускаться до -50 градусов. Однако при умеренном климате такое значение соответствует заявленным требованиям нормы. Следовательно, считается, что показатели в разные временные сезоны должны отличаться друг от друга.
К примеру, если плотность аккумулятора в зимний период составляет 1,25 г/см3, то это свидетельствует о критическом уровне, при котором транспортное средство не сможет завестись. Особенно речь идёт о районах, в которых температура может опускаться до -50 градусов. Однако при умеренном климате такое значение соответствует заявленным требованиям нормы. Следовательно, считается, что показатели в разные временные сезоны должны отличаться друг от друга.
Перед многими автовладельцами встаёт дилемма: разная или одинаковая должна быть плотность аккумулятора зимой и летом? Давайте разбираться.
Зима
Плотность электролита на зиму в аккумуляторе транспортного средства должна составлять около 1,27 г/см3. Но такое значение оптимально лишь для центральных районов России. В регионах, в которых температурный режим ниже -35 градусов, показатель изменяется в диапазоне от 1,28 г/см3 до 1,35 г/см3. Например, если автомобиль работает в условиях Крайнего Севера, то величина колеблется в пределах 1,31–1,35 г/см3. Возникает вопрос: почему плотность электролита в аккумуляторе зимой должна иметь такое значение? Существует две причины, дающих ответ на поставленный вопрос:
Возникает вопрос: почему плотность электролита в аккумуляторе зимой должна иметь такое значение? Существует две причины, дающих ответ на поставленный вопрос:
- Жидкость с большой вероятностью превратится в лёд при минусовой температуре, так как в ней доля воды превышает допустимую норму.
- Механизмы автомобиля замерзают в мороз и требуют увеличения электродвижущей силы, чтобы осуществить запуск двигателя. Даже лучшие модели автомобилей не смогут работать без дополнительной энергии. Уменьшение значения показателя вплоть до 1,1 г/см3 приведёт к замерзанию электрического аккумулятора.
Зимняя плотность аккумулятора находится на низком уровне. Следовательно, при разрядке она упадёт до критических значений. Чтобы решить эту проблему, желательно постоянно следить за состоянием АКБ. Чтобы проследить взаимосвязь между уровнем заряда и водным соотношением в составе электролита, можно рассмотреть различные сценарии при уменьшении АКБ на 25 % и 50 %:
- При первоначальной плотности в 1,30 г/см3 она сократится до 1,26 г/см3 и 1,22 г/см3.

- При начальном значении показателя в 1,27 г/см3 объём уменьшится до 1,23 г/см3 и 1,19 г/см3.
- При исходной величине в 1,23 г/см3 диапазон упадёт до 1,19 г/см3 и 1,15 г/см3.
Следовательно, плотность аккумулятора на зиму не должна опускаться ниже 1,27 г/см3. Однако нужно помнить, что электролит не может прогреться в результате ежедневных поездок от дома на работу, которые составляют менее получаса. Это в свою очередь влияет на АКБ, который получает необходимый уровень заряда только после осуществления разогрева. Значение показателя стремительно падает по причине того, что аккумуляторная батарея разряжается.
Таким образом, отвечая на вопрос, какая плотность аккумулятора должна быть зимой, можно привести таблицу оптимальных значений. Однако данные показатели характерны исключительно для полностью заряженной батареи. В случае если заряд находится на недостаточном уровне, то они будут больше.
| Регион использования транспортного средства | Значение показателя плотности, г/см3 |
|---|---|
| Южные регионы | 1,25 |
| Центральные регионы | 1,27 |
| Северные регионы | 1,29 |
| Регионы Крайнего Севера | 1,31 |
Лето
В летний период аккумуляторная батарея имеет проблему, связанную с потерей большого количества жидкости. Плотность рекомендуется держать на 0,02 г/см3 ниже значения, которое требуется по стандартам. В первую очередь такое замечание относится к регионам, расположенным на юге России.
Плотность рекомендуется держать на 0,02 г/см3 ниже значения, которое требуется по стандартам. В первую очередь такое замечание относится к регионам, расположенным на юге России.
Летом температурный режим под капотом, в котором располагается аккумулятор, повышен. Это влечёт за собой следующие моменты:
- Улетучивание жидкости из состава кислоты.
- Активное прохождение процессов превращения электрической энергии в химическую, протекающих в аккумуляторных кислотных батареях.
Всё это обеспечивает сильную отдачу тока, осуществляющуюся даже при минимальных допустимых показателях плотности электролита. Например, значение 1,22 г/см3 характерно для местности с тёплым и влажным климатом. Если уровень электролита систематически опускается, то это приводит к увеличению значения. Такой взаимосвязанный процесс является причиной химического разрушения проводников электрического тока. Поэтому контроль количества воды в АКБ – важная задача, выполнение которой является залогом грамотного ухода за автомобилем.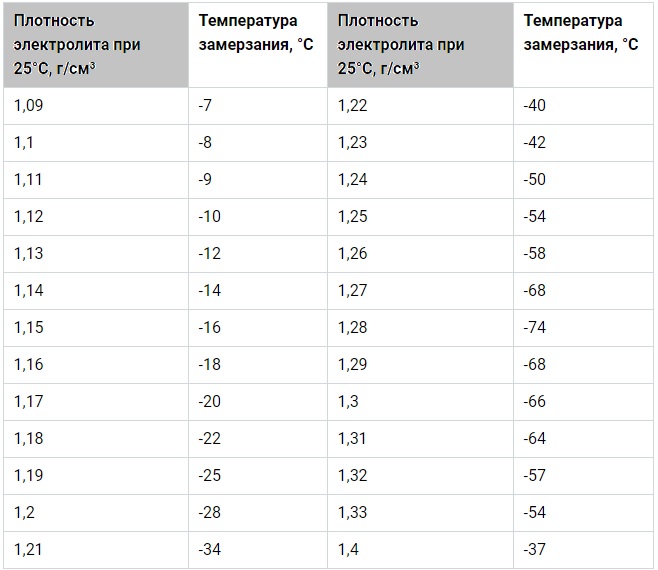 Решение заключается в добавлении дистиллированной жидкости при понижении уровня электролита. Если данное действие опустить, то могут возникнуть проблемы с перезарядом и сульфацией.
Решение заключается в добавлении дистиллированной жидкости при понижении уровня электролита. Если данное действие опустить, то могут возникнуть проблемы с перезарядом и сульфацией.
Рассеянность автолюбителей – главный фактор, который лежит в основе разрядки аккумулятора. Другими словами, если водитель не уследил за состоянием АКБ, то нужно предпринять определённые меры. Они заключаются в обеспечении батареи зарядом при помощи специального устройства. Однако перед этим необходимо обратить внимание на уровень жидкости, которая могла испариться в процессе функционирования. Если это произошло, требуется долить очищенную воду без содержания каких-либо примесей.
Следовательно, рассмотрев, какая плотность должна быть в аккумуляторе зимой в зависимости от региона, нельзя не привести значения для летнего сезона.
| Регион использования транспортного средства | Значение показателя плотности, г/см3 |
|---|---|
| Южные регионы | 1,25 |
| Центральные регионы | 1,27 |
| Северные регионы | 1,27 |
| Регионы Крайнего Севера | 1,27 |
Как правильно откорректировать плотность электролита?
Автовладельцы часто сталкиваются с необходимостью поднять плотность в аккумуляторной батарее, что объясняется двумя причинами. Во-первых, периодическим регулированием количества дистиллированной жидкости. Во-вторых, частой зарядкой устройства, так как уменьшение интервала осуществления данного действия – первый признак того, что желательно провести процедуру повышения величины. Выделяют два способа корректировки значения показателя:
Во-первых, периодическим регулированием количества дистиллированной жидкости. Во-вторых, частой зарядкой устройства, так как уменьшение интервала осуществления данного действия – первый признак того, что желательно провести процедуру повышения величины. Выделяют два способа корректировки значения показателя:
- применение электролита, обладающего высокой концентрацией;
- использование дополнительных кислот.
Чтобы изменить в нужном направлении плотность в аккумуляторной батарее, следует приобрести следующие предметы:
- специализированный стакан с делениями, применяемыми для измерения объёма;
- цистерна для создания нового раствора;
- электролит или кислота корректирующего содержания;
- очищенная жидкость.
Алгоритм действий по изменению значения включает в себя 5 этапов:
- Взять небольшое количество электролита с банки аккумуляторной батареи.
- Добавить корректирующий раствор в количестве, которое соответствует взятому на предыдущем этапе.
 Такое действие осуществляется при условии, что поставлена задача поднять плотность. Если необходимо получить противоположный результат, то регулирующий раствор заменяют на дистиллированную жидкость.
Такое действие осуществляется при условии, что поставлена задача поднять плотность. Если необходимо получить противоположный результат, то регулирующий раствор заменяют на дистиллированную жидкость. - Аккумулятор следует подзарядить с помощью специального устройства, так как номинальный ток даст возможность поступившей воде смешаться.
- После отключения АКБ от батареи целесообразно выждать в районе 2 часов. Это позволит плотности во всех банках встать на один уровень, что сделает вероятность возникновения погрешности при контрольном тестировании минимальной.
- Вторично осмотреть значение электролита. Если оно осталось на прежнем уровне, то повторно осуществить предыдущие этапы.
Плотность электролита изменяется в результате понижения в определённом отсеке аккумулятора. Причём предварительно полезно изучить номинальный объём, который в нём находится. Например, в классической стартерной батарее 6СТ-55 величина электролита равна 633 см3, а в 6СТ-45 – 500 см3. Если рассматривать его состав, то в него входят серная кислота и очищенная вода в процентном соотношении 40 на 60. Достичь необходимой плотности показателя можно, опираясь на представленные данные в следующей таблице:
Достичь необходимой плотности показателя можно, опираясь на представленные данные в следующей таблице:
| Плотность аккумулятора, г/см3 | Обязательная величина параметра, г/см3 | ||||||||
|---|---|---|---|---|---|---|---|---|---|
| 1,24 | 1,25 | 1,26 | |||||||
| Забор электро-лита | Долив раствора 1,40 г/см3 | Добавление жидкости | Забор электро-лита | Долив раствора 1,40 г/см3 | Добавление жидкости | Забор электро-лита | Долив раствора 1,40 г/см3 | Добавление жидкости | |
| 1,24 | — | — | — | 60 | 62 | — | 120 | 125 | — |
| 1,25 | 44 | — | 25 | — | — | — | 65 | 70 | — |
| 1,26 | 85 | — | 88 | 39 | — | 40 | — | — | — |
| 1,27 | 122 | — | 126 | 78 | — | 80 | 40 | — | 43 |
| 1,28 | 156 | — | 162 | 117 | — | 120 | 80 | — | 86 |
| 1,29 | 190 | — | 200 | 158 | — | 162 | 123 | — | 127 |
| 1,30 | — | — | — | — | — | — | — | — | — |
Продолжение таблицы
| Плотность аккумулятора, г/см3 | Обязательная величина параметра, г/см3 | ||||||||
|---|---|---|---|---|---|---|---|---|---|
| 1,27 | 1,28 | 1,30 | |||||||
| Забор электро-лита | Долив раствора 1,40 г/см3 | Добавление жидкости | Забор электро-лита | Долив раствора 1,40 г/см3 | Добавление жидкости | Забор электро-лита | Долив раствора 1,40 г/см3 | Добавление жидкости | |
| 1,24 | 173 | 175 | — | 252 | 256 | — | — | — | — |
| 1,25 | 118 | 120 | — | 215 | 220 | — | — | — | — |
| 1,26 | 85 | 66 | — | 177 | 180 | — | 290 | 294 | — |
| 1,27 | — | — | — | 122 | 126 | — | 246 | 250 | — |
| 1,28 | 40 | — | 43 | 63 | 65 | — | 8198 | 202 | — |
| 1,29 | 75 | — | 78 | — | — | — | 143 | 146 | — |
| 1,30 | 109 | — | 113 | 36 | — | 38 | 79 | 81 | — |
Отметим, что представленные данные соответствуют корректирующему электролиту с плотностью 1,40 г/см3. Если жидкость будет иметь другое значение, то возникает необходимость использовать следующую формулу расчёта для рассматриваемого показателя:
Если жидкость будет иметь другое значение, то возникает необходимость использовать следующую формулу расчёта для рассматриваемого показателя:
Представленные вычисления можно заменить методом золотого сечения, который гораздо проще применить на практике:
- Откачать больший объём воды из банки аккумулятора.
- Вылить полученную воду в специальный стакан с делениями, чтобы получить информацию о величине.
- Заполнить половину освободившегося объёма банки необходимым количеством электролита.
- Если значение ещё не соответствует требуемому, то долить ¼ от откаченной величины.
- Продолжать добавлять раствор до достижения оптимального результата.
Кислотная среда небезопасна для человека при неграмотном обращении. Целесообразно соблюдать все меры предосторожности, чтобы раствор электролита не попал на кожу или в дыхательные пути. Осуществлять корректировку рассматриваемой величины рекомендуется в помещениях с хорошей вентиляцией.
Возникают ситуации, в которых значение показателя опускается ниже 1,18 г/см3. В таких случаях использование электролита должно сопровождаться применением кислоты. Причём алгоритм действий изменения плотности включает в себя аналогичные этапы с одной поправкой: шаг разбавления при таком значении должен быть небольшим. Это связано с тем фактом, что плотность электролита имеет очень большую концентрацию, и возникает вероятность пропустить нужную отметку.
В процессе приготовления раствора в жидкость нужно вливать кислоту, а не наоборот.
При определённых обстоятельствах не представляется возможным исправить плотность электролита. Поэтому есть только один выход: купить новый аккумулятор. Возникает вопрос: как определить такие случаи? Очень просто: электролит становится коричневого оттенка, что свидетельствует об осыпании активной массы, принимающей участие в реакции электрохимического плана. Следовательно, это приводит к постепенной поломке аккумуляторной батареи.
Чтобы такая ситуация не застала врасплох, необходимо знать, что хороший АКБ будет служить в течение 5 лет при следовании всем эксплуатационным правилам. Следовательно, если данный срок истёк, то нет смысла проводить манипуляции по ремонту батареи. Если вы хотите, чтобы ваш прибор прослужил положенный срок, то следуйте следующим указаниям:
- контролируйте плотность с помощью ареометра;
- обеспечивайте грамотное обслуживание;
- проверять уровень заряда.
Чем грозит завышенная или заниженная плотность электролита?
Оптимальный уровень плотности находится в пределах от 1,27 до 1,35 г/см3 в соответствии с сезоном и температурным режимом региона. Если значение рассматриваемого показателя выше нормы, то это свидетельствует о завышении, что отрицательно влияет на функционирование автомобиля. Данный процесс может привести к повреждениям аккумуляторной батареи. В ситуациях, при которых наблюдается противоположная картина, существует вероятность того, что автомобиль не заведётся. Главная причина в том, что АКБ замёрзнет при низких температурах.
В ситуациях, при которых наблюдается противоположная картина, существует вероятность того, что автомобиль не заведётся. Главная причина в том, что АКБ замёрзнет при низких температурах.
Следовательно, необходимо контролировать значение, чтобы плотность электролита в аккумуляторе зимой и летом соответствовала оптимальной. Это поможет избежать возникновения непредвиденных обстоятельств. Однако сделать подобное проблематично, так как плотность изменяется при разных уровнях заряда аккумулятора. Например, при её уменьшении происходит поглощение дистиллированной жидкости батареей, что приводит к увеличению концентрации показателя. В обратных ситуациях возникает процесс сульфатации, ведущий к снижению уровня плотности. В результате этой химической реакции пластины наглухо закрываются и теряют возможность правильно заряжаться. Главный исход – выход из строя АКБ.
Плотность электролита в аккумуляторе — зимой и летом: таблица
Большая часть аккумуляторных батарей, которые продаются в России, относится к полуобслуживаемым. Это означает, что владелец может откручивать пробки, проверять уровень и плотность электролита и при необходимости доливать внутрь дистиллированную воду. Все кислотные АКБ, когда только поступают в продажу, заряжены, как правило, на 80 процентов. При покупке следите за тем, чтобы продавец выполнил предпродажную проверку, одним из пунктов которой является проверка плотности электролита в каждой из банок.
Это означает, что владелец может откручивать пробки, проверять уровень и плотность электролита и при необходимости доливать внутрь дистиллированную воду. Все кислотные АКБ, когда только поступают в продажу, заряжены, как правило, на 80 процентов. При покупке следите за тем, чтобы продавец выполнил предпродажную проверку, одним из пунктов которой является проверка плотности электролита в каждой из банок.
В сегодняшней статье на нашем портале Vodi.su мы рассмотрим понятие плотности электролита: что это такое, какой она должна быть зимой и летом, как ее повысить.
В кислотных АКБ в качестве электролита применяется раствор h3SO4, то есть серной кислоты. Плотность напрямую связана с процентным содержанием раствора — чем больше серы, тем она выше. Еще один немаловажный фактор — температура самого электролита и окружающего воздуха. Зимой плотность должна быть выше, чем летом. Если же она упадет до критической отметки, то электролит попросту замерзнет со всеми вытекающими последствиями.
Измеряется данный показатель в граммах на сантиметр кубический — г/см3. Измеряют ее при помощи простого прибора ареометра, который собой представляет стеклянную колбу с грушей на конце и поплавком со шкалой в середине. При покупке нового АКБ продавец обязан измерить плотность, она должна составлять, в зависимости от географической и климатической зоны, 1,20-1,28 г/см3. Допускается разница по банкам не более 0,01 г/см3. Если же разница больше, это свидетельствует о возможном коротком замыкании в одной из ячеек. Если же плотность одинаково низкая во всех банках, это говорит как о полном разряде батареи, так и о сульфатации пластин.
Помимо измерения плотности продавец должен также проверить, как аккумулятор держит нагрузку. Для этого применяют нагрузочную вилку. В идеале напряжение должно падать с 12 до девяти Вольт и держаться на этой отметке некоторое время. Если же оно падает быстрее, а электролит в одной из банок кипит и выделяет пар, значит от покупки этой АКБ следует отказаться.
Плотность в зимний и летний период
Более детально данный параметр для вашей конкретной модели АКБ нужно изучить в гарантийном талоне. Созданы специальные таблицы для различных температур, при которых электролит может замерзнуть. Так, при плотности 1,09 г/см3 замерзание происходит при -7°С. Для условий севера плотность должна превышать 1,28-1,29 г/см3, ведь при таком показателе температура его замерзания составляет -66°С.
Плотность обычно указывают для температуры воздуха +25°С. Она должна составлять для полностью заряженной батареи:
- 1,29 г/см3 — для температур в пределах от -30 до -50°С;
- 1,28 — при -15-30°С;
- 1,27 — при -4-15°С;
- 1,24-1,26 — при более высоких температурах.
Таким образом, если вы эксплуатируете автомобиль в летний период в географических широтах Москвы или Санкт-Петербурга, плотность может быть в пределах 1,25-1,27 г/см3. Зимой же, когда температуры опускаются ниже -20-30°С, плотность повышается до 1,28 г/см3.
Обратите внимание, что “повышать” ее искусственно никак не нужно. Вы попросту продолжаете пользоваться своим автомобилем в обычном режиме. А вот если АКБ быстро разряжается, имеется смысл провести диагностику и при необходимости поставить на зарядку. В случае же, если машина долго стоит на морозе без работы, АКБ лучше снять и унести в теплое место, иначе он от длительного простоя попросту разрядится, а электролит начнет кристаллизоваться.
Практические советы по эксплуатации АКБ
Самое основное правило, которое следует запомнить, — в батарею ни в коем случае нельзя заливать серную кислоту. Повышать плотность таким образом вредно, так как при повышении активизируются химические процессы, а именно сульфатации и коррозии, и уже через год пластины станут полностью ржавыми.
Регулярно проверяйте уровень электролита и при его падении доливайте дистиллированную воду. Затем АКБ нужно либо поставить на зарядку, чтобы кислота смешалась с водой, либо зарядить АКБ от генератора во время длительной поездки.
Если машину ставите «на прикол», то есть некоторое время не используете ее, то, даже если среднесуточные температуры опускаются ниже нуля, нужно позаботиться о том, чтобы АКБ был полностью заряжен. Это минимизирует риск замерзания электролита и разрушения свинцовых пластин.
При падении плотности электролита увеличивается его сопротивление, из-за чего, собственно, и затруднен запуск двигателя. Поэтому прежде, чем завести мотор, прогрейте электролит, включив на некоторое время фары или другое электрооборудование. Не забывайте также проверять состояние клемм и очищать их. Из-за плохого контакта пускового тока недостаточно для создания нужного крутящего момента.
Что такое аккумулятор? — learn.sparkfun.com
Добавлено в избранное Любимый 20Введение
Батареи — это совокупность одной или нескольких ячеек, химические реакции которых создают поток электронов в цепи. Все батареи состоят из трех основных компонентов: анода (сторона «-»), катода (сторона «+») и какого-то электролита (вещество, которое химически реагирует с анодом и катодом).
Все батареи состоят из трех основных компонентов: анода (сторона «-»), катода (сторона «+») и какого-то электролита (вещество, которое химически реагирует с анодом и катодом).
Когда анод и катод батареи подключены к цепи, между анодом и электролитом происходит химическая реакция. Эта реакция заставляет электроны проходить через цепь и возвращаться к катоду, где происходит другая химическая реакция. Когда материал в катоде или аноде расходуется или больше не может быть использован в реакции, батарея не может производить электричество. В этот момент ваша батарея «разряжена».
Батареи, которые необходимо выбрасывать после использования, известны как первичные батареи .Батареи, которые можно перезаряжать, называются вторичными батареями и .
Литий-полимерные батареи, например, можно заряжать
Без батарей ваш квадрокоптер пришлось бы привязать к стене, вам пришлось бы вручную провернуть машину, а ваш контроллер Xbox должен был бы быть постоянно подключен к сети (как в старые добрые времена).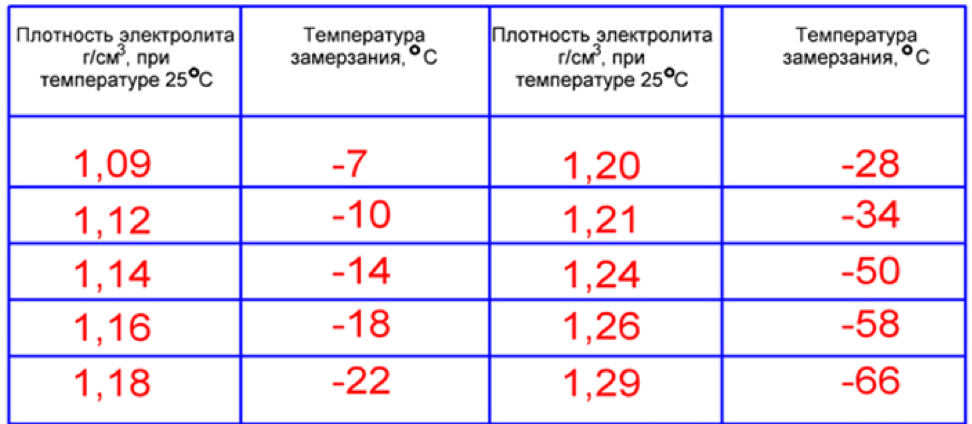 Батареи позволяют хранить потенциальную электрическую энергию в переносном контейнере.
Батареи позволяют хранить потенциальную электрическую энергию в переносном контейнере.
Батареи бывают разных форм, размеров и химического состава.
Изобретение современной батареи часто приписывают Алессандро Вольта. На самом деле все началось с удивительной аварии, связанной с рассечением лягушки.
Что вы узнаете
В этом руководстве будут подробно рассмотрены следующие темы:
- Как были изобретены батарейки
- Из каких частей состоит аккумулятор
- Как работает аккумулятор
- Общие термины, используемые для описания батарей
- Различные способы использования батарей в схемах
Рекомендуемая литература
Есть несколько концепций, с которыми вы, возможно, захотите ознакомиться перед тем, как начать читать это руководство:
Хотите изучить различные батареи?
Мы вас прикрыли!
Щелочная батарея 9 В
В наличии PRT-10218 Это ваши стандартные щелочные батареи на 9 вольт от Rayovac. Даже не думайте пытаться их перезарядить. Используйте их с…
Даже не думайте пытаться их перезарядить. Используйте их с…
История
Термин Батарея
Исторически слово «батарея» использовалось для описания «серии подобных объектов, сгруппированных вместе для выполнения определенной функции», как в случае артиллерийской батареи. В 1749 году Бенджамин Франклин впервые использовал этот термин для описания серии конденсаторов, которые он соединил вместе для своих экспериментов с электричеством.Позже этот термин будет использоваться для любых электрохимических ячеек, соединенных вместе с целью обеспечения электроэнергии.
Батарея «конденсаторов» Лейденской банки, соединенная вместе(Изображение любезно предоставлено Альвинруном из Wikimedia Commons)
Изобретение батареи
В один роковой день 1780 года итальянский физик, врач, биолог и философ Луиджи Гальвани рассекал лягушку, прикрепленную к медному крючку. Когда он коснулся лягушачьей лапы железным отростком, нога дернулась.Гальвани предположил, что энергия исходит от самой ноги, но его коллега-ученый Алессандро Вольта считал иначе.
Когда он коснулся лягушачьей лапы железным отростком, нога дернулась.Гальвани предположил, что энергия исходит от самой ноги, но его коллега-ученый Алессандро Вольта считал иначе.
Вольта выдвинул гипотезу, что импульсы лягушачьей лапки на самом деле были вызваны различными металлами, пропитанными жидкостью. Он повторил эксперимент, используя ткань, пропитанную рассолом, вместо трупа лягушки, что привело к аналогичному напряжению. Вольта опубликовал свои открытия в 1791 году, а позже создал первую батарею, гальваническую батарею, в 1800 году.
Гальваническая свая состояла из набора цинковых и медных пластин, разделенных тканью, пропитанной рассолом
СтопкаVolta страдала от двух основных проблем: из-за ее веса электролит вытек из ткани, а особые химические свойства компонентов привели к очень короткому сроку службы (около часа).Следующие двести лет уйдут на совершенствование конструкции Вольты и решение этих проблем.
Исправления к гальванической свае
Уильям Крукшанк из Шотландии решил проблему утечки, положив гальваническую батарею на бок, чтобы сформировать «желобную батарею».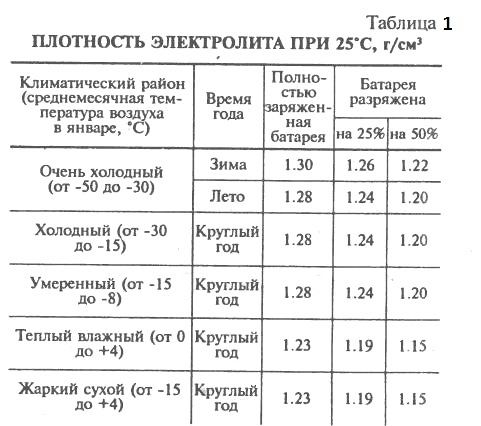
Лотковая батарея решила проблему утечки гальванической сваи
Вторая проблема, короткий срок службы, была вызвана разложением цинка из-за примесей и скоплением пузырьков водорода на меди.В 1835 году Уильям Стерджен обнаружил, что обработка цинка ртутью предотвратит разложение.
Британский химик Джон Фредерик Дэниелл использовал второй электролит, который вступал в реакцию с водородом, предотвращая накопление на медном катоде. Батарея Даниэля с двумя электролитами, известная как «элемент Даниэля», станет очень популярным решением для обеспечения энергией зарождающихся телеграфных сетей.
Коллекция клеток Даниэля из 1836 г.
Первая аккумуляторная батарея
В 1859 году французский физик Гастон Планте создал батарею из двух прокатанных листов свинца, погруженных в серную кислоту.Путем реверсирования электрического тока через батарею химия вернется в исходное состояние, создав первую перезаряжаемую батарею.
Позже, в 1881 году, Камилла Альфонс Фор улучшила конструкцию Планте, превратив листы свинца в пластины. Эта новая конструкция упростила производство аккумуляторов, и свинцово-кислотные аккумуляторы получили широкое распространение в автомобилях.
-> Дизайн обычного «автомобильного аккумулятора» существует уже более 100 лет
(Изображение любезно предоставлено Эмилианом Робертом Виколом из Wikimedia Commons) <-
Сухая камера
Вплоть до конца 1800-х годов электролит в батареях был в жидком состоянии.Это сделало транспортировку аккумуляторов очень осторожным делом, и большинство аккумуляторов никогда не предназначалось для перемещения после подключения к цепи.
В 1866 году Жорж Лекланше создал батарею, используя цинковый анод, катод из диоксида марганца и раствор хлорида аммония в качестве электролита. Хотя электролит в элементе Лекланше был все еще жидким, химический состав батареи оказался важным шагом для изобретения сухого элемента.
Карл Гасснер придумал, как создать электролитную пасту из хлорида аммония и гипса.Он запатентовал новую «сухую» батарею в 1886 году в Германии.
Эти новые сухие элементы, обычно называемые «угольно-цинковыми батареями», производились массово и пользовались огромной популярностью до конца 1950-х годов. Хотя углерод не используется в химической реакции, он играет важную роль в качестве электрического проводника в углеродно-цинковой батарее.
-> Цинк-угольная батарея 3 В 1960-х годов
(Изображение любезно предоставлено PhFabre из Wikimedia Commons) <-
В 1950-х годах Льюис Урри, Пол Марсал и Карл Кордеш из компании Union Carbide (позже известной как «Eveready», а затем «Energizer») заменили электролит хлористого аммония щелочным веществом на основе химического состава батареи, сформулированного Вальдемаром. Юнгнер в 1899 году.Щелочные батареи с сухими элементами могут содержать больше энергии, чем угольно-цинковые батареи того же размера, и имеют более длительный срок хранения.
Щелочные батареи приобрели популярность в 1960-х годах, обогнали угольно-цинковые батареи и с тех пор стали стандартными первичными элементами для потребительского использования.
-> Щелочные батареи бывают разных форм и размеров
(Изображение любезно предоставлено Aney ~ commonswiki из Wikimedia Commons) <-
Аккумуляторы 20-го века
В 1970-х годах компания COMSAT разработала никель-водородную батарею для использования в спутниках связи.Эти батареи хранят водород в газообразной форме под давлением. Многие искусственные спутники, такие как Международная космическая станция, по-прежнему используют никель-водородные батареи.
Исследования нескольких компаний с конца 1960-х годов привели к созданию никель-металлгидридной (NiMH) батареи. NiMH батареи были выпущены на потребительский рынок в 1989 году и стали более дешевой альтернативой никель-водородным аккумуляторным элементам меньшего размера.
Японская компания Asahi Chemical создала первую литий-ионную батарею в 1985 году, а Sony создала первую коммерческую литий-ионную батарею в 1991 году. В конце 1990-х годов был создан мягкий гибкий корпус для литий-ионных аккумуляторов, в результате чего возникли «литий-полимерные» или «LiPo» аккумуляторы.
В конце 1990-х годов был создан мягкий гибкий корпус для литий-ионных аккумуляторов, в результате чего возникли «литий-полимерные» или «LiPo» аккумуляторы.
Химические реакции в литий-полимерной батарее практически такие же, как и в литий-ионной батарее
Очевидно, что было изобретено, произведено и устарело гораздо больше химикатов батарей. Если вы хотите узнать больше о современных и популярных технологиях аккумуляторов, ознакомьтесь с нашим руководством по технологиям аккумуляторов.
Компоненты
Батареисостоят из трех основных компонентов: анода , катода и электролита . Сепаратор часто используется для предотвращения соприкосновения анода и катода, если электролита недостаточно. Для хранения этих компонентов аккумуляторы обычно имеют какой-то кожух .
Хорошо, большинство батарей на самом деле не разделены на три равные части, но вы поняли.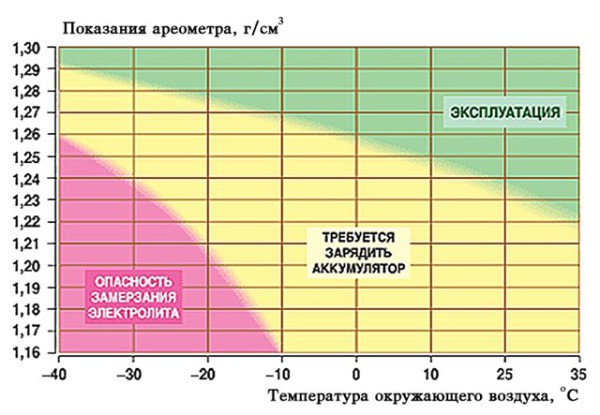 Лучшее поперечное сечение щелочной ячейки можно найти в Википедии.
Лучшее поперечное сечение щелочной ячейки можно найти в Википедии. И анод, и катод относятся к типу электродов . Электроды — это проводники, через которые электричество входит или выходит из компонента в цепи.
Анод
Электроны выходят из анода в устройстве, подключенном к цепи. Это означает, что обычный «ток» течет в анод.
На аккумуляторах анод обозначен как отрицательная (-) клемма
В батарее химическая реакция между анодом и электролитом вызывает накопление электронов на аноде.Эти электроны хотят двигаться к катоду, но не могут пройти через электролит или сепаратор.
Катод
Электроны текут в катод в устройстве, подключенном к цепи. Это означает, что обычный «ток» течет из катода.
На аккумуляторах катод помечен как положительный (+) вывод
В батареях в химической реакции внутри катода или вокруг него используются электроны, образующиеся на аноде. Электроны могут попасть на катод только через цепь, внешнюю по отношению к батарее.
Электроны могут попасть на катод только через цепь, внешнюю по отношению к батарее.
Электролит
Электролит — это вещество, часто жидкость или гель, способное переносить ионы между химическими реакциями, происходящими на аноде и катоде. Электролит также препятствует потоку электронов между анодом и катодом, так что электроны легче проходят через внешнюю цепь, чем через электролит.
-> В щелочных батареях может протекать электролит, гидроксид калия, если они подвергаются воздействию высоких температур или обратного напряжения.
(Изображение любезно предоставлено Вильямом Дэвисом из Wikimedia Commons) <-
Электролит имеет решающее значение в работе аккумулятора.Поскольку электроны не могут проходить через него, они вынуждены проходить через электрические проводники в виде цепи, соединяющей анод с катодом.
Сепаратор
Сепараторы представляют собой пористые материалы, которые предотвращают соприкосновение анода и катода, что может вызвать короткое замыкание в батарее. Сепараторы могут быть изготовлены из различных материалов, включая хлопок, нейлон, полиэстер, картон и синтетические полимерные пленки. Сепараторы не вступают в химическую реакцию ни с анодом, ни с катодом, ни с электролитом.
Сепараторы могут быть изготовлены из различных материалов, включая хлопок, нейлон, полиэстер, картон и синтетические полимерные пленки. Сепараторы не вступают в химическую реакцию ни с анодом, ни с катодом, ни с электролитом.
В гальванической куче использовалась ткань или картон (разделитель), пропитанные рассолом (электролитом), чтобы электроды разнесены.
Ионы в электролите могут быть положительно заряженными, отрицательно заряженными и иметь различные размеры. Могут быть изготовлены специальные сепараторы, которые пропускают одни ионы, но не пропускают другие.
Кожух
Большинству батарей требуется способ удерживать химические компоненты. Кожухи, также известные как «кожухи» или «оболочки», представляют собой просто механические конструкции, предназначенные для удержания внутренних компонентов батареи.
Свинцово-кислотный аккумулятор в пластиковом корпусе
Корпуса батареймогут быть изготовлены практически из чего угодно: из пластика, стали, мягких пластиковых пакетов и т. Д. В некоторых батареях используется токопроводящий стальной кожух, который электрически соединен с одним из электродов. В случае обычного щелочного элемента AA стальной кожух соединен с катодом.
Операция
Батареи обычно требуют нескольких химических реакций для работы.По крайней мере, одна реакция происходит внутри анода или вокруг него, и одна или несколько реакций происходят внутри или вокруг катода. Во всех случаях реакция на аноде дает дополнительные электроны в процессе, называемом окислением , а реакция на катоде использует дополнительные электроны во время процесса, известного как восстановление .
Когда переключатель замкнут, цепь замыкается, и электроны могут течь от анода к катоду. Эти электроны активируют химические реакции на аноде и катоде.
По сути, мы разделяем определенный вид химической реакции, реакцию восстановления-окисления или окислительно-восстановительную реакцию, на две отдельные части. При переносе электронов между химическими веществами происходят окислительно-восстановительные реакции. Мы можем использовать движение электронов в этой реакции, чтобы они выходили за пределы батареи и питали нашу цепь.
Анодное окисление
Эта первая часть окислительно-восстановительной реакции, окисление, происходит между анодом и электролитом и производит электроны (обозначены как e — ).
Некоторые реакции окисления образуют ионы, например, в литий-ионной батарее. В других химических реакциях расходуются ионы, как в обычных щелочных батареях. В любом случае ионы могут свободно проходить через электролит, а электроны — нет.
Катодное восстановление
Другая половина окислительно-восстановительной реакции, восстановление, происходит в катоде или рядом с ним. Электроны, образующиеся в результате реакции окисления, расходуются во время восстановления.
В некоторых случаях, например, в литий-ионных батареях, положительно заряженные ионы лития, образующиеся во время реакции окисления, расходуются во время восстановления.В других случаях, например, в щелочных батареях, во время восстановления образуются отрицательно заряженные ионы.
Электронный поток
В большинстве батарей некоторые или все химические реакции могут происходить, даже когда батарея не подключена к цепи. Эти реакции могут повлиять на срок годности батареи.
По большей части, реакции будут происходить с полной силой только тогда, когда между анодом и катодом замыкается электрически проводящая цепь. Чем меньше сопротивление между анодом и катодом, тем больше электронов может течь и тем быстрее протекают химические реакции.
Короткое замыкание в аккумуляторе (в данном случае даже случайное) может быть опасным. Известно, что литий-ионные батареи перегреваются и даже задымляются или загораются при коротком замыкании.
Мы можем пропускать эти движущиеся электроны через различные электрические компоненты, известные как «нагрузка», для выполнения чего-то полезного. В анимационном ролике в начале этого раздела мы зажигаем виртуальную лампочку движущимися электронами.
Батарея разряжена
Химические вещества в аккумуляторе в конечном итоге достигают состояния равновесия. В этом состоянии химические вещества больше не будут реагировать, и в результате аккумулятор больше не будет генерировать электрический ток. На данный момент аккумулятор считается «мертвым».
Первичные элементы необходимо утилизировать, когда батарея разряжена. Вторичные элементы можно перезаряжать, и это достигается путем подачи через батарею обратного электрического тока.Перезарядка происходит, когда химические вещества выполняют еще одну серию реакций, чтобы вернуть их в исходное состояние.
Терминология
Люди часто используют общий набор терминов, говоря о напряжении аккумулятора, емкости, возможности источника тока и так далее.
Ячейка
Элемент относится к одному аноду и катоду, разделенным электролитом, используемым для выработки напряжения и тока. Батарея может состоять из одной или нескольких ячеек.Например, одна батарея AA — это одна ячейка. Автомобильные аккумуляторы содержат шесть ячеек по 2,1 В.
Обычная 9-вольтовая батарея содержит шесть щелочных элементов по 1,5 В, установленных друг над другом
Первичный
Первичные клетки содержат химический состав, который нельзя изменить. В результате аккумулятор необходимо выбрасывать после того, как он разрядился.
Среднее
Вторичные элементы можно перезаряжать, и их химический состав возвращается в исходное состояние.Эти элементы, иначе известные как «аккумуляторные батареи», можно использовать много раз.
Номинальное напряжение
Номинальное напряжение аккумулятора — это напряжение, указанное производителем.
Например, щелочные батареи типа AA указаны как имеющие напряжение 1,5 В. В этой статье Mad Scientist Hut показано, что их испытанные щелочные батареи начинаются с напряжения около 1,55 В, а затем медленно теряют напряжение по мере разряда. В этом примере номинальное напряжение «1,5 В» относится к максимальному или пусковому напряжению батареи.
Этот аккумуляторный блок Storm для квадрокоптеров показывает кривую разряда для их LiPo-элементов, начиная с 4,2 В и снижаясь до 2,8 В по мере разряда. Номинальное напряжение, указанное для большинства литий-ионных и LiPo-элементов, составляет 3,7 В. В этом случае номинальное напряжение «3,7 В» относится к среднему напряжению аккумулятора в течение всего цикла разряда.
Вместимость
Емкость аккумулятора — это мера количества электрического заряда, который он может доставить при определенном напряжении. Большинство батарей рассчитаны на ампер-часы (Ач) или миллиампер-часы (мАч).
Этот LiPo аккумулятор рассчитан на 1000 мАч, что означает, что он может обеспечить 1 ампер в течение 1 часа, прежде чем он будет считаться разряженным.
Большинство графиков разряда батареи показывают зависимость напряжения батареи от емкости, например, эти тесты батареи AA, проведенные PowerStream. Чтобы выяснить, достаточно ли емкости аккумулятора для питания вашей цепи, найдите самое низкое допустимое напряжение и найдите соответствующий номинал мАч или Ач.
C-скорость
Многие батареи, особенно мощные литий-ионные, обозначают ток разряда как «C-Rate», чтобы более четко определить характеристики батареи.C-Rate — это скорость разряда относительно максимальной емкости аккумулятора.
1С — это количество тока, необходимое для разрядки аккумулятора за 1 час. Например, аккумулятор емкостью 400 мАч, обеспечивающий ток 1С, будет обеспечивать 400 мА. 5С для той же батареи будет 2 А.
Большинство батарей теряют емкость при повышенном потреблении тока. Например, этот информационный график продукта от Chargery показывает, что их LiPo-элемент имеет меньше мАч при более высоких скоростях C.
ПРИМЕЧАНИЕ: Общий совет гласит, что вы должны заряжать LiPo батареи при 1С или ниже.
MIT предлагает фантастическое руководство по спецификациям и терминологии батарей, которое идет намного дальше этого обзора.
Использование
Однокамерный
Некоторые схемы могут питаться от одного элемента, но убедитесь, что батарея может обеспечивать достаточное напряжение и ток.
Этот экран для фотонной батареи питается от одного элемента LiPoЕсли напряжение слишком высокое или слишком низкое для вашей схемы, вам, вероятно, понадобится преобразователь постоянного тока в постоянный.
серии
Чтобы увеличить напряжение между выводами батареи, вы можете расположить элементы последовательно. Последовательность означает штабелирование ячеек встык, соединение анода одного с катодом следующего.
Последовательно соединяя батареи, вы увеличиваете общее напряжение. Сложите напряжение всех ячеек, чтобы определить рабочее напряжение. Емкость остается прежней.
В этом примере четыре ячейки 1,5 В соединены последовательно.Напряжение на нагрузке составляет 6 В, а общий набор аккумуляторов имеет емкость 2000 мАч.
В большинстве бытовых электронных устройств, в которых используются щелочные батареи, батареи устанавливаются последовательно. Например, этот держатель батареек 2x AA может поднять номинальное напряжение до 3 В для проекта.
ПРИМЕЧАНИЕ: Если вы заряжаете литий-ионные или литий-полимерные батареи последовательно, вам необходимо обязательно использовать специальные схемы, известные как «балансировщик», чтобы обеспечить равномерное напряжение между элементами.Некоторые зарядные устройства, такие как это, имеют балансиры для безопасной зарядки.Параллельно
Если напряжение отдельной ячейки соответствует нагрузке, вы можете добавить батареи параллельно, чтобы увеличить емкость. Обратите внимание, что это также означает увеличение доступного тока (C-Rate).
Будьте осторожны при параллельном подключении аккумуляторов! Все элементы должны иметь одинаковое номинальное напряжение и одинаковый уровень заряда. Если есть какая-либо разница в напряжении, может произойти короткое замыкание, что приведет к перегреву и, возможно, возгоранию.
В этом примере четыре ячейки 1,5 В подключены параллельно. Напряжение на нагрузке остается на уровне 1,5 В, но общая емкость увеличивается до 8000 мАч.
Серияи параллельный
Если вы хотите увеличить напряжение и емкость, вы можете комбинировать последовательные и параллельные батареи. Еще раз убедитесь, что уровень напряжения одинаков для батарей, включенных параллельно, поскольку может произойти короткое замыкание.
В этом примере полное напряжение на нагрузке составляет 3 В, а общая емкость аккумуляторов составляет 4000 мАч.
В больших аккумуляторных блоках, особенно литий-ионных, вы часто видите конфигурацию, указанную с использованием «S» и «P» для последовательного и параллельного подключения. Конфигурация схемы выше — 2S2P. В качестве практического примера современные электромобили используют массивные массивы батарей, соединенных последовательно и параллельно.
Ресурсы и дальнейшее развитие
К настоящему времени вы должны понимать, как были изобретены батарейки и как они работают. Батареи — это один из способов обеспечения вашего проекта электроэнергией, и они могут быть невероятно полезны, если вам нужен портативный источник питания.
Если вы хотите больше узнать о батареях, вот еще несколько уроков:
Хотите увидеть аккумуляторы в действии? Взгляните на эти проекты, в которых используются разные батареи в разных конфигурациях:
Simon Splosion Wireless
Это учебное пособие, демонстрирующее один из многих методов «взлома» Саймона Сэйса. Мы выделим технику, чтобы взять ваш Simon Says Wireless.
Frontiers | Интерфейсы между катодом и электролитом в твердотельных литиевых батареях: проблемы и перспективы
Kaihui Nie 1,2 , Yanshuai Hong 1,2 , Jiliang Qiu 1,2 , Qinghao Li 1,2 * , Xiqian Yu 1,2 * , Hong Li 1 , 2 и Ликван Чен 1,2- 1 Лаборатория возобновляемых источников энергии, Институт физики Китайской академии наук, Пекин, Китай
- 2 Университет Китайской академии наук, Пекин, Китай
Твердотельные литиевые батареи широко признаются в качестве многообещающих кандидатов для следующего поколения различных устройств накопления энергии с вероятностью реализации улучшенной плотности энергии и превосходных характеристик безопасности.Тем не менее, граница раздела между электродом и твердым электролитом остается ключевой проблемой, которая препятствует практическому развитию твердотельных литиевых батарей. В этом обзоре мы уделяем особое внимание границе раздела между твердыми электролитами и преобладающими катодами. Вкратце изложены основные принципы формирования интерфейсного слоя и можно выделить три типа интерфейсных слоев. Для типичных твердотельных литиевых батарей наиболее распространенной и сложной задачей является достижение и поддержание тесного контакта твердое тело-твердое тело.Между тем, различные конкретные проблемы возникают с различными типами твердых электролитов в зависимости от внутренних свойств соседних твердых компонентов. Наше обсуждение в основном касается следующих электролитов, включая твердый полимерный электролит, неорганический твердый оксид и сульфидные электролиты, а также композитные электролиты. Обобщены также эффективные стратегии преодоления нестабильности интерфейса. Для фундаментального выяснения межфазного поведения необходимы передовые методы определения характеристик с течением времени и разрешение в атомарном масштабе, чтобы получить больше информации с разных точек зрения.Здесь также рассматривается недавний прогресс, достигнутый благодаря расширенной характеристике. Мы подчеркиваем, что совместная характеристика различных передовых методов характеризации необходима для окончательного разъяснения поведения границы раздела фаз, и подчеркиваем, что комбинация различных стратегий модификации поверхности раздела требуется для создания приличной поверхности раздела катод-электролит для превосходных твердотельных литиевых батарей.
Введение
Ежедневно растущее потребление энергии требует усовершенствованных аккумуляторов с более высокой плотностью энергии и превосходными характеристиками безопасности, особенно для крупномасштабных приложений, таких как электромобили и энергосистемы хранения (Tarascon and Armand, 2001).В твердотельных литиевых батареях обычный жидкий электролит на основе легковоспламеняющихся карбонатных компонентов заменяется твердым электролитом. Таким образом, проблема безопасности, связанная с тепловым разгоном и сгоранием электролита, вероятно, будет значительно снижена (Zhang et al., 2013). Благодаря механическим свойствам твердого электролита твердотельные литиевые батареи могут в значительной степени противостоять дендриту лития, а срок службы может быть продлен дольше, чем у литиевых батарей на основе жидкого электролита.Широкое окно электрохимической стабильности твердого электролита может дополнительно сделать возможным применение металлического Li в качестве анода и катодов с еще более высоким окислительным потенциалом. При большей разнице химических потенциалов лития между анодом и катодом накопление энергии может быть соответственно значительно улучшено. Благодаря этим блестящим свойствам твердотельные литиевые батареи привлекли большое внимание исследователей в последние годы и стали многообещающими кандидатами для устройств хранения энергии следующего поколения с ожиданиями улучшенных характеристик безопасности, более длительного срока службы и более высокой плотности энергии (Bates et al., 2000; Duan et al., 2017). В зависимости от того, содержит ли батарея жидкий электролит или нет, твердотельные литиевые батареи можно разделить на все твердотельные литиевые батареи и гибридные литиевые батареи с твердым жидким электролитом (Cao et al., 2018).
Разработке практически доступных твердотельных литиевых батарей препятствуют два основных узких места. Первый — это низкая ионная проводимость твердого электролита, которая на несколько порядков ниже, чем у жидкого электролита при комнатной температуре (RT).В последние десятилетия непрерывные исследовательские усилия были направлены на создание твердого электролита превосходного качества, и к настоящему времени достигнут значительный прогресс. До сих пор ионная проводимость некоторых систем при комнатной температуре приближалась или даже превышала проводимость жидких электролитов. RT-проводимость оксидов типа NASICON (Aono et al., 1990; Fergus, 2012) и литиевых гранатов (Murugan et al., 2007) достигла ~ 1 мСм см −1 . Като и др. дополнительно увеличил число до ~ 25 мСм см -1 в Li 9.54 Si 1,74 P 1,44 S 11,7 Cl 0,3 (Kato et al., 2016). Сейчас доступны приличные твердые электролиты с изначально высокой проводимостью Li + , числом переноса ионов лития t Li + ~ 1 и, в частности, без стадии десольватации по сравнению с органическими жидкими электролитами, t Li + составляет около 0,2 0,5 (Xu, 2004; Zugmann et al., 2011). Ожидается, что соответствующие твердотельные литиевые батареи будут демонстрировать большую емкость и высокую плотность мощности для будущих применений (Kato et al., 2016).
Несмотря на быстрое развитие самого твердого электролита, еще более серьезным препятствием для твердотельных литиевых батарей является высокое межфазное сопротивление, вызванное плохим контактом и межфазными реакциями (Zhang et al., 2016). Без текучести жидкости сложно получить плотный контакт между твердым электролитом и электродом. Периодический электрод, расширяющийся и сжимающийся во время цикла, еще больше ухудшает механический контакт между частицами. Как следствие, высокая поляризация и низкое использование активных материалов являются обычными для твердотельных литиевых батарей.Между тем, нестабильность высокого напряжения твердого электролита — еще одна заслуживающая внимания проблема для твердотельных литиевых батарей. Ожидается, что твердые электролиты обеспечат более широкий интервал электрохимической стабильности по сравнению с жидким электролитом. В литературе также сообщается о широком электрохимическом окне до 5,0 В или даже 6,0 В в системе инертных электродов. Однако некоторые результаты расчетов и экспериментальные результаты подтвердили, что окно не так высоко, как сообщалось ранее (Han et al., 2016). В частности, для SPE, преобладающие экспериментальные отчеты по которым в основном основаны на катоде LiFePO 4 с циклом в пределах 3.8 V. Учитывая каталитическое поведение оксидов переходных металлов, практическая стабильность твердого электролита при высоком напряжении все еще требует дальнейшего исследования и проверки. Более того, профиль электрического потенциала на границе раздела электрод-электролит все еще остается без ответа проблемой, которая оказывает значительное влияние на реакцию на границе раздела и характеристики батареи. Было проведено множество исследований резкого изменения электрического потенциала на границе раздела катод-электролит (Liang et al., 2018). И было указано, что межфазные побочные реакции могут резко ускоряться из-за специфического местного электрического потенциала. Тем не менее, до сих пор отсутствует глубокое и систематическое понимание потенциального распределения профилей по интерфейсу и его соответствующего влияния на inte
Simple English Wikipedia, бесплатную энциклопедию
Схематический символ батареиАккумулятор преобразует химическую энергию в электрическую с помощью химической реакции.Обычно химические вещества хранятся внутри батареи. Он используется в цепи для питания других компонентов. Батарея вырабатывает электричество постоянного тока (DC) (электричество, которое течет в одном направлении и не переключается туда и обратно).
Использование электричества из розетки в здании дешевле и эффективнее, но аккумулятор может обеспечивать электричеством в районах, где нет распределения электроэнергии. Это также полезно для движущихся вещей, например электромобилей и мобильных телефонов.
Батареи могут быть первичными или вторичными. Первичная цепь выбрасывается, когда она больше не может обеспечивать электричество. Вторичный аккумулятор можно заряжать и использовать повторно.
Батарея может состоять из одной ячейки или нескольких элементов . Каждая ячейка имеет анод, катод и электролит. Электролит — это основной материал внутри батареи. Часто это кислота, к которой прикасаться опасно. Анод реагирует с электролитом с образованием электронов (это отрицательный конец или —).Катод реагирует с электролитом и забирает электроны (это положительный конец или + конец). [1] Электрический ток возникает, когда провод соединяет анод с катодом, и электроны перемещаются от одного конца к другому. (Но аккумулятор может быть поврежден просто проводом, соединяющим два конца, поэтому между двумя концами также необходима нагрузка . Нагрузка — это то, что замедляет электроны и обычно делает что-то полезное, например, лампочку в фонарик, или электроника в калькуляторе). [2]
Батареи, подключенные параллельно — показаны на схеме и на чертежеЭлектролит может быть жидким или твердым. Батарея называется аккумулятором с влажным или сухим элементом, в зависимости от типа электролита.
Химические реакции, происходящие в батарее, являются экзотермическими реакциями. Этот тип реакции вызывает тепло. Например, если вы оставите ноутбук включенным на долгое время, а затем прикоснетесь к аккумулятору, он будет теплым или горячим.
Аккумуляторная батарея заряжается путем обращения вспять химической реакции, происходящей внутри батареи.Но перезаряжаемый аккумулятор можно заряжать только определенное количество раз (время зарядки). Даже встроенные батареи нельзя заряжать вечно. Более того, каждый раз, когда батарея заряжается, ее способность удерживать заряд немного снижается. Неперезаряжаемые батареи нельзя заряжать, так как могут вытечь различные вредные вещества, например гидроксид калия.
Ячейки могут быть подключены, чтобы сделать батарею большего размера. Соединение плюса одной ячейки с минусом следующей ячейки называется соединением их последовательно .Напряжение каждой батареи складывается. Две батареи по шесть вольт, соединенные последовательно, составят 12 вольт. [3]
Соединение положительного полюса одной ячейки с положительным полюсом другого, а отрицательного — с отрицательным называется соединением их параллельно . Напряжение остается прежним, но ток складывается. Напряжение — это давление, проталкивающее электроны по проводам, оно измеряется в вольтах. Ток — это то, сколько электронов может пройти одновременно, он измеряется в амперах.Комбинация тока и напряжения — это мощность (ватты = вольт x ампер) батареи.
Батареи бывают разных форм, размеров и напряжений.
Элементы AA, AAA, C и D, включая щелочные батареи, имеют стандартные размеры и форму и имеют напряжение около 1,5 В. Напряжение ячейки зависит от используемых химикатов. Электрический заряд, который он может передать, зависит от размера ячейки, а также от химических веществ. Заряд аккумулятора обычно измеряется в ампер-часах.Поскольку напряжение остается неизменным, больший заряд означает, что более крупный элемент может подавать больше ампер или работать в течение более длительного времени.
Первая батарея была изобретена в 1800 году Алессандро Вольта. В наши дни его аккумулятор называют гальваническим. [4]
В современных небольших батареях жидкость иммобилизируется в виде пасты, и все это помещается в герметичный корпус. Из-за этого ничего не может вылиться из аккумулятора. В более крупных аккумуляторах, таких как автомобильные, все еще есть жидкость, и они не герметичны.Разновидность батареи, в которой в качестве электролита используются расплавленные соли, была изобретена во время Второй мировой войны.
- Сухие элементы, элементы, не содержащие жидкости (или содержащие иммобилизованную жидкость, такую как паста или гель) в качестве электролита
- Первичная ячейка, ячейки, которые нельзя перезарядить
- Щелочная батарея, «щелочная», не перезаряжаемая
- Батарея ртутная, неперезаряжаемая
- Аккумулятор Leclanche, «сверхтяжелый», не перезаряжаемый
- Литиевая батарейка, неперезаряжаемая, «таблетка»
- Батарея из оксида серебра, неперезаряжаемая, батарейка для часов
- Вольтаическая свая, первая батарея Аллесандро Вольтаса
- Вторичный элемент, элементы, которые можно заряжать
- Первичная ячейка, ячейки, которые нельзя перезарядить
- Влажные элементы, элементы, содержащие жидкость в качестве электролита
- Топливный элемент, перезаряжаемый за счет добавления топлива
Топливные элементы и солнечные элементы не являются батареями, потому что они не накапливают энергию внутри себя.
Конденсатор не является батареей, потому что он не накапливает энергию в химической реакции. Конденсатор может накапливать электричество и производить электричество намного быстрее, чем батарея, но обычно он стоит слишком дорого, чтобы сделать его настолько большим, насколько может быть батарея. Ученые и инженеры-химики работают над улучшением конденсаторов и аккумуляторов для электромобилей.
Небольшие электрические генераторы, управляемые руками и ногами, могут обеспечивать питание небольших электрических устройств. Радиоприемники с часовым механизмом, заводные фонари и аналогичные устройства также имеют заводную пружину для хранения механической энергии.
Infogalactic: ядро планетарных знаний
Электролит — это вещество, которое при растворении в полярном растворителе, таком как вода, образует электропроводящий раствор. Растворенный электролит разделяется на катионы и анионы, которые равномерно диспергируются в растворителе. В электрическом отношении такой раствор нейтрален. Если к такому раствору приложить электрический потенциал (напряжение), катионы раствора будут притягиваться к электроду, который имеет большое количество электронов, в то время как анионы будут притягиваться к электроду, который имеет дефицит электронов.Движение анионов и катионов в противоположных направлениях внутри раствора составляет ток. Это включает большинство растворимых солей, кислот и оснований. Некоторые газы, такие как хлористый водород, в условиях высокой температуры или низкого давления также могут действовать как электролиты. Растворы электролитов также могут возникать в результате растворения некоторых биологических (например, ДНК, полипептиды) и синтетических полимеров (например, полистиролсульфоната), называемых полиэлектролитами, которые содержат заряженные функциональные группы.Вещество, которое в растворе диссоциирует на ионы, приобретает способность проводить электричество. Натрий, калий, хлорид, кальций и фосфат являются примерами электролитов, неофициально известных как литов . В медицине замена электролитов необходима, когда у пациента наблюдается длительная рвота или диарея, а также в ответ на тяжелую физическую активность. Доступны коммерческие растворы электролитов, особенно для больных детей (растворы, такие как Pedialyte) и спортсменов (спортивные напитки, такие как Gatorade).Электролитный мониторинг важен при лечении анорексии и булимии.
Этимология
Слово «электролит» происходит от греческого слова «lytós», что означает «способный развязываться или ослаблять». [ необходима ссылка ]
История
Сванте Аррениус в своей диссертации 1884 года изложил свое объяснение того факта, что твердые кристаллические соли при растворении диссоциируют на парные заряженные частицы, за что он получил Нобелевскую премию по химии 1903 года. [1] [2] [3] [4]
Аррениус объяснил, что при образовании раствора соль распадается на заряженные частицы, которые Майкл Фарадей дал название «ион» много лет назад. Фарадей считал, что ионы образуются в процессе электролиза. Аррениус предположил, что даже в отсутствие электрического тока растворы солей содержат ионы. Таким образом, он предположил, что химические реакции в растворе — это реакции между ионами. [2] [3] [4]
Формация
Растворы электролитов обычно образуются, когда соль помещается в растворитель, такой как вода, и отдельные компоненты диссоциируют из-за термодинамических взаимодействий между молекулами растворителя и растворенного вещества в процессе, называемом сольватацией. Например, когда поваренная соль (хлорид натрия) NaCl помещается в воду, соль (твердое вещество) растворяется на составляющие ионы в соответствии с реакцией диссоциации
- NaCl (с) → Na + (водн.) + Cl — (водн.)
Кроме того, вещества могут реагировать с водой с образованием ионов.Например, газообразный диоксид углерода растворяется в воде с образованием раствора, содержащего ионы гидроксония, карбоната и гидрокарбоната.
Расплавленные соли также могут быть электролитами, например, когда хлорид натрия расплавлен, жидкость проводит электричество. В частности, ионные жидкости, которые представляют собой расплавленные соли с температурой плавления ниже 100 ° C, представляют собой тип неводных электролитов с высокой проводимостью и, таким образом, находят все больше и больше применений в топливных элементах и батареях. [5]
Электролит в растворе можно охарактеризовать как концентрированный, если он имеет высокую концентрацию ионов, или как разбавленный, если он имеет низкую концентрацию.Если большая часть растворенного вещества диссоциирует с образованием свободных ионов, электролит сильный; если большая часть растворенного вещества не диссоциирует, электролит слаб. Свойства электролитов можно использовать с помощью электролиза для извлечения составляющих элементов и соединений, содержащихся в растворе.
Физиологическое значение
В физиологии первичными ионами электролитов являются натрий (Na + ), калий (K + ), кальций (Ca 2+ ), магний (Mg 2+ ), хлорид (Cl — ). ), гидрофосфат (HPO 4 2-) и гидрокарбонат (HCO 3 —).Символы электрического заряда в виде плюса (+) и минуса (-) указывают на то, что вещество имеет ионную природу и имеет несбалансированное распределение электронов в результате химической диссоциации. Натрий является основным электролитом, содержащимся во внеклеточной жидкости, и участвует в балансе жидкости и контроле артериального давления.
Все известные высшие формы жизни требуют тонкого и сложного электролитного баланса между внутриклеточной и внеклеточной средой. В частности, важно поддерживать точный осмотический градиент электролитов.Такие градиенты влияют и регулируют гидратацию тела, а также pH крови и имеют решающее значение для функции нервов и мышц. У живых организмов существуют различные механизмы, которые жестко контролируют концентрацию различных электролитов.
И мышечная ткань, и нейроны считаются электрическими тканями тела. Мышцы и нейроны активируются за счет активности электролитов между внеклеточной или интерстициальной жидкостью и внутриклеточной жидкостью. Электролиты могут проникать в клеточную мембрану или покидать ее через специализированные белковые структуры, встроенные в плазматическую мембрану, называемые ионными каналами.Например, сокращение мышц зависит от присутствия кальция (Ca 2+ ), натрия (Na + ) и калия (K + ). Без достаточного уровня этих ключевых электролитов может возникнуть мышечная слабость или сильные мышечные сокращения.
Электролитный баланс поддерживается пероральным или в экстренных случаях внутривенным (IV) приемом электролитсодержащих веществ и регулируется гормонами, как правило, почками, вымывающими излишки. У людей электролитный гомеостаз регулируется такими гормонами, как антидиуретический гормон, альдостерон и паратироидный гормон.Серьезные электролитные нарушения, такие как обезвоживание и гипергидратация, могут привести к сердечным и неврологическим осложнениям и, если они не будут быстро разрешены, вызовут неотложную медицинскую помощь.
Измерение
Измерение электролитов — это обычно выполняемая диагностическая процедура, выполняемая медицинскими технологами посредством анализа крови с помощью ионоселективных электродов или анализа мочи. Интерпретация этих значений бессмысленна без анализа истории болезни и часто невозможна без параллельного измерения почечной функции.Наиболее часто измеряемыми электролитами являются натрий и калий. Уровни хлоридов измеряются редко, за исключением анализа газов артериальной крови, поскольку они по своей природе связаны с уровнями натрия. Одним из важных тестов, проводимых с мочой, является тест на удельный вес, чтобы определить возникновение электролитного дисбаланса.
Регидратация
При пероральной регидратационной терапии электролитные напитки, содержащие соли натрия и калия, восполняют уровень воды и электролитов в организме после обезвоживания, вызванного физическими упражнениями, чрезмерным употреблением алкоголя, потоотделением (сильным потоотделением), диареей, рвотой, интоксикацией или голоданием.Спортсмены, тренирующиеся в экстремальных условиях (в течение трех или более часов непрерывно, например, марафон или триатлон), не потребляющие электролиты, рискуют обезвоживанием (или гипонатриемией). [6]
Домашний электролитный напиток можно приготовить, используя воду, сахар и соль в точных пропорциях. [7] Готовые препараты также доступны в продаже, [8] , а также для ветеринарного использования, например, Electrovite.
Электролиты обычно содержатся во фруктовых соках, кокосовой воде, спортивных напитках, молоке, орехах и многих фруктах и овощах (цельных или в форме сока) (например,г., картофель, авокадо).
Электрохимия
Основная статья: электролизКогда электроды помещены в электролит и приложено напряжение, электролит будет проводить электричество. Одинокие электроны обычно не могут проходить через электролит; вместо этого на катоде происходит химическая реакция, поглощающая электроны анода. Другая реакция происходит на аноде, производя электроны, которые в конечном итоге переносятся на катод. В результате в электролите вокруг катода образуется облако отрицательного заряда, а вокруг анода — положительный заряд.Ионы в электролите нейтрализуют эти заряды, позволяя электронам продолжать течь и реакции продолжаться.
Например, в растворе обычной поваренной соли (хлорида натрия, NaCl) в воде катодная реакция будет
- 2H 2 O + 2e — → 2OH — + H 2
и газообразный водород будет пузыриться; анодная реакция
- 2NaCl → 2 Na + + Cl 2 + 2e —
и газообразный хлор будет высвобожден.Положительно заряженные ионы натрия Na + будут реагировать на катод, нейтрализуя там отрицательный заряд OH —, а отрицательно заряженные ионы гидроксида OH — будут реагировать на анод, нейтрализуя положительный заряд Na +. там. Без ионов из электролита заряды вокруг электрода замедлили бы непрерывный поток электронов; диффузия H + и OH — через воду к другому электроду занимает больше времени, чем перемещение гораздо более распространенных солевых ионов.Электролиты диссоциируют в воде, потому что молекулы воды являются диполями, и диполи ориентируются энергетически выгодным образом для сольватации ионов.
В других системах в электродных реакциях могут участвовать металлы электродов, а также ионы электролита.
Электролитические проводники используются в электронных устройствах, где химическая реакция на границе раздела металл / электролит дает полезные эффекты.
- В аккумуляторах в качестве электродов используются два материала с разным сродством к электрону; электроны текут от одного электрода к другому вне батареи, в то время как внутри батареи цепь замыкается ионами электролита.Здесь электродные реакции преобразуют химическую энергию в электрическую. [9]
- В некоторых топливных элементах твердый электролит или протонный проводник электрически соединяет пластины, сохраняя при этом водородный и кислородный топливные газы разделенными. [10]
- В баках для гальваники электролит одновременно наносит металл на покрываемый объект и электрически соединяет этот объект в цепи.
- В манометрах два тонких столбика ртути разделены небольшим зазором, заполненным электролитом, и по мере прохождения заряда через устройство металл растворяется с одной стороны и отслаивается с другой, вызывая видимый зазор. медленно двигаться вперед.
- В электролитических конденсаторах химический эффект используется для создания чрезвычайно тонкого «диэлектрического» или изолирующего покрытия, в то время как слой электролита ведет себя как одна пластина конденсатора.
- В некоторых гигрометрах влажность воздуха определяется путем измерения проводимости почти сухого электролита.
- Горячее размягченное стекло является проводником электролита, и некоторые производители стекла поддерживают его в расплавленном состоянии, пропуская через него большой ток.
Твердые электролиты
Твердые электролиты в основном можно разделить на четыре группы:
- Гелевые электролиты — они очень похожи на жидкие электролиты.По сути, это жидкости в гибком решетчатом каркасе. Для увеличения проводимости таких систем часто применяются различные добавки. [9] [11]
- Сухие полимерные электролиты — они отличаются от жидких и гелевых электролитов тем, что соль растворяется непосредственно в твердой среде. Обычно это полимер с относительно высокой диэлектрической проницаемостью (ПЭО, ПММА, ПАН, полифосфазены, силоксаны и др.) И соль с низкой энергией решетки. Для увеличения механической прочности и электропроводности таких электролитов очень часто используются композиты, вводится инертная керамическая фаза.Есть два основных класса таких электролитов: полимер в керамике и керамика в полимере. [12] [13] [14]
- Твердые керамические электролиты — ионы мигрируют через керамическую фазу посредством вакансий или междоузлий внутри решетки. Также существуют стеклокерамические электролиты.
- Органические ионные пластичные кристаллы — это тип органических солей, обладающих мезофазами (то есть промежуточным состоянием вещества между жидкостью и твердым телом), в которых подвижные ионы ориентационно или вращательно разупорядочены, а их центры расположены в упорядоченных участках кристаллической структуры. [10] Они имеют различные формы беспорядка из-за одного или нескольких фазовых переходов твердое тело-твердое тело ниже точки плавления и поэтому обладают пластичными свойствами и хорошей механической гибкостью, а также улучшенным межфазным контактом электрод-электролит. В частности, протонно-органические ионные пластичные кристаллы (POIPC), [10] , которые представляют собой твердые протонные органические соли, образованные переносом протона от кислоты Бренстеда к основанию Бренстеда и по существу являются протонными ионными жидкостями в расплавленном состоянии, как было установлено, быть перспективными твердотельными протонными проводниками для топливных элементов.Примеры включают 1,2,4-триазолий перфторбутансульфонат [10] и метансульфонат имидазолия. [15]
См. Также
Список литературы
ИЗЛУЧЕНИЕ ЭЛЕКТРОНА
1. Электронная трубка зависит от своего воздействия на поток электронов, которые действуют как носители тока. Для создания этого потока электронов в каждой трубке есть специальный металлический электрод (катод). Но при обычных комнатных температурах свободные электроны катода не могут покинуть его поверхность из-за определенных сдерживающих сил, которые действуют как барьер.Эти притягивающие поверхностные силы стремятся удерживать электроны внутри катодного вещества, за исключением небольшой части, которая имеет достаточную кинетическую энергию (энергию движения), чтобы пробить барьер. Большинство электронов движутся слишком медленно, чтобы это произошло.
2. Чтобы покинуть поверхность материала, электроны должны совершить определенную работу, чтобы преодолеть сдерживающие поверхностные силы. Для выполнения этой работы электроны должны иметь достаточную энергию, сообщаемую им от какого-либо внешнего источника энергии, поскольку их собственная кинетическая энергия недостаточна.Существует четыре основных метода получения электронной эмиссии с поверхности материала: термоэлектронная эмиссия, фотоэлектрическая эмиссия, автоэлектронная эмиссия и вторичная эмиссия.
3. Термоэлектронная эмиссия. Это самый важный и наиболее часто используемый в электронных лампах. В этом методе металл нагревается, что приводит к увеличению тепловой или кинетической энергии несвязанных электронов. Таким образом, большее количество электронов достигнет достаточной скорости и энергии, чтобы покинуть поверхность эмиттера.Количество электронов, высвобождаемых на единицу площади излучающей поверхности, связано с абсолютной температурой катода и количеством работы, которую электрон должен совершить, покидая излучающую поверхность.
4. Термоэмиссия получается за счет электрического нагрева катода. Это можно сделать двумя способами: 1) используя электроны, испускаемые нагревательной спиралью для проведения тока (прямой нагрев), или 2) размещая нагревательную спираль в никелевом цилиндре, покрытом оксидом бария, который излучает электроны (косвенный обогрев).Обычно используется метод непрямого нагрева.
5. Фотоэлектрическая эмиссия. В этом процессе энергия светового излучения, падающего на поверхность металла, передается свободным электронам внутри металла и ускоряет их в достаточной степени, чтобы они могли покинуть поверхность.
6. Автоэлектронная эмиссия или эмиссия с холодным катодом. Приложение сильного электрического поля (т. Е. Высокого положительного напряжения за пределами поверхности катода) буквально вытянет электроны с поверхности материала из-за притяжения положительного поля.Чем сильнее поле, тем больше автоэлектронная эмиссия с холодной поверхности эмиттера.
7. Вторичная эмиссия. Когда высокоскоростные электроны внезапно ударяются о металлическую поверхность, они отдают свою кинетическую энергию электронам и атомам, на которые они ударяются. Некоторые из бомбардирующих электронов сталкиваются непосредственно со свободными электронами на поверхности металла и могут выбить их с поверхности. Электроны, освобожденные таким образом, известны как вторичные электроны эмиссии, поскольку первичные электроны из какого-то другого источника должны быть доступны для бомбардировки вторичной электронно-излучающей поверхности.
УПРАЖНЕНИЯ:
1. Контрольные вопросы:
1. От чего зависит действие электронной лампы? 2. Что присутствует в каждой трубке для создания потока электронов? 3. При каких температурах свободные электроны не могут покинуть поверхность катода? 4. Какие силы удерживают электроны внутри катодного вещества? 5. Что должны сделать электроны, чтобы убежать? 6. Что должны иметь электроны, чтобы преодолеть сдерживающие поверхностные силы? 7.Сколько существует методов получения электронной эмиссии? 8. Какие они? 9. Что сообщает внешнюю энергию электронам при термоэлектронной эмиссии? 10. Какая энергия используется для образования свободных электронов при фотоэмиссии? 11. Что такое автоэлектронная эмиссия?
12. Как получается вторичная эмиссия? 13. Какое излучение чаще всего используется в электронике?
2. Переводите международные слова без словаря.
катод, эмиттер, материал, цилиндр, часть, энергия, излучение, температура, термический, адекватный, абсолютный, специальный, эмиссия, электрон, обычно
3. Определите, к каким частям речи принадлежат эти слова, и переведите их :
реализовывать, выравнивать, электрифицировать, классифицировать, создавать, усиливать, расширять, увеличивать, широко, аналогично, иначе — вперед, к, вверх, наружу, вниз
Текст 5 Прочтите и переведите текст.
ДИОДЫ
1. Простейшей комбинацией элементов, составляющих электронную лампу, является диод.Он состоит из катода, который служит для испускания электронов, и пластины или анода, окружающей катод, который действует как коллектор электронов. Оба электрода заключены в герметичную оболочку из стекла или металла. Если катод нагревается косвенно, должна быть спираль или нагреватель. Размер диодных трубок варьируется от крошечных металлических трубок до выпрямителей большого размера. Пластина обычно представляет собой полый металлический цилиндр из никеля, молибденового графита, тантала или железа.
2.Основной закон электричества гласит, что одинаковые заряды отталкиваются друг от друга, а разные заряды притягиваются. Электроны, испускаемые катодом электронной лампы, являются отрицательными электрическими зарядами. Эти заряды могут либо притягиваться, либо отталкиваться от пластины диодной лампы, в зависимости от того, заряжена пластина положительно или отрицательно.
3. Фактически, при приложении разности потенциалов (напряжения) от батареи или другого источника между пластиной и катодом диода внутри трубки создается электрическое поле.Силовые линии этого поля всегда проходят от отрицательно заряженного элемента к положительно заряженному. Электроны, будучи отрицательными электрическими зарядами, следуют направлению силовых линий в электрическом поле.
4. Устанавливая электрическое поле правильной полярности между катодом и пластиной и «формируя» силовые линии этого поля по определенным траекториям, 1 движение электронов можно контролировать по желанию. Батарея подключается между пластиной и катодом диода, чтобы сделать пластину положительной по отношению к катоду, при этом силовые линии электрического поля проходят в направлении от катода к пластине.
5. Снова, приложение напряжения нагревателя приводит к эмиссии электронов с катода. Электроны следуют по силовым линиям к положительной пластине и ударяют по ней с высокой скоростью. Поскольку движущиеся заряды содержат электрический ток, поток электронов к пластине представляет собой электрический ток, называемый током пластины.
6. Достигнув пластины, электронный ток продолжает течь по внешней цепи, состоящей из соединительных проводов и батареи. Поступающие электроны поглощаются положительной клеммой батареи, и такое же количество электронов вытекает из отрицательной клеммы батареи и возвращается на катод, таким образом восполняя запас электронов, потерянных при эмиссии.
7. Пока катод трубки поддерживается при температурах излучения, а пластина остается положительной, ток пластины будет продолжать течь от катода к пластине внутри трубки и от пластины обратно к катоду через внешнюю цепь.
8. Теперь подключение батареи поменялось местами, чтобы сделать пластину отрицательной по отношению к катоду. Когда на нагреватель подается напряжение, катод испускает поток электронов. Однако эти электроны сильно отталкиваются от отрицательно заряженной пластины и стремятся заполнить межэлектродное пространство между катодом и пластиной.Поскольку электроны фактически не достигают пластины, трубка действует как разомкнутая цепь.
9. Общее количество электронов, испускаемых катодом диода, всегда одинаково при данной рабочей температуре. Напряжение на пластине (напряжение между пластиной и катодом) не влияет, следовательно, на количество электронов, испускаемых катодом. Однако достигают ли эти электроны пластины на самом деле, определяется напряжением между пластиной и катодом 2 , а также явлением, известным как объемный заряд.
10. Термин объемный заряд применяется к облаку электронов, которое образуется в межэлектродном пространстве между катодом и пластиной. Поскольку оно состоит из электронов, это облако представляет собой отрицательный заряд в межэлектродном пространстве, который оказывает отталкивающее действие на электроны, испускаемые катодом. Таким образом, эффект одного только этого отрицательного объемного заряда заключается в том, чтобы заставить значительную часть испускаемых электронов вернуться обратно в катод и предотвратить попадание других электронов на пластину.
11. Объемный заряд, однако, действует не сам по себе. Ему противодействует электрическое поле от положительной пластины, которое проникает сквозь объемный заряд, притягивая электроны и таким образом частично преодолевая его эффекты. При низких положительных напряжениях пластины только ближайшие к ней электроны притягиваются к ней и составляют небольшой ток пластины. Тогда объемный заряд оказывает сильное влияние на ограничение количества электронов, достигающих пластины.
12. По мере увеличения напряжения на пластине большее количество электронов притягивается к пластине через отрицательный пространственный заряд и, соответственно, меньшее количество электронов отталкивается обратно на катод.Если напряжение на пластине сделать достаточно высоким, в конечном итоге достигается точка, в которой все электроны, испускаемые катодом, притягиваются к пластине, и влияние объемного заряда полностью преодолевается. Дальнейшее увеличение напряжения на пластине не может увеличить ток пластины через трубку, а эмиссия с катода ограничивает максимальный ток.
Дата: 02.07.2015; вид: 1378;
»Какая плотность клеток?
Какая плотность клеток?
Reader ModeПлотность биологического материала отвечает за оседание клеток на дно наших лабораторных пробирок и многолуночных планшетов и служит основой рутинного центрифугирования, которое является частью повседневной жизни многих биологов.Эти самые различия в плотности между клетками и их водянистая внешность также являются основой контраста, который мы наблюдаем на изображениях фазовой микроскопии. Эти различия также важны за пределами лабораторных условий. Например, планктону приходится бороться с этой разницей плотности, чтобы оставаться на глубине океана, где много солнечного света, а не опускаться на почерневшие глубины. Учитывая, что большинство биологов и биохимиков ежедневно используют разделение на основе плотности, кажется удивительным, насколько редко на самом деле обсуждаются плотности, подобные тем, которые собраны в таблице 1.
Таблица 1: Плотности биологических объектов относительно воды. Это почти эквивалентно их выражению в г / мл или 1000 кг / м3. Значения отсортированы по убыванию. Если не указано иное, значения были измерены в растворе сахарозы или фиколла.
Что лежит в основе различной плотности различных органелл и типов клеток? В значительной степени эти различия можно объяснить соотношением содержания воды и сухой массы. Белки имеют плотность ≈1.3-1,4 (BNID 104272, 101502) относительно воды (или почти эквивалентно в единицах г / мл или 1000 кг / м 3 ). Учитывая контрольное значение плотности воды, равное 1, на основе относительного содержания белков и воды получается спектр промежуточных значений плотности клеток от 1 до 1,3. Липиды находятся на нижнем уровне рядом с водой с плотностью около 1 (BNID 108142). С другой стороны, гранулы крахмала с плотностью ≈1,5 (BNID 103206) и нуклеотидами при ≈1,7 могут сдвинуть общий баланс масс в противоположном направлении.
Знание плотности часто основывается на месте, в котором оседает данный биологический компонент при вращении в центрифуге, содержащей градиент концентраций, часто производимых сахарозой или, в случае ДНК, хлоридом цезия. Плотность отражает массу, деленную на объем, но для заряженных соединений в растворе на плотность также влияют оболочки из так называемой связанной воды. Плотность в этом случае становится эффективной плотностью, уменьшенной связанной водой и, таким образом, в некоторой степени зависящей от концентрации соли (BNID 107858).
Скорость седиментации, как это происходит в центрифуге, количественно выражается в единицах Сведберга, которые являются источником названий 70S, 23S и т.д. для рибосомы и ее субъединиц рРНК. 23S рРНК оседает со скоростью 23 × 10 -12 м / с при нормальной гравитации. В ультрацентрифуге, создающей ускорение в один миллион g, скорость пропорционально масштабируется до 23 × 10 -6 м / с или примерно 1 мм / мин. Скорость осаждения зависит от плотности, размера и формы молекулы.Для аналогичных форм и плотностей скорость осаждения масштабируется как квадратный корень из молекулярной массы. Для таких случаев молекулярная масса представляет собой квадрат скорости седиментации, так что субъединицы 23S и 16S рибосомы имеют молекулярную массу с отношением примерно (23/16) 2 или примерно 2, что близко к измерения 0,9 и 0,5 МДа соответственно (BNID 110972, 110967). В клинике скорость оседания эритроцитов (красных кровяных телец) обычно используется для измерения воспаления.Скорость намного выше 10 мм / час обычно указывает на присутствие проседиментационного фактора фибриногена, который является общим индикатором воспалительного состояния.
Хорошо известно, что вода — это самая распространенная молекулярная фракция клеток, но насколько точно? Если мы исследуем ткани многоклеточных организмов, определение содержания воды — это простая задача измерения массы ткани до и после сушки. Но как проводить такие измерения для клеток? Когда мы взвешиваем массу клеток до и после сушки, как мы измеряем только клетки без воды вокруг них? Даже после центрифугирования в осадке клеток остается вода, что приводит к неопределенности в отношении самой сухой массы.
И снова на помощь приходит радиоизотопное мечение (Cayley et al 1991). Во-первых, меченая вода (с использованием трития, 3 H) измеряется в осадке клеток. Это указывает на сумму воды внутри и снаружи клеток. Затем другое растворимое соединение, которое помечено, но не может проникнуть в клетку, такое как 14 C-инулин или 3 H-PEG, измеряет объем воды вне клеток в центрифугированном осадке (например, в E coli около 25-35% объема гранул (BNID)).Разница указывает на содержание воды внутри клеток. Такие методы приводят к типичным значениям в диапазоне от ≈60-65% по массе для почкующихся дрожжей и эритроцитов до ≈70% для E. coli и амебы D. discoideum и до ≈80% для мышц крысы и ткани сердца свиньи (BNID 105938, 103689). Поскольку в составе сухого вещества преобладают компоненты с плотностью ≈1,3 (т.е. белки), это приводит к характеристической общей плотности ≈1,1 (BNID 103875, 106439, 101502). Из этих характерных фракций можно сделать вывод, что сухая масса на объем составляет около 300-500 мг / мл (BNID 108131, 108135, 108136), но при медленном росте значения могут быть выше.Низкая плотность характерна для сухих семян и подводных растений, у которых есть плавучие части с плотностью меньше, чем плотность окружающей воды, что позволяет им плавать. Плотность ниже, чем у воды, может быть достигнута либо с помощью газа, как у водорослей и некоторых бактерий, либо с помощью растворенных веществ с молекулярной массой (MW) ниже, чем окружающая среда (например, замена натрия с MW≈23 на аммоний с MW≈18), как в мелкие ракообразные, антарктические веслоногие рачки.
Люди состоят примерно на 60% из воды (40% в клетках, 15% в межклеточной жидкости и 5% в плазме крови, BNID 110743), и большинство из нас испытали сильные эффекты обезвоживания после того, как забыли выпить даже всего несколько стаканов. .Тем не менее, некоторые клетки могут быть удивительно устойчивыми к снижению содержания в них воды. Например, на скорость метаболизма глюкозы в клетках печени крыс не влияла 25% потеря внутриклеточной воды. Такое уменьшение может быть достигнуто путем осмоса — изменения тонуса (концентрации растворенного вещества) внеклеточной жидкости.


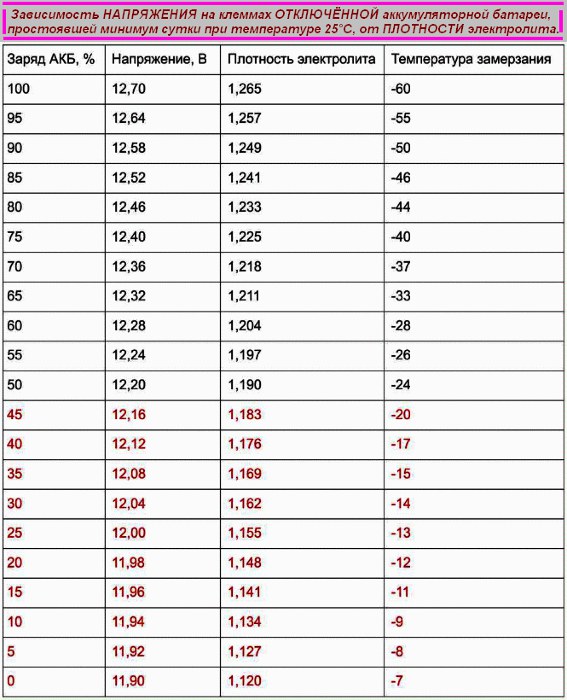 А самое главное на то как она будет держать заряд.
А самое главное на то как она будет держать заряд.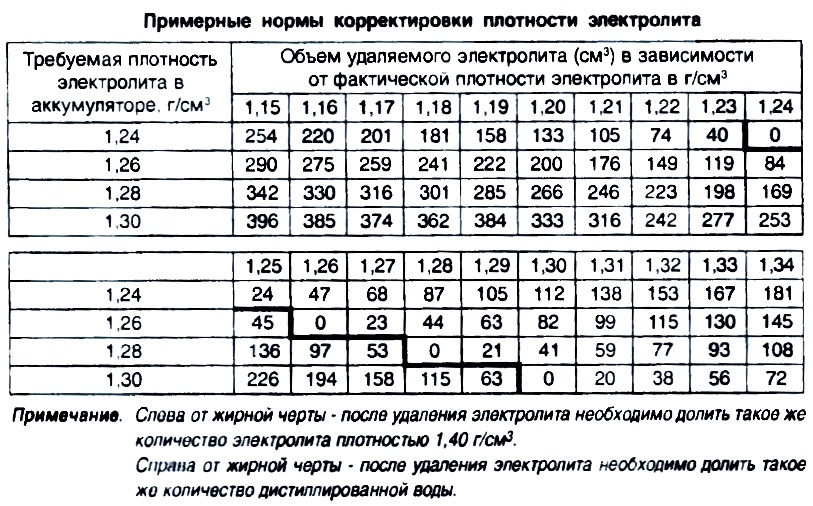
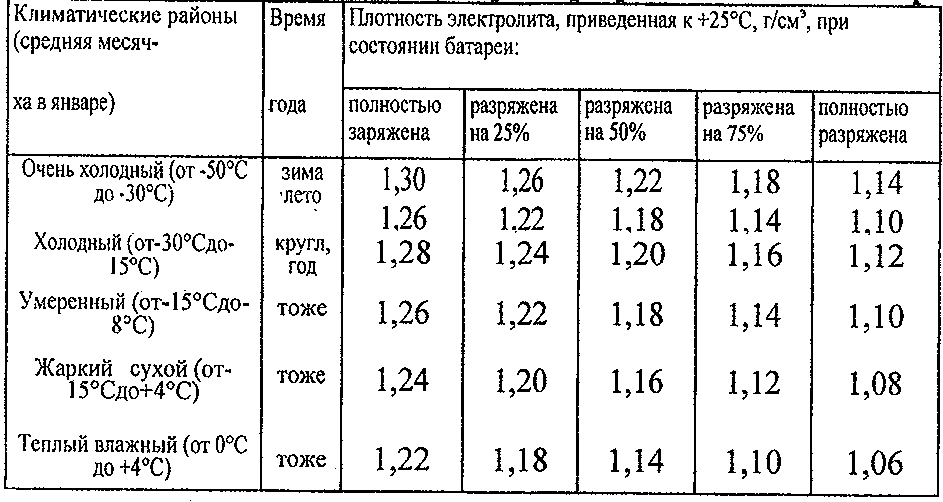 Далее заливают дистиллированную воду для закрытия пластин.
Далее заливают дистиллированную воду для закрытия пластин.


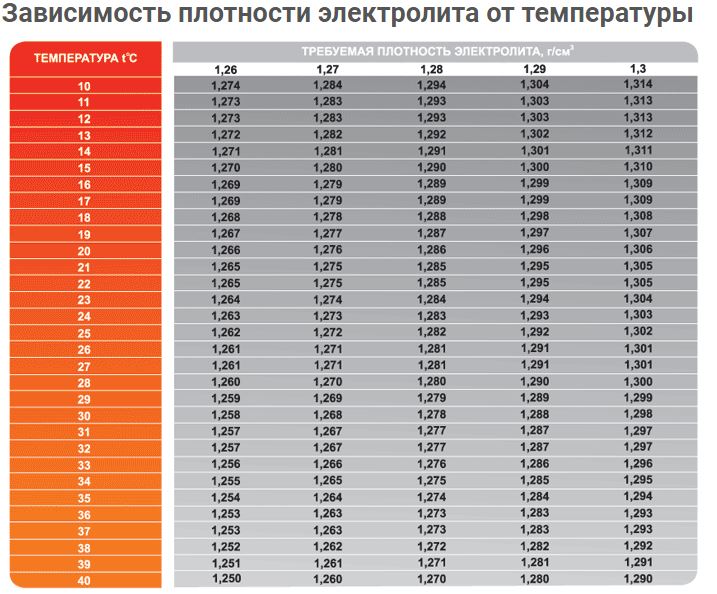 4. Нельзя заливать более насыщенный раствор кислоты, это приведет к разогреву электролита в батарее;
4. Нельзя заливать более насыщенный раствор кислоты, это приведет к разогреву электролита в батарее;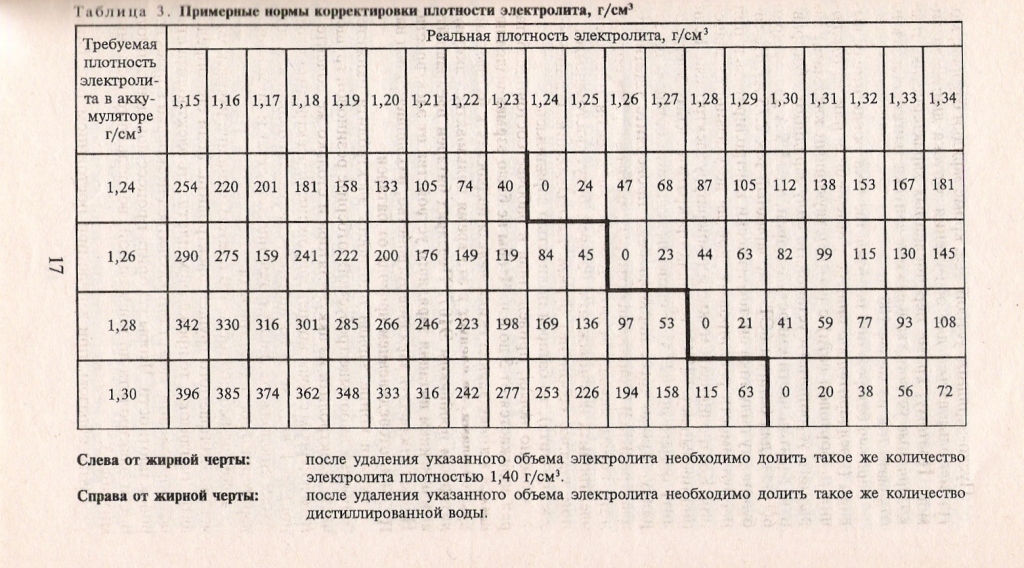 При потере заряда снижается и плотность наполнителя. Во процессе зарядки этот параметр постепенно увеличивается. Если батарея утрачивает большую часть емкости, речь идет о падении концентрации кислоты.
При потере заряда снижается и плотность наполнителя. Во процессе зарядки этот параметр постепенно увеличивается. Если батарея утрачивает большую часть емкости, речь идет о падении концентрации кислоты. При попадании на кожу вещество вызывает химический ожог. Опасными являются и пары кислоты, поэтому работают только в хорошо проветриваемом помещении.
При попадании на кожу вещество вызывает химический ожог. Опасными являются и пары кислоты, поэтому работают только в хорошо проветриваемом помещении.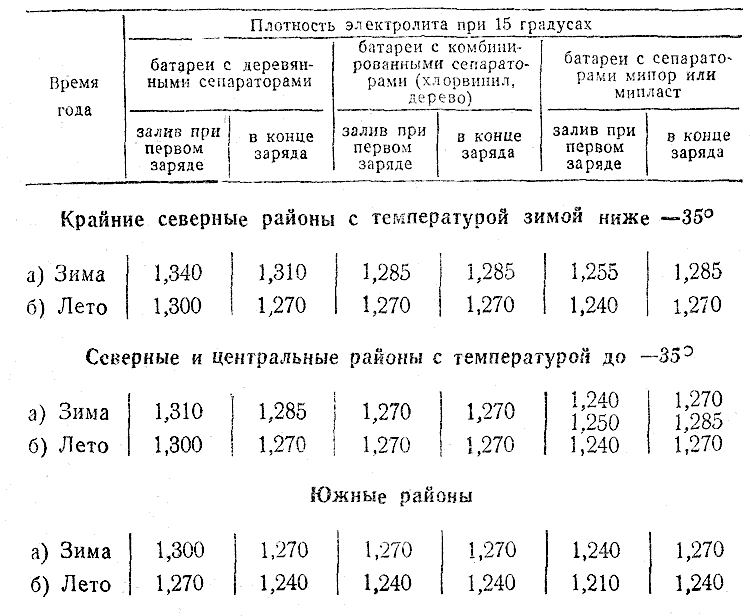 Показания оценивают с учетом температуры окружающей среды.
Показания оценивают с учетом температуры окружающей среды.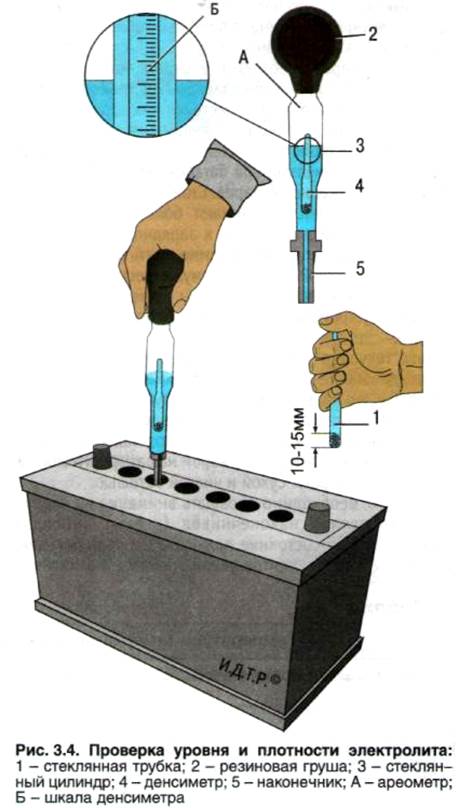
 Несколько недель устройство проработает, однако потом придется покупать новое.
Несколько недель устройство проработает, однако потом придется покупать новое. Не допускается переворачивать АКБ для слива. В этом случае осыпавшиеся частицы со дна могут замкнуть пластины. Или электроды деформируются, порвут сепаратор и будет замыкание. В случае замыкания банки аккумулятор можно смело идти сдавать в приёмку.
Не допускается переворачивать АКБ для слива. В этом случае осыпавшиеся частицы со дна могут замкнуть пластины. Или электроды деформируются, порвут сепаратор и будет замыкание. В случае замыкания банки аккумулятор можно смело идти сдавать в приёмку.
 Такое действие осуществляется при условии, что поставлена задача поднять плотность. Если необходимо получить противоположный результат, то регулирующий раствор заменяют на дистиллированную жидкость.
Такое действие осуществляется при условии, что поставлена задача поднять плотность. Если необходимо получить противоположный результат, то регулирующий раствор заменяют на дистиллированную жидкость.