Медь. Химия меди и ее соединений
Медь
1. Положение меди в периодической системе химических элементов
2. Электронное строение меди
3. Физические свойства
4. Нахождение в природе
5. Способы получения
6. Качественные реакции
7. Химические свойства
Оксид меди (II)
Оксид меди (I)
Гидроксид меди (II)
Соли меди
Медь
Положение в периодической системе химических элементов
Медь расположена в 11 группе (или в побочной подгруппе II группы в короткопериодной ПСХЭ) и в четвертом периоде периодической системы химических элементов Д.И. Менделеева.
Электронное строение меди
Электронная конфигурация меди в основном состоянии:
+29Cu 1s22s22p63s23p63d104s1 1s 2s 2p
3s 3p 4s 3d
У атома меди уже в основном энергетическом состоянии происходит провал (проскок) электрона с 4s-подуровня на 3d-подуровень.
Физические свойства
Медь – твердый металл золотисто-розового цвета (розового цвета при отсутствии оксидной плёнки). Медь относительно легко поддается механической обработке. В природе встречается в том числе в чистом виде и широко применяется в различных отраслях науки, техники и производства.
Изображение с портала zen.yandex.com/media/id/5d426107ae56cc00ad977411/uralskaia-boginia-liubvi-5d6bcceda660d700b075a12d
Температура плавления 1083,4
Нахождение в природе
Медь встречается в земной коре (0,0047-0,0055 масс.%), в речной и морской воде. В природе медь встречается как в соединениях, так и в самородном виде. В промышленности используют халькопирит CuFeS2, также известный как медный колчедан, халькозин Cu2S и борнит Cu5FeS4. Также распространены и другие минералы меди: ковеллин CuS, куприт Cu2O, азурит Cu3(CO3)2(OH)2, малахит Cu2(OH)2CO3.
Способы получения меди
Медь получают из медных руд и минералов. Основные методы получения меди — электролиз, пирометаллургический и гидрометаллургический.
- Гидрометаллургический метод: растворение медных минералов в разбавленных растворах серной кислоты, с последующим вытеснением металлическим железом.
Например, вытеснение меди из сульфата железом:
CuSO4 + Fe = Cu + FeSO4
Видеоопыт взаимодействия сульфата меди (II) с железом можно посмотреть здесь.
- Пирометаллургический метод: получение меди из сульфидных руд. Это сложный процесс, который включает большое количество реакций. Основные стадии процесса:
1) Обжиг сульфидов:
2CuS + 3O2 = 2CuO + 2SO2
2) восстановление меди из оксида, например, водородом:
CuO + H2 = Cu + H2O
- Электролиз растворов солей меди:
2CuSO4 + 2H2O → 2Cu + O2 + 2H2SO4
Качественные реакции на ионы меди (II)
Качественная реакция на ионы меди +2 – взаимодействие солей меди (II) с щелочами
 При этом образуется голубой осадок гидроксида меди(II).
При этом образуется голубой осадок гидроксида меди(II).Например, сульфат меди (II) взаимодействует с гидроксидом натрия:
CuSO4 + 2NaOH → Cu(OH)2 + Na2SO4
Соли меди (II) окрашивают пламя в зеленый цвет.
Химические свойства меди
В соединениях медь может проявлять степени окисления +1 и +2.
1. Медь — химически малоактивный металл.
1.1. При нагревании медь реагирует с достаточно сильными окислителями, например, с кислородом, образуя CuО, Cu2О в зависимости от условий:
4Cu + О2 → 2Cu2О
2Cu + О2 → 2CuО
1. 2. Медь реагирует с серой с образованием сульфида меди (II):
2. Медь реагирует с серой с образованием сульфида меди (II):
Cu + S → CuS
Видеоопыт взаимодействия меди с серой можно посмотреть здесь.
1.3. Медь взаимодействует с галогенами. При этом образуются галогениды меди (II):
Cu + Cl2 = CuCl2
Сu + Br2 = CuBr2
Видеоопыт взаимодействия меди с хлором можно посмотреть здесь.
1.4. С азотом, углеродом и кремнием медь не реагирует:
Cu + N2 ≠
Cu + C ≠
Cu + Si
1.5. Медь не взаимодействует с водородом.
Cu + H2 ≠
1. 6. Медь взаимодействует с кислородом с образованием оксида:
6. Медь взаимодействует с кислородом с образованием оксида:
2Cu + O2 → 2CuO
2. Медь взаимодействует и со сложными веществами:
2.1. Медь в сухом воздухе и при комнатной температуре не окисляется, но во влажном воздухе, в присутствии оксида углерода (IV) покрывается зеленым налетом карбоната гидроксомеди (II):
2Cu + H2O + CO2 + O2 = (CuOH)2CO3
2.2. В ряду напряжений медь находится правее водорода и поэтому не может вытеснить водород из растворов минеральных кислот (разбавленной серной кислоты и др.).
Например, медь не реагирует с разбавленной серной кислотой:
Cu + H2SO4 (разб.) ≠
Видеоопыт взаимодействия меди с соляной кислотой можно посмотреть здесь.
2.3. При этом медь реагирует при нагревании с концентрированной серной кислотой. При нагревании реакция идет, образуются оксид серы (IV), сульфат меди (II) и вода:
Cu + 2H2SO4(конц.) → CuSO4 + SO2 + 2H2O
2.4. Медь реагирует даже при обычных условиях с азотной кислотой.
С концентрированной азотной кислотой:
Cu + 4HNO3(
С разбавленной азотной кислотой:
3Cu + 8HNO3(разб.) = 3Cu(NO3)2 + 2NO + 4H2O
Реакция меди с азотной кислотой
2. 5. Растворы щелочей на медь практически не действуют.
5. Растворы щелочей на медь практически не действуют.
2.6. Медь вытесняет металлы, стоящие правее в ряду напряжений, из растворов их солей.
Например, медь реагирует с нитратом ртути (II) с образованием нитрата меди (II) и ртути:
Hg(NO3)2 + Cu = Cu(NO3)2 + Hg
2.7. Медь окисляется оксидом азота (IV) и солями железа (III)
2Cu + NO2 = Cu2O + NO
2FeCl3 + Cu = 2FeCl2 + CuCl2
Оксид меди (II)
Оксид меди (II) CuO – твердое кристаллическое вещество черного цвета.
Способы получения оксида меди (II)
Оксид меди (II) можно получить различными методами:
1. Термическим разложением
Cu(OH)2 → CuO + H2O
2. В лаборатории оксид меди (II) получают окислением меди при нагревании на воздухе при 400–500°С:
В лаборатории оксид меди (II) получают окислением меди при нагревании на воздухе при 400–500°С:
2Cu + O2 2CuO
3. В лаборатории оксид меди (II) также получают прокаливанием солей (CuOH)2CO3, Cu(NO3)2:
(CuOH)2CO3 2CuO + CO2 + H2O
2Cu(NO3)2 2CuO + 4NO2 + O2
Химические свойства оксида меди (II)
Оксид меди (II) – основный оксид (при этом у него есть слабо выраженные амфотерные свойства). При этом он является довольно сильным окислителем.
1. При взаимодействии оксида меди (II) с сильными и растворимыми кислотами образуются соли.
Например, оксид меди (II) взаимодействует с соляной кислотой:
СuO + 2HBr = CuBr2 + H2O
CuO + 2HCl = CuCl2 + H2O
Видеоопыт взаимодействия оксида меди (II) с серной кислотой можно посмотреть здесь.
2. Оксид меди (II) вступает в реакцию с кислотными оксидами.
Например, оксид меди (II) взаимодействует с оксидом серы (VI) с образованием сульфата меди (II):
CuO + SO3 → CuSO4
3. Оксид меди (II) не взаимодействует с водой.
4. В окислительно-восстановительных реакциях соединения меди (II) проявляют окислительные свойства:
Например, оксид меди (II) окисляет аммиак:
3CuO + 2NH3 → 3Cu + N2 + 3H2O
Оксид меди (II) можно восстановить углеродом, водородом или угарным газом при нагревании:
СuO + C → Cu + CO
Видеоопыт взаимодействия оксида меди (II) с водородом можно посмотреть здесь.
Более активные металлы вытесняют медь из оксида.
Например, алюминий восстанавливает оксид меди (II):
3CuO + 2Al = 3Cu + Al2O3
Оксид меди (I)
Оксид меди (I) Cu2O – твердое кристаллическое вещество коричнево-красного цвета.
Способы получения оксида меди (I)
В лаборатории оксид меди (I) получают восстановлением свежеосажденного гидроксида меди (II), например, альдегидами или глюкозой:
CH3CHO + 2Cu(OH)2 → CH3COOH + Cu2O↓ + 2H2O
CH2ОН(CHOН)4СНО + 2Cu(OH)2 → CH2ОН(CHOН)4СООН + Cu2O↓ + 2H2O
Химические свойства оксида меди (I)
1. Оксид меди (I) обладает основными свойствами.
При действии на оксид меди (I) галогеноводородных кислот получают галогениды меди (I) и воду:
Например, соляная кислота с оксидом меди (I) образует хлорид меди (I):
Cu2O + 2HCl = 2CuCl↓ + H2O
2. При растворении Cu2O в концентрированной серной, азотной кислотах образуются только соли меди (II):
При растворении Cu2O в концентрированной серной, азотной кислотах образуются только соли меди (II):
Cu2O + 3H2SO4(конц.) = 2CuSO4 + SO2 + 3H2O
Cu2O + 6HNO3(конц.) = 2Cu(NO3)2 + 2NO2 + 3H2O
5Cu2O + 13H2SO4 + 2KMnO4 = 10CuSO4 + 2MnSO4 + K2SO4 + 13H2O
3. Устойчивыми соединениями меди (I) являются нерастворимые соединения (CuCl, Cu2S) или комплексные соединения [Cu(NH3)2]+. Последние получают растворением в концентрированном растворе аммиака оксида меди (I), хлорида меди (I):
Cu2O + 4NH3 + H2O = 2[Cu(NH3)2]OH
CuCl + 2NH3 = [Cu(NH3)2]Cl
Аммиачные растворы солей меди (I) взаимодействуют с ацетиленом:
СH ≡ CH + 2[Cu(NH3)2]Cl → СuC ≡ CCu + 2NH4Cl
4. В окислительно-восстановительных реакциях соединения меди (I) проявляют окислительно-восстановительную двойственность:
В окислительно-восстановительных реакциях соединения меди (I) проявляют окислительно-восстановительную двойственность:
Например, при взаимодействии с угарным газом, более активными металлами или водородом оксид меди (II) проявляет свойства окислителя:
Cu2O + CO = 2Cu + CO2
Cu2O + H2 = 2Cu + H2O
3Cu2O + 2Al = 6Cu + Al2O3
А под действием окислителей, например, кислорода — свойства восстановителя:
2Cu2O + O2 = 4CuO
Гидроксид меди (II)
Способы получения гидроксида меди (II)
1. Гидроксид меди (II) можно получить действием раствора щелочи на соли меди (II).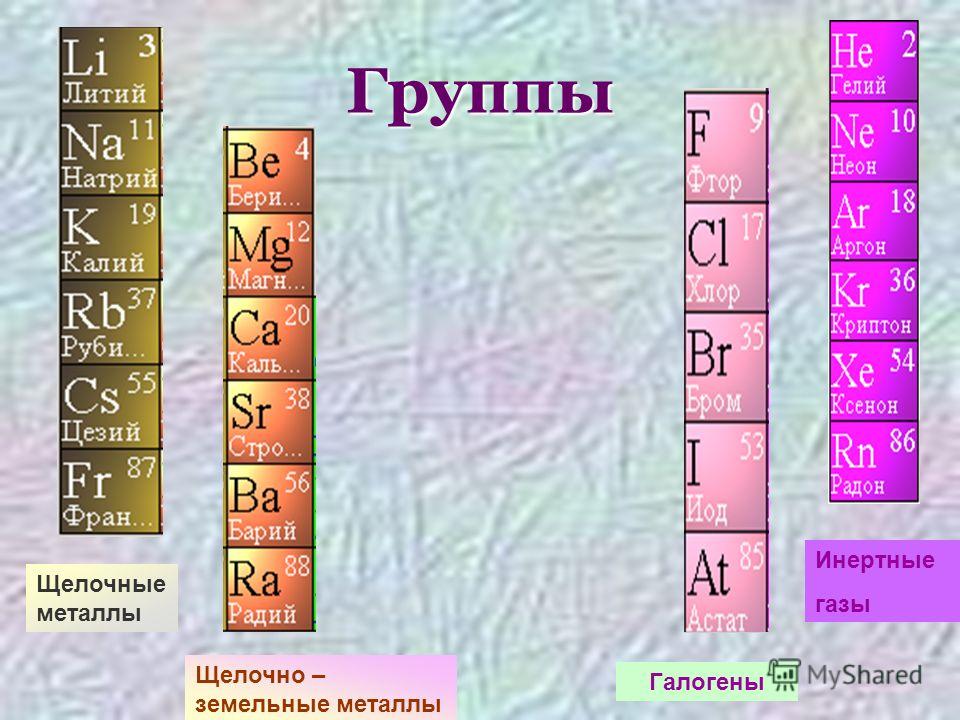
Например, хлорид меди (II) реагирует с водным раствором гидроксида натрия с образованием гидроксида меди (II) и хлорида натрия:
CuCl2 + 2NaOH → Cu(OH)2 + 2NaCl
Химические свойства
Гидроксид меди (II) Сu(OН)2 проявляет слабо выраженные амфотерные свойства (с преобладанием основных).
1. Взаимодействует с кислотами.
Например, взаимодействует с бромоводородной кислотой с образованием бромида меди (II) и воды:
Сu(OН)2 + 2HBr = CuBr2 + 2H2O
Cu(OН)2 + 2HCl = CuCl2 + 2H2O
2. Гидроксид меди (II) легко взаимодействует с раствором аммиака, образуя сине-фиолетовое комплексное соединение:
Сu(OH)2 + 4(NH3 · H2O) = [Cu(NH3)4](OH)2 + 4H2O
Cu(OH)2 + 4NH3 = [Cu(NH3)4](OH)2
3. При взаимодействии гидроксида меди (II) с концентрированными (более 40%) растворами щелочей образуется комплексное соединение:
При взаимодействии гидроксида меди (II) с концентрированными (более 40%) растворами щелочей образуется комплексное соединение:
Cu(OH)2 + 2NaOH(конц.) = Na2[Cu(OH)4]
Но этой реакции в ЕГЭ по химии пока нет!
4. При нагревании гидроксид меди (II) разлагается:
Сu(OH)2 → CuO + H2O
Соли меди
Соли меди (I)
В окислительно-восстановительных реакциях соединения меди (I) проявляют окислительно-восстановительную двойственность. Как восстановители они реагируют с окислителями.
Например, хлорид меди (I) окисляется концентрированной азотной кислотой:
CuCl + 3HNO3(конц.) = Cu(NO3)2 + HCl + NO2 + H2O
Также хлорид меди (I) реагирует с хлором:
2CuCl + Cl2 = 2CuCl2
Хлорид меди (I) окисляется кислородом в присутствии соляной кислоты:
4CuCl + O2 + 4HCl = 4CuCl2 + 2H2O
Прочие галогениды меди (I) также легко окисляются другими сильными окислителями:
2CuI + 4H2SO4 + 2MnO2 = 2CuSO4 + 2MnSO4 + I2 + 4H2O
Иодид меди (I) реагирует с концентрированной серной кислотой:
4CuI + 5H2SO4(конц. гор.) = 4CuSO4 + I2 + H2S + 4H2O
гор.) = 4CuSO4 + I2 + H2S + 4H2O
Сульфид меди (I) реагирует с азотной кислотой. При этом образуются различные продукты окисления серы на холоде и при нагревании:
Cu2S + 8HNO3(конц.хол.) = 2Cu(NO3)2 + S + 4NO2 + 4H2O
Cu2S + 12HNO3(конц.гор.) = Cu(NO3)2 + CuSO4 + 10NO2 + 6H2O
Для соединений меди (I) возможна реакция диспропорционирования:
2CuCl = Cu + CuCl2
Комплексные соединения типа [Cu(NH3)2]+ получают растворением в концентрированном растворе аммиака:
CuCl + 3NH3 + H2O → [Cu(NH3)2]OH + NH4Cl
Соли меди (II)
В окислительно-восстановительных реакциях соединения меди (II) проявляют окислительные свойства.
Например, соли меди (II) окисляют иодиды и сульфиты:
2CuCl2 + 4KI = 2CuI + I2 + 4HCl
2CuCl2 + Na2SO3 + 2NaOH = 2CuCl + Na2SO4 + 2NaCl + H2O
Бромиды и иодиды меди (II) можно окислить перманганатом калия:
5CuBr2 + 2KMnO4 + 8H2SO4 = 5CuSO4 + K2SO4 + 2MnSO4 + 5Br2 + 8H2O
Соли меди (II) также окисляют сульфиты:
2CuSO4 + Na2SO3 + 2H2O = Cu2O + Na2SO4 + 2H2SO4
Более активные металлы вытесняют медь из солей.
Например, сульфат меди (II) реагирует с железом:
CuSO4 + Fe = FeSO4 + Cu
Cu(NO3)2 + Fe = Fe(NO3)2 + Cu
Сульфид меди (II) можно окислить концентрированной азотной кислотой.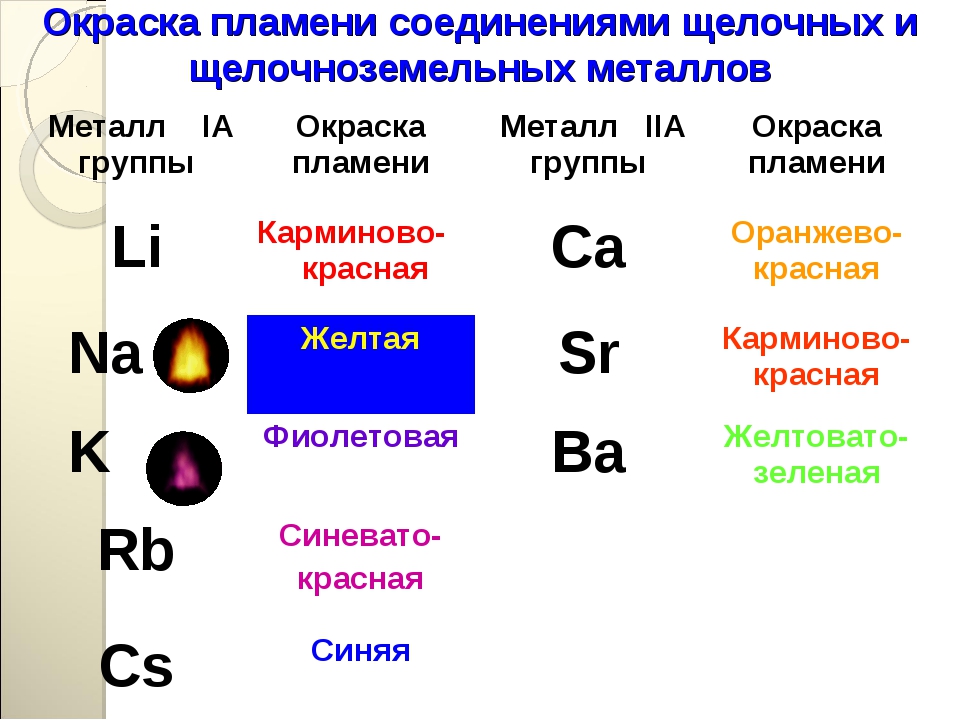 При нагревании возможно образование сульфата меди (II):
При нагревании возможно образование сульфата меди (II):
CuS + 8HNO3(конц.гор.) = CuSO4 + 8NO2 + 4H2O
Еще одна форма этой реакции:
CuS + 10HNO3(конц.) = Cu(NO3)2 + H2SO4 + 8NO2↑ + 4H2O
При горении сульфида меди (II) образуется оксид меди (II) и диоксид серы:
2CuS + 3O2 2CuO + 2SO2↑
Соли меди (II) вступают в обменные реакции, как и все соли.
Например, растворимые соли меди (II) реагируют с сульфидами:
CuBr2 + Na2S = CuS↓ + 2NaBr
При взаимодействии солей меди (II) с щелочами образуется голубой осадок гидроксида меди (II):
CuSO4 + 2NaOH = Cu(OH)2↓ + Na2SO4
Электролиз раствора нитрата меди (II):
2Cu(NO3)2 + 2Н2О → 2Cu + O2 + 4HNO3
Некоторые соли меди при нагревании разлагаются, например, нитрат меди (II):
2Cu(NO3)2 → 2CuO + 4NO2 + O2
Основный карбонат меди разлагается на оксид меди (II), углекислый газ и воду:
(CuOH)2CO3 → 2CuO + CO2 + H2O
При взаимодействии солей меди (II) с избытком аммиака образуются аммиачные комплексы:
CuCl2 + 4NH3 = [Cu(NH3)4]Cl2
При смешивании растворов солей меди (II) и карбонатов происходит гидролиз и по катиону слабого основания, и по аниону слабой кислоты:
2CuSO4 + 2Na2CO3 + H2O = (CuOH)2CO3↓ + 2Na2SO4 + CO2
Медь и соединения меди.
1) Через раствор хлорида меди (II) с помощью графитовых электродов пропускали постоянный электрический ток. Выделившийся на катоде продукт электролиза растворили в концентрированной азотной кислоте. Образовавшийся при этом газ собрали и пропустили через раствор гидроксида натрия. Выделившийся на аноде газообразный продукт электролиза пропустили через горячий раствор гидроксида натрия. Напишите уравнения описанных реакций.
2) Вещество, полученное на катоде при электролизе расплава хлорида меди (II), реагирует с серой. Полученный продукт обработали концентрированной азотной кислотой, и выделившийся газ пропустили через раствор гидроксида бария. Напишите уравнения описанных реакций.
3) Неизвестная соль бесцветна и окрашивает пламя в желтый цвет. При легком нагревании этой соли с концентрированной серной кислотой отгоняется жидкость, в которой растворяется медь; последнее превращение сопровождается выделением бурого газа и образованием соли меди. При термическом распаде обеих солей одним из продуктов разложения является кислород. Напишите уравнения описанных реакций.
При термическом распаде обеих солей одним из продуктов разложения является кислород. Напишите уравнения описанных реакций.
4) При взаимодействии раствора соли А со щелочью было получено студенистое нерастворимое в воде вещество голубого цвета, которое растворили в бесцветной жидкости Б с образованием раствора синего цвета. Твердый продукт, оставшийся после осторожного выпаривания раствора, прокалили; при этом выделились два газа, один из которых бурого цвета, а второй входит в состав атмосферного воздуха, и осталось твердое вещество черного цвета, которое растворяется в жидкости Б с образованием вещества А. Напишите уравнения описанных реакций.
5) Медную стружку растворили в разбавленной азотной кислоте, и раствор нейтрализовали едким кали. Выделившееся вещество голубого цвета отделили, прокалили (цвет вещества изменился на черный), смешали с коксом и повторно прокалили. Напишите уравнения описанных реакций.
6) В раствор нитрата ртути (II) добавили медную стружку. После окончания реакции раствор профильтровали, и фильтрат по каплям прибавляли к раствору, содержащему едкий натр и гидроксид аммония. При этом наблюдали кратковременное образование осадка, который растворился с образованием раствора ярко-синего цвета. При добавлении в полученный раствор избытка раствора серной кислоты происходило изменение цвета. Напишите уравнения описанных реакций.
После окончания реакции раствор профильтровали, и фильтрат по каплям прибавляли к раствору, содержащему едкий натр и гидроксид аммония. При этом наблюдали кратковременное образование осадка, который растворился с образованием раствора ярко-синего цвета. При добавлении в полученный раствор избытка раствора серной кислоты происходило изменение цвета. Напишите уравнения описанных реакций.
7) Оксид меди (I) обработали концентрированной азотной кислотой, раствор осторожно выпарили и твердый остаток прокалили. Газообразные продукты реакции пропустили через большое количество воды и в образовавшийся раствор добавили магниевую стружку, в результате выделился газ, используемый в медицине. Напишите уравнения описанных реакций.
8) Твердое вещество, образующееся при нагревании малахита, нагрели в атмосфере водорода. Продукт реакции обработали концентрированной серной кислотой, внесли в раствор хлорида натрия, содержащий медные опилки, в результате образовался осадок.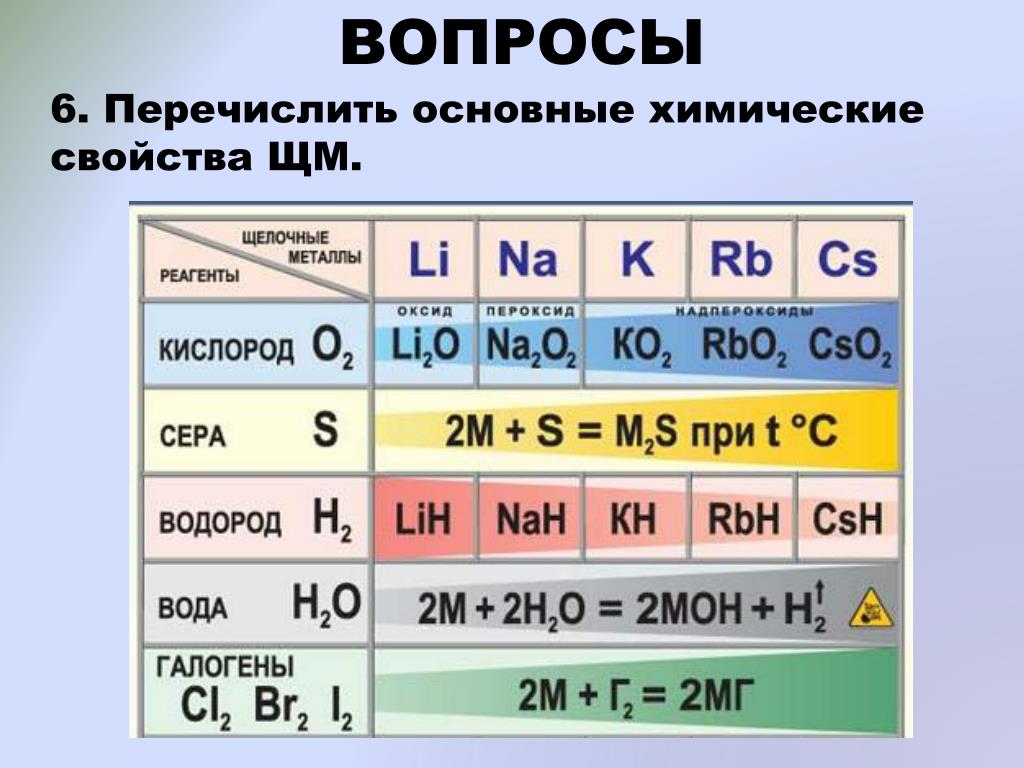 Напишите уравнения описанных реакций.
Напишите уравнения описанных реакций.
9) Соль, полученную при растворении меди в разбавленной азотной кислоте, подвергли электролизу, используя графитовые электроды. Вещество, выделившееся на аноде, ввели во взаимодействие с натрием, а полученный продукт реакции поместили в сосуд с углекислым газом. Напишите уравнения описанных реакций.
10) Твердый продукт термического разложения малахита растворили при нагревании в концентрированной азотной кислоте. Раствор осторожно выпарили, и твердый остаток прокалили, получив вещество черного цвета, которое нагрели в избытке аммиака (газ). Напишите уравнения описанных реакций.
11) К порошкообразному веществу черного цвета добавили раствор разбавленной серной кислоты и нагрели. В полученный раствор голубого цвета приливали раствор едкого натра до прекращения выделения осадка. Осадок отфильтровали и нагрели. Продукт реакции нагревали в атмосфере водорода, в результате чего получилось вещество красного цвета. Напишите уравнения описанных реакций.
Напишите уравнения описанных реакций.
12) Неизвестное вещество красного цвета нагрели в хлоре, и продукт реакции растворили в воде. В полученный раствор добавили щелочь, выпавший осадок голубого цвета отфильтровали и прокалили. При нагревании продукта прокаливании, который имеет черный цвет, с коксом было получено исходное вещество красного цвета. Напишите уравнения описанных реакций.
13) Раствор, полученный при взаимодействии меди с концентрированной азотной кислотой, выпарили и осадок прокалили. Газообразные продукты полностью поглощены водой, а над твердым остатком пропустили водород. Напишите уравнения описанных реакций.
14) Черный порошок, который образовался при сжигании металла красного цвета в избытке воздуха, растворили в 10%-серной кислоте. В полученный раствор добавили щелочь, и выпавший осадок голубого цвета отделили и растворили в избытке раствора аммиака. Напишите уравнения описанных реакций.
15) Вещество черного цвета получили, прокаливая осадок, который образуется при взаимодействии гидроксида натрия и сульфата меди (II). При нагревании этого вещества с углем получают металл красного цвета, который растворяется в концентрированной серной кислоте. Напишите уравнения описанных реакций.
При нагревании этого вещества с углем получают металл красного цвета, который растворяется в концентрированной серной кислоте. Напишите уравнения описанных реакций.
16) Металлическую медь обработали при нагревании йодом. Полученный продукт растворили в концентрированной серной кислоте при нагревании. Образовавшийся раствор обработали раствором гидроксидом калия. Выпавший осадок прокалили. Напишите уравнения описанных реакций.
17) К раствору хлорида меди (II) добавили избыток раствора соды. Выпавший осадок прокалили, а полученный продукт нагрели в атмосфере водорода. Полученный порошок растворили в разбавленной азотной кислоте. Напишите уравнения описанных реакций.
18) Медь растворили в разбавленной азотной кислоте. К полученному раствору добавили избыток раствора аммиака, наблюдая сначала образование осадка, а затем – его полное растворение с образованием темно-синего раствора. Полученный раствор обработали серной кислотой до появления характерной голубой окраски солей меди. Напишите уравнения описанных реакций.
Напишите уравнения описанных реакций.
19) Медь растворили в концентрированной азотной кислоте. К полученному раствору добавили избыток раствора аммиака, наблюдая сначала образование осадка, а затем – его полное растворение с образованием темно-синего раствора. Полученный раствор обработали избытком соляной кислоты. Напишите уравнения описанных реакций.
20) Газ, полученный при взаимодействии железных опилок с раствором соляной кислоты, пропустили над нагретым оксидом меди (II) до полного восстановления металла. полученный металл растворили в концентрированной азотной кислоте. Образовавшийся раствор подвергли электролизу с инертными электродами. Напишите уравнения описанных реакций.
21) Йод поместили в пробирку с концентрированной горячей азотной кислотой. Выделившийся газ пропустили через воду в присутствии кислорода. В полученный раствор добавили гидроксид меди (II). Образовавшийся раствор выпарили и сухой твердый остаток прокалили. Напишите уравнения описанных реакций.
Напишите уравнения описанных реакций.
22) Оранжевый оксид меди поместили в концентрированную серную кислоту и нагрели. К полученному голубому раствору прилили избыток раствора гидроксида калия. выпавший синий осадок отфильтровали, просушили и прокалили. Поученное при этом твердое черное вещество в стеклянную трубку, нагрели и пропустили над ним аммиак. Напишите уравнения описанных реакций.
23) Оксид меди (II) обработали раствором серной кислоты. При электролизе образующегося раствора на инертном аноде выделяется газ. Газ смешали с оксидом азота (IV) и поглотили с водой. К разбавленному раствору полученной кислоты добавили магний, в результате чего в растворе образовалось две соли, а выделение газообразного продукта не происходило. Напишите уравнения описанных реакций.
24) Оксид меди (II) нагрели в токе угарного газа. Полученное вещество сожгли в атмосфере хлора. Продукт реакции растворили в в воде. Полученный раствор разделили на две части. К одной части добавили раствор иодида калия, ко второй – раствор нитрата серебра. И в том, и в другом случае наблюдали образование осадка. Напишите уравнения описанных реакций.
К одной части добавили раствор иодида калия, ко второй – раствор нитрата серебра. И в том, и в другом случае наблюдали образование осадка. Напишите уравнения описанных реакций.
25) Нитрат меди (II) прокалили, образовавшееся твердое вещество растворили в разбавленной серной кислоте. Раствор полученной соли подвергли электролизу. Выделившееся на катоде вещество растворили в концентрированной азотной кислоте. Растворение протекает с выделением бурого газа. Напишите уравнения описанных реакций.
26) Щавелевую кислоту нагрели с небольшим количеством концентрированной серной кислоты. Выделившийся газ пропустили через раствор гидроксида кальция. В котором выпал осадок. Часть газа не поглотилась, его пропустили над твердым веществом черного цвета, полученным при прокаливании нитрата меди (II). В результате образовалось твердое вещество темно-красного цвета. Напишите уравнения описанных реакций.
27) Концентрированная серная кислота прореагировала с медью. Выделившийся при газ полностью поглотили избытком раствора гидроксида калия. Продукт окисления меди смешали с расчетным количеством гидроксида натрия до прекращения выпадения осадка. Последний растворили в избытке соляной кислоты. Напишите уравнения описанных реакций.
Выделившийся при газ полностью поглотили избытком раствора гидроксида калия. Продукт окисления меди смешали с расчетным количеством гидроксида натрия до прекращения выпадения осадка. Последний растворили в избытке соляной кислоты. Напишите уравнения описанных реакций.
Медь. Соединения меди.
- CuCl2 Cu + Сl2
на катоде на аноде
Cu + 4HNO3(конц.) = Cu(NO3)2 + 2NO2↑ + 2H2O
2Cu(NO3)2 2CuO + 4NO2↑ + O2↑
6NaOH(гор.) + 3Cl2 = NaClO3 + 5NaCl + 3H2O
- CuCl2 Cu + Сl2
на катоде на аноде
Cu + S CuS
CuS + 8HNO3(конц. гор.) = CuSO4 + 8NO2↑ + 4H2O
гор.) = CuSO4 + 8NO2↑ + 4H2O
или CuS + 10HNO3(конц.) = Cu(NO3)2 + H2SO4 + 8NO2↑ + 4H2O
4NO2 + 2Ba(OH)2 = Ba(NO3)2 + Ba(NO2)2 + 2H2O
- NaNO3(тв.) + H2SO4(конц.) = HNO3 + NaHSO4
Cu + 4HNO3(конц.) = Cu(NO3)2 + 2NO2↑ + 2H2O
2Cu(NO3)2 2CuO + 4NO2↑ + O2↑
2NaNO3 2NaNO2 + O2↑
- Cu(NO3)2 + 2NaOH = Cu(OH)2↓ + 2NaNO3
Cu(OH)2 + 2HNO3 = Cu(NO3)2 + 2H2O
2Cu(NO3)2 2CuO + 4NO2↑ + O2↑
CuO + 2HNO3 = Cu(NO3)2 + H2O
- 3Cu + 8HNO3(разб.
 ) = 3Cu(NO3)2 + 2NO2↑ + 4H2O
) = 3Cu(NO3)2 + 2NO2↑ + 4H2O
Cu(NO3)2 + 2КOH = Cu(OH)2↓ + 2КNO3
2Cu(NO3)2 2CuO + 4NO2↑ + O2↑
CuO + C Cu + CO
- Hg(NO3)2 + Cu = Cu(NO3)2 + Hg
Cu(NO3)2 + 2NaOH = Cu(OH)2↓ + 2NaNO3
Сu(OH)2 + 4(NH3 · H2O) = [Cu(NH3)4](OH)2 + 4H2O
[Cu(NH3)4](OH)2 + 5H2SO4 = CuSO4 + 4NH4HSO4 + 2H2O
- Cu2O + 6HNO3(конц.) = 2Cu(NO3)2 + 2NO2 + 3H2O
2Cu(NO3)2 2CuO + 4NO2↑ + O2↑
4NO2 + O2 + 2H2O = 4HNO3
10HNO3 + 4Mg = 4Mg(NO3)2 + N2O + 5H2O
- (CuOH)2CO3 2CuO + CO2 + H2O
CuO + H2 Cu + H2O
Cu + 2H2SO4(конц. ) = CuSO4 + SO2 + 2H2O
) = CuSO4 + SO2 + 2H2O
CuSO4 + Cu + 2NaCl = 2CuCl↓ + Na2SO4
- 3Cu + 8HNO3(разб.) = 3Cu(NO3)2 + 2NO2↑ + 4H2O
2Cu(NO3)2 + 2H2O 2Cu + O2 + 4HNO3
на катоде на аноде
2Na + O2 = Na2O2
2Na2O2 + CO2 = 2Na2CO3 + O2
- (CuOH)2CO3 2CuO + CO2 + H2O
CuO + 2HNO3 Cu(NO3)2 + H2O
2Cu(NO3)2 2CuO + 4NO2↑ + O2↑
3CuO + 2NH3 3Cu + N2 + 3H2O
- CuO + H2SO4 CuSO4 + H2O
CuSO4 + 2NaOH = Cu(OH)2 + Na2SO4
Cu(OH)2 CuO + H2O
CuO + H2 Cu + H2O
- Cu + Cl2 CuCl2
CuCl2 + 2NaOH = Cu(OH)2↓ + 2NaCl
Cu(OH)2 CuO + H2O
CuO + C Cu + CO
- Cu + 4HNO3(конц.
 ) = Cu(NO3)2 + 2NO2↑ + 2H2O
) = Cu(NO3)2 + 2NO2↑ + 2H2O
4NO2 + O2 + 2H2O = 4HNO3
2Cu(NO3)2 2CuO + 4NO2↑ + O2↑
CuO + H2 Cu + H2O
- 2Cu + O2 = 2CuO
CuO + H2SO4 = CuSO4 + H2O
CuSO4 + NaOH = Cu(OH)2↓ + Na2SO4
Сu(OH)2 + 4(NH3 · H2O) = [Cu(NH3)4](OH)2 + 4H2O
- СuSO4 + 2NaOH = Cu(OH)2 + Na2SO4
Cu(OH)2 CuO + H2O
CuO + C Cu + CO
Cu + 2H2SO4(конц.) = CuSO4 + SO2 + 2H2O
16) 2Cu + I2 = 2CuI
2CuI + 4H2SO4 2CuSO4 + I2 + 2SO2 + 4H2O
СuSO4 + 2KOH = Cu(OH)2 + K2SO4
Cu(OH)2 CuO + H2O
17) 2CuCl2 + 2Na2CO3 + H2O = (CuOH)2CO3 + CO2 + 4NaCl
(CuOH)2CO3 2CuO + CO2 + H2O
CuO + H2 Cu + H2O
3Cu + 8HNO3(разб.) = 3Cu(NO3)2 + 2NO2↑ + 4H2O
18) 3Cu + 8HNO3(разб.) = 3Cu(NO3)2 + 2NO2↑ + 4H2O
Сu(NO3)2 + 2NH3· H2O = Cu(OH)2↓ + 2NH4NO3
Cu(OH)2 + 4NH3· H2O = [Cu(NH3)4](OH)2 + 4H2O
[Cu(NH3)4](OH)2 + 3H2SO4 = CuSO4 + 2(NH4)2SO4 + 2H2O
19) Cu + 4HNO3(конц.) = Cu(NO3)2 + 2NO2↑ + 2H2O
Сu(NO3)2 + 2NH3· H2O = Cu(OH)2↓ + 2NH4NO3
Cu(OH)2 + 4NH3· H2O = [Cu(NH3)4](OH)2 + 4H2O
[Cu(NH3)4](OH)2 + 6HCl = CuCl2 + 4NH4Cl + 2H2O
20) Fe + 2HCl = FeCl2 + H2
CuO + H2 = Cu + H2O
Cu + 4HNO3(конц.) = Cu(NO3)2 + 2NO2↑ + 2H2O
2Cu(NO3)2 + 2H2O 2Cu + O2 + 4HNO3
21) I2 + 10HNO3 = 2HIO3 + 10NO2 + 4H2O
4NO2 + 2H2O + O2 = 4HNO3
Cu(OH)2 + 2HNO3 Cu(NO3)2 + 2H2O
2Cu(NO3)2 2CuO + 4NO2↑ + O2↑
22) Cu2O + 3H2SO4 = 2CuSO4 + SO2 + 3H2O
СuSO4 + 2KOH = Cu(OH)2 + K2SO4
Cu(OH)2 CuO + H2O
3CuO + 2NH3 3Cu + N2 + 3H2O
23) CuO + H2SO4 = CuSO4 + H2O
2CuSO4 + 2H2O 2Cu + O2 + 2H2SO4
4NO2 + O2 + 2H2O = 4HNO3
10HNO3 + 4Mg = 4Mg(NO3)2 + NH4NO3 + 3H2O
24) CuO + CO Cu + CO2
Cu + Cl2 = CuCl2
2CuCl2 + 2KI = 2CuCl↓ + I2 + 2KCl
CuCl2 + 2AgNO3 = 2AgCl↓ + Cu(NO3)2
25) 2Cu(NO3)2 2CuO + 4NO2↑ + O2↑
CuO + H2SO4 = CuSO4 + H2O
2CuSO4 + 2H2O 2Cu + O2 + 2H2SO4
Cu + 4HNO3(конц.) = Cu(NO3)2 + 2NO2↑ + 2H2O
26) H2C2O4 CO↑ + CO2↑ + H2O
CO2 + Ca(OH)2 = CaCO3 + H2O
2Cu(NO3)2 2CuO + 4NO2↑ + O2↑
CuO + CO Cu + CO2
27) Cu + 2H2SO4(конц.) = CuSO4 + SO2 + 2H2O
SO2 + 2KOH = K2SO3 + H2O
СuSO4 + 2NaOH = Cu(OH)2 + Na2SO4
Cu(OH)2 + 2HCl CuCl2 + 2H2O
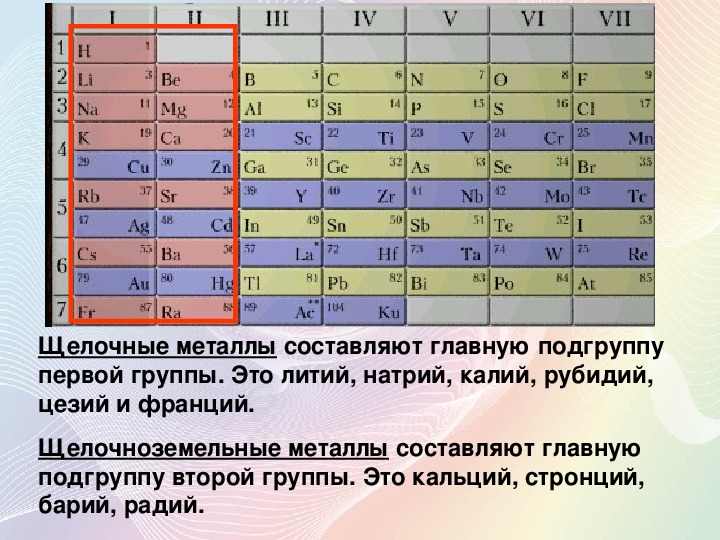
общая характеристика, строение; свойства и получение простых веществ — урок. Химия, 8–9 класс.
Щелочными металлами называются химические элементы-металлы \(IA\) группы Периодической системы Д. И. Менделеева: литий \(Li\), натрий \(Na\), калий \(K\), рубидий \(Rb\), цезий \(Cs\) и франций \(Fr\).
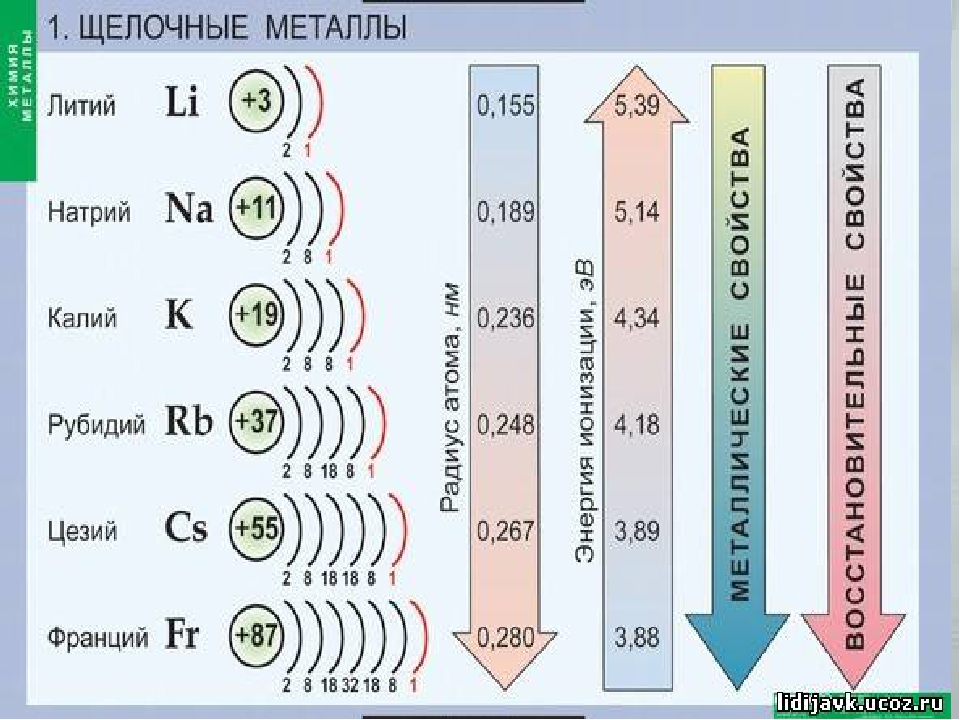
Электронное строение атомов. На внешнем энергетическом уровне атомы щелочных металлов имеют один электрон ns1. Поэтому для всех металлов группы \(IA\) характерна степень окисления \(+1\).
Этим объясняется сходство свойств всех щелочных металлов.
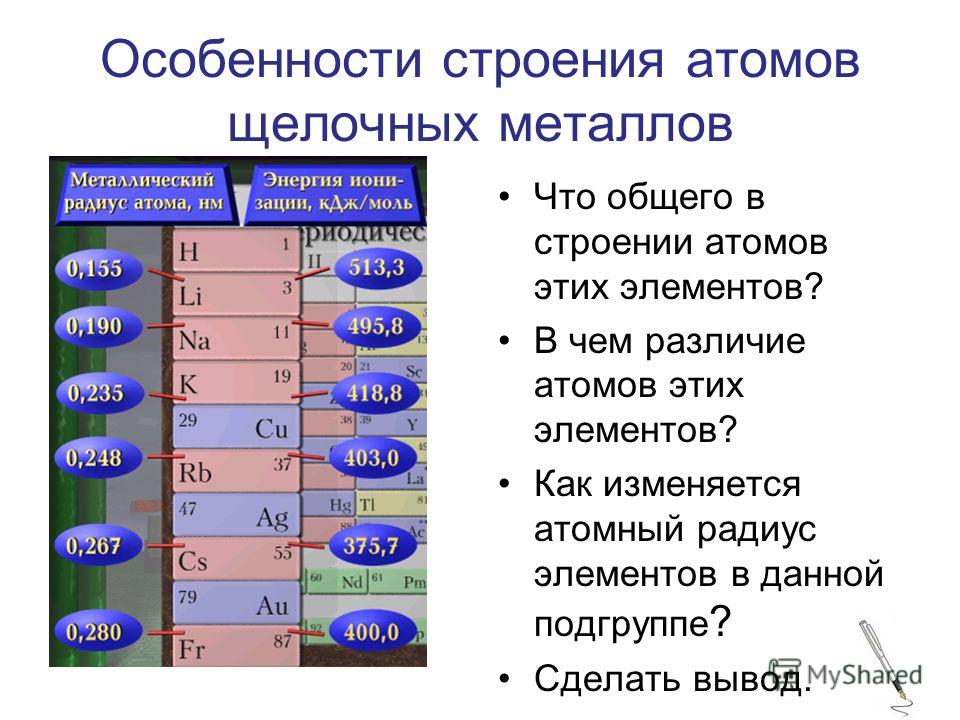
Для них (сверху вниз по группе) характерно:
- увеличение радиуса атомов;
- уменьшение электроотрицательности;
- усиление восстановительных, металлических свойств.
Нахождение в природе. Из щелочных металлов наиболее широко распространены в природе натрий и калий. Но из-за высокой химической активности они встречаются только в виде соединений.
Основными источниками натрия и калия являются:
- каменная соль (хлорид натрия \(NaCl\)),
- глауберова соль, или мирабилит — декагидрат сульфата натрия Na2SO4 \(·\) 10h3O,
- сильвин — хлорид калия \(KCl\),
- сильвинит — двойной хлорид калия-натрия \(KCL\) \(·\)\(NaCl\) и др.
Соединения лития, рубидия и цезия в природе встречаются значительно реже, поэтому их относят к числу редких и рассеянных.
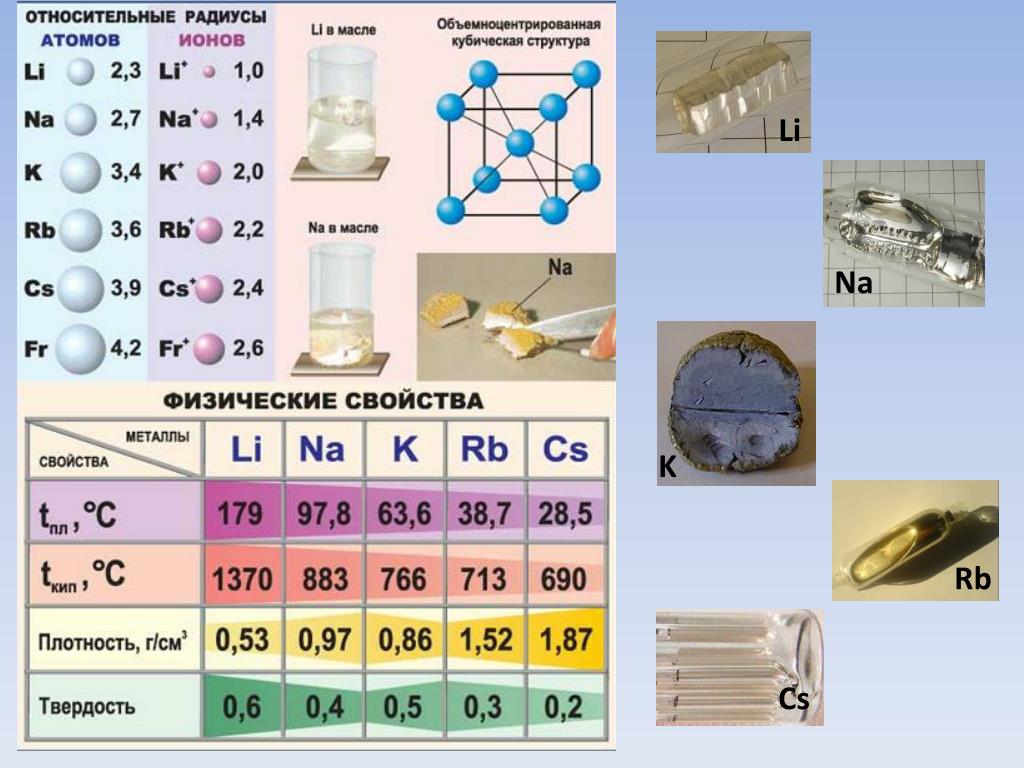
Физические свойства простых веществ. В твёрдом агрегатном состоянии атомы связаны металлической связью. Наличие металлической связи обусловливает общие физические свойства простых веществ-металлов: металлический блеск, ковкость, пластичность, высокую тепло- и электропроводность.
В свободном виде простые вещества, образованные элементами \(IA\) группы — это легкоплавкие металлы серебристо-белого (литий, натрий, калий, рубидий) или золотисто-жёлтого (цезий) цвета, обладающие высокой мягкостью и пластичностью.
Наиболее твёрдым является литий, остальные щелочные металлы легко режутся ножом и могут быть раскатаны в фольгу.
Только у натрия плотность немного больше единицы ρ=1,01 г/см3, у всех остальных металлов плотность меньше единицы.
Химические свойства. Щелочные металлы обладают высокой химической активностью, реагируя с кислородом и другими неметаллами.
Поэтому хранят щелочные металлы под слоем керосина или в запаянных ампулах. Они являются сильными восстановителями.
Все щелочные металлы активно реагируют с водой, выделяя из неё водород.
Пример:
2Na+2h3O=2NaOH+h3↑.
Взаимодействие натрия с водой протекает с выделением большого количества теплоты (т. е. реакция является экзотермической). Кусочек натрия, попав в воду, начинает быстро двигаться по её поверхности. Под действием выделяющейся теплоты он расплавляется, превращаясь в каплю, которая, взаимодействуя с водой, быстро уменьшается в размерах. Если задержать её, прижав стеклянной палочкой к стенке сосуда, капля воспламенится и сгорит ярко-жёлтым пламенем.
Получение. Металлический натрий в промышленности получают главным образом электролизом расплава хлорида натрия с инертными (графитовыми) электродами.
В расплаве хлорида натрия присутствуют ионы:
NaCl⇄Na++Cl−.
При электролизе
на катоде восстанавливаются катионы Na+, а на аноде окисляются анионы Cl−:
катод (\(–\)): 2Na++2e=2Na,
анод (\(+\)): 2Cl−−2e=Cl2↑.
Суммарное уравнение реакции при электролизе расплава хлорида натрия:
2NaCl→2Na+Cl2↑.
Источники:
Иллюстрация: https://arhivurokov.ru/multiurok/html/2017/02/26/s_58b332582fb94/img1.jpg
Металлы побочной подгруппы I группы (металлы подгруппы меди)
К побочной подгруппе первой группы относятся медь, серебро, золото. Несмотря на то что эти элементы не имеют незаполненных -оболочек, по свойствам они во многом сходны с переходными металлами они проявляют переменную валентность, их соединения легко восстанавливаются, многие из них окрашены. По-видимому, благодаря этим свойствам соединения подгруппы меди в основном применяются в окислительно-восстановительном катализе, хотя некоторые соли меди и серебра катализируют и ионные процессы. [c.96]В периодической системе элементов медь, серебро, золото образуют побочную подгруппу первой группы. Эти элементы не являются типичными металлами по химическим свойствам. По физическим свойствам медь, серебро и золото — металлы. Атомы элементов подгруппы меди имеют в наружном слое один электрон, но могут терять, кроме наружного электрона, еще электроны из предпоследнего слоя. Поэтому медь, серебро и золото бывают в химических соединениях не только одновалентными. Так, золото проявляет валентность + 1 и + 3. [c.185]
Элементы побочной подгруппы I группы медь Си, серебро Ag, и золото Аи известны с древнейших времен. Все они встречаются в природе в самородном виде, что свидетельствует о химической инертности свободных металлов, резко усиливающейся от меди к золоту. Не случайно серебро и золото относят к благородным металлам. Все эти элементы в электрохимическом ряду напряжений металлов стоят правее водорода и вытесняются многими металлами из растворов солей [c.159]
Общие сведения. Цинк, кадмий, ртуть являются последними представителями -переходных элементов в периодах. Это обстоятельство, а также специфика полностью завершенной ( °) орбитали накладывают на химию этих элементов определенные особенности. С одной стороны, они еще похожи на своих предшественников по периоду, с другой — в большей мере, чем другие -элементы, похожи на элементы главной группы (НА). Например, сульфат цинка очень похож на сульфат магния, а его карбонат — на карбонат бериллия. Общими для всех элементов главной и побочной подгрупп второй группы являются близость оптических спектр
Щелочные металлы — семейство химических элементов — «Химическая продукция»
Что такое щелочные металлы?
У щелочных металлов электронная конфигурация внешнего энергетического уровня : ns1, на внешнем энергетическом уровне находится 1 s-электрон.
Типичная степень окисления щелочных металлов в соединениях +1.
Располагаются сразу за инертными газами, поэтому особенность строения атомов щелочных металлов заключается в том, что они содержат один электрон на внешнем энергетическом уровне: их электронная конфигурация ns1.
Валентные электроны щелочных металлов могут быть легко удалены, потому что атому энергетически выгодно отдать электрон и приобрести конфигурацию инертного газа.
Поэтому для всех щелочных металлов характерны восстановительные свойства.
Это подтверждают низкие значения их потенциалов ионизации (потенциал ионизации атома цезия — самый низкий) и электроотрицательности (ЭО).
Однозарядные катионы
В большинстве соединений щелочные металлы присутствуют в виде однозарядных катионов.
Однако существуют и соединения, где щелочные металлы представлены анионами (см. Алкалиды).
атомные и физические свойства щелочных металлов
| Атомный номер | Название, символ | Число природных изотопов | Атомная масса | Энергия ионизации , кДж·моль −1 | Сродство к электрону , кДж·моль −1 | ЭО | Δ Hдисс , кДж·моль −1 | Металл. радиус, нм | Ионный радиус (КЧ 6), нм | tпл ,°C | tкип ,°C | Плотность ,г/см³ | Δ Hпл , кДж·моль −1 | Δ Hкип , кДж·моль −1 | Δ Hобр , кДж·моль −1 |
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 3 | Литий Li | 2 | 6,941(2) | 520,2 | 59,8 | 0,98 | 106,5 | 0,152 | 0,076 | 180,6 | 1342 | 0,534 | 2,93 | 148 | 162 |
| 11 | Натрий Na | 1 | 22,989768(6) | 495,8 | 52,9 | 0,99 | 73,6 | 0,186 | 0,102 | 97,8 | 883 | 0,968 | 2,64 | 99 | 108 |
| 19 | Калий К | 2+1 а | 39,0983(1) | 418,8 | 46,36 | 0,82 | 57,3 | 0,227 | 0,138 | 63,07 | 759 | 0,856 | 2,39 | 79 | 89,6 |
| 37 | Рубидий Rb | 1+1 а | 85,4687(3) | 403,0 | 46,88 | 0,82 | 45,6 | 0,248 | 0,152 | 39,5 | 688 | 1,532 | 2,20 | 76 | 82 |
| 55 | Цезий Cs | 1 | 132,90543(5) | 375,7 | 45,5 | 0,79 | 44,77 | 0,265 | 0,167 | 28,4 | 671 | 1,90 | 2,09 | 67 | 78,2 |
| 87 | Франций Fr | 2а | (223) | 380 | (44,0) | 0,7 | — | — | 0,180 | 20 | 690 | 1,87 | 2 | 65 | — |
| 119 | Унуненний Uue |
Радиоактивные изотопы: 40K, T1/2 = 1,277·109 лет; 87Rb, T1/2 = 4,75·1010 лет; 223Fr, T1/2 = 21,8 мин; 224Fr, T1/2 = 3,33 мин.
Все металлы этой подгруппы имеют серебристо-белый цвет (кроме серебристо-жёлтого цезия), они очень мягкие, их можно резать скальпелем. Литий, натрий и калий легче воды и плавают на её поверхности, реагируя с ней.
Многие минералы содержат в своём составе щелочные металлы. Например, ортоклаз, или полевой шпат, состоит из алюмосиликата калия K2[Al2Si6O16], аналогичный минерал, содержащий натрий — альбит — имеет состав Na2[Al2Si6O16]. В морской воде содержится хлорид натрия NaCl, а в почве — соли калия — сильвин KCl, сильвинит NaCl·KCl, карналлит KCl·MgCl2·6h3O, полигалит K2SO4·MgSO4·CaSO4·2h3O.
Химические свойства щелочных металлов
Из-за высокой химической активности щелочных металлов по отношению к воде, кислороду, и иногда даже и азоту (Li) их хранят под слоем керосина. Чтобы провести реакцию со щелочным металлом, кусочек нужного размера аккуратно отрезают скальпелем под слоем керосина, в атмосфере аргона тщательно очищают поверхность металла от продуктов его взаимодействия с воздухом и только потом помещают образец в реакционный сосуд.
Взаимодействие с водой
Важное свойство щелочных металлов — их высокая активность по отношению к воде. Наиболее спокойно (без взрыва) реагирует с водой литий:
{\mathsf {2\ Li+2\ H_{2}O\longrightarrow 2\ LiOH+\ H_{2}\uparrow ))
При проведении аналогичной реакции натрий горит жёлтым пламенем и происходит небольшой взрыв. Калий ещё более активен: в этом случае взрыв гораздо сильнее, а пламя окрашено в фиолетовый цвет.
Взаимодействие с кислородом
Продукты горения щелочных металлов на воздухе имеют разный состав в зависимости от активности металла.
Только литий сгорает на воздухе с образованием оксида стехиометрического состава:
{\mathsf {4\ Li+\ O_{2}\longrightarrow 2\ Li_{2}O))
При горении натрия в основном образуется пероксид Na2O2 с небольшой примесью надпероксида NaO2:
{\mathsf {2\ Na+\ O_{2}\longrightarrow \ Na_{2}O_{2))}
В продуктах горения калия, рубидия и цезия содержатся в основном надпероксиды:
{\mathsf {K+\ O_{2}\longrightarrow \ KO_{2))}
Для получения оксидов натрия и калия нагревают смеси гидроксида, пероксида или надпероксида с избытком металла в отсутствие кислорода:
{\mathsf {2\ Na+2\ NaOH\longrightarrow 2\ Na_{2}O+\ H_{2}\uparrow ))
{\mathsf {2\ Na+\ Na_{2}O_{2}\longrightarrow 2\ Na_{2}O))
{\mathsf {3\ K+\ KO_{2}\longrightarrow 2\ K_{2}O))
Для кислородных соединений щелочных металлов характерна следующая закономерность: по мере увеличения радиуса катиона щелочного металла возрастает устойчивость кислородных соединений, содержащих пероксид-ион О2−
2 и надпероксид-ион O−
2.
Для тяжёлых щелочных металлов характерно образование довольно устойчивых озонидов состава ЭО3. Все кислородные соединения имеют различную окраску, интенсивность которой увеличивается в ряду от Li до Cs:
Таблица формула
| Формула кислородного соединения | Цвет |
|---|---|
| Li2O | Белый |
| Na2O | Белый |
| K2O | Желтоватый |
| Rb2O | Жёлтый |
| Cs2O | Оранжевый |
| Na2O2 | Светло- жёлтый |
| KO2 | Оранжевый |
| RbO2 | Тёмно- коричневый |
| CsO2 | Жёлтый |
Оксиды щелочных металлов обладают всеми свойствами, присущими основным оксидам: они реагируют с водой, кислотными оксидами и кислотами:
{\mathsf {Li_{2}O+\ H_{2}O\longrightarrow 2\ LiOH))
{\mathsf {K_{2}O+\ SO_{3}\longrightarrow \ K_{2}SO_{4))}
{\mathsf {Na_{2}O+2\ HNO_{3}\longrightarrow 2\ NaNO_{3}+\ H_{2}O))
Пероксиды и надпероксиды проявляют свойства сильных окислителей:
{\mathsf {Na_{2}O_{2}+2\ NaI+2\ H_{2}SO_{4}\longrightarrow \ I_{2}+2\ Na_{2}SO_{4}+2\ H_{2}O))
Пероксиды и надпероксиды интенсивно взаимодействуют с водой, образуя гидроксиды:
{\mathsf {Na_{2}O_{2}+2\ H_{2}O\longrightarrow 2\ NaOH+\ H_{2}O_{2))}
{\mathsf {2\ KO_{2}+2\ H_{2}O\longrightarrow 2\ KOH+\ H_{2}O_{2}+\ O_{2}\uparrow ))
Взаимодействие с другими веществами
Щелочные металлы реагируют со многими неметаллами. При нагревании они соединяются с водородом с образованием гидридов, с галогенами, серой, азотом, фосфором, углеродом и кремнием с образованием, соответственно, галогенидов, сульфидов, нитридов, фосфидов, карбидов и силицидов:
{\mathsf {2\ Na+\ H_{2}\longrightarrow 2\ NaH))
{\mathsf {2\ Na+\ Cl_{2}\longrightarrow 2\ NaCl))
{\mathsf {2\ K+\ S\longrightarrow \ K_{2}S))
{\mathsf {6\ Li+\ N_{2}\longrightarrow 2\ Li_{3}N))
{\mathsf {2\ Li+2\ C\longrightarrow \ Li_{2}C_{2))}
При нагревании щелочные металлы способны реагировать с другими металлами, образуя интерметаллиды. Активно (со взрывом) щелочные металлы реагируют с кислотами.
Щелочные металлы растворяются в жидком аммиаке и его производных — аминах и амидах:
{\mathsf {2\ Na+2\ NH_{3}\longrightarrow 2\ NaNH_{2}+\ H_{2}\uparrow ))
При растворении в жидком аммиаке щелочной металл теряет электрон, который сольватируется молекулами аммиака и придаёт раствору голубой цвет. Образующиеся амиды легко разлагаются водой с образованием щёлочи и аммиака:
{\mathsf {KNH_{2}+\ H_{2}O\longrightarrow \ KOH+\ NH_{3}\uparrow ))
Щелочные металлы взаимодействуют с органическими веществами спиртами (с образованием алкоголятов) и карбоновыми кислотами (с образованием солей):
{\mathsf {2\ Na+2\ CH_{3}CH_{2}OH\longrightarrow 2\ CH_{3}CH_{2}ONa+\ H_{2}\uparrow ))
{\mathsf {2\ Na+2\ CH_{3}COOH\longrightarrow 2\ CH_{3}COONa+\ H_{2}\uparrow ))
Качественное определение щелочных металлов
Поскольку потенциалы ионизации щелочных металлов невелики, то при нагревании металла или его соединений в пламени атом ионизируется, окрашивая пламя в определённый цвет:
Окраска пламени щелочными металлами и их соединениями
| Щелочной металл | Цвет пламени |
|---|---|
| Li | Карминно-красный |
| Na | Жёлтый |
| K | Фиолетовый |
| Rb | Буро-красный |
| Cs | Фиолетово-красный |
Получение щелочных металлов
Электролиз расплавов галогенидов
Для получения щелочных металлов используют в основном электролиз расплавов их галогенидов, чаще всего — хлоридов, образующих природные минералы:
{\mathsf {2\ LiCl\longrightarrow 2\ Li+\ Cl_{2}\uparrow ))
катод: {\displaystyle {\mathsf {Li^{+))}+e\longrightarrow {\mathsf {Li))}
анод: {\displaystyle {\mathsf {2Cl^{-))}-2e\longrightarrow {\mathsf {Cl_{2))}\uparrow }
Электролиз расплавов гидроксидов
Иногда для получения щелочных металлов проводят электролиз расплавов их гидроксидов:
{\mathsf {4\ NaOH\longrightarrow 4\ Na+2\ H_{2}O+\ O_{2}\uparrow ))
катод: {\displaystyle {\mathsf {Na^{+))}+e\longrightarrow {\mathsf {Na))}
анод: {\displaystyle {\mathsf {4OH^{-))}-4e\longrightarrow {\mathsf {2H_{2}O+O_{2))}\uparrow }
Восстановление из галогенидов
Щелочной металл может быть восстановлен из соответствующего хлорида или бромида кальцием, магнием, кремнием и др. восстановителями при нагревании под вакуумом до 600—900 °C:
{\mathsf {2\ MCl+\ Ca\longrightarrow 2\ M\uparrow +\ CaCl_{2))}
Чтобы реакция пошла в нужную сторону, образующийся свободный щелочной металл (M) должен удаляться путём отгонки. Аналогично возможно восстановление цирконием из хромата. Известен способ получения натрия восстановлением из карбоната углём при 1000 °C в присутствии известняка.
Поскольку щелочные металлы в электрохимическом ряду напряжений находятся левее водорода, то электролитическое получение их из водных растворов солей невозможно; в этом случае образуются соответствующие щёлочи и водород.
Соединения щелочных металлов
Гидроксиды
Для получения гидроксидов щелочных металлов в основном используют электролитические методы. Наиболее крупнотоннажным является производство гидроксида натрия электролизом концентрированного водного раствора поваренной соли:
{\mathsf {2\ NaCl+2\ H_{2}O\longrightarrow \ H_{2}\uparrow +\ Cl_{2}\uparrow +2\ NaOH))
катод: {\displaystyle 2\ {\mathsf {H^{+))}+2\ e\longrightarrow \ {\mathsf {H_{2))}\uparrow }
анод: {\displaystyle 2\ {\mathsf {Cl^{-))}-2\ e\longrightarrow \ {\mathsf {Cl_{2))}\uparrow }
Прежде щёлочь получали реакцией обмена:
{\mathsf {Na_{2}CO_{3}+\ Ca(OH)_{2}\longrightarrow \ CaCO_{3}\downarrow +2\ NaOH))
Получаемая таким способом щёлочь была сильно загрязнена содой Na2CO3.
Гидроксиды щелочных металлов — белые гигроскопичные вещества, водные растворы которых являются сильными основаниями. Они участвуют во всех реакциях, характерных для оснований — реагируют с кислотами, кислотными и амфотерными оксидами, амфотерными гидроксидами:
{\mathsf {2\ LiOH+\ H_{2}SO_{4}\longrightarrow \ Li_{2}SO_{4}+2\ H_{2}O))
{\mathsf {2\ KOH+\ CO_{2}\longrightarrow \ K_{2}CO_{3}+\ H_{2}O))
{\mathsf {KOH+\ Al(OH)_{3}\longrightarrow \ K[Al(OH)_{4}]))
Гидроксиды щелочных металлов при нагревании возгоняются без разложения, за исключением гидроксида лития, который так же, как гидроксиды металлов главной подгруппы II группы, при прокаливании разлагается на оксид и воду:
{\mathsf {2\ LiOH\longrightarrow \ Li_{2}O+\ H_{2}O))
Гидроксид натрия используется для изготовления мыла, синтетических моющих средств, искусственного волокна, органических соединений, например фенола.
Соли
Важным продуктом, содержащим щелочной металл, является сода Na2CO3. Основное количество соды во всём мире производят по методу Сольве, предложенному ещё в начале XX века. Суть метода состоит в следующем: водный раствор NaCl, к которому добавлен аммиак, насыщают углекислым газом при температуре 26—30 °C. При этом образуется малорастворимый гидрокарбонат натрия, называемый питьевой содой:
{\mathsf {NaCl+\ NH_{3}+\ CO_{2}+\ H_{2}O\longrightarrow \ NaHCO_{3}\downarrow +\ NH_{4}Cl))
Аммиак добавляют для нейтрализации кислотной среды, возникающей при пропускании углекислого газа в раствор, и получения гидрокарбонат-иона HCO3−, необходимого для осаждения гидрокарбоната натрия. После отделения питьевой соды раствор, содержащий хлорид аммония, нагревают с известью и выделяют аммиак, который возвращают в реакционную зону:
{\mathsf {2\ NH_{4}Cl+\ Ca(OH)_{2}\longrightarrow 2\ NH_{3}\uparrow +\ CaCl_{2}+2\ H_{2}O))
Таким образом, при аммиачном способе получения соды единственным отходом является хлорид кальция, остающийся в растворе и имеющий ограниченное применение.
При прокаливании гидрокарбоната натрия получается кальцинированная, или стиральная, сода Na2CO3 и диоксид углерода, используемый в процессе получения гидрокарбоната натрия:
{\mathsf {2\ NaHCO_{3}\longrightarrow \ Na_{2}CO_{3}+\ CO_{2}\uparrow +\ H_{2}O))
Основной потребитель соды — стекольная промышленность.
В отличие от малорастворимой кислой соли NaHCO3, гидрокарбонат калия KHCO3 хорошо растворим в воде, поэтому карбонат калия, или поташ, K2CO3 получают действием углекислого газа на раствор гидроксида калия:
{\mathsf {2\ KOH+\ CO_{2}\longrightarrow \ K_{2}CO_{3}+\ H_{2}O))
Поташ используют в производстве стекла и жидкого мыла.
Литий — единственный щелочной металл, для которого не получен гидрокарбонат. Причина этого явления в очень маленьком радиусе иона лития, который не позволяет ему удерживать довольно крупный ион HCO−
3.
Безопасность
Все щелочные металлы проявляют высокую активность при взаимодействии с водой, кислородом, галогенами и другими соединениями. Особенно опасны взаимодействия с водой, так как продуктами реакций являются едкие щёлочи, а также происходит огромное выделение энергии, сопровождаемое огненной вспышкой (в случае с калием) или взрывом (в случае с рубидием или цезием). Поэтому необходимо соблюдать правила безопасности при работе с ними. Работа должна проводиться исключительно в перчатках из латекса, также необходимо надевать защитные очки. В экспериментах используют только небольшие количества, манипуляции с которыми производят при помощи щипцов; в случае непрореагировавших остатков щелочных металлов (например, натрия или калия), применяют утилизацию в обезвоженном спирте. Рубидий и цезий ввиду чрезвычайно высокой химической активности (взрывоопасные) практически не применяют в опытах.
Урок 9. Щелочные и щёлочноземельные металлы – HIMI4KA
У нас вышел новый курс, где всё объясняется ещё проще. Подробннее по ссылке
Щелочные металлы
Щелочные металлы — это элементы главной подгруппы I группы Периодической системы химических элементов Менделеева (ПСМ) (кроме водорода).
Задание 9.1. Назовите все щелочные металлы. Составьте схемы строения атомов натрия и калия. Укажите распределение их валентных электронов.
На внешнем уровне у атомов таких металлов находится по 1 электрону, но расстояние до ядра, а значит, и притяжение к нему, у этих электронов различно.
Вопрос. У какого элемента (натрия или калия) внешние электроны дальше от ядра?
Чем дальше электроны от ядра, тем слабее они притягиваются к нему, тем легче данный атом отдаёт электроны. А это означает, что металлические свойства выражены тем ярче, чем дальше валентные электроны от ядра (при прочих равных условиях). Поэтому сверху вниз в каждой главной подгруппе увеличивается число энергетических уровней в атомах, растёт металлическая активность элементов, т. е. способность их атомов отдавать электроны.
Вопрос. Какой металл более активный: натрий или калий?
Таким образом, активность щелочных металлов возрастает
Но поскольку на внешнем уровне любого щелочного металла находится один электрон, в любой химической реакции щелочные металлы могут отдать только один электрон. Значит, они имеют постоянную валентность I и образуют оксиды состава
Этот оксид растворяется в воде, реагирует с нею:
Полученное основание — щёлочь.
Вопрос. Что такое щёлочь? (См. урок 2.3.)
В подгруппе сверху вниз увеличивается и сила оснований, т. е. способность диссоциировать в водных растворах на ионы. Самой сильной щёлочью является CsOH.
Растворы щелочей мылкие на ощупь, разъедают кожу и ткани (щёлочи — едкие!), изменяют окраску индикаторов. Поскольку все металлы главной подгруппы I группы образуют щёлочи, — их называют «щелочные металлы».
Рассмотрим свойства щелочных металлов на примере натрия. При этом будем придерживаться схемы, изложенной начале второй части.
Строение атома Nа изображается схемой:
Имея один валентный электрон (…3s1), натрий является активным металлом с постоянной валентностью I:
Простое вещество «натрий» — очень лёгкий (легче воды) серебристо-белый металл, который легко режется ножом. Натрий активно реагирует с кислородом, водородом, неметаллами, водой:
Вопрос. Почему атом серы присоединил 2 электрона?
Задание 9.2. Составьте уравнения реакций натрия с хлором Cl2, азотом N2 и водой (при затруднениях см. пояснения в уроке 7).
Даже небольшие кусочки натрия (величиной с горошину) при попадании в воду вызывают оглушительный взрыв — это взрывается водород (см. урок 12). Тот же эффект будет, если натрий опустить в раствор кислоты или соли. Кроме того, здесь возможны более сложные побочные процессы. Поэтому составлять уравнения реакций для щелочных металлов в качестве примеров процессов
- металл + раствор кислоты →
- металл + раствор соли →
не рекомендуется.
Натрий образует основный оксид Nа2O, который реагирует с водой, с кислотами и кислотными оксидами (см. урок 2.1), например:
Задание 9.3. Составьте уравнения реакций оксида натрия с водой и с серной кислотой.
Гидроксид натрия NaOH (едкий натр, каустическая сода) проявляет все свойства щелочей: реагирует с кислотными оксидами, кислотами, растворами солей (см. урок 2.3), например:
Все соединения натрия окрашивают пламя в жёлтый цвет. Это качественная реакция на соединения натрия.
Задание 9.4. Составьте уравнения реакций гидроксида натрия с хлоридом железа III, фосфорной кислотой, оксидом серы IV. (При затруднениях см. урок 2.3.)
Задание 9.5. Опишите по разобранной схеме свойства калия и его соединений.
Многие соединения натрия нашли применение в быту и промышленности. Так, каустическая сода NаОН применяется для получения мыла, в производстве алюминия, искусственных волокон и др. Кальцинированная сода Na2CO3 также применяется при получении мыла, а также при варке стекла, стирке белья и др. Но в пищу эти «соды» не употребляются! При приготовлении пищи используют питьевую соду NaHCO3 и поваренную соль NaCl. Питьевая сода используется при лечении простуды, её кладут в печенье, пирожки. Без соли NaCl почти любая еда покажется невкусной, без неё невозможно законсервировать мясо, овощи, грибы. Эти вещества применяются и в технических целях.
Щелочноземельные металлы
Металлы главной подгруппы II группы в отличие от щелочных металлов имеют довольно разные свойства.
Вопросы
- Сколько электронов на внешнем уровне атомов этих металлов?
- Какой металл более активен: натрий или магний? Почему?
Эти металлы имеют на внешнем уровне по 2 электрона, следовательно, они менее активны, чем их «соседи» — щелочные металлы, так как на отрыв двух электронов нужно затратить больше энергии, чем на отрыв одного электрона.
Вопрос. Как изменяется активность металлов в подгруппе сверху вниз? Почему?
В этой подгруппе, как и у щелочных металлов, сверху вниз увеличивается сила оснований, т. е. способность диссоциировать в водных растворах на ионы. Кроме того, увеличивается заряд иона, а значит, усиливается притяжение группы ОН в гидроксиде металла: ионы Na+ и OH– притягиваются слабее, чем Са2+ и ОН–.
Поэтому первые два элемента этой подгруппы не образуют щелочей:
Кальций уже образует сильное основание — щёлочь, а стронцию и барию соответствуют ещё более сильные основания.
Запомните: Ca, Sr, Ba — щелочноземельные* металлы, так как их оксиды проявляют щелочные свойства.
* «Земли» — устаревшее название оксидов металлов, так как эти оксиды входят в состав земли (почвы).
Несмотря на эти различия, перечисленные элементы имеют много сходного в свойствах.
Вопрос. Какую валентность проявляют эти химические элементы в соединениях?
Главное сходство химических элементов главной подгруппы II группы заключается в том, что они проявляют в соединениях постоянную валентность II, так как на внешнем уровне имеют по два электрона, а на предвнешнем уровне нет незавершённых подуровней.
Рассмотрим свойства химических элементов главной подгруппы II группы на примере кальция. Строение атома кальция изображается схемой:
Имея два валентных электрона: …4s2, кальций является активным металлом, поскольку оба электрона расположены на внешнем уровне. Его постоянная валентность равна двум:
Простое вещество «кальций» — довольно прочный, серебристо-белый умеренно твёрдый металл. Активно реагирует с кислородом, водородом, неметаллами, водой, растворами кислот:
Рассмотрим как происходит взаимодействие кальция с азотом:
Вопрос. Почему атом азота присоединяет три электрона?
Задание 9.6. Составьте уравнения реакций кальция с кислородом, хлором (Cl2), серой, водой, соляной кислотой.
Оксид кальция CaO (негашёная известь) очень активно реагирует с водой с выделением такого большого количества теплоты, что вода закипает:
Этот процесс называется «гашением извести», а систему называют «кипелкой».
Вопрос. С какими ещё веществами может реагировать оксид кальция?
Как основный оксид CaO реагирует с кислотными оксидами и с кислотами:
- CaO + SO2 → СаSO3
- CaO + НNO3 → … (закончить уравнение этой реакции).
Гидроксид кальция Са(ОН)2 (гашёная известь) проявляет все свойства щелочей.
Вопрос. С какими веществами могут реагировать щелочи? (При затруднении см. урок 2.3.)
Задание 9.7. Составить уравнения реакций:
- Са(ОН)2 + СO2 →
- Са(ОН)2 + H3PO4 →
- Са(ОН)2 + Na2CO3 →
Прозрачный раствор гидроксида кальция в воде называется известковой водой. Она мутнеет при пропускании через неё углекислого газа:
Этот эффект реакции считают качественным признаком того, что в данном растворе присутствуют ионы кальция. Убедиться в этом поможет также реакция с пламенем: все соединения кальция окрашивают пламя в кирпично-красный цвет.
Задание 9.8. Опишите по предложенной схеме свойства магния и его соединений.
Многие соединения кальция играют заметную роль в нашей жизни. Достаточно сказать, что фосфат кальция, карбонат кальция составляют основу костей, зубов. Без ионов кальция не может свертываться кровь. Без соединений кальция невозможно построить дом, так как известь (гашёная и негашёная) обеспечивает скрепление строительных блоков друг с другом:
Образование в результате этих реакций прочных нерастворимых карбонатов и силикатов кальция надёжно скрепляет стены. Аналогичные реакции происходят при схватывании цемента.
Оксид кальция в больших количествах получают обжигом известняка:
Карбонат кальция СаСО3 составляет основу мела, мрамора, известняка. Из него состоят целые горы и пласты земной коры. Под действием воды и углекислого газа из воздуха карбонат кальция переходит в водорастворимое состояние — гидрокарбонат кальция:
Аналогичные процессы происходят и с карбонатами магния. В результате этих и других процессов в природной воде появляются ионы кальция и магния.
Вода, содержащая ионы кальция и магния, называется ЖЁСТКОЙ.
Этот термин возник из-за того, что некоторые овощи и плоды под действием такой воды становятся жёсткими: ионы кальция и магния вступают в реакцию с органическими компонентами плодов и овощей.
Чаще всего жёсткая вода приносит неприятности: долго развариваются продукты, плохо моет мыло (см. урок 24.4), на стенках котлов и труб появляется слой накипи, что может привести к авариям:
Накипь, конечно, можно растворить при помощи соляной кислоты:
Задание 9.10. Можно ли растворить накипь при помощи серной, азотной, фосфорной кислот? Ответ подтвердите ионно-молекулярными уравнениями реакций.
Но лучше всего в случаях, когда жёсткость воды повышена, а это нежелательно, умягчать воду. Для этого ионы кальция и магния нужно перевести в нерастворимое состояние.
Вопрос. Умягчается ли вода при кипячении?
Частично вода умягчается при кипячении, так как при этом растворимые гидрокарбонаты переходят в нерастворимые карбонаты. Но некоторые соли кальция и магния (сульфаты, хлориды) при нагревании не изменяются. В этом случае в воду добавляют вещества, образующие с ионами кальция и магния осадки.
Задание 9.11. Какие из солей: кальцинированная сода, фосфат натрия, поваренная соль — устраняют жёсткость воды? Ответ подтвердить ионными уравнениями реакций, считая, что в состав воды входит сульфат кальция.
Чаще всего для умягчения воды используют кальцинированную соду Na2CO3:
Кальцинированная сода входит в состав стиральных порошков, которые также содержат и фосфаты. Эти вещества «автоматически» смягчают воду при стирке.
Выводы
Щелочные металлы — это простые вещества, которые образованы элементами главной подгруппы первой группы. Это очень активные металлы, которые образуют с водой сильные растворимые основания — щёлочи.
Щелочноземельные металлы — это простые вещества, которые образованы некоторыми элементами главной подгруппы второй группы Ca, Sr, Ba. Это очень активные металлы, которые образуют с водой щёлочи. Ионы кальция и магния делают воду жёсткой.
Хотите ещё проще? Мы создали новый курс, где максимум за 7 дней вы овладете химией с нуля. Подробннее по ссылке
Учимся определять медь и отличать ее от других металлов и сплавов
Химически чистая медь обладает тремя отличительными характеристиками. Это имеющий цвет, пластичный и стойкий к коррозии металл. Последнее свойство обусловлено формированием тонкой оксидной пленки. Этот слой делает медь химически инертной в неагрессивной среде, а также привносит красный оттенок в ее золотисто-розовый цвет.
Наилучший способ точно идентифицировать медь – спектральный анализ, требует дорогостоящего оборудования – анализатора металлов, тогда как отличить медь в домашних условиях – задача с ограниченным набором средств. Тут лучшими приборами выступают органы чувств, легкодоступные химикаты, огонь и подручные приспособления.
Визуальное восприятие – наиболее простой, но не всегда достаточно точный метод. Впрочем, в большинстве случаев он работает и отличить лом меди от лома другого цветмета не трудно. Действительно, несмотря на название категории цветные металлы, одинаково окрашенными оказываются только:
- медь;
- золото;
- цезий;
- осмий.
Остальные металлы характеризуются серой тональностью и отличаются преимущественно по интенсивности блеска. Поэтому цвет – отличное «средство идентификации», в таких вопросах как отличить медь от алюминия, цинка или никеля.
Чистая медь с характерным медным цветом
Естественный окрас чистого элемента Cu – красно-розовый. Смотреть на металл рекомендуется при естественном свете. Искусственное освещение, за исключением светодиодных ламп теплых цветовых температур, меняет оттенок в сторону желто-зеленого тона.
Второе правило визуальной идентификации меди – требуется устранить поверхностную оксидную пленку. Окисление создает на поверхности металла зеленовато голубой налет. Поэтому определять на цвет, что у вас медь, желательно по свежему спилу или обработав материал напильником. Намного сложнее обстоит ситуация с медными сплавами: латунью и бронзой. Также визуально трудно различить Cu и омедненный алюминий.
к содержанию ↑Как отличить медь от латуни и бронзы
Первый металл представляет сплав Cu-Zn. Содержание цинка варьируется в интервале 4 – 45%. Когда сплав характеризуется высоким добавлением основной примеси, отличить его от чистого металла несложно по цвету. Окрас меди розово-красный, латуни – светлее, но у лома латуни может быть загрязненным поверхность. Чем больше цинка в сплаве, тем сильнее его цвет смещается от красного к желтому оттенку. Поэтому визуальное восприятие неприемлемо для высокомедных латуней, где вхождения примесей на уровне 10%. В этом случае остается 3 варианта как отличить медь от латуни без использования инструмента:
- По звуку. Тут желательно иметь музыкальный слух. При ударе о металл, мягкая медь звучит приглушенно, тогда как латунь – звонко. Метод хорошо работает для массивных, габаритных изделий – труб, например.
- По сгибу. Пластичность меди, позволяет легко сгибать металл. Более твердая латунь не настолько податлива.
- На вес. Плотность Cu9 г/куб.см выше чем у Zn (7.1). Результирующая величина характеристики у латуни, в среднем 8.6 г/куб.см. Разница невысокая, но при наличии точных весов, отличить металлы возможно.
Визуальное отличие меди от бронзы и латуни
Хорошим идентификатором меди, относительно латуни выступает стружка. У чистого металла она спиралеобразная. Напротив стружка латуни прямая, игольчатой формы.
Более сложный подход связан с использованием химикатов, а именно соляной кислоты. Химически инертная медь не реагирует в растворе, тогда как при погружении латуни на поверхности металла образуется белый налет. Это хлорид цинка, результат реакции этого металла на кислоту.
Стружка меди
Видео – медь и латунь:
к содержанию ↑Как
Chem4Kids.com: Элементы и периодическая таблица: Щелочные металлы
Перейдем к левой части таблицы Менделеева. При поиске семейств в первую очередь вы найдете семейство элементов из щелочных металлов. Они также известны как щелочных металлов . Вы должны помнить, что во второй группе есть отдельная группа, называемая щелочноземельными металлами. Это совсем другая семья, хотя у них похожее имя. Крайний левый столбец — это Группа 1 (Группа I).Когда мы говорим о группах таблицы Менделеева, ученые используют римские цифры при их написании. «Единица» в этом случае относится к наличию одного электрона на самой внешней орбитали.
Кто в семье? Начиная сверху, мы находим водород (H). Но ждать. Этого элемента нет в семье. Когда мы рассказывали вам о семьях, мы говорили, что это группы элементов, которые реагируют одинаково. Водород — это особый элемент периодической таблицы, не принадлежащий ни к какой семье.Хотя водород входит в группу I, он НЕ является щелочным металлом.
Теперь, когда мы рассмотрели это исключение, членами семейства являются: литий (Li), натрий (Na), калий (K), рубидий (Rb), цезий (Cs) и франций (Fr). Как и во всех семьях, эти элементы имеют общие черты. Они очень реактивные . Зачем? Все они имеют по одному электрону на внешней оболочке. Это один электрон от счастья (полная оболочка). Когда вы так близки к полной оболочке, вы хотите соединиться с другими элементами и потерять этот электрон.Повышенное желание привязаться означает, что вы более активны. Фактически, когда вы помещаете некоторые из этих чистых элементов в воду (H 2 O), они могут вызвать огромные взрывы.
Щелочные металлы также являются металлами. Это очевидно из названия. Часто в химии характеристики присваиваются по внешнему виду элементов. Вы обнаружите, что щелочная группа блестящая и легкая. Их легкий вес и физические свойства отличают их от других металлов. Они пластичные, (гибкие) и иногда достаточно мягкие, чтобы их можно было разрезать тупым ножом.Щелочные металлы — это не тот металл, который вы бы использовали для изготовления монет или домов.
Нация инноваций: крошечные батарейки (видео США-NSF)
Медно-никелевые сплавы — Сплавы с медью и никелем
Химическая формула
Сплавы Cu / Ni
Рассматриваемые темы
- Предпосылки
- Ключевые свойства
- Области применения
- Конденсаторные системы морской воды и опреснительные установки
- Автомобильные приложения
- Морские применения
- Монеты
- Сопротивление Проволока
- Термопары
- Другие области применения
Предпосылки
Иногда называемые медно-никелевыми сплавами, существует ряд различных медно-никелевых сплавов, которые обладают разными свойствами и, следовательно, подходят для множества различных применений.Некоторые из наиболее известных медно-никелевых сплавов включают:
- Медь с 10% никеля
- Медь с 30% никеля
- Медь с 25% никеля и 0,05-0,4% марганца
- Медь с 45% никеля (также известная как константан )
Все медно-никелевые сплавы состоят только из одной фазы, поскольку двойная система медно-никелевый сплав проявляет полную растворимость в твердом состоянии.
Ключевые свойства
Свойства медно-никелевых сплавов меняются в зависимости от состава, однако некоторые свойства медно-никелевых сплавов описаны ниже.
Медно-никелевый сплав Медь 90/10 и медь 70/30
- Превосходная устойчивость к коррозии, особенно в морской воде
- 70/30 более прочная и обладает превосходной стойкостью к ударной коррозии
- Хорошая устойчивость к биообрастанию, с 90 / 10 немного превосходит сплав 70/30
Сплавы с высоким содержанием меди:
- Пластичный
- Можно упрочнять только холодной обработкой
- Хорошая коррозионная стойкость
- Хорошая прочность
- Низкотемпературный коэффициент электрического сопротивления
Содержание никеля в этих медно-никелевых сплавах также позволяет им сохранять свою прочность при повышенных температурах по сравнению с медными сплавами без никеля.
Области применения медно-никелевых сплавов
Медно-никелевые сплавыКонденсаторные системы морской воды и опреснительные установки
Из-за хорошей устойчивости к коррозии в морской воде медно-никелевый сплав Медь 90/10 и медно-никелевый сплав Медь 70/30 используются для системы конденсаторов морской воды и опреснительных установок, а также трубопроводы на химических предприятиях.
Автомобильные приложения
Из-за того, что медно-никелевый сплав Медь 90/10 не требует защиты поверхности и, следовательно, обеспечивает дополнительную безопасность, этот медно-никелевый сплав все чаще используется для тормозных и гидравлических систем подвески и систем охлаждения в автомобилях и коммерческих транспортных средств.
Морские применения
Хорошая стойкость к биообрастанию и коррозии в морской воде медно-никелевых сплавов, сплавов меди 90/10 и меди 70/30 привела к его использованию в таких приложениях, как облицовка корпусов судов, опоры масла. буровые платформы и решетки забортной воды.
Монеты
Медно-никелевые сплавы, состоящие из меди с 25% никеля и 0,05-0,4% марганца, обычно используются для изготовления монет, медалей и других полуценных изделий.
Проволока сопротивленияПроволока сопротивления
Проволока сопротивленияИз-за очень низкого температурного коэффициента удельного электрического сопротивления медно-никелевые сплавы, состоящие из меди с 45% никелевого сплава, используются для изготовления резистивных проводов в прецизионных резисторах. Это свойство медно-никелевых сплавов позволяет резистору работать с почти одинаковым сопротивлением независимо от температуры.
Термопары
ТермопарыМедно-никелевые сплавы, состоящие из сплава меди с 45% никеля, также используются для термопар, поскольку они создают высокую и однородную ЭДС при взаимодействии с другими металлами, такими как медь и железо.
Другие области применения
Медно-никелевые сплавы также используются в охлаждающих контурах, боеприпасах, коррозионно-стойких узлах в морской воде, трубках конденсаторов.
Таблица свойств медно-никелевых сплавов
Материал: медные сплавы — медно-никелевые сплавы
| Свойство | Минимальное значение (SI) | Максимальное значение (SI) | Единицы (SI) | Минимальное значение (Imp.) | Максимальное значение (Imp.) | Единицы (имп.) | |||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| Атомный объем (средний) | 0,0071 | 0,0073 | м 3 / кмоль | 433,268 | 445,473 | 445,473 | Плотность | 8,5 | 8,95 | Мг / м 3 | 530,638 | 558,731 | фунт / фут 3 | ||
| кг Энергосодержание 140156 | .4 | 19501 | ккал / фунт | ||||||||||||
| Модуль упругости в объеме | 130 | 170 | ГПа | 18,8549 | 24,6564 | 10 | 9015 9015 9015 9015 9015 9015 9015 9015 9015 9015 Сжатие 9015МПа | 12,3282 | 79.7708 | тысяч фунтов / кв. Дюйм | |||||
| Пластичность | 0,03 | 0,44 | 0,03 | 0,44 | 9015 9015 9015 9015 9015 9015 9015 9015 | 9015 | 9015 .3282 | 79.7708 | тысяч фунтов на квадратный дюйм | ||||||
| Предел выносливости | 138 | 240 | МПа | 20.0152 | 34.809 | килограмм | 9015 9015 9015 9015 | / 2 | 23,6612 | 71,8937 | тысяч фунтов / кв. Дюйм 1/2 | ||||
| Твердость | 580 | 1650 | МПа | 84.1219 | 312 | тысяч фунтов / кв. Дюйм | |||||||||
| Коэффициент потерь | 1,5e-005 | 0,00056 | 1,5e-005 | 0,00056 | MP6 модуля упругости 6 R 12.3282 | 79.7708 | тысяч фунтов / кв.дюйм | ||||||||
| Коэффициент Пуассона | 0,34 | 0,35 | 0,34 | 0,35 | 9015 9015 9015 9015 9015 9015 5 9015 9015 9015 65267 | 8,41219 | 10 6 фунт / кв. Дюйм | ||||||||
| Предел прочности на разрыв | 267 | 624 | МПа | 38.7251 | МПа | 38.7251 | 90.5036 | GP10 | 17.4045 | 22.6259 | 10 6 фунт / кв. Дюйм | ||||
| Температура стекла | K | ° F | 9015 9015 9015 9015 | кДж / кг | 94.5825 | 103,181 | БТЕ / фунт | ||||||||
| Максимальная рабочая температура | 425 | 480 | K | 305,33 | 404,33 | ° F | |||||||||
| 2031,53 | 2254,73 | ° F | |||||||||||||
| Минимальная рабочая температура | 0 | 0 | K | -459,67 | -459,67 | 9015 9015 9015 ТепловойДж / кг.K | 0,297162 | 0,298709 | БТЕ / фунт F | ||||||
| Теплопроводность | 19 | 66 | Вт / м · К | 35,5686 | 123,554 90,15 фут3 90,16 фут3 / фут3 F | ||||||||||
| Температурное расширение | 16 | 17 | 10 -6 / K | 28,8 | 30,6 | 10 -6 / ° F | 9015 9015 Потенциал 9015 МВ / м | В / мил | |||||||
| Диэлектрическая постоянная | |||||||||||||||
| Сопротивление 11 | 90.736,3 | 10 -8 Ом.м | 11,7 | 36,3 | 10 -8 Ом.м |
| Сопротивление окружающей среде | ||||
| 1 = Плохо 5 = Отлично | ||||
| Воспламеняемость | 5 | |||
| Пресная вода | 5 | |||
| Органические растворители | 5 | |||
| 9015 Морское окисление 9015 Вода | 5 | |||
| Сильная кислота | 2 | |||
| Сильная щелочь | 5 | |||
| UV | 5 | |||
| Износ | 9015 | Weak Alkalis | 5 |
Для получения дополнительной информации об этом источнике посетите Институт материалов. Также известный как медно-никель, он имеет состав от 10% до 45% никеля. Благодаря большому ассортименту сплавов они обладают множеством различных свойств и областей применения. Основные типы сплавов и типичные области применения, такие как конденсаторы, автомобилестроение, судостроение и т. Д.
Toprak Alkali Metaller (2A grubu)
Elementlerin hepsi periyodik tabloda sıralanmıştır.Бу sıralama temel alınan fark ise atom numarası yani proton sayısıdır. Elementler атом çekirdeğindeki proton sayılarına göre periyodik tabloya dizilirler. Periyodik tablodaki düşey sütunlara grup , yatak sütunlara ise periyot denir.
Periyodik tablonun 2A grubunda bulunan elementlere toprak щелочной металл denir.
Periyodik tablonun en solunda 1A grubu bulunur. 1A grubundaki metallere ise щелочной металл denir. Toprak щелочной металл, щелочной металл в hemen sağındadır.
Toprak Щелочной металлоискатель elektriği iletir mi ?
Metalik özelliği güçlü olan toprak щелочной металл elektriği iyi iletir.
Toprak производитель щелочных металлов şunlardır:
- Берилюм (Be)
- Магнезюм (Мг)
- Калсиюм (Калифорния)
- Стронсия (Sr)
- Бариум (Ba)
- Радюм (Ра)
Toprak щелочного металла için kodlama olarak «Benim mağrur canım sırf baklava ile rahatlar» ifadesi kullanılabilir.
Toprak Alkali Metallerin Özellikleri
Toprak щелочные металлы özellikleri şöyle sıralanabilir:
- Periyodik cetvelde 2A grubunda bulunurlar.
- Değerlik elektron sayıları 2’dir.
- Bileşiklerinde +2 değerlik alırlar.
- Parlak ve gümüş — beyaz renktedirler.
- Erime ve kaynama noktaları düşüktür.
- Oda koşullarında katı halde bulunurlar.
- Щелочной металлоискатель kadar olmasalar da reaktiftirler.
- Düşük yoğunluğa sahiptirler.
Toprak Alkali Metaller Doğada Nasıl Bulunur?
2A grubunda bulunan toprak щелочные металлы tamamına doğada rastlanır.
Zümrüt, doğal olarak oluşan bir berilyum bileşiğidir. Kalsiyum ve magnezyum, yer kabuğunda bol miktarda bulunur ve kalsit (kireçtaşı) gibi önemli kayaçların yapısına katılır.
Diğer toprak производитель щелочных металлов doğada daha az bulunmaktadır. Радюм doğada аз булунан техликели ве радиоактиф бир элементтир.İnsan sağlığını bozacak ışınlar yayar. 1601 yıllık yarılanma ömrü olan radyum, ancak daha ağır elementlerin radyoaktif bozunumundan kaynaklanan bir çürüme zinciri doğada mevcut hale gelir.
Kalsiyum ve magnezyum gibi elementler insan vücudunda bulunur. Özellikle kalsiyum kemik sağlığımız açısından önemlidir.
Toprak Alkali Metallerin Kullanım Alanları
Топрак щелочной металл, берилюм, магнезюм, кальсиюм, стронсиюм, барюм ве радюмдан олушур. Бу elementlerin çeşitli kullanım alanları üzerinde kısaca duralım.
Berilyum : Berilyum, mukavemet, dayanıklılık ve sıcaklık stableitesi gerektiren metal alaşımlarının imalatında kullanılır. Yanıcı çözücülerin kullanıldığı endüstrilerde, bakır-berilyum araçları kıvılcımı önler.
Magnezyum : Magnezyum güçlü ve hafif bir metaldir ve genellikle uçak parçaları üretmek için alüminyum ve çinko ile karıştırılır. Diğer metaller ile karıştırıldığında, metal, otomobil motorları üretmek için sıcaklığa dayanıklı hale gelir.Sağlığımız açısından önemli bir elementtir.
Kalsiyum : Cam ve kağıt endüstrileri için hızlı ve sönmüş kireç yapımını içeren çok sayıda endüstriyel kullanıma sahiptir. Gıda, ilaç ve kozmetik endüstrileri diş macunu, витамин ürünlerinde kalsiyum kullanır.
Stronsiyum : Yakıldığında parlak kırmızı bir renk üretir, bu da havai fişek ve işaret fişeklerinin yapısına katmak için idealdir. Aynı zamanda cam katkı maddesi olarak da kullanılır.
Baryum : Kükürt ile birleştirilerek baryum sülfat elde edilir, sondaj işlemlerinde yalama çamuru olarak kullanılır ve mide ağrılarını ve bağırsak problemlerçarakin alıvışı.
Radyum radyoaktif olduğu için normal koşullarda kullanım alanı yoktur. Laboratuvar koşullarında deney ve radyoaktif amaçlarla kullanılabilir.
Toprak Alkali Metallerin Bazı Kimyasal Özellikleri
Tüm toprak щелочной металл, en dış kabuğunda iki elektrona sahiptir. Яни değerlik elektron sayısı 2’dir. Bu nedenle bileşiklerinde +2 yüklü katyonlar oluşturarak 2 elektron verirler. Kimyasal özelliklerin çoğu sadece grubun ilk beş üyesi için gözlemlenmiştir. Çünkü radyum radyoaktivitesi nedeniyle fazla günlük hayatta reaksiyonda yer almaz.
Kimyasal olarak, tüm производитель щелочных металлов halojenürler oluşturmak için halojenlerle reaksiyona girer. Berilyum hariç tüm 2A grubu metalleri de büyük bir dikkatle ele alınması gereken güçlü alkali hidroksitler oluşturmak için су иле reaksiyona girer. Даха агыр toprak metalleri, даха хафиф оланлара гёре даха güçlü тепкиме верир. Çünkü metalik özellik periyodik cetvelde aşağı doğru artar.
Toprak щелочной металл, periyodik cetvelde kendi bulundukları periyotların ikinci en düşük birinci iyonlaşma enerjilerine sahiptir.Çünkü 2A grubunda olan bu metallerin solunda daha aktif olan щелочной металл grubu bulunmaktadır. Tüm щелочных металлов ikinci iyonlaşma enerjisi de biraz düşüktür.
Berilyum elementi diğerlerine göre daha az metalik özellik gösterir. Ametallerle arasındaki fark diğerleri kadar yüksek değildir.
MgCO 3 , MgSO 4 , CaCO 3 , CaO, Ca (OH) 2 , SrCl 2 , BaSO 4 , gibi bileşikler en yaygın toprak bileşikleridir щелочного металла.
Этикетлер:
Щелочные металлы (группа 1)
21.3 Щелочные металлы (группа 1)
Цели обучения
- Чтобы описать, как выделяются щелочные металлы.
- Для ознакомления с реакциями, соединениями и комплексами щелочных металлов.
Щелочные металлы настолько реактивны, что никогда не встречаются в природе в элементарной форме.Хотя некоторые из их руд богаты, изолировать их от руд довольно сложно. По этим причинам элементы группы 1 были неизвестны до начала 19 века, когда сэр Хэмфри Дэви впервые получил натрий (Na) и калий (K), пропуская электрический ток через расплавленные щелочи. (Зола, образующаяся при сжигании древесины, в основном состоит из карбоната калия и натрия.) Литий (Li) был открыт 10 лет спустя, когда шведский химик Йохан Арфведсон изучал состав нового бразильского минерала.Цезий (Cs) и рубидий (Rb) не были открыты до 1860-х годов, когда Роберт Бунзен провел систематический поиск новых элементов. Известный студентам-химикам как изобретатель горелки Бунзена, спектроскопические исследования руд Бунзена показали голубые и темно-красные линии излучения, которые он приписал двум новым элементам, Cs и Rb, соответственно. Франций (Fr) содержится в природе только в следовых количествах, поэтому наши знания о его химии ограничены. Все изотопы Fr имеют очень короткие периоды полураспада, в отличие от других элементов в группе 1.
Сэр Хэмфри Дэви (1778–1829)
Дэви родился в Пензансе, Корнуолл, Англия. В лаборатории он был немного диким, часто нюхал и пробовал на вкус продукты своих экспериментов, что почти наверняка укорачило ему жизнь. Он обнаружил физиологические эффекты, которые заставляют закись азота называть «веселящий газ» (и стал зависимым от него!), И он почти потерял зрение в результате взрыва трихлорида азота (NCl 3 ), который он первым применил. подготовить.Дэви был одним из первых, кто осознал полезность «электрических свай» (батарей) Алессандро Вольта. Последовательно соединив несколько «стопок» и вставив электроды в расплавленные соли щелочных и щелочноземельных металлов, он смог выделить шесть ранее неизвестных элементов как чистые металлы: натрий, калий, кальций, стронций, барий и магний. Он также открыл бор и первым получил фосфин (PH 3 ) и теллурид водорода (H 2 Te), оба из которых очень токсичны.
Роберт Вильгельм Бунзен (1811–18
Недвижимость Что можно предсказать из Периодической таблицы
A. Атомный радиус
На рис. 5.14 показаны относительные размеры атомов типичных элементов. Обратите внимание, что размер атома увеличивается сверху вниз в столбце и справа налево по строке. Эта тенденция связана с электронной конфигурацией. Когда мы смотрим на элементы в столбце 1, например, мы видим, что одиночный валентный электрон для каждого последующего элемента находится на более высоком основном энергетическом уровне, чем последний, и, таким образом, электрон находится дальше от положительно заряженного ядра; следовательно
радиус атома
увеличивается сверху вниз.Такое же регулярное увеличение размера можно наблюдать в каждом столбце периодической таблицы.
Атомы уменьшаются в размерах слева направо. Для элементов в пределах периода электроны добавляются один за другим к одному и тому же основному уровню энергии. В то же время протоны также добавляются один за другим к ядру, увеличивая его положительный заряд. Этот увеличивающийся положительный заряд увеличивает притяжение ядра для всех электронов и притягивает их все ближе к ядру, уменьшая радиус атома.Таким образом, атомный размер — это периодическое свойство, которое увеличивается сверху вниз в столбце и справа налево по периоду.
| РИСУНОК 5.14 Относительные размеры атомов типичных элементов. |
B. Энергия ионизации
Энергия ионизации элемента — это минимальная энергия, необходимая для удаления электрона из газообразного атома этого элемента, оставляя положительный ион.Уравнение, выражающее ионизацию натрия, будет:
Электроны удерживаются в атоме силой притяжения положительно заряженного ядра. Чем дальше от ядра находятся самые удаленные электроны, тем менее прочно они удерживаются. Таким образом, энергия ионизации в группе элементов уменьшается по мере увеличения атомного номера элементов. Среди атомов встречающихся в природе щелочных металлов одиночный валентный электрон цезия наиболее удален от ядра (на шестом основном энергетическом уровне), и мы можем правильно предсказать, что энергия ионизации цезия является самой низкой из всех щелочных металлов.(Напомним, что франций не встречается в природе.)
Слева направо в течение периода энергия ионизации элементов имеет тенденцию к увеличению. Число протонов в ядре (заряд ядра) увеличивается, но валентные электроны элементов находятся на одном уровне энергии. Удалить электрон из атома становится все труднее. Энергия ионизации хлора намного больше, чем у натрия, элемента в тот же период.
Энергии ионизации элементов с 1 по 36 показаны в зависимости от их атомных номеров на рис. 5.15. Пики на графике — это высокие энергии ионизации благородных газов. Высота пиков уменьшается по мере увеличения номера самого высокого занятого уровня энергии. Нижние точки на графике — это энергии ионизации щелочных металлов, у которых есть только один электрон в валентной оболочке. Эти точки также немного уменьшаются по мере увеличения номера самого высокого занятого уровня энергии.График показывает, что энергия ионизации периодически связана с атомным номером. Даже внутри ряда периодической таблицы изменения энергии ионизации тесно связаны с электронной конфигурацией.
Энергия ионизации элемента является мерой его металлической природы. Из рисунка 5.15 мы видим, что каждый щелочной металл имеет самую низкую энергию ионизации среди элементов за свой период. Следовательно, щелочные металлы — самые металлические элементы. Снизу вверх в периодической таблице и слева направо по ней металлическая природа элементов уменьшается.
| РИСУНОК 5.15 Энергия ионизации элементов с 1 по 36 в зависимости от их атомных номеров. |
Неметаллы, расположенные в правом верхнем углу таблицы Менделеева, имеют высокий
энергии ионизации. За исключением благородных газов, фтор обладает наибольшей ионизацией.
энергия. Следовательно, за исключением благородных газов, фтор наименее металлический.
(или самый неметаллический) элемент.Сверху вниз по столбцу или слева
фтора элементы становятся более металлическими. Таким образом, энергия ионизации увеличивается.
снизу вверх по столбцу и слева направо через период.
Сродство к электрону тесно связано, но противоположно энергии ионизации. Сродство к электрону — это изменение энергии, которое происходит, когда электрон присоединяется к нейтральному атому. Для неметалла это изменение обычно является высвобождением энергии.Уравнение, показывающее эту реакцию для хлора:
Сродство к электрону измерить довольно сложно. Точные значения были определены только для нескольких элементов. В целом значения становятся все более отрицательными слева направо в течение периода. Следовательно, галоген будет иметь самое отрицательное сродство к электрону из всех типичных элементов в его период (помните, что благородные газы не являются типичными элементами).Сродство к электрону не меняется с той же регулярностью, что и радиус атома или энергия ионизации, и относительные значения не могут быть так легко предсказаны.
На рис. 5.16 показано, как меняются атомные радиусы, энергии ионизации и свойства металлов в периодической таблице.
| РИСУНОК 5.16 Тенденции различных атомных свойств в зависимости от положения в периодической таблице. |
С.Образование ионов
Атомы электрически нейтральны. Число положительно заряженных протонов в ядре атома равно количеству отрицательно заряженных электронов вне ядра. Если электроны добавляются или теряются в результате реакции атома, атом приобретает заряд и становится ион.
1. Правило октетов
Мы уже заметили, что благородные газы очень инертны. (Раздел 5.6А). Это отсутствие реакционной способности объясняется стабильной электронной конфигурацией. Возвращаясь к Разделу 5.5C (Таблица 5.3), вы можете видеть, что все благородные газы, кроме гелия, имеют восемь электронов (два s и шесть p) на самом высоком занятом уровне энергии. Когда атомы других репрезентативных элементов вступают в реакцию, они теряют, приобретают или совместно используют достаточно электронов, чтобы получить электронную структуру благородного газа — полный октет, восемь электронов, в своей внешней оболочке. Эта тенденция выражается в Правило октета: Обычно атом реагирует способами, которые дают ему октет электронов во внешней оболочке.Исключение составляют водород и литий; они реагируют способами, которые дают им ту же электронную конфигурацию, что и гелий, с двумя электронами внешней оболочки.
Атом с одним, двумя или тремя валентными электронами обычно реагирует потерей этих электронов и приобретает электронную конфигурацию благородного газа, следующего за ним по атомному номеру. Атом с шестью или семью валентными электронами обычно реагирует, добавляя достаточно электронов, чтобы приобрести электронную конфигурацию благородного газа, следующего за ним по атомному номеру.Другие атомы могут получить полный октет, деля электроны с соседним атомом (обсуждается в Раздел 7.1.)
2. Положительные ионы или катионы
Когда нейтральный атом теряет электрон, он образует положительно заряженный ион, называемый катионом (произносится как «cát-i-on»). Обычно металлы теряют электроны с образованием катионов. Таким образом, атом достигает электронной конфигурации благородного газа, следующего за ним по порядковому номеру.
Например, щелочной металл теряет один электрон, образуя катион с единственным положительным зарядом.Натрий теряет свой единственный 3s валентный электрон с образованием иона Na + , который имеет электронную конфигурацию неона:
Щелочноземельный металл теряет два электрона, образуя катион с зарядом +2. При образовании иона магния Mg 2+ атом магния теряет два своих валентных электрона:
Алюминий теряет свои три валентных электрона с образованием катиона с зарядом +3:
Названия этих катионов такие же, как у металлов, из которых они образованы (см. Таблицу 5.7).
|
|
| ||||||||||||||||||||||||||||||
Переходные элементы и металлы справа от них не всегда подчиняются правилу октетов; часто они образуют более одного катиона.Например, железо образует Fe 2+ и Fe 3+ ; кобальт образует Co 2+ и Co 3+ . Названия этих ионов должны указывать заряд, который они несут. Предпочтительная система номенклатуры (наименования) рекомендована Международным союзом теоретической и прикладной химии (IUPAC). В этой системе за названием металла следует римская цифра (в скобках), показывающая заряд иона. Между именем и номером не остается лишнего пробела. Таким образом, Fe 2+ — это железо (II) (произносится как «железо два»), а Fe 3+ — это железо (III).В более старой системе имя катиона с более низким зарядом оканчивается на ous , а имя катиона с более высоким зарядом заканчивается на ic . Примеры обеих систем именования приведены в таблице 5.8.
| Символ | Название ИЮПАК | Старое название |
|---|---|---|
| Со 2+ | кобальт (II) | кобальтовый |
| Со 3+ | кобальт (III) | кобальтовый |
| Cu + | медь (I) | медь |
| Cu 2+ | медь (II) | медь |
| Cr 2+ | хром (II) | хром |
| Cr 3+ | хром (III) | хром |
| Fe 2+ | железо (II) | черный |
| Fe 3+ | железо (III) | железо |
Обратите внимание, что ни один из обсуждаемых здесь катионов не имеет заряда больше +3.Когда образуются ионы, электроны один за другим отрываются от атома. Таким образом, первый электрон удаляется из нейтрального атома, второй электрон — из иона с зарядом +1, третий электрон — из иона с зарядом +2 и так далее. Количество энергии, необходимое для удаления электрона, резко возрастает по мере увеличения положительного заряда иона. Убрать четвертый электрон и образовать ион с зарядом +4 энергетически маловероятно.
3. Отрицательные ионы или анионы
Когда нейтральный атом получает электрон, он образует отрицательно заряженный ион, называемый анионом.
(произносится как «ан-и-он»).Обычно неметаллы образуют анионы, приобретая достаточно электронов, чтобы приобрести электронную конфигурацию благородного газа со следующим более высоким атомным номером. Элементы группы 6 с шестью валентными электронами образуют анионы, приобретая два электрона; галогены с семью валентными электронами образуют анионы, приобретая один электрон. Имена этих анионов включают корневое имя элемента и окончание ide . В таблице 5.9 перечислены несколько распространенных анионов и их названия; в каждом случае корень имени выделяется курсивом.
| Символ | Имя | Символ | Имя | |
|---|---|---|---|---|
| ф — | фтор иде-ион | О 2- | ox ид-ион | |
| Класс — | хлор иде-ион | С 2- | сульф ид-ион | |
| Br — | бром иде-ион | |||
| I — | йод ион ид | |||
4.Многоатомные ионы
Ионы, описанные в предыдущих параграфах, являются одноатомными ионами; то есть каждый содержит только один атом. Также известны многие многоатомные ионы.
Многоатомные ионы — это группы связанных вместе атомов, которые несут заряд из-за избытка или недостатка электронов. В Таблице 5.10 перечислены формулы и названия нескольких общих многоатомных ионов. Символы в формуле показывают, какие элементы присутствуют. Нижние индексы (понимается «1») говорят, сколько атомов каждого элемента присутствует в ионе.
D. Металлы и неметаллы;
Кислоты и основания
До сих пор мы показали, что металлы обычно имеют один, два или три валентных электрона. Они имеют низкую энергию ионизации и находятся слева в периодической таблице. Неметаллы имеют четыре, пять, шесть или семь валентных электронов, имеют высокую энергию ионизации и находятся в верхнем правом углу периодической таблицы. Все эти свойства тесно связаны с электронными конфигурациями, и мы использовали электронные конфигурации при их обсуждении.Однако до того, как были известны электронные конфигурации, люди знали о различиях между металлами и неметаллами.
Ранние химики наблюдали, как физические свойства металла (ковкость, блеск и проводимость), описанные в разделе 3.3, в отличие от неметаллов. Эти химики также выявили различия в химических свойствах. Соединения, образующиеся при взаимодействии оксидов металлов с водой, очень похожи. и сильно отличается от тех, которые образуются при реакции оксидов неметаллов с водой.
Когда оксид металла реагирует с водой, образуется гидроксид:
| Оксид металла | Уравнение | Гидроксид |
|---|---|---|
| оксид натрия | Na 2 O + H 2 O 2 NaOH | натрия гидроксид |
| оксид магния | MgO + H 2 O Мг (ОН) 2 | гидроксид магния |
| оксид алюминия | Al 2 O 3 + 3 H 2 O 2 Al (OH) 3 | гидроксид алюминия |
Когда неметаллический оксид реагирует с водой, образуется кислота:
| Оксид неметалла | Уравнение | Кислота |
|---|---|---|
| диоксид углерода | CO 2 + H 2 O H 2 CO 3 | угольная кислота |
| триоксид серы | SO 3 + H 2 O H 2 SO 4 | серная кислота |
| оксид фосфора | P 4 O 10 + 6 H 2 O 4H 3 PO 4 | фосфорная кислота |
Таблица 5.11 перечислено несколько распространенных гидроксидов и кислот.
| Гидроксиды общие | Кислоты обыкновенные | |||
|---|---|---|---|---|
| натрия гидроксид | NaOH | соляная кислота | HCl | |
| гидроксид калия | КОН | уксусная кислота | HC 2 H 3 O 2 | |
| гидроксид кальция | Са (ОН) 2 | азотная кислота | HNO 3 | |
| гидроксид алюминия | Al (OH) 3 | серная кислота | H 2 SO 4 | |
| гидроксид аммония | NH 4 OH | угольная кислота | H 2 CO 3 | |
| фосфорная кислота | H 3 PO 4 | |||
Гидроксиды — это подмножество более крупной группы, называемой основания, хотя не все основания являются гидроксидами.Во всех, кроме гидроксида аммония, катион гидроксида представляет собой ион металла. Гидроксид растворяется в воде с образованием иона гидроксида. Раствор гидроксида кажется скользким из-за воздействия этих ионов на кожу. (Вы могли заметить это свойство у бытового аммиака, разбавленного раствора гидроксида аммония). Раствор гидроксида дает класс соединений, называемых индикаторы характерные цвета (см. таблицу 5.12).
| Кислоты | Гидроксиды | |
|---|---|---|
| В водных растворах | выпуск H + | выпуск ОН — |
| Показатели | ||
| красный | синий |
фенолфталеин | бесцветный | красный |
метиловый апельсин | красный | желтый |
Наиболее распространенные кислоты содержат водород, неметалл,
и часто кислород.Кислоты растворяются в воде с образованием ионов водорода. Индикаторы
в кислотных растворах показывают другой цвет, чем в растворах гидроксидов.
Зачем делать антенны из меди, а не из алюминия или нержавеющей стали
Все мои антенны J-Pole и Slim Jim изготовлены из жестких медных труб типа M. Type-M, также известный как Red Copper, в основном используется в сантехнической промышленности для подачи питьевой воды в дома и на предприятиях. Хотя стоимость меди постоянно растет, строительная отрасль переходит на другие материалы для сантехники.Но подобно тому, как медные трубки переносят воду в дома, они также могут переносить электроны в наших антеннах.
Одна вещь, которая делает медь отличным выбором для антенн, заключается в том, что она является очень эффективным проводником электрической энергии. Фактически, единственный распространенный элемент, более проводящий, чем медь, — это серебро. Вы можете себе представить, сколько будет стоить антенна, сделанная из серебра.
С сайта EuroCopper.org:
Вес на вес, за исключением драгоценных металлов, медь является лучшим проводником электричества и тепла, поэтому неудивительно, что около 60% от общего объема меди используется для этих целей.
Медь используется в электрических сетях высокого, среднего и низкого напряжения, а проводимость меди считается стандартом, с которым сравниваются другие проводники.Алюминиевые кабели заменяются медными, поскольку проводимость меди в два раза выше, чем у алюминия, что делает медные кабели чрезвычайно энергоэффективными, что помогает снизить потребление энергии во всем мире.
Медная проволока уже давно является предпочтительным проводящим материалом для большинства кабелей, используемых для силовых и телекоммуникационных сетей.Обладая высокой проводимостью в сочетании с пластичностью, которая упрощает вытяжку до диаметров с жесткими допусками, его также можно легко паять для создания экономичных и прочных соединений.
| Металл | Электропроводность |
| Серебристый | 106 |
| Медь (чистая) | 100 |
| Медь (твердая) | 89,5 |
| Алюминий | 45 |
| Сталь | 3-15 |
Таблица электропроводности металлов.
Поскольку медь в два раза электропроводнее алюминия и в 6 раз больше, чем сталь, она является отличным выбором в качестве материала для антенн. Повышенный электрический КПД означает, что большая часть вашей радиочастотной энергии будет подниматься и выходить из антенны, а не задерживаться, создавая тепловую энергию. Более эффективное излучение также означает, что вы можете работать с более высокой мощностью с медной антенной, чем с другими строительными материалами. Мои J-полюсы без проблем прошли испытания на мощность 500 Вт, и нет причин, по которым они не смогли бы выйти на полный законный предел мощности, если это потребуется.
Медь не является идеальным строительным материалом для антенны, у нее есть несколько недостатков. Один из них — стоимость. Медь стала почти полудрагоценным металлом, и ее стоимость продолжает расти. По мере улучшения ситуации на рынке жилья цена на медь снова может значительно повыситься.
Медь — лучший материал для базовых антенн. Металл мягкий и податливый, но довольно жесткий.

 ) = 3Cu(NO3)2 + 2NO2↑ + 4H2O
) = 3Cu(NO3)2 + 2NO2↑ + 4H2O ) = Cu(NO3)2 + 2NO2↑ + 2H2O
) = Cu(NO3)2 + 2NO2↑ + 2H2O