виды и способы борьбы / Статьи и обзоры / Элек.ру
«Коррозия» — термин, который известен нам как процесс самопроизвольного разрушения металла.
Ежегодно миллионы тонн металла под воздействием физико-химических и химических реакций, возникающих во время взаимодействия с окружающей средой, «съедаются» коррозией. Развитие саморазрушения может быть как частичным (местная коррозия), так и полным (сплошная коррозия), а все зависит от длительности и интенсивности разрушающего процесса. По типу коррозия подразделяется на химическую и электрохимическую.
Химическая коррозия обусловлена взаимодействием поверхности металлических материалов с коррозионно-активной средой. Данный процесс разрушения металла протекает в жидкостях и газах, которые, в свою очередь, не в состоянии проводить электрический ток. Из этого следует, что химическое саморазрушение подразделяется на газовую коррозию, где разрушение происходит именно под воздействием газов при высоких температурах, и коррозию в жидких неэлектролитах, которые бывают органического (нефть, бензин, керосин, различные спирты и т.
Электрохимическая коррозия подразумевает собой разрушение металла при непосредственном контакте с электролитически проводящей окружающей средой. Для такого вида коррозии всегда требуется наличие электролита, с которым соприкасаются электроды. Также это могут быть два разных металла с разными окислительно-восстановительными свойствами, соприкасающиеся друг с другом и образующие гальваническую пару.
Гальваническая пара это не что иное, как пара проводников, соединенных вместе с целью обеспечения электрического контакта, возможно, изготовленных из разных металлов. Каждый металл имеет свой электродный потенциал. При воздействии электролита один возьмет на себя роль катода, а второй роль анода, и между ними будет происходить коррозионный процесс, по итогам которого катод будет разрушать анод. В качестве электролита вполне сойдет влага из воздуха для приведения в действие электродного потенциала гальванической пары, при этом пары уязвимы в разной степени: одни больше, а другие меньше.
В химии есть определенный порядок металлов, где они выставлены в последовательности, характеризующей их электродный потенциал в растворах электролитов, и называется она — электрохимический ряд напряжений металлов. Эта гальваническая шкала (
Итак, исходя из этой шкалы, мы получаем следующее: когда два металла находятся в непосредственном контакте, то тот, что левее, будет корродировать, а тот что правее, будет более инертно защищенным. Необходимо достигать минимальной разности потенциалов между двумя изделиями:
- разница в 0,1 будет являться допустимо безопасной;
- разница в 0,2 будет являться допустимой при выполнении некоторых условий:
— в сборочной единице специально предусмотрена электрохимическая защита одного изделия за счет коррозии другого.
Также темп коррозии будет находиться в зависимости от площади поверхности открытых металлов. При условиях, если деталь более инертна, чем крепеж, крепеж будет коррозировать более ускоренными темпами. Например, использование оцинкованной метизной продукции для соединения нержавеющих сталей приведет к ускоренному образованию коррозии на метизах и ухудшению их механических свойств.
Защита от электрохимической коррозии; какой металл будет катодом, а какой анодом в гальванической паре; допустимые, недопустимые и ограниченно допустимые контакты металлов — регламентируются ГОСТ 9-005-72 «Электрохимическая коррозия, допустимость контактов металлов».
В Таблице 1 представлены справочные данные некоторых металлов для определения совместимости.
Таблица 1. Справочные данные некоторых металлов для определения совместимостиВ данной таблице можно увидеть, что использование нержавеющей стали и металлических изделий с нанесением цинкового покрытия недопустимо и приведет к образованию коррозии, что уменьшит срок службы изделий.
В случае, если нет возможности исключить образование недопустимой гальванической пары, стоит выполнить дополнительные действия по уменьшению контактной коррозии с помощью следующих способов:
- дополнительная установка неметаллических шайб, вставок или прокладок в местах соединений;
- изолирование соединения от воздействия окружающей среды;
- нанесение дополнительных металлических покрытий, совместимых между собой;
- покраска поверхностей в местах соединений;
- электрическая изоляция металлических изделий.
Данные процедуры стоит проводить, отталкиваясь от технических требований к изделию, от сроков и условий их эксплуатации и от экономической составляющей.
Пренебрежение требованиями к методам защиты от контактной коррозии может привести к поломке, потере работоспособности или разрушению изделий. Не исключено, что это приведет к дополнительным материальным затратам, нанесению морального или физического ущерба.
Источник: ООО «КМ-профиль», опубликовано в журнале «Электротехнический рынок» № 2 (98) 2021
Электрохимическая коррозия и ее причины
Электрохимическая
коррозия является самым распространенным видом коррозии. Она возникает в
случаях контакта металла с электролитически проводящей окружающей
средой.
Она возникает в
случаях контакта металла с электролитически проводящей окружающей
средой.
При данном процессе, восстановление окислительного компонента коррозионной среды проходит в отличительное от ионизации атомов металла время и электродный потенциал влияет на их скорость. Первопричина, по которой возникает электрохимическая коррозия металлов — термодинамическая неустойчивость металла в окружающей его среде. Ржавление обивки днища корабля, трубопровода, металлических конструкций в атмосфере — все это частные случаи электрохимической коррозии.
Для борьбы с электрохимической коррозией нужно знать механизм ее работы и причины возникновения. Протекание механизма коррозии может осуществляться по двум вариантам.
Гомогенный:
• Поверхностный слой металла рассматривается как однородный и гомогенный;
• Причина растворения металла заключается в термодинамической возможности протекания анодного или катодного актов;
• Анодные и катодные участки мигрируют по металлической поверхности;
• На скорость коррозии влияет кинетический фактор;
• Однородная поверхность может быть рассмотрена, как предельный случай, реализация которого возможна и в жидких металлах.
Гетерогенный:
• Из-за различных положений атомов в кристаллической решетке твердые металлы имеют негомогенную поверхность;
Электрохимическая коррозия металлов имеет ряд особенностей: делится на анодный и катодные процессы, кинетически зависящие друг от друга и протекающие одновременно; на некоторых металлических поверхностях коррозия принимает локальных характер; основной металл растворяется на анодах.
Поверхность металла представляет собой множество короткозамкнутых электродов. При контакте с коррозионной средой образуется гальванический элемент, способствующий электрохимическому разрушение.
Существует три основные причины возникновения местного гальванического элемента:
• Неоднородность металлического сплава: наличие микро- и макровключений, микро- и макропор, зерен кристаллов;
• Неоднородность физических условий: облучение, воздействие температуры и внешних токов.

На нашем заводе вы всегда сможете заказать теплообменники, а так же редуктор вертикальный цилиндрический одноступенчатый.
Производимые предприятием теплообменники и емкости:
Продажи трубопроводной арматуры:
- Задвижки
- Фланцы из нержавейки
- Фланцы сталь 20
- Фланцы стальные плоские
Интересные материалы сайта
Коррозия металлов и борьба с ней
Коррозия металлов — это процесс образование гальванических пар. Образование таких паров приводит к неблагоприятному процессу, жертвой которого становится целый ряд металлов.
Под коррозией понимают происходящее на поверхности электрохимическое или химическое разрушение металлического материала. Наиболее часто при коррозии металл окисляется с образованием ионов металла, которые при дальнейших превращениях дают различные продукты коррозии. Коррозия может быть вызвана как химическим, так и электрохимическим процессом.
Наиболее часто при коррозии металл окисляется с образованием ионов металла, которые при дальнейших превращениях дают различные продукты коррозии. Коррозия может быть вызвана как химическим, так и электрохимическим процессом.
Химическая коррозия.
Химическая коррозия — взаимодействие поверхности металла с коррозионно-активной средой, не сопровождающееся возникновением электрохимических процессов на границе фаз. В этом случае взаимодействия окисление металла и восстановление окислительного компонента коррозионной среды протекают в одном акте. Например, образование окалины при взаимодействии материалов на основе железа при высокой температуре с кислородом.
При электрохимической коррозии ионизация атомов металла и восстановление окислительного компонента коррозионной среды протекают не в одном акте и их скорости зависят от электродного потенциала металла (например, ржавление стали в морской воде).
Электрохимическая коррозия.
Электрохимическая коррозия — это разрушение металла под воздействием возникающих в коррозионной среде гальванических элементов называют электрохимической коррозией. При электрохимической коррозии (наиболее частая форма коррозии) всегда требуется наличие электролита (Конденсат, дождевая вода и т. д.) как, например, при ржавлении железа во влажной атмосфере.
При электрохимической коррозии (наиболее частая форма коррозии) всегда требуется наличие электролита (Конденсат, дождевая вода и т. д.) как, например, при ржавлении железа во влажной атмосфере.
Электроды образуют либо различные элементы структуры материала, либо два различных соприкасающихся материала. Если в воде растворены ионы солей, электропроводность ее повышается, и скорость процесса увеличивается.
При соприкосновении двух металлов с различными окислительно-восстановительными потенциалами и погружении их в раствор электролита, образуется гальванический элемент, так называемый, коррозионный элемент. Он представляет собой ни что иное, как замкнутую гальваническую ячейку. В ней происходит медленное растворение металлического материала с отрицательным окислительно-восстановительным потенциалом. Этот вид коррозии особо присущ металлам с высокими отрицательными потенциалами.
Особо подвержены риску места соприкосновения металлов с различными потенциалами, например сварочные швы или заклепки.
Борьба с коррозией.
Решение проблемы, избавление от коррозии является важной задачей, так как коррозия ежегодно приводит к миллиардным убыткам. Основной ущерб, причиняемый коррозией, заключается не в потере металла как такового, а в огромной стоимости изделий, разрушаемых коррозией.
Способы избавления о коррозии.
Идеальная защита от коррозии на 80% обеспечивается правильной подготовкой поверхности, и только на 20 % качеством используемых лакокрасочных материалов и способом их нанесения. Наиболее производительным и эффективным методом подготовки поверхности перед дальнейшей защитой субстрата является абразивоструйная очистка.
Обычно выделяют три направления методов защиты от коррозии:
1. Конструкционный
2. Активный
3. Пассивный
Для предотвращения коррозии в качестве конструкционных материалов применяют нержавеющие стали, кортеновские стали, цветные металлы.
В качестве защиты от коррозии может применяться нанесение какого-либо покрытия, которое препятствует образованию коррозионного элемента (пассивный метод).
• Другая возможность защитить металл от коррозии — применение защитного электрода с большим отрицательным потенциалом, например, из цинка или магния. Для этого специально создается коррозионный элемент. Защищаемый металл выступает в роли катода, и этот вид защиты называют катодной защитой.
• Система холодного цинкования предназначена для усиления антикоррозионных свойств комплексного многослойного покрытия. Система обеспечивает полную катодную (или гальваническую) защиту железных поверхностей от коррозии в различных агрессивных средах.
• Для борьбы с коррозией используют также методы газотермического напыления.
С помощью газотермического напыления на поверхности металла создается слой из другого металла/сплава, обладающий более высокой стойкостью к коррозии (изолирующий) или наоборот менее стойкий (протекторный). Такой слой позволяет остановить коррозию защищаемого металла.
Цинкование.
Цинкование — это то нанесение цинка или его сплава на металлическое изделие для придания его поверхности определённых физико-химических свойств, в первую очередь высокого сопротивления коррозии. Цинкование — наиболее распространённый и экономичный процесс металлизации, применяемый для защиты железа и его сплавов от атмосферной коррозии (коррозия). На эти цели расходуется примерно 40 % мировой добычи цинка. Толщина покрытия должна быть тем больше, чем агрессивнее окружающая среда и чем длительнее предполагаемый срок эксплуатации. Электролитическое цинкование ведётся в основном из кислых и щёлочно-цианистых электролитов; специальные добавки позволяют получать блестящие покрытия. Диффузионное цинкование, осуществляемое из паровой или газовой фазы при высоких температурах (375—850 °C), применяется для покрытия труб и др. конструкций. Толщина диффузионного слоя зависит от температуры и времени цинкования и может составлять 0,1—1,5 мм.
Цинкование — наиболее распространённый и экономичный процесс металлизации, применяемый для защиты железа и его сплавов от атмосферной коррозии (коррозия). На эти цели расходуется примерно 40 % мировой добычи цинка. Толщина покрытия должна быть тем больше, чем агрессивнее окружающая среда и чем длительнее предполагаемый срок эксплуатации. Электролитическое цинкование ведётся в основном из кислых и щёлочно-цианистых электролитов; специальные добавки позволяют получать блестящие покрытия. Диффузионное цинкование, осуществляемое из паровой или газовой фазы при высоких температурах (375—850 °C), применяется для покрытия труб и др. конструкций. Толщина диффузионного слоя зависит от температуры и времени цинкования и может составлять 0,1—1,5 мм.
Коррозия металла и способы защиты от нее
Коррозия — процесс химического или электрохимического разрушения металлов под действием окружающей среды. Установлено, что от коррозии ежегодно теряется безвозвратно около 10 % производимых металлов, т. е. годовая продукция крупного металлургического завода.
е. годовая продукция крупного металлургического завода.
В процессе химического разрушения на поверхности металла образуется пленка из продуктов коррозии, обычно оксидов. В некоторых случаях эта пленка может защищать лежащий под ней металл от дальнейшей коррозии. Сравнительно плотные оксиды пленки образуются на поверхности алюминия, свинца, олова, никеля, хрома. При окислении железа в сухом воздухе или в атмосфере сухого кислорода образуется также достаточно плотная пленка, но она по мере роста растрескивается и отслаивается от металла. Чаще всего химическая коррозия происходит в среде сухих газов при высокой температуре (металлическая арматура печей, клапаны двигателей, лопатки газовых турбин и т.п.) или в жидкостях неэлектролитов (окисление металла в спирте, бензине, нефти, мазуте и т. п.).
При электрохимической коррозии металл разрушается вследствие его растворения в жидкой среде, являющейся электролитом. Сущность процесса электрохимической коррозии заключается в том, что атомы, находящиеся в узлах кристаллической решетки металла, при контакте с раствором электролита переходят в раствор в форме ионов, оставляя эквивалентное количество электронов в металле. Переход атомов металла в ионы и растворение их в жидком электролите определяется величиной нормального электродного потенциала. Он характеризует то напряжение электрического тока, которое надо приложить к границе раздела твердого металла с жидким электролитом, чтобы воспрепятствовать переходу иона металла в раствор. Чем отрицательнее нормальный электродный потенциал, тем более резко выражено стремление металла к растворению в электролитах (например, свинец растворяется значительно медленнее, чем железо). Данный вид коррозии может также возникнуть при контакте двух разнородных металлов в присутствии электролита, когда между этими металлами возникает гальванический ток. В гальванической паре любых двух металлов будет растворяться тот металл, который обладает более отрицательным электродным потенциалом. Например, железо имеет более низкий отрицательный электродный потенциал, чем цинк, и более высокий, чем медь. Следовательно, при контакте железа с цинком будет разрушаться цинк, а при контакте железа с медью — железо.
Переход атомов металла в ионы и растворение их в жидком электролите определяется величиной нормального электродного потенциала. Он характеризует то напряжение электрического тока, которое надо приложить к границе раздела твердого металла с жидким электролитом, чтобы воспрепятствовать переходу иона металла в раствор. Чем отрицательнее нормальный электродный потенциал, тем более резко выражено стремление металла к растворению в электролитах (например, свинец растворяется значительно медленнее, чем железо). Данный вид коррозии может также возникнуть при контакте двух разнородных металлов в присутствии электролита, когда между этими металлами возникает гальванический ток. В гальванической паре любых двух металлов будет растворяться тот металл, который обладает более отрицательным электродным потенциалом. Например, железо имеет более низкий отрицательный электродный потенциал, чем цинк, и более высокий, чем медь. Следовательно, при контакте железа с цинком будет разрушаться цинк, а при контакте железа с медью — железо. Гальванические пары при коррозии образуются не только между отдельными участками контактирующих металлов, но также и между микроскопически малыми кристалликами одного и того же сплава, если они различаются по химическому составу и физическим свойствам. В результате возникает коррозионное разрушение, которое может проникнуть очень глубоко и идти по границам раздела зерен (межкристаллическая коррозия). Например, в перлите феррит более электроотрицателен, чем цементит, он и будет разрушаться в соответствующих условиях.
Гальванические пары при коррозии образуются не только между отдельными участками контактирующих металлов, но также и между микроскопически малыми кристалликами одного и того же сплава, если они различаются по химическому составу и физическим свойствам. В результате возникает коррозионное разрушение, которое может проникнуть очень глубоко и идти по границам раздела зерен (межкристаллическая коррозия). Например, в перлите феррит более электроотрицателен, чем цементит, он и будет разрушаться в соответствующих условиях.
Таким образом, электрохимическая коррозия — это разрушение сплава, сопровождающееся появлением электрического тока в результате работы множества микрогальванических элементов на корродирующей поверхности металла.
На скорость растворения металла в электролите влияют примеси, способы обработки металла, концентрация электролитов. Металл, находящийся под нагрузкой, корродирует значительно быстрее ненагруженного, так как нарушается целостность защитной пленки и образуются микротрещины (коррозионное растрескивание). Разрушение металла одновременным воздействием знакопеременных нагрузок и коррозионной среды называют коррозионной усталостью.
Разрушение металла одновременным воздействием знакопеременных нагрузок и коррозионной среды называют коррозионной усталостью.
В зависимости от характера окружающей среды электрохимическая коррозия может быть подводной, атмосферной, почвенной, вызванной блуждающими токами. Электрохимическая коррозия металлов в воде обусловливается присутствием в ней растворенного кислорода. При атмосферной коррозии электролитом служит тонкая пленка влаги, сам же процесс коррозии ничем не отличается от коррозии в воде.
В результате коррозии стали на ее поверхности появляется смесь различных гидратированных оксидов железа, имеющих состав «FeO-ph3O+mFe2O3-<?h3O (ржавчина).
Активному протеканию процесса коррозии способствует углекислый и в особенности сернистый газы, хлористый водород, различные соли.
Защиту от коррозии следует начинать с правильного подбора химического состава и структуры металла. При конструировании необходимо избегать форм, способствующих задержке влаги. Для защиты металла от коррозии применяют различные способы.
Для защиты металла от коррозии применяют различные способы.
Легирование стали повышает ее антикоррозионные свойства. Например, совершенную стойкость к атмосферной коррозии показывают нержавеющие легированные стали, содержащие в большом количестве хром, который, образуя на поверхности оксидные пленки, приводит сталь в пассивное состояние. Существенно повышается (в 1,5…3 раза) коррозионная стойкость строительных сталей при введении в их состав меди (0,2…0,5 %). Повышенной стойкости нержавеющих сталей против коррозии способствуют также их однородность и небольшое содержание вредных примесей.
Защитные покрытия представляют собой пленки (металлические, оксидные, лакокрасочные и т.п.).
Металлические покрытия бывают двух типов — анодные и катодные. Для анодного покрытия используют металлы, обладающие более отрицательным электродным потенциалом, чем основной металл (например, цинк, хром). Для катодного покрытия выбирают металлы, имеющие меньшее отрицательное значение электродного потенциала, чем основной металл (медь, олово, свинец, никель и др.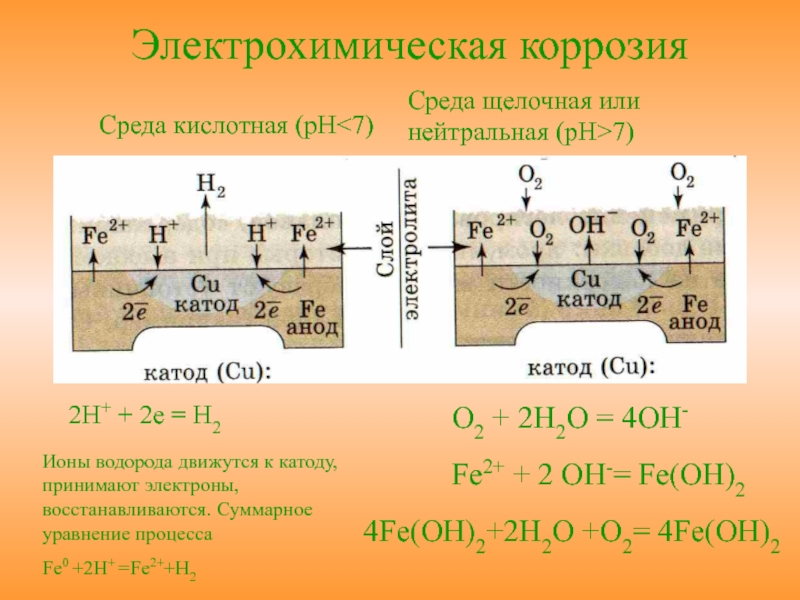 ). Металлические покрытия наносят горячим методом, гальваническим и металлизацией.
). Металлические покрытия наносят горячим методом, гальваническим и металлизацией.
При горячем методе покрытия изделия погружают в ванну с расплавленным защитным металлом, температура которого ниже, чем температура плавления изделия (цинк, олово, свинец).
Гальванический метод защиты состоит в том, что на поверхности изделия путем электролитического осаждения из растворов солей создается тонкий слой защищаемого металла. Покрываемое изделие при этом служит катодом, а осаждаемый металл — анодом.
Металлизация — покрытие поверхности детали расплавленным металлом, распыленным сжатым воздухом. Преимуществом этого метода защиты металла является то, что покрывать расплавом можно уже собранные конструкции. Недостаток заключается в том, что получается шероховатая поверхность.
Металлические покрытия можно наносить также посредством диффузии металла покрытия в основной металл— алитирование, силицирование, хромирование (см. с. 316), а также способом плакирования, т. е. наложения на основной металл тонкого слоя защитного металла (биметалл) и зарепления его путем горячей прокатки (например, железо — медный сплав, дюралюминий — чистый алюминий).
е. наложения на основной металл тонкого слоя защитного металла (биметалл) и зарепления его путем горячей прокатки (например, железо — медный сплав, дюралюминий — чистый алюминий).
Оксидирование — защита оксидными пленками. Для этого естественную оксидную пленку, всегда имеющуюся на металле, делают более прочной путем обработки сильным окислителем, например концентрированной азотной кислотой, растворами марганцевой или хромовой кислот и их солей. Частным случаем оксидирования является воронение стали. В этом случае на поверхности также создается оксидная пленка, но более сложными приемами, связанными с многократной термической обработкой при температуре ЗО0…40О°С в присутствии древесного угля.
Фосфатирование состоит в получении на изделии поверхностной пленки из нерастворимых солей железа или марганца в результате погружения металла в горячие растворы кислых фосфатов железа или марганца.
Лакокрасочные покрытия основаны на механической защите металла пленкой из различных красок и лаков. Ванны, раковины, декоративные изделия для защиты от коррозии покрывают эмалью, т. е. наплавляют на металл при температуре 750…800°С различные комбинации силикатов.
Ванны, раковины, декоративные изделия для защиты от коррозии покрывают эмалью, т. е. наплавляют на металл при температуре 750…800°С различные комбинации силикатов.
При временной защите металлических изделий от коррозии (транспортировании, складировании) используют для покрытия металла невысыхающие масла (технический вазелин, лак этиноль), а также ингибиторы, т. е. вещества, замедляющие протекание реакции (нитрит натрия с углекислым аммонием, с уротропином, ингибитор ную бумагу и др.).
Источник информации: http://bibliotekar.ru/spravochnik-33/118.htm
Коррозия металлов
Коррозией называется непроизвольное разрушение металлов и сплавов под действием окружающей среды.
Коррозия называется химической, если она происходит под действием сухих газов или жидкостей-неэлектролитов, т.е. жидкостей, не проводящих электрический ток (бензин, керосин, смола и т.п.).
Коррозия называется электрохимической, если она происходит при взаимодействии с жидкостями-электролитами, т. е. проводящими электрический ток (вода, пар, водяные растворы солей, щелочи, кислоты и т.п.).
е. проводящими электрический ток (вода, пар, водяные растворы солей, щелочи, кислоты и т.п.).
Так как в подавляющем большинстве случаев металлические детали работают в условиях влажной атмосферы или газов, а некоторые детали, например в подводных лодках, пароходах и гидросамолетах, при непосредственном контакте с растворами солей (морская вода), то явление коррозии может наблюдаться на них в сильной степени, если не будут приняты меры, замедляющие скорость коррозии или устраняющие ее вовсе.
Статистические данные показывают, что количество металлов и сплавов, пришедших в негодность от коррозии, составляет около 40% от общего количества выплавленных металлов и сплавов.
Мировые потери от коррозии за время с 1890 по 1923 г. выражаются огромной цифрой — 706 млн. т из 1760 млн. т общего количества чугуна и стали, выплавленных за тот же период.
Химическая коррозия металлов и сплавов
При химической коррозии металл или сплав, взаимодействуя с газами при высоких температурах или с жидкостями-неэлектролитами. образует различные химические соединения (оксиды, сульфиды и др.), т. е. разрешается, переходя в неметаллическое состояние.
образует различные химические соединения (оксиды, сульфиды и др.), т. е. разрешается, переходя в неметаллическое состояние.
Электрохимическая коррозия металлов и сплавов
При электрохимической коррозии металл или сплав, взаимодействуя с электролитом, переходит в раствор в виде положительно заряженных частиц (ионов).
Происходящие здесь процессы напоминают действие простейшего гальванического элемента.
Если такой элемент состоит из пластинки цинка, опущенной в раствор сернокислого цинка, и пластинки меди, опущенной в раствор сернокислой меди, то при замыкании этих пластинок возникает электрический ток и электроны начинают перемещаться от цинковой пластинки к медной.
Это значит, что у цинка большая способность превращаться в положительно заряженные частицы (ионы).
В силу этих причин цинковая пластинка в гальваническом элементе в процессе работы будет разрушаться. Образование микрогальванических элементов вследствие неоднородности структуры при взаимодействии металлов и сплавов с жидкостями-электролитами и составляет сущность процесса электрохимической коррозии.
§
Коррозия металлов | Статья в журнале «Молодой ученый»
В статье рассмотрены основные вопросы процесса коррозионного повреждения металла, виды коррозии и коррозионных разрушений, способы защиты от коррозии.
Ключевые слова: остаточный ресурс, коррозия металлов, защита от коррозии.
Основным критерием оценки остаточного ресурса технического устройства (далее ТУ) являются прочностные характеристики, определяемые расчётами. Расчёт прочностных характеристик зависит от марки материала, геометрических параметров, толщины элементов ТУ. При проектировании ТУ учитываются все эти параметры с учётом допусков, проектной скорости коррозии, сроков и условий эксплуатации. Однако в процессе эксплуатации ключевым фактором, влияющим на пригодность ТУ является коррозионное повреждение металла, скорость которого может отличаться от проектной в несколько раз. Для определения прогнозируемых сроков эксплуатации ТУ необходима оценка скорости коррозии в конкретных условиях эксплуатации, а так же возможность влиять на неё с целью увеличения этих сроков. Для решения этих вопросов необходимо понимание самих процессов протекания коррозии, природы и сути процесса.
Для определения прогнозируемых сроков эксплуатации ТУ необходима оценка скорости коррозии в конкретных условиях эксплуатации, а так же возможность влиять на неё с целью увеличения этих сроков. Для решения этих вопросов необходимо понимание самих процессов протекания коррозии, природы и сути процесса.
Коррозия — это разрушение металла под действием окружающей среды. По механизму протекания различают два типа коррозии — химическую и электрохимическую. Химическая коррозия начинает влиять на металл сначала его происхождения. Окалина ее продукт. Взаимодействие металла и окружающей среды протекает постоянно, химические процессы, проходящие при этом взаимодействии можно назвать борьбой за выживание, наша задача свести потери металла в этой борьбе к минимуму.
По характеру агрессивной среды различают атмосферную коррозию, подземную и подводную.
Виды коррозионных разрушений разнообразны — равномерная коррозия, неравномерная, коррозия пятнами, коррозия язвами, подповерхностная коррозия, точечная или питтинговая, структурно-избирательная коррозия, межкристаллитная коррозия (этот самый опасный вид коррозии, обусловленный сложностью выявления). Последствия скрытно протекающих коррозионных процессов зачастую приводят к авариям, которых могло бы и не быть.
Последствия скрытно протекающих коррозионных процессов зачастую приводят к авариям, которых могло бы и не быть.
Химическая коррозия — это процесс разрушения металла под действием внешней среды, не сопровождаемая образованием электрического тока. Ее разновидность газовая коррозия, представляет собой процесс взаимодействия газов при высокой температуре с металлом. При таком взаимодействии образуется оксидная пленка, на железе она рыхлая, легко отскакивает и не защищает от разрушения.
В отличии от химической — электрохимическая коррозия протекает при контакте металла с раствором электролита. При этом электролитом может являться любая жидкость или газ. Примером электрохимической коррозии может быть атмосферная коррозия. Электрохимическая коррозия, более трудно прогнозируемая, чем химическая, ввиду необходимости учёта множества факторов, зачастую изменяющихся в процессе эксплуатации ТУ. При этом скорость протекания процессов электрохимической коррозии на порядок больше чем при химической коррозии.
В одних случаях на поверхности металла может образоваться плотная оксидная пленка, выполняющая роль защитного слоя. Образовавшаяся оксидная пленка предохраняет металл от разрушения. Это явление широко используется в современной технике, как способ защиты от коррозионных процессов.
Существует немало способов защиты от коррозии. Самый лучший из них создание такого металла, который бы вообще не корродировал. Один из путей создания коррозионностойкого металла — получение особых сплавов, в которые добавляют хром, никель, молибден, титан и другие компоненты. Так называемое легирование. Технология создания таких сплавов трудоемка, и связана с повышенными экономическими затратами. Цена таких материалов выше и не всегда целесообразно применение их в конкретных условиях.
Ингибирование — способ, при котором скорость коррозии снижается, если в агрессивную среду ввести соединения, значительно замедляющие коррозионный процесс. Одним из механизмов ингибирования является адсорбция ингибитора на поверхности защищаемого изделия. Ингибируемые бумаги и пленки применяются при долговременном хранении.
Различают металлические и неметаллические защитные покрытия, изолирующие металл от агрессивной среды. Большие детали или трубы защищают методом металлизации. Плакирование — метод защиты металла от коррозии другим металлом, который устойчив к агрессивной среде.
Трубы газо- и нефтепроводов защищаются комбинированным способом, мазутно-битумное покрытие, ингибированная бумага и одновременно с этим катодная защита. Сущность электрозащиты состоит в том что, на катод, которым является сам трубопровод, накачиваются электроны от внешнего источника тока, и это тормозит коррозию. Анодом в этом случае может служить любой ненужный металл. Так же широко сейчас применяются различные плёнки на основе полиэтилена, внутренняя поверхность так же защищается различными покрытиями на основе керамики. Сварные стыки также защищаются от взаимодействия с перекачиваемой средой различными способами.
При защите ТУ применяется метод протекторной защиты. Протектор — активный металл, с более отрицательным потенциалом, например цинк, который разрушаясь сам, защищает объект.
Надежным способом зашиты от коррозии, являются гальванические покрытия, которые получают электролизом в водных растворах.
Неметаллические покрытия — это покрытия лаками, красками, различными силикатными эмалями и полимерными материалами. Покрытие силикатными эмалями широко применяется в химической промышленности. Кислотостойкие эмали применяют для покрытия вакуумных аппаратов, резервуаров, реакторов.
Затраты на защиту металла от коррозии оправданы и дают хороший экономический эффект, с учётом снижения затрат на замену непригодного ТУ. Где то, например подземные трубопроводы с агрессивной средой, она просто необходима для безопасной эксплуатации.
При проведении экспертизы промышленной безопасности технических устройств, применяемых на опасных производственных объектах, одной из важнейших задач является определение скорости коррозии и прогнозирование этой скорости на планируемый период эксплуатации. Мероприятия по антикоррозионной защите могут значительно увеличить срок эксплуатации и, как следствие, снизить затраты на замену ТУ.
Литература:
- Материаловедение и технология металлов. / Ф. Гарифуллин, Г. Фетисов. — Издательство: Оникс. 2009. 624 с.
- Коррозия и защита от коррозии. / Семенова И. В., Флорианович Г. М., Хорошилов А. В. — Издательство: М.: Физматлит. 2002. 335 с.
Электрохимическая коррозия. Электрохимическая коррозия металлов. Химическая коррозия. Химическая коррозия металлов.
Коррозия — разрушение металла под воздействием окружающей среды. Коррозия помимо уничтожения металла отрицательно влияет на эксплуатационные характеристики деталей, содействуя всем видам разрушения. Коррозия в зависимости от характера окружающей среды может быть химической и электрохимической.
Цианирование. Цианирование стали. Процесс цианирования. Нитроцементация. Нитроцементация стали.
Азотирование. Азотирование стали. Азотирование деталей. Ионное азотирование. Технология азотирования.
Электрохимическая коррозия имеет место в водных растворах, а так же в обыкновенной атмосфере, где имеется влага. Сущность этой коррозии в том, что ионы металла на поверхности детали, имея малую связь с глубинными ионами, легко отрываются от металла молекулами воды. Металл, потеряв часть положительно заряженных частиц, ионов, заряжается отрицательно за счет избыточного количества оставшихся электронов. Одновременно слой воды, прилегающий к металлу, за счет ионов металла приобретает положительный заряд. Разность зарядов на границе металл – вода обуславливает скачок потенциала, который в процессе коррозии изменяется, увеличиваясь от растворения металла, и уменьшаясь от осаждения ионов из раствора на металле.
Если количество ионов переходящих в раствор и осаждающихся на металле одинаково, то скорости растворения и осаждения металла равны и процесс коррозии (разрушения металла) не происходит. Этому соответствует равновесный потенциал φ.
За нулевой потенциал принимают равновесный потенциал водородного иона в водном растворе при концентрации положительных ионов водорода, равной 1 моль ионов H+ на 1 литр.
Стандартные потенциалы элементов по отношению к водородному потенциалу
Металлы, стандартный потенциал которых отрицательный – корродируют в воде, в которой растворен кислород тем активнее, чем отрицательней значение электрохимического потенциала. Уходящие ионы металла, взаимодействуя с ионами OH—, образуют гидроксиды, нерастворимые в воде, которые называют ржавчиной, а процесс их образования – ржавлением.
Схема ржавления железа:
2Fe — 4e -> 2Fe2+
2Fe2+ + 4OH— -> 2Fe(OH)2
Гидроксид железа Fe(OH)2 в присутствии кислорода, растворенного в воде, превращается в Fe(OH)3. Так как это нерастворимое соединение, то равновесный потенциал не может быть достигнут и коррозия будет продолжаться до полного разрушения.
В зависимости от структуры коррозия имеет разное проявление: при однородном металле – коррозия происходит равномерно по всей поверхности. При неоднородном металле – коррозия избирательная и называется точечной. Это явление наиболее опасно, так как приводит к быстрой порче всего изделия. Избирательная коррозия создает очаги концентрации напряжений, что содействует разрушению.
Химическая коррозия может происходить за счет взаимодействия металла с газовой средой при отсутствии влаги. Продуктом коррозии являются оксиды металла. Образуется пленка на поверхности металла толщиной в 1…2 периода кристаллической решетки. Этот слой изолирует металл от кислорода и препятствует дальнейшему окислению, защищает от электрохимической коррозии в воде. При создании коррозионно-стойких сплавов – сплав должен иметь повышенное значение электрохимического потенциала и быть по возможности однофазным.
Электрохимическое и термодинамическое исследование коррозионных характеристик стали API X120 в 3,5% растворе NaCl
Эрран, А., де ла Крус, Дж. М. и де Андрес, Б. Global Search Metaheuristics для планирования транспортировки нескольких нефтепродуктов в многотрубная система. Компьютеры и химическая инженерия 37 , 248–261, https://doi.org/10.1016/j.compchemeng.2011.10.003 (2012).
CAS Статья Google Scholar
Карретеро Олалла, В. и др. . Анализ механизмов упрочнения трубопроводных сталей в зависимости от параметров горячей прокатки. Mater. Sci. Eng., A 604 , 46–56, https://doi.org/10.1016/j.msea.2014.02.066 (2014).
CAS Статья Google Scholar
Оконкво, П. К., Шакур, Р. А., Ахмед, Э. и Мохамед, А. М. Характеристики эрозионного износа трубопроводной стали API X42. англ.Неудача. Анальный. 60 , 86–95, https://doi.org/10.1016/j.engfailanal.2015.11.046 (2016).
CAS Статья Google Scholar
Шакур, А. и др. . Коррозионное поведение высокопрочной низколегированной стали HSLA в растворе 35 мас.% NaCl, содержащем диэтилентриамин DETA в качестве ингибитора коррозии. 2018 , https://doi.org/10.5339/qfarc.2018.EEPD356 (2018).
Риос-Меркадо, Р.З. и Борраз-Санчес, К. Проблемы оптимизации в системах транспортировки природного газа: современный обзор. заявл. Энергия 147 , 536–555, https://doi.org/10.1016/j.apenergy.2015.03.017 (2015).
Артикул Google Scholar
Гуо, Й., Мэн, Т., Ван, Д., Тан, Х. и Хе, Р. Экспериментальные исследования коррозии сталей трубопроводов серии X при воздействии переменного тока. англ.Неудача. Анальный. 78 , 87–98, https://doi.org/10.1016/j.engfailanal.2017.03.003 (2017).
CAS Статья Google Scholar
Мохтади-Бонаб, М. А. и Эскандари, М. Акцент на различных факторах, влияющих на вызванное водородом растрескивание в стали для трубопроводов нефти и природного газа. англ. Неудача. Анальный. 79 , 351–360, https://doi.org/10.1016/j.engfailanal.2017.05.022 (2017).
CAS Статья Google Scholar
Педроса, И. Р. В., Кастро, Р. Сд, Ядава, Ю. П. и Феррейра, Р. А. С. Исследование фазовых превращений в стали API 5L X80 с целью повышения ее вязкости разрушения. Mater. Res. 16 , 489–496 (2013).
CAS Статья Google Scholar
Zhang, J.-m, Sun, W.-h & Sun, H. Механические свойства и микроструктура высокопрочной трубопроводной стали марки X120. J. Iron. Steel Res.Int. 17 , 63–67, https://doi.org/10.1016/S1006-706X(10)60185-9 (2010).
CAS Статья Google Scholar
Cao, R. et al. . Влияние кремния и меди на микроструктуру, растяжение и свойства Шарпи металлов сварных швов с помощью очищенной проволоки X120. Mater. Sci. Eng., A 718 , 350–362, https://doi.org/10.1016/j.msea.2018.01.080 (2018).
CAS Статья Google Scholar
Yoo, J.-Y., Ahn, S.-S., Seo, D.-H., Song, W.-H. И Канг, К.-Б. Новая разработка трубопроводных сталей высокого качества от X80 до X120. Mater. Manuf. Процессы 26 , 154–160, https://doi.org/10.1080/104269102534 (2011).
CAS Статья Google Scholar
Линтер Б. Р., Бурштейн Г. Т. Реакции сталей трубопроводов в растворах диоксида углерода. Коррозия наук. 41 , 117–139, https: // doi.org / 10.1016 / S0010-938X (98) 00104-8 (1999).
CAS Статья Google Scholar
Гао М., Панг X. и Гао К. Механизм роста пленок продуктов коррозии CO2. Коррозия наук. 53 , 557–568, https://doi.org/10.1016/j.corsci.2010.09.060 (2011).
CAS Статья Google Scholar
Чжан, Дж., Ван, Дж., Чжу, Ф.И Ду М. Исследование ингибирующих свойств софоролипидов для коррозии стали X65 в промысловой воде, насыщенной диоксидом углерода, на промысле. Ind. Eng. Chem. Res. 54 , 5197–5203, https://doi.org/10.1021/ie5044055 (2015).
CAS Статья Google Scholar
Mazumder, MAJ, Nazal, MK, Faiz, M. & Ali, SA Имидазолины, содержащие одно-, двух- и треххвостые гидрофобы и гидрофильные подвески (Ch3Ch3NH) nH в качестве ингибиторов коррозии мягкой стали в CO2– 0.5 М NaCl. RSC Adv. 6 , 12348–12362, https://doi.org/10.1039/C5RA21276F (2016).
CAS Статья Google Scholar
Нешич, С. Ключевые вопросы, связанные с моделированием внутренней коррозии нефте- и газопроводов — обзор. Коррозия наук. 49 , 4308–4338, https://doi.org/10.1016/j.corsci.2007.06.006 (2007).
CAS Статья Google Scholar
Кермани, М. Б. и Моршед, А. Коррозия углекислым газом при добыче нефти и газа — конспект. Коррозия 59 , 659–683, https://doi.org/10.5006/1.3277596 (2003).
CAS Статья Google Scholar
Рен, К., Ван, В., Цзинь, X., Лю, Л. и Ши, Т. Физико-химические характеристики пленок FeCO3 под влиянием анионов. RSC Adv. 5 , 20302–20308, https://doi.org/10.1039 / C4RA14313B (2015).
CAS Статья Google Scholar
Элиан Ф. и Альфантази А. Влияние температуры на коррозионное поведение трубопроводной стали API-X100 в растворах CO2-HCO3- при давлении 1 бар: электрохимическое исследование. Mater. Chem. Phys. 140 , 508–515, https://doi.org/10.1016/j.matchemphys.2013.03.061 (2013).
CAS Статья Google Scholar
Элиан Ф. Ф., Мохаммади Ф. и Альфантази А. Электрохимическое исследование влияния содержания хлоридов на коррозию стали API-X100 с помощью CO2. Коррозия наук. 64 , 37–43, https://doi.org/10.1016/j.corsci.2012.06.032 (2012).
CAS Статья Google Scholar
Аль-Джаруди, С.С., Уль-Хамид, А. и Аль-Мумен, М.А. Преждевременный выход из строя насосно-компрессорных труб, используемых в добывающей скважине малосернистой нефти сорта Extra Arab Light. англ. Неудача. Анальный. 47 , 178–198, https://doi.org/10.1016/j.engfailanal.2014.10.006 (2015).
CAS Статья Google Scholar
Эрнандес-Эспехель, А., Домингес-Креспо, Массачусетс, Кабрера-Сьерра, Р., Родригес-Менесес, К. и Арсе-Эстрада, Э.М. кислые кислые среды. Коррозия наук. 52 , 2258–2267, https: // doi.org / 10.1016 / j.corsci.2010.04.003 (2010).
CAS Статья Google Scholar
Мустафа А. Х., Ари-Вахджоеди Б. и Исмаил М. С. Ингибирование CO2-коррозии стали X52 ингибитором на основе имидазолина в среде CO2-вода под высоким давлением. J. Mater. Англ. Выполнять. 22 , 1748–1755, https://doi.org/10.1007/s11665-012-0443-5 (2013).
CAS Статья Google Scholar
Валькарсе, М. Б. и Васкес, М. Пассивность углеродистой стали, исследованная в растворах с низкой степенью карбонизации: влияние хлорид- и нитрит-ионов. Mater. Chem. Phys. 115 , 313–321, https://doi.org/10.1016/j.matchemphys.2008.12.007 (2009).
CAS Статья Google Scholar
Ван Б., Сюй Л., Лю Г. и Лу М. Коррозионное поведение и механизм стали 3Cr в среде CO2 с различной концентрацией Ca2 +. Коррозия наук. 136 , 210–220, https://doi.org/10.1016/j.corsci.2018.03.013 (2018).
CAS Статья Google Scholar
Уморен, С., Эбенсо, Э., Окафор, П., Огбобе, О. Водорастворимые полимеры в качестве ингибиторов коррозии. Технология пигментов и смол 35 , 346–352, https://doi.org/10.1108/03699420610711353 (2006).
CAS Статья Google Scholar
Ingham, B., Ko, M., Laycock, N., Kirby, NM & Williams, DE. Первые стадии кристаллизации сидерита во время коррозии стали с помощью CO2, оцененные с помощью синхротронного мало- и широкоугольного рассеяния рентгеновских лучей на синхротроне in situ. . . Фарадей Обсудить. 180 , 171–190, https://doi.org/10.1039/C4FD00218K (2015).
ADS CAS Статья PubMed PubMed Central Google Scholar
Чжэн, Л.Ф., Лэндон, Дж., Кебке, Н. С., Чандан, П. и Лю, К. Л. Пригодность и стабильность 2-меркаптобензимидазола в качестве ингибитора коррозии в системе улавливания CO2 после сжигания. Коррозия 71 , 692–702, https://doi.org/10.5006/1524 (2015).
CAS Статья Google Scholar
Артур Д. Э., Джонатан А., Аме П. О. и Аня К. Обзор оценки полимерных материалов, используемых в качестве ингибиторов коррозии металлов и сплавов. Внутр. J. Ind. Chem. 4 , 2, https://doi.org/10.1186/2228-5547-4-2 (2013).
Артикул Google Scholar
Кахраман Р. Подавление атмосферной коррозии низкоуглеродистой стали обработкой бензоатом натрия. J. Mater. Англ. Выполнять. 11 , 46–50, https://doi.org/10.1007/s11665-002-0007-1 (2002).
CAS Статья Google Scholar
Финшгар М., Фассбендер С., Николини Ф. и Милошев И. Полиэтиленимин как ингибитор коррозии нержавеющей стали ASTM 420 в почти нейтральной солевой среде. Коррозия наук. 51 , 525–533, https://doi.org/10.1016/j.corsci.2008.12.006 (2009).
CAS Статья Google Scholar
Finšgar, M., Fassbender, S., Hirth, S. & Milošev, I. Электрохимическое и XPS исследование полиэтилениминов разного молекулярного размера в качестве ингибиторов коррозии для нержавеющей стали AISI 430 в почти нейтральной хлоридной среде. Mater. Chem. Phys. 116 , 198–206, https://doi.org/10.1016/j.matchemphys.2009.03.010 (2009).
CAS Статья Google Scholar
Биглхол, Д., Вебстер, Б. и Вернер, С. Исследование эллипсометрии адсорбции молекул на границах электролита с золотом и нержавеющей сталью. J. Colloid Interface Sci. 202 , 541–550, https://doi.org/10.1006/jcis.1998.5475 (1998).
ADS CAS Статья Google Scholar
Казази М., Афшар А. и Саджаднежад М. Ингибирующее действие полиэтиленимина (PEI) на точечную коррозию аустенитной нержавеющей стали 304 в 3,5% растворе NaCl. Международный журнал Общества черной металлургии Ирана 10 , 14–22 (2013).
Google Scholar
Jianguo, Y., Лин В., Отиено-Алего В. и Швайнсберг Д. П. Поливинилпирролидон и полиэтиленимин как ингибиторы коррозии низкоуглеродистой стали в фосфорной кислоте. Коррозия наук. 37 , 975–985, https://doi.org/10.1016/0010-938X(95)00008-8 (1995).
CAS Статья Google Scholar
Секин, I. Ингибирование коррозии мягкой стали катионными и анионными полимерами в системе охлаждающей воды. J. Electrochem. Soc. 139 , 3167, https://doi.org/10.1149/1.2069050 (1992).
CAS Статья Google Scholar
Zhang, X. et al. . Антикоррозийное поведение четвертичного полиэтиленимина в кислой среде. Mater. Sci. Форум 610–613 , 136–141, https://doi.org/10.4028/www.scientific.net/msf.610-613.136 (2009).
Артикул Google Scholar
Гао, Б., Чжан, X. и Шэн, Ю. Исследования по приготовлению и ингибированию коррозии кватернизованного полиэтиленимина для низкоуглеродистой стали в серной кислоте. Mater. Chem. Phys. 108 , 375–381, https://doi.org/10.1016/j.matchemphys.2007.10.033 (2008).
CAS Статья Google Scholar
Али С.А. и Саид М.Т. Синтез и изучение ингибирования коррозии некоторых солей N, N-диаллил четвертичного аммония на основе 1,6-гександиамина и их полимеров. Полимер 42 , 2785–2794, https://doi.org/10.1016/S0032-3861(00)00665-0 (2001).
CAS Статья Google Scholar
G1-90-e1, A. Стандартная практика подготовки, очистки и оценки образцов для испытаний на коррозию. (1999).
Singh, A. et al. . Предстоящий ингибитор, полезный для нефтегазодобывающей промышленности: потеря веса, электрохимический, поверхностный и квантово-химический расчет. Scientific Reports 7 , 14904, https://doi.org/10.1038/s41598-017-13877-0 (2017).
ADS CAS Статья PubMed PubMed Central Google Scholar
Sliem, M. H. et al. . Поверхностно-активное вещество AEO7 как экологически чистый ингибитор коррозии углеродистой стали в растворе HCl. Scientific Reports 9 , 2319, https://doi.org/10.1038/s41598-018-37254-7 (2019).
CAS Статья PubMed PubMed Central Google Scholar
Salah, M., Lahcène, L., Omar, A. & Yahia, H. Изучение ингибирования коррозии стали C38 в 1 M растворе HCl полиэтилениминметиленфосфоновой кислотой. Международный журнал промышленной химии 8 , 263–272, https://doi.org/10.1007/s40090-017-0123-2 (2017).
CAS Статья Google Scholar
Яко, Э. А., Анаи, Р. А., Абдулмаджид, М. Х., Томи, И. Х. Р. и Кадхим, М. М.Потенциодинамическая поляризация, анализ поверхности и компьютерные исследования 1,3,4-тиадиазольного соединения в качестве ингибитора коррозии для иракских керосиновых цистерн. J. Mol. Struct. 1202 , 127356, https://doi.org/10.1016/j.molstruc.2019.127356 (2020).
CAS Статья Google Scholar
Ортега-Толедо, Д.М., Гонсалес-Родригес, Дж. Г., Казалес, М., Мартинес, Л. и Мартинес-Виллафанье, А. Ингибирование коррозии трубопроводной стали Х-120 с помощью CO2 модифицированным имидазолином в условиях потока . Коррозия наук. 53 , 3780–3787, https://doi.org/10.1016/j.corsci.2011.07.028 (2011).
CAS Статья Google Scholar
Zhao, J. & Chen, G. Синергетический ингибирующий эффект имидазолина на основе олеиновой кислоты и бензоата натрия на коррозию мягкой стали в насыщенном CO 2 солевом растворе. Электрохимы. Acta 69 , 247–255, https://doi.org/10.1016/j.electacta.2012.02.101 (2012).
CAS Статья Google Scholar
Schweinsberg, DP, Hope, GA, Trueman, A. & Otieno-Alego, V. Электрохимическое и SERS исследование действия поливинилпирролидона и полиэтиленимина в качестве ингибиторов меди в аэрированном H 2 SO 4 . Коррозия наук. 38 , 587–599, https://doi.org/10.1016/0010-938X(95)00148-D (1996).
CAS Статья Google Scholar
Вашишт, Х. и др. . Синергетическое взаимодействие между гидроксидом тетрабутилфосфония и иодид-ионами на поверхности мягкой стали для ингибирования коррозии в кислой среде. J. Mol. Liq. 224 , 19–29, https://doi.org/10.1016/j.molliq.2016.09.056 (2016).
CAS Статья Google Scholar
Бахгат Радван, А., Слим, М. Х., Оконкво, П. К., Шибл, М. Ф. и Абдулла, А. М.Ингибирование коррозии стали API X120 в высокоагрессивной среде с использованием стеарамидопропилдиметиламина. J. Mol. Liq. 236 , 220–231, https://doi.org/10.1016/j.molliq.2017.03.116 (2017).
CAS Статья Google Scholar
Усман Б. Дж., Уморен С. А. и Гасем З. М. Ингибирование коррозии стали API 5L X60 в насыщенном CO2 3,5% растворе NaCl дубильной кислотой и синергетический эффект добавки KI. J. Mol. Liq. 237 , 146–156, https://doi.org/10.1016/j.molliq.2017.04.064 (2017).
CAS Статья Google Scholar
Оконкво П. К., Слим М. Х., Шакур Р. А., Мохамед А. М. и Абдулла А. М. Влияние температуры на коррозионное поведение трубопроводной стали API X120 в среде h3S. J. Mater. Англ. Выполнять. 26 , 3775–3783, https://doi.org/10.1007/s11665-017-2834-0 (2017).
CAS Статья Google Scholar
Джавиди М. и Бехрад С. Анализ отказов трубопровода влажного газа из-за локальной коррозии CO 2 . англ. Неудача. Анальный. 89 , 46–56, https://doi.org/10.1016/j.engfailanal.2018.03.006 (2018).
CAS Статья Google Scholar
Singh, A. et al. . Электрохимические и поверхностные исследования некоторых порфинов в качестве ингибитора коррозии для стали J55 в условиях слабой коррозии. заявл. Прибой. Sci. 359 , 331–339, https://doi.org/10.1016/j.apsusc.2015.10.129 (2015).
ADS CAS Статья Google Scholar
Джавиди М. и Ходапараст М. Ингибирующее действие моноэтиленгликоля на коррозию стали API 5L X52 с помощью CO2. J. Mater. Англ. Выполнять. 24 , 1417–1425, https://doi.org/10.1007/s11665-015-1415-3 (2015).
CAS Статья Google Scholar
Zhang, H.-h, Pang, X. & Gao, K. Локальная CO2-коррозия углеродистой стали с различной микроструктурой в солевых растворах с ингибитором на основе имидазолина. заявл. Прибой. Sci. 442 , 446–460, https://doi.org/10.1016/j.apsusc.2018.02.115 (2018).
ADS CAS Статья Google Scholar
Фенг, Л., Янг, Х., Цуй, X., Чен, Д. и Ли, Г. Экспериментальные и теоретические исследования антикоррозионных свойств стальной арматуры с использованием недавно разработанной формулы экологически чистого ингибитора. RSC Adv. 8 , 6507–6518, https://doi.org/10.1039/C7RA13045G (2018).
CAS Статья Google Scholar
Saha, SK, Dutta, A., Ghosh, P., Sukul, D. & Banerjee, P. Новые молекулы на основе Шиффа в качестве эффективных ингибиторов коррозии для поверхностей из мягкой стали в среде 1 M HCl: экспериментальные и теоретический подход. Phys. Chem. Chem. Phys 18 , 17898–17911, https: // doi.org / 10.1039 / C6CP01993E (2016).
CAS Статья PubMed PubMed Central Google Scholar
Чжан Б. Р. и др. . Синергетическое ингибирование коррозии экологически чистыми ингибиторами коррозии углеродистой стали в мягкой воде. Коррозия наук. 94 , 6–20, https://doi.org/10.1016/j.corsci.2014.11.035 (2015).
CAS Статья Google Scholar
Мансфельд, Ф. Использование спектроскопии электрохимического импеданса для изучения защиты от коррозии с помощью полимерных покрытий. J. Appl. Электрохим 25 , 187–202, https://doi.org/10.1007/BF00262955 (1995).
Артикул Google Scholar
Abd-Elaal, AA, Elbasiony, NM, Shaban, SM & Zaki, EG Изучение ингибирования коррозии некоторых приготовленных неионных поверхностно-активных веществ на основе 3- (4-гидроксифенил) пропановой кислоты и оценка влияния наночастиц серебра по параметрам поверхности. J. Mol. Liq. 249 , 304–317, https://doi.org/10.1016/j.molliq.2017.11.052 (2018).
CAS Статья Google Scholar
Гадала И. М. и Альфантази А. Электрохимическое поведение трубопроводной стали API-X100 в почвенных растворах, имитирующих почти нейтральный и слабощелочной pH. Коррозия наук. 82 , 45–57, https://doi.org/10.1016/j.corsci.2013.12.020 (2014).
CAS Статья Google Scholar
Laidler, K. J. React. Kinet. (Pergamon Press, New York, 1963).
Луковиц И., Кальман Э. и Цукки Ф. Ингибиторы коррозии — взаимосвязь между электронной структурой и эффективностью. Коррозия 57 , 3–8, https://doi.org/10.5006/1.32 (2001).
CAS Статья Google Scholar
Fouda, A. e., Abd El-Aal, A., Sliem, M. H., Abdullah, A. Каприламидопропилбетаин в качестве высокоэффективного экологически чистого ингибитора коррозии для стали API X120 в 1 M h3SO4. Египет. J. chem ., Https://doi.org/10.21608/ejchem.2019.13652.1844 (2019).
Ren, X., Xu, S., Chen, S., Chen, N. & Zhang, S. Экспериментальные и теоретические исследования триизопропаноламина в качестве ингибитора алюминиевого сплава в 3% растворе NaCl. RSC Adv. 5 , 101693–101700, https://doi.org/10.1039/C5RA21050J (2015).
CAS Статья Google Scholar
Эль-Хаддад, М.N. Гидроксиэтилцеллюлоза используется в качестве экологически чистого ингибитора коррозии стали 1018 c в 3,5% растворе NaCl. Carbohydr. Polym. 112 , 595–602, https://doi.org/10.1016/j.carbpol.2014.06.032 (2014).
CAS Статья PubMed PubMed Central Google Scholar
Сурешкумар Сринивасан, А. В. А. А. Скрининг и оценка экологически безопасных ингибиторов коррозии для процесса абсорбции CO2 на основе амина, ингибиторы коррозии, принципы и недавнее применение Махмуд Алиофхазраи.IntechOpen (4 апреля 2018 г.).
Эспиноза-Васкес, А. и Родригес-Гомес, Ф. Дж. Кофеин и никотин в 3% растворе NaCl с CO2 в качестве ингибиторов коррозии для низкоуглеродистой стали. RSC Adv. 6 , 70226–70236, https://doi.org/10.1039/c6ra07673d (2016).
CAS Статья Google Scholar
Мобин, М. и Хан, М. А. Адсорбционные и коррозионные свойства полиэтиленгликоля и поверхностно-активных добавок на низкоуглеродистой стали в h3SO4. J. Mater. Англ. Выполнять. 23 , 222–229, https://doi.org/10.1007/s11665-013-0767-9 (2014).
CAS Статья Google Scholar
Радван, А. Б., Слим, М. Х., Юсуф, Н. С., Альнуайми, Н. А. и Абдулла, А. М. Повышение коррозионной стойкости арматурной стали в агрессивных условиях эксплуатации с использованием хлорида бегентримония. Scientific Reports 9 , 18115, https: // doi.org / 10.1038 / s41598-019-54669-y (2019).
ADS CAS Статья PubMed PubMed Central Google Scholar
Wang, Y. et al. . Влияние pH и хлоридов на микромеханизм питтинговой коррозии высокопрочной трубопроводной стали в аэрированных растворах NaCl. заявл. Прибой. Sci. 349 , 746–756, https://doi.org/10.1016/j.apsusc.2015.05.053 (2015).
CAS Статья Google Scholar
Зейно А., Абдулазиз И., Халед М., Джавич М. В. и Обот И. Б. Механическое исследование полиаспарагиновой кислоты (PASP) в качестве экологически чистого ингибитора коррозии мягкой стали в 3% аэрированном растворе NaCl. J. Mol. Liq. 250 , 50–62, https://doi.org/10.1016/j.molliq.2017.11.160 (2018).
CAS Статья Google Scholar
Эль-Тайб Хеакал, Ф., Фауда, А. С. и Радван, М. С. Ингибирующее действие некоторых производных тиадиазола на коррозию углеродистой стали в нейтральном растворе хлорида натрия. Mater. Chem. Phys. 125 , 26–36, https://doi.org/10.1016/j.matchemphys.2010.08.067 (2011).
CAS Статья Google Scholar
Абдель Назир, А., Эль-Аббаси, Х. М. и Фауда, А. С. Адсорбция и ингибирование коррозии углеродистой стали цефоперазоном в качестве экологически чистого ингибитора в HCl. J. Mater. Англ. Выполнять. 22 , 2314–2322, https://doi.org/10.1007/s11665-013-0528-9 (2013).
CAS Статья Google Scholar
Хамди А. и Эль-Генди Н. С. Термодинамические, адсорбционные и электрохимические исследования для ингибирования коррозии углеродистой стали экстрактом хны в кислой среде. Египет. J. Pet. 22 , 17–25, https://doi.org/10.1016/j.ejpe.2012.06.002 (2013).
Артикул Google Scholar
Каннан, П., Рао, Т. С. и Раджендран, Н. Повышение коррозионной стойкости углеродистой стали в кислых условиях с использованием ингибитора нафталин-2-илнафталин-2-карбоксаммида. J. Colloid Interface Sci. 512 , 618–628, https://doi.org/10.1016/j.jcis.2017.09.061 (2018).
ADS CAS Статья PubMed PubMed Central Google Scholar
Фазаель, А.С., Хорасани, М. и Сараби, А.А. Эффект функционализированных поликарбоксилатных структур в качестве ингибиторов коррозии в моделированном пористом растворе бетона. заявл. Прибой. Sci. 441 , 895–913, https://doi.org/10.1016/j.apsusc.2018.02.012 (2018).
ADS CAS Статья Google Scholar
Choi, W. et al. . Эпоксидная функционализация полиэтиленимина для синтеза стабильного адсорбента диоксида углерода при адсорбции с переменным температурным режимом. Nat. Commun. 7 , 12640, https://doi.org/10.1038/ncomms12640 (2016).
ADS CAS Статья PubMed PubMed Central Google Scholar
Xu, X., Pejcic, B., Heath, C. & Wood, C. D. Улавливание углерода с помощью шариков полиэтиленимин-гидрогеля (PEI HBs). J. Mater. Chem. A 6 , 21468–21474, https://doi.org/10.1039/C8TA07760F (2018).
CAS Статья Google Scholar
Шарма П., Чакрабарти С., Рой С. и Кумар Р. Молекулярный взгляд на улавливание CO2 полиэтиленимином: роль структурной и динамической неоднородности. Langmuir 34 , 5138–5148, https: // doi.org / 10.1021 / acs.langmuir.8b00204 (2018).
CAS Статья PubMed PubMed Central Google Scholar
Чжан В., Лю, Х., Сан, К., Драге, Т. К. и Снейп, К. Э. Улавливание CO2 из окружающего воздуха с помощью адсорбента полиэтиленимин-диоксид кремния в псевдоожиженных слоях. Chem. Англ. Sci. 116 , 306–316, https://doi.org/10.1016/j.ces.2014.05.018 (2014).
CAS Статья Google Scholar
Шен, X., Ду, Х., Маллинс, Р. Х. и Коммалапати, Р. Р. Применение полиэтиленимина в улавливании и выделении диоксида углерода: от теоретического исследования к экспериментальной работе. Energy Technol. 5 , 822–833, https://doi.org/10.1002/ente.201600694 (2017).
CAS Статья Google Scholar
Wang, J. et al. . Улавливание углекислого газа с использованием мезопористых углеродов, содержащих полиэтиленимин. J. Environ. Sci. 25 , 124–132, https://doi.org/10.1016/S1001-0742(12)60011-4 (2013).
CAS Статья Google Scholar
Sk, M. H. et al. . Локальное перенасыщение и рост защитных отложений при коррозии стали стали с помощью CO2: влияние pH и потока раствора. Коррозия наук. 126 , 26–36, https://doi.org/10.1016/j.corsci.2017.05.026 (2017).
CAS Статья Google Scholar
Лю, К. Ю., Мао, Л. Дж. И Чжоу, С. В. Влияние содержания хлоридов на CO2-коррозию углеродистой стали в условиях моделирования нефтяных и газовых скважин. Коррозия наук. 84 , 165–171, https://doi.org/10.1016/j.corsci.2014.03.025 (2014).
CAS Статья Google Scholar
Молчан И.С. и др. . Коррозионное поведение мягкой стали в ионных жидкостях трицианометанида 1-алкил-3-метилимидазолия для улавливания CO2. RSC Adv. 4 , 5300–5311, https://doi.org/10.1039/C3RA45872E (2014).
CAS Статья Google Scholar
Эмори В., Цзян С. Л., Дуан Д. Л. и Чжэн Ю. Г. Влияние тиосульфата и сульфида натрия на коррозионное поведение углеродистой стали в процессе улавливания СО2 на основе МДЭА. J. Mater. Англ. Выполнять. 26 , 335–342, https://doi.org/10.1007/s11665-016-2458-9 (2017).
CAS Статья Google Scholar
Произошла ошибка при настройке пользовательского файла cookie
Этот сайт использует файлы cookie для повышения производительности. Если ваш браузер не принимает файлы cookie, вы не можете просматривать этот сайт.
Настройка вашего браузера для приема файлов cookie
Существует множество причин, по которым cookie не может быть установлен правильно. Ниже приведены наиболее частые причины:
- В вашем браузере отключены файлы cookie.Вам необходимо сбросить настройки своего браузера, чтобы он принимал файлы cookie, или чтобы спросить вас, хотите ли вы принимать файлы cookie.
- Ваш браузер спрашивает вас, хотите ли вы принимать файлы cookie, и вы отказались. Чтобы принять файлы cookie с этого сайта, используйте кнопку «Назад» и примите файлы cookie.
- Ваш браузер не поддерживает файлы cookie. Если вы подозреваете это, попробуйте другой браузер.
- Дата на вашем компьютере в прошлом. Если часы вашего компьютера показывают дату до 1 января 1970 г., браузер автоматически забудет файл cookie.Чтобы исправить это, установите правильное время и дату на своем компьютере.
- Вы установили приложение, которое отслеживает или блокирует установку файлов cookie. Вы должны отключить приложение при входе в систему или проконсультироваться с системным администратором.
Почему этому сайту требуются файлы cookie?
Этот сайт использует файлы cookie для повышения производительности, запоминая, что вы вошли в систему, когда переходите со страницы на страницу. Чтобы предоставить доступ без файлов cookie потребует, чтобы сайт создавал новый сеанс для каждой посещаемой страницы, что замедляет работу системы до неприемлемого уровня.
Что сохраняется в файле cookie?
Этот сайт не хранит ничего, кроме автоматически сгенерированного идентификатора сеанса в cookie; никакая другая информация не фиксируется.
Как правило, в файлах cookie может храниться только информация, которую вы предоставляете, или выбор, который вы делаете при посещении веб-сайта. Например, сайт не может определить ваше имя электронной почты, пока вы не введете его. Разрешение веб-сайту создавать файлы cookie не дает этому или любому другому сайту доступа к остальной части вашего компьютера, и только сайт, который создал файл cookie, может его прочитать.
Что такое коррозия? — Кэтуэлл
Металл, извлеченный из первичной руды, имеет естественную тенденцию возвращаться в свое естественное состояние под действием кислорода и воды. Это действие называется коррозией, и наиболее распространенным примером является ржавление стали.
Определение коррозииКоррозия — это процесс разложения металлов, в результате чего они возвращаются природе, откуда они были изначально получены.
Коррозия — дорогостоящая проблема. Но, понимая его коренные причины, можно предпринять эффективные шаги для предотвращения и борьбы с ним.
Железная руда и коррозия
Железная руда — это комбинация минералов, из которых можно извлечь металлическое железо. Коррозия — это процесс, обратный металлургии. Другими словами, энергия, используемая для преобразования природной руды в металл, меняется на противоположную, когда металл подвергается воздействию кислорода и воды.
Ячейка электрохимическая
Существует несколько форм металлической коррозии, большинство из которых происходит из-за электрохимической ячейки. Основными компонентами ячейки электрохимической коррозии являются анодный участок, катодный участок, путь электронов (металлическое соединение) и путь ионов (электролит). Для возникновения коррозии должны присутствовать все четыре компонента.
Подробнее о гальванических сериях и благородстве металлов.
Металл на аноде окисляется, что приводит к потере массы или коррозии.Электроны, образующиеся в результате этой реакции, проходят к катоду по металлическому пути, потребляются в реакции и предотвращают коррозию катодной области.
Наиболее распространенными электролитными средами являются вода, почва и бетон, загрязненный хлоридами. Путь электронов может быть внутренним по отношению к самому металлу или внешним, таким как провод, прямое соединение или другие соединяющие металлические компоненты.Анодная реакция, состоящая из окисления металла, может быть представлена как Fe → Fe 2+ + 2e — .
Кислород (O2), который хорошо растворяется в водном слое, является возможным акцептором электронов. Восстановление кислорода в нейтральных или основных средах происходит по реакции O 2 + 2H 2 O + 4e — → 4OH — .
Подробнее о гальванических сериях и благородстве металлов.
Описание коррозии — ячейка электрохимической коррозииАнодные области металлической поверхности окисляются и теряют электроны в катодной области.В катодной области кислород восстанавливается и вступает в реакцию с окисленным металлом с образованием оксида металла, так называемой ржавчины.
Последнее обновление: 10.12.2019
Corr Science »Принципы коррозии
Принципы коррозии
2. ПРИНЦИПЫ КОРРОЗИИ
2.1 ПОЛОВИННЫЕ КЛЕТОЧНЫЕ РЕАКЦИИ
Коррозия — это электрохимический процесс, при котором металлы и сплавы превращаются преимущественно в оксиды, гидроксиды и водные соли.
В процессе коррозии происходят две реакции. В одной из них, анодной реакции, атомы металла ионизируются и переходят в раствор, оставляя свои электроны на исходной поверхности металла. Во второй, катодной реакции, свободные электроны в металле захватываются химическими частицами, такими как O2 и h3O, в реакциях восстановления.
Рассмотрим упрощенную версию реакции коррозии между железом и водой. Общая реакция протекает следующим образом:
Fe + 2h3O → Fe (OH) 2 + h3 (1)
Полная реакция может быть разбита на окислительную реакцию ANODIC
Fe → Fe2 + + 2e- (2)
и восстанавливающая КАТОДНАЯ реакция
2h3O + 2e- → h3 + 2 (OH) — (3)
Рисунок 2.1 изображает этот процесс коррозии.
Реакции 2 и 3 называются реакциями «полуячейки». Реакция 2 — это половина процесса, ответственного за повреждение во время коррозии. Скорость, с которой протекает эта реакция, напрямую связана со скоростью коррозии.
2.2 ЭЛЕКТРОДНЫЕ ПОТЕНЦИАЛЫ
Значения ЭЛЕКТРОДНОГО ПОТЕНЦИАЛА связаны с каждой из реакций полуячейки и дают меру вероятности возникновения реакции. Фигура 2.2 показаны стандартные электродные потенциалы, измеренные по стандартной шкале водородных электродов для некоторых выбранных реакций полуячейки. Эта шкала устанавливает в качестве базы значение ноль вольт для снижения содержания водорода.
Чем более активен металл, тем отрицательнее его стандартный потенциал. В случае железа оно составляет -0,440 В, тогда как для более инертных технических металлов, таких как платина, стандартный электродный потенциал составляет +1,20 В.
Эта информация позволяет нам определить, будет ли металл подвергаться коррозии в данной среде.
РИСУНОК 2.1 — Схема процесса коррозии
Стандартный полуэлементный электрод
Реакционный потенциал (В)
Zn → Zn2 + + 2e- -0,76
Fe → Fe2 + + 2e- -0,44
2H + + 2e- → h3 0,00
2h3O + 2e- → h3 + 2 (OH) — 0,40
O2 + 4H + + 4e- → 2h3O 1.23
Cl2 + 2e- → 2Cl- 1,36
РИСУНОК 2.2 — Выбранный стандартный полуэлемент Потенциалы
В стандартных условиях потенциал коррозионной ячейки представляет собой разность между потенциалом полуячейки катодной реакции и потенциалом анодной половины ячейки. Для реакции 1 разность потенциалов между катодной и анодной реакциями полуячейки составляет:
E = +0,401 — (-0,440) = + 0,841V
Положительное значение потенциала указывает на то, что реакция возможна и что в этих условиях произойдет коррозия.Однако теория не позволяет рассчитать скорость коррозии; это должно быть измерено, предпочтительно на месте. Таким образом, расчет потенциала коррозионной ячейки не может предсказать величину повреждения, которое может возникнуть в результате реакции коррозии.
2.3 СКОРОСТИ КОРРОЗИИ И ПОЛЯРИЗАЦИЯ
Наличие разности потенциалов между анодной и катодной областями полуэлементов генерирует ток. Это имеет эффект уменьшения разности потенциалов между половинными ячейками, явление, известное как поляризация.На форму поляризационной кривой влияет множество факторов, но в простейшей форме она показана на рисунке 2.3.
В точке пересечения двух поляризационных кривых металл будет свободно корродировать. Потенциал, при котором это происходит, называется потенциалом свободной коррозии (Ecorr), который генерирует ток коррозии (Icorr). По току коррозии можно рассчитать скорость коррозии.
Электродный потенциал и гальваническая коррозия
Разность потенциалов между анодом и катодом может быть измерена с помощью прибора для измерения напряжения, но поскольку абсолютный потенциал анода или катода нельзя измерить напрямую — все измерения потенциала производятся в соответствии со стандартом. электрод.Стандартный электродный потенциал установлен на ноль, и измеренная разность потенциалов может считаться абсолютной.
Стандартный водородный электрод
- Полуячейка, в которой происходит реакция водорода, называется стандартным водородным электродом — SHE
Стандартный электродный потенциал
- Разность потенциалов, измеренная между металлическим M и Стандартный водородный электрод — SHE
Электрохимический ряд (электродвижущий ряд) представляет собой список металлов, упорядоченных в порядке их стандартных потенциалов на водородном электроде:
| Элемент | Электродный потенциал (вольт ) | |
|---|---|---|
| Литий | -3.04 | |
| Рубидий | -2,92 | |
| Калий | -2,92 | |
| Кальций | -2,87 | |
| Барий | 93 -1093 Магний-2,37 | |
| Бериллий | -1,85 | |
| Алюминий | -1,67 | |
| Марганец | -1.19 | |
| Цинк | -0,76 | |
| Хром | -0,74 | |
| Вольфрам | -0,58 | |
| — | -1093 Кобальт | -0,28 |
| Никель | -0,24 | |
| Олово | -0,14 | |
| Свинец | -0,13 | Водород +00 |
| Сурьма | +0,10 | |
| Медь | +0,34 | |
| Йод | +0,54 | |
| Серебро | 94 Бром+1.07 | |
| Платина | +1.20 | |
| Хлор | +1.36 | |
| Золото | +1.50 | |
| Фтор | +2,87 |
Примечание! — металлы выше в электрохимическом ряду вытесняют металлы ниже в ряду — это означает, что при соединении двух металлов с разными потенциалами металл с самым низким потенциалом корродирует.
Проблема коррозии при соединении меди и железа / стали
Очень распространенные соединения в системах трубопроводов — медь и железо / сталь. при таком соединении железо / сталь корродирует во много раз быстрее, чем , чем одно железо / сталь.
Коррозия как электрохимический процесс
Коррозию можно рассматривать как естественный возврат металлов в их руды, и она будет происходить везде, где может быть или установлен гальванический элемент или поле. Все, что нужно для создания поля, — это два разнородных металла, которые прямо или косвенно связаны электролитом, например, водой. Это та же химическая реакция, которая происходит в батарее.
Почти все металлы в той или иной степени подвержены коррозии. Скорость и степень коррозии зависят от степени различия металлов, а также физических и химических характеристик среды, металла и окружающей среды.В мягкой воде коррозия возникает из-за недостатка растворенных катионов, таких как кальций и магний, в воде. При образовании накипи внутри трубопровода образуется осадок или покрытие карбоната кальция или магния. Это покрытие может препятствовать коррозии трубы, поскольку оно действует как барьер, но оно также может вызвать засорение трубы. Вода с высоким содержанием натрия, хлорида или других ионов увеличивает проводимость воды и способствует коррозии
Огромное количество энергии, затраченной на добычу, очистку и производство металлов в полезные объекты, можно рассеять множеством различных путей.Коммунальные предприятия, особенно системы питьевого водоснабжения и канализации, несут наибольший экономический ущерб *.
Водораспределительная магистраль
Если вы живете в старой части города, где водопроводам от 50 до 100 лет, вода, которую вы пьете, вполне могла пройти через трубу в таком состоянии! Подобная сильная коррозия чаще встречается в районах с кислой водой. Такая вода поступает из горных снеготаяний и сточных вод и обычно приобретает кислотность за счет растворенного в атмосфере углекислого газа.
Воды из рек, озер и особенно грунтовые воды из колодцев обычно достаточно долго находились в контакте с карбонатсодержащими отложениями, чтобы их можно было нейтрализовать. Администраторы гидротехнических сооружений любят делать воду слегка щелочной и слегка перенасыщенной карбонатом кальция, чтобы поддерживать тонкий слой твердого карбоната на внутренней части трубы, который защищает ее от коррозии.
В случае с Flint, когда они переключили источники воды, они не смогли понять, что предыдущий источник добавлял в воду ингибитор фосфатной коррозии для создания защитного слоя внутри труб с питьевой водой.
Инженеры-экологи, а иногда и пользователи Gamry Instruments в исследованиях коррозии, были вызваны во Флинт. Исследователи проверили воду на загрязнение свинцом, и результаты были ошеломляющими. (Полный текст статьи « Как свинец попал в водопроводную воду Флинта » на веб-сайте C&EN)
В соответствующей статье от C&EN ученые обеспокоены воздействием свинца на детей из-за возможности возникновения когнитивных и поведенческих проблем. Узнайте больше о том, как, по мнению исследователей, токсичный металл связан с преступными деяниями, « Преступления свинца ».
Если вы исследователь, ищущий простую в использовании надежную систему, которая дает правильные ответы, электрохимические инструменты Gamry являются лидерами на рынке испытаний на коррозию. Провести тестирование ASTM легко со стандартным списком экспериментов Gamry. Использование нашего мастера последовательностей позволяет объединить эксперименты — нажмите «Пуск», а затем вернитесь, когда закончите. Узнайте больше о потенциостатах Gamry для защиты от коррозии, красок и покрытий.
* http: // chemwiki.ucdavis.edu/: Экономические аспекты коррозии намного важнее, чем думает большинство людей; ориентировочная стоимость коррозии только в США составила 276 миллиардов долларов в год. Из этой суммы около 121 миллиарда долларов было потрачено на борьбу с коррозией, а разница в 155 миллиардов долларов осталась чистой убытком для экономики. Источник изображения и некоторый контент благодаря Michiganradio.org.
Материаловедение: Учебники
Электрохимия 1
В этом разделе мы рассмотрим
- химические процессы коррозии,
- необходимые компоненты для защиты от коррозии
- электрохимическая серия (поясняется позже)
Коррозия металлов происходит за счет переноса электрона с участием двух процессы окисления и восстановления.При окислении атомы металла теряют электроны. Окружающая среда затем приобретает электроны с уменьшением .
Металл (или часть металлического предмета), на котором теряются электроны, — это назвал анод . Металл, жидкость или газ, который получает электронов называется катодом .
Обычно при коррозии атомы металла отдают электроны, чтобы стать положительно заряженных ионов, в реакции окисления:
M M n + + ne — (для металла M с n валентными электронами) | |
| Место, в котором происходит окисление, называется анодом. | |
Примеры: | Железо: Fe Fe 2+ + 2e — |
Электроны, генерируемые металлом, переносятся на другой материал.

