Химики СПбГУ с помощью компьютерной модели обнаружили возможности для более «зеленого» использования карбида кальция
Научная работа опубликована в журнале Королевского химического общества Chemical Science.
Карбид кальция известен человечеству уже более 150 лет — это твердое вещество желтовато-белого, бежевого или серого цвета, полученное в результате соединения кальция с углеродом. Сегодня карбид кальция используют для получения газообразного ацетилена, который широко применяется в промышленности — от производства уксусной кислоты и этилового спирта, до пластмассы, каучука и ракетных двигателей.
Углерод, необходимый для синтеза карбида кальция, добывается не оптимальным с точки зрения концепции устойчивого развития способом — в шахтах. В результате запасы ископаемого ресурса истощаются (не устойчивый подход), а над поверхностью земли растет количество углерода. «Мы работаем над стратегией углерод-нейтрального цикла производства. В частности, для получения карбида кальция можно использовать углерод, добываемый при термическом разложении (пиролизе) отходов, а полученное в результате вещество — применять в промышленности для создания новых соединений», — отметил Константин Родыгин, научный сотрудник лаборатории кластерного катализа СПбГУ.
Исследование было поддержано грантом СПбГУ и проводилось в рамках проекта по актуальной химии карбида кальция, которым занимается лаборатория кластерного катализа Университета при участии исследователей из Института органической химии имени Н. Д. Зелинского РАН. Значительная часть моделирования была проведена с помощью мощностей РЦ «Вычислительный центр» Научного парка СПбГУ.
«Главным вызовом для человечества сегодня является создание промышленных процессов нового поколения, позволяющих получать важнейшие органические соединения и материалы в рамках углерод-нейтрального подхода. Особое значение имеет замена ископаемых ресурсов на возобновляемые и решение таким образом экологических задач. Как было показано в наших работах, органический синтез на базе карбида кальция открывает новые возможности для реализации углерод-нейтральных технологий. Причем ключевое значение имеет понимание химических процессов трансформации карбидных частиц в химических процессах в растворе», — отметил руководитель лаборатории кластерного катализа СПбГУ, заведующий лабораторией металлокомплексных и наноразмерных катализаторов Института органической химии имени Н.
Предложить новую стратегию использования вещества химики смогли с помощью моделирования процессов, возникающих на уровне атомов и молекул при взаимодействии карбида кальция с водой и растворителем диметилсульфоксидом. Карбид кальция — это, по сути, соль, включающая отрицательно заряженные кислотные остатки ацетилена (так называемые ацетиленид-анионы с зарядом −2) и положительно заряженные ионы кальция. В работе исследовались кислотно-основные свойства ацетиленид-анионов, воды и некоторых других веществ в растворителе диметилсульфоксиде. В таком растворителе можно наблюдать необычную ситуацию: взаимодействие ацетиленид-анионов и воды, называемое гидролизом, идет не полностью. Образуются анионы с зарядом −1, которые потом могут вступать в широкий спектр ключевых для органического синтеза химических реакций.
«После проведения анализа выяснилось, что вместо воды можно использовать и другие протонирующие вещества для перевода ацетиленида в раствор, а в качестве растворителя для реакций с карбидом кальция можно искать альтернативные диметилсульфоксиду, еще менее токсичные и «зеленые» растворители», — рассказал соавтор статьи, ассистент Института химии СПбГУ Михаил Полынский.
Таким образом, производство с участием карбида кальция в перспективе может стать более «зеленым» не только из-за потенциально более безопасных способов добычи углерода, но и благодаря возможности карбида кальция вступать в реакции с менее токсичными растворителями.
Ассистент Института химии СПбГУ Михаил Полынский
Отметим, что одним из авторов статьи стала выпускница СПбГУ Мария Сапова, начавшая работу над проектом во время обучения в магистратуре. «Задача меня сразу привлекла: идея комбинации различных расчетных методов открывает большие возможности для моделирования сложных процессов, как, например, процесс растворения в нашем случае. Эта работа помогла не просто расширить кругозор, а выйти за рамки задач по моделированию кристаллов, которыми я занималась, и почувствовать границы применимости различных методов расчетной химии. Думаю, что такие сложные многоступенчатые подходы в моделировании должны развиваться дальше: это позволит нам приблизиться к описанию реальных экспериментов», — отметила Мария Сапова.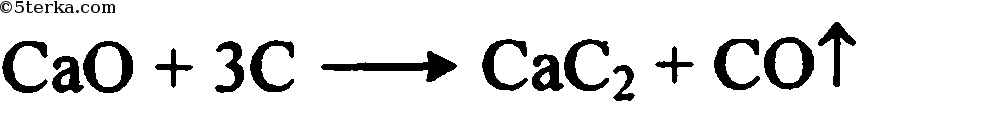
Как уточнил Михаил Полынский, работа на данном этапе — полностью теоретическая и заключалась в компьютерном моделировании процесса получения ацетиленидов из карбида кальция. «Для моделирования мы использовали так называемые квантово-химические методы, борн-оппенгеймеровскую молекулярную динамику. В результате такого моделирования можно сделать короткое молекулярное кино, показывающее, как выглядит движение атомов и молекул на очень коротких, пикосекундных временных интервалах», — заключил Михаил Полынский.
Карбид кальция в основном применяется в сварочных работах
Применение карбида кальция
Карбид кальция в основном применяется для сварочных работ. Это нестабильное соединение, которое распадается на открытом воздухе под воздействием молекул воды, входящими в состав газовой смеси.
Карбид очень легко воспламеняется с выделением огромного количества энергии, что может привести к взрыву. Поэтому его использование и хранение вблизи открытого источника огня крайне опасно. Все сварочные работы, проводимые часто с использованием карбида, лучше осуществлять в специально оборудованном помещении. Жизненно важно, чтобы там не хранились материалы, которые легко воспламеняются и горючие жидкости.
В результате химической реакции карбида с водой выделяется большое количество ацетилена. В помещении, где производится это вещество, должна быть учтена свободная циркуляция воздуха, для полного проветривания. Запрещено размещать подобные установки в подвальных помещениях.
Пыль карбида
Не менее опасна и пыль карбида. Она может вызывать очень серьезные реакции со стороны кожных покровов, поэтому при работе с этим материалом использование индивидуальных средств защиты является обязательным условием. Также защиты требуют глаза и слизистые оболочки рта и носа, поэтому необходимо надевать очки и защитную маску.
Также защиты требуют глаза и слизистые оболочки рта и носа, поэтому необходимо надевать очки и защитную маску.
После использования карбида, как топлива для сварочных работ, остается шлак. Он представляет собой известковый ил, который удаляется в специально приготовленные ямы и бункеры. Это соединение также очень легко воспламеняется, поэтому к его хранению и утилизации выдвигаются такие же высокие требования безопасности, как и к самому исходному веществу.
Несмотря на все возможные риски, карбид остается самым экономически обоснованным источником получения ацетилена. Выход газа может составить 250 м3 из одного килограмма. А один килограмм ацетилена выделяет 8 000 кДж в виде тепловой энергии.
 Карбид, который выпускает наша компания, имеет очень высокое качество и подходит для любого процесса, в котором его использование предусмотрено.
Карбид, который выпускает наша компания, имеет очень высокое качество и подходит для любого процесса, в котором его использование предусмотрено.Новости / Служба новостей ТПУ
Ученые Томского политехнического университета разработали новую технологию получения кубического карбида вольфрама высокой чистоты. Этот перспективный материал может заменить дорогие платиновые катализаторы для получения водородного топлива и тем самым снизить его стоимость. Результаты исследования опубликованы в журнале Journal of Alloys and Compounds (IF: 4,65; Q1). Подробнее о работе томских политехников рассказали журналисты федерального агентства РИА Новости.
Водород широко применяется в нефтепереработке и производстве удобрений. Кроме того, это перспективное экологичное топливо, которое при сгорании высвобождает большое количество энергии и образует воду без выделения каких-либо вредных газов. Преимущества использования водорода очевидны, однако для полномасштабного внедрения водородных технологий в энергетику ученым и инженерам предстоит решить еще много задач.
Перспективный материал для применения в этой сфере — кубический карбид вольфрама высокой чистоты. Его очень сложно получить в обычных условиях: для синтеза нужна температура около 3000°С и высокая скорость охлаждения. Коллективу ученых под руководством профессора отделения электроэнергетики и электротехники ТПУ Александра Сивкова удалось получить этот материал высокой чистоты (до 95 %) благодаря уникальной установке, разработанной в политехе.
Речь идет о коаксиальном магнитоплазменном ускорителе. Он позволяет достичь высокой температуры и стремительного охлаждения при помощи сверхбыстрых плазменных струй. В качестве исходных материалов используются доступные и относительно дешевые порошки вольфрама и технического углерода, которые предварительно помещаются в ускоритель. При истечении плазменной струи в рабочую камеру исходные порошки в ходе плазмохимической реакции превращаются в кубический карбид вольфрама.
При истечении плазменной струи в рабочую камеру исходные порошки в ходе плазмохимической реакции превращаются в кубический карбид вольфрама.
По словам доцента отделения электроэнергетики и электротехники ТПУ Ивана Шаненкова, особенности плазмодинамического синтеза (создание сверхбыстрых плазменных струй более 3 км/с, высокая скорость охлаждения, импульсный характер процесса длительностью менее 1 мс) позволяют формировать наноразмерные (менее 70 нм) частицы кубического карбида вольфрама в углеродных оболочках.
«Такие структуры успешно применяются в реакции получения водорода из воды посредством электрокатализа. Это позволит минимизировать использование редких и дорогостоящих благородных металлов платиновой группы», — рассказал Иван Шаненков.
Он отметил, что задачей синтеза композитных материалов на основе кубического карбида вольфрама занимаются несколько научных коллективов по всему миру. Разработка плазмодинамического метода синтеза позволила преодолеть большинство ограничений, связанных с возможностью получения этого материала. Ученые ТПУ совместно с исследователями из Цзилиньского университета и университета Циндао (Китай) подтвердили высокий потенциал применения материала для электрокаталитического получения водорода.
Ученые ТПУ совместно с исследователями из Цзилиньского университета и университета Циндао (Китай) подтвердили высокий потенциал применения материала для электрокаталитического получения водорода.
В ближайшем будущем ученые планируют научиться управлять характеристиками материала, чтобы еще больше повысить каталитическую активность материала и полностью отказаться от использования дорогостоящих благородных металлов.
Исследование выполнено при поддержке Российского научного фонда.
Напишите уравнение реакции взаимодействия с водой (гидролиза) карбида кальция СаС2. Назовите
Установите соответствие между описанием модели и её обозначением: для каждой позиции из первого столбца выберите соответствующую позицию из второго ст … олбца, обозначенную цифрой. ОПИСАНИЕ А) 3 атома кислорода Б) 3 молекулы озона В) молекула озона ОБОЗНАЧЕНИЕ 1) 3О3 2) 3О 3) 3О2 4) О3
Вариант 1
1. Четыре электрона в третьем электронном слое имеет атом:
1) алюминия 2) кальция 3) углерода 4) кремния
2. Степень окисления -3 возможна у
… элемента, имеющего электронное строение
1) 2, 8,7 2) 2,3 3) 2,5 4) 2,8,2
3. Степень окисления серы одинакова в ряду:
1) CuSO4,Cu2S, h3SO4 2) SO3, h3SO4, Na2SO3
3) SO3, Nh5HSO4 ,h3SO4 4) Al2S3,SO2,Na2SO3
4. Сила притяжения валентных электронов увеличивается в ряду:
1) B-Al и Si-P 3) B-Al и P-Si
2) Al-B и Si-P 4) Al-B и P-Si
5. Атом химического элемента с распределением электронов по уровням 2,1 образует с водородом связь
1) ионную 2) ковалентную неполярную
3) металлическую 4) ковалентную полярную
6. Расположены в порядке усиления металлических свойств элементы:
1) Rb-K-Na 2) Be-Mq-Ca 3) Be-B-Al 4) K-Ca-Mq
7. Формула высшего оксида хрома
1) ЭО2 2) Э2О3 3) Э2О7 4) ЭО3
8. Оксид углерода (4) взаимодействует с каждым из двух веществ:
1) гидроксид калия, хлороводород
2) оксид кальция, гидроксид калия
3) гидроксид натрия, серная кислота
4) гидроксид бария, азотная кислота
9. Щелочь образуется при взаимодействии с водой:
1) бария 2) алюминия 3) железа 4) бериллия
10.
Степень окисления -3 возможна у
… элемента, имеющего электронное строение
1) 2, 8,7 2) 2,3 3) 2,5 4) 2,8,2
3. Степень окисления серы одинакова в ряду:
1) CuSO4,Cu2S, h3SO4 2) SO3, h3SO4, Na2SO3
3) SO3, Nh5HSO4 ,h3SO4 4) Al2S3,SO2,Na2SO3
4. Сила притяжения валентных электронов увеличивается в ряду:
1) B-Al и Si-P 3) B-Al и P-Si
2) Al-B и Si-P 4) Al-B и P-Si
5. Атом химического элемента с распределением электронов по уровням 2,1 образует с водородом связь
1) ионную 2) ковалентную неполярную
3) металлическую 4) ковалентную полярную
6. Расположены в порядке усиления металлических свойств элементы:
1) Rb-K-Na 2) Be-Mq-Ca 3) Be-B-Al 4) K-Ca-Mq
7. Формула высшего оксида хрома
1) ЭО2 2) Э2О3 3) Э2О7 4) ЭО3
8. Оксид углерода (4) взаимодействует с каждым из двух веществ:
1) гидроксид калия, хлороводород
2) оксид кальция, гидроксид калия
3) гидроксид натрия, серная кислота
4) гидроксид бария, азотная кислота
9. Щелочь образуется при взаимодействии с водой:
1) бария 2) алюминия 3) железа 4) бериллия
10. Окислительно-восстановительной реакции соответствует уравнение:
1) 2NaOH+h3SO4=Na2SO4+2h3O 2) CaCO3=CaO+CO2
3) MqO+SiO2=MqSiO3 4) 2h3O=2h3+O2
11. Разбавленная серная кислота реагирует с каждым веществом ряда:
1) BaCl2,CO2, KOH 2)ZnO, Ca, NaOH
3) Co, Zn(OH)2,Mq 4) Aq, Ba(OH)2,K2SO3
12. Сера является окислителем в реакции:
1) h3+S=h3S 2) h3O+SO3=h3SO4
3) 2SO2+O2=2SO3 4) MqO+SO2=MqSO3
13. Сокращенное ионное уравнение Н+ +ОН- =Н2О соответствует реакции
1) гидроксид натрия и хлорид аммония 2) гидроксид цинка и соляная кислота
3) гидроксид калия и соляная кислота 4) гидроксид бария и серная кислота
14. Гидроксид натрия реагирует в растворе с каждым из двух веществ ряда:
1) Са(ОН)2, НСl 2) NaNO3,CuCl2 3) MqO, h3SO4 4) Nh5Cl, CO2
15. Сумма коэффициентов в реакции железа с соляной кислотой
1) 4 2) 5 3) 3 4) 2
16. И с хлором , и гидроксидом натрия может реагировать в растворе вещество:
1) KI 2) ZnBr2 3) Fe2(SO4)3 4) CuF2
+X +Y
17. В схеме превращений NaOH- ——— Na2CO3————-NaCl
веществами Х и У соответственно являются:
1) K2CO3, HCl 2) CO2, KCl 3) K2CO3, KCl 4) CO2, HCl
В1.
Окислительно-восстановительной реакции соответствует уравнение:
1) 2NaOH+h3SO4=Na2SO4+2h3O 2) CaCO3=CaO+CO2
3) MqO+SiO2=MqSiO3 4) 2h3O=2h3+O2
11. Разбавленная серная кислота реагирует с каждым веществом ряда:
1) BaCl2,CO2, KOH 2)ZnO, Ca, NaOH
3) Co, Zn(OH)2,Mq 4) Aq, Ba(OH)2,K2SO3
12. Сера является окислителем в реакции:
1) h3+S=h3S 2) h3O+SO3=h3SO4
3) 2SO2+O2=2SO3 4) MqO+SO2=MqSO3
13. Сокращенное ионное уравнение Н+ +ОН- =Н2О соответствует реакции
1) гидроксид натрия и хлорид аммония 2) гидроксид цинка и соляная кислота
3) гидроксид калия и соляная кислота 4) гидроксид бария и серная кислота
14. Гидроксид натрия реагирует в растворе с каждым из двух веществ ряда:
1) Са(ОН)2, НСl 2) NaNO3,CuCl2 3) MqO, h3SO4 4) Nh5Cl, CO2
15. Сумма коэффициентов в реакции железа с соляной кислотой
1) 4 2) 5 3) 3 4) 2
16. И с хлором , и гидроксидом натрия может реагировать в растворе вещество:
1) KI 2) ZnBr2 3) Fe2(SO4)3 4) CuF2
+X +Y
17. В схеме превращений NaOH- ——— Na2CO3————-NaCl
веществами Х и У соответственно являются:
1) K2CO3, HCl 2) CO2, KCl 3) K2CO3, KCl 4) CO2, HCl
В1. Установите соответствие
Тип реакции Схема реакции
А. соединения
Б.обмена
В.разложения
Г.замещения 1.h3SO4+ Mq=MqSO4+h3
2.CaCO3=CaO+CO2
3.2h3S+3O2=2SO2+2h3O
4.C+2h3=Ch5
5.MqCl2+Na2CO3=MqCO3+2NaCl
A Б В Г
В2. Установите соответствие
Формула вещества Класс соединений
А.K2CO3
Б.Al2O3
В.h3S
Г.Ba(OH)2 1. основный оксид
2.амфотерный оксид
3.кислотный оксид
4.основание
5.амфотерный гидроксид
6.кислота
7.соль
A Б В Г
Установите соответствие
Тип реакции Схема реакции
А. соединения
Б.обмена
В.разложения
Г.замещения 1.h3SO4+ Mq=MqSO4+h3
2.CaCO3=CaO+CO2
3.2h3S+3O2=2SO2+2h3O
4.C+2h3=Ch5
5.MqCl2+Na2CO3=MqCO3+2NaCl
A Б В Г
В2. Установите соответствие
Формула вещества Класс соединений
А.K2CO3
Б.Al2O3
В.h3S
Г.Ba(OH)2 1. основный оксид
2.амфотерный оксид
3.кислотный оксид
4.основание
5.амфотерный гидроксид
6.кислота
7.соль
A Б В Г
для следующих веществ укажи по одной области применения: дистиллированная вода, физ.раствор, уксус,рассол
Дописать уравнения реакций до конца, составить полное ионное и сокращённое ионное уравнения для следующих веществ: А) нитрат магния (II) и гидроксид к … алия Б) сульфид калия и азотная кислота
В 3-х пробирках находятся соли катионов II аналитической группы Ba2+, Ca2+, Sr2+ имеется соляная и уксусная кислоты. Какой еще необходим реактив, чт … обы определить в какой катион находится в какой пробирке.
Даны 2 пробирки с растворами солей. В одной из них соль Fe3+, в другой Fe2+. Определить с помощью характерных реакций эти соли.
В одной из них соль Fe3+, в другой Fe2+. Определить с помощью характерных реакций эти соли.
Что называют химической коррозией металлов? Напишите уравнения реакций следующих превращений:
а) Fe → Fe(OH)2 → Fe(OH)3 б) S → SO2 → h3SO3
в) C → CO2
… → h3CO3 г)N2→NO→NO2 →HNO3
2. Расскажите об использовании оцинкованного железа. Какой металл – железо или цинк – является более активным? Какой из металлов имеет более инертную оксидную пленку? Продолжает ли цинк защищать железо от коррозии после нарушения целостности слоя цинка?
3. Перечислите основные способы защиты металлов от коррозии. Расскажите о применении защитных покрытий.
4. Химическую коррозию вызывают: вода и кислород; оксиды углерода и серы; растворы солей; все перечисленные факторы. Свой ответ поясните.
5. Наиболее активно коррозирует: техническое железо; железо, покрытое слоем никеля; химически чистое железо; нержавеющая сталь. Свой ответ поясните.
6. Изделие из алюминия лучше всего скреплять заклепками, сделанными из: железа; меди; магния; алюминия. Свой ответ поясните
Свой ответ поясните
Составить уравнения реакций:1) натрий + фосфорная кислота2) алюминий + серная кислота3) гидроксид меди(II) + азотная кислота4) оксид железа (III) + со … ляная кислота5) магний + кислород6) Магний + хлор
суммативное оценивание по единице обучения «Чистые вещества и смеси в повседневной жизни» Помогите пожалуйста
ПОМОГИТЕ ПОЖАЛУЙСТА!!!!!!!! Обчисліть масу вуглецю (С), необхідного для відновлення цинк оксиду масою 3,24г, якщо одним із продуктів цієї реакції є Ка … рбон(ІІ) оксид
| Вещество или материал | Результат воздействия воды |
| Азид свинца | Нестоек, взрывается при увеличении влажности до 30% |
| Алюминий металлический | При горении разлагает воду на водород и кислород |
| Битум | Подача компактных струй воды ведет к выбросу и усилению горения |
| Гидраты щелочных и щелочноземельных металлов | Реагируют с водой с выделением водорода |
| Железо кремнистое (ферросилиций) | Выделяется фтористый водород, самовоспламеняющийся на воздухе |
| Кальций фосфористый | Реагируют с водой с выделением самовоспламеняющегося на воздухе фосфористого водорода |
| Кальция перекись | Разлагается в воде с выделением кислорода |
|
Карбид алюминия Карбид бария Карбид кальция Карбиды щелочных металлов |
Разлагаются с водой с выделением горючих газов, при контакте с водой взрываются |
| Кислота азотная | Экзотермическая реакция |
| Кислота серная | Экзотермическая реакция |
| Кислота соляная | Экзотермическая реакция |
| Магний и его сплавы | При горении разлагают воду на водород и кислород |
|
Натрий водородистый Натрий металлический |
Реагируют с водой с выделением водорода |
| Натрий гидросернокислый | Сильно разогревается, может вызвать возгорание горючих материалов |
|
Натрий перекись Калий перекись |
При попадании воды возможен взрывообразный выброс и усиление горения |
| Натрий сернистый |
Сильно разогревается (свыше 400 град. С), может вызвать возгорание горючих веществ, при попадании на кожу вызывает ожог, сопровождающийся трудно заживающими язвами С), может вызвать возгорание горючих веществ, при попадании на кожу вызывает ожог, сопровождающийся трудно заживающими язвами
|
| Негашеная известь | Реагирует с водой, выделяя большое количество тепла |
| Нитроглицерин | Взрывается от удара струи воды |
| Петролатум | Подача компактных струй может привести к выбросу и усилению горения |
| Рубидий металлический | Реагирует с водой с выделением водорода |
| Селитра л | Подача струй воды в расплав селитры ведет к сильному взрывообразному выбросу и усилению горения |
| Серный ангидрид | При попадании воды возможен взрывообразный выброс |
| Сесквилхлорид | Взаимодействие с водой происходит со взрывом |
| Силаны | Реагируют с водой с выделением самовоспламеняющегося на воздухе водородистого кремния |
|
Термит Титан и его сплавы Титан четыреххлористый |
Реагируют с водой с выделением большого количества тепла |
|
Триэтилалюминий Хлорсульфиновая кислота |
Реагируют с водой со взрывом |
| Цинковая пыль | Разлагает воду на водород и кислород |
Щелочные металлы (натрий, калий, кальций, цезий и др. ) )
|
Выделяют водород, который воспламеняется от тепла реакций |
Астрономы: вода создаёт алмазные планеты
В космосе могут существовать планеты, в значительной части состоящие из алмазов. Драгоценный минерал образуется там благодаря обычной воде. Такой вывод сделан в научной статье, опубликованной в издании Planetary Science Journal.
Астрономы давно знают, что некоторые звёзды гораздо богаче углеродом, чем Солнце. Между тем светило и его планеты образуются из одного и того же материала.
Значит, экзопланеты в таких системах весьма богаты углеродом. Он может существовать там как в составе химических соединений, так и в самородной форме, то есть в виде графита и алмазов. Поэтому такие планеты часто называют алмазными, хотя, конечно, подобное небесное тело не представляет собой один огромный драгоценный камень.
Раньше планетологи только предполагали, что эти миры будут богаты алмазами. Теперь же они раскрыли химический механизм, который должен приводить к образованию драгоценных кристаллов. Более того, эксперты заключили, что на определённой глубине алмаз должен стать одним из основных компонентов мантии планеты.
Теперь же они раскрыли химический механизм, который должен приводить к образованию драгоценных кристаллов. Более того, эксперты заключили, что на определённой глубине алмаз должен стать одним из основных компонентов мантии планеты.
Самородный углерод в виде алмазов может быть одним из основных компонентов мантии некоторых планет.
Поясним. Один из самых распространённых в коре и мантии Земли элементов – кремний. Он присутствует в виде кремнезёма (SiO2) и силикатов (соединений металлов с группой -SiO4). На «углеродных» же планетах одним из основных соединений должен быть карбид кремния (SiC).
С другой стороны, внутри Земли очень много воды. В коре, мантии и ядре планеты может скрываться до 90 мировых океанов. И земной шар не уникален в этом отношении: по некоторым расчётам, при формировании скалистых планет в их недрах неизбежно образуются большие массы воды.
Учёные из США предположили, что на определённой глубине карбид кремния такой планеты должен вступить в реакцию с водой с образованием чистого углерода, кремнезёма и газообразного водорода: SiC + 2H2O = SiO2 + C + 2H2. С учётом огромного давления и температуры углерод в таких условиях будет превращаться в алмазы.
С учётом огромного давления и температуры углерод в таких условиях будет превращаться в алмазы.
Чтобы проверить эту гипотезу, исследователи провели эксперимент. Они использовали алмазные наковальни, чтобы оказать на образцы давление в 500 тысяч атмосфер. При этом вещества нагревались лазером до 2200 градусов Цельсия. Спрогнозированная специалистами реакция действительно произошла.
Впрочем, окончательное подтверждение, что алмазные планеты действительно существуют должно прийти из астрономических наблюдений, а не физических экспериментов. Авторы подчёркивают, что подобные миры будут отличаться по плотности от обычных «неуглеродных» тел типа Земли. Если измерить с достаточной точностью массу и радиус экзопланеты, можно будет выяснить, скрывают ли её недра в буквальном смысле неземные сокровища.
К слову, ранее Вести.Ru рассказывали о воссоздании в лаборатории алмазных дождей из недр планет-гигантов. Писали мы и о мирах, богатых сапфирами и рубинами.
ХиМиК.ru — КАРБИДЫ — Химическая энциклопедия
КАРБИДЫ (от лат. carbo — уголь), соед. углерода с металлами, а также с бором и кремнием. По типу хим. связи карбиды делят на ионные (солеобразные), ковалентные и металлоподобные (ионно-ковалентно-металлические). Ионные карбиды (см. табл. 1) образуют металлы I и II гр. (соотв. М2С2 и МС2), РЗЭ и актиноиды (МС, М2С3, МС2), а также Аl. В этих соед. атом С в зависимости от типа гибридизации (sp3, sp2 или sp) образует ионы С4-, (C=C4-, (С=С=С)4-, (C=C)2-. Ковалентные карбиды (см. табл. 2) образуют В и Si; атом С в этих соед. находится в состоянии sp-, sp2— и sp3-гибридизации. Металлoподобные карбиды образуют переходные металлы IV-VII гр., Со, Ni и Fe. В этих карбидах связь металл-углерод ионно-ковалентная, причем атом С отрицательно заряжен, связь металл — металл чисто металлическая, атомы С между собой не связаны.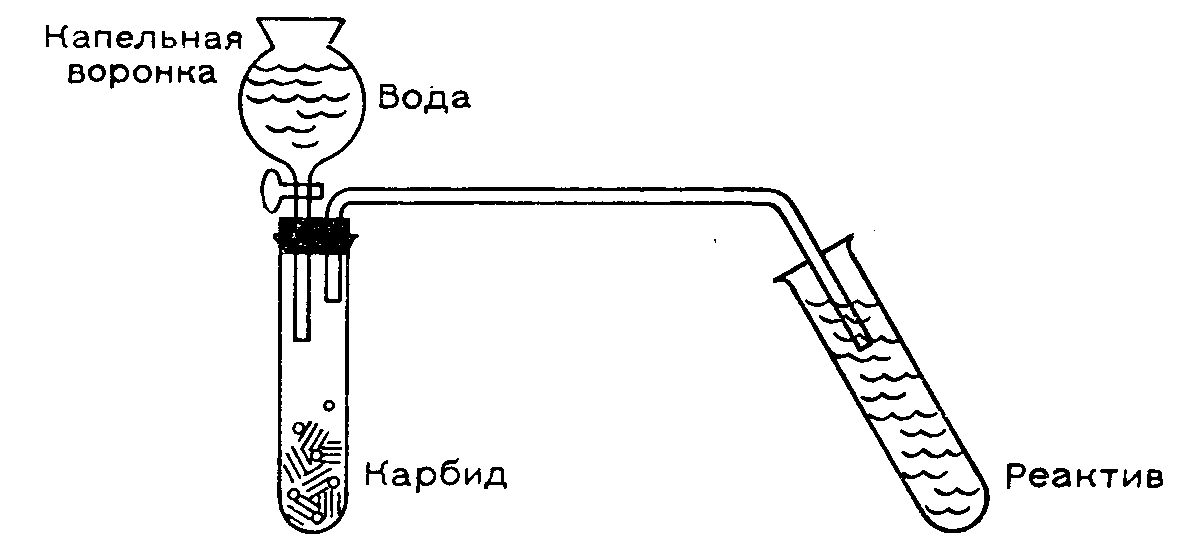
Карбиды щелочных металлов кристаллизуются в решетках типа графита, атомы металлов размещаются между углеродными слоями, построенными из гексагoн. сеток. Карбиды щел.-зем. металлов кристаллизуются в гранецентрир. тетрагон. решетке типа СаС2, карбиды РЗЭ, монокарбиды актиноидов и переходных металлов в гранецентрир. кубической типа NaCl, сесквикарбиды актиноидов М2С3 в объемноцентрир. кубич. решетке типа Рu2С3. Ионные карбиды щелочных металлов разлагаются при т-ре ок. 800 °С, карбиды щел.-зем. металлов в интервале 1800-2300°С, ковалентные карбиды и металлоподобные разлагаются и плавятся при более высоких т-рах. В периодич. системе в пределах группы т-ры плавления карбидов возрастают с увеличением порядкового номера металла и обычно в 1,5-2 раза выше, чем т-ры плавления соответствующих металлов. Это обусловлено высокой прочностью связи М-С. Металлоподобные карбиды обладают металлич. проводимостью, для них характерен положит.
 температурный коэф. r. Для сесквикарбидов величина r (достигает 500 мкОм.см) примерно на порядок выше, чем для дикарбидов и монокарбидов (20-50 мкОм.см). Дикарбиды РЗЭ также обладают
металлич. св-вами. Карбиды В и Si, а также Be, Mg и Аl — полупроводники.
Мех. св-ва карбидов зависят от прочности хим. связи, степени ее ковалентности и межатомного расстояния. наиб. высокой твердостью обладают карбиды В, Si, Be, а также монокарбиды РЗЭ и переходных металлов; твердость последних уменьшается при переходе от карбидов подгруппы IVа к карбидам подгруппы VIa. Все карбиды при комнатной т-ре — хрупкие в-ва, их пластич. деформация возможна в условиях всестороннего сжатия при очень высоких напряжениях.
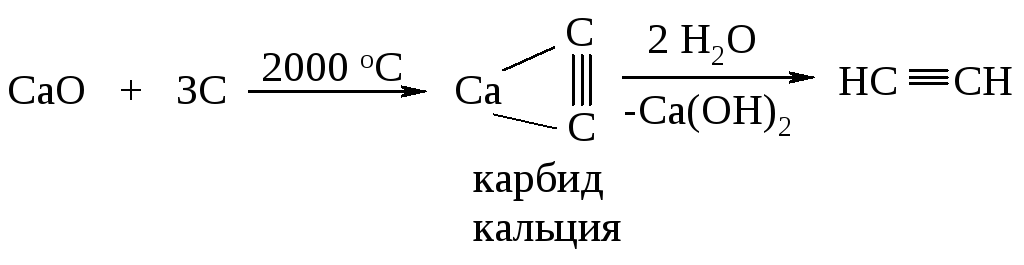
Ионные карбиды разлагаются водой с образованием метана, ацетилена, метилацетилена или смеси углеводородов и гидроксида металла, напр.:
температурный коэф. r. Для сесквикарбидов величина r (достигает 500 мкОм.см) примерно на порядок выше, чем для дикарбидов и монокарбидов (20-50 мкОм.см). Дикарбиды РЗЭ также обладают
металлич. св-вами. Карбиды В и Si, а также Be, Mg и Аl — полупроводники.
Мех. св-ва карбидов зависят от прочности хим. связи, степени ее ковалентности и межатомного расстояния. наиб. высокой твердостью обладают карбиды В, Si, Be, а также монокарбиды РЗЭ и переходных металлов; твердость последних уменьшается при переходе от карбидов подгруппы IVа к карбидам подгруппы VIa. Все карбиды при комнатной т-ре — хрупкие в-ва, их пластич. деформация возможна в условиях всестороннего сжатия при очень высоких напряжениях.
Ионные карбиды разлагаются водой с образованием метана, ацетилена, метилацетилена или смеси углеводородов и гидроксида металла, напр.:Аl4С3 + 12Н2О : 4Аl(ОН)3 + 3СН4;
Na2C2 + 2Н2О : 2NaOH + С2Н2;
Mg2C3 + 4Н2О : 2Mg(OH)2 + С3Н4.
Ковалентные и металлоподобные карбиды не разлагаются водой и большинством минер. к-т и щелочей.
Получают карбиды из элементов, восстановлением оксидов металлов, газофазным способом, металлотермически. Синтез из элементов осуществляют при высоких т-рах в вакууме или инертной атмосфере. В зависимости от технол. параметров процесса образуются порошки с размером частиц от 0,5 мкм до 2 мм. Синтез может осуществляться в режиме горения, т. к. в результате р-ции выделяется большое кол-во тепла, либо в плазме при 5000-10000 К в дуговых, высокочастотных и сверхчастотных плазмотронах. В результате быстрого охлаждения из парогазовой смеси элементов в плазмообразующем газе (Аr или Не) образуются ультрадисперсные порошки с размерами частиц 10-100 нм.
Восстановлением оксидов металлов производят наиб. важные соед. — бора карбиды, кремния карбиды, а также вольфрама карбиды, титана карбид и др. Карбиды переходных металлов. Газофазным способом получают карбиды из хим. соед., к-рые испаряются, разлагаются, а затем восстанавливаются и взаимод. друг с другом, напр.:
друг с другом, напр.:
2МСl + 2ССl4 + 5Н2: 2МС + 10НСl.
Чаще всего этот синтез осуществляют в плазме, получая дисперсные порошки. По металлотермич. способу оксиды металлов восстанавливают металлами (Mg, Al или Са) в присут. углерода, напр.:
МО + С + Мg : МС + МgО.
Особо чистые карбиды, не содержащие кислорода и азота, синтезируют взаимод. С и металла в расплаве др. металла или сплава, напр. TiC получают в сплаве Fe Ni.
Из ионных карбидов наиб. важен кальция карбид СаС2, из ковалентных В4С и SiC. Металлоподобные карбиды упрочняют чугун и сталь [Fe3C, (Fe,Cr)3C, Fe2W2C, (Fe,Cr,Mo)23C6], они являются основой твердых вольфрама сплавов (WC, TiC, WC, TiC, TaC, WC) и др. твердых сплавов (TiC, VC, Сr3С2, ТаС), используемых для обработки металлов резанием. Карбиды применяют также как восстановители, раскислители и катализаторы, они входят в состав жаропрочных и жаростойких композиционных материалов, в т. ч. керметов.
ч. керметов.
===
Исп. литература для статьи «КАРБИДЫ»: Стормс Э., Тугоплавкие карбиды, пер. с англ., М., 1970; Гольдшмидт X., Сплавы внедрения, пер. с англ., в. 1-2, М, 1971, Тот Л., Карбиды и нитриды переходных металлов, пер. с англ., М, 1974. Самсонов Г. В., Упадхая Г. Ш., Нешпор В. С., Физическое материаловедение карбидов, К., 1974, Высокотемпературные карбиды, под ред. Г. В. Самсонова, К, 1975, Карбиды и сплавы на их основе, под ред. Г. В. Самсонова, К, 1976, Свойства, получение и применение тугоплавких соединений, Справочник, под ред. Т. Я. Косолаповой. М, 1986, П. С. Кислый.
Страница «КАРБИДЫ» подготовлена по материалам химической энциклопедии.
Переработка топлива для реакторов из карбида урана. I. Реакция с водой и HCl
Версия PDF также доступна для скачивания.
Кто
Люди и организации, связанные либо с созданием этого отчета, либо с его содержанием.
Какие
Описательная информация, помогающая идентифицировать этот отчет.Перейдите по ссылкам ниже, чтобы найти похожие предметы в Электронной библиотеке.
Когда
Даты и периоды времени, связанные с этим отчетом.
Статистика использования
Когда последний раз использовался этот отчет?
Взаимодействовать с этим отчетом
Вот несколько советов, что делать дальше.
Версия PDF также доступна для скачивания.
Ссылки, права, повторное использование
Международная структура взаимодействия изображений
Распечатать / Поделиться
Печать
Электронная почта
Twitter
Facebook
Tumblr
Reddit
Ссылки для роботов
Полезные ссылки в машиночитаемых форматах.
Ключ архивных ресурсов (ARK)
Международная структура взаимодействия изображений (IIIF)
Форматы метаданных
Изображений
URL
Статистика
Брэдли, М.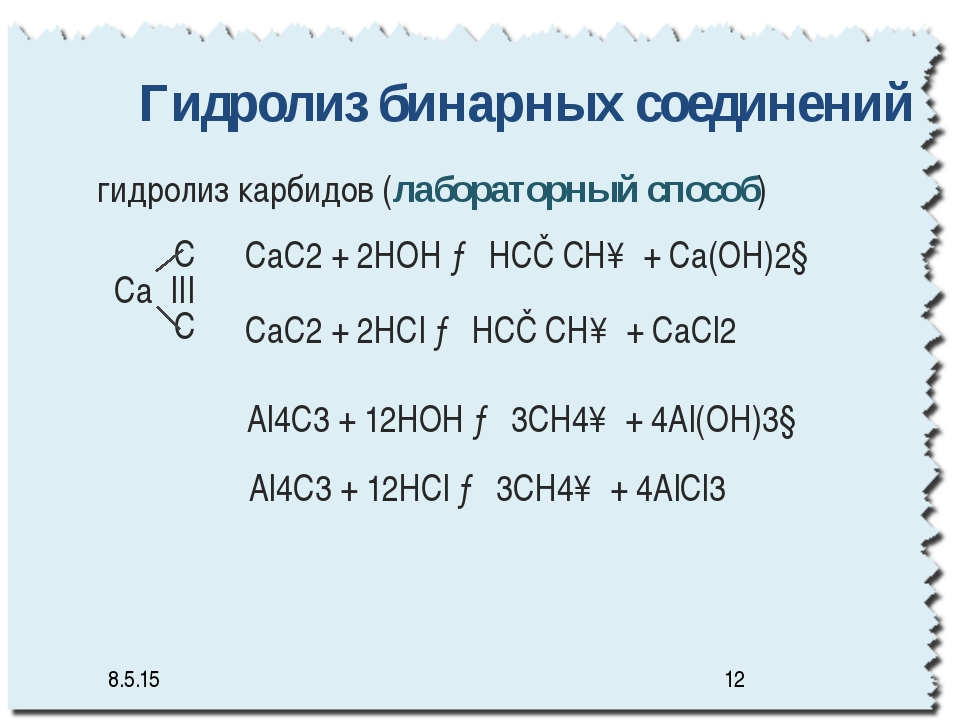 Дж. И Феррис, Л. М. Переработка топлива для реакторов на основе карбида урана. I. Реакция с водой и HCl,
отчет,
15 августа 1961 г .;
Теннесси.
(https://digital.library.unt.edu/ark:/67531/metadc868999/:
по состоянию на 9 мая 2021 г.), Библиотеки Университета Северного Техаса, Цифровая библиотека UNT, https://digital.library.unt.edu; кредитование Департамента государственных документов библиотек ЕНТ.
Дж. И Феррис, Л. М. Переработка топлива для реакторов на основе карбида урана. I. Реакция с водой и HCl,
отчет,
15 августа 1961 г .;
Теннесси.
(https://digital.library.unt.edu/ark:/67531/metadc868999/:
по состоянию на 9 мая 2021 г.), Библиотеки Университета Северного Техаса, Цифровая библиотека UNT, https://digital.library.unt.edu; кредитование Департамента государственных документов библиотек ЕНТ.
(PDF) Исследование концепции использования карбида кальция в качестве источника энергии для транспортировки с морского дна
278 Новые тенденции в технологии производства — Том 1, выпуск 1, 2018 г.
фаза и (g) — вещество в газе фаза.Значения Hn были определены авторами
самостоятельно на основе химических таблиц (Mizerski, 2013) в связи с тем, что эти значения
существенно различались в разных публикациях.
(2)
Один из продуктов указанной реакции — гидроксид кальция (гашеная известь, известковая известь)
Ca (OH) 2. Это неорганическое химическое соединение кальция из группы гидроксидов.Это
Это неорганическое химическое соединение кальция из группы гидроксидов.Это
, который характеризуется плохой растворимостью в воде (около 1,3 г / дм³ при 20 ° C). Водный раствор гидроксида кальция
, который является сильным основанием (pH около 12), вызывает коррозию и носит разговорный термин
«известняковая вода». Он используется, среди прочего, для обнаружения углекислого газа в присутствии
, раствор которого становится мутным из-за осаждения карбоната кальция.
Гидроксид кальция широко применяется в технике.Для раскисления почв он используется в сухом состоянии
, а его водный раствор («известковое молоко») используется как компонент раствора, для окраски
и в химических процессах. Он образует «липовый пирог» с небольшим количеством воды. Также используется
в стоматологии в качестве компонента стоматологического цемента (https: //pubchem.ncbi. Nlm.nih.gov/
соединение / 6093208).
Однако процесс реакции карбида кальция CaC2 с водой h3O может протекать, как полагают авторы
, по другому пути, показанному зависимостью (3). В реакции
В реакции
также образуется, как и в реакции (2), C2h3-ацетилен и оксид кальция CaO. Энергия этой реакции
составляет h3 = -58,07 кДж / моль, что составляет около 47% энергии, полученной в реакции (2)
(3)
Согласно второму закону термодинамики в спонтанных процессах, система
становится беспорядочной и является необходимым условием для спонтанная реакция — это отрицательное значение
свободной реакции G, то есть, если система способна работать, произойдет преобразование
и внутренняя энергия системы уменьшится (Smith, 1990).Этому условию
(необходимое условие) отвечает реакция (2), для которой G = -87,5 кДж / моль (Mizerski, 2013)
, определенная на основе соотношения (3a), является значением меньше нуля.
(3a)
Кроме того, определение энтропии реакции S = 98. 77 Дж / (моль К) (Mizerski, 2013;
77 Дж / (моль К) (Mizerski, 2013;
Smith, 1990) согласно соотношению (3b), мы можем определить, что анализируемая реакция
является спонтанной, поскольку она удовлетворяет условиям: H <0; T ∙ S> 0; направление процесса —
изменение G (H, T, S) = H — T ∙ S (Smith, 1990) меньше нуля. Где T определяет температуру преобразования
в К. Это значение не указывается, потому что независимо от его значения критерий
удовлетворяется.
∙
∙
∙
∙ (3b)
Оксид кальция (известь), образующийся в реакции (3b) CaO, представляет собой неорганическое химическое соединение
, принадлежащее к группе основных оксидов, содержащих кальций на втором степень окисления и составляет
белое мелкокристаллическое тело при комнатной температуре. Он широко используется в строительстве, например, для изготовления растворов
Он широко используется в строительстве, например, для изготовления растворов
, в стекольной и керамической промышленности и в металлургии. Используется как инсектицид
(инсектицид). В сельском хозяйстве его используют как удобрение для повышения pH почвы. Он также
используется в одном из методов карбида (1). В лабораториях он используется в качестве дегидратирующего агента и используется для получения аммиака
(Morrison, Boyd 1997; https://pubchem.ncbi.nlm.nih.gov/compound/
14778).
Оксид кальция обладает гигроскопичными свойствами. Он резко связывается с водой с образованием гидроксида кальция
с выделением тепла. Эту реакцию можно представить в (4). Тепло, выделяемое при этом
, составляет h4 = -65,17 кДж / моль. Оказывается, что h2 согласно закону Гесса
(Bielański, 2002; Morrison, Boyd, 1997) (теплота химической реакции, протекающей в постоянном объеме
или под постоянным давлением, не зависит от пути реакции, а только на начальном и конечном состоянии
) в точности равна сумме энергии h3 + h4, выделенной в реакциях (3
, и 4). Отсюда следует, что процесс разложения карбида может протекать в соответствии с уравнением
Отсюда следует, что процесс разложения карбида может протекать в соответствии с уравнением
Реакции воды и молекул C1 на карбидных и модифицированных металлами карбидных поверхностях (Журнальная статья)
Ван, Вейминг, Тэкетт, Брайан М. и Чен, Джинггуанг Дж. Реакции воды и молекул С1 на карбидных и модифицированных металлами карбидных поверхностях . США: Н. П., 2017.
Интернет. DOI: 10.1039 / C6CS00862C.
Ван, Вейминг, Тэкетт, Брайан М., & Chen, Jingguang G. Реакции воды и молекул C1 на карбидных и модифицированных металлами карбидных поверхностях . Соединенные Штаты. https://doi.org/10.1039/C6CS00862C
Ван, Вейминг, Тэкетт, Брайан М. и Чен, Цзингуан Г. Чт.
«Реакции воды и молекул C1 на карбидных и металл-модифицированных карбидных поверхностях». Соединенные Штаты. https://doi.org/10.1039 / C6CS00862C. https://www.osti.gov/servlets/purl/1434771.
Соединенные Штаты. https://doi.org/10.1039 / C6CS00862C. https://www.osti.gov/servlets/purl/1434771.
@article {osti_1434771,
title = {Реакции воды и молекул C1 на карбидных и модифицированных металлами карбидных поверхностях},
author = {Ван, Вейминг и Тэкетт, Брайан М. и Чен, Цзингуан Г.},
abstractNote = {Образование карбидов может значительно изменить физические и химические свойства основных металлов.В текущем обзоре мы суммируем общие тенденции реакций воды и молекул C1 над карбидом переходных металлов (TMC) и поверхностями и тонкими пленками TMC, модифицированными металлами. Хотя основное внимание в настоящем обзоре уделяется теоретическим и экспериментальным исследованиям реакций молекул C1 (CO, CO2, Ch4OH и т. Д.), Также будут рассмотрены реакции воды, поскольку вода играет важную роль во многих молекулах C1. реакции трансформации. Этот обзор организован путем отдельного обсуждения термических реакций и электрохимических реакций, что дает представление о применении ТМС в гетерогенном катализе и электрокатализе соответственно. В термических реакциях мы обсуждаем термическое разложение воды и метанола, а также реакции CO и CO2 на поверхностях TMC. В области электрохимических реакций мы обобщаем недавние исследования реакции выделения водорода, электроокисления метанола и CO и электровосстановления CO2. Наконец, также обсуждаются возможности будущих исследований и проблемы, связанные с использованием ТМС в качестве катализаторов и электрокатализаторов.},
В термических реакциях мы обсуждаем термическое разложение воды и метанола, а также реакции CO и CO2 на поверхностях TMC. В области электрохимических реакций мы обобщаем недавние исследования реакции выделения водорода, электроокисления метанола и CO и электровосстановления CO2. Наконец, также обсуждаются возможности будущих исследований и проблемы, связанные с использованием ТМС в качестве катализаторов и электрокатализаторов.},
doi = {10.1039 / C6CS00862C},
url = {https: // www.osti.gov/biblio/1434771},
journal = {Обзоры химического общества},
issn = {0306-0012},
число = 7,
объем = 46,
place = {United States},
год = {2017},
месяц = {2}
}
: Карбид кальция
Серия записных книжек с химическими данными: Карбид кальция
ОПАСНЫЕ МАТЕРИАЛЫ
Сам по себе карбид кальция имеет только одну опасность: он вызывает коррозию. Однако, когда карбид кальция контактирует с водой, происходит очень быстрая химическая реакция — выделяется газообразный ацетилен. Это реальная опасность, связанная с карбидом кальция, потому что под давлением ацетилен взорвется.
Однако, когда карбид кальция контактирует с водой, происходит очень быстрая химическая реакция — выделяется газообразный ацетилен. Это реальная опасность, связанная с карбидом кальция, потому что под давлением ацетилен взорвется.
Есть много других названий карбида кальция, включая ацетиленоген, ацетилид кальция, дикарбид кальция, карбид и этин (производное кальция). Химическая формула карбида кальция — CaC 2 . Его молекулярная масса 64.
Его обозначение ООН / NA — 1402, его STCC (Стандартный код транспортных товаров) — 4916408, его номер CAS (Химические реферативные услуги) — 75-20-7, и его RTECS (Реестр токсических эффектов химических веществ) или NIOSH ( Национальный институт безопасности и гигиены труда) обозначение EV9400000.Система 704 NFPA классифицирует карбид кальция как 1-4-2-W, Министерство транспорта США классифицирует его как «легковоспламеняющееся твердое вещество, опасное во влажном состоянии», а Международная морская организация классифицирует его как легковоспламеняющееся твердое вещество 4,3. Обычно он имеет чистоту примерно 75%. Остальное — оксид кальция (известь).
Обычно он имеет чистоту примерно 75%. Остальное — оксид кальция (известь).
Недвижимость
Карбид кальция существует в виде порошка или комков и обладает слабой коррозионной активностью. Имеет слабый запах, похожий на запах чеснока.
Карбид кальция с удельным весом 2,22 тонет в воде. Он начнет реагировать при первом контакте с водой, но недостаточно быстро, чтобы не утонуть.
Несмотря на то, что это стабильное химическое вещество, карбид кальция бурно реагирует с некоторыми другими химическими веществами, включая кислоты, щелочи, фторид свинца, магний, селен, нитрат серебра, серу, пероксид натрия и хлорид олова. Имеются сообщения о том, что при контакте карбида кальция с медью или латунью могут образовываться взрывоопасные соединения.Помните об этом, выбирая инструменты для обработки пролитой карбида кальция.
Маловероятно, что вы когда-нибудь увидите плавление карбида кальция, даже при пожаре, потому что необходимая температура составляет 4 172 ° F. Карбид кальция кипит при 4055 ° F, что также маловероятно. Вещество не имеет давления паров, температуры вспышки, диапазона воспламенения и температуры воспламенения, но все же относится к легковоспламеняющимся твердым веществам!
Карбид кальция кипит при 4055 ° F, что также маловероятно. Вещество не имеет давления паров, температуры вспышки, диапазона воспламенения и температуры воспламенения, но все же относится к легковоспламеняющимся твердым веществам!
Карбид кальция не горит, но ацетилен, образующийся при реакции с водой, легко воспламеняется до взрывоопасности.Генерация этого газа — основное применение карбида кальция.
Любой бизнес, который разливает ацетилен по бутылкам, сам будет вырабатывать газ из карбида кальция, который поставляется этим компаниям в герметичных, герметичных и водонепроницаемых контейнерах. Ацетилен не доставляется на большие расстояния, потому что он имеет такой широкий диапазон воспламеняемости (от 2,5% до 80%), горит при такой высокой температуре (11526 калорий на грамм, что дает температуру пламени 5710 ° F при сжигании в кислороде). , и очень нестабильно. Если его ударить током даже при небольшом давлении, ацетилен взорвется!
Химическая реакция, при которой из карбида кальция образуется ацетилен:
CaC2 + 2HOH — CH + Ca (OH)
Ацетилен будет бурно пузыриться из раствора, который состоит из гидроксида кальция (гашеная известь), едкого вещества, растворенного в воде.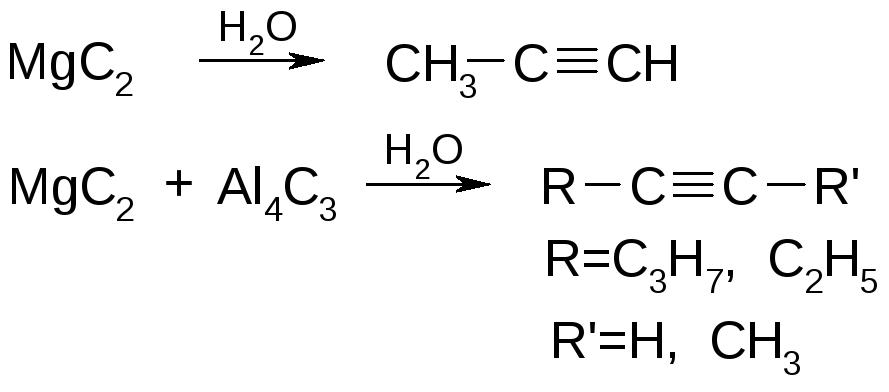 Эта реакция может быть катастрофической, если она происходит на открытом воздухе. Когда ацетилен вырабатывается для коммерческого использования, реакция происходит в закрытом контейнере. Вода добавляется через впускной клапан, а ацетилен удаляется через другой порт.
Эта реакция может быть катастрофической, если она происходит на открытом воздухе. Когда ацетилен вырабатывается для коммерческого использования, реакция происходит в закрытом контейнере. Вода добавляется через впускной клапан, а ацетилен удаляется через другой порт.
Опасности
При транспортировке и обращении с карбидом кальция образуется большое количество пыли. Вдыхать эту пыль опасно. Удушающий ацетилен будет образовываться любой пылью карбида кальция, достигающей легких, а оксид кальция в пыли будет раздражать легкие.
Оксид кальция также может вызывать раздражение кожи и глаз. Проглатывание вещества опасно для рта, губ и горла.
Поскольку образование ацетилена является основной опасностью, связанной с карбидом кальция, вы должны принять меры для предотвращения взрыва. Плотность пара ацетилена составляет 0,897, что означает, что он немного легче воздуха. Поскольку он образуется при выделении карбида кальция, газ будет подниматься, пузырясь из раствора. Именно здесь возникает наибольшая опасность, потому что концентрация взрывоопасного газа будет максимальной, как раз над реагирующим карбидом кальция.С этого момента газ начнет рассеиваться в воздухе. Чем сильнее ветер, тем быстрее произойдет рассеяние.
Усилия по сдерживанию
Не всегда очевидно, когда карбид кальция смешивается с водой; он может даже вступить в реакцию с влагой в воздухе. Таким образом, усилия по сдерживанию должны учитывать все формы, в которых может высвобождаться карбид кальция, и все способы, которыми он может вступать в контакт с водой.
Независимо от того, где происходит утечка, вы, , должны выполнить определенные процедуры, чтобы предотвратить катастрофические последствия разлива.
- Подходите к разливу с наветренной стороны;
- Удалить все источники возгорания, включая аппарат;
- Как можно быстрее обезопасьте место вокруг разлива;
- Избегайте любых действий, которые могут встряхнуть материал или привести к его контакту с водой.
Спасатели часто настолько обеспокоены тем, что вода достигнет реагирующего с водой материала, что они могут забыть попытаться предотвратить попадание реагирующего с водой материала на воду.Не допускайте попадания материала в канализацию или водоемы. И помните, что влага в почве, которая содержит карбид кальция, может быть еще одним источником воды, которая запускает реакцию.
Не позволяйте пыли карбида кальция кружиться вокруг и не попадать на нее w r и т. Д., Накрыв ее брезентом из пластика, резины или другого материала, не пропускающего воду.
Это важная процедура. Некоторые спасатели могут подумать, что если не поливать разлив водой, материал останется сухим.Однако они часто забывают о возможности дождя. Даже если не будет дождя, сильный ветер может развеять материал, а если земля будет влажной, реакция начнется немедленно.
Если вода контактировала с карбидом кальция или если дождь кажется вероятным, и материал не может быть покрыт, одним из решений является создание защитных дамб, прудов и ям. Вы можете рыть траншеи или ямы, чтобы содержать твердые частицы или раствор. Используйте песок, глину, почву или другое вещество в качестве материала для обваловки — точно так же, как вы бы сделали для любой разлившейся жидкости.Эти материалы также можно использовать для перекрытия входов в канализацию и водные пути. Просто помните, что любая влажность в этих материалах начнет реакцию образования ацетилена.
Если карбид кальция попадает в водный путь, вы должны уведомить все соответствующие органы и пользователей воды ниже по течению. При контакте материала с водой произойдет немедленная реакция. Однако некоторые из более крупных комков утонут, и на их реакцию потребуется больше времени. Удалите их, углубив дно водного пути.Но будьте осторожны, потому что, пока извлеченные комки влажные, они будут выделять ацетилен.
Глоссарий
Удушье —Бессознательное состояние или смерть, вызванные нехваткой кислорода.
Рассеивание — Акт широкого рассеивания материала или его рассеивания с общей территории.
Наркоз — Глубокая потеря сознания, вызванная лекарством или химическим веществом.
Реактор — Обычно закрытый сосуд, в котором протекает химическая реакция.
Плотность пара —Плотность пара или газа по сравнению с воздухом.
Реагирует с водой — Обладает способностью вступать в химические или физические реакции при контакте с водой.
В быстро движущемся потоке камнеподобный материал может уноситься вниз по потоку, высвобождая ацетилен при движении. В этом случае образование газа будет распространяться на большую площадь, и этот может уменьшить опасность, если, конечно, ацетилен, выпущенный ниже по потоку, не воспламеняется, а пораженная область более густонаселенная или подвергается большему воздействию.
Наиболее опасная ситуация возникнет, если карбид кальция попадет в замкнутое пространство, содержащее воду, например, в канализацию. Очень широкий диапазон воспламеняемости ацетилена позволяет огромному количеству газа накапливаться и перемещаться по канализационной системе. Скопление газа и взрыв, возникающие при достижении источника возгорания, могут иметь катастрофические последствия и привести к значительному ущербу. Это может быть гораздо более разрушительным, чем результаты изолированного разлива, происходящего на открытом воздухе. Помните, что вы обязательно должны предотвратить попадание карбида кальция в канализацию.
Обработка пожаров
Если вода действительно достигает разлива карбида кальция на открытом воздухе, и ацетилен воспламеняется, последующие процедуры будут зависеть от обстоятельств, местоположения, воздействия и опасности для жизни человека.
В некоторых случаях с ацетиленом можно обращаться как с пожаром, вызванным утечкой сжатого газа из контейнера. Правило здесь такое: не тушите огонь, если нельзя немедленно остановить поток газа. Причина, конечно, в том, что пока газ горит, он не накапливается и не вызывает разрушительного взрыва.Если нет опасности для жизни человека или воздействия, может быть лучше позволить ацетилену продолжать гореть.
Вы даже должны стимулировать образование большего количества газа, добавляя воду к любому непрореагировавшему карбиду, пока весь карбид не прореагирует и огонь не погаснет из-за нехватки топлива. Просто помните, что преднамеренный ожог , который начинается без опасности для жизни человека и подвергается воздействию , может выйти из-под контроля и нанести серьезный ущерб. Вы должны знать обо всех опасностях и последствиях умышленных ожогов и брать на себя ответственность за них.
Спасатели могут начать преднамеренный поджог, если они чувствуют, что не могут предотвратить скопление ацетиленового газа и что это скопление представляет большую опасность взрыва, если он воспламенится на каком-либо участке с подветренной стороны. Преднамеренное воспламенение газа намного опаснее, чем позволить горящему газу продолжать гореть, потому что акт воспламенения может вызвать взрыв, если накопилось достаточно газа. Опять же, командир инцидента должен знать все опасности и быть готовым к последствиям своих решений.
Из-за плотности пара ацетилена образование паров маловероятно. Однако, если они это сделают, их можно рассеять с помощью распыления воды или тумана, нанесенного на предполагаемую область. Но не позволяйте воде контактировать с обнаженным карбидом кальция.
Командир инцидента может использовать любой негорючий, неопасный сухой порошок для тушения пожара: сухой песок, глина, графит, кальцинированная сода (карбонат натрия), сухой портландцемент, поваренная соль (хлорид натрия) или известь (оксид кальция). ).Известь — это то же химическое вещество, что и оксид кальция, который может присутствовать в карбиде кальция, поэтому командир уже должен знать о его коррозионной активности и реактивности с водой.
Эти материалы могут заглушить огонь или высушить воду, чтобы замедлить или остановить образование газа. Двуокись углерода может работать, а может и не работать, и, конечно же, пена содержит воду, которая может усилить реакцию. Старайтесь избегать распространения материала или образования пыли во время тушения.
При работе с карбидом кальция не обязательно носить полностью герметизированные химические костюмы.Но обязательно носите защитную одежду, которая защитит вашу кожу и глаза. Сюда входят резиновые перчатки и ботинки, щитки для лица, защитные очки и любая другая одежда, которая будет сопротивляться материалу. Обычное стрелочное снаряжение защитит ту часть тела, которую оно закрывает. Рукава и манжеты брюк должны быть завязаны. Вы должны носить автономный дыхательный аппарат с положительным давлением в любой атмосфере, где образовалась пыль. Однако никакая одежда не защитит вас от взрыва ацетилена или огромного тепла, выделяемого при сжигании ацетилена.
Первая помощь
Поскольку ацетилен является реактивным газом, его вдыхание может вызвать головокружение, явную интоксикацию, головные боли, учащенное дыхание и наркоз. Дайте пострадавшему свежий воздух и сделайте искусственное дыхание, если дыхание человека ухудшилось или остановилось.
Используйте большое количество воды для мытья частей тела, которые контактировали с материалом. Немедленно промойте глаза в течение как минимум 15 минут, иногда приподнимая веки.Во всех случаях попадания на кожу или в глаза необходима медицинская помощь. Если ацетилен загорелся, ожоги будут тяжелыми. Их следует лечить как можно скорее.
Спасатели могут попытаться удержать материал, сгребая его в водонепроницаемые контейнеры. Они могут даже использовать фронтальные погрузчики и экскаваторы, чтобы собрать карбид кальция и погрузить его в крытые грузовики или большие безопасные контейнеры.
Если вы, , участвуете в очистке и удалении, помните, что вы должны соблюдать все федеральные, государственные и местные правила.Также помните, что собранная загрязненная почва теперь содержит вещество, реагирующее с водой, и любая влага, присутствующая или впоследствии контактирующая с почвой, вызовет выделение и накопление ацетилена. И любые искры от инструментов для уборки могут стать источником возгорания для взрыва.
Но, если нет надвигающегося ветра или ливня, безопаснее прикрыть материал, следить за ситуацией и обезопасить территорию до прибытия профессиональных бригад по уборке. Спасатели должны заниматься удалением самостоятельно только тогда, когда это абсолютно необходимо.Опытный, образованный, хорошо обученный командир инцидента должен решать, так ли это.
Золото и карбид вместе производят водород
Химики Brookhaven Lab Пинг Лю и Хосе Родригес помогли охарактеризовать структурные и механистические детали нового низкотемпературного катализатора для производства газообразного водорода высокой чистоты из воды и окиси углерода. Фото: Брукхейвенская национальная лаборатория.Ученые разработали новый низкотемпературный катализатор для производства газообразного водорода высокой чистоты с одновременным использованием окиси углерода (CO). Это открытие, о котором сообщается в статье Science , может улучшить характеристики топливных элементов, которые работают на водородном топливе, но могут быть отравлены CO.
«Этот катализатор производит более чистую форму водорода для подачи в топливный элемент», — сказал Хосе Родригес, химик из Брукхейвенской национальной лаборатории Министерства энергетики США.Родригес и его коллеги из химического отделения Брукхейвена, Пинг Лю и Вэньцянь Сюй, были среди группы ученых, которые помогли охарактеризовать структурные и механические детали катализатора, который был синтезирован и испытан сотрудниками Пекинского университета в Китае.
Поскольку катализатор работает при низких температурах и давлениях для преобразования воды (H 2 O) и CO в газообразный водород (H 2 ) и диоксид углерода (CO 2 ), он также может снизить стоимость эксплуатации этого так называемая реакция «сдвига водяного газа».«При низких температуре и давлении потребление энергии будет ниже, а экспериментальная установка будет менее дорогой и простой в использовании в небольших помещениях, таких как топливные элементы для автомобилей», — сказал Родригес.
Катализатор состоит из кластеров наночастиц золота, нанесенных на подложку из карбида молибдена. Эта химическая комбинация сильно отличается от катализаторов на основе оксидов, используемых для реакции конверсии водяного газа в крупномасштабных промышленных установках по производству водорода. «Карбиды более химически активны, чем оксиды, — сказал Родригес, — а граница раздела золото-карбид имеет хорошие свойства для реакции конверсии водяного газа; она лучше взаимодействует с водой, чем чистые металлы.«
«Группа в Пекинском университете открыла новый синтетический метод, и это был настоящий прорыв», — сказал Родригес. «Они нашли способ получить определенную фазу — или конфигурацию — атомов, которая очень активна для этой реакции».
Ученые из Брукхейвена сыграли ключевую роль в расшифровке причин высокой каталитической активности этой специфической конфигурации. Родригес, Вэньцянь Сюй и Сию Яо (в то время студент Пекинского университета, а теперь научный сотрудник в Брукхейвене) провели структурные исследования с использованием дифракции рентгеновских лучей в Национальном источнике синхротронного света США (NSLS), пока катализатор работал в промышленных или технических условиях. условия.Эти эксперименты позволили выявить важные детали того, как структура менялась в разных рабочих условиях, в том числе при разных температурах.
Располагая этими структурными деталями, Чжицзюнь Цзо, приглашенный профессор Брукхейвенского технологического университета Тайюань, Китай, и химик Брукхейвен Пинг Лю помогли разработать модели и теоретическую основу, объясняющую, почему катализатор работает именно так. Для этого использовались вычислительные ресурсы Брукхейвенского центра функциональных наноматериалов (CFN).
«Мы смоделировали различные границы раздела между золотом и карбидом молибдена и изучили механизм реакции, чтобы точно определить, где происходят реакции — активные центры, где атомы связываются, — и как разрываются и реформируются связи», — сказала она.
Дополнительные исследования в Центре науки о нанофазных материалах (CNMS) Национальной лаборатории Ок-Ридж, усовершенствованном источнике света (ALS) в Национальной лаборатории Лоуренса Беркли и двух синхротронных исследовательских центрах в Китае добавили понимания ученым.
«Это сложная реакция, состоящая из нескольких частей», — сказала Лю, но отметила один важный фактор: «Взаимодействие между золотом и карбидным субстратом очень важно. Золото обычно очень слабо связывает вещи. С помощью этого метода синтеза мы получаем более сильное сцепление. золото в карбид молибдена контролируемым образом «.
Эта конфигурация катализатора на основе карбида золота стабилизирует ключевой промежуточный продукт, который образуется по мере протекания реакции, и стабильность этого промежуточного продукта определяет скорость производства водорода, сказала она.
Команда Брукхейвена продолжит изучение этого и других карбидных катализаторов с новыми возможностями на Национальном источнике синхротронного света II (NSLS-II), новом объекте, который открылся в лаборатории Брукхейвена в 2014 году, заменив NSLS и произведя рентгеновские лучи, которые составляют 10000 раз ярче. С помощью этих более ярких рентгеновских лучей ученые надеются уловить больше деталей химического состава в действии, включая детали промежуточных соединений, которые образуются в процессе реакции, чтобы подтвердить теоретические прогнозы, сделанные в этом исследовании.
Этот рассказ адаптирован из материалов Брукхейвенской национальной лаборатории с редакционными изменениями, внесенными компанией Materials Today. Взгляды, выраженные в этой статье, не обязательно отражают точку зрения Elsevier. Ссылка на первоисточник.
Карбид кальция как дегидратирующий агент для спиртов
% PDF-1.7 % 1 0 объект > / Метаданные 2 0 R / OCProperties> / OCG [6 0 R] >> / Контуры 7 0 R / Страницы 8 0 R / StructTreeRoot 9 0 R / Тип / Каталог / ViewerPreferences> >> эндобдж 10 0 obj > эндобдж 2 0 obj > поток application / pdf
Пушка из карбида кальция!
У каждого учителя химии должен быть большой запас карбида кальция в кладовой, потому что это идеальное химическое вещество для демонстраций, привлекающих внимание людей! Излишне говорить, что я покупаю его оптом ( здесь ).Карбид кальция — ценный инструмент для демонстрации нескольких типов химических реакций, включая однократное замещение, двойное замещение, реакции горения и другие химические принципы.
Посмотрите видео, чтобы узнать, как сделать пушку из карбида кальция из ПВХ, и ознакомьтесь с химическими реакциями ниже, чтобы понять химию того, что происходит внутри этой громкой, вызывающей головную боль пушки!
Как собрать карбидную пушку
(см. Инструкции в видео на YouTube выше)
Как сделать демонстрацию карбидной пушки
Принадлежности
1 грамм Карбид кальция
20 мл 304зажигалка
мяч или полотенце
шомпол (измеритель)
Порядок зажигания твердосплавной пушки
Отвинтите колпачок с конца пушки из ПВХ.Насыпьте 1 грамм карбида в колпачок и плотно закрутите. Установите пушку в стойку (см. Видео). Удерживая ствол в вертикальном положении, налейте 20 мл воды в ствол, убедившись, что вода идет прямо на дно, где хранится карбид. Поместите мяч в мяч (или полотенце) в отверстие ствола и протолкните примерно половину длины ствола шомполом (метровой палкой или палкой). Направляйте ствол подальше от всего, что может быть повреждено.
Чем дольше вы ждете, тем больше ацетилена и тем сильнее гремит пушка.Когда все будет готово (я обычно жду около 20 секунд), зажгите зажигалку и подержите ее возле отверстия зажигания. Снимите изоленту, закрывающую отверстие, и поднесите зажигалку к отверстию. Тогда БУМ!
Я посетил Монтану этим утром на телеканале KTVQ (CBS) , чтобы поделиться чудесами науки и показать зрителям Монтаны и Вайоминга, насколько потрясающим может быть карбид кальция!
Карбид кальция и вода уравнение:
карбид кальция + вода -> ацетилен + гидроксид кальция
CaC2 + h3O -> C2h3 + Ca (OH) 2
Реакция взаимодействия карбида кальция и воды вычисленное химическое уравнение :
CaC2 + 2 h3O -> C2h3 + Ca (OH) 2
Уравнение реакции горения ацетилена:
газообразный ацетилен + кислород -> диоксид углерода + вода
C2h3 + O2 -> CO2 + h3O
Расчетное химическое уравнение сгорания ацетилена:
2 C2h3 + 5 O2 -> 4 CO2 + 2 h3O
Как всегда, соблюдайте осторожность при проведении научных экспериментов.
