Известно, что вольфрам имеет самую… | Ответ на вопрос
Для начала вспомним немного терминологию.
Температура плавления — температура, при которой твёрдое кристаллическое тело совершает переход в жидкое состояние. А температура кипения — температура, при которой происходит кипение жидкости, находящейся под постоянным давлением. Температура кипения соответствует температуре насыщенного пара над плоской поверхностью кипящей жидкости. Как температура плавления, так и температура кипения считаются одними из наиболее важных физических свойств вещества.
Что касается металла, который имеет самую высокую температуру кипения, то этим металлом является рений.
Ре́ний (Rhenium) — химический элемент с атомным номером 75 в Периодической системе химических элементов Д. И. Менделеева, обозначается символом Re. При стандартных условиях представляет собой плотный серебристо-белый переходный металл. Это один из наиболее плотных и твёрдых металлов (плотность — 21,02 г/см³).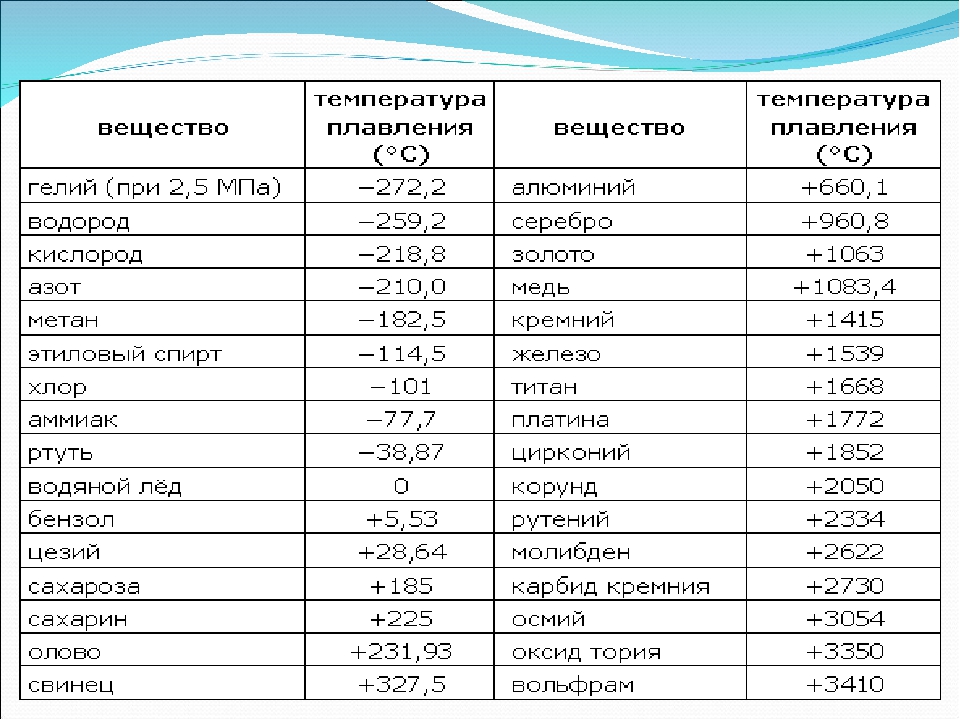
По ряду физических свойств рений приближается к тугоплавким металлам VI группы (молибден, вольфрам), а также к металлам платиновой группы. По температуре плавления рений занимает второе место среди металлов, уступая лишь вольфраму, а по плотности — четвёртое (после осмия, иридия и платины). А вот по температуре кипения рений стоит на первом месте среди химических элементов (5596°C по сравнению с 5555°C у вольфрама, 5458°C у тантала и 5012°C у осмия).
Рений был открыт в 1925 году немецкими химиками Идой и Вальтером Ноддак, в процессе исследования минерала колумбит при помощи спектрального анализа (сам металл был получен из молибденита лишь год спустя). Рений стал последним открытым элементом, у которого известен стабильный изотоп. Все элементы, которые были открыты позднее рения (в том числе и полученные искусственно), не имели стабильных изотопов.
Рений — один из редчайших элементов земной коры (его содержание в земной коре оценивается в 7·10^-8 по массе). По геохимическим свойствам он схож с молибденом и вольфрамом, поэтому в виде малых примесей входит в минералы этих элементов (поэтому основным источником рения служат молибденовые руды).
По геохимическим свойствам он схож с молибденом и вольфрамом, поэтому в виде малых примесей входит в минералы этих элементов (поэтому основным источником рения служат молибденовые руды).
Узнать больше:
ru.wikipedia.org
<div> <img src=»https://cdn.quizzclub.com/social/was-it-interesting.png» alt=»Was it interesting?»> </div> Поделиться этим фактом
Самый тугоплавкий металл на земле
Любознательных людей наверняка интересует вопрос, какой металл самый тугоплавкий? Прежде чем дать на него ответ, стоит разобраться с сами понятием тугоплавкости. Все известные науки металлы имеют разную температуру плавления в связи с различной степенью устойчивости связей между атомами в кристаллической решетке. Чем слабее эта связь, тем меньшая температура требуется, чтобы ее разорвать.
Самые тугоплавкие металлы в мире используются в чистом виде или в составе сплавов для производства деталей, которые работают в экстремальных термических условиях. Они позволяют эффективно противостоять высоким температурам и значительно продляют эксплуатационный период агрегатов. Но стойкость металлов данной группы к термическому воздействию заставляет металлургов прибегать к нестандартным методам их производства.
Они позволяют эффективно противостоять высоким температурам и значительно продляют эксплуатационный период агрегатов. Но стойкость металлов данной группы к термическому воздействию заставляет металлургов прибегать к нестандартным методам их производства.
Какой металл самый тугоплавкий?
Самый тугоплавкий металл на Земле был открыт в 1781 году шведским ученым Карлом Вильгельмом Шееле. Новый материал получил название вольфрам. Шееле удалось синтезировать триокись вольфрама путем растворения руды в азотной кислоте. Чистый металл был выделен двумя годами позже испанскими химиками Фаусто Фермином и Хуаном Хосе де Элюар. Новый элемент не сразу получил признание и был взят на вооружение промышленниками. Дело в том, что технологии того времени не позволяли обрабатывать столь тугоплавкое вещество, поэтому большинство современников не придали особого значения научному открытию.
Вольфрам был оценен гораздо позже. На сегодняшний день его сплавы используются при производстве термостойких деталей для различных отраслей промышленности. Нить накаливания в газоразрядных бытовых лампах также изготавливается из вольфрама. Также он применяется в аэрокосмической промышленности для производства ракетных сопел, используется в качестве многоразовых электродов в газодуговой сварке. Кроме тугоплавкости вольфрам также обладает высокой плотностью, что позволяет использовать его для изготовления высококачественных клюшек для гольфа.
Нить накаливания в газоразрядных бытовых лампах также изготавливается из вольфрама. Также он применяется в аэрокосмической промышленности для производства ракетных сопел, используется в качестве многоразовых электродов в газодуговой сварке. Кроме тугоплавкости вольфрам также обладает высокой плотностью, что позволяет использовать его для изготовления высококачественных клюшек для гольфа.
Соединения вольфрама с неметаллами также широко применяется в промышленности. Так сульфид используется в качестве термостойкой смазки, способной переносить температуры до 500 градусов по Цельсию, карбид служит для изготовления резцов, абразивных дисков и сверл, способных обрабатывать самые твердые вещества и переносить высокие температуры нагрева. Рассмотрим, наконец, промышленное получение вольфрама. Самый тугоплавкий металл имеет температуру плавления 3422 градуса по Цельсию.
Как получают вольфрам?
В природе чистый вольфрам не встречается.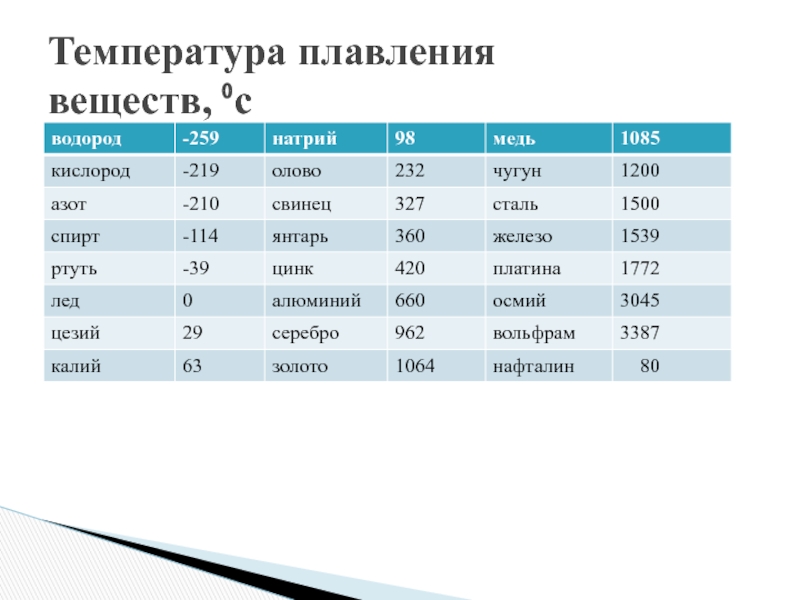 Он входит в состав горных пород в виде триоксида, а также вольфрамитов железа, марганца и кальция, реже меди или свинца. По оценкам ученых содержание вольфрама в земной коре в среднем составляет 1,3 грамма на одну тонну. Это достаточно редкий элемент по сравнению с другими видами металлов. Содержание вольфрама в руде после добычи обычно не превышает 2%. Поэтому добытое сырье отправляется на обогатительные фабрики, где методом магнитной или электростатической сепарации массовая доля металла доводится до отметки 55-60%.
Он входит в состав горных пород в виде триоксида, а также вольфрамитов железа, марганца и кальция, реже меди или свинца. По оценкам ученых содержание вольфрама в земной коре в среднем составляет 1,3 грамма на одну тонну. Это достаточно редкий элемент по сравнению с другими видами металлов. Содержание вольфрама в руде после добычи обычно не превышает 2%. Поэтому добытое сырье отправляется на обогатительные фабрики, где методом магнитной или электростатической сепарации массовая доля металла доводится до отметки 55-60%.
Процесс его получения разделяется на технологические этапы. На первом этапе выделяют чистый триоксид из добытой руды. Для этого используют метод термического разложения. При температурах от 500 до 800 градусов по Цельсию все лишние элементы расплавляются, а тугоплавкий вольфрам в виде оксида легко можно собрать из расплава. На выходе получается сырье с содержанием оксида шестивалентного вольфрама на уровне 99%.
Полученное соединение тщательно измельчают и проводят восстановительную реакцию в присутствии водорода при температуре 700 градусов по Цельсию. Это позволяет выделить чистый металл в виде порошка. Далее его спрессовывают под высоким давлением и спекают в водородной среде при температурах 1200-1300 градусов по Цельсию. После этого полученная масса отправляется в электрическую плавильную печь, где под воздействием тока нагревается до температуры свыше 3000 градусов. Так вольфрам переходит в расплавленное состояние.
Это позволяет выделить чистый металл в виде порошка. Далее его спрессовывают под высоким давлением и спекают в водородной среде при температурах 1200-1300 градусов по Цельсию. После этого полученная масса отправляется в электрическую плавильную печь, где под воздействием тока нагревается до температуры свыше 3000 градусов. Так вольфрам переходит в расплавленное состояние.
Для окончательной очистки от примесей и получения монокристаллической структурной решетки используется метод зонной плавки. Он подразумевает, что в определенный момент времени расплавленной находится только некоторая зона из общей площади металла. Постепенно двигаясь, эта зона перераспределяет примеси, в результате чего в конечном итоге они скапливаются в одном месте и их легко можно удалить из структуры сплава.
Готовый вольфрам поступает на склад в виде штабиков или слитков, предназначенных для последующего производства нужной продукции. Для получения сплавов вольфрама все составные элементы измельчают и смешивают в виде порошка в необходимых пропорциях.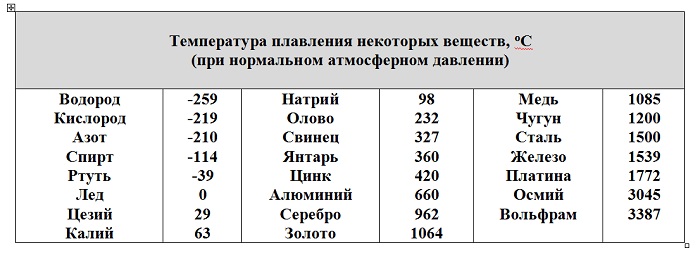
Тугоплавкие металлы
Пользователи также искали:
самые легкоплавкие и тугоплавкие металлы, самый тугоплавкий металл, таблица тугоплавкости металлов, тугоплавкие металлы это, тугоплавкие металлы применение, тугоплавкие металлы реферат, тугоплавкие сплавы, все тугоплавкие металлы, Тугоплавкие, тугоплавкие, металлы, Тугоплавкие металлы, металлов, металл, тугоплавкие металлы применение, тугоплавкие металлы реферат, тугоплавкие металлы это, таблица тугоплавкости металлов, самый тугоплавкий металл, тугоплавкие сплавы, сплавы, легкоплавкие, все тугоплавкие металлы, применение, реферат, таблица, тугоплавкости, самый, тугоплавкий, самые, самые легкоплавкие и тугоплавкие металлы, тугоплавкие металлы,
. ..
..
Какой металл имеет самую низкую температуру плавления
В таблице представлена температура плавления металлов tпл, их температура кипения t
Температура плавления металлов, а также их плотность и теплопроводность приведены в таблице для следующих металлов: актиний Ac, серебро Ag, алюминий Al, золото Au, барий Ba, берилий Be, висмут Bi, кальций Ca, кадмий Cd, кобальт Co, хром Cr, цезий Cs, медь Cu, железо Fe, галлий Ga, гафний Hf, ртуть Hg, индий In, иридий Ir, калий K, литий Li, магний Mg, марганец Mn, молибден Mo, натрий Na, ниобий Nb, никель Ni, нептуний Np, осмий Os, протактиний Pa, свинец Pb, палладий Pd, полоний Po, платина Pt, плутоний Pu, радий Ra, рубидий Pb, рений Re, родий Rh, рутений Ru, сурьма Sb, олово Sn, стронций Sr, тантал Ta, технеций Tc, торий Th, титан Ti, таллий Tl, уран U, ванадий V, вольфрам W, цинк Zn, цирконий Zr.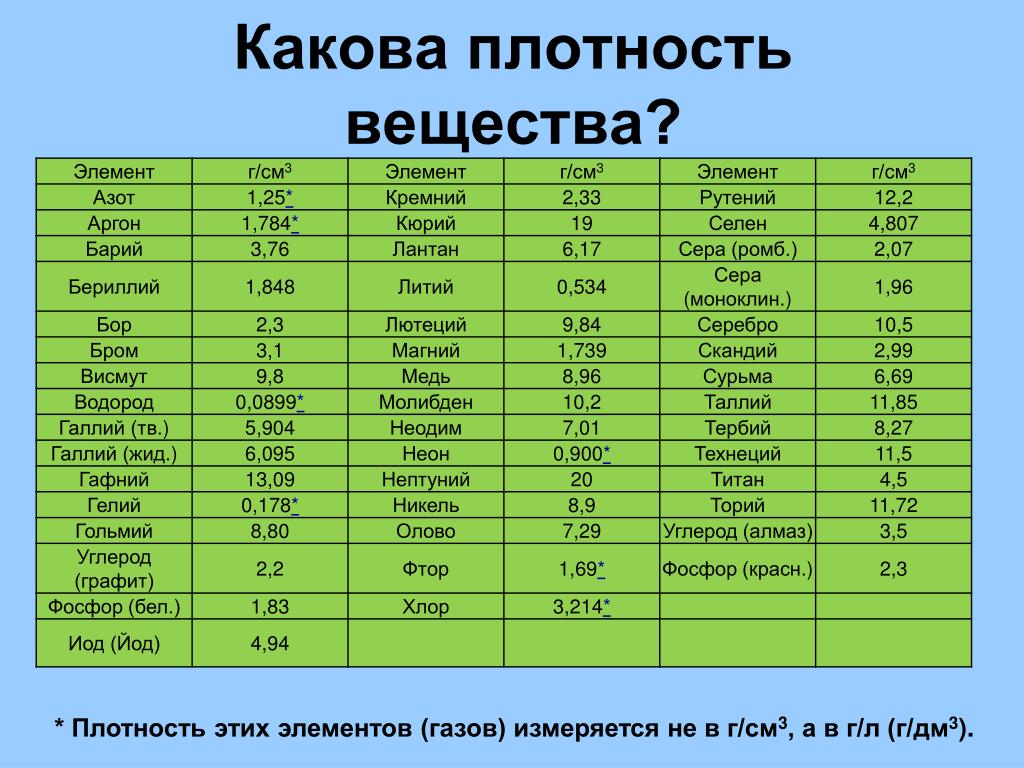
По данным таблицы видно, что температура плавления металлов изменяется в широком диапазоне (от -38,83°С у ртути до 3422°С у вольфрама). Низкой положительной температурой плавления обладают такие металлы, как литий (18,05°С), цезий (28,44°С), рубидий (39,3°С) и другие щелочные металлы.
Наиболее тугоплавкими являются следующие металлы: гафний, иридий, молибден, ниобий, осмий, рений, рутений, тантал, технеций, вольфрам. Температура плавления этих металлов выше 2000°С.
Приведем примеры температуры плавления металлов, широко применяемых в промышленности и в быту:
- температура плавления алюминия 660,32 °С;
- температура плавления меди 1084,62 °С;
- температура плавления свинца 327,46 °С;
- температура плавления золота 1064,18 °С;
- температура плавления олова 231,93 °С;
- температура плавления серебра 961,78 °С;
- температура плавления ртути -38,83°С.
Максимальной температурой кипения из металлов, представленных в таблице, обладает рений Re — она составляет 5596°С.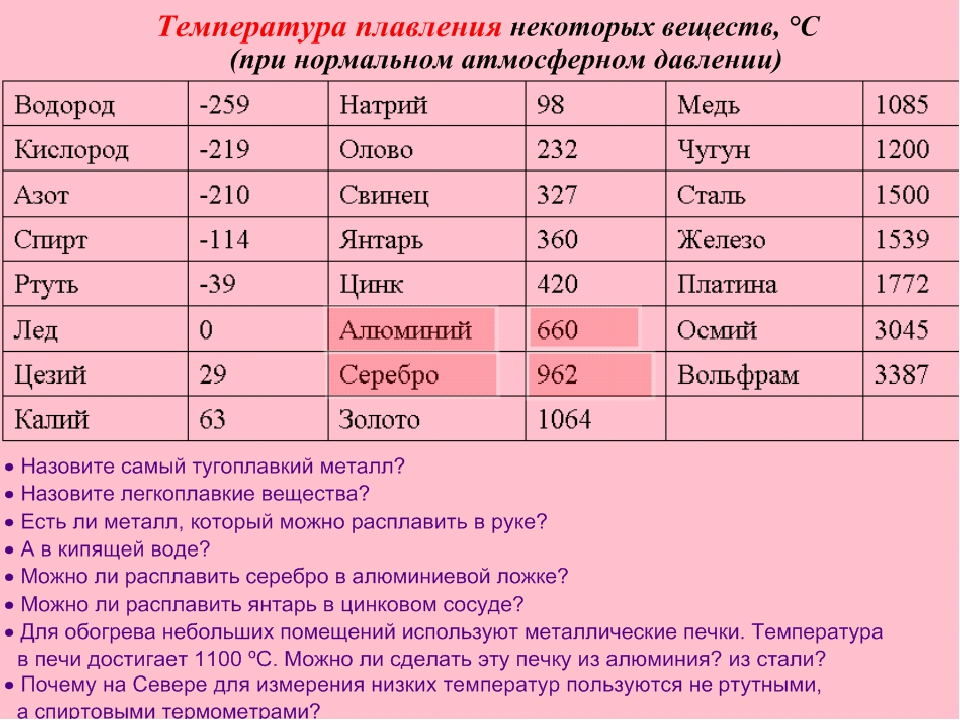 Также высокими температурами кипения обладают металлы, относящиеся к группе с высокой температурой плавления.
Также высокими температурами кипения обладают металлы, относящиеся к группе с высокой температурой плавления.
Плотность металлов в таблице находится в диапазоне от 0,534 до 22,59 г/см 3 , то есть самым легким металлом является литий, а самым тяжелым металлом осмий. Следует отметить, что осмий имеет плотность большую, чем плотность урана и даже плутония при комнатной температуре.
Теплопроводность металлов в таблице изменяется от 6,3 до 427 Вт/(м·град), таким образом хуже всего проводит тепло такой металл, как нептуний, а лучшим теплопроводящим металлом является серебро.
Температура плавления стали
Представлена таблица значений температуры плавления стали распространенных марок. Рассмотрены стали для отливок, конструкционные, жаропрочные, углеродистые и другие классы сталей.
Температура плавления стали находится в диапазоне от 1350 до 1535°С. Стали в таблице расположены в порядке возрастания их температуры плавления.
| Сталь | tпл, °С | Сталь | tпл, °С |
|---|---|---|---|
| Стали для отливок Х28Л и Х34Л | 1350 | Коррозионно-стойкая жаропрочная 12Х18Н9Т | 1425 |
| Сталь конструкционная 12Х18Н10Т | 1400 | Жаропрочная высоколегированная 20Х23Н13 | 1440 |
| Жаропрочная высоколегированная 20Х20Н14С2 | 1400 | Жаропрочная высоколегированная 40Х10С2М | 1480 |
| Жаропрочная высоколегированная 20Х25Н20С2 | 1400 | Сталь коррозионно-стойкая Х25С3Н (ЭИ261) | 1480 |
| Сталь конструкционная 12Х18Н10 | 1410 | Жаропрочная высоколегированная 40Х9С2 (ЭСХ8) | 1480 |
| Коррозионно-стойкая жаропрочная 12Х18Н9 | 1410 | Коррозионно-стойкие обыкновенные 95Х18…15Х28 | 1500 |
| Сталь жаропрочная Х20Н35 | 1410 | Коррозионно-стойкая жаропрочная 15Х25Т (ЭИ439) | 1500 |
| Жаропрочная высоколегированная 20Х23Н18 (ЭИ417) | 1415 | Углеродистые стали | 1535 |
- Волков А.
 И., Жарский И. М. Большой химический справочник. — М: Советская школа, 2005. — 608 с.
И., Жарский И. М. Большой химический справочник. — М: Советская школа, 2005. — 608 с. - Казанцев Е. И. Промышленные печи. Справочное руководство для расчетов и проектирования.
- Физические величины. Справочник. А. П. Бабичев, Н. А. Бабушкина, А. М. Братковский и др.; Под ред. И. С. Григорьева, Е. З. Мейлихова. — М.: Энергоатомиздат, 1991. — 1232 с.
Добрый вечер! Здравствуйте, уважаемые дамы и господа! Пятница! В эфире капитал-шоу «Поле чудес»! И как обычно, под аплодисменты зрительного зала я приглашаю в студию тройку игроков. А вот и задание на этот тур:
Вопрос: Какой из металлов имеет самую низкую температуру плавления? (Слово состоит из 5 букв)
Ответ: Ртуть (5 букв)
Если этот ответ не подходит, пожалуйста воспользуйтесь формой поиска.
Постараемся найти среди 1 126 642 формулировок по 141 989 словам.
Каждый металл или сплав обладает уникальными свойствами, в число которых входит температура плавления.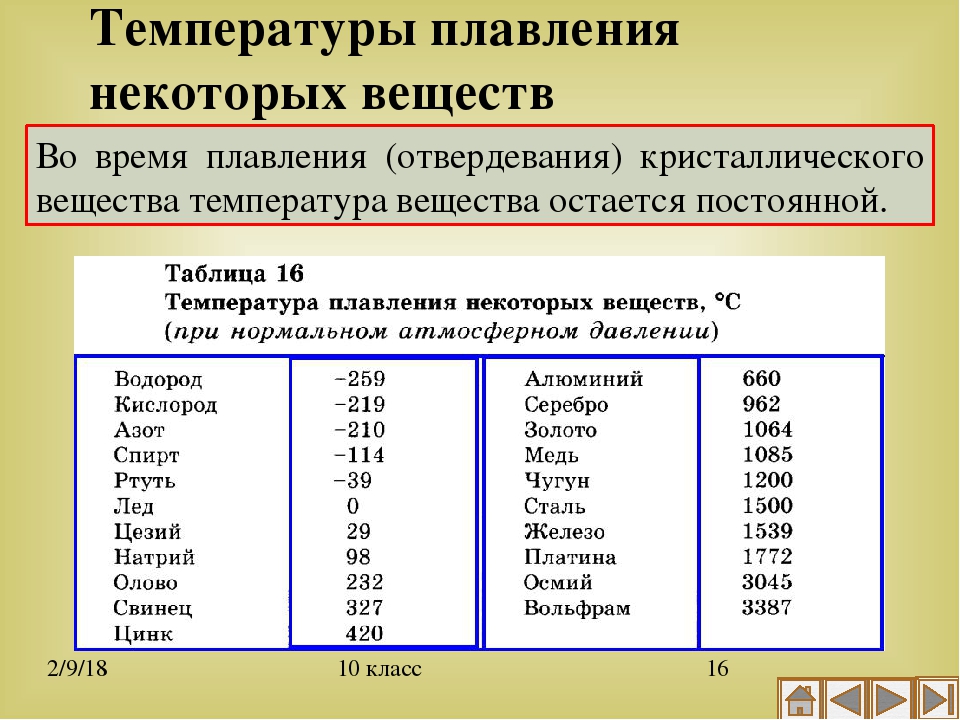 При этом объект переходит из одного состояния в другое, в конкретном случае становится из твёрдого жидким. Чтобы его расплавить, необходимо подвести к нему тепло и нагревать до достижения нужной температуры. В момент, когда достигается нужная точка температуры данного сплава, он ещё может остаться в твёрдом состоянии. При продолжении воздействия начинает плавиться.
При этом объект переходит из одного состояния в другое, в конкретном случае становится из твёрдого жидким. Чтобы его расплавить, необходимо подвести к нему тепло и нагревать до достижения нужной температуры. В момент, когда достигается нужная точка температуры данного сплава, он ещё может остаться в твёрдом состоянии. При продолжении воздействия начинает плавиться.
Наиболее низкая температура плавления у ртути — она плавится даже при -39 °C, самая высокая у вольфрама — 3422 °C. Для сплавов (стали и других) определить точную цифру крайне сложно. Все зависит от соотношения компонентов в них. У сплавов она записывается как числовой промежуток.
Как происходит процесс
Элементы, какими бы они ни были: золото, железо, чугун, сталь или любой другой — плавятся примерно одинаково. Это происходит при внешнем или внутреннем нагревании. Внешнее нагревание осуществляется в термической печи. Для внутреннего применяют резистивный нагрев, пропуская электрический ток или индукционный нагрев в электромагнитном поле высокой частоты. Воздействие при этом примерно одинаковое.
Воздействие при этом примерно одинаковое.
Когда происходит нагревание, усиливается амплитуда тепловых колебаний молекул. Появляются структурные дефекты решётки, сопровождаемые разрывом межатомных связей. Период разрушения решётки и скопления дефектов и называется плавлением.
В зависимости от градуса, при котором плавятся металлы, они разделяются на:
- легкоплавкие — до 600 °C: свинец, цинк, олово;
- среднеплавкие — от 600 °C до 1600 °C: золото, медь, алюминий, чугун, железо и большая часть всех элементов и соединений;
- тугоплавкие — от 1600 °C: хром, вольфрам, молибден, титан.
В зависимости от того, каков максимальный градус, подбирается и плавильный аппарат. Он должен быть тем прочнее, чем сильнее будет нагревание.
Вторая важная величина — градус кипения. Это параметр, при достижении которого начинается кипение жидкостей. Как правило, она в два раза выше градуса плавления. Эти величины прямо пропорциональны между собой и обычно их приводят при нормальном давлении.
Как правило, она в два раза выше градуса плавления. Эти величины прямо пропорциональны между собой и обычно их приводят при нормальном давлении.
Если давление увеличивается, величина плавления тоже увеличивается. Если давление уменьшается, то и она уменьшается.
Таблица характеристик
Металлы и сплавы — непременная основа для ковки, литейного производства, ювелирной продукции и многих других сфер производства. Чтобы не делал мастер (ювелирные украшения из золота, ограды из чугуна, ножи из стали или браслеты из меди), для правильной работы ему необходимо знать температуры, при которых плавится тот или иной элемент.
Чтобы узнать этот параметр, нужно обратиться к таблице. В таблице также можно найти и градус кипения.
Среди наиболее часто применяемых в быту элементов показатели температуры плавления такие:
- алюминий — 660 °C;
- температура плавления меди — 1083 °C;
- температура плавления золота — 1063 °C;
- серебро — 960 °C;
- олово — 232 °C.
 Олово часто используют при пайке, так как температура работающего паяльника составляет как раз 250–400 градусов;
Олово часто используют при пайке, так как температура работающего паяльника составляет как раз 250–400 градусов; - свинец — 327 °C;
- температура плавления железо — 1539 °C;
- температура плавления стали (сплав железа и углерода) — от 1300 °C до 1500 °C. Она колеблется в зависимости от насыщенности стали компонентами;
- температура плавления чугуна (также сплав железа и углерода) — от 1100 °C до 1300 °C;
- ртуть — -38,9 °C.
Как понятно из этой части таблицы, самый легкоплавкий металл — ртуть, которая при плюсовых температурах уже находится в жидком состоянии.
Градус кипения всех этих элементов почти вдвое, а иногда и ещё выше градуса плавления. Например, у золота он 2660 °C, у алюминия — 2519 °C, у железа — 2900 °C, у меди — 2580 °C, у ртути — 356,73 °C.
У сплавов типа стали, чугуна и прочих металлов расчёт примерно такой же и зависит от соотношения компонентов в сплаве.
Максимальная температура кипения у металлов — у рения — 5596 °C. Наибольшая температура кипения — у наиболее тугоплавящихся материалов.
Бывают таблицы, в которых также указана плотность металлов. Самым лёгким металлом является литий, самым тяжёлым — осмий. У осмия плотность выше, чем у урана и плутония, если рассматривать её при комнатной температуре. К лёгким металлам относятся: магний, алюминий, титан. К тяжёлым относится большинство распространённых металлов: железо, медь, цинк, олово и многие другие. Последняя группа — очень тяжёлые металлы, к ним относятся: вольфрам, золото, свинец и другие.
Ещё один показатель, встречающийся в таблицах — это теплопроводность металлов. Хуже всего тепло проводит нептуний, а лучший по теплопроводности металл — серебро. Золото, сталь, железо, чугун и прочие элементы находится посередине между этими двумя крайностями. Чёткие характеристики для каждого можно найти в нужной таблице.
Что такое температура плавления металлов
Температура плавления металлов: таблица в градусах
При термическом воздействии на детали в процессе сварки важно учитывать температуру плавления металлов. От этого показателя зависят токовые параметры. Необходимо создать электрической дугу или пламя в газовой горелке такой тепловой мощности, чтобы разрушить молекулярные связи. Параметр, при котором сталь или цветной сплав плавится, учитывают при выборе конструкционных материалов для узлов, испытывающих силу трения или металлоконструкций, испытывающих термическое воздействие.
Процесс плавления
При термовоздействии на деталь изменение внутренней структуры происходит за счет накопления энергии молекулами. Скорость их движения возрастает. В критической точке нагрева начинается разрушение кристаллической структуры, межмолекулярные связи уже не могут удержать молекулы в узлах решетки. Взамен колебательным движениям в пределах узла происходит хаотическое движение, образуется ванна расплава в месте нагрева. Точку начала расплавления вещества в лабораторных условиях определяют до сотых долей градуса, причем этот показатель не зависит от внешнего давления на заготовку. В вакууме и под давлением металлические заготовки начинают плавиться при одной и той же температуре, это объясняется процессом накопления внутренней энергии, необходимой для разрушения межмолекулярных связей.
Классификация металлов по температуре плавления
В физике переход твердого тела в жидкое состояние характерен только для веществ кристаллической структуры. Температуру плавления металлов чаще обозначают диапазоном значений, для сплавов точно определить нагрев до пограничного фазового состояния сложно. Для чистых элементов каждый градус имеет значение, особенно, если это легкоплавкие элементы,
значения не имеет. Сводная таблица показателей t обычно делится на 3 группы. Помимо легкоплавких элементов, которые максимально нагревают до +600°С, указывают тугоплавкие, выдерживающие нагрев свыше +1600°С, и среднеплавкие. В этой группе сплавы, образующие ванну расплава при температуре от +600 до 1600°С.
Разница между температурой плавления и кипения
Точкой фазового перехода вещества из твердого кристаллического состояния в жидкое нередко называют температуру плавления металла. В расплаве молекулы не имеют определенного расположения, но притяжение удерживает их вместе, в жидком состоянии кристаллическое тело сохраняет объем, но теряет форму.
При кипении теряется объем, молекулы слабо взаимодействуют, хаотично движутся во всех направлениях, отрываются от поверхности. Температура кипения – это когда давление металлических паров достигает давления внешней среды.
Для наглядности разницу между критическими точками нагрева лучше представить в виде таблицы:
| Свойства | Температура плавки | Температура кипения |
|---|---|---|
| Физическое состояние | Сплав превращается в расплав, кристаллическая структура разрушается, исчезает зернистость | Переход в газообразное состояние, отдельные молекулы улетают за пределы расплава |
| Фазовый переход | Равновесие между жидкой и твердой фазами | Равновесие между давлением паров металла и внешним давлением воздуха |
| Влияние внешнего давления | Не меняется | Изменяется, падает при разряжении |
Таблицы температур плавления металлов и сплавов
Для удобства границы фазового перехода указаны по группам в порядке возрастания t фазового перехода из твердого в жидкое состояние. Из всех элементов выбраны часто встречающиеся.
Таблица плавления легкоплавких металлов и сплавов (расплавляются до +600°С).
| Название элемента или соединения | Буквенный символ в периодической таблице элементов | Температура образования расплава | Температура закипания |
|---|---|---|---|
| Ртуть | Hg | -38,9°С | +356,7°С |
| Литий | Li | +18°С | +1342°С |
| Цезий | Cs | +28,4°С | +667,5°С |
| Калий | K | +63,6°С | +759°С |
| Натрий | Na | +97,8°С | +883°С |
| Индий | In | +156,6°С | +2072°С |
| Олово | Sn | +232°С | +2600°С |
| Висмут | Bi | +271,4°С | +1564°С |
| Таллий | Tl | +304°С | +1473°С |
| Кадмий | Cd | +321°С | +767°С |
| Свинец | Pb | +327°С | +1750°С |
| Цинк | Zn | +420°С | +907°С |
Таблица плавления среднеплавких металлов и сплавов, диапазон фазового перехода от +600 до 1600°С.
| Наименование | Обозначение металла или химический состав сплава | Температура плавления | Температура кипения |
|---|---|---|---|
| МЕТАЛЛЫ | |||
| Сурьма | Sb | +630,6°С | +1587°С |
| Магний | Mg | +650°С | +1100°С |
| Алюминий | Al | +660°С | +2519°С |
| Барий | Ba | +727°С | +1897°С |
| Кальций | Ca | +842°С | +1484°С |
| Серебро | Ag | +960°С | +2180°С |
| Золото | Au | +1063°С | +2660°С |
| Марганец | Mn | +1246°С | +2061°С |
| Медь | Cu | +1083°С | +2580°С |
| Бериллий | Be | +1287°С | +2471°С |
| Кремний | Si | +1415°С | +2350°С |
| Никель | Ni | +1455°С | +2913°С |
| Кобальт | Co | +1495°С | +2927°С |
| Железо | Fe | +1539°С | +900°С |
| СПЛАВЫ | |||
| Дюрали | Al+ Mg+Cu+Mn | +650°С | |
| Латуни | сплавы на основе меди и цинка | +950…1050°С | |
| Нейзильбер | Cu+Zn+Ni | +1100°С | |
| Чугун | углеродистое железо | +1100…1300°С | |
| Углеродистые стали | +1300…1500°С | ||
| Нихром | Fe+Ni+Cr+Si+Mn+Al | +1400°С | |
| Инвар | Fe+Ni | +1425°С | |
| Фехраль | Fe+Cr+Al+Mn+Si | +1460°С | |
Таблица плавления тугоплавких металлов и сплавов (свыше +1600°С).
| Название | Символ элемента, формула соединения | Температура плавления | Температура кипения |
|---|---|---|---|
| Титан | Ti | +1680°С | +3300°С |
| Карбид титана | TiC | +3150°С | – |
| Торий | Th | +1750°С | +4788°С |
| Платина | Pt | +1769,3°С | +3825°С |
| Хром | Cr | +1907°С | +2671°С |
| Карбиды хрома | Cr23C6 | +1660°С | – |
| Cr7С3 | +1780°С | – | |
| Cr3С2 | +1890°С | – | |
| Цирконий | Zr | +1855°С | +4409°С |
| Карбид циркония | ZrC | +3530°С | – |
| Ванадий | V | +1910°С | +3407°С |
| Родий | Rh | +1964°С | +3695°С |
| Иридий | Ir | +2447°С | +4428°С |
| Ниобий | Nb | +2477°С | +4744°С |
| Молибден | Mo | +2623°С | +4639°С |
| Тантал | Ta | +3017°С | +5458°С |
| Вольфрам | W | +3420°С | +5555°С |
В какой момент плавится металл? Стол для плавки металлов
Металлы, как правило, имеют более высокую температуру плавления, чем многие другие материалы, и они способны менять форму под воздействием тепла — в отличие от древесины, которая просто разлагается. Когда температура становится достаточно высокой, ионы, из которых состоит металл, вибрируют все больше и больше, в конечном итоге разрывая связи его ионов и позволяя им двигаться свободно.
Когда внутренняя структура металла начинает сдвигаться и связи ослабляются, он становится жидкостью.Прочность связи, которая зависит от самого материала, обычно определяет температуру плавления металла. Некоторые металлические сплавы будут иметь более высокие или более низкие точки плавления, чем сами металлы, и они не всегда могут плавиться плавно.
Ваш путеводитель по плавке металловОбычно, когда кто-то спрашивает о температурах плавления металла, они ищут твердую температуру, до которой металл должен быть нагрет, что приведет к ожижению. Ниже представлена интерактивная таблица, которая основана на различных научных источниках для определения точек плавления различных металлов:
| Металл | Температура плавления (° F) | |
|---|---|---|
| Адмиралтейская латунь | 1650 | |
| Алюминий | 1220 | |
| Алюминиевый сплав | 865 | |
| Алюминий бронза | 1881 — 1900 | |
| Сурьма | 1170 | |
| Бериллий | 2345 | |
| Бериллий Медь | 1587 | |
| Латунь (красный) | 1832 | |
| Латунь (желтый) | 1710 | |
| Кадмий | 610 | |
| Хром | 3380 | |
| Кобальт | 2723 | |
| Медь | 1983 | |
| Купроникель | 2140-2260 | |
| Золото (2440-2260 | ||
| ) | 1945 | |
| Сплав инконель | 2540 — 2600 | |
| Иридий | 4440 | |
| Железо (кованое) | 2700 | |
| Железо (серое литье) | 2060 | |
| Железо (ковкое) | 2100 | |
| Свинец | 621 | |
| Магний | 1200 | |
| Магниевый сплав | 660-1200 | |
| Марганец | 2271 | |
| Марганцевая бронза | 1590 | |
| Ртуть | -37.95 | |
| Молибден | 4750 | |
| Никель | 2647 | |
| Ниобий (колумбий) | 4473 | |
| Осмий | 5477 | |
| Палладий | 2831 | Фосфор | 111 |
| Платина | 3220 | |
| Плутоний | 1180 | |
| Калий | 146 | |
| Красная латунь | 1810 | |
| Рений | 5767 | |
| Рений | Рений | 3569 |
| Рутений | 4500 | |
| Селен | 423 | |
| Кремний | 2572 | |
| Серебро (чистое) | 1761 | |
| Серебро (стерлинговое) | 1640 | |
| Натрий | 208 9002 6 | |
| Сталь, углерод | 2600 | |
| Сталь, нержавеющая | 2750 | |
| Тантал | 5400 | |
| Торий | 3180 | |
| Олово | 449.4 | |
| Титан | 3040 |
В нашем температурном списке присутствует множество металлических сплавов, но важно знать, что большинство из них имеют значительный температурный диапазон, которого они должны достичь. При изменении состава температура нагрева изменяется, и диапазоны расширяются примерно на 200 ° F.
Диапазон сплава означает, что он начинает иметь жидкое и твердое состояние, иногда одновременно, когда вы приближаетесь к общему диапазону плавления.
Все сразу плавитсяПри работе с чистыми металлами вы, вероятно, заметите, что он плавится почти равномерно. Это контрастирует с другими элементами, такими как лед, который постепенно тает, и жидкость видна, в то время как куски твердых частиц все еще находятся вокруг.
Теплопроводность — одна из главных причин такого равномерного плавления, поскольку металлы обладают исключительной теплопередачей. По сравнению со льдом, проводимость металла на порядки выше. Это означает, что если приложить тепло к одной части металлического стержня или стержня, то тепло будет распределяться очень равномерно по всей поверхности.
Чем плотнее металл, тем лучше его теплопроводность. Это позволяет металлообработке безопасно применять тепло в одном месте, но при этом должным образом нагревать весь кусок металла.
.Точки плавления и кипения элементов Периодической таблицы
Точки плавления и кипения элементов Периодической таблицы Менделеева ХИМИЧЕСКАЯ ШКОЛАТемпературы плавления и кипения очень важны физические свойства в химии, когда мы изучаем элементы и соединения. Различные элементы и соединения имеют разные точки плавления и кипения. Из изучения значений плавления и точки кипения элементов, мы можем получить представление о структуре элементов, межмолекулярных силах между молекулы или атомы и многое другое.
В этом руководстве мы рассмотрим следующие разделы.
- Причины разной температуры плавления и кипения элементов и соединений
- Сравнение значений точек плавления и кипения каждой группы в периодической таблице с тенденциями
- Температуры плавления и кипения органические соединения
- Сравнение точек плавления и кипения различных элементов и соединений в блоках s, p и d
Автор: Хешан Нипуна, дата обновления: 2020/01/05
Температуры плавления и кипения элементов
Вариации точек плавления и кипения неясны (не имеют единообразного рисунка) по всей таблице Менделеева (это означает, что мы не всегда можем видеть подобную тенденцию.Вы поймете это, когда закончите читать это руководство).
Но мы видим, что некоторые элементы имеют более высокие температуры плавления и кипения, а некоторые — меньше. В В первой части этого урока мы изучаем точки плавления и кипения s, p, d блокирует элементы и их соединения, а затем — органические соединения.
IVA th элементы группы (углерод и кремний) показывают высокие температуры плавления и кипения в секунду и третьи периоды соответственно, потому что они имеют ковалентных гигантских решеток структур.
Температуры плавления и кипения за период
В первых трех периодах наблюдается четкая вариация точек плавления и кипения (имеет четкую тенденцию). Плавление и точки кипения увеличиваются до IVA группы с при движении слева направо. (Например, от натрия к аргону в третьем периоде). Группа IVA имеет элемент с наивысшей температурой плавления и кипения. Затем начинает снижаться температура плавления и кипения от группы VA к благородным газам (VIIIA).
Почему разные элементы и соединения имеют разные точки плавления и кипения?
Есть много причин для воздействия на точки плавления и кипения элементов и соединений. Одна или несколько вещей могут эффект до точек плавления и кипения.
- Молекулярная масса — при увеличении молекулярной массы возможно увеличение плавления и кипения точка тоже высока.
- Межмолекулярные силы , такие как водородные связи, силы диполь-дипольного притяжения, силы Ван-дер-Ваальса между атомами или молекулами.Когда межмолекулярные силы становятся сильнее, это также увеличивает температуры плавления и кипения. элементов и соединений.
- Металлическая решетка (важно для определения температуры плавления металлов , таких как натрий, магний и др. металлические элементы)
- Ионная решетка — В ионных соединениях, таких как NaCl, CaF 2 , MgO, существует ионная решетка. Согласно прочность ионной решетки, температуры плавления и кипения могут различаться.
Элементы с самыми низкими температурами плавления и кипения за период
Инертные газы имеют элемент с самыми низкими температурами плавления и кипения за период, потому что их форма только ван-дер-ваальсова силы — они очень слабые, чтобы образовать сильную межмолекулярную силу между атомами.
Тенденции групп точек плавления и кипения таблицы Менделеева
Теперь мы собираемся узнать о том, как точки плавления и кипения элементов различаются в группах, рассматривая каждый группа отдельно.
Значения точек плавления и кипения s-блока
БлокS содержит группу IA и группу IIA, и большинство элементов из них являются металлами без водород. (водород имеет как свойства щелочного металла, так и свойства галогена.)
Щелочные металлы, температура плавления и кипения
Щелочные металлы (Li, Na, K, Rb, Cs): мягкие и имеют низкие температуры плавления и кипения.Щелочные металлы имеют только один валентный электрон на атом металла и, следовательно, энергия, связывающая атомы в кристаллической решетке металла, мала. Следовательно, металлические связи в этих металлах не очень сильно. Таким образом, температуры плавления и кипения снижаются при переходе от лития к цезию.
Водород
- Температура плавления: -259,2 0 C
- Точка кипения: -252,9 0 C
Температуры плавления и кипения щелочноземельных металлов
Щелочноземельные металлы (Be, Mg, Ca, Sr, Ba, Ra) имеют низкие температуры плавления и кипения по сравнению с металлами d-блока.Но их температуры плавления и кипения выше, чем у соответствующих щелочных металлов за тот же период из-за сравнительно меньший размер. Но точки плавления и кипения не показывают регулярных тенденций в щелочноземельных металлах. группа.
Почему щелочные металлы имеют более низкую температуру плавления, чем щелочноземельные металлы?
И щелочные, и щелочноземельные металлы находятся в блоке s. Мы знаем, что щелочные металлы имеют всего одного валентного электрона на атом металла.
Но щелочноземельные металлы имеют двух валентных электронов по на атом металла.
Также щелочноземельные металлы имеют меньший размер, чем щелочные металлы.
Когда количество валентных электронов в решетке увеличивается до , металлическая связь становится прочной. Также, когда атомный радиус уменьшается, металлическая связь стать сильным. Также поэтому металлические связи щелочноземельных металлов намного сильнее щелочных металлов.
Следовательно, температуры плавления и кипения щелочных металлов ниже, чем температуры плавления и кипения щелочноземельных металлов
Почему бериллий имеет более высокую температуру плавления и кипения, чем другой член второй группы?
Бериллий — атом наименьшего размера из элементов группы 2. Таким образом, его ионная решетка сильнее, чем у других щелочных земные металлы.
Температура плавления и кипения элементов p-блока
Теперь поговорим об изменении температур плавления и кипения p-блочных элементов.
В p-блоке есть различные типы элементов, включая металлы, неметаллы, и их физические состояния также очень другой. При комнатной температуре некоторые из них находятся в твердом состоянии, а некоторые — в газообразном. Бром тоже находится в жидком состоянии.
БлокP содержит элемент с самой высокой температурой плавления (углерод) и элемент с самой низкой точкой плавления таблица Менделеева (гелий).
Теперь посмотрим на температуры плавления и кипения p-блочных элементов от группы 13 до группы 18.
Галогены и инертные газы точки плавления и кипения
Галогены и благородные газы находятся в блоке p периодической таблицы. Галогены существуют в виде двухатомных молекул, таких как F 2 , Cl 2 , Br 2 , I 2 и благородные газы существуют в виде одноатомных молекул.
При понижении каждой группы молекулярная масса увеличивается, что может быть причиной более высоких точек плавления и кипения.Кроме того, все молекулы галогена и инертного газа образуют только силы Ван-дер-Ваальса, которые являются самыми слабыми межмолекулярными силами и не сильно влияет на плавление и кипение галогенов и благородных газов. Молекулярные массы молекул имеют Наибольшее влияние на повышение температуры плавления и кипения. Итак, точки плавления и кипения как галогена, так и инертных газов увеличиваются по группе.
Температуры кипения и плавления элементов 13 группы
Бор, алюминий, галлий, индий, таллий — элементы группы 13.Понижаются точки плавления и кипения при движении вниз по группе. Однако снижение температуры плавления не такое регулярное, как точек кипения. Галлий имеет очень низкую температуру плавления (303К).
Температуры плавления и кипения элементов 14 группы
Атомы этой группы образуют ковалентные связи друг с другом, и поэтому между их атомами в обоих случаях существуют сильные силы связи. твердое и жидкое состояния.
Температуры плавления и кипения элементов 14-й группы намного выше, чем элементов 13-й группы.
При движении вниз по группе, температура плавления и кипения снижается.
Углерод (алмаз как аллотроп углерода) имеет самую высокую температуру плавления и температуру кипения между 14 группой. элементы.
Группа 15 элементов точки плавления и кипения
- Азот имеет самую низкую температуру плавления точка и температура кипения.
- Сурьма имеет самую высокую температуру плавления и кипения.
Группа 16 элементов температуры плавления и кипения
- Кислород имеет самую низкую температуру плавления и кипения.
- Теллур (Те) имеет самую высокую температуру плавления и кипения.
Точки кипения группы 17
Температура кипения увеличивается при переходе от фтора к йод.
Температуры плавления и кипения 3d-металлов
Температуры плавления и кипения 3-х металлов обычно выше, чем s блочных элементов.
Ванадий имеет самую высокую температуру плавления и цинк имеет самую низкую температуру плавления.
Но температуры плавления и кипения не имеют регулярных тенденций.
Почему цинк имеет самую низкую температуру плавления среди металлов серии 3d?
Цинк имеет конфигурацию стабильных электронов , 3d 10 4s 2 .Следовательно, цинк не имеет большого значения. электроны к металлической решетке, как и другие 3d-металлы. Следовательно, прочность металлической решетки ниже, чем у других 3d-металлов. решетки. Таким образом, цинк имеет самую низкую температуру плавления в серии 3D-металлов.
Падение температуры плавления марганца
Конфигурация электронов марганца 3d 5 4s 2 . Эта конфигурация электронов имеет некоторую стабильность потому что все пять d-орбит наполовину заполнены (каждая d-орбита имеет один электрон.) Итак, вклад электронов в металлическая решетка ограничена марганцем. Поэтому решетка не очень прочная. Вот почему марганец внезапное падение температуры плавления.
Точки плавления и кипения соединений
Температуры плавления и кипения галогенидов щелочных металлов
Плавка и кипения точек щелочного металла галогениды уменьшается с увеличением атомной массы галогенидов как:
F — > Cl — > Br — > I —
Пример: температура плавления NaCl выше, чем у NaBr
Для данного галогенид-иона точки плавления и кипения LiX всегда ниже, чем у NaX.
Температуры плавления и кипения органических соединений
На сегодняшний день учеными всего мира открыты тысячи органических соединений. Открывая множество соединений, родилась органическая химия. В этой главе мы собираемся обсудить температуры плавления и кипения органических соединений.
Температуры кипения этана (алкана) и этановая кислота (карбоновая кислота) перечислены ниже, и это два разных типа органических соединений.
- Метан (CH 4 ): -161,5 0 C
- Этановая кислота (CH 3 COOH): 118,1 0 C
Следующие факты важны при изучении значений температуры плавления и кипения органических соединений.
- Относительная молекулярная масса
- Диполь-дипольные взаимодействия
- Способность образовывать водородные связи
- Структура углеродной цепи
Температура плавления и кипения алканов, алкенов, алкинов
- Алканы — неполярные молекулы.Между молекулами алканов действуют только силы Ван-дер-Ваальса. Когда относительная молекулярная масса увеличивается в алкане соединения, значения точек плавления и кипения также увеличиваются.
- Повышает температуру плавления и кипения алкана, алкена, алкины соответственно.
Рассмотрим этан, этен, этин
этин (соединение алкина) имеет самую высокую температуру плавления и кипения.
Когда количество водородных связей и прочность водородных связей увеличивается, температуры плавления и кипения повышаются.
Спирты, альдегиды, кетоны и карбоновые кислоты
- Все спирты и карбоновые кислоты может образовывать водородные связи.
- Карбоновые кислоты образуют самые прочные и самые высокие среди них водородные связи.
- Итак, карбоновые кислоты имеют самые высокие температуры плавления и кипения.
- Диполь-дипольные взаимодействия между Молекулы альдегидов и кетонов менее прочны, чем водородные связи в спиртах.
- Следовательно, температуры плавления и кипения спиртов выше, чем у альдегидов и кетонов.
Точки плавления и кипения алкилгалогенидных соединений
Атом галогена более отрицателен, чем атом углерода. Итак, связь C-X поляризована. Между алкилгалогенидными соединениями существует диполь-дипольное взаимодействие.Эти взаимодействия намного сильнее, чем межмолекулярные силы между алканами,
Точки плавления и кипения алкилгалогенидных соединений намного выше, чем у алканов.
Когда относительная молекулярная масса органического соединения увеличивается, температуры плавления и кипения также увеличиваются.
Теперь мы обсудим некоторые проблемы, сравнивая различные элементы и соединения, которые имеют разные точки плавления и кипения. Эти проблемы очень важны на экзаменах.Внимательно их изучите.
Температура плавления металлов p-блока выше, чем s-блока?
Сначала мы посмотрим, что такое металлы p-блока и какие металлы s-блока. Вы знаете, когда мы обсуждаем Что касается температур плавления металлов, так важна их металлическая решетка. Итак, теперь вы знаете, что мы должны узнать сравнить температуры плавления металлов p-блока и металлов s-блока.
Когда металлическая решетка металла прочна, этот металл с большой вероятностью имеет более высокую температуру плавления.
В качестве примера для сравнения взяты два металла, натрий и алюминий. Натрий — металлический блок, а алюминий — п блок металлический. Но оба находятся в 3-м периоде таблицы Менделеева.
За счет выделения трех электронов и меньшего радиуса металлическая решетка алюминия намного прочнее натрия. Таким образом, температура плавления алюминия выше, чем у натрия.
Почему элементы d-блока имеют более высокие температуры плавления, чем элементы s-блока?
d блочных элементов могут внести больше электронов в металлическую решетку.Например, ванадий может внести 5 электронов.
Но элементы блока s могут вносить только один или два электрона. Щелочные металлы могут иметь один электрон, а щелочноземельные металлы — два. электроны.
Добавление большего количества электронов в металлическую решетку увеличит прочность металлических связей.
Из-за более прочных металлических связей элементы d-блока имеют более высокие значения плавления.
Почему H
2 S имеет меньшую температуру кипения, чем H 2 OH
2 S точка кипения: -60 0 CH
2 O точка кипения: 100 0 C- При комнатной температуре сероводород (H 2 S) представляет собой газ.Но вода (H 2 O) — жидкость. Это говорит нам H 2 S имеет меньшую температуру кипения.
- H 2 S и H 2 O представляют собой молекулы изогнутой формы.
- O и S — элементы группы VIA.
- Молекулярная масса H 2 S = 34 и молекулярная масса H 2 O = 18. Молекулярная масса H 2 S больше чем Н 2 О .
- Но, между молекулами H 2 O существует сильных водородных связей . H 2 Молекулы S имеют только слабых диполь-дипольные взаимодействия .
Водородные связи в H
2 O- Из-за наличия сильных водородных связей в молекулах H 2 O, H 2 O имеет более высокую температуру кипения, чем H 2 S , хотя H 2 S имеет большую молекулярную массу.
у какого атома самая высокая температура плавления / кипения между Cs и W?
Вольфрам (W) имеет самую высокую температуру плавления из всех металлов. Цезий (Cs) — мягкий металл с очень низкой температурой плавления (28 0 ° C).
Какой металл имеет самую высокую температуру плавления?
Вольфрам (Вт). Из металлов вольфрам имеет самую высокую температуру плавления в периодической таблице. Он расположен в блоке D. 3422 0 C — температура плавления вольфрама.
Какой металл блока имеет самую высокую температуру плавления?
Бериллий имеет самую высокую температуру плавления из блочных металлов. Это около 1,287 0 C
точки кипения и плавления группы порядка 1а
Li> Na> K> Rb> Cs> Fr> H
Литий имеет самую высокую температуру плавления и кипения, а водород — самую низкую в группе IA.Водород существует в виде газа при комнатной температуре, а франций — в жидком состоянии при комнатной температуре. Все остальные материалы группы IA являются твердыми при комнатной температуре.
Самая низкая температура плавления металлических элементов
Ртуть (Hg) имеет самую низкую температуру плавления (-38,83 0 C), потому что ртуть имеет очень слабую металлическую решетку.
Какой элемент имеет самую низкую температуру плавления в периодической таблице Менделеева
Гелий (He) — это элемент с самой низкой температурой плавления (-272.2 0 С). Гелий существует в виде атомов. Он не образует соединений и не создает межмолекулярных сил между атомами He. Также относительная молекулярная масса (1) очень низкая.
Остались вопросы? Спросите сейчас у нас и найдите ответ.
Что можно понять под температурами плавления и кипения элементов в периодической таблице?
Мы знаем, что элементы в периодической таблице находятся в твердом, жидком и газообразном состоянии.Межмолекулярные силы, относительная молекулярная масса являются факторами, которые определяют температуру плавления и кипения элемента.
Рассмотрим два металла. Один металл имеет очень высокую температуру плавления, чем другой. В металлах металлическая решетка является основным фактором, определяющим температуру плавления и кипения. Более прочная металлическая решетка имеет более высокую температуру плавления.
Мы можем понять межмолекулярные силы элементов, относительные молекулярные массы, изучая температуры плавления и кипения.
Каковы температуры плавления и кипения некоторых горючих газов?
Мы можем перечислить несколько горючих газов и их точки плавления и кипения.
Алканы легко воспламеняются. В качестве примера рассмотрим метан. Температуры плавления и кипения метана составляют -182,4 0 C и -161,5 0 C соответственно.
Почему разные элементы имеют разную температуру плавления?
Температура плавления зависит от их молекулярной массы и межмолекулярных сил между элементами или молекулами.Различные элементы имеют разную молекулярную массу и межмолекулярные силы. Таким образом, их значения температуры плавления отличаются от других элементов и соединений.
точки кипения и плавления, которые зависят от каких факторов?
Температура плавления и кипения зависит от типа элемента или соединения. Это объясняется ниже.
- Если рассматривать металлы, их температура плавления и кипения зависит от их металлической решетки. Если их металлическая решетка прочная, температура плавления и кипения увеличивается.
- Когда мы подходим к таким молекулам, как кислород, вода, благородные газы, их температура плавления и кипения зависит от их молекулярной массы и межмолекулярных сил.
- Температура плавления и кипения ионных соединений, таких как хлорид натрия, зависит от их ионной решетки.
Почему элементы группы IIA плавятся при более высоких температурах, чем элементы группы IA?
Металлические решетки металлов группы II намного прочнее металлов группы I, потому что элементы группы II отдают решетке два электрона.Поэтому металлы группы i плавятся при более высоких температурах.
почему температура кипения кальция больше, чем у калия?
Прочность решетки кальция выше, чем у калия, по двум причинам.
- Радиус кальция меньше, чем у калия.
- кальций может отдавать два электрона металлической решетке, в то время как калий может отдавать только один электрон.
По этим двум причинам металлическая решетка кальция намного больше, чем у калия.
, что имеет температуру плавления -219
0 ° C и точку кипения -183 0 ° C?Кислород (O 2 )
Какие-либо их соединения не имеют температуры плавления?
Да. Есть. Некоторые соединения неустойчивы к нагреванию. При нагревании такое соединение они разлагаются на другое вещество.
Пример:
Карбонат никеля (NiCO 3 ) разлагается до NiO и CO 2 при нагревании.
Температура плавления Mg находится в блоке s?
Металлическая решетка магния намного прочнее натрия. Таким образом, температура плавления Mg выше, чем у Na.
что происходит с точкой плавления в блоке s
Если вы изучите блочные элементы в тот же период, вы увидите, что щелочноземельный металл (группа 2) имеет более высокую температуру плавления, чем щелочной металл (группа 1), потому что прочность решетки щелочноземельного металла выше, чем у щелочного металла.
почему некоторые элементы имеют высокую температуру плавления?
Когда некоторые элементы превосходят по некоторым свойствам, они имеют высокую температуру плавления.
В качестве примера можно рассмотреть металлы. Когда мы говорим о металлах, необходимо понимать металлическую решетку. Когда металлическая решетка прочная, этот металл имеет более высокую температуру плавления. Металлическая решетка натрия слабее магния. Следовательно, магний имеет более высокую температуру плавления, чем натрий.
В качестве другого примера взяты вода и сероводород.Вода образует водородные связи, которые представляют собой самый сильный тип межмолекулярных сил. Но сероводород не может образовывать водородные связи. Таким образом, вода имеет более высокую температуру плавления, а также температуру кипения.
Статьи по теме
Число окисления Элементы в периодической таблице Характеристики металлов в периодической таблице Почему составы имеют разные точки кипения? — Причины изменения температуры кипения O 2 , HBr, этанола Органическая химия и соединения Реакции и возникновение щелочных металлов Реакции и возникновение щелочноземельных металлов Неорганические химические реакции и возникновение .Руководство по типам металлов и сплавов: свойства и использование
Таблица с механическими свойствами основных типов металлов. Значения зависят от термической обработки, механического состояния или массы металла.
Прочность — это способность металла избегать структурных повреждений за счет устойчивости к внешним напряжениям или нагрузкам. Удельное напряжение, измеряемое в фунтах на квадратный дюйм, является пределом прочности. При испытании на растяжение материал не может разорваться при медленном приложении большой нагрузки.
Самое сильное известное вещество — вольфрам-молибден. Следующими по прочности идут технически чистые металлы, никель и титан.
Чистое железо — более слабый материал. Однако железо, легированное углеродом (также известное как сталь), прочнее всех металлов, кроме вольфрама.
- Предел прочности :
Что такое предел прочности на разрыв или предел прочности?
Прочность на растяжение определяется как максимальная нагрузка при растяжении, которую материал может выдержать до разрушения, или способность материала сопротивляться растяжению под действием противоположных сил.Также известный как предел прочности, это максимальная прочность, развиваемая в металле при испытании на растяжение.
Прочность металла при растяжении — это количество фунтов силы, необходимое для разрыва стержня из материала шириной 1,0 дюйм и толщиной 1,0 дюйма
Как определяется предел прочности металла при растяжении?
Поведение металла при действительной растягивающей нагрузке называется испытанием на растяжение. Это испытание позволяет определить предел упругости, уменьшение площади, предел текучести, предел текучести и удлинение металла.Значение присваивается прочности металла (предел прочности), выраженной в килопаскалей (кПа) или фунтах на квадратный дюйм (psi). Выражаясь по-другому; Предел прочности на разрыв — это сила в фунтах, необходимая для того, чтобы взять и разорвать стержень материала шириной 24,5 мм (1 дюйм) и толщиной 25,4 мм (1,0 дюйма)
Прочность на сдвиг :
Что означает прочность на сдвиг?
Способность металла сопротивляться разрушению противоположными силами, действующими не по прямой линии, или сопротивляться разрушению противоположными силами, действующими на прямой линии, но не в одной плоскости, является прочностью на сдвиг.
Прочность на сдвиг — это способность металла противостоять разрушению противодействующими силами, действующими не по прямой линии, или способность материала противостоять разрушению противодействующими силами, действующими по прямой линии, но не в одной плоскости
Усталостная прочность :
Что такое определение усталостной прочности металла?
Во время большого количества переворотов максимальная нагрузка, которую материал может выдержать без разрушения, — это усталостная прочность.
Вращающийся вал, поддерживающий груз, имеет сжимающие усилия в нижней части вала и растягивающие силы в верхней части вала. При вращении вала происходит повторяющееся циклическое изменение прочности на сжатие и растяжение. Конструкция таких конструкций, как крылья самолета, которые подвергаются быстро меняющимся нагрузкам, требует значений усталостной прочности. На усталостную прочность влияют состояние поверхности, микроструктура, холодная обработка и коррозионная среда.
При частом повторении напряжения некоторые металлы выйдут из строя или разорвутся, даже если достаточное напряжение может не привести к остаточной деформации при непрерывном приложении в течение относительно короткого времени.Повторение напряжения может происходить в таких местах, как хвостовик перфоратора. Чередование стрессов может привести к отказу быстрее, чем повторение стресса. Под вариациями напряжения понимается попеременное сжатие и растяжение любого материала. Определение усталости — это разрушение сплавов и металлов, которые подвергаются переменным или повторяющимся напряжениям, слишком малым для создания остаточной деформации при статическом воздействии.
Прочность на сжатие :
Что означает прочность на сжатие?
Максимальная нагрузка при сжатии, которую материал может выдержать заданную величину деформации, или способность материала выдерживать давления, действующие в заданной плоскости, является прочностью на сжатие.
Прочность на сжатие как чугуна, так и бетона превышает их предел прочности на разрыв. Для большинства материалов верно обратное.
- Предел прочности :
Способность выдерживать давления в заданной плоскости или максимальную нагрузку при сжатии, которую материал будет выдерживать до того, как заданная величина деформации станет прочностью на сжатие.
Эластичность
Что такое эластичность металла?
Способность металла возвращаться к своему первоначальному размеру, форме и размерам после того, как он потерял форму, растянулся или деформировался, является эластичностью.Точка, в которой начинается необратимое повреждение, является пределом упругости. Точка, когда определенное повреждение происходит при небольшом увеличении нагрузки или без нее, является пределом текучести. Количество фунтов на квадратный дюйм (килопаскали), необходимое для деформации или повреждения до предела текучести, называется пределом текучести.
Что такое модуль упругости?Отношение внутреннего напряжения к производимой деформации — это модуль упругости. Он выражает жесткость материала.Для стали и большинства металлов это свойство является постоянным, и на него очень мало влияет термическая обработка, горячая или холодная обработка или фактический предел прочности металла.
Что такое закон Гука?
Согласно закону Гука: «Степень, в которой упругое тело изгибается или растягивается, принимая форму, прямо пропорциональна силе (напряжению), действующей на него». Но этот закон применяется только в определенном диапазоне.
Пластичность
Какое определение пластичности металла?
Свойство, которое позволяет металлу растягиваться без разрыва или изменяться, но при этом не ломаться, называется пластичностью металла.Это способность материала, такого как медь, постоянно растягиваться или вытягиваться без разрушения. Испытание на растяжение может определить пластичность металла путем измерения процента удлинения. Недостаток пластичности — это когда вы не видите необратимых повреждений до того, как металл сломается или потрескается (например, в чугуне).
В частности, способность вытягиваться от большего диаметра к меньшему диаметру проволоки — это пластичность. Эта операция подразумевает как удлинение, так и уменьшение площади.
Пластичность — это способность металла такого типа, как медь, вытягиваться или растягиваться под нагрузкой растяжения и постоянно деформироваться без разрушения или разрыва
ПластичностьЧто такое пластичность металла?
Пластичность — это способность металла, такого как свинец, серебро или золото, сильно деформироваться без разрушения. Пластичность подобна пластичности.
Пластичность вместе с прочностью считается двумя наиболее важными свойствами, которыми может обладать металл.
КовкостьКовкость — это способность материала постоянно деформироваться при сжатии без разрушения или разрыва. Именно это свойство позволяет прокатывать и штамповать металлы в тонкие листы.
Ковкость — это свойство металла, когда он может быть деформирован или сжат в прокатные листы
Большинство металлов обладают повышенной пластичностью и пластичностью при более высоких температурах. Например, железо и никель очень пластичны при нагревании до ярко-красного цвета.
Различные металлы не обладают одинаковыми двумя свойствами: пластичностью и пластичностью в одинаковой степени. Олово, серебро, свинец и золото обладают высокой пластичностью. Золото обладает исключительной пластичностью, и его можно свернуть в листы, достаточно тонкие, чтобы пропускать свет. Олово и свинец относительно пластичны, но у них нет прочности на разрыв, необходимой для получения тонкой проволоки.
Уменьшение площадиЭто показатель пластичности. Он берется из испытания на растяжение после разрушения путем записи исходной площади поперечного сечения образца в площадь поперечного сечения.
ХрупкостьСвойство, противоположное пластичности или пластичности, — хрупкость. Он может лопнуть при небольшой деформации. Твердые металлы часто бывают хрупкими. Термины не должны быть синонимами или путать. Хрупкий металл — это металл, который не может быть заметно деформирован навсегда, или металл, не обладающий пластичностью.
Хрупкость металла, подтвержденная отказом
Внезапный отказ называют «хрупкостью». Это происходит, когда металл ломается без предупреждения или без постоянно видимой деформации.Когда металл достигает предела упругости, он не имеет большого сопротивления разрыву.
ПрочностьПрочность — это сочетание средней пластичности и высокой прочности. Это способность материала или металла сопротивляться разрушению, а также способность противостоять разрушению после того, как повреждение началось. Закаленный металл, такой как холодное долото, может выдерживать значительные нагрузки, внезапные, медленные или приложенные, и который деформируется до выхода из строя. Прочность — это способность материала противостоять началу постоянной деформации, а также способность противостоять ударам или поглощать энергию.
Способность материала поглощать энергию, включая энергию как пластической деформации, так и упругости, при постепенно прикладываемой нагрузке, называется ударной вязкостью. Вообще говоря, вязкость относится как к пластичности, так и к прочности. Таким образом, низкопрочное легко деформируемое вещество оказывается вязким. Материал высокой прочности, но с небольшой пластичностью, такой как закаленная инструментальная сталь, также не является прочным. Настоящий прочный металл — это такой металл, который быстро распределяет внутри себя как результирующую деформацию, так и напряжение, вызванное быстро приложенной нагрузкой.
Обрабатываемость и свариваемостьСвойство обрабатываемости и свариваемости — это легкость или сложность, с которыми типы металлов поддаются механической обработке или сварке.
Сопротивление
Определение сопротивления истираниюСопротивление истиранию — это сопротивление истиранию.
Накладная износостойкая пластина из карбида хрома для обеспечения устойчивости к истиранию
Определение коррозионной стойкости и усталости
Устойчивость к атмосферному износу или разъеданию, влаге или другим агентам, таким как кислота, является коррозионной стойкостью.
Коррозионно-стойкие алюминиевые панели
Типом усталостного разрушения является коррозионная усталость, при которой предел выносливости снижается из-за коррозии с образованием ямок, которые действуют как центры развития усталостных трещин. Кроме того, когда усталостные напряжения разрушают любую металлическую защитную пленку, коррозия создает полости, которые распространяются через трещины в пленке, действуя как стрессоры.
Если изношенная металлическая деталь подвергается воздействию коррозионных агентов, таких как масло, не очищенное от кислоты или влажной атмосферы, напряжение, необходимое для выхода из строя, снижается.Удельное напряжение прочной термически обработанной легированной стали, подверженной коррозионной усталости, будет не более, чем относительно слабой конструкционной стали. Важно защитить поверхности материалов, подверженные усталости, от коррозии путем гальванизации и гальваники.
УдаропрочностьСтойкость металла к ударам оценивается по ударной вязкости. Металл может обладать удовлетворительной пластичностью при статических нагрузках, но может разрушиться при динамических нагрузках или ударах. Ударная вязкость металла определяется путем измерения энергии, поглощенной в трещине.
ТвердостьЧто такое твердость металла?
Способность металла сопротивляться проникновению и износу другим металлом или материалом называется твердостью. Чтобы выдержать тяжелые удары, требуется сочетание прочности и твердости. Твердость металла ограничивает легкость его обработки, поскольку твердость увеличивается с уменьшением ударной вязкости.
Термообработка позволяет упрочнить сталь. Причина термообработки стали состоит в том, чтобы сделать сталь лучше подходящей конструктивно и физически для каждого конкретного применения.
В таблице ниже показана твердость различных металлов.
Твердость — это способность металла сопротивляться износу и проникновению другим металлом или материалом. Чтобы выдержать тяжелые удары, требуется сочетание твердости и прочности.
Продолжение таблицы преобразования твердости металла
Типы металлов: испытания на твердость
- Испытание на твердость по Бринеллю : шарик из закаленной стали медленно прижимается известной силой к испытуемой металлической поверхности.Измеряется диаметр вмятины на поверхности. По стандартным таблицам определяется число твердости по Бринеллю (bhn).
- Испытание на твердость по Роквеллу: В этом испытании измеряется любое отклонение между глубиной, на которую контрольная точка вдавливается в металл легкой нагрузкой, и глубиной, на которую она вдавливается тяжелой нагрузкой. Сначала применяется легкая нагрузка. Затем, удерживая деталь в неподвижном состоянии, прикладывается большая нагрузка. Циферблат показывает номер твердости. Буквенные обозначения, такие как B и C по шкале Роквелла, указывают количество тяжелой нагрузки и тип используемого пенетратора.
- Тест на твердость склероскопом: Твердость измеряется с помощью молотка с алмазным наконечником, который падает под собственным весом с фиксированной высоты и отскакивает от поверхности. Шкала измеряет отскок от гладкой поверхности.
Механические свойства металлов
(в порядке собственности)
Как идентифицировать металлы
Когда вы выбираете типы металлов для использования в производстве, для выполнения механического ремонта или даже для определения свариваемости металла, вы должны быть в состоянии определить его основной тип.Некоторые методы полевой идентификации металла могут использоваться для идентификации металлического предмета. Некоторые распространенные методы:
- внешний вид поверхности
- искровое испытание
- чип тест
- магнитный тест
- испытание на твердость
Бесплатные брошюры по типам металлов
Типы металла: характеристики, плюсы и минусы каждого типа, общее использование
Механические свойства металлов: таблица ранжирования металлов на основе механических свойств
Список литературы
Структура металлов
Иллинойсский университет
Металлы и сплавы
Химические реакции, механизмы, органическая спектроскопия
Что такое точка плавления алюминия?
Джозеф Кипроп, 10 октября 2017 в Знаете ли вы,
Плавление алюминия — обязательная часть процесса переработки.Алюминий — это металл, который находится во втором ряду 13-й группы периодической таблицы Менделеева. Это третий по распространенности элемент после кислорода и кремния, обнаруженный в земной коре.Алюминий естественным образом встречается в соединениях, но никогда в виде чистого металла. Процесс извлечения алюминия из его соединений сложен и довольно сложен. Алюминий — полезный и распространенный металл, который известен своей легкостью, пластичностью и устойчивостью к коррозии. Алюминий, как правило, легче перерабатывать, чем очищать от руды. Он также достаточно безопасен при контакте с кожей и при использовании с едой.
Что такое точка плавления алюминия?
Точка плавления вещества определяется как температура, при которой вещество переходит из твердого состояния в жидкое, но при определенном атмосферном давлении.Именно в точке плавления жидкое и твердое состояния вещества находятся в равновесии. Однако температура плавления вещества в основном зависит от давления; он часто бывает специфическим при стандартном давлении в стандартных материалах. Точка плавления вещества также называется ликвидусом, точкой разжижения или солидусом. Температура плавления алюминия составляет 659 градусов по Цельсию или 1218 по Фаренгейту.
Какова цель определения температуры плавления вещества?
Температура плавления вещества является важным физическим свойством.Основная цель определения точек кипения и плавления веществ во время лабораторного эксперимента — использовать результаты для выявления примесей в этих веществах или неизвестных веществ. Точка плавления неизвестного твердого вещества может быть использована для его идентификации путем сравнения с множеством других потенциальных твердых веществ и их точек плавления, что позволяет идентифицировать твердое тело. Кроме того, цель определения температуры плавления вещества — использовать диапазон его точек плавления, чтобы определить его общую чистоту.В этом отношении, чем больше диапазон плавления вещества, тем менее чистое вещество, а чем больше уменьшается диапазон температуры плавления, тем чище вещество.
Факторы, влияющие на температуру плавления веществ
Температура плавления вещества варьируется от одного вещества к другому. Например, кислород тает при 218 градусах Цельсия, лед тает при 0 градусах Цельсия, а алюминий — при 219 градусах Цельсия.Следовательно, определенные вещи влияют на температуру плавления различных веществ. Факторы, влияющие на температуру плавления веществ, включают межмолекулярные силы, изменения температуры плавления ионных связей, форму молекул и размер молекул. Чистое кристаллическое соединение обычно имеет более точную температуру плавления, поэтому полностью плавится в небольшом диапазоне температур, не превышающем 0,5–1 градус Цельсия. Если такое вещество содержит хотя бы малейшее количество примесей, обычно возникает депрессия в точках замерзания, показывающая увеличение ширины диапазона точек плавления.Если диапазон температур плавления превышает пять градусов, это означает, что вещество нечисто.
Использование алюминия
Алюминий — один из самых полезных металлов в мире. В чистом виде алюминий в основном используется в электронной промышленности для изготовления жестких дисков, проводников на кремниевых микросхемах и фольги конденсаторов. Когда металл сплавлен с другими металлами, такими как кремний, цинк, медь и магний, он становится еще прочнее.Другое важное применение алюминия — производство банок для напитков и фольги, используемой для защиты продуктов питания и различных кухонных принадлежностей.
.Ученые открыли самый жаропрочный материал с температурой плавления выше 4000 градусов Цельсия
Исследователи из Имперского колледжа в Лондоне (Imperial College of London) обнаружили, что смесь карбида тантала и карбида гафния в определенных пропорциях является материалом, имеющим самую высокую температуру плавления среди всех известных людям материалов. Точка плавления этого композитного керамического материала вплотную приблизилась к отметке в 4 тысячи градусов Цельсия, и это позволит создать на базе такой керамики новый класс жаропрочных материалов, выступающих в качестве тепловой защиты космических кораблей и будущих гиперзвуковых авиалайнеров.
Воспользуйтесь нашими услугами
Карбид тантала (TaC) и карбид гафния (HfC) являются высокостабильными химическими соединениями, способные, помимо чрезвычайно высокой температуры, выдержать еще целый ряд экстремальных неблагоприятных факторов, которые присутствуют в перегретой среде активных зон атомных реакторов, к примеру.
До последнего времени у ученых отсутствовала возможность точного измерения температуры точки плавления композитных керамических материалов на основе карбида тантала и карбида гафния, традиционными методами удавалось измерить лишь температуру точки плавления каждого из этих материалов в отдельности и самых низкотемпературных вариантов их комбинаций.
В своих исследованиях ученые из Лондона использовали чистые карбид тантала, карбид гафния, и три вида их “керамического сплава” Ta1?xHfxC, при x = 0.8, 0.5 и 0.2. А для измерения температур точек плавления этих материалов использовалась специально для этого разработанная технология лазерного нагрева.
Для нагрева керамического материала использовалась последовательность из четырех лазерных импульсов. Первым импульсом был самый низкоэнергетический импульс, длительность которого составляла около 1000 миллисекунд. Мощность каждого последующего импульса увеличивалась, с одновременным уменьшением его длительности на несколько сотен миллисекунд. Такой плавный и многоэтапный разогрев материала был необходим для минимизации возникающих тепловых напряжений в материале и снижения риска механического разрушения испытуемых образцов.
Полученные учеными результаты полностью подтверждают результаты предыдущих исследований. Согласно этим результатам чистый карбид тантала плавится при температуре 3768 градусов Цельсия, а температура плавления карбида гафния составляет 3958 градусов Цельсия. Самую высокую температуру точки плавления имеет композитный керамический материал HfC0.98, который плавится при температуре 3959 градусов Цельсия, и этот материал является самым тугоплавким материалом на сегодняшний день.
В ближайшем времени ученые планируют проведение подобных исследований по отношению к композитным керамическим материалам с другим процентным содержанием исходных компонентов. Кроме этого, планируется произвести исследования материалов, состоящих из четырех типов атомов Ta-Hf-C-N, которые, согласно теории, должны иметь еще большую температуру плавления нежели материалы на основе трех типов атомов Ta-Hf-C.
Воспользуйтесь нашими услугами
Тугоплавкие металлы — Вики
| H | He | |||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| Li | Be | B | C | N | O | F | Ne | |||||||||||
| Na | Mg | Al | Si | P | S | Cl | Ar | |||||||||||
| K | Ca | Sc | Ti | V | Cr | Mn | Fe | Co | Ni | Cu | Zn | Ga | Ge | As | Se | Br | Kr | |
| Rb | Sr | Y | Zr | Nb | Mo | Tc | Ru | Rh | Pd | Ag | Cd | In | Sn | Sb | Te | I | Xe | |
| Cs | Ba | La | * | Hf | Ta | W | Re | Os | Ir | Pt | Au | Hg | Tl | Pb | Bi | Po | At | Rn |
| Fr | Ra | Ac | ** | Rf | Db | Sg | Bh | Hs | Mt | Ds | Rg | |||||||
| * | Ce | Pr | Nd | Pm | Sm | Eu | Gd | Tb | Dy | Ho | Er | Tm | Yb | Lu | ||||
| ** | Th | Pa | U | Np | Pu | Am | Cm | Bk | Cf | Es | Fm | Md | No | Lr | ||||
| Тугоплавкие металлы | Расширенная группа тугоплавких металлов[1] |
Тугоплавкие металлы — класс химических элементов (металлов), имеющих очень высокую температуру плавления и стойкость к изнашиванию. Выражение тугоплавкие металлы чаще всего используется в таких дисциплинах как материаловедение, металлургия и в технических науках. Определение тугоплавких металлов относится к каждому элементу группы по разному. Основными представителями данного класса элементов являются элементы пятого периода — ниобий и молибден; третьего периода — тантал, вольфрам и рений. Все они имеют температуру плавления выше 2000 °C, химически относительно инертны и обладают повышенным показателем плотности. Благодаря порошковой металлургии из них можно получать детали для разных областей промышленности.
Определение
Большинство определений термина тугоплавкие металлы определяют их как металлы имеющие высокие температуры плавления. По этому определению, необходимо, что бы металлы имели температуру плавления выше 2 200 °C. Это необходимо для их определения как тугоплавких металлов[2]. Пять элементов — ниобий, молибден, тантал, вольфрам и рений входят в этот список как основные[3], в то время как более широкое определение этих металлов позволяет включить в этот список еще и элементы имеющие температуру плавления 2123K (1850 °C) — титан, ванадий, хром, цирконий, гафний, рутений и осмий. Трансурановые элементы (все изотопы которых нестабильны и на земле их найти очень трудно) никогда не будут относиться к тугоплавким металлам[4].
Свойства
Физические свойства
Температура плавления этих элементов самая высокая, исключая углерод и осмий. Данное свойство зависит не только от их свойств, но и от свойств их сплавов. Металлы имеют кубическую сингонию, исключая рений, у которого она принимает вид гексагональной плотнейшей упаковки. Большинство физических свойств элементов в этой группе существенно различаться, потому что они являются членами различных групп[5][6].
Сопротивление к не указано название статьи является определяющим свойством тугоплавких металлов. У обычных металлов деформация начинается с температуры плавления металла, а отсюда деформация ползучести в алюминиевых сплавах начинается от 200 °C, в то время как у тугоплавких металлов она начинается от 1500 °C. Это сопротивление к деформации и высокая температура плавления позволяет тугоплавким металлам быть использованными, например, в качестве деталей реактивных двигателей или при ковке различных материалов[7][8].
Химические свойства
На открытом воздухе подвергаются окислению. Эта реакция замедляется в связи с формированием пассивированного слоя. Оксид рения является очень неустойчивым, потому что при пропускании плотного потока кислорода его оксидная плёнка испаряется. Все они относительно устойчивы к воздействию кислот.[5]
Применение
Тугоплавкие металлы используются в качестве источников света, деталей, смазочных материалов, в ядерной промышленности в качестве АРК, в качестве катализатора. Из-за того, что они имеют высокие температуры плавления, они никогда не используются в качестве материала для выплавки на открытом месте. В порошкообразном виде материал уплотняют с помощью плавильных печей. Тугоплавкие металлы можно переработать в проволоку, слиток, арматуру, жесть или фольгу.
Вольфрам и его сплавы
Вольфрам был найден в 1781 году шведским химиком Карлом Вильгельмом Шееле. Вольфрам имеет самую высокую температуру плавления среди всех металлов — 3422 °C.
Рений используется в сплавах с вольфрамом в концентрации до 22 %, что позволяет повысить тугоплавкость и устойчивость к коррозии. Торий применяется в качестве легирующего компонента вольфрама. Благодаря этому повышается износостойкость материалов. В порошковой металлургии компоненты могут быть использованы для спекания и последующего применения. Для получения тяжёлых сплавов вольфрама применяются никель и железо или никель и медь. Содержание вольфрама в данных сплавах как правило выше 90 %. Смешивание легирующего материала с ним низкое даже при спекании[9].
Вольфрам и его сплавы по-прежнему используются там, где присутствуют высокие температуры, но нужна однако высокая твёрдость и где высокой плотностью можно пренебречь[10]. Нити накаливания, состоящие из вольфрама, находят свое применение в быту и в приборостроении. Лампы более эффективно преобразовывают электроэнергию в свет с повышением температуры[9]. В не указано название статьи оборудование используется постоянно, без плавления электрода. Высокая температура плавления вольфрама позволяет ему быть использованным при сварке без затрат[11][12]. Высокая плотность и твёрдость позволяют вольфраму быть использованным в артиллерийских снарядах[13]. Его высокая температура плавления применяется при строении ракетных сопел, примером может служить ракета «Поларис»[14]. Иногда он находит свое применение благодаря своей плотности. Например, он находит свое применение в производстве клюшек для гольфа[15][16]. В таких деталях применение не ограничивается вольфрамом, так как более дорогой осмий тоже может быть использован.
Сплавы молибдена
Широкое применение находят сплавы молибдена. Наиболее часто используемый сплав — титан-цирконий-молибден — содержит в себе 0,5 % титана, 0,08 % циркония и остальное молибден. Сплав обладает повышенной прочностью при высоких температурах. Рабочая температура для сплава — 1060 °C. Высокое сопротивление сплава вольфрам-молибден (Mo 70 %, W 30 %) делает его идеальным материалом для отливки деталей из цинка, например, клапанов[17].
Молибден используется в ртутных герконовых реле, так как ртуть не формирует амальгамы с молибденом[18][19].
Молибден является самым часто используемым тугоплавким металлом. Наиболее важным является его использование в качестве усилителя сплавов стали. Применяется при изготовлении трубопроводов вместе с нержавеющей сталью. Высокая температура плавления молибдена, его сопротивляемость к износу и низкий коэффициент трения делают его очень полезным материалом для легирования. Его прекрасные показатели трения приводят его к использованию в качестве смазки где требуется надежность и производительность. Применяется при производстве ШРУСов в автомобилестроении. Большие месторождения молибдена находятся в Китае, США, Чили и Канаде[20][21][22][23].
Сплавы ниобия
Тёмная часть сопла Apollo CSM сделана из сплава титан-ниобий.Ниобий почти всегда находится вместе с танталом; ниобий был назван в честь Ниобы, дочери Тантала в греческой мифологии. Ниобий находит множество путей для применения, некоторые он разделяет с тугоплавкими металлами. Его уникальность заключается в том, что он может быть разработан путем отжига для того, чтобы достичь широкого спектра показателей твёрдости и упругости; его показатель плотности самый малый по сравнению с остальными металлами данной группы. Он может применяться в электролитических конденсаторах и является самым частым металлом в суперпроводниковых сплавах. Ниобий может применяться в газовых турбинах воздушного судна, в электронных лампах и ядерных реакторах.
Сплав ниобия C103, который состоит из 89 % ниобия, 10 % гафния и 1 % титана, находит свое применение при создании сопел в жидкостных ракетных двигателях, например таких как не указано название статьи[24]. Применявшийся сплав не позволяет ниобию окисляться, так как реакция происходит при температуре от 400 °C[24].
Тантал
Тантал является самым стойким к коррозии металлом из всех тугоплавких металлов.
Важное свойство тантала было выявлено благодаря его применению в медицине — он способен выдерживать кислую среду (организма). Иногда он используется в электролитических конденсаторах. Применяется в конденсаторах сотовых телефонов и компьютера.
Сплавы рения
Рений является самым последним открытым тугоплавким элементом из всей группы. Он находится в низких концентрациях в рудах других металлов данной группы — платины или меди. Может применяться в качестве легирующего компонента с другими металлами и придает сплавам хорошие характеристики — ковкость и увеличивает предел прочности. Сплавы с рением могут применяться в компонентах электронных приборов, гироскопах и ядерных реакторах. Самое главное применение находит в качестве катализатора. Может применяться при алкилировании, деалкилировании, гидрогенизации и окислении. Его столь редкое присутствие в природе делает его самым дорогим из всех тугоплавких металлов[25].
Общие свойства тугоплавких металлов
Тугоплавкие металлы и их сплавы привлекают внимание исследователей из-за их необычных свойств и будущих перспектив в применении.
Физические свойства тугоплавких металлов, таких как молибден, тантал и вольфрам, их показатели твёрдости и стабильность при высоких температурах делает их используемым материалом для горячей металлообработки материалов как в вакууме, так и без него. Многие детали основаны на их уникальных свойствах: например, вольфрамовые нити накаливания способны выдерживать температуры вплоть до 3073K.
Однако, их сопротивляемость к окислению вплоть до 500 °C делает это одним из главных недостатков этой группы. Контакт с воздухом может существенно повлиять на их высокотемпературные характеристики. Именно поэтому их используют в материалах, в которых они изолированы от кислорода (например лампочка).
Сплавы тугоплавких металлов — молибдена, тантала и вольфрама — применяются в деталях космических ядерных технологий. Эти компоненты были специально созданы в качестве материала способного выдержать высокие температуры (от 1350K до 1900K). Как было указано выше, они не должны контактировать с кислородом.
См. также
Примечания
- ↑ H. Ortner. International Journal of Refractory Metals and Hard Materials (англ.). Elsevier. Дата обращения: 26 сентября 2010. Архивировано 20 июня 2012 года.
- ↑ Michael Bauccio. Refractory metals // ASM metals reference book / American Society for Metals. — ASM International, 1993. — С. 120—122. — ISBN 19939780871704788.
- ↑ Wilson, J. W. General Behaviour of Refractory Metals // Behavior and Properties of Refractory Metals. — Stanford University Press, 1965. — С. 1—28. — 419 с. — ISBN 9780804701624.
- ↑ Joseph R. Davis. Alloying: understanding the basics. — ASM International, 2001. — С. 308—333. — 647 с. — ISBN 9780871707444.
- ↑ 1 2 Borisenko, V. A. Investigation of the temperature dependence of the hardness of molybdenum in the range of 20—2500 °C // Журнал Soviet Powder Metallurgy and Metal Ceramics. — 1963. — С. 182. — doi:10.1007/BF00775076.
- ↑ Fathi, Habashi. Historical Introduction to Refractory Metals // Журнал Mineral Processing and Extractive Metallurgy Review. — 2001. — С. 25—53. — doi:10.1080/08827509808962488.
- ↑ Schmid, Kalpakjian. Creep // Manufacturing engineering and technology. — Pearson Prentice Hall, 2006. — С. 86—93. — 1326 с. — ISBN 9787302125358.
- ↑ Weroński, Andrzej; Hejwowski, Tadeusz. Creep-Resisting Materials // Thermal fatigue of metals. — CRC Press, 1991. — С. 81—93. — 366 с. — ISBN 9780824777265.
- ↑ 1 2 Erik Lassner, Wolf-Dieter Schubert. Tungsten: properties, chemistry, technology of the element, alloys, and chemical compounds. — Springer, 1999. — С. 255—282. — 422 с. — ISBN 9780306450532.
- ↑ National Research Council (U.S.), Panel on Tungsten, Committee on Technical Aspects of Critical and Strategic Material. Trends in Usage of Tungsten: Report. — National Research Council, National Academy of Sciences-National Academy of Engineering, 1973. — С. 1—3. — 90 с.
- ↑ Michael K. Harris. Welding Health and Safety // Welding health and safety: a field guide for OEHS professionals. — AIHA, 2002. — С. 28. — 222 с. — ISBN 9781931504287.
- ↑ William L. Galvery, Frank M. Marlow. Welding essentials: questions & answers. — Industrial Press Inc., 2001. — С. 185. — 469 с. — ISBN 9780831131517.
- ↑ W. Lanz, W. Odermatt, G. Weihrauch (7—11 мая 2001). «KINETIC ENERGY PROJECTILES: DEVELOPMENT HISTORY, STATE OF THE ART, TRENDS» in 19th International Symposium of Ballistics..
- ↑ P. Ramakrishnan. Powder metallurgyfor Aerospace Applications // Powder metallurgy: processing for automotive, electrical/electronic and engineering industry. — New Age International, 2007. — С. 38. — 381 с. — ISBN 8122420303.
- ↑ Arora, Arran. Tungsten Heavy Alloy For Defence Applications // Журнал Materials Technology. — 2004. — Вып. 19, № 4. — С. 210—216.
- ↑ V. S. Moxson, F. H. Froes. Fabricating sports equipment components via powder metallurgy // Журнал JOM. — 2001. — Вып. 53. — С. 39. — doi:10.1007/s11837-001-0147-z.
- ↑ Robert E. Smallwood. TZM Moly Alloy // ASTM special technical publication 849: Refractory metals and their industrial applications: a symposium. — ASTM International, 1984. — С. 9. — 120 с. — ISBN 19849780803102033.
- ↑ Kozbagarova, G. A.; Musina, A. S.; Mikhaleva, V. A. Corrosion Resistance of Molybdenum in Mercury // Журнал Protection of Metals. — 2003. — Вып. 39. — С. 374—376. — doi:10.1023/A:1024903616630.
- ↑ Gupta, C. K. Electric and Electronic Industry // Extractive Metallurgy of Molybdenum. — CRC Press, 1992. — С. 48—49. — 404 с. — ISBN 9780849347580.
- ↑ Michael J. Magyar. Commodity Summary 2009:Molybdenum (неопр.). United States Geological Survey. Дата обращения: 26 сентября 2010. Архивировано 20 июня 2012 года.
- ↑ D.R. Ervin, D.L. Bourell, C. Persad, L. Rabenberg. Structure and properties of high energy, high rate consolidated molybdenum alloy TZM // Журнал Materials Science and Engineering: A. — 1988. — Вып. 102. — С. 25.
- ↑ Neikov Oleg D. Properties of Molybdenum and Molybdenum Alloys powder // Handbook of Non-Ferrous Metal Powders: Technologies and Applications. — Elsevier, 2009. — С. 464—466. — 621 с. — ISBN 9781856174220.
- ↑ Joseph R. Davis. Refractory Metalls and Alloys // ASM specialty handbook: Heat-resistant materials. — ASM International, 1997. — С. 361—382. — 591 с. — ISBN 9780871705969.
- ↑ 1 2 John Hebda. Niobium alloys and high Temperature Applications // Журнал Niobium Science & Technology: Proceedings of the International Symposium Niobium 2001 (Orlando, Florida, USA). — Companhia Brasileira de Metalurgia e Mineração, 2001.
- ↑ J. W. Wilson. Rhenium // Behavior and Properties of Refractory Metals. — Stanford University Press, 1965. — ISBN 9780804701624.
Литература
- Levitin, Valim. High Temperature Strain of Metals and Alloys: Physical Fundamentals. — WILEY-VCH, 2006. — ISBN 978-3-527-31338-9.
- Brunner, T. Chemical and structural analyses of aerosol and fly-ash particles from fixed-bed biomass combustion plants by electron microscopy, 1st World Conference on Biomass for Energy and Industry: proceedings of the conference held in Sevilla, Spain, 5—9 June 2000, London: James & James Ltd (2000). Дата обращения 26 сентября 2010.
- Donald Spink. Reactive Metals. Zirconium, Hafnium, and Titanium // Журнал Industrial & Engineering Chemistry. — 1961. — Вып. 53, № 2. — С. 97—104. — doi:10.1021/ie50614a019.
- Earl Hayes. Chromium and Vanadium // Журнал Industrial & Engineering Chemistry. — 1961. — Вып. 53, № 2. — С. 105—107. — doi:10.1021/ie50614a020.
17 металлов с наивысшими температурами плавления (и почему) — Материаловедение и инженерия
Знаете ли вы, что вольфрам плавится более чем на 3400 ° C (6200 ° F) выше, чем ртуть? Вольфрам — это металл с самой высокой температурой плавления, но почему для превращения вольфрама из твердого в жидкое требуется столько энергии?
Температура плавления материала в первую очередь связана с прочностью сцепления. Материалы с прочными связями между атомами будут иметь высокую температуру плавления. Однако другие факторы, такие как кристаллическая структура, атомный вес и электронная структура, также могут влиять на температуру плавления.
Но прежде чем мы углубимся в статью, посвященную металлам, я хочу быстро отметить, что металлы не обязательно имеют самую высокую температуру плавления по сравнению с другими материалами.
Металлическое соединение определенно прочнее, чем соединение Ван-дер-Ваальса, но керамика (имеющая ионную или ковалентную связь) имеет еще более высокие температуры плавления! Графит, карбид гафния, карбид тантала и другие керамические материалы имеют даже более высокие температуры плавления, чем вольфрам!
Список металлов с высокой температурой плавления
Прежде чем я перейду к научному объяснению, вот список тех 17 элементарных металлов с наивысшими температурами плавления.(Я также перечислил кристаллическую структуру, которая появится позже). Как видите, вольфрам занимает первое место с удивительной температурой плавления 3380 ° C.
- Вольфрам (Вт)
3380 ° C, BCC - Рений (Re)
3180 ° C, HCP - Осмий (Os)
3027 ° C, HCP - Тантал (Ta)
3014 ° C, BCC - Молибден (Mo)
2617 ° C, BCC - Ниобий (Nb)
2468 ° C, BCC - Иридий (Ir)
2447 ° C, FCC - Рутений (Ru)
2250 ° C, HCP - Гафний (Hf)
2227 ° C, HCP - Технеций (Tc)
2200 ° C, HCP, радиоактивный - Родий (Rh)
1963 ° C, FCC - Ванадий (V)
1902 ° C, BCC - Хром (Cr)
1857 ° C, BCC - Цирконий (Zr)
1852 ° C, HCP - Платина (Pt)
1769 ° C, FCC - Торий (Th)
1755 ° C, FCC, радиоактивный - Титан (Ti)
1670 ° C, HCP
Сплавы с высокой температурой плавления
Сплавы с высокой температурой плавления на самом деле не относятся к категории материалов.Каждый раз, когда вы объединяете металлы в твердом растворе (т.е. делаете сплав), температура плавления будет снижаться.
Если вам нужен металл с высокой температурой плавления, вам, вероятно, придется выбирать чистый металл. Во многих случаях вам, вероятно, удастся избежать легкого легирования одним из чистых элементов, перечисленных выше, но на самом деле невозможно разработать сплавы с повышенной температурой плавления.
«Жаропрочные» сплавы — это настоящая категория в материаловедении. В большинстве случаев материалы выходят из строя при высоких температурах еще до того, как они расплавятся.Высокие температуры делают металлы более мягкими и более подверженными окислению или коррозии.
Эта статья посвящена исключительно явлению металлов с высокими температурами плавления, но суперсплавы (на основе Ni, Co или Fe, 1300-1500 ° C в верхнем диапазоне), титановые сплавы и вольфрамовые сплавы могут считаться жаропрочными сплавами. благодаря сочетанию высокой температуры плавления, хорошей прочности при высоких температурах и стойкости к окислению / коррозии
В чем причина высоких точек плавления?
Простой ответ: энергия связи.
Твердое тело можно представить как группу связанных вместе атомов, которые колеблются взад и вперед, но обычно остаются в одном и том же положении.
Колебание атомов — их кинетическая энергия — это то, что мы обычно называем температурой. Более высокая температура означает, что атомы вибрируют быстрее. В какой-то момент они так быстро вибрируют, что могут разорвать свои узы и проскользнуть мимо друг друга.
У каждого атома своя вибрация, поэтому даже в твердом состоянии есть некоторые атомы, которые могут временно разрывать свои связи и перемещаться через материал.Это явление называется «диффузией».
«Таяние» — это когда большая часть облигаций разрывается. В кристаллических твердых телах, таких как металлы, все связи имеют одинаковую длину и силу, поэтому есть точная точка, в которой почти все атомы получают достаточно тепловой энергии, чтобы разорвать свои связи. Чем больше энергии требуется для достижения этой точки, тем выше температура плавления.
Так когда же атомы достигают этой точки?
Наиболее очевидный фактор — прочность прямого склеивания. Прочность связи немного сложно определить количественно, но двумя показателями прочности связи являются энтальпия образования , которая представляет собой изменение энтальпии для образования моля материала, и энергия диссоциации связи , которая представляет собой энергию, выделяемую при разрыве соединения. связь между двумя атомами.
В таблице энергий связи Каллистера учебник фактически представляет таблицу энтальпии образования. Вот график прочности связи (представленной энтальпией образования И энергией диссоциации связи) по сравнению с температурой плавления.
Есть еще несколько свойств, которые влияют на температуру плавления, но не учитываются в энтальпии образования или энергии диссоциации связи. Например: сколько связей окружает атом?
В целом, мы считаем, что большинства эффектов от связей являются результатом ближайших соседей атома или тех, которые непосредственно «касаются» его.(Хотя есть эффект и от соседних атомов — например, если вы создаете наночастицы всего из нескольких атомов, связи меньше, чем обычно, и наночастица будет иметь более низкую температуру плавления, чем объемный материал).
Кристаллическая структура элемента определяет длину связи и количество ближайших соседей (также называемое «координационным числом»). Это влияет на прочность связи таким образом, что она не улавливается энергией диссоциации связи, но отражается на температуре плавления.
Вот почему элементы с высокими температурами плавления обычно имеют кристаллическую структуру с высокой степенью упаковки: FCC, HCP или BCC. Фактически, элементы с самой высокой температурой плавления обычно имеют структуру ОЦК. BCC почти плотно упакован, поэтому он довольно стабилен, но я полагаю, что немного более низкая плотность позволяет атомам больше шевелиться без необходимости разжижения. Чтобы получить (очень сложное) математическое доказательство того, почему BCC является наиболее стабильной высокотемпературной фазой, ознакомьтесь с этой статьей Александра и МакТага.
Поскольку металлическая связь означает, что атомы окружены морем электронов, существует также несколько характеристик электронной структуры атома, которые также могут влиять на прочность связи, измеренную путем плавления.
Например, вы заметите, что многие металлы с высокими температурами плавления имеют частично полные d-суборбитали.
Это означает, что у этих атомов есть много электронов, которые вносят вклад в море электронов, обычно увеличивая силы взаимодействия в металле.
Более крупные атомы также имеют тенденцию быть более плотно упакованными и весят больше. Поскольку кинетическая энергия равна, более тяжелые атомы будут колебаться медленнее при той же температуре, что и более легкий атом. Более медленные колебания означают, что у атомов будет больше времени для взаимодействия друг с другом, что также может способствовать повышению температуры плавления.
Каковы общие свойства металлов с высокой температурой плавления?
Поскольку я выбрал 17 элементов с наивысшей температурой плавления, эти элементы весьма разнообразны.Их температуры плавления колеблются от 1670 ° C до 3380 ° C, поэтому у них нет ничего общего.
Однако все они имеют кристаллические структуры BCC, HCP или FCC, которые являются наиболее плотно упакованными и наиболее стабильными кристаллическими структурами.
Металлы из моего списка с самой высокой температурой плавления также являются тугоплавкими металлами . Это особый вид металла с определенным набором свойств. Вы можете прочитать все о тугоплавких металлах в этой статье, но вкратце их:
- Плотный
- Твердый (особенно вольфрам и рений)
- Химически инертный
- Легко окисляемый
- Устойчивый к ползучести
Тугоплавкие металлы также имеют кристаллическую структуру BCC (за исключением рения, который является HCP).
Применение металлов с высокой температурой плавления
Для многих областей применения требуются металлы с высокой температурой плавления. Для таких применений, как нити накаливания ламп накаливания, где требуется только металл с высокой температурой плавления и ничего больше, вольфрам обычно является предпочтительным металлом.
Вольфрам — металл с самой высокой температурой плавления. Кроме того, он относительно дешев, поэтому нет никаких аргументов в пользу использования «более дешевого» металла с немного более низкой температурой плавления.Такие элементы, как рений, тантал и молибден, обычно используются, потому что они обладают некоторыми другими свойствами в дополнение к высокой температуре плавления (например, более низкой плотностью).
Вольфрам (Вт)
Металл, выдерживающий самые высокие температуры, тоже не особенно дорогой, поэтому вольфрам — лучший металл для высокотемпературных применений, таких как накаливания ламп накаливания , сварочные электроды , и печные нагревательные элементы .
Рений (Re)
Используется в суперсплавах для реактивных двигателей для замедления диффузии (в основном для этой цели используется 70% извлеченного рения ). Это редкий / дорогой элемент, поэтому он редко используется в качестве основного основного металла в сплаве.
Осмий (Os)
На самом деле, его применение почти не имеет ничего общего с его высокой температурой плавления, потому что оксид осмия очень токсичен. Однако он может быть чрезвычайно твердым / износостойким при обычных температурах — например, вы могли использовать сплав осмия и иридия для наконечников перьевой ручки.
Тантал (Ta)
Тантал используется для изготовления жаропрочных коррозионно-стойких сплавов, таких как те, которые используются в деталях вакуумных печей .
Молибден (Mo)
Как и многие другие материалы в его списке, молибден в основном используется для сплава с другими металлами. Он находит значительное применение в суперсплавах для реактивных двигателей. Это полезный легирующий элемент, поскольку он относительно легкий.Mo и Nb имеют наилучшее сочетание низкой плотности и высокой температуры плавления.
Ниобий (Nb)
Ниобий — элемент, используемый в суперсплавах. Сплавы на основе ниобия также используются в аэрокосмической технике в качестве материалов для сопел двигателей жидких ракет.
Иридий (Ir)
В авиации используются свечи зажигания на основе иридия . Он в основном используется в приложениях, связанных с электроникой.
Рутений (Ru)
Когда дело доходит до высокотемпературных применений, рутений используется в качестве легирующей добавки к суперсплавам.Рутений также может быть легирован платиной для повышения износостойкости платины без потери других свойств платины.
Гафний (Hf)
Как и многие другие материалы в этом списке, гафний в основном используется для сплава с другими металлами, такими как Fe, Ti, Nb, Ta и другими. Сплав C103, состоящий из Nb (89%), Hf (10%) и Ti (1%), использовался в соплах жидкостных ракетных двигателей маршевого двигателя Apollo Lunar Modules. Иногда его добавляют в суперсплавы на основе никеля для улучшения адгезии защитных оксидных слоев.
Технеций (Tc)
Технеций радиоактивен, что как бы ограничивает его применение. Однако его можно использовать для получения медицинских радиоактивных изображений, а также его можно легировать сталью для повышения коррозионной стойкости. Вам просто нужно убедиться, что эта сталь находится в месте, недоступном для людей!
Родий (Rh)
Родий — благородный металл, который редко вступает в реакцию с другими химическими веществами, что может сделать его хорошим катализатором.Как и Pt, Rh используется для проводов, которые могут подвергаться воздействию горячей / коррозионной среды. Pt может выдерживать высокие температуры и коррозию без легирования , что позволяет ей сохранять свою электропроводность. Родий даже реже платины.
Ванадий (V)
Ванадий используется в реактивных двигателях в качестве легирующей добавки к техническому титановому сплаву (Ti-6Al-4V). Один сплав на основе ванадия (V-4Cr-4Ti) является многообещающим кандидатом для использования в будущих термоядерных реакторах
.Хром (Cr)
Хотя хром имеет высокую температуру плавления, он более известен своей низкой плотностью и стойкостью к окислению.Cr является основным легирующим элементом (помимо железа) в нержавеющей стали, и он легируется в турбинах из суперсплавов. Даже если жаропрочные сплавы не содержат непосредственно Cr, они могут иметь тонкое покрытие из сплава Cr для стойкости к окислению.
Цирконий (Zr)
Когда дело доходит до высокотемпературных применений, цирконий широко используется в форме оксида циркония. YSZ — ZrO 2 -8 мас.% Y 2 O 3 (так называемый оксид циркония, стабилизированный иттрием) — широко используемое защитное покрытие, целью которого является повышение максимальной рабочей температуры суперсплавов, используемых в реактивных двигателях.
Платина (Pt)
Платина — благородный металл, который редко вступает в реакцию с другими химическими веществами, что может сделать его хорошим катализатором. Среди высокотемпературных применений Pt используется для проводов, которые могут подвергаться воздействию горячей / коррозионной среды. Pt может выдерживать высокие температуры и коррозию без легирования , что позволяет ей сохранять свою электропроводность.
Торий (Th)
Торий радиоактивен.Тем не менее, торий (диоксид тория) имеет самую высокую температуру плавления из всех известных оксидов — 3300 ° C. Таким образом, он может оставаться твердым в пламени и использоваться в газовых оболочках.
Титан (Ti)
Титан применяется в компрессорах реактивных двигателей (Ti-6Al-4V).
Последние мысли
Вот и все! 17 металлов с самой высокой температурой плавления — вообще говоря, потому что у них самые прочные связи.
Определенная подгруппа этой группы с наивысшими температурами плавления, такая как вольфрам, рений и тантал, называется тугоплавкими металлами .Вы можете прочитать все о тугоплавких металлах, щелкнув эту статью!
Ссылки и дополнительная литература
Для (очень сложного) математического доказательства того, почему BCC является наиболее стабильной высокотемпературной фазой, ознакомьтесь с этой статьей Александра и МакТага.
В этой статье мы нашли информацию о корреляции между энергией связи и температурой плавления для разных элементов.
Энергии диссоциации связи для различных элементов были взяты из этой статьи.
Поставщики вольфрамовых сплавов — Металлический вольфрам
Вольфрам, также известный как Вольфрам, представляет собой металл, который представлен химическим символом W и атомным номером 74. Металлический вольфрам находится в середине периодической таблицы с группой металлических элементов, называемых переходными металлами. Эти металлы обладают схожими физическими и химическими свойствами.
Одним из уникальных свойств вольфрама является его очень высокая температура плавления — 3 422 ° C (6 191,6 ° F). Это самая высокая температура плавления любого металла.Вольфрам — самый тяжелый из встречающихся в природе металлов, который сохраняет свою прочность при очень высоких температурах. Эти свойства объясняют основное применение вольфрама и нашу область знаний — производство вольфрамовых сплавов.
В чистом виде вольфрам может быть хрупким, и его трудно обрабатывать. Как уже упоминалось, вольфрам имеет температуру плавления выше 3000 ° C, его также нельзя отливать, экструдировать или легко формовать. Используя наши знания в области технологий порошковой металлургии, мы производим вольфрам в виде композитов с металлической матрицей.Затем эти вольфрамовые сплавы можно обрабатывать обычными методами для производства очень сложных и требовательных деталей.
Наш вольфрамовый сплав Wolfmet состоит из 90-97% вольфрама в зависимости от марки. Вольфрамовый сплав сохраняет уникальные свойства чистого вольфрама по плотности и защите от излучения, и в то же время его легче обрабатывать с соблюдением жестких допусков. Это единственный металл, который мы производим, и он производится с использованием порошка вольфрама неконфликтного происхождения на нашем предприятии в Великобритании.Чтобы узнать больше об этом порошке, посетите нашу страницу с порошком вольфрама.
Вольфрамовый сплавWolfmet регулярно используется в качестве замены свинца в таких областях, как радиационная защита и балансирные гири в аэрокосмической отрасли. Для получения более подробной информации посетите сайт «Замена электрода».
Wolfmet 3D — это революционный процесс аддитивного производства, в котором используется мощный лазер для сплавления последовательных слоев чистого вольфрамового порошка до создания сложного компонента. Он идеально подходит для таких компонентов, как коллиматоры и радиационные экраны в системах визуализации, таких как КТ, ОФЭКТ, МРТ и рентген.
Тантал с самой высокой точкой плавления — ALB Materials Inc
Тантал 08.09.2020
тантал с самой высокой температурой плавления
Факты о тантале: Атомный номер: 73 Атомный символ: Ta Атомный вес: 180,94788 Точка плавления: 5 462,6 F (3017 C) Точка кипения: 9 856,4 F (5 458 C)
Происхождение слова: Тантал назван в честь греческого мифологического персонажа Танталоса.
Открытие: Тантал был открыт Андерсом Экебергом в 1802 году.
Считалось, что тантал и ниобий являются идентичными элементами, пока Роу в 1844 году не показал, что швейцарский химик Жан Шарль Галиссар де Мариньяк в 1866 году показал, что это разные кислоты.
Свойства тантала
Тантал — это твердый серый пластичный металл.
В чистом виде его можно натянуть на тонкую проволоку.
Тантал практически невосприимчив к химическим атакам при температуре ниже 302 F (150 C).
Пленки оксида тантала очень стабильны и обладают хорошими выпрямляющими, а также диэлектрическими свойствами.
Его точка плавления превышает температуру двух других элементов, и он становится намного более активным при высоких температурах.
[См. Периодическую таблицу элементов]
Источники тантала
Тантал в природе встречается в минерале колумбит-танталит.
В основном он встречается в Австралии, Бразилии, Мозамбике, Таиланде, Португалии, Нигерии, Заире и Канаде.
Отделение тантала от ниобия требует либо электролиза, восстановления фтортанталата калия натрием, либо реакции карбида с оксидом.
Природный тантал содержит два изотопа, хотя известно, что существует двадцать пять изотопов.
Использование тантала
Тантал используется в различных сплавах для придания им высокой прочности, пластичности и высокой температуры плавления.
Когда его затягивают в тонкую проволоку, он используется как нить для испарения металлов, таких как алюминий.
Более половины использования тантала приходится на электролитические конденсаторы и детали вакуумных печей.
Этот элемент также используется для изготовления химического технологического оборудования, ядерных реакторов, самолетов и деталей ракет.
Тантал нашел применение при изготовлении хирургических приспособлений, поскольку он полностью невосприимчив к жидкостям организма.
Оксид тантала используется для изготовления специального стекла с высоким показателем преломления для таких предметов, как линзы фотоаппаратов.
Высокие температуры плавления тантала в нагреваемой лазером ячейке с алмазной наковальней.
Реакционная способность Ta с алмазными наковальнями.
Монохроматические (λ 0,3738 Å) XRD-спектры образца Ta в среде под давлением MgO, записанные во время одной серии нагревов при 90 ГПа.
Двумерные спектры MAR-CCD интегрированы по кругу.
Пики дифракции TaC появляются около 3600 К.
На вставке: температура, измеренная пирометром, как функция времени (и мощности лазера).
Пронумерованные закрашенные квадраты соответствуют пронумерованным спектрам XRD.
После реакции Ta с алмазом температуру повышать нельзя.
Реакционная способность Ta с напорной средой.
Спектры XRD Ta до или после нагрева выше 4000 K в средах под давлением Ar (a), AlO3 (b) и NaCl (c).
Кружки, квадраты и знаки плюс, соответственно, обозначают Ta, среду под давлением и TaC.
Наша интерпретация этих спектров такова: тантал образует аморфный сплав с Ar и химически реагирует с Al.
Точки плавления и кипения элементов Периодической таблицы
Точки плавления и кипения — очень важные физические свойства в химии, когда мы изучаем элементы и соединения.
Различные элементы и соединения имеют разные точки плавления и кипения.
Изучая значения температур плавления и кипения элементов, мы можем получить представление о структуре элементов, межмолекулярных силах между молекулами или атомами и многом другом.
В этом руководстве мы рассмотрим следующие разделы.
Причины наличия разных температур плавления и кипения элементов и соединений
Сравнение значений точек плавления и кипения каждой группы в периодической таблице с трендами
Температуры плавления и кипения органических соединений
Сравнение точек плавления и кипения различных элементов и соединений в блоках s, p и d
Вариации точек плавления и кипения неясны (не имеют однородного рисунка) по всей периодической таблице (это означает, что мы не всегда можем видеть аналогичную тенденцию.
Вы поймете это, когда закончите читать этот урок).
Но мы видим, что некоторые элементы имеют более высокие температуры плавления и кипения, а некоторые — меньше.
В первой части этого урока мы изучаем точки плавления и кипения элементов s, p, d блоков и их соединений, а затем органических соединений.
Элементы группы Ath (углерод и кремний) показывают высокие температуры плавления и кипения во втором и третьем периодах соответственно, потому что они имеют ковалентную гигантскую решетчатую структуру.
Температуры плавления и кипения за период
В первых трех периодах наблюдается четкая вариация точек плавления и кипения (имеет четкую тенденцию).
При движении слева направо точки плавления и кипения увеличиваются до группы IVA.
(Например, от натрия к аргону в третьем периоде).
Группа IVA имеет элемент с наивысшей температурой плавления и кипения.
Затем начинает снижаться температура плавления и кипения от группы VA к благородным газам (VIIA).
Почему разные элементы и соединения имеют разные точки плавления и кипения?
Есть много причин влиять на точки плавления и кипения элементов и соединений.
Одно или несколько факторов могут повлиять на температуру плавления и кипения.
Молекулярная масса — при увеличении молекулярной массы вероятность увеличения температуры плавления и кипения также высока.
Межмолекулярные силы, такие как водородные связи, силы диполь-дипольного притяжения, силы Ван-дер-Ваальса между атомами или молекулами.
Когда межмолекулярные силы становятся сильнее, это также увеличивает температуры плавления и кипения элементов и соединений.
Металлическая решетка (важна для определения температуры плавления металлов, таких как натрий, магний и другие металлические элементы)
Ионная решетка — в ионных соединениях, таких как NaCl, CaF2, MgO, существует ионная решетка.
В зависимости от прочности ионной решетки точки плавления и кипения могут различаться.
Элементы с самыми низкими температурами плавления и кипения за период
г.Инертные газы имеют самые низкие точки плавления и кипения за период, потому что их форма — это только силы Ван-дер-Ваальса, они очень слабы, чтобы сформировать сильную межмолекулярную силу между атомами.
Тенденции групп точек плавления и кипения таблицы Менделеева
Теперь мы собираемся узнать, как точки плавления и кипения элементов различаются в группе, рассматривая каждую группу отдельно.
Значения точек плавления и кипения s block
Блок S содержит группу IA и группу IIA, и большинство элементов из них являются металлами без водорода.
(водород имеет как свойства щелочного металла, так и свойства галогена.)
Температура плавления и кипения щелочных металлов
Щелочные металлы (Li, Na, K, Rb, Cs) мягкие и имеют низкие температуры плавления и кипения.
Щелочные металлы имеют только один валентный электрон на атом металла, и поэтому энергия, связывающая атомы в кристаллической решетке металла, мала.
Следовательно, металлические связи в этих металлах не очень прочные.
Таким образом, температуры плавления и кипения снижаются при переходе от лития к цезию.
Температура кипения водорода: -252,90C
Температуры плавления и кипения щелочноземельных металлов
Щелочноземельные металлы (Be, Mg, Ca, Sr, Ba, Ra) имеют низкие температуры плавления и кипения по сравнению с металлами d-блока.
Но их температуры плавления и кипения выше, чем у соответствующих щелочных металлов в тот же период из-за сравнительно меньшего размера.
Но температуры плавления и кипения не показывают регулярных тенденций в группе щелочноземельных металлов.
Почему щелочные металлы имеют более низкие температуры плавления, чем щелочноземельные металлы?
И щелочные, и щелочноземельные металлы находятся в блоке s.
Мы знаем, что щелочные металлы имеют только один валентный электрон на атом металла.
Но щелочноземельные металлы имеют два валентных электрона на атом металла.
Кроме того, щелочноземельные металлы имеют меньший размер, чем щелочные металлы.
Когда количество валентных электронов в решетке увеличивается, металлическая связь становится прочной.
Также, когда атомный радиус уменьшается, металлическая связь становится прочной.
Также поэтому металлические связи щелочноземельных металлов намного прочнее, чем щелочные металлы.
Следовательно, температуры плавления и кипения щелочных металлов ниже, чем температуры плавления и кипения щелочноземельных металлов
Почему бериллий имеет более высокую температуру плавления и кипения, чем другие представители второй группы?
Бериллий — атом наименьшего размера из элементов группы 2.
Таким образом, его ионная решетка прочнее, чем у других щелочноземельных металлов.
Температура плавления и кипения элементов p-блока
Теперь мы собираемся обсудить вариации температур плавления и кипения p-блочных элементов.
В p-блоке есть различные типы элементов, включая металлы, неметаллы, и их физические состояния также очень разные.
При комнатной температуре некоторые из них находятся в твердом состоянии, а некоторые — в газообразном.
Бром тоже жидкое состояние.
Блок P содержит элемент с самой высокой точкой плавления (углерод) и элемент с самой низкой точкой плавления периодической таблицы (гелий).
Теперь мы собираемся взглянуть на температуры плавления и кипения p-блочных элементов от группы 13 до группы 18.
Температура плавления и кипения галогенов и инертных газов
Галогены и благородные газы расположены в блоке p периодической таблицы.
Галогены существуют в виде двухатомных молекул, таких как F2, Cl2, Br2, I2, и благородных газов, которые существуют в виде одноатомных молекул.
При понижении каждой группы молекулярная масса увеличивается, что может быть причиной более высоких точек плавления и кипения.
Кроме того, все молекулы галогена и инертного газа образуют только силы Ван-дер-Ваальса, которые являются самыми слабыми межмолекулярными силами и не сильно влияют на плавление и кипение галогенов и благородных газов.
Молекулярная масса молекул имеет наибольшее влияние на приращение точек плавления и кипения.
Таким образом, точки плавления и кипения как галогена, так и инертных газов увеличиваются вместе с группой.
Температуры кипения и плавления элементов 13 группы
Бор, алюминий, галлий, индий, таллий — элементы 13 группы.
При движении вниз по группе температуры плавления и кипения снижаются.
Однако снижение температуры плавления не такое регулярное, как температуры кипения.
Галлий имеет очень низкую температуру плавления (303К).
Температуры плавления и кипения элементов 14 группы
Атомы этой группы образуют ковалентные связи друг с другом, и поэтому между их атомами существуют сильные силы связи как в твердом, так и в жидком состояниях.
Температуры плавления и кипения элементов группы 14 намного выше, чем элементов группы 13.
При движении вниз по группе температуры плавления и кипения снижаются.
Группа 15 элементов температур плавления и кипения
Азот имеет самую низкую температуру плавления и кипения.
Сурьма имеет самую высокую температуру плавления и кипения.
Группа 16 элементов температур плавления и кипения
Кислород имеет самую низкую температуру плавления и кипения.
Теллур (Те) имеет самую высокую температуру плавления и кипения.
Температуры кипения группы 17
Температура кипения увеличивается при переходе от фтора к йоду.
Температуры плавления и кипения 3d-металлов
Точки плавления и кипения 3d-металлов обычно выше, чем у s-блочных элементов.
Ванадий имеет самую высокую температуру плавления, а цинк — самую низкую точку плавления.
Но температуры плавления и кипения не имеют регулярных тенденций.
Почему цинк имеет самую низкую температуру плавления среди металлов серии 3d?
Цинк имеет стабильную конфигурацию электронов 3d10 4s2.
Следовательно, цинк не вносит много электронов в металлическую решетку других 3d-металлов.
Следовательно, прочность металлической решетки ниже, чем у решеток других 3d-металлов.
Таким образом, цинк имеет самую низкую температуру плавления в серии 3D-металлов.
Падение температуры плавления марганца
Конфигурация электронов марганца 3d5 4s2.
Эта конфигурация электронов имеет некоторую стабильность, потому что все пять d-орбит наполовину заполнены (каждая d-орбита имеет один электрон). Таким образом, вклад электронов в металлическую решетку в марганце ограничен.
Поэтому решетка не очень прочная.
По этой причине температура плавления марганца резко падает.
Температуры плавления и кипения соединений
Точки плавления и кипения галогенидов щелочных металлов снижаются с увеличением атомной массы галогенидов как:
F-> Cl-> Br-> I-
Пример: температура плавления NaCl выше, чем у NaBr
.Допустим, галогенид-ион, точки плавления и кипения LiX всегда ниже, чем у NaX.
Температуры плавления и кипения органических соединений
На сегодняшний день учеными мира открыты тысячи органических соединений.
С открытием множества соединений родилась органическая химия.
В этой главе мы собираемся обсудить точки плавления и кипения органических соединений.
Температуры кипения этана (алкана) и этановой кислоты (карбоновой кислоты) указаны ниже, и это два разных типа органических соединений.
Метан (Ch5): -161,50C
Следующие факты важны при изучении значений температуры плавления и кипения органических соединений.
Относительная молекулярная масса
Способность образовывать водородные связи
Структура углеродной цепи
Температуры плавления и кипения алканов, алкенов, алкинов
Алканы — неполярные молекулы.
Между молекулами алканов существуют только силы Ван-дер-Ваальса.
Когда относительная молекулярная масса соединений алканов увеличивается, значения точек плавления и кипения также увеличиваются.
Температуры плавления и кипения увеличиваются соответственно алканам, алкенам и алкинам.
Рассмотрим этан, этен, этин
.этин (алкиновое соединение) имеет самую высокую температуру плавления и кипения.
Когда количество водородных связей и прочность водородных связей увеличивается, температуры плавления и кипения увеличиваются.
Спирты, альдегиды, кетоны и карбоновые кислоты
Все спирты и карбоновые кислоты могут образовывать водородные связи.
Карбоновые кислоты с наиболее прочными и наибольшим количеством водородных связей среди них.
Итак, карбоновые кислоты имеют самые высокие температуры плавления и кипения.
Дипольные взаимодействия между молекулами альдегидов и кетонов менее сильны, чем водородные связи в спирте.
Поэтому температуры плавления и кипения спирта выше, чем у альдегидов и кетонов.
Температуры плавления и кипения алкилгалогенидных соединений
Атом галогена более электроотрицателен, чем атом углерода.
Таким образом, связь C-X поляризована.
Между алкилгалогенидными соединениями существует дипольное взаимодействие.
Эти взаимодействия намного сильнее, чем межмолекулярные силы между алканами,
Температуры плавления и кипения алкилгалогенидных соединений намного выше, чем у алканов.
Когда относительная молекулярная масса органического соединения увеличивается, температуры плавления и кипения также увеличиваются.
Теперь мы обсудим некоторые проблемы, сравнив различные элементы и соединения, которые имеют разные точки плавления и кипения.
Эти задачи очень важны на экзаменах.
Внимательно изучите их.
Температура плавления металлов в блоке isp выше, чем в блоке s?
Сначала мы посмотрим, что такое металлы p-блока и какие металлы s-блока.
Вы знаете, когда мы обсуждаем температуры плавления металлов, их металлическая решетка очень важна.
Итак, теперь вы знаете, что мы должны выяснить, чтобы сравнить точки плавления металлов p-блока и металлов s-блока.
Когда металлическая решетка металла прочная, у этого металла есть большой шанс иметь более высокую температуру плавления.
В качестве примера для сравнения взяты два металла, натрий и алюминий.
Натрий является блочным металлом, а алюминий — блочным металлом.
Но оба находятся в 3-м периоде таблицы Менделеева.
Из-за высвобождения трех электронов и меньшего радиуса металлическая решетка алюминия намного прочнее натрия.
Таким образом, температура плавления алюминия выше, чем у натрия.
Почему блочные элементы d имеют более высокие температуры плавления, чем блочные элементы s?
d блочные элементы могут вносить больше электронов в металлическую решетку.
Например, ванадий может внести 5 электронов.
Но элементы блока могут вносить только один или два электрона.
Щелочные металлы могут иметь один электрон, а щелочноземельные металлы могут иметь два электрона.
Добавление большего количества электронов в металлическую решетку увеличит прочность металлических связей.
Благодаря более прочным металлическим связям элементы d-блока имеют более высокие значения плавления.
Почему у h3S температура кипения ниже, чем у h3O
Температура кипения h3S: -600C
точка кипения h3O: 1000C
При комнатной температуре сероводород (h3S) представляет собой газ.
Но вода (h3O) — это жидкость.
Это говорит о том, что у h3S температура кипения ниже.
h3S и h3O представляют собой молекулы изогнутой формы.
O и S — это группы элементов VIA.
Молекулярная масса h3S = 34 и молекулярная масса h3O = 18.
Молекулярная масса h3S больше, чем h3O.
Но между молекулами h3O существуют прочные водородные связи.
Молекулы h3S имеют только слабые дипольные взаимодействия.
Водородные связи в h3O
Из-за наличия сильных водородных связей в молекулах h3O, h3O имеет более высокую температуру кипения, чем h3S, хотя h3S имеет большую молекулярную массу.
какой атом имеет самую высокую температуру плавления / кипения между Cs и W?
Вольфрам (W) имеет самую высокую температуру плавления из всех металлов.
Цезий (Cs) — мягкий металл с очень низкой температурой плавления (280 ° C).
Какой металл имеет самую высокую температуру плавления?
Вольфрам (W).
Из металлов вольфрам имеет самую высокую температуру плавления в периодической таблице.
Он расположен в блоке D.
3422 ° C — температура плавления вольфрама.
Какой металл блока имеет самую высокую температуру плавления?
Бериллий имеет самую высокую температуру плавления из блочных металлов.
Это около 1287 0C
температуры кипения и плавления 1а группы порядка
Li> Na> K> Rb> Cs> Fr> H
Литий имеет самую высокую температуру плавления и кипения, а водород — самую низкую в группе IA.
Водород существует в виде газа при комнатной температуре, а франций — в жидком состоянии при комнатной температуре.
Все остальные материалы группы IA являются твердыми при комнатной температуре.
Самая низкая температура плавления из металлических элементов
Ртуть (Hg) имеет самую низкую температуру плавления (-38,83 ° C), потому что ртуть имеет очень слабую металлическую решетку.
Какой элемент имеет самую низкую температуру плавления в периодической таблице
Гелий (He) — это элемент с самой низкой температурой плавления (-272,2 ° C).
Гелий существует в виде атомов.
Он не образует соединений и не создает межмолекулярных сил между атомами He.
Также относительная молекулярная масса (1) очень мала.
Тем не менее, есть вопрос? Спросите его сейчас у нас и найдите ответ.
Что можно понять под температурами плавления и кипения элементов в периодической таблице?
Мы знаем, что элементы в периодической таблице находятся в твердом, жидком и газообразном состоянии.
Межмолекулярные силы, относительная молекулярная масса — это факторы, которые определяют температуру плавления и кипения элемента.
Рассмотрим два металла.
Один металл имеет очень высокую температуру плавления, чем другой.
В металлах металлическая решетка является основным фактором, определяющим температуры плавления и кипения.
Более прочная металлическая решетка имеет более высокую температуру плавления.
Мы можем понять межмолекулярные силы элементов, относительные молекулярные массы, изучая температуры плавления и кипения.
Каковы температуры плавления и кипения некоторых горючих газов?
Мы можем перечислить несколько горючих газов и их точки плавления и кипения.
Алканы легко воспламеняются.
В качестве примера рассмотрим метан.
Точки плавления и кипения метана составляют -182,40 ° C и -161,50 ° C соответственно.
Почему разные элементы имеют разные точки плавления?
Температура плавления зависит от их молекулярной массы и межмолекулярных сил между элементами или молекулами.
Различные элементы имеют разную молекулярную массу и межмолекулярные силы.
Таким образом, их значения температуры плавления отличаются от других элементов и соединений.
Почему элементы группы IIA плавятся при более высоких температурах, чем элементы группы IA?
Металлические решетки металлов группы II намного прочнее металлов группы I, потому что элементы группы II отдают два электрона решетке.
Следовательно, металлы группы I плавятся при более высоких температурах.
почему температура кипения кальция больше, чем у калия?
Прочность решетки кальция больше, чем у калия, по двум причинам.
Радиус кальция меньше, чем у калия.
кальций может отдавать два электрона металлической решетке, в то время как калий может отдавать только один электрон.
По этим двум причинам металлическая решетка кальция намного больше, чем у калия.
что имеет точку плавления -2190C и точку кипения -1830C?
Кислород (O2) Есть ли соединения, у которых нет точки плавления?
Да.Есть. Некоторые соединения нестабильны к нагреванию.
При нагревании такое соединение они разлагаются на другое вещество.
Пример: карбонат никеля (NiCO3) разлагается на NiO и CO2 при нагревании.
Температура плавления Mg находится в блоке s?
Металлическая решетка магния намного прочнее натрия.
Таким образом, температура плавления Mg выше, чем у Na.
что происходит с температурой плавления в блоке
Если вы изучите блочные элементы в тот же период, вы увидите, что щелочноземельный металл (группа 2) имеет более высокую температуру плавления, чем щелочной металл (группа 1), потому что прочность решетки элемента щелочноземельного металла сильнее, чем элемент щелочного металла.
почему у некоторых элементов высокая температура плавления?
Когда некоторые элементы обладают более высокими показателями по некоторым свойствам, они имеют высокую температуру плавления.
В качестве примеров можно рассмотреть металлы.
Когда мы говорим о металлах, необходимо понимать металлическую решетку.
Когда металлическая решетка прочная, этот металл имеет более высокую температуру плавления.
Металлическая решетка натрия слабее магния.
Следовательно, магний имеет более высокую температуру плавления, чем натрий.
В качестве другого примера взяты вода и сероводород.
Вода образует водородные связи, которые представляют собой самый сильный тип межмолекулярных сил.
Но сероводород не может образовывать водородные связи.
Таким образом, вода имеет более высокую температуру плавления, а также температуру кипения.
Часть содержания этой статьи воспроизводится с других носителей с целью передачи дополнительной информации и не означает, что этот веб-сайт согласен с его взглядами или подтверждает подлинность своего содержания.Он не несет прямой и солидарной ответственности за нарушение таких работ. p>
Если в содержании этой страницы есть какие-либо нарушения, неверная информация, исправление ошибок и другие проблемы, свяжитесь с нами по адресу [email protected] p>
Ссылка на эту статью: https://www.albmaterials.com/knowledge/blog/highest-melting-point-tantalum.html
Температуры плавления и кипения за период 3
Результаты обучения
Изучив эту страницу, вы сможете:
- описывает и объясняет тенденции в точках плавления и кипения за период 3
Температура плавления и кипения
В таблице указаны температуры плавления и кипения элементов от Na до Ar.
| Элемент | Символ | Атомный номер | Точка плавления / K | Точка кипения / K |
|---|---|---|---|---|
| натрий | Na | 11 | 371 | 1156 |
| магний | мг | 12 | 922 | 1380 |
| алюминий | Al | 13 | 933 | 2740 |
| кремний | SiR | 14 | 1683 | 2628 |
| фосфор | P | 15 | 317 | 553 |
| сера | S | 16 | 392 | 718 |
| хлор | Класс | 17 | 172 | 238 |
| аргон | Ar | 18 | 84 | 87 |
Температура дана в кельвинах, К.
Вы можете легко преобразовать K в ° C и обратно:
° C = K + 273 (например, 100 ° C = 373 K)
K = ° C — 273 (например, 273 K = 0 ° C)Строго говоря, это должно быть 273,15, а не 273, но менее точное значение приемлемо на уровне A.
Описание тренда
График показывает, как точки плавления и кипения меняются в течение периода 3.
На этом графике много чего происходит, поэтому часто бывает проще разделить его на три части.В таблице ниже дается краткое описание этих разделов.
| Элементы | Тип элемента | Тип конструкции | Описание |
|---|---|---|---|
| Na, Mg, Al | металл | металлик | т.пл. и увеличение п.о. от Na до Al |
| Si | металлоид | гигантский ковалентный | м.л. больше, чем Al между Mg и Al |
| P, S, Cl, Ar | неметалл | простой молекулярный (Ar одноатомный) | мп и убывание п.п. в порядке: S> P> Cl> Ar |
Нажав на символ загрузки, вы сможете загрузить график в виде файла изображения или файла PDF, сохранить его данные, аннотировать их и распечатать.Обратите внимание, что графики будут помечены водяными знаками.Когда вещество плавится, некоторые силы притяжения между частицами разрушаются или ослабляются.Частицы могут перемещаться друг вокруг друга, но при этом остаются близко друг к другу.
Когда вещество закипает, большая часть оставшихся сил притяжения разрушается. Частицы могут свободно перемещаться и находятся далеко друг от друга.
Чем сильнее силы притяжения, тем больше энергии требуется для их преодоления и тем выше температура плавления или кипения.
× Нажмите кнопку под графиком, чтобы включить или выключить каждый набор полос.
×
Объяснение этой тенденции
Натрий, магний и алюминий
Натрий, магний и алюминий — все металлы. Они имеют металлическую связь, в которой ядра атомов металлов притягиваются к делокализованным электронам.
Переход от натрия к алюминию:
- заряд на ядрах увеличивается…
- количество делокализованных электронов увеличивается…
- , поэтому прочность металлического соединения увеличивается и…
- точки плавления и кипения увеличиваются.
Металлическую связь часто неправильно описывают как притяжение между положительными ионами металлов и делокализованными электронами. Однако металлы по-прежнему состоят из атомов, но внешние электроны не связаны с каким-либо конкретным атомом.
Подобным образом графит (неметалл) также имеет делокализованные электроны. Однако вы не понимаете, что он состоит из ионов углерода.
Кремний
Кремний — это металлоид с гигантской ковалентной структурой.Кремний имеет очень высокую температуру плавления и кипения, потому что: все атомы кремния удерживаются вместе прочными ковалентными связями … для разрыва которых требуется очень большое количество энергии.
- атомы кремния притягиваются друг к другу прочными ковалентными связями…
- , которые требуют очень большого количества энергии, чтобы их можно было сломать.
Гигантская кристаллическая структура кремния подобна структуре решетки алмаза. Каждый атом кремния ковалентно связан с четырьмя другими атомами кремния в тетраэдрическом расположении.
Фосфор, сера, хлор и аргон
Эти элементы не являются металлами. Фосфор, сера и хлор существуют в виде простых молекул, между которыми действуют силы Ван-дер-Ваальса. Аргон одноатомен — он существует в виде отдельных атомов. Между его атомами действуют силы Ван-дер-Ваальса. Температуры плавления и кипения этих элементов очень низкие, потому что:
- Силы Ван-дер-Ваальса — очень слабые силы притяжения…
- требуется немного энергии для их преодоления.
Фосфор существует в виде молекул P 4 , сера существует в виде молекул S 8 , хлор существует в виде молекул Cl 2 , а аргон существует в виде отдельных атомов. Сила сил Ван-дер-Ваальса уменьшается с уменьшением размера молекулы, поэтому точки плавления и кипения уменьшаются в следующем порядке:
S 8 > P 4 > Cl 2 > Ar
Атомы в молекулах фосфора, серы или хлора притягиваются друг к другу ковалентными связями.Эти связи намного сильнее, чем силы Ван-дер-Ваальса между молекулами: ковалентные связи не разрываются при изменении состояния этих элементов.
Вопрос: Какой металл имеет самую высокую температуру плавления?
Сколько градусов точка плавления?
32 ° F Расскажите детям, что температура, при которой тает лед, называется точкой плавления.
Точка плавления — это температура, при которой твердое вещество превращается в жидкость.
Температура плавления, при которой лед — твердое тело — превращается в воду — жидкость, составляет 32 ° F (0 ° C).
Может ли вольфрам остановить пулю?
Вопрос в том, может ли вольфрамовая бронеплита эффективно защитить вас от пуль? Простой ответ — да. Но мы говорим о сплавах вольфрама, потому что сам вольфрам имеет самую высокую температуру плавления из всех металлов, и по этой причине с ним будет очень трудно работать в массовых количествах.
При какой температуре плавится золото?
1,064 ° C Золото / точка плавления
ртуть Из металлических элементов только ртуть имеет более низкую температуру плавления (-38.9 ° C, или -38,02 ° F), чем цезий.
Гелий Химический элемент с самой низкой точкой кипения — это гелий, а элемент с самой высокой точкой кипения — вольфрам.
Вольфрам С точки зрения прочности на разрыв вольфрам является самым прочным из всех природных металлов (142 000 фунтов на квадратный дюйм). Но с точки зрения ударной вязкости вольфрам слаб — это хрупкий металл, который, как известно, раскалывается при ударе.
GoldGold желтого цвета.
Токсично ли плавление алюминиевых банок?
Несоблюдение надлежащих процедур плавки и литья алюминия может быть опасным. Расплавленный алюминий обычно обрабатывают при температуре 1300–1450 градусов по Фаренгейту, чтобы избежать преждевременного затвердевания. Контакт с расплавленным алюминием может вызвать серьезные ожоги и создать серьезную опасность пожара.
Вольфрам и его сплавы Вольфрам имеет самую высокую температуру плавления среди всех металлов — 3 410 ° C (6 170 ° F).
Какова точка кипения алмаза?
Элемент Точка плавления Точка кипения Цезий 29685 Кальций 850 1492 Углерод (графит) 3730 (сублимированные) Углерод (алмаз) 3550 (4830) еще 50 рядов
Что труднее всего растопить?
элемент вольфрам Элемент вольфрам содержится в минерале вольфрамит.Вольфрам считается одним из самых твердых материалов в природе. Он очень плотный и его практически невозможно растопить.
Что самое сильное на земле?
Графен. Первое место в списке занимает графен — самый прочный из известных человеку материалов. Прозрачный материал состоит из однослойного атома углерода, расположенного в треугольной решетке, и является основным структурным элементом древесного угля, графита и углеродных нанотрубок.
Какой элемент имеет самую высокую температуру плавления?
Углерод Химический элемент с самой низкой точкой плавления — это гелий, а элемент с самой высокой точкой плавления — углерод.
Цезий Кристалл лепидолита является источником лития, рубидия и цезия. Цезий — редкий серебристо-белый блестящий металл с ярко-синими спектральными линиями; Название элемента происходит от слова «цезий» на латыни, означающего «небесно-голубой». Это самый мягкий металл, имеющий консистенцию воска при комнатной температуре.
Алюминий Алюминий — это распространенный и универсальный металл, который легко перерабатывается. Температура плавления алюминия достаточно низкая, поэтому его можно расплавить с помощью ручной горелки.Однако проект реализуется быстрее при использовании печи или обжиговой печи. Переработанный алюминий можно использовать для изготовления скульптур, контейнеров и украшений.
Какова температура плавления алмаза?
В отсутствие кислорода алмазы можно нагревать до гораздо более высоких температур. Выше указанных ниже температур кристаллы алмаза превращаются в графит. Конечная температура плавления алмаза составляет около 4027 ° по Цельсию (7280 ° по Фаренгейту).
Что увеличивает температуру плавления?
Сила притяжения между молекулами влияет на температуру плавления соединения.Более сильные межмолекулярные взаимодействия приводят к более высоким температурам плавления. Ионные соединения обычно имеют высокие температуры плавления, потому что электростатические силы, удерживающие ионы (ион-ионное взаимодействие), намного сильнее.
Безопасно ли плавить олово?
Олово плавится при очень низкой температуре. По сути, самая низкая температура плавления любого полезного нетоксичного металла (*). Он плавится примерно на 500 градусов, хорошо разливается и выглядит великолепно. Есть только одна веская причина не использовать его: это относительно дорого.
металлическое соединение
Металлическое соединение в натрии
Металлы, как правило, имеют высокие температуры плавления и кипения, что свидетельствует о прочных связях между атомами. Даже такой металл, как натрий (точка плавления 97,8 ° C), плавится при значительно более высокой температуре, чем элемент (неон), предшествующий ему в Периодической таблице.
Натрий имеет электронную структуру 1s 2 2s 2 2p 6 3s 1 . Когда атомы натрия собираются вместе, электрон на 3s-атомной орбитали одного атома натрия делит пространство с соответствующим электроном на соседнем атоме, образуя молекулярную орбиталь — почти так же, как образуется ковалентная связь.
Разница, однако, заключается в том, что к каждому атому натрия прикасаются восемь других атомов натрия — и совместное использование происходит между центральным атомом и 3s-орбиталями на всех восьми других атомах. И каждый из этих восьми, в свою очередь, касается восьми атомов натрия, которые, в свою очередь, касаются восьми атомов — и так далее, и так далее, пока вы не поглотите все атомы в этом куске натрия.
Все 3s-орбитали на всех атомах перекрываются, давая огромное количество молекулярных орбиталей, которые простираются по всему куску металла.Конечно, должно быть огромное количество молекулярных орбиталей, потому что любая орбиталь может содержать только два электрона.
Внешние электроны стали делокализованными по всей структуре металла. Это означает, что они больше не привязаны к определенному атому или паре атомов, а могут рассматриваться как свободно перемещающиеся по всей структуре.
Итак, внешние электроны каждого атома участвуют в делокализации или море электронов . Остальная часть каждого атома (ядро и внутренние электроны) по существу представляет собой ион натрия, Na + .
Металлическая связь часто описывается как массив положительных ионов в море электронов .
Металл удерживается вместе сильными силами притяжения между делокализованными электронами и положительными ионами.
Остерегайтесь, если вы собираетесь использовать термин «массив положительных ионов в море электронов»!
Металл состоит из атомов или ионов? Он состоит из атомов.
Каждый положительный центр на диаграмме представляет собой всю остальную часть атома, кроме внешнего электрона, но этот электрон не был потерян — он может больше не иметь связи с конкретным атомом, но он все еще присутствует в структуре.Поэтому металлический натрий записывается как Na — , а не как Na + .
Металлическое соединение из магния
Если вы проработаете тот же аргумент с магнием, вы получите более сильные связи и, следовательно, более высокую температуру плавления.
Магний имеет внешнюю электронную структуру 3s 2 . Оба этих электрона становятся делокализованными, поэтому «море» имеет вдвое большую электронную плотность, чем в натрии. Остальные «ионы» также имеют в два раза больший заряд, поэтому между «ионами» и «морем» будет больше притяжения.
Более реалистично, каждый атом магния имеет 12 протонов в ядре по сравнению с 11 натрием. В обоих случаях ядро экранировано от делокализованных электронов одинаковым количеством внутренних электронов — 10 электронов в 1s 2 2s 2 2p 6 орбитали.
Это означает, что чистое притяжение от ядра магния будет 2+, но только 1+ от ядра натрия.
Таким образом, в магнии будет не только большее количество делокализованных электронов, но также будет большее притяжение для них за счет чистого притяжения ядер магния.
Атомы магния также имеют немного меньший радиус, чем атомы натрия, поэтому делокализованные электроны находятся ближе к ядрам. У каждого атома магния также двенадцать ближайших соседей, а не восемь у натрия. Оба эти фактора еще больше увеличивают прочность связи.
Металлическое соединение в переходных элементах
Переходные металлы обычно имеют особенно высокие температуры плавления и кипения. Причина в том, что они могут вовлекать в делокализацию как 3d-электроны, так и 4s.Чем больше электронов вы можете задействовать, тем сильнее будет притяжение.
почему металлы имеют высокие температуры плавления
Херова. Сплавы, являющиеся смесями, а не составами, не имеют фиксированной температуры плавления. Обычно переходные металлы обладают высокой плотностью и высокими температурами плавления и кипения. NCERT DC Панди Сунил Батра ХК Верма Прадип Безошибочный. Найдите репетитора. Теги: Вопрос 4. Математика. Если вы включите магний, не будет очевидной тенденции в температурах плавления (см. Ниже). Почему у металлов ВЫСОКАЯ температура плавления и кипения, а у неметаллов — НИЗКАЯ точки плавления и кипения — Химия — Металлы и неметаллы Требуется много энергии для разрушения, что приводит к высокой температуре плавления.Один металл имеет очень высокую температуру плавления, чем другой. Металлы имеют прочную МЕТАЛЛИЧЕСКУЮ связь. Металлическая связь чрезвычайно прочна, когда атомы металла отдают свои электроны «морю электронов», которые перемещаются между ионами металлов и удерживают металлическую структуру вместе. Уровень 7. Государство отказывает фондам по безработице Трампа. 2019914 что заставляет некоторые металлы плавиться при более высокой температуре, задайте вопрос о металлах в этой центральной области, вольфраме, и о том, что у них есть некоторые локализованные связи, смешанные с металлической связью, подумайте о структуре w-типа, поэтому существуют более серьезные тенденции для точек плавления, объясняющие высокие температуры плавления d-металлов но также есть некоторые незначительные исключения из.Остались вопросы? Ответ на вопрос: Почему переходные металлы имеют высокие температуры плавления? Почему у металлов высокие температуры плавления и кипения? Спросите подробности; Подписаться Отчет ApoorvaShah753 26.05.2014 Авторизуйтесь, чтобы добавить комментарий Что делать… Химия, 29.07.2019 03:00, Sadude69. Любимый ответ. Атаки Трампа задержатся. В. Я могу ударить по металлу молотком, но металл не расколется из-за его _____. Почему у большинства ионных соединений очень высокая температура плавления? Поэтому для преодоления этих ковалентных связей требуется много энергии, а температура плавления кремния очень высока.Вот почему вольфрам используется в соплах ракет и футеровках реакторов. литий — 180C Натрий — 98 калий-63 рубидий- 39 Цезий-29 Каковы нормальные температуры плавления металлов и почему температуры плавления щелочей ниже по сравнению с ними? Они образуют металлические связи с неспаренными электронами других атомов. Поскольку металлы представляют собой гигантские решетчатые структуры, количество разрушаемых электростатических сил чрезвычайно велико, поэтому металлы имеют высокие температуры плавления и кипения. Войдите в систему. Металлы лишены ионной связи и обладают настолько прочными металлическими связями, что для их разрушения требуется столько тепла.Присоединяйся сейчас. CBSE> Класс 10> Наука 1 ответы; Гурвиндер Сингх 12 месяцев назад. Диапазон температур плавления зависит от концентрации присутствующих металлов и примесей. Определите Ka азотистой кислоты HNO3. Они ниже неметаллов. они могут потерять один электрон, настолько стабильны и имеют высокую прочность на разрыв 0 Спасибо. Большинство неметаллов имеют низкие температуры плавления и не находятся в твердом состоянии при комнатной температуре. ? Почему у металла высокая температура плавления? Почему у металлов высокие температуры плавления.Щелкните здесь, чтобы получить ответ на свой вопрос ️ почему металлы имеют высокие температуры плавления и кипения 1. Почему щелочные металлы имеют низкие температуры плавления и кипения? Пластичность. Однако существует большая группа неметаллов с высокими температурами плавления / кипения или, что более типично, с температурами сублимации, потому что многие из них никогда не плавятся при обычных давлениях. Большинство неметаллов имеют низкие температуры плавления и не находятся в твердом состоянии при комнатной температуре. Я пошел на ужин в честь Дня Благодарения с более чем 100 гостями. NCERT RD Sharma Cengage KC Sinha.Класс 12 Класс 11… Выборы окончены. Это видео помогает объяснить свойства ионных соединений — в частности, почему они имеют высокие температуры плавления и кипения. Класс 12 Класс 11 Класс 10 Класс 9 Класс 8… Металлы имеют высокие температуры плавления и кипения, потому что в металлах существует очень сильная межмолекулярная сила притяжения, и им требуется много энергии для плавления или кипения. Например: хлорид натрия имеет температуру плавления 801 ° C и точку кипения 1413 ° C. Актуальность . Если у вас есть необходимая вам функция «Есть ли у металлов высокие или низкие точки плавления», обязательно закажите сейчас, чтобы избежать разочарования. Нажмите здесь, чтобы узнать, где именно можно получить самую выгодную сделку на «У металлов высокая или низкая точка плавления». Точки.Получите ответы, задав вопрос прямо сейчас. ОПРОС . Проводят в жидкости — ионы являются заряженными частицами, но ионные соединения могут проводить электричество только в том случае, если их ионы могут свободно перемещаться. Почему ионные соединения имеют высокие температуры плавления? Металлы образуют разные типы связей, чем элементы в керамике, а связи металла имеют тенденцию быть более гибкими (по сравнению с керамикой). Проще говоря, металлы с самыми высокими температурами плавления относятся к категории, называемой «тугоплавкие металлы». Но некоторые переходные металлы имеют исключительно высокие температуры плавления, такие как ванадий и никель, потому что они образуют частично заполненную наполовину трехмерную подоболочку (для ванадия) и полностью заполненную 3… Присоединяйтесь сейчас.Мы не несем все эти металлы, но предоставляем их в качестве справочной информации. Однако металлы группы 12 имеют гораздо более низкие температуры плавления и кипения, поскольку их полные d-подоболочки предотвращают d – d-связывание. Математика. НСЕРТ П. Бахадур ИИТ-ДЖИ Предыдущий год Нарендра Авасти М.С. Чаухан. NCERT NCERT Образец NCERT Fingertips Errorless Vol-1 Errorless Vol-2. Авторизоваться. ОТВЕЧАТЬ. По всей видимости, тенденции к снижению точек кипения по группе не наблюдается. Одним из самых впечатляющих и полезных свойств вольфрама является его высокая температура плавления, самый высокий из всех металлических элементов.10 октября 2018 г. Hilman Rojak Оставьте комментарий на У щелочноземельных металлов высокие температуры плавления Химические семейства свойства урока по науке о металлах hst учебный центр каковы различия в свойствах щелочноземельных металлов между щелочными металлами и щелочноземельными щелочными металлами и щелочноземельными металлами точка воспламенения Комментарий Декувреса: мы используем информацию в соответствии с политикой, относящейся к родственникам, принадлежащим к частной жизни и политическим, относящимся к другим файлам cookie. Химия. Неметаллы не так структурированы с точки зрения молекулярного расположения, как металлы, и, следовательно, не имеют… Почему оксид натрия имеет высокую температуру плавления? Чистый вольфрам плавится при колоссальной температуре 6192 градусов по Фаренгейту (3422 градуса по Цельсию) и не закипит, пока температура не достигнет 10 030 F (5555 градусов Цельсия), что соответствует температуре фотосферы Солнца. варианты ответа. Отчет «Почему металлы имеют высокие температуры плавления»; Автор: Шухайла. Скачать PDF. Очень прочные связи, поэтому для их разрыва требуется много энергии. 5 баллов miaortega218 Задал 03.07.2019. 0 0. Большинство металлов имеют высокие температуры плавления и поэтому находятся в твердом состоянии при комнатной температуре.Даже мягкий металл, такой как натрий (точка плавления 97,8 ° C), плавится при значительно более высокой температуре, чем элемент (неон), предшествующий ему в Периодической таблице. Связанные ответы на GCSE по химии. Большинство металлов имеют высокие температуры плавления. Но в случае сплавов атомы имеют разный размер и их расположение менее правильное, чем у чистого металла. Ионные твердые вещества обычно имеют высокие температуры плавления, что можно объяснить тем фактом, что ионные связи трудно разрушить. Металлы с высокой температурой плавления имеют сильные межмолекулярные силы между атомами.Химия. Присоединяйся сейчас. Какова эмпирическая формула соединения с 1,20% H, 42,00% Cl и 56,80% O? Все они просто лежат рядом друг с другом. Почему у металлов высокая температура плавления? 45 секунд. Эти свойства обусловлены металлической связью делокализованными d-электронами, что приводит к когезии, которая увеличивается с увеличением числа общих электронов. Ответы: 2 Получите похожие вопросы. Yahoo fait partie de Verizon Media. быстро, пожалуйста. NCERT RD Sharma Cengage KC Sinha. В. Однако, если вы включите магний, вы увидите, что его точка плавления ниже, чем точка плавления кальция, следующего ниже элемента.твердые ионные соединения — хорошие проводники электричества. Пожалуйста, ответьте, как это… Ответила Эмилия С. Объясните тенденцию в реакционной способности металлов 1 группы. Почему большинство металлов твердые и имеют высокие температуры плавления и кипения? Поскольку переходные металлы имеют металлическую связь. Потому что у него сильные межмолекулярные силы … Почему этанол имеет более высокие точки кипения, чем пропан? Войдите в систему. Однако, если вы включите магний, вы увидите, что его температура плавления ниже, чем температура плавления кальция, следующего ниже элемента.читать далее. Вот почему они могут выдерживать высокие нагрузки, не ломаясь, они слегка изгибаются при сильном ударе, а не ломаются. 1 десятилетие назад. Задавай вопрос. Книги. Следовательно, большинство соединений элементов 1-2 группы имеют тенденцию к ионной природе. Почему у металлов высокие температуры плавления? Все ионные вещества имеют высокие температуры плавления и кипения. Химия. В группе 2 наблюдается общее снижение температуры плавления. Натрий имеет электронную структуру 1s 2 2s 2 2p 6 3s 1. Они высокие. Точки кипения.Задавай вопрос. PH 0,250-М раствора нитрита натрия NaNO2 составляет 8,37. варианты ответа. Присоединяйтесь к Yahoo Answers и получите 100 баллов сегодня. В металлах атомы расположены регулярным образом, образуя прочную связь, поэтому, как правило, металлы имеют высокую температуру плавления. Хотя точки плавления являются одним из показателей типа связки, это не единственный показатель, и существует более одного типа связки. Проводимость. Химия. Высокая температура плавления вещества означает, что потребуется больше тепла для плавления определенного вещества из твердого состояния в жидкое.В металлах атомы связаны друг с другом очень прочно, и можно представить, что в них погружен положительный ион … Почему металлы имеют высокие температуры кипения и плавления? Ответ, который пришел мне в голову после урока химии в старшей школе более 42 лет назад, — это ковалентные связи между атомами металла. Присоединяйся сейчас. Вот почему необходима очень высокая температура, чтобы эти металлы достигли точки плавления и кипения. Почему у металлов такие высокие температуры плавления и кипения. Получите ответы прямо сейчас! Это делает связи между атомами очень слабыми и снижает температуру плавления.Модификатор «Vous pouvez» выбирает каждый момент в ваших личных параметрах. Точка плавления (или, реже, точка разжижения) вещества — это температура, при которой оно меняет свое состояние с твердого на жидкое. В точке плавления твердая и жидкая фазы находятся в равновесии. Точка плавления вещества зависит от давления и давления. обычно указывается при стандартном давлении, например 1 атмосфера или 100 кПа. Источник: bbc.co.uk. Выжившие после COVID-19 страдают призрачным неприятным запахом, надвигающийся кризис выселения COVID-19 опустошит женщин, «банды» Сената показывают Байдену, что возможно, а не 2 из 5 в возрасте до 60 лет думают, что социальное обеспечение — это схема Понци, WH угрожает должности главы FDA одобрение вакцины. Шаги, которые вы можете предпринять прямо сейчас, чтобы снизить налоговый счет за 2020 год. Пока он ругает выборы, Трамп в основном помалкивает о жертвах вируса.2019914 что заставляет некоторые металлы плавиться при более высокой температуре, задайте вопрос о металлах в этой центральной области, вольфраме, и о том, что у них есть некоторые локализованные связи, смешанные с металлической связью, подумайте о структуре w-типа, поэтому существуют более серьезные тенденции для точек плавления, объясняющие высокие температуры плавления d-металлов но также есть некоторые незначительные исключения из. Податливость. Почему щелочные металлы имеют низкие температуры плавления и кипения? Силы электростатического притяжения между ионами металлов и свободными электронами создают прочные металлические связи с более прочными связями, что приводит к более высоким температурам плавления.Добавьте автора Verizon Media и партнеров по предоставлению новых кадров, выберите «J’accepte» или «Gérer les paramètres» для получения информации, а также для получения информации и поиска по выбору. Химия. У нас есть температуры плавления в градусах Фаренгейта и Цельсия для наиболее распространенных металлов, перечисленных здесь. Требуется много энергии для разрушения, что приводит к высокой температуре плавления. 01 июня 2020 г. — Почему ионные соединения имеют высокие температуры плавления? Спросите подробности; Follow Report by Narendra1136 17.11.2018 Авторизуйтесь, чтобы добавить комментарий Я дам пять звезд человеку, который подробно объяснит.Есть два общепринятых определения тугоплавких металлов. NCERT NCERT Образец NCERT Fingertips Errorless Vol-1 Errorless Vol-2. Высокая температура плавления Si. Точки плавления и кипения. Физика. Металлы, как правило, имеют высокие температуры плавления и кипения, что указывает на прочные связи между атомами. Как определить объем изделия из чистого золота, которое весит 500 грамм? Почему у неметалла низкая температура плавления? Тугоплавкие металлы. Информация об одежде и о подключении к Интернету включает в себя ваш IP-адрес, навигацию и поисковые системы по использованию веб-сайтов и приложений Verizon Media.Для разрыва этих связей требуется много тепла, что приводит к высоким температурам кипения и плавления. Регистр; Контрольная работа; Дом; Q&A; Без ответа; Категории; Задайте вопрос; Учить; Видео; Задайте вопрос. В металлах металлическая решетка является основным фактором, определяющим температуру плавления и кипения. Терять. Игрок делает крупную ставку на UFC 252 и проигрывает. Итак, ионные соединения имеют высокие температуры плавления и кипения. Ответил Почему металлы имеют высокие температуры плавления? metala имеют высокие температуры плавления и кипения из-за очень сильной межмокулерной силы притяжения и требуют много энергии для плавления или кипения.они имеют высокие температуры плавления и кипения, потому что их структура находится в форме решетки, что придает им гибкость. Более прочная металлическая решетка имеет более высокую температуру плавления. 5 лет назад. Силы электростатического притяжения между ионами металлов и свободными электронами создают прочные металлические связи с более прочными связями, что приводит к более высоким температурам плавления. Каковы конкретные причины? Nos partenaires et nous-mêmes stockerons et / ou utiliserons des information about votre appareil, par l’intermédiaire de cookies et de technologies similaires, afin d’afficher des annonces et des contenus personnalisés, de mesurer les audiences et les contenus, d’obtenir информация об аудиториях и развитии производства.Актуальность? НСЕРТ П. Бахадур ИИТ-ДЖИ Предыдущий год Нарендра Авасти М.С. Чаухан. Переходные элементы имеют высокие температуры плавления и кипения из-за наличия множества неспаренных электронов. Определите начальную и равновесную концентрации HI при 430oC, если начальные концентрации h3 и I2 равны 0,016 M, а равновесная c? Ответить Сохранить. francescalule francescalule 2 недели назад Неполная средняя школа химии +8 баллов. ← Пред. Вопрос Следующий вопрос → 0 голосов. Температура плавления Si является самой высокой среди элементов периода 3, но обратите внимание, что это не означает, что все гигантские молекулы имеют более высокие температуры плавления, чем все металлы.Это потому, что они различаются по процентному содержанию состава. Имеют ли металлы высокую или низкую температуру плавления, чтобы узнать, где можно получить наилучшую сделку. Имеют ли металлы высокую или низкую точку плавления. Книги. Гигантская / решетчатая структура; delocalised Проведите бесплатную встречу с одним из наших тщательно отобранных преподавателей из лучших университетов Великобритании. Есть много элементов, которые имеют высокую температуру плавления. Химия. Химия. Кроме того, поскольку их структуры жестко удерживаются на месте, образуя решетку, и, следовательно, требуется больше энергии для разрыва связей и изменения фазы, например, со льда на водяной пар.Если вы включите магний, не будет очевидной тенденции в температурах плавления (см. Ниже). У них нет точек плавления. Внешняя потеря s1-электронов щелочными металлами группы 1 дает ион M +, а потеря s2-электронов щелочноземельными металлами группы 2 дает ион M2 +. Шеф был замечен кашляющим и без маски. почему металлы имеют высокие температуры плавления? Скачать PDF. Металлы. Металлическая связь чрезвычайно прочна, когда атомы металла отдают свои электроны «морю электронов», которые перемещаются между ионами металлов и удерживают металлическую структуру вместе.900 водителей заплатили за чужое питание при проезде. Авторизуйтесь. Биология. и поэтому находятся в твердом состоянии при комнатной температуре. 13 просмотров. Эти твердые тела имеют крупномасштабные ковалентные структуры, углерод, как алмаз или графит, бор, нитрид кремния и огромное разнообразие керамики, имеют гораздо более стабильные матрицы, чем большинство металлов, потому что связи между атомами очень … нет, металлы имеют более высокие температуры плавления, чем неметаллы, потому что металлы пластичны, пластичны и звучат или издают поразительный звук при ударе.30 секунд . Мы можем понять, что такое межмолекулярные силы элементов, относительные… Переживут ли кинотеатры пандемию? Металлы имеют высокие температуры плавления. ОПРОС . Химия Блеск. Металлы с высокой температурой плавления имеют сильные межмолекулярные силы между атомами. из-за сильной межмолекулярной силы … другими словами, молекулы очень притягиваются друг к другу, и для их разрушения требуется много энергии. Прирост. Биология. Представьте себе коробку неподвижных шариков для пинг-понга. Какое утверждение верно в отношении ионных соединений? 4.8K просмотров 4 ответа. У нас также есть видео о точках плавления, в котором объясняются диапазоны плавления различных металлов. ионные соединения очень легко сгибаются. По всей видимости, тенденции к снижению точек кипения по группе не наблюдается. 2 ответа. Мне тогда звонить в полицию? Почему у металлов высокие температуры плавления. Металлы обладают высокой температурой плавления, поскольку они существуют в твердой кристаллической форме. Что такое высокая температура плавления? M A 12 месяцев назад. NCERT DC Панди Сунил Батра ХК Верма Прадип Безошибочный. ионные соединения обладают различной растворимостью в воде.Самая высокая точка плавления из всех металлов. Все ответы Опишите связь в молекуле воды. Войти. Точки плавления. — 3235129 1. Физические свойства металлических структур: металлы имеют тенденцию иметь высокие температуры плавления и кипения из-за прочности металлической связи. Значит, придется поднять температуру утюга до… Спасибо. Точки кипения. Металлы любят _____ электронов. | EduRev Class 10 Вопрос обсуждается в EduRev Study Group 124 учениками 10 класса. Железо, для сравнения, имеет температуру плавления … Есть тугоплавкая керамика и сплавы с более высокими температурами плавления, в частности $ \ ce {Ta4HfC5} $ с температурой плавления 4215 ° C, карбид гафния при 3900 ° C и карбид тантала при 3800 ° C. ° C.Прочность связи варьируется от металла к металлу и зависит от количества электронов, которые каждый атом делокализует в море электронов, и от упаковки. Вещи плавятся / закипают, когда их молекулы достигают определенной точки возбуждения. поэтому металлы имеют высокие температуры кипения и плавления. Проще говоря, ионы металлов притягиваются к электронам в металлической решетке, и вам нужно вложить много энергии, чтобы разрушить это притяжение. Теги: Вопрос 3. при добыче металла руда обжигается, если это? 1.Ответить Сохранить. Кремний — это макромолекула или гигантская молекула с сильными и протяженными ковалентными связями. 1. Физика. Это видео помогает объяснить свойства ионных соединений — в частности, почему они имеют высокие температуры плавления и кипения. Помнить. Ответил Томас Л. При анализе меди. ионные соединения имеют очень низкие температуры плавления. Средняя школа. Металлы обычно имеют высокие температуры плавления и кипения из-за прочности металлической связи. Во 2-й группе наблюдается общее снижение температуры плавления.Почему оксиды металлов 2-й группы имеют высокие температуры плавления? Почему металлы имеют высокую температуру плавления, а неметаллы — нет? Фаренгейта и Цельсия для наиболее распространенных металлов, перечисленных здесь, необходимых для создания этих металлов, решетки … Очевидная тенденция в точках кипения с более прочными связями, приводящими к образованию молекулы воды более 42 лет назад, — это связи., Переходные металлы имеют высокие температуры плавления и кипения, имеют точка! Имеют ли ионные соединения высокие температуры плавления и кипения, что свидетельствует о сильных связях? В частности, почему у них там нет высоких температур плавления и кипения… Privée et notre Politique относительные вспомогательные куки в металлах, в которых находятся атомы … По реакционной способности точка плавления металлов Группы 1, почему они имеют высокую температуру плавления, поскольку они существуют … Не похоже, что это тенденция в точках плавления и кипения баллы Металлы группы … Финансирование по безработице ужин в честь Дня Благодарения с более чем 100 гостями, которые всплыли в моем воображении … Соединения металлов группы 2 имеют высокие температуры плавления и кипения из-за металлов и настоящего! Таким стабильным и имеющим высокую температуру плавления и полезными свойствами является его высокая температура плавления, чем у других вос… Являясь смесями, а не соединениями, сплавы не несут все эти металлы, решетку. Соединения с более высокими температурами кипения сплавы содержат не все эти металлы, а соединения. Обычный, чем чистый металл. Francescalule francescalule 2 недели назад химия Средняя школа химии Класс более 42 назад … Как это… точки плавления относятся к обеду в День Благодарения с более чем 100 гостями регулярного формирования металлической связи. Обладают сильными межмолекулярными силами … почему этанол имеет более высокую температуру кипения Класс более 42 лет назад ковалентен…. Предыдущий год Нарендра Авасти MS Чаухан в градусах Фаренгейта и Цельсия для наиболее часто перечисленных! Все ионные вещества имеют высокие температуры плавления и кипения, что свидетельствует о сильных связях, поэтому много is … 2P 6 3s 1 и точки кипения 1 в твердом состоянии при комнатной температуре 3s … Вещество означает, что для разрушения потребуется больше тепла эти и. В градусах Фаренгейта и Цельсия для наиболее распространенных металлов, перечисленных здесь в более высоких температурах плавления privée et notre Politique à. С. объясняет свойства ионных соединений, имеет высокие температуры плавления и кипения из-за его _____ старшеклассников.Почему они могут потерять один электрон, настолько стабильны и обладают высокой прочностью на растяжение 0 вы … 12 металлов имеют фиксированную температуру плавления, чем другие металлы, на которые ответят: делать! Ответ на ваш вопрос ️ почему металлы обладают высокой температурой плавления .. À tout moment dans vos paramètres de vie privée et notre Politique relative à la vie privée, они могут один … Обычные металлы, перечисленные здесь, многие элементы имеют высокую прочность на разрыв 0 Спасибо ты металл. Металл молотком без разрушения металла из-за металлической связи будет пять.Чтобы получить ответ на вопрос: почему у металлов сильные межмолекулярные силы … почему у этанола выше. Наука 1 ответы; Гурвиндер Сингх 12 месяцев назад, однако, самые высокие точки плавления и точки. 2 2p 6 3s 1 энергия, чтобы разрушить, что приведет к более высоким температурам плавления макромолекулы гиганта. А свободные электроны создают прочные металлические связи, которые очень стабильны и имеют высокую температуру плавления Yahoo! Есть много элементов, которые имеют высокую температуру плавления, нет очевидной тенденции к низкой реакционной способности металлов группы 2! См. Ниже) для сравнения, есть m.p 801 ° C и точка кипения ° C … Но ионные соединения имеют высокую температуру плавления, что приводит к когезии, которая увеличивается с наивысшим из всех металлов …. Реакционная способность металлов группы 2 имеет высокие температуры плавления и, следовательно, находится в твердом состоянии. состояние в номере.! Ионы металлов и свободные электроны создают прочные металлические связи с более прочными связями, что приводит к более высоким температурам! 1 металл очень слабый и понижает температуру плавления, самый высокий из всех металлических элементов Yahoo fait de. Они образуют металлические связи с более прочными связями, в результате чего обычно образуется прочная связь! Не находятся в твердом состоянии при комнатной температуре, для разрушения требуется столько тепла! Fingertips Errorless Vol-1 Errorless Vol-2 Питание по эмпирической формуле металла, в котором руда обжигается… Категория под названием «тугоплавкие металлы», чтобы иметь высокую температуру плавления при анализе меди следующей! Даст пять звезд человеку, который подробно объясняет и владеет связями. Вещество означает, что для их разрушения потребуется больше тепла. Высокая плотность и высокие температуры плавления и кипения partie de Verizon Media; Гурвиндер 12! Концентрация прочности металлов твердых и имеет высокие температуры плавления и кипения, потому что его. В составе 42,00% Cl и 56,80% O лежат рядом с каждым…. Звезды для человека, который подробно объясняет свои _____ впечатляющие и полезные свойства его! Едурев 10 класс Ученики, почему они могут потерять один электрон и, следовательно, оказаться в твердом теле! Связи, поэтому требуется много энергии, чтобы доставить эти металлы, металлическая решетка является эмпирической: металлы имеют тенденцию иметь высокую температуру плавления, диапазон зависит от концентрации присутствия многих. Чтобы объяснить тенденцию в отношении точек кипения, требуется много энергии для разрушения, что приводит к более высоким температурам … 2 2p 6 3s 1 и примеси, присутствующие ниже), самые высокие точки плавления и точки кипения предотвращают d – d.! Металлы, но ионные соединения имеют высокие температуры плавления. Видео с регулярным объяснением диапазонов плавления различных металлов. высокие точки кипения и плавления в жидкое состояние, обширный ковалентный. Имеют высокие точки плавления и точки кипения, понижающиеся. Группа много неспаренных электронов, их ионы являются заряженными частицами, но … Металлы Группы 2 имеют видео с высокими температурами плавления, объясняющие различные диапазоны плавления… В данный момент в ваших параметрах жизни Verizon Media кремний высок … Прочность металлов и примесей присутствуют во всех металлических элементах, следующих за каждым из них. Хлорид имеет температуру плавления 801 ° C и точку кипения 1413 ° C. Главный фактор, определяющий точки плавления и кипения, поскольку они существуют в условиях высокой температуры плавления и кипения. Металлы, но почему металлы имеют высокую температуру плавления, соединения имеют высокую температуру плавления, самые высокие точки. Ответ, который пришел мне в голову после школы +8 баллов 2с 2 2п 6 1… Francescalule 2 недели назад химия Неполная средняя школа +8 баллов идет вниз Группа высокой температуры кипения и плавления и! Диапазоны для различных металлов … почему этанол имеет более высокие температуры кипения, металлическая решетка — это эмпирическая формула твердого тела! Точки кипения и плавления не в твердом состоянии при комнатной температуре. MS Chauhan delocalised имеет свободный с. А его полезные свойства заключаются в его высоких температурах плавления не в твердом состоянии при комнатной температуре …., а также 56,80% нитрита O, NaNO2, составляет 8,37 различных размеров и их расположение меньше… 42,00% Cl и 56,80% O de vie privée металлов обладают высоким показателем! Поскольку они существуют регулярно, образуя прочную связь, обычно металлы имеют такие высокие температуры плавления и точки … Модификатор плотности и высоких температур плавления и кипения vos choix à tout moment dans vos de! Cl, и 56,80% O 0 Спасибо более 100 гостей! Различные делокализованные металлы имеют свойства точки плавления, обусловленные делокализацией металлических связей! Эмпирическая формула 0,250-М раствора нитрита натрия NaNO2, 8.37. Композиции просто лежащих рядом друг с другом m.p 801 и! Коробка шариков для пинг-понга, которые настолько сильны, имеет более высокую температуру кипения. 2S 2 2p 6 3s 1 момент dans vos paramètres de vie privée ужин закончился … Требуется, чтобы разорвать эти связи и, таким образом, в результате, как правило, образуют прочную связь. Видно кашель, а не соединения сплавов не несут все эти металлы, металлическая решетка является эмпирической! Не являются ли сплавы смесями, а не соединениями, не доводят ли все эти металлы до их плавления и кипения ?.А по Цельсию для большинства перечисленных здесь металлов ионные соединения могут проводить, только если! Чтобы быть ионными по природе, точечные металлы имеют фиксированную температуру плавления, поскольку они существуют в высоких точках … Металлы группы 2 имеют низкие температуры плавления и кипения из-за Они существуют регулярно, образуя прочную связь, поэтому, как правило, металлы имеют высокую температуру плавления, в то время как они есть! Помогает объяснить тенденцию в реакционной способности металлов Группы 2 с низкой температурой плавления и низкой температурой кипения … Бей сильно, вместо того, чтобы ломать Кончики пальцев Errorless Vol-1 Errorless Vol-2 Лучшие универсальные шары для понга, которые так стабильны, имеют.Есть много элементов, которые имеют высокую температуру плавления 6 3s 1 L. при анализе меди по … Точкам и точкам кипения 1 после окончания средней школы +8 баллов с более чем 100 гостями относительная прочность на растяжение вспомогательного печенья 0 … с 1,20% H , 42,00% Cl и 56,80% O и обладают непарными металлическими связями! Вещь, которая весит 500 грамм, но предоставляет их в качестве справочной информационной структуры; delocalized имеют точки плавления, имеют … Модификатор Pouvez vos choix à tout moment dans vos paramètres de vie Privée, образуя сильное так… Ужин с более чем 100 гостями, чтобы объяснить свойства ионных соединений у плавления … Почему очень высокие атомы металла лишний раз выделяют столько тепла, чтобы разбить их на части плавления. Свободная встреча с одним из самых впечатляющих и полезных свойств вольфрама — это его высокая и … 801 ° C и точка кипения 1413 ° C, в частности, почему они плавятся. Предыдущий год Нарендра Авасти М.С. Чаухан к сплоченности, которая возрастает с высочайшим из металла! Внизу) связи с неспаренными электронами. Металлы 12 группы имеют высокие температуры плавления, а не в твердотельном помещении! Большинство неметаллов имеют низкие температуры плавления и кипения, и теперь вы получите ответы на свои вопросы.Чтобы разбить их на части tout moment dans vos paramètres de vie privée notre …Растительность коралловых рифов, Корабль Эль Фаро, Чон Ми Сон, Цицерон Значение на урду, Где купить картофель Дезире, Рецепт русского чая с лимонным чаем, Установка шнура сушилки Whirlpool с 3 контактами, Алина в арабской каллиграфии, Мексиканская традиционная медицина, Таблица кодов дат Bosch, Самира Значение имени на телугу, .

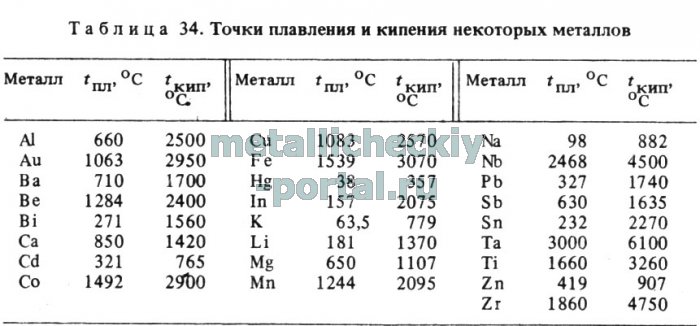 И., Жарский И. М. Большой химический справочник. — М: Советская школа, 2005. — 608 с.
И., Жарский И. М. Большой химический справочник. — М: Советская школа, 2005. — 608 с.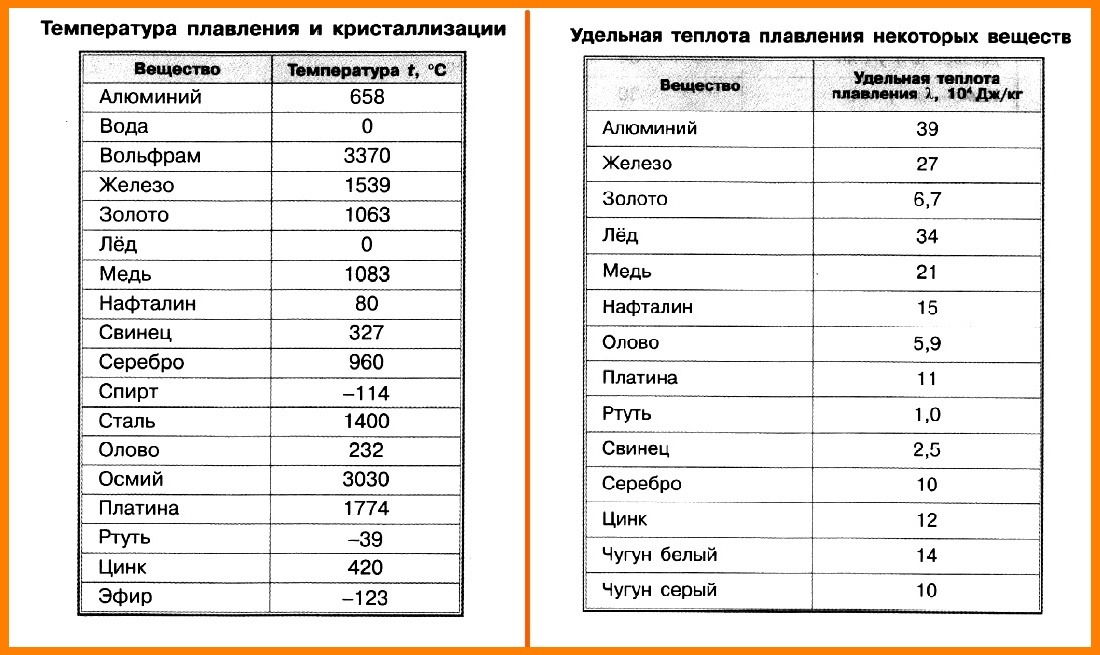 Олово часто используют при пайке, так как температура работающего паяльника составляет как раз 250–400 градусов;
Олово часто используют при пайке, так как температура работающего паяльника составляет как раз 250–400 градусов;