Ингибитор коррозии — что это такое? Классификация, применение и свойства
Коррозии подвержены металлы и некоторые другие материалы. Если коррозия разрушает структуру материала, тогда изделие теряет свои эксплуатационные качества, что приводит к аварийно-опасным ситуациям. Одним из средств решения этой проблемы являются ингибиторы коррозии металлов.
Описание ингибиторов
Что такое ингибитор коррозии? Ингибиторы коррозии – это специальные вещества, которые приостанавливают (задерживают) процесс химических и физических реакций. Ингибиторы коррозии занимают особое место в ряду таких веществ.
К ингибиторам относят средства, которые образуют на поверхности металла особую защитную пленку, которые получается в процессе реакции раствора ингибитора и продуктов коррозии.
Появление соединений, которые замедляют коррозийные процессы, стало прорывом. На данный момент, большинство способов защиты – это защита с помощью ингибиторов.
Эффективность защитных процессов с участием ингибиторов, напрямую зависит от металла, особенностей внешней среды, давления на материал и т.п.
Стоит отметить, что работа ингибиторная защита от коррозии не постоянно, попадая в раствор, добавка постепенно растворяется, поэтому в будущем необходимо добавлять его в агрессивную среду небольшими порциями.
Виды и применение ингибиторов коррозии металлов
К основным видам ингибиторов относят:
- Катодные – уменьшают скорость катодного взаимодействия.
- Анодные – тормозят растворение анода.
- Смешанные – добавки, которые замедляют реакции и катодные, а анодные.
Существует классификация ингибиторов по происхождению:
- Органические – это органические вещества, которые являются более универсальными, так как уменьшают скорость катодных и анодных реакций.
 К ним можно отнести азот, серу, кислород, ароматические соединения. Главным преимуществом и отличием от неорганических ингибиторов выступает тот факт, что органические вещества адсорбируются только на поверхности материала, не вступая в реакцию с ржавчиной.
К ним можно отнести азот, серу, кислород, ароматические соединения. Главным преимуществом и отличием от неорганических ингибиторов выступает тот факт, что органические вещества адсорбируются только на поверхности материала, не вступая в реакцию с ржавчиной. - Неорганические ингибиторы коррозии, что это такое? Они содержат неорганические вещества в составе ингибитора. Особенность работы с неорганическими частицами в ингибиторе заключается в том, что при неверно подобранной концентрации, они могут не защитить металл, образовав на нем тончайшую пленку, а наоборот вступить в реакцию с продуктами коррозии и ускорить процесс разрушения. Относятся хроматы, бихроматы натрия и калия, бикарбонат кальция и т.д.
Принцип действия ингибиторов
Классификация ингибиторов по механизму действия
Основные типы:
- Работающие в кислотной среде — амины, ацетиленовые спирты, серосодержащие соединения, альдегиды. Данный тип веществ применяется в газо- и нефтедобывающей промышленности, ими покрываются трубопроводы, по которым идет газ или нефтепродукты, а также изделия, участвующие в этих процессах.

- Ингибиторы для нейтральных сред – фосфаты, нитриты, аминокислоты, хроматы, алкилфосфаты, сульфонаты. Наибольшее применение нашли в сфере водоснабжения, охлаждения, применяются на морских судах. Здесь также как везде, раствор ингибитора используется в качестве защитного покрытия любых изделий перечисленных отраслей, емкости, несущие конструкции, отдельные элементы.
- Протекающие в щелочной среде. Вещества участвуют в составах специальных моющих средств. Действие их основано на том, что они уменьшают силу тока в его химических источниках. Ингибиторы для таких целей чаще всего используют совместно с катионами.
Распространенные типы кислотных ингибиторов
Наиболее экономичный антикоррозийный ингибитор — кислотный. Его расход в процессе травления металла минимален, что влечет за собой снижение себестоимости продукта и процедуры защиты в целом.
К свойствам кислотных ингибиторов так же можно дописать тот факт, что при нанесении их на материал, он еще и очищает его от образовавшихся окалин и различных оксидных пленок.
На отечественном рынке чаще всего можно встретить такие ингибиторы коррозии как И-5-В и И-5-ВМ. Данные добавки предназначены для изделий из низкоуглеродистых, среднеуглеродистых и высокоуглеродистых и легированных сталей. Они эффективно применяются в промышленности, а также оба ингибитора можно совмещать друг с другом.
Применение ингибиторов коррозии с таким составом снижает угар металла, способствует очищению поверхности протравленного материала, а также благоприятно влияет на санитарно-гигиенические условия труда.
Свойства ингибиторов коррозии
Все свойства ингибиторов сводятся к антикоррозийной защите металлических изделий. Механизм работы прост: ингибитор в составе раствора наносится на поверхность элемента и защищает его от внешнего влияния агрессивных сред. Защита создается с помощью адсорбции (увеличения концентрации ингибитора в растворе и на поверхности материала, соответственно) на металлическом элементе.
Ингибитор коррозии катодный
Данный тип добавок замедляет растворение металл при катодном процессе. Потенциал системы из своего обычного нейтрального состояния уходит в отрицательную сторону, что приводит к уменьшению коррозийного тока, и на поверхности образуется антикоррозийная пленка. Эта пленка является трудно растворимой не только для нормальных условий, но и для многих агрессивных сред. Она становится барьером между внешней средой и металлом, сохраняя его целостность.
Катодная ингибиторная защита от коррозии, что это? Чаще всего это соединения, которые увеличивают кислотность среды, что снижает возможность растворения металла.
Катодные добавки не применяются в кислых средах, так как там они не эффективны.

Как отмечалось ранее, ингибитор перед применением должен быть растворен в каком-либо веществе, самый простой – вода. Специалистами подбирается верная концентрацию добавки в данном объеме воды.
Стоит отметить, что данный тип веществ является наименее эффективным, в сравнении с анодными и смешанными ингибиторами.
Анодные ингибиторы коррозии
Данные вещества являются пассиваторами – вещества, переходящие из активного состояния в пассивное и образующие пленку. Эта пленка защищает металлический элемент. Коррозия замедляется вследствие уменьшения скорости перехода ионов металла в раствор, а также уменьшается площадь анодных участков, покрытых пленкой, за счет их разделения.
Именно анодные добавки, если с ними переборщить, могут не уменьшить, а ускорить коррозионное разрушение материала. Популярны карбонаты, силикаты, фосфаты, нитрит натрия, как ингибиторы анодной коррозии.
Смешанные ингибиторы коррозии
Смешанные добавки – это хроматы. Хроматы значительно тормозят анодную и катодную реакцию вместе, поэтому они являются наиболее эффективными. Процесс такой реакции протекает по окислительному типу.
Хроматы значительно тормозят анодную и катодную реакцию вместе, поэтому они являются наиболее эффективными. Процесс такой реакции протекает по окислительному типу.
Применение ингибиторов в нефтегазовой промышленности
Нефть и газ являются достаточно агрессивными средами, так как в них находятся едкие вещества, которые способны разъедать материалы и пагубно влиять на здоровье человека. Исходя из этого, специальные добавки для защиты металлических конструкций, применяют на любой стадии добычи, транспортировки, хранения и эксплуатации нефти и газа. Важным аспектом является то, что ингибитор на всех этих стадиях желательно применять один и тот же.
Кроме защиты металла, в сами нефтепродукты могут добавляться примеси, которые делают ее менее агрессивной средой: антикоррозийные ингибиторы парафинообразования, антивоспламенители и антивспениватели. Наиболее распространенное вещество для защиты магистральных нефте- и газопроводов – соединения на основе аминов.
Применение ингибиторов в бытовых условиях
Процессы коррозии поражают не только металлические изделия промышленных и строительных производств, но и любые металлические изделия у нас дома, а также машины и приборы.
Самое простое домашнее средство с ингибитором – это грунтовка. Как всегда, поверхность необходимо подготовить, а потом загрунтовать шпателем или кисточкой. Грунтовка создает на изделии защитный слой, разделяя металл и окружающую среду.
Некоторые лакокрасочные покрытия также имеют в своем составе ингибиторы.
Наиболее простые и понятные ингибиторы для домашнего обихода – сурик (свинцовая краска красного цвета) добавленный в грунтовку, добавленные в раствор ортофосфаты железа или цинка и т.п.
Свинцовая краска красного цвета
Применение ингибиторов при обработке техники
Коррозия в технике является наибольшей угрозой для жизни человека. Зачастую коррозирующий участок в большом элементе не так страшен, как коррозия на участке болтового соединения или сварного шва.
Зачастую коррозирующий участок в большом элементе не так страшен, как коррозия на участке болтового соединения или сварного шва.
Чаще всего, конечно, с проблемой ржавчины сталкиваются владельцы авто и везут свои машины на СТО для того, чтобы там специалисты сами обработали материал и нанесли антикоррозийное покрытие с применением ингибиторов или нет.
Разрушение техники сложно приостановить, так как участки, подверженные разрушению обычно труднодоступны, затруднительна обработка ингибитором коррозии, и очистка пораженного участка. В малодоступных местах стараются применять жидкие составы для их лучшего нанесения и распределения – масла, битумные горячие составы, мягкие смазки и т.д.
Заключение
В целом, ингибиторы коррозии металлов увеличили срок работоспособности изделий и техники. С их помощью появилась возможность четко провести границу между элементом и окружающей средой и надолго приостановить развитие коррозии. Теперь это все доступное защитное средство, имеющее широкий выбор и различный ценовой диапазон.
Ингибиторы коррозии металлов – свойства, состав и применение
Ингибиторы коррозии используются для замедления образования ржавчины на металлах. Действие замедлителей основано на возможности отдельных химических веществ снижать скорость развития коррозии в металлах или даже вовсе ее угнетать.
Ингибиторы востребованы при защите металлических изделий во время травления и промывания. Данные вещества добавляются в полимерные покрытия, воски, смазки, упаковку, в закрытое пространство, где хранится металл. В результате этих мероприятий увеличиваются защитные возможности покрытий.
При попадании на металл, начинается адсорбция ингибиторов, что снижает скорость ионизации. Процесс ионизации может замедляться как у металла, так и у кислорода, либо в обоих случаях одновременно.
В последнее время налажено производство большого ассортимента различных ингибиторов. Существуют замедлители, предназначенные для отдельных групп металлов (черные или цветные) и вещества универсального применения, которые можно применять во всех случаях.
к содержанию ↑Обратите внимание! Выбирая тот или иной ингибитор, нужно проконсультироваться со специалистом или внимательно изучить справочники. Дело в том, что одно и то же вещество, по отношению к разным металлам, может как способствовать, так и замедлять развитие коррозийного процесса.
Защита от атмосферной коррозии
Чтобы предохранить металлы от воздействия атмосферной коррозии, применяются ингибиторы контактного типа, а также летучие ингибиторы, которые испаряются и самостоятельно распространяются по металлической поверхности.
Применение летучих ингибиторов связано с высокими требованиями к барьерным материалам:
- материалы должны быть непроницаемы для ингибиторных паров;
- упаковка должна быть герметичной, иначе вещество тут же улетучится.
Существует несколько методов использования ингибиторов для предохранения металлических изделий от атмосферной коррозии:
- ингибитор наносится на поверхность металла из растворов водного типа или же органических растворителей;
- осуществляется процесс сублимации ингибиторов на металлическую поверхность из воздуха, в котором имеется большая концентрация ингибиторных паров;
- на поверхность металла наносится полимерный состав, включающий в себя ингибитор;
- изделие заворачивается в ингибированную бумагу;
- в закрытое пространство направляется пористый носитель с ингибитором.

В последнем случае в качестве носителей выступает «линопон» или «линасиль». Эти адсорбенты, размещенные в замкнутом пространстве, обеспечивают продолжительную сохранность металлов, предохраняют от возникновения коррозии и «бронзовой болезни». Также благодаря адсорбентам появляется возможность сохранности изделий в случае резкого изменения условий окружающей среды.
Мероприятия по консервации с помощью ингибиторов рекомендуется осуществлять при влажности на уровне ниже критической, в условиях чистого воздуха. Не допускается наличие кислых паров в воздухе в помещении (такие пары выделяются во время химической чистки), где проводится консервация.
Адсорбция ингибитора, с образованием мощного защитного слоя, происходит не сразу, а в течение некоторого времени. Продолжительность затраченного времени зависит от характера не только ингибитора, но и обрабатываемого металла. До обработки ингибитором изделия из металла тщательной очищаются от грязи и жира, а потом подвергаются сушке.
До обработки ингибитором изделия из металла тщательной очищаются от грязи и жира, а потом подвергаются сушке.
к содержанию ↑Обратите внимание! Перед консервацией металл нельзя трогать голыми руками. Всю работу в дальнейшем нужно делать в резиновых перчатках.
Защита для стальных конструкций
Наиболее популярны водные растворы (в особенности вязкие) нитрита натрия. Этот раствор представляет собой ингибитор контактного типа, наносимый на поверхность изделия (например, системы отопления или другой металлоконструкции).
Добавление в водные растворы нитрита натрия дополнительного компонента, увеличивающего вязкость структуры (оксиэтилцеллюлоза, глицерин, ксилит, крахмал), значительно повышает эффективность вещества. В частности, увеличивается срок гарантированной защиты металла вне зависимости от условий климата. Вязкие составы предохраняют растворы нитрита натрия от засыхания, не позволяют отходить солевым кристалликам от металлической поверхности, а также снижают процент стекания вещества в условиях повышенной влажности.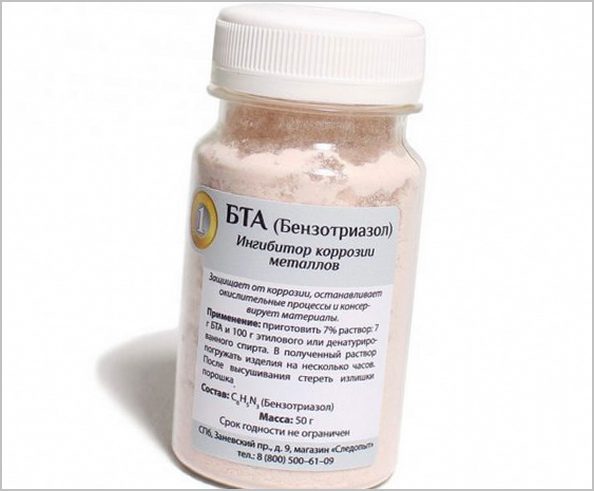
Чаще всего используется 25% раствор нитрита натрия, — если речь идет об изделиях из стали, и 40% раствор — для защиты чугунных деталей. Металл обрабатывается раствором, разогретым до 65-85 градусов. Возникшие на поверхности кристаллы нитрита натрия в результате конденсирования влаги при хранении (к примеру, при хранении между технологическими операциями), образуют концентрированный раствор ингибиторного вещества.
Именно этот раствор и пассивирует металл. Чтобы нейтрализовать кислые атмосферные компоненты, попадающие на металл с конденсирующей влагой, в раствор нитрита натрия добавляют небольшой процент соды (до 0,6%). Необходимо иметь в виду, что снижения концентрации нитрита натрия до величин, ниже установленного порога, ведет к так называемой местной коррозии. Этот фактор является причиной целесообразности использования при долгосрочном хранении вязких видов растворов.
Среди летучих ингибиторов чаще всего применяется нитрит дициклогексиламин. Данное вещество прекрасно подходит именно для чугуна и стали, но способствует коррозионным процессам в меди и ее сплавах, олове, цинке, свинце, алюминиево-медных сплавах, магнии и кадмии. Летучие защитные вещества не меняют устойчивость к коррозии у алюминия, никеля, хрома, а кроме того, не оказывают влияния на механические характеристики пластика, кожи, резины, красок и лаков.
Летучие защитные вещества не меняют устойчивость к коррозии у алюминия, никеля, хрома, а кроме того, не оказывают влияния на механические характеристики пластика, кожи, резины, красок и лаков.
Данный ингибитор применяется в виде растворов спирта. Для нанесения на каждый квадратный метр 1,5-2,5 граммов вещества берется 8,5% раствор спирта. Сразу после обработки деталь герметично упаковывается или размещается в изолированном пространстве.
к содержанию ↑Защита меди и ее сплавов, а также серебра
Чтобы предотвратить коррозионные процессы на меди и ее сплавах, а также на серебре, применяется ингибитор контактного типа — бензотриазол. Это вещество входит в контакт с солями 1 и 2-валентной меди, в результате чего возникают полимерные соединения, нерастворимые в водной среде и устойчивые к высоким температурам.
За счет возникновения нерастворимых структур, бензотриазол сдерживает так называемую «бронзовую болезнь». Рекомендуется применение бензотриазола для защиты как уже очищенных объектов, так и для предметов, у которых решено оставить коррозионное покрытие или патину без изменений. Бензотриазол также замедляет потемнение предметов из бронзы, меди и серебра.
Бензотриазол также замедляет потемнение предметов из бронзы, меди и серебра.
Применение ингибиторов, назначение, состав, органические ингибиторы коррозии
Существуют специальные вещества, которые способны замедлить образование коррозии на поверхности металлических конструкций. Удивительно, но ингибиторы, которые предварительно вводятся уже образовавшиеся коррозийную среду и способны повлияет на скорость протекания большинство химических реакций, провоцирующих ржавчину и последующее разрушение материала.
Таким образом, ингибитор кислотной коррозии способен регулировать ее распространение по материалу.
Благодаря этому сложному изобретению можно:
- осуществлять профилактику возникновения коррозии на различных поверхностях и материалах,
- обеспечить замедление разрушения пораженного коррозией участка,
- создать все условия для изоляции поверхности, которая уже пострадала от всевозможных химических реакций и ржавчины.

Из-за коррозии сотни предприятий ежегодно получают большие финансовые убытки. Это спровоцировано тем, что участки коррозии быстро распространяются, заполняя собой всю поверхность конструкции. Таким образом, происходит ее полное разрушение. В дальнейшем подобное оборудование не пригодно для последующей эксплуатации, не нуждается в полной замене. Ингибиторы способствует тому, что задерживают распространения коррозии. Поэтому производители выигрывают время за счет применения подобных средств.
Назначение ингибиторов
Наибольшую ценность для технологов представляют особые органические соединения, способные в правильных пропорциях выступать основными ингибиторами коррозии.
Однако вся проблема состоит в том, что подобные химические элементы и вещества стоят значительные финансовые средства. Производителям приходится выбирать между периодической заменой различного оборудования из металла и применения подобных дорогостоящих веществ.
С одной стороны, выгоднее всего один раз заплатить для того, чтобы обеспечить себя запасным защитных веществ, позволяющих предупредить появление коррозии и замедлить ее развитие. Если она уже появилась на стенках какой- либо поверхности, то со временем все равно придется обеспечить полноценную замену всего присутствующего на данной территории оборудования.
Если она уже появилась на стенках какой- либо поверхности, то со временем все равно придется обеспечить полноценную замену всего присутствующего на данной территории оборудования.
Ни один ингибитор в мире не способен избавить от коррозии на 100%.
Поэтому ингибитор коррозии, применение которого так популярно среди большинства производителей, желающих сэкономить на замене некоторых деталей, уже пораженных коррозией не является универсальным средством борьбы с ней.
Но у производителей есть и другой выбор. Они могут изначально закупать оборудование, созданное с учетом специальных стойких коррозии материалов. Такие товары уже обработаны защитным покрытием и ржавчина на стенках не образуется. Конечно же, у них также есть свой срок эксплуатации. Однако, таким образом, производители переплачивают дважды не только за дешевый материал, который выходит из строя, но из-за всевозможных ингибиторов, лишь на некоторое время замедляющих протекания химических реакций на поверхности материала.
Основной причиной, провоцирующей возникновение коррозии, является вода, попадающая на поверхность различных материалов.
Например, если труба постоянно взаимодействует с водой, это ускорит протекание определённых химических реакций. В результате коррозия образуется на поверхности трубы значительно быстрее.
Некоторые предприятия нуждаются в замене составных элементов покрытия даже без использования ингибиторов. Например, чтобы предотвратить последующее растрескивание в крепеже различного оборудования, которое участвует в транспортировке нефти или же работе с ней, нужно использовать трубы, сделанные из специального материала. В данном случае экономия неуместна, так как нефть относится к группе легковоспламеняющихся жидкостей. Поэтому работать с ней нужно очень осторожно. В принципе это же касается и природного газа, а также других полезных для промышленности веществ и различных материалов.
С одной стороны, защитные покрытия стоят немалых денег, но они способствуют обеспечению дополнительной защиты для всего предприятия, занимающегося производством различных видов товаров.
На данный момент правительств многих стран старается закупать или же производить вещества:
- предотвращающие появление коррозии,
- замедляющие процессы её протекания,
- способствующие обеспечению профилактики возникновения ржавчины на стенках труб и другого оборудования.
Таблица. Физико-химические свойства и способы применения ингибиторов.
| N п/п | Название ингибитора | Хими- ческая формула | Физические свойства | >Способ применения | ||
|---|---|---|---|---|---|---|
| агрегатн. состояние плавл. | раство- римость | лету- честь | ||||
| 1 | >НДА (Нитрит дицикло-гексиламина) | Кристаллический порошок 165-180° | Хорошо в спиртах, плохо в воде | 0,76 мг/м | В виде ингибитирован- ной бумаги, порошка, спиртовых растворов | |
| 2 | МСДА (Маслорастворимая соль дицикло-гексиламина) | Пастообразное вещество, застыв. 10-15° 10-15° |
8 мг/м | В 1-3% растворе, в маслах и бензине | ||
| 3 | КЦА (Карбонат цикло-гексиламина) | Кристаллическое вещество, 106° — 1 | В воде и в органичес- ких растворите- лях | В виде порошка, в смеси с НДА, в виде спиртововодных насыщенных растворов; в виде ингибитирован- ной бумаги | ||
| >4 | ХЦА (Хромат цикло-гексиламина) | Кристаллический порошок, 180° | В воде и в спиртах | В виде порошка, 1-3% спиртовых или водно-спиртовых растворов, ингибитирован- ной бумаги | ||
| 5 | М (Маслорастворимая соль цикло-гексиламина) ингибитор | Пастообразное вещество застыв. +12° | В воде и в органичес- ких растворите- лях | В виде 0,5-3% раствора в минеральном масле | ||
| 6 | Диамин (4,4-диаминодицикло- гексилметан) | Пастообразное вещество 40° | Нераство- рим в воде. Растворим в органичес- ких растворителях Растворим в органичес- ких растворителях |
Ограниченное применение из-за малой стабильности | ||
| 7 | В-30 (Карбонат 4,4-диамино-дициклогек- силметана) | Порошок пл. 133-158° | Почти нераство- рим в воде, ацетоне, спирте | В виде ингибитирован- ной бумаги, порошка | ||
| 8 | БЦГА (Бензоат цикло-гексиламина) | Порошок 181-232° | Слабо растворим в воде, в этиловом спирте | В виде ингибитирован- ной бумаги | ||
| 9 | БДЦГА (Бензоат дицикло-гексиламина) | -«- | -«- | -«- | ||
| 10 | Ц-1 (Паранитробензоат цикло-гексиламина) | -«- | -«- | -«- | ||
| 11 | Д-1 (Паранитробензоат дицикло-гексиламина) | -«- | -«- | -«- | ||
| 12 | Ц-2 (Метанитробензоат цикло-гексиламина) | -«- | -«- | |||
Как защитить покрытие от коррозии
Существует несколько способов, позволяющих обеспечить защиту покрытий от появления неприятных последствий, спровоцированных коррозией. Наиболее популярными является использование плазменных или же диффузионных типов покрытий, а также нанесение особой смазки, которая содержит ингибиторы.
Наиболее популярными является использование плазменных или же диффузионных типов покрытий, а также нанесение особой смазки, которая содержит ингибиторы.
Всё дело в том, что защита коррозии ингибиторами эффективна лишь в том случае, если после замедления распространения ржавчины, вся металлическая конструкция в скором времени будет заменена на новую.
Но при помощи использования ингибирующих смазок появляется уникальная возможность повлиять на процессы протекания химических реакций на поверхности материала. В результате можно значительно замедлить распространение площади коррозии, её перехода на другие типы конструкций.
Защитное действие ингибирующих смазок фактически состоит в том, чтобы «собрать» излишнюю воду, которая постепенно скапливается на всей площади поверхности металла.
Таким образом, при помощи сил адгезии происходит последующее образование прочного слоя. Данная, так называемая защитная плёнка представляет собой особый адсорбционный слой, позволяющий предотвратить попадание воды на металл.
Металл защищён от коррозии, так как находится в изоляции от воды, воздуха и других атмосферных воздействий. Плёнка не разрушается со временем, благодаря этому происходит процесс замедление последующего разрушения материалов.
Органические ингибиторы
Целесообразным с точки зрения финансовых вложений в производство и наиболее дешёвым методом борьбы с распространением коррозии является применение ингибиторов. Они эффективны в большинстве случаев. Но стоит не забывать и о том, что существуют такие участки на поверхности, которые уже не подлежат восстановлению или же замедлению протекания процессов коррозии. В данном случае лучше сразу воспользоваться соответствующими инструментами и совершить демонтаж части поверхности, только в том случае, если это возможно. Новая деталь обеспечит дополнительную прочность и долговечность всей поверхности металла.
Применение этого метода позволяет при помощи использования особых технологий создать определённую среду, обеспечивающую борьбу не только с самой коррозией, но и с её последствиями, выраженными уже разрушенными частями конструкции.
Большая часть всех, уже открытых или же усовершенствованных в мире ингибиторов являются органическими. Они функционируют посредством использования процессов адсорбции. Уже образованные слои выполняют функции фазовых или же энергетических типов барьеров.
Состав ингибиторов
У каждого ингибитора при этом свой собственный механизм работы, который зависит не только от условий среды, но и от состава самого вещества, обеспечивающего защиту металла и других материалов от коррозии.
Большинство профессоров при этом пришли к выводу, что механизмы работы ингибиторов во многом зависят от их происхождения и составных элементов вещества.
Но при этом даже сам ингибитор нуждается в применении дополнительных веществ и химических элементов для того, чтобы начать свою работу. Для ингибитора, который впоследствии способен растворяться в масле используют литиевую соль. Иногда вспомогательным элементом выступает алкенилянтарная кислота. Другими химическими веществами, функционирующими в качестве дополнительных составных частей для самого ингибитора, являются магниевые соли. Но только они должны быть в обязательном порядке извлечены из органических кислот.
Другими химическими веществами, функционирующими в качестве дополнительных составных частей для самого ингибитора, являются магниевые соли. Но только они должны быть в обязательном порядке извлечены из органических кислот.
Кроме основной защитной функции ингибиторы так же позволяют улучшать свойства некоторых материалов. Например, если от длительного взаимодействия с водой на поверхности металла появляются первые признаки коррозии, выраженные ржавчиной, то именно ингибитор позволяет увеличить способность масла к отталкиванию жидкостей.
Особой популярностью в наше время пользуются ингибиторы коррозии, основанные на органических соединениях. Ведь механизмы их работы во многом зависят от соблюдения многих условий и факторов. Ведь раньше большее внимание уделяли строению самого ингибитора, его особенностям на молекулярном уровне. На данный момент особую важность представляет концентрация самого вещества и возможность дальнейшей эксплуатации замедлителя коррозии.
Особую важность представляют собой условия хранения ингибиторов, от которых во многом зависит качество их дальнейшей работы.
В изучении данной темы уже достигнуты определённые результаты. Но при этом, несмотря на то, что принципы работы ингибиторов изучаются специалистами из разных стран, их номенклатура не отличается достаточным количеством веществ. Особенно это касается ингибиторов, которые в свою очередь предназначены для использования в сероводородной среде.
Эта проблема возникает из-за того, что данные защитные вещества, обеспечивающие замедления химических реакций, провоцирующих возникновение коррозии, ещё до конца не изучены. Поэтому учёным следует задуматься над расширением области изучения ингибиторов и созданием полноценного каталога данных веществ. Данные вещества особенно важны для сохранения уникальных с промышленной точки зрения конструкций, позволяющих обеспечивать рост экономики во всём мире.
Ингибиторы представляют собой особое значение для промышленности. Вместе с тем, стоит задуматься над организацией производства материалов, которые уже будут содержать в своём составе вещества, позволяющие обеспечить полноценную защиту от коррозии.
Удивительно, но существование ингибиторов обусловлено спросом на их использование. Значит, в мире с каждым годом появляется всё больше материалов, нуждающихся в обработке и защите ингибиторами от коррозии и ржавчины.
Быть может предпринимателям, организовывающим производство каких-либо товаров, стоит обеспечить правильный микроклимат в промышленных помещениях. Это бы избавило их от дополнительных затрат, связанных с последующим предотвращением последствий коррозии.
Органические соединения в результате представляют собой наиболее эффективный способ борьбы с коррозией, позволяющий обеспечить профилактику её возникновения и распространения.
Ингибитор коррозии: характеристики, виды, принцип действия
Коррозия представляет опасность для металлических поверхностей. Чтобы ее задержать, используются специальные вещества – ингибиторы. Правильный подбор такого средства продлевает сроки эксплуатации изделия или металлоконструкции.
Правильный подбор такого средства продлевает сроки эксплуатации изделия или металлоконструкции.
В этой статье расскажем о том, что представляет собой такое вещество, обсудим эффективность ингибитора коррозии, а также рассмотрим разновидности средств.
Особенности вещества
Сразу стоит отметить, что когда говорят об ингибиторах, не имеют ввиду конкретное вещество. Это набор составов, которые наносят на затронутые коррозией участки или применяют в качестве профилактического средства.
Использование такого средства задерживает ферментативные процессы. Свойства ингибиторов коррозии позволяют воздействовать на активные вещества. В зависимости от ситуации применения, они направлены на полную блокировку процессов или замедление их протекания.
В результате химической реакции происходит образование свободных радикалов, ржавение задерживается и длительность использования металлического элемента увеличивается.
В работе важно соблюдение дозировки и понимание степени эффективности воздействия разных типов веществ. Таким образом, удается не только запускать химическую реакцию, но и получать гарантию, что она будет протекать точно как вам нужно.
Таким образом, удается не только запускать химическую реакцию, но и получать гарантию, что она будет протекать точно как вам нужно.
Из чего состоят ингибиторы
Принцип действия ингибиторов коррозии зависит от состава. В качестве активных веществ выступают следующие:
- Трихлорид азота. Такой тип вещества подойдет для использования в том случае, если запускают реакцию водорода и хлора.
- Гидрохинон. Ингибиторный процесс проводится на основании запуска окисления на поверхности.
- Различные типы соединения технеция. Средство задерживает развитие коррозии на металлических изделиях, в том числе, на крупных конструкциях.
От специалистов, которые занимаются вопросами защиты от коррозии, требуется понимание взаимодействия ингибиторов с разными типами веществ. К примеру, когда планируется запустить реакцию водорода и хлора, используют небольшие концентрации реагента.
Механизм действия ингибитора коррозии бывает двух типов. Первый – обратимый. В таком случае в химической реакции не происходит взаимного изменения молекул.
Первый – обратимый. В таком случае в химической реакции не происходит взаимного изменения молекул.
Также некоторые реагенты вызывают необратимый процесс, когда состав реагирующих друг с другом веществ сильно изменяется.
Важно понимать особенности разных типов средств, чтобы не только получить нужный эффект, но и не допустить повреждения обрабатываемого материала тем или иным способом.
Защитные свойства и механизмы их действия
В промышленности такие вещества применяются активно. Они нужны для того, чтобы продлить сроки службы металла, даже если он находится в агрессивных средах, к примеру, на открытом воздухе.
При запуске химической реакции, необходимо, чтобы вещество впиталось внутрь металла. В таком случае происходит накопление положительного потенциала – коррозия развивается намного медленнее.
Также вещества работают и по поверхностному принципу. В таком случае на детали появляется тонкая пленка. Она нужна, чтобы оградить металл от попадания на него солнечного света и воды, а также появления других распространенных проблем, приводящих к ржавению.
Это универсальный метод, в основе которого применяется множество средств – от аминов и сульфидов до тиолов и мочевины. Так большое распространение получили и азотосодержащие гетероциклические соединения – промышленные предприятия закупают их в больших объемах.
Свойства, характеристики и особенности применения
Для каждого вещества определена основная область использования. Ее определяют по характеристикам, указанным в сопроводительной документации.
Вещества получают следующие обозначения:
- Марка. Позволяет понять технические особенности использования средства. Рядом с ней постоянно прописывается и ТУ, по которым производится состав. Это дает понять, где его можно и нельзя использовать, какой результат ожидать от нанесения.
- Плотность. Указывается при комнатной температуре, потому что это стандартные условия обработки.
- Процент содержания примесей. Указывается, сколько содержится металлических включений, смол, основного азота.

- Вязкость. Прописывается при 50 °С. Помогает понять, насколько комфортно будет работать с таким веществом при его нанесении на обрабатываемую поверхность.
- Температура эксплуатации. Кроме основного параметра – температуры застывания, также указывается, когда вещество может вспыхнуть или самовоспламениться.
Характеристики ингибиторов коррозии напрямую влияют на область их применения. Продукция закупается в больших объемах, чтобы защитить металлоконструкции, нефтегазопромысловое оборудование и другие изделия от множества типов угроз.
Так они замедляют коррозию как при контакте с воздухом, так и в агрессивных средах, при воздействии растворов соляной и серной кислоты.
Физико-химических свойств ингибиторов коррозии.
| Марка ингибитора | Общая характеристика | Плотность при 20 °С, г/см3 | Содержание, % | Вязкость при 50 °С, сСт | Температура, °С | ||||
|---|---|---|---|---|---|---|---|---|---|
| основного азота, в пределах | смол, не более | механи-ческих примесей | засты-вания | вспышки | самовоспла-менения | ||||
| И-1-А* (ТУ 38-103246-87) | Вязкая темно-коричневая жидкость с характерным запахом пиридинов, почти не растворяется в воде, хорошо растворяется в органических растворителях, а также в соляной, серной и других сильных кислотах | 1,0. ..1,1 ..1,1 |
7,0…9, 5 | 5 | 0,2 | — | — | — | — |
| И-1-В* (ТУ 38-103-238-74) | Темно-коричневая жидкость с характерным слабым запахом, легко растворимая в кислотах и в воде | 1,25…1,35 | — | 3,0 | — | — | — | — | — |
| «Север-1» (И-2-А)* (ТУ 38-103-201-76) | Легкоподвижная темно-коричневая жидкость, хорошо растворяется в бензоле, спирте, ацетоне, соляной и серной кислотах | 0,93…1,05 | 4,90…6,65 | 3,5 | 0,2 | 7…12 | -65 | +23 | +385 |
| И-З-А* (ТУ 38-403-29-73) | Темно-коричневая жидкость с характерным запахом, хорошо растворимая в полярных органических растворителях и минеральных кислотах | 0,99…1,07 | 8,3…11,0 | 3,5 | 0,2 | 15 | -33…-45 | +76 | +413 |
| И-4-А* (ТУ 38-403-44-73) | Темно-коричневая жидкость с характерным запахом, хорошо растворимая в бензоле, спирте, ацетоне, соляной, серной кислотах и ряде других продуктов | 0,94. ..1,00 ..1,00 |
4,9…6,65 | 3,5 | 0,2 | 3…7 | -50…-75 | +15 | +413 |
| И-4-Д (ТУ 38-403-46-73) | Темно-коричневая вязкая жидкость с характерным запахом, эмульгируется в водных растворах, растворяется в толуоле, хлороформе, четыреххлористом углероде и некоторых других средах | 0,85…0,95 | — | — | — | 65…95 | -12…-15 | +81 | +239 |
| «Тайга-1» (И-5-ДНК) (ТУ 38-403-47-73) | Легкоподвижная темно-коричневая жидкость с характерным запахом, эмульгируется в водных растворах, растворяется в углеводородах | 0,92…0,96 | — | — | — | — | -50 | +20 | +340 |
| И-2-Е | Легкоподвижная темно-коричневая жидкость со слабым характерным запахом, растворимая в воде, спирте, кислотах | 1,0. ..1,1 ..1,1 |
— | — | 8…10 | — | -50 | — | — |
| «Тайга-2» (И-5-ДТМ) ТУ 38-403-78-78) | Легкоподвижная темно-коричневая жидкость, растворимая в спирте, бензоле, дихлорэтане и других органических растворителях | 0,87…0,89 | — | — | 3,9… 4,0 | — | -45 | — | — |
| И-21-Д (ТУ 38-403-101-78) | Легкоподвижная темно-коричневая жидкость, растворимая в спирте, бензоле, дихлорэтане и других органических растворителях | 0,8…0,9 | — | — | 5,0 | — | -16 | — | — |
| И-30-Д (ТУ 38-403-79-76) | Легкоподвижная темно-коричневая жидкость, эмульгируется в воде, растворяется в спирте, бензоле, дихлорэтане | 0,85… 0,87 | — | — | 5,0 | — | -40 | — | — |
| И-К-10 (ТУ 38-403-68-75) | Легкоподвижная коричневая жидкость, растворяется в воде, спирте, кислотах | 1,06. ..1,1 ..1,1 |
— | — | 8…11 | — | -50 | — | — |
| И-К-40 (ТУ 38-403-75-75) | Легкоподвижная коричневая жидкость, растворяется в воде, спирте, кислотах | 0,95…1,15 | — | — | 10…15 | — | -50 | — | — |
| Нефтехим (ТУ 38. УССР 201463-66) | Представляет собой смесь полиэтиленполиамидов карбоновых кислот легкого талового масла и солей пиперазина этих кислот в растворе керосина и катализата риформинга | — | — | — | — | 7 | -18 | +37 | 340…435 |
| Газохим (ТУ 113-03-20-73) | Однородная жидкость темно-коричневого цвета, растворяется в углеводородах | 0,97 | — | — | — | — | -10 | +61 | 262 |
Не менее востребована и защита от ржавения при контакте с пластовыми и сточными водами, жидкостями с большим процентом содержания сероводорода, углекислоты и других агрессивных веществ. Понимая принципы работы, можно подобрать решение для поставленной задачи.
Понимая принципы работы, можно подобрать решение для поставленной задачи.
Наша компания много лет занимается вопросами обработки металлических изделий для защиты от коррозии.
Мы проводим оцинковку с использованием современных средств – это помогает увеличить длительность использования металлоконструкций разных типов, вне зависимости от среды эксплуатации.
Работаем с 2007 года. У нас в распоряжении три цеха горячего цинкования, а также самая глубокая ванна в ЦФО. Это позволяет работать даже с наиболее крупными деталями.
Чтобы задать все вопросы, касающиеся проведения оцинковки, звоните нам или оставляйте заявки на сайте.
Вернуться к статьямПоделиться статьей
Ингибиторы коррозии — это… Что такое Ингибиторы коррозии?
- Ингибиторы коррозии
- Ингибиторы коррозии, вещества, снижающие скорость коррозии; применяются для антикоррозионной защиты материалов, главным образом металлов.
 Подробнее см. Ингибиторы химические.
Подробнее см. Ингибиторы химические.
Большая советская энциклопедия. — М.: Советская энциклопедия. 1969—1978.
- Ингибиторы (в биологии)
- Ингибиторы роста
Смотреть что такое «Ингибиторы коррозии» в других словарях:
Ингибиторы коррозии — (a. corrosion inhibitors; н. Korrosionsinhibitor; ф. inhibiteurs de corrosion; и. inhibidores de corrosion, sustancia anticorrosiva) вещества, введение к рых в относительно небольших кол вах в агрессивную среду вызывает заметное… … Геологическая энциклопедия
ИНГИБИТОРЫ КОРРОЗИИ — хим. соединения или их композиции, присутствие к рых в небольших кол вах в агрессивной среде замедляет коррозию металлов. Защитное действие И. к. обусловлено изменением состояния пов сти металла вследствие адсорбции (адсорбц. И. к.) или… … Химическая энциклопедия
ингибиторы коррозии — [corrosion inhibitors] неорганические и органические поверхностно активные вещества, добавление малых количеств которых в коррозионную среду приводит к уменьшению коррозии металлов.
 Неорганические ингибиторы коррозии водорастворимые вещества с… … Энциклопедический словарь по металлургии
Неорганические ингибиторы коррозии водорастворимые вещества с… … Энциклопедический словарь по металлургииингибиторы коррозии для растворов на углеводородной основе — — [http://slovarionline.ru/anglo russkiy slovar neftegazovoy promyishlennosti/] Тематики нефтегазовая промышленность EN Nocor 133 203 … Справочник технического переводчика
Ингибиторы химические — вещества, тормозящие разнообразные химические реакции; находят широкое применение для предотвращения или замедления нежелательных процессов, например коррозионного разрушения металлов, окисления топлив, смазочных масел и пищевых продуктов … Большая советская энциклопедия
Ингибиторы — [inhibitors] (от лат. inhebeo останавливаю, сдерживаю) вещества, тормозящие химические реакции. Характерной особенностью bнгибиторjd является эффективность их в малых концентрациях от тысячных долей процента до нескольких процентов. Ингибиторы… … Энциклопедический словарь по металлургии
ИНГИБИТОРЫ — (от латинского inhibeo задерживаю) вещества, тормозящие химические процессы.
 Различают ингибиторы: коррозии, полимеризации, окисления. Ингибиторы добавляют в реакционную среду от долей процента до нескольких процентов … Металлургический словарь
Различают ингибиторы: коррозии, полимеризации, окисления. Ингибиторы добавляют в реакционную среду от долей процента до нескольких процентов … Металлургический словарьИнгибиторы — – в химии – в ва, тормозящие хим. процессы, например коррозию, полимеризацию, окисление (см. Антиоксиданты). относит. масса И., вводимых в реакционную среду, может изменяться от долей % (И. полимеризации) до неск. % (присадки к… … Энциклопедия терминов, определений и пояснений строительных материалов
Ингибиторы и замедлители — – вещества, которые либо полностью прекращают процессы полимеризации и поликонденсации, либо замедляют их скорость. Для этих целей используют гидрохимон, серу, ароматические амины, уротропин или гексаметилентетрамин и др. [Словарь строительных… … Энциклопедия терминов, определений и пояснений строительных материалов
ИНГИБИТОРЫ — (от лат. inhibeo удерживаю) вещества, снижающие скорость химических, в т.
 ч. ферментативных, реакций или подавляющие их. Применяют для предотвращения или замедления нежелательных процессов: коррозии металлов, старения полимеров, окисления топлив… … Большой Энциклопедический словарь
ч. ферментативных, реакций или подавляющие их. Применяют для предотвращения или замедления нежелательных процессов: коррозии металлов, старения полимеров, окисления топлив… … Большой Энциклопедический словарь
Ингибиторы коррозии металлов: особенности, разновидности
Ингибиторы коррозии металлов по праву считают одними из наиболее эффективных средств профилактики появления ржавчины. Даже применение в малых дозах дает возможность остановить нежелательные процессы. Раньше для очистки и профилактики коррозии применялись растворы на основе серной кислоты и крахмала, а также пивных дрожжей. Современная наука изучает тысячи разновидностей ингибиторов, а их число ежегодно возрастает.
Актуальность борьбы с коррозией металла продолжает увеличиваться,так как металлические конструкции применяются во всех сферах. Благодаря применению ингибиторов можно предотвратить повреждение конструкций и сэкономить денежные средства на проведении ремонтных работ и замене вышедших из строя конструкций. Сегодня ингибиторы добавляют в состав профессиональных преобразователей коррозии, которые являются наиболее эффективными средствами профилактики и аккуратной очистки ржавчины.
Сегодня ингибиторы добавляют в состав профессиональных преобразователей коррозии, которые являются наиболее эффективными средствами профилактики и аккуратной очистки ржавчины.
Ингибиторы в составе преобразователя ржавчины
Нейтральный преобразователь коррозионных разрушений включает в себя растительные танины, функциональные присадки и ингибиторы коррозии металлов. Танины воздействуют на ржавчину, активируя процесс трансформации оксида железа в специальные соединения, способствующие созданию крепкой адгезии с металлической поверхностью. Ингибиторы останавливают коррозионные процессы на металлоконструкциях, образуя защитную пленку, в то время как функциональные присадки пропитывают даже самые глубокие слои ржавчины толщиной до 150 мкм. Химический препарат не содержит едких компонентов и минеральных кислот, экологически сертифицирован и безопасен для природы.
При приобретении состава необходимо ознакомиться с инструкцией производителя и подготовить поверхность. Для этого проводится очистка от пыли и загрязнений и удаление рыхлой коррозии. Состав перемешивается и наносится на поверхность металлоконструкции удобным способом на указанное в инструкции время. При необходимости можно повторить процедуру до получения желаемого результата.
Для этого проводится очистка от пыли и загрязнений и удаление рыхлой коррозии. Состав перемешивается и наносится на поверхность металлоконструкции удобным способом на указанное в инструкции время. При необходимости можно повторить процедуру до получения желаемого результата.
Преимущества применения преобразователя с ингибиторами
Нейтральный преобразователь ржавчины эффективен как на производстве, так и в домашних условиях. Средство останавливает коррозионные разрушения, создавая защитный слой, препятствующий дальнейшему образованию ржавчины. Состав увеличивает функциональность бетонных конструкций и содержит специальные присадки, обеспечивающие глубокую пропитку коррозионных очагов. Благодаря высокому уровню адгезии средства обеспечивается качественное сцепление покрытий, а содержание природных ингибиторов растительного типа способствует замедлению образования коррозии.
Техника безопасности при работе с химическим составом
При обработке поверхностей преобразователем ржавчины необходимо надевать средства индивидуальной защиты. Используйте защитные очки, респиратор, резиновые перчатки и сменную одежду. Если состав попал на тело, срочно промойте поражённое место чистой водой. При появлении болевых ощущений обратитесь к врачу. Хранить химические составы необходимо вдали от детей и домашних питомцев.
Используйте защитные очки, респиратор, резиновые перчатки и сменную одежду. Если состав попал на тело, срочно промойте поражённое место чистой водой. При появлении болевых ощущений обратитесь к врачу. Хранить химические составы необходимо вдали от детей и домашних питомцев.
Рекомендуем
ИФХАН-58ПР — Нейтральный преобразователь ржавчины..
Предназначен для модификации коррозии на поверхностях черных металлов, строительных металлоконструкций, труб, арматурных сталей. Без кислоты.
Подробнее…
Коррозия металлов и эффективность ингибиторов коррозии в менее проводящих средах
Коррозия наносит большой материальный и экономический ущерб во всем мире. Это вызывает значительные материальные потери из-за частичного или полного разрушения материала. Выброшенные частицы можно рассматривать как примеси; они могут негативно изменить состав окружающей среды или функциональность различных устройств. Также коррозия может вызвать негативные визуальные изменения материалов. Таким образом, существует необходимость более детального понимания процессов коррозии, чтобы разработать меры по предотвращению коррозии и минимизации ее потенциальных рисков 1 .
Также коррозия может вызвать негативные визуальные изменения материалов. Таким образом, существует необходимость более детального понимания процессов коррозии, чтобы разработать меры по предотвращению коррозии и минимизации ее потенциальных рисков 1 .
Учитывая экологические проблемы и ограниченные запасы ископаемого топлива, растет интерес к альтернативным видам топлива, среди которых важную роль играет биотопливо из возобновляемых источников. Существует ряд различных потенциально доступных видов биотоплива, но биоэтанол, производимый из биомассы, в настоящее время является наиболее подходящей альтернативой для замены (или смешивания) бензина. Использование биоэтанола регулируется Директивой 2009/28 / EC в Европейском Союзе 2 , 3 .
Этанол (биоэтанол) имеет существенно другие свойства по сравнению с бензинами. Он обладает высокой полярностью, проводимостью, полностью смешивается с водой, и т. Д. Эти свойства делают этанол (а также топливные смеси, содержащие этанол) агрессивными с точки зрения коррозии 4 . Для топлива с низким содержанием этанола загрязнение небольшими количествами воды может вызвать отделение водно-этанольной фазы от углеводородной фазы, что может быть очень коррозионным. Сам безводный этанол может быть агрессивным по отношению к некоторым менее благородным металлам и вызывать «сухую коррозию» 5 .В существующих автомобилях коррозия может возникать в некоторых металлических частях (особенно из меди, латуни, алюминия или углеродистой стали), которые контактируют с топливом. Кроме того, полярные загрязнители (особенно хлориды) могут способствовать коррозии как источнику загрязнения; растворимость кислорода и реакции окисления (которые могут происходить в смесях этанол-бензин (EGB) и быть источником кислотных веществ) также могут играть важную роль 6 , 7 .
Для топлива с низким содержанием этанола загрязнение небольшими количествами воды может вызвать отделение водно-этанольной фазы от углеводородной фазы, что может быть очень коррозионным. Сам безводный этанол может быть агрессивным по отношению к некоторым менее благородным металлам и вызывать «сухую коррозию» 5 .В существующих автомобилях коррозия может возникать в некоторых металлических частях (особенно из меди, латуни, алюминия или углеродистой стали), которые контактируют с топливом. Кроме того, полярные загрязнители (особенно хлориды) могут способствовать коррозии как источнику загрязнения; растворимость кислорода и реакции окисления (которые могут происходить в смесях этанол-бензин (EGB) и быть источником кислотных веществ) также могут играть важную роль 6 , 7 .
Одной из возможностей защиты металлов от коррозии является использование так называемых ингибиторов коррозии, которые позволяют существенно замедлить (подавить) процессы коррозии. 8 .Выбор ингибиторов коррозии зависит от типа агрессивной среды, наличия стимуляторов коррозии и, в частности, от механизма действия данного ингибитора. В настоящее время не существует универсальной базы данных или доступной классификации, которая позволила бы легко ориентироваться в ингибиторах коррозии.
8 .Выбор ингибиторов коррозии зависит от типа агрессивной среды, наличия стимуляторов коррозии и, в частности, от механизма действия данного ингибитора. В настоящее время не существует универсальной базы данных или доступной классификации, которая позволила бы легко ориентироваться в ингибиторах коррозии.
Коррозионные среды можно разделить на водные и неводные, поскольку интенсивность и характер коррозионных процессов в этих средах существенно различаются. Для неводных сред типична электрохимическая коррозия, связанная с различными химическими реакциями, тогда как в водных средах происходит только электрохимическая коррозия (без других химических реакций).Более того, электрохимическая коррозия намного интенсивнее в водных средах 9 .
В неводной жидкой органической среде процессы коррозии зависят от степени полярности органических соединений. Это связано с замещением водорода в некоторых функциональных группах металлами, что связано с изменением характеристик коррозионных процессов с электрохимических на химические, для которых характерны более низкие скорости коррозии по сравнению с электрохимическими процессами. Неводные среды обычно имеют низкие значения электропроводности 9 . Для увеличения проводимости в органических средах можно добавлять так называемые вспомогательные электролиты, такие как тетрафторбораты или перхлораты тетраалкиламмония. К сожалению, эти вещества могут обладать ингибирующими свойствами или, наоборот, увеличивать скорость коррозии 10 .
Неводные среды обычно имеют низкие значения электропроводности 9 . Для увеличения проводимости в органических средах можно добавлять так называемые вспомогательные электролиты, такие как тетрафторбораты или перхлораты тетраалкиламмония. К сожалению, эти вещества могут обладать ингибирующими свойствами или, наоборот, увеличивать скорость коррозии 10 .
Существует несколько методов краткосрочных и долгосрочных испытаний скорости коррозии металлических материалов или эффективности ингибиторов коррозии, а именно с циркуляцией окружающей среды или без нее, i.е. , статическое и динамическое испытание на коррозию, соответственно 11 , 12 , 13 , 14 , 15 . Для обоих методов расчет скорости коррозии металлических материалов основан на потере веса испытуемых материалов за определенный период времени. В последнее время электрохимические методы становятся все более важными в исследованиях коррозии из-за их высокой эффективности и короткого времени измерения. Более того, они часто могут предоставить больше информации и более полное представление о процессах коррозии.Наиболее часто используемые методы — это спектроскопия электрохимического импеданса (EIS), потенциодинамическая поляризация и измерение стабилизации потенциала коррозии во времени (в планарной, двухэлектродной или трехэлектродной схеме) 16 , 17 , 18 , 19 , 20 , 21 , 22 , 23 .
Здесь мы представляем пять методов краткосрочного и долгосрочного тестирования коррозионной агрессивности окружающей среды, коррозионной стойкости металлических материалов и эффективности ингибиторов коррозии.Все методы оптимизированы для измерений в неводной среде и демонстрируются на EGB. Эти методы позволяют получить репрезентативные и воспроизводимые результаты, которые могут помочь более подробно понять процессы коррозии, чтобы предотвратить и минимизировать коррозионные повреждения.
Для испытания на статическую коррозию погружением в системах металл-жидкость, испытания на статическую коррозию в системах металл-жидкость можно проводить в простом аппарате, состоящем из бутылки объемом 250 мл, снабженной крючком для подвешивания анализируемого образца, см. Рисунок 1 .
Для динамического испытания на коррозию с циркуляцией жидкости ингибиторы коррозии металлов или агрессивность жидкостей (топлива) могут быть испытаны в проточном аппарате с циркуляцией жидкой среды, представленной на рис. 2 . Проточный аппарат состоит из закаленной части и резервуара с исследуемой жидкостью. В закаленной части испытуемая жидкость контактирует с металлическим образцом в присутствии кислорода воздуха или в инертной атмосфере. Подача газа (воздуха) обеспечивается фриттой с трубкой, доходящей до дна колбы.Резервуар с испытуемой жидкостью, содержащий около 400-500 мл испытуемой жидкости, соединен с обратным холодильником, что позволяет соединить аппарат с атмосферой. В охладителе испаренная часть жидкости замораживается при -40 ° C. Перистальтический насос позволяет перекачивать жидкость с подходящей скоростью около 0,5 л / ч — 1 через замкнутый контур из химически стабильных и инертных материалов (, например, , тефлон, витон, тайгон) из хранилища в закаленная часть, из которой жидкость возвращается через перелив в накопительную часть.
Для испытания на статическую коррозию погружением с охладителем флегмы в присутствии газообразной среды ингибиторы коррозии, сопротивление металлических материалов или агрессивность жидкой среды могут быть проверены в аппарате, представленном в рис. 3 . Аппарат состоит из двух частей. Первая часть состоит из закаленной двухгорлой колбы на 500 мл с термометром. В колбе содержится достаточное количество жидкой среды. Вторая часть состоит из (i) рефлюкса с матовым стеклом для обеспечения плотного соединения с колбой, (ii) подвески для размещения металлических образцов и (iii) фритты с трубкой для подачи газа (воздуха). достигнув дна колбы.Аппарат подключен к атмосфере через охладитель, что предотвращает испарение жидкости.
Аппарат для электрохимических измерений в двухэлектродной схеме представлен на рис. 4 . Электроды изготовлены из металлических листов (3 х 4 см, из мягкой стали), которые с одной стороны полностью залиты эпоксидной смолой для защиты от окружающей агрессивной среды. Оба электрода прикручены к матрице так, чтобы расстояние между ними было примерно 1 мм 22 .
Электрохимические измерения в трехэлектродной схеме состоят из рабочего, контрольного и вспомогательного электродов, размещенных в измерительной ячейке так, что обеспечивается небольшое расстояние между электродами; см. Рисунок 5 . В качестве электрода сравнения используются каломельные или хлорид-серебряные электроды с солевым мостиком, содержащие либо (i) 3 мольL — 1 раствор нитрата калия (KNO 3 ), либо (ii) 1 мольL — 1 можно использовать раствор хлорида лития (LiCl) в этаноле.В качестве вспомогательного электрода можно использовать платиновую проволоку, сетку или пластину. Рабочий электрод состоит из (i) измерительной части (испытуемый материал с резьбой) и (ii) винтовой насадки, изолированной от коррозионной среды, см. Рисунок 6 . Электрод должен быть в достаточной степени изолирован с помощью уплотнения, предотвращающего перетекание.
Требуется подписка. Пожалуйста, порекомендуйте JoVE своему библиотекарю.
Определение химического состава границ раздела ингибитор коррозии / металла с помощью XPS: минимизация пост-иммерсионного окисления один из двух разных растворов 1 M HCl + x мМ органической ХИ, и перенесенный для измерения XPS, как описано выше.Также отображаются аналогичные данные для полированного образца. Углеродистая сталь имела номинальный весовой% состав C (0,08-0,13), Mn (0,30-0,50), P (0,04), S (0,05) и Fe (остальное). Двумя исследованными органическими ионами являются: 2-меркаптобензимидазол (MBI) и (Z) -2-2 (2- (октадек-9-ен-1-ил) -4,5-дигидро-1 H -имидазол- 1-ил) этанамин (OMID). При используемых концентрациях (MBI: 2 мМ; OMID: 1 мМ) измерения скорости коррозии 13 , 14 показывают, что все частицы значительно ингибируют коррозию углеродистой стали, i.е. Эффективность ингибирования (η%) 2 > 90%. Также отображаются наилучшие соответствия спектральным профилям O 1s и Fe 2p. Фотоэлектронные пики были смоделированы с помощью функций формы линий Гаусса-Лоренца (ГЛ) (30% Лоренца), за исключением уровня Fe 2p металлического железа, где использовалась лоренцевская асимметричная форма линии с затуханием хвоста (LF). Катионные состояния Fe x + моделировались мультиплетными огибающими, состоящими из 3 и 4 функций GL для Fe 2+ и Fe 3+ соответственно 15 .Для описания фона неупруго рассеянных электронов использовалась функция типа Ширли 16 . Сосредоточившись на обзорных данных XPS (, рис. 1 (a), ), спектр, полученный от полированного образца, показывает три заметных пика: , то есть Fe 2p, O 1s и C 1s. Эти особенности могут быть определены следующим образом: Fe 2p возникает из углеродистой стали, O 1s возникает как из поверхностной оксидной пленки, так и из адсорбатов, а сигнал C 1s возникает из-за добавочного углерода.Погружение в любой из растворов 1 M HCl + x мМ органической ХИ приводит к значительным изменениям в соответствующем обзорном спектре. Появляется характеристика, присвоенная базовому уровню N 1s, которая согласуется с поверхностной адсорбцией ингибиторов; MBI и OMID содержат N. Более того, сигнал основного уровня O1s значительно ослаблен.
Что касается данных O 1s от полированной подложки (, рис. 1 (b), ), профиль может быть оснащен четырьмя компонентами. Два компонента при более низких энергиях связи (BE), ~ 530.0 эВ и ~ 531,3 эВ, можно отнести к фазам оксида железа (O 2–) и гидроксида (OH –) соответственно. Два компонента с более высокой энергией связи, обозначенные O 1 (BE ~ 532,2 эВ) и O 2 (BE ~ 533,3 эВ), вероятно, связаны с адсорбированным ОН (O 1 ) и дополнительными частицами углерода (O 1 и О 2 ) 17 . Погружение в любой из растворов 1 M HCl + x мМ органической ХИ приводит к полному тушению компонентов O 2– и OH –.На основании этого можно сделать вывод, что ингибиторы коррозии адсорбируются на поверхностях, свободных от оксидов / гидроксидов. Спектры Fe 2p на рис. 1 (c) согласуются с этим результатом, так как на ингибированных подложках виден только пик металлического Fe (Fe 0 ). На полированном образце присутствуют элементы Fe 2+ и Fe 3+ из-за поверхностного оксида / гидроксида.
XPS-спектры O 1s и Fe 2p на уровне ядра из двух образцов углеродистой стали, погруженных в 1 M HCl + 2 мМ MBI, сравниваются на , рис. 2 .Один образец был перенесен с использованием перчаточного бокса, полностью промытого N 2 , в то время как другой был удален из раствора в перчаточный бокс, частично промытый N 2 , т.е. O 2 концентрация была значительно выше целевого значения. Для последнего образца очевидно, что произошло пост иммерсионное окисление, присутствуют признаки , т.е. Fe 2 + / 3 + и O 2– / OH –.
Рис. 1. XPS-спектры полированных и ингибированных образцов углеродистой стали.XPS спектры ( a ) Overview, ( b ) O 1s и ( c ) Fe 2p. Данные, представленные на каждой панели, были получены из образцов углеродистой стали, которые были погружены на 4 часа в один из двух различных растворов 1 M HCl + x мМ органической ХИ, , т.е. , 2 мМ MBI и 1 мМ OMID. Все спектры были получены при угле эмиссии фотоэлектронов ( E ) 0 ° (эмиссия вдоль нормали к поверхности). Для (b) и (c) также отображаются наилучшие соответствия (голубые маркеры) экспериментальным данным (сплошные черные линии), достигнутые с помощью комбинации GL (пунктирные красные линии), LF (прерывистые красные линии) и Ширли. -тип (пунктирные серые линии) функции.Метки пиков объяснены в основном тексте. Щелкните здесь, чтобы просмотреть увеличенную версию этого рисунка.
Рис. 2. Влияние пост иммерсионного окисления на спектры РФЭС. РФЭС спектры ( a ) O 1s и ( b ) Fe 2p. Данные были получены для образцов из углеродистой стали, которые были погружены в растворы 1 M HCl + 2 мМ MBI (η% = 99%) на 4 часа. Спектры были получены при θ E = 0 °. На каждой панели нижний (верхний) спектр — это образец, перенесенный через полностью (частично) перчаточный ящик с продувкой N 2 .Метки пиков объяснены в основном тексте. (Модифицированная версия рисунка 5 в ссылке 9.) Нажмите здесь, чтобы просмотреть увеличенный вариант рисунка.
Исследование адсорбции ингибиторов коррозии на металлах с помощью функциональной теории плотности и моделирования молекулярной динамики
1. Введение
Коррозию активных металлов, таких как железо (Fe), медь (Cu) и алюминий (Al), можно уменьшить, изменив их поверхность с использованием органических / полимерных ингибиторов коррозии. Молекулы ингибитора адсорбируются на поверхности металла и образуют защитный барьер от коррозии [1].Способность ингибиторов к защите от коррозии зависит от степени взаимодействия между молекулами ингибитора и поверхностью металла [2]. Основной механизм, посредством которого адсорбированные молекулы ингибитора изменяют процесс коррозии, состоит либо в изменении катодной и анодной реакций коррозии, либо в физическом блокировании активных центров, присутствующих на поверхности металла, либо в [3].
Изучение литературы ясно показывает, что огромное количество выходов публикаций, где были проведены экспериментальные работы для понимания процесса ингибирования коррозии, однако использование теоретических исследований, включая теорию функционала плотности (DFT) и молекулярно-динамическое моделирование (MD), появилось в последнее время. лет.В традиционной экспериментальной работе ученым приходится тестировать огромное количество органических соединений, чтобы выбрать их в качестве потенциального ингибитора коррозии. Такой поиск требует больше времени и денег. Однако в эпоху развития аппаратных и программных технологий мы получили возможность выбирать органические соединения в качестве потенциальных ингибиторов коррозии, не тратя огромные деньги на химические вещества. Эффективность ингибирования коррозии органических соединений на основе молекулярных и электронных свойств может быть точно предсказана с помощью расчетов методом МД и ТФП.В последние годы ученые приложили свои положительные усилия в области коррозии, используя теоретические расчеты [4, 5, 6]. Насколько нам известно, обзор существует в литературе только с описанием ТСП и МД по отдельности, но не в отношении исследования ингибирования коррозии [7, 8]. Здесь мы пытаемся одновременно описать как DFT, так и MD на одной платформе.
В этой главе мы попытаемся изучить некоторые недавние исследования и концепции, которые могут предоставить новую концепцию в области вычислительной химии, связанную с явлением ингибирования коррозии.Здесь мы суммируем адсорбцию органических молекул на поверхности металла, особенно железа, алюминия и меди, чтобы изучить их свойства ингибирования коррозии с помощью моделирования методом DFT и MD.
2. Основные концепции, относящиеся к молекулярному моделированию
В литературе имеется большое количество публикаций / статей, в которых свойства ингибиторов ингибирования коррозии изучались с помощью теоретических исследований. Как правило, органические молекулы обладают способностью отдавать электроны на пустую d-орбиталь поверхности металла и образовывать ковалентную связь, известную как координационная связь.Однако они также подвергаются обратному донорству, когда они принимают свободные электроны, присутствующие на заполненных металлических орбиталях, и это называется ретродонирующими связями. Таким образом, такие связи делают органические соединения потенциальным кандидатом на ингибирование коррозии. Теоретические параметры, такие как самая высокая занятая молекулярная орбиталь (HOMO), самая низкая незанятая молекулярная орбиталь (LUMO), дипольный момент ( μ ), запрещенная зона (∆ E ), индексы Фукуи, плотность заряда, поляризуемость, мягкость и т. Д.[9, 10, 11] обсуждались при вычислении DFT.
DFT исследование отдельно представляет органическое соединение и поверхность металла [12, 13, 14, 15, 16]. В DFT взаимодействие между молекулой ингибитора и поверхностью металла не моделировалось напрямую. Однако в МД наиболее реактивный фрагмент молекулы, имеющий большее сродство к взаимодействию с поверхностью металла, исследуется методом ab initio. Этот метод дает реальную картину, которая действительно происходит в процессе коррозии, например, взаимодействие между молекулой ингибитора и поверхностью металла, ориентация молекулы по отношению к металлу и организация молекул.
3. Исследование взаимодействия ингибитор / поверхность с использованием DFT
3.1. Основы DFT: теорема Хоэнберга-Кона
Квантовая электрохимия — это область, которая включает квантовую механику, электрохимию и электродинамику. В общем, квантовая электрохимия — это приложение теории функционала плотности (DFT) для изучения электрохимических процессов, таких как перенос электрона к поверхностям электродов [17].
В литературе существует так много книг и статей, которые описывают базовый набор, используемый в DFT [18, 19, 20, 21, 22, 23, 24, 25, 26, 27, 28, 29, 30, 31 ].Итак, здесь мы приводим лишь несколько пинт ДПФ без использования математики.
3.2. Функционал
Функционал — это функция функции, т. Е. Электрона. Поэтому на основе фундаментальной квантовой механики и экспериментальных результатов были разработаны различные функционалы, которые перечислены в таблице 1 [29].
Аббревиатуры Имя Тип X α X alpha Только обмен H4 FOck 90DA Обмен H4 VWN Vosko, Wilks, and Nusair LDA BLYP Функционал корреляции Бекке с обменом Ли, Янга, Парра Градиент-скорректированный член B с поправкой на градиент , Янг и Парр Гибридный обмен PW91 Пердью и Ван 1991 С поправкой на градиент G96 Gill 1996 Обмен P4 с поправкой на градиент B96 Becke 1996 Градиент с коррекцией B3P86 Биржа Беке, корреляция Пердью Гибрид B3PW91 Биржа Бекке, Пердью и Ванга Гибридная корреляция
Таблица 1.
Список функционала плотности [29].
Есть несколько поколений функционала плотности. Первое поколение известно как метод X α и является самым простым. Этот функционал был разработан Дж. К. Слейтером, который работал над приближением Хартри-Фока, но неохотно открыл простейшее для ДПФ. В X α был включен функциональный электронный обмен, но не корреляция. Результаты, полученные с помощью метода X α , так же точны, как HF, но в некоторых случаях лучше, чем HF.
Функционал второго поколения использует как плотность, так и ее градиенты. В 1986 году был предложен первый функционал энергии с поправкой на градиент, в котором Беке, Пердью и Ван предложили обмен и корреляцию Пердью [32, 33]. В настоящее время наиболее популярны функционалы Becke и Perdew для обмена и корреляции соответственно [32], также Lee et al. [34] для корреляции и Пердью и Ванга для обмена и корреляции и [35]. Эти функционалы известны как «обобщенные градиентные приближения (GGA)».”
Третье поколение является гибридным и более совершенным, чем GGA. В этом случае функционал состоит как из обмена типа Хартри-Фока, так и из обмена ДПФ, рассчитанного на основе орбиталей. В 1998 году был представлен гибридный функционал B3LYP. В 1994 году компания Gaussian впервые представила этот функционал в вычислительном пакете, и он записывается следующим уравнением:
EXC = aoEXHF + a1EXLSD + a2EXGGA + a3ECE1
, где E X (HF) представляют собой Hartree-Fock обменная энергия, E X (LSD) обозначает обменную энергию Дирака, а E X (GGA) и E C — градиентные поправки для обменной энергии, т.е.е., функционал Be88form и Lee-Yang-Parr (LYP) соответственно [34, 36].
3.3. Базисные наборы
При вычислении DFT используются различные базисные наборы [37]. Самый простой — STO-3G. В этом базисе 1s задается тремя гауссианами, а 2s, 2px, 2py и 2pz — еще тремя. Улучшение базисного набора может быть достигнуто за счет включения двух 1s-функций для водорода и для атомов 2-й строки, таких как две 2s и две 2p-функции углерода. Эти функционалы называются базисными наборами расщепленной валентности.Здесь валентные и основные орбитали представлены двумя наборами функций и одним набором функций соответственно. Пример для этого:
Углерод 3-21G: три гауссиана для комбинации единиц, те же два гауссиана для комбинации двоек и 2p; плюс 2s ’и 2p’ того же гауссова.
Углерод 6-31G: шесть гауссиан для комбинации единиц, те же три гауссиана для комбинации двоек и 2p; плюс 2s ’и 2p’ того же гауссова.
В целом это может быть представлено как i — jk , здесь i обозначает количество гауссиан, представляющих каждую базисную функцию ядра, а j и k представляют собой числа гауссианов для разделения валентные базисные функции.
Дальнейшее развитие создает базисные наборы с тройной разделенной валентностью, например 6-311G. В этом базисном наборе основной функционал состоит из шести гауссианов и трех наборов функций валентности, содержащих три, один и один гауссиан, соответственно.
Также введены множественные дзета-базисы, такие как двойные дзета (DZ) и тройные дзета (TZ) базисы. Разница между базисными наборами с множественной и расщепленной валентностью заключается в том, что в множественных базисных наборах все орбитали разделены на два или три набора функций и т. Д.Кроме того, в нескольких базисных наборах использовались разные коэффициенты α для s- и p-орбиталей.
Таким образом, улучшение расчета электронной структуры может быть достигнуто путем добавления функций, соответствующих орбиталям с более высоким угловым моментом. Эту концепцию можно объяснить следующим образом: для атома водорода добавляются p-функции; для углерода, азота, кислорода и т. д. добавляются d-функции; а для переходных металлов вводятся f-функции. Они представлены добавлением звездочки к базовому набору, а также указанием функций p, d, f.Это можно понять в следующем примере:
6-31G ∗ или 6-31G (d): добавляет d функций к элементам 2-й строки (C, N, O и т. Д.).
6.31G ∗∗ или 6-31G (d, p): добавляет функцию d к элементам 2-й строки (C, N, O и т. Д.) И функции p к элементам H. электронов на гетероатомах можно объединить, добавив диффузные функции, которые представлены в базисном наборе с помощью знаков + и ++. Для атомов водорода поляризация и диффузные функции не очень важны, но для других атомов, таких как углерод, азот, кислород, это важно, например,
6-31 + G: означает, что диффузные функции были добавлены к элементам 2-й строки ( C, N, O и т. Д.).
6-31 ++ G: означает, что диффузные функции добавлены к элементам 2-й строки и H.
В случае переходных элементов, содержащих большое количество электронов, требуется больше времени для расчета. Итак, для расчетов переходных металлов используется базис LanL2DZ. Этот базисный набор получается путем объединения валентных электронов с использованием двойных дзета-функций и Los Alamos ECP. Программное обеспечение, используемое в исследовании ингибирования коррозии с широким диапазоном базовых наборов, таких как Spartan, Material Studio, Gaussian 03, Gaussian 09 и совсем недавно было представлено Gaussian 14.В таблице 2 представлены часто используемые базисные наборы [37].
Рис. 1. XPS-спектры полированных и ингибированных образцов углеродистой стали.XPS спектры ( a ) Overview, ( b ) O 1s и ( c ) Fe 2p. Данные, представленные на каждой панели, были получены из образцов углеродистой стали, которые были погружены на 4 часа в один из двух различных растворов 1 M HCl + x мМ органической ХИ, , т.е. , 2 мМ MBI и 1 мМ OMID. Все спектры были получены при угле эмиссии фотоэлектронов ( E ) 0 ° (эмиссия вдоль нормали к поверхности). Для (b) и (c) также отображаются наилучшие соответствия (голубые маркеры) экспериментальным данным (сплошные черные линии), достигнутые с помощью комбинации GL (пунктирные красные линии), LF (прерывистые красные линии) и Ширли. -тип (пунктирные серые линии) функции.Метки пиков объяснены в основном тексте. Щелкните здесь, чтобы просмотреть увеличенную версию этого рисунка.
Рис. 2. Влияние пост иммерсионного окисления на спектры РФЭС. РФЭС спектры ( a ) O 1s и ( b ) Fe 2p. Данные были получены для образцов из углеродистой стали, которые были погружены в растворы 1 M HCl + 2 мМ MBI (η% = 99%) на 4 часа. Спектры были получены при θ E = 0 °. На каждой панели нижний (верхний) спектр — это образец, перенесенный через полностью (частично) перчаточный ящик с продувкой N 2 .Метки пиков объяснены в основном тексте. (Модифицированная версия рисунка 5 в ссылке 9.) Нажмите здесь, чтобы просмотреть увеличенный вариант рисунка.
Углерод 3-21G: три гауссиана для комбинации единиц, те же два гауссиана для комбинации двоек и 2p; плюс 2s ’и 2p’ того же гауссова.
Углерод 6-31G: шесть гауссиан для комбинации единиц, те же три гауссиана для комбинации двоек и 2p; плюс 2s ’и 2p’ того же гауссова.
6-31G ∗ или 6-31G (d): добавляет d функций к элементам 2-й строки (C, N, O и т. Д.).
6.31G ∗∗ или 6-31G (d, p): добавляет функцию d к элементам 2-й строки (C, N, O и т. Д.) И функции p к элементам H. электронов на гетероатомах можно объединить, добавив диффузные функции, которые представлены в базисном наборе с помощью знаков + и ++. Для атомов водорода поляризация и диффузные функции не очень важны, но для других атомов, таких как углерод, азот, кислород, это важно, например,
6-31 + G: означает, что диффузные функции были добавлены к элементам 2-й строки ( C, N, O и т. Д.).
6-31 ++ G: означает, что диффузные функции добавлены к элементам 2-й строки и H.
В случае переходных элементов, содержащих большое количество электронов, требуется больше времени для расчета. Итак, для расчетов переходных металлов используется базис LanL2DZ. Этот базисный набор получается путем объединения валентных электронов с использованием двойных дзета-функций и Los Alamos ECP. Программное обеспечение, используемое в исследовании ингибирования коррозии с широким диапазоном базовых наборов, таких как Spartan, Material Studio, Gaussian 03, Gaussian 09 и совсем недавно было представлено Gaussian 14.В таблице 2 представлены часто используемые базисные наборы [37].

 К ним можно отнести азот, серу, кислород, ароматические соединения. Главным преимуществом и отличием от неорганических ингибиторов выступает тот факт, что органические вещества адсорбируются только на поверхности материала, не вступая в реакцию с ржавчиной.
К ним можно отнести азот, серу, кислород, ароматические соединения. Главным преимуществом и отличием от неорганических ингибиторов выступает тот факт, что органические вещества адсорбируются только на поверхности материала, не вступая в реакцию с ржавчиной.




 Подробнее см. Ингибиторы химические.
Подробнее см. Ингибиторы химические. Неорганические ингибиторы коррозии водорастворимые вещества с… … Энциклопедический словарь по металлургии
Неорганические ингибиторы коррозии водорастворимые вещества с… … Энциклопедический словарь по металлургии Различают ингибиторы: коррозии, полимеризации, окисления. Ингибиторы добавляют в реакционную среду от долей процента до нескольких процентов … Металлургический словарь
Различают ингибиторы: коррозии, полимеризации, окисления. Ингибиторы добавляют в реакционную среду от долей процента до нескольких процентов … Металлургический словарь ч. ферментативных, реакций или подавляющие их. Применяют для предотвращения или замедления нежелательных процессов: коррозии металлов, старения полимеров, окисления топлив… … Большой Энциклопедический словарь
ч. ферментативных, реакций или подавляющие их. Применяют для предотвращения или замедления нежелательных процессов: коррозии металлов, старения полимеров, окисления топлив… … Большой Энциклопедический словарь