Титан
| Титан | |
|---|---|
| Атомный номер | 22 |
| Внешний вид простого вещества | |
| Свойства атома | |
|
Атомная масса (молярная масса) |
47,88 а. е. м. (г/моль) |
| Радиус атома | 147 пм |
|
Энергия ионизации (первый электрон) |
657,8(6,82) кДж/моль (эВ) |
| Электронная конфигурация | [Ar] 3d2 4s2 |
| Химические свойства | |
| Ковалентный радиус | 132 пм |
| Радиус иона | (+4e)68 (+2e)94 пм |
|
Электроотрицательность (по Полингу) |
1,54 |
| Электродный потенциал | -1,63 |
| Степени окисления | 4, 3 |
| Термодинамические свойства простого вещества | |
| Плотность | 4,54 г/см? |
| Молярная теплоёмкость | |
| Теплопроводность |
21. 9 Вт/(м·K) 9 Вт/(м·K) |
| Температура плавления | 1933 K |
| Теплота плавления | 18.8 кДж/моль |
| Температура кипения | 3560 K |
| Теплота испарения | 422,6 кДж/моль |
| Молярный объём | 10,6 см3/моль |
| Кристаллическая решётка простого вещества | |
| Структура решётки |
гексагональная плотноупакованная (?-Ti) |
| Параметры решётки | a=2,951 с=4,697 (?-Ti) A |
| Отношение c/a | 1,587 |
| Температура Дебая | 380 K |
| Ti | 22 |
|
47,88 |
|
| [Ar]3d24s2 | |
| Титан | |
Титан — элемент побочной подгруппы четвёртой группы, четвёртого периода периодической системы химических элементов, с атомным номером 22. Обозначается символом Ti (лат. Titanium). Простое вещество титан (CAS-номер: 7440-32-6) — лёгкий металл серебристо-белого цвета. Существует в двух кристаллических модификациях: ?-Ti с гексагональной плотноупакованной решёткой, -Ti с кубической объёмно-центрированной упаковкой, температура перехода α↔β 883 °C
Обозначается символом Ti (лат. Titanium). Простое вещество титан (CAS-номер: 7440-32-6) — лёгкий металл серебристо-белого цвета. Существует в двух кристаллических модификациях: ?-Ti с гексагональной плотноупакованной решёткой, -Ti с кубической объёмно-центрированной упаковкой, температура перехода α↔β 883 °C
История открытия элемента Титан
Схема атома титана
Открытие TiO2 сделали практически одновременно и независимо друг от друга англичанин У. Грегор и немецкий химик М. Г. Клапрот. У. Грегор, исследуя состав магнитного железистого песка (Крид, Корнуолл, Англия, 1789), выделил новую «землю» (окись) неизвестного металла, которую назвал менакеновой. В 1795 г. немецкий химик Клапрот открыл в минерале рутиле новый элемент и назвал его титаном. Спустя два года Клапрот установил, что рутил и менакеновая земля — окислы одного и того же элемента, за которым и осталось название «титан», предложенное Клапротом. Через 10 лет открытие титана состоялось в третий раз.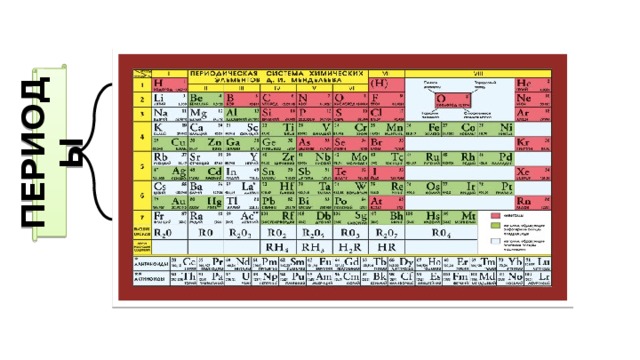
Первый образец металлического титана получил в 1825 году Й. Я. Берцелиус. Из-за высокой химической активности титана и сложности его очистки чистый образец Ti получили голландцы А. ван Аркел и И. де Бур в 1925 термическим разложением паров иодида титана TiI4.
Происхождение названия
Металл получил своё название в честь титанов, персонажей древнегреческой мифологии, детей Геи. Название элементу дал Мартин Клапрот, в соответствии со своими взглядами на химическую номенклатуру в противоход французской химической школе, где элемент старались называть по его химическим свойствам. Поскольку немецкий исследователь сам отметил невозможность определения свойств нового элемента только по его оксиду, он подобрал для него имя из мифологии, по аналогии с открытым им ранее ураном.
Однако согласно другой версии, публиковавшейся в журнале «Техника-Молодежи» в конце 80-х, новооткрытый металл обязан своим именем не могучим титанам из древнегреческих мифов, а Титании — королеве фей в германской мифологии (жена Оберона в шекспировском «Сне в летнюю ночь»).
Нахождение в природе
Титан находится на 10-м месте по распространённости в природе. Содержание в земной коре 0,57 % по массе. В свободном виде не встречается. Известно более 100 минералов, содержащих титан. Важнейшие из них: рутил TiO2, ильменит FeTiO3, титаномагнетит FeTiO3 + Fe3O4, перовскит CaTiO3, титанит CaTiOSiO4, танталит (Fe,Mn)2+Ta2O6 и манганотанталит MnT
Запасы и добыча
Основные руды: ильменит (FeTiO3), рутил (TiO2), титанит (CaTiSiO5).
На 2002 год, 90 % добываемого титана использовалось на производство диоксида титана TiO2. Мировое производство диоксида титана составляло 4,5 млн т. в год. Подтвержденные запасы диоксида титана (без России) составляют около 800 млн т.[2]. На 2006 год, по оценке Геологической службы США, в пересчёте на диоксид титана и без учёта России, запасы ильменитовых руд составляют 603—673 млн т., а рутиловых — 49.7—52.7 млн т. При современных темпах добычи мировых разведанных запасов титана (без учёта России) х
в год. Подтвержденные запасы диоксида титана (без России) составляют около 800 млн т.[2]. На 2006 год, по оценке Геологической службы США, в пересчёте на диоксид титана и без учёта России, запасы ильменитовых руд составляют 603—673 млн т., а рутиловых — 49.7—52.7 млн т. При современных темпах добычи мировых разведанных запасов титана (без учёта России) х
Россия обладает вторыми в мире, после Китая, запасами титана. Минерально-сырьевую базу титана России составляют 20 месторождений (из них 11 коренных и 9 россыпных), достаточно равномерно рассредоточенных по территории страны. Самое крупное из разведанных месторождений находится в 25 км от города Ухта (Республика Коми). Запасы месторождения оцениваются в 2 миллиарда тонн.
Крупнейший в мире производитель титана — российская компания «ВСМПО-АВИСМА».
Получение
Брусок кристаллического титана (чистота 99,995 %, вес ?283 г, длина ?14 см, диаметр ?25 мм), изготовленный на заводе «Уралредмет» иодидным методом ван Аркеля и де Бура
Концентрат титановых руд подвергают сернокислотной или пирометаллургической переработке. Продукт сернокислотной обработки — порошок диоксида титана TiO2. Пирометаллургическим методом руду спекают с коксом и обрабатывают хлором, получая пары тетрахлорида титана TiCl4: TiO2 + 2C + 2Cl2 =TiCl4 + 2CO
Продукт сернокислотной обработки — порошок диоксида титана TiO2. Пирометаллургическим методом руду спекают с коксом и обрабатывают хлором, получая пары тетрахлорида титана TiCl4: TiO2 + 2C + 2Cl2 =TiCl4 + 2CO
Образующиеся пары TiCl4
Полученную титановую «губку» переплавляют и очищают. Ильменитовые концентраты восстанавливают в электродуговых печах с последующим хлорированием возникающих титановых шлаков. Рафинируют титан иодидным способом или электролизом, выделяя Ti из TiCl4. Для получения титановых слитков применяют дуговую, электроннолучевую или плазменную переработку.
Физические свойства
Титан — легкий серебристо-белый металл. Существует в двух кристаллических модификациях: ?-Ti с гексагональной плотноупакованной решёткой (a=2,951 A; с=4,697 A; z=2; пространственная группа C6mmc), ?-Ti с кубической объёмноцентрированной упаковкой (a=3,269 A; z=2; пространственная группа
 Точка плавления 1671 °C, точка кипения 3260 °C, плотность ?-Ti и ?-Ti соответственно равна 4,505 (20 °C) и 4,32 (900 °C) г/см?, атомная плотность 5,71×1022 ат/см³. Пластичен, сваривается в инертной атмосфере.
Точка плавления 1671 °C, точка кипения 3260 °C, плотность ?-Ti и ?-Ti соответственно равна 4,505 (20 °C) и 4,32 (900 °C) г/см?, атомная плотность 5,71×1022 ат/см³. Пластичен, сваривается в инертной атмосфере.Имеет высокую вязкость, при механической обработке склонен к налипанию на режущий инструмент, и поэтому требуется нанесение специальных покрытий на инструмент, различных смазок.
При обычной температуре покрывается защитной пассивирующей пленкой оксида TiO2, благодаря этому коррозионностоек в большинстве сред (кроме щелочной).
Титановая пыль имеет свойство взрываться. Температура вспышки 400°С.
Химические свойства
Устойчив к коррозии благодаря оксидной плёнке, но при измельчении в порошок горит на воздухе.
Титан устойчив к разбавленным растворам многих кислот и щелочей (кроме HF,H3PO4 и концентрированной H2SO4).
Легко реагирует даже со слабыми кислотами в присутствии комплексообразователей, например, с плавиковой кислотой HF он взаимодействует благодаря образованию комплексного аниона [TiF6]2-.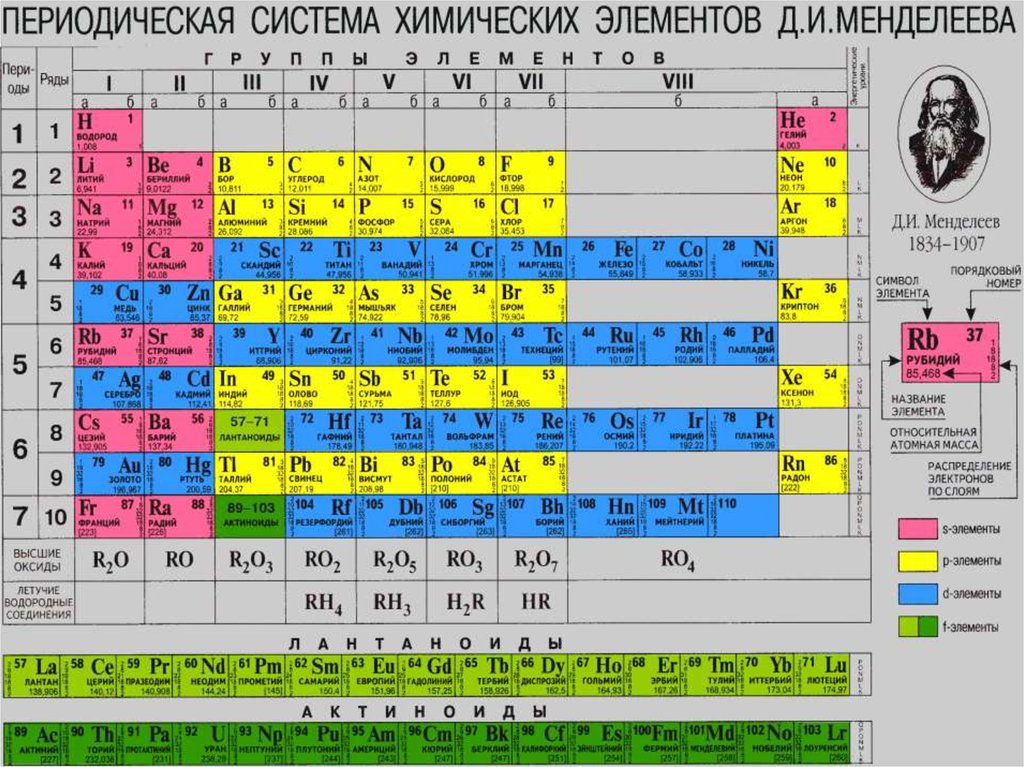
При нагревании на воздухе до 1200°C Ti загорается с образованием оксидных фаз переменного состава TiOx. Из растворов солей титана осаждается гидроксид TiO(OH)2·xH2O, осторожным прокаливанием которого получают оксид TiO2. Гидроксид TiO(OH)2·xH2O и диоксид TiO2амфотерны.
TiO2 взаимодействует с серной кислотой при длительном кипячении. При сплавлении с содой Na2CO3 или поташом K2CO3 оксид TiO2 образует титанат: TiO2+K2CO3=K2TiO3+CO2.
При нагревании Ti взаимодействует с галогенами. Тетрахлорид титана TiCl4 при обычных условиях — желтоватая, сильно дымящая на воздухе жидкость, что объясняется сильным гидролизом TiCl4 содержащимися в воздухе парами воды и образованием мельчайших капелек HCl и взвеси гидроксида титана.
Восстановлением TiCl4водородом, Al, Si, другими сильными восстановителями, получен трихлорид и дихлорид титана TiCl3 и TiCl2 — твердые вещества с сильно восстановительными свойствами. Ti взаимодействует с Br2 и I2.
Ti взаимодействует с Br2 и I2.
С N2 выше 400 °C титан образует нитрид TiNx(x=0,58-1,00). При взаимодействии титана с C образуется карбид титана TiCx (x=0,49-1,00).
При нагревании Ti поглощает H2 с образованием соединения переменного состава TiHх (x=1,0). При нагревании эти гидриды разлагаются с выделением H2. Титан образует сплавы со многими металлами.
Применение
Часы из титанового сплава
В виде сплавов
- Металл применяется в химической промышленности (реакторы, трубопроводы, насосы), лёгких сплавах, остеопротезах. Является важнейшим конструкционным материалом в авиа-, ракето-, кораблестроении.
- Используется в художественном литье[5]
- Титан является легирующей добавкой в некоторых марках стали.
-
Нитинол (никель-титан) — сплав, обладающий памятью формы, применяемый в медицине и технике.

- Алюминиды титана являются очень стойкими к окислению и жаропрочными, что в свою очередь определило их использование в авиации и автомобилестроении в качестве конструкционных материалов.
В виде соединений
- Белый диоксид титана (TiO2) используется в красках (например, титановые белила), а также при производстве бумаги и пластика. Пищевая добавка E171.
- Титанорганические соединения (напр. тетрабутоксититан) применяются в качестве катализатора и отвердителя в химической и лакокрасочной промышленности.
- Неорганические соединения титана применяются в химической электронной, стекловолоконной промышленности в качестве добавки или покрытий.
- Диборид титана — важный компонент сверхтвердых материалов для обработки металлов.
- Нитрид титана применяется для покрытия инструментов.
-
Титанат бария BaTiO3, титанат свинца PbTiO3 и ряд других титанатов —- сегнетоэлектрики.

Анализ рынков потребления
В 2005 компания Titanium Corporation опубликовала следующую оценку потребления титана в мире:
60 % — краска;
20 % — пластик;
13 % — бумага;
7 % — машиностроение.
Цены
15-25 $ за килограмм, в зависимости от чистоты.
Чистота и марка чернового титана (титановой губки) обычно определяется по степени её пластичности.
Физиологическое действие
Нитрид титана
Соединения титана
Химический элемент Титан: свойства и применение
Содержание
- Описание
- Изотопы
- Применение
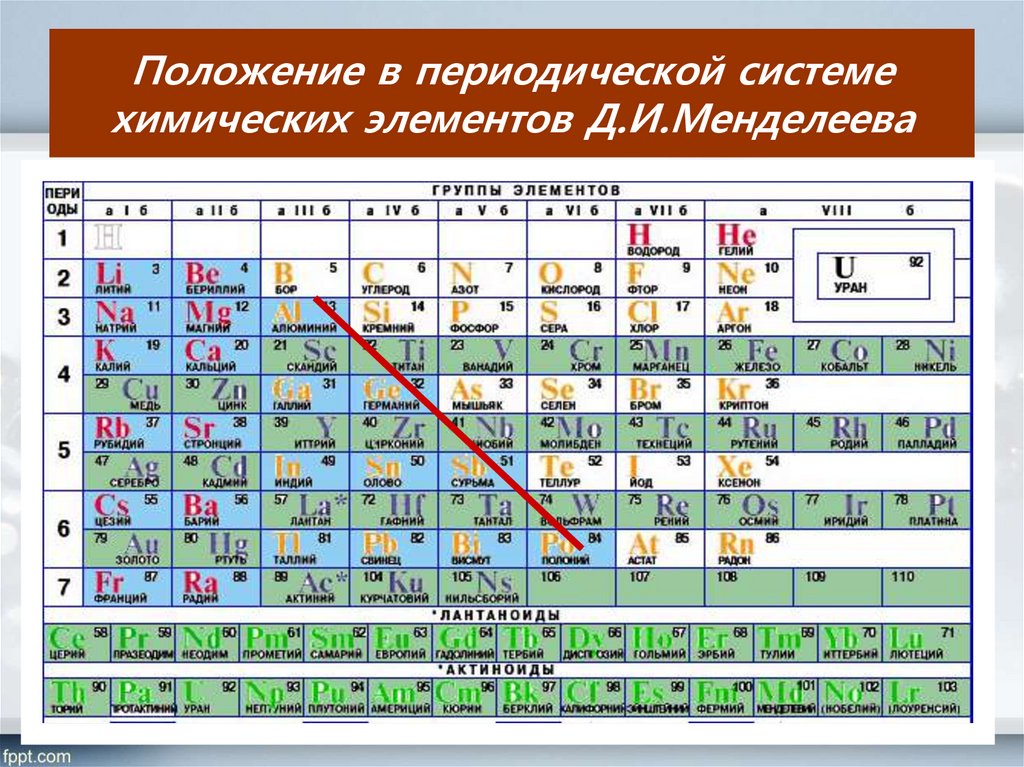
Титан – один из химических элементов, принадлежащих периодической таблице Д.И. Менделеева. Его атомный номер – 22. В таблице он относится к 4-й группе химических элементов и 4-му периоду. Обозначают титан буквами Ti.
Описание
Первый образец металла был получен в 1825 году. Применение в промышленных отраслях он нашел только в 1940 году. Назвали элемент как героев из мифов Древней Греции, т.к. невозможно было определить его свойства исключительно по оксиду.
Применение в промышленных отраслях он нашел только в 1940 году. Назвали элемент как героев из мифов Древней Греции, т.к. невозможно было определить его свойства исключительно по оксиду.
Титан занимает 10-ую строку в перечне самых распространенных в природе элементов. Его добывают из земной коры, морской воды, ультраосновных, основных и кислых пород, глины, сланца. Крупнейшие месторождения располагаются в Казахстане, Южной Корее, Индии, Австралии, Египте, Швеции, Норвегии, Китае, США, Канаде, Украине, РФ и ЮАР. Ярегское месторождение – самое масштабное на территории России. Из большей части добываемого вещества производят диоксид титана.
Изотопы
Известно несколько изотопов титана. Их массовые числа составляют 38-63 (22 протона, 16-41 нейтронов). В состав природного титана входит пять стабильных изотопов: с массовыми числами 46Ti, 47Ti, 48Ti, 49Ti, 50Ti. Существуют искусственные изотопы с продолжительным периодом полураспада: с массовыми числами 44Ti (60 лет), 45Ti (184 минуты).
Титан представляет собой металл серебристо-белого цвета. Плавится он при температуре примерно 1670 °C (в случае нормального давления). При низких температурах (-80 °C) этот элемент становится более хрупким. Он пластичный, вязкий, во время механической обработки налипает на инструменты (предотвратить это можно нанесением специального покрытия). Металл производят из диоксида титана с добавлением небольшого количества примесей, в т.ч. рутилового концентрата, синтетического рутила.
Обладая оксидной пленкой, титан не подвержен коррозии. В виде порошка, стружки, проволоке может самовоспламениться на воздухе. Пыль взрывается, стружка нередко приводит к возникновению пожара. Элемент выдерживает воздействие разбавленных кислотных и щелочных растворов, влажного хлора, водных растворов хлора. За счет комплексообразователей вступает в реакцию со слабыми кислотами. В органической среде может подвергнуться коррозийным процессам из-за попадания воды на металл.
Применение
Металлический титан нашел применение во многих промышленных областях, т. к. он почти такой же прочный, как сталь, но при этом на 45% легче. Он на 60% тяжелее алюминия, но прочнее его в 2 раза. Сплавы используются как конструкционный материал для авиа-, ракето- и кораблестроения. Металл применяют в следующих отраслях промышленности:
к. он почти такой же прочный, как сталь, но при этом на 45% легче. Он на 60% тяжелее алюминия, но прочнее его в 2 раза. Сплавы используются как конструкционный материал для авиа-, ракето- и кораблестроения. Металл применяют в следующих отраслях промышленности:
- химическая – различные трубопроводные устройства, насосы и т.п.;
- военная – бронежилеты, подводные лодки, перегородки самолетов и т.п.;
- автомобильная;
- сельскохозяйственная;
- пищевая;
- спортивная;
- ювелирная и др.
Этот элемент распространен и в медицине. Из него делают протезы, имплантаты, стоматологические инструменты, серьги для пирсинга.
Из различных соединений титана производят краску, бумагу, пластик, пищевую добавку, катализаторы и отвердители, бижутерию. Ими покрывают инструменты, купола церквей, создают дымовые завесы. Наибольшая доля использования титана во всем мире приходится на создание краски.
Элемент обладает физиологической инертностью, за счет чего он может использоваться в протезировании в качестве металла, напрямую контактирующего с тканями организма человека. Существенное преимущество титана заключается в том, что он не только прочный, но и может срастись с костью, что является важным в стоматологии.
Существенное преимущество титана заключается в том, что он не только прочный, но и может срастись с костью, что является важным в стоматологии.
Элемент Титан — Атом титана
Титан является химическим элементом с символом Ti и атомным номером 22. Иногда его называют «металл космической эры», [2] он имеет низкую плотность и является прочным, блестящие, коррозионностойкие (в т.ч. морская вода, царская водка и хлор) переход металл серебристого цвета.
Титан был обнаружен в Корнуолле,
Англия, Уильям Грегор в 1791 году и
назван Мартином Генрихом Клапротом в честь
Титаны греческой мифологии.
Элемент встречается в пределах нескольких
месторождения полезных ископаемых, в основном рутила и
ильмениты, которые широко распространены
в земной коре и литосфере,
и встречается почти у всех живых существ,
горные породы, водоемы и почвы. [3] Металл
извлекается из основного минерала
руды по способу Кролла [4] или процесс Хантера. Самый распространенный
соединение, диоксид титана, является популярным
фотокатализатор и используется в производстве
из белых пигментов. [5] Другие соединения включают титан
тетрахлорид (TiCl 4 ), компонент
дымовых завес и катализаторов; и титан
трихлорид (TiCl 3 ), который
используется в качестве катализатора в производстве
из полипропилена. [3]
[3]
Титан может быть сплавлен с железом, алюминием,
ванадий, молибден и другие элементы,
производить прочные легкие сплавы для
аэрокосмическая (реактивные двигатели, ракеты и космические корабли),
военный, промышленный процесс (химикаты
и нефтехимии, опреснительные установки,
целлюлозно-бумажная), автомобильная, сельскохозяйственная,
медицинские протезы, ортопедические имплантаты,
стоматологические и эндодонтические инструменты и файлы,
зубные имплантаты, спортивные товары, ювелирные изделия,
мобильные телефоны и другие приложения. [3]
[3]
Два наиболее полезных свойства
металлическая форма — коррозионная стойкость и
самое высокое соотношение прочности и веса
любой металл. [6] В нелегированном состоянии,
титан такой же прочный, как некоторые стали,
но на 45% легче. [7] Существуют две аллотропные формы [8] и
пять встречающихся в природе изотопов этого
элемент, от 46 Ti до 50 Ti,
при этом 48 Ti является наиболее распространенным
(73,8%). [9] Титановые
свойства химически и физически
похож на цирконий, потому что оба
имеют одинаковое количество валентных электронов
и находятся в одной группе в периодическом
стол.
Физический свойства
Металлический элемент, титан признан благодаря высокому соотношению прочности и веса. [8] Это прочный металл с низкая плотность, которая достаточно пластична (особенно в бескислородной среде), [3] блестящий, и металлически-белого цвета. [10] Относительно высокая температура плавления (более чем 1 650 °C или 3 000 °F) делает его полезным в качестве тугоплавкого металла. Он парамагнетик и имеет довольно низкую электро- и теплопроводность. [3]
Технические (чистота 99,2%) марки титана
иметь предел прочности при растяжении около
63 000 фунтов на квадратный дюйм (434 МПа), что равно
обычные низкосортные стальные сплавы, но
На 45% легче. [7] Титан на 60% плотнее алюминия,
но более чем в два раза прочнее [7] как наиболее часто используемый алюминий 6061-T6
сплав. Некоторые титановые сплавы (например,
Бета C) достигают прочности на растяжение более
200 000 фунтов на квадратный дюйм (1400 МПа). [11] Однако титан
теряет прочность при нагревании выше 430 °C
(806 °F). [12]
[7] Титан на 60% плотнее алюминия,
но более чем в два раза прочнее [7] как наиболее часто используемый алюминий 6061-T6
сплав. Некоторые титановые сплавы (например,
Бета C) достигают прочности на растяжение более
200 000 фунтов на квадратный дюйм (1400 МПа). [11] Однако титан
теряет прочность при нагревании выше 430 °C
(806 °F). [12]
Достаточно твердый (хотя и не такой твердый
как некоторые марки термообработанной стали),
немагнитный и плохой проводник тепла
и электричество. Обработка требует мер предосторожности,
так как материал будет размягчаться и раздражаться, если
острые инструменты и правильные методы охлаждения
не используются. Как те, что сделаны из стали,
титановые конструкции имеют предел выносливости
что гарантирует долговечность в некоторых приложениях. [10] Специальные титановые сплавы
жесткость также обычно не так хороша
как и другие материалы, такие как алюминиевые сплавы
и углеродное волокно, поэтому оно меньше используется для
конструкций, требующих высокой жесткости.
Как те, что сделаны из стали,
титановые конструкции имеют предел выносливости
что гарантирует долговечность в некоторых приложениях. [10] Специальные титановые сплавы
жесткость также обычно не так хороша
как и другие материалы, такие как алюминиевые сплавы
и углеродное волокно, поэтому оно меньше используется для
конструкций, требующих высокой жесткости.
Металл представляет собой диморфный аллотроп,
гексагональная альфа-форма превращается в телоцентрированную
кубическая (решетчатая) форма β при 882 °C
(1620 °F). [12] Удельная теплоемкость альфа-формы увеличивается
резко как то греется к этому переходу
температура, но затем падает и остается
довольно постоянна для β-формы независимо от
температуры. [12] Подобно цирконию и гафнию, дополнительный
существует омега-фаза, которая термодинамически
стабилен при высоких давлениях, но метастабилен
при атмосферном давлении. Эта фаза обычно
шестиугольный ( идеальный ) или тригональный ( искаженный )
и может рассматриваться как результат мягкого
продольный акустический фонон β
фаза, вызывающая коллапс плоскостей (111)
атомов. [13]
[12] Подобно цирконию и гафнию, дополнительный
существует омега-фаза, которая термодинамически
стабилен при высоких давлениях, но метастабилен
при атмосферном давлении. Эта фаза обычно
шестиугольный ( идеальный ) или тригональный ( искаженный )
и может рассматриваться как результат мягкого
продольный акустический фонон β
фаза, вызывающая коллапс плоскостей (111)
атомов. [13]
Ссылки
- Andersson, N. et al. (2003 г.). «Спектры излучения TiH и TiD вблизи 938 нм». J. Chem.
физ. 118 : 10543. doi:10.1063/1.
 1539848. http://bernath.uwaterloo.ca/media/257.pdf.
1539848. http://bernath.uwaterloo.ca/media/257.pdf. - Уильям Л. Мастертон; Сесиль Н. Херли (2008). Химия: принципы и реакции (6-е изд.). Cengage Обучение. п. 18. ISBN 0495126713. http://books.google.com/?id=teubNK-b2bsC&pg=PT44&lpg=PT44&dq=titanium+%22space-age+metal%22&q=titanium%20%22space-age%20metal%22.
- «Титан». Британская энциклопедия . 2006. http://www.britannica.com/eb/article-9072643/titanium. Проверено 29 декабря 2006 г. .
- Лиде, Д. Р., изд. (2005), CRC Справочник Химия и физика (86-е изд.), Бока-Ратон (Флорида): CRC Press, ISBN 0-8493-0486-5
- Кребса,
Роберт Э.
 (2006). История и
Использование химических элементов нашей Земли:
Справочное руководство (2-е издание) .
Вестпорт, Коннектикут: Гринвуд
Нажимать. ISBN 0313334382.
(2006). История и
Использование химических элементов нашей Земли:
Справочное руководство (2-е издание) .
Вестпорт, Коннектикут: Гринвуд
Нажимать. ISBN 0313334382. - Мэтью Дж. Доначи-младший (1988). ТИТАН: Технический Руководство . Металлс Парк, Огайо: ASM International. п. 11. ISBN 0871703092.
- Барксдейл 1968, с. 738
- «Титан». Энциклопедия Колумбии (6-е изд.). Нью-Йорк: Колумбийский университет
Нажимать.
 2000–2006 гг. ISBN 0-7876-5015-3.
http://www.answers.com/Титан.
2000–2006 гг. ISBN 0-7876-5015-3.
http://www.answers.com/Титан. - Барбалас, Кеннет Л. (2006). «Периодическая таблица элементов: Ti — титан». http://environmentalchemistry.com/yogi/periodic/Ti-pg2.html#Nuclides. Проверено 26 декабря 2006 г. .
- Ствертка, Альберт (1998). «Титан». Руководство к Элементам (пересмотренная ред.). Оксфордский университет Нажимать. стр. 81–82. ISBN 0–19-508083-1.
- Мэтью Дж. Доначи-младший (1988). Титан: технический
Руководство . Металлс Парк, Огайо: ASM International.
Приложение J, таблица J.2. ISBN 0871703092.

- Барксдейл 1968, с. 734
- Сикка, Южная Каролина; Вохра, Ю.К., Чидамбарам, Р. (1982).
«Омега-фаза в материалах». Прогресс в
Материаловедение 27 :
245–310. дои: 10.1016/0079-6425(82)
-0.
Титан
Зона данных | Открытие | Факты | Внешний вид и характеристики | Использование | Изобилие и изотопы | Ссылки
22
Ti
47,87
Химический элемент титан относится к переходным металлам. Он был обнаружен в 1791 году преподобным Уильямом Грегором.
Зона данных
| Классификация: | Титан является переходным металлом |
| Цвет: | серебристо-белый |
| Атомный вес: | 47,87 |
| Состояние: | твердый |
| Температура плавления: | 1668 или С, 1941 К |
| Точка кипения: | 3287 или С, 3560 К |
| Электроны: | 22 |
| Протоны: | 22 |
| Нейтроны в наиболее распространенном изотопе: | 26 |
| Электронные оболочки: | 2,8,10,2 |
| Электронная конфигурация: | [Ар] 3d 2 4 с 2 |
| Плотность @ 20 или C: | 4,50 г/см 3 |
Реакции, Соединения, Радиусы, Проводимости»>Показать больше, в том числе: Теплота, Энергия, Окисление,
Реакции, Соединения, Радиусы, Проводимости
| Атомный объем: | 10,64 см 3 /моль |
| Структура: | hcp: шестигранник закрытый pkd |
| Твердость: | 6,0 мес. |
| Удельная теплоемкость | 0,52 Дж г -1 К -1 |
| Теплота плавления | 14,15 кДж моль -1 |
| Теплота распыления | 471 кДж моль -1 |
| Теплота парообразования | 425 кДж моль -1 |
| 1 ст энергия ионизации | 658 кДж моль -1 |
| 2 nd энергия ионизации | 1310,3 кДж моль -1 |
| 3 rd энергия ионизации | 2652,5 кДж моль -1 |
| Сродство к электрону | 7,6 кДж моль -1 |
| Минимальная степень окисления | -1 |
| Мин. общее окисление нет. | 0 |
| Максимальная степень окисления | 4 |
| Макс. общее окисление нет. | 4 |
| Электроотрицательность (шкала Полинга) | 1,54 |
| Объем поляризуемости | 14,6 Å 3 |
| Реакция с воздухом | мягкий, вес/вт ⇒ TiO 2 |
| Реакция с 15 M HNO 3 | пассивированный |
| Реакция с 6 М HCl | нет |
| Реакция с 6 М раствором NaOH | нет |
| Оксид(ы) | TiO, Ti 2 O 3 , TiO 2 (титан) + другие |
| Гидрид(ы) | TiH 2 |
| Хлориды | TiCl 2 , TiCl 3 , TiCl 4 |
| Атомный радиус | 140 часов |
| Ионный радиус (1+ ион) | 128 часов |
| Ионный радиус (2+ ион) | 100 вечера |
| Ионный радиус (3+ ион) | 20:00 |
| Ионный радиус (1-ион) | – |
| Ионный радиус (2-ионный) | – |
| Ионный радиус (3-ионный) | – |
| Теплопроводность | 21,9 Вт м -1 К -1 |
| Электропроводность | 2,6 x 10 6 S m -1 |
| Температура замерзания/плавления: | 1668 или С, 1941 К |
Музей Гуггенхайма, Бильбао, облицованный титановыми панелями.
Ильменит, минерал, в котором Уильям Грегор открыл титан.
Открытие титана
Доктор Дуг Стюарт
Об открытии титана было объявлено в 179 г.1 геолога-любителя преподобного Уильяма Грегора из Корнуолла, Англия. (1), (2)
Грегор нашел черный магнитный песок, похожий на порох, в ручье в приходе Маннакан в Корнуолле, Англия. (Теперь мы называем этот песок ильменитом; это смесь, состоящая в основном из оксидов железа и титана.)
Грегор проанализировал песок и обнаружил, что он состоит в основном из магнетита (Fe 3 O 4 ) и довольно нечистого оксида. из нового металла, который он описал как «красновато-коричневую известь».0009
Эта накипь становилась желтой при растворении в серной кислоте и пурпурной при восстановлении железом, оловом или цинком. Грегор пришел к выводу, что имеет дело с новым металлом, который назвал манакканитом в честь прихода Маннакан.
Открыв новый металл, Грегор вернулся к своим пастырским обязанностям.
В нашей истории мало что осталось до 1795 года, когда известный немецкий химик Мартин Клапрот испытал волнение при открытии нового металлического элемента. Клапрот назвал новый металл титаном в честь титанов, сыновей богини Земли в греческой мифологии.
Клапрот обнаружил титан в минеральном рутиле из Бойника, Венгрия. Как и известь Грегора, рутил был красного цвета. В 1797 году Клапрот прочитал отчет Грегора от 1791 года и понял, что красный оксид, в котором он нашел титан, и красный оксид, в котором Грегор нашел манакканит, на самом деле были одним и тем же; титан и макканит были одним и тем же элементом, и Грегор был истинным первооткрывателем этого элемента.
Грегор, возможно, опередил Клапрота в открытии нового металла, но ученые предпочли «титан» Клапрота «манаканиту» Грегора 9.0009
Получить образец чистого титана оказалось намного сложнее, чем обнаружить его.
Многие ученые пытались, но прошло 119 лет с момента его открытия, пока в 1910 году металлургом Мэтью Хантером из Скенектади, штат Нью-Йорк, не был выделен титан с чистотой 99,9%, который нагрел хлорид титана (IV) с натрием до красного каления в цилиндре высокого давления. . (2)
. (2)
В 1936 году процесс Кролла (нагревание хлорида титана (IV) с магнием) сделал возможным коммерческое производство титана. К 1948 мировое производство достигло всего 3 тонн в год.
Однако к 1956 году ученые и инженеры осознали, что свойства титана весьма желательны, и мировое производство выросло до 25 000 тонн в год. (3)
Прогноз мирового производства металлического титана с использованием процесса Кролла на 2011 год составлял 223 000 метрических тонн. (4)
Кузнец делает нож из титана и показывает свойства металла.
Мелкодисперсный титан легко горит.
Компьютерное изображение атомов титана (синий), связанных с углеродной нанотрубкой в водородном (красный) топливном элементе. Подобные молекулы могут повысить эффективность топливных элементов для автомобилей. Изображение: T. Yildirim/NIST
Изображение: T. Yildirim/NIST
Внешний вид и характеристики
Вредное воздействие:
Металлический титан считается нетоксичным. В виде металлической стружки или порошка он представляет значительную пожароопасность. Хлориды титана вызывают коррозию.
Характеристики:
Чистый титан — легкий, серебристо-белый, твердый, блестящий металл. Он обладает превосходной прочностью и коррозионной стойкостью, а также имеет высокое соотношение прочности к весу.
Скорость коррозии титана настолько низка, что после 4000 лет пребывания в морской воде коррозия проникла бы в металл только на толщину тонкого листа бумаги. (3)
При высоких температурах металл горит на воздухе, и, что необычно, титан также горит в чистом азоте.
Титан пластичен и податлив при нагревании.
Нерастворим в воде, но растворим в концентрированных кислотах.
Использование титана
Металлический титан используется в качестве легирующей добавки с металлами, включая алюминий, железо, молибден и марганец.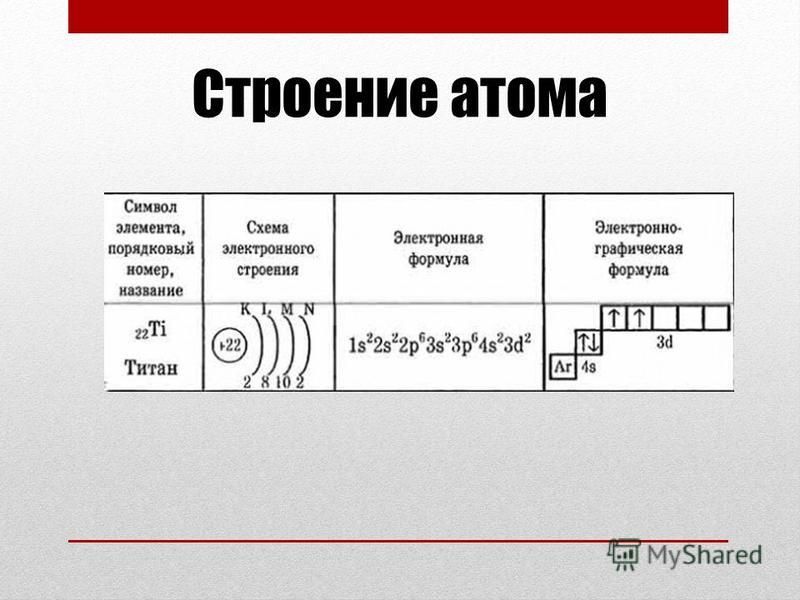 Сплавы титана в основном используются в аэрокосмической, авиастроении и двигателях, где необходимы прочные, легкие, термостойкие материалы.
Сплавы титана в основном используются в аэрокосмической, авиастроении и двигателях, где необходимы прочные, легкие, термостойкие материалы.
Благодаря своей стойкости к морской воде (см. выше) титан используется для изготовления корпусов кораблей, гребных валов и других конструкций, подвергающихся воздействию моря.
Титан также используется в имплантатах для замены суставов, таких как шаровидный тазобедренный сустав.
Около 95% производства титана приходится на диоксид титана (диоксид титана). Этот интенсивно белый пигмент с высоким коэффициентом преломления и сильным поглощением УФ-излучения используется в белой краске, пищевых красителях, зубной пасте, пластмассах и солнцезащитных кремах.
Титан используется в ряде товаров повседневного обихода, таких как сверла, велосипеды, клюшки для гольфа, часы и портативные компьютеры.
Изобилие и изотопы
Изобилие в земной коре: 0,56% по массе, 0,25% по молям
Изобилие в Солнечной системе: 4 части на миллион по массе, 100 частей на миллиард по молям
Стоимость, чистая: 661 доллар США за 100 г , объем: $ за 100 г
Источник: Титан является девятым по распространенности металлом в земной коре. Титан не встречается в природе в свободном виде, но встречается в таких минералах, как рутил (оксид титана), ильменит (железный оксид титана) и сфен (титанит или силикат кальция-титана).
Титан не встречается в природе в свободном виде, но встречается в таких минералах, как рутил (оксид титана), ильменит (железный оксид титана) и сфен (титанит или силикат кальция-титана).
В промышленных масштабах металл выделяют с использованием процесса Кролла, при котором первоначально оксид титана получают из минерального ильменита. Затем оксид TiO 2 превращают в хлорид (TiCl 4 ) путем карбохлорирования. Его конденсируют и очищают фракционной перегонкой, а затем восстанавливают расплавленным магнием в атмосфере аргона.
Изотопы: Титан имеет 18 изотопов с известными периодами полураспада с массовыми числами от 39 до 57. Встречающийся в природе титан представляет собой смесь пяти стабильных изотопов, и они находятся в указанных процентах: 46 Ti (8,2%), 47 Ti (7,4%), 48 Ti (73,7%), 49 Ti (5,4%) и 50 Ti (5,2%). Наиболее распространенным в природе из этих изотопов является 48 Ti с содержанием 73,7%.


 1539848. http://bernath.uwaterloo.ca/media/257.pdf.
1539848. http://bernath.uwaterloo.ca/media/257.pdf. (2006). История и
Использование химических элементов нашей Земли:
Справочное руководство (2-е издание) .
Вестпорт, Коннектикут: Гринвуд
Нажимать. ISBN 0313334382.
(2006). История и
Использование химических элементов нашей Земли:
Справочное руководство (2-е издание) .
Вестпорт, Коннектикут: Гринвуд
Нажимать. ISBN 0313334382.  2000–2006 гг. ISBN 0-7876-5015-3.
http://www.answers.com/Титан.
2000–2006 гг. ISBN 0-7876-5015-3.
http://www.answers.com/Титан.