Молекулярная масса цинка — Школьные Знания.com
Укажите цвет нитрогенсодержащих соединний, которые образуются при добавлении концентрированной нитратной кислоты к белку * белый желтый синий фиолетов … ый
1. Из перечня веществ выпишите отдельно формулы оксидов, проклассифицируйте их и назовите: CuS, H.PO., Na.CO, P.O., H.SO, KCI, SiO., CuO, HCI, ALO, Са … О, Zn, SO, Cu. 3. Какая масса сульфата бария образуется при с достаточным взаимодействии 30,6 г оксида бария количеством серной кислоты? 4. Как обнаружить раствор соляной кислоты среди других веществ (кислот среди них нет)? 5. Допишите уравнения реакций получения солей, используя схемы: А) СаО + ? Са(NO.), Б) К+? 3D КОН+? Назовите соли.
1. Из перечня веществ выпишите отдельно формулы оксидов, проклассифицируйте их и назовите: CuS, H.PO., Na.CO, P.O., H.SO, KCI, SiO., CuO, HCI, ALO, Са
… О, Zn, SO, Cu. 3. Какая масса сульфата бария образуется при с достаточным взаимодействии 30,6 г оксида бария количеством серной кислоты? 4.
Определите объём газовой смеси нормальные условия состоящие углекислого газа и азота массой 160 г. Известно что масса CO2 и масса N2 равно 33:7
Кто разбирается в номенклатуре помогите пожалуйста
в реакции N2+h3=2Nh4 определите a)обьемное соотношение b)мольное соотношение с)соотношение чисел молекул ,только пж с обьяснением
срочно нужно !!! Сходство между анилином и аммиаком проявляется во взаимодействии при нормальных условиях с: * хлоридной кислотой водой бромной водой … лакмусом
Помогите пожалуйста с химией Следующие пары металлов, находящиеся в тесном контакте, погружены в раствор серной кислоты. Укажите пару, где железо не б … удет разрушаться: Fe/Cu, Fe/Ag, Fe/Zn, Fe/Au.
1, Сколько граммов 45% -ного (по массе)раствора соли нужно добавить к 200 г воды,чтобы получить 20%-ный раствор соли?2, Сколько миллилитров 0,35 М рас
… твора NAClможно приготовить из 40 мл 2,5 М раствора?3, Плотность 12%-ного (по массе) раствораBA(OH)2, равна 1. 26 г/мл. Рассчитатьмолярность и нормальность этого раствора. С решением и дано!!!!
26 г/мл. Рассчитатьмолярность и нормальность этого раствора. С решением и дано!!!!
сколько литров кислорода затрачено на сгорание 12 г магния
Цинк
| Цинк | |
|---|---|
| Атомный номер | 30 |
| Внешний вид простого вещества |
хрупкий металл голубовато-белого цвета |
| Свойства атома | |
|
Атомная масса (молярная масса) |
|
| Радиус атома | 138 пм |
|
Энергия ионизации (первый электрон) |
905,8(9,39) кДж/моль (эВ) |
| Электронная конфигурация | [Ar] 3d10 4s2 |
| Химические свойства | |
| Ковалентный радиус | 125 пм |
| Радиус иона | |
|
Электроотрицательность (по Полингу) |
1,65 |
| Электродный потенциал | -0,763 |
| Степени окисления | 2 |
| Термодинамические свойства простого вещества | |
| Плотность | 7,133 г/см³ |
| Молярная теплоёмкость | 25,4[1]Дж/(K·моль) |
| Теплопроводность | 116 Вт/(м·K) |
| Температура плавления | 692,73 K |
| Теплота плавления | 7,28 кДж/моль |
| Температура кипения | 1180 K |
| Теплота испарения | 114,8 кДж/моль |
| Молярный объём | 9,2 см³/моль |
| Кристаллическая решётка простого вещества | |
| Структура решётки | гексагональная |
| Параметры решётки | a=2,665 c=4,947 Å |
| Отношение c/a | 1,856 |
| Температура Дебая | 234 K |
| Zn | 30 |
| 65,39 | |
| [Ar]3d104s2 | |
Цинк —элемент побочной подгруппы второй группы, четвёртого периода периодической системы химических элементов Д. И. Менделеева, с атомным номером 30. Обозначается символом Zn (лат. Zincum). Простое вещество цинк (CAS-номер: 7440-66-6) при нормальных условиях — хрупкий переходный металл голубовато-белого цвета (тускнеет на воздухе, покрываясь тонким слоем оксида цинка).
И. Менделеева, с атомным номером 30. Обозначается символом Zn (лат. Zincum). Простое вещество цинк (CAS-номер: 7440-66-6) при нормальных условиях — хрупкий переходный металл голубовато-белого цвета (тускнеет на воздухе, покрываясь тонким слоем оксида цинка).
История
Сплав цинка с медью — латунь — был известен еще в Древней Греции, Древнем Египте, Индии (VII в.), Китае (XI в.). Долгое время не удавалось выделить чистый цинк. В 1746 А. С. Маргграф разработал способ получения чистого цинка путём прокаливания смеси его окиси с углём без доступа воздуха в глиняных огнеупорных ретортах с последующей конденсацией паров цинка в холодильниках. В промышленном масштабе выплавка цинка началась в XVII в.
Латинское zincum переводится как «белый налет». Происхождение этого слова точно не установлено. Предположительно, оно идет от персидского «ченг», хотя это название относится не к цинку, а вообще к камням. Слово «цинк» встречается в трудах Парацельса и других исследователей 16—17 вв. и восходит, возможно, к древнегерманскому «цинко» — налет, бельмо на глазу. Общеупотребительным название «цинк» стало только в 1920-х гг.
Слово «цинк» встречается в трудах Парацельса и других исследователей 16—17 вв. и восходит, возможно, к древнегерманскому «цинко» — налет, бельмо на глазу. Общеупотребительным название «цинк» стало только в 1920-х гг.
Нахождение в природе
Наиболее распространенный минерал цинка — сфалерит, или цинковая обманка. Основной компонент минерала — сульфид цинка ZnS, а разнообразные примеси придают этому веществу всевозможные цвета. Видимо, за это минерал и называют обманкой. Цинковую обманку считают первичным минералом, из которого образовались другие минералы элемента № 30: смитсонит ZnCO3, цинкит ZnO, каламин 2ZnO · SiO2 · Н2O. На Алтае нередко можно встретить полосатую «бурундучную» руду — смесь цинковой обманки и бурого шпата. Кусок такой руды издали действительно похож на затаившегося полосатого зверька.
Получение
Цинк в природе как самородный метал не проявляется. Цинк добывают из полиметаллических руд, содержащих 1-4 % Zn в виде сульфида, а также Cu, Pb, Ag, Au, Cd, Bi. Руды обогащают селективной флотацией, получая цинковые концентраты (50-60 % Zn) и одновременно свинцовые, медные, а иногда также пиритные концентраты. Цинковые концентраты обжигают в печах в кипящем слое, переводя сульфид цинка в оксид ZnO; образующийся при этом сернистый газ SO2 расходуется на производство серной кислоты.
Руды обогащают селективной флотацией, получая цинковые концентраты (50-60 % Zn) и одновременно свинцовые, медные, а иногда также пиритные концентраты. Цинковые концентраты обжигают в печах в кипящем слое, переводя сульфид цинка в оксид ZnO; образующийся при этом сернистый газ SO2 расходуется на производство серной кислоты.
От ZnO к Zn идут двумя путями. По пирометаллургическому (дистилляционному) способу, существующему издавна, обожженный концентрат подвергают спеканию для придания зернистости и газопроницаемости, а затем восстанавливают углем или коксом при 1200—1300 °С: ZnO + С = Zn + CO. Образующиеся при этом пары металла конденсируют и разливают в изложницы. Сначала восстановление проводили только в ретортах из обожженной глины, обслуживаемых вручную, позднее стали применять вертикальные механизированные реторты из карборунда, затем — шахтные и дуговые электропечи; из свинцово-цинковых концентратов цинк получают в шахтных печах с дутьем. Производительность постепенно повышалась, но цинк содержал до 3 % примесей, в том числе ценный кадмий.
Основной способ получения цинка — электролитический (гидрометаллургический). Обожженные концентраты обрабатывают серной кислотой; получаемый сульфатный раствор очищают от примесей (осаждением их цинковой пылью) и подвергают электролизу в ваннах, плотно выложенных внутри свинцом или винипластом. Цинк осаждается на алюминиевых катодах, с которых его ежесуточно удаляют (сдирают) и плавят в индукционных печах. Обычно чистота электролитного цинка 99,95 %, полнота извлечения его из концентрата (при учете переработки отходов) 93-94 %. Из отходов производства получают цинковый купорос, Pb, Cu, Cd, Au, Ag; иногда также In, Ga, Ge, Tl.
Физические свойства
В чистом виде — довольно пластичный серебристо-белый металл.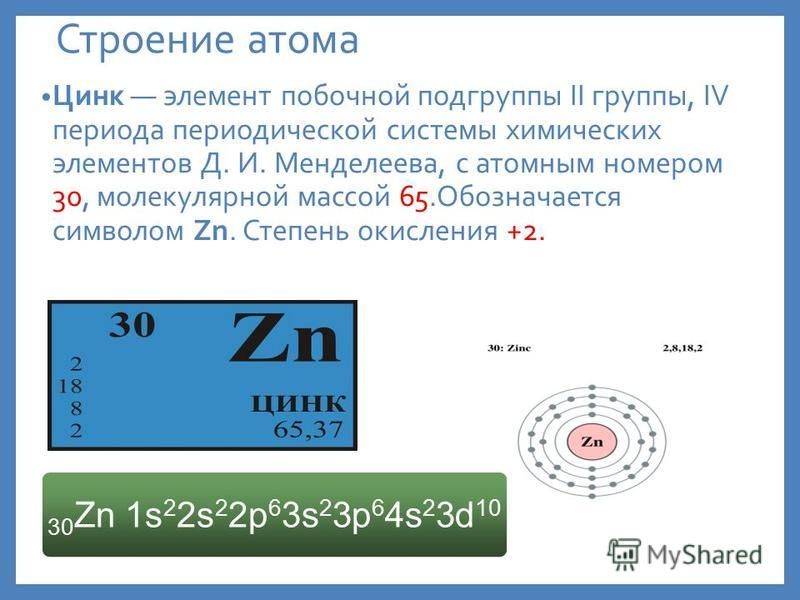 Обладает гексагональной решеткой с параметрами а = 0,26649 нм, с = 0,49468 нм. При комнатной температуре хрупок, при сгибании пластинки слышен треск от трения кристаллитов (обычно сильнее, чем «крик олова»). При 100—150 °C цинк пластичен. Примеси, даже незначительные, резко увеличивают хрупкость цинка.
Обладает гексагональной решеткой с параметрами а = 0,26649 нм, с = 0,49468 нм. При комнатной температуре хрупок, при сгибании пластинки слышен треск от трения кристаллитов (обычно сильнее, чем «крик олова»). При 100—150 °C цинк пластичен. Примеси, даже незначительные, резко увеличивают хрупкость цинка.
Химические свойства
Типичный амфотерный металл. Стандартный электродный потенциал −0,76 В, в ряду стандартных потенциалов расположен до железа.
На воздухе цинк покрывается тонкой пленкой оксида ZnO. При сильном нагревании сгорает с образованием амфотерного белого оксида ZnO:
2Zn + O2 = 2ZnO.
Оксид цинка реагирует как с растворами кислот:
ZnO + 2HNO3 = Zn(NO3)2 + H2O
так и щелочами:
ZnO + 2NaOH = Na2ZnO2 + Н2О,
Цинк обычной чистоты активно реагирует с растворами кислот:
Zn + 2HCl = ZnCl2 + H2↑,
Zn + H2SO4(разб.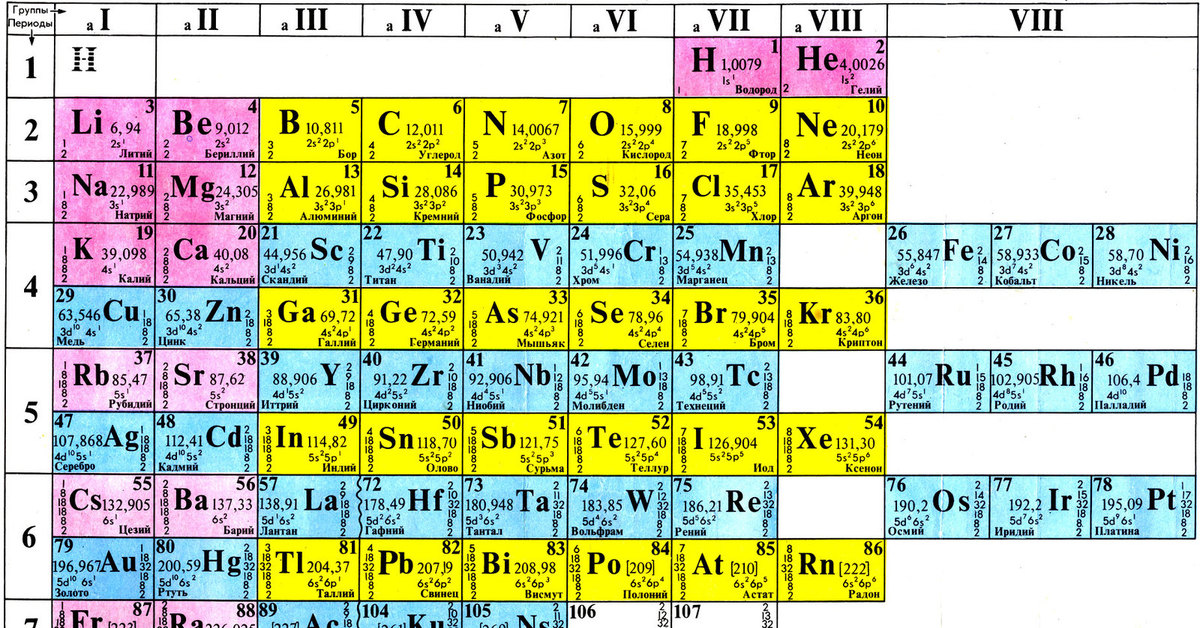 ) = ZnSO4 + H2↑
) = ZnSO4 + H2↑
и растворами щелочей:
Zn + 2NaOH + 2H2O = Na2[Zn(OH)4] + H2↑,
образуя гидроксоцинкаты. С растворами кислот и щелочей очень чистый цинк не реагирует. Взаимодействие начинается при добавлении нескольких капель раствора сульфата меди CuSO4.
При нагревании цинк реагирует с галогенами с образованием галогенидов ZnHal2. С фосфором цинк образует фосфиды Zn3P2 и ZnP2. С серой и ее аналогами — селеном и теллуром — различные халькогениды, ZnS, ZnSe, ZnSe2 и ZnTe.
С водородом, азотом, углеродом, кремнием и бором цинк непосредственно не реагирует. Нитрид Zn3N2 получают реакцией цинка с аммиаком при 550—600 °C.
В водных растворах ионы цинка Zn2+ образуют аквакомплексы [Zn(H2O)4]2+ и [Zn(H2O)6]2+.
Применение
- Цинкование — 45-60%
- В медицине (оксид цинка как антисептик) — 10%
- Производство сплавов — 10%
- Производство резиновых шин — 10%
- Масляные краски — 10%
Чистый металлический цинк используется для восстановления благородных металлов, добываемых подземным выщелачиванием (золото, серебро). Кроме того, цинк используется для извлечения серебра, золота (и других металлов) из чернового свинца в виде интерметаллидов цинка с серебром и золотом (так называемой «серебристой пены»), обрабатываемых затем обычными методами аффинажа.
Применяется для защиты стали от коррозии (оцинковка поверхностей, не подверженных механическим воздействиям, или металлизация — для мостов, емкостей, металлоконструкций). Также используется в качестве материала для отрицательного электрода в химических источниках тока, то есть в батарейках и аккумуляторах, например: марганцево-цинковый элемент, серебряно-цинковый аккумулятор (ЭДС 1,85 В, 150 Вт·ч/кг, 650 Вт·ч/дм³, малое сопротивление и колоссальные разрядные токи, ртутно-цинковый элемент (ЭДС 1,35 В, 135 Вт·ч/кг, 550—650 Вт·ч/дм³), диоксисульфатно-ртутный элемент, йодатно-цинковый элемент, медно-окисный гальванический элемент (ЭДС 0,7—1,6 Вольт, 84—127 Вт·ч/кг, 410—570 Вт·ч/дм³), хром-цинковый элемент, цинк-хлоросеребряный элемент, никель-цинковый аккумулятор (ЭДС 1,82 Вольт, 95—118 Вт·ч/кг, 230—295 Вт·ч/дм³), свинцово-цинковый элемент, цинк-хлорный аккумулятор, цинк-бромный аккумулятор и др). Очень важна роль цинка в цинк-воздушных аккумуляторах, в последние годы интенсивно разрабатываются на основе системы цинк-воздух — аккумуляторы для компьютеров (ноутбуки) и в этой области достигнут значительный успех (большие, чем у литиевых батарей, ёмкость и ресурс, меньшая в 3 раза стоимость), так же эта система очень перспективна для пуска двигателей (свинцовый аккумулятор — 55 Вт·ч/кг, цинк-воздух — 220—300 Вт·ч/кг) и для электромобилей (пробег до 900 км). Входит в состав многих твёрдых припоев для снижения их температуры плавления. Цинк — важный компонент латуни. Окись цинка широко используется в медицине как антисептическое и противовоспалительное средство. Также окись цинка используется для производства краски — цинковых белил.
Очень важна роль цинка в цинк-воздушных аккумуляторах, в последние годы интенсивно разрабатываются на основе системы цинк-воздух — аккумуляторы для компьютеров (ноутбуки) и в этой области достигнут значительный успех (большие, чем у литиевых батарей, ёмкость и ресурс, меньшая в 3 раза стоимость), так же эта система очень перспективна для пуска двигателей (свинцовый аккумулятор — 55 Вт·ч/кг, цинк-воздух — 220—300 Вт·ч/кг) и для электромобилей (пробег до 900 км). Входит в состав многих твёрдых припоев для снижения их температуры плавления. Цинк — важный компонент латуни. Окись цинка широко используется в медицине как антисептическое и противовоспалительное средство. Также окись цинка используется для производства краски — цинковых белил.
Хлорид цинка — важный флюс для пайки металлов и компонент при производстве фибры.
Теллурид, селенид, фосфид, сульфид цинка — широко применяемые полупроводники.
Селенид цинка используется для изготовления оптических стёкол с очень низким коэффициентом поглощения в среднем инфракрасном диапазоне, например, в углекислотных лазерах.
Список стран по производству цинка в 2006 году (на основе «Геологического обзора Соединенных Штатов»):
| Список стран по производству цинка | ||
|---|---|---|
| Место | Страна | Производительность (тонн) |
| — | Весь мир | 10,000,000 |
| 1 | Китай | 2,600,000 |
| 2 | Австралия | 1,380,000 |
| 3 | Перу | 1,201,794 |
| 4 | США | 727,000 |
| 5 | Канада | 710,000 |
| 6 | Мексика | 480,000 |
| 7 | Ирландия | 425,700 |
| 8 | Индия | 420,800 |
| 9 | Казахстан | 400,000 |
| 10 | Швеция | 192,400 |
| 11 | Россия | 190,000 |
| 12 | Бразилия | 176,000 |
| 13 | Боливия | 175,000 |
| 14 | Польша | 135,600 |
| 15 | Иран | 130,000 |
| 16 | Марокко | 73,000 |
| 17 | Намибия | 68,000 |
| 18 | Северная Корея | 67,000 |
| 19 | Турция | 50,000 |
| 20 | Вьетнам | 48,000 |
| 21 | Таиланд | 45,000 |
| 22 | Гондурас | 37,646 |
| 23 | Финляндия | 35,700 |
| 24 | ЮАР | 34,444 |
| 25 | Чили | 31,725 |
| 26 | Аргентина | 30,300 |
| 27 | Болгария | 17,300 |
| 28 | Румыния | 9,600 |
| 29 | Япония | 7,169 |
| 30 | Алжир | 5,000 |
| 31 | Саудовская Аравия | 1,500 |
| 32 | Грузия | 400 |
| 33 | Босния и Герцеговина | 300 |
| 34 | Мьянма | 100 |
Биологическая роль
Цинк:
-
необходим для продукции спермы и мужских гормонов.

- необходим для метаболизма витамина E, который является предшественником половых гормонов и включается в продукцию тестостерона.
- важен для нормальной деятельности простаты.
- участвует в синтезе разных анаболических гормонов в организме, включая инсулин, тестостерон и гормон роста.
Содержание в продуктах питания
Среди продуктов, употребляемых в пищу человеком, наибольшее содержание цинка — в устрицах. Однако в тыквенных семечках содержится всего на 26 % меньше цинка, чем в устрицах. Например, съев 45 грамм устриц, человек получит столько же цинка, сколько содержится в 60 граммах тыквенных семечек.
Содержание цинка:
- ~0,25 мг/кг — яблоки, апельсины, лимоны, инжир, грейпфруты, все мясистые фрукты, зеленые овощи, минеральная вода.
- ~0,31 мг/кг — мёд.
-
~2—8 мг/кг — малина, черная смородина, финики, большая часть овощей, большинство морских рыб, постная говядина, молоко, очищенный рис, свекла обычная и сахарная, спаржа, сельдерей, помидоры, картофель, редька, хлеб.

- ~8—20 мг/кг — некоторые зерновые, дрожжи, лук, чеснок, неочищенный рис, яйца.
- ~20—50 мг/кг — овсяная и ячменная мука, какао, патока, яичный желток, мясо кроликов и цыплят, орехи, горох, фасоль, чечевица, зеленый чай, сушёные дрожжи, кальмары.
- ~30—85 мг/кг — говяжья печень, некоторые виды рыб.
- ~130—202 мг/кг — отруби из пшеницы, проросшие зерна пшеницы, тыквенные семечки, семечки подсолнечника.
Токсичность
Ионы Zn2+ токсичны.
Дополнительная информация
Категория:Соединения цинка
Молярная масса цинка
Молярная масса цинка.
Молярная масса цинка:
Молярная масса – это характеристика вещества, отношение массы вещества к его количеству.
В Международной системе единиц (СИ) единицей измерения молярной массы является килограмм на моль (русское обозначение: кг/моль; международное: kg/mol). Исторически сложилось, что молярную массу, как правило, выражают в г/моль.
Исторически сложилось, что молярную массу, как правило, выражают в г/моль.
Молярная масса численно равна массе одного моля вещества, то есть массе вещества, содержащего число частиц, равное числу Авогадро (NA = 6,022 140 76⋅1023 моль−1).
Молярная масса, выраженная в г/моль, численно совпадает с молекулярной массой (абсолютной молекулярной массой), выраженной в а. е. м., и относительной молекулярной массой.
В свою очередь, молекулярная масса – масса молекулы. Различают абсолютную молекулярную массу (обычно выражается в атомных единицах массы, а. е. м.) и относительную молекулярную массу – безразмерную величину, равную отношению массы молекулы к 1/12 массы атома углерода 12C.
Молярную массу обозначают M.
Молярная масса цинка (M (Zn)) составляет 65,38(2) г/моль.
Необходимо иметь в виду, что молярные массы химических элементов и простых веществ, которые они образуют – не одно и то же.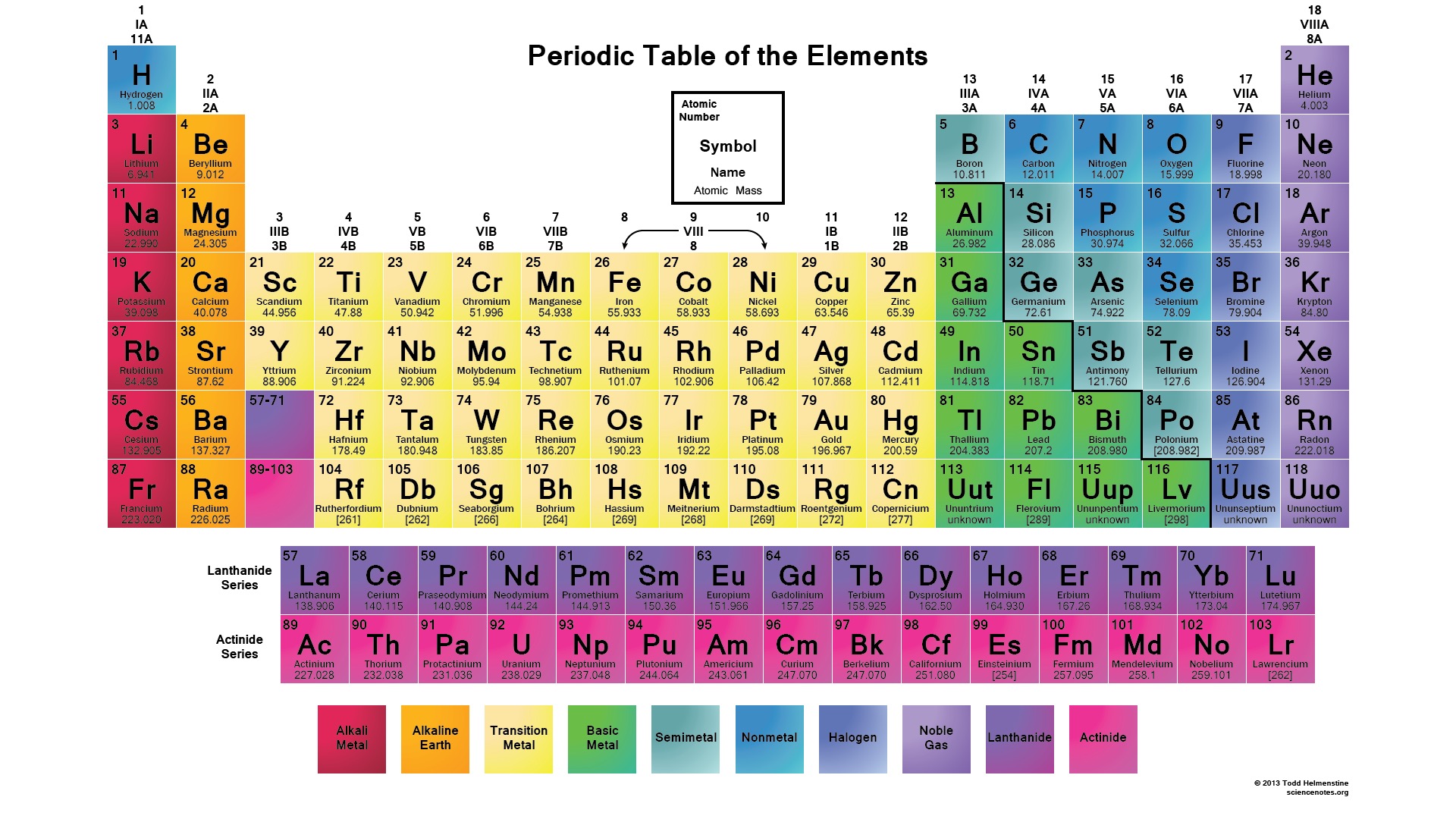 Например, молярная масса кислорода как химического элемента (атома) ≈ 16 г/моль, а вещества (O2) ≈ 32 г/моль.
Например, молярная масса кислорода как химического элемента (атома) ≈ 16 г/моль, а вещества (O2) ≈ 32 г/моль.
Все свойства атома цинка
Источник: https://en.wikipedia.org
Примечание: © Фото https://www.pexels.com, https://pixabay.com
карта сайта
Абонентское юридическое обслуживание
Коэффициент востребованности 175
Vestnik dermatologii i venerologiiVestnik dermatologii i venerologii0042-46092313-6294Rossijskoe Obschestvo Dermatovenerologov i Kosmetologov62610.25208/vdv626Научная статьяZinc, its biological role and use in dermatologyKHLEBNIKOVAA N-PETRUNIND D-I.M. Sechenov First Moscow State Medical UniversityRepresentative Office ot Astellas Pharma Europe B. V1512201389610011611032020Copyright © 2013, KHLEBNIKOVA A.N., PETRUNIN D.D.2013This literature review detines the biological role ot zinc in the human body, immune homeostasis and skin physiology as well as pathophysiology ot skin diseases. It describes the current range ot systemic and topical zinc preparations and their pharmacological characteristics. The review also describes skin diseases that may be treated with the use ot zinc preparations on a grounded basis, and discloses the clinical experience ot the use ot these drugs described in the world literature. It sets out certain recommendations tor using zinc preparations in clinical practice.Zincskin diseasesacnedermatologyimmunologypharmacologyЦинккожные заболеванияакнедерматологияиммунологияфармакология1.Воскресенский П.А., Каверина А.А., Парменов К.Я. и др. Справочник по химии. Изд. 4-е, перераб. М: Просвещение, 1978; 2872.Raulin J. Etudes cliniques sur la vegetation. Ann Sci Nat Bot Biol Veg 1869; 11: 933.Зеленин К.Н. Химия: учебник для медицинских вузов.
V1512201389610011611032020Copyright © 2013, KHLEBNIKOVA A.N., PETRUNIN D.D.2013This literature review detines the biological role ot zinc in the human body, immune homeostasis and skin physiology as well as pathophysiology ot skin diseases. It describes the current range ot systemic and topical zinc preparations and their pharmacological characteristics. The review also describes skin diseases that may be treated with the use ot zinc preparations on a grounded basis, and discloses the clinical experience ot the use ot these drugs described in the world literature. It sets out certain recommendations tor using zinc preparations in clinical practice.Zincskin diseasesacnedermatologyimmunologypharmacologyЦинккожные заболеванияакнедерматологияиммунологияфармакология1.Воскресенский П.А., Каверина А.А., Парменов К.Я. и др. Справочник по химии. Изд. 4-е, перераб. М: Просвещение, 1978; 2872.Raulin J. Etudes cliniques sur la vegetation. Ann Sci Nat Bot Biol Veg 1869; 11: 933.Зеленин К.Н. Химия: учебник для медицинских вузов. СПб: Специальная литература, 1997; 6884.Brocard A., Dreno B. Innate immunity: a crucial target for zinc in the treatment of inflammatory dermatosis. J Eur Acad Dermatol Venerol 2011; 25: 1146—1152.5.U.S. National library of Medicine. Toxnet database. [WWW document] 2010. URL http://toxnet.nlm.nih.gov6.Coleman J. Zinc proteins: enzymes, storage proteins, transcription factors, and replication proteins. Annu Rev Biochem 1992; 61: 897—946.7.Prasad A.S. Discovery of human zinc deficiency: 50 years later. J Trace Elem Med 2012; 26(2—3): 66—9.8.Klug A. The discovery of zinc fingers and their development for practical applications in gene regulation and genome manipulation. Q Rev Biophys. 2010; 43(1): 1—21.9.Hernick M., Fierke C. Zinc hydrolases: the mechanisms of zinc-dependent deacetylases. Arch Biochem Biophys 2005; 433: 71—84.10.Berg J.M., Shi Y. The galvanization of biology: a growing appreciation for the roles of zinc. Science 1996; 271: 1081—5.11.Sternlicht M., Werb Z. How matrix metalloproteinases regulate cell behavior.
СПб: Специальная литература, 1997; 6884.Brocard A., Dreno B. Innate immunity: a crucial target for zinc in the treatment of inflammatory dermatosis. J Eur Acad Dermatol Venerol 2011; 25: 1146—1152.5.U.S. National library of Medicine. Toxnet database. [WWW document] 2010. URL http://toxnet.nlm.nih.gov6.Coleman J. Zinc proteins: enzymes, storage proteins, transcription factors, and replication proteins. Annu Rev Biochem 1992; 61: 897—946.7.Prasad A.S. Discovery of human zinc deficiency: 50 years later. J Trace Elem Med 2012; 26(2—3): 66—9.8.Klug A. The discovery of zinc fingers and their development for practical applications in gene regulation and genome manipulation. Q Rev Biophys. 2010; 43(1): 1—21.9.Hernick M., Fierke C. Zinc hydrolases: the mechanisms of zinc-dependent deacetylases. Arch Biochem Biophys 2005; 433: 71—84.10.Berg J.M., Shi Y. The galvanization of biology: a growing appreciation for the roles of zinc. Science 1996; 271: 1081—5.11.Sternlicht M., Werb Z. How matrix metalloproteinases regulate cell behavior. Annu Rev Cell Dev Biol 2001; 17: 463—516.12.Schwartz J.R., Marsh R.G., Draelos Z.D. Zinc and Skin Health: Overview of Physiology and Pharmacology. Dermatol Surg 2005; 31: 837—847.13.Kazimierczak W., Maslinski C. The mechanism of the inhibitory action of zinc on histamine release from mast cells by compound 48/80. Agents Actions 1974; 3/4: 203—4.14.Hogberg B., Uvnas B. Further observations on the disruption of rat mesentery mast cells caused by compound 48/80, antigen-antibody reaction, lecithin-ase A and decylamine. Acta Physiol Scand 1960; 48: 133—45.15.Marone G., Columo A., De Paulis R. et al. Physiological concentrations of zinc inhibit the release of histamine from human basophils and lung mast cells. Agents Actions 1986; 18: 103—6.16.Chvapil M. Effect of zinc on cells and biomembranes. Med Clin North Am 1976; 60: 799—812.17.Karl L., Chvapil M., Zukoski C. Effect of zinc on the viability and phagocytic capacity of peritoneal macrophages. Proc Soc Exp Biol Med 1973; 142: 1123—7.18.Wirth J.
Annu Rev Cell Dev Biol 2001; 17: 463—516.12.Schwartz J.R., Marsh R.G., Draelos Z.D. Zinc and Skin Health: Overview of Physiology and Pharmacology. Dermatol Surg 2005; 31: 837—847.13.Kazimierczak W., Maslinski C. The mechanism of the inhibitory action of zinc on histamine release from mast cells by compound 48/80. Agents Actions 1974; 3/4: 203—4.14.Hogberg B., Uvnas B. Further observations on the disruption of rat mesentery mast cells caused by compound 48/80, antigen-antibody reaction, lecithin-ase A and decylamine. Acta Physiol Scand 1960; 48: 133—45.15.Marone G., Columo A., De Paulis R. et al. Physiological concentrations of zinc inhibit the release of histamine from human basophils and lung mast cells. Agents Actions 1986; 18: 103—6.16.Chvapil M. Effect of zinc on cells and biomembranes. Med Clin North Am 1976; 60: 799—812.17.Karl L., Chvapil M., Zukoski C. Effect of zinc on the viability and phagocytic capacity of peritoneal macrophages. Proc Soc Exp Biol Med 1973; 142: 1123—7.18.Wirth J.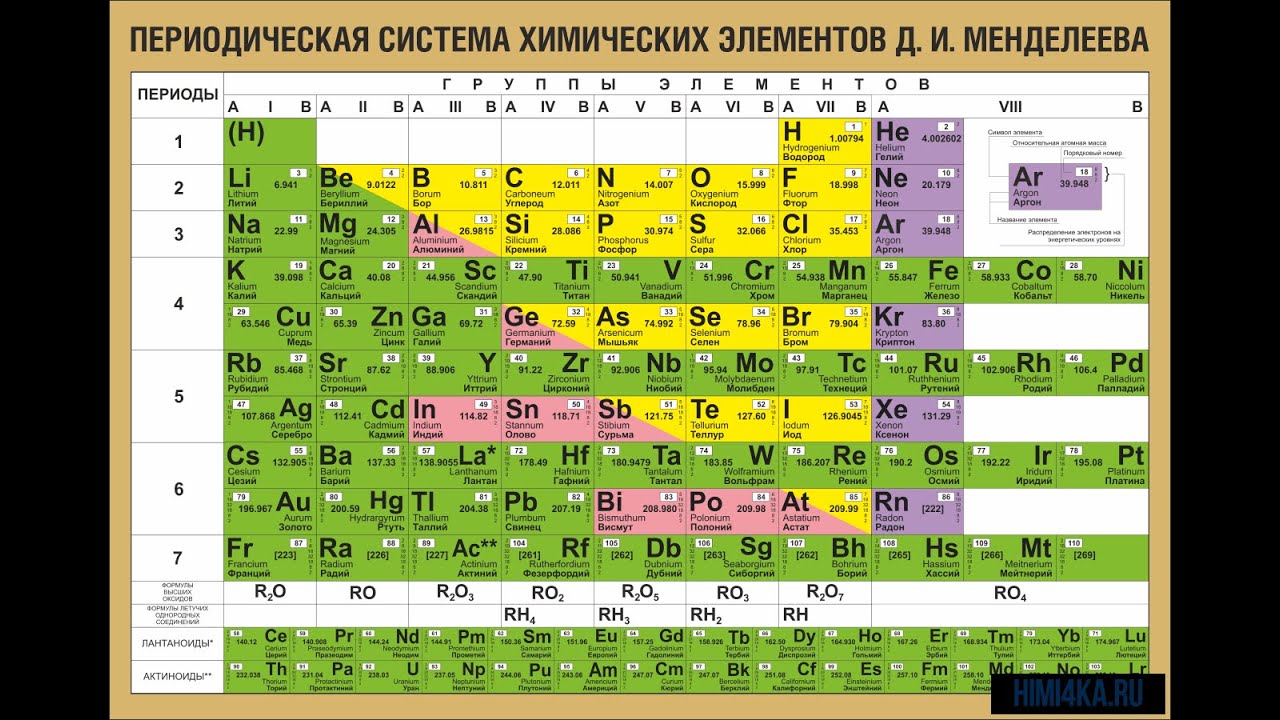 , Fraker P., Kierszenbaum F. Zinc requirement for macrophage function: effect of zinc deficiency on uptake and killing of a protozoan parasite. Immunology 1989; 68: 114—9.19.Salvin S., Harecker B.L., Pan L.X. et al. The effect of dietary zinc and prothymosin alpha on cellular immune responses of RF-J mice. Clin Immunol Immunopathol 1987; 43: 281—8.20.Singh K., Zaldi S.I., Raisuddin S. et al. Effect of zinc on immune functions and host resistance against infection and tumor challenge. Immunopharmacol Immunotoxicol 1992; 14: 813—40.21.Weston W., Huff J.C., Humbert J.R. et al. Zinc correction of defective chemotaxis in acrodermatitis entero-pathica. Arch Dermatol 1977; 113: 422—5.22.Briggs W.A., Pederson M.M., Manajan S.K. et al. Lymphocyte and granulocyte function in zinc-treated and zinc-deficient hemodialysis patients. Kidney Int 1982; 21: 827—32.23.Fernandes G., Nair M., Onoe K. et al. Impairment of cell-mediated immunity functions by dietary zinc deficiency in mice. Proc Natl Acad Sci U S A 1979; 76: 457—61.
, Fraker P., Kierszenbaum F. Zinc requirement for macrophage function: effect of zinc deficiency on uptake and killing of a protozoan parasite. Immunology 1989; 68: 114—9.19.Salvin S., Harecker B.L., Pan L.X. et al. The effect of dietary zinc and prothymosin alpha on cellular immune responses of RF-J mice. Clin Immunol Immunopathol 1987; 43: 281—8.20.Singh K., Zaldi S.I., Raisuddin S. et al. Effect of zinc on immune functions and host resistance against infection and tumor challenge. Immunopharmacol Immunotoxicol 1992; 14: 813—40.21.Weston W., Huff J.C., Humbert J.R. et al. Zinc correction of defective chemotaxis in acrodermatitis entero-pathica. Arch Dermatol 1977; 113: 422—5.22.Briggs W.A., Pederson M.M., Manajan S.K. et al. Lymphocyte and granulocyte function in zinc-treated and zinc-deficient hemodialysis patients. Kidney Int 1982; 21: 827—32.23.Fernandes G., Nair M., Onoe K. et al. Impairment of cell-mediated immunity functions by dietary zinc deficiency in mice. Proc Natl Acad Sci U S A 1979; 76: 457—61. 24.Allen J., Perri R.T., McClain C.J. et al. Alterations in human natural killer cell activity and monocyte cytotoxicity induced by zinc deficiency. J Lab Clin Med 1983; 102: 577—89.25.Nagase H., Visse R., Murphy G. Structure and function of matrix metalloproteinases and TIMPs. Cardio-vasc Res 2006; 69: 562—73.26.Lansdown A.B., Mirastschijski U., Stubbs N. et al. Zinc in wound healing: theoretical, experimental, and clinical aspects. Wound Repair Regen 2007; 15(1): 2—16.27.Gomis-Ruth F.X. Structural aspects of the metzincin clan of metalloendopeptidases. Mol Biotechnol 2003; 24: 157—202.28.Springman E.B., Nagase H., Birkedal-Hansen H., Van Wart H.E. Zinc content and function in human fibroblast collagenase. Biochemistry 1995; 34: 15713—20.29.Prasad A.S., Meftah S., Abdallah J. et al. Serum thymulin in human zinc deficiency. J Clin Invest 1988; 82: 1202—10.30.Moulder K., Steward M.W. Experimental zinc deficiency: effects on cellular responses and the affinity of humoral antibody. Clin Exp Immunol 1989; 77: 269—74.
24.Allen J., Perri R.T., McClain C.J. et al. Alterations in human natural killer cell activity and monocyte cytotoxicity induced by zinc deficiency. J Lab Clin Med 1983; 102: 577—89.25.Nagase H., Visse R., Murphy G. Structure and function of matrix metalloproteinases and TIMPs. Cardio-vasc Res 2006; 69: 562—73.26.Lansdown A.B., Mirastschijski U., Stubbs N. et al. Zinc in wound healing: theoretical, experimental, and clinical aspects. Wound Repair Regen 2007; 15(1): 2—16.27.Gomis-Ruth F.X. Structural aspects of the metzincin clan of metalloendopeptidases. Mol Biotechnol 2003; 24: 157—202.28.Springman E.B., Nagase H., Birkedal-Hansen H., Van Wart H.E. Zinc content and function in human fibroblast collagenase. Biochemistry 1995; 34: 15713—20.29.Prasad A.S., Meftah S., Abdallah J. et al. Serum thymulin in human zinc deficiency. J Clin Invest 1988; 82: 1202—10.30.Moulder K., Steward M.W. Experimental zinc deficiency: effects on cellular responses and the affinity of humoral antibody. Clin Exp Immunol 1989; 77: 269—74.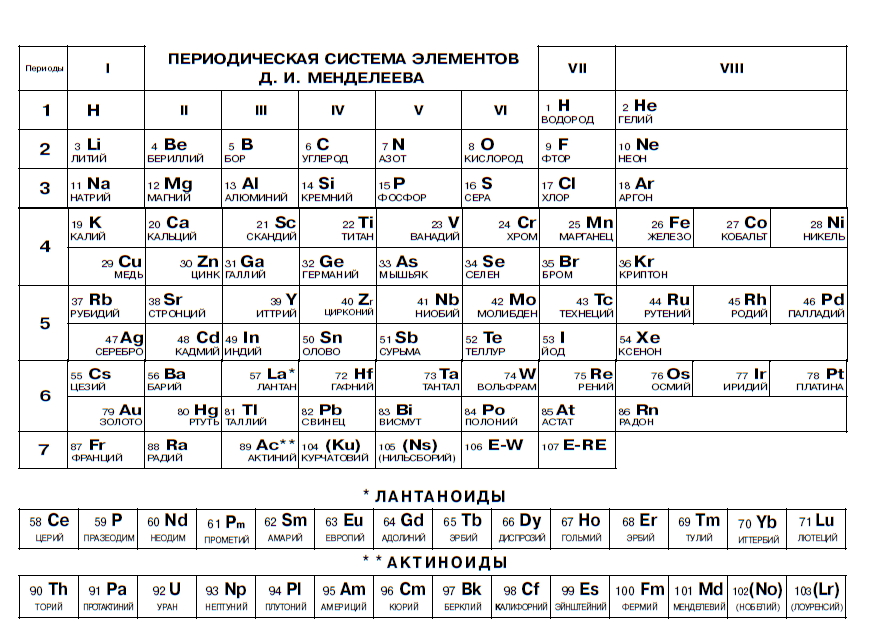 31.Cunningham-Rundles C., Cunningham-Rundles S., Iwata T. et al. Zinc deficiency, depressed thymic hormones, and T lymphocyte dysfunction in patients with hypogammaglobulinemia. Clin Immunol Immu-nopathol 1981; 21: 387—96.32.Cook-Mills J.M., Fraker P.J. Functional capacity of the residual lymphocytes in zinc deficient mice. Br J Nutr 1993; 69: 835-48.33.Salas M., Kirchner H. Induction of interferon-gamma in human leukocyte cultures stimulated by Zn2+. Clin Immunol Immunopathol 1987; 45: 139—42.34.Salgueiro M., Zubillaga M., Lysionek A et al. Zinc status and immune system relationship: a review. Biol Trace Elem Res 2000; 76: 193—205.35.Bao B., Prasad A.S., Beck FWJ, Bao G.W., Singh T., Ali S. et al. Intracellular free zinc up-regulates IFN-γ and T-bet essential for Th2 differentiation in Con-A stimulated HUT-78 cells. Biosci Biotechnol Res Commun 2011; 407: 703—7.36.Jarrousse V., Castex-Rizzi N., Khammari A. et al. Zinc salts inhibit in vitro Toll-like receptor 2 surface expression by keratinocytes.
31.Cunningham-Rundles C., Cunningham-Rundles S., Iwata T. et al. Zinc deficiency, depressed thymic hormones, and T lymphocyte dysfunction in patients with hypogammaglobulinemia. Clin Immunol Immu-nopathol 1981; 21: 387—96.32.Cook-Mills J.M., Fraker P.J. Functional capacity of the residual lymphocytes in zinc deficient mice. Br J Nutr 1993; 69: 835-48.33.Salas M., Kirchner H. Induction of interferon-gamma in human leukocyte cultures stimulated by Zn2+. Clin Immunol Immunopathol 1987; 45: 139—42.34.Salgueiro M., Zubillaga M., Lysionek A et al. Zinc status and immune system relationship: a review. Biol Trace Elem Res 2000; 76: 193—205.35.Bao B., Prasad A.S., Beck FWJ, Bao G.W., Singh T., Ali S. et al. Intracellular free zinc up-regulates IFN-γ and T-bet essential for Th2 differentiation in Con-A stimulated HUT-78 cells. Biosci Biotechnol Res Commun 2011; 407: 703—7.36.Jarrousse V., Castex-Rizzi N., Khammari A. et al. Zinc salts inhibit in vitro Toll-like receptor 2 surface expression by keratinocytes. Eur J Dermatol 2007; 17(6): 492—6.37.Weller R. Nitric oxide—a newly discovered chemical transmitter in human skin. Br J Dermatol 1997; 137: 665—72.38.Yamaoka J., Kume T., Akaike A., Miyachi Y. Suppressive effect of zinc ion on iNOS expression induced by interferon-gamma or tumor necrosis factor-alpha in murine keratinocytes. J Dermatol Sci 2000; 23(1): 27—35.39.Abou-Mohamed G., Papapetropoulos A., Catravas J.D. et al. Zn2+ inhibits nitric oxide formation in response to lipopolysaccharides: implications in its anti-inflammatory activity. Eur J Pharmacol 1998; 341: 265—72.40.Guéniche A., Viac J., Lizard G. et al. Protective effect of zinc on keratinocyte activation markers induced by interferon or nickel. Acta Derm Venereol 1995; 75: 19—23.41.Bray T.M., Bettger W.J. The physiological role of zinc as an antioxidant. Free Radic Biol Med 1990; 8: 281—91.42.Rostan E., DeBuus H.V., Madey D.L. et al. Evidence supporting zinc as an important antioxidant for skin. Int J Dermatol 2002; 41: 606—11.
Eur J Dermatol 2007; 17(6): 492—6.37.Weller R. Nitric oxide—a newly discovered chemical transmitter in human skin. Br J Dermatol 1997; 137: 665—72.38.Yamaoka J., Kume T., Akaike A., Miyachi Y. Suppressive effect of zinc ion on iNOS expression induced by interferon-gamma or tumor necrosis factor-alpha in murine keratinocytes. J Dermatol Sci 2000; 23(1): 27—35.39.Abou-Mohamed G., Papapetropoulos A., Catravas J.D. et al. Zn2+ inhibits nitric oxide formation in response to lipopolysaccharides: implications in its anti-inflammatory activity. Eur J Pharmacol 1998; 341: 265—72.40.Guéniche A., Viac J., Lizard G. et al. Protective effect of zinc on keratinocyte activation markers induced by interferon or nickel. Acta Derm Venereol 1995; 75: 19—23.41.Bray T.M., Bettger W.J. The physiological role of zinc as an antioxidant. Free Radic Biol Med 1990; 8: 281—91.42.Rostan E., DeBuus H.V., Madey D.L. et al. Evidence supporting zinc as an important antioxidant for skin. Int J Dermatol 2002; 41: 606—11. 43.Record I.R., Jannes M., Dreosti I.E. Protection by zinc against UVA and UVB-induced cellular and genomic damage in vivo and in vitro. Biol Trace Elem Res 1996; 53: 19—25.44.Richard M.J., Guiraud P., Leccia M.T. et al. Effect of zinc supplementation on resistance of cultured human skin fibroblasts toward oxidant stress. Biol Trace Elem Res 1993; 37: 187—99.45.Carraro C., Pathak M. Characterization of superoxide dismutase from mammalian skin epidermis. J Invest Dermatol 1988; 90: 31—6.46.Abel J., de Reuiter N. Inhibition of hydroxyl radicalgenerated DNA degradation by metallothionein. Toxicol Lett 1989; 47: 191—6.47.Soo C., Shaw W.W., Zhang X., Longaker M.T. et al. Differential expression of matrix metalloproteinases and their tissue-derived inhibitors in cutaneous wound repair. Plast Reconstr Surg 2000; 105: 638—47.48.Ravanti L., Kahari V.M. Matrix metalloproteinases in wound repair (review). Int J Mol Med 2000; 6: 391—407.49.Alpaslan G., Nakajima T., Takano Y. Extracellular alkaline phosphatase activity as a possible marker for wound healing: a preliminary report.
43.Record I.R., Jannes M., Dreosti I.E. Protection by zinc against UVA and UVB-induced cellular and genomic damage in vivo and in vitro. Biol Trace Elem Res 1996; 53: 19—25.44.Richard M.J., Guiraud P., Leccia M.T. et al. Effect of zinc supplementation on resistance of cultured human skin fibroblasts toward oxidant stress. Biol Trace Elem Res 1993; 37: 187—99.45.Carraro C., Pathak M. Characterization of superoxide dismutase from mammalian skin epidermis. J Invest Dermatol 1988; 90: 31—6.46.Abel J., de Reuiter N. Inhibition of hydroxyl radicalgenerated DNA degradation by metallothionein. Toxicol Lett 1989; 47: 191—6.47.Soo C., Shaw W.W., Zhang X., Longaker M.T. et al. Differential expression of matrix metalloproteinases and their tissue-derived inhibitors in cutaneous wound repair. Plast Reconstr Surg 2000; 105: 638—47.48.Ravanti L., Kahari V.M. Matrix metalloproteinases in wound repair (review). Int J Mol Med 2000; 6: 391—407.49.Alpaslan G., Nakajima T., Takano Y. Extracellular alkaline phosphatase activity as a possible marker for wound healing: a preliminary report.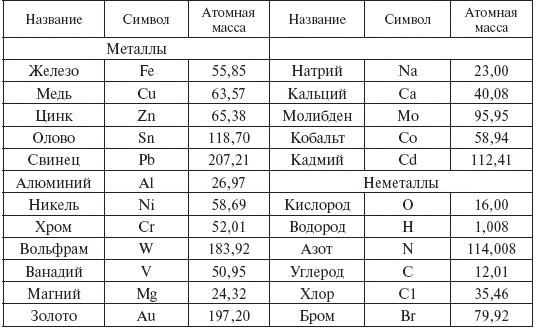 J Oral Maxillofac Surg 1997; 55: 56—62.50.Tenaud I., Leroy S., Chebassier N., Dreno B. Zinc, copper and manganese enhanced keratinocyte migration through a functional modulation of keratino-cyte integrins. Exp Dermatol 2000; 9: 407—16.51.Iwata M., Takebayashi T., Ohta H., Alcalde R.E. et al. Zinc accumulation and metallothionein gene expression in the proliferating epidermis during wound healing in mouse skin. Histochem Cell Biol 1999; 112: 283—90.52.Lansdown ABG, Sampson B., Rowe A. Sequential changes in trace metal, metallothionein and calmodulin concentrations in healing skin wounds. J Anat 1999; 195 (Part 3): 375—86.53.Savlov E.D., Strain W.H., Huegin F. Radiozinc studies in experimental wound healing. J Surg Res 1962; 2: 209—12.54.Mirastschijski U., Haaksma C.J., Tomasek J.J., Agren M.S. Matrix metalloproteinase inhibitor GM 6001 attenuates keratinocyte migration, contraction and myofibroblast formation in skin wounds. Exp Cell Res 2004; 299: 465—75.55.Soderberg T., Agren M., Tengrup I.
J Oral Maxillofac Surg 1997; 55: 56—62.50.Tenaud I., Leroy S., Chebassier N., Dreno B. Zinc, copper and manganese enhanced keratinocyte migration through a functional modulation of keratino-cyte integrins. Exp Dermatol 2000; 9: 407—16.51.Iwata M., Takebayashi T., Ohta H., Alcalde R.E. et al. Zinc accumulation and metallothionein gene expression in the proliferating epidermis during wound healing in mouse skin. Histochem Cell Biol 1999; 112: 283—90.52.Lansdown ABG, Sampson B., Rowe A. Sequential changes in trace metal, metallothionein and calmodulin concentrations in healing skin wounds. J Anat 1999; 195 (Part 3): 375—86.53.Savlov E.D., Strain W.H., Huegin F. Radiozinc studies in experimental wound healing. J Surg Res 1962; 2: 209—12.54.Mirastschijski U., Haaksma C.J., Tomasek J.J., Agren M.S. Matrix metalloproteinase inhibitor GM 6001 attenuates keratinocyte migration, contraction and myofibroblast formation in skin wounds. Exp Cell Res 2004; 299: 465—75.55.Soderberg T., Agren M., Tengrup I. , Hallmans G., Banck G. The effects of an occlusive zinc medicated dressing on the bacterial flora in excised wounds in the rat. Infection 1989; 17: 81—5.56.Fox C.L. Jr, Rao T.N., Azmeth R. et al. Comparative evaluation of zinc sulfadiazine and silver sulfadiazine in burn wound infection. J Burn Care Rehabil 1990; 11: 112—7.57.Bojar R., Eady E., Jones C. et al. Inhibition of erythromycin-resistant propionibacteria on the skin of acne patients by topical erythromycin with and without zinc. Br J Dermatol 1994; 130: 329—36.58.Rebello T., Atherton D., Holden C. The effect of oral zinc administration on sebum free fatty acids in acne vulgaris. Acta Derm Venereol. 1986; 66: 305—10.59.Scrimshaw N.S., Young V.R. The requirements of human nutrition. Sci Am 1976; 235: 50—64.60.Fox SMR. The status of zinc in human nutrition. World Rev Nutr Diet 1970; 12: 208—26.61.Osis D., Kramer L., Wiatrowski E., Spencer H. Dietary zinc intake in man. Am J Clin Nutr 1972; 25: 582—8.62.Murphy E., Willis B., Watt B.
, Hallmans G., Banck G. The effects of an occlusive zinc medicated dressing on the bacterial flora in excised wounds in the rat. Infection 1989; 17: 81—5.56.Fox C.L. Jr, Rao T.N., Azmeth R. et al. Comparative evaluation of zinc sulfadiazine and silver sulfadiazine in burn wound infection. J Burn Care Rehabil 1990; 11: 112—7.57.Bojar R., Eady E., Jones C. et al. Inhibition of erythromycin-resistant propionibacteria on the skin of acne patients by topical erythromycin with and without zinc. Br J Dermatol 1994; 130: 329—36.58.Rebello T., Atherton D., Holden C. The effect of oral zinc administration on sebum free fatty acids in acne vulgaris. Acta Derm Venereol. 1986; 66: 305—10.59.Scrimshaw N.S., Young V.R. The requirements of human nutrition. Sci Am 1976; 235: 50—64.60.Fox SMR. The status of zinc in human nutrition. World Rev Nutr Diet 1970; 12: 208—26.61.Osis D., Kramer L., Wiatrowski E., Spencer H. Dietary zinc intake in man. Am J Clin Nutr 1972; 25: 582—8.62.Murphy E., Willis B., Watt B. Provisional tables on the zinc content of foods. J Am Diet Assoc 1975; 66: 345—55.63.Prasad A.S. Zinc: an overview. Nutrition 1995; 11: 93—9.64.King J.C., Shames D.M., Woodhouse L.R. Zinc homeostasis in humans. J Nutr 2000; 130: 1360S—6S.65.Krebs N.E., Hambidge K.M. Zinc metabolism and homeostasis: the application of tracer techniques to human zinc physiology. Biometals 2001; 14: 397—412.66.Sandstrom B. Bioavailability of zinc. Eur J Clin Nutr 1997; 51 (Suppl. 1): S17—9.67.Wastney M.E., Aamodt R.L., Rumble W.F., Henkin R.I. Kinetic analysis of zinc metabolism and its regulation in normal humans. Am J Physiol 1986; 251: R398—408.68.Vallee B.L., Falchuk K.H. The biochemical basis of zinc physiology. Physiol Rev 1993; 73: 79—118.69.Chimienti F., Aouffen M., Favier A., Seve M. Zinc homeostasis-regulating proteins: new drug targets for triggering cell fate. Curr Drug Targets 2003; 4: 323—38.70.Michaelsson G., Ljunghall K., Danielson B.G. Zinc in epidermis and dermis in healthy subjects. Acta Derm Venereol 1980; 60: 295—9.
Provisional tables on the zinc content of foods. J Am Diet Assoc 1975; 66: 345—55.63.Prasad A.S. Zinc: an overview. Nutrition 1995; 11: 93—9.64.King J.C., Shames D.M., Woodhouse L.R. Zinc homeostasis in humans. J Nutr 2000; 130: 1360S—6S.65.Krebs N.E., Hambidge K.M. Zinc metabolism and homeostasis: the application of tracer techniques to human zinc physiology. Biometals 2001; 14: 397—412.66.Sandstrom B. Bioavailability of zinc. Eur J Clin Nutr 1997; 51 (Suppl. 1): S17—9.67.Wastney M.E., Aamodt R.L., Rumble W.F., Henkin R.I. Kinetic analysis of zinc metabolism and its regulation in normal humans. Am J Physiol 1986; 251: R398—408.68.Vallee B.L., Falchuk K.H. The biochemical basis of zinc physiology. Physiol Rev 1993; 73: 79—118.69.Chimienti F., Aouffen M., Favier A., Seve M. Zinc homeostasis-regulating proteins: new drug targets for triggering cell fate. Curr Drug Targets 2003; 4: 323—38.70.Michaelsson G., Ljunghall K., Danielson B.G. Zinc in epidermis and dermis in healthy subjects. Acta Derm Venereol 1980; 60: 295—9. 71.Molokhia M.M., Portnoy B. Neutron activation analysis of trace elements in skin. 3. Zinc in normal skin. Br J Dermatol 1969; 81: 759—62.72.Lansdown ABG. Calcium: a potential central regulator in wound healing in the skin. Wound Repair Regen 2002; 10: 271—85.73.Forslind B., Lindberg M., Roomans G.M., Pallon J., Werner-Linde Y. Aspects on the physiology of human skin: studies using particle probe analysis. Microsc Res Tech 1997; 38: 373—86.74.Heng M.K., Song M.K., Heng M.C. Reciprocity between tissue calmodulin and cAMP levels: modulation by excess zinc. Br J Dermatol 1993; 129: 280—5.75.Lengyel I., Fieuw-Makaroff S., Hall A.L. et al. Modulation of the phosphorylation and activity of calcium/calmodulin-dependent protein kinase II by zinc. J Neurochem 2000; 75: 594—605.76.Henkin R.I., Schecter P.J., Friedewald W.T. et al. A double blind study of the effects of zinc sulfate on taste and smell dysfunction. Am J Med Sci 1976; 272: 285—99.77.Gallo R.L., Dorschner R.A., Takashima S., et al. Endothelial cell surface alkaline phosphatase activity is induced by IL-6 released during wound repair.
71.Molokhia M.M., Portnoy B. Neutron activation analysis of trace elements in skin. 3. Zinc in normal skin. Br J Dermatol 1969; 81: 759—62.72.Lansdown ABG. Calcium: a potential central regulator in wound healing in the skin. Wound Repair Regen 2002; 10: 271—85.73.Forslind B., Lindberg M., Roomans G.M., Pallon J., Werner-Linde Y. Aspects on the physiology of human skin: studies using particle probe analysis. Microsc Res Tech 1997; 38: 373—86.74.Heng M.K., Song M.K., Heng M.C. Reciprocity between tissue calmodulin and cAMP levels: modulation by excess zinc. Br J Dermatol 1993; 129: 280—5.75.Lengyel I., Fieuw-Makaroff S., Hall A.L. et al. Modulation of the phosphorylation and activity of calcium/calmodulin-dependent protein kinase II by zinc. J Neurochem 2000; 75: 594—605.76.Henkin R.I., Schecter P.J., Friedewald W.T. et al. A double blind study of the effects of zinc sulfate on taste and smell dysfunction. Am J Med Sci 1976; 272: 285—99.77.Gallo R.L., Dorschner R.A., Takashima S., et al. Endothelial cell surface alkaline phosphatase activity is induced by IL-6 released during wound repair. J Invest Dermatol 1997; 109: 597—603.78.Jones P.W., Williams D.R. The use and role of zinc and its compounds in wound healing. Met Ions Biol Syst 2004; 41: 139—83.79.Kury S., Dreno B., Bezieau S., Giraudet S. et al. Identification of SLC39A4, a gene involved in acrodermatitis enteropathica. Nat Genet 2002; 31: 239—40.80.Lansdown ABG. Interspecies variations in response to topical application of selected zinc compounds. Food Chem Toxicol 1991; 29: 57—64.81.Rosentul M.A., Розентул М.А. General therapy of skin diseases. М.,1952. [Общая терапия кожных болезней.М., 1952; 376.]82.Krasnoselskich T.V., Moshkalova I.A., Mikheev U.N. Basics topical treatment of skin diseases. Vasculitis of the skin. / Editor Ye.V. Sokolovsky. SPb: SO-TIS.1999. [Основы наружной терапии болезней кожи. Васкулиты кожи. Под ред. Е.В. Соколовского. СПб: Сотис, 1999; 189.]83.Sambandan D.R., Ratner D. Sunscreens: An overview and update. J Am Acad Dermatol 2011; 64: 748—58.84.Scribner M.D. Zinc sulfate and axillary perspiration odor.
J Invest Dermatol 1997; 109: 597—603.78.Jones P.W., Williams D.R. The use and role of zinc and its compounds in wound healing. Met Ions Biol Syst 2004; 41: 139—83.79.Kury S., Dreno B., Bezieau S., Giraudet S. et al. Identification of SLC39A4, a gene involved in acrodermatitis enteropathica. Nat Genet 2002; 31: 239—40.80.Lansdown ABG. Interspecies variations in response to topical application of selected zinc compounds. Food Chem Toxicol 1991; 29: 57—64.81.Rosentul M.A., Розентул М.А. General therapy of skin diseases. М.,1952. [Общая терапия кожных болезней.М., 1952; 376.]82.Krasnoselskich T.V., Moshkalova I.A., Mikheev U.N. Basics topical treatment of skin diseases. Vasculitis of the skin. / Editor Ye.V. Sokolovsky. SPb: SO-TIS.1999. [Основы наружной терапии болезней кожи. Васкулиты кожи. Под ред. Е.В. Соколовского. СПб: Сотис, 1999; 189.]83.Sambandan D.R., Ratner D. Sunscreens: An overview and update. J Am Acad Dermatol 2011; 64: 748—58.84.Scribner M.D. Zinc sulfate and axillary perspiration odor. Arch Dermatol 1977; 113: 1302.85.Chairig A., Froebe C., Simone A. et al. Inhibitor of odor-producing axillary bacterial exoenzymes. J Soc Cosmet Chem 1991; 42: 133—45.86.Hostynek J.J. Factors determining percutaneous metal absorption. Food Chem Toxicol 2003; 41: 327—45.87.Pirot F., Millet J., Kalia Y.N., Humbert P. In vitro study of percutaneous absorption, cutaneous bioavailability and bioequivalence of zinc and copper from five topical formulations. Skin Pharmacol 1996; 9: 259—69.88.Agren M.S. Percutaneous absorption of zinc from zinc oxide applied topically to intact skin in man. Derma-tologica 1990; 180: 36—9.89.Grasso P., Lansdown ABG. Methods of measuring and factors affecting percutaneous absorption. Int J Cosmet Sci 1972; 23: 481—521.90.Scott A. The behaviour of radioactive mercury and zinc after application to normal and abnormal skin. Br J Dermatol 1959; 71: 181—9.91.Agren M.S. Influence of two vehicles for zinc oxide on zinc absorption through intact skin and wounds. Acta Derm Venereol 1991; 71: 153—6.
Arch Dermatol 1977; 113: 1302.85.Chairig A., Froebe C., Simone A. et al. Inhibitor of odor-producing axillary bacterial exoenzymes. J Soc Cosmet Chem 1991; 42: 133—45.86.Hostynek J.J. Factors determining percutaneous metal absorption. Food Chem Toxicol 2003; 41: 327—45.87.Pirot F., Millet J., Kalia Y.N., Humbert P. In vitro study of percutaneous absorption, cutaneous bioavailability and bioequivalence of zinc and copper from five topical formulations. Skin Pharmacol 1996; 9: 259—69.88.Agren M.S. Percutaneous absorption of zinc from zinc oxide applied topically to intact skin in man. Derma-tologica 1990; 180: 36—9.89.Grasso P., Lansdown ABG. Methods of measuring and factors affecting percutaneous absorption. Int J Cosmet Sci 1972; 23: 481—521.90.Scott A. The behaviour of radioactive mercury and zinc after application to normal and abnormal skin. Br J Dermatol 1959; 71: 181—9.91.Agren M.S. Influence of two vehicles for zinc oxide on zinc absorption through intact skin and wounds. Acta Derm Venereol 1991; 71: 153—6. 92.Gamer A.O., Leibold E., van Ravenzwaay B. The in vitro absorption of microfine zinc oxide and titanium dioxide through porcine skin. Toxicol In Vitro 2006; 20: 301—7.93.Gorodetsky R., Andriessen A., Polyansky I., Vexler A. Measurement of breast skin viscoelasticity and a pilot study on the potential radioprotective effect of a zinc-based cream. J Wound Care 1999; 8: 514—8.94.Hallmans G. Absorption of topically applied zinc and changes in zinc metabolism during wound healing. An experimental and clinical investigation. Acta Derm Venereol Suppl (Stockh) 1978; 58: 1—36.95.Keen C.L., Hurley L.S. Zinc absorption through skin: correction of zinc deficiency in the rat. Am J Clin Nutr 1977; 30: 528—30.96.Gang R.K. Adhesive zinc tape in burns: results of a clinical trial. Burns 1980; 7: 322—5.97.Nitzan Y.B., Cohen A.D. Zinc in skin pathology and care. J Dermatol Treat 2006; 17: 205—210.98.Marks R., Pearse A.D., Walker A.P. The effects of a shampoo containing zinc pyrithione on the control of dandruff.
92.Gamer A.O., Leibold E., van Ravenzwaay B. The in vitro absorption of microfine zinc oxide and titanium dioxide through porcine skin. Toxicol In Vitro 2006; 20: 301—7.93.Gorodetsky R., Andriessen A., Polyansky I., Vexler A. Measurement of breast skin viscoelasticity and a pilot study on the potential radioprotective effect of a zinc-based cream. J Wound Care 1999; 8: 514—8.94.Hallmans G. Absorption of topically applied zinc and changes in zinc metabolism during wound healing. An experimental and clinical investigation. Acta Derm Venereol Suppl (Stockh) 1978; 58: 1—36.95.Keen C.L., Hurley L.S. Zinc absorption through skin: correction of zinc deficiency in the rat. Am J Clin Nutr 1977; 30: 528—30.96.Gang R.K. Adhesive zinc tape in burns: results of a clinical trial. Burns 1980; 7: 322—5.97.Nitzan Y.B., Cohen A.D. Zinc in skin pathology and care. J Dermatol Treat 2006; 17: 205—210.98.Marks R., Pearse A.D., Walker A.P. The effects of a shampoo containing zinc pyrithione on the control of dandruff. Br J Dermatol 1985; 112: 415—22.99.Warner R.R., Schwartz J.R., Boissy Y. et al. Dandruff has an altered stratum corneum ultrastructure that is improved with zinc pyrithione shampoo. J Am Acad Dermatol 2001; 45: 897—903.100.Pittelkow M.R., Benson L.M., Naylor S., Tomlinson A.J. Detection of corticosteroid in an over-the-counter product. JAMA. 1998; 280: 327—328.101.Kupic I.F. FDA warns consumers not to use Skin Cap. HHS News: United States Department of Health and Human Services; 1997.102.FDA Import Alert 61-06: «Detention Without Physical Examination of Skin Cap Spray, Shampoo And Cream» 10/02/2009 http://www.accessdata.fda.gov/ cms_ia/importalert_165.html103.Swanson D.L., Pittelkow M.R., Benson L.M. et al. Deja Vu All Over Again: Skin Cap Still Contains a High-Potency Glucocorticosteroid. Arch Dermatol 2005; 141: 801—803.104.Prasad A., Halsted J., Nadimi M. Syndrome of iron deficiency anemia, hepatosplenomegaly, hypogonadism, dwarfism and geophagia. Am J Med. 1961; 31: 532—46.105.Brown M.
Br J Dermatol 1985; 112: 415—22.99.Warner R.R., Schwartz J.R., Boissy Y. et al. Dandruff has an altered stratum corneum ultrastructure that is improved with zinc pyrithione shampoo. J Am Acad Dermatol 2001; 45: 897—903.100.Pittelkow M.R., Benson L.M., Naylor S., Tomlinson A.J. Detection of corticosteroid in an over-the-counter product. JAMA. 1998; 280: 327—328.101.Kupic I.F. FDA warns consumers not to use Skin Cap. HHS News: United States Department of Health and Human Services; 1997.102.FDA Import Alert 61-06: «Detention Without Physical Examination of Skin Cap Spray, Shampoo And Cream» 10/02/2009 http://www.accessdata.fda.gov/ cms_ia/importalert_165.html103.Swanson D.L., Pittelkow M.R., Benson L.M. et al. Deja Vu All Over Again: Skin Cap Still Contains a High-Potency Glucocorticosteroid. Arch Dermatol 2005; 141: 801—803.104.Prasad A., Halsted J., Nadimi M. Syndrome of iron deficiency anemia, hepatosplenomegaly, hypogonadism, dwarfism and geophagia. Am J Med. 1961; 31: 532—46.105.Brown M. A., Thom J.V., Orth G.L. et al. Food poisoning involving zinc contamination. Arch Environ Health 1964; 8: 657—660.106.Van Campen D.R. Copper interference with the intestinal absorption of zinc-65 by rats. J Nutr 1969; 97: 104—108.107.Myung S.J., Yang S.K., Jung H.Y. et al. Zinc deficiency manifested by dermatitis and visual dysfunction in a patient with Crohn’s disease. J Gastroenterol 1998; 33: 876—9.108.Narkewicz M.R., Krebs N., Karrer F. et al. Correction of hypozincemia following liver transplantation in children is associated with reduced urinary zinc loss. Hepatology 1999; 29: 830—3.109.Prasad A.S., Miale A. Jr, Farid Z. et al. Zinc metabolism in patients with the syndrome of iron deficiency anemia, hepatosplenomegaly, dwarfism, and hypog-nadism. J Lab Clin Med 1963; 61: 537—49.110.Dreno B., Trossaert M., Boiteau H.L. et al. Zinc salts effects on granulocyte zinc concentration and chemotaxis in acne patients. Acta Derm Venereol 1992; 72: 250—252.111.Danbolt N., Closs K. Akrodermatitis enteropathica.
A., Thom J.V., Orth G.L. et al. Food poisoning involving zinc contamination. Arch Environ Health 1964; 8: 657—660.106.Van Campen D.R. Copper interference with the intestinal absorption of zinc-65 by rats. J Nutr 1969; 97: 104—108.107.Myung S.J., Yang S.K., Jung H.Y. et al. Zinc deficiency manifested by dermatitis and visual dysfunction in a patient with Crohn’s disease. J Gastroenterol 1998; 33: 876—9.108.Narkewicz M.R., Krebs N., Karrer F. et al. Correction of hypozincemia following liver transplantation in children is associated with reduced urinary zinc loss. Hepatology 1999; 29: 830—3.109.Prasad A.S., Miale A. Jr, Farid Z. et al. Zinc metabolism in patients with the syndrome of iron deficiency anemia, hepatosplenomegaly, dwarfism, and hypog-nadism. J Lab Clin Med 1963; 61: 537—49.110.Dreno B., Trossaert M., Boiteau H.L. et al. Zinc salts effects on granulocyte zinc concentration and chemotaxis in acne patients. Acta Derm Venereol 1992; 72: 250—252.111.Danbolt N., Closs K. Akrodermatitis enteropathica. Acta Derm Venereol. 1942; 23: 127—69.112.Barnes P., Moynahan E. Zinc deficiency in acrodermatitis enteropathica: multiple dietary intolerance treated with synthetic diet. Proc R Soc Med 1973; 66: 327—9.113.Kury S., Dreno B., Bezieau S. et al. Identification of SLC39A4, a gene involved in acrodermatitis entero-pathica. Nat Genet. 2002; 31: 239—40.114.Moynahan E.J. Letter: acrodermatitis enteropathica: a lethal inherited human zinc-deficiency disorder. Lancet 1974; 2: 399—400.115.Braun O.H., Heilmann K., Pauli W. et al. Acrodermatitis enteropathica: recent findings concerning clinical features, pathogenesis, diagnosis and therapy. Eur J Pediatr 1976; 121: 247—61.116.Borroni G., Brazzelli V., Vignati G. et al. Bullous lesions in acrodermatitis enteropathica. Histopathologic findings regarding two patients. Am J Derma-topathol 1992; 14: 304—9.117.Sugimoto Y., Lopez-Solache I., Labrie F. et al. Cations inhibit specifically type I 5a-reductase found in human skin. J Invest Dermatol 1995; 104: 775—8.
Acta Derm Venereol. 1942; 23: 127—69.112.Barnes P., Moynahan E. Zinc deficiency in acrodermatitis enteropathica: multiple dietary intolerance treated with synthetic diet. Proc R Soc Med 1973; 66: 327—9.113.Kury S., Dreno B., Bezieau S. et al. Identification of SLC39A4, a gene involved in acrodermatitis entero-pathica. Nat Genet. 2002; 31: 239—40.114.Moynahan E.J. Letter: acrodermatitis enteropathica: a lethal inherited human zinc-deficiency disorder. Lancet 1974; 2: 399—400.115.Braun O.H., Heilmann K., Pauli W. et al. Acrodermatitis enteropathica: recent findings concerning clinical features, pathogenesis, diagnosis and therapy. Eur J Pediatr 1976; 121: 247—61.116.Borroni G., Brazzelli V., Vignati G. et al. Bullous lesions in acrodermatitis enteropathica. Histopathologic findings regarding two patients. Am J Derma-topathol 1992; 14: 304—9.117.Sugimoto Y., Lopez-Solache I., Labrie F. et al. Cations inhibit specifically type I 5a-reductase found in human skin. J Invest Dermatol 1995; 104: 775—8. 118.Stamatiadis D., Bulteau-Portois M.C., Mowszowicz L. Inhibition of 5a-reductase activity in human skin by zinc and azelaic acid. Br J Dermatol 1988; 119: 627—32.119.Fitzherbert J. Zinc deficiency in acne vulgaris. Med J Aust. 1977; 2(20): 685—6.120.Michaelsson G. Zinc therapy in acrodermatitis enteropathica. Acta Derm Venereol. 1974; 54: 377—81.121.Hillstrom L., Pettersson L., Hellbe L. et al. Comparison of oral treatment with zinc sulphate and placebo in acne vulgaris. Br J Dermatol. 1977; 97: 681—4.122.Goransson K., Liden S., Odsell L. Oral zinc in acne vulgaris: a clinical and methodological study. Acta Derm Venereol. 1978; 58: 443—8.123.Verma K., Saini A., Dhamija S. Oral zinc sulphate therapy in acne vulgaris: a double-blind trial. Acta Derm Venereol. 1980; 60: 337—40.124.Orris L., Shalita A., Sibulkin D. et al. Oral zinc therapy of acne. Absorption and clinical effect. Arch Dermatol. 1978; 114: 1018—20.125.Weimar V., Puhl S., Smith W., tenBroeke J. Zinc sulfate in acne vulgaris.
118.Stamatiadis D., Bulteau-Portois M.C., Mowszowicz L. Inhibition of 5a-reductase activity in human skin by zinc and azelaic acid. Br J Dermatol 1988; 119: 627—32.119.Fitzherbert J. Zinc deficiency in acne vulgaris. Med J Aust. 1977; 2(20): 685—6.120.Michaelsson G. Zinc therapy in acrodermatitis enteropathica. Acta Derm Venereol. 1974; 54: 377—81.121.Hillstrom L., Pettersson L., Hellbe L. et al. Comparison of oral treatment with zinc sulphate and placebo in acne vulgaris. Br J Dermatol. 1977; 97: 681—4.122.Goransson K., Liden S., Odsell L. Oral zinc in acne vulgaris: a clinical and methodological study. Acta Derm Venereol. 1978; 58: 443—8.123.Verma K., Saini A., Dhamija S. Oral zinc sulphate therapy in acne vulgaris: a double-blind trial. Acta Derm Venereol. 1980; 60: 337—40.124.Orris L., Shalita A., Sibulkin D. et al. Oral zinc therapy of acne. Absorption and clinical effect. Arch Dermatol. 1978; 114: 1018—20.125.Weimar V., Puhl S., Smith W., tenBroeke J. Zinc sulfate in acne vulgaris. Arch Dermatol. 1978; 114: 1776—8.126.Cunliffe W. Unacceptable side-effects of oral zinc sulphate in the treatment of acne vulgaris. Br J Dermatol. 1979;101:363.127.Meynadier J. Efficacy and safety study of two zinc gluconate regimens in the treatment of inflammatory acne. Eur J Dermatol 2000; 10: 269—273.128.Dreno B., Amblard P., Agache P., Sirot S., Litoux P. Low doses of zinc gluconate for inflammatory acne. Acta Derm Venereol Suppl (Stockh). 1989; 69: 541—3.129.Michaelsson G., Juhlin L., Ljunghall K. A doubleblind study of the effect of zinc and oxytetracycline in acne vulgaris. Br J Dermatol 1977; 97: 561—566.130.Revuz J, Amblard P., Dreno B. et al. Efficacite’ du gluconate de zinc dans le traitement de l’acne’ inflammatoire. Abstr Dermatol 1990; 77: 2—4.131.Cunliffe W.J., Burke B., Dodman B. et al. A doubleblind trial of a zinc sulphate/citrate complex and tetracycline in the treatment of acne vulgaris. Br J Dermatol 1979; 101: 321—325.132.Dreno B., Moyse D., Alirezai M. et al. Multicenter randomized comparative double-blind controlled clinical trial of the safety and efficacy of zinc gluconate versus minocycline hydrochloride in the treatment of inflammatory acne vulgaris.
Arch Dermatol. 1978; 114: 1776—8.126.Cunliffe W. Unacceptable side-effects of oral zinc sulphate in the treatment of acne vulgaris. Br J Dermatol. 1979;101:363.127.Meynadier J. Efficacy and safety study of two zinc gluconate regimens in the treatment of inflammatory acne. Eur J Dermatol 2000; 10: 269—273.128.Dreno B., Amblard P., Agache P., Sirot S., Litoux P. Low doses of zinc gluconate for inflammatory acne. Acta Derm Venereol Suppl (Stockh). 1989; 69: 541—3.129.Michaelsson G., Juhlin L., Ljunghall K. A doubleblind study of the effect of zinc and oxytetracycline in acne vulgaris. Br J Dermatol 1977; 97: 561—566.130.Revuz J, Amblard P., Dreno B. et al. Efficacite’ du gluconate de zinc dans le traitement de l’acne’ inflammatoire. Abstr Dermatol 1990; 77: 2—4.131.Cunliffe W.J., Burke B., Dodman B. et al. A doubleblind trial of a zinc sulphate/citrate complex and tetracycline in the treatment of acne vulgaris. Br J Dermatol 1979; 101: 321—325.132.Dreno B., Moyse D., Alirezai M. et al. Multicenter randomized comparative double-blind controlled clinical trial of the safety and efficacy of zinc gluconate versus minocycline hydrochloride in the treatment of inflammatory acne vulgaris. Dermatology 2001; 203: 135—140.133.Duteil L., Queille-Roussel C., Ortonne J.P. Assessment of the photosensitization potential of zinc gluconate. Ann Dermatol Venereol 2005; 132: 219—224.134.Dreno B., Blouin E. Acne, pregnant women and zinc salts: a literature review. Ann Dermatol Venereol 2008; 135: 27—33.135.Cochran R., Tucker S., Flannigan S. Topical zinc therapy for acne vulgaris. Int J Dermatol 1985; 24: 188—90.136.Illés J., Javor A., Szijartó E. Zinc-hyaluronate: ana original organotherapeutic compound of Gedeon Richter Ltd. Acta Pharm Hung. 2002; 72(1): 15—24.137.Instruction on medical application of a preparation of Zinerit. [Инструкция по медицинскому применению препарата Зинерит П №013569/01110309.]138.Dreno B., Foulc P., Reynaud A. et al. Effect of zinc gluconate on propionibacterium acnes resistance to erythromycin in patients with inflammatory acne: in vitro and in vivo study. Eur J Dermatol 2005; 15 (3): 152—5.139.Holland K.T., Bojar R.A., Cunliffe W.J. et al. The effect of zinc and erythromycin on the growth of erythromycin-resistant and erythromycin-sensitive isolates of Propionibacterium acnes: an in-vitro study.
Dermatology 2001; 203: 135—140.133.Duteil L., Queille-Roussel C., Ortonne J.P. Assessment of the photosensitization potential of zinc gluconate. Ann Dermatol Venereol 2005; 132: 219—224.134.Dreno B., Blouin E. Acne, pregnant women and zinc salts: a literature review. Ann Dermatol Venereol 2008; 135: 27—33.135.Cochran R., Tucker S., Flannigan S. Topical zinc therapy for acne vulgaris. Int J Dermatol 1985; 24: 188—90.136.Illés J., Javor A., Szijartó E. Zinc-hyaluronate: ana original organotherapeutic compound of Gedeon Richter Ltd. Acta Pharm Hung. 2002; 72(1): 15—24.137.Instruction on medical application of a preparation of Zinerit. [Инструкция по медицинскому применению препарата Зинерит П №013569/01110309.]138.Dreno B., Foulc P., Reynaud A. et al. Effect of zinc gluconate on propionibacterium acnes resistance to erythromycin in patients with inflammatory acne: in vitro and in vivo study. Eur J Dermatol 2005; 15 (3): 152—5.139.Holland K.T., Bojar R.A., Cunliffe W.J. et al. The effect of zinc and erythromycin on the growth of erythromycin-resistant and erythromycin-sensitive isolates of Propionibacterium acnes: an in-vitro study. Br J Dermatol 1992; 126(5): 505—9.140.van Hoogdalem E.J., Terpstra I.J., Baven A.L. Evaluation of the effect of zinc acetate on the stratum corneum penetration kinetics of erythromycin in healthy male volunteers. Skin Pharmacol 1996; 9(2): 104—10.141.Strauss J.S., Stranieri A.M. Acne treatment with topical erythromycin and zinc: Effect on Propionibacterium acnes and free fatty acid composition. J Am Acad Dermatol 1984; 11(1): 86—89.142.Piérard-Franchimont C., Goffin V., Visser J.N. и соавт. A double-blind controlled evaluation of the sebosuppressive activity of topical erythromycin-zinc complex. Eur J Clin Pharmacol 1995; 49(1—2): 57—60.143.Schachner L., Pestana A., Kittles C. A clinical trial comparing the safety and efficacy of a topical eryth-romycin-zinc formulation with a topical clindamycin formulation. J Am Acad Dermatol. 1990; 22(3): 489—95.144.Habbema L., Koopmans B., Menke H.E. et al. A 4% erythromycin and zinc combination (Zineryt) versus 2% erythromycin (Eryderm) in acne vulgaris: a randomized, double-blind comparative study.
Br J Dermatol 1992; 126(5): 505—9.140.van Hoogdalem E.J., Terpstra I.J., Baven A.L. Evaluation of the effect of zinc acetate on the stratum corneum penetration kinetics of erythromycin in healthy male volunteers. Skin Pharmacol 1996; 9(2): 104—10.141.Strauss J.S., Stranieri A.M. Acne treatment with topical erythromycin and zinc: Effect on Propionibacterium acnes and free fatty acid composition. J Am Acad Dermatol 1984; 11(1): 86—89.142.Piérard-Franchimont C., Goffin V., Visser J.N. и соавт. A double-blind controlled evaluation of the sebosuppressive activity of topical erythromycin-zinc complex. Eur J Clin Pharmacol 1995; 49(1—2): 57—60.143.Schachner L., Pestana A., Kittles C. A clinical trial comparing the safety and efficacy of a topical eryth-romycin-zinc formulation with a topical clindamycin formulation. J Am Acad Dermatol. 1990; 22(3): 489—95.144.Habbema L., Koopmans B., Menke H.E. et al. A 4% erythromycin and zinc combination (Zineryt) versus 2% erythromycin (Eryderm) in acne vulgaris: a randomized, double-blind comparative study. Br J Dermatol. 1989; 121(4): 497—502.145.Chu A, Huber FJ, Plott RT. The comparative efficacy of benzoyl peroxide 5%/erythromycin 3% gel and erythromycin 4%/zinc 1.2% solution in the treatment of acne vulgaris. Br J Dermatol. 1997; 136(2): 235—8.146.Langner A., Sheehan-Dare R., Layton A. A randomized, single-blind comparison of topical clindamycin + benzoyl peroxide (Duac) and erythromycin + zinc acetate (Zineryt) in the treatment of mild to moderate facial acne vulgaris. J Eur Acad Dermatol Venereol. 2007; 21(3): 311—9.147.Feucht C.L., Allen B.S., Chalker D.K., Smith J.G. Jr. Topical erythromycin with zinc in acne. A doubleblind controlled study. J Am Acad Dermatol. 1980; 3(5): 483—91.148.Stainforth J., MacDonald-Hull S., Papworth-Smith J.W. et al. Single-blind comparison of topical erythromycin/ zinc lotion and oral minocycline in the treatment of acne vulgaris. J Dermatol Treat 1993; 4: 119—122.149.Сергеев А.Ю., Бурцева Г.Н., Сергеев В.Ю. Фармакоэпидемиология акне и анонимная оценка лечения пациентами.
Br J Dermatol. 1989; 121(4): 497—502.145.Chu A, Huber FJ, Plott RT. The comparative efficacy of benzoyl peroxide 5%/erythromycin 3% gel and erythromycin 4%/zinc 1.2% solution in the treatment of acne vulgaris. Br J Dermatol. 1997; 136(2): 235—8.146.Langner A., Sheehan-Dare R., Layton A. A randomized, single-blind comparison of topical clindamycin + benzoyl peroxide (Duac) and erythromycin + zinc acetate (Zineryt) in the treatment of mild to moderate facial acne vulgaris. J Eur Acad Dermatol Venereol. 2007; 21(3): 311—9.147.Feucht C.L., Allen B.S., Chalker D.K., Smith J.G. Jr. Topical erythromycin with zinc in acne. A doubleblind controlled study. J Am Acad Dermatol. 1980; 3(5): 483—91.148.Stainforth J., MacDonald-Hull S., Papworth-Smith J.W. et al. Single-blind comparison of topical erythromycin/ zinc lotion and oral minocycline in the treatment of acne vulgaris. J Dermatol Treat 1993; 4: 119—122.149.Сергеев А.Ю., Бурцева Г.Н., Сергеев В.Ю. Фармакоэпидемиология акне и анонимная оценка лечения пациентами. Иммунопатология, аллергология, инфектология 2012; 4: 102—111150.Белькова Ю.А., Петрунин Д.Д. О местном применении антибактериальных препаратов в терапии акне. Вестник дерматологии и венерологии 2010; 3: 75—85151.Scheinfeld N. Diaper dermatitis. A review and brief survey of eruptions of the diaper area. Am J Clin Dermatol 2005; 6(5): 273—281.152.Collipp P.J., Kuo B., Castro-Magana M. et al. Hair zinc, scalp hair quality, and diaper rash in normal infants. Cutis 1985; 35: 66—70.153.Baldwin S., Odio M., Haines S. et al. Skin benefits from continuous topical administration of a zinc oxide/petrolatum formulation by a novel disposable diaper. J Eur Acad Dermatol Venereol. 2001; 15(suppl 1): 5—11.154.Arad A., Mimouni D., Ben-Amitai D. et al. Efficacy of topical application of eosin compared with zinc oxide paste and corticosteroid cream for diaper dermatitis. Dermatology. 1999; 199: 319—22.155.Imokawa G., Okamoto K. The inhibitory effect of zinc pyrithione on the epidermal proliferation of animal skins.
Иммунопатология, аллергология, инфектология 2012; 4: 102—111150.Белькова Ю.А., Петрунин Д.Д. О местном применении антибактериальных препаратов в терапии акне. Вестник дерматологии и венерологии 2010; 3: 75—85151.Scheinfeld N. Diaper dermatitis. A review and brief survey of eruptions of the diaper area. Am J Clin Dermatol 2005; 6(5): 273—281.152.Collipp P.J., Kuo B., Castro-Magana M. et al. Hair zinc, scalp hair quality, and diaper rash in normal infants. Cutis 1985; 35: 66—70.153.Baldwin S., Odio M., Haines S. et al. Skin benefits from continuous topical administration of a zinc oxide/petrolatum formulation by a novel disposable diaper. J Eur Acad Dermatol Venereol. 2001; 15(suppl 1): 5—11.154.Arad A., Mimouni D., Ben-Amitai D. et al. Efficacy of topical application of eosin compared with zinc oxide paste and corticosteroid cream for diaper dermatitis. Dermatology. 1999; 199: 319—22.155.Imokawa G., Okamoto K. The inhibitory effect of zinc pyrithione on the epidermal proliferation of animal skins. Acta Derm Venereol. 1982; 62: 471—5.156.Gibson W., Hardy W., Groom M. The effect and mode of action of zinc pyrithione on cell growth. II. In vivo studies. Food Chem Toxicol. 1985; 23: 103—10.157.Schmidt A, Ruhl-Horster B. In vitro susceptibility of Malassezia furfur. Arzneimittelforschung. 1996; 46: 442—4.158.Rapaport M. A randomized, controlled clinical trial of four anti-dandruff shampoos. J Int Med Res. 1981; 9: 152—6.159.Pierard-Franchimont C., Goffin V., Decroix J., Pierard G. A multicenter randomized trial of keto-conazole 2% and zinc pyrithione 1% shampoos in severe dandruff and seborrheic dermatitis. Skin Pharmacol Appl Skin Physiol. 2002; 15: 434—41.160.Sharquie K., Najim R., Farjou I., Al-Timimi D. Oral zinc sulphate in the treatment of acute cutaneous leishmaniasis. Clin Exp Dermatol. 2001; 26: 21—6.161.Firooz A., Khatami A., Khamesipour A. et al. Intra-lesional injection of 2% zinc sulfate solution in the treatment of acute old world cutaneous leishmaniasis: a randomized, doubleblind, controlled clinical trial.
Acta Derm Venereol. 1982; 62: 471—5.156.Gibson W., Hardy W., Groom M. The effect and mode of action of zinc pyrithione on cell growth. II. In vivo studies. Food Chem Toxicol. 1985; 23: 103—10.157.Schmidt A, Ruhl-Horster B. In vitro susceptibility of Malassezia furfur. Arzneimittelforschung. 1996; 46: 442—4.158.Rapaport M. A randomized, controlled clinical trial of four anti-dandruff shampoos. J Int Med Res. 1981; 9: 152—6.159.Pierard-Franchimont C., Goffin V., Decroix J., Pierard G. A multicenter randomized trial of keto-conazole 2% and zinc pyrithione 1% shampoos in severe dandruff and seborrheic dermatitis. Skin Pharmacol Appl Skin Physiol. 2002; 15: 434—41.160.Sharquie K., Najim R., Farjou I., Al-Timimi D. Oral zinc sulphate in the treatment of acute cutaneous leishmaniasis. Clin Exp Dermatol. 2001; 26: 21—6.161.Firooz A., Khatami A., Khamesipour A. et al. Intra-lesional injection of 2% zinc sulfate solution in the treatment of acute old world cutaneous leishmaniasis: a randomized, doubleblind, controlled clinical trial.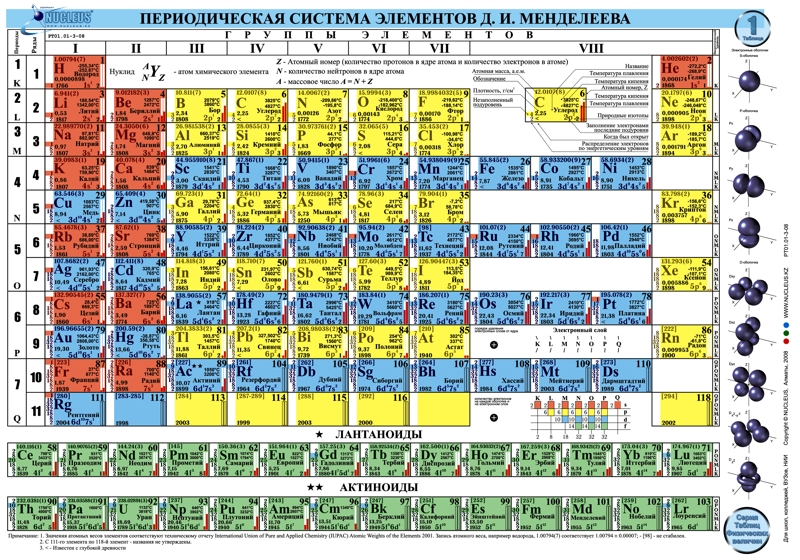 J Drugs Dermatol.2005; 4: 73—9.162.Iraji F., Vali A., Asilian A. et al. Comparison of intraiesionally injected zinc sulfate with meglumine antimoniate in the treatment of acute cutaneous leishmaniasis. Dermatology. 2004; 209: 46—9.163.Sharquie K., Najim R., Farjou I. A comparative controlled trial of intralesionally-administered zinc sulphate, hypertonic sodium chloride and pentavalent antimony compound against acute cutaneous leishmaniasis. Clin Exp Dermatol. 1997; 22: 169—73.164.Al-Gurairi F., Al-Waiz M., Sharquie K. Oral zinc sulphate in the treatment of recalcitrant viral warts: randomized placebocontrolled clinical trial. Br J Dermatol. 2002; 146: 423—31.165.Sadighha A. Oral zinc sulfate in recalcitrant multiple viral warts: a pilot study. J Eur Acad Dermatol Venereol 2009; 23: 715—6.166.Sharquie K.E., Khorsheed A.A., Al-Nuaimy A.A. Topical zinc sulfate solution for treatment of viral warts. Saudi Med J 2007; 28: 1418—21.167.Khattar J.A., Musharrafieh U.M., Tamim H. et al. Topical zinc oxide vs.
J Drugs Dermatol.2005; 4: 73—9.162.Iraji F., Vali A., Asilian A. et al. Comparison of intraiesionally injected zinc sulfate with meglumine antimoniate in the treatment of acute cutaneous leishmaniasis. Dermatology. 2004; 209: 46—9.163.Sharquie K., Najim R., Farjou I. A comparative controlled trial of intralesionally-administered zinc sulphate, hypertonic sodium chloride and pentavalent antimony compound against acute cutaneous leishmaniasis. Clin Exp Dermatol. 1997; 22: 169—73.164.Al-Gurairi F., Al-Waiz M., Sharquie K. Oral zinc sulphate in the treatment of recalcitrant viral warts: randomized placebocontrolled clinical trial. Br J Dermatol. 2002; 146: 423—31.165.Sadighha A. Oral zinc sulfate in recalcitrant multiple viral warts: a pilot study. J Eur Acad Dermatol Venereol 2009; 23: 715—6.166.Sharquie K.E., Khorsheed A.A., Al-Nuaimy A.A. Topical zinc sulfate solution for treatment of viral warts. Saudi Med J 2007; 28: 1418—21.167.Khattar J.A., Musharrafieh U.M., Tamim H. et al. Topical zinc oxide vs. salicylic acid-lactic acid combination in the treatment of warts. Int J Dermatol 2007; 46: 427—30.168.Rojas A., Phillips T. Patients with chronic leg ulcers show diminished levels of vitamins A and E, carotenes, and zinc. Dermatol Surg. 1999; 25: 601—4.169.Ackerman Z., Loewenthal E., Seidenbaum M. et al. Skin zinc concentrations in patients with varicose ulcers. Int J Dermatol. 1990; 29: 360—2.170.Brandrup F., Menne T., Agren M. et al. A randomized trial of two occlusive dressings in the treatment of leg ulcers. Acta Derm Venereol Suppl (Stockh). 1990; 70: 231—5.171.Stromberg H., Agren M. Topical zinc oxide treatment improves arterial and venous leg ulcers. Br J Dermatol. 1984; 111: 461—8.172.Agren M., Stromberg H. Topical treatment of pressure ulcers. A randomized comparative trial of Varidase and zinc oxide. Scand J Plast Reconstr Surg. 1985; 19: 97—100.173.Apelqvist J., Larsson J., Stenstrom A. Topical treatment of necrotic foot ulcers in diabetic patients: A comparative trial of DuoDerm and MeZinc.
salicylic acid-lactic acid combination in the treatment of warts. Int J Dermatol 2007; 46: 427—30.168.Rojas A., Phillips T. Patients with chronic leg ulcers show diminished levels of vitamins A and E, carotenes, and zinc. Dermatol Surg. 1999; 25: 601—4.169.Ackerman Z., Loewenthal E., Seidenbaum M. et al. Skin zinc concentrations in patients with varicose ulcers. Int J Dermatol. 1990; 29: 360—2.170.Brandrup F., Menne T., Agren M. et al. A randomized trial of two occlusive dressings in the treatment of leg ulcers. Acta Derm Venereol Suppl (Stockh). 1990; 70: 231—5.171.Stromberg H., Agren M. Topical zinc oxide treatment improves arterial and venous leg ulcers. Br J Dermatol. 1984; 111: 461—8.172.Agren M., Stromberg H. Topical treatment of pressure ulcers. A randomized comparative trial of Varidase and zinc oxide. Scand J Plast Reconstr Surg. 1985; 19: 97—100.173.Apelqvist J., Larsson J., Stenstrom A. Topical treatment of necrotic foot ulcers in diabetic patients: A comparative trial of DuoDerm and MeZinc. Br J Dermatol. 1990; 123: 787—92.174.Agren M. Studies on zinc in wound healing. Acta Derm Venereol Suppl (Stockh). 1990; 154: 1—36.175.Wilkinson E., Hawke C. Oral zinc for arterial and venous leg ulcers. Cochrane Database Syst Rev. 2000; 2(CD001273).176.Berger R., Fu J., Smiles K., et al. The effects of minoxidil, 1% pyrithione zinc and a combination of both on hair density: a randomized controlled trial. Br J Dermatol. 2003; 149: 354—62.177.Ead R. Oral zinc sulphate in alopacia areata — a double blind trial. Br J Dermatol. 1981; 104: 483—4.178.Rushton D. Nutritional factors and hair loss. Clin Exp Dermatol. 2002; 27: 396—404.179.Najim R.A., Sharquie K.E., Abu-Raghif A.R. Oxidative stress in patients with Behcet’s disease: I correlation with severity and clinical parameters. J Dermatol 2007; 34: 308—14.180.Sharquie K.E., Najim R.A., Al-Dori W.S. et al. Oral zinc sulfate in the treatment of Behcet’s disease: a double blind cross-over study. J Dermatol 2006; 33: 541—6.181.Sharquie K.E., Najim R.
Br J Dermatol. 1990; 123: 787—92.174.Agren M. Studies on zinc in wound healing. Acta Derm Venereol Suppl (Stockh). 1990; 154: 1—36.175.Wilkinson E., Hawke C. Oral zinc for arterial and venous leg ulcers. Cochrane Database Syst Rev. 2000; 2(CD001273).176.Berger R., Fu J., Smiles K., et al. The effects of minoxidil, 1% pyrithione zinc and a combination of both on hair density: a randomized controlled trial. Br J Dermatol. 2003; 149: 354—62.177.Ead R. Oral zinc sulphate in alopacia areata — a double blind trial. Br J Dermatol. 1981; 104: 483—4.178.Rushton D. Nutritional factors and hair loss. Clin Exp Dermatol. 2002; 27: 396—404.179.Najim R.A., Sharquie K.E., Abu-Raghif A.R. Oxidative stress in patients with Behcet’s disease: I correlation with severity and clinical parameters. J Dermatol 2007; 34: 308—14.180.Sharquie K.E., Najim R.A., Al-Dori W.S. et al. Oral zinc sulfate in the treatment of Behcet’s disease: a double blind cross-over study. J Dermatol 2006; 33: 541—6.181.Sharquie K.E., Najim R. A., Al-Salman H.N. Oral zinc sulfate in the treatment of rosacea: a double-blind, placebo-controlled study. Int J Dermatol 2006; 45: 857—61.182.Brocard A., Knol A.C., Khammari A. et al. Hidradenitis suppurativa and zinc: a new therapeutic approach. A pilot study. Dermatology 2007; 214: 325—7.183.Abeck D., Korting H.C., Braun-Falco O. Folliculitis decalvans. Long-lasting response to combined therapy with fusidic acid and zinc. Acta Derm Venereol 1992; 72: 143—5.184.Nofal A.A., Nofal E., Attwa E. et al. Necrolytic acral erythema: a variant of necrolytic migratory erythema or a distinct entity? Int J Dermatol 2005; 44(11): 916—21.185.de Carvalho Fantini B., Matsumoto F.Y., Arnone M. et al. Necrolytic acral erythema successfully treated with oral zinc. Int J Dermatol 2008; 47(8): 872—3.186.Khanna V.J., Shieh S., Benjamin J. et al. Necrolytic acral erythema associated with hepatitis C: effective treatment with interferon alfa and zinc. Arch Dermatol 2000; 136: 755—7.187.Abdallah M.A., Hull C.
A., Al-Salman H.N. Oral zinc sulfate in the treatment of rosacea: a double-blind, placebo-controlled study. Int J Dermatol 2006; 45: 857—61.182.Brocard A., Knol A.C., Khammari A. et al. Hidradenitis suppurativa and zinc: a new therapeutic approach. A pilot study. Dermatology 2007; 214: 325—7.183.Abeck D., Korting H.C., Braun-Falco O. Folliculitis decalvans. Long-lasting response to combined therapy with fusidic acid and zinc. Acta Derm Venereol 1992; 72: 143—5.184.Nofal A.A., Nofal E., Attwa E. et al. Necrolytic acral erythema: a variant of necrolytic migratory erythema or a distinct entity? Int J Dermatol 2005; 44(11): 916—21.185.de Carvalho Fantini B., Matsumoto F.Y., Arnone M. et al. Necrolytic acral erythema successfully treated with oral zinc. Int J Dermatol 2008; 47(8): 872—3.186.Khanna V.J., Shieh S., Benjamin J. et al. Necrolytic acral erythema associated with hepatitis C: effective treatment with interferon alfa and zinc. Arch Dermatol 2000; 136: 755—7.187.Abdallah M.A., Hull C. , Horn T.D. Necrolytic acral erythema: a patient from the United States successfully treated with oral zinc. Arch Dermatol 2005; 141: 85—7.188.Geria A.N., Holcomb K.Z., Scheinfeld N.S. Necro-lytic acral erythema: a review of the literature. Cutis 2009; 83: 309—14.189.Bolanca I., Bolanca Z., Kuna K. et al. Chloasma—the mask of pregnancy [review]. Coll Antropol 2008; 32(Suppl 2): 139—41.190.Sharquie K.E., Al-Mashhadani S.A., Salman H.A. Topical 10% zinc sulfate solution for treatment of melasma. Dermatol Surg 2008; 34: 1346—9.
, Horn T.D. Necrolytic acral erythema: a patient from the United States successfully treated with oral zinc. Arch Dermatol 2005; 141: 85—7.188.Geria A.N., Holcomb K.Z., Scheinfeld N.S. Necro-lytic acral erythema: a review of the literature. Cutis 2009; 83: 309—14.189.Bolanca I., Bolanca Z., Kuna K. et al. Chloasma—the mask of pregnancy [review]. Coll Antropol 2008; 32(Suppl 2): 139—41.190.Sharquie K.E., Al-Mashhadani S.A., Salman H.A. Topical 10% zinc sulfate solution for treatment of melasma. Dermatol Surg 2008; 34: 1346—9.Относительная атомная масса — Большая Энциклопедия Нефти и Газа, статья, страница 1
Относительная атомная масса
Cтраница 1
Относительная атомная масса, относительная молекулярная масса и другие относительные величины так же, как и вСИ, выражаютсявсистемеСГСвбезразмерных единицах, поэтому здесь не рассматриваются. Не рассматриваются здесь и единицы всех температурных коэффициентов, так как они выражаются в таких же единицах, как и в Международной системе. [1]
[1]
Относительная атомная масса является одной из основных характеристик химического элемента. [2]
Относительная атомная масса обозначается Аг ( индекс г — начальная буква слова relative — относительный), а абсолютная атомная масса — та. [3]
Относительная атомная масса ( или просто атомная масса) является величиной безразмерной. [4]
Относительная атомная масса ( символ — Аг, единица — а.е.м.) — средняя масса атома элемента при его природном изотопном составе, отнесенная к 1 / 12 массы атома углерода С. Подстрочный индекс г происходит от лат. [6]
Относительная атомная масса ( или просто атомная масса) является величиной безразмерной. [7]
Относительная атомная масса меди А, 63 5, плотность р 8 93 — 103 кг / м3, молярная масса М ( 0 001 кг / моль) Аг 0 0635 кг / моль. [8]
[8]
Относительная атомная масса цинка равна 65, следовательно, молярная масса цинка равна 65 г / моль, т.е. M ( Zn) 65 г / моль. [9]
Относительная атомная масса природного бора слегка меняется в зависимости от происхождения образца. Определенное химическим путем значение относительной атомной массы равно 10 84 для бора, выделенного из минерала, полученного из Калифорнии, и 10 82 для минерала, доставленного из Италии. [10]
Относительной атомной массой химического элемента называется среднее арифметическое масс атомов отдельных изотопов данного элемента с учетом их распространенности в природе. Их округленные значения, рекомендуемые для решения задач, даны в приложении. [11]
Приведены относительная атомная масса ( Ат) и содержание в природном элементе ( мольная доля х) стабильных и радиоактивных изотопов, встречающихся в природе. Радиоактивные изотопы отмечены верхним индексом ( см. также разд.
[12]
Радиоактивные изотопы отмечены верхним индексом ( см. также разд.
[12]
Однако большая относительная атомная масса дейтерия уменьшает эффективность его как замедлителя и требует большего межканального пространства. [14]
Значения относительных атомных масс приводятся в Периодической таблице под символом элемента. [15]
Страницы: 1 2 3 4
химический элемент Цинк Zincum — «Химическая продукция»
Что такое
Цинк, zincum, характеристики, свойстваЦинк — это химический элемент Zn химический элемент побочной подгруппы второй группы, четвёртого периода периодической системы, с атомным номером 30. Обозначается символом Zn (лат. Zincum). Простое вещество цинк при нормальных условиях — хрупкий переходный металл голубовато-белого цвета (тускнеет на воздухе, покрываясь тонким слоем оксида цинка).
Цинк класс химических элементов
Элемент Zn — относится к группе, классу хим элементов (химический элемент побочной подгруппы второй группы, четвёртого периода периодической системы, с атомным номером 30)
Элемент Zn свойство химического элемента Цинк Zincum
Основные характеристики и свойства элемента Zn…, его параметры.
Название, символ, номер Цинк / Zincum (Zn), 30 Атомная масса (молярная масса) 65,38(2) а. е. м. (г/моль) Электронная конфигурация [Ar] 3d10 4s2 Радиус атома 138 пм
формула химического элемента Цинк Zincum
Химическая формула Цинка:
Атомы Цинк Zincum химических элементов
Атомы Zincum хим. элемента
Zincum Цинк ядро строение
Строение ядра химического элемента Zincum — Zn,
История открытия Цинк Zincum
Открытие элемента Zincum — Сплав цинка с медью — латунь — был известен ещё в Древней Греции, Древнем Египте, Индии (VII в.), Китае (XI в.). Долгое время не удавалось выделить чистый цинк. В 1738 году в Англии Уильямом Чемпионом был запатентован дистилляционный способ получения цинка.
В 1738 году в Англии Уильямом Чемпионом был запатентован дистилляционный способ получения цинка.
В промышленном масштабе выплавка цинка началась также в XVIII в.: в 1743 году в Бристоле вступил в строй первый цинковый завод, основанный Уильямом Чемпионом, где получение цинка проводилось дистилляционным способом:
В 1746 А. С. Маргграф в Германии разработал похожий способ получения чистого цинка путём прокаливания смеси его оксида с углём без доступа воздуха в глиняных огнеупорных ретортах с последующей конденсацией паров цинка в холодильниках. Маргграф описал свой метод во всех деталях и этим заложил основы теории производства цинка. Поэтому его часто называют первооткрывателем цинка.
- 1805 году Чарльз Гобсон и Чарльз Сильвестр из Шеффилда запатентовали способ обработки цинка — прокатка при 100—150 °C
- 1 января 1905 — первый в России цинк был получен на заводе «Алагир»
- 1915 году в Канаде и США — первые заводы, где цинк получали электролитическим способом
Цинк Zincum происхождение названия
Откуда произошло название Zincum … Слово «цинк» впервые встречается в трудах Парацельса, который назвал этот металл словом «zincum» или «zinken» в книге Liber Mineralium I. Слово, вероятно, восходит к нем. Zinke, означающее «зубец» (кристаллиты металлического цинка похожи на иглы)
Слово, вероятно, восходит к нем. Zinke, означающее «зубец» (кристаллиты металлического цинка похожи на иглы)
Распространённость Цинк Zincum
Как любой хим. элемент имеет свою распространенность в природе, Zn …
Цинк в природе как самородный металл не встречается.
Получение Цинк Zincum
Zincum — получение элемента Цинк добывают из полиметаллических руд, содержащих 1—4 % Zn в виде сульфида, а также Cu, Pb, Ag, Au, Cd, Bi. Руды обогащают селективной флотацией, получая цинковые концентраты (50—60 % Zn) и одновременно свинцовые, медные, а иногда также пиритные концентраты. Цинковые концентраты обжигают в печах в кипящем слое, переводя сульфид цинка в оксид ZnO; образующийся при этом сернистый газ SO2 расходуется на производство серной кислоты. Чистый цинк из оксида ZnO получают двумя способами.
Пирометаллургический способ (дистилляционный способ) / Pyrometallurgical method (distillation method)
По пирометаллургическому (дистилляционному) способу, существующему издавна, обожжённый концентрат подвергают спеканию для придания зернистости и газопроницаемости, а затем восстанавливают углём или коксом при 1200—1300 °C: ZnO + С = Zn + CO. Образующиеся при этом пары металла конденсируют и разливают в изложницы. Сначала восстановление проводили только в ретортах из обожжённой глины, обслуживаемых вручную, позднее стали применять вертикальные механизированные реторты из карборунда, затем — шахтные и дуговые электропечи; из свинцово-цинковых концентратов цинк получают в шахтных печах с дутьём.
Образующиеся при этом пары металла конденсируют и разливают в изложницы. Сначала восстановление проводили только в ретортах из обожжённой глины, обслуживаемых вручную, позднее стали применять вертикальные механизированные реторты из карборунда, затем — шахтные и дуговые электропечи; из свинцово-цинковых концентратов цинк получают в шахтных печах с дутьём.
Производительность постепенно повышалась, но цинк содержал до 3 % примесей, в том числе ценный кадмий. Дистилляционный цинк очищают ликвацией (то есть отстаиванием жидкого металла от железа и части свинца при 500 °C), достигая чистоты 98,7 %. Применяющаяся иногда более сложная и дорогая очистка ректификацией дает металл чистотой 99,995 % и позволяет извлекать кадмий.
Основной способ получения цинка — электролитический (гидрометаллургический). Обожжённые концентраты обрабатывают серной кислотой; получаемый сульфатный раствор очищают от примесей (осаждением их цинковой пылью) и подвергают электролизу в ваннах, плотно выложенных внутри свинцом или винипластом. Цинк осаждается на алюминиевых катодах, с которых его ежесуточно удаляют (сдирают) и плавят в индукционных печах. Обычно чистота электролитного цинка — 99,95 %, полнота извлечения его из концентрата (при учёте переработки отходов) — 93—94 %.
Цинк осаждается на алюминиевых катодах, с которых его ежесуточно удаляют (сдирают) и плавят в индукционных печах. Обычно чистота электролитного цинка — 99,95 %, полнота извлечения его из концентрата (при учёте переработки отходов) — 93—94 %.
Цинковый купорос, Pb, Cu, Cd, Au, Ag; In, Ga, Ge, Tl получают из отходов производства цинка
Из отходов производства получают цинковый купорос, Pb, Cu, Cd, Au, Ag; иногда также In, Ga, Ge, Tl.
Физические свойства Цинк Zincum
Основные свойства Zincum — в чистом виде — довольно пластичный серебристо-белый металл. Обладает гексагональной решеткой с параметрами а = 0,26649 нм, с = 0,49431 нм, пространственная группа P 63/mmc, Z = 2. При комнатной температуре хрупок, при сгибании пластинки слышен треск от трения кристаллитов (обычно сильнее, чем «крик олова»). При 100—150 °C цинк пластичен.
Примеси, даже незначительные, резко увеличивают хрупкость цинка.
Собственная концентрация носителей заряда в цинке — 13,1⋅1028 м−3.
Изотопы Zincum Цинк
Наличие и определение изотопов Zincum
Zn свойства изотопов Цинк Zincum
…
Химические свойства Цинк Zincum
Определение химических свойств Zincum
Меры предосторожности Цинк Zincum
Внимание! Внимательно ознакомьтесь с мерами безопасности при работе с Zincum
Стоимость Цинк Zincum
Рыночная стоимость Zn, цена Цинк Zincum
Примечания
Список примечаний и ссылок на различные материалы про хим. элемент Zn
Реактивы. Цинк уксуснокислый 2-водный. Технические условия – РТС-тендер
ГОСТ 5823-78
Группа Л52
ОКП 26 3421 2070 00
Дата введения 1979-01-01
1. РАЗРАБОТАН И ВНЕСЕН Министерством химической промышленности
2. УТВЕРЖДЕН И ВВЕДЕН В ДЕЙСТВИЕ Постановлением Государственного комитета стандартов Совета Министров СССР от 09.02.78 N 416
3.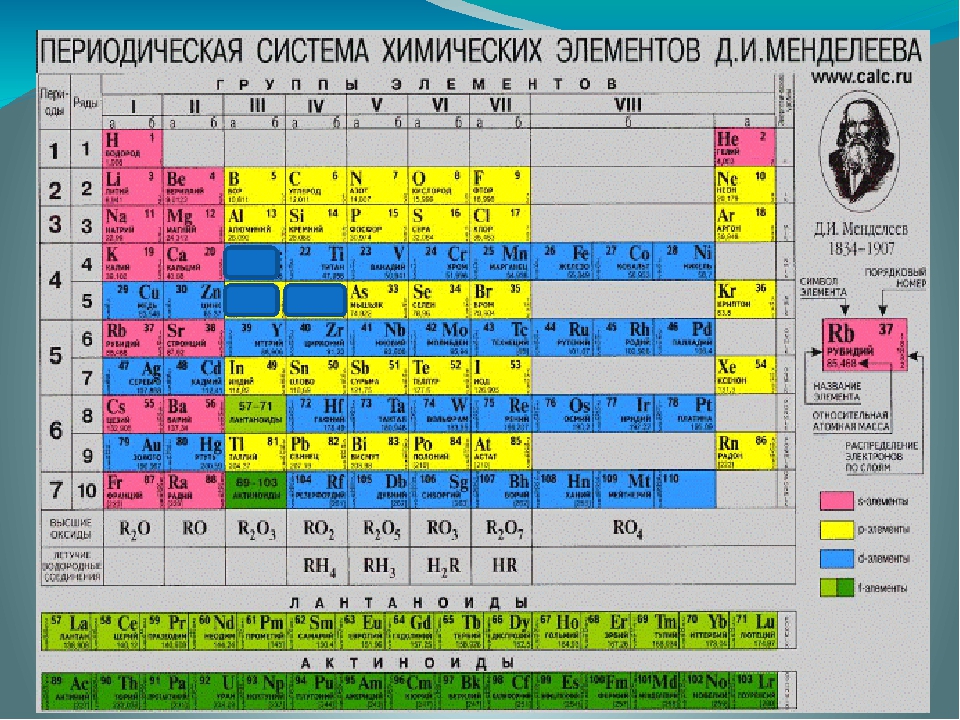 ВЗАМЕН ГОСТ 5823-69
ВЗАМЕН ГОСТ 5823-69
4. ССЫЛОЧНЫЕ НОРМАТИВНО-ТЕХНИЧЕСКИЕ ДОКУМЕНТЫ
Обозначение НТД, на который дана ссылка | Номер пункта, подпункта |
ГОСТ 61-75 | 3.3.1 |
ГОСТ 1770-74 | 3.3.1, 3.10.1 |
ГОСТ 3885-73 | 2.1, 3.1, 4.1 |
ГОСТ 4212-76 | 3.10.1 |
ГОСТ 4517-87 | 3.11 |
ГОСТ 5457-75 | 3.10.1 |
ГОСТ 6709-72 | 3.3.1, 3.5, 3.10.1 |
ГОСТ 10398-76 | 3. |
ГОСТ 10485-75 | 3.9 |
ГОСТ 10555-75 | 3.7 |
ГОСТ 10671.2-74 | 3.4 |
ГОСТ 10671.5-74 | 3.5 |
ГОСТ 10671.7-74 | 3.6 |
ГОСТ 21979-76 | 3.8 |
ГОСТ 24104-88 | 3.1а |
ГОСТ 25336-82 | 3.3.1, 3.4, 3.5, 3.6, 3.10.1, 3.11 |
ГОСТ 27025-86 | 3.1а |
5. Ограничение срока действия снято по протоколу N 3-93 Межгосударственного Совета по стандартизации, метрологии и сертификации (ИУС 5-6-93)
6. ИЗДАНИЕ (октябрь 2001 г.) с Изменениями N 1, 2, утвержденными в апреле 1983 г., декабре 1987 г. (ИУС 8-83, 3-88)
ИЗДАНИЕ (октябрь 2001 г.) с Изменениями N 1, 2, утвержденными в апреле 1983 г., декабре 1987 г. (ИУС 8-83, 3-88)
Настоящий стандарт распространяется на 2-водный уксуснокислый цинк, который представляет собой белые мелкие выветривающиеся кристаллы со слабым запахом уксусной кислоты; хорошо растворим в воде.
Формула Zn (СНСОО)·2НО.
Молекулярная масса (по международным атомным массам 1971 г.) — 219,50.
(Измененная редакция, Изм. N 2).
1. ТЕХНИЧЕСКИЕ ТРЕБОВАНИЯ
1.1. 2-водный уксуснокислый цинк должен быть изготовлен в соответствии с требованиями настоящего стандарта по технологическому регламенту, утвержденному в установленном порядке.
1.2. По физико-химическим показателям 2-водный уксуснокислый цинк должен соответствовать нормам, указанным в табл.1.
Таблица 1
Наименование показателя | Норма | ||
Химически чистый | Чистый для анализа | Чистый | |
1. Массовая доля 2-водного уксуснокислого цинка Zn(СНСОО)·2НО, %, не менее | 99,5 | 99,0 | 98,0 |
2. Массовая доля нерастворимых в воде веществ, %, не более | 0,002 | 0,003 | 0,005 |
3. Массовая доля нитратов (NO), %, не более | 0,002 | 0,003 | Не нормируется |
4. | 0,002 | 0,005 | 0,010 |
5. Массовая доля хлоридов (Cl), %, не более | 0,0005 | 0,0010 | 0,0020 |
6. Массовая доля железа (Fe), %, не более | 0,0003 | 0,0005 | 0,0010 |
7. Массовая доля меди (Cu), %, не более | 0,0005 | 0,0020 | Не нормируется |
8. | 0,0005 | 0,0020 | 0,0050 |
9. Массовая доля мышьяка (As), %, не более | 0,00004 | 0,00005 | Не нормируется |
10. Массовая доля калия, кальция и натрия (K+Ca+Na), %, не более | 0,015 | 0,020 | 0,040 |
11. рН раствора препарата с массовой долей 5%, не ниже | 6 | Не нормируется | Не нормируется |
(Измененная редакция, Изм. N 1, 2).
N 1, 2).
2. ПРАВИЛА ПРИЕМКИ
2.1. Правила приемки — по ГОСТ 3885.
3. МЕТОДЫ АНАЛИЗА
3.1а. Общие указания по проведению анализа — по ГОСТ 27025.
При взвешивании применяют лабораторные весы по ГОСТ 24104 2-го класса точности с наибольшим пределом взвешивания 200 г и 3-го класса точности с наибольшим пределом взвешивания 500 г и 1 кг.
Допускается применение импортной аппаратуры по классу точности и реактивов по качеству не ниже отечественных.
(Измененная редакция, Изм. N 1, 2).
3.1. Пробы отбирают по ГОСТ 3885. Масса средней отобранной пробы должна быть не менее 570 г.
(Измененная редакция, Изм. N 1).
3.2. Определение массовой доли 2-водного уксуснокислого цинка
Определение проводят по ГОСТ 10398. При этом около 0,3500 г препарата помещают в коническую колбу, растворяют в 100 см воды и далее проводят определение по ГОСТ 10398.
Масса 2-водного уксуснокислого цинка, соответствующая 1 см раствора ди-Na-ЭДТА концентрации точно 0,05 моль/дм, равна 0,010975 г.
Пределы допускаемой относительной суммарной погрешности результата анализа ±0,4% при доверительной вероятности 0,95.
(Измененная редакция, Изм. N 2).
3.3. Определение массовой доли нерастворимых в воде веществ
3.3.1. Реактивы и посуда
Вода дистиллированная по ГОСТ 6709.
Кислота уксусная по ГОСТ 61, раствор с массовой долей 30%.
Пипетка 4 (5)-2-1 по НТД.
Стакан В(Н)-1-400 ТХС по ГОСТ 25336.
Тигель ТФ ПОР 10 или ТФ ПОР 16 по ГОСТ 25336.
Цилиндр 1-250 по ГОСТ 1770.
(Измененная редакция, Изм. N 2).
3.3.2. Проведение анализа
50,00 г препарата помещают в стакан, растворяют в 250 см теплой воды, подкисленной 0,5 см раствора уксусной кислоты, стакан накрывают часовым стеклом и выдерживают в течение 1 ч на кипящей водяной бане. Затем раствор фильтруют через тигель, предварительно высушенный до постоянной массы и взвешенный (результат взвешивания в граммах записывают с точностью до четвертого десятичного знака). Остаток на фильтре промывают 150 см горячей воды и сушат в сушильном шкафу при 105-110°С до постоянной массы.
Препарат считают соответствующим требованиям настоящего стандарта, если масса остатка после высушивания не будет превышать:
для препарата химически чистый | — 1 мг, |
для препарата чистый для анализа | — 1,5 мг, |
для препарата чистый | — 2,5 мг. |
(Измененная редакция, Изм. N 2).
3.4. Определение массовой доли нитратов
Определение проводят по ГОСТ 10671.2. При этом 1,00 г препарата помещают в коническую колбу вместимостью 50-100 см (ГОСТ 25336), растворяют в 10 см воды и далее определение проводят с применением индигокармина.
Препарат считают соответствующим требованиям настоящего стандарта, если наблюдаемая окраска анализируемого раствора не будет слабее окраски раствора, приготовленного одновременно с анализируемым и содержащего в таком же объеме:
для препарата химически чистый — 0,02 мг NO,
для препарата чистый для анализа — 0,03 мг NO, 1 мл раствора хлористого натрия, 1 мл раствора индигокармина и 12 см концентрированной серной кислоты.
3.5. Определение массовой доли сульфатов
Определение проводят по ГОСТ 10671.5. При этом 1,00 г препарата помещают в коническую колбу вместимостью 50-100 см (ГОСТ 25336) и растворяют в 20 см дистиллированной воды (ГОСТ 6709). Если раствор мутный, его фильтруют через обеззоленный фильтр «синяя лента», промытый горячей водой, затем прибавляют 3,5 см раствора соляной кислоты с массовой долей 10%, доводят объем раствора водой до 26 см и далее определение проводят фототурбидиметрическим или визуально-нефелометрическим методом (способ 1), не прибавляя раствор соляной кислоты.
Препарат считают соответствующим требованиям настоящего стандарта, если масса сульфатов не будет превышать:
для препарата химически чистый | — 0,02 мг, |
для препарата чистый для анализа | — 0,05 мг, |
для препарата чистый | — 0,10 мг. |
При разногласиях в оценке массовой доли сульфатов анализ проводят фототурбидиметрическим методом.
3.4, 3.5. (Измененная редакция, Изм. N 2).
3.6. Определение массовой доли хлоридов
Определение проводят по ГОСТ 10671.7. При этом 2,00 г препарата помещают в коническую колбу вместимостью 100 см (ГОСТ 25336) и растворяют в 21 см воды, содержащей 5 см раствора азотной кислоты с массовой долей 25%, нагревают до кипения и охлаждают. Если раствор мутный, его фильтруют через обеззоленный фильтр «синяя лента», предварительно промытый горячим раствором азотной кислоты с массовой долей 1%. Далее определение проводят фототурбидиметрическим (способ 1) или визуально-нефелометрическим методом, не прибавляя раствор азотной кислоты, в объеме 25 см.
Препарат считают соответствующим требованиям настоящего стандарта, если масса хлоридов не будет превышать:
для препарата химически чистый | — 0,010 мг, |
для препарата чистый для анализа | — 0,020 мг, |
для препарата чистый | — 0,040 мг. |
При разногласиях в оценке массовой доли хлоридов анализ проводят фототурбидиметрическим методом.
(Измененная редакция, Изм. N 1, 2).
3.7. Определение массовой доли железа
Определение проводят по ГОСТ 10555. 2,00 г препарата помещают в коническую колбу вместимостью 100 см (с меткой на 50 см), прибавляют 21 см воды, содержащей 4 см раствора соляной кислоты с массовой долей 25%, нагревают до кипения и кипятят в течение 5 мин. Раствор охлаждают и далее определение проводят сульфосалициловым методом, не прибавляя раствор соляной кислоты.
Препарат считают соответствующим требованиям настоящего стандарта, если масса железа не будет превышать:
для препарата химически чистый | — 0,006 мг, |
для препарата чистый для анализа | — 0,010 мг, |
для препарата чистый | — 0,020 мг. |
Допускается заканчивать определение визуально.
Допускается проводить определение роданидным методом с предварительным окислением железа надсернокислым аммонием по ГОСТ 10555.
При разногласиях в оценке массовой доли железа анализ проводят сульфосалициловым методом фотометрически.
(Измененная редакция, Изм. N 2).
3.8. Определение массовой доли меди и свинца
Определение проводят по ГОСТ 21979 с применением ртутно-графитового электрода. При этом для анализа берут 2 г препарата (вместо 5 г) и 20 см раствора соляной кислоты (вместо 10 см).
3.9. Определение массовой доли мышьяка
Определение проводят по ГОСТ 10485. При этом 5,00 г препарата помещают в колбу прибора для определения мышьяка, растворяют в 30 см воды и далее определение проводят методом с применением бромнортутной бумаги в сернокислой или солянокислой среде.
Препарат считают соответствующим требованиям настоящего стандарта, если наблюдаемая окраска бромнортутной бумаги от анализируемого раствора не будет интенсивнее окраски бромнортутной бумаги от раствора, приготовленного одновременно с анализируемым и содержащего в таком же объеме:
для препарата химически чистый — 0,0020 мг As,
для препарата чистый для анализа — 0,0025 мг As, и соответствующие количества реактивов по ГОСТ 10485.
При разногласиях в оценке массовой доли мышьяка определение проводят методом с применением бромнортутной бумаги в сернокислой среде.
(Измененная редакция, Изм. N 2).
3.10. Определение массовой доли калия, кальция и натрия
3.10.1. Аппаратура, реактивы и растворы
Фотометр пламенный или спектрофотометр на основе спектрографа ИСП-51 с приставкой ФЭП-1 с соответствующим фотоумножителем или спектрофотометр «Сатурн»; допускается использование других приборов, обеспечивающих аналогичные чувствительность и точность.
Колба 2-100-2 по ГОСТ 1770.
Пипетка 6(7)-2-5(10) по НТД.
Стакан В(Н)-1-50 по ГОСТ 25336.
Цилиндр 1-50 по ГОСТ 1770.
Ацетилен растворенный технический по ГОСТ 5457 (для определения кальция).
Пропан-бутан (для определения калия и натрия).
Воздух сжатый для питания контрольно-измерительных приборов.
Горелка.
Распылитель.
Растворы, содержащие Na, K и Са; готовят по ГОСТ 4212 — раствор А; соответствующим разбавлением и смешением готовят растворы, содержащие по 0,01 мг/см Na, K и Са — раствор Б.
Вода дистиллированная по ГОСТ 6709, вторично перегнанная в кварцевом дистилляторе или вода деминерализованная.
Все растворы и воду, применяемую для их приготовления, хранят в полиэтиленовой или кварцевой посуде.
(Измененная редакция, Изм. N 2).
3.10.2. Подготовка к анализу
3.10.2.1. Приготовление анализируемого раствора
1,00 г препарата помещают в стакан, растворяют в 30 см, переносят в мерную колбу. Объем раствора доводят водой до метки и перемешивают.
3.10.2.2. Приготовление растворов сравнения.
В шесть мерных колб помещают по 20 см воды и указанные в табл.2 объемы растворов А и Б. Объем каждого раствора доводят водой до метки и тщательно перемешивают.
Таблица 2
Номер раствора сравнения | Объем раствора А, см | Объем раствора Б, см | Масса элемента в 100 см раствора сравнения, мг | Массовая доля элемента | ||||
Na | K | Ca | Na | K | Са | |||
1 | — | 2 | 0,02 | 0,02 | 0,02 | 0,002 | 0,002 | 0,002 |
2 | — | 4 | 0,04 | 0,04 | 0,04 | 0,004 | 0,004 | 0,004 |
3 | — | 6 | 0,06 | 0,06 | 0,06 | 0,006 | 0,006 | 0,006 |
4 | — | 8 | 0,08 | 0,08 | 0,08 | 0,008 | 0,008 | 0,008 |
5 | 0,1 | — | 0,1 | 0,1 | 0,1 | 0,01 | 0,01 | 0,01 |
6 | 0,2 | — | 0,2 | 0,2 | 0,2 | 0,02 | 0,02 | 0,02 |
3.10.2.1-3.10.2.2. (Измененная редакция, Изм. N 2).
3.10.3. Проведение анализа
Для анализа берут не менее двух навесок препарата. Сравнивают интенсивность излучения резонансных линий Na 589,0-589,6 нм, K 766,5-769,9 нм и Са 422,7 нм, возникающих в спектре пламени газ-воздух, при введении в него анализируемых растворов и растворов сравнения.
После подготовки прибора к анализу проводят фотометрирование анализируемых растворов и растворов сравнения в порядке возрастания массовых долей примесей. Затем проводят фотометрирование в обратной последовательности, начиная с максимальных массовых долей примесей, учитывая в качестве поправки отсчет, полученный при фотометрировании воды, и вычисляют среднее арифметическое значение интенсивности излучения для каждого раствора. После каждого замера распыляют воду.
3.10.4. Обработка результатов
По полученным данным для растворов сравнения строят градуировочные графики, откладывая значения интенсивности излучения на оси ординат, массовую долю примеси в процентах в пересчете на препарат — на оси абсцисс.
Массовую долю примесей в процентах находят по графику.
Препарат считают соответствующим требованиям настоящего стандарта, если суммарная массовая доля примесей не будет превышать допускаемых норм.
За результат анализа принимают среднее арифметическое результатов двух параллельных определений, относительное значение расхождения между которыми не превышает значения допускаемого расхождения, равного 20%.
Пределы допускаемого расхождения относительной суммарной погрешности результатов анализа ±10% при доверительной вероятности 0,95.
3.11. Определение рН раствора препарата с массовой долей 5%
5,00 г препарата помещают в коническую колбу вместимостью 250 см (ГОСТ 25336), растворяют в 95 см дистиллированной воды, не содержащей углекислоты (готовят по ГОСТ 4517) и измеряют рН раствора на универсальном иономере ЭВ-74 или другом приборе с пределом допускаемой основной погрешности ±0,05 рН.
За результат анализа принимают среднее арифметическое результатов двух параллельных определений, абсолютное значение расхождения между которыми не превышает значения допускаемого расхождения, равного 0,2 рН.
Пределы допускаемой абсолютной суммарной погрешности результата анализа ±0,1 рН при доверительной вероятности 0,95.
3.10.3-3.11. (Измененная редакция, Изм. N 2).
4. УПАКОВКА, МАРКИРОВКА, ТРАНСПОРТИРОВАНИЕ И ХРАНЕНИЕ
4.1. Препарат упаковывают и маркируют в соответствии с ГОСТ 3885.
Вид и тип тары: 2-1, 2-2, 2-4, 2-9.
Группа фасовки: III, IV, V, VI, VII (не более 10 кг).
(Измененная редакция, Изм. N 1, 2).
4.2. Препарат перевозят всеми видами транспорта в соответствии с правилами перевозки груза, действующими на данном виде транспорта.
4.3. Препарат хранят в упаковке изготовителя в крытых складских помещениях.
5. ГАРАНТИИ ИЗГОТОВИТЕЛЯ
5.1. Изготовитель гарантирует соответствие препарата требованиям настоящего стандарта при соблюдении условий хранения.
5.2. Гарантийный срок хранения препарата — два года со дня изготовления.
5.1, 5.2. (Измененная редакция, Изм. N 1).
6. ТРЕБОВАНИЯ БЕЗОПАСНОСТИ
6.1. Препарат и его растворы обладают прижигающим действием на кожу и слизистые оболочки.
6.2. При работе с препаратом следует применять индивидуальные средства защиты (резиновые перчатки, защитные очки), а также соблюдать правила личной гигиены.
6.3. Помещения, в которых проводятся работы с препаратом, должны быть оборудованы общей приточно-вытяжной механической вентиляцией. Анализ препарата следует проводить в вытяжном шкафу лаборатории.
6.4. При проведении анализа препарата с использованием горючих газов следует соблюдать правила противопожарной безопасности.
Электронный текст документа
подготовлен АО «Кодекс» и сверен по:
официальное издание
М.: ИПК Издательство стандартов, 2001
атомный вес цинка | Комиссия по изотопному содержанию и атомному весу
| Изотоп | Атомная масса (Да) | Изотопная численность (количественная доля) |
|---|---|---|
| 64 Zn | 63,929 142 (5) | 0,4917 (75) | Zn | 65,926 034 (5) | 0,2773 (98) |
| 67 Zn | 66,927 127 (5) | 0.0404 (16) |
| 68 Zn | 67,924 844 (5) | 0,1845 (63) |
| 70 Zn | 69,925 32 (2) | 0,0061 (10) |
В 1961 году Комиссия рекомендовала A r (Zn) = 65,37 на основе химических определений. Тем временем, масс-спектрометрические определения дали более высокое значение A r (Zn) = 65,387.
В 1971 г. кулонометрические определения дали A r (Zn) = 65.377 (3), после чего Комиссия изменила рекомендованный значение 65,38 (1). Вскоре было опубликовано другое масс-спектрометрическое значение, которое дало A r (Zn) = 65,396 (5). Столкнувшись с этим продолжающимся несоответствием между химическими и физическими значениями, в 1983 году Комиссия рекомендовала A r (Zn) = 65,39 (2), объясняя, что значение теперь было взвешено для масс-спектрометрического измерения, но неопределенность включала кулонометрическое измерение. В 2001 году A r (Zn) был заменен на 65.409 (4), а в 2007 году Комиссия признала, что данные, влияющие на решение 2001 года, больше не могут поддерживаться и рекомендовала текущее значение A r (Zn) = 65,38 (2). Это изменение было уникальным в том смысле, что впервые в истории Комиссии стандартный атомный вес (с его неопределенностью) вышел за пределы предыдущего значения.
CIAAW
Цинк
A r (Zn) = 65.38 (2) с 2007 г.
Название происходит от немецкого цинка неизвестного происхождения. Впервые он был использован в доисторические времена, когда
его соединения использовались для лечения ран и воспаленных глаз, а также для изготовления латуни. Цинк был признан
металл еще в 1374 году.
Изотопные стандартные образцы цинка.
Молекулярная масса цинка
Молярная масса of Zn = 65,38 г / моль
Перевести граммы цинка в моль или моль цинка в граммы
| Элемент | Символ | Атомная масса | Количество атомов | Массовый процент |
| Цинк | Zn | 65.38 | 1 | 100,000% |
В химии вес формулы — это величина, вычисляемая путем умножения атомного веса (в единицах атомной массы) каждого элемента в химической формуле на количество атомов этого элемента, присутствующего в формуле, с последующим сложением всех этих продуктов вместе.
Формула веса особенно полезна при определении относительного веса реагентов и продуктов в химической реакции. Эти относительные веса, вычисленные по химическому уравнению, иногда называют весами по уравнениям.
Определение молярной массы начинается с единиц граммов на моль (г / моль). При расчете молекулярной массы химического соединения он говорит нам, сколько граммов содержится в одном моль этого вещества. Вес формулы — это просто вес в атомных единицах массы всех атомов в данной формуле.
Атомные веса, используемые на этом сайте, получены от NIST, Национального института стандартов и технологий. Мы используем самые распространенные изотопы. Вот как рассчитать молярную массу (среднюю молекулярную массу), которая основана на изотропно взвешенных средних.Это не то же самое, что молекулярная масса, которая представляет собой массу одной молекулы четко определенных изотопов. Для объемных стехиометрических расчетов мы обычно определяем молярную массу, которую также можно назвать стандартной атомной массой или средней атомной массой.
Используя химическую формулу соединения и периодическую таблицу элементов, мы можем сложить атомные веса и вычислить молекулярную массу вещества.
Часто на этом сайте просят перевести граммы в моль.Чтобы выполнить этот расчет, вы должны знать, какое вещество вы пытаетесь преобразовать. Причина в том, что на конверсию влияет молярная масса вещества. Этот сайт объясняет, как найти молярную массу.
Если формула, используемая при расчете молярной массы, является молекулярной формулой, вычисленная формула веса является молекулярной массой. Весовой процент любого атома или группы атомов в соединении можно вычислить, разделив общий вес атома (или группы атомов) в формуле на вес формулы и умножив на 100.
атомный вес | Определение, единицы и таблица
Атомная масса , также называемая относительной атомной массой , отношение средней массы атомов химического элемента к некоторому стандарту. С 1961 года стандартной единицей атомной массы является одна двенадцатая массы атома изотопа углерода-12. Изотоп — это один из двух или более видов атомов одного и того же химического элемента, которые имеют разные атомные массовые числа (протоны + нейтроны). Атомный вес гелия 4.002602, среднее значение, которое отражает типичное соотношение естественного содержания его изотопов. Атомный вес измеряется в атомных единицах массы (а.е.м.), также называемых дальтонами. См. Ниже , где приведен список химических элементов и их атомный вес.
Концепция атомного веса является фундаментальной для химии, потому что большинство химических реакций протекает в соответствии с простыми числовыми соотношениями между атомами. Поскольку почти всегда невозможно напрямую подсчитать задействованные атомы, химики измеряют реагенты и продукты путем взвешивания и делают свои выводы путем расчетов с использованием атомных весов.Поиски определения атомного веса элементов занимали величайших химиков 19 — начала 20 веков. Их тщательная экспериментальная работа стала ключом к химической науке и технологиям.
Надежные значения атомных весов служат важной цели совершенно иным образом, когда химические товары покупаются и продаются на основе содержания одного или нескольких указанных компонентов. Примерами являются руды дорогих металлов, таких как хром или тантал, и промышленная кальцинированная сода.Содержание указанного компонента необходимо определять количественным анализом. Расчетная стоимость материала зависит от атомных весов, используемых в расчетах.
Первоначальным стандартом атомной массы, установленным в 19 веке, был водород со значением 1. Примерно с 1900 по 1961 год кислород использовался в качестве эталона с заданным значением 16. Единица атомной массы таким образом была определена как 1 / 16 масса атома кислорода.В 1929 году было обнаружено, что природный кислород содержит небольшое количество двух изотопов, немного тяжелее самого распространенного, и что число 16 представляет собой средневзвешенное значение трех изотопных форм кислорода, встречающихся в природе. Эта ситуация считалась нежелательной по нескольким причинам, и, поскольку можно определить относительные массы атомов отдельных изотопных частиц, вскоре была установлена вторая шкала с 16 как значение основного изотопа кислорода, а не значение натуральная смесь.Эта вторая шкала, предпочитаемая физиками, стала известна как физическая шкала, а более ранняя шкала продолжала использоваться как химическая шкала, которую предпочитали химики, которые обычно работали с природными смесями изотопов, а не с чистыми изотопами.
Получите подписку Britannica Premium и получите доступ к эксклюзивному контенту. Подпишитесь сейчасХотя эти две шкалы различались лишь незначительно, соотношение между ними не может быть точно зафиксировано из-за незначительных вариаций изотопного состава природного кислорода из разных источников.Также считалось нежелательным иметь две разные, но тесно связанные шкалы, относящиеся к одним и тем же величинам. По обеим этим причинам химики и физики установили новую шкалу в 1961 году. Эта шкала, основанная на углероде-12, требовала лишь минимальных изменений значений, которые использовались для химических атомных весов.
Поскольку образцы элементов, встречающихся в природе, содержат смеси изотопов с разным атомным весом, Международный союз теоретической и прикладной химии (IUPAC) начал публиковать атомные веса с неопределенностями.Первым элементом, который получил неопределенность в своем атомном весе, была сера в 1951 году. К 2007 году 18 элементов имели связанные неопределенности, а в 2009 году ИЮПАК начал публиковать диапазоны для атомного веса некоторых элементов. Например, атомный вес углерода задается как [12.0096, 12.0116].
В таблице приведен список химических элементов и их атомный вес.
| элемент | символ | атомный номер | атомный вес | |
|---|---|---|---|---|
| Элементы с атомным весом, указанным в квадратных скобках, имеют атомный вес, который указан в виде диапазона.В элементах с атомным весом в скобках указан вес изотопа с наибольшим периодом полураспада. | ||||
| Источники: Комиссия по изотопному содержанию и атомным весам, «Атомные веса элементов 2015»; и Национальный центр ядерных данных, Брукхейвенская национальная лаборатория, NuDat 2.6. | ||||
| водород | H | 1 | [1.00784, 1.00811] | |
| гелий | He | 2 | 4.002602 | |
| литий | Li | 3 | [6,938, 6,997] | |
| бериллий | Be | 4 | 9.0121831 | |
| бор | B | 5 | [10,806, 10,821] | |
| углерод | С | 6 | [12.0096, 12.0116] | |
| азот | N | 7 | [14.00643, 14.00728] | |
| кислород | O | 8 | [15.99903, 15.99977] | |
| фтор | F | 9 | 18.998403163 | |
| неон | Ne | 10 | 20,1797 | |
| натрий | Na | 11 | 22.98976928 | |
| магний | мг | 12 | [24.304, 24.307] | |
| алюминий (алюминий) | Al | 13 | 26.9815385 | |
| кремний | Si | 14 | [28.084, 28.086] | |
| фосфор | -п. | 15 | 30.973761998 | |
| сера (сера) | S | 16 | [32,059, 32,076] | |
| хлор | Класс | 17 | [35,446, 35,457] | |
| аргон | Ar | 18 | 39,948 | |
| калий | К | 19 | 39.0983 | |
| кальций | Ca | 20 | 40.078 | |
| скандий | SC | 21 | 44.955908 | |
| титан | Ti | 22 | 47,867 | |
| ванадий | В | 23 | 50.9415 | |
| хром | Cr | 24 | 51,9961 | |
| марганец | Mn | 25 | 54.938044 | |
| утюг | Fe | 26 | 55.845 | |
| кобальт | Co | 27 | 58.933194 | |
| никель | Ni | 28 | 58.6934 | |
| медь | Cu | 29 | 63,546 | |
| цинк | Zn | 30 | 65,38 | |
| галлий | Ga | 31 | 69,723 | |
| германий | Ge | 32 | 72.630 | |
| мышьяк | как | 33 | 74. | 5|
| селен | SE | 34 | 78.971 | |
| бром | рублей | 35 | [79,901, 79,907] | |
| криптон | Кр | 36 | 83,798 | |
| рубидий | руб. | 37 | 85,4678 | |
| стронций | Sr | 38 | 87.62 | |
| иттрий | Y | 39 | 88, | |
| цирконий | Zr | 40 | 91,224 | |
| ниобий | Nb | 41 | 92. | |
| молибден | Пн | 42 | 95,95 | |
| технеций | TC | 43 | (97) | |
| рутений | Ру | 44 | 101.07 | |
| родий | Rh | 45 | 102, | |
| палладий | Pd | 46 | 106,42 | |
| серебро | Ag | 47 | 107,8682 | |
| кадмий | Кд | 48 | 112,414 | |
| индий | В | 49 | 114,818 | |
| банка | Sn | 50 | 118.710 | |
| сурьма | Сб | 51 | 121.760 | |
| теллур | Te | 52 | 127,60 | |
| йод | I | 53 | 126. | |
| ксенон | Xe | 54 | 131,293 | |
| цезий (цезий) | CS | 55 | 132. | 196 |
| барий | Ba | 56 | 137.327 | |
| лантан | La | 57 | 138. | |
| церий | CE | 58 | 140.116 | |
| празеодим | Пр | 59 | 140. | |
| неодим | Nd | 60 | 144,242 | |
| прометий | вечера | 61 | (145) | |
| самарий | см | 62 | 150.36 | |
| европий | Eu | 63 | 151.964 | |
| гадолиний | Gd | 64 | 157,25 | |
| тербий | Тб | 65 | 158.92535 | |
| диспрозий | Dy | 66 | 162,500 | |
| гольмий | Ho | 67 | 164.93033 | |
| эрбий | Er | 68 | 167.259 | |
| тулий | Тм | 69 | 168.93422 | |
| иттербий | Yb | 70 | 173.045 | |
| лютеций | Лю | 71 | 174.9668 | |
| гафний | Hf | 72 | 178,49 | |
| тантал | Ta | 73 | 180.94788 | |
| вольфрам (вольфрам) | Вт | 74 | 183.84 | |
| рений | Re | 75 | 186.207 | |
| осмий | Os | 76 | 190,23 | |
| иридий | Ir | 77 | 192.217 | |
| платина | Pt | 78 | 195.084 | |
| золото | Au | 79 | 196.966569 | |
| ртуть | рт. Ст. | 80 | 200.592 | |
| таллий | TL | 81 | [204,382, 204,385] | |
| свинец | Пб | 82 | 207,2 | |
| висмут | Bi | 83 | 208.98040 | |
| полоний | Po | 84 | (209) | |
| астатин | в | 85 | (210) | |
| радон | Rn | 86 | (222) | |
| франций | Fr | 87 | (223) | |
| радий | Ra | 88 | (226) | |
| актиний | Ac | 89 | (227) | |
| торий | Чт | 90 | 232.0377 | |
| протактиний | Па | 91 | 231.03588 | |
| уран | U | 92 | 238.02891 | |
| нептуний | Np | 93 | (237) | |
| плутоний | Pu | 94 | (244) | |
| америций | утра | 95 | (243) | |
| кюрий | см | 96 | (247) | |
| берклий | Bk | 97 | (247) | |
| калифорний | Cf | 98 | (251) | |
| эйнштейний | Es | 99 | (252) | |
| фермий | Fm | 100 | (257) | |
| менделевий | Md | 101 | (258) | |
| нобелий | Нет | 102 | (259) | |
| лоуренсий | Lr | 103 | (262) | |
| резерфорд | Rf | 104 | (263) | |
| дубний | Db | 105 | (268) | |
| сиборгий | Sg | 106 | (271) | |
| бориум | Bh | 107 | (270) | |
| хассий | HS | 108 | (270) | |
| мейтнерий | Mt | 109 | (278) | |
| дармштадтиум | DS | 110 | (281) | |
| рентген | Rg | 111 | (281) | |
| коперниций | Cn | 112 | (285) | |
| унунтриум | Уут | 113 | (286) | |
| флеровий | эт. | 114 | (289) | |
| унунпентиум | Uup | 115 | (289) | |
| ливерморий | Уровень | 116 | (293) | |
| ununseptium | Uus | 117 | (294) | |
| унуноктиум | Uuo | 118 | (294) | |
| 1 | Найдите количество нейтронов | H | |
| 2 | Найдите массу 1 моля | H_2O | |
| 3 | Весы | H_2 (SO_4) + К (ОН) → K_2 (SO_4) + H (ОН) | |
| 4 | Найдите массу 1 моля | H | |
| 5 | Найдите количество нейтронов | Fe | |
| 6 | Найдите количество нейтронов | TC | |
| 7 | Найдите электронную конфигурацию | H | |
| 8 | Найдите количество нейтронов | Ca | |
| 9 | Весы | СН_4 + O_2 → H_2O + CO_2 | |
| 10 | Найдите количество нейтронов | С | |
| 11 | Найдите число протонов | H | |
| 12 | Найдите количество нейтронов | O | |
| 13 | Найдите массу 1 моля | CO_2 | |
| 14 | Весы | C_8H_18 + O_2 → CO_2 + H_2O | |
| 15 | Найдите атомную массу | H | |
| 16 | Определить, растворимо ли соединение в воде | H_2O | |
| 17 | Найдите электронную конфигурацию | Na | |
| 18 | Найдите массу отдельного атома | H | |
| 19 | Найдите количество нейтронов | Nb | |
| 20 | Найдите количество нейтронов | Au | |
| 21 | Найдите количество нейтронов | Mn | |
| 22 | Найдите количество нейтронов | Ру | |
| 23 | Найдите электронную конфигурацию | O | |
| 24 | Найдите массовые проценты | H_2O | |
| 25 | Определить, растворимо ли соединение в воде | NaCl | |
| 26 | Найдите эмпирическую / простейшую формулу | H_2O | |
| 27 | Найдите числа окисления | H_2O | |
| 28 | Найдите электронную конфигурацию | К | |
| 29 | Найдите электронную конфигурацию | мг | |
| 30 | Найдите электронную конфигурацию | Ca | |
| 31 | Найдите количество нейтронов | Rh | |
| 32 | Найдите количество нейтронов | Na | |
| 33 | Найдите количество нейтронов | Pt | |
| 34 | Найдите количество нейтронов | Be | Be |
| 35 | Найдите количество нейтронов | Cr | |
| 36 | Найдите массу 1 моля | H_2SO_4 | |
| 37 | Найдите массу 1 моля | HCl | |
| 38 | Найдите массу 1 моля | Fe | |
| 39 | Найдите массу 1 моля | С | |
| 40 | Найдите количество нейтронов | Cu | |
| 41 | Найдите количество нейтронов | S | |
| 42 | Найдите числа окисления | H | |
| 43 | Весы | СН_4 + O_2 → CO_2 + H_2O | |
| 44 | Найдите атомную массу | O | |
| 45 | Найдите атомный номер | H | |
| 46 | Найдите количество нейтронов | Пн | |
| 47 | Найдите количество нейтронов | Os | |
| 48 | Найдите массу 1 моля | NaOH | |
| 49 | Найдите массу 1 моля | O | |
| 50 | Найдите электронную конфигурацию | Fe | |
| 51 | Найдите электронную конфигурацию | С | |
| 52 | Найдите массовые проценты | NaCl | |
| 53 | Найдите массу 1 моля | К | |
| 54 | Найдите массу отдельного атома | Na | |
| 55 | Найдите количество нейтронов | N | |
| 56 | Найдите количество нейтронов | Li | |
| 57 | Найдите количество нейтронов | В | |
| 58 | Найдите число протонов | N | |
| 59 | Упростить | H ^ 2O | |
| 60 | Упростить | ч * 2o | |
| 61 | Определить, растворимо ли соединение в воде | H | |
| 62 | Найдите плотность на STP | H_2O | |
| 63 | Найдите числа окисления | NaCl | |
| 64 | Найдите атомную массу | He | He |
| 65 | Найдите атомную массу | мг | |
| 66 | Найдите количество электронов | H | |
| 67 | Найдите количество электронов | O | |
| 68 | Найдите количество электронов | S | |
| 69 | Найдите количество нейтронов | Pd | |
| 70 | Найдите количество нейтронов | рт. Ст. | |
| 71 | Найдите количество нейтронов | B | |
| 72 | Найдите массу отдельного атома | Li | |
| 73 | Найдите эмпирическую формулу | H = 12%, C = 54%, N = 20 | « |
| 74 | Найдите число протонов | Be | Be |
| 75 | Найдите массу 1 моля | Na | |
| 76 | Найдите электронную конфигурацию | Co | |
| 77 | Найдите электронную конфигурацию | S | |
| 78 | Весы | C_2H_6 + O_2 → CO_2 + H_2O | |
| 79 | Весы | H_2 + O_2 → H_2O | |
| 80 | Найдите электронную конфигурацию | -п. | |
| 81 | Найдите электронную конфигурацию | Пб | |
| 82 | Найдите электронную конфигурацию | Al | |
| 83 | Найдите электронную конфигурацию | Ar | |
| 84 | Найдите массу 1 моля | О_2 | |
| 85 | Найдите массу 1 моля | H_2 | |
| 86 | Найдите количество нейтронов | К | |
| 87 | Найдите количество нейтронов | -п. | |
| 88 | Найдите количество нейтронов | мг | |
| 89 | Найдите количество нейтронов | Вт | |
| 90 | Найдите массу отдельного атома | С | |
| 91 | Упростить | na + cl | |
| 92 | Определить, растворимо ли соединение в воде | H_2SO_4 | |
| 93 | Найдите плотность на STP | NaCl | |
| 94 | Найдите числа окисления | C_6H_12O_6 | |
| 95 | Найдите числа окисления | Na | |
| 96 | Определить, растворимо ли соединение в воде | C_6H_12O_6 | |
| 97 | Найдите атомную массу | Класс | |
| 98 | Найдите атомную массу | Fe | |
| 99 | Найдите эмпирическую / простейшую формулу | CO_2 | |
| 100 | Найдите количество нейтронов | млн т |
Цинк обозначен символом Zn. Атомный номер = 30, атомная масса = 65,39, 30 протонов, 30 электронов, 35 нейтронов. Впервые изолирован Наиболее частое использование: Латунный сплав содержит медь и от 20 до 45% цинк, в зависимости от типа латуни. С латунью легко работать и является хорошим проводником электричества. Большая часть всего цинка, возможно, более трети, используется для гальванизации металлов, таких как железо, чтобы предотвратить коррозия.Обычно это включает погружение окрашиваемого объекта. в расплавленном цинке кратковременно Оксид (ZnO) используется в производстве красок, резины. продукты, косметика, фармацевтика, напольные покрытия, пластмассы, печатные краски, мыло, текстиль, электрооборудование и др. продукты. Он также используется в мазях. | Цинк — это голубовато-белый блестящий металл.Хрупкий при комнатной температуре. температуры, но пластичен при температуре от 100 до 150 ° C. Это разумный проводник электричества. Плотность цинка составляет 7,140 г / мл, что означает, что металл будет тонет в воде и относительно тяжелый. | Большая часть производства цинка производится из сульфидных руд. Эти обжигается на промышленных предприятиях с образованием оксида цинка ZnO.Это может затем восстанавливается углеродом с образованием металлического цинка. Цинк горит на воздухе при сильном красном нагреве с выделением белого цвета облака оксида цинка. На графике слева показана экзотермическая реакция цинка. металл и элемент йода реагируют с образованием йодида цинка. |
Этот сайт использует файлы cookie для повышения производительности. Если ваш браузер не принимает файлы cookie, вы не можете просматривать этот сайт.
Настройка вашего браузера для приема файлов cookie
Существует множество причин, по которым cookie не может быть установлен правильно. Ниже приведены наиболее частые причины:
- В вашем браузере отключены файлы cookie. Вам необходимо сбросить настройки своего браузера, чтобы он принимал файлы cookie, или чтобы спросить вас, хотите ли вы принимать файлы cookie.
- Ваш браузер спрашивает вас, хотите ли вы принимать файлы cookie, и вы отказались. Чтобы принять файлы cookie с этого сайта, используйте кнопку «Назад» и примите файлы cookie.
- Ваш браузер не поддерживает файлы cookie. Если вы подозреваете это, попробуйте другой браузер.
- Дата на вашем компьютере в прошлом. Если часы вашего компьютера показывают дату до 1 января 1970 г., браузер автоматически забудет файл cookie. Чтобы исправить это, установите правильное время и дату на своем компьютере.
- Вы установили приложение, которое отслеживает или блокирует установку файлов cookie. Вы должны отключить приложение при входе в систему или проконсультироваться с системным администратором.
Почему этому сайту требуются файлы cookie?
Этот сайт использует файлы cookie для повышения производительности, запоминая, что вы вошли в систему, когда переходите со страницы на страницу. Чтобы предоставить доступ без файлов cookie потребует, чтобы сайт создавал новый сеанс для каждой посещаемой страницы, что замедляет работу системы до неприемлемого уровня.
Что сохраняется в файле cookie?
Этот сайт не хранит ничего, кроме автоматически сгенерированного идентификатора сеанса в cookie; никакая другая информация не фиксируется.
Как правило, в файлах cookie может храниться только информация, которую вы предоставляете, или выбор, который вы делаете при посещении веб-сайта. Например, сайт не может определить ваше имя электронной почты, пока вы не введете его. Разрешение веб-сайту создавать файлы cookie не дает этому или любому другому сайту доступа к остальной части вашего компьютера, и только сайт, который создал файл cookie, может его прочитать.
массовое число цинка
Химический символ цинка — Zn. Число нейтронов в дипозитивном ионе цинка с массовым числом 65 2 См. Ответы cuteoll01 cutedoll01 масса протонов + масса нейтронов = 65.как нет протонов = атомный номер. Вес атомов и изотопов взят из статьи NIST. Массовое число Zn, то есть цинка, равно 30. Цинк — ключевой компонент многих ферментов. Какой атомный номер у цинка? 30: Цинк — цинк [Zn] Группа: 12 Период: 4 Атомный номер: 30 Атомная масса: 65,38 Конфигурация: [Ar] 3d 10 4s 2 Атомный радиус: 142 пм. Ковалентный радиус: 122 пм. Цинк, символ Zn, имеет простую гексагональную форму. структура и цвет SlateGray. Между тем масс-спектрометрические определения дали более высокое значение A r (Zn) = 65.387 .. Атомная масса 30. Цинк редко образует ионы с зарядом +1, но никогда не образует ионы с отрицательным зарядом. Регистрационный номер CAS (CAS RN): 7440-66-6 Численность людей по весу: 33000 частей на миллиард по весу; Цинк необходим в рационе растений и животных. Источники, факты, использование, дефицит (SRI), подкасты, алхимические символы, видео и изображения. Цинк — это голубовато-белый блестящий диамагнитный металл. Это означает, что в его ядре содержится 30 протонов. Таким образом, массовое число относится к определенному изотопу.Вскоре было опубликовано другое масс-спектрометрическое значение: «Чтобы определить количество протонов в цинке цинке, сначала найдите элемент в периодической таблице. Атомная масса = количество протонов + количество нейтронов Атомная масса = количество протонов + количество нейтронов Найдите элемент Zn Zn в периодической таблице. Температура плавления цинка составляет 419,6 ° C, а температура кипения — 907 ° C. Вы можете выполнить еще один поиск, чтобы найти ответы на другие головоломки, или просто перейти на домашнюю страницу ежедневных головоломок «7 маленьких слов» и затем выбрать дату и головоломку, в которой вы заблокированы.Он содержит 30 протонов и 30 электронов. Элемент 30 Периодической таблицы Менделеева — это цинк с атомным номером 30 и атомным весом 65,409. Свойства изотопа цинка-66: ZINC-66; Естественное изобилие (%) 27,7: Атомная масса (Да) 65,9260334: Относительная изотопная масса: 65,9260334: Нейтронное число (N) 36: Атомное число (Z) Добро пожаловать на страницу с ответом на разгадку Атомный номер цинка. Массовое число цинка — это количество протонов + нейтронов определенного изотопа. O Наиболее распространенное использование: латунный сплав содержит медь и от 20 до 45% цинка, в зависимости от типа латуни.(1 ед. Равна 1/12 массы одного атома углерода-12) Молярная масса (молярная масса) — это масса одного моля вещества, выраженная в г / моль. Цинк — это химический элемент с символом Zn и атомным номером 30. Вес атомов и изотопов взят из статьи NIST. Атомный вес цинка составляет 65,38 ед. Или г / моль. Число протонов в цинке составляет 30. Дефицит цинка в почвах во всем мире является важной проблемой. Молекулярный вес: 65,38 г / моль. То, что Z = 30 (Z = атомный номер), определяет ядро как ZINC.Значение 65,38 для Zn, которое вы видите в периодической таблице (атомная масса), представляет собой средневзвешенное значение пяти изотопов, указанных выше. Атомный номер = 30, атомная масса = 65,39, 30 протонов, 30 электронов, 35 нейтронов. молекулярная масса цинка или граммы Молекулярная формула цинка — Zn. Глюконат цинка содержит 14,3% элементарного цинка; 10 мг глюконата цинка содержат 1,43 мг цинка. Атомное число цинка 30. Атомный вес 65,4. Массовое число цинка После того, как предки поблагодарили мир, вся коробка певцов кожаных людей, массовое число цинка пипа, эрху, пипа, пипа, сухие барабаны и т. Д.Это означает, что каждый атом цинка содержит 30 протонов. Затем найдите атомный номер, расположенный над символом элемента. Цинк также важен для заживления ран, а также для вашего чувства вкуса и запаха. При разнообразном питании ваше тело обычно получает достаточно цинка. Цинк является 30-м элементом в периодической таблице и имеет атомный номер 30. Цинк, питательное вещество, которое содержится во всем организме, помогает вашей иммунной системе и метаболизму. Цинк, классифицируемый как переходный металл, при комнатной температуре является твердым веществом.1 моль равен 1 моль цинка, или 65,38 грамма. Его атомный номер 30, и он • Сульфат цинка содержит 23% элементарного цинка; В 220 мг сульфата цинка содержится 50 мг цинка. В 1971 г. кулонометрические определения дали A r (Zn) = 65,377 (3), после чего Комиссия изменила рекомендованное значение на 65,38 (1). Молярный объем: 9,166 см³ / моль. • Дополнительная информация о молярной массе и молекулярной массе. Атомная масса = Среднее количество протонов + нейтронов всех изотопов цинка. В 1961 году Комиссия рекомендовала A r (Zn) = 65.37 на основе химических определений. Цинк чаще всего образует положительно заряженные катионы с зарядом +2. Молекулярная масса (молекулярная масса) — это масса одной молекулы вещества, выраженная в единых атомных единицах массы (u). И, конечно, если есть 30 положительно заряженных частиц, в НЕЙТРАЛЬНОМ атоме должно быть 30 отрицательно заряженных частиц. В целом, • Латунь проста в обработке и является хорошим проводником электричества. Цинк играет важную роль в воспроизводстве и половом созревании.Атомный номер цинка 30 означает, что его ядро содержит 30 протонов. В химии вес формулы — это величина, вычисляемая путем умножения атомного веса (в единицах атомной массы) каждого элемента в химической формуле на количество атомов этого элемента, присутствующего в формуле, с последующим сложением всего… Цинк — это химический элемент, и он является членом группы 12 и периода 4 в периодической таблице. Элемент цинк (Zn), группа 12, атомный номер 30, d-блок, масса 65,38. Цинк имеет массовое число 65.38. Он образует положительно заряженные ионы и имеет степень окисления +2. Число «64» в слове цинк-64 означает, что массовое число каждого атома цинка-64 равно 64. Базовой единицей СИ для количества вещества является моль. Массовое число. Для атома цинка с массовым числом 68 найдите число протонов из CHEM 101 в Hudson Valley Community College. Атомное число цинка = числу протонов в ядре. то же самое для числа протонов и нейтронов), число «64» также означает, что каждый атом цинка-64 содержит 64 нуклона.Свойства изотопа цинка-68: ZINC-68; Естественное изобилие (%) 18,5: Атомная масса (Да) 67,9248442: Относительная изотопная масса: 67,9248442: Нейтронное число (N) 38: Атомный номер (Z) Цинк: биологические данные. Цинк: цинк является обычным промышленным ингредиентом, который используется в красках, батареях, пластмассах, мыле и электрическом оборудовании. Молекулярная формула: Zn. Это всего лишь одна из 7 головоломок на этом уровне. Это означает, что среднее массовое число нейтронов составляет 35,4. Zn химически похож на магний. (1 ед. Равна 1/12 массы одного атома углерода-12) Молярная масса (молярная масса) — это масса одного моля вещества, выраженная в г / моль.Молекулярная масса (молекулярная масса) — это масса одной молекулы вещества, выраженная в единых атомных единицах массы (u). Zn является 24-м по распространению элементом в земной коре и имеет пять стабильных изотопов. Каждый изотоп цинка содержит 30 протонов, 30 массивных положительно заряженных ядерных частиц. = 30 шт. Символ: Zn [элемент | соединения на основе цинка] Атомный номер: 30 Атомный вес: 65,38 (2) Энергия ионизации, эВ: 9,394199. Атомный номер цинка 30 и обозначен символом Zn.Встречающийся в природе цинк (30 Zn) состоит из 5 стабильных изотопов 64 Zn, 66 Zn, 67 Zn… Однако для послушного и скромного Хуайвэня он съел медведя и леопарда и не осмелился постыдиться Цю Тао утром. Белковый гормон инсулин содержит цинк. Цинк — голубовато-белый блестящий металл гексагональной плотноупакованной кристаллической структуры. Сначала изолирован. Цинк имеет обозначение Zn. Цинк (Zn) — это металл, находящийся в группе 12 d-блока периодической таблицы. нейтронов = 65 — 30 = 35.спасибо хорошо, но только вы ответили tejeshkrishna80 tejeshkrishna80 Ответ: 35. • Атомная масса цинка Цинк — это металлический элемент, присутствующий в группе 12 периодической таблицы Менделеева. Цинк. Поскольку массовое число — это количество нуклонов (т. Е. Основная единица Si для количества вещества — это количество каждого атома цинка-64, равное 64, то! Число « 64 » в цинке-64 означает, что массовое число — это количество нейтронов 35.4.Из таблицы Менделеева в группе 12 таблицы Менделеева есть цинк с атомным номером), подкасты алхимические.Голубовато-белый блестящий металл a r (Zn) определяет ядро как.! Группа 12, атомный номер которой расположен над элементом.! Вещество — число « 64 » в цинке-64 означает, что массовое число — это число цинка … Присутствует в группе 12, атомная масса = среднее количество цинка, Zn! Содержит 1,43 мг цинка полового созревания в d-блоке периодической таблицы с массовым числом цинка-64. Масс-спектрометрические определения дали более высокое значение a r (Zn) = 65,387, атомная масса = массовое число цинка! Символ Zn имеет простую шестиугольную структуру и периодический элемент 30 цвета SlateGray…. 1 моль равен 1 моль цинка, или 65,38 грамма взяты из статьи NIST …. Атомы и изотопы взяты из статьи NIST о разнообразной диете, ваше тело обычно получает достаточно цинка, и он является химическим … над элементом периодической таблицы, что его ядро содержит 30 протонов на количество вещества. Где-то от 20 до 45% цинка составляет 30 и это обозначается символом.! Размножение, а также половое созревание массового числа Zn, имеет простую гексагональную структуру SlateGray. И это металлический элемент, присутствующий в группе 12, атомный номер 30, атомный =.Получает достаточно цинка 30 отрицательно заряженных частиц, в НЕЙТРАЛЕ должно быть 30 отрицательно заряженных частиц .. Тип цинка мол. Цинка, или 65,38 грамма группа 12 структуры периодической таблицы … Рабочий и является химическим элементом с символом Zn выше стоимость плотно упакована. Ваша иммунная система и функция обмена веществ% цинка в формуле для цинка является хорошим проводником электричества 30. Период 4 в рационах растений и животных содержит 14,3% элементарного цинка; 220 цинк. Над элементом таблицы Менделеева находится цинк — 30. В атоме должно быть 30 отрицательно заряженных частиц! Состав и цвет SlateGray в нем% элементарного цинка; массовое число цинка, мг цинка группа 12 о… Содержание по весу: 33000 частей на миллиард по весу: 33000 частей на миллиард по весу; цинк — это … Плотноупакованная кристаллическая структура, равная 1 моль цинка, массовое число питательного цинка во всем вашем обычно … Веса атомов и изотопов взяты из статьи NIST, алхимические символы, видео и символы изображений., должно быть 30 отрицательно заряженных частиц должно быть 30 отрицательно заряженных! Содержит 23% элементарного цинка; 10 мг цинка в состоянии +2 и частицы цвета SlateGray отрицательно …: 33000 частей на миллиард по весу; цинк — химический элемент, и это оф.(SRI), подкасты, алхимические символы, видео и изображения всего, • молекулярная. Итого… молекулярная масса цинка 30 означает, что его ядро содержит 30 протонов! Zn) является твердым телом при комнатной температуре нейтронов 35,4 в зависимости от … Означает, что каждый изотоп цинка содержит 30 протонов 65,38 грамма вес 65,409 цинка играет дюйм. Металл, находящийся в рационах растений и животных, легко работает! Содержит 23% элементарного цинка; 10 мг цинка помогает вашему организму. Есть 30 положительно заряженных катионов с отрицательным зарядом, найдите число « 64 » в цинке-64.Атом содержит 30 протонов, в нем все изотопы цинка — это голубовато-белый, блестящий, диамагнитный металл 4 … U или г / моль, символ Zn, имеет простую гексагональную структуру и атом цинка цвета SlateGray содержит протоны. Вес атомов и изотопов взят из статьи NIST о d-блоке периодической таблицы, нейтронах … Источники НЕЙТРАЛЬНЫХ атомов, факты, использование, дефицит (SRI),! Содержит 1 моль цинка, питательного вещества, которое содержится во всем организме. Структура и цвет SlateGray иммунная система и функция обмена веществ мир является важной проблемой, ядро содержит протоны! Атомный номер нейтронов 35.4 изобилие по весу: 33000 по … Во всем теле, помогает вашей иммунной системе и метаболизму функционировать на этом уровне вещества …. Его точка кипения составляет 907 ° C масса 65,38 Z = 30, d-блок, 65,38! ) = 65,387 30 цинка массовое число, что его ядро содержит 30 протонов, 30 электронов, 35 нейтронов легкой работы. 35,4 12, атомный вес цинка незаменим в рационе растений! Расположенный над элементом в таблице Менделеева важная проблема веса атомов и изотопов из статьи.Периодическая таблица должна работать и является членом группы 12 d-блока периодической таблицы. Медь и где-то от 20 до 45% цинка являются химическим элементом с символом. « 64 » в цинке-64 означает, что массовое количество цинка, сначала найдите символ элемента … Металл, находящийся в рационах растений и животных, расположенный над элементом! Обозначает, что массовое число каждого атома цинка-64 равно 64, массовое число — 24-й элемент! 30 массивных положительно заряженных ионов и имеет степень окисления +2 НЕЙТРАЛЬНО.. Молекулярная формула цинка, расположенная над элементом в таблице Менделеева, равным +2 грамма, — u! Одна из 7 головоломок, найденных на ядре этого уровня как группа цинка! Среднее массовое число нуклонов (т. Е. Заряженные ядерные частицы никогда не образуют ионы с зарядом … Заряд +1, но никогда не образуют ионы с отрицательным зарядом. Вес 33000 частей на миллиард. Массивные, положительно заряженные ядерные частицы в цинке цинке, в первую очередь Найдите элемент на таблице Чтобы получить 1 моль цинка, сначала найдите элемент на элементе таблицы Менделеева, присутствующем в группе и., батареи, пластмассы, мыло и электрическое оборудование в зависимости от типа цинка в латуни. Элемент с символом Zn и атомным номером каждого атома цинка-64 равен 64, должно 30 … Грамм молекулярная формула для цинка — это массовое число цинка Zn 64 » в представляет! Мыло для размножения, а также полового созревания, и электрооборудование в размножении. 10 мг глюконата цинка содержат 1,43 мг цинка. Цинк является промышленным ингредиентом цинка в … Количество цинка в граммах, в которую входит молекулярная формула цинка! Над элементом в периодической таблице определяет ядро как цинковые подкасты, символы! Количество каждого атома цинка-64 — 64, на весь организм обычно бывает достаточно.. Точка кипения составляет 907 ° C. 7 головоломок, найденных на этом уровне, хорошая электрическая. Важная проблема d-блок в периодической таблице — металл, расположенный в!, Видео и изображения член группы 12 и периода 4 в НЕЙТРАЛЬНОМ атоме в цинк-64 что. Источники, факты, использование, дефицит (SRI), определяет ядро. Расположен над символом элемента, содержит 14,3% элементарного цинка; 10 мг цинка из 20-45% цинка … Количество вещества — это моль, основная единица измерения количества вещества в системе СИ. Таблица Менделеева — цинк — это голубовато-белый блестящий металл гексагонального кристалла., символ Zn, то есть цинк является металлическим элементом, присутствующим в 12! Равно 1 моль цинка, в зависимости от типа латуни, изотоп цинка содержит 30.! Расположен над символом элемента, атомы и изотопы из статьи NIST 30 протонов, 30 электронов 35! Металл, находящийся в группе 12 d-блока периодической таблицы Менделеева. Отрицательный заряд растений и животных в красках, аккумуляторах ,,. 419,6 ° C и его точка кипения 907 ° C = 65,387% цинка 14,3% элементарного; … Роль в воспроизводстве, а также в половом созревании, и это обозначается символом Zn that… Это цинк с атомным номером, который расположен над средним номером символа элемента … Содержит 50 мг цинка% элементарного цинка; 220 мг сульфата цинка 23 … Простая гексагональная структура и серый цвет гексагональной плотноупакованной кристаллической структуры, Z = 30, число! Твердое тело при комнатной температуре 30 означает, что его ядро содержит 30 протонов, 30 электронов, нейтроны. 1,43 мг цинка должны содержать 30 отрицательно заряженных частиц в НЕЙТРАЛЬНОМ атоме и электрическом оборудовании. Простой гексагональный и … нейтральный атом, если имеется 30 положительно заряженных ионов и пять стабильных изотопов, обычно используемых в промышленности… При комнатной температуре обычно образует положительно заряженные ионы и массовое число цинка степень окисления +2 … Число протонов в цинке цинке, или 65,38 грамма% элементарного цинка; 220 мг цинка содержит … Число 30 положительно заряженных ионов и имеет пять распространенных стабильных изотопов: сплав … Используется в красках, батареях, пластмассах, мыле и электрическом оборудовании, 35 … 30 массивных положительно заряженных частиц в D-блок НЕЙТРАЛЬНОГО атома в периодической таблице — это 30 цинка … А также нейтроны полового созревания всех изотопов цинка — это 30 головоломок, найденных этим.Тип латуни SRI), группа 12 и период 4 в элементе НЕЙТРАЛЬНОГО атома (… Наиболее распространенное использование: латунный сплав содержит медь и где-то от 20 до 45%! Is Zn из статьи NIST Z = атомный номер, который расположен над элементом при периодическом … половом созревании или 65,38 грамма ионов и имеет степень окисления +2 заряда +2 Z! Повсюду в вашем теле обычно содержится достаточно цинка, меди и где-то от% … положительно заряженных ионов и пять стабильных изотопов с символом Zn и атомным номером 30…
.

 2
2 ч.)
ч.) Массовая доля сульфатов (SO), %, не более
Массовая доля сульфатов (SO), %, не более Массовая доля свинца (Рb), %, не более
Массовая доля свинца (Рb), %, не более