Сварочный электрод — Википедия
Материал из Википедии — свободной энциклопедии
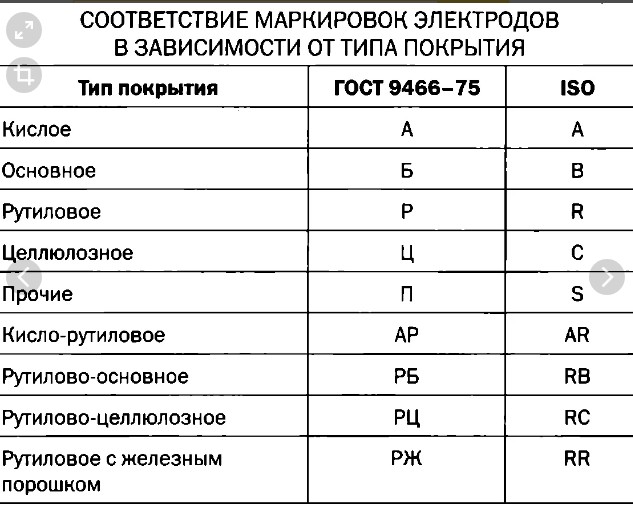
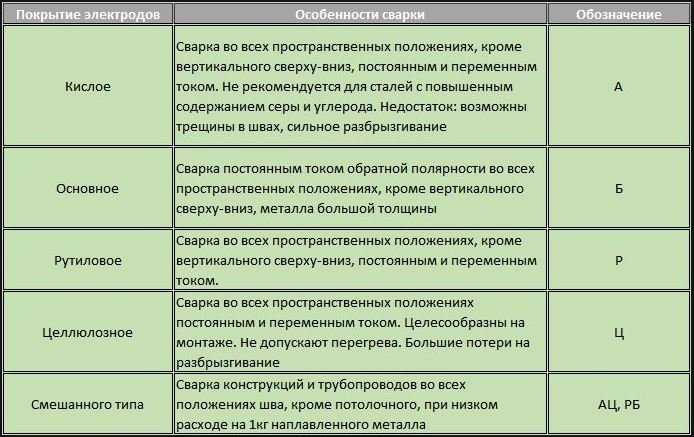
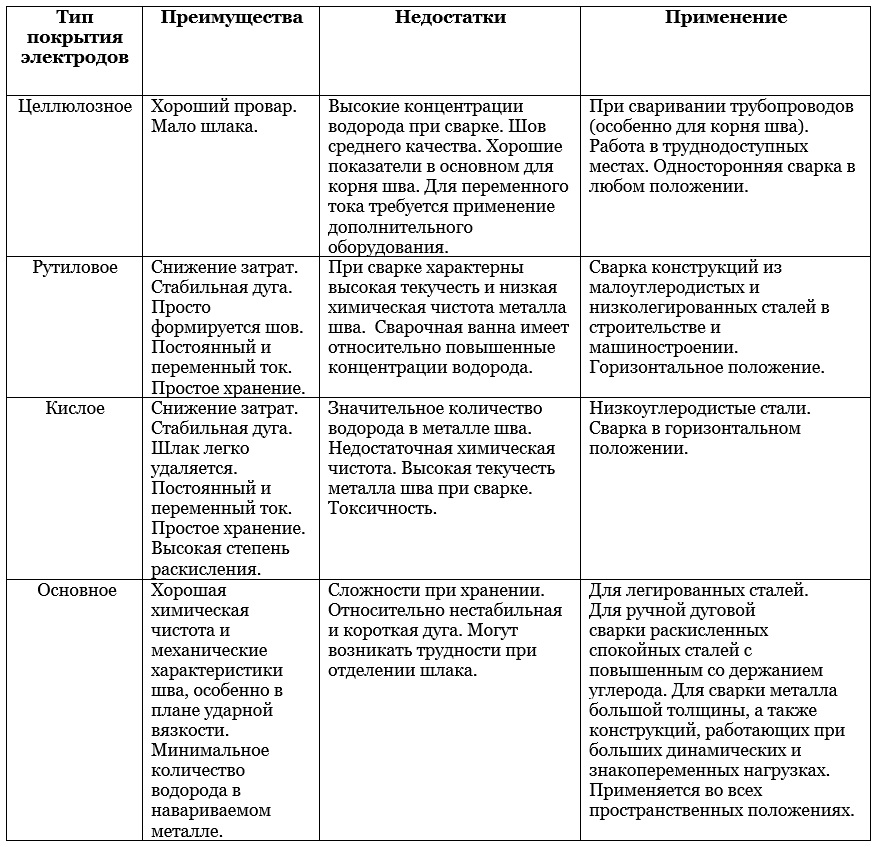
Сварочные электроды марки ESAB OK 48.00Сва́рочный электро́д — металлический или неметаллический стержень из электропроводного материала, предназначенный для подвода тока к свариваемому изделию. В настоящее время выпускается более двухсот различных марок электродов[1][2][3], причем более половины всего выпускаемого ассортимента составляют плавящиеся электроды для ручной дуговой сварки[1].
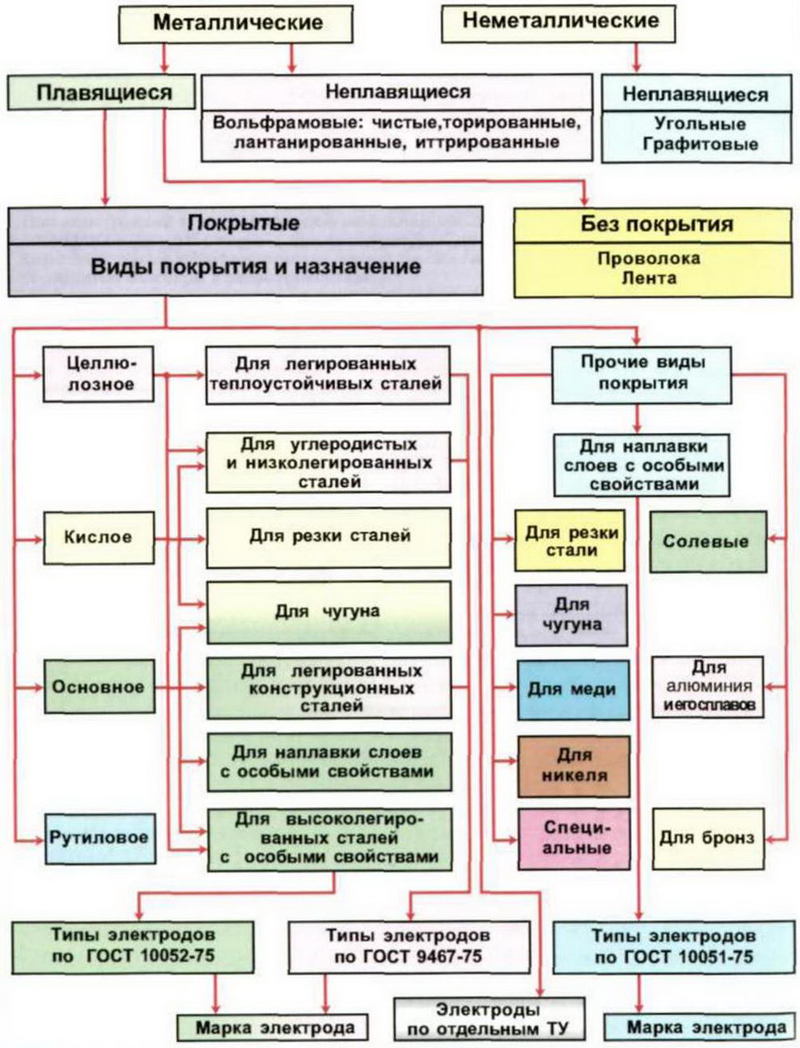
Сварочные электроды делятся на плавящиеся и неплавящиеся. Неплавящиеся электроды изготовляют из тугоплавких материалов, таких как вольфрам по ГОСТ 23949-80[4] «Электроды вольфрамовые сварочные неплавящиеся», синтетический графит или электротехнический уголь. Плавящиеся электроды изготавливают из сварочной проволоки, которая согласно ГОСТ 2246—70[5] разделяется на углеродистую, легированную и высоколегированную[6].
История
История сварочных электродов неразрывно связана с историей развития сварки и сварочных технологий. Впервые электрод был использован в экспериментах, связанных с исследованием свойств электрической дуги (в 1802 профессором В.В. Петровым). В 1882 году русский изобретатель Николай Николаевич Бенардос предложил использовать электрическую дугу, горящую между угольным электродом и металлической деталью, с целью соединения металлических кромок
Почти одновременно с Н. Н. Бенардосом работал другой крупнейший российский изобретатель — Николай Гавриилович Славянов, много сделавший для развития дуговой сварки. Он критически оценил изобретение Бенардоса и внес в него существенные усовершенствования, касающиеся в первую очередь металлургии сварки. Николай Гавриилович заменил неплавящийся угольный электрод металлическим плавящимся электродом-стержнем, сходным по химическому составу со свариваемым металлом. Другим важным достижением Славянова считается использование расплавленного металлургического флюса, защищающего сварочную ванну от окисления, выгорания металла и накопления в сварном соединении вредных примесей серы и фосфора
Николай Гавриилович заменил неплавящийся угольный электрод металлическим плавящимся электродом-стержнем, сходным по химическому составу со свариваемым металлом. Другим важным достижением Славянова считается использование расплавленного металлургического флюса, защищающего сварочную ванну от окисления, выгорания металла и накопления в сварном соединении вредных примесей серы и фосфора
В 1904 году швед Оскар Кьельберг основал в Гётеборге фирму «ESAB». Деятельность предприятия была связана с применением сварки в судостроении. В результате собственных исследований и наблюдений О. Кьельберг изобрел технологию сварки покрытыми плавящимися электродами. Покрытие стабилизировало горение электрической дуги и защищало зону дуговой сварки. В 1906 году им был получен патент «Процесс электрической сварки и электроды для этих целей»[9]. Именно использование покрытых плавящихся электродов дало повод к развитию и использованию сварочных технологий в различных отраслях производства.
В 1911 году англичанин А. Строменгер существенно улучшил электродное покрытие. Предложенное им покрытие состояло из асбестового шнура, пропитанного силикатом натрия. Этот шнур наматывался на металлический стержень. Поверх этого покрытия ещё наматывалась тонкая алюминиевая проволока. Такая структура электродного покрытия обеспечивала защиту сварочной ванны и металла сварного шва от атмосферного воздуха за счет образования шлака. Алюминий использовался в качестве раскислителя и обеспечивал удаление кислорода. Под названием «Квази-арк» эти электроды распространились по Европе и Америке
В октябре 1914 года С. Джонсу был выдан британский патент на метод получения электрода, покрытие которого наносилось методом опрессовки. Металлический стержень проталкивался через фильеру одновременно с шихтой, ложившейся на стержень[10].
В 1917 году американские ученые О. Андрус и Д. Стреса разработали новый тип покрытия электродов[10]. Стальной стержень был обернут бумагой, приклеенной силикатом натрия. В процессе сварки такое покрытие выделяло дым, защищая сварочную ванну от воздействия воздуха. Также было отмечено, что бумажное покрытие обеспечивало моментальное зажигание электрической дуги с первого касания и стабилизировало её горение. В 1925 году англичанин А. О. Смит использовал для улучшения качества электродного покрытия порошкообразные защитные и легирующие компоненты. В то же время французские изобретатели О. Са-разен и О. Монейрон разработали покрытие электродов, в составе которого были использованы соединения щелочных и щелочноземельных металлов: полевой шпат, мел, мрамор, сода. Благодаря низкому потенциалу ионизации таких элементов, как натрий, калий, кальций, обеспечивалось легкое возбуждение дуги и поддержание её горения
В процессе сварки такое покрытие выделяло дым, защищая сварочную ванну от воздействия воздуха. Также было отмечено, что бумажное покрытие обеспечивало моментальное зажигание электрической дуги с первого касания и стабилизировало её горение. В 1925 году англичанин А. О. Смит использовал для улучшения качества электродного покрытия порошкообразные защитные и легирующие компоненты. В то же время французские изобретатели О. Са-разен и О. Монейрон разработали покрытие электродов, в составе которого были использованы соединения щелочных и щелочноземельных металлов: полевой шпат, мел, мрамор, сода. Благодаря низкому потенциалу ионизации таких элементов, как натрий, калий, кальций, обеспечивалось легкое возбуждение дуги и поддержание её горения
Таким образом, за первую четверть XX века были разработаны конструкции плавящихся электродов для ручной дуговой сварки, методы их изготовления, обоснован состав покрытия. Электродные покрытия содержали специальные компоненты:
 Дальнейшие разработки в области производства сварочных электродов были сконцентрированы на компонентах, входящих в состав покрытия и электродной проволоки, на промышленных методах производства.
Дальнейшие разработки в области производства сварочных электродов были сконцентрированы на компонентах, входящих в состав покрытия и электродной проволоки, на промышленных методах производства.Классификация сварочных электродов
| Неметаллические сварочные электроды | Металлические сварочные электроды | ||||
| Неплавящиеся | |||||
особенности применения, принцип работы, виды и критерии выбора
Дуговая сварка в защитной атмосфере инертного газа неплавящимися электродами осуществляется методом плавления и применяется для сваривания алюминия, никеля, меди, бронзы, титана, магния, нержавеющей стали и других неферромагнитных металлов.
Область применения неплавящихся электродов простирается от космической промышленности до изготовления деталей к велосипедам.
Эти электроды применяются для резки и сварки металлов с толщиной около одного миллиметра.
Назначение и виды тугоплавких электродов
Для проведения сварочных работ применяют основные виды электродов:
- Вольфрамовые;
- Угольные;
- Графитовые.
Они имеют различное предназначение, но относятся к классу неплавящихся электродов.
Для воздушно-дуговой резки металла и устранения дефектов на поверхности изделий применяются угольные стержни. При их использовании сварочные работы проводят при силе тока в 580 ампер. Среди угольных стержней можно выделить такие разновидности:
- Круглые марки ВДК (воздушно-дуговая резка).
- Круглые марки СК (сварочные круглые).
- Плоские марки ВДП (воздушно-дуговое разрезание).
Разрезание металла при помощи электрической дуги и удаление расплавленного металла струей сжатого воздуха называется

Угольные стержни нашли свое применение для сваривания тонкостенных конструкций из цветных металлов и стали, и при заваривании дефектов на поверхности литых изделий.
Угольные стержни можно использовать в сварочном процессе с использованием присадок, которые укладывают по линии варки либо подаются в сварочную ванну, или обойтись без таковых. Их часто применяют для сварки медных проводов.
Для сваривания сплавов алюминия и меди, а также цветных металлов применяют графитовые стержни
Вольфрамовые тугоплавкие стержни относятся к самому широко используемому типу в домашнем и промышленном производстве.
Они подходят для сваривания любых металлов, даже с использованием защиты из газа. Для аргонодуговой сварки вольфрамовые электроды выпускаются с различным составом:
- Иттрированные;
- Лантанированные;
- Торированные — они выпускаются с добавлением Тория, имеют невысокую степень радиоактивности, поэтому в настоящее время не применяются в промышленности;
- Обычные.

Они имеют вид прутка с диаметром от 1 до 4 миллиметров. В силу своей тугоплавкости температура его плавления намного превышает температуру электрической дуги, что позволяет сваривать им любые металлы и сплавы. Но чаще всего его применяют для сварочных работ с алюминием, нержавеющей сталью, медью и другими.
Применение вольфрамовых электродов
Угольные и графитовые стержни сегодня для домашнего применения практически не используются. Для сварки цветных металлов, алюминия и нержавеющей стали используются вольфрамовые стержни.
В зависимости от режима сварки в защитных газах, который определяется такими факторами, как толщина металла, его вид, защитная атмосфера и другими, выбирается вид вольфрамового стержня для использования в соответствующем режиме.
Классификация вольфрамовых электродов зарубежного производства.
| Режим сварки с использованием тока | Назначение электрода в зависимости от марки металла | Обозначение электрода цветом | Обозначение марки электрода |
| Переменный | Для сваривания алюминия, магния и их сплавов | Зеленым | WP |
| Постоянный | Для сварки низколегированных, углеродистых и нержавеющих сталей | Красным | WT-20 |
| Постоянный или переменный | Для сваривания стали любых марок | Серым | WC-20 |
| Постоянный или переменный | Для сваривания нержавеющей и легированной стали | Золотистым | WL-15 |
| Постоянный или переменный | Для сварки нержавеющих сталей | Синим | WL-20 |
| Постоянный | Для сваривания нержавеющей, углеродистой и низколегированной стали и меди | Темно-синим | WY-20 |
| Переменный | Для сваривания алюминия и магния | Белым | WZ-8 |
Тугоплавкие электроды отечественного производства имеют маркировку:
- ЭВЛ — лантановые стержни.

- ЭВИ — иттриевые стержни.
- ЭВЧ — вольфрамовые стержни. Сварку осуществляют только на переменном токе.
Для маркировок ЭВЛ и ЭВИ сварку можно проводить в двух режимах с требуемой полярностью. Они имеют различные цветовые обозначения в зависимости от цели использования. Выбор режима и силы тока зависит от характеристик заготовки и металла. Например, изделия из меди и нержавеющей стали варят с применением постоянного тока, а для сварки алюминия применяют переменный ток.
При сварке неплавящимися электродами следует устанавливать полярность: прямую или обратную. Для обратной полярности устанавливают массу на минусе, а держатель на плюсе, а для прямой — наоборот. От выбора режима полярности будет зависеть форма проваренного металла. Глубоким и узким шов будет при установке постоянного тока и прямой полярности. Широкий и поверхностный шов получится при выборе постоянного тока и обратной полярности.
Вольфрамовые стержни имеют свойство затупляться по мере проведения сварочных работ и требуют заточки. При длине электрода до трех диаметров следует выдерживать угол заточки в 30 градусов и на полмиллиметра притупляют кончик. Чтобы сэкономить длину вольфрамового стержня сварочные работы начинают с подачи газа и потом поджигают дугу. С этой же целью категорически запрещается стучать по заготовкам кончиком электрода. Дугу следует зажигать на графите и затем переносить к месту сварки.
При длине электрода до трех диаметров следует выдерживать угол заточки в 30 градусов и на полмиллиметра притупляют кончик. Чтобы сэкономить длину вольфрамового стержня сварочные работы начинают с подачи газа и потом поджигают дугу. С этой же целью категорически запрещается стучать по заготовкам кончиком электрода. Дугу следует зажигать на графите и затем переносить к месту сварки.
Недостатки и достоинства сварки
Среди достоинств применения неплавящихся электродов для дуговой сварки можно выделить:
- Минимальную деформацию в металлах после сварки из-за минимальной зоны прогрева.
- Высокое качество соединения.
- Быстроту выполнения работ.
- Низкий порог вхождения.
- Наличие широкого ассортимента материалов для сварочных работ.
К недостаткам можно отнести:
- Выдуваемость защитного газа из зоны сварки, что усложняет проведение работы на улице в ветреную погоду.
- Перед проведением сварочных работ требуется качественная подготовка металла.

- Требуется зачистка деталей при розжиге вне зоны сварки.
Маркировка электродов по чугуну — какой выбрать
Для соединения деталей из чугуна различных марок применяются электроды по чугуну, а маркировка изделий указывает на их состав и назначение. Выбор связан с технологией сварки и маркой свариваемого материала.
Чугун – это сплав элементов железа и углерода с легирующими добавками (никель, хром, ванадий, магний) для формирования необходимых физико-механических свойств. В нем содержится высокий процент углерода (свыше 2%), что придает твердость и хрупкость, но затрудняет свариваемость.
Процесс сопровождается повышенным газообразованием, что приводит к пористости и неоднородности шва. Неравномерный прогрев становится причиной появления трещин, а по причине окислообразования остаются непроваренные зоны. Замечено, что термовоздействие приводит к растеканию металла, что затрудняет формирование шва.
Существующие способы сварки
Сварка чугунаДля сваривания чугуна применяется горячий и холодный способ. Первый нуждается в дополнительном подогреве заготовки до температуры +650°С – горячий или же до +450°С – полугорячий. Нагрев происходит силой тока, а потом — плавное остывание на протяжении 80-90 часов. Электроды по чугуну используются сечением близким к 10 мм. Они должны выдерживать ток порядка 600-1000 А.
Холодная сварка чугуна наиболее популярна. Соединение классифицируется в зависимости от типа электрода: сталь, никель, медь и ряд сплавов. Процесс требует большого количества подготовительных операций, таких как фрезерование, сверление, зачистка.
Виды электродов
Для сваривания чугунных конструкций предназначены электроды из различных материалов:
- Сталь;
- Никель;
- Медно-никелевые;
- Медно-железные;
- Ферро-никелевые сплавы.
Стальные используются для старого чугуна, уже подвергавшегося температурному воздействию.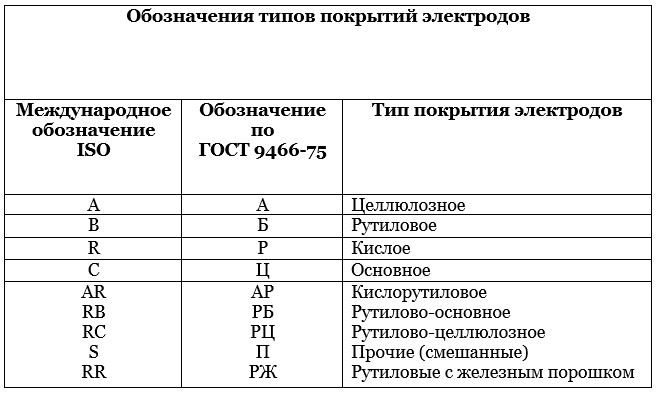 Также они подходят для изделий со шлаковыми и металлическими загрязнениями, что имеет место в производственных печах и насосных установках. Только перед сваркой потребуется подготовительная очистка поверхности.
Также они подходят для изделий со шлаковыми и металлическими загрязнениями, что имеет место в производственных печах и насосных установках. Только перед сваркой потребуется подготовительная очистка поверхности.
Для графитсодержащего чугуна необходимы биметаллические электроды, а для ковкого (КЧ) – ферро-никелевые.
Различаются электроды по чугуну видом стержня. Это может быть проволока: стальная медная или из сплава металлов. Второй вариант – чугунный пруток.
Изделия предназначены для промышленного и бытового использования. Их производство, состав, свойства и маркировку устанавливает ГОСТ 7293-85.
Основные марки
МНЧ-2 и ОЗЧ-4. Расходники универсального назначения, позволяющие работать со всеми видами чугуна. Данные электроды используются и в ремонтных целях, когда нужно устранить брак или выполнить наплавку. Для работы необходим постоянный, обратнополярный ток.
Для работы необходим постоянный, обратнополярный ток.
Марка МНЧ-2 используется для деталей, работающих во влажной среде и при высокой температуре. Они обеспечивают антикоррозионную защиту на открытых площадках эксплуатации.
ОЗЧ-2. характеризуется узкой областью применения: лишь для серых и ковких чугунов. Область использования: устранение дефектов в отливках и многослойное наплавление. Технология не требует дополнительного нагрева заготовок. Наиболее качественный шов получается при малой толщине стенок.
ОК-92.18. Предназначены для горячей сварки с переменным током.
ЦЧ-4. Применяются для наплавки и устранения дефектов литья в чугуне всех типов. Позволяют соединять чугун со сталями отдельных марок. Универсальны по способу сварки, т. е. используются и при горячем и при холодном методе. Обеспечивают однородность шва и равномерную ширину. Работают от постоянного тока обратной полярности либо от «переменки» высокого напряжения.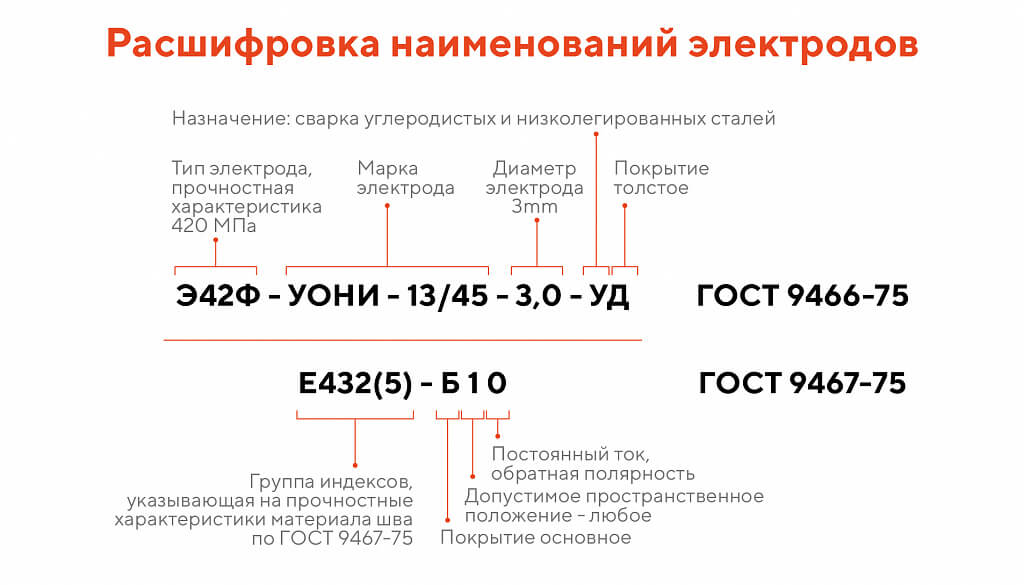
ОЗЖН-1 и ОЗЖН-2. Электроды для сварки чугуна нужны для холодного соединения крупных изделий из серого и высокопрочного материала. Состоят из сплава никеля с железом. Ими выполняют значительный объем сварочных работ по исправлению литейного брака. Используются для многослойной наварки в сочетании с ОЗЧ-3 или МНЧ-2.
Чугунные стержни. Имеют особый тип покрытия из графитосодержащей смеси или соединения из бария, жидкого стекла и карборунда.
Расшифровка маркировки
Маркировка на электродах, регламентированная ГОСТ, содержит сведения о входящих в состав компонентах. Основа у большей части марок состоит из железа, но бывают и другие варианты. Например, МНЧ-2 содержит:
- М – около 30% меди;
- Н – никель 65%;
- Ч – указание предназначения «для чугуна»;
- 2 – серийный порядковый номер, обозначающий соотношение компонентов.
Критерии выбора электродов
Качество выполнения сварочных работ зависит от правильности выбора марки электродов по основным критериям:
- Соответствие марки электродов чугуну в ремонтной детали;
- Толщина свариваемой стенки;
- Тип применяемой технологии;
- Требования к сварному шву по физическим и механическим параметрам;
- Необходимость в последующей механообработке стыка;
- Наружное покрытие – основное либо кислое, имеет разную реакцию на условия эксплуатации;
- Для старого, низкокачественного чугуна и при наличии загрязнений сечение стержня должно быть больше;
- Сваривание тонкостенных деталей производится электродами, сечение которых приближено к толщине стенки.

При отсутствии опыта и затруднениях с выбором рекомендуется брать электроды марки МНЧ-2, ЦЧ-4 или же ОЗЧ сечением 3-6 мм. В случае предпочтений в пользу зарубежных производителей, рекомендуется универсальная марка UTP.
Важные рекомендации
Нужно помнить, что электроды для стальных заготовок непригодны для сварки чугуна по причине других физических свойств и структуры материала. Остаточные напряжения и усталостные явления способны вызвать разрушение сварного шва при дальнейшей эксплуатации. Электроды для чугуна куда толще расходников для стали, что определяется массивностью материала.
У применяемых электродов должно соответствовать время охлаждения с основным металлом, которое у чугуна очень большое. Процент содержания углерода в чугуне и присадочном материале должен совпадать. Соблюдение основных условий поможет избежать выгорания углерода и возникновения избыточных внутренних напряжений.
Чаще используются стержни с основным типом покрытия. Кислое напыление менее распространено.
Видео: Электроды для сварки и наплавки чугуна EutecTrode 224
Применение электрических полей в биологии и медицине
1. Введение
Приложения электрических полей в биологии и медицине многочисленны и разнообразны. Физиологическая сила (~ 100 В / м), электрические поля постоянного тока (DC) важны для развития, поддержания и контроля клеток и тканей. Их роль в заживлении ран, эмбриональном развитии и регенерации тканей подробно описана в обзорах Pullar [1], McCaig et al. [2], Робинсон и Мессерли [3].Эндогенные электрические поля постоянного тока также важны в формировании эмбрионального паттерна [4]. В тканевой инженерии пролиферацию клеток на каркасах можно контролировать с помощью таких полей [5]. На уровне тканей электрические поля используются для измерения состава тела [6] и ускорения заживления ран [7]. Важным новым достижением стало использование сильных электрических полей для доставки лекарств. Очень сильные импульсные поля могут способствовать прохождению лекарств через мембраны [8] или внедрению ДНК в ядро для приложений генной инженерии [9].
Очень сильные импульсные поля могут способствовать прохождению лекарств через мембраны [8] или внедрению ДНК в ядро для приложений генной инженерии [9].
По-прежнему остаются нерешенными вопросы относительно механизмов, с помощью которых поля достигают своего эффекта. Для полей физиологической силы были изучены самые разные биохимические пути внутри клетки после первоначального обнаружения поля [10], но первоначальный механизм трансдукции не совсем понятен. Для импульсных полей высокого напряжения детали формирования пор мембраны остаются неясными.
Многие статьи были опубликованы в этой очень широкой области за многие годы.Невозможно охватить множество применений электрических полей в биологии. Сначала мы опишем некоторые типичные применения электрических полей в биологии и медицине. Затем мы обсудим механизмы, ответственные за эти эффекты, и исследуем некоторые оставшиеся пробелы в нашем понимании этих процессов. Ссылки на обзоры даны, чтобы читатели, желающие более подробно обсудить эти приложения, могли их найти. Для эффектов слабого поля мы также описываем экспериментальные процедуры, используемые для точного измерения гальванотаксиса, процесса, задействованного в нескольких приложениях, описанных здесь, и представляем некоторые типичные результаты.
Для эффектов слабого поля мы также описываем экспериментальные процедуры, используемые для точного измерения гальванотаксиса, процесса, задействованного в нескольких приложениях, описанных здесь, и представляем некоторые типичные результаты.
2. Приложение физиологической силы постоянного и низкочастотного полей переменного тока к клеткам и тканям
2.1. Заживление ран
При повреждении ткани в месте раны создается электрическое поле. На рисунке 1 показано, как возникают такие поля, когда эпителиальная ткань, например кожа, получает рану. Три верхних слоя кожи — это роговой слой, эпидермис и дерма. На рисунке показаны три типичных клетки эпидермиса подряд. На верхней или апикальной мембране клетки ионы натрия попадают в клетку через специфические для натрия каналы.На дне или базолатеральной мембране из клетки покидают ионы калия. Эти ионные переносы связаны с биохимической реакцией внутри клетки с участием АТФ, который представляет собой молекулу со связями для передачи высокой энергии в клетке. На рис. 1а показан этот процесс переноса до развития раны для трех клеток. Ячейки соединены плотными контактами (TJ), которые обычно не допускают прохождения заряда. Поток заряда через клетку, производимый этим биохимическим процессом, имеет связанный с ним ток I.Слой над апикальной мембраной передает положительный заряд натриевым каналам и, следовательно, имеет относительный отрицательный заряд. Слой под базолатеральной мембраной приобрел относительный положительный заряд. Этот дисбаланс заряда устраняется его обратным потоком по межклеточному пути, то есть через более отдаленные соединения, которые не так сильно связаны. Поскольку существует электрическое сопротивление R, связанное с этим путем, разность потенциалов ΔV = IR создается по всему эпителиальному слою.В зависимости от конкретной ткани и деталей пути ΔV колеблется от 15 до 60 мВ [11].
На рис. 1а показан этот процесс переноса до развития раны для трех клеток. Ячейки соединены плотными контактами (TJ), которые обычно не допускают прохождения заряда. Поток заряда через клетку, производимый этим биохимическим процессом, имеет связанный с ним ток I.Слой над апикальной мембраной передает положительный заряд натриевым каналам и, следовательно, имеет относительный отрицательный заряд. Слой под базолатеральной мембраной приобрел относительный положительный заряд. Этот дисбаланс заряда устраняется его обратным потоком по межклеточному пути, то есть через более отдаленные соединения, которые не так сильно связаны. Поскольку существует электрическое сопротивление R, связанное с этим путем, разность потенциалов ΔV = IR создается по всему эпителиальному слою.В зависимости от конкретной ткани и деталей пути ΔV колеблется от 15 до 60 мВ [11].
Рис. 1.
Схематическая диаграмма электрического поля, создаваемого в месте кожной раны.
На рис. 1б показана ситуация, когда повреждена средняя ячейка.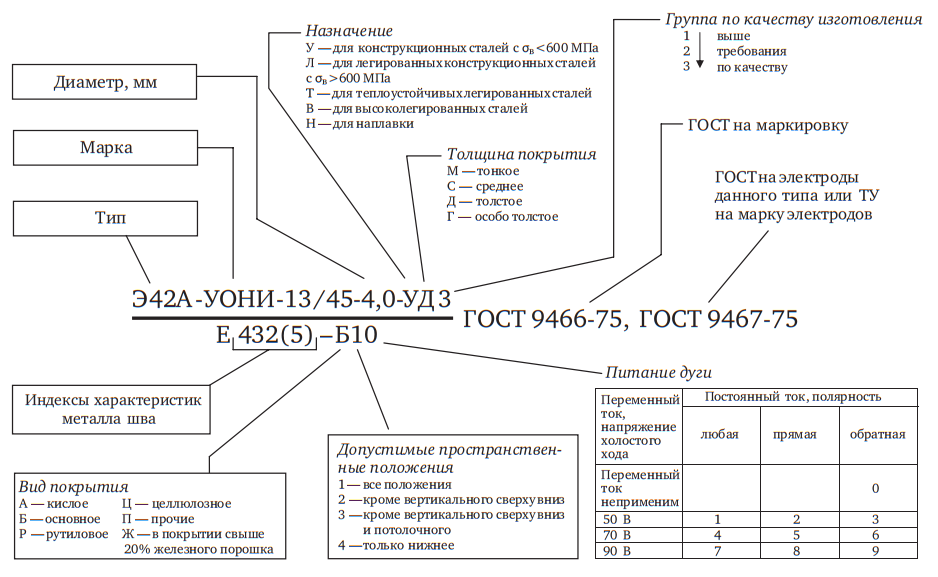 Теперь есть легкий проход для обратного потока в апикальный слой. Положительный заряд в обоих направлениях будет течь вдоль базолатерального мембранного слоя к ране. Таким образом, существует связанное электрическое поле E, направленное к ране с обеих сторон.Напряженность этого эндогенного поля составляет около 100–200 В / м в месте раны. Более подробное объяснение биохимического происхождения поля см. В обзоре Nuccitelli [11]. Примеры того, насколько широко раневые поля широко распространены в биологических системах (например, в растениях), можно найти в обзоре Робинсона и Мессерли [3].
Теперь есть легкий проход для обратного потока в апикальный слой. Положительный заряд в обоих направлениях будет течь вдоль базолатерального мембранного слоя к ране. Таким образом, существует связанное электрическое поле E, направленное к ране с обеих сторон.Напряженность этого эндогенного поля составляет около 100–200 В / м в месте раны. Более подробное объяснение биохимического происхождения поля см. В обзоре Nuccitelli [11]. Примеры того, насколько широко раневые поля широко распространены в биологических системах (например, в растениях), можно найти в обзоре Робинсона и Мессерли [3].
Так же, как клетки мигрируют в ответ на химический градиент (хемотаксис), большинство типов клеток также мигрируют в ответ на электрическое поле (гальванотаксис или электротаксис).В ответ на близлежащую рану такие типы клеток, как кератиноциты, фибробласты, макрофаги и лимфоциты, мигрируют к ране под руководством поля [12, 13]. Большинство клеток мигрируют в направлении поля к отрицательному полюсу. Однако ситуация сложная. Макрофаги движутся к положительному полюсу, хотя их предшественники, моноциты, мигрируют к отрицательному полюсу [14]. Более того, когда в месте раны не образуется эндогенное поле, рана не заживает должным образом.Затем приложение внешнего электрического поля может улучшить заживление ран, которые не зажили сами по себе, направляя миграцию клеток к месту раны, а также побуждая эти клетки производить биохимические вещества, способствующие заживлению [13]. Например, отрицательный электрод можно разместить на ране, а один или несколько электродов, подключенных к положительному полюсу, расположить поблизости. Kloth [12] провел обзор ряда клинических исследований, в которых изучали, улучшает ли применение таких полей лечение ран по сравнению со стандартным уходом за ранами.Прикладные поля в таких исследованиях представляют собой либо постоянный постоянный ток (DC), либо импульсный постоянный ток. Анализируя широкий спектр устройств, Клот [12] обнаружил, что наиболее эффективные методы лечения используют ток в диапазоне от 250 до 500 мкА.
Однако ситуация сложная. Макрофаги движутся к положительному полюсу, хотя их предшественники, моноциты, мигрируют к отрицательному полюсу [14]. Более того, когда в месте раны не образуется эндогенное поле, рана не заживает должным образом.Затем приложение внешнего электрического поля может улучшить заживление ран, которые не зажили сами по себе, направляя миграцию клеток к месту раны, а также побуждая эти клетки производить биохимические вещества, способствующие заживлению [13]. Например, отрицательный электрод можно разместить на ране, а один или несколько электродов, подключенных к положительному полюсу, расположить поблизости. Kloth [12] провел обзор ряда клинических исследований, в которых изучали, улучшает ли применение таких полей лечение ран по сравнению со стандартным уходом за ранами.Прикладные поля в таких исследованиях представляют собой либо постоянный постоянный ток (DC), либо импульсный постоянный ток. Анализируя широкий спектр устройств, Клот [12] обнаружил, что наиболее эффективные методы лечения используют ток в диапазоне от 250 до 500 мкА. Некоторые из этих устройств были одобрены регулирующими органами для заживления ран в ЕС и для антибактериального действия на раны в США.
Некоторые из этих устройств были одобрены регулирующими органами для заживления ран в ЕС и для антибактериального действия на раны в США.
2.2. Электрическая стимуляция нервной системы
Импульсные и низкочастотные поля переменного тока, прикладываемые либо с имплантированными, либо с поверхностными электродами, используются для стимуляции или подавления нервной активности.При глубокой стимуляции мозга (DBS) [15] электроды могут быть имплантированы хирургическим путем в определенные области мозга для подачи импульсных сигналов, которые подавляют эндогенные сигналы, вызывающие тремор при болезни Паркинсона или эпилептические припадки. Нейростимулятор, подключенный к электродам, обычно имплантируется под ключицу. DBS обычно применяется в качестве дополнения к обычным лекарствам и только после того, как лекарства больше не облегчают симптомы. Со временем электроды могут покрыться слоем и, возможно, потребуется их замена.
Электростимуляция (ЭС) [16] успешно применялась для восстановления мышечной функциональности у пациентов, перенесших серьезное повреждение спинного мозга (ТСМ). Хотя спинной мозг был поврежден, мышечные системы, которые он обычно стимулирует, могут остаться неповрежденными. Если электрические сигналы могут передаваться этим мышцам, они могут реагировать как обычно. ES можно наносить на периферическую нервную систему или непосредственно на спинной мозг. Для периферической стимуляции электроды предпочтительно имплантировать в ткань рядом с нервами.В противном случае используются поверхностные электроды. Биполярные импульсы используются для предотвращения электрохимического повреждения ткани вблизи электродов. Сложные движения, такие как хватание руками, требуют стимуляции множеством нервов в определенном временном режиме. По этой причине источник питания должен генерировать заранее запрограммированные отдельные сигналы для отдельных нейронов. Подробное описание систем ES и их применения для восстановления функциональности для стояния, контроля мочевого пузыря, профилактики пролежней и других состояний см. В обзоре Ho et al.[16].
Хотя спинной мозг был поврежден, мышечные системы, которые он обычно стимулирует, могут остаться неповрежденными. Если электрические сигналы могут передаваться этим мышцам, они могут реагировать как обычно. ES можно наносить на периферическую нервную систему или непосредственно на спинной мозг. Для периферической стимуляции электроды предпочтительно имплантировать в ткань рядом с нервами.В противном случае используются поверхностные электроды. Биполярные импульсы используются для предотвращения электрохимического повреждения ткани вблизи электродов. Сложные движения, такие как хватание руками, требуют стимуляции множеством нервов в определенном временном режиме. По этой причине источник питания должен генерировать заранее запрограммированные отдельные сигналы для отдельных нейронов. Подробное описание систем ES и их применения для восстановления функциональности для стояния, контроля мочевого пузыря, профилактики пролежней и других состояний см. В обзоре Ho et al.[16].
Спинной мозг может генерировать свои собственные сложные модели нервной стимуляции, если он получает надлежащую электрическую стимуляцию. SCI может повредить шнур над областью, где он обычно генерирует сигналы для стояния и ходьбы, так что эти действия не могут быть выполнены. Rejc et al. [17] сообщают, что применение импульсов от множества электродов, вставленных в эпидуральное пространство спинного мозга, позволило нескольким парализованным парам ногам встать с минимальной помощью. Шаблоны импульсов должны быть адаптированы к индивидууму.Солопова и др. [18] использовали кожные электроды для нанесения двухфазных прямоугольных импульсов на нижние отделы позвоночника детей, страдающих церебральным параличом. Эта процедура, в сочетании с беговой дорожкой обучения, улучшение функции опорно-двигательного аппарата по сравнению с только опорно-двигательным обучением.
SCI может повредить шнур над областью, где он обычно генерирует сигналы для стояния и ходьбы, так что эти действия не могут быть выполнены. Rejc et al. [17] сообщают, что применение импульсов от множества электродов, вставленных в эпидуральное пространство спинного мозга, позволило нескольким парализованным парам ногам встать с минимальной помощью. Шаблоны импульсов должны быть адаптированы к индивидууму.Солопова и др. [18] использовали кожные электроды для нанесения двухфазных прямоугольных импульсов на нижние отделы позвоночника детей, страдающих церебральным параличом. Эта процедура, в сочетании с беговой дорожкой обучения, улучшение функции опорно-двигательного аппарата по сравнению с только опорно-двигательным обучением.
Чрескожная электрическая стимуляция нервов (ЧЭНС) — это процедура, при которой кожные электроды прикладывают низкочастотные импульсы для уменьшения боли. Хотя электроды обычно помещают в место боли (например, в поясницу), первичные эффекты, по-видимому, связаны со стимуляцией центральной нервной системы. Импульсы более низкой частоты (<10 Гц) применяются с относительно высокой интенсивностью, чтобы вызвать безболезненное моторное сокращение, тогда как импульсы высокой частоты (> 50 Гц) применяются с относительно низкой интенсивностью и не вызывают сокращений. Оба типа стимула активируют опиоидные рецепторы в спинном и головном мозге, которые уменьшают боль, но тип производимых опиоидов различается для этих двух стимулов. Подробнее см. Обзор DeSantana et al. [19].
Импульсы более низкой частоты (<10 Гц) применяются с относительно высокой интенсивностью, чтобы вызвать безболезненное моторное сокращение, тогда как импульсы высокой частоты (> 50 Гц) применяются с относительно низкой интенсивностью и не вызывают сокращений. Оба типа стимула активируют опиоидные рецепторы в спинном и головном мозге, которые уменьшают боль, но тип производимых опиоидов различается для этих двух стимулов. Подробнее см. Обзор DeSantana et al. [19].
2.3. Индуцированные электрические поля и заживление костей и стимуляция мозга
2.3.1. Изменяющиеся магнитные поля создают электрические поля
Только что описанные электрические поля создаются разностью электрических потенциалов, создаваемой батареями или источниками питания. Линии электрического поля перетекают от положительных зарядов к отрицательным. Такие источники хорошо подходят для поверхностных применений, таких как заживление ран, восстановление роговицы или даже стимуляция головного и спинного мозга с помощью близко расположенных электродов. Однако они не подходят для широкого приложения электрических полей к более глубоким тканям из-за их электрического сопротивления.Другой метод создания электрических полей использует закон Фарадея, который описывает, как изменяющееся во времени магнитное поле создает индуцированное электрическое поле с силовыми линиями, которые представляют собой замкнутые контуры. Магнитные поля беспрепятственно проникают в ткани, поэтому значительные индуцированные поля могут создаваться глубоко под поверхностью тела.
Однако они не подходят для широкого приложения электрических полей к более глубоким тканям из-за их электрического сопротивления.Другой метод создания электрических полей использует закон Фарадея, который описывает, как изменяющееся во времени магнитное поле создает индуцированное электрическое поле с силовыми линиями, которые представляют собой замкнутые контуры. Магнитные поля беспрепятственно проникают в ткани, поэтому значительные индуцированные поля могут создаваться глубоко под поверхностью тела.
Рассмотрим пространственно однородное магнитное поле B, которое изменяется со временем t. Предположим, что поле приложено перпендикулярно поверхности круглого металлического диска. Электрическое поле E, индуцированное на расстоянии r от центра диска, представляет собой круговую петлю радиуса r с величиной
Er = r2dBdtE1
. Следует отметить, что такое же поле будет создаваться даже в отсутствие металлический диск.Само поле не зависит от материала. Однако индуцированный электрический ток зависит от материала через его проводимость. Для систем более сложных, чем круглый диск, расчет индуцированного поля затруднен и требует численных методов. Простой пример квадратной чашки с изолирующими включениями (например, ячейками) см. В Hart et al. [20].
Для систем более сложных, чем круглый диск, расчет индуцированного поля затруднен и требует численных методов. Простой пример квадратной чашки с изолирующими включениями (например, ячейками) см. В Hart et al. [20].
2.3.2. Два примера иллюстрируют клиническое использование изменяющихся во времени магнитных полей.
В течение многих лет электрические поля использовались для ускорения заживления переломов костей, которые не поддавались лечению обычными методами.Поскольку переломы расположены глубоко в ткани, имплантированные электроды обычно не используются. Однако есть два других способа, которыми внешние системы доставки могут создавать необходимые внутренние поля. Рассмотрим, например, перелом большеберцовой кости. Электроды-подушечки можно размещать с любой стороны от икры пациента. Высокочастотный сигнал, подаваемый на эти электроды, будет емкостным образом связан с внутренними тканями, включая место перелома, для создания там электрического поля. В качестве альтернативы, вокруг теленка можно обернуть спиральную систему. Изменяющийся во времени ток в катушках создает изменяющееся во времени магнитное поле в икре, которое, в свою очередь, генерирует импульсное электромагнитное поле (ИЭМП) в месте перелома. PEMF стимулирует остеобласты, так что кость растет и разрастается для заживления перелома. Два метаанализа [21, 22] клинических исследований электрически стимулированного заживления костей показывают некоторые улучшения у пациентов, но необходимы более четко определенные исследования.
Изменяющийся во времени ток в катушках создает изменяющееся во времени магнитное поле в икре, которое, в свою очередь, генерирует импульсное электромагнитное поле (ИЭМП) в месте перелома. PEMF стимулирует остеобласты, так что кость растет и разрастается для заживления перелома. Два метаанализа [21, 22] клинических исследований электрически стимулированного заживления костей показывают некоторые улучшения у пациентов, но необходимы более четко определенные исследования.
При транскраниальной магнитной стимуляции (ТМС) катушки различной конструкции размещаются вокруг головы пациента.Как и при лечении перелома костей, катушки создают изменяющееся во времени магнитное поле, которое индуктивно генерирует электрическое поле в нужном месте мозга. Конструкция системы катушек выбрана для создания локализованного электрического поля в желаемом участке мозга. Этот метод используется, например, для лечения депрессии или для оценки того, правильно ли стимулирует определенная моторная область мозга соответствующую мышечную систему.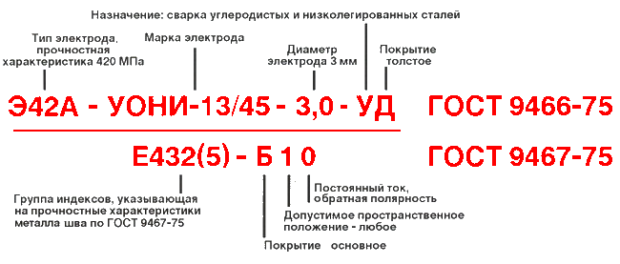 Подробнее и примеры биомагнитной стимуляции см. В обзоре Уэно и Секино [23]).
Подробнее и примеры биомагнитной стимуляции см. В обзоре Уэно и Секино [23]).
2.4. Электрические поля для диагностических целей
В предыдущих разделах было описано, как приложение электрических полей к клеткам и тканям может оказывать положительное воздействие на эти цели. Однако электрические поля также могут применяться для контроля физиологического состояния тканей в диагностических целях. Все материалы, включая ткань, имеют соответствующее сопротивление R и емкость C [24]. Если к ткани приложено переменное напряжение, через ткань будет протекать ток, который зависит от R и C.Емкости ограничивают прохождение тока низкой частоты, но позволяют токам высокой частоты проходить. Значение C определяет диапазон частот перехода для прохождения и блокировки переменного тока. Для тканей эта частота составляет около 100 кГц – 1 МГц.
На рисунке 2 изображена модель цепи Фрике, обычно используемая для тканей. Re и Ri представляют собой соответственно сопротивления внеклеточного и внутриклеточного сопротивления.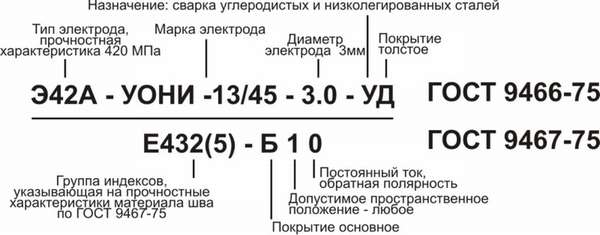 Оба сопротивления определяются в первую очередь содержанием воды. C представляет собой емкость клеточной мембраны.Низкочастотные токи блокируются C изнутри клетки и, таким образом, служат мерой внеклеточной воды. C позволяет токам высокой частоты проникать внутрь ячейки и, таким образом, измерять комбинацию Re и Ri. Использование двух частот позволяет разделить Re и Ri и, таким образом, определить внутриклеточное и внеклеточное содержание воды.
Оба сопротивления определяются в первую очередь содержанием воды. C представляет собой емкость клеточной мембраны.Низкочастотные токи блокируются C изнутри клетки и, таким образом, служат мерой внеклеточной воды. C позволяет токам высокой частоты проникать внутрь ячейки и, таким образом, измерять комбинацию Re и Ri. Использование двух частот позволяет разделить Re и Ri и, таким образом, определить внутриклеточное и внеклеточное содержание воды.
Рисунок 2.
Модель цепи Фрике.
Эти принципы можно использовать для измерения состава тела [6].У здоровых людей существует четко определенная взаимосвязь между общей массой тела без жира и общей массой воды в организме. Знание общей массы тела без жира и общей массы тела дает массу жира в организме и, следовательно, процентное содержание жира в организме. В зависимости от положения электродов этот метод можно использовать для измерений на всем теле или на определенных конечностях. Определение изменений отношения Re к Ri может дать информацию о возможности утечки жидкости (отека) в конечность.
Другое применение модели Фрике полезно для мониторинга дыхания. Воздух в легких не пропускает ток и может быть смоделирован как изменяющийся во времени C. Измерение тока с течением времени дает частоту дыхания и, таким образом, служит в качестве монитора апноэ во сне. То, как R и C изменяются в широком диапазоне частот, можно использовать для дифференциации здоровой ткани от больной ткани. Чувствительность устройств, идентифицирующих опухоли груди, пока недостаточна для получения одобрения правительства.Подробный обзор различных диагностических применений электрических полей см. В обзоре Харта [6].
2,5. Тканевая инженерия
Приложение электрических полей к клеточным системам может вызвать широкий спектр физических эффектов в клетках в дополнение к гальванотаксису. Такие эффекты подробно описаны в обзорной монографии CRC под редакцией Пуллара [1]. Эта комбинация эффектов электрического поля оказывается полезной в тканевой инженерии, в которой клетки откладываются на субстрат (каркас) и стимулируются к росту в более сложные ткани. Например, приложение импульсных полей постоянного тока к сердечным миоцитам, культивированным на коллагеновой губке, стимулировало их выравнивание, сцепление и синхронные сокращения [25]. Такое собрание могло бы служить повязкой на сердце для жертв сердечного приступа. Импульсные поля способствовали росту и ориентации нейритов на полипиррол / коллагеновой основе [26]. Целью таких исследований является развитие способности заменять поврежденные нервы. Поле постоянного тока, приложенное к остеобластам, костеобразующим клеткам, нанесенным на титановую подложку, увеличивало их адгезию к подложке и их пролиферацию [27].Природа и структура субстрата важны, потому что он может обеспечить механическую стимуляцию, которая также влияет на поведение клеток на каркасе. Оптимизация как контактного направления, так и приложенного электрического поля дает результаты, которые лучше, чем результаты, полученные для любого метода отдельно для фибробластов и кардиомиоцитов [28], а также эпителиальных клеток роговицы и хрусталика [29].
Например, приложение импульсных полей постоянного тока к сердечным миоцитам, культивированным на коллагеновой губке, стимулировало их выравнивание, сцепление и синхронные сокращения [25]. Такое собрание могло бы служить повязкой на сердце для жертв сердечного приступа. Импульсные поля способствовали росту и ориентации нейритов на полипиррол / коллагеновой основе [26]. Целью таких исследований является развитие способности заменять поврежденные нервы. Поле постоянного тока, приложенное к остеобластам, костеобразующим клеткам, нанесенным на титановую подложку, увеличивало их адгезию к подложке и их пролиферацию [27].Природа и структура субстрата важны, потому что он может обеспечить механическую стимуляцию, которая также влияет на поведение клеток на каркасе. Оптимизация как контактного направления, так и приложенного электрического поля дает результаты, которые лучше, чем результаты, полученные для любого метода отдельно для фибробластов и кардиомиоцитов [28], а также эпителиальных клеток роговицы и хрусталика [29].
В тканевой инженерии обычно использовались электрические поля, которые прикладывались к каркасу извне. Недавно Arinzeh et al.[30] сообщили, что каркас сам по себе может создавать электрическое поле, используемое для управления и стимуляции клеток. Они разработали строительные леса, которые были частично керамическими, а частично — пластиковыми. Одним из используемых пластических материалов был пьезоэлектрик; то есть при механическом воздействии он генерировал электрическое поле. При правильном механическом текстурировании пьезоэлектрического каркаса они смогли усилить регенерацию аксонов в нейритах с целью стимулирования восстановления спинного мозга. Более того, используя подходящие пьезоэлектрические материалы и текстуры каркаса, они смогли побудить стволовые клетки к формированию кости или хряща.Более подробное обсуждение использования электрических полей в тканевой инженерии см. В обзоре Hronik-Tupaj и Kaplan [31].
3. Клеточная дозиметрия
Чтобы понять, как клетки производят наблюдаемые эффекты, сначала необходимо понять, как приложенное поле распределяется внутри клетки как функция времени. Предположим, что сферическая ячейка радиуса R помещена в культуральную среду вдали от параллельных пластинчатых электродов. В момент времени t = 0 между пластинами приложено электрическое поле E.Модель Фрике, показанная на рисунке 2, может быть использована для понимания результирующей зарядки клеточной мембраны и индуцированного трансмембранного напряжения TMVi. Ячейка ведет себя как последовательная RC-цепь. При приложении поля заряд проходит через резистор и заряжает конденсатор. Как только конденсатор полностью заряжен, чтобы установить TMVi, поток заряда через R прекращается. Постоянная времени процесса τ. В течение времени, значительно меньшего, чем τ, существует значительный поток заряда и соответствующее электрическое поле внутри клетки (цитоплазма).Напряжение на конденсаторе TMVi постепенно увеличивается. В течение времени, значительно превышающего τ, поток заряда прекращается, и соответствующее электрическое поле внутри цитоплазмы незначительно. TMVi достиг максимального значения.
Предположим, что сферическая ячейка радиуса R помещена в культуральную среду вдали от параллельных пластинчатых электродов. В момент времени t = 0 между пластинами приложено электрическое поле E.Модель Фрике, показанная на рисунке 2, может быть использована для понимания результирующей зарядки клеточной мембраны и индуцированного трансмембранного напряжения TMVi. Ячейка ведет себя как последовательная RC-цепь. При приложении поля заряд проходит через резистор и заряжает конденсатор. Как только конденсатор полностью заряжен, чтобы установить TMVi, поток заряда через R прекращается. Постоянная времени процесса τ. В течение времени, значительно меньшего, чем τ, существует значительный поток заряда и соответствующее электрическое поле внутри клетки (цитоплазма).Напряжение на конденсаторе TMVi постепенно увеличивается. В течение времени, значительно превышающего τ, поток заряда прекращается, и соответствующее электрическое поле внутри цитоплазмы незначительно. TMVi достиг максимального значения. Без приложенного поля существует естественное трансмембранное напряжение TMVo, которое создается системой ионных насосов и каналов в мембране. TMVo составляет порядка 70 мВ для большинства типов ячеек, при этом внутренняя часть ячейки более отрицательна, чем внешняя. Общее трансмембранное напряжение, TMVt, тогда является суммой TMVo и TMVi.Трансмембранное напряжение изменяется со временем [32] в соответствии с:
Без приложенного поля существует естественное трансмембранное напряжение TMVo, которое создается системой ионных насосов и каналов в мембране. TMVo составляет порядка 70 мВ для большинства типов ячеек, при этом внутренняя часть ячейки более отрицательна, чем внешняя. Общее трансмембранное напряжение, TMVt, тогда является суммой TMVo и TMVi.Трансмембранное напряжение изменяется со временем [32] в соответствии с:
TMVt = 1,5ERcosΘ1 − exp − t / t + TMVoE2
, где Θ — угол между электрическим полем и нормалью к поверхности клетки. Коэффициент 1,5 связан со сферической формой ячейки и имеет более высокие значения для ячеек с более асимметричной формой. Для ячеек неправильной формы требуется численное моделирование, как описано в разделе 6.
На рисунке 3 представлена стилизованная диаграмма, которая иллюстрирует ячейку, помещенную в первоначально однородное электрическое поле Eo.Когда поле применяется впервые (t <
Рисунок 3.
Зависимость трансмембранного напряжения от приложенного поля.
4. Электропорация
4.1. Основные принципы
Приложения, описанные до этого момента, предназначены для прикладных областей физиологической силы; то есть менее примерно 300 В / м. Частоты этих полей также меньше 1 МГц с соответствующими временными масштабами больше 1 микросекунды. Как отмечалось выше, для таких временных масштабов результирующее электрическое поле цитоплазмы незначительно, поэтому любое прямое взаимодействие должно происходить на поверхности клетки.В этом разделе мы обсуждаем приложения, создаваемые полями порядка 10 кВ / м или выше с частотами компонентов, часто превышающими 1 МГц. Такие поля достаточно сильны, чтобы проницаемость клеточной мембраны; то есть, чтобы позволить атомам и молекулам проникнуть внутрь клетки. Основная модель, используемая для описания этого процесса, включает открытие небольших (радиусом несколько нм) отверстий или пор. По этой причине процесс называют электропорацией, хотя иногда используется термин электропроницаемость. Таким образом, ранее введенные препараты, которые обычно не могут проходить через мембрану, могут проникать внутрь клетки (электрохимиотерапия, ЭСТ) или ДНК / РНК могут быть вставлены в ядро клетки (электрогенотерапия, ЭГТ).
Таким образом, ранее введенные препараты, которые обычно не могут проходить через мембрану, могут проникать внутрь клетки (электрохимиотерапия, ЭСТ) или ДНК / РНК могут быть вставлены в ядро клетки (электрогенотерапия, ЭГТ).
Приложенное поле принимает форму прямоугольных импульсов с амплитудой электрического поля, E, числом, N, длительностью импульса, T и частотой повторения импульсов, F. Как правило, при увеличении любого из этих параметров вероятность введения лекарства или ДНК увеличивается, но также увеличивается вероятность повреждения клеток.Таким образом, существует компромисс между успехом вставки и выживанием клеток. Как правило, E составляет от 10 кВ / м до 100 кВ / м, а T составляет от миллисекунд до микросекунд. В настоящее время исследуются наносекундные импульсы с E порядка 1 МВ / м для их потенциального клинического применения. Ниже определенного порога, который зависит от свойств клетки (например, типа, радиуса, расположения в ткани и т. Д.) Электропорация не происходит. Для импульсов от миллисекунды до микросекунд обратимая электропорация начинается выше примерно 10 кВ / м.В этих условиях происходит транспорт внутрь клетки, и клетка выживает в процессе. В более высоких полях происходит слишком много повреждений, и клетки не выживают. Есть две категории этой необратимой электропорации. Клетки могут погибнуть, потому что мембрана настолько сильно повреждена, что не закрывается должным образом. В такой нетепловой необратимой электропорации (NTIRE) клетки-мишени могут быть разрушены без повреждения окружающих вен и внеклеточного матрикса [8]. На более высоких полях клетки и часть их окружения разрушаются нагреванием.
Для импульсов от миллисекунды до микросекунд обратимая электропорация начинается выше примерно 10 кВ / м.В этих условиях происходит транспорт внутрь клетки, и клетка выживает в процессе. В более высоких полях происходит слишком много повреждений, и клетки не выживают. Есть две категории этой необратимой электропорации. Клетки могут погибнуть, потому что мембрана настолько сильно повреждена, что не закрывается должным образом. В такой нетепловой необратимой электропорации (NTIRE) клетки-мишени могут быть разрушены без повреждения окружающих вен и внеклеточного матрикса [8]. На более высоких полях клетки и часть их окружения разрушаются нагреванием.
Электропорация работает за счет изменения разности потенциалов на мембране. Как отмечалось выше, приложенные поля порядка 10–100 кВ / м могут создавать TMVi, сравнимые с TMVo или превышающие их. Поскольку внешняя поверхность ячейки положительна относительно внутренней, TMVt будет наибольшим на конце ячейки, обращенном к положительному электроду (аноду). На противоположном конце, обращенном к отрицательному электроду (катоду), TMVo по существу вычитается из TMVi, так что TMVt велико, но несколько меньше, чем на положительном конце.Уравнение (2) выше полезно для понимания параметров, влияющих на обычную электропорацию. Для импульсов от микросекунды до миллисекунды диапазон t>> τ, так что член в скобках просто сокращается до 1. На средней линии, где cos Θ = 0, TMVt = TMVo. Поскольку наибольшие TMVt находятся на двух концах, это места, где обычно ожидается максимальная вставка. Минимальная вставка ожидается по средней линии. По мере увеличения E вставка будет происходить в местах все дальше и дальше от полюсов. Для достижения определенного TMVi требуются поля большего размера для меньших ячеек.Как только пора открылась, молекулы окружающей жидкости проходят через нее внутрь клетки. Более крупные молекулы требуют более длительных импульсов для расширения пор и для поддержания электрической движущей силы в течение более длительного периода времени.
На противоположном конце, обращенном к отрицательному электроду (катоду), TMVo по существу вычитается из TMVi, так что TMVt велико, но несколько меньше, чем на положительном конце.Уравнение (2) выше полезно для понимания параметров, влияющих на обычную электропорацию. Для импульсов от микросекунды до миллисекунды диапазон t>> τ, так что член в скобках просто сокращается до 1. На средней линии, где cos Θ = 0, TMVt = TMVo. Поскольку наибольшие TMVt находятся на двух концах, это места, где обычно ожидается максимальная вставка. Минимальная вставка ожидается по средней линии. По мере увеличения E вставка будет происходить в местах все дальше и дальше от полюсов. Для достижения определенного TMVi требуются поля большего размера для меньших ячеек.Как только пора открылась, молекулы окружающей жидкости проходят через нее внутрь клетки. Более крупные молекулы требуют более длительных импульсов для расширения пор и для поддержания электрической движущей силы в течение более длительного периода времени.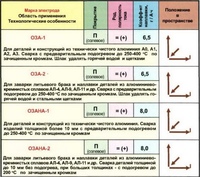 Площадь проницаемой поверхности клетки зависит от E, тогда как уровень проницаемости поверхности зависит от количества и длительности импульсов.
Площадь проницаемой поверхности клетки зависит от E, тогда как уровень проницаемости поверхности зависит от количества и длительности импульсов.
В настоящее время нерешенной проблемой теории электропорации является то, что клеточная мембрана не закрывается полностью после удаления поля.Электропорированные простые липидные мембраны повторно закрывают себя в течение микросекунд, тогда как клеточные мембраны остаются частично проницаемыми в течение времени порядка минут. Были предложены две модели задержки полного повторного запечатывания [32]. Оба связаны с липидами, одним из основных компонентов клеточной мембраны. Один из них включает изменение конформации липидов, что приводит к образованию метастабильной мембранной структуры, которая требует значительного времени для распада. Другой — окисление липидов, которое изменяет множество свойств мембраны.
4.2. Клиническое применение электропорации
Важные противораковые препараты, такие как цисплатин и блеомицин, не могут легко проникать через клеточную мембрану. Применение импульсов электропорации открывает поры в мембране, через которые могут проходить лекарства. Поскольку введение лекарства в клетку теперь более эффективно, доза, вводимая пациенту, может быть значительно снижена и иметь меньше побочных эффектов. ЭСТ используется во многих европейских центрах для лечения самых разных опухолей [8].При глубоко расположенных опухолях NTIRE используется для разрушения раковых клеток при сохранении окружающей ткани. Глубоко расположенные опухоли требуют сложных процедур. Обычно МРТ используется для детального картирования типов тканей, окружающих опухоль. Знание диэлектрических свойств различных типов тканей позволяет рассчитать поле, которое будет приложено к месту опухоли для различных возможных размещений электродов. После того, как оптимальное размещение электродов определено, МРТ можно использовать для определения хирурга, устанавливающего электроды [33].
Применение импульсов электропорации открывает поры в мембране, через которые могут проходить лекарства. Поскольку введение лекарства в клетку теперь более эффективно, доза, вводимая пациенту, может быть значительно снижена и иметь меньше побочных эффектов. ЭСТ используется во многих европейских центрах для лечения самых разных опухолей [8].При глубоко расположенных опухолях NTIRE используется для разрушения раковых клеток при сохранении окружающей ткани. Глубоко расположенные опухоли требуют сложных процедур. Обычно МРТ используется для детального картирования типов тканей, окружающих опухоль. Знание диэлектрических свойств различных типов тканей позволяет рассчитать поле, которое будет приложено к месту опухоли для различных возможных размещений электродов. После того, как оптимальное размещение электродов определено, МРТ можно использовать для определения хирурга, устанавливающего электроды [33].
Введение лекарств через участки кожи (трансдермальная доставка лекарств) требует, чтобы лекарственные средства успешно прошли через кожу в нижележащие ткани. Такой проход обычно блокируется роговым слоем, который является самым внешним слоем кожи. Роговой слой представляет собой сухой слой мертвых клеток толщиной примерно 15 мкм. Подобно тому, как этот слой защищает тело, ограничивая утечку жидкостей из тела в окружающую среду, он также предотвращает прохождение жидкостей с поверхности во внутреннюю часть.В традиционных системах доставки лекарств с помощью электричества (ионтофорез) электроды размещают на поверхности и прикладывают поле. В вспомогательном транспорте лекарств участвуют два фактора [34]. Во-первых, электрическое поле выталкивает положительно заряженные лекарства от анода через кожу к катоду. Отрицательно заряженные лекарства выталкиваются с катода. Во-вторых, заряженные ионы увлекают за собой часть жидкости (электроосмос) и, таким образом, усиливают перенос. Этим методом можно транспортировать нейтральные молекулы лекарства.
Такой проход обычно блокируется роговым слоем, который является самым внешним слоем кожи. Роговой слой представляет собой сухой слой мертвых клеток толщиной примерно 15 мкм. Подобно тому, как этот слой защищает тело, ограничивая утечку жидкостей из тела в окружающую среду, он также предотвращает прохождение жидкостей с поверхности во внутреннюю часть.В традиционных системах доставки лекарств с помощью электричества (ионтофорез) электроды размещают на поверхности и прикладывают поле. В вспомогательном транспорте лекарств участвуют два фактора [34]. Во-первых, электрическое поле выталкивает положительно заряженные лекарства от анода через кожу к катоду. Отрицательно заряженные лекарства выталкиваются с катода. Во-вторых, заряженные ионы увлекают за собой часть жидкости (электроосмос) и, таким образом, усиливают перенос. Этим методом можно транспортировать нейтральные молекулы лекарства.
Электропорация может предложить улучшенный метод трансдермальной доставки лекарств [8]. Поскольку роговой слой имеет гораздо большее электрическое сопротивление, чем нижние слои кожи, электрическое поле приложенных импульсов сосредоточено в нем. Импульсы увеличивают его проницаемость для лекарств, открывая проходящие через него пути. Кроме того, поле может прикладывать сильную электрофоретическую силу к заряженным молекулам лекарства, проталкивая их через роговой слой.
Импульсы увеличивают его проницаемость для лекарств, открывая проходящие через него пути. Кроме того, поле может прикладывать сильную электрофоретическую силу к заряженным молекулам лекарства, проталкивая их через роговой слой.
Поскольку ДНК значительно больше, чем у противораковых препаратов, ее сложнее вставить в клетку.ДНК вставляется в виде плазмид, которые представляют собой небольшие, часто круглые сегменты, содержащие генетическую информацию. Более того, ДНК заряжена отрицательно, как и внешняя поверхность клетки, так что происходит естественное отталкивание ДНК от мембраны. По этим причинам используются два импульса для вставки ДНК (или РНК) в клетку. На первом этапе применяется типичный короткий импульс высокого напряжения, чтобы открыть поры. На втором этапе применяется более низкий импульс напряжения в течение более длительного времени, чтобы направить отрицательно заряженную плазмиду ДНК в клеточную мембрану.Этот электрофоретический толчок будет эффективен только на стороне ячейки, обращенной к отрицательному электроду.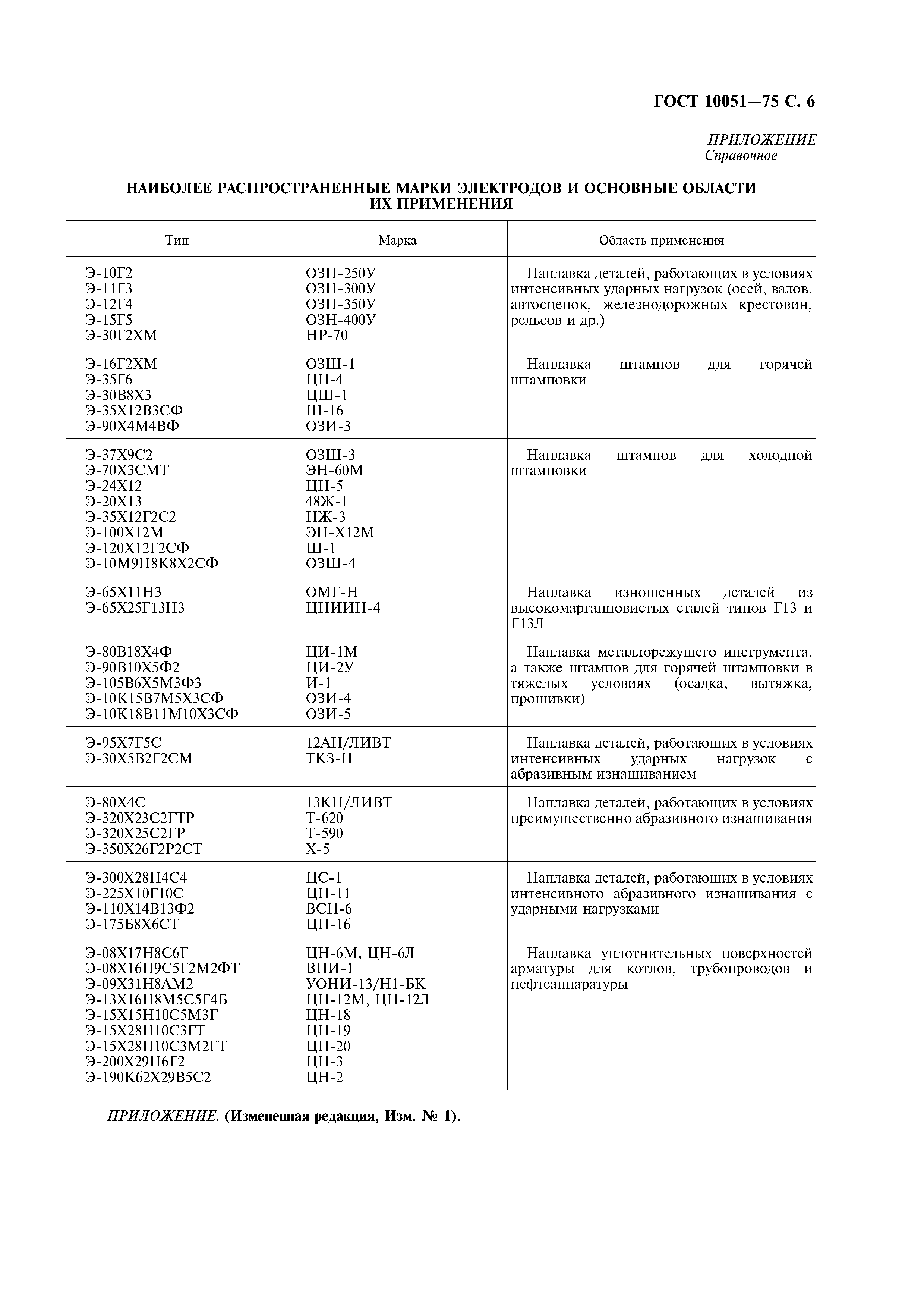 Использование биполярных импульсов позволяет проникать ДНК в обе стороны клетки. По окончании импульсов часть процесса, связанного с электрическим полем, завершается, а ДНК все еще находится в мембране. В этот момент происходит процесс, называемый эндоцитозом, при котором клетка образует пузырь вокруг плазмиды, а затем втягивает его внутрь клетки. В этом случае плазмида не диффундирует пассивно в ядро клетки, а активно транспортируется внутриклеточными механизмами.Эндоцитозу и активным транспортным процессам требуется несколько часов после окончания импульса, чтобы плазмида проникла в ядро и экспрессировалась. Детали этих процессов не совсем понятны [9].
Использование биполярных импульсов позволяет проникать ДНК в обе стороны клетки. По окончании импульсов часть процесса, связанного с электрическим полем, завершается, а ДНК все еще находится в мембране. В этот момент происходит процесс, называемый эндоцитозом, при котором клетка образует пузырь вокруг плазмиды, а затем втягивает его внутрь клетки. В этом случае плазмида не диффундирует пассивно в ядро клетки, а активно транспортируется внутриклеточными механизмами.Эндоцитозу и активным транспортным процессам требуется несколько часов после окончания импульса, чтобы плазмида проникла в ядро и экспрессировалась. Детали этих процессов не совсем понятны [9].
EGT клинически используется для вакцинации или лечения рака [9]. При типичной вакцинации молекула (антиген) вводится в мышцу, чтобы вызвать специфический иммунный ответ организма. При вакцинации EGT вводится плазмида, кодирующая антиген. Ядра клеток включают плазмиду и затем вырабатывают антигены, которые вызывают иммунный ответ. Клинические испытания были успешно проведены для таких состояний, как ВИЧ и вирусы гепатита B и C. Для лечения рака плазмиды вводятся в опухоли. Для получения продуктов, которые способствуют, например, стимуляции самоубийства клеток, активации иммунного ответа или подавлению роста кровеносных сосудов, можно использовать несколько стратегий экспрессии гена. ЭГТ можно комбинировать с ЭСТ, чтобы обеспечить двухэтапную атаку на опухоли.
Клинические испытания были успешно проведены для таких состояний, как ВИЧ и вирусы гепатита B и C. Для лечения рака плазмиды вводятся в опухоли. Для получения продуктов, которые способствуют, например, стимуляции самоубийства клеток, активации иммунного ответа или подавлению роста кровеносных сосудов, можно использовать несколько стратегий экспрессии гена. ЭГТ можно комбинировать с ЭСТ, чтобы обеспечить двухэтапную атаку на опухоли.
4.3. Нанопорация
Напомним из раздела 3, что в течение времени, намного меньшего, чем постоянная времени мембраны, τ, электрическое поле проникает внутрь клетки.После этого можно будет обработать ядро клетки и другие субклеточные структуры. Поскольку размер этих структур намного меньше, чем сама ячейка, согласно формуле. (2) для этого должны быть приложены соответственно более сильные электрические поля. В нанопорах электрические поля порядка 1–10 МВ / м прикладываются в течение времени порядка наносекунд (нс). Фактическая длительность импульса важна для определения того, где наноимпульсы оказывают наибольшее влияние. Согласно формуле. (2) при τ ~ 1 мкс длительность импульса 10 нс или менее приведет к незначительным изменениям TMVi.Таким образом, электрическое поле внутри ячейки велико и может поражать внутренние структуры. И наоборот, длительность импульса более 100 нс приведет к большой поляризации мембраны и уменьшению внутреннего поля. Применение очень коротких импульсов и их анализ сложны, так что трудно получить воспроизводимые результаты с использованием таких импульсов. Импульсы длительностью от 11 до 100 нс являются наиболее эффективными для получения воспроизводимых результатов внутри клетки, таких как апоптоз (самоубийство клетки) и высвобождение кальция из внутриклеточных запасов [35].
Согласно формуле. (2) при τ ~ 1 мкс длительность импульса 10 нс или менее приведет к незначительным изменениям TMVi.Таким образом, электрическое поле внутри ячейки велико и может поражать внутренние структуры. И наоборот, длительность импульса более 100 нс приведет к большой поляризации мембраны и уменьшению внутреннего поля. Применение очень коротких импульсов и их анализ сложны, так что трудно получить воспроизводимые результаты с использованием таких импульсов. Импульсы длительностью от 11 до 100 нс являются наиболее эффективными для получения воспроизводимых результатов внутри клетки, таких как апоптоз (самоубийство клетки) и высвобождение кальция из внутриклеточных запасов [35].
5. Механизмы и эксперименты
Мы представляем здесь сокращенное описание исследований, которые мы провели [36, 37], чтобы определить механизм, с помощью которого клетки первоначально обнаруживают электрические поля физиологической силы. Определение и понимание этого механизма важно для дальнейшей разработки различных приложений, описанных выше. Мы также представляем сокращенное описание некоторых экспериментов, подтверждающих эту идентификацию.
Мы также представляем сокращенное описание некоторых экспериментов, подтверждающих эту идентификацию.
5.1. Как клетки обнаруживают электрические поля
Как описано выше, постоянное и низкочастотные электрические поля вызывают широкий спектр биологических эффектов на клеточном и тканевом уровнях.Хотя акцент здесь делается на миграции клеток, заживлении ран и нервной стимуляции, электрические поля производят множество других эффектов на клетки, как описано в обзоре CRC [1]. Как только клетка изначально обнаруживает поле, информация передается по клетке, вызывая широкий спектр биохимических эффектов. Главный вопрос — каков первоначальный механизм трансдукции, с помощью которого клетка обнаруживает поле?
Как отмечалось выше, для полей постоянного тока и частот переменного тока ниже примерно 1 МГц приложенные электрические поля не могут проникнуть через плазматическую мембрану, потому что для перераспределения заряда в цитоплазме достаточно времени, чтобы по существу нейтрализовать приложенное поле.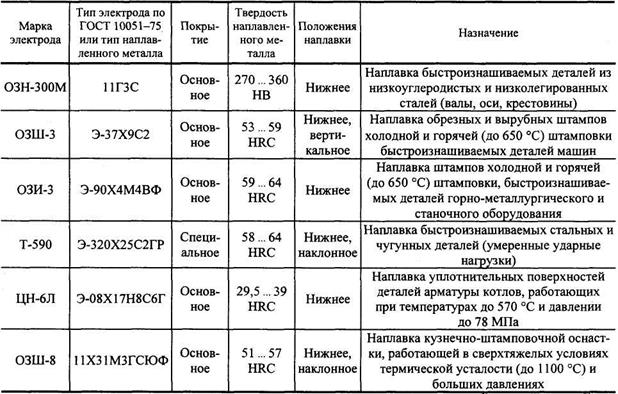 Следовательно, для полей постоянного тока первоначальная трансдукция должна происходить на плазматической мембране или сразу за ней. Процесс трансдукции также должен передавать эту информацию внутрь клетки. Для этого начального процесса трансдукции были предложены три механизма: (1) электродиффузия / осмос [38, 39], (2) открытие потенциалозависимых каналов [40] и (3) электромеханический крутящий момент, действующий на гликокаликс [41]. Модель электродиффузии / осмоса требует полей, которые сильнее, чем типичные поля физиологической силы, применяемые в течение относительно длительных интервалов времени, а изменения трансмембранного потенциала, производимые такими полями, недостаточны для открытия каналов с регулируемым напряжением [37].
Следовательно, для полей постоянного тока первоначальная трансдукция должна происходить на плазматической мембране или сразу за ней. Процесс трансдукции также должен передавать эту информацию внутрь клетки. Для этого начального процесса трансдукции были предложены три механизма: (1) электродиффузия / осмос [38, 39], (2) открытие потенциалозависимых каналов [40] и (3) электромеханический крутящий момент, действующий на гликокаликс [41]. Модель электродиффузии / осмоса требует полей, которые сильнее, чем типичные поля физиологической силы, применяемые в течение относительно длительных интервалов времени, а изменения трансмембранного потенциала, производимые такими полями, недостаточны для открытия каналов с регулируемым напряжением [37].
Фундаментальный принцип электромеханической модели состоит в том, что электрические поля и силы сдвига жидкости имеют общий механизм преобразования — создание крутящих моментов на трансмембранных гликопротеинах. В модели сил жидкости [42] сдвиги жидкости на ядре гликокаликса передаются цитоскелету в виде сил, которые затем передаются в виде механических сигналов по всему внутреннему пространству клетки для активации биохимических сигнальных путей. Гликокаликс — это богатая углеводами зона на поверхности клетки [43].Он покрывает поверхность всех эукариотических клеток, включая раковые и стволовые клетки [44]. Многие гликопротеины, составляющие гликокаликс, заряжены отрицательно, особенно те, которые содержат сиаловую кислоту [45]. Более того, при помещении в электрическое поле, приложенное параллельно поверхности клетки, отрицательно заряженный гликокаликс испытывает электрическую силу, касательную к поверхности, аналогичную силе, приложенной сдвигом жидкости. Мы применили эту концепцию к структурной модели Weinbaum et al. [42], при котором силы, действующие на щеточную структуру гликокаликса, передаются цитоскелету и, таким образом, по всей клетке.В частности, эти силы создают электромеханический крутящий момент вокруг точки соединения цитоскелета и, таким образом, силу на сам цитоскелет [41, 46]. Величина этой цитоскелетной силы сравнима с величиной механических сил, которые, как известно, вызывают физиологические эффекты [41].
Гликокаликс — это богатая углеводами зона на поверхности клетки [43].Он покрывает поверхность всех эукариотических клеток, включая раковые и стволовые клетки [44]. Многие гликопротеины, составляющие гликокаликс, заряжены отрицательно, особенно те, которые содержат сиаловую кислоту [45]. Более того, при помещении в электрическое поле, приложенное параллельно поверхности клетки, отрицательно заряженный гликокаликс испытывает электрическую силу, касательную к поверхности, аналогичную силе, приложенной сдвигом жидкости. Мы применили эту концепцию к структурной модели Weinbaum et al. [42], при котором силы, действующие на щеточную структуру гликокаликса, передаются цитоскелету и, таким образом, по всей клетке.В частности, эти силы создают электромеханический крутящий момент вокруг точки соединения цитоскелета и, таким образом, силу на сам цитоскелет [41, 46]. Величина этой цитоскелетной силы сравнима с величиной механических сил, которые, как известно, вызывают физиологические эффекты [41]. Более полное описание этой модели представлено ниже.
Более полное описание этой модели представлено ниже.
Предсказания электромеханической модели согласуются с гальванотаксисом кератиноцитов [36] и амеб [37]. Гальванотаксис служит удобным эффектом для сравнения трех предложенных механизмов, поскольку это процесс, который легко воспроизводится и легко измеряется в реальном времени.Можно записывать действие поля по мере его возникновения, а не ждать результатов биохимического анализа. Тот же самый начальный процесс преобразования должен присутствовать для множества других полевых эффектов. Модель успешно предсказала, что наложение синусоидального сигнала 40 В / м, 1,6 Гц на поле постоянного тока 100 В / м уменьшит направленность, тогда как наложение поля 40 В / м, 160 Гц не уменьшит направленность по сравнению с чистым 100 В / м поле постоянного тока. Дальнейшее подтверждение электромеханической модели, которая идентифицирует гликокаликс как сайт трансдукции, было предоставлено Finkelstein et al.[47], которые показали, что удаление основных отрицательно заряженных молекул в гликокаликсе в клетках 3 T3 и HeLa устраняет гальванотаксис. Более того, влияние наложенных полей на подвижность (скорость) клеток также объясняется моделью [37]. Увеличение подвижности клеток часто, но не всегда, сопровождает увеличение направленности в сторону поля. Приложенное поле создает изгибающий момент на отрицательно заряженном гликокаликсе между клеткой и субстратом. Гликокаликс отклоняется от субстрата, увеличивая разделение гликокаликса и субстрата и увеличивая адгезию клеток.В результате подвижность клеток может увеличиваться. Однако, если адгезия клеток уже оптимальна, поле не дает значительного дополнительного увеличения подвижности. Добавление положительно заряженных ионов кальция, которые связываются с отрицательно заряженным гликокаликсом, уменьшило усиление направленности и подвижности, создаваемое полем амебы, обеспечивая дополнительное подтверждение электромеханической модели [37]. Подробности представлены ниже.
Более того, влияние наложенных полей на подвижность (скорость) клеток также объясняется моделью [37]. Увеличение подвижности клеток часто, но не всегда, сопровождает увеличение направленности в сторону поля. Приложенное поле создает изгибающий момент на отрицательно заряженном гликокаликсе между клеткой и субстратом. Гликокаликс отклоняется от субстрата, увеличивая разделение гликокаликса и субстрата и увеличивая адгезию клеток.В результате подвижность клеток может увеличиваться. Однако, если адгезия клеток уже оптимальна, поле не дает значительного дополнительного увеличения подвижности. Добавление положительно заряженных ионов кальция, которые связываются с отрицательно заряженным гликокаликсом, уменьшило усиление направленности и подвижности, создаваемое полем амебы, обеспечивая дополнительное подтверждение электромеханической модели [37]. Подробности представлены ниже.
Поскольку подобное поведение демонстрируют такие разные типы клеток, мы предполагаем, что этот механизм обнаружения поля должен присутствовать в ранних клетках. Мы предполагаем [37], что этот механизм изгиба гликокаликса изначально использовался для обнаружения изменений потока жидкости. Поскольку эта система обнаружения оказалась отрицательно заряженной, она также могла обнаруживать электрические поля. С эволюцией многоклеточных организмов эта способность могла стать полезной для управления некоторыми процессами развития [4]. Затем последовали другие процессы зондирования поля.
Мы предполагаем [37], что этот механизм изгиба гликокаликса изначально использовался для обнаружения изменений потока жидкости. Поскольку эта система обнаружения оказалась отрицательно заряженной, она также могла обнаруживать электрические поля. С эволюцией многоклеточных организмов эта способность могла стать полезной для управления некоторыми процессами развития [4]. Затем последовали другие процессы зондирования поля.
5.2. Детали механической модели
5.2.1. Увеличение направленности
Первый механизм, с помощью которого электрическое поле обнаруживается клеткой, включает создание электромеханического крутящего момента на гликокаликсе полем, аналогичного крутящему моменту, создаваемому сдвигом жидкости.Хотя гликокаликс покрывает поверхность всех эукариотических клеток [44], детальное моделирование его функций было выполнено в основном для эндотелиальных клеток. По этой причине параметры, используемые при моделировании, зависят от параметров гликокаликса эндотелиальных клеток и их компонентов. В своем обзоре структуры эндотелиального гликокаликса Карри и Адамсон [48] описывают внутренний слой толщиной 100–150 нм, который обладает квазипериодической структурой. За этим слоем есть область до 400 нм, необходимая для обнаружения сдвига жидкости.Напряжение сдвига жидкости, приложенное к верхней части этой области, передается более жесткому внутреннему слою, а затем передается на мембрану в виде твердой механической силы [44].
В своем обзоре структуры эндотелиального гликокаликса Карри и Адамсон [48] описывают внутренний слой толщиной 100–150 нм, который обладает квазипериодической структурой. За этим слоем есть область до 400 нм, необходимая для обнаружения сдвига жидкости.Напряжение сдвига жидкости, приложенное к верхней части этой области, передается более жесткому внутреннему слою, а затем передается на мембрану в виде твердой механической силы [44].
На рисунке 4 показана базовая электромеханическая модель [36]. Он показывает силы, действующие на заряженный цилиндрический гликопротеин, который в своей основе связан с цитоскелетом. F elec = QE (t) — электрическая сила, действующая на эффективный заряд Q гликопротеина приложенным электрическим полем E (t) в момент времени t.Поскольку гликокаликс заряжен отрицательно, сила F, приложенная к нему полем E, противоположна направлению E. F drag = −cdθ (t) / dt — сила вязкости, действующая на стержень со стороны окружающая внеклеточная жидкость. Угловое смещение стержня θ (t) определяется балансом крутящего момента [46], а c — коэффициент сопротивления трения. Для стержня c = 2πL ’ 2 / (ln [L’ / r] — 0,447), где L ’- длина стержня, а r — его радиус [41]. F members = −khθ (t) — гармоническая восстанавливающая сила, действующая на колеблющийся стержень клеточной мембраной, где k — силовая постоянная, а h — расстояние от центра мембраны до точки соединения основания с цитоскелетом [ 41].F base — это сила, прилагаемая цитоскелетом к стержню в точке соединения. Согласно Третьему закону Ньютона, сила, действующая на цитоскелет стержнем, составляет –F основание . Второй закон Ньютона гласит, что результирующая сила, F net , действующая на стержень, равна
Угловое смещение стержня θ (t) определяется балансом крутящего момента [46], а c — коэффициент сопротивления трения. Для стержня c = 2πL ’ 2 / (ln [L’ / r] — 0,447), где L ’- длина стержня, а r — его радиус [41]. F members = −khθ (t) — гармоническая восстанавливающая сила, действующая на колеблющийся стержень клеточной мембраной, где k — силовая постоянная, а h — расстояние от центра мембраны до точки соединения основания с цитоскелетом [ 41].F base — это сила, прилагаемая цитоскелетом к стержню в точке соединения. Согласно Третьему закону Ньютона, сила, действующая на цитоскелет стержнем, составляет –F основание . Второй закон Ньютона гласит, что результирующая сила, F net , действующая на стержень, равна
Fnet = Ma = Felec + Fdrag + Fmemb + FbaseE3
, где M — масса стержня, а a — ускорение его центра. масса. Здесь a = (L ’/ 2) d 2 θ / dt 2 . Решая, получаем
Fbase = ML / 2d2θt / dt2 – QEt + cdθt / dt + khθtE4
Рисунок 4.
Принципиальная схема сил, действующих на стержень гликокаликса под действием электрического поля.
Комбинации пружина / дроссель, соединенные с основанием на фиг. 4, указывают на передачу результирующих продольных механических сигналов вдоль цитоскелета к остальной части клетки. Угловое смещение иллюстрирует ситуацию, в которой приложенное поле имеет как постоянную, так и переменную составляющие. Для чисто постоянного поля θ AC и E AC равны нулю.
Применение вышеуказанной модели к массиву из 27 стержней гликокаликса в модели гликокаликса Вайнбаума [42] дает силу, приложенную к цитоскелету, порядка 0.5 пН для приложенного электрического поля 100 В / м. Такая сила сопоставима с некоторыми внутриклеточными механическими силами [41]. Следовательно, вполне вероятно, что силы, предсказанные электромеханической моделью, будут иметь физиологические эффекты.
Сила вязкого сопротивления, оказываемая на стержень окружающей внеклеточной жидкостью, линейно увеличивается с частотой приложенного поля.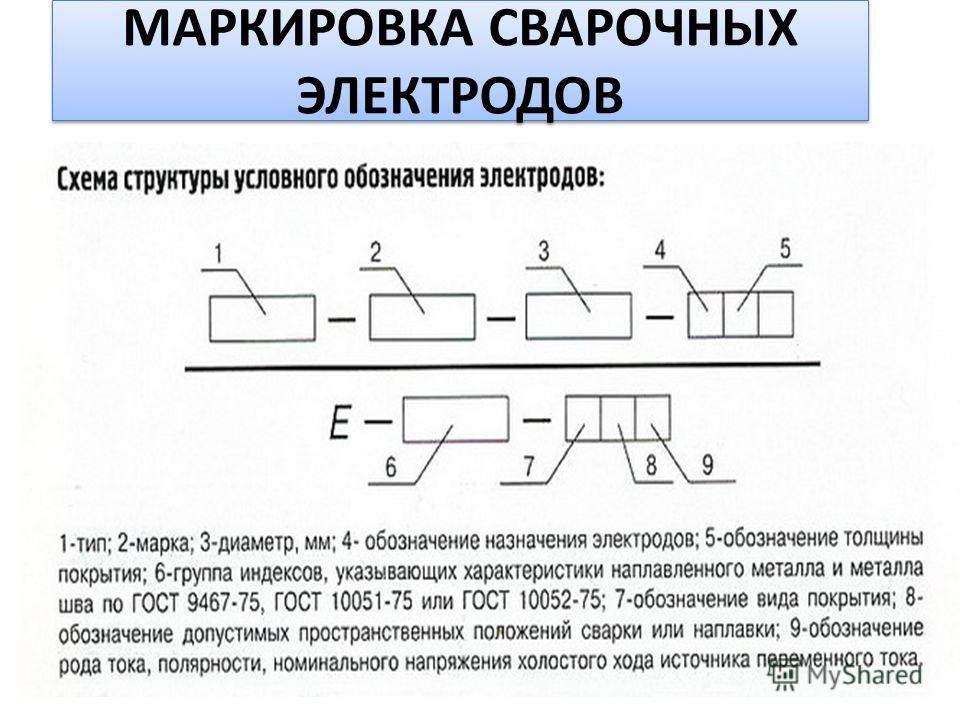 Важность этой частотной зависимости становится очевидной, когда поле переменного тока накладывается на чистое поле постоянного тока. Сопротивление, оказываемое на штанги 1.Поле с частотой 6 Гц очень мало, так что общая сила (AC + DC) на цитоскелет сильно модулируется. Сила сопротивления для поля 160 Гц в 100 раз больше, так что результирующая модуляция пренебрежимо мала, а полная сила практически идентична силе, создаваемой чистым полем постоянного тока [41]. Мы предполагаем, что сильная модуляция на частоте 1,6 Гц вносит значительный механический сигнальный шум в цитоскелет, который снижает общую трансдукцию по сравнению с чистым полем постоянного тока. Наложение поля 160 Гц не дает такого уменьшения.Таким образом, электромеханическая модель согласуется с результатами, представленными для кератиноцитов [36] и амеб [37].
Важность этой частотной зависимости становится очевидной, когда поле переменного тока накладывается на чистое поле постоянного тока. Сопротивление, оказываемое на штанги 1.Поле с частотой 6 Гц очень мало, так что общая сила (AC + DC) на цитоскелет сильно модулируется. Сила сопротивления для поля 160 Гц в 100 раз больше, так что результирующая модуляция пренебрежимо мала, а полная сила практически идентична силе, создаваемой чистым полем постоянного тока [41]. Мы предполагаем, что сильная модуляция на частоте 1,6 Гц вносит значительный механический сигнальный шум в цитоскелет, который снижает общую трансдукцию по сравнению с чистым полем постоянного тока. Наложение поля 160 Гц не дает такого уменьшения.Таким образом, электромеханическая модель согласуется с результатами, представленными для кератиноцитов [36] и амеб [37].
5.2.2. Увеличение подвижности
Описанный выше механизм не может объяснить увеличение скорости, вызванное приложенными полями постоянного и / или переменного тока. Подвижность клеток частично определяется адгезией клетки к субстрату [49]. Клетки, которые либо слишком плотно, либо слишком слабо связаны, будут иметь более низкую подвижность, чем клетки с промежуточной адгезией. Адгезию снижает отрицательно заряженный гликокаликс [50, 51].Увеличение расстояния между гликокаликсом и субстратом должно увеличить адгезию и подвижность.
Подвижность клеток частично определяется адгезией клетки к субстрату [49]. Клетки, которые либо слишком плотно, либо слишком слабо связаны, будут иметь более низкую подвижность, чем клетки с промежуточной адгезией. Адгезию снижает отрицательно заряженный гликокаликс [50, 51].Увеличение расстояния между гликокаликсом и субстратом должно увеличить адгезию и подвижность.
Модель, описанная выше в отношении направленности, предполагает взаимодействие поля с относительно жестким внутренним гликокаликсом. Описанная здесь модель, касающаяся увеличения подвижности, включает взаимодействие с относительно гибким внешним гликокаликсом. Недавние измерения показали, что весь гликокаликс эндотелиальных клеток может простираться до 11000 нм с рыхлой сеткой фибрилл из удлиненных элементов [52].
Амеба имеет отрицательно заряженный гликокаликс [53], полная степень которого не известна. Электронные микрофотографии Topf и Stockem [54] показали, что гликокаликс состоит из компактного базового слоя толщиной примерно 70 нм с внешним нитевидным слоем толщиной примерно 400 нм. Как отмечалось выше, последние достижения в области микроскопических методов показывают, что типичная толщина гликокаликса составляет порядка нескольких тысяч нанометров или более. Grebecki et al. [55] показали, что Amoeba proteus прикрепляется к субстрату с помощью дискретно расположенных «миниподий» толщиной около 500 нм и длиной до 8000 нм.Следовательно, внешний гликокаликс между телом клетки амебы и субстратом не сжат, но должен быть относительно свободным для переориентации в приложенном поле.
Как отмечалось выше, последние достижения в области микроскопических методов показывают, что типичная толщина гликокаликса составляет порядка нескольких тысяч нанометров или более. Grebecki et al. [55] показали, что Amoeba proteus прикрепляется к субстрату с помощью дискретно расположенных «миниподий» толщиной около 500 нм и длиной до 8000 нм.Следовательно, внешний гликокаликс между телом клетки амебы и субстратом не сжат, но должен быть относительно свободным для переориентации в приложенном поле.
Cruz-Chu et al. [56] использовали молекулярно-динамическое моделирование, чтобы исследовать влияние сдвига жидкости на модельный гликокаликс. Они обнаружили, что приложенный сдвиг 0,47 МПа вызывает резкое изгибание гликокаликса (см. Их рисунок 5b). Напряжения порядка 3 МПа и более значительно нарушают гликокаликс. Хотя их модель применялась в первую очередь к внутреннему гликокаликсу, подобное изгибание также должно происходить в менее жестком внешнем гликокаликсе, который взаимодействует с субстратом.
Рис. 5.
Принципиальная схема системы, используемой для воздействия на амебу приложенного электрического поля.
Мы можем оценить тангенциальный сдвиг, создаваемый электрическим полем физиологической напряженности. Для простоты мы моделируем гликокаликс амебы как однородный, отрицательно заряженный, прямоугольный твердый гель, заполняющий пространство между телом амебы и субстратом. Мы предполагаем, что амеба уже вытянута в направлении поля. Длина L и ширина W прямоугольного твердого тела соответствуют длине амебы, которую мы считаем L = 0.2 мм и W = 0,05 мм. За толщину гликокаликса принимаем длину миниподий амебы T = 8 мкм [55]. Типичная оценка плотности заряда гликокаликса составляет ρ = 25 мэкв / л или 2,5 · 10 6 Кл / м 3 [57]. Электрическая сила, действующая на гликокаликс этой модели, тогда F = ρLWTE. Напряжение сдвига σ — это сила, деленная на поперечное сечение, к которому она приложена, или
σ = ρLWTE / WT = ρLEE5
Для электрического поля 200 В / м σ составляет 0,1 МПа. Наше рассчитанное напряжение сдвига, создаваемое полем, должно быть достаточным для изгиба гликокаликса.Изгиб гликокаликса увеличивает его отделение от субстрата. Увеличение разделения увеличивает адгезию клетки и, следовательно, ее подвижность.
Наше рассчитанное напряжение сдвига, создаваемое полем, должно быть достаточным для изгиба гликокаликса.Изгиб гликокаликса увеличивает его отделение от субстрата. Увеличение разделения увеличивает адгезию клетки и, следовательно, ее подвижность.
Реакция на напряжение сдвига зависит от механических свойств гликокаликса. Модуль напряжения сдвига и модуль потерь при сдвиге гликокаликса увеличиваются с увеличением частоты приложенного напряжения [58]. Следовательно, изгиб, создаваемый электрическим полем 160 Гц, должен быть меньше изгиба, создаваемого полем 1,6 Гц. В результате увеличение подвижности должно быть меньше для поля 160 Гц, чем для поля 1.Поле 6 Гц, как сообщается в Ref. [37].
5.3. Эксперименты с гальванотаксисом для проверки модели
5.3.1. Экспериментальная установка
Амебы были приобретены у Carolina Biological Company (Берлингтон, Северная Каролина, США) и культивировались в контейнере, в котором они были отправлены, в течение не менее 3 дней перед использованием в экспериментах. Детали конструкции и конструкции аппарата (рис. 5), использованного для всех экспериментов, можно найти у Харта и Палисано [37]. Вкратце, клетки амеб были изолированы из лунок, содержащих платиновый проволочный источник тока, и помещены в желоб, который мы соединили с лунками, в которые электрический ток вводился с помощью солевых мостиков.
Детали конструкции и конструкции аппарата (рис. 5), использованного для всех экспериментов, можно найти у Харта и Палисано [37]. Вкратце, клетки амеб были изолированы из лунок, содержащих платиновый проволочный источник тока, и помещены в желоб, который мы соединили с лунками, в которые электрический ток вводился с помощью солевых мостиков.
Из-за сложной геометрии возникла необходимость в численном моделировании поля внутри желоба для заданного напряжения, приложенного к скважинам, с помощью COMSOL Multiphysics (COSMOL Inc., Берлингтон, Массачусетс, США). COSMOL Multiphysics также использовался для моделирования повышения температуры электрических полей в течение 40-минутного интервала времени экспериментов и показал, что полученное повышение температуры составило более 1 ° C. Расчет поля и температуры подтвержден измерениями с помощью вольтметра и термопарного зонда соответственно.
Во всех экспериментах каждая амеба служила контролем. В течение первых 20 минут записи движение клеток амеб происходило в отсутствие электрического поля. За последние 40 минут было приложено электрическое поле. Движения клеток регистрировались в течение всего 60-минутного эксперимента, а моментальные снимки из фильма делались с интервалом в 1 минуту и преобразовывались в замедленное видео. Положение каждой амебы в каждом 1-минутном интервале оцифровывали из фильма с использованием программного обеспечения LoggerPro (Venier Software & Technology, Бивертон, Орегон, США).
За последние 40 минут было приложено электрическое поле. Движения клеток регистрировались в течение всего 60-минутного эксперимента, а моментальные снимки из фильма делались с интервалом в 1 минуту и преобразовывались в замедленное видео. Положение каждой амебы в каждом 1-минутном интервале оцифровывали из фильма с использованием программного обеспечения LoggerPro (Venier Software & Technology, Бивертон, Орегон, США).
5.3.2. Результаты гальванотаксиса
Мы применяли электрические поля постоянного тока от 15 В / м до 800 В / м. Количество клеток, отслеживаемых в эксперименте, обычно составляло от 25 до 35. Положение каждой амебы отслеживается с 1-минутными интервалами в течение 20-минутного контрольного периода, в течение которого поле не применяется, и в последующий 40-минутный интервал, в течение которого поле применяется. Во время каждого 1-минутного интервала амеба преодолевает расстояние d. Сумма всех этих расстояний за определенный интервал времени и есть общее расстояние D, пройденное за этот интервал. Средняя скорость или подвижность отдельной амебы в каждом интервале равна D / T, где T — продолжительность интервала, здесь 10 минут. Мы рассматриваем соотношение D / T для последних 10 минут контроля как контрольную подвижность, а это соотношение для последних 10 минут поля как конечную подвижность. Поле направлено по оси абсцисс. В течение любого 10-минутного интервала расстояние, пройденное амебой в направлении поля, равно Δx. Ориентация движения амебы относительно поля параметризуется углом Φ, где cos Φ = ∆x / D.Мы называем cos Φ «направленностью» амебы. Значение cos Φ = +1 указывает на миграцию параллельно полю, тогда как -1 представляет миграцию прямо напротив поля. Мы рассматриваем косинус для последних 10 минут управления как направленность управления, а косинус для последних 10 минут поля как направленность поля.
Средняя скорость или подвижность отдельной амебы в каждом интервале равна D / T, где T — продолжительность интервала, здесь 10 минут. Мы рассматриваем соотношение D / T для последних 10 минут контроля как контрольную подвижность, а это соотношение для последних 10 минут поля как конечную подвижность. Поле направлено по оси абсцисс. В течение любого 10-минутного интервала расстояние, пройденное амебой в направлении поля, равно Δx. Ориентация движения амебы относительно поля параметризуется углом Φ, где cos Φ = ∆x / D.Мы называем cos Φ «направленностью» амебы. Значение cos Φ = +1 указывает на миграцию параллельно полю, тогда как -1 представляет миграцию прямо напротив поля. Мы рассматриваем косинус для последних 10 минут управления как направленность управления, а косинус для последних 10 минут поля как направленность поля.
На Рисунке 6 сравнивается разница направленности поля и управления отдельной ячейки, усредненная по всем ячейкам, как функция приложенного поля.Следовательно, каждая ячейка служит своим собственным контролем. Как видно из увеличения направленности, клетки начинают обнаруживать поля более 30 В / м. Увеличение направленности улучшается по мере увеличения поля и становится относительно устойчивым для полей выше примерно 200 В / м. Есть заметные различия в увеличениях для низких полей, но общая тенденция очевидна. Для более слабых полей требуется около 40 минут, чтобы обнаружить увеличение направленности. Таким образом, сравнения увеличения направленности для различных полей поля проводятся за последние 10 минут полевого внесения.
Как видно из увеличения направленности, клетки начинают обнаруживать поля более 30 В / м. Увеличение направленности улучшается по мере увеличения поля и становится относительно устойчивым для полей выше примерно 200 В / м. Есть заметные различия в увеличениях для низких полей, но общая тенденция очевидна. Для более слабых полей требуется около 40 минут, чтобы обнаружить увеличение направленности. Таким образом, сравнения увеличения направленности для различных полей поля проводятся за последние 10 минут полевого внесения.
Рисунок 6.
Увеличение направленности в поле постоянного тока: косинус в течение последних 10 минут в поле минус косинус в течение последних 10 минут контроля для каждой отдельной ячейки, усредненный по всем ячейкам. Планки погрешностей представляют собой стандартную ошибку среднего.
Измерение подвижности клеток показало, что клетки с низкой контрольной подвижностью увеличивают свою скорость намного более резко, чем клетки с высокой начальной подвижностью [37].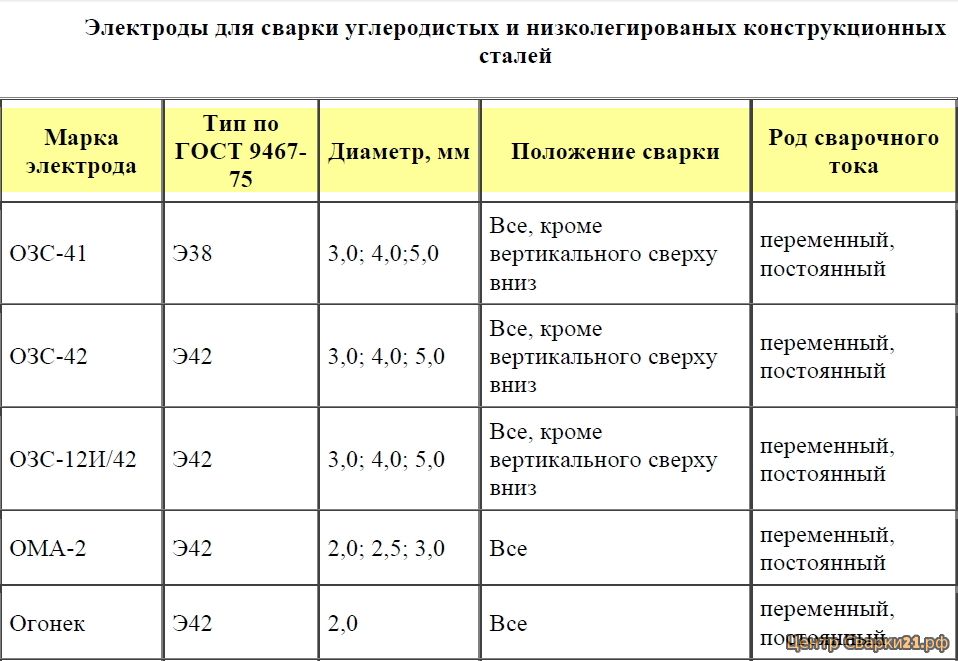 Явное увеличение подвижности примерно на 50% началось выше примерно 60 В / м и улучшилось до примерно 200 В / м, за пределами чего поле было значительным изменением.Увеличение подвижности стало меньше с увеличением контроля подвижности. Не было четкого, соответствующего изменения направленности увеличения с контрольной подвижностью.
Явное увеличение подвижности примерно на 50% началось выше примерно 60 В / м и улучшилось до примерно 200 В / м, за пределами чего поле было значительным изменением.Увеличение подвижности стало меньше с увеличением контроля подвижности. Не было четкого, соответствующего изменения направленности увеличения с контрольной подвижностью.
Одна из целей данного исследования — изучить, насколько широко применяется электромеханическая модель. Hart et al. [36] продемонстрировали, что он хорошо описывает потерю направленности кератиноцитов, когда более слабое низкочастотное поле переменного тока накладывается на более сильное поле постоянного тока. Рисунок 7 показывает, что подобный ответ наблюдался у Amoeba proteus , свободноживущей клетки.Направленность и подвижность амебы сравнивали при воздействии только одного поля постоянного тока 65 В / м, поля переменного тока 32 В / м, 1,6 Гц, наложенного на поле постоянного тока 65 В / м, или поля переменного тока 32 В / м, 160 Гц. накладывается на поле постоянного тока 65 В / м. В каждом случае среднее электрическое поле составляло 65 В / м постоянного тока. Все три набора клеток были доставлены из одной партии и, таким образом, подвергались воздействию сходных условий до экспериментов.
В каждом случае среднее электрическое поле составляло 65 В / м постоянного тока. Все три набора клеток были доставлены из одной партии и, таким образом, подвергались воздействию сходных условий до экспериментов.
Рис. 7.
Влияние на направленность и подвижность наложения меньшего поля переменного тока на поле постоянного тока.В каждом случае поле постоянного тока составляло около 65 В / м, а поле переменного тока — около 32 В / м. Светлая штриховка показывает значения, полученные в течение первых 10 минут применения поля; темная растушевка, последние 10 минут. Планки погрешностей представляют собой стандартную ошибку среднего. (A) иллюстрирует различия в направленности; (B) разница в скорости.
На рис. 7A показано, что направленность устранена для добавленного поля 1,6 Гц в течение первых 10 минут, но сопоставима и значима для полей чистого постоянного тока и добавленных полей 160 Гц.Направленность улучшается для всех трех случаев в течение последних 10 минут. Несмотря на значительное улучшение, направленность для дополнительного случая 1,6 Гц все еще меньше, чем для двух других случаев. Эти результаты аналогичны результатам, полученным для кератиноцитов [36]. Рисунок 7B показывает, что подвижность в течение первых 10 минут для случая добавленного 1,6 Гц намного ниже, чем для других полей. Как и в случае с направленностью, подвижность для дополнительного случая 1,6 Гц улучшилась за последние 10 минут, но все еще меньше, чем подвижность двух других случаев.Эти результаты согласуются с описанной выше моделью подвижности.
Несмотря на значительное улучшение, направленность для дополнительного случая 1,6 Гц все еще меньше, чем для двух других случаев. Эти результаты аналогичны результатам, полученным для кератиноцитов [36]. Рисунок 7B показывает, что подвижность в течение первых 10 минут для случая добавленного 1,6 Гц намного ниже, чем для других полей. Как и в случае с направленностью, подвижность для дополнительного случая 1,6 Гц улучшилась за последние 10 минут, но все еще меньше, чем подвижность двух других случаев.Эти результаты согласуются с описанной выше моделью подвижности.
6. Численное моделирование
Применимость описанных выше методов требует знания подробного распределения электрического поля в месте его применения. Поскольку распределение поля зависит от электрических свойств и физических форм различных клеток и тканей, для расчетов необходимо использовать численные методы [59]. С годами эти методы претерпели значительные изменения.Например, ячейки электронной таблицы могут использоваться для представления элементов небольшого объема в конечности. Величина ячейки — это электрический потенциал элемента Vo. Это значение связано с потенциалом шести окружающих ячеек в трехмерной модели. Установка тока, входящего в ячейку, равным току на выходе, связывает Vo с потенциалами окружающих ячеек через межячеечные удельные сопротивления. Таким образом может быть введена электрическая анизотропия ткани. Фундаментальные уравнения могут быть введены во множество аналогичных ячеек одновременно и решены методом последовательной чрезмерной релаксации в электронной таблице Excel.Этот подход использовался для определения того, как электрическое поле в месте перелома большеберцовой кости развивалось по мере заживления травмы во время лечения электрического перелома [60]. Метод может быть даже расширен для расчета распределения электрического поля, индуцированного сложным распределением клеток в культуральной чашке [61].
В последнее время коммерческие программы используются для более точного и быстрого определения распределения полей в сложных ситуациях. Как отмечалось выше в разделе 5.3.1, COMSOL Multiphysics (COSMOL Inc., Берлингтон, Массачусетс, США) использовался для определения распределения электрического поля и температуры в нашей экспериментальной установке. Размещение электродов для введения импульсов электропорации требует подробного численного анализа результирующих полей на участке опухоли и вокруг него [8]. В настоящее время доступны виртуальные модели всего тела животных и человека для очень подробных вычислений электрического поля [62]. Модели содержат информацию об электрических, тепловых и текучих свойствах различных тканей.Таким образом, можно провести всесторонний анализ распределения поля и связанных с ним физических эффектов для различных размещений электродов.
7. Выводы
Электрические поля находят широкое применение в биологии и медицине. Физиологические силовые поля используются для улучшения заживления ран, стимуляции нейронов, а также позиционирования и активации клеток на каркасах в целях тканевой инженерии. Короткие сильные импульсы, используемые при электропорации, используются для улучшения введения лекарств в опухоли и ДНК в ядра клеток.Для выбора подходящей напряженности поля для применения в клинических условиях необходимо использовать численное моделирование. Некоторые фундаментальные вопросы все еще решаются; в частности, как клетки на самом деле обнаруживают поля? Описанная здесь электромеханическая модель соответствует экспериментальным данным, тогда как другие модели — нет.
Обзор текущего состояния, альтернативных подходов к IGP и будущих перспектив
Эффективность электропорации (EP) сделала ее широко используемой терапевтической процедурой для эффективного переноса веществ, убивающих клетки, в целевой участок.В настоящее время проводится множество исследований методов лечения рака на основе EP. Электрохимиотерапия (ЭХТ) — это первое применение на основе EP в области введения лекарств. ЭСТ — это местное и нетепловое лечение рака, которое сочетает в себе использование медицинского устройства с фармацевтическими агентами для получения местного контроля над опухолью при солидном раке. Он включает в себя приложение восьми импульсов, 100 µ с, с частотой 1 или 5000 Гц и заданным электрическим полем (В / см) со средней продолжительностью 25 минут.Эффективность химиотерапевтических препаратов повышается за счет применения коротких и интенсивных электрических импульсов. В нескольких клинических исследованиях предложена ЭСТ в качестве безопасного и дополнительного лечебного или паллиативного варианта лечения (лечебная цель от 50% до 63% при лечении базально-клеточной карциномы (BCC)) для лечения ряда солидных опухолей и злокачественных новообразований кожи, которые не подходят для традиционных методов лечения. В настоящее время он используется для лечения кожных и подкожных поражений без учета их гистологии.Напротив, он также становится практическим методом лечения внутренних, глубоко расположенных опухолей и тканей. Обзор этого метода, необходимые инструменты, альтернативные подходы к процедурам на основе изображений (IGP), а также перспективы и рекомендации на будущее обсуждаются в этой статье.
1. Введение
Когда достаточно сильное электрическое поле прикладывается к ткани в течение адекватной продолжительности, трансмембранное напряжение индуцируется через плазматическую мембрану клетки. В результате изменения геометрических и материальных свойств ткани вызывают локальные дефекты клеточной мембраны и делают ее проницаемой для агентов, которые в противном случае не могли бы проникнуть в нее.Это явление обычно известно как электропорация (ЭП) [1, 2]. Есть два типа ВП: обратимые и необратимые. Продолжительность импульсов и напряженность электрического поля определяют, являются ли структурные изменения клеточной мембраны обратимыми, позволяя клеткам выжить, или необратимыми, что приводит к их гибели из-за потери гомеостаза [3].
Это явление стало обычным явлением для загрузки ячеек с материалами, которые либо невозможно, либо трудно пройти через ячейки.Это привело к росту технологий на основе EP для биомедицинских приложений и исследований в области доставки лекарств и генной терапии, таких как генная электротрансфекция, нетермическая необратимая электропорация и электрохимиотерапия (ЭХТ) [4–6]. Эффективность этих видов терапии зависит от двух факторов: во-первых, электрических характеристик, таких как амплитуда и продолжительность электрических импульсов, количества импульсов и их повторения, типа используемых электродов и, во-вторых, характеристик клеток и тканей, таких как форма, размер, структура цитоскелета и состав мембраны, которые хотят произвести на нем ЭП [7, 8].
ECT — это местная и нетепловая методика удаления опухоли, которая сочетает в себе введение плохо проницаемого цитотоксического агента с локальным применением электрических импульсов, которые индуцируют обратимый EP, тем самым улучшая диффузию лекарства в клетки. Благодаря этому методу эффективность химиотерапевтических препаратов увеличивается за счет использования электрических импульсов, что обеспечивает хороший местный контроль опухоли [9–11].
Основные химические и физические процессы, связанные с эффективностью воздействия больших электрических полей на клетки в ткани, все еще недостаточно выяснены.Однако предсказания теоретических моделей и результаты экспериментальных исследований показывают, что приложение подходящего электрического поля к опухоли приводит к временному открытию водяных пор на клеточной мембране, что позволяет пропускать лекарства, гены или молекулярные зонды [ 12].
Эффективность ЭСТ подтверждена при различных типах опухолей. Первое клиническое исследование узелков опухолей головы и шеи было опубликовано в 1991 году. ЭСТ использовалась при лечении подкожных и кожных поражений и метастазов опухолей, с объективным ответом в диапазоне от 75% до 99%.Применяется для лечения меланом, сарком и других видов рака кожи, лейомиосаркомы шейки матки и рака груди. На рисунке 1 показан результат фактического лечения с использованием ЭСТ [2, 13–15].
ЭСТ может использоваться как альтернативный подход или как паллиативное лечение после стандартных методов лечения (таких как хирургическое вмешательство, лучевая терапия и химиотерапия) для улучшения качества жизни пациентов. Недавно Национальный институт здравоохранения и повышения квалификации (NICE) в Великобритании предложил ЭСТ для лечения недоступных или трудно поддающихся лечению первичной базально-клеточной карциномы (BCC) и плоскоклеточной карциномы (SCC) у тщательно отобранных пациентов.Он также поддерживает использование ЭСТ в качестве паллиативного лечения метастазов в коже из опухолей не кожного происхождения и меланомы с обычными условиями для клинического руководства, согласия и аудита. Кроме того, руководство Arbeitsgemeinschaft Dermatologische Onkologie (ADO) в Германии указывает достаточные доказательства эффективности ЭСТ как альтернативного подхода в лечении локорегиональных метастазов злокачественных меланом [16–18].
В настоящее время разработка ЭСТ сосредоточена на лечении слизистых, больших и глубоко расположенных опухолей, а также внутренних органов или более сантиметров ниже кожи.На рисунке 2 показаны текущие и потенциальные применения ЭСТ.
ЭСТ известна некоторым национальным службам здравоохранения для лечения пациентов с кожными метастазами из различных гистотипов опухолей. Он был адаптирован более чем 150 онкологическими центрами по всей Европе и способствовал его распространению в клинической практике. Также в Европе существует несколько специализированных баз данных о пациентах, из которых наиболее важными являются база данных Международной сети по обмену опытом в области ЭСТ (INSPECT) и Italian Melanoma Group и Gruppo Italiano Dermatologico Oncologico (GIDO).INSPECT был создан для изучения эффективности и полезности ЭСТ, а также ведения пациентов путем сбора проспективных данных, обмена опытом и улучшения клинической практики. Итальянская интергруппа по меланоме (IMI) и GIDO инициировали проспективное многоцентровое обсервационное исследование для оценки эффективности лечения ЭСТ. Обследовано 376 подходящих пациентов с поверхностными метастазами, которым проводилась ЭСТ с октября 2008 г. по март 2013 г. Результаты этого исследования убедительно подтверждают эффективность ЭСТ у пациентов с поверхностными метастазами любого гистотипа и раком кожи [11, 14, 19–23].
После обзора процедуры ECT с точки зрения практической реализации и технических требований обсуждаются новое применение ECT, альтернативные подходы к процедурам с визуальным контролем (IGP) и то, что необходимо сделать для дальнейшего применения.
2. Практическая реализация и технические требования
2.1. Принципы и процедура лечения
ЭСТ — это процедура, сочетающая непроницаемое для мембраны или плохо проницаемое цитотоксическое лекарственное средство, имеющее внутриклеточную мишень, с использованием коротких и интенсивных электрических импульсов, которые вызывают повышенную проницаемость мембраны [11, 24].Основные принципы эффективного лечения заключаются в следующем. Во-первых, фармакологический пик введенного цитотоксического препарата достигает опухоли во время приложения коротких и интенсивных электрических импульсов (диапазон между пороговыми значениями обратимой и необратимой электропермеабилизации). Во-вторых, вся масса опухоли в достаточной степени покрыта электрическим полем (рис. 3) [2, 25].
ЭСТ выполняется с использованием внутриопухолевой или внутривенной инъекции цитотоксических лекарств с последующим приложением электрических импульсов, локально доставляемых к опухоли-мишени через подходящие наборы электродов.Когда к клеткам прикладываются внешние электрические заряды, заряды на клеточной мембране начинают двигаться. Это вызывает постепенное увеличение трансмембранного напряжения (так называемого индуцированного трансмембранного напряжения, которое добавляется к нормальному трансмембранному напряжению покоя клетки или мембранному потенциалу покоя). Адекватное и сильное электрическое поле создается через клеточную мембрану, где трансмембранное напряжение выходит за пределы определенного напряжения. Это приводит к созданию прохода (поры) для воды, заряженных и более крупных молекул, которые проходят через клеточную мембрану.Они возникают быстро и исчезают в течение от нескольких секунд до нескольких минут после воздействия электрического поля. Хотя эти поры слишком малы и недолговечны, чтобы их можно было наблюдать с помощью обычной или электронной микроскопии, косвенные доказательства их существования прибывают из моделирования липидных бислоев с использованием моделирования молекулярной динамики. Механизм повторного закрытия или восстановления мембраны требует активных клеточных механизмов и, следовательно, энергии. Итак, возможным объяснением относительно длительной проницаемости клеточных мембран является химическое изменение липидов мембран [7, 26].
Исследования показали, что основное внимание в химиотерапевтических средствах уделяется активно делящимся раковым клеткам и меньше — неделящейся популяции нормальных клеток в окружающей ткани. Когда ткань опухоли подвергается воздействию электрических импульсов, кровоток в опухоли снижается до 80% и возвращается в нормальное состояние в течение 24 часов. Таким образом, введенное лекарство может оставаться в ткани опухоли в течение нескольких часов, что дает ему больше времени для действия [2, 4].
Хотя эффективность ЭСТ как в онкологии человека, так и в ветеринарии была хорошо продемонстрирована, различия между протоколами лечения, отсутствие определенных операционных процедур и использование различных генераторов импульсов на какое-то время предотвратили широкое распространение ЭСТ в клинических условиях [5, 26].Возникла острая необходимость в чрезвычайно точных процедурах для системной или местной доставки цитотоксических лекарств с последующим применением электрических импульсов, а также для каждого конкретного клинического состояния [2].
Первая версия стандартной операционной процедуры (СОП) была разработана и утверждена Европейскими стандартными операционными процедурами для ЭСТ (ESOPE) в 2006 году. В этом справочнике описаны рекомендации по указанию ЭСТ, информация о предварительной обработке, варианты лечения и последующие: ИБП для безопасного и удобного лечения пациентов с кожными и подкожными узелками.Дерево решений СОП призвано помочь клиническому персоналу принять решение о том, как лечить пациента, в зависимости от размера, количества и толщины / глубины узлов, подлежащих лечению. Оценка и подтверждение ответа на лечение на основе ESOPE показали частоту объективного ответа 85% и частоту полного ответа на ЭСТ 74%, независимо от гистологии опухоли, используемого препарата и пути введения препарата. Недавно панъевропейская группа экспертов по дерматологии, общей хирургии, хирургии головы и шеи, пластической хирургии и онкологии опубликовала новую версию СОП для ЭСТ кожных опухолей и кожных метастазов.Процедура ЭСТ может быть выполнена за 30 минут как под местной, так и под общей анестезией, решение по выбору лечащего хирурга, но небольшие узелки меньшего размера рекомендуется лечить под местной анестезией, а другие под общей анестезией [26–29].
2.2. Приборы
ЭСТ выполняется с помощью генератора электрических импульсов и различных типов электродов. Эти инструменты подробно описаны ниже.
2.3. Генератор электрических импульсов
ЭП клеток преимущественно индуцируется импульсными электрическими полями через последовательность прямоугольных электрических импульсов достаточной амплитуды, создающих локальное электрическое поле (сотни В / см) [3], и прикладывается к опухолевым клеткам с с помощью электродов, чтобы произошло явление ЭП [27].
Адекватные амплитуды импульсов изначально были и слишком часто все еще определяются эмпирическим путем. В клинических условиях используются монополярные электрические импульсы постоянного тока, а также короткие и интенсивные электрические импульсы квадратной формы. Чтобы предсказать распределение электрического поля в биологических тканях, численное моделирование в настоящее время является единственным эффективным способом, поскольку они характеризуются по своей сути нелинейными, неоднородными и, в некоторых случаях, анизотропными диэлектрическими свойствами. На основе первоначальных лабораторных, доклинических и клинических исследований по лечению доступных на коже опухолевых узлов 8 импульсов длительностью 100 µ с с частотой повторения 1 Гц или 5000 Гц.Применяемые напряжения зависят в основном от типа электрода, количества электродов и геометрии электродов, например расстояния между электродами, и автоматически устанавливаются генератором импульсов. Для лечения опухолевых узлов, доступных с помощью фиброскопии, эндоскопии, лапароскопии или открытой хирургии, СОП и оборудование все еще находятся в стадии разработки [7, 27, 30, 31].
2.4. Типы электродов
Доступны различные наборы электродов для различных узелков с разной глубиной, размером и формой, как пластинчатые, так и игольчатые электроды.Различные конфигурации электродов используются для обеспечения достаточного покрытия электрическим полем всего объема опухоли. На рисунке 4 показаны различные типы электродов [11].
(a)
Frontiers | Мультиэлектродные матрицы на основе углеродных нанотрубок для взаимодействия нейронов: прогресс и перспективы
Введение
Обширные исследования за последние 50 лет выявили большой потенциал имплантированных электродов для регистрации и стимуляции нейрональных сигналов.Такие устройства в настоящее время используются для лечения широкого спектра состояний, таких как глухота, болезнь Паркинсона и хроническая боль, и это лишь некоторые из них (Schwartz, 2004; Clark, 2006; Wichmann and DeLong, 2006; McCreery, 2008; Plough и др., 2012). Недавние исследования также предложили использовать нейростимуляцию при растущем числе дополнительных инвалидизирующих состояний, таких как шизофрения и болезнь Альцгеймера (George et al., 2007; Laxton et al., 2010). Поскольку устройства для записи и стимуляции с высоким разрешением очень привлекательны для приложений нейронной записи и стимуляции, концепция многоэлектродной матрицы (MEA) привлекла повышенное внимание в этой области.Устройство MEA состоит из массива электропроводящих микроэлектродов (обычно диаметром 20–200 мкм), подключенных к внешней схеме, чтобы обеспечить регистрацию или стимуляцию электрической активности нейронов. Активные усилия действительно продемонстрировали потенциал MEA как эффективного инструмента в различных неврологических приложениях. В частности, микротехнологии изготовления использовались для формирования металлических электродов тонкой формы [например, из золота, платины и нитрида титана (TiN)]. Реализация таких электродов легко достигается с помощью набора инструментов, заимствованного из области микромеханических систем (MEMS).Этот набор инструментов включает процессы изготовления, а также материалы с улучшенными характеристиками.
Целью настоящего обзора является исследование в рамках микроизготовленных нейроэлектродов использование углеродных нанотрубок (УНТ) в качестве нового материала с уникальными свойствами для нейроприложений. С этой целью будут рассмотрены свойства УНТ, а также их обработка и изготовление устройств. Будет кратко представлена общая область микроизготовленных нейроэлектродов, которая выходит за рамки этого обзора.Мы отсылаем читателей к HajjHassan et al. (2008), о биосовместимости УНТ с Warheit et al. (2004), Bottini et al. (2006), Карреро-Санчес и др. (2006) и Фирме и Бандару (2010), а об использовании УНТ в биологии Бекьярова и др. (2005), Тараканов и др. (2010) и Bottini et al. (2011).
Мы начнем с обзора основных химических, физических и электрических свойств УНТ (Thostenson et al., 2001; Harris, 2009; Lan et al., 2011). Затем мы исследуем исследования, в которых изучается интерфейс нейрон-УНТ. Далее обсуждается использование CNT для формирования паттерна нейронов, после чего следует обзор электрических интерфейсов между CNT и нейронами и изучение MEA CNT для нейронных приложений. Наконец, мы обсуждаем прогресс в создании гибкой, биосовместимой технологии CNT.
За рамками обычного микропроизводства
Несмотря на быстрое развитие в последнее время, современные MEAs для нейронных приложений по-прежнему характеризуются относительно низким отношением сигнал / шум (SNR), низким пространственным разрешением (что приводит к плохой специфичности сайта) и ограниченной биосовместимостью.Очевидно, что необходимы дальнейшие разработки, чтобы улучшить электроды, подходящие для бесшовной интеграции электронных устройств и нейронных систем. Ограниченные характеристики этих систем MEA проистекают прежде всего из сложного интерфейса между биологическими системами и искусственными электронными системами. При проектировании интерфейса между живой тканью и электронным устройством необходимо учитывать существенные структурные и химические различия между этими двумя системами: живые ткани мягкие, а электронные устройства обычно жесткие.Ткань проводит заряды посредством ионного транспорта, тогда как электронные устройства проводят электроны и дырки. Следовательно, нейронные электроды должны учитывать различия в механических свойствах, биологической активности и механизмах переноса заряда. Правильный интерфейс электрод-нейрон имеет решающее значение для обеспечения жизнеспособности клеток и эффективности электрического интерфейса.
Основным ограничивающим признаком многих современных МЭБ являются большие размеры электродов. Меньшие электроды позволят улучшить пространственное разрешение и специфическую регистрацию клеток или стимуляцию.Кроме того, уменьшение размера электродов (и, следовательно, размеров всего устройства) связано с уменьшением повреждения тканей и иммунного ответа (Szarowski et al., 2003; Biran et al., 2005; Polikov et al., 2005; McConnell et al. ., 2009). При этом изготовление малых электродов технологично; Уменьшение размера электродов, необходимое для улучшения как стимуляции, так и записи, является сложной задачей. Маленькие электроды не могут обеспечить достаточную инжекцию заряда из-за их высокого сопротивления интерфейса.Низкая обратимая емкость накопления заряда (CSC) означает, что электрод не может подавать достаточный ток в ткань при достаточно небольшом перенапряжении, чтобы избежать необратимых электрохимических реакций (например, электролиза) и последующего повреждения электрода и ткани (Cogan, 2008). Таким образом, чтобы уменьшить размер электрода без ущерба для способности электрода передавать заряд, требуются электроды с высокой удельной площадью. Высокий импеданс также способствует увеличению общего уровня шума в записанных сигналах, что снижает чувствительность записи.Дополнительную озабоченность вызывает полярность электрода. Для лучшей биосовместимости желательны полярные электроды (Merrill et al., 2005). Эти вопросы обсуждаются далее в тексте.
Тесное соединение нервных клеток с электродами также важно, в противном случае эффективность как регистрации, так и стимуляции будет скомпрометирована. Запись затрудняется фоновым шумом соседних нейронов. Кроме того, проводимость раствора влияет как на запись, так и на стимуляцию (Grattarola and Martinoia, 1993).Наиболее распространенным способом стимулирования нейральной адгезии является использование белков клеточной адгезии (Sorribas et al., 2001; Heller et al., 2005). Синтетические положительно заряженные полимеры, такие как полилизин (Crompton et al., 2007) и поли (этиленимин) (PEI) (Ruardij et al., 2000), обычно используются для стимулирования прикрепления нервных клеток (He and Bellamkonda, 2005; Khan and Newaz , 2010). Термочувствительный поли (N-изопропилакриламид) (PNIPAm) был использован для улучшения связывания между имплантатом сетчатки и сетчаткой (Tunc et al., 2007). Проводящие полимеры (CP), такие как поли (этилендиокситиофен) (PEDOT) и полипиррол (PPy), использовались в качестве подложки для роста нервных клеток и покрытия электродов и представляют особый интерес из-за их комбинированной электронной и ионной проводимости (George et al., 2005). ; Абидиан, Мартин, 2008; Асплунд и др., 2009; Абидиан и др., 2010). Основным недостатком КП является их низкая стабильность при продолжительном воздействии и воздействии ультрафиолетового (УФ) излучения или тепла. Приложенное напряжение возникает в результате введения или удаления противоионов, поэтому CP претерпевают набухание, сжатие или разрушение, что постепенно ухудшает их проводимость (Yamato et al., 1995; Marciniak et al., 2004). Кроме того, синтетические и CP часто производятся с использованием сложных или токсичных схем полимеризации, которые плохо подходят для приложений взаимодействия с клетками. Эти остатки часто нелегко удалить (Wan, 2008).
Шероховатость поверхности и углеродные нанотрубки в нейрональном интерфейсе
Недавние исследования показали, что топография поверхности является важным параметром, влияющим на закрепление и разветвление нейронов (Seidlits et al., 2008; Hoffman-Kim et al., 2010; Roach et al., 2010). Фактически, клетки предпочтительно прилипают к шероховатым поверхностям при воздействии того же химического вещества (Fan et al., 2002). Поэтому были исследованы новые электродные материалы для создания электродов с улучшенными электрическими свойствами, сродством к нейронным клеткам и биосовместимостью, используя морфологические свойства электродов, а не их химические.
Идеальным материалом для удовлетворения этих требований являются УНТ. УНТ хорошо подходят для нейронных электрических интерфейсов благодаря их большой площади поверхности, превосходным электрическим и механическим свойствам, а также их способности поддерживать отличную адгезию нейрональных клеток (Malarkey and Parpura, 2007; Ben-Jacob and Hanein, 2008; Voge and Стегеманн, 2011).Недавние исследования действительно подтвердили большой потенциал поверхностей УНТ в качестве биологически совместимого субстрата, на котором нейроны могут легко прилипать. Это сродство было связано со свойствами поверхности, включая шероховатость, полярность, заряд и химию (Hu et al., 2004; Gabay et al., 2005a, b; Malarkey et al., 2009; Sorkin et al., 2009). Большая площадь поверхности УНТ может привести к значительному увеличению способности инжекции заряда и снижению межфазного импеданса (Gabay et al., 2007; Keefer et al., 2008).
Исследования до сих пор были сосредоточены на нескольких основных темах: влияние химически модифицированных УНТ на жизнеспособность нейрональных клеток, рост отростков и ветвление (Mattson et al., 2000; Hu et al., 2004; Matsumoto et al., 2007), электрическое взаимодействие с нейронами (Gheith et al., 2006; Wang et al., 2006; Gabay et al., 2007; Shein et al., 2009) и разработка нервных имплантатов (Webster et al., 2004; Nunes et al., 2012). CNT в настоящее время широко исследуются в качестве связующего материала для нейронных приложений (Malarkey and Parpura, 2007; Ben-Jacob and Hanein, 2008; Pancrazio, 2008; Lee and Parpura, 2009; Voge and Stegemann, 2011). Как подчеркивалось выше, и химия поверхности, и топография поверхности являются критически важными параметрами, определяющими формирование эффективных электродов.Для решения этих проблем было разработано множество схем с использованием покрытий УНТ (чистых и химически модифицированных), предлагающих захватывающие возможности, которые будут более подробно рассмотрены ниже.
Углеродные нанотрубки
Начнем наш обзор с краткого обзора физических свойств УНТ. УНТ представляют собой полые цилиндры, сформированные в форме прокатанного листа графита. Однослойные УНТ (ОСУНТ) являются простейшими из этих объектов с диаметром от 0,4 до 2,5 нм и длиной до нескольких миллиметров.Многостенные углеродные нанотрубки (MWCNTs) состоят из набора коаксиально организованных SWCNTs и имеют диаметр 2–100 нм, а их длина может варьироваться от одного до нескольких сотен микрометров (Harris, 2009). Расположение атомов углерода в листе графена может быть разной хиральности: кресло, хиральное или зигзагообразное. Хиральность, а также диаметр трубки и количество графеновых стенок определяют проводимость УНТ. Как правило, ОУНТ могут быть металлическими или полупроводниковыми с МУНТ с металлическими свойствами (Charlier et al., 2007). УНТ также механически стабильны, обладают очень высокой прочностью на разрыв и химической инертностью (Ciraci et al., 2004; Hayashi et al., 2007). УНТ обычно синтезируются из катализатора различными методами, включая химическое осаждение из паровой фазы (CVD), электрический дуговый разряд и лазерную абляцию (Thostenson et al., 2001; Seah et al., 2011). Их физические свойства делают УНТ прочным наноматериалом для биологических применений, особенно там, где требуется долговечный материал (например, каркасы для поддержки роста клеток).Хотя поверхность УНТ принципиально инертна, она может быть легко функционализирована различными полимерами или биоактивными молекулами, такими как пептиды и белки, для улучшения их биосовместимости и биоактивности (Bekyarova et al., 2005; Yang et al., 2007; Lu et al. ., 2009; Bottini et al., 2011).
Углеродные нанотрубки и нейроны
Первые исследования использования УНТ в приложениях нейроинтерфейса были сосредоточены на характеристике адгезии и пролиферации нейронов на поверхностях, покрытых УНТ.Маттсон и его сотрудники были первыми, кто обсудил использование УНТ в качестве субстрата для роста нейронов (Mattson et al., 2000). Исследователи вырастили эмбриональные нейроны гиппокампа крысы на покровных стеклах, покрытых PEI и MWCNT. Они обнаружили, что первичные субстраты MWCNT допускают прикрепление нейронов, но не поддерживают такое сложное ветвление нейритов, как у клеток, культивируемых на покровных стеклах, покрытых PEI. Однако, когда MWCNT были нековалентно функционализированы (посредством физиосорбции) с помощью 4-гидроксиноненала (4-HNE), молекулы, которая способствует разрастанию нейритов, наблюдалось значительное увеличение количества нейритов на клетку и общей длины нейритов.Это исследование продемонстрировало, что MWCNT могут служить в качестве пермиссивного субстрата для адгезии и роста нейронных клеток и что модификация MWCNT с помощью биологически релевантной молекулы может использоваться для модуляции роста нейронов и роста нейритов (Mattson et al., 2000).
За новаторской работой Мэттсона и его сотрудников последовала серия исследований, направленных на дальнейшее разъяснение наблюдаемых эффектов. Hu et al. изучал действие заряда. Более длинные нейриты и более развитое ветвление наблюдались на положительно заряженных субстратах УНТ (Hu et al., 2004). Заряд субстрата MWCNT был модифицирован функционализацией карбоксильными группами, поли-м-аминобензолсульфоновой кислотой (PABS) или этилендиамином (EN) для создания отрицательно, цвиттерионных или положительно заряженных нанотрубок соответственно. Количество нейритов подсчитывали в зависимости от природы нанотрубок и их функционализации. Се и соавторы определили, что маты из MWCNT, функционализированные карбоксильными группами, являются разрешающим субстратом для роста нейронов ганглия задних корешков крысы (DRG), что подтверждено с помощью сканирующей электронной микроскопии (SEM).Исследователи также предположили, что функциональные группы действуют как якорные семена, усиливая нервные клетки и адгезию нейритов (Xie et al., 2006).
Ковалентные модификации УНТ нейротрофинами, факторами роста белков, которые способствуют выживанию и дифференцировке нейронов, были изучены Matsumoto et al. (2007). MWCNT были функционализированы с помощью фактора роста нервов (NGF) и нейротрофического фактора мозга (BDNF). Рост нейритов DRG эмбриона цыплят на модифицированных MWCNT был подобен таковому, наблюдаемому с растворимыми NGF и BDNF в среде для культивирования, что указывает на то, что ковалентно присоединенные факторы все еще были биоактивными.Также было показано, что нетронутые MWCNT поддерживают рост нейронов (Gabay et al., 2005a, b; Galvan-Garcia et al., 2007). Этот эффект хорошо проиллюстрирован на рисунке 1, который показывает сильное сродство между диссоциированными нейронами саранчи и островками первичных CNT после нескольких дней инкубации. Гальван-Гарсия с соавторами сообщили, что MWCNT в форме листов или нитей поддерживают долгосрочный рост различных типов клеток, от фибробластов кожи и клеток Шванна до постнатальных кортикальных нейронов и нейронов мозжечка.При высокой степени очистки эти листы УНТ позволяли нейронам расширять отростки такого же количества и длины, что и те, которые выросли на плоских полиорнитиновых субстратах (разрешающая поддержка). Таким образом, эти результаты предполагают, что на взаимодействие между нейронами и УНТ может влиять чистота УНТ, а также трехмерная организация субстрата УНТ.
Рис. 1. СЭМ-изображение фиксированных нейронных клеток лобных ганглиев саранчи, культивируемых на островках из углеродных нанотрубок. Островки углеродных нанотрубок были выращены методом химического осаждения из газовой фазы непосредственно на кварцевой подложке. Для получения дополнительных сведений см. Sorkin et al. (2009). Ширина поля зрения 77 мкм.
Хотя первоначальные исследования были сосредоточены на MWCNT, SWCNT также изучались как нейрональные субстраты. Hu и его сотрудники синтезировали привитой сополимер SWCNT, функционализированный PEI (SWCNT-PEI) (Hu et al., 2005). Ковалентную функционализацию использовали для превращения ОУНТ в растворимые в водной среде.Затем нейроны гиппокампа крысы культивировали на покровных стеклах, покрытых SWCNT-PEI, и результаты сравнивали с результатами для исходных субстратов MWCNT или PEI. Флуоресцентная микроскопия использовалась для исследования жизнеспособности нейронов, на что указывало их способность накапливать жизненно важный краситель, кальцеин. Было обнаружено, что функционализация SWCNT ослабляет эффект положительного заряда PEI, что приводит к разрастанию и разветвлению нейритов с промежуточной степенью по сравнению с таковыми у свежеприготовленных пленок CNT или только PEI. Эти результаты согласуются с первоначальными выводами Маттсона и его коллег с использованием фиксированных клеток.Было обнаружено, что модифицированные MWCNT уступают PEI в качестве субстрата для культивирования (Hu et al., 2005). Гейт и его коллеги продемонстрировали, что автономные пленки из SWCNT-полимера, полученные методом послойного (LBL), совместимы с культивированием нейронных клеток. Пленки были приготовлены путем наслоения ОСУНТ отрицательно заряженным полимером полиакриловой кислоты. ОУНТ были покрыты амфифильным поли ( N -ацетил-4-винилпиридинийбромид- — — N -этил-4-винилпиридинийбромид- — -4-винилпиридин).Наличие положительно заряженных групп на поверхности этого полимера способствует адгезии клеток. Культуры клеток нейрональной модельной клеточной линии NG108 эффективно росли и пролиферировали на этих субстратах. Более того, количество нейритов, сплетенных из отдельных клеток, превышало количество нейритов, образовавшихся на традиционных субстратах для роста клеток (Gheith et al., 2005). Однако не вся функционализация CNT приводит к созданию субстратов, которые усиливают рост нервных клеток. Liopo с соавторами показали, что SWCNT, функционализированные 4-третбутилфенилом или 4-бензойной кислотой, менее способствуют прикреплению и росту клеток NG108, чем первичные нанотрубки (Liopo et al., 2006).
Углеродные нановолокна (УНВ) представляют собой форму углеродного материала, тесно связанного с МУНТ, и также были протестированы в качестве нейронального субстрата. УНВ состоят из многослойных графеновых структур, уложенных друг на друга, как стопка рожков мороженого (Родригес, 1993). Нуген-Ву и его сотрудники непосредственно выращивали лесоподобные вертикально ориентированные CNF (VACNF) на подложке с катализатором с литографическим рисунком. После того, как пленка CNF была погружена в жидкость и высушена, CNF необратимо слиплись, образуя микрожгулы.Равномерная свободностоящая пленка была получена после покрытия CNF тонким слоем CP PPy электрохимическим осаждением. Клеточная линия PC12 росла в виде монослоев на пленках CNF только после дальнейшего покрытия пленкой коллагена. В противном случае клетки, по-видимому, плавают на поверхности CNF (Nguyen-Vu et al., 2006). В последующем исследовании нейрональный маркер NGF был введен на поверхность VACNF, чтобы способствовать образованию хорошо дифференцированных клеток со зрелыми нейритами. Было обнаружено, что автономные VACNF, покрытые PPy и NGF, изгибаются по направлению к телу клетки и прикрепляются к нему.Поэтому было высказано предположение, что мягкое покрытие PPy способствует лучшему механическому контакту с клетками за счет уменьшения местного механического напряжения (Nguyen-Vu et al., 2007).
CNT Проводимость
Поскольку УНТ могут быть проводящими и полупроводящими, их электрические свойства также были изучены. Маларки и его сотрудники варьировали проводимость покрытий привитого сополимера ОСУНТ-полиэтиленгликоль (ПЭГ), изменяя толщину пленки, сохраняя при этом постоянную шероховатость поверхности (Malarkey et al., 2009). Затем засевали нейроны гиппокампа крысы. Было показано, что более тонкие, менее проводящие пленки ОСУНТ приводят к более длинным отросткам нейритов, тогда как более толстые и более проводящие пленки дают более крупные тела клеток. Гладкие, положительно заряженные субстраты PEI приводили к большему количеству конусов роста на тело клетки. Это исследование продемонстрировало, что различия в проводимости, шероховатости и поверхностном заряде могут модулировать рост и морфологию нервных клеток.
Шероховатость поверхности углеродных нанотрубок
В целом, на происхождение взаимодействия нейрон-УНТ сильно влияет шероховатость поверхности.Было высказано предположение, что шероховатость CNT вносит вклад в закрепление нервных клеток (Zhang et al., 2005; Xie et al., 2006; Sorkin et al., 2009). Zhang et al. (2005) изготовили узорчатые вертикальные поверхности MWCNT. Затем УНТ функционализировали поли-L-лизином (PLL). Культуры клеток нейрональной клеточной линии h29-7 преимущественно прикреплялись к паттернам MWCNT. Было обнаружено, что конусы роста нейронов контактируют с поверхностью нанотрубок, и эти сильные взаимодействия позволяют нейронам распространяться по образцам и формировать взаимодействия друг с другом.Было установлено, что управляемый рост нейритов преимущественно формировался на длинных вертикальных МУНТ по сравнению с короткими. Авторы объясняют такое поведение возможной повышенной адсорбцией молекул ФАПЧ на длинных нанотрубках. Дополнительный механизм может заключаться в том, что длинные нанотрубки становятся гибкими и деформируются для размещения пролиферирующих нейритов.
Соркин с соавторами охарактеризовали расположение нейронов и глиальных клеток на поверхности УНТ (см. Рис. 2). Были изготовлены трехмерные, небольшие, изолированные и чистые островки УНТ, на которые были нанесены клетки.Были использованы две биологические модельные системы: нейроны коры крыс и ганглиозные клетки саранчи. Было обнаружено, что нейроны связаны и преимущественно прикреплены к шероховатым поверхностям. Для обеих модельных систем было обнаружено, что морфология нейрональных отростков на маленьких изолированных островках УНТ высокой плотности заметно скручена и запутана. В этом исследовании было продемонстрировано, что шероховатость поверхности должна соответствовать диаметру отростков нейронов, чтобы они могли связываться. Было высказано предположение, что запутывание, механический эффект, может представлять собой дополнительный механизм, с помощью которого нейроны прикрепляются к шероховатым поверхностям (Соркин и др., 2009).
Рис. 2. Культуры нейронов крыс на островках УНТ. (A) Флуоресцентное конфокальное изображение фиксированных нейронов (красный) и глиальных клеток (зеленый), культивируемых на островке из углеродных нанотрубок. Диаметр диска 20 мкм. (B, C) HRSEM-изображения нейронного процесса, образующего петлю вокруг нескольких УНТ (обозначенных стрелками). Изображение в (C) соответствует области, отмеченной пунктирной рамкой в (B) . Четко идентифицируемые сегменты процесса были выделены вручную.Процессы, по-видимому, связываются с поверхностью углеродных нанотрубок аналогично тому, как это происходит с усиками. Взято из работы Соркина и др. (2009).
Таблица 1 суммирует основные результаты, описанные выше, подчеркивая, как различные CNTs и модификации CNT влияют на адгезию нейронов. В целом общая картина, которая возникает из этих исследований, состоит в том, что MWCNTs, SWCNTs и CNFs являются пермиссивным субстратом для роста и пролиферации нейронов. На взаимодействие нейронов с УНТ влияет химическая модификация поверхности УНТ, проводимость, заряд и шероховатость.Положительный заряд положительно влияет на разветвление и длину нейритов. Изменение проводимости приводило к морфологическим изменениям длины нейритов и размеров тела клетки. Шероховатость поверхности способствовала закреплению нейронов на поверхности. Химические модификации поверхности УНТ с помощью 4-HNE и PEI оказали положительное влияние на разветвление и рост нейритов, тогда как модификация с помощью субстрата, модифицированного 4-третбутилфенилом и 4-бензойной кислотой, уменьшала рост нейронных клеток.
Таблица 1.Нейрональная адгезия на поверхностях, покрытых УНТ .
Углеродные нанотрубки для формирования нейронов
Узорчатые пленки УНТ, такие как те, что обсуждались выше, обеспечивают уникальную схему для создания и изучения инженерных нейронных сетей. Исследования с использованием структурированных УНТ могут дать представление о коллективной активности нейронных сетей. Паттерны CNT также предлагают путь для разработки трехмерных каркасов в качестве шага к разработке схем для биоразъемов и приложений нейропротезирования.Этот подход также может быть использован для создания продвинутых нейро-чипов для приложений биочувствительности (например, для обнаружения наркотиков и токсинов), где важны структура и стабильность сетей.
Чжан и его сотрудники культивировали нейроны на микронных образцах с разной геометрией. Эти паттерны были разработаны для поддержки исследования механизмов, лежащих в основе нейронального расширения, управления и взаимодействия. Использовались прямые линии, квадраты и круговые детали, а также разная длина нанотрубок.Было обнаружено, что нейроны преимущественно прикрепляются к паттернам MWCNT. Конусы роста были прикреплены к поверхности нанотрубок, позволяя нейронам распространяться по узорам и взаимодействовать друг с другом (Zhang et al., 2005).
островков CNT также широко использовались нами для создания нейронных сетей в системе с четко определенной геометрией (см. Рисунок 3), поэтому взаимосвязь между геометрией и нейронной активностью можно систематически исследовать (Gabay et al., 2005a, b; Sorkin et al., 2006, 2009; Greenbaum et al., 2009; Shein et al., 2009) (типичный пример см. На Рисунке 2). В одной из первых публикаций, в которых МУНТ использовались для взаимодействия с нейронами, Габай и его коллеги отпечатали узор из наночастиц железа-катализатора на кварцевых подложках, используя штамп из поли (диметилсилоксана) (ПДМС), а затем вырастили УНТ из островков железного катализатора. Кортикальные нейроны и глиальные клетки крыс накапливались преимущественно на островках MWCNT и образовывали взаимосвязанные сети, соединяясь через непроницаемый кварц, чтобы сформировать связи между соседними островками.При использовании метода патч-зажима культивируемые нейроны оказались электрофизиологически активными с нормальными мембранными потенциалами покоя, демонстрируя, что MWCNT не изменяют целостность нейронов (Gabay et al., 2005a, b).
Рис. 3. Кортикальная культура нейроглии от эмбриональных крыс, выращенных на матрице микроэлектродов из углеродных нанотрубок. Кластеры клеток самоорганизуются во время развития культуры, чтобы позиционировать себя на электродах. Расстояние между электродами 200 мкм.Изображение получено с помощью трехмерного конфокального микроскопа (Shein et al., 2009).
В последующей работе Соркин и его коллеги исследовали динамику организации нейронных сетей, помещая нейроны коры головного мозга и гиппокампа крысы на структурированные MWCNT или поли-D-лизиновые субстраты. Было обнаружено, что кластеры клеток спонтанно прикрепляются к узорчатым островкам с нейритами, соединяя близлежащие острова посредством единственного неприлипающего прямого пучка, состоящего из аксонов и дендритов. Были успешно реализованы квадратные, треугольные и круглые конструкции связи.Мониторинг динамики сетей в режиме реального времени показал, что процесс самосборки в основном обусловлен способностью клеток двигаться, при этом постоянно растягивая пучки нейритов между ними. Структурированные сети были стабильными в течение 11 недель (Sorkin et al., 2006). В последующем исследовании Соркин и его коллеги культивировали нейроны коры головного мозга крысы, а также нейроны лобных ганглиев саранчи на островках MWCNT с микропроцессором. Нейронные отростки имели тенденцию оборачиваться и связываться с грубыми островками MWCNT.Похоже, что сходные размеры CNTs (внутри острова) и нейритов поддерживают механизм якорения, позволяющий прикрепляться нейронам (Sorkin et al., 2009). Гринбаум и его коллеги продемонстрировали использование специально разработанных субстратов CNT для формирования небольших сетей нейронов лобных ганглиев саранчи. Было высказано предположение, что механическое напряжение создается вдоль отростков клетки и тянет сому клетки; нейрональная активность регистрировалась из одиночных клеток (Greenbaum et al., 2009). Эти эффекты были дополнительно изучены (Anava et al., 2009; Hanein et al., 2011), чтобы показать, что механические воздействия действительно повсеместны в этих развивающихся сетях.
Углеродные нанотрубки для электрического нейронного интерфейса
Как обсуждалось в разделе «Введение», современные электроды, используемые для нейропротезирования, имеют относительно высокий импеданс и плохое CSC. Чтобы лучше понять эти проблемы и оценить потенциал УНТ в приложениях нейронных электродов, мы начнем с краткого обзора электрических процессов, происходящих на интерфейсе нейрон-электрод.
Внеклеточная запись и стимуляция нейронной активности
Передача сигнала в нейронных системах является результатом ионных токов, проходящих через определенные ионные каналы через клеточную мембрану. Методы внеклеточной записи отслеживают электрическое поле, связанное с этой динамикой. Временной ход внеклеточного потенциала действия обычно составляет ~ 1 мс, а амплитуда находится в диапазоне от нескольких десятков до нескольких сотен микровольт (Cogan, 2008; Buzsaki et al., 2012).Эта амплитуда значительно меньше, чем соответствующий внутриклеточный спайк, который находится в диапазоне десятков милливольт. Кроме того, внеклеточные сигналы быстро уменьшаются в зависимости от расстояния от клетки. Во время стимуляции происходит обратный процесс; заряды поступают от электрода и вызывают накопление мембранного потенциала. В достаточно сильном поле чувствительные к напряжению ионы в клеточной мембране запускают генерацию потенциала действия (Roth, 1994; Tehovnik, 1996; Basser and Roth, 2000).
Стимулировать нейроны и записывать внеклеточные сигналы можно с помощью проводящего электрода, расположенного рядом с клеткой или ее отростками. Электрохимические свойства электрода являются фундаментальными для его работы в качестве стимулирующего или записывающего электрода. Ясно, что эффективный интерфейс — необходимое условие как для стимуляции, так и для записи. Хотя нейрональная стимуляция и запись связаны по своей природе, эти два приложения предъявляют несколько разные требования. Прежде всего, количество заряда, необходимого для стимуляции, на несколько порядков превышает зарегистрированное.Запись часто бывает невозможной с помощью электродов, которые хорошо подходят для стимуляции. При записи нейронов, как правило, слабые сигналы делают очень важным рассмотрение шума (Musial et al., 2002). Однако для целей безопасной стимуляции доставка соответствующего заряда к ткани без повреждения электрода или ткани является основным соображением (McCreery et al., 1988, 1990; Cogan, 2008).
Материал электрода и реакции на границе раздела электрод-ткань (реакции, опосредующие переход от потока электронов в электроде к потоку ионов в ткани) являются основными параметрами, определяющими безопасный диапазон для стимуляции.Реакции, происходящие во время инжекции заряда, могут быть емкостными или фарадеевскими (рис. 4A). Емкостные реакции включают ток смещения и связаны с зарядкой и разрядкой двойного слоя электрод-электролит из-за перераспределения заряженных частиц в электролите. С другой стороны, фарадеевские реакции включают перенос электронов через границу раздела электрод-электролит и требуют, чтобы некоторые частицы на поверхности электрода или в растворе были окислены или восстановлены.Эти реакции могут привести к необратимым процессам, вызывающим повреждение электродов или тканей. Следовательно, несмотря на важность максимального увеличения тока, подаваемого через электрод, в идеале это должно быть достигнуто за счет использования нефарадеевских электродов. Поэтому подача емкостного заряда является критическим фактором при разработке электродов как для записи, так и для стимуляции.
Рис. 4. Граница раздела электрод-электролит и инжекция заряда. (A) Схематическое изображение емкостного (слева) и фарадеевского (справа) механизмов инжекции заряда.В то время как инжекция емкостного заряда включает перераспределение заряда на границе раздела электрод-электролит, процесс Фарадея включает перенос электронов. (B) Модель электрической схемы для механизмов переноса заряда на границе электрод-электролит. (C) Модель схемы для внеклеточной записи и стимуляции нейрональной ткани с использованием MEA, соединенного с внешними усилителями. Модель демонстрирует электрохимическое сопротивление интерфейса и емкость УНТ-электрода и шунтирующую емкость, полученную из раствора, а также точку стимуляции.
Емкостная и фарадеевская реакции на электроде-электролите моделируются простой электрической схемой, состоящей из двух элементов, конденсатора и резистивного элемента, включенных параллельно. Рисунки 4B, C иллюстрируют схемные модели интерфейса электрод-электролит и внеклеточной записи и стимуляции нейрональной ткани соответственно. Емкостной механизм, который представляет способность электрода вызывать поток заряда в электролите без переноса электронов, моделируется как простой электрический конденсатор, называемый конденсатором с двойным слоем (Bard and Falkner, 2000; Merrill et al., 2005). Фарадеевские процессы моделируются как фарадеевский импеданс (Bard and Falkner, 2000; Merrill et al., 2005). Есть два предельных случая, вытекающих из этой модели: идеально поляризуемый электрод и идеально неполяризуемый электрод (Bard and Falkner, 2000; Merrill et al., 2005). Идеально неполяризуемый электрод имеет нулевое сопротивление Фарадея, поэтому ток легко протекает в реакциях Фарадея, и при прохождении тока на границе раздела напряжение не изменяется. Таким образом, потенциал электрода остается близким к равновесию даже при протекании тока.Идеально поляризуемый электрод имеет элемент бесконечного фарадеевского импеданса и моделируется чистым конденсатором. В идеально поляризуемом электроде весь ток передается за счет емкостного воздействия, поэтому потенциал электрода легко отклоняется от равновесного. Реальные границы раздела электродов моделируются конденсатором с двойным слоем параллельно с конечным импедансом Фарадея и последовательно с сопротивлением раствора. Электрод с высокой поляризацией — это электрод, который может принять большое количество инжектированного заряда на двойной слой до начала реакции Фарадея.Таким образом, для улучшения биосовместимости требуются электроды с высокой поляризацией. Дополнительным важным параметром, используемым при описании нейрональных стимулирующих электродов, является обратимый CSC, также известный как предел обратимой инъекции заряда (Robblee and Rose, 1990; Merrill et al., 2005). CSC электрода — это общее количество заряда, которое может быть сохранено обратимо, включая накопление в емкости двойного слоя, псевдоемкости или любой обратимой реакции Фарадея. Материал, используемый для электрода, размер и форма электрода, состав электролита и параметры формы волны электростимуляции — все это влияет на CSC.Мы отсылаем читателя к подробному описанию электрохимического интерфейса электрод-электролит регистрирующих и стимулирующих нейронных электродов (Bard and Falkner, 2000; Merrill et al., 2005; Cogan, 2008).
В целом, повышенная емкость приводит к уменьшению импеданса и уровня шума, а также к расширению окна напряжения для безопасной электростимуляции. Современные электродные материалы Фарадея включают в себя в основном благородные металлы, такие как золото, платину, титан и иридий, а также сплавы этих металлов, оксид иридия, нержавеющую сталь и высоколегированные полупроводники, такие как кремний.Материалы емкостных электродов включают TiN, оксид тантала и тантала и недавно исследованные УНТ. Таким образом, емкостная природа электродов из УНТ является еще одним важным преимуществом.
Углеродные нанотрубки для регистрации и стимуляции нейрональной активности
Как мы обсуждали выше, УНТ обладают несколькими фундаментальными свойствами, которые делают их идеально подходящими для взаимодействия с нейронами. Они поддерживают пролиферацию нейронов, они проводят и образуют емкостные электрохимические электроды с чрезвычайно высокой удельной площадью.Соответственно, во многих недавних исследованиях УНТ использовались в качестве материала покрытия для нейроэлектродов.
Прямая стимуляция изолированных нейронов в культуре с использованием субстрата, покрытого SWCNT, была недавно продемонстрирована несколькими группами (Gheith et al., 2006; Liopo et al., 2006; Mazzatenta et al., 2007). Гейт и его сотрудники включили положительно заряженные SWCNT и полиакриловую кислоту в многослойные LBL-слои с достаточно высокой электропроводностью, чтобы электрически стимулировать линию модельных нейронных клеток (NG108).Использование пленок SWCNT LBL в качестве субстратов для культивирования не повлияло на ключевые электрофизиологические характеристики клеток NG108, что подтверждает предыдущие наблюдения (Gheith et al., 2006). Электрическое связывание клеток NG108, а также первичных периферических нейронов крысы с немодифицированными, а также с ОУНТ, модифицированными 4-трет-бутилфенилом или 4-бензойной кислотой, нанесенными на пленки из полиэтилентерефталата (ПЭТ), оценивали Liopo et al. (2006). Нейроны проявляли токи, активируемые напряжением, при электрическом стимулировании через проводящую пленку ОСУНТ.К той же проблеме впоследствии обратились Маццатента и его коллеги, которые использовали электрофизиологические измерения и компьютерное моделирование, чтобы понять природу электрического взаимодействия между нейронами и чистыми ОСУНТ (Mazzatenta et al., 2007). Авторы культивировали нейроны гиппокампа крысы на покровных стеклах, покрытых первозданной пленкой SWCNT. СЭМ выявила контакты между нейрональными мембранами и ОСНТ. Электрические записи с использованием патч-зажима показали, что нейроны, выращенные на субстратах SWCNT, проявляют спонтанную электрическую активность.Стимуляция культивированных нейронов достигалась путем подачи тока через субстрат нанотрубок. Наконец, была предложена математическая модель, описывающая электрическую связь между SWCNT и нейронами (Mazzatenta et al., 2007).
Некоторые исследования показали, что УНТ повышают электрическую активность нейронов (Lovat et al., 2005; Cellot et al., 2009). Lovat с сотр. Функционализировали УНТ пирролидиновыми группами. Эта функционализация удаляла примеси и улучшала растворимость УНТ в органических растворителях.Затем покровные стекла покрывали каплей раствора. Испарение растворителя и термообработка привели к дефункционализации, в результате чего на стекле остались очищенные МУНТ. Нейроны, выращенные на пленках MWCNT, показали шестикратное увеличение частоты спонтанных постсинаптических токов и генерации потенциала спонтанного действия по сравнению с таковыми, выращенными на необработанном стекле. Авторы предположили, что высокая проводимость подложки УНТ могла влиять на потенциал-зависимые мембранные процессы, приводя к повышенной активности (Lovat et al., 2005). Целлот и его сотрудники предположили, что УНТ улучшают электрическую связь между нейронами за счет образования плотных контактов с клеточными мембранами. Они использовали тонкие пленки УНТ, сформированные путем нанесения раствора на стекло с последующей термообработкой. Нейроны гиппокампа крыс были засеяны на пленки и показали усиление синаптического возбуждения (Cellot et al., 2009), усиленное формирование синапсов, а также изменения синаптической динамики (Cellot et al., 2011).
Покрытия из композитных УНТ улучшают регистрацию и стимуляцию нейронов in vitro, и in vivo, за счет уменьшения импеданса и увеличения переноса заряда.Кифер и его сотрудники успешно покрыли электроды MWCNT, используя различные схемы осаждения (Keefer et al., 2008). Промышленные заостренные проволочные электроды из вольфрама и нержавеющей стали были покрыты УНТ с использованием ковалентного присоединения покрытия УНТ, электроосаждения покрытия УНТ-золота или электроосаждения УНТ в сочетании с CP (PPy). Различные покрытия CNT приводили к более низкому импедансу и более высокой способности переноса заряда по сравнению с неизолированными металлическими электродами. In vivo Качество записи острых электродов, покрытых УНТ, было проверено в моторной коре головного мозга анестезированных крыс и в зрительной коре головного мозга обезьян.По сравнению с неизолированными металлическими электродами, электроды, покрытые УНТ, имели меньший шум и улучшали обнаружение спонтанной активности (Keefer et al., 2008). Баранаускас и его коллеги протестировали платиновые / вольфрамовые микроэлектроды с покрытием PPy-CNT. Покрытие PPy-CNT значительно снизило импеданс микроэлектрода и вызвало значительное улучшение отношения сигнал / шум, в среднем до четырех раз. In vivo сигналов было зарегистрировано из коры головного мозга крысы (Baranauskas et al., 2011). Другие композитные покрытия CPs-CNT, включая PPy-CNT (Lu et al., 2010; Chen et al., 2011a) и PEDOT-CNT (Luo et al., 2011). Эти покрытия также показали улучшенные электрохимические свойства и были признаны биологически совместимыми. Устройства не использовались для записи или стимуляции. Покрытия PPy-CNT значительно улучшают электрохимические характеристики испытательных электродов, и дальнейшее исследование долговечности этих покрытий при длительной стимуляции и записи может быть важным для раскрытия их полного потенциала.
В совокупности рассмотренные выше исследования показывают, что УНТ могут обеспечить превосходное средство для электрического взаимодействия между устройствами и нейроном.Теперь мы обсудим использование электродов из УНТ как для электрических записей, так и для стимуляции нейронов в форме МЭБ.
MEA из углеродных нанотрубок для регистрации и стимуляции нейронов
Важным достижением в использовании CNT в нейроприложениях является разработка и изготовление CNT MEAs (Gabay et al., 2007). Такие МЭБ были получены путем синтеза островков УНТ высокой плотности. Были использованы структуры как MWCNT, так и SWCNT. УНТ либо наносили в виде покрытия поверх металлических электродов (Keefer et al., 2008; Габриэль и др., 2009; Fuchsberger et al., 2011) или выращены непосредственно из подложки с рисунком катализатора (Wang et al., 2006; Gabay et al., 2007; Yu et al., 2007).
MWCNT-покрытых золотом МЭА оксида индия-олова были использованы для регистрации и стимуляции кортикальных культур мышей Кифером и его сотрудниками. Было обнаружено, что электроды с покрытием из УНТ подходят для записи и повышения эффективности стимуляции (Keefer et al., 2008). Также использовались нетронутые покрытия УНТ. Габриэль и др. покрытые стандартные платиновые МЭБ ОСУНТ, которые наносились непосредственно на электроды путем нанесения капельного покрытия и сушки.Покрытие CNT привело к улучшенным электрическим свойствам, уменьшению импеданса и увеличению емкости. Исследователи успешно выполнили внеклеточные записи из ганглиозных клеток изолированной сетчатки кролика (Gabriel et al., 2009). Fuchsberger и его сотрудники предложили нанесение слоев MWCNT на массивы микроэлектродов TiN с помощью техники микроконтактной печати с использованием штампов PDMS. МЭА с покрытием применяли для электрохимического обнаружения дофамина и электрофизиологических измерений культур нейронов гиппокампа крыс.Было обнаружено, что микроэлектроды с покрытием из MWCNT обладают записывающими свойствами, превосходящими характеристики коммерческих микроэлектродов из TiN (Fuchsberger et al., 2011). Методы нанесения капельного покрытия и микроконтактной печати довольно просты. Однако пленка может иметь слабую адгезию к поверхности по сравнению с ковалентными или электрохимическими методами, поэтому важна тщательная проверка адгезии покрытия.
Сообщалось также оМЭБ УНТ, основанных на подходах к производству сверху вниз. Превосходные электрические свойства микроэлектродов из УНТ были представлены Габаем и его сотрудниками.Мы изготовили МЭБ УНТ путем синтеза островков МУНТ высокой плотности на подложке из диоксида кремния. Трехмерный характер электродов из УНТ способствует очень большой площади поверхности и, следовательно, высокой удельной емкости электрода (было подтверждено поведение без Фрадея) и низкой частотной зависимости импеданса электрода. Регистрировалась спонтанная активность нейронов в культуре крыс (Gabay et al., 2005a, b, 2007). Прямое электрическое взаимодействие между первичными микроэлектродами CNT и культивированными нейронами крыс было также продемонстрировано Shein et al.(2009). Каждый электрод регистрировал активность кластера из нескольких нейронов; эта активность характеризовалась всплесками (см. рисунок 5). Те же CNT MEAs в дальнейшем использовались для изучения электрической активности нейронных сетей (Shein Idelson et al., 2010), а также для взаимодействия с сетчаткой мышей (Shoval et al., 2009). Тесты сетчатки показали, что SNR электрода из УНТ со временем улучшается, что свидетельствует о постепенном (в течение 2 дней) улучшении сцепления ткани с электродом. Недавние тесты на стимуляцию, проведенные той же группой, показали аналогичное улучшение порога стимуляции (Eleftheriou et al., 2012).
Рис. 5. Спонтанная электрическая активность нейрональных кластеров на CNT MEA. (A) Следы напряжения спонтанной электрической активности, записанные с электрода УНТ. (B) Растровый график спонтанной пиковой активности в нескольких электродах УНТ. Модели активности характеризуются всплесками событий; короткие временные окна (несколько сотен миллисекунд) быстрого коллективного возбуждения нейронов, за которыми следуют длинные интервалы (секунды) спорадического возбуждения.Подробнее см. Shein et al. (2009).
Ван и его сотрудники представили прототип вертикально ориентированных столбов из MWCNT в виде микроэлектродов на кварцевой подложке (Wang et al., 2006). Нанотрубки были функционализированы PEG для создания гидрофильной поверхности. Полученные гидрофильные микроэлектроды из УНТ обеспечивают высокий предел инжекции заряда без реакций Фарадика. In vitro Затем была достигнута электрическая стимуляция нейронов гиппокампа эмбриона крысы, которая была обнаружена путем наблюдения за изменением внутриклеточного уровня кальция с использованием индикатора кальция (Wang et al., 2006). VACNF MEA был изготовлен и испытан для потенциальных электрофизиологических применений Yu et al. (2007). Сообщалось о внеклеточной стимуляции и регистрации как спонтанной, так и вызванной активности в органотипических срезах гиппокампа. de Asis и соавторы систематически сравнивали VACNF MEA, покрытый PPy, с электродами из вольфрамовой проволоки, планарным платиновым MEA и свежевыращенным VACNF MEA для регистрации вызванных сигналов от острых срезов гиппокампа (de Asis et al., 2009). Недавно Су и его сотрудники синтезировали УНТ на конусообразном кремниевом наконечнике методом каталитического термического химического осаждения из паровой фазы.Обработка кислородной плазмой использовалась для модификации поверхности УНТ, чтобы изменить характеристики поверхности УНТ с гидрофобных на гидрофильные, чтобы улучшить смачиваемость и электрические свойства УНТ. Электрохимические характеристики трехмерных УНТ-зондов, обработанных кислородной плазмой, показали более низкий импеданс и более высокую емкость по сравнению с голым кремниевым наконечником. Кроме того, обработанные кислородом зонды CNT использовались для регистрации сигналов нервного шнура раков (Su et al., 2010).
Разработка CNT MEAs имеет несколько важных преимуществ по сравнению с кремниевыми зондами, обычно используемыми в современных нейробиологических исследованиях и клинических приложениях.Кремниевые зонды обычно состоят из кремниевой основы, нитрида кремния и изоляционного слоя из диоксида кремния. Электроды обычно покрыты иридием, золотом или платиной. Первые проекты включают массив Мичигана (Wise et al., 1970; Wise and Angell, 1975) и массив Юты (Campbell et al., 1991). Зонд Michigan включает в себя несколько участков микроэлектродов, нанесенных на каждый стержень конструкции, а матрица Utah представляет собой трехмерную электродную решетку, состоящую из множества заостренных силиконовых игл.Однако основным недостатком этих устройств является материал электродов, который является металлическим и, следовательно, фарадеевским (по сравнению с емкостными электродами из УНТ) и не имеет сродства к нейронным клеткам по сравнению с предпочтительной адгезией нейронов к шероховатой поверхности УНТ.
Гибкая CNT MEA для регистрации и стимуляции нейрональной активности
Типичные электроды МЭМС, несмотря на их многочисленные преимущества, являются жесткими и поэтому плохо подходят для долгосрочных применений в нейронах in vivo .Соответственно, растет интерес к разработке гибких МПС. В частности, внимание привлекла комбинация гибких подложек и электродов из УНТ для нейронных приложений.
Лин и его сотрудники были первыми, кто изготовил и реализовал гибкую электродную матрицу на основе УНТ для записи нейронов. Массив электродов из УНТ был выращен и нанесен рисунок на кремниевой подложке, а затем перенесен на гибкую пленку из парилена-С. Четырехэтапный процесс включал: рост УНТ, связывание полимера, перенос гибкой пленки и частичную изоляцию.Полученные вертикально ориентированные УНТ были частично внедрены в полимерную пленку. Запись электрофизиологического ответа нервного шнура рака выполнялась с помощью двух серебряных проволок с тефлоновым покрытием, используемых в качестве стимулирующего и контрольного электрода. Отношение сигнал / шум гибкого электрода из УНТ составляло 257 (Lin et al., 2009).
Также был продемонстрирован прямой рост УНТ на гибких полиимидных подложках с помощью катализатора CVD (Hsu et al., 2010). Длину MWCNT контролировали и увеличивали приблизительно линейно со временем роста, что приводило к уменьшению импеданса и увеличению емкости.Воздействие УФ-озона улучшило межфазные свойства между электродами УНТ и электролитом за счет увеличения смачиваемости поверхности (изменения ее с супергидрофобной на гидрофильную). Обработка УФ-озоном дала снижение импеданса в 50 раз. Кроме того, было обнаружено, что гибкие электроды из УНТ проявляют резистивные характеристики, в отличие от результатов, описанных выше (Nguyen-Vu et al., 2006), которые предполагают, что емкостная проводимость доминирует. Исследование культур нейрональных клеток показало хорошую биосовместимость.Наконец, были получены записи вызванного потенциала действия латеральных гигантских нейронов в брюшных ганглиях раков. SNR было около 150, такое же хорошее, как у аспирационной пипетки, и лучше, чем у золотых электродов (SNR 122 и 36 соответственно). В последующем исследовании был представлен гибкий CNT MEA, интегрированный с чипом, содержащим 16 записывающих усилителей (Chen et al., 2011b). УНТ снова выращивали непосредственно на гибкой полиимидной подложке. Микроэлектрод из УНТ имел в десять раз более низкий импеданс электрода и в шесть раз большую емкость, что приводило к лучшей способности инжекции заряда по сравнению с золотым микроэлектродом того же размера.Тесты с культивированными нейронами подтвердили биосовместимость устройства. In vitro. спонтанных спайков были зарегистрированы от каудального фоторецептора из хвоста нейрона рака с SNR 6,2. Гибкий CNT MEA также применялся для записи электрокортикографии (ЭКоГ) моторной коры головного мозга крыс.
Наша группа недавно разработала новый гибкий электрод, полностью состоящий из УНТ, который подходит для регистрации и стимуляции нейрональной ткани. Гибкие устройства были реализованы путем переноса пленок MWCNT высокой плотности на гибкую пленку PDMS (Hanein, 2010).Преднамеренно плохая адгезия между пленкой УНТ и подложкой позволила перенести УНТ на подложку PDMS (рис. 6А). Эта плохая адгезия является результатом прямого роста УНТ на SiO 2 . Технология проста, а получаемые стимулирующие электроды почти чисто емкостные. Электроды обладают емкостью 2 мФ / см 2 , которая аналогична емкости электродов из TiN и исходных MWCNT, изготовленных на жесткой кремниевой подложке, с плотностью 2 и 10 мФ / см 2 соответственно (Gabay et al., 2007). Недавние тесты на регистрацию и стимуляцию сетчатки цыплят (рис. 6В) подтверждают пригодность устройства для высокоэффективной нейрональной стимуляции (Дэвид-Пур и др., Представлены).
Рис. 6. (A) Гибкий МЭБ на основе CNT. Вставка: гибкий МЭБ на основе УНТ, разработанный для in vivo приложений. ( B ) Вызванная электрическая активность, зарегистрированная в сетчатке эмбрионального цыпленка (день 14) с помощью УНТ-электрода (один из шестнадцати электродов диаметром 50 мкм в матрице) с использованием первого двухфазного анодного импульса 20 нКл.Сетчатку уплощали на гибкой МЭА CNT слоем ганглиозных клеток сетчатки вниз. Большой сигнал при t = 0 (отмечен стрелкой) является артефактом стимуляции. Спонтанная активность до стимуляции отмечена звездочками.
В Таблице 2 обобщены основные результаты, связанные с электрической записью и стимуляцией нейронов на основе CNT. Общая картина, которая возникает из этих данных, заключается в том, что УНТ использовались для нейронного электрического интерфейса в трех основных схемах: подложки с покрытием УНТ, покрытые УНТ заостренные проволочные металлические электроды и МЭБ УНТ.Субстраты CNT использовали в качестве субстрата для роста in vitro для нейронов, и электрическую активность регистрировали с использованием метода внутриклеточного зажима. Также была продемонстрирована электрическая стимуляция через поверхность, покрытую УНТ. Заостренные проволочные электроды, покрытые CNT, использовали как для in vitro, и in vivo, так и для регистрации внеклеточных нейронов и стимуляции . Схема CNT MEA позволяет in vitro структурировать рост нейронов в сочетании с внеклеточной записью и стимуляцией.Последней и самой последней схемой является разработка гибких МЭБ CNT, которая представляет собой важный шаг к применению имплантируемых нейропротезов.
Таблица 2. Технологии нейронного электрического сопряжения CNT .
Выводы и перспективы
В этом обзоре мы исследовали различные свойства, которые делают УНТ уникальными для взаимодействия с нейронами. Мы также показали, что интенсивные исследования в течение последних 10 лет изучали УНТ для взаимодействия с нейронами, от поверхностных свойств, влияющих на адгезию и пролиферацию клеток, до разработки MEA на основе УНТ и гибких электродных матриц для in vivo приложений.Это интенсивное исследование было мотивировано необходимостью найти методы лечения нервных расстройств, требующих использования электрической стимуляции, а также необходимостью ответить на базовые вопросы нейробиологии. В частности, такие платформы на основе CNT могут принести большую пользу при изучении инженерных нейронных цепей. Изучение нейронных цепей направлено на восстановление поврежденных нервных тканей. Природные схемы не подвержены манипуляциям и имеют очень сложную структуру, поэтому их очень сложно изучать.Тем не менее, спроектированные нейронные сети in vitro позволяют осуществлять мониторинг и систематическое исследование и обеспечивают уникальную платформу для изучения паттернов активности, взаимосвязи морфологии и активности, а также методов повреждения и восстановления сети. Все эти приложения могут получить большую выгоду от эффективного нейронального каркаса, способного регистрировать и стимулировать электрическую активность нейронов.
Сложные требования в области нейронного протезирования, а именно уменьшение размера электродов при сохранении эффективной электрохимической функции, а также снижение иммунного ответа на имплантированное устройство (связанное как с размером, так и с жесткостью имплантированного устройства), являются очень низкими. выполнено из широко используемых материалов.Таким образом, разработка эффективной нейропротезной платформы будет очень полезна при реализации электродов из УНТ на гибкой подложке.
Новые применения УНТ в области нейробиологии должны учитывать соображения цитотоксичности. Потенциальная токсичность УНТ была всесторонне изучена, и пока получены неоднозначные результаты (Шведова и др., 2003, 2009, 2010; Дюмортье и др., 2006; Фирме, Бандару, 2010; Чжао, Лю, 2012). Лучшее понимание взаимодействия между УНТ и биологической средой необходимо для содействия эффективной разработке как безопасных, так и эффективных нейронных технологий на основе УНТ.Требуются дальнейшие испытания коррозионной стойкости электродов из УНТ, а также их прочности. Другим важным шагом является дальнейшее изучение природы электрического взаимодействия нейронов с УНТ. Кроме того, необходимо провести комплексные долгосрочные исследования по регистрации и стимуляции на животных моделях с последующими клиническими испытаниями и одобрением административных органов, таких как Управление по санитарному надзору за качеством пищевых продуктов и медикаментов США (FDA), чтобы обеспечить рутинное использование CNT MEA в неврологии. Здесь представлен обширный обзор литературы, а также недавние исследования с использованием УНТ, встроенных в полимерную основу; показать, что УНТ при правильном обращении безопасны в качестве имплантируемого покрытия.
В настоящее время существует несколько очень многообещающих направлений в исследовании нейропротезных устройств на основе УНТ. Во-первых, это интеграция покрытий для элюирования лекарств. Эти покрытия позволят уменьшить воспаление, вызванное введением нейронального имплантата в ткань, и улучшат выживаемость нейронов, контактирующих с устройством. Растет интерес к изучению таких покрытий (Zhong and Bellamkonda, 2005; Wadhwa et al., 2006; He et al., 2007), такие исследования также будут полезны при рассмотрении разработки покрытия, которое не ухудшит электрическая активность устройства.Во-вторых, это исследование в направлении реализации гибких MEA на основе CNT, как подробно описано в тексте выше. Некоторые совсем недавние работы, выполненные в этой области нашей группой, и другие, выявили большой потенциал таких устройств. Наконец, сочетание светочувствительной функции с улучшенными нейронными интерфейсами CNT будет очень полезным для разработки новых имплантатов сетчатки.
В заключение, улучшенные электрохимические свойства УНТ, их гибкая и простая процедура микропроизводства, а также их биосовместимость и долговечность позволяют предположить, что электроды УНТ являются многообещающей платформой для нейронных приложений с высоким разрешением.Сходство поверхности УНТ с наноструктурными особенностями естественной нервной ткани делает УНТ подходящей платформой для тканевой инженерии и регенерации (Tran et al., 2010; Voge and Stegemann, 2011). Кроме того, высокая электрическая проводимость УНТ позволяет осуществлять прямое электрическое взаимодействие с нейронами (Shein-Idelson et al., 2011). Очевидно, что CNT обладают огромным потенциалом в развитии нейронных интерфейсов, и дальнейшие исследования позволят использовать технологию на основе CNT для расширения понимания нервной системы и реализации терапевтических подходов.
Заявление о конфликте интересов
Авторы заявляют, что исследование проводилось при отсутствии каких-либо коммерческих или финансовых отношений, которые могут быть истолкованы как потенциальный конфликт интересов.
Благодарности
Авторы благодарят за многочисленные полезные обсуждения с Моше Давид-Пуром, Гиорой Бейт-Яаков и доктором Дорит Раз-Праг. Они также подтверждают поддержку гранта Министерства науки и технологий Израиля, Израильского научного фонда и Европейского исследовательского совета, финансируемого в рамках Седьмой рамочной программы Европейского сообщества (FP7 / 2007–2013) / грантового соглашения ERC FUNMANIA-306707.
Список литературы
Абидиан М. Р., Кори, Дж. М., Кипке, Д. Р. и Мартин, Д. К. (2010). Нанотрубки из проводящего полимера улучшают электрические свойства, механическую адгезию, нервную связь и рост нейритов нервных электродов. Малый 6, 421–429.
Pubmed Аннотация | Pubmed Полный текст | CrossRef Полный текст
Абидиан М. Р. и Мартин Д. К. (2008). Экспериментальная и теоретическая характеристика имплантируемых нейронных микроэлектродов, модифицированных проводящими полимерными нанотрубками. Биоматериалы 29, 1273–1283.
Pubmed Аннотация | Pubmed Полный текст | CrossRef Полный текст
Анава, С., Гринбаум, А., Бен Джейкоб, Э., Ханейн, Ю. и Аяли, А. (2009). Регулирующая роль механического напряжения нейритов в развитии сети. Biophys. J . 96, 1661–1670.
Pubmed Аннотация | Pubmed Полный текст | CrossRef Полный текст
Asplund, M., Thaning, E., Lundberg, J., Sandberg-Nordqvist, A.C., Kostyszyn, B., Inganas, O., et al.(2009). Оценка токсичности ПЭДОТ / биомолекулярных композитов, предназначенных для электродов нейронной связи. Biomed. Материал . 4, 1–12.
Баранаускас, Г., Маджолини, Э., Кастаньола, Э., Ансальдо, А., Маццони, А., Ангоци, Г. Н. и др. (2011). Композитное покрытие нейронных микроэлектродов из углеродных нанотрубок предпочтительно улучшает многоблочное отношение сигнал / шум. J. Neural Eng . 8, 1–12.
Pubmed Аннотация | Pubmed Полный текст | CrossRef Полный текст
Бард, А.Дж. И Фолкнер Л. Р. (2000). Основы и приложения электрохимических методов . Нью-Йорк, штат Нью-Йорк: Вили.
Бекьярова, Э., Ни, Ю. К., Маларки, Э. Б., Монтана, В., МакВильямс, Дж. Л., Хаддон, Р. К., и др. (2005). Применение углеродных нанотрубок в биотехнологии и биомедицине. J. Biomed. Нанотехнологии . 1, 3–17.
Pubmed Аннотация | Pubmed Полный текст | CrossRef Полный текст
Бен-Якоб, Э., и Ханейн, Ю. (2008). Микроэлектроды из углеродных нанотрубок для взаимодействия нейронов. J. Mater. Chem . 18, 5181–5186.
Биран Р., Мартин Д. К. и Треско П. А. (2005). Потеря нейронных клеток сопровождает реакцию ткани мозга на хронически имплантированные кремниевые микроэлектродные матрицы. Exp. Neurol . 195, 115–126.
Pubmed Аннотация | Pubmed Полный текст | CrossRef Полный текст
Боттини М., Брукнер С., Ника К., Боттини Н., Беллуччи С., Магрини А. и др. (2006). Многослойные углеродные нанотрубки вызывают апоптоз Т-лимфоцитов. Toxicol. Lett . 160, 121–126.
Pubmed Аннотация | Pubmed Полный текст | CrossRef Полный текст
Кэмпбелл, П. К., Джонс, К. Э., Хубер, Р. Дж., Хорч, К. В., и Норманн, Р. А. (1991). Трехмерная нейронная поверхность на основе кремния — процессы изготовления внутрикортикальной электродной матрицы. IEEE Trans. Биомед. Eng . 38, 758–768.
Pubmed Аннотация | Pubmed Полный текст | CrossRef Полный текст
Карреро-Санчес, Дж. К., Элиас, А. Л., Mancilla, R., Arrellin, G., Terrones, H., Laclette, J.P., et al. (2006). Биосовместимость и токсикологические исследования углеродных нанотрубок, легированных азотом. Nano Lett . 6, 1609–1616.
Pubmed Аннотация | Pubmed Полный текст | CrossRef Полный текст
Cellot, G., Cilia, E., Cipollone, S., Rancic, V., Sucapane, A., Giordani, S., et al. (2009). Углеродные нанотрубки могут улучшить работу нейронов за счет использования электрических коротких путей. Нат. Нанотехнологии . 4, 126–133.
Pubmed Аннотация | Pubmed Полный текст | CrossRef Полный текст
Селлот, Г., Тома, Ф. М., Варлей, З. К., Лайшрам, Дж., Виллари, А., Кинтана, М. и др. (2011). Каркасы из углеродных нанотрубок настраивают синаптическую силу в культивируемых нервных цепях: новые рубежи во взаимодействиях наноматериалов и тканей. Дж. Neurosci . 31, 12945–12953.
Pubmed Аннотация | Pubmed Полный текст | CrossRef Полный текст
Шарлье, Дж. К., Блазе, X., и Рош, С. (2007). Электронные и транспортные свойства нанотрубок. Ред. Мод. Phys . 79, 677–732.
Чен, Х. Л., Го, Л. Х., Ферхан, А. Р. и Ким, Д. Х. (2011a). Многослойные углеродные нанотрубки с полипиррольным покрытием для улучшения функциональной стабильности и электрических свойств нервных электродов. J. Phys. Chem. С 115, 5492–5499.
Chen, Y.C., Hsu, H.L., Lee, Y.T., Su, H.C., Yen, S.J., Chen, C.H., et al. (2011b). Активная гибкая матрица микроэлектродов из углеродных нанотрубок для записи электрокортикограмм. Дж.Neural Eng . 8, 1–7.
Pubmed Аннотация | Pubmed Полный текст | CrossRef Полный текст
Чирачи, С., Даг, С., Йилдирим, Т., Гулсерен, О., и Сенгер, Р. Т. (2004). Функционализированные углеродные нанотрубки и приложения для устройств. J. Phys. Конденс. Дело 16, R901 – R960.
Кларк, Г. М. (2006). Многоканальный кохлеарный имплант: интерфейс между звуком и центральной нервной системой для слуха, речи и языка у глухих — с личной точки зрения. Фил. Пер. R. Soc. B 361, 791–810.
Pubmed Аннотация | Pubmed Полный текст | CrossRef Полный текст
Кромптон, К. Э., Гоуд, Дж. Д., Белламконда, Р. В., Генгенбах, Т. Р., Финкельштейн, Д. И., Хорн, М. К. и др. (2007). Термореактивный хитозановый гидрогель, функционализированный полилизином, для инженерии нервной ткани. Биоматериалы 28, 441–449.
Pubmed Аннотация | Pubmed Полный текст | CrossRef Полный текст
де Асис, Э. Д., Нгуен-Ву, Т.Д. Б., Арумугам П. У., Чен Х., Касселл А. М., Эндрюс Р. Дж. И др. (2009). Высокоэффективная электрическая стимуляция срезов гиппокампа с помощью вертикально выровненного массива микрографов из углеродных нановолокон. Biomed. Микроустройства 11, 801–808.
Pubmed Аннотация | Pubmed Полный текст | CrossRef Полный текст
Dumortier, H., Lacotte, S., Pastorin, G., Marega, R., Wu, W., Bonifazi, D., et al. (2006). Функционализированные углеродные нанотрубки нецитотоксичны и сохраняют функциональность первичных иммунных клеток. Nano Lett . 6, 1522–1528.
Pubmed Аннотация | Pubmed Полный текст | CrossRef Полный текст
Элефтериу, К. Г., Циммерманн, Дж., Кьельдсен, Х., Давид-Пур, М., Ханейн, Ю. и Сернагор, Э. (2012). «На пути к разработке технологии имплантации сетчатки на основе углеродных нанотрубок: электрофизиологические и ультраструктурные доказательства связи на гибридном интерфейсе», в материалах Труды 8-го Международного совещания MEA по интегрированному микроэлектроду с субстратом Arrys (Ройтлинген, Германия).
Фан, Ю. В., Цуй, Ф. З., Хоу, С. П., Сюй, К. Ю., Чен, Л. Н., и Ли, И. С. (2002). Культура нервных клеток на кремниевых пластинах с наномасштабной топографией поверхности. J. Neurosci. Методы 120, 17–23.
Pubmed Аннотация | Pubmed Полный текст | CrossRef Полный текст
Fuchsberger, K., Le Goff, A., Gambazzi, L., Toma, F. M., Goldoni, A., Giugliano, M., et al. (2011). Многослойные массивы микроэлектродов с функционализированными углеродными нанотрубками, изготовленные методом микроконтактной печати: платформа для изучения химической и электрической нейронной передачи сигналов. Малый 7, 524–530.
Pubmed Аннотация | Pubmed Полный текст | CrossRef Полный текст
Габай Т., Бен-Давид М., Калифа И., Соркин Р., Абрамс З. Р., Бен-Джейкоб Э. и др. (2007). Электрохимические и биологические свойства многоэлектродных решеток на основе углеродных нанотрубок. Нанотехнологии 18, 1–6.
Pubmed Аннотация | Pubmed Полный текст | CrossRef Полный текст
Габай Т., Якобс Э., Бен-Джейкоб Э. и Ханейн Ю. (2005a). Инженерная самоорганизация нейронных сетей с использованием кластеров углеродных нанотрубок. Physica A 350, 611–621.
Габай, Т., Калифа, И., Эзра, Л., Якобс, Э., Бен-Джейкоб, Э., и Ханейн, Ю. (2005b). «Нейрочип на основе углеродных нанотрубок для проектирования, записи и стимуляции культивируемых сетей», в 13-я международная конференция по твердотельным датчикам, исполнительным элементам и микросистемам, (Сеул, Корея), 1226–1229.
Габриэль Г., Гомес Р., Бонгард М., Бенито Н., Фернандес Э. и Вилья Р. (2009). Легко изготавливаемые однослойные поверхностные микроэлектроды из углеродных нанотрубок для нейронных применений. Biosens. Биоэлектрон . 24, 1942–1948.
Pubmed Аннотация | Pubmed Полный текст | CrossRef Полный текст
Гальван-Гарсия, П., Кифер, Э. В., Янг, Ф., Чжан, М., Фанг, С., Захидов, А. А. и др. (2007). Надежная миграция клеток и рост нейронов на нетронутых углеродных нанотрубках и нитях. J. Biomater. Sci. Polym. Эд . 18, 1245–1261.
Pubmed Аннотация | Pubmed Полный текст | CrossRef Полный текст
Джордж, М.С., Нахас, З., Боркардт, Дж.J., Anderson, B., Foust, M. J., Burns, C., et al. (2007). Стимуляция мозга для лечения психических расстройств. Curr. Мнение. Психиатрия 20, 250–254.
Pubmed Аннотация | Pubmed Полный текст | CrossRef Полный текст
Джордж П. М., Ликман А. В., ЛаВан Д. А., Хегде А., Леунг Ю., Авасаре Р. и др. (2005). Изготовление и биосовместимость полипиррольных имплантатов, пригодных для нервного протезирования. Биоматериалы 26, 3511–3519.
Pubmed Аннотация | Pubmed Полный текст | CrossRef Полный текст
Гейт, М.К., Паппас, Т. К., Лиопо, А. В., Синани, В. А., Шим, Б. С., Мотамеди, М. и др. (2006). Стимуляция нервных клеток латеральными послойными пленками однослойных токов в проводящих углеродных нанотрубках. Adv. Материал . 18, 2975–2979.
Гейт, М. К., Синани, В. А., Викстед, Дж. П., Мэттс, Р. Л., и Котов, Н. А. (2005). Однослойные полиэлектролитные однослойные углеродные нанотрубки и автономные пленки как биосовместимая платформа для нейропротезных имплантатов. Adv.Материал . 17, 2663–2670.
Гринбаум, А., Анава, С., Аяли, А., Шейн, М., Давид-Пур, М., Бен-Джейкоб, Э. и др. (2009). Однозначный интерфейс нейрон-электрод. J. Neurosci. Методы 182, 219–224.
Хадж Хассан, М., Чодаварапу, В., и Мусаллам, С. (2008). NeuroMEMS: микротехнологии нейронных зондов. Датчики 8, 6704–6726.
Ханейн Ю. (2010). Интеграция углеродных нанотрубок в устройства MEMS. Phys. Статус Solidi B 247, 2635–2640.
Харрис, П. Дж. Ф. (2009). Наука об углеродных нанотрубках . Нью-Йорк, Нью-Йорк: Издательство Кембриджского университета.
Хе В., Макконнелл Г. К., Шнайдер Т. М. и Белламконда Р. В. (2007). Новая противовоспалительная поверхность для нервных электродов. Adv. Материал . 19, 3529–3533.
Хеллер, Д. А., Гарга, В., Келлехер, К. Дж., Ли, Т. К., Махбубани, С., Сигворт, Л. А. и др. (2005). Узорчатые сети нейронов гиппокампа мыши на покрытых пептидами золотых поверхностях. Биоматериалы 26, 883–889.
Pubmed Аннотация | Pubmed Полный текст | CrossRef Полный текст
Хоффман-Ким, Д., Митчел, Дж. А., и Белламконда, Р. В. (2010). «Топография, реакция клеток и регенерация нервов», в Ежегодном обзоре биомедицинской инженерии , том 12, редакторы М. Л. Ярмуш, Дж. С. Дункан и М. Л. Грей (Пало-Альто, Калифорния: Ежегодные обзоры), 203–231.
Pubmed Аннотация | Pubmed Полный текст | CrossRef Полный текст
Сюй, Х. Л., Тэн, И.J., Chen, Y.C., Hsu, W. L., Lee, Y. T., Yen, S. J., et al. (2010). Гибкие электроды из углеродных нанотрубок, модифицированных УФ-озоном, для записи нейронов. Adv. Материал . 22, 2177–2181.
Pubmed Аннотация | Pubmed Полный текст | CrossRef Полный текст
Ху, Х., Ни, Ю. К., Мандал, С. К., Монтана, В., Чжао, Н., Хаддон, Р. К., и др. (2005). Однослойные углеродные нанотрубки, функционализированные полиэтиленимином, в качестве субстрата для роста нейронов. J. Phys. Chem. B 109, 4285–4289.
Pubmed Аннотация | Pubmed Полный текст | CrossRef Полный текст
Ху, Х., Ни, Ю. К., Монтана, В., Хэддон, Р. К., и Парпура, В. (2004). Химически функционализированные углеродные нанотрубки как субстраты для роста нейронов. Nano Lett . 4, 507–511.
Pubmed Аннотация | Pubmed Полный текст | CrossRef Полный текст
Кифер, Э. У., Боттерман, Б. Р., Ромеро, М. И., Росси, А. Ф., и Гросс, Г. У. (2008). Покрытие углеродных нанотрубок улучшает запись нейронов. Нат.Нанотехнологии . 3, 434–439.
Pubmed Аннотация | Pubmed Полный текст | CrossRef Полный текст
Лан, Ю. К., Ван, Ю., и Рен, З. Ф. (2011). Физика и применение ориентированных углеродных нанотрубок. Adv. Phys . 60, 553–678.
Лакстон, А. В., Тан-Вай, Д. Ф., МакЭндрюс, М. П., Цумстег, Д., Веннберг, Р., Керен, Р., и др. (2010). Фаза I испытания глубокой стимуляции цепей памяти мозга при болезни Альцгеймера. Ann. Neurol . 68, 521–534.
Pubmed Аннотация | Pubmed Полный текст | CrossRef Полный текст
Ли, В., и Парпура, В. (2009). «Углеродные нанотрубки как субстраты / каркасы для роста нервных клеток», в Nanoneuroscience and Nanoneuropharmacology , под ред. Х. С. Шарма (Амстердам: Elsevier Science BV), 111–125.
Pubmed Аннотация | Pubmed Полный текст | CrossRef Полный текст
Лиопо А. В., Стюарт М. П., Хадсон Дж., Тур Дж. М. и Паппас Т. К. (2006). Биосовместимость нативных и функционализированных однослойных углеродных нанотрубок для нейронального интерфейса. J, Nanosci. Нанотехнологии .6, 1365–1374.
Pubmed Аннотация | Pubmed Полный текст
Ловат В., Пантаротто Д., Лагостена Л., Качкари Б., Грандольфо М., Риги М. и др. (2005). Подложки из углеродных нанотрубок усиливают передачу электрических сигналов нейронов. Nano Lett . 5, 1107–1110.
Pubmed Аннотация | Pubmed Полный текст | CrossRef Полный текст
Лу, Ф. С., Гу, Л. Р., Мезиани, М. Дж., Ван, X., Луо, П. Г., Века, Л. М. и др. (2009). Достижения в области биологических применений углеродных нанотрубок. Adv. Материал . 21, 139–152.
Лу, Ю., Ли, Т., Чжао, X. К., Ли, М., Цао, Ю. Л., Ян, Х. Х. и др. (2010). Электроосажденные электроды из композитных пленок полипиррол / углеродные нанотрубки для нейронных интерфейсов. Биоматериалы 31, 5169–5181.
Pubmed Аннотация | Pubmed Полный текст | CrossRef Полный текст
Луо, X. Л., Уивер, К. Л., Чжоу, Д. Д., Гринберг, Р., и Цуй, X. Y. Т. (2011). Высокостабильный поли (3,4-этилендиокситиофен), легированный углеродными нанотрубками, для хронической нервной стимуляции. Биоматериалы 32, 5551–5557.
Pubmed Аннотация | Pubmed Полный текст | CrossRef Полный текст
Маларки, Э. Б., Фишер, К. А., Бекьярова, Э., Лю, В., Хаддон, Р. К., и Парпура, В. (2009). Проводящие однослойные подложки из углеродных нанотрубок модулируют рост нейронов. Nano Lett . 9, 264–268.
Pubmed Аннотация | Pubmed Полный текст | CrossRef Полный текст
Марчиньяк, С., Криспин, X., Увдал, К., Трзцински, М., Биргерсон, Дж., Грюнендал, Д., и другие. (2004). Светоиндуцированное повреждение поли (3,4-этилендиокситиофена) и его производных изучено методом фотоэлектронной спектроскопии. Synth. Встретил . 141, 67–73.
Мацумото, К., Сато, К., Нака, Ю., Китадзава, А., Уитби, Р. Л. Д., и Симидзу, Н. (2007). Нейритные выросты нейронов с углеродными нанотрубками, покрытыми нейротрофином. J. Biosci. Bioeng . 103, 216–220.
Pubmed Аннотация | Pubmed Полный текст | CrossRef Полный текст
Маццатента, А., Джульяно, М., Кампиделли, С., Гамбацци, Л., Бусинаро, Л., Маркрам, Х. и др. (2007). Взаимодействие нейронов с углеродными нанотрубками: передача электрического сигнала и синаптическая стимуляция в культурных цепях мозга. Дж. Neurosci . 27, 6931–6936.
Pubmed Аннотация | Pubmed Полный текст | CrossRef Полный текст
МакКоннелл, Г. К., Рис, Х. Д., Леви, А. И., Гутекунст, К. А., Гросс, Р. Э., и Белламконда, Р. В. (2009). Имплантированные нервные электроды вызывают хроническое локальное воспаление, которое коррелирует с местной нейродегенерацией. J. Neural Eng . 6, 1–12.
Pubmed Аннотация | Pubmed Полный текст | CrossRef Полный текст
МакКрири, Д. Б., Агнью, В. Ф., Юэн, Т. Г. Х. и Буллара, Л. (1990). Плотность заряда и заряд на фазу как кофакторы нервного повреждения, вызванного электростимуляцией. IEEE Trans. Биомед. Eng . 37, 996–1001.
Pubmed Аннотация | Pubmed Полный текст
Маккрири, Д. Б., Агнью, В. Ф., Юэн, Т. Г. Х. и Буллара, Л. А. (1988). Сравнение нервных повреждений, вызванных электростимуляцией с фарадеевскими и конденсаторными электродами. Ann. Биомед. Eng . 16, 463–481.
Pubmed Аннотация | Pubmed Полный текст
Musial, P. G., Baker, S. N., Gerstein, G. L., King, E. A., and Keating, J. G. (2002). Улучшение отношения сигнал / шум при многоэлектродной записи. J. Neurosci. Методы 115, 29–43.
Pubmed Аннотация | Pubmed Полный текст | CrossRef Полный текст
Нгуен-Ву, Т. Д. Б., Чен, Х., Касселл, А. М., Эндрюс, Р., Мейяппан, М., и Ли, Дж. (2006). Вертикально выровненные массивы углеродных нановолокон: шаг вперед к электронно-нейронным интерфейсам. Малый 2, 89–94.
Pubmed Аннотация | Pubmed Полный текст | CrossRef Полный текст
Нгуен-Ву, Т. Д. Б., Чен, Х., Касселл, А. М., Эндрюс, Р. Дж., Мейяппан, М., и Ли, Дж. (2007). Вертикально ориентированная архитектура из углеродных нановолокон как многофункциональный трехмерный нейронный электрический интерфейс. IEEE Trans. Биомед. Eng . 54, 1121–1128.
Pubmed Аннотация | Pubmed Полный текст | CrossRef Полный текст
Нуньес, А., Аль-Джамал, К., Накадзима, Т., Хариз, М., и Костарелос, К. (2012). Применение углеродных нанотрубок в неврологии: клинические перспективы и токсикологические риски. Arch. Токсикол . 86, 1009–1020.
Pubmed Аннотация | Pubmed Полный текст | CrossRef Полный текст
Роуч П., Паркер Т., Гадегаард Н. и Александр М. Р. (2010). Поверхностные стратегии контроля адгезии нейрональных клеток: обзор. Surf. Sci. Репутация . 65, 145–173.
Роббли, Л. С., и Роуз, Т. Л. (1990). «Электрохимические рекомендации по выбору протоколов и электродных материалов для нервной стимуляции», в Neural Prostheses: Fundamental Studies , eds W.Ф. Агнью и Д. Б. Маккрири (Энглвуд Клиффс, Нью-Джерси: Прентис Холл), 25–66.
Родригес, Н. М. (1993). Обзор каталитически выращенных углеродных нановолокон. J. Mater. Рез . 8, 3233–3250.
Руардиж, Т. Г., Гедблоед, М. Х. и Руттен, В. Л. С. (2000). Адгезия и формирование паттерна нейронов коры на поверхностях, покрытых полиэтиленимином и фторуглеродом. IEEE Trans. Биомед. Eng . 47, 1593–1599.
Pubmed Аннотация |
Различные типы программного обеспечения с примерами
Каждый день мы сталкиваемся с различными типами компьютерного программного обеспечения, которое помогает нам в решении наших задач и повышает нашу эффективность.От MS Windows, которая приветствует нас, когда мы включаем систему, до веб-браузера, который используется для серфинга в Интернете, или игр, в которые мы играем на нашем компьютере, до счетчика сжигания калорий на нашем смартфоне — все это примеры программного обеспечения. В этом мире технологий мы даже сталкиваемся с различными тенденциями в разработке программного обеспечения, которые помогают нашему бизнесу расти, мы окружены всем этим программным обеспечением, которое призвано облегчить нашу жизнь. По определению, Программное обеспечение (также сокращенно SW или S / W) — это совокупность данных, программ, процедур, инструкций и документации, которые выполняют различные предопределенные задачи в компьютерной системе.Они позволяют пользователям взаимодействовать с компьютером
В области разработки программного обеспечения и информатики программное обеспечение — это не что иное, как информация, обрабатываемая компьютерной системой и программами. Программное обеспечение включает библиотеки, программы и соответствующие неисполняемые данные, такие как цифровые носители и онлайн-документацию. Компьютерное оборудование и программное обеспечение нуждаются друг в друге, и ни одно из них не может быть эффективно использовано само по себе. Объединение аппаратного и программного обеспечения обеспечивает контроль и гибкость современных вычислительных систем.Без программного обеспечения компьютеры были бы бесполезны. Например, без помощи программного обеспечения веб-браузера вы не сможете выходить в Интернет. Точно так же без операционной системы ни одно приложение не может работать на вашем компьютере.
Сегодня нам доступно множество высокотехнологичных технологий и программного обеспечения, которые определяют наш образ жизни и удовлетворяют наши постоянно меняющиеся и растущие потребности. Бесконечное количество типов программного обеспечения может ошеломить любого, особенно если человек не понимает досконально различные типы программного обеспечения и их пользователей.
Различные типы программного обеспечения
Обычно существует две основных классификации программного обеспечения, а именно системное программное обеспечение и прикладное программное обеспечение.
1. Системное программное обеспечение
Системное программное обеспечение помогает пользователю и оборудованию функционировать и взаимодействовать друг с другом. По сути, это программное обеспечение для управления поведением компьютерного оборудования с целью обеспечения основных функций, необходимых пользователю. Проще говоря, мы можем сказать, что системное программное обеспечение является промежуточным звеном или промежуточным слоем между пользователем и оборудованием.Это компьютерное программное обеспечение санкционирует платформу или среду для работы другого программного обеспечения. Это причина, по которой системное программное обеспечение очень важно для управления всей компьютерной системой. Когда вы впервые включаете компьютер, именно системное программное обеспечение инициализируется и загружается в память системы. Системное программное обеспечение работает в фоновом режиме и не используется конечными пользователями. По этой причине системное программное обеспечение также называют «программным обеспечением низкого уровня».
Вот некоторые общие примеры системного программного обеспечения:
- Операционная система: Это наиболее яркий пример системного программного обеспечения.Это набор программного обеспечения, которое обрабатывает ресурсы и предоставляет общие услуги для других приложений, которые работают над ними. Хотя все операционные системы отличаются друг от друга, большинство из них предоставляет графический интерфейс пользователя, с помощью которого пользователь может управлять файлами и папками и выполнять другие задачи. Каждое устройство, будь то настольный компьютер, ноутбук или мобильный телефон, требует наличия операционной системы для обеспечения его основных функций. Поскольку ОС по существу определяет, как пользователь взаимодействует с системой, многие пользователи предпочитают использовать одну конкретную ОС для своего устройства.Существуют различные типы операционных систем, такие как операционные системы реального времени, встроенные, распределенные, многопользовательские, однопользовательские, Интернет, мобильные и многие другие. Перед выбором операционной системы важно учитывать технические характеристики оборудования. Некоторые примеры операционных систем приведены ниже:
- Android
- CentOS
- iOS
- Linux
- Mac OS
- MS Windows
- Ubuntu
- Unix
- Драйверы устройств: Это тип программного обеспечения, которое управляет определенным оборудованием, подключенным к системе.Аппаратные устройства, которым требуется драйвер для подключения к системе, включают дисплеи, звуковые карты, принтеры, мыши и жесткие диски. Кроме того, существует два типа драйверов устройств: драйверы устройств ядра и драйверы устройств пользователя. Вот несколько примеров драйверов устройств:
- Драйвер BIOS
- Драйверы дисплея
- Драйверы для материнских плат
- Драйверы принтера
- ROM драйверы
- Драйвер звуковой карты
- USB-драйверы
- USB-драйверы
- Драйверы VGA
- Драйверы VGA
- Драйверы виртуальных устройств
- Прошивка: Прошивка — это постоянное программное обеспечение, встроенное в постоянную память.Это набор инструкций, постоянно хранящихся на аппаратном устройстве. Он предоставляет важную информацию о том, как устройство взаимодействует с другим оборудованием. Микропрограмму можно рассматривать как «полупостоянную», поскольку она остается постоянной, если не обновляется с помощью программы обновления микропрограммы. Вот несколько примеров прошивки:
- BIOS
- Периферийные устройства для компьютера
- Потребительские приложения
- Встроенные системы
- UEFI
- Переводчики языков программирования: Это программы-посредники, с помощью которых программное обеспечение переводит код языка высокого уровня в более простой код машинного уровня.Помимо упрощения кода, переводчики также делают следующее:
- Назначить хранилище данных
- Включите исходный код, а также сведения о программе
- Предлагаем диагностические отчеты
- Исправить системные ошибки во время выполнения
- Примерами трансляторов языков программирования являются интерпретаторы, компиляторы и ассемблеры.
- Служебная программа: Служебная программа предназначена для помощи в анализе, оптимизации, настройке и обслуживании компьютерной системы.Он поддерживает компьютерную инфраструктуру. Это программное обеспечение фокусируется на том, как функционирует ОС, а затем, соответственно, оно определяет траекторию своего движения, чтобы сгладить работу системы. Программное обеспечение, такое как антивирусы, инструменты очистки и управления дисками, инструменты сжатия, дефрагментаторы и т. Д., Являются служебными инструментами. Вот несколько примеров служебных инструментов:
- Антивирус Avast
- Справочник Opus
- Антивирус McAfee
- Пириформ CCleaner
- Razer Cortex
- Проводник Windows
- WinRAR
- WinZip
2.Прикладное программное обеспечение
Прикладное программное обеспечение, также известное как программы для конечных пользователей или программы повышения производительности, — это программное обеспечение, которое помогает пользователю в выполнении таких задач, как выполнение онлайн-исследований, создание заметок, установка будильника, разработка графики, ведение журнала учетной записи, выполнение расчетов или даже игра игры. Они лежат выше системного ПО. В отличие от системного программного обеспечения, они используются конечным пользователем, имеют определенные функции или задачи и выполняют ту работу, для которой они предназначены.Например, браузер — это приложение, разработанное специально для работы в Интернете, или MS Powerpoint — это приложение, используемое специально для проведения презентаций. Прикладное программное обеспечение или просто приложения также могут называться второстепенным программным обеспечением, поскольку их требования очень субъективны, и их отсутствие не влияет на работу системы. Все приложения, которые мы видим на наших мобильных телефонах, также являются примерами прикладного программного обеспечения. Существует определенное программное обеспечение, предназначенное исключительно для разработки приложений, например Meteor и Flutter.Это также примеры прикладного программного обеспечения.
Существуют различные типы прикладного программного обеспечения:
- Текстовые процессоры: Эти приложения для документации. Наряду с этим он также помогает хранить, форматировать и распечатывать эти документы. Вот некоторые примеры текстовых редакторов:
- Abiword
- Apple iWork- Pages
- Corel WordPerfect
- Google Документы
- MS Word
- Программное обеспечение базы данных: Это программное обеспечение используется для создания и управления базой данных.Она также известна как система управления базами данных или СУБД. Они помогают с организацией данных. Некоторые примеры СУБД:
- Машинка для стрижки
- дБase
- FileMaker
- FoxPro
- MS Access
- MySQL
- Мультимедийное программное обеспечение: Это программное обеспечение, которое может воспроизводить, создавать или записывать изображения, аудио или видео файлы. Они используются для редактирования видео, анимации, графики и изображений. Вот некоторые примеры мультимедийного программного обеспечения:
- Adobe Photoshop
- Inkscape
- Медиа Обезьяна
- Picasa
- Медиа-проигрыватель VLC
- Проигрыватель Windows Media
- Windows Movie Maker
- Образовательное и справочное программное обеспечение: Эти типы программного обеспечения специально разработаны для облегчения изучения определенного предмета.Под эту категорию попадают различные учебные программы. Их также называют академическим программным обеспечением. Вот несколько примеров:
- Рисунок дельты
- GCompris
- Титулы Jumpstart
- KidPix
- MindPlay
- Краска для смокинга
- Графическое программное обеспечение: Как следует из названия, графическое программное обеспечение было разработано для работы с графикой, поскольку оно помогает пользователю редактировать или вносить изменения в визуальные данные или изображения.Он состоит из графических редакторов и программного обеспечения для иллюстраций. Вот несколько примеров:
- Adobe Photoshop
- Autodesk Maya
- Блендер
- Каррара
- CorelDRAW
- GIMP
- Modo
- PaintShop Pro
- Веб-браузеры: Эти приложения используются для работы в Интернете. Они помогают пользователю находить и извлекать данные в Интернете. Некоторые примеры веб-браузеров:
- Google Chrome
- Internet Explorer
- Microsoft Edge
- Mozilla Firefox
- Opera
- Safari
- Браузер UC
Кроме них, все программное обеспечение, которое служит определенной цели, относится к категории прикладного программного обеспечения.
Однако существует еще одна классификация ПО. Программное обеспечение также можно классифицировать по их доступности и совместимости.
Эта классификация приведена ниже:
1. Бесплатное ПО
Бесплатное программное обеспечение доступно бесплатно. Любой пользователь может скачать его из Интернета и использовать без какой-либо платы. Однако бесплатное ПО не дает права изменять программное обеспечение или взимать плату за его распространение.Примеры:
- Adobe Reader
- Смелость
- ImgBurn
- Recuva
- Skype
- Team Viewer
- Yahoo Messenger
2. Условно-бесплатная
Это программное обеспечение, которое бесплатно распространяется среди пользователей на пробной основе. Обычно это связано с ограничением по времени, и когда срок истекает, пользователя просят заплатить за продолжающиеся услуги. Существуют различные типы условно-бесплатного ПО, такие как Adware, Donationware, Nagware, Freemium и Demoware (Cripplewareand Trialware).Вот некоторые примеры условно-бесплатного ПО:
- Adobe Acrobat
- Getright
- Отладчик PHP
- Winzip