что это и для чего нужен, устройство и схема стандартного электрода
Стандартный – это элемент сравнения, применяющийся для определения потенциалов в гальванических элементах и при различных электрохимических реакциях.
Так как измерить потенциал отдельного невозможно, используется сравнительный элемент, в частности в составе электролитических ячеек.
Содержание
- Стандартный водородный электрод: что это?
- Как он работает?
- Схема стандартного водородного электрода
- Итог
Стандартный водородный электрод: что это?
Электроды сравнения – электрохимические системы, использующиеся для измерения электродных потенциалов.
Любой , находящийся в состоянии термодинамического равновесия, способный обеспечить постоянство во времени и воспроизводимость всех характеристик, может служить элементом сравнения.
Разновидности электродов для измерения pH.Наиболее распространенными являются водородный, каломельный, галогеносеребряный и оксидно-ртутный вариант устройства.
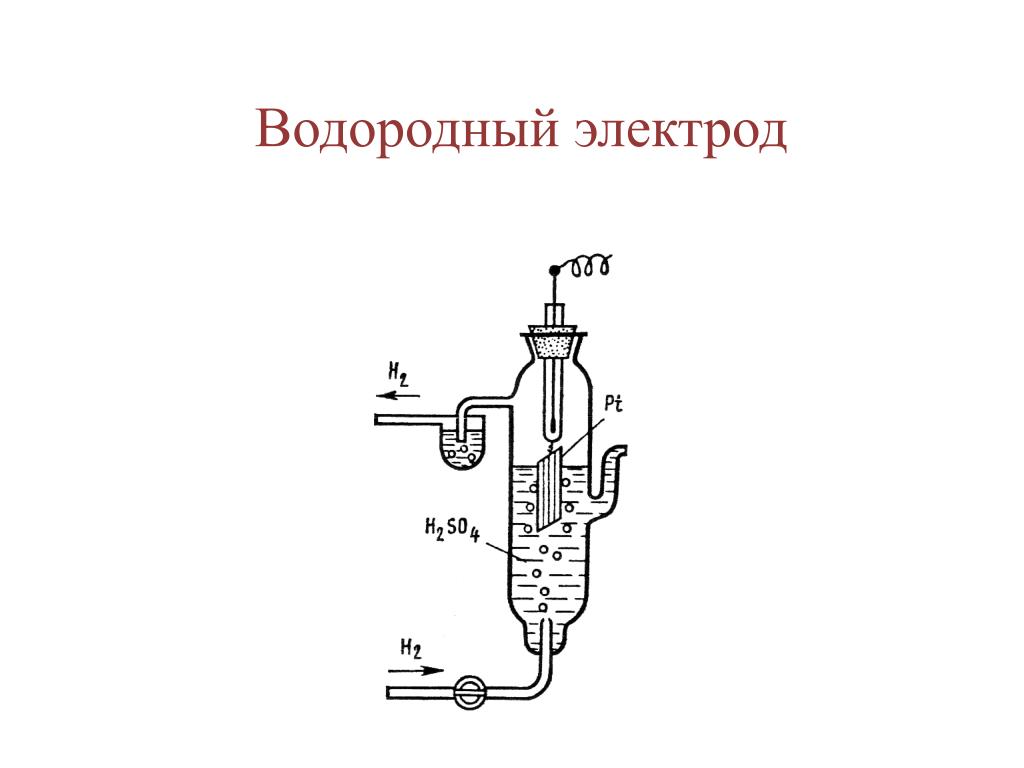
Стандартный элемент сравнения представляет собой проволоку или пластинку, выполненную из металла, который хорошо адсорбирует гидроген.
Обычно используются такие металлы, как платина или палладий, на которые электролитическим методом нанесена платина в тонкодисперсном состоянии. Это увеличивает активную площадь поверхности для взаимодействия с гидрогеном.
Пластина погружается в водный раствор, насыщенный ионами гидрогена. Через раствор, под атмосферным давлением, пропускается химически чистый водород.
В результате поверхность платиновой пластины гидрогенизируется и на границе поверхности платиновой пластины с раствором устанавливается равновесие между переходом гидрогена из молекулярного состояния в атомарное и наоборот.
Как он работает?
Принцип работы устройства основан на растворимости металлов в электролите. Даже при погружении металла в воду он начинает подвергаться действию ее молекул.
С поверхности пластины начинают отрываться ионы, и они попадают в слой воды, контактирующий с металлом. В результате нейтральный атом превращается в ион.
В результате нейтральный атом превращается в ион.
Это приводит к высвобождению отрицательно заряженных частиц – электронов. Между положительными атомами и электронами появляется потенциал. Его действие обуславливает концентрацию ионов у поверхности металла, образуя адсорбционный слой.
Такая структура носит название – двойной электрический слой.
Устройство водородного электрода.В электрохимии потенциалы металлов измеряются в вольтах, по отношению к некоторому стандартному элементу. Согласно международной договоренности, в качестве такого элемента принято считать стандартный ВЭ.
При давлении газообразного водорода на границе с раствором в 1 атмосферу, концентрации положительных ионов водорода 1 моль/л и температуре 298 К, потенциал принимается равным 0 и его называют нормальным водородным электродом.
В настоящее время не существует методики, позволяющей независимо определить потенциал отдельно взятого . Для этих целей применяется данное устройство.
В частности, собирается гальваническая цепь, состоящая из измеряемого и ВЭ. Так как потенциал второго принят за 0, то относительный потенциал второго будет равен электродвижущей силе гальванического элемента.
При работе данного устройства важно использовать гидроген, хорошо очищенный от примесей серы и мышьяка. Также нежелательной примесью является кислород, который может реагировать с гидрогеном на поверхности платиновой пластины с образованием воды, что приведет к нестабильной работе.
Схема стандартного водородного электрода
Данное устройство используют для измерения потенциалов электрохимических реакций.
Стандартный водородный электрод.Схема водородного электрода представляет собой:
- пластину, изготовленную из палладия или платины;
- подвод газообразного водорода;
- водный раствор, как правило, соляной или серной кислоты с концентрацией водорода 1 моль/л;
- водяной затвор;
- электролитический мост для соединения со второй половиной гальванической цепи.

Устройство элемента сравнения очень простое. Кроме того, его можно применять в широком интервале температур и давлений, а также в не водных и частично водных растворах.
Эксплуатация устройства сопряжена с определенными трудностями, например, с необходимостью постоянной подачи химически чистого водорода. Несмотря на это, стандартные элементы сравнения широко использовались в работах многих известных ученых.
Так, С.П.Л. Серенсен, с использованием данного устройства, разработал современную теорию pH-метрии, а Макклендон впервые использовал сравнения для внутрижелудочной pH-метрии.
Итог
Стандартный сравнительный элемент широко используется для определения потенциалов электродов. Для этого собирается гальванический элемент, состоящий из измеряемого и стандартного водородного электрода.
Также его применяют для определения растворимости, pH-метрии, скорости протекания электрохимических реакций и для измерения концентрации ионов водорода. Простота схемы ВЭ делает его наиболее удобным для использования.
7.4. Устройство и принцип работы водородного, стеклянного и хлоридсеребрянного электродов
В количественном анализе чаще всего
применяют два типа электродов: в качестве
индикаторного – стеклянный, и
хлоридсеребряный – как электрод
сравнения. Особая роль принадлежит
водородному электроду, который является
универсальным электродом сравнения,
так как его потенциал принят за нуль.
Рассмотрим более подробно устройство
и принцип работы именно этих электродов.
Потенциал любого электрода может быть рассчитан на основании уравнения Нернста, исходя из значения стандартного электродного потенциала и условий протекания электродных реакций (активности ионов, температуры, числа электронов, участвующих в процессе). Абсолютное значение определить невозможно, поэтому его можно оценить относительно любого электрода, потенциал которого в данных условиях остается неизменным
Е = -0,059рН + const (7.11)
Этот
электрод относится к стандартным газовым
электродам I
рода (обратимым по катиону), а проводником
I
рода в нем служит электрод из платины,
который непосредственного участия в
электродной реакции не принимает.
Рисунок 7.18 Устройство стандартного водородного электрода.
Как
видно из рисунка 7.18, основным элементом
водородного электрода служит высокочистая
специально обработанная платиновая
пластина, покрытая слоем электролитически
осажденной платины (платиновой черни),
имеющей большую удельную поверхность.
Эта пластина погружена в водный раствор
серной или соляной кислоты с концентрацией
(7.12)
Разница
потенциалов на границе раздела имеет
некоторое постоянное значение, которое
условно принято за нуль. Степень
воспроизводимости результатов у такого
электрода очень высока, однако в
аналитических лабораториях водородный
электрод не применяют из-за относительной
сложности работы с ним.
Степень
воспроизводимости результатов у такого
электрода очень высока, однако в
аналитических лабораториях водородный
электрод не применяют из-за относительной
сложности работы с ним.
Для определения электродного потенциала данного металла составляют гальванический элемент, где один из полуэлементов – это испытуемый металл, погруженный в раствор собственной соли при стандартных условиях, а вторым полуэлементом является стандартный водородный электрод. Значение ЭДС такого элемента числено равно стандартному электродному потенциалу данного металла и приводится в таблице ряда напряжений металлов.
Электродный потенциал металла, измеренный при стандартных условиях относительно стандартного водородного электрода, называют стандартным (нормальным) электродным потенциалом.
Таким образом, потенциал электрода сравнения по отношению к водородному электроду всегда точно известен и может быть вычислен по уравнению Нернста
;
(7. 13)
13)
где – формальный потенциал системы, в которой концентрации всех участников составляют 1 моль/л. Этот потенциал включает в себя коэффициенты активности (f) окисленной и восстановленной форм и зависит от ионной силы раствора.
Типы pH-электродов и их применение
Первые рН-электроды имели стеклянную колбу или пузырек, заполненный сильным электролитом, и имели внутри полуэлемент Ag/AgCl (серебро/хлорид серебра) с серебряной проволокой в качестве контакта.
Работа оригинальных pH-электродов и современных электродов не сильно изменилась, однако по мере совершенствования технологии были созданы новые конструкции, такие как комбинированные электроды, электроды с двойным соединением, заполненные гелем электроды, твердотельные электроды, ионселективные электроды и эпоксидный корпус. электроды
Большинство современных типов рН-электродов известны как комбинированные электроды. Комбинированные электроды имеют стеклянный электрод, чувствительный к ионам водорода (H+), и дополнительный электрод сравнения в одном корпусе.
Как работает комбинированный электрод?
Комбинированный электрод измеряет разность потенциалов между двумя сторонами стеклянного электрода. Для измерения потенциалов должна быть замкнутая цепь. Цепь замыкается через внутренние растворы электрода и внешний измеряемый раствор и рН-метр.
Когда электрод погружается в тестовый раствор, стеклянная колба воспринимает ионы водорода как милливольты (мВ) из-за положительного заряда ионов водорода. Электролит или внутренний раствор улавливают мВ-сигнал от стеклянной колбы. Затем этот сигнал передается на внутренний электрод. Провод Ag/AgCl затем передает этот сигнал кабелю электрода, который ведет к измерителю.
Электрод сравнения, содержащий электролит или заполняющий раствор, создает постоянное напряжение в милливольтах, которое передается на провод Ag/AgCl. Затем провод передает сигнал, который можно считать «контрольным», измеряемым на кабеле электрода.
Цепь замыкается небольшим количеством внутреннего раствора из электрода сравнения, протекающего через пористую мембрану, сделанную из керамического фитиля. Эта мембрана или соединение, как ее называют, находится в теле электрода.
Эта мембрана или соединение, как ее называют, находится в теле электрода.
pH-метр измеряет разницу между внутренним электродом и электродом сравнения в милливольтах постоянного тока. Это показание мВ затем считывается измерителем и отображается в единицах pH.
Как работают электроды с двойным соединением?
Как упоминалось выше, комбинированный электрод отделен от тестируемого раствора соединением с электролитом, из которого он вытекает. В неблагоприятных условиях, когда испытуемые растворы могут быть сильно кислыми или щелочными, или находиться под высоким давлением или высокими температурами, положительное течение раствора электролита через соединение может быть изменено на противоположное. После реверсирования тестируемый образец может попасть в отделение сравнения, загрязняя электрод сравнения и в конечном итоге разрушив электрод.
В приложениях, где возможно изменение направления потока электролита, используется двойной переход. Для защиты эталона от загрязнения в электрод встроен второй переход. Второй спай, или электрод с двойным спаем, как известно, имеет дополнительную камеру между тестируемым раствором и электродом сравнения. Прежде чем примеси из испытуемого раствора попадут на электрод сравнения, они должны сначала диффундировать не только через исходный спай, но и через второй. Дополнительная камера работает как буфер, замедляя изменения в растворе электролита электрода сравнения. Преимущество электродов с двойным соединением заключается в том, что они служат дольше и хорошо работают в неблагоприятных условиях.
Второй спай, или электрод с двойным спаем, как известно, имеет дополнительную камеру между тестируемым раствором и электродом сравнения. Прежде чем примеси из испытуемого раствора попадут на электрод сравнения, они должны сначала диффундировать не только через исходный спай, но и через второй. Дополнительная камера работает как буфер, замедляя изменения в растворе электролита электрода сравнения. Преимущество электродов с двойным соединением заключается в том, что они служат дольше и хорошо работают в неблагоприятных условиях.
Как работают ионно-селективные полевые транзисторы (ISFET)?
Ионно-селективные полевые транзисторы (ISFET) или твердотельные электроды основаны на кремниевой микросхеме, которая при контакте с тестовым раствором обнаруживает и измеряет переменный потенциал напряжения между его поверхностью и нижележащим полупроводниковым материалом. Этот переменный потенциал пропорционален концентрации ионов водорода в образце и используется для определения значения pH. Электроды
Электроды
ISFET долговечны и просты в обслуживании. Зонды изготовлены из нержавеющей стали и, поскольку в них нет стекла, они идеально подходят для пищевой промышленности. Они практически не ломаются.
Другие преимущества электрода ISFET включают прочную область измерения pH, которую можно чистить зубной щеткой; их можно хранить в сухом виде; они имеют быстрое время отклика и могут использоваться для тестирования экстремальных уровней кислот или щелочей по шкале pH.
Недостатки ISFET в том, что они в два-три раза дороже традиционных электродов; они не обеспечивают такой же стабильности и точности, как стеклянные электроды; у них есть известная проблема дрейфа, и большинство из них работают только с рН-метрами, адаптированными к технологии ISFET.
Как работают ионоселективные электроды?
Ионоселективные электроды (ИСЭ) используются для измерения удельной концентрации ионов в растворе, обычно в режиме реального времени. Электроды состоят из датчика, преобразующего активность иона, растворенного в растворе, в электрический потенциал.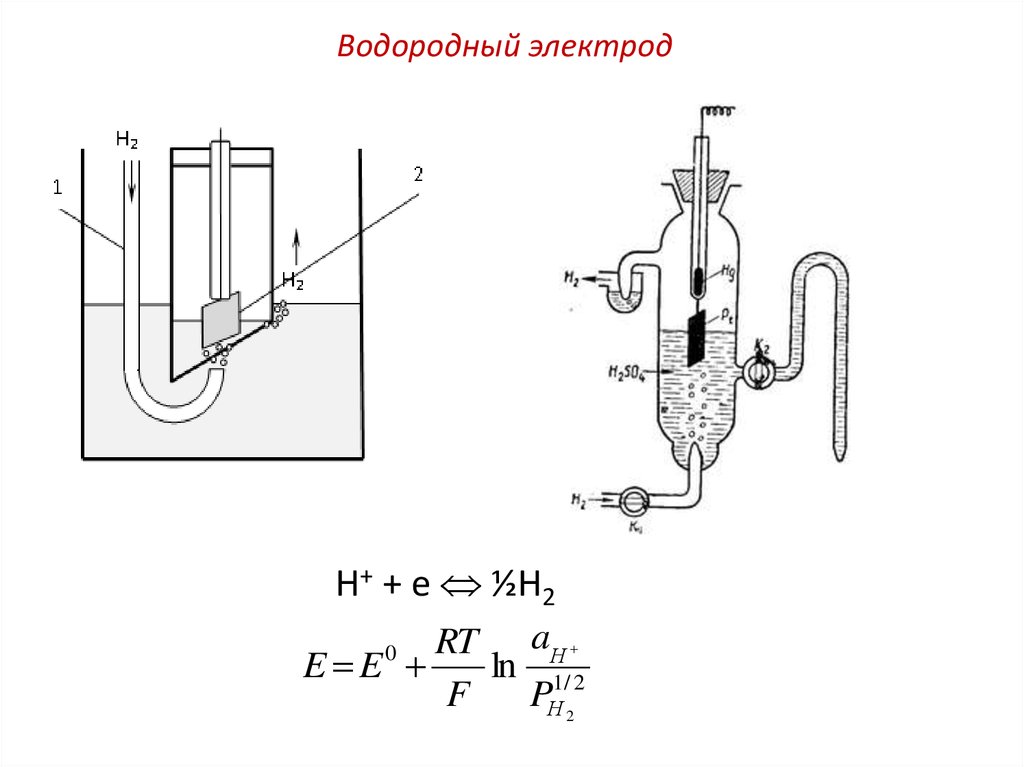 В то время как традиционный рН-электрод измеряет потенциал растворенных ионов водорода; ISE может измерять потенциал ионов во многих веществах, включая аммиак, кадмий, кальций, бромид, фторид, медь и цианид, растворенные в растворе.
В то время как традиционный рН-электрод измеряет потенциал растворенных ионов водорода; ISE может измерять потенциал ионов во многих веществах, включая аммиак, кадмий, кальций, бромид, фторид, медь и цианид, растворенные в растворе.
ISE могут использоваться только с pH-метрами, которые отображают показания в милливольтовой шкале, а также в шкале pH. Измерения конвертируются в части на миллион (ppm).
Вместо стеклянной колбы чувствительная часть электрода выполнена в виде ион-специфичной мембраны вместе с ион-специфическим электродом сравнения. При использовании регулятора ионной силы ISE требуется калибровочный раствор, специфичный для ионов, и замещающий раствор электролита. ИСЭ
используются на водоочистных сооружениях, производственных предприятиях и лабораториях, где требуются измерения конкретных ионов в реальном времени для получения результатов очистки, контроля качества и анализа растворов.
Часто задаваемые вопросы
В: В чем разница между электродом со стеклянным корпусом и электродом с эпоксидным корпусом?
A: Электроды с эпоксидным корпусом имеют ударопрочный корпус, который подходит для работы в полевых условиях или грубого обращения. Колбы сделаны из стекла, поэтому при обращении с ними необходимо соблюдать осторожность. Пластиковый корпус также препятствует использованию электродов с высокотемпературными растворами и растворителями.
Колбы сделаны из стекла, поэтому при обращении с ними необходимо соблюдать осторожность. Пластиковый корпус также препятствует использованию электродов с высокотемпературными растворами и растворителями.
В: В чем разница между многоразовым (заполненным жидкостью) и заполненным гелем электродом?
A: В многоразовом электроде небольшое количество раствора электролита просачивается через соединение в тестовый раствор, его можно восполнить или долить через заливное отверстие на корпусе электрода. Это помогает поддерживать точность, а также продлевает срок службы электрода.
В: Каков ожидаемый срок службы электрода?
A: Обычно pH-электроды служат от одного до двух лет. На продолжительность жизни влияет множество факторов. Если для приложения выбран неправильный электрод, срок его службы сократится. При тестировании агрессивных кислот или щелочей срок службы сокращается. Наконец, если электрод не обслуживается и не хранится должным образом, срок службы электрода может сократиться.