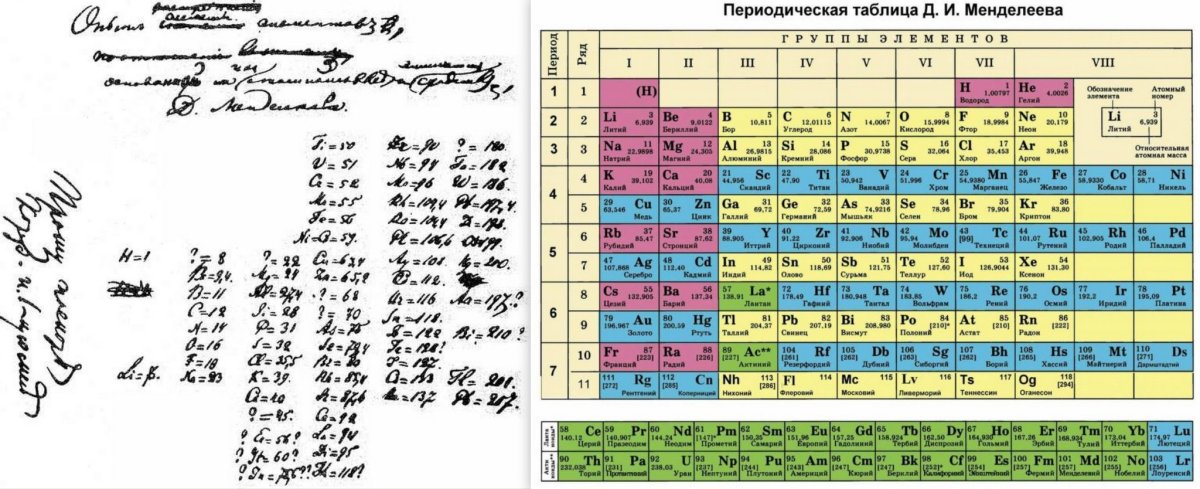
Таблица Менделеева online — W
W
74
2
12
32
18
8
2
183.85±3
5d46s2
Вольфрам
Изотопы
| Символ нуклида |
Z(p) | N(n) | Масса изотопа (а. е. м.) |
Период полураспада (T1/2) |
Спин и чётность ядра |
|---|---|---|---|---|---|
| Энергия возбуждения | |||||
| 158W | 74 | 84 | 157,97456 | 1,37 мс | 0+ |
| 158mW | 1,889 МэВ | 143 мкс | 8+ | ||
| 159W | 74 | 85 | 158,97292 | 8,2 мс | 7/2- |
| 160W | 74 | 86 | 159,96848 | 90 мс | |
| 161W | 74 | 87 | 160,96736 | 409 мс | 7/2- |
| 162W | 74 | 88 | 161,963497 | 1,36 с | 0+ |
| 163W | 74 | 89 | 162,96252 | 2,8 с | 3/2- |
| 164W | 74 | 90 | 163,958954 | 6,3 с | 0+ |
| 165W | 74 | 91 | 164,958280 | 5,1 с | 3/2- |
| 166W | 92 | 165,955027 | 19,2 с | 0+ | |
| 167W | 74 | 93 | 166,954816 | 19,9 с | 3/2- |
| 168W | 74 | 94 | 167,951808 | 51 с | 0+ |
| 169W | 74 | 95 | 168,951779 | 76 с | 5/2- |
| 170W | 74 | 96 | 169,949228 | 2,42 мин | 0+ |
| 171W | 74 | 97 | 2,38 мин | 5/2- | |
| 172W | 74 | 98 | 171,94729 | 6,6 мин | 0+ |
| 173W | 74 | 99 | 172,94769 | 7,6 мин | 5/2- |
| 174W | 74 | 100 | 173,94608 | 33,2 мин | 0+ |
| 175W | 74 | 101 | 174,94672 | 35,2 мин | 1/2- |
| 176W | 74 | 102 | 2,5 ч | 0+ | |
| 177W | 74 | 103 | 176,94664 | 132 мин | 1/2- |
| 178W | 74 | 104 | 177,945876 | 21,6 сут | 0+ |
| 179W | 74 | 105 | 178,947070 | 37,05 мин | 7/2- |
| 179m1W | 221,926 кэВ | 6,40 мин | 1/2- | ||
| 179m2W | 1,63190 МэВ | 390 нс | 21/2+ | ||
| 179m3W | 3,34845 МэВ | 750 нс | 35/2- | ||
| 180W | 74 | 106 | 179,946704 | 1,2·1018 лет | 0+ |
| 180m1W | 1,52904 МэВ | 5,47 мс | 8- | ||
| 180m2W | 3,26456 МэВ | 2,33 мкс | 14- | ||
| 181W | 74 | 107 | 180,948197 | 121,2 сут | 9/2+ |
| 182W | 74 | 108 | стабилен | 0+ | |
| 183W | 74 | 109 | 182,9502230 | стабилен | 1/2- |
| 183mW | 309,493 кэВ | 5,2 с | 11/2+ | ||
| 184W | 74 | 110 | 183,9509312 | стабилен | 0+ |
| 185W | 74 | 111 | 184,9534193 | 75,1 сут | 3/2- |
| 185mW | 197,43 кэВ | 1,597 мин | 11/2+ | ||
| 74 | 112 | 185,9543641 | стабилен | 0+ | |
| 186m1W | 1,5172 МэВ | 18 мкс | 7- | ||
| 186m2W | 3,5428 МэВ | 3 мс | 16+ | ||
| 187W | 74 | 113 | 186,9571605 | 23,72 ч | 3/2- |
| 188W | 74 | 114 | 187,958489 | 69,78 сут | 0+ |
| 189W | 74 | 115 | 11,6 мин | 3/2- | |
| 190W | 74 | 116 | 189,96318 | 30,0 мин | 0+ |
| 190mW | 2,381 МэВ | 3,1 мс | 10- | ||
| 191W | 74 | 117 | 190,96660 | 20 с | 3/2- |
| 192W | 74 | 118 | 191,96817 | 10 с | 0+ |
Вольфрам — 74
Вольфрам — химический элемент с атомным номером 74 в периодической системе, обозначается символом W (лат.
Атомный номер — 74
Атомная масса — 183,84
Плотность, кг/м³ — 19300
Температура плавления, °С — 3410
Теплоемкость, кДж/(кг·°С) — 0,134
Электроотрицательность — 1,7
Ковалентный радиус, Å — 1,30
1-й ионизац. потенциал, эв — 7,98
Открытие вольфрама связано с именами шведского химика Карла Вильгельма Шееле (известного своими научными исследованиями и открытиями многих веществ, в частности, он первый открыл хлор), а также испанских химиков, братьев д’Элуяр (д’Эльгуайр).
В 1781 году Шееле, исследуя минерал тунгстен, в переводе на русский язык тяжелый камень, установил, что он является соединением кальция с неизвестной кислотой, которую К. Шееле назвал тунгстеновой. Эту же кислоту в 1783 году обнаружили братья д’Элуяр в другом минерале в вольфрамите. Вольфрамит был известен давно и часто встречался в оловянных рудах. Знаменитый ученый XVI века Агрикола сказал о нем «пожирает олово, как волк овцу», так как при плавке оловянных руд вместе с вольфрамитом в пену шлака всплывало значительное количество олова.
Кларк вольфрама земной коры составляет (по Виноградову) 1,3 г/т. Его среднее содержание в горных породах, г/т: ультраосновных — 0,1, основных — 0,7, средних — 1,2, кислых — 1,9.
Вольфрам встречается в природе главным образом в виде окисленных сложных соединений, образованных трехокисью вольфрама WO3 с оксидами железа и марганца или кальция, а иногда свинца, меди, тория и редкоземельных элементов.
Общие мировые запасы вольфрама (без России) составляют около 7,5 млн тонн, подтвержденные запасы около 4 млн тонн. Наиболее крупными запасами обладают Казахстан, Китай, Канада и США; известны также месторождения в Боливии, Португалии, России и Южной Корее. Мировое производство вольфрама составляет 18-20 тысяч тонн в год, в том числе в Китае 10, России 3,5; Казахстане 0,7, Австрии 0,5. Основные экспортёры вольфрама: Китай, Южная Корея, Австрия. Главные импортёры: США, Япония, Германия, Великобритания.
Металл, свойства, факты, соединения, использование
Что такое вольфрам?
Вольфрам является химическим элементом или прочным серебристым переходным металлом группы 6 (VIB) периодической таблицы с символом W и атомным номером 74. Из-за его твердости он используется для изготовления стали и ламп накаливания. Символ вольфрама происходит от названия Wolfram, которое до сих пор используется в некоторой литературе.
Из-за его твердости он используется для изготовления стали и ламп накаливания. Символ вольфрама происходит от названия Wolfram, которое до сих пор используется в некоторой литературе.
Свойства вольфрама и молибдена очень похожи, но химический состав этих двух металлов немного отличается. Он имеет самую высокую температуру плавления среди всех металлов и второе место после углерода среди всех элементов таблицы Менделеева. Вольфрам помещается в d-блок современной периодической таблицы вместе с членами группы хрома и молибдена.
Открытие вольфрама
Минерал вольфрам (шведский тяжелый камень CaWO 4 ) был изучен в 1751 году Кронштедтом. В 1981 году Карл Вильгельм Шееле открыл новый оксид этого минерала.
Два года спустя испанские химики Хосе и Фаусто Эльхуяр (два брата) выделили тот же оксид из минерала, известного как вольфрамит. Они выделили металлический вольфрам реакцией восстановления углерода из древесного угля. Символ вольфрама происходит от имени Вольфрам.
Свойства вольфрама
Атомный номер вольфрама 74 и электронная конфигурация [Xe] 4f 14 5d 4 6s 2 . Это последний металл в третьем переходном ряду, в котором все d-электроны участвуют в металлической связи.
Металл очень твердый, тугоплавкий и относительно нереакционноспособный благодаря защитному оксидному слою. Он образует типичную металлическую объемно-центрированную кубическую кристаллическую решетку, такую как молибден.
Металлы Cr, Mo и W относятся к VI группе периодической таблицы. Обычная степень окисления или состояние вольфрама +6 (VI).
| Вольфрам | |||
| Символ | Вт | ||
| Дискавери | Хуан и Фаусто Эльхуяр | ||
| Название производное от | Шведское слово tung sten, означающее тяжелый камень | ||
| Периодические свойства | |||
| Атомный номер | 74 | ||
| Электрон на оболочку | 2, 8, 18, 32, 12, 2 | ||
| Электронная конфигурация | [Xe] 4f 14 5d 4 6s 2 | ||
| Блок | D-блок | ||
| Период | 6 | ||
| Группа | 6 | ||
| Атомный вес | 183,84 | ||
| Общие изотопы | 182 Вт, 184 Вт, 186 Вт | ||
| Физические свойства | |||
| Состояние при 20 °C | Твердый | ||
| Температура плавления | 3695 К (3422°С, 6192°F) | ||
| Точка кипения | 6203 К(5930°C, 10706°F) | ||
| Плотность | 19,3 г/см 3 | ||
| Молярная теплоемкость | 24,27 Дж моль -1 К -1 | ||
| Удельное электрическое сопротивление | 52,80 нОм·м | ||
| Атомный радиус | 2,18 Å | ||
| Ковалентный радиус | 1,50 Å | ||
| Кристаллическая структура | объемно-центрированная кубическая (ОЦК) | ||
| Химические свойства | |||
| Общая степень окисления | 6, 5, 4, 3, 2, 0 | ||
| Электроотрицательность | 2,36 (шкала Полинга) | ||
| Сродство к электрону | 78,757 кДж моль −1 | ||
| Энергия ионизации (кДж/моль) | 1-й | 2-й | |
| 770 | 1700 | ||
| Номер CAS | 7440-33-7 | ||
Где встречается вольфрам
Вольфрам встречается в природе в основном в виде вольфрамита, Fe(Mn)WO 4 и шеелит или вольфрамат кальция, CaWO 4 .
Основные запасные места металла в Китае, США, Южной Корее, Боливии, Португалии, России.
Изотопы вольфрама
Металлический вольфрам имеет четыре природных изотопа ( 182 Вт, 183 Вт, 184 Вт и 186 90 20 Вт) и один радиоактивный изотоп (900 20 Вт). Радиоактивный изотоп металла имеет очень долгую жизнь.
Все пять изотопов радиоактивно распадаются с образованием гафния в результате ядерной реакции. Наблюдаются еще 30 радиоактивных изотопов металла. Они могут быть получены различными типами ядерных реакций.
Производство вольфрамового порошка из вольфрамита
- Концентрированную руду вольфрама типа вольфрамита обжигают на воздухе с карбонатом натрия или расплавленным гидроксидом натрия (NaOH).
- Натрий-вольфрамовую кислоту экстрагируют и обрабатывают водой. Осажденную вольфрамовую кислоту нагревают с получением WO 3 .
- Чистый металл W получают восстановлением оксида металла цинком, алюминием или водородом.

- Металлы молибден и вольфрам имеют очень высокие температуры плавления и изначально получают их в виде порошка. Вольфрам переводится в массивное состояние путем сжатия под водородом при высоких температурах.
Химические соединения
Химический состав вольфрама близок к молибдену. Наиболее распространенная и стабильная степень окисления металла +6, но также стабильны состояния +5 и +4.
Сильные восстановительные свойства металла не выполняются до состояний +3 и +2. Оксиды, фториды и оксокислоты образуются в различных степенях окисления.
Оксиды
Желтый WO 3 является конечным продуктом нагревания других соединений вольфрама на воздухе. Он нерастворим в кислотах. ВО 3 , 2H 2 O образуется в сильнокислых средах. Ее называют вольфрамовой кислотой, но это не гидратированная кислота.
Некоторые низшие оксиды, такие как WO 2 , были получены восстановлением триоксида водородом. Кислотная природа оксидов уменьшается с уменьшением степени окисления.
Кислотная природа оксидов уменьшается с уменьшением степени окисления.
Галогениды
Гексагалогениды металла получают прямым соединением. Бесцветный фторид, такой как WF 6 , более стабилен. Он достаточно реакционноспособен и легко реагирует с кислородом и влагой с образованием оксогалогенидов и HF. ВБр 6 нестабилен и разлагается при осторожной обработке червями. Оксогалогениды металла бывают двух типов:
- WOX 4 (X = F, Cl, Br) : Это летучие твердые ковалентные соединения, гидролизующиеся с образованием WO 3 .
- WO 2 X 2 (X = F, Cl, Br, I) : Желтый цвет WO 2 Cl 2 разлагается при температуре выше 200 °C с образованием WO 3 красного цвета и WO 3 .
Известны также петагалогениды металлического вольфрама. Желтый галогенид, такой как WF 5 образуется путем восстановления WF 6 при температуре от 500 до 800 °C. При температуре выше 30 °C желтое твердое вещество представляет собой непропорциональную реакцию между WF 4 и WF 6 .
При температуре выше 30 °C желтое твердое вещество представляет собой непропорциональную реакцию между WF 4 и WF 6 .
Тетрафторид металла образуется восстановлением гексафторида бензолом или другими углеводородами. Это нелетучее красно-коричневое химическое соединение.
Кластеры галогенидов
Нижняя степень окисления вольфрама нестабильна и сильно восстанавливается по своей природе. Металл образует только WCl 3 и WBr 3 в степени окисления +3. Вольфрам (II) совершенно нестабилен.
Комплексный галогенид W (II) относится к типу W 6 X 12 (где X = хлор, бром, йод). Он образует кластерные соединения, такие как (W 6 X 8 ) +4 X 4 — . Нулевая степень окисления наблюдается в карбонильных комплексах типа W(CO) 6 .
Аналитические реакции
Присоединение соляной кислоты к вольфрамату, гидратированная вольфрамовая кислота осаждается. При нагревании белый обрыв вольфрамовой кислоты желтеет. В этом можно убедиться, нагревая осадок с Zn и HCl или SnCl 9 .0015 2 при образовании синего осадка.
При нагревании белый обрыв вольфрамовой кислоты желтеет. В этом можно убедиться, нагревая осадок с Zn и HCl или SnCl 9 .0015 2 при образовании синего осадка.
Вольфраматы осаждают в виде бензидинового вольфрамата из разбавленной 0,1 н. серной кислоты. Осадок прокаливают до WO 3 и взвешивают. При рН от 7 до 8 вольфраматы могут осаждаться в виде BaWO 4 .
Для чего используется вольфрам?
- Чистый металлический вольфрам используется для изготовления нитей накала электрических ламп или ламп накаливания старого образца и антикатодов в рентгеновских трубках.
- Вольфрам является важным легирующим металлом для высокоскоростных инструментов из-за его твердости. Он образует несколько очень твердых сплавов, таких как спутник (кобальт, хром и вольфрам) и видия (WC + 10 процентов меди).
- Сульфид соединения W (IV) используется в высокотемпературных смазочных материалах, а вольфраматы кальция/магния широко используются в флуоресцентном освещении.

- Форма оксида, подобная WO 3 , используется в качестве химического катализатора на электростанциях. Он превращает оксид азота в азот и воду в присутствии аммиака.
- Благодаря своей твердости карбид вольфрама (WC) является важным карбидом металла для горнодобывающей и нефтяной промышленности. Используется для изготовления различных видов быстрорежущих режущих инструментов. Его можно приготовить путем смешивания порошка вольфрама и порошка углерода при температуре 2200 ° C.
Биологическая роль вольфрама
Вольфрам — единственный элемент третьего переходного ряда, функционирующий в биологической системе. Белок, содержащий металл, встречается редко и в основном встречается у термофильных анаэробов.
Вольфрам также встречается в нескольких ферментах с молибденом. Механизм биологической функции металлического вольфрама в ферментах заключается в оксо-переносе W (VI) на субстрат.
Темы химии
Вольфрам
Зона данных | Открытие | Факты | Внешний вид и характеристики | Использование | Изобилие и изотопы | Каталожные номера
74
W
183,8
Химический элемент вольфрам относится к переходным металлам. Он был открыт в 1779 году Питером Вульфом.
Он был открыт в 1779 году Питером Вульфом.
Зона данных
| Классификация: | Вольфрам является переходным металлом |
| Цвет: | серебристо-белый |
| Атомный вес: | 183,84 |
| Состояние: | твердый |
| Температура плавления: | 3422 или С, 3695 К |
| Точка кипения: | 5550 или С, 5823 К |
| Электроны: | 74 |
| Протоны: | 74 |
| Нейтроны в наиболее распространенном изотопе: | 110 |
| Электронные оболочки: | 2,8,18,32,12,2 |
| Электронная конфигурация: | [Xe] 4f 14 5d 4 6s 2 |
| Плотность @ 20 или C: | 19,3 г/см 3 |
Реакции, Соединения, Радиусы, Проводимости»>Показать больше, в том числе: Теплота, Энергия, Окисление,
Реакции, Соединения, Радиусы, Проводимости
| Атомный объем: | 9,53 см 3 /моль |
| Структура: | bcc: объемно-центрированная кубическая |
| Твердость: | 7,5 мес. |
| Удельная теплоемкость | 0,13 Дж г -1 К -1 |
| Теплота плавления | 35,40 кДж моль -1 |
| Теплота распыления | 860 кДж моль -1 |
| Теплота парообразования | 824,0 кДж моль -1 |
| 1 ст энергия ионизации | 770 кДж моль -1 |
| 2 nd энергия ионизации | 1700 кДж моль -1 |
| 3 rd энергия ионизации | – |
| Сродство к электрону | 78,6 кДж моль -1 |
| Минимальная степень окисления | -2 |
| Мин. общее окисление нет. | 0 |
| Максимальная степень окисления | 6 |
| Макс. общее окисление нет. | 6 |
| Электроотрицательность (шкала Полинга) | 2,36 |
| Объем поляризуемости | 11,1 Å 3 |
| Реакция с воздухом | Вт/Вт, ⇒ WO 3 |
| Реакция с 15 M HNO 3 | нет |
| Реакция с 6 М HCl | нет |
| Реакция с 6 М раствором NaOH | – |
| Оксид(ы) | WO 2 , WO 3 (оксид вольфрама) |
| Гидрид(ы) | – |
| Хлорид(ы) | ВКл 2 , ВКл 4 , ВКл 6 |
| Атомный радиус | 139вечера |
| Ионный радиус (1+ ион) | – |
| Ионный радиус (2+ ион) | – |
| Ионный радиус (3+ ион) | – |
| Ионный радиус (1-ион) | – |
| Ионный радиус (2-ионный) | – |
| Ионный радиус (3-ионный) | – |
| Теплопроводность | 173 Вт м -1 К -1 |
| Электропроводность | 18,2 x 10 6 S m -1 |
| Температура замерзания/плавления: | 3422 или С, 3695 К |
Открытие вольфрама
В 1779 году ирландский химик Питер Вульф сделал вывод о существовании нового элемента – вольфрама – на основании анализа минерала вольфрамита (железо-марганцевого вольфрамата).
Вольфрам был выделен в виде оксида вольфрама (WO 3 ) в 1781 году в Швеции Карлом В. Шееле из минерала шеелита (вольфрамата кальция). Однако у него не было подходящей печи для восстановления оксида до металла.
Вольфрам был окончательно выделен братьями Фаусто и Хуаном Хосе де Эльхуяр в 1783 году в Испании путем восстановления подкисленного вольфрамита древесным углем.
Название элемента происходит от шведских слов «tung sten», означающих тяжелый камень.
Химический символ W происходит от первоначального названия элемента Вольфрам.
Вольфрам является одним из пяти основных тугоплавких металлов (металлы с очень высокой термостойкостью и износостойкостью).
Пять тугоплавких металлов – обратите внимание на их близкое родство в периодической таблице
Другими тугоплавкими металлами являются ниобий, молибден, тантал и рений.
Металлический вольфрам. Фото Томихандорфа.
Телескоп большой площади (LAT) исследует космические лучи, отслеживая электроны и позитроны, которые они производят после столкновения со слоями вольфрама. Предоставлено: НАСА/Лаборатория концептуальных изображений Центра космических полетов имени Годдарда.
Предоставлено: НАСА/Лаборатория концептуальных изображений Центра космических полетов имени Годдарда.
Галогенная лампа, более известная как вольфрамовая галогенная лампа.
Внешний вид и характеристики
Вредное воздействие:
Вольфрам считается малотоксичным.
Характеристики:
Вольфрам – очень твердый, плотный, серебристо-белый, блестящий металл, который на воздухе тускнеет, образуя защитное оксидное покрытие. В виде порошка вольфрам имеет серый цвет.
Металл имеет самую высокую температуру плавления из всех металлов, а при температуре свыше 1650 o C также имеет самую высокую прочность на растяжение. Чистый вольфрам пластичен, а вольфрамовые проволоки даже очень малого диаметра обладают очень высокой прочностью на растяжение.
Вольфрам обладает высокой устойчивостью к коррозии. Он образует вольфрамовую кислоту (H 2 WO 4 ) или вольфрамовую кислоту из гидратированного оксида (WO 3 ), а ее соли называются вольфраматами, или вольфраматы.
Он образует вольфрамовую кислоту (H 2 WO 4 ) или вольфрамовую кислоту из гидратированного оксида (WO 3 ), а ее соли называются вольфраматами, или вольфраматы.
В соединениях вольфрам существует в основном в степени окисления VI.
Использование вольфрама
Вольфрам и его сплавы широко используются для изготовления нитей накала в электрических лампах и электронных лампах старого типа (не энергосберегающих).
Вольфрам также используется в качестве нити накала в галогенных вольфрамовых лампах. В этих лампах используются галогены, такие как бром и йод, чтобы предотвратить разрушение вольфрамовой нити накала, и поэтому они более энергоэффективны, чем стандартные лампы накаливания.
Быстрорежущая сталь (которая позволяет резать материал на более высоких скоростях, чем углеродистая сталь) содержит до 18% вольфрама.
Вольфрам используется в сплавах тяжелых металлов из-за его твердости и в высокотемпературных применениях, таких как сварка.
Карбид вольфрама (WC или W 2 C) очень твердый и используется для изготовления сверл. Он также используется для ювелирных изделий из-за его твердости и износостойкости.
Изобилие и изотопы
Изобилие в земной коре: 1,25 частей на миллион по весу, 0,1 частей на миллион по молям
Содержимое Солнечной системы: 4 части на миллиард по весу, 30 частей на триллион по молям
Стоимость в чистом виде: 11 долларов США за 100 г
Стоимость, оптом: 2,95 доллара США за 100 г
Источник: Вольфрам не встречается в природе в свободном виде. Основными рудами вольфрама являются вольфрамит (вольфрамат железа и марганца) и шеелит (вольфрамат кальция, CaWO 3 ). В промышленных масштабах металл получают восстановлением оксида вольфрама водородом или углеродом.
Изотопы: Вольфрам имеет 33 изотопа, периоды полураспада которых известны с массовыми числами от 158 до 190. Встречающийся в природе вольфрам представляет собой смесь пяти изотопов, и они находятся в указанных процентах: 180 Вт (0,1%), 182 Вт (26,5%), 183 Вт (14,3%), 184 Вт (30,6%) и 186 Вт (28,4%).