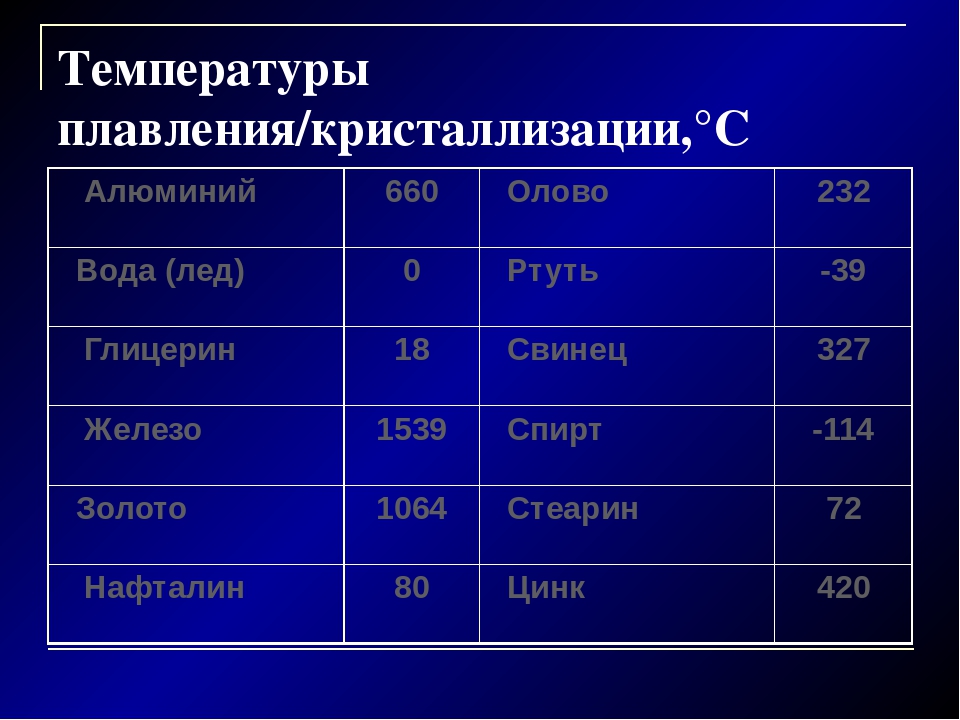
Металлы Температуры плавления Таблицы — Энциклопедия по машиностроению XXL
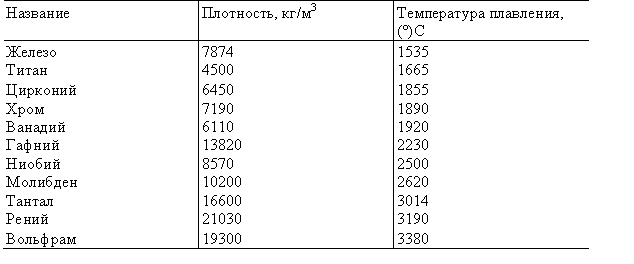
Периодическая зависимость от атомного номера замечена и для многих физических свойств. Так, температуры плавления низки у всех щелочных металлов (300—400 К), растут постепенно при повышении атомного номера внутри каждого периода таблицы Менделеева, достигают максимума (2500—3000 К) в области V6 и VI6 подгрупп и далее постепенно убывают. [c.99]
В табл. 3 приведены величины давления паров и скоростей испарения различных металлов, вычисленные по уравнению (7). Кроме того, в этой же таблице даны значения температур плавления материалов и соответствующие им давления паров металлов. Данные табл. 3 позволяют определять 24 примерные режимы выявления строения металлов при испарении в вакууме. [c.24]
Согласно экспериментальным данным авторов, между температурой перегрева, вязкостью и плотностью жидких металлов в интервале температур плавления — кипения (испарения) существует определенная связь.
Металл Группа В таблице Менделеева Поверхностное натяжение поверхностная энергия) вблизи температуры плавления, эрг-см Температура кипения, С
Да и ме о растворимости кислорода в металлах, входяш,их в состав высокотемпературных припоев, приведены в табл. 4. Из таблицы видно, что кислород особенно интенсивно растворяется в расплавленных олове и меди. При охлаждении расплава меди растворенный кислород переходит в окислы. При содержании 0,39 % Оз по массе образуется эвтектика медь — кислород с температурой плавления ЮбВ С. [c.26]
[c.26]
Бериллий [7, 51, 224]—легкий серебристый металл. Его атомный вес 9,01, порядковый номер в таблице Менделеева— 4, Плотность бериллия 1,85 г/см , т.е. заметно меньше, чем у алюминия (2,7 г/см ), и близок к магнию (1,74 г/см ). Бериллий распространен в земной коре гораздо меньше, чем алюминий и магний (7,51 % А1, 1,94%, Mg, 0,0005 % Be). Вследствие довольно сложной его переработки, бериллий является пока еще относительно дорогим металлом, хотя уже в заметных количествах производится промышленностью. Применению металлического бериллия в технике способствует особое сочетание его физических и химических свойств. Бериллий имеет высокую-температуру плавления (1284 °С) и значительные прочностные (0в==6ОО—650 МПа) и упругие свойства (модуль, упругости = 28000- 37000 МПа).
Предполагая далее, что самодиффузии в вольфраме протекает по вакансионному механизму, энергию миграции вакансий ] оценили исходя из известной величины энергии активации самодиффузии QвD [Ю] (см.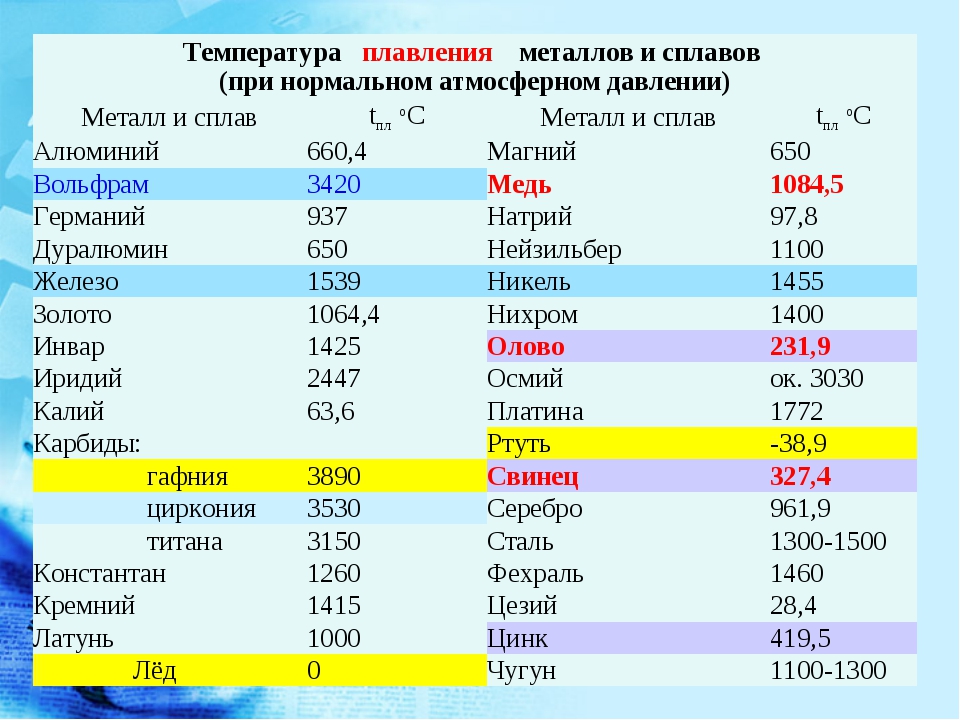
Эта работа и была проделана автором. В процессе работы были отобраны наиболее надежные данные по температурам плавления. металлов, абсолютным значениям энтропий твердых и жидких металлов, по величине энтальпии жидких металлов и на основе точного расчета равновесия [38, 40]составлена таблица термодинамических характеристик процессов плавления веществ (см. табл. У-1). В эту таблицу включены энтальпии и энтропии процессов плавления, а также уравнения логарифмов констант равновесия процессов плавления. Приведенные в табл. V- уравнения могут быть использованы как для приближенных, так и для точных расчетов равновесия. Первые два члена каждого уравнения отвечают значению 1 /(, соответствующему приближенному расчету. Вторые два члена уравнения соответствуют поправке к приближенному значению /( на изменение теплоемкостей веществ.
табл. У-1). В эту таблицу включены энтальпии и энтропии процессов плавления, а также уравнения логарифмов констант равновесия процессов плавления. Приведенные в табл. V- уравнения могут быть использованы как для приближенных, так и для точных расчетов равновесия. Первые два члена каждого уравнения отвечают значению 1 /(, соответствующему приближенному расчету. Вторые два члена уравнения соответствуют поправке к приближенному значению /( на изменение теплоемкостей веществ.
В электротермии из тугоплавких металлов применяются в основном вольфрам, молибден, тантал и ниобий. Эти металлы, относящиеся к элементам V и VI групп таблицы Менделеева, мономорфны, имеют объемно центрированную кубическую кристаллическую решетку с высокой прочностью межатомной связи, следствием чего являются высокие значения температуры плавления и механической прочности.
ТАБЛИЦА 18. СРЕДНИЕ ТЕМПЕРАТУРЫ ПЛАВЛЕНИЯ И СКРЫТАЯ ТЕПЛОТА ПЛАВЛЕНИЯ НЕКОТОРЫХ МЕТАЛЛОВ
[c.22]
СРЕДНИЕ ТЕМПЕРАТУРЫ ПЛАВЛЕНИЯ И СКРЫТАЯ ТЕПЛОТА ПЛАВЛЕНИЯ НЕКОТОРЫХ МЕТАЛЛОВ
[c.22]
Газовую сварку никеля можно вести и без флюса, однако результаты будут хуже. Флюс должен иметь более низкую температуру плавления, чем основной металл, и улучшать жидкотекучесть жидкой ванны. При газовой сварке никеля применяются многокомпонентные флюсы, составы их (в процентах) приведены в таблице.
Как видно из таблицы, при температуре плавления происходит резкое изменение растворимости водорода, которое для различных металлов можно характеризовать отнощением объемов водорода, растворенного в жидком металле, к объему водорода, растворенного в твердом металле [c.331]
При установке режима сварки пользуются таблицами режимов, которые разработаны для основных групп металлов, встречающихся на практике. Если необходимо сваривать новый металл, то, зная его основные свойства (электропроводимость, теплопроводность, жаропрочность, температуру плавления), всегда можно найти группу металлов с близкими свойствами (см.
Таблица П1.11 Химический состав проволоки и наплавленного металла для различных электродных покрытий, содержащих окислы с разными температурами плавления и сродством металла к кислороду
Алюминий и его сплавы широко применяются в промышленности. Окисная пленка (А1 0з) с температурой плавления свыше 2000°С, образующаяся при сварке на поверхности сварочной ванны, затрудняет плавление металла и сплавление свариваемых кромок, тем самым снижая прочностные свойства сварного шва. Частично оксидную пленку удаляют с металла путем химического травления в процессе подготовки изделия под сварку, частично за счет применения флюсов. Состав флюсов для газовой сварки алюминия, его сплавов и алюминиевых бронз приведен в таблице 2.16.
[c.116]
Состав флюсов для газовой сварки алюминия, его сплавов и алюминиевых бронз приведен в таблице 2.16.
[c.116]
При сварке плавлением неравномерное распределение температур приводит к возникновению неравномерной пластической деформации по завершении нагрева (рис. 3). При этом в жидком металле сварочной ванны 1 деформации отсут-Таблица I. Основные виды сварки
Характеристики материалов, которые могут быть использованы для покрытия излучателей, приведены в табл. 7.10. Нижняя температура 562° С соответствует температуре внешней оболочки космического корабля, а верхняя температура 1250° С относится к радиатору сбросного тепла преобразователя энергии [11]. Как видно из таблицы, для излучения тепла при низких температурах (500— 600° С) подходящими материалами являются порошок двуокиси титана, плавленая окись кремния, белая эпоксидная краска и стекло, напыленное на алюминий. Для высоких температур могут быть использованы черные покрытия в виде анодированных металлов, имеющих высокий коэффициент излучения.
Имеющиеся данные о физических свойствах жидких металлов крайне ограничены. Значения, приводимые в таблицах, основаны на данных, почерпнутых из различных источников. Во всех случаях, температуры были выше точки плавления металла, но в ряде [c.305]
Данные табл. V-2 могут использоваться либо для непосредственного определения при любых температурах значений lgi( и AZ процессов расплавления веществ, либо для расчетов равновесия реакций взаимодействия жидких металлов с другими веществами. С помощью данных этой таблицы были выведены точные уравнения зависимости Ig/ от температуры для процессов плавления металлов (см. табл. V-1).
Таблица может служить дополнением к ранее изданным вспомогательным таблицам автора. С ее помощью возможно быстрое определение численных значений Ig/ и AZ при различных температурах для процессов плавления любых металлов и процессов взаимодействия расплавленных металлов с другими веществами или соединениями.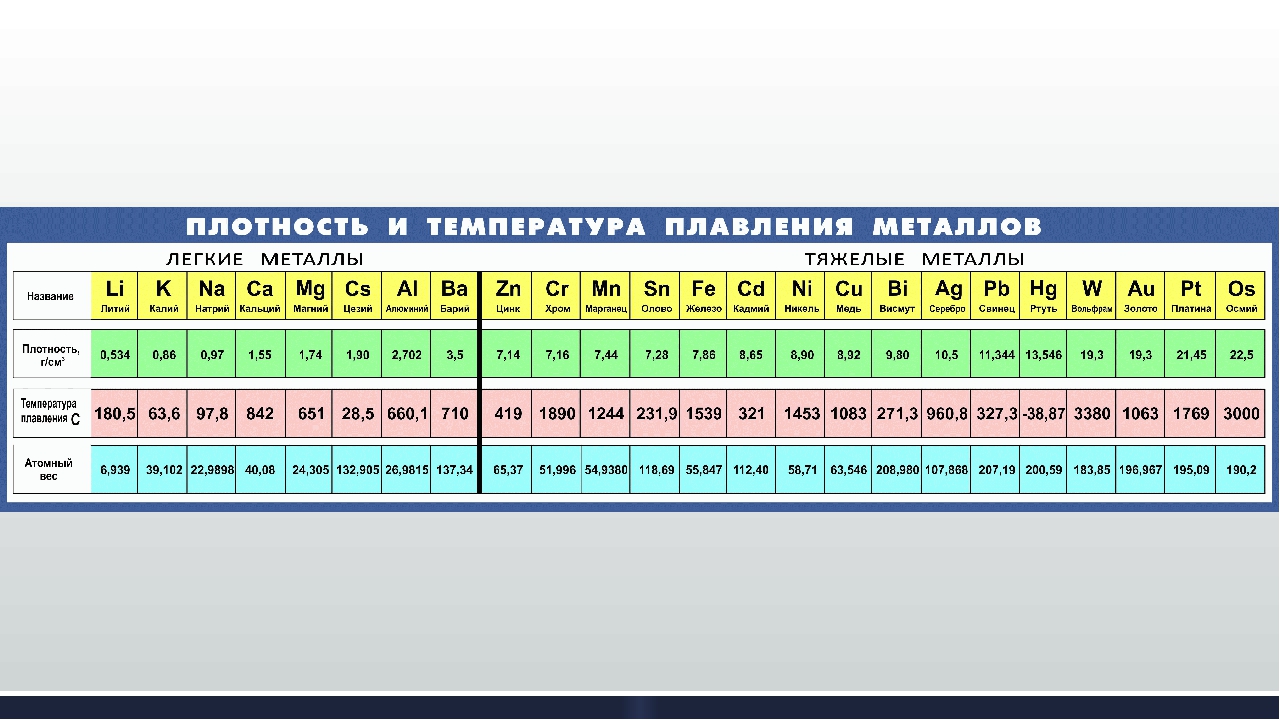 [c.167]
[c.167]
В табл. 12 представлены основные характеристики некоторых металлов и их окислов, сульфидов, хлоридов [16]. Как видно из данных этой таблицы, окисные пленки большинства металлов, которые можно рассматривать как продукты хемосорбции кислорода, обладают более высокой механической прочностью, чем сами металлы. Температура плавления окислов, их плотность, термодинамические показатели, энергия связи ( в), как правило, превышают соответствующие данные для чистых металлов. Сульфиды металлов и их фосфорсодержащие соединения менее тугоплавки и прочны, чем их кислородные аналоги. С этим связана одна из главных причин применения противоизносных и противозадирных серофосфорсодержащих присадок [75—78, 85]. Галоидные пленки тяжелых металлов удовлетворяют всем требованиям граничной смазки их температура плавления и механическая прочность значительно ниже, чем для чистых металлов, и в то же время достаточно высоки, чтобы противостоять высоким нагрузкам и температурам в условиях граничного трения. Хлорсодержащие маслорастворимые ПАВ также являются распространенным классом присадок к трансмиссионным и гипоидным маслам [85]. Особый интерес представляют кислородные соединения бора (бораты). Окислы бора в отличие от самого бора и окислов других металлов легкоплавки тем пература плавления бора 20 75°С, его окисла (В2О3) —450 °С. Это предопределяет -использование солей борных кислот в качестве присадок к моторным и трансмиссионным маслам, а также к смазочно-охлаждающим жидкостям. Так, значительное распространение получили борсодержащие алкенилсукцинимидные присадки и борсодержащие основания Манниха
[c.60]
Хлорсодержащие маслорастворимые ПАВ также являются распространенным классом присадок к трансмиссионным и гипоидным маслам [85]. Особый интерес представляют кислородные соединения бора (бораты). Окислы бора в отличие от самого бора и окислов других металлов легкоплавки тем пература плавления бора 20 75°С, его окисла (В2О3) —450 °С. Это предопределяет -использование солей борных кислот в качестве присадок к моторным и трансмиссионным маслам, а также к смазочно-охлаждающим жидкостям. Так, значительное распространение получили борсодержащие алкенилсукцинимидные присадки и борсодержащие основания Манниха
[c.60]
Большое влияние на загрязнение и коррозию поверхностей нагрева котла оказывает температура плавления соединений ванадия с натрием. В табл. 1.4 приведена температура плавления некоторых ванадиевых соединений, наиболее часто встречающихся на поверхностях нагрева котла и влияющих на коррозию металла.
 Из таблицы видно, что температура плавления разнотипных натрий-ванадиевых соединений является относительно низкой. Также низкую температуру плавления имеет и пентаксид ванадия, в сравнении с три- и тетраоксидом.
[c.36]
Из таблицы видно, что температура плавления разнотипных натрий-ванадиевых соединений является относительно низкой. Также низкую температуру плавления имеет и пентаксид ванадия, в сравнении с три- и тетраоксидом.
[c.36]Данные таблицы показывают, что при равной скорости движения металла влияние частоты на р и ДТр чрезвычайно велико. При необходимости создать значительный перегрев ядра расплава над температурой плавления последнего желательно использовать относительно низкие частоты в сочетании с мерами по ограничению циркуляции. Заметим попутно, что в однофазной индукционной печи при одинаковом конструктивном решении скорость движения металла растет с увеличением частоты, пока параметр о = г /21Аэ 6=9, и снижается при дальнейшем повьппении частоты [18]. [c.16]
Монтаж микрошлифов. Микрошлифы неправильной формы или с размерами меньше 10 мм в поперечнике, а также порошки заливаются в оправки (фиг. 3). Материалом для заливки служит легкоплавкий сплав с температурой плавления, не вызывающей изменения в структуре металла. В табл 1 приведены материалы, применяемые для заливки образцов. Кроме указанных в таблице применяются также бакелит и ре-зиноид (первая сушка при 60°, вторая при 120°) и канадский бальзам (застывает при комнатной температуре).
[c.137]
В табл 1 приведены материалы, применяемые для заливки образцов. Кроме указанных в таблице применяются также бакелит и ре-зиноид (первая сушка при 60°, вторая при 120°) и канадский бальзам (застывает при комнатной температуре).
[c.137]
Многие физические свойства тугоплавких металлов тесно связаны с нх положением в периодической системе Менделеева. На рис. IV. 59 для примера приведены температуры плавления переходных металлов в трех длинных периодах в зависимости от их положе-ния в таблице Менделеева. Отчетливо видно, что в каждом nepuo i. температура плавления вначале повышается и достигает максимального значения для металлов подгруппы VIA, а далее падает. Температура плавления тесно связана с силами междуатомной связи в металлах, хотя и не является мерой их величины, и, следовательно, для [c.464]
В табл. 10-3 [Л. 12] приведены значения рабочих температур То и скор остей спарения М для ряда чистых металлов, работающих при температуре, обеспечивающих одно и то же значение удельной электронной эмиссии, равное / = 3 а/сж .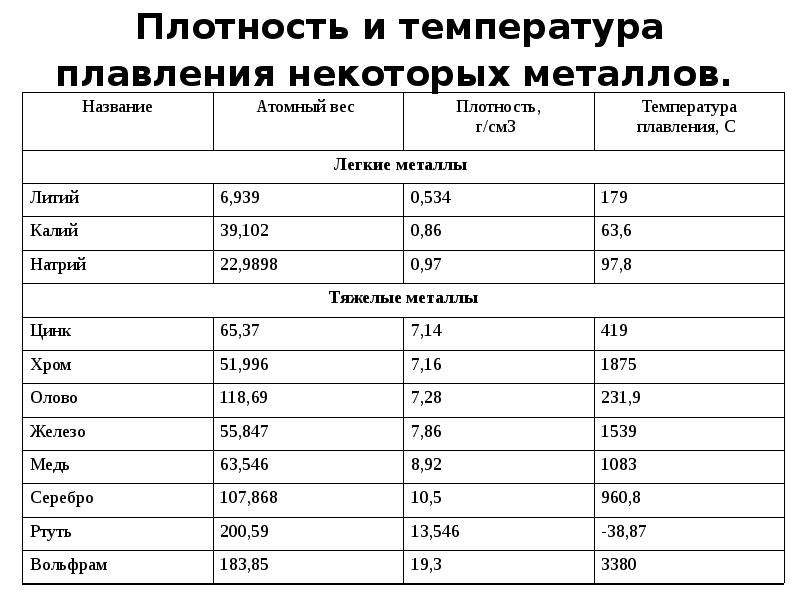 В этой же таблице даны значения температуры плавления Т , отношение То1Т и работы выхода [c.216]
В этой же таблице даны значения температуры плавления Т , отношение То1Т и работы выхода [c.216]
Алюминий очень распространен в природе его содержание в земной коре составляет 8,8%. Чистый алюминий — металл серебристобелого цвета с температурой плавления 660° и удельным весом 2,7. Порядковый номер алюминия в периодической таблице Менделеева 13. Алюминий имеет гранецентрированную кубическую решетку (К 2) с параметром 4,04 А. Аллотропических превращений алюминий не имеет. [c.228]
Титан — один из наиболее распространенных в природе металлов, его содержание в земной коре равно 0,6%. Чистый титан — металл белого цвета, имеющий температуру плавления 1680° и удельный вес 4,5. Порядковый номер титана в периодической таблице Менделеева 22. Титан имеет две модификации — а и р. До 882° титан существует в а-модификации и имеет плотноупакованную гексагональную решетку (Г12), а выше 882° в модификации р, имеющей объемноцентрированную кубическую решетку (К8).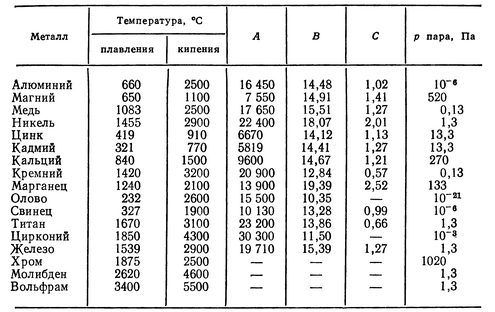 Степень гексагональности решетки титана равна 1,587.
[c.235]
Степень гексагональности решетки титана равна 1,587.
[c.235]
При выборе значений параметров режима и закона их изменения в процессе сварки следует исходить из необходимости создания условий для интенсивной радиально направленной пластической деформации металла рельефа (без его перегрева и выплеска или преждевременного смятия) с одновременным нагревом зоны сварочного контакта до температуры, близкой к температуре плавления, с последующим после осадки рельефа образованием литого ядра. Для вьшолнения этих условий рекомендуется использовать циклограмму процесса с постоянной силой сжатия (см. табл. 5.6, п. 1) при сварке тонколистового металла. Для сварки больших толщин (3,5…6 мм) применяют циклограмму с повьш1енной силой проковки (п. 2 той же таблицы), что позволяет уменьшить зазоры между деталями и уплотнить литое ядро. Для борьбы с вьшлесками рельефную сварку осуществляют модулированными импульсами тока (см. рис. 5.19, б) с длительностью нарастания = (0,2…0,3) св, при этом начальное значение тока /св. н = (0,3…0,5)/св. Для сварки больших толщин можно использовать двухимпульсный режим нагрева (см. табл. 5.6, п. 5). Первый (подогревный) импульс тока применяют для выравнивания высоты рельефов [/под = (0,6…0,7)/св], второй (сварочный) желательно с плавным нарастанием для предупреждения выплесков. Предпочтительны режимы средней жесткости с модуляцией тока, что особенно важно при большом числе одновременно свариваемых рельефов.
[c.337]
н = (0,3…0,5)/св. Для сварки больших толщин можно использовать двухимпульсный режим нагрева (см. табл. 5.6, п. 5). Первый (подогревный) импульс тока применяют для выравнивания высоты рельефов [/под = (0,6…0,7)/св], второй (сварочный) желательно с плавным нарастанием для предупреждения выплесков. Предпочтительны режимы средней жесткости с модуляцией тока, что особенно важно при большом числе одновременно свариваемых рельефов.
[c.337]
Теплоемкость измеряется в кал/г °С в физической системе единиц и в вт-сек1г°С — в электрической. В табл. 3 приведены значения теплопроводности и теплоемкости при комнатной температуре, а также удельные веса и температуры плавления для некоторых металлов и сплавов, с которыми наиболее часто приходится встречаться при контактной сварке. В этой же таблице даны значения коэфициента температуропроводности, характеризующего скорость распространения температуры в неравномерно нагретом теле. Коэфициент температуропроводности равен а = — и измеряется в с. ч 1сек. Как видно
[c.29]
ч 1сек. Как видно
[c.29]
Высокая температура плавления окисла легирующего компонента этот окисел не долокен образовывать легкоплавких эвтектик с другими окислами компонентов сплава. Эти условия необходимы для того, чтобы окисел легирующего компонента находился на поверхности сплава при повышенных температурах в твердом состоянии. В качестве примера можно привести элемент бор, который является аналогом А1 по менделеевской таблице, но дает легкоплавкие окислы. Температура плавле-ния В2О3 294°, и поэтому бор, в отличие от алюминия, согласно вышеизложенному, не может являться компонентом, повышающим жаро стойкость. Это связано с тем, что в жидких (расплавленных) окисных пленках, помимо гораздо больших скоростей диффузии ионов и атомов, возможен также и эффективный конвекционный перенос вещества. Не исключается также протекание газовой коррозии металлов под жидкими пленками расплавленных окислов с принципиально другим — электрохимическим — механизмом, как это, например, имеет место при коррозии металлов в расплавах солей [19]. [c.92]
[c.92]
Температуры и энтальпии правращений, а также абсолютные значения энтропий почти для всех металлов и неметаллов уже определены. Р1сключение составляет вольфрам, бериллий и полоний, для которых неизвестны энтальпии превращений альфа- в бета-модификацию-и плутоний, для которого неизвестна скрытая теплота плавления. Данные для этих металлов в связи с вышесказанным в таблицы настояп1ей главы не включены. [c.118]
Температура плавления и плотности металлов таблица
В таблице представлена температура плавления металлов tпл, их температура кипения tк при атмосферном давлении, плотность металлов ρ при 25°С и теплопроводность λ при 27°С.
Температура плавления металлов, а также их плотность и теплопроводность приведены в таблице для следующих металлов: актиний Ac, серебро Ag, алюминий Al, золото Au, барий Ba, берилий Be, висмут Bi, кальций Ca, кадмий Cd, кобальт Co, хром Cr, цезий Cs, медь Cu, железо Fe, галлий Ga, гафний Hf, ртуть Hg, индий In, иридий Ir, калий K, литий Li, магний Mg, марганец Mn, молибден Mo, натрий Na, ниобий Nb, никель Ni, нептуний Np, осмий Os, протактиний Pa, свинец Pb, палладий Pd, полоний Po, платина Pt, плутоний Pu, радий Ra, рубидий Pb, рений Re, родий Rh, рутений Ru, сурьма Sb, олово Sn, стронций Sr, тантал Ta, технеций Tc, торий Th, титан Ti, таллий Tl, уран U, ванадий V, вольфрам W, цинк Zn, цирконий Zr.
По данным таблицы видно, что температура плавления металлов изменяется в широком диапазоне (от -38,83°С у ртути до 3422°С у вольфрама). Низкой положительной температурой плавления обладают такие металлы, как литий (18,05°С), цезий (28,44°С), рубидий (39,3°С) и другие щелочные металлы.
Наиболее тугоплавкими являются следующие металлы: гафний, иридий, молибден, ниобий, осмий, рений, рутений, тантал, технеций, вольфрам. Температура плавления этих металлов выше 2000°С.
Приведем примеры температуры плавления металлов, широко применяемых в промышленности и в быту:
- температура плавления алюминия 660,32 °С;
- температура плавления меди 1084,62 °С;
- температура плавления свинца 327,46 °С;
- температура плавления золота 1064,18 °С;
- температура плавления олова 231,93 °С;
- температура плавления серебра 961,78 °С;
- температура плавления ртути -38,83°С.
Максимальной температурой кипения из металлов, представленных в таблице, обладает рений Re — она составляет 5596°С. Также высокими температурами кипения обладают металлы, относящиеся к группе с высокой температурой плавления.
Также высокими температурами кипения обладают металлы, относящиеся к группе с высокой температурой плавления.
Плотность металлов в таблице находится в диапазоне от 0,534 до 22,59 г/см 3 , то есть самым легким металлом является литий, а самым тяжелым металлом осмий. Следует отметить, что осмий имеет плотность большую, чем плотность урана и даже плутония при комнатной температуре.
Теплопроводность металлов в таблице изменяется от 6,3 до 427 Вт/(м·град), таким образом хуже всего проводит тепло такой металл, как нептуний, а лучшим теплопроводящим металлом является серебро.
Температура плавления стали
Представлена таблица значений температуры плавления стали распространенных марок. Рассмотрены стали для отливок, конструкционные, жаропрочные, углеродистые и другие классы сталей.
Температура плавления стали находится в диапазоне от 1350 до 1535°С. Стали в таблице расположены в порядке возрастания их температуры плавления.
| Сталь | tпл, °С | Сталь | tпл, °С |
|---|---|---|---|
| Стали для отливок Х28Л и Х34Л | 1350 | Коррозионно-стойкая жаропрочная 12Х18Н9Т | 1425 |
| Сталь конструкционная 12Х18Н10Т | 1400 | Жаропрочная высоколегированная 20Х23Н13 | 1440 |
| Жаропрочная высоколегированная 20Х20Н14С2 | 1400 | Жаропрочная высоколегированная 40Х10С2М | 1480 |
| Жаропрочная высоколегированная 20Х25Н20С2 | 1400 | Сталь коррозионно-стойкая Х25С3Н (ЭИ261) | 1480 |
| Сталь конструкционная 12Х18Н10 | 1410 | Жаропрочная высоколегированная 40Х9С2 (ЭСХ8) | 1480 |
| Коррозионно-стойкая жаропрочная 12Х18Н9 | 1410 | Коррозионно-стойкие обыкновенные 95Х18…15Х28 | 1500 |
| Сталь жаропрочная Х20Н35 | 1410 | Коррозионно-стойкая жаропрочная 15Х25Т (ЭИ439) | 1500 |
| Жаропрочная высоколегированная 20Х23Н18 (ЭИ417) | 1415 | Углеродистые стали | 1535 |
- Волков А.
 И., Жарский И. М. Большой химический справочник. — М: Советская школа, 2005. — 608 с.
И., Жарский И. М. Большой химический справочник. — М: Советская школа, 2005. — 608 с. - Казанцев Е. И. Промышленные печи. Справочное руководство для расчетов и проектирования.
- Физические величины. Справочник. А. П. Бабичев, Н. А. Бабушкина, А. М. Братковский и др.; Под ред. И. С. Григорьева, Е. З. Мейлихова. — М.: Энергоатомиздат, 1991. — 1232 с.
Каждый металл или сплав обладает уникальными свойствами, в число которых входит температура плавления. При этом объект переходит из одного состояния в другое, в конкретном случае становится из твёрдого жидким. Чтобы его расплавить, необходимо подвести к нему тепло и нагревать до достижения нужной температуры. В момент, когда достигается нужная точка температуры данного сплава, он ещё может остаться в твёрдом состоянии. При продолжении воздействия начинает плавиться.
Наиболее низкая температура плавления у ртути — она плавится даже при -39 °C, самая высокая у вольфрама — 3422 °C. Для сплавов (стали и других) определить точную цифру крайне сложно. Все зависит от соотношения компонентов в них. У сплавов она записывается как числовой промежуток.
Все зависит от соотношения компонентов в них. У сплавов она записывается как числовой промежуток.
Как происходит процесс
Элементы, какими бы они ни были: золото, железо, чугун, сталь или любой другой — плавятся примерно одинаково. Это происходит при внешнем или внутреннем нагревании. Внешнее нагревание осуществляется в термической печи. Для внутреннего применяют резистивный нагрев, пропуская электрический ток или индукционный нагрев в электромагнитном поле высокой частоты. Воздействие при этом примерно одинаковое.
Когда происходит нагревание, усиливается амплитуда тепловых колебаний молекул. Появляются структурные дефекты решётки, сопровождаемые разрывом межатомных связей. Период разрушения решётки и скопления дефектов и называется плавлением.
В зависимости от градуса, при котором плавятся металлы, они разделяются на:
- легкоплавкие — до 600 °C: свинец, цинк, олово;
- среднеплавкие — от 600 °C до 1600 °C: золото, медь, алюминий, чугун, железо и большая часть всех элементов и соединений;
- тугоплавкие — от 1600 °C: хром, вольфрам, молибден, титан.

В зависимости от того, каков максимальный градус, подбирается и плавильный аппарат. Он должен быть тем прочнее, чем сильнее будет нагревание.
Вторая важная величина — градус кипения. Это параметр, при достижении которого начинается кипение жидкостей. Как правило, она в два раза выше градуса плавления. Эти величины прямо пропорциональны между собой и обычно их приводят при нормальном давлении.
Если давление увеличивается, величина плавления тоже увеличивается. Если давление уменьшается, то и она уменьшается.
Таблица характеристик
Металлы и сплавы — непременная основа для ковки, литейного производства, ювелирной продукции и многих других сфер производства. Чтобы не делал мастер (ювелирные украшения из золота, ограды из чугуна, ножи из стали или браслеты из меди), для правильной работы ему необходимо знать температуры, при которых плавится тот или иной элемент.
Чтобы узнать этот параметр, нужно обратиться к таблице. В таблице также можно найти и градус кипения.
В таблице также можно найти и градус кипения.
Среди наиболее часто применяемых в быту элементов показатели температуры плавления такие:
- алюминий — 660 °C;
- температура плавления меди — 1083 °C;
- температура плавления золота — 1063 °C;
- серебро — 960 °C;
- олово — 232 °C. Олово часто используют при пайке, так как температура работающего паяльника составляет как раз 250–400 градусов;
- свинец — 327 °C;
- температура плавления железо — 1539 °C;
- температура плавления стали (сплав железа и углерода) — от 1300 °C до 1500 °C. Она колеблется в зависимости от насыщенности стали компонентами;
- температура плавления чугуна (также сплав железа и углерода) — от 1100 °C до 1300 °C;
- ртуть — -38,9 °C.
Как понятно из этой части таблицы, самый легкоплавкий металл — ртуть, которая при плюсовых температурах уже находится в жидком состоянии.
Градус кипения всех этих элементов почти вдвое, а иногда и ещё выше градуса плавления. Например, у золота он 2660 °C, у алюминия — 2519 °C, у железа — 2900 °C, у меди — 2580 °C, у ртути — 356,73 °C.
Например, у золота он 2660 °C, у алюминия — 2519 °C, у железа — 2900 °C, у меди — 2580 °C, у ртути — 356,73 °C.
У сплавов типа стали, чугуна и прочих металлов расчёт примерно такой же и зависит от соотношения компонентов в сплаве.
Максимальная температура кипения у металлов — у рения — 5596 °C. Наибольшая температура кипения — у наиболее тугоплавящихся материалов.
Бывают таблицы, в которых также указана плотность металлов. Самым лёгким металлом является литий, самым тяжёлым — осмий. У осмия плотность выше, чем у урана и плутония, если рассматривать её при комнатной температуре. К лёгким металлам относятся: магний, алюминий, титан. К тяжёлым относится большинство распространённых металлов: железо, медь, цинк, олово и многие другие. Последняя группа — очень тяжёлые металлы, к ним относятся: вольфрам, золото, свинец и другие.
Ещё один показатель, встречающийся в таблицах — это теплопроводность металлов.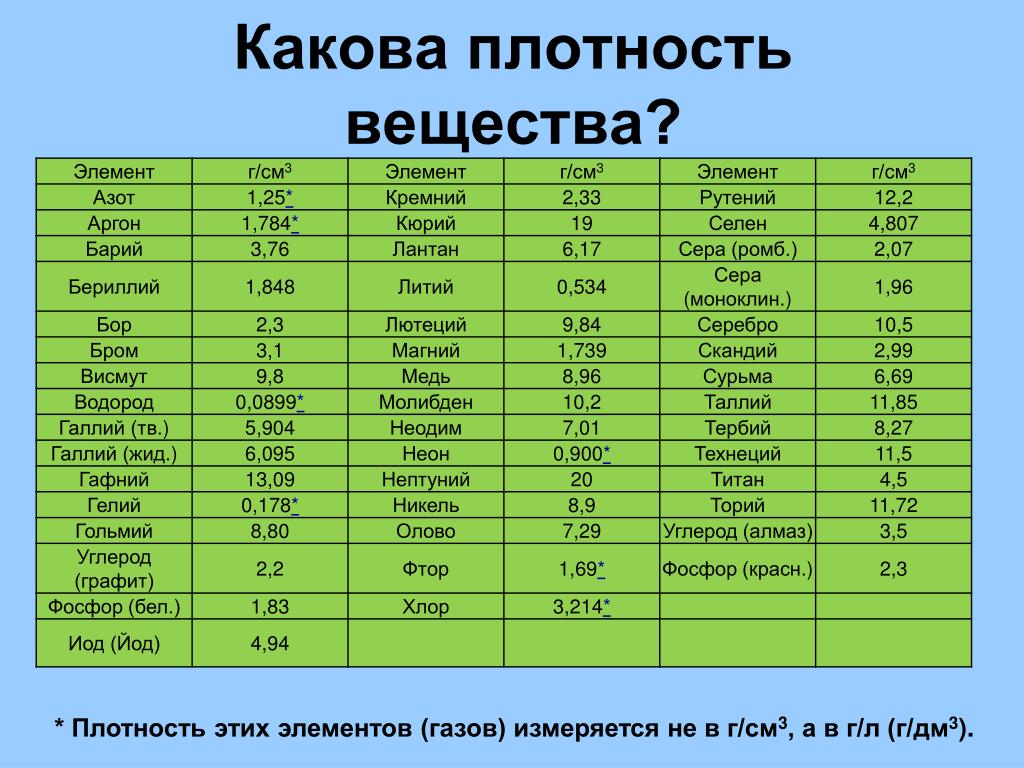 Хуже всего тепло проводит нептуний, а лучший по теплопроводности металл — серебро. Золото, сталь, железо, чугун и прочие элементы находится посередине между этими двумя крайностями. Чёткие характеристики для каждого можно найти в нужной таблице.
Хуже всего тепло проводит нептуний, а лучший по теплопроводности металл — серебро. Золото, сталь, железо, чугун и прочие элементы находится посередине между этими двумя крайностями. Чёткие характеристики для каждого можно найти в нужной таблице.
Каждый металл или сплав обладает уникальными свойствами, в число которых входит температура плавления. При этом объект переходит из одного состояния в другое, в конкретном случае становится из твёрдого жидким. Чтобы его расплавить, необходимо подвести к нему тепло и нагревать до достижения нужной температуры. В момент, когда достигается нужная точка температуры данного сплава, он ещё может остаться в твёрдом состоянии. При продолжении воздействия начинает плавиться.
Наиболее низкая температура плавления у ртути – она плавится даже при -39 °C, самая высокая у вольфрама – 3422 °C. Для сплавов (стали и других) определить точную цифру крайне сложно. Все зависит от соотношения компонентов в них. У сплавов она записывается как числовой промежуток.
Как происходит процесс
Элементы, какими бы они ни были: золото, железо, чугун, сталь или любой другой – плавятся примерно одинаково. Это происходит при внешнем или внутреннем нагревании. Внешнее нагревание осуществляется в термической печи. Для внутреннего применяют резистивный нагрев, пропуская электрический ток или индукционный нагрев в электромагнитном поле высокой частоты . Воздействие при этом примерно одинаковое.
Когда происходит нагревание , усиливается амплитуда тепловых колебаний молекул. Появляются структурные дефекты решётки , сопровождаемые разрывом межатомных связей. Период разрушения решётки и скопления дефектов и называется плавлением.
В зависимости от градуса, при котором плавятся металлы, они разделяются на:
- легкоплавкие – до 600 °C: свинец, цинк, олово;
- среднеплавкие – от 600 °C до 1600 °C: золото, медь, алюминий, чугун, железо и большая часть всех элементов и соединений;
- тугоплавкие – от 1600 °C: хром, вольфрам, молибден, титан.

В зависимости от того, каков максимальный градус, подбирается и плавильный аппарат. Он должен быть тем прочнее, чем сильнее будет нагревание.
Вторая важная величина – градус кипения. Это параметр, при достижении которого начинается кипение жидкостей. Как правило, она в два раза выше градуса плавления. Эти величины прямо пропорциональны между собой и обычно их приводят при нормальном давлении.
Если давление увеличивается, величина плавления тоже увеличивается. Если давление уменьшается, то и она уменьшается.
Таблица характеристик
Металлы и сплавы – непременная основа для ковки , литейного производства, ювелирной продукции и многих других сфер производства. Чтобы не делал мастер (ювелирные украшения из золота , ограды из чугуна, ножи из стали или браслеты из меди) , для правильной работы ему необходимо знать температуры, при которых плавится тот или иной элемент.
Чтобы узнать этот параметр, нужно обратиться к таблице. В таблице также можно найти и градус кипения.
В таблице также можно найти и градус кипения.
Среди наиболее часто применяемых в быту элементов показатели температуры плавления такие:
- алюминий – 660 °C;
- температура плавления меди – 1083 °C;
- температура плавления золота – 1063 °C;
- серебро – 960 °C;
- олово – 232 °C. Олово часто используют при пайке, так как температура работающего паяльника составляет как раз 250–400 градусов;
- свинец – 327 °C;
- температура плавления железо – 1539 °C;
- температура плавления стали (сплав железа и углерода) – от 1300 °C до 1500 °C. Она колеблется в зависимости от насыщенности стали компонентами;
- температура плавления чугуна (также сплав железа и углерода) – от 1100 °C до 1300 °C;
- ртуть – -38,9 °C.
Как понятно из этой части таблицы, самый легкоплавкий металл – ртуть, которая при плюсовых температурах уже находится в жидком состоянии.
Градус кипения всех этих элементов почти вдвое, а иногда и ещё выше градуса плавления.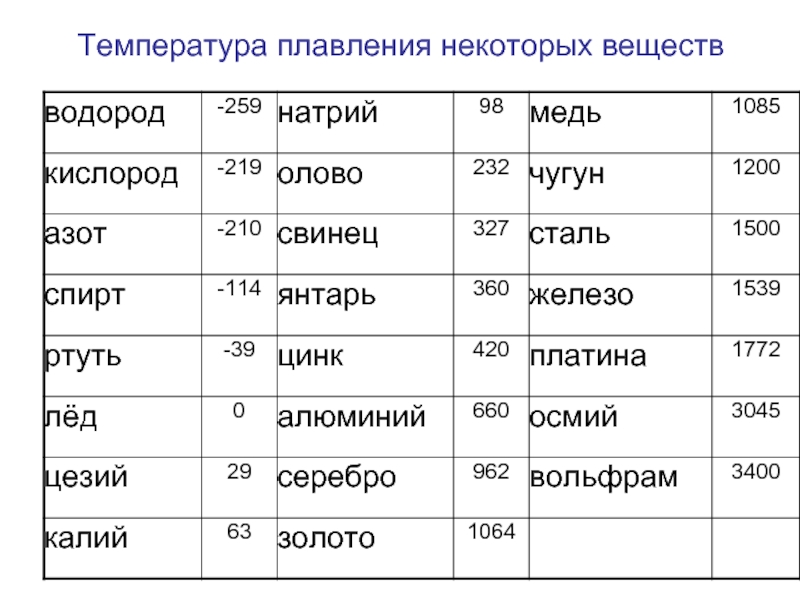 Например, у золота он 2660 °C, у алюминия – 2519 °C , у железа – 2900 °C, у меди – 2580 °C, у ртути – 356,73 °C.
Например, у золота он 2660 °C, у алюминия – 2519 °C , у железа – 2900 °C, у меди – 2580 °C, у ртути – 356,73 °C.
У сплавов типа стали, чугуна и прочих металлов расчёт примерно такой же и зависит от соотношения компонентов в сплаве.
Максимальная температура кипения у металлов – у рения – 5596 °C . Наибольшая температура кипения – у наиболее тугоплавящихся материалов.
Бывают таблицы, в которых также указана плотность металлов . Самым лёгким металлом является литий, самым тяжёлым – осмий. У осмия плотность выше, чем у урана и плутония, если рассматривать её при комнатной температуре. К лёгким металлам относятся: магний, алюминий, титан. К тяжёлым относится большинство распространённых металлов: железо, медь, цинк, олово и многие другие. Последняя группа – очень тяжёлые металлы, к ним относятся: вольфрам, золото, свинец и другие.
Ещё один показатель, встречающийся в таблицах – это теплопроводность металлов . Хуже всего тепло проводит нептуний, а лучший по теплопроводности металл – серебро.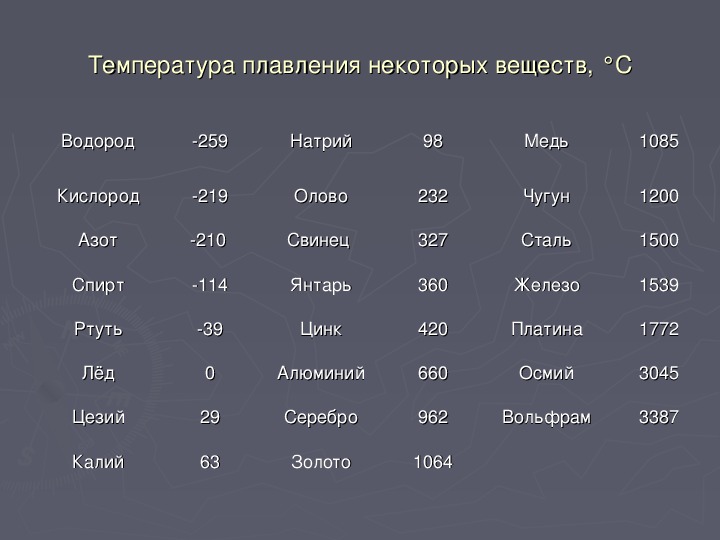 Золото, сталь, железо, чугун и прочие элементы находится посередине между этими двумя крайностями. Чёткие характеристики для каждого можно найти в нужной таблице.
Золото, сталь, железо, чугун и прочие элементы находится посередине между этими двумя крайностями. Чёткие характеристики для каждого можно найти в нужной таблице.
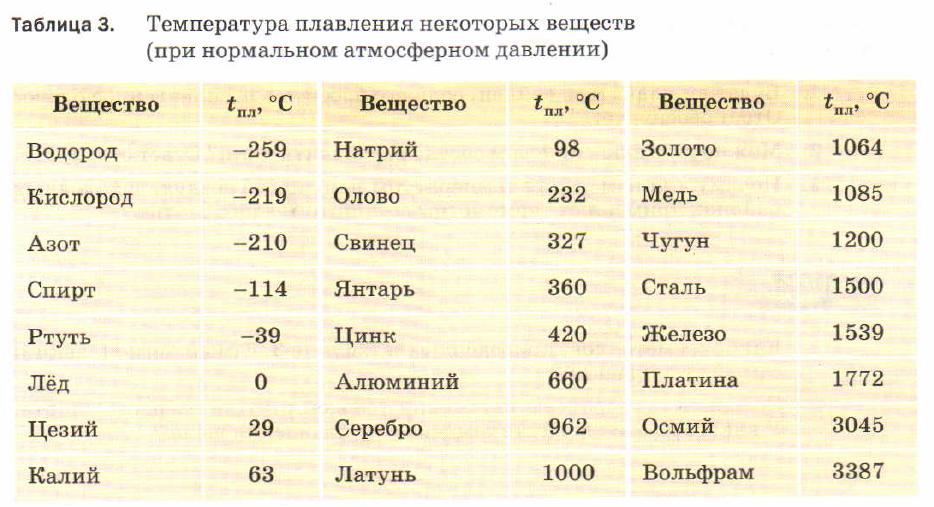
Температура плавления, наряду с плотностью, относится к физическим характеристикам металлов . Температура плавления металла – температура, при которой металл переходит из твердого состояния, в котором находится в нормальном состоянии (кроме ртути), в жидкое состояние при нагревании. При плавлении объем металла практически не изменяется, поэтому на температуру плавления нормальное атмосферное давление не влияет .
Температура плавления металлов находится в диапазоне от -39 градусов Цельсия до +3410 градусов . Для большинства металлов температура плавления высокая, однако, некоторые металлы можно расплавить в домашних условиях при нагревании на обычной горелке (олово, свинец).
Классификация металлов по температуре плавления
- Легкоплавкие металлы , температура плавления которых колеблется до 600 градусов Цельсия, например цинк, олово, висмут .

- Среднеплавкие металлы , которые плавятся при температуре от 600 до 1600 градусов Цельсия: такие как алюминий, медь, олово, железо .
- Тугоплавкие металлы , температура плавления которых достигает более 1600 градусов Цельсия – вольфрам, титан, хром и др.
- – единственный металл, находящийся при обычных условиях (нормальное атмосферное давление, средняя температура окружающей среды) в жидком состоянии. Температура плавления ртути составляет порядка -39 градусов по Цельсию.
Таблица температур плавления металлов и сплавов
| Металл | |
| Алюминий | 660,4 |
| Вольфрам | 3420 |
| Дюралюмин | |
| Железо | 1539 |
| Золото | 1063 |
| Иридий | 2447 |
| Калий | 63,6 |
| Кремний | 1415 |
| Латунь | |
| Легкоплавкий сплав | 60,5 |
| Магний | 650 |
| Медь | 1084,5 |
| Натрий | 97,8 |
| Никель | 1455 |
| Олово | 231,9 |
| Платина | 1769,3 |
| Ртуть | –38,9 |
| Свинец | 327,4 |
| Серебро | 961,9 |
| Сталь | 1300-1500 |
| Цинк | 419,5 |
| Чугун | 1100-1300 |
При плавлении металла для изготовления металлических изделий-отливок от температуры плавления зависит выбор оборудования, материала для формовки металла и др.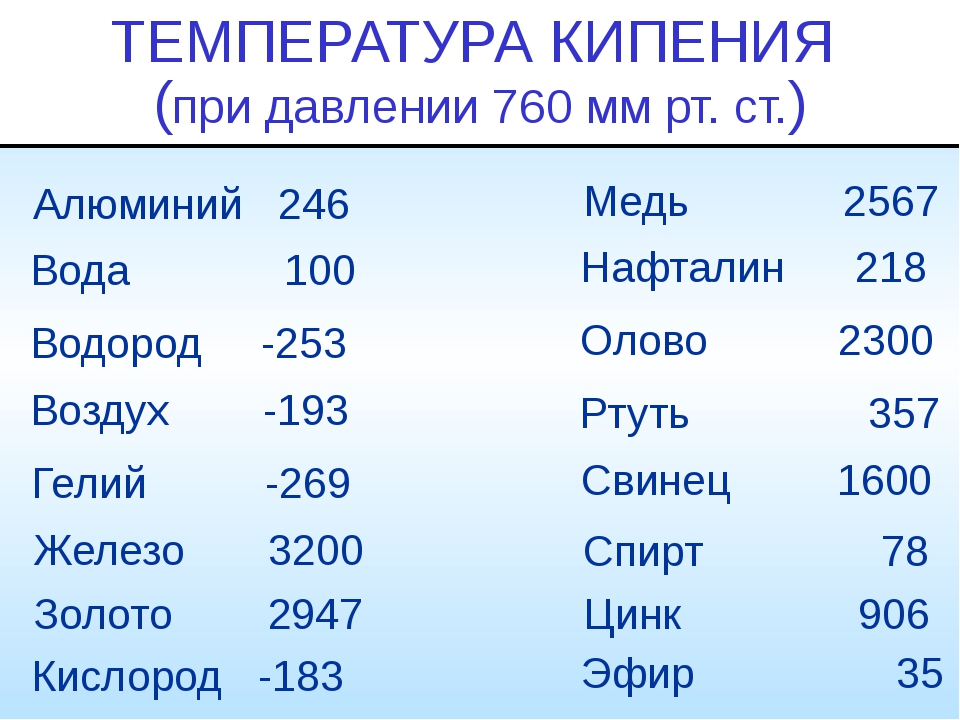 Следует также помнить, что при легировании металла другими элементами температура плавления чаще всего снижается .
Следует также помнить, что при легировании металла другими элементами температура плавления чаще всего снижается .
Не стоит путать понятия «температура плавления металла» и «температура кипения металла» – для многих металлов эти характеристики существенно отличаются: так, серебро плавится при температуре 961 градус по Цельсию, а закипает только при достижении нагрева до 2180 градусов.
Температура плавления металла – это минимальная температура, при которой он переходит из твердого состояния в жидкое. При плавлении его объем практически не изменяется. Металлы классифицируют по температуре плавления в зависимости от степени нагревания.
Легкоплавкие металлы имеют температуру плавления ниже 600°C. Это цинк, олово, висмут. Такие металлы можно расплавить в домашних условиях , разогрев их на плите, или с помощью паяльника. Легкоплавкие металлы используются в электронике и технике для соединения металлических элементов и проводов для движения электрического тока. Температура плавления олова составляет 232 градуса, а цинка – 419.
Среднеплавкие металлы начинают переходить из твердого в жидкое состояние при температуре от 600°C до 1600°C. Они используются для изготовления плит, арматур, блоков и других металлических конструкций, пригодных для строительства. К этой группе металлов относятся железо, медь, алюминий, они также входят в состав многих сплавов. Медь добавляют в сплавы драгоценных металлов, таких как золото, серебро, платина. Золото 750 пробы на 25% состоит из лигатурных металлов, в том числе и меди, которая придает ему красноватый оттенок. Температура плавления этого материала равна 1084 °C. А алюминий начинает плавиться при относительно низкой температуре, составляющей 660 градусов Цельсия. Это легкий пластичный и недорогой металл, который не окисляется и не ржавеет, поэтому широко используется при изготовлении посуды. Температура плавления железа равна 1539 градусов. Это один из самых популярных и доступных металлов, его применение распространено в строительстве и автомобильной промышленности. Но ввиду того, что железо подвергается коррозии, его нужно дополнительно обрабатывать и покрывать защитным слоем краски, олифы или не допускать попадания влаги.
Но ввиду того, что железо подвергается коррозии, его нужно дополнительно обрабатывать и покрывать защитным слоем краски, олифы или не допускать попадания влаги.
Температура тугоплавких металлов выше 1600°C. Это вольфрам, титан, платина, хром и другие. Их используют в качестве источников света, машинных деталей, смазочных материалов, а также в ядерной промышленности. Из них изготавливают проволоки, высоковольтные провода и используют для расплавки других металлов с более низкой температурой плавления. Платина начинает переходить из твердого в жидкое состояние при температуре 1769 градусов, а вольфрам – при температуре 3420°C.
Ртуть – единственный металл, находящийся в жидком состоянии при обычных условиях, а именно, нормальном атмосферном давлении и средней температуре окружающей среды. Температура плавления ртути составляет минус 39°C. Этот металл и его пары являются ядовитыми, поэтому он используется только в закрытых емкостях или в лабораториях. Распространенное применение ртути – градусник для измерения температуры тела.
Температура плавления таблицы — Справочник химика 21
Чистые индивидуальные органические вещества имеют определенную температуру плавления. Таблицы с температурами плавления органических веществ приведены во многих справочниках. [c.349]Температура плавления, молекулярные веса и ближайшие формулы компонентов парафина видны из таблицы 75. [c.328]
Из данных таблицы 104 следует, что наилучшим комплексом физико-механических свойств обладают полипропиленовые волокна. Полипропиленовые волокна имеют более высокую температуру плавления, чем полиэтиленовые, не уступая последним, волокнам по другим свойствам. [c.344]
В табл. 16 приведены результаты расчета поверхностного натяжения четных н-алканов. В таблице сопоставлены расчетные значения поверхностного натяжения между ассоциатом и расплавом и экспериментальные значения поверхностного натяжения при 20 °С на границе н-алкан — воздух.
 Для н-гексадекана температура плавления 18°С близка к температуре, при которой экспериментально определено поверхностное натяжение, в этом случае и наблюдается хорошее совпадение расчетного и экспериментального значений поверхностного натяжения (табл. 16). [c.126]
Как видно из таблицы 24, физические свойства элементов закономерно изменяются с увеличением атомной массы усиливается окраска, увеличиваются температуры плавления и кипения. [c.109]
Данные этой таблицы указывают на снижение процента к-пара-.финов и увеличение доли изопарафинов и нафтенов с повышением температуры плавления исходных очищенных образцов парафинов. [c.48]
Для н-гексадекана температура плавления 18°С близка к температуре, при которой экспериментально определено поверхностное натяжение, в этом случае и наблюдается хорошее совпадение расчетного и экспериментального значений поверхностного натяжения (табл. 16). [c.126]
Как видно из таблицы 24, физические свойства элементов закономерно изменяются с увеличением атомной массы усиливается окраска, увеличиваются температуры плавления и кипения. [c.109]
Данные этой таблицы указывают на снижение процента к-пара-.финов и увеличение доли изопарафинов и нафтенов с повышением температуры плавления исходных очищенных образцов парафинов. [c.48] В первом разделе справочника содержатся сведения о физико-химических свойствах химических соединений, используемых в процессах добычи и транспорта нефти в виде индивидуальных веществ или как компонент какого-либо состава. Все вещества условно подразделены на четыре группы неорганические вещества, органические вещества, макромолекулярные соединения и поверхностно-активные вещества. В каждой группе вещества расположены в алфавитном порядке, приведены их физические свойства молекулярная масса, внешний вид, плотность, температура плавления, температура кипения, растворимость и т. д. Для каждого соединения описано его назначение в используемых процессах добычи и транспорта нефти или его функциональное назначение в многокомпонентных системах. Ввиду разбросанности сведений о физико-химических свойствах индивидуальных веществ по многочисленным литературным источникам использованная в этом разделе литература сгруппирована и приведена перед таблицами, без привязки источников информации к каждому веществу. [c.5]
Все вещества условно подразделены на четыре группы неорганические вещества, органические вещества, макромолекулярные соединения и поверхностно-активные вещества. В каждой группе вещества расположены в алфавитном порядке, приведены их физические свойства молекулярная масса, внешний вид, плотность, температура плавления, температура кипения, растворимость и т. д. Для каждого соединения описано его назначение в используемых процессах добычи и транспорта нефти или его функциональное назначение в многокомпонентных системах. Ввиду разбросанности сведений о физико-химических свойствах индивидуальных веществ по многочисленным литературным источникам использованная в этом разделе литература сгруппирована и приведена перед таблицами, без привязки источников информации к каждому веществу. [c.5]
Получение производных — важный этап в анализе органических соединений. Каждому представителю данного класса соединений соответствует производное с определенной температурой плавления (например, температура плавления амида уксусной кислоты 82° С, амида пропионовой кислоты 79° С, амида масляной кислоты П5°С).
 В ряде руководств по анализу органических соединений приводятся таблицы температур плавления производных наиболее употребляемых органических веществ. По температуре плавления производного можно сделать заключение о строении соответствующего ему вещества, если оно было ранее описано. Выбор реактива для получения производного определяется доступностью и устойчивостью реактива, простотой, удобством, скоростью реакции, выходом и четкой температурой плавления производного важно также, чтобы температуры плавления производных изомеров или соседних гомологов резко отличались друг от друга. [c.227]
Объясните резкое возрастание активности взаимодействия щелочных металлов с водой при переходе от лития к цезию. Для ответа на вопрос используйте данные таблицы 5 (см. приложение), причем не только такие, как изменение энтальпии взаимодействия щелочных металлов с водой и гидратации их ионов, но и такие физические характеристики, как температура плавления и плотность.
В ряде руководств по анализу органических соединений приводятся таблицы температур плавления производных наиболее употребляемых органических веществ. По температуре плавления производного можно сделать заключение о строении соответствующего ему вещества, если оно было ранее описано. Выбор реактива для получения производного определяется доступностью и устойчивостью реактива, простотой, удобством, скоростью реакции, выходом и четкой температурой плавления производного важно также, чтобы температуры плавления производных изомеров или соседних гомологов резко отличались друг от друга. [c.227]
Объясните резкое возрастание активности взаимодействия щелочных металлов с водой при переходе от лития к цезию. Для ответа на вопрос используйте данные таблицы 5 (см. приложение), причем не только такие, как изменение энтальпии взаимодействия щелочных металлов с водой и гидратации их ионов, но и такие физические характеристики, как температура плавления и плотность. [c.159]
Построение калибровочной прямой. Строят кривые охлаждения индивидуальных веществ на миллиметровой бумаге в координатах ЭДС — время. Рекомендуемый масштаб по оси абсцисс 1 мм = 30с, по оси ординат 10 мм — 0,5 мВ. Полученные экспериментальные кривые, подобные представленным, на рис. 6,4, вследствие неравновесных условий охлаждения могут отличаться по виду от теоретических кривых (сравните кривые на рис. 6.1, б и 6.4). В частности, возможно явление переохлаждения, когда температура опускается ниже температуры кристаллизации, а выпадения кристаллов не наблюдается. Это приводит к появлению провалов на кривых охлаждениях. В этих случаях для определения ЭДС начала кристаллизации проводят интерполяцию линейного участка кривой, как показано на рис. 6.4. Строят график в координатах температура плавления (°С)—ЭДС кристаллизации индивидуальных веществ (рис. 6.5). Температуру плавления индивидуальных веществ находят в справочных таблицах (см.
[c.159]
Построение калибровочной прямой. Строят кривые охлаждения индивидуальных веществ на миллиметровой бумаге в координатах ЭДС — время. Рекомендуемый масштаб по оси абсцисс 1 мм = 30с, по оси ординат 10 мм — 0,5 мВ. Полученные экспериментальные кривые, подобные представленным, на рис. 6,4, вследствие неравновесных условий охлаждения могут отличаться по виду от теоретических кривых (сравните кривые на рис. 6.1, б и 6.4). В частности, возможно явление переохлаждения, когда температура опускается ниже температуры кристаллизации, а выпадения кристаллов не наблюдается. Это приводит к появлению провалов на кривых охлаждениях. В этих случаях для определения ЭДС начала кристаллизации проводят интерполяцию линейного участка кривой, как показано на рис. 6.4. Строят график в координатах температура плавления (°С)—ЭДС кристаллизации индивидуальных веществ (рис. 6.5). Температуру плавления индивидуальных веществ находят в справочных таблицах (см.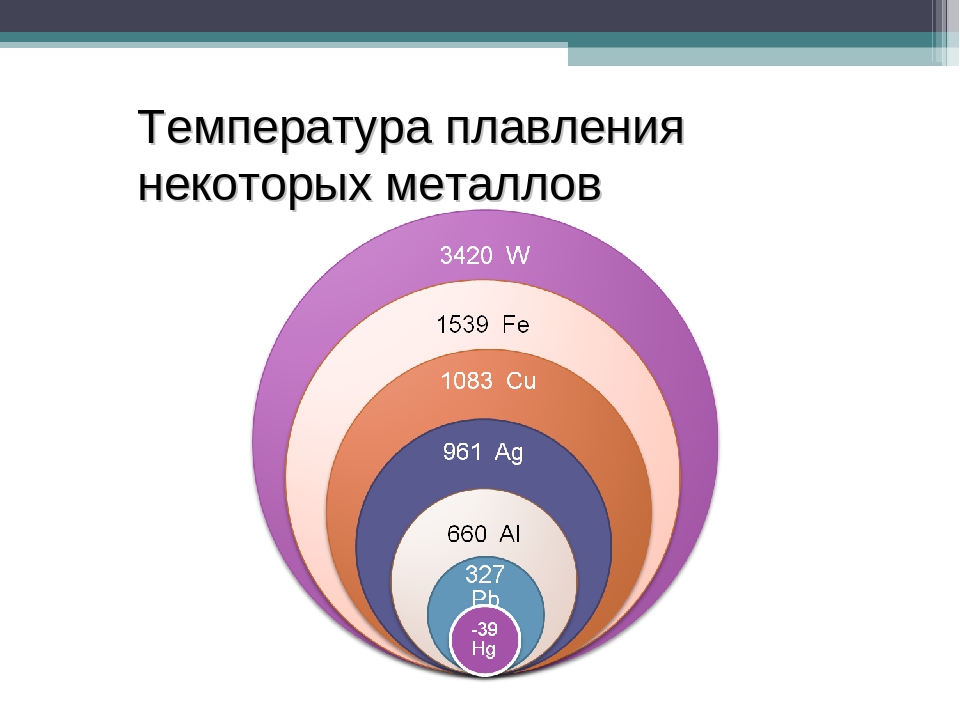 Приложение). [c.44]
Приложение). [c.44]При хорошем прессовании порошков вещества образцы в капиллярах плавятся, начиная с верхних слоев. При наличии пузырьков воздуха наблюдается обратное явление, т. е. плавление начинается в нижних слоях, вверху же оно замедляется, так как верхние кристаллы отделяются от нижнего расплавленного слоя воздушной прослойкой. После выбивания пузырьков кристаллы опускаются вниз, т. е. тонут в расплавленном веществе. Температурой плавления следует считать ту температуру, при которой появляются первые признаки плавления вещества, в капилляре. Экспериментальные и расчетные данные записать в таблицу по образцу [c.193]
Обратите внимание на температуры плавления и кипения воды. Сравните их с физическими константами соединений водорода с соседями кислорода по Периодической таблице (фтороводород, хло-роводород, аммиак, фосфин) и элементами VI группы (сероводород, селеноводород) (см. табл. 3 ). [c.104]
Приводим таблицу полученных афиров, расположенных в порядке увеличения температур плавления (таблица).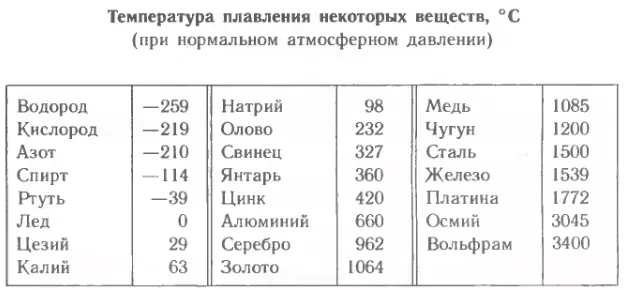 Если продукт дает кри-сталлосольват с бензолом, в таблице указана температура плавления вещества после высушивания и удаления бензола. Содержание кристаллизационного бензола мы определяли по потере в весе при высушивании— сначала при низкой температуре, затем при 100°. [c.1066]
Если продукт дает кри-сталлосольват с бензолом, в таблице указана температура плавления вещества после высушивания и удаления бензола. Содержание кристаллизационного бензола мы определяли по потере в весе при высушивании— сначала при низкой температуре, затем при 100°. [c.1066]Окисление, как оказалось, ускоряется в данной операции при замене воздуха кислородом или при употребл1е(нии сжатого воздуха. Грюн и Ульрих обрабаты- вали 100 г парафина (температура плавления 52° С) при 160° в течение 12 часов. 17олучекные ими результаты представлены в верхней таблице на Tp. 83. [c.82]
Типические элементы образуют оксиды, формулы которых можно предсказать на основании положения элементов в периодической таблице например, элементы третьего периода образуют следующие оксиды НагО, МяО, А12О3, ЗЮз, Р2О5 63 и С12О7. Оксиды элементов, находящихся в левой части таблицы, являются сильными основаниями. Для них характерно наличие больщого отрицательного заряда на атомах кислорода, и по типу связи они принадлежат к ионным соединениям.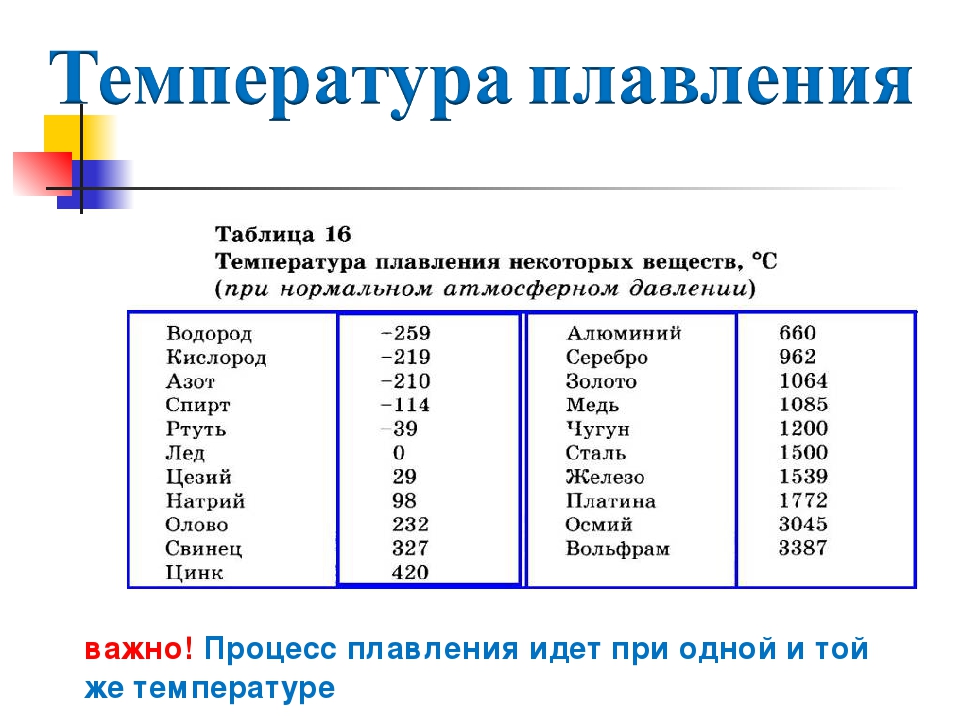 Температуры плавления этих ионных оксидов, как правило, достигают 2000°С, но многие из них разлагаются уже при более низких температурах. Они реагируют с водой с образованием основных растворов [c.321]
Температуры плавления этих ионных оксидов, как правило, достигают 2000°С, но многие из них разлагаются уже при более низких температурах. Они реагируют с водой с образованием основных растворов [c.321]
По зависимости давления насыщенного пара от температуры и плотности данного вещества А с молекулярной массой М в твердом и жидком состояниях ( ТВ и ж в кг/м ) в tpoйнoй точке (тр.т) 1) постройте график зависимости Ig Р от 1/Т 2) определите по графику координаты тройной точки 3) рассчитайте среднюю теплоту испарения и возгонки 4) постройте график зависимости давления насыщенного пара от температуры 5) определите теплоту плавления вещества при температуре тройной точки 6) вычислите dT/dP для процесса плавления при температуре тройной точки 7) вычислите температуру плавления вещества при давлении Р Па 8) вычислите изменение энтропии, энергий Гиббса и Гельмгольца, энтальпии и внутренней энергии для процесса возгонки 1 моль вещества в тройной точке 9) определите число термодинамических степеней свободы при следующих значениях температуры и давления а) Ттр.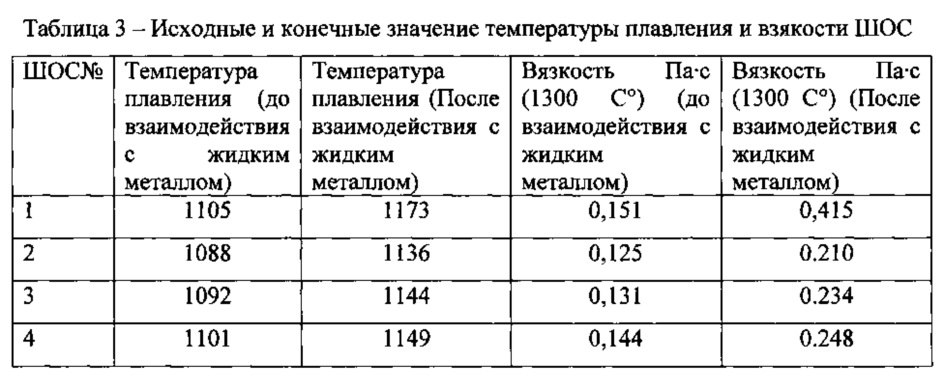 т. Ртр.т б) Т .т.к. Р = I атм в) Т в.т. Ртр.т- Необходимые для расчета данные возьмите из таблицы (см. с. 167). [c.166]
т. Ртр.т б) Т .т.к. Р = I атм в) Т в.т. Ртр.т- Необходимые для расчета данные возьмите из таблицы (см. с. 167). [c.166]
Отличительной особенностью ароматических углеводородов по сравнению с парафиновыми и циклоалкановыми рав ой молекулярной массы оказывается большая плотность, а также более высокие температуры кипения и плавления. В табл. 1 представлены температуры кипения ароматических углеводородов в диапазоне давлений 0,133—101 кПа и их температуры плавления [3, с. 634— 667]. Как видно из таблицы, с введением заместителей в ядро температура кипения углеводорода повышается, при этом температура плавления резко снижается. Углеводороды с несколькими заместителями, как лравило, имеют более высокие температуры кипения, чем изомерные соединения с одним заместителем (например, ксилолы и этилбензол, триметилбензолы и изопропилбензол, тетраметилбензолы и цимолы или изобутилбензол).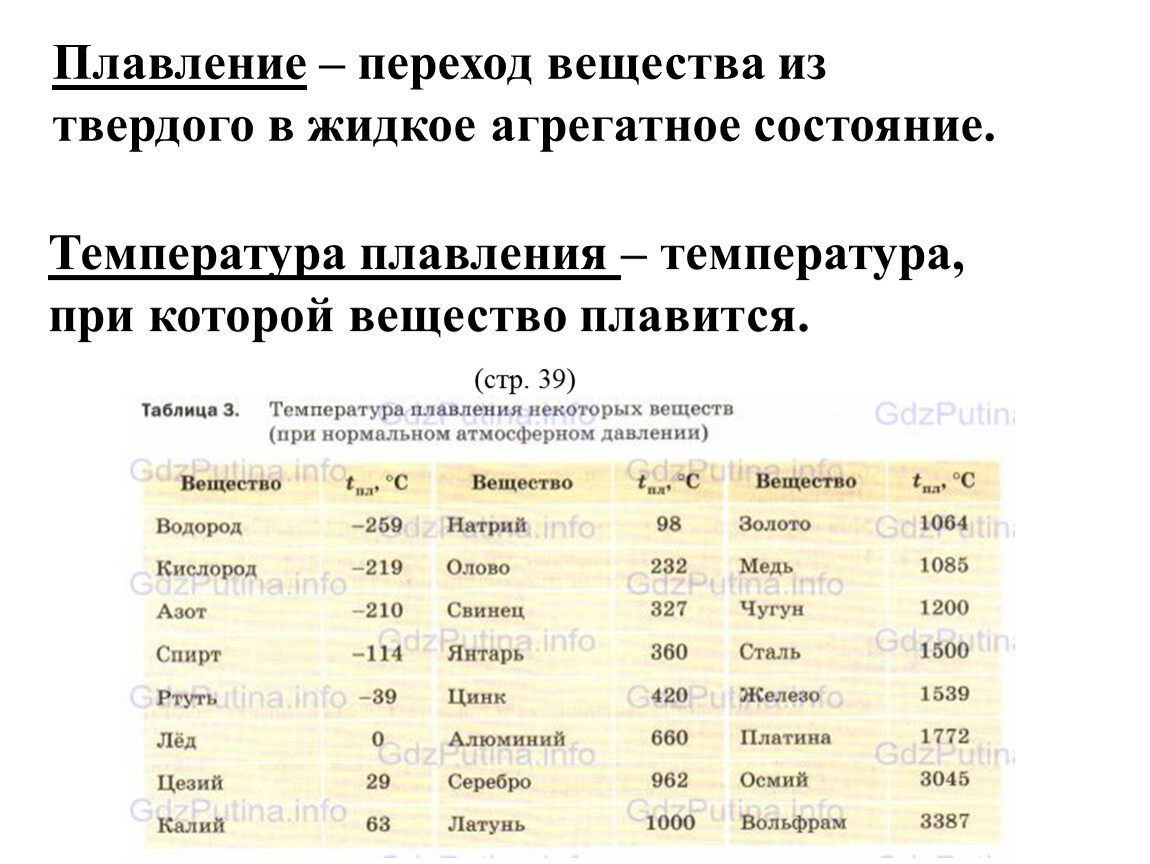 Из двух- и более замещенных бензолов более высокую температуру кипения имеют рядовые изомеры (о-ксилол, гемимеллитол, преннтол), а наименьшую—изомеры с симметричным расположением заместителей («/г-ксилол, мезитилен, дурол). Симметричные изомеры в большинстве случаев обладают наибольшей температурой плавления. Температуры кипения и пла1вления полициклических ароматических углеводородов значительно выше, чем температуры кипения и плавления изомеров бензола с такой же молекулярной массой. [c.10]
Из двух- и более замещенных бензолов более высокую температуру кипения имеют рядовые изомеры (о-ксилол, гемимеллитол, преннтол), а наименьшую—изомеры с симметричным расположением заместителей («/г-ксилол, мезитилен, дурол). Симметричные изомеры в большинстве случаев обладают наибольшей температурой плавления. Температуры кипения и пла1вления полициклических ароматических углеводородов значительно выше, чем температуры кипения и плавления изомеров бензола с такой же молекулярной массой. [c.10]
Значительную часть имеющихся данных по галоидоангидридам и а.мидам сульфокислот целесообразно привести в виде таблиц, так как методы получения этих соединений стандартны, а данные об их свойствах большей частью ограничиваются температурой плавления. [c.268]
ПИЙ устойчивы при температурах не выше 133° О температура плавления карбамида). В табл. 1 приведены температуры диссоциации комплексов карбамида с некоторыми производными нормальных парафинов [17 ] из данных таблицы видно, что с увеличением молекулярного веса углеводородного компонента температура диссоциации соответствуюпцего карбамидного комплекса возрастает.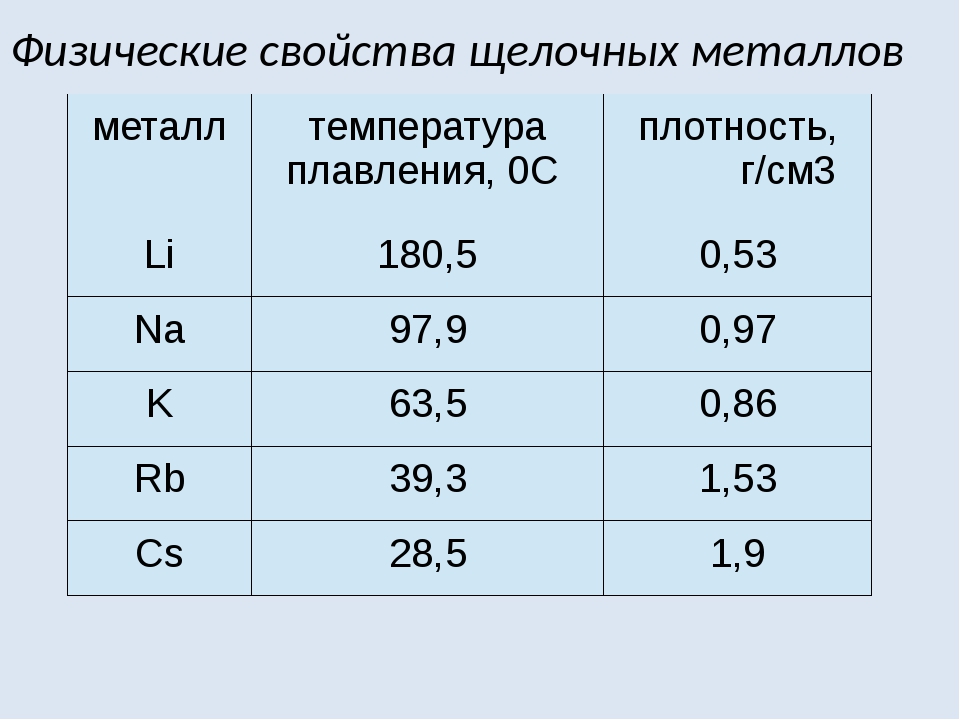 Аналогичная зависимость для карбамидных комплексов нормальных парафинов от С1вНз4 до СдоНва была установлена в работе [18]. [c.13]
Аналогичная зависимость для карбамидных комплексов нормальных парафинов от С1вНз4 до СдоНва была установлена в работе [18]. [c.13]
Следовательно, периодический характер изменения тепломе-кости тел при температуре плавления следует считать следствием периодического изменения ангармонической составляющей, что, в свою очередь, обусловлено как периодическим изменением температурного интервала Тт—так и влиянием характера химической связи, меняющегося последовательно в соответствии с изменением положения в периодической таблице. Интервал нараста- [c.86]
Из таблицы видно, что при почти одинаковой с нарафиыами температуре плавления церезины обладают более высокими удельными и молекулярными весами, рефракцией, вязкостью и температурой кипения. [c.27]
Работу можно провести упрощенным методом. В полумикропробирку внести 2—3 г камфоры и опустить проволочную мещалку. Поместить пробирку в круглодонную колбу или стакан с глицерином либо вазелиновым маслом. В пробирке закрепить термометр на 200° С с делениями по О,Г. Слой камфоры должен быть на 1 см выше шарика термометра. Колбу с маслом нагревать медленно на горелке или электрической плитке, покрытой асбестом. Р асплавить камфору и отставить горелку. Перемешивая мешалкой расплав, наблюдать за температурой. Она сначала понижается вследствие охлаждения расплава, а затем снова повышается, поскольку выделяется теплота кристаллизации. Максимальная температура соответствует температуре кристаллизации. Таким же путем определить температуры плавления смесей. Данные внести в таблицу. Рассчитать по уравнению (IV.11) К камфоры и молекулярный вес пспы-туемого вещества. [c.53]
В пробирке закрепить термометр на 200° С с делениями по О,Г. Слой камфоры должен быть на 1 см выше шарика термометра. Колбу с маслом нагревать медленно на горелке или электрической плитке, покрытой асбестом. Р асплавить камфору и отставить горелку. Перемешивая мешалкой расплав, наблюдать за температурой. Она сначала понижается вследствие охлаждения расплава, а затем снова повышается, поскольку выделяется теплота кристаллизации. Максимальная температура соответствует температуре кристаллизации. Таким же путем определить температуры плавления смесей. Данные внести в таблицу. Рассчитать по уравнению (IV.11) К камфоры и молекулярный вес пспы-туемого вещества. [c.53]
По данным таблиц температура плавления KNOa равна 610 К, а ТП—713 К- Расхождение этих значений с полученными из эксперимента объясняется частичной взаимной растворимостью этих веществ. Эффекты, отвечающие плавлению чистых кристаллов KNO3 (610 К) и ТИ (713 К), проявляются на кривой ДТА в виде небольших всплесков. Очевидно, что проведение фазового анализа по полученной термограмме затруднено, хотя она и представляет ценность как характеристика химического взаимодействия между исходными компонентами. [c.73]
Очевидно, что проведение фазового анализа по полученной термограмме затруднено, хотя она и представляет ценность как характеристика химического взаимодействия между исходными компонентами. [c.73]
Температура плавления латуни: таблица для легированных сплавов
Температура плавления латуни: верхний и нижний предел + таблица температур для различных марок латуни по ГОСТу + 3 типа классификации латуни + 5 важных свойств металла + разбор влияния легирующих добавок + применение латуни по 6 типам проката + методика плавки латуни в домашних условиях.температура плавления латуни
Говоря о популярности сплавов цветных металлов, латунь по праву занимает лидирующие позиции уже не первый год. История производства материала уходит корнями в древний Рим, но патент и первые промышленные потуги датируются только в конце 1800 годов.
В сегодняшней статье мы расскажем какова температура плавления латуни, можно ли производить сплав дома, и каков он из себя вообще.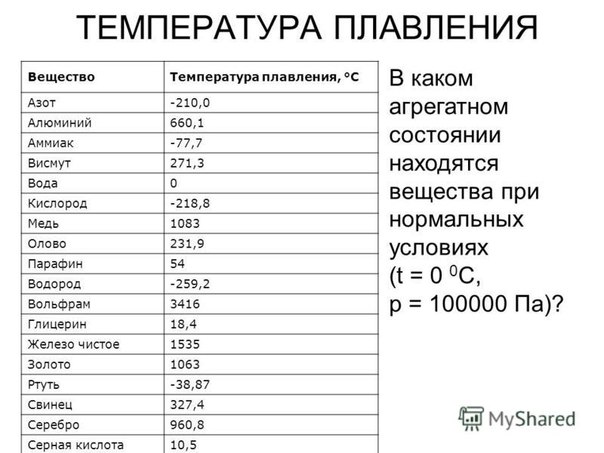
Что такое латунь?
Медь и цинк – оговоренные 2 химических элемента в чистом виде мало чем похожи, но в совокупности они образовывают один из популярнейших сплавов в мире – латунь. В базовом веществе доля меди порядка 70%, а 28%+ — это цинк. Остальные 2% — разнообразные примеси, коими может выступать свинец, кремний и даже олово.
Интересные факты о латуни:
- римляне именовали латунь орихалком «златомедью» из-за характерного золотистого оттенка;
- западные страны предпочитают гильзы оружия делать из высококачественной латуни – это снижает количество механических повреждений ствола в процессе эксплуатации;
- зипповские зажигалки состоят из гальванизированной латуни;
- на Руси латунь была незаменимым материалом в производстве самоваров;
- латунь не обошла стороной и страны Африки. Местные аборигены делают из нее ритуальные маски;
- корпусы магнитов и компасов практично делать из латуни, ибо данный сплав не имеет магнитных свойств;
- Л68 и Л62 – две марки декоративной латуни, используемые новичками в ювелирном деле с целью обучения механической обработки золотых предметов.

Существует особый рецепт латуни из сплава никеля с медью, где в качестве легирующей добавки используется 2.4% алюминия. Оговоренный материал крайне популярен у изготовителей бижутерии, ибо отличить его от золота 583-й пробы крайне сложно. Не редко данное свойство сплава используется с целью махинации, потому, приобретать украшения лучше всего в сертифицированных местах, где за качество товара имеются ответственные лица и выдается сопутствующая документация.
6 шагов, как отличить медь от латуни в домашних условиях
1) Классификация латуни + ее достоинства/недостатки
Латунь – это яркий и практичный материал, нашедший себя в решении многих бытовых и промышленных вопросах. Желтоватый оттенок, и простота полировки поверхности металла, в совокупности со слабым окислением на внешней среде, делает сплав объективно лучшим для решения ряда задач, связанных со строительством транспортных систем и в изготовлении некоторых деталей аппаратуры.
 Детальнее о плюсах и минусах латуни расскажет таблица ниже.
Детальнее о плюсах и минусах латуни расскажет таблица ниже.| Преимущества латуни | Недостатки материала |
|---|---|
| Небольшой вес латуни делает материал незаменимым в авиационном и ракетном строительстве. | Теплопроводимость – это обоюдоострый меч. Из-за низкого показателя у латуни имеется ряд ограничений по использованию для систем, требующих высоких показателей теплоотдачи. |
| Декоративность сплава. Вариативность в цветовой гамме дает возможность творить из материала качественные и презентабельные элементы декора интерьера и не только. | Латунь не отличается высокой прочностью. Та же бронза может дать ей фору. |
| Низкая теплопроводимость, что важно в строительных конструкциях, где сохранение тепла ставится на первое место. | Падение значения коррозийной стойкости по мере повышения температуры окружающей среды. |
На практике, вариативность долевого вхождения компонентов в сплав латуни куда выше. К примеру, если в сплаве имеется 50% цинка, то получаемый материал считается низкокачественным, а его технология производства базируется на вторичных отходах. Детальнее о классификации латуни расскажет таблица ниже.
К примеру, если в сплаве имеется 50% цинка, то получаемый материал считается низкокачественным, а его технология производства базируется на вторичных отходах. Детальнее о классификации латуни расскажет таблица ниже.
| Тип классификации | Составляющие | Описание |
|---|---|---|
| Компетентность | Двухкомпонентные | В составе сплава находится только 2 компонента. Доля прочих примесей допустима, но только в пределах, которые не затронут физические/химические свойства полученного материала. Свойства определяются по фазовому составу — α –фаза или β-фаза. Детальнее по ним ниже. |
| Многокомпонентные | Помимо двух базовых компонентов – медь + цинк, в состав включены вспомогательные примеси, при чем, добавляться могут даже неметаллы. | |
| Обработка | Деформируемые | Разновидности сплавов латуни, которые можно деформировать механическим воздействием в холодном состоянии вещества. Форма выпуска материала – листовой и прутковый. Форма выпуска материала – листовой и прутковый. |
| Литейные | Сплавы латуни, которые можно деформировать только с использованием высоких температур + давления из вне. Сплав используется для производства деталей, требуемых высоких показателей прочности. К примеру, те же подшипники. | |
| Вхождение цинка | Томпак | Высококачественный сплав латуни с долевым содержанием цинка на уровне 6%-21%. Отличительные характеристики материала – антифрикционные и антикоррозийные свойства, что дает возможность его использования в изготовлении биметаллического сплава латунь-сталь. |
| Желтая | Долевое содержание цинка находится в пределах 22%-35%. Материал все еще крайне пластичен. | |
| Техническая | Здесь уже доля цинка достигает показателя в 50%. Сплав используется для массового производства частей аппаратуры и фитингов. |
Анализируя данные выше легко заменить закономерность смены свойств сплава по мере увеличения/уменьшения дозировки цинка и прочих легирующих добавок. В химическом плане, латунь – это смесь цинка, меди и α-раствора. Структура материала обычно состоит из 2 фаз — α- или α+β’. В первом случае получаем медную ГЦК структуру, а во втором – CuZn раствор, концентрация которого 1.5, а форма ячеек максимально простая.
В химическом плане, латунь – это смесь цинка, меди и α-раствора. Структура материала обычно состоит из 2 фаз — α- или α+β’. В первом случае получаем медную ГЦК структуру, а во втором – CuZn раствор, концентрация которого 1.5, а форма ячеек максимально простая.
Важно: большая эластичность латуни наблюдается в α -фазе, но повышенная прочность – это β’-фаза.
Следовательно, при покупке материала с ориентацией на дальнейшую переплавку, обращайте внимание на маркировку. Среднее значение по прочности и пластичности достигается благодаря 30% цинка в сплаве.
2) Свойства латуни + области ее применения и маркировка
Предоставить четкую сборку у химических свойств материала проблематично, ибо параметры меняются в зависимости от долевого содержания цинка и легирующих добавок. У каждого нового сплава собственные особенности, которые делают материал в своем роде уникальным. Максимум – это предоставление обобщенных характеристик для эталонных % цинка/меди в сплаве латуни (30% на 70%).

Свойства латуни:
- плотность варьируется в пределах 8 400 – 8 800 килограмм на метр кубический;
- обладает немагнетичностью при отсутствии внешнего магнитного поля, то бишь не ферромагнетик;
- при нормальном температурном режиме, удельная теплоемкость латуни составляет 0.4 килоджоуля на килограмм в -1 на кельвин в -1 степени;
- тепловая проводимость латуни растет по мере увеличения доли чистой меди внутри сплава. Нижний предел составляет 0.3 кал. на сантиметр* секунду на Цельсии, а верхняя граница – 0.6;
- легко поддается полировке.
Классическая плавильная сварка для латуни не подходит. Оптимальным считается вариант использования контактной сварки. Свойства выше подаются для двухкомпонентной латуни. Для многокомпонентных сплавов работают другие правила. Ниже предоставлены роли основных легирующих компонентов внутри сплавов латуни.
| Вещество | Как влияет? |
|---|---|
| Олово | Значительно увеличивает сопротивление коррозии в соленой воде. Благодаря такому свойству, латунь с большим долевым содержанием олова часто называют «морской» — про области применения материала. Благодаря такому свойству, латунь с большим долевым содержанием олова часто называют «морской» — про области применения материала. |
| Марганец | Еще один металл, способный положительно отобразится на антикоррозийных свойствах латуни. Дополнительное преимущество – увеличение прочности получаемого сплава, пусть оно и не является сильно значительным (в 1.5-2 раза от базового значения двухкомпонентной латуни). |
| Никель | Увеличение прочности и противостояния коррозии в различных агрессивных средах. |
| Кремний | Используется для создания сплавов латуни с антифрикционными свойствами, что позволяет заменять более дорогие материалы, к примеру, бронзу. Параллельно уменьшается показатель прочности материала, что дает возможность проще сваривать детали из получаемого сплава латуни. |
| Свинец | Работает в две стороны. Из минусов – снижение механических свойств латуни. Из плюсов – упрощение в обработке резаками, из-за чего сплав часто называют автоматным. |
| Алюминий | Понижение летучих свойств цинка благодаря возникновению на поверхности материала плёнки из оксида алюминия. |
Свинцовый легирующий сплав латуни является самым распространённым из всех рассматриваемых. В отношении маркировки, латунь обозначают буквой «Л». После нее идет в шаблоне процентное содержание меди и легирующих компонентов.
Двухкомпонентные латуни используются для производства деталей автомобильных средств, приборов в химической/теплохимической промышленности, при штамповке изделий (гаек, болтов, конденсаторов труб толстостенных патрубков и тому подобного).
Многокомпонентных разновидностей латуни куда больше. Вы и сами можете об этом судить из масштабности таблицы выше. К основным областям применения материала относят – производство деталей в судостроительстве, разработка конденсаторов в теплохимической аппаратуре, различные мелкие детали часов, полиграфических сборок и прочих мелких изделий.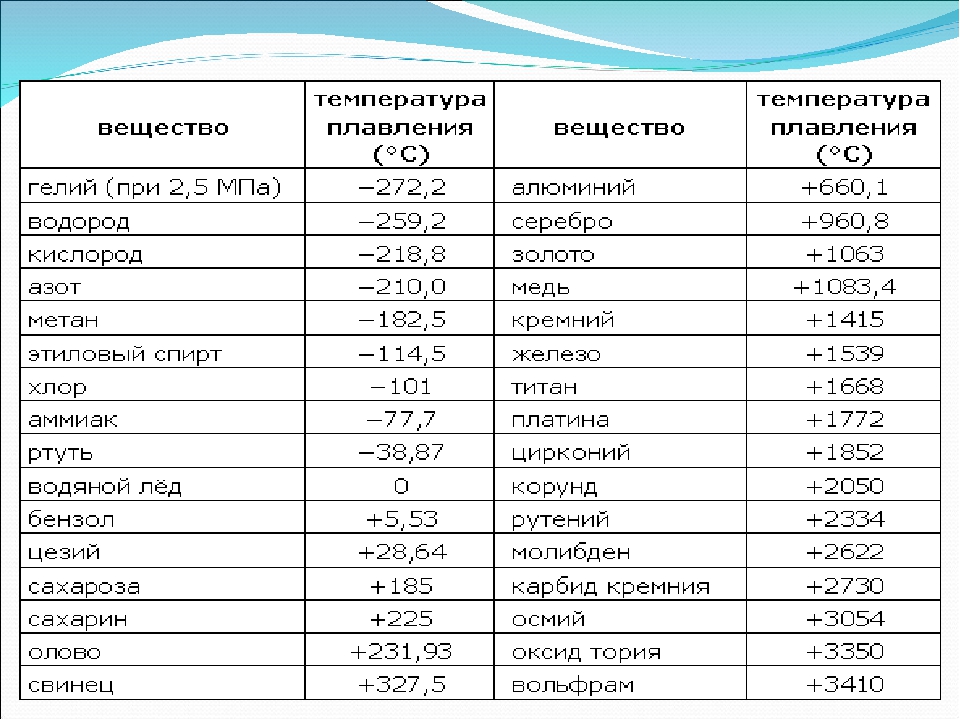
В отдельную категорию по ГОСТам выделяют латуни литейного типа. Базовые свойства материала – коррозийная стойкость, качественные антифрикционные показатели, жидкотекучесть и незначительная склонность к ликвидации. В отношении области применения – это детали арматуры литого типа и другие мелочи с необходимостью в противостоянии к коррозии.
Последняя категория латунных сплавов – это ювелирка. Здесь поставки сырья происходят только в гранулах желтого или золотистого цвета, для дальнейшей обработки высокими температурами и переплавки в «ювелирные изделия» низкого качества. Почитателям бижутерии будет чем поживиться.
Применение по типу проката
| Тип проката | Вид | Описание + применение |
|---|---|---|
| Прут | Прямоугольное длинномерное изделие из сплава, служащее промежуточной заготовкой для производства других деталей. Сечение прутков может быть любое – овальное, квадратное, прямоугольное или даже треугольное.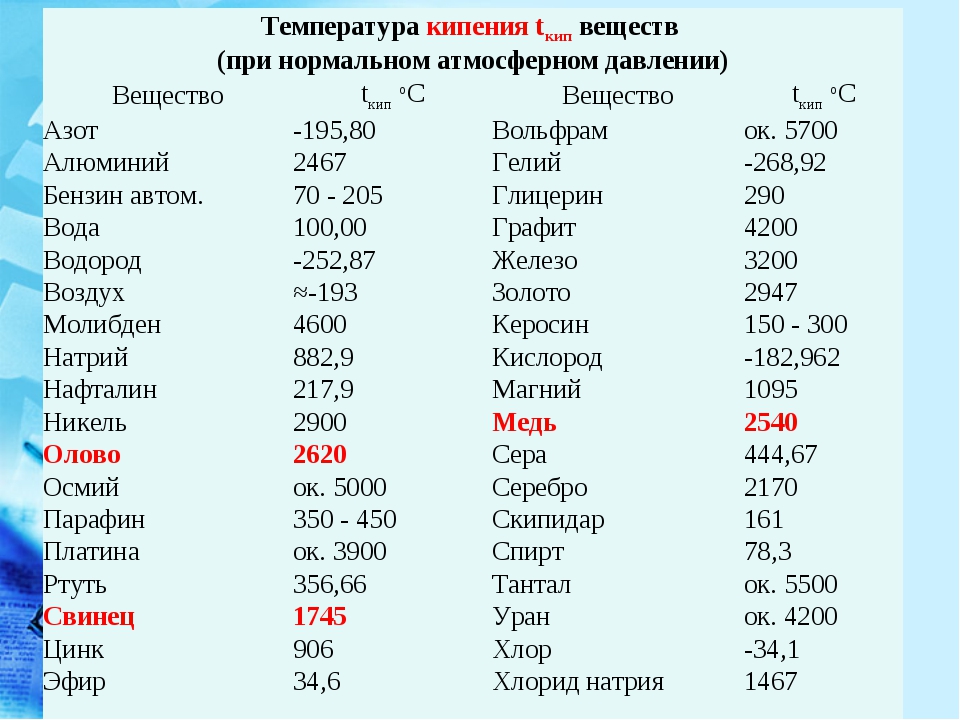 | |
| Плитка | Полуфабрикат из сплава латуни плоского типа, сечение которого по высоте не больше 3 сантиметров. Изготовление латунной плитки происходит посредством проката + литья. Основная область применения материала – декорирование отделки зданий. | |
| Проволока | Профиль вытянутого типа с небольшим диаметром по сечению. Имеет широкую область применения – авиастроение, судостроение, приборостроение, как основа для сварки и даже в обувной промышленности. | |
| Труба | Трубопроводные изделия из высококачественной латуни 0 дорогое удовольствие, но спрос на товар в быту среди богатеньких потребителей все же имеется. Базовые физические свойства латунных труб –пластичность и повышенное противостояние к коррозии. | |
| Круг | По сути, — это те же прутки, но только с большим диаметром в сечении, имеющий только круглую плоскость на срезе. Область применения – автомобильное и судовое строение, основа для механизмов высокоточных приборов и станочные детали. | |
| Лист | Подобие плитки, но с меньшим значением толщины. Материал обладает высокими показателями стойкости к коррозии, прочности и противостояние кислотам/морской воде. Области применения – электроэнергетика, автомобилестроение, полиграфия и прочие направления промышленности/быта. |
Латунь присуща везде, пусть и не в большом количестве (в отличие от той же стали). Если хотите больше узнать о классификациях, типизациях и маркировках латунных сплавов, советуем изучить ГОСТ 1019-47. Далее нами будут рассмотрены тепловые характеристики латуни и ее наиболее распространенных сплавов.
Латунь: температура плавления + плавка материала в домашних условиях
Единственный способ добычи латуни – плавка. В зависимости от химического состава сплава, определяется температурный режим, при котором достигается точка плавкости материала. Параметры текучести, плавкости и теплопроводимости будут описаны далее.
1) Какова температура плавления латуни: точное значение + таблицы
Латунь – сплав на основе меди. Тепловая проводимость в процессе нагрева постепенно увеличивается. При комнатной температуре, максимальный показатель наблюдается у марки латуни Л96. При 27 градусах Цельсия, теплопроводимость металла составляет 245 Вт/(м*град.).
Тепловая проводимость в процессе нагрева постепенно увеличивается. При комнатной температуре, максимальный показатель наблюдается у марки латуни Л96. При 27 градусах Цельсия, теплопроводимость металла составляет 245 Вт/(м*град.).
Таблица выше предоставляет исчерпывающую информацию теплопроводимости в отношении популярных марок латуни. Первый столбец отвечает за маркировку, второй – температурное значение в Кельвинах, а третий – показатель теплопроводимости в Вт/(м*град.).
Высокая вариативность наблюдается и в отношении показателя плавления металлического сплава. По ГОСТам, температура плавления латуни изменяется в пределах 865-1055 градусов Цельсия. Столь значительный разброс обусловлен обилием легирующих добавок в многокомпонентных марках материала.
По краевым значениям выделим несколько марок:
- ЛМц58-2 – марганцовистая латунь имеет минимальный показатель по температуре плавления в 865 градусов;
- Л96 – томпак волоченый считается самым тугоплавким и всех марок латуни по ГОСТам.
 Его температура плавления составляет пиковые 1055 градусов Цельсия.
Его температура плавления составляет пиковые 1055 градусов Цельсия.
К другим легкоплавким латуням относят 59, Л62, ЛАН59-3-2, ЛКС65-1,5-3 и прочие, а к тугоплавким — Л90, ЛА85-0,5 и томпак оловянистый ЛТО90-1.
2) Как плавить латунь в домашних условиях?
В отличие от олова и свинца, который можно успешно расплавить в металлической емкости на обычной горелке или печке, для работы с латунью потребуется использование специализированного оборудования, а точнее печи для плавки.
Особенности технологии и виды наплавки металла
А) Какие инструменты понадобятся?
Первостепенный инструмент к покупке – специализированная индукционная печь. Для плавки латуни будет достаточно пикового значения в 1 300 градусов Цельсия. Использование более мощного оборудования нежелательно, ибо может привести к выгоранию цинка в составе сплава. Детальная модель устройства описана на рисунке ниже.
Печь либо покупается, либо делается собственноручно.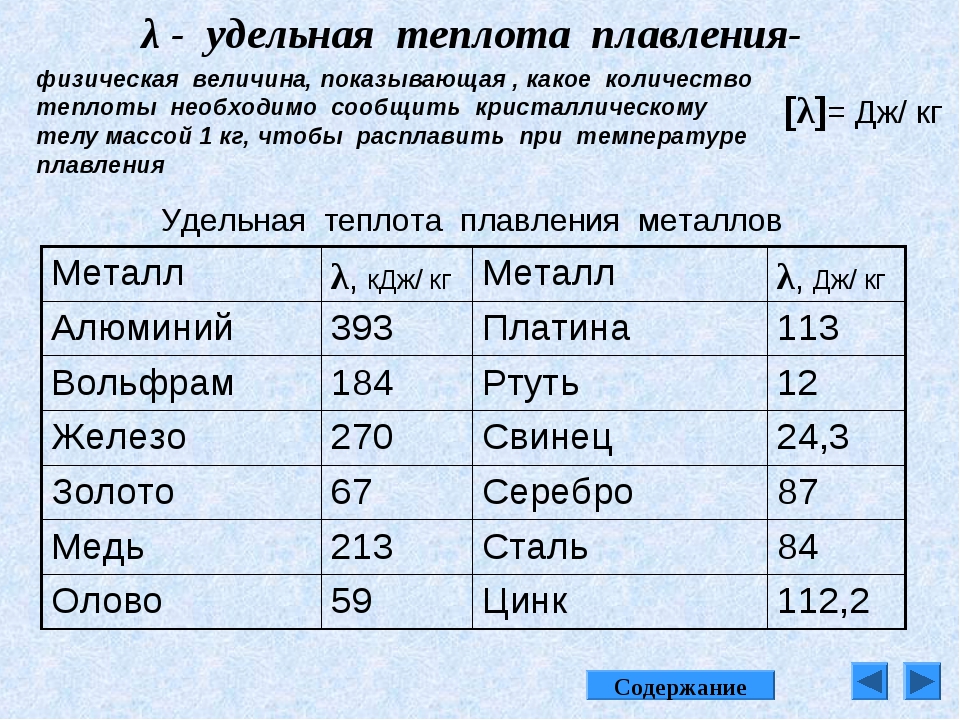 Если выбрали второй вариант, то горн собираем из огнеупорного кирпича и глины. Стягиваем это все металлом и сверху организовываем огнеупорную крышку. Внутри – электроспираль прикрепленная по периметру конструкции на керамические трубки, а тигель (куда производится закладка металла) из графита или шамотного кирпича. Спираль печи можно делать также собственноручно. Расчёт идет на 20 000 Ватт, потому, в качестве сырья используется нихромовая нить с высоким запасом термоустойчивости.
Если выбрали второй вариант, то горн собираем из огнеупорного кирпича и глины. Стягиваем это все металлом и сверху организовываем огнеупорную крышку. Внутри – электроспираль прикрепленная по периметру конструкции на керамические трубки, а тигель (куда производится закладка металла) из графита или шамотного кирпича. Спираль печи можно делать также собственноручно. Расчёт идет на 20 000 Ватт, потому, в качестве сырья используется нихромовая нить с высоким запасом термоустойчивости.
Дополнительное оборудование для плавки латуни дома:
Часть инструментов приобретается, а часть находится дома. Если в процессе плавки используется новый тигель, его предварительно требуется закалить. Для этого нагреваем печь до температуры в 100 градусов и помещаем туда плавильную емкость. Оставляем так на 18-25 минут, а после даем остыть естественным путем.
Б) Подготовка + процесс плавки латуни
В качестве исходных материалов используется медь + цинк, либо лом – второй вариант в приоритете.
 При потребности производства многокомпонентного сплава, потребуется позаботиться о легирующих добавках – олово, свинец, марганец, алюминий и прочие металлы.
При потребности производства многокомпонентного сплава, потребуется позаботиться о легирующих добавках – олово, свинец, марганец, алюминий и прочие металлы.Как подготовить вторсырье к плавке:
- чистка от мусора с поверхности, что актуально для вторичного сырья;
- промыть металл с мылом под водой- удаляем масляные пятна и прочие места с загрязнениями;
- при наличии на поверхности лома латуни лака, его снимают специальным химическим составом. Например – разбавитель лака. Делать это рекомендуется в помещении с хорошей вентиляцией.
Подготовки требует и помещение для плавки латуни – минимальное количество легковоспламеняющихся объектов + качественная вентиляционная система. Идеальный вариант – вынести печь на улицу под навес и расположить вдали от хозпостроек. Беспрепятственный доступ кислорода позволяет эффективнее производить плавку металла, и снижает риск получения ожогов.
Алгоритм плавки латуни:
- Нагрев форм внутри печки до 100 градусов по Цельсию.
 То, что нужно закалить и ложку с ёмкостью для плавки мы уже оговаривали. Для форм процедура требуется с целью удаления влаги, которая может спровоцировать разбрызгивание расплавленной латуни.
То, что нужно закалить и ложку с ёмкостью для плавки мы уже оговаривали. Для форм процедура требуется с целью удаления влаги, которая может спровоцировать разбрызгивание расплавленной латуни. - Укладываем латунь в тигель.
- Доводим температуру внутри печи до половины от точки плавления – 440-500 градусов Цельсия.
- Ставим тигель внутрь печи и увеличиваем температурный режим до предельного в 900-980 градусов. Для каждого из типов латуни обязан соблюдаться собственный режим плавления, потому, узнать о легирующих добавках лома необходимо заранее. Можно повысить температуру за пределы точки плавления, но это несет опасность окисления сплава, что способно испортить сырье.
- После расплавления латуни, с поверхности ложкой снимаем слой окисления. Мешать сплав запрещено. Действуйте аккуратно + избегайте пузырьков воздуха, которые могут повлиять на итоговое качество латуни в форме.
- Готовый сплав вытаскиваем из печи (щипцами за тигель) и заливаем в форму. Повторяем алгоритм необходимое количество раз.

При плавке латуни не рекомендуется использовать тигель из-под других цветных металлов – это снизит качество итогового сплава латуни + повлияет на ее физические/химические свойства.
Описание процесса производства латуни в домашних условиях:
В) Техника безопасности при плавке латуни в домашних условиях
Расплавление латуни или создание сплава с нуля – трудоемкий и опасный процесс, которым не советуется заниматься личностям без опыта в металлургийной промышленности. Новичкам советуется начинать путь освоения ниши с небольших порций плавления, постепенно увеличивая объемы до требуемых.
Требования по технике безопасности:
- рабочее место с вентиляцией. Можно на улице под навесом;
- вблизи печи не должны находиться легковоспламеняющиеся предметы, газовые баллоны или взрывоопасные жидкости;
- рядом с рабочим местом обязан находится огнетушитель и ведро с водой. Второе потребуется для снижения болевых ощущений во время получения ожогов от расплавленной латуни;
- уплотнённая одежда из хлопчатобумажной ткани, а обувь из натуральной кожи с большим параметром уплотнения;
- для легких – респиратор, для глаз – защитные очки;
- в месте работы должны отсутствовать провода и прочие мелочи, за которые человек может зацепиться ногами;
- избегайте брызг при заливке латуни в формы.
То, что в месте производства обязана располагаться аптечка – не обсуждается. Хоть температура плавления латуни в промышленном масштабе считается маленькой, одной тысячи градусов вполне хватит, чтобы изничтожить огнем все и вся в радиусе 10-30 метров. Соблюдайте технику безопасности, и плавка цветных металлов станет для вас не рисковым делом, а рядовым явлением с качественным результатом. Удачи!
Диаграмма— Точки плавления металлов
от Lexi, Content Development Group, эксклюзивно для Fire Mountain Gems and Beads®
При пайке твердым припоем важно знать температуру плавления металла, с которым вы работаете. Используйте эту таблицу, чтобы всегда убедиться, что температура текучести припоя ниже, чем температура плавления вашего металла.
| Тип металла | По Фаренгейту | Цельсия |
| Оловянный | 440 | 226 |
| Олово | 450 | 232 |
| Цинк | 786 | 418 |
| Алюминий | 1220 | 660 |
| Золото 585 пробы | 1615 | 879 |
| Стерлинговое Серебро | 1640 | 893 |
| Латунь | 1652-1724 | 900-940 |
| Золото 18 карат | 1700 | 926 |
| Чистое серебро | 1760 | 960 |
| Бронза | 1825 | 996 |
| Золото (чистое) | 1948 | 1064 |
| Медь | 1983 | 1084 |
| Никель | 2030 | 1110 |
| Высокоуглеродистая сталь | 2500 | 1371 |
| Нержавеющая сталь | 2550 | 1398 |
| Среднеуглеродистая сталь | 2600 | 1426 |
| Низкоуглеродистая сталь | 2700 | 1482 |
| Платина | 3221 | 1771 |
Как вам этот ресурс? Ваш отзыв помогает нам предоставлять ресурсы, которые наиболее важны для вас.
Точка плавления черных и цветных металлов (Полная таблица)
Какова точка плавления металла? Какая самая высокая и самая низкая температура плавления металла? Важной проблемой, о которой следует помнить при обработке металлических материалов, является температура плавления.
Во-первых, давайте посмотрим, что такое температура плавления.
Точка плавления вещества — это температура, при которой твердая и жидкая фазы чистого вещества уравновешиваются при определенном давлении, то есть при давлении и температуре точки плавления химический потенциал чистого вещества равен к химическому потенциалу жидкости.
Для твердой системы (наносистемы) из чистого материала с большой дисперсией нельзя игнорировать поверхностную часть, и ее химический потенциал зависит не только от температуры и давления, но также зависит от размера твердых частиц, которые относятся к термодинамический процесс фазового перехода первого рода.
Проще говоря, только определенная температура плавления может изменить форму металла, тем самым выковывая разные изделия.
Следовательно, мы должны сначала понять температуру плавления различных металлов перед обработкой.
Давайте погрузимся в температуру плавления различных черных и цветных металлов.
| № | Металл | Температура плавления (℃) | Примечание | |||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|
| | Черный металл | Черный металл Температура плавления стали 1400–1500 ℃ и 1200 ℃ чугуна.|||||||||||
| 2 | Хром | 1890 | Чистый металл | |||||||||
| 3 | Марганец | 1244 | Чистый металл | |||||||||
| Цветной металл | Цветной металл Металл | | ||||||||||
| 2 | Магний | 651 | Чистый металл | |||||||||
| 3 | Калий | 63 | Чистый металл | |||||||||
| 4 | 5 | Кальций | 815 | Чистый металл | ||||||||
| 6 | Стронций | 769 | Чистый металл | |||||||||
| 7 | Барий | 1285 | 1285 | 90001083 | Чистый металл | |||||||
| 9 | 9 0007 Свинец328 | Чистый металл | ||||||||||
| 10 | Цинк | 419 | Чистый металл | |||||||||
| 11 | Олово | 232 | 3 | 3 | Чистый металл | |||||||
| 13 | Никель | 1453 | Чистый металл | |||||||||
| 14 | Сурьма | 630 | Чистый металл | |||||||||
| 39 | Металл | |||||||||||
| 16 | Кадмий | 321 | Чистый металл | |||||||||
| 17 | Висмут | 271 | Чистый металл | |||||||||
| 18 | Золото | Серебро | 961 | Чистый металл | ||||||||
| 20 | 9 0007 Платина1774 | Чистый металл | ||||||||||
| 21 | Рутений | 231 | Чистый металл | |||||||||
| 22 | Палладий | 1555 | Чистый металл | |||||||||
| 24 | Иридий | 2454 | Чистый металл | |||||||||
| 25 | Бериллий | 1284 | Чистый металл | |||||||||
| 27 | Рубидий | 39 | Чистый металл | |||||||||
| 28 | Цезий | 29 | Чистый металл | |||||||||
| 29 | Титан | 1675 | Цирконий | 1852 | Чистый металл | |||||||
| 31 | Гафний | 2230 | Чистый металл | |||||||||
| 32 | Ванадий | 1890 | Чистый металл | |||||||||
| 33 | 9000 9000 9000 Тантал | 2996 | Чистый металл | |||||||||
| 35 | Вольфрам | 3410 | Чистый металл | |||||||||
| 36 | 37007 Молибден | 2617 | Чистый металл | |||||||||
| 38 | Индий | 157 | Чистый металл | |||||||||
| 39 | Таллий | 304 | Чистый металл | |||||||||
| 40 | Немецкий | |||||||||||
| 41 | Рений | 3180 | 900 07 Чистый металл||||||||||
| 42 | Лантан | 921 | Чистый металл | |||||||||
| 43 | Церий | 799 | Чистый металл | |||||||||
| 44 | Prasemium | Prasemium | ||||||||||
| 45 | Неодим | 1021 | Чистый металл | |||||||||
| 46 | Самарий | 1072 | Чистый металл | |||||||||
| 47 | 0008 Гадолиний | 1313 | Чистый металл | |||||||||
| 49 | Тербий | 1356 | Чистый металл | |||||||||
| 50 | Диспрозий | 1412 | Чистый металл | Чистый металл | ||||||||
| 52 | E рбий | 1529 | Чистый металл | |||||||||
| 53 | Тулий | 1545 | Чистый металл | |||||||||
| 54 | Иттербий | 819 | Чистый металл | |||||||||
| 56 | Скандий | 1541 | Чистый металл | |||||||||
| 57 | Иттрий | 1522 | Чистый металл | |||||||||
| 58 | 9000 |
В Периодической таблице элементов есть два неметаллических материала, которые представляют собой кремний и бор, и их температура плавления составляет 1420 ° C и 2300 ° C соответственно.
Какая самая высокая и самая низкая точка плавления? Из таблицы мы смогли ясно понять температуру плавления различных металлов. Что касается металла с самой высокой и самой низкой точкой плавления, я также дам вам краткое введение.
Есть металл серебристо-белого цвета, называемый цезием. Он был найден в 1860 году. За исключением ртути, он имеет самую низкую температуру плавления — 29 ° C.
Среди всех чистых металлов вольфрам имеет самую высокую температуру плавления.
В 1783 году два испанца обнаружили, что температура плавления вольфрама составляет 3417 ± 10 ° C.
Наиболее устойчивыми к высоким температурам являются карбиды ниобия (TG 0,88) и карбиды ниобия (HfG 0,95). Температуры плавления двух материалов составляли 4010 ± 75 ° C и 3960 ± 20 ° C соответственно.
Проверьте эти15 металлов с самой низкой температурой плавления — Материаловедение и инженерия
Часто люди предполагают, что металлы имеют высокие температуры плавления. Но знаете ли вы, что металлы составляют половину всех элементов, находящихся в жидком состоянии при комнатной температуре? (Их всего 2!)
Металлы могут иметь широкий диапазон температур плавления, и вы можете быть удивлены, узнав все способы использования низких температур плавления.
Температура плавления материала в первую очередь связана с прочностью связи. Материалы с более слабыми связями между атомами будут иметь низкую температуру плавления. Однако другие факторы, такие как кристаллическая структура, атомный вес и электронная структура, также могут влиять на температуру плавления.
Вот 15 металлов с самыми низкими температурами плавления; продолжайте читать, и вы увидите, чем полезны эти металлы!
15 металлов с самой низкой температурой плавления: ртуть, франций, цезий, галлий, рубидий, калий, натрий, индий, литий, олово, полоний, висмут, таллий, кадмий и свинец.
Мы также составили список металлов с максимальной температурой плавления . Прочтите эту статью, чтобы узнать больше!
| Металл | Точка плавления ( o C) | Кристаллическая структура | ||||
| Ртуть (Hg) | -39 | -39 | ** (Fr) | 27 | Неизвестно, BCC *** | |
| Цезий (Cs) | 28 | Телоцентрированный кубический | ||||
| Галлий (Ga) | 30 Орторомбический | |||||
| Рубидий (Rb) | 40 | Телоцентрированный кубический | ||||
| Калий (K) | 63 | Телоцентрированный кубический | Na0008 | 98 | Телоцентрированная кубическая | |
| Индий (дюйм) | 157 | Телоцентрированная четырехугольная | ||||
| 9018 4 Литий (Li) | 180 | Телоцентрированный кубический | ||||
| Олово (Sn) | 232 | Алмазный тетрагональный | ||||
| Полоний ** (Po) | Кубический||||||
| Висмут (Bi) | 271 | Ромбоэдрический | ||||
| Таллий (Tl) | 304 | Шестигранник с плотной упаковкой | ||||
| Гексагональный плотноупакованный | ||||||
| Свинец (Pb) | 327 | Гранецентрированный кубический |
Почему некоторые металлы имеют низкую температуру плавления?
Простой ответ: низкая энергия связи .
Твердое тело можно представить как группу связанных вместе атомов, которые колеблются взад и вперед, но обычно остаются в одном и том же положении.
Колебание атомов — их кинетическая энергия — это то, что мы обычно называем температурой. Более высокая температура означает, что атомы колеблются быстрее. В какой-то момент они так быстро вибрируют, что могут разорвать свои узы и проскользнуть мимо друг друга.
У каждого атома своя вибрация, поэтому даже в твердом состоянии есть некоторые атомы, которые могут временно разрывать свои связи и перемещаться через материал. Это явление называется «диффузией».
«Таяние» — это когда большая часть облигаций разрывается. В кристаллических твердых телах, таких как металлы, все связи имеют одинаковую длину и силу, поэтому есть точная точка, в которой почти все атомы получают достаточно тепловой энергии, чтобы разорвать свои связи. Чем больше энергии требуется для достижения этой точки, тем выше температура плавления.
Так когда же атомы достигают этой точки?
Очевидно, что наиболее очевидным фактором является прямая прочность связи . Вот график прочности связи (представленной энтальпией образования) по сравнению с температурой плавления.
Есть еще несколько свойств, которые влияют на температуру плавления, но не учитываются в энтальпии образования или энергии диссоциации связи. Например: сколько связей окружает атом?
В целом, мы считаем, что эффектов от связей являются результатом непосредственного «касания» атома ближайшими соседями.(Хотя есть эффект и от соседних атомов — например, если вы делаете наночастицы всего с несколькими атомами вместе, связи меньше, чем обычно, и наночастица будет иметь более низкую температуру плавления, чем объемный материал).
Кристаллическая структура элемента определяет длину связи и количество ближайших соседей (также называемое «координационным числом»). Это влияет на прочность связи таким образом, что она не улавливается энергией диссоциации связи, но отражается на температуре плавления.
Вот почему элементы с высокими температурами плавления обычно имеют кристаллическую структуру с высокой степенью упаковки: FCC, HCP или BCC. С другой стороны, элементы с низкими температурами плавления обычно имеют кристаллическую структуру с более низкой упаковкой.
Конечно, все еще существуют металлы с низкой температурой плавления с кристаллическими структурами FCC, HCP или BCC, поскольку они являются наиболее стабильными структурами.
Сплавы с низкой температурой плавления
Хотя не существует сплавов с исключительно высокими температурами плавления, поскольку легирование приводит к более низкой температуре плавления, чем любой отдельный элемент, существует много полезных сплавов с низкими температурами плавления, таких как припои, легкоплавкие сплавы и амальгамы.
При объединении двух элементов одна чрезвычайно общая точка называется эвтектической точкой . Точка эвтектики имеет несколько отличных свойств, но важно то, что она имеет низкую точку плавления.
Вот график температуры плавления сплава свинца и олова: вы можете видеть, что самая низкая точка плавления составляет около 75% олова и 25% свинца. Это эвтектическая точка для бинарного сплава свинец-олово.
Конечно, у вас может быть сплав с более чем двумя базовыми элементами.В зависимости от системы сплава возможно наличие нескольких эвтектических точек (хотя это трудно визуализировать, поскольку для ее рисования потребуется более двух измерений).
Легкоплавкие сплавы — это сплавы, специально разработанные для обеспечения низкой температуры плавления. Обычно они состоят в основном из Bi, Pb и Sn.
| Низкоплавкий Название сплава | Bi | Pb | Sn | Cd | Cd | Melan Точка | |||||||
| Cerrobend | 50% | 26.7% | 13,3% | 10% | — | — | 70 o C | ||||||
| Cerrolow 117 | 5,3 44,7% | 8,3% | 8,3% | 19,1% | — | 47 o C | |||||||
| Cerrolow 174 | 57% | — | 17% | — | 8 9018 9018 | 3 C | |||||||
| Field’s | 32% | — | 17% | — | 51% | — | 62 o C | 000— | 10% | — | 21.5% | 68,5% | -19 o C |
| Harper’s | 44% | 25% | 25% | 6% | 8 — | 758 75 o C||||||||
| Lichtenberg’s | 50% | 30% | 20% | — | — | — | 92 o Lipow 50% | 27% | 13% | 10% | — | — | 80 o C |
| Ньютон | 50% | 20% | 20% — | — | — | 96 o C | |||||||
| Rose’s | 50% | 25% | 25% | — | — | 898 o C | |||||||
| Wood’s | 50% | 25% | 12.5% | 12,5% | — | — | 71 o C |
Припои можно рассматривать как подмножество легкоплавких сплавов. Я расскажу подробнее о его применении в подразделе «Применение», но припои используются для соединения материалов, что немного похоже на деликатную сварку. Исторически припои были на основе свинца , но когда ученые обнаружили, что свинец опасен для здоровья, бессвинцовые припои (обычно с использованием висмута, индия и / или олова) в значительной степени заменили припои на основе свинца.
Амальгамы — еще один токсичный тип сплава с низкой температурой плавления. Амальгамы — это (были) сплавы на основе ртути, которые использовались в стоматологии. Сейчас они редки, хотя некоторые сплавы на основе ртути используются в химических процессах.
Желаемые свойства материалов с низкой температурой плавления?
Конечно, металлы с низкими температурами плавления могут использоваться, как и другие металлы, в ситуациях, когда температура плавления не имеет значения, поэтому обычные свойства, такие как прочность, пластичность, электропроводность и т. Д.полезны в зависимости от приложения.
Но если вы выбираете металл именно потому, что он имеет низкую температуру плавления, вам может потребоваться несколько связанных свойств:
Энтальпия плавленияЭто энергия, необходимая для превращения твердого вещества в жидкость при температуре плавления. Высокая () энтальпия плавления может быть хорошей, потому что она снижает вероятность плавления материала, если скачки температуры слишком близки к его точке плавления.С другой стороны, низкая энтальпия плавления может быть хорошей, потому что это означает, что плавление во время обработки дешевле.
Изменение объемаОбычно требуется небольшое сокращение объема при затвердевании из жидкости. Высокие изменения объема — это плохо, потому что это означает, что отливка будет иметь пустоты от изменения объема. Висмут и галлий уникальны, потому что они расширяются при затвердевании. Они могут быть хорошими для создания плотных стыков, потому что металл будет расширяться и сжимать стык при охлаждении.
ТеплопроводностьОбычно требуется высокая теплопроводность. Теплопроводность показывает, насколько быстро тепло передается от одной части металла к другой — это также влияет на охлаждение. Если вы используете сплав специально для того, чтобы плавить его снова и снова, высокая теплопроводность позволит плавлению происходить быстрее, с меньшим расходом тепла на воздух или тигель. Кроме того, металлы, используемые в жидком состоянии (например, жидкое олово для обработки стекла), обычно должны иметь высокую проводимость для взаимодействия с другими частями процесса.
Стабильность циклаСтабильность цикла означает, насколько материал изменяется за цикл твердое тело → жидкость → твердое тело. Во время этого цикла размер зерен может измениться, состав может стать менее однородным (например, сплав тяжелого металла и легкого металла может разделиться, так что нижняя часть станет более плотной, чем верхняя), металл может испариться, если температура кипения будет слишком высокой. закрыть температуру плавления, металл может вступить в реакцию с кислородом или намочить тигель и т. д.Все это снижает стабильность цикла, потому что конечный продукт не такой, как исходный продукт после цикла нагрева-охлаждения. Стабильность цикла всегда хорошая, но особенно в тех случаях, когда металл используется в жидкой форме (например, оловянные бассейны для стекла).
ТеплоемкостьЕсли вам нужен сплав именно потому, что он дешев в обработке, обычно вам нужна низкая теплоемкость. Теплоемкость — это то, насколько изменяется температура материала при вводе энергии — низкая теплоемкость может достичь точки плавления с низкими затратами энергии.Если вы используете этот металл по причинам, не связанным с его температурой плавления, высокая теплоемкость будет хорошей, потому что это снизит вероятность случайного плавления материала.
ТоксичностьОчевидно, что токсичность — это плохо, и это серьезный недостаток ртути и свинца. В контролируемой среде (сопровождаемой большим количеством документов) токсичные элементы могут использоваться при переработке. В целом, однако, сейчас редко можно добавлять токсичные элементы в конечные продукты, даже если это не представляет особой опасности для населения.Люди по-прежнему предпочитают избегать свинцовых пуль, несмотря на то, что отравление свинцом — меньшая из ваших проблем, если ребенок играет с пулей.
СмачиваемостьСмачивание зависит как от жидкости, так и от твердого вещества. Смачивание относится к углу, под которым капля жидкости образует твердое тело, и связано с тем, насколько жидкость прилипает к твердому телу. Если вы часто используете металл в жидкой форме, низкая смачиваемость обычно хороша, потому что это гарантирует, что вы не потеряете металл, который прилипает к чему-то другому.
Например, жидкое олово используется для создания плоских стекол, потому что олово не смачивает стекло. Однако, если вы использовали сплав с низкой температурой плавления для соединения деталей (например, припоя), высокая смачиваемость является очень важной характеристикой.
Коэффициент диффузииКоэффициент диффузии обычно вызывает беспокойство у металлов с высокой температурой плавления, поскольку низкий коэффициент диффузии важен для сопротивления ползучести. Если вы используете сплав с низкой температурой плавления для сопротивления ползучести, у вас есть более серьезные проблемы, о которых следует беспокоиться.(На самом деле, забавный факт: ваш компьютер / телефон становится медленнее со временем, потому что очень маленькие провода ползут из-за тепла компьютера. Поэтому для этих припоев предпочтительнее низкий коэффициент диффузии.) Однако бывают ситуации, когда высокий коэффициент диффузии это хорошо. Высокий коэффициент диффузии обеспечивает однородность жидкого сплава по составу. Это также может быть полезно при связывании материалов в таких приложениях, как 3D-печать.
Стойкость к коррозии и окислениюСтойкость к окислению — это степень вероятности реакции чего-либо на кислород. Коррозионная стойкость — это вероятность того, что материал вступит в реакцию с чем-то еще в окружающей среде. В жидком состоянии диффузия происходит намного быстрее, поэтому реакции особенно летучие. Многие металлы, такие как титан, сильно окисляются в жидком состоянии, поэтому их часто плавят в вакууме. Плавление в вакууме обходится дорого, поэтому, если вы используете олово, потому что его плавить дешево, вы, вероятно, также захотите убедиться, что он не слишком сильно окисляется. То же самое и с коррозией, хотя в производственной среде легче контролировать большинство коррозионных загрязнителей.
ВоспламеняемостьДа, некоторые металлы горят. Магний — известный пример. Воспламеняемость при обработке строго отрицательная. Подобно сильно окисляющим материалам, легковоспламеняющиеся металлы при обработке требуют вакуума или некислородной среды.
РадиоактивностьДа, многие некоторые металлы с низкой температурой плавления также радиоактивны (оказывается, нестабильные внутриатомные силы также могут приводить к нестабильным межатомным взаимодействиям). Некоторые радиоактивные элементы явно используются из-за их радиоактивного потенциала (и точка плавления не имеет значения), но в остальном радиоактивность представляет опасность для здоровья человека.
Общие применения металлов с низкой температурой плавления
Металлы с низкой температурой плавления могут быть ценными по многим причинам: они дешевы в обработке (поскольку большие затраты на обработку обычно связаны с нагревом), их можно использовать для плавления и соединения предметов (припои), их можно использовать в качестве предохранительный клапан температуры (если предохранитель нагреется и расплавится, он отключит машину), они обычно имеют высокую диффузию, что может сделать их идеальными для переплета в 3D-печати, и они полезны для приложений, требующих жидкого металла, поскольку им требуется меньше энергии, чтобы стать жидкими.
Припои наиболее часто используются для сплавов с низкой температурой плавления, и вы можете рассматривать припои как подмножество легкоплавких сплавов. Припои используются специально, чтобы соединять предметы вместе — как пистолет для горячего клея. Припои используются в ювелирных изделиях (потому что металл выглядит одинаково) и в печатных платах (для сохранения проводимости). Припои также могут использоваться в механическом цехе для временного «приклеивания» труднообрабатываемой детали на место во время работы с ней. В настоящее время припои обычно изготавливают из висмута, индия и олова, но раньше основным компонентом припоев был свинец.
Устройства безопасности — еще одно распространенное применение для легкоплавких сплавов. Такие устройства, как пожарные спринклеры, котлы и сосуды высокого давления с подогревом, могут иметь заглушку из легкоплавкого сплава. Эта свеча плавится при определенной температуре, сбрасывая опасное давление или срабатывая спринклерную систему даже при отсутствии питания. Эти предохранительные заглушки очень надежны, потому что на них не повлияет отключение электроэнергии или механические поломки, но они также предназначены для одноразового использования. (Что ж, надеюсь, они будут бесполезны).Защитные устройства обычно изготавливаются из галлия и индия.
Связка — это применение для легкоплавких сплавов, которое требует хорошего смачивания. Если металл можно превратить в жидкость при низкой температуре, в то время как другие части все еще остаются твердыми, металл будет связывать другие части вместе, когда остынет. Склеивание похоже на пайку, но термин «склеивание» обычно используется, когда вы рассматриваете склеивание на большой площади поверхности, в то время как припои обычно имеют форму проволоки и плавятся в определенных точках.
Покрытия — это способ защиты одного материала другим.Например, сталь очень прочная и имеет отличные механические свойства, но плохие коррозионные свойства. Хотя обычно покрывают сталь цинком (оцинкованной сталью) или краской, легкоплавкие сплавы, состоящие из таких элементов, как олово и галлий, также могут использоваться в качестве антикоррозийного покрытия для конструкционных металлов.
Особые области применения каждого металла с низкой температурой плавления
Вот список металлов с низкой температурой плавления и их применения:
РтутьРтуть и ртутные сплавы (называемые амальгамами) используются для изготовления термометров и зубных пломб.Милосердие также можно использовать при добыче драгоценных металлов, таких как золото, потому что жидкая ртуть относительно дешева и может растворять золото.
ФранцийПоскольку Франций является чрезвычайно радиоактивным элементом, этот металл не используется в коммерческих целях. Он использовался в исследовательских целях в области химии и исследования атомной структуры. Франций — очень редкий элемент, который быстро распадается. Его перерыв составляет всего 22 минуты.
ЦезийНерадиоактивный Цезий обычно используется в нефтегазовой промышленности в буровых растворах.Радиоизотопы цезия используются как излучатели гамма-излучения. Самое интересное применение цезия — атомные часы. Это самые точные часы, которые когда-либо были изобретены!
ГаллийГаллий — это металл со второй по величине точкой плавления. Его температура плавления достаточно низка, чтобы он растаял в вашей руке (или в чашке чая), что является веселой шуткой, названной одной из моих любимых книг «Исчезающая ложка». Обычный эвтектический сплав олова, галлинстан, состоит из галлия, индия и олова.Он имеет температуру плавления около -19 o ° C, что позволяет ему быть жидким металлом, заменяющим ртуть в термометрах. Эта жидкость с высокой проводимостью также может быть использована в качестве охлаждающей жидкости. Поскольку галлий легко сплавляется с другими металлами и является нетоксичным металлом с самой низкой температурой плавления, он является ключевым элементом плавких предохранительных пробок.
РубидийРубидий взрывается в воде, поэтому в чистом виде он мало используется. Он может придавать фейерверку пурпурный цвет, а также может использоваться в приложениях экспериментальной физики, таких как термоэлектрики, генераторы или магнитометры.
КалийКалий — это элемент с высокой реакционной способностью, который значительно ограничивает его технические применения. Он играет важную роль в питании. Оксиды калия могут использоваться в производстве стекла и мыла. Как и все металлы группы 1, он больше используется из-за своих химических свойств, чем как объемный металл.
НатрийНатрий также взрывается в воде (или, по крайней мере, загорается), и гораздо более известен благодаря его использованию в поваренной соли и других химических соединениях.Натрий можно использовать для создания желтого цвета в фейерверках или в натриевых лампах, но на самом деле он не используется в чистом виде, кроме как в качестве промежуточного шага к другому химическому веществу.
ИндийИндий часто легируют галлием для многих из тех же применений. Индий также является ключевым компонентом бессвинцовых припоев.
ЛитийВ материаловедении и машиностроении литий используется в авиастроении. Его добавляют в алюминий с целью снижения веса.Помимо легких сплавов Al-Li, литий используется для производства литий-ионных аккумуляторов для электронных устройств. Он также используется в качестве источника трития для ядерных применений и имеет применение в медицине.
ОловоОлово — очень полезный металл, поскольку он имеет низкую температуру плавления и к тому же нетоксичен. Олово сплавлено для изготовления оловянных изделий, хотя большая часть олова в мире используется для изготовления припоев. Припои — это куски металла, которые плавятся, а затем используются для соединения других объектов.Припой можно использовать для соединения ювелирных изделий, хотя его самое важное применение — это соединение проводов на печатных платах. Олово также используется для изготовления плоского стекла (это проблема с древних времен): поскольку стекло не прилипает к олову и имеет меньшую плотность, чем олово, распространенным методом изготовления плоского оконного стекла является плавление стекла на поверхности бассейна. расплавленного олова. Стекло всплывет вверх, образует плоский лист, и его можно охладить до плоского стекла.
ПолонийПолоний был открыт Пьером и Мари Кюри и назван в честь страны ее рождения, что означает, как вы уже догадались, он радиоактивен и чрезвычайно токсичен.У полония есть несколько нишевых применений, в которых используется его радиоактивность, но металл редко намеренно легируют. Одним из примеров, который я нашел, был сплав на основе никеля со следами полония, разработанный для создания преднамеренно радиоактивных свечей зажигания. Утверждается, что эти радиоактивные свечи зажигания способствовали лучшему сгоранию топлива, но они нуждались в частой замене, учитывая период полураспада полония.
ВисмутВ отличие от большинства материалов, висмут расширяется при затвердевании (вероятно, потому, что он имеет моноклинную кристаллическую структуру, которая имеет ужасную упаковку и, вероятно, способствует низкой температуре плавления металла).Расширение висмута при охлаждении делает его превосходным для соединения других материалов, поскольку расширенная часть будет оказывать дополнительное давление, чтобы все было вместе. Висмут также является дешевой нетоксичной легирующей добавкой к припоям. Поскольку висмут также имеет высокую плотность и мягкость, аналогичную свинцу, его часто используют в качестве нетоксичной замены свинцу, даже помимо припоев. (Кристаллы висмута тоже красивы, их можно использовать для рисования, как грифель карандаша).
ТаллийВозможно, жидкий металл с самой низкой температурой плавления — это эвтектика между ртутью и таллием (8.5% таллия). Если вас беспокоит токсичная ртуть в этом сплаве, вам стоит еще больше беспокоиться о токсичности таллия. Таллий не только чрезвычайно токсичен, он также может быть радиоактивным, поэтому вы, вероятно, никогда раньше не слышали об этом металле.
КадмийКадмий особенно устойчив к коррозии, что означает, что его можно использовать в качестве защитного покрытия для металлов, таких как сталь. Кадмий может быть токсичным, особенно если он просачивается в окружающую среду и попадает в пищевую цепочку (вот почему вы должны утилизировать свои батареи!).Однако в больших объемах металл не так опасен и может легироваться в припои в качестве более безопасной альтернативы свинцу.
СвинецВсем известно, что свинец токсичен (это нейротоксин), но он был чрезвычайно полезным металлом на протяжении веков — отчасти потому, что его было легко добывать, но также потому, что его низкая температура плавления позволяет легко отливать. Свинец также мягкий, пластичный и относительно устойчивый к кислороду. Свинец использовался в припое, пулях, рыболовных приманках, батареях, оловянных изделиях, легкоплавких сплавах, красках и многом другом; хотя правительства и природоохранные агентства десятилетиями пытались сократить использование свинца.
Последние мысли
Многие люди думают, что сплавы с высокой температурой плавления более полезны, чем сплавы с низкой температурой плавления, но я надеюсь, что теперь вы знаете, что это не так!
Металлы с низкой температурой плавления чрезвычайно полезны по целому ряду причин, хотя они, к сожалению, также имеют тенденцию быть токсичными или радиоактивными. Металлические элементы с низкой температурой плавления, как правило, имеют неплотноупакованные кристаллические структуры, а также низкую энергию связи.
Используя точки эвтектики в составе сплава, инженеры смогли снизить температуры плавления некоторых сплавов ниже точки плавления чистого элемента, даже создав галлинстан, нетоксичную замену ртути, которая является жидкой при комнатной температуре.
Ссылки и дополнительная литература
Если вам понравилась эта разбивка металлов с низкой температурой плавления, вас также может заинтересовать мое объяснение металлов с высокой температурой плавления! В этой статье я более подробно остановлюсь на свойствах, влияющих на высокую температуру плавления.
Для более технического взгляда на сплавы с низкой температурой плавления, вот хороший научный обзор.
Если вы хотите узнать больше об этих свечах зажигания с радиоактивным полонием, посетите эту веб-страницу.
Эта статья и эта статья являются нашими источниками химического состава легкоплавких сплавов.
Если вам понравилось просматривать несколько приложений для множества различных элементов, вам, вероятно, понравится книга Сэма Кина The Disappearing Spoon . Возможно, это единственная книга, которой мы с женой владели до знакомства, так что теперь она у нас на двух разных языках!
Произошла ошибка при настройке пользовательского файла cookie
Этот сайт использует файлы cookie для повышения производительности. Если ваш браузер не принимает файлы cookie, вы не можете просматривать этот сайт.
Настройка вашего браузера для приема файлов cookie
Существует множество причин, по которым cookie не может быть установлен правильно. Ниже приведены наиболее частые причины:
- В вашем браузере отключены файлы cookie. Вам необходимо сбросить настройки своего браузера, чтобы он принимал файлы cookie, или чтобы спросить вас, хотите ли вы принимать файлы cookie.
- Ваш браузер спрашивает вас, хотите ли вы принимать файлы cookie, и вы отказались. Чтобы принять файлы cookie с этого сайта, используйте кнопку «Назад» и примите файлы cookie.
- Ваш браузер не поддерживает файлы cookie. Если вы подозреваете это, попробуйте другой браузер.
- Дата на вашем компьютере в прошлом. Если часы вашего компьютера показывают дату до 1 января 1970 г., браузер автоматически забудет файл cookie. Чтобы исправить это, установите правильное время и дату на своем компьютере.
- Вы установили приложение, которое отслеживает или блокирует установку файлов cookie. Вы должны отключить приложение при входе в систему или проконсультироваться с системным администратором.
Почему этому сайту требуются файлы cookie?
Этот сайт использует файлы cookie для повышения производительности, запоминая, что вы вошли в систему, когда переходите со страницы на страницу. Чтобы предоставить доступ без файлов cookie потребует, чтобы сайт создавал новый сеанс для каждой посещаемой страницы, что замедляет работу системы до неприемлемого уровня.
Что сохраняется в файле cookie?
Этот сайт не хранит ничего, кроме автоматически сгенерированного идентификатора сеанса в cookie; никакая другая информация не фиксируется.
Как правило, в файлах cookie может храниться только информация, которую вы предоставляете, или выбор, который вы делаете при посещении веб-сайта. Например, сайт не может определить ваше имя электронной почты, пока вы не введете его. Разрешение веб-сайту создавать файлы cookie не дает этому или любому другому сайту доступа к остальной части вашего компьютера, и только сайт, который создал файл cookie, может его прочитать.
Точки плавления металлов по сравнению с неметаллами
Точка плавления элемента — это момент, когда он превращается из твердой формы в жидкость.Металлы, которые являются физически гибкими элементами, способными проводить тепло и электричество, имеют тенденцию быть твердыми при комнатной температуре из-за их относительно высоких температур плавления. Неметаллы, являющиеся физически слабыми и плохо проводящими тепло и электричество, могут быть твердыми, жидкими или газообразными, в зависимости от элемента. Температуры плавления металлов и неметаллов сильно различаются, но металлы имеют тенденцию плавиться при более высоких температурах.
Паттерны точки плавления
Как только вы включите точки плавления всех элементов в периодической таблице, появляется закономерность.Когда вы перемещаетесь слева направо по периоду (горизонтальный ряд), температура плавления элементов начинает расти, затем они достигают пика в группе 14 (вертикальный столбец с углеродом наверху) и, наконец, они уменьшаются. по мере приближения к правой стороне. По мере того, как вы перемещаетесь по таблице сверху вниз, картина подъема и падения становится меньше, а это означает, что элементы в более низкие периоды имеют более похожие точки плавления.
Типы связывания, повышающие температуру плавления
Существует два типа связывания, которые приводят к более высоким температурам плавления: ковалентное и металлическое.Ковалентные связи — это когда электронные пары поровну распределяются между атомами, и они притягивают атомы еще ближе друг к другу, если задействовано несколько пар электронов. В металлических связях участвуют электроны, которые делокализованы: они плавают между многими атомами, а не только двумя, а положительно заряженные ядра прочно связаны с окружающим «морем» электронов.
Что понижает точку плавления
Поскольку сильные связи между атомами дают элементам более высокие температуры плавления, также верно и то, что более низкие температуры плавления являются результатом более слабых связей или отсутствия связей между атомами.Ртуть, металл с самой низкой температурой плавления — -38,9 градуса по Цельсию или -37,9 градуса по Фаренгейту — не может образовывать никаких связей, поскольку он имеет нулевое сродство к электрону. Многие неметаллы, такие как кислород и хлор, очень электроотрицательны: они имеют высокое сродство к электронам и эффективно отрывают их от другого атома, поэтому связь легко разрывается. В результате эти неметаллы имеют отрицательную температуру плавления.
Тугоплавкие металлы
Хотя многие металлы имеют высокие температуры плавления, существует избранная группа из нескольких элементов, которые имеют исключительно высокие температуры плавления и являются физически прочными.Это тугоплавкие металлы или металлы с температурой плавления не менее 2000 градусов по Цельсию или 3632 градусов по Фаренгейту. Благодаря своей термостойкости они используются в разнообразном оборудовании, от микроэлектроники до ракет. Например, металлы вольфрам и молибден рассматриваются в качестве строительного материала на электростанциях из-за их исключительно высоких температур плавления, которые обеспечивают огромную термостойкость.
Группа 1: Свойства щелочных металлов
На этой странице обсуждаются тенденции изменения некоторых атомных и физических свойств элементов Группы 1 — лития, натрия, калия, рубидия и цезия.В разделах ниже рассматриваются тенденции изменения атомного радиуса, энергии первой ионизации, электроотрицательности, точек плавления и кипения и плотности.
Тенденции атомного радиуса
На диаграмме ниже показано увеличение атомного радиуса вниз по группе.
Радиус атома определяется двумя факторами:
- Число слоев электронов вокруг ядра
- Притяжение внешних электронов к ядру
Сравните электронные конфигурации лития и натрия:
- Li: 1s 2 2s 1
- Na: 1s 2 2s 2 2p 6 3s 1
В каждом элементе внешний электрон получает суммарный заряд +1 от ядра.Положительный заряд ядра компенсируется отрицательными зарядами внутренних электронов. Этот эффект показан на рисунке ниже:
Это верно для каждого из других атомов в Группе 1. Единственный фактор, влияющий на размер атома, — это количество слоев внутренних электронов, которые окружают атом. Больше слоев электронов занимают больше места из-за отталкивания электронов. Следовательно, атомы увеличиваются в размере на вниз по группе. — \]
График, показывающий первые энергии ионизации атомов Группы 1, показан выше.Обратите внимание, что энергия первой ионизации уменьшается по группе. Энергия ионизации определяется тремя факторами:
- заряд на ядре,
- степень экранирования внутренними электронами,
- расстояние между внешними электронами и ядром.
Внизу группы увеличение заряда ядра в точности компенсируется увеличением числа внутренних электронов. Как упоминалось ранее, в каждом из элементов Группы 1 самые удаленные электроны испытывают суммарный заряд +1 от центра.Однако расстояние между ядром и внешними электронами увеличивается вниз по группе; электроны становится легче удалить, а энергия ионизации падает.
Тенденции электроотрицательности
Электроотрицательность — это мера тенденции атома притягивать связывающую пару электронов. Обычно его измеряют по шкале Полинга, по которой наиболее электроотрицательному элементу (фтору) присваивается электроотрицательность 4,0 (таблица A2).
График, показывающий электроотрицательность элементов Группы 1, показан выше.Каждый из этих элементов имеет очень низкую электроотрицательность по сравнению с фтором, и электроотрицательность уменьшается от лития к цезию.
Изобразите связь между атомом натрия и атомом хлора. Связь можно считать ковалентной, состоящей из пары общих электронов. Электронная пара будет притягиваться к атому хлора, потому что ядро хлора содержит намного больше протонов, чем ядро натрия. Это показано на рисунке ниже:
Электронная пара настолько близка к хлору, что происходит эффективный перенос электрона от атома натрия к атому хлора — атомы ионизируются.Это сильное притяжение ядра хлора объясняет, почему хлор гораздо более электроотрицателен, чем натрий.
Теперь сравните это со связью литий-хлор. Чистое натяжение с каждого конца связи такое же, как и раньше, но атом лития меньше атома натрия. Это означает, что электронная пара будет сильнее притягиваться к чистому заряду +1 на литиевом конце и, следовательно, ближе к нему.
В некоторых соединениях лития часто присутствует степень ковалентной связи, которой нет в остальной части группы.Например, йодид лития растворяется в органических растворителях; это типичное свойство ковалентных соединений. Атом йода настолько велик, что притяжение ядра йода к паре электронов относительно невелико, и полностью ионная связь не образуется.
Обобщение тенденции вниз по группе
По мере того, как атомы металла увеличиваются в размерах, любая пара связывающих электронов удаляется от ядра металла и, следовательно, менее сильно к нему притягивается. Это соответствует снижению электроотрицательности в группе 1.За исключением некоторых соединений лития, каждый из элементов группы 1 образует соединения, которые можно считать ионными. Каждый из них настолько слабо электроотрицателен, что в связи группы 1 с галогеном мы предполагаем, что электронная пара на более электроотрицательном атоме притягивается так близко к этому атому, что образуются ионы.
Тенденции температур плавления и кипения
На рисунке выше показаны точки плавления и кипения элементов Группы 1. И температура плавления, и температура кипения снижаются по группе.
Когда любой из металлов группы 1 плавится, металлическая связь ослабляется настолько, что атомы могут двигаться более свободно, и полностью разрывается при достижении точки кипения. Уменьшение точек плавления и кипения отражает уменьшение прочности каждой металлической связи.
Атомы в металле удерживаются вместе притяжением ядер к электронам, которые делокализованы по всей массе металла. По мере увеличения размера атомов расстояние между ядрами и этими делокализованными электронами увеличивается; следовательно, аттракционы падают.Атомы легче разделяются, образуя жидкость, а затем газ. Как обсуждалось ранее, каждый атом демонстрирует чистую тягу от ядер +1. Повышенный заряд ядра в нижней части группы компенсируется дополнительными уровнями экранирования электронов. Как и прежде, тенденция определяется расстоянием между ядром и связывающими электронами.
Тенденции плотности
Плотность элементов группы 1 увеличивается вниз по группе (за исключением колебания в сторону уменьшения для калия).Эта тенденция показана на рисунке ниже:
Металлы этой серии относительно легкие — литий, натрий и калий менее плотны, чем вода (менее 1 г / см -3 ). Трудно дать простое объяснение этой тенденции, потому что плотность зависит от двух факторов, оба из которых меняются в зависимости от группы. Атомы упакованы одинаково, поэтому учитываются два фактора: сколько атомов может быть упаковано в данном объеме, и масса отдельных атомов.Упакованное количество зависит от объемов отдельных атомов; эти объемы, в свою очередь, зависят от их атомного радиуса.
Атомный радиус увеличивается вниз по группе, поэтому объем атомов также увеличивается. Таким образом, в заданный объем может быть помещено меньше атомов натрия, чем атомов лития. Однако по мере того, как атомы становятся больше, их масса увеличивается. Данное количество атомов натрия будет весить больше, чем такое же количество атомов лития. Следовательно, 1 см 3 натрия содержит меньше атомов, чем тот же объем лития, но каждый атом весит больше.Для определения плотности требуются математические расчеты.

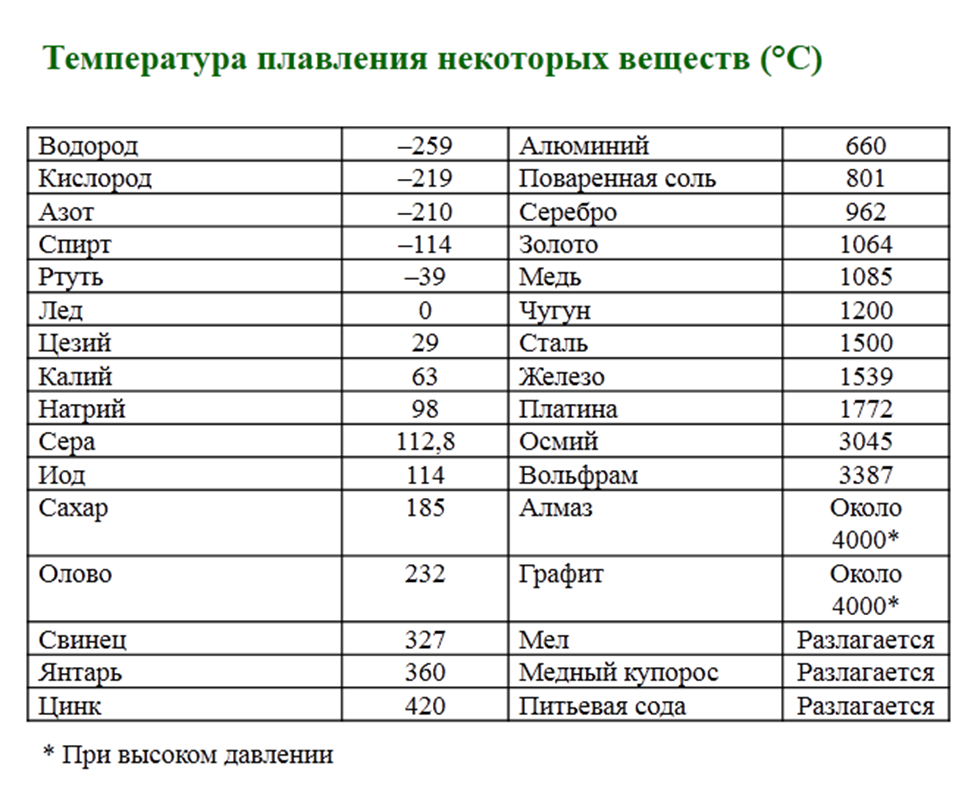 И., Жарский И. М. Большой химический справочник. — М: Советская школа, 2005. — 608 с.
И., Жарский И. М. Большой химический справочник. — М: Советская школа, 2005. — 608 с.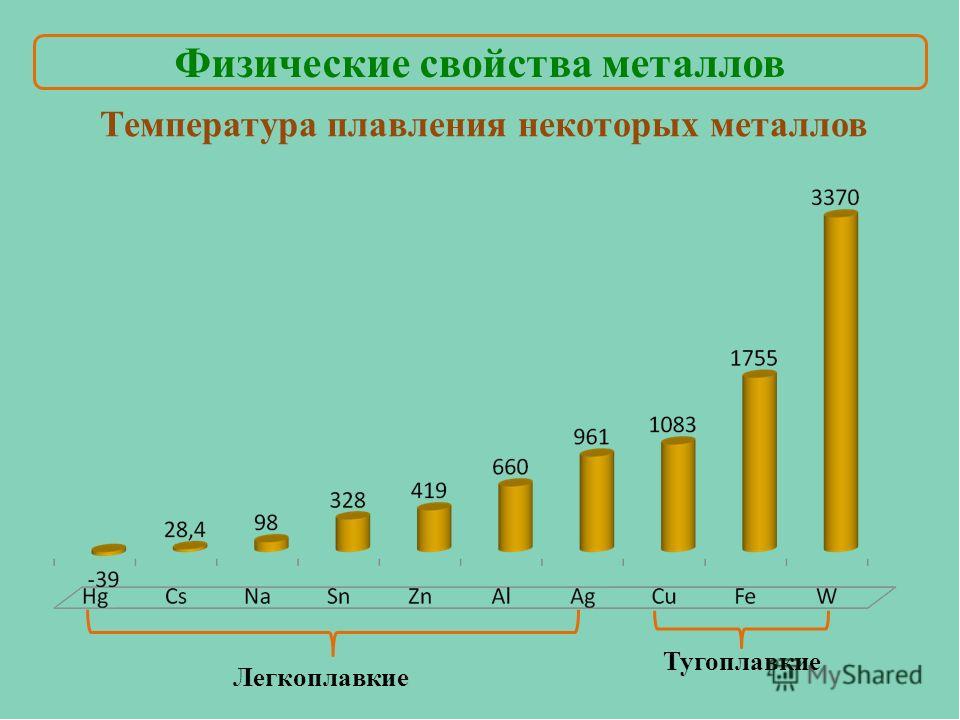


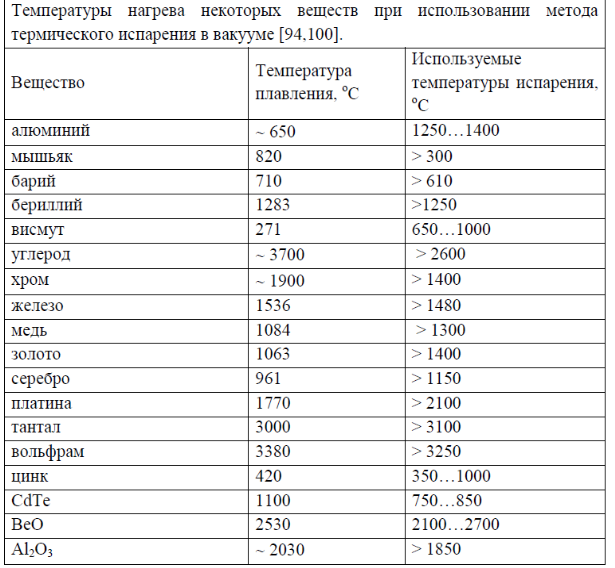
 Его температура плавления составляет пиковые 1055 градусов Цельсия.
Его температура плавления составляет пиковые 1055 градусов Цельсия. То, что нужно закалить и ложку с ёмкостью для плавки мы уже оговаривали. Для форм процедура требуется с целью удаления влаги, которая может спровоцировать разбрызгивание расплавленной латуни.
То, что нужно закалить и ложку с ёмкостью для плавки мы уже оговаривали. Для форм процедура требуется с целью удаления влаги, которая может спровоцировать разбрызгивание расплавленной латуни.