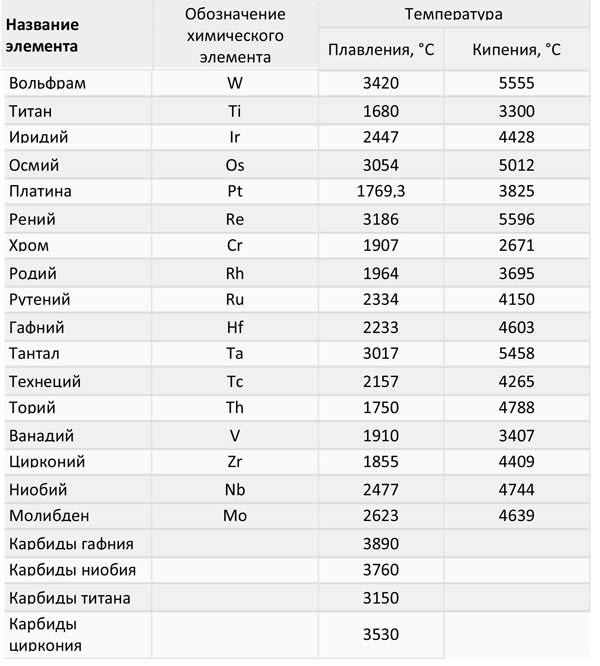
Охлаждающие свойства меди
- химическая формула — Cu
- плотность — 8,93 кг / дм 3
- точка кипения — 2560 градусов по Цельсию
- температура плавления — 1083,4 ° С
- предел прочности на разрыв — 210-240 Н / мм2
- теплопроводность (для 0 ст. С) — 397 Вт / мК
- тепловое расширение (для 20 — 100 град. C) — 0,0168 мм / м / ºC
Техническая медь имеет много примесей, которые в некоторых случаях очень существенно влияют на ее физико-механические свойства:
- элементы, которые образуют твердые растворы в меди (например, Al, Fe, Ni, Sn, Zn, Ag, Pt, Cd и др.), которые оказывают небольшое влияние на пластические свойства меди, повышая ее твердость и прочность, снижая электропроводность и тепловой;
- элементы, которые не образуют твердых растворов с медью даже в небольших количествах. В эту группу входят главным образом свинец и висмут, которые создают эвтектическую смесь на границах зерен, являются наиболее неблагоприятными загрязнителями меди, снижая в наибольшей степени ее пластические и физические свойства;
- элементы, которые даже в небольших количествах образуют химические соединения с медью.
 Эти элементы включают, прежде всего, кислород и серу. Оксиды и сульфиды меди в виде эвтектических смесей также образуются на границах зерен и, как и в предыдущем случае, они понижают пластические свойства, увеличивают прочностные свойства, но более мягким способом.
Эти элементы включают, прежде всего, кислород и серу. Оксиды и сульфиды меди в виде эвтектических смесей также образуются на границах зерен и, как и в предыдущем случае, они понижают пластические свойства, увеличивают прочностные свойства, но более мягким способом.
Медь обладает относительно высокой коррозионной стойкостью. Во влажном воздухе медь покрыта слоем основного карбоната меди, т.н. патина, в некоторой степени защищающая от дальнейшей коррозии. Однако атмосфера меди не является устойчивой к влажной промышленной атмосфере, содержащей диоксид серы, поскольку слой основного сульфата меди, образующийся на его поверхности, не защищает его от дальнейшей коррозии.
Влияние примесей на механические свойства меди очень различно и зависит главным образом от состояния, в котором эти загрязнители встречаются и где они находятся. Структура окисленной меди зависит от содержания кислорода в медном сплаве. В системах холодного, холодного водоснабжения и отопления в основном используются трубы из фосфоресцентной меди.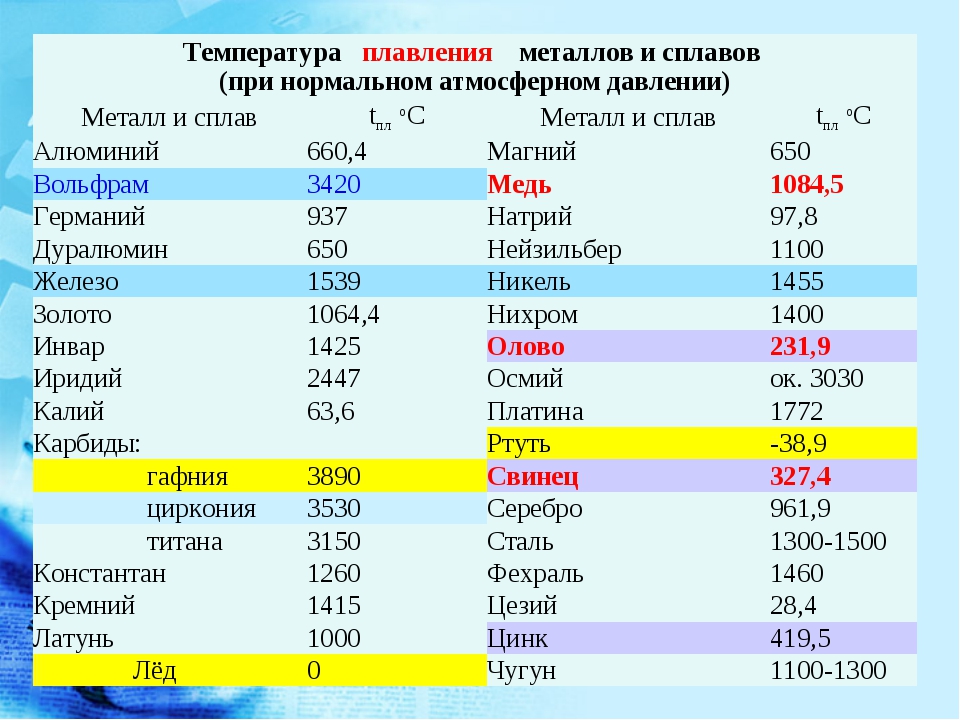 Фосфор является наиболее популярным раскислителем, но его используют в небольших количествах, поскольку его больший остаток в меди после раскисления, как правило, нежелателен, поскольку он влияет на хрупкость материала.
Фосфор является наиболее популярным раскислителем, но его используют в небольших количествах, поскольку его больший остаток в меди после раскисления, как правило, нежелателен, поскольку он влияет на хрупкость материала.
температура плавления 1360ºС — Перевод на английский — примеры русский
На основании Вашего запроса эти примеры могут содержать грубую лексику.
На основании Вашего запроса эти примеры могут содержать разговорную лексику.
Твёрдость по минералогической шкале 4, плотность 3180=3200 кг/м2, в иттрофлюорите до 3300 кг/м2; температура плавления 1360ºС.
Hardness on mineralogical scale is 4, density 3180=3200 kg/m2, in yttrium-fluorite up to 3300 kg/m2,Предложить пример
Другие результаты
Температура плавления желтой меди 905 градусов по Цельсию.
В транспортном документе должна быть указана температура плавления груза.
Реактивацию осуществляют при температуре ниже температуры плавления серы, а регенерацию осуществляют при
В колонке 20 указано замечание 6 с соответствующей температурой: температура плавления + 4 K.
При такой скорости поверхность планера достигает температуры плавления стали, 2000 градусов, как в доменной печи.
At that speed, the surface of the airfoil is the temperature of molten steel — 3,500 degrees Fahrenheit — like a blast furnace.УСТРОЙСТВО ДЛЯ ИЗМЕРЕНИЯ ТЕМПЕРАТУРЫ ПЛАВЛЕНИЯ
У него самая высокая температура плавления и предел прочности среди металлов.
Во время изменения фазы РСМ обладает способностью поглощать большое количество энергии из-за высокой температуры плавления.
During a phase change, a PCM has the capacity to absorb large amounts of energy due to its highУникально низкую температуру плавления у плутония объясняют гибридизацией 5f- и 6d-орбиталей и образованием направленных связей в этих металлах.
The unusually low melting point of neptunium and plutonium (~640 ºC) is explained by hybridization of 5f and 6d orbitals and the formation of directional bonds in these metals. Он имеет высокую температуру плавления, и поэтому его можно обжарить или приготовить на гриле.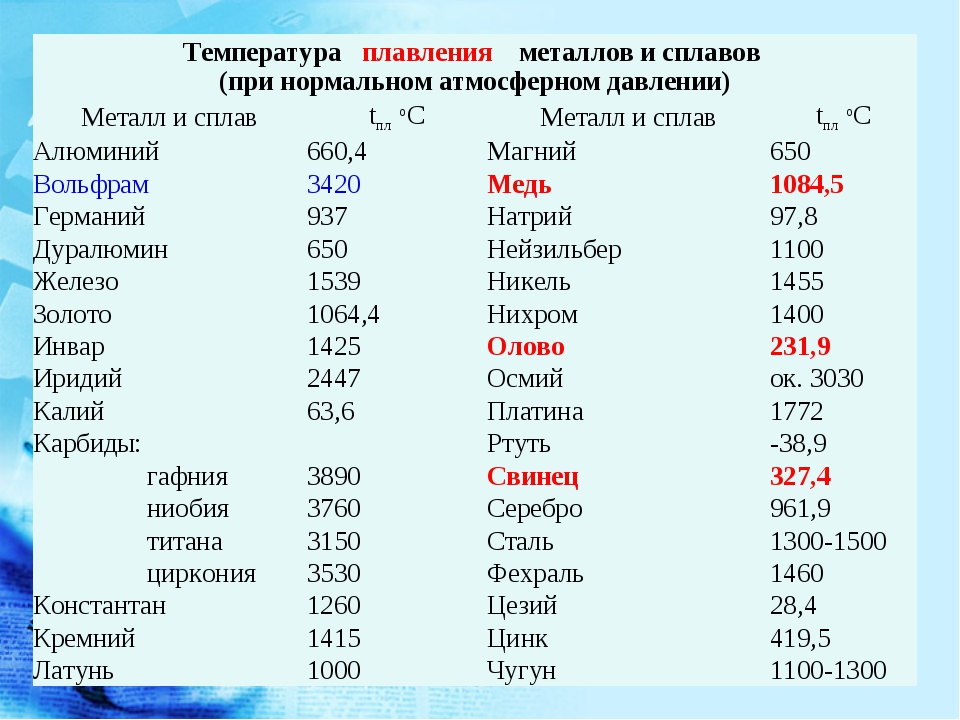
Часто ДМСО-d6 смешивают с CDCl3 или CD2Cl2 для снижения вязкости и температуры плавления.
It is often mixed with CDCl3 or CD2Cl2 for lower viscosity and melting points.Он обладает одной из самых высоких температур плавления среди всех лёгких металлов.
It also has one of the highest melting pointsБлагодаря сравнительно низкой температуре плавления цинк можно отделить от некоторых других металлов в специальных печах для вытопки.
Zinc has a relatively low melting point and may be separated from some other metals in a sweat furnace.
Температура газоотводных труб, клапанов повышенного и пониженного давления и пламегасителей должна поддерживаться по меньшей мере на уровне, превышающем
Нельзя допускать затвердевания вещества; температура при перевозке должна поддерживаться на уровне, превышающем значение температуры плавления.
Существует множество летучих органических соединений, например таких, как пары, исходящие от твердых веществ с высокой температурой плавления.
There are many organic compounds which are volatile, such as vapours from solids with
Давление паров бета-ГХГ значительно ниже, а температура плавления — намного выше, чем у альфа-ГХГ.
Beta-HCH has a much lower vapor pressure and a much higher melting point than the alpha-HCH. Ниже температуры плавления плотность вычисляется в предположении, что материал изотропен. Выше
Так же стекло Advantex имеет повышенную температуру плавления и модуль упругости по сравнению с традиционным стеклом Е — что является существенным преимуществом во многих сферах применения.
Урок 12. медь. цинк. титан. хром. железо. никель. платина — Химия — 11 класс
Химия, 11 класс
Урок № 12. Медь. Цинк. Титан. Хром. Железо. Никель. Платина
Перечень вопросов, рассматриваемых в теме: урок посвящён изучению основных металлов побочной подгруппы или Б-группы: меди, цинка, титана, хрома, железа, никеля и платины, их физическим и химическим свойствам, способам получения и применению.
Глоссарий
Катализатор – вещество, которое ускоряет химическую реакцию.
Пассивация – переход металла в неактивное состояние из-за образования на его поверхности оксидной плёнки. Может усиливаться концентрированными кислотами.
Проскок электрона – отступление от общей для большинства элементов последовательности заполнения электронных оболочек.
Хромирование/никелирование – покрытие поверхности металла другим, более устойчивым, для предотвращения коррозии.
Цинковая обманка (ZnS) – сложно идентифицируемое соединение цинка, подверженное сильному влиянию примесей на ее внешний вид.
Основная литература: Рудзитис, Г. Е., Фельдман, Ф. Г. Химия. 10 класс. Базовый уровень; учебник/ Г. Е. Рудзитис, Ф. Г, Фельдман – М.: Просвещение, 2018. – 224 с.
Дополнительная литература:
1. Рябов, М.А. Сборник задач, упражнений и тесто по химии. К учебникам Г.Е. Рудзитис, Ф.Г. Фельдман «Химия. 10 класс» и «Химия. 11 класс»: учебное пособие / М.А. Рябов. – М.: Экзамен. – 2013. – 256 с.
2. Рудзитис, Г.Е. Химия. 10 класс : учебное пособие для общеобразовательных организаций. Углублённый уровень / Г.Е. Рудзитис, Ф.Г. Фельдман. – М. : Просвещение. – 2018. – 352 с.
Открытые электронные ресурсы:
- Единое окно доступа к информационным ресурсам [Электронный ресурс]. М. 2005 – 2018.
 URL: http://window.edu.ru/ (дата обращения: 01.06.2018).
URL: http://window.edu.ru/ (дата обращения: 01.06.2018).
ТЕОРЕТИЧЕСКИЙ МАТЕРИАЛ ДЛЯ САМОСТОЯТЕЛЬНОГО ИЗУЧЕНИЯ
Медь
Электронная конфигурация
Медь является металлом, расположенным в I группе побочной подгруппе и имеет следующую электронную конфигурацию:
1s2
Рисунок 1 – Электронная конфигурация атома меди
Мы видим, что у меди наблюдается проскок электрона – отступление от общей для большинства элементов последовательности заполнения электронных оболочек. По принципу наименьшей энергии электронные орбитали должны заполняться в следующем порядке:
1s → 2s → 2p → 3s → 3p → 4s → 3d …
Но для некоторых атомов энергетически более выгодно иметь наполовину (5 электронов, дальше увидим у хрома) или полностью заполненную (10 электронов, как у меди) 3d-орбиталь.
Медь имеет две валентности: 1 и 2 и проявляет степени окисления +1 и +2.
Физические свойства
Медь обладает следующими физическими свойствами
Таблица 1 – Основные физические свойства меди
Свойство | Значение |
Цвет | Светло-розовый |
Структура | Тягучая, вязкая, легко прокатывается |
Температура плавления, °С | 1083 |
Нахождение в природе
В природе медь встречается в самородном виде, а также в составе некоторых минералов:
- медный блеск, Cu2S;
- куприт, Cu2O;
- медный колчедан, CuFeS;
- малахит, (CuOH)2CO3.

Способы получения меди
Основными способами получения меди являются:
- Восстановление коксом и оксидом углерода (II). Таким образом получают медь из куприта:
Cu2O + С = 2Сu + CO
Cu2O + CO = 2Cu + CO2
- Обжиг в специальных печах до оксидов. Данный способ подходит для сульфидных и карбонатных руд.
- Электролиз. Единственный из перечисленных способов, который позволяет получить медь без примесей.
Химические свойства
При комнатной температуре медь не вступает в реакции с большинством соединений. При повышенной температуре ее реакционная способность резко возрастает.
Реакции с простыми веществами:
2Cu + O2 = 2CuO
2Cu + Cl2 = 2CuCl2
Cu + S = CuS
Реакции со сложными веществами:
Cu + 2H2SO4(конц) = CuSO4 + SO2↑ +2H2O
Cu + 4HNO3(конц) = Cu(NO3)2 + 2NO2↑ + 2H2O
3Cu + 8HNO3(разб) = 3Cu(NO3)2 + 2NO↑ + 4H2O
Применение
Широкое применение находит как сама медь, так и её соединения.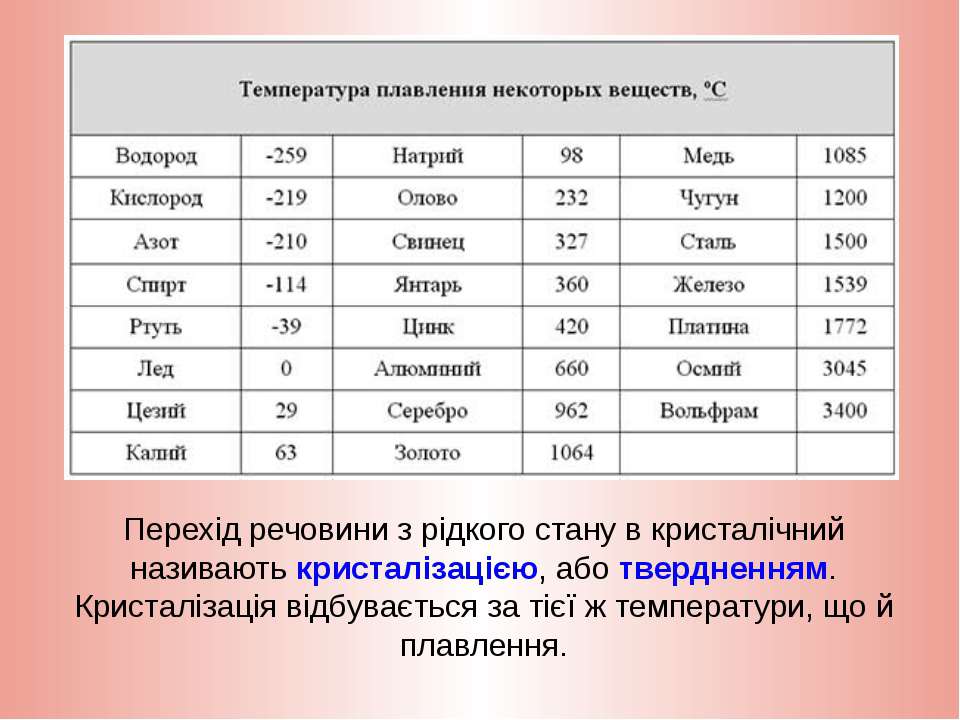 В чистом виде она используется для производства проводов, кабелей, теплообменных аппаратов, а также входит в состав многих сплавов.
В чистом виде она используется для производства проводов, кабелей, теплообменных аппаратов, а также входит в состав многих сплавов.
Соединения меди, например, медный купорос CuSO4∙5H2O используется для защиты растений, а гидроксид меди является качественным реагентом для определения альдегидной группы у органических соединений, а также наличия глицерина (дает голубое окрашивание раствора).
Цинк
Электронная конфигурация
Цинк является металлом, расположенным в II группе побочной подгруппе, и имеет следующую электронную конфигурацию:
Рисунок 2 – Электронная конфигурация атома цинка
В связи с тем, что 4s-орбиталь заполнена, цинк может находиться в единственной степени окисления, равной +2.
Физические свойства
Цинк обладает следующими физическими свойствами
Таблица 2 – Основные физические свойства цинка
Свойство | Значение |
Цвет | Голубовато-серебристый |
Структура | Хрупок |
Температура плавления, °С | 419,5 |
Нахождение в природе
В природе цинк встречается только в связанном состоянии, а именно в цинковом шпате ZnCO3 и цинковой обманке ZnS. Свое название цинковая обманка получила за то, что его сложно идентифицировать, поскольку он может выглядеть совершенно по-разному: быть различного цвета и структуры в зависимости от посторонних примесей.
Свое название цинковая обманка получила за то, что его сложно идентифицировать, поскольку он может выглядеть совершенно по-разному: быть различного цвета и структуры в зависимости от посторонних примесей.
Способы получения цинка
Чистый цинк получают обжигом с последующим восстановлением:
ZnS + O2 = ZnO + SO2↑
ZnO + C = Zn + CO↑
Химические свойства
Цинк является довольно устойчивым металлом, поскольку на воздухе покрывается оксидной пленкой, и в дополнение практически не взаимодействует с водой при нормальных условиях. Но так же, как и медь, становится более активным при повышении температуры.
Реакции с простыми веществами:
2Zn + O2 = 2ZnO
2Zn + Cl2 = 2ZnCl2
Zn + S = ZnS
Реакции со сложными веществами:
Zn + 2NaOH(крист) = NaZnO2 + H2↑
Zn + 2NaOH + 2H2O = Na2[Zn(OH)4] + H2↑
Zn + 2HCl = ZnCl2 + H2↑
Применение
Цинк является коррозионно-устойчивым металлом, поэтому он нашёл применение в производстве защитных покрытий металлов, гальванических элементов, а также как компонент сплавов.
Титан
Электронная конфигурация
Титан является элементом IV группы побочной подгруппы и имеет следующее электронное строение:
Рисунок 3 – Электронная конфигурация атома титана
Данная конфигурация позволяет атому титана проявлять две степени окисления: +2 и +4.
Физические свойства
Титан обладает следующими физическими свойствами:
Таблица 3 – Основные физические свойства титана
Свойство | Значение |
Цвет | Серебристо-белый |
Структура | Высокая прочность и взякость |
Температура плавления, °С | 1665 |
Нахождение в природе
В природе титан можно найти в составе таких минералов, как:
- титаномагнетит, FeTiO3∙Fe3O4;
- ильменит, FeTiO3;
- рутил, TiO2.
Способы получения титана
В связи с тем, что в природе не существует титановых руд, человеку приходится извлекать его путём хлорирования рудных концентратов с их последующим восстановлением с помощью магния или натрия.
TiCl4 + 2Mg = Ti + 2MgCl2
Для удаления примесей магния и его соли полученную смесь продуктов нагревают под вакуумом.
Химические свойства
Титан является очень активным металлом, но его оксидная пленка не даёт ему взаимодействовать при нормальных условиях ни с морской водой, ни даже с «царской водкой». Поэтому все реакции протекают при повышенных температурах.
Реакции с простыми веществами:
Ti + 2Cl2 = TiCl4
Ti + O2 = TiO2
Азотная кислота действует на титан только в форме порошка, в то время как разбавленная серная кислота реагирует с металлом:
2Ti + 3H2SO4 = Ti2(SO4)3 + 3H2↑
Применение
Титан и его сплавы отличает не только коррозионная стойкость, но и лёгкость, прочность. В связи с этим он активно используется при построении космических ракет, самолётов, подлодок и морских судов. Титан не взаимодействует с тканями организмов, из-за чего используется в хирургии.
Хром
Электронная конфигурация
Хром находится в IV группе побочной подгруппе и имеет следующее электронное строение:
Рисунок 4 – Электронная конфигурация атома хрома
Так как для атома хрома энергетически более выгодно иметь наполовину заполненную 3d-орбиталь, у него, как и у меди, наблюдается проскок электрона, что позволяет ему находиться в степенях окисления от +1 до +6, но наиболее устойчивыми являются +2, +3, +6.
Физические свойства
Хром обладает следующими физическими свойствами:
Таблица 4 – Основные физические свойства хрома
Свойство | Значение |
Цвет | Серебристо-белый с металлическим блеском |
Структура | Твердый |
Температура плавления, °С | 1890 |
Нахождение в природе
В природе большая часть хрома заключена в составе хромистого железняка Fe(CrO2)2. Иногда может встречаться в виде оксида хрома (III) и других соединениях.
Иногда может встречаться в виде оксида хрома (III) и других соединениях.
Способы получения хрома
Из хромистого железняка путем восстановлением углем при высоких температурах получают смесь железа и хрома – феррохром:
FeO + Cr2O3 + 3C = Fe + 2Cr + 3CO↑
Для получения чистого хрома проводят восстановление оксида хрома (III) алюминием:
Cr2O3 + 2Al = 2Cr + Al2O3
Химические свойства
Как и все вышеописанные металлы, хром покрыт оксидной плёнкой, которую трудно растворить даже сильными кислотами. Благодаря ней он обладает высокой стойкости к коррозии, поэтому начинает реагировать с разбавленными растворами кислот лишь спустя время. Концентрированные кислоты, такие как HNO3 и H2SO4, пассивируют оксидную пленку (укрепляют ее).
Применение
Благодаря своей коррозионной стойкости, хром используют в качестве защитных покрытий (хромируют поверхности металлов и сплавов).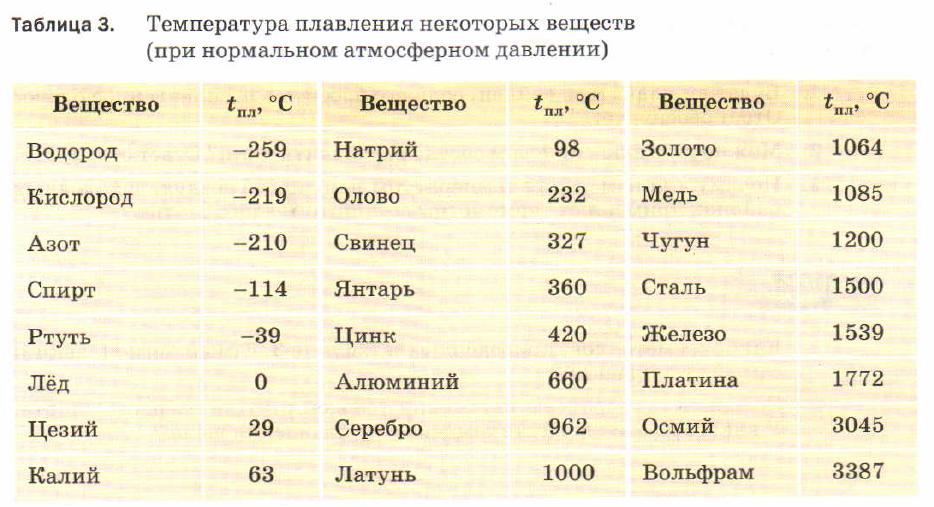 Также используется для создания легированных сталей, речь о которых пойдет в следующем уроке.
Также используется для создания легированных сталей, речь о которых пойдет в следующем уроке.
Железо
Железо – металл, с которым мы чаще всего сталкиваемся в нашей жизни, поэтому переоценить его значимость для человека невозможно. Он является самым распространенным после алюминия и составляет 5% земной коры. Теперь перейдем к рассмотрению его строения и свойств.
Электронная конфигурация
Железо находится в VII группе Б-подгруппе и имеет такое электронное строение, которое позволяет ему находиться в двух степенях окисления: +2 и +3. Конечно, в теории железо может выступать в качестве шестивалентного металла, но из-за пространственных затруднений ему не удается образовать такое количество связей. Поэтому такое состояние является неустойчивым для данного металла.
Рисунок 5 – Электронная конфигурация атома железа
Физические свойства
Железо обладает следующими физическими свойствами:
Таблица 5 – Основные физические свойства железа
Свойство | Значение |
Цвет | Серебристо-белый |
Структура | Мягкий, пластичный |
Температура плавления, °С | 1539 |
Нахождение в природе
Встречается железо в виде различных соединений: оксидов, сульфидов, силикатов. В свободном виде железо находят в метеоритах, изредка встречается самородное железо (феррит) в земной коре как продукт застывания магмы.
В свободном виде железо находят в метеоритах, изредка встречается самородное железо (феррит) в земной коре как продукт застывания магмы.
Способы получения железа
Существует множество способов получения железа, и отличаются они друг от друга степенью его чистоты и требуемым типом конечного продукта.
- Восстановлением из оксидов (железо пирофорное).
- Электролизом водных растворов его солей (железо электролитическое).
- Разложением пентакарбонила железа Fe(CO)5 при нагревании до t 250°С.
- Методом зонной плавки (получение особо чистого железа).
- Технически чистое железо (около 0,16% примесей углерода, кремния, марганца, фосфора, серы и др.) выплавляют, окисляя компоненты чугуна в мартеновских сталеплавильных печах и в кислородных конверторах.
- Сварочное или кирпичное железо получают, окисляя примеси малоуглеродистой стали железным шлаком или путём восстановления руд твёрдым углеродом.
Химические свойства
Под воздействием высоких температур железо взаимодействует с простыми веществами:
2Fe + 3O2 = Fe2O3 ∙FeO
В ходе данной реакции происходит получение смеси оксидов, которую иногда записывают в виде общей формулы Fe3O4.
2Fe + 3Cl2 = 2FeCl3
Fe + S = FeS
Взаимодействует с разбавленными кислотами, причем с соляной кислотой происходит образование соли только двухвалентного железа:
Fe + 2HCl(разб) = FeCl2 + H2↑
При комнатной температуре железо пассивируется концентрированными кислотами, но при высоких температурах вступает в реакцию окисления:
2Fe + 6H2SO4(конц) = Fe2(SO4)3 + 3SO2 + 6H2O
Вступает в реакцию обмена с солями, образованными катионами более слабых металлов:
Fe + CuSO4 = FeSO4 + Cu↓
Применение
Про области применения железа можно говорить достаточно долго, поэтому выделим основные направления:
- В связи с его способностью быстро намагничиваться, его используют в трансформаторах и электромоторах.
- Основная масса железа расходуется на производство различных сплавов, таких как чугун и сталь.

Никель и платина
Далее стоит обратить на два металла: никель и платина. Как нам известно, они имеют схожие области применения, но отличаются по цене и качеству, потому предлагаю сравнить их.
Электронная конфигурация
Электронное строение металлов выглядит следующим образом:
Ni …3s2 3p6 3d8 4s2
Характерные степени окисления: + 2 и +3, но последняя является неустойчивой.
Pt …5s2 5p6 5d9 6s1
Характерные степени окисления: + 2 и +4.
Физические свойства
Таблица 5 – Основные физические свойства железа
Свойство | Значение | |
Ni | Pt | |
Цвет | Серебристо-белый | Белый |
Структура | Очень твердый | Пластичный |
Температура плавления, °С | 1453 | 1769 |
Химические свойства
Никель при повышенных температурах реагирует с галогенами с образованием солей, и с кислородом с образованием оксида никеля (II), в то время как платина очень устойчива к любым взаимодействиям.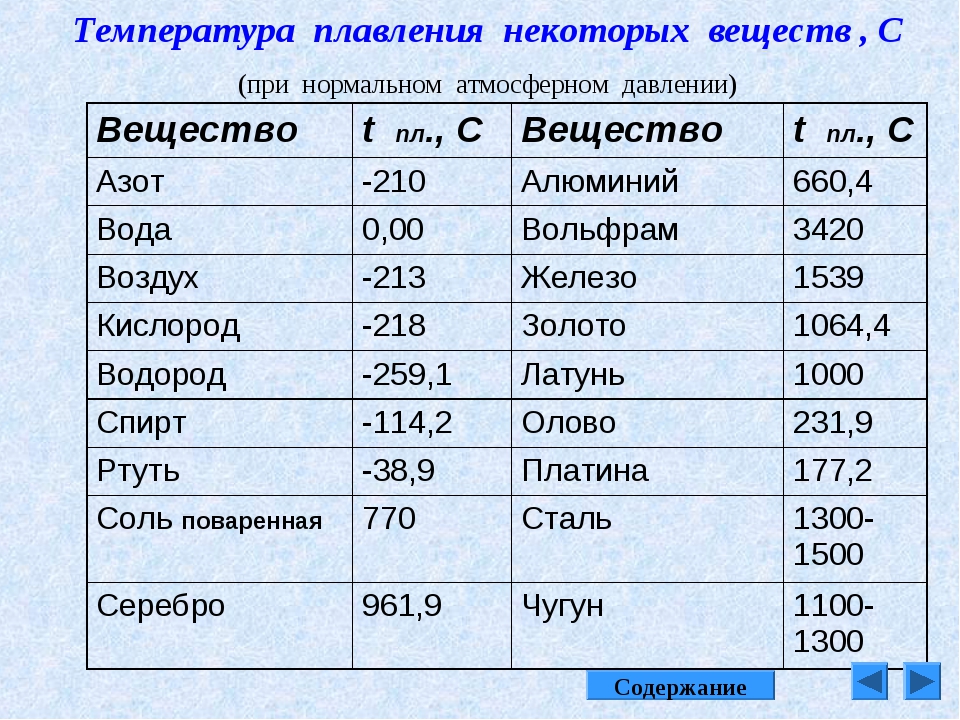 Реагирует с серой и галогенами в мелкораздробленном виде.
Реагирует с серой и галогенами в мелкораздробленном виде.
Никель медленно взаимодействует с разбавленными кислотами, когда платина реагирует только с «царской водкой».
Применение
Оба металла активно используются в переработке нефти в качестве катализаторов.
Катализатор – вещество, которое ускоряет химическую реакцию.
Каждые 2-3 года закупаются тонны реагентов, в составе которых всего несколько десятых процента платины или никеля, но именно они определяют их стоимость.
Также они используются в составе высококачественных сплавов, а никель – как антикоррозионное покрытие.
ПРИМЕРЫ И РАЗБОР РЕШЕНИЙ ЗАДАЧ ТРЕНИРОВОЧНОГО МОДУЛЯ
- Решение задачи на вычисление количества исходного реагента.
Условие задачи: При растворении меди в растворе концентрированной азотной кислоты выделилось 2 л газа. Вычислите массу прореагировавшей меди.
Шаг первый. Напишем уравнение реакции и определим, какой газ выделился, расставим коэффициенты.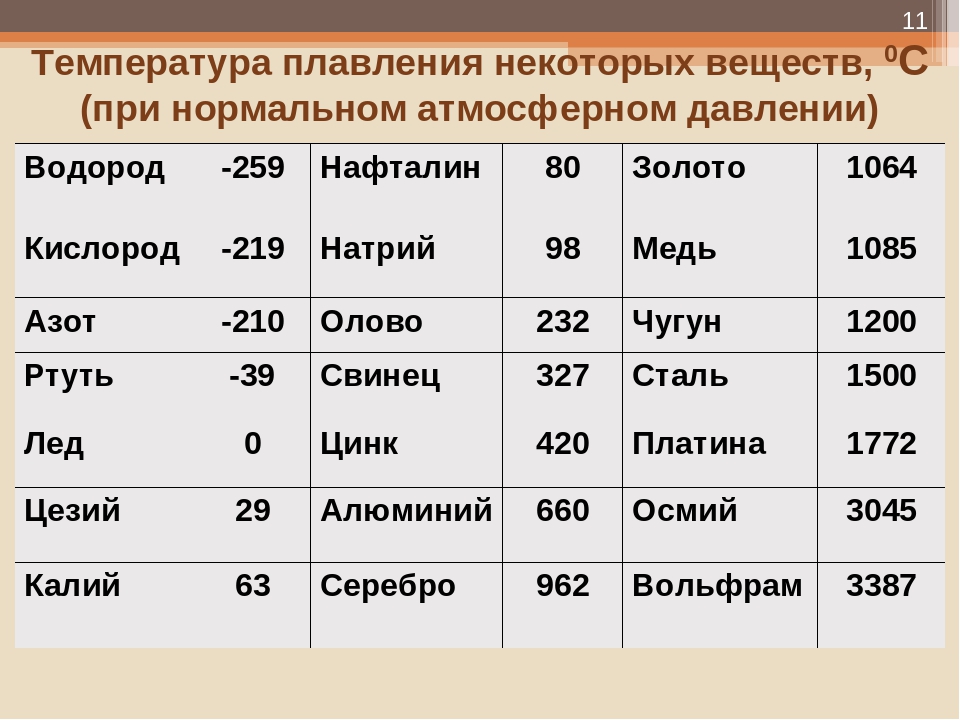
Cu + 4HNO3(конц) = Cu(NO3)2 + 2NO2↑ + 2H2O
Шаг второй. Вычислим количество вещества газа:
Шаг третий. Вычислим количество вещества меди:
По уравнению реакции: n(Cu) = 0,5n(NO2), тогда
n(Cu) = 0,5 ∙ 0,089 = 0,044 (моль)
Шаг четвёртый. Вычислим массу меди:
m(Cu) = 0,044 ∙ 46 = 2,024 (г)
Ответ: 2,024 (г).
- Решение задачи на выход продукта.
Условия задачи: при обжиге 8,515 г сульфида цинка с последующим восстановлением оксида с помощью угля выделилось 3,45 л газа. Рассчитайте выход реакции обжига, если выход реакции восстановления равен 60%.
Шаг первый. Запишем уравнения реакций и вычислим молярные массы компонентов:
ZnS + O2 = ZnO + SO2↑
ZnO + C = Zn + CO↑
M (ZnO) = 81 г/моль
Шаг второй. Вычислим количество вещества газа:
Шаг третий. Вычислим массу оксида цинка:
Так как выход реакции составил 60%, то
n (ZnO) = 0,6n (CO) = 0,6 ∙ 0,154 = 0,0924 (моль)
Шаг четвёртый. Вычислим массу оксида цинка:
Вычислим массу оксида цинка:
Шаг пятый. Вычислим выход реакции:
Ответ: 87, 89%.
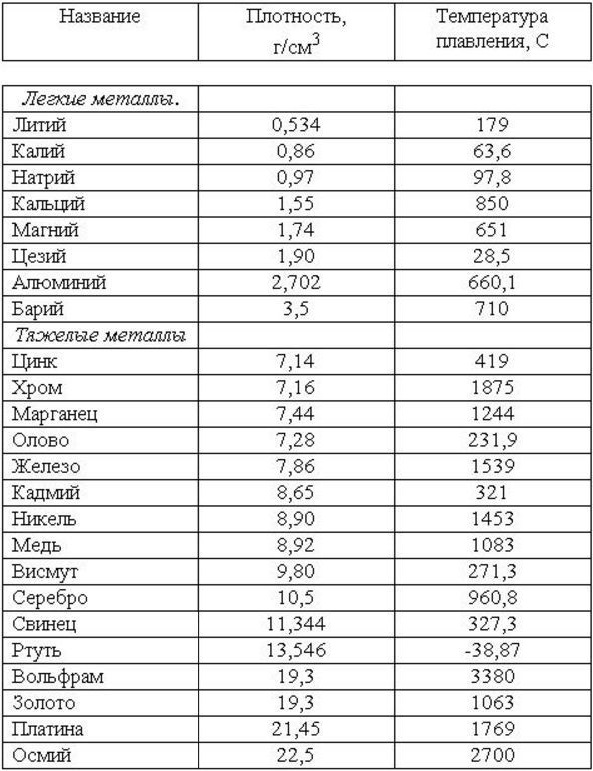
Зачем добывают серу в индонезии. Добыча серы в индонезии
Сера – одно из немногих веществ, которыми уже несколько тысяч лет назад оперировали первые «химики». Она стала служить человечеству задолго до того, как заняла в таблице Менделеева клетку под №16.
Об одном из самых древних (хотя и гипотетических!) применений серы рассказывают многие старинные книги. Как источник тепла при термообработке грешников серу живописуют и Новый и Ветхий заветы. И если книги такого рода не дают достаточных оснований для археологических раскопок в поисках остатков райских кущ или геенны огненной, то их свидетельство о том, что древние были знакомы с серой и некоторыми ее свойствами, можно принять на веру.
Одна из причин этой известности – распространенность самородной серы в странах древнейших цивилизаций. Месторождения этого желтого горючего вещества разрабатывались греками и римлянами, особенно в Сицилии, которая вплоть до конца прошлого века славилась в основном серой.
С древнейших времен серу использовали для религиозно-мистических целей, ее зажигали при различных церемониях и ритуалах. Но так же давно элемент №16 приобрел и вполне мирские назначения: серой чернили оружие, ее употребляли при изготовлении косметических и лекарственных мазей, ее жгли для отбелки тканей и для борьбы с насекомыми. Добыча серы значительно увеличилась после того, как был изобретен черный порох. Ведь сера (вместе с углем и селитрой) – непременный его компонент.
И сейчас пороховое производство потребляет часть добываемой серы, правда весьма незначительную. В наше время сера – один из важнейших видов сырья для многих химических производств. И в этом причина непрерывного роста мирового производства серы.
Происхождение серы
Большие скопления самородной серы встречаются не так уж часто. Чаще она присутствует в некоторых рудах. Руда самородной серы – это порода с вкраплениями серы.
Когда образовались эти вкрапления – одновременно с сопутствующими породами или позже? От ответа на этот вопрос зависит направление поисковых и разведочных работ. Но, несмотря на тысячелетия общения с серой, человечество до сих пор не имеет однозначного ответа. Существует несколько теорий, авторы которых придерживаются противоположных взглядов.
Но, несмотря на тысячелетия общения с серой, человечество до сих пор не имеет однозначного ответа. Существует несколько теорий, авторы которых придерживаются противоположных взглядов.
Теория сингенеза (т.е. одновременного образования серы и вмещающих пород) предполагает, что образование самородной серы происходило в мелководных бассейнах. Особые бактерии восстанавливали сульфаты, растворенные в воде, до сероводорода, который поднимался вверх, попадал в окислительную зону и здесь химическим путем или при участии других бактерий окислялся до элементарной серы. Сера осаждалась на дно, и впоследствии содержащий серу ид образовал руду.
Теория эпигенеза (вкрапления серы образовались позднее, чем основные породы) имеет несколько вариантов. Самый распространенный из них предполагает, что подземные воды, проникая сквозь толщи пород, обогащаются сульфатами. Если такие воды соприкасаются с месторождениями нефти или природного газа, то ионы сульфатов восстанавливаются углеводородами до сероводорода.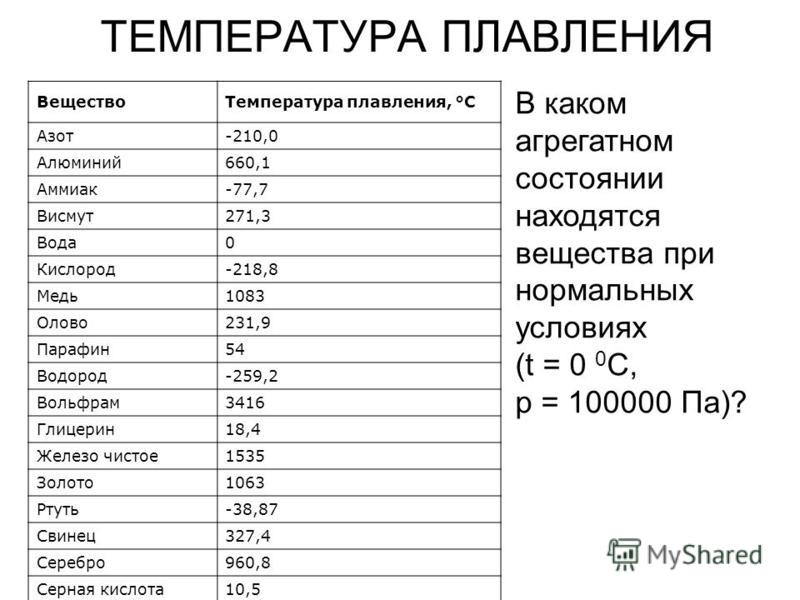 Сероводород поднимается к поверхности и, окисляясь, выделяет чистую серу в пустотах и трещинах пород.
Сероводород поднимается к поверхности и, окисляясь, выделяет чистую серу в пустотах и трещинах пород.
В последние десятилетия находит все новые подтверждения одна из разновидностей теории эпигенеза – теория метасоматоза (в переводе с греческого «метасоматоз» означает «замещение». Согласно ей в недрах постоянно происходит превращение гипса CaSO 4 · 2H 2 O и ангидрита CaSO 4 в серу и кальцит СаCO 3 . Эта теория создана в 1935 г. советскими учеными Л.М. Миропольским и Б.П. Кротовым. В ее пользу говорит, в частности, такой факт.
В 1961 г. в Ираке было открыто месторождение Мишрак. Сера здесь заключена в карбонатных породах, которые образуют свод, поддерживаемый уходящими вглубь опорами (в геологии их называют крыльями). Крылья эти состоят в основном из ангидрита и гипса. Такая же картина наблюдалась на отечественном месторождении Шор-Су.
Геологическое своеобразие этих месторождений можно объяснить только с позиций теории метасоматоза: первичные гипсы и ангидриты превратились во вторичные карбонатные руды с вкраплениями самородной серы. Важно не только соседство минералов – среднее содержание серы в руде этих месторождений равно содержанию химически связанной серы в ангидрите. А исследования изотопного состава серы и углерода в руде этих месторождений дали сторонникам теории метасоматоза дополнительные аргументы.
Важно не только соседство минералов – среднее содержание серы в руде этих месторождений равно содержанию химически связанной серы в ангидрите. А исследования изотопного состава серы и углерода в руде этих месторождений дали сторонникам теории метасоматоза дополнительные аргументы.
Но есть одно «но»: химизм процесса превращения гипса в серу и кальцит пока не ясен, и потому нет оснований считать теорию метасоматоза единственно правильной. На Земле и сейчас существуют озера (в частности, Серное озеро близ Серноводска), где происходит сингенетическое отложение серы и сероносный ил не содержит ни гипса, ни ангидрита.
Все это означает, что разнообразие теорий и гипотез о происхождении самородной серы – результат не только и не столько неполноты наших знаний, сколько сложности явлений, происходящих в недрах. Еще из элементарной школьной математики все мы знаем, что к одному результату могут привести разные пути. Этот закон распространяется и на геохимию.
Добыча серы
Серные руды добывают разными способами – в зависимости от условий залегания. Но в любом случае приходится уделять много внимания технике безопасности. Залежам серы почти всегда сопутствуют скопления ядовитых газов – соединений серы. К тому же нельзя забывать о возможности ее самовозгорания.
Но в любом случае приходится уделять много внимания технике безопасности. Залежам серы почти всегда сопутствуют скопления ядовитых газов – соединений серы. К тому же нельзя забывать о возможности ее самовозгорания.
Добыча руды открытым способом происходит так. Шагающие экскаваторы снимают пласты пород, под которыми залегает руда. Взрывами рудный пласт дробят, после чего глыбы руды отправляют на обогатительную фабрику, а оттуда – на сероплавильный завод, где из концентрата извлекают серу. Методы извлечения различны. О некоторых из них будет рассказано ниже. А здесь уместно кратко описать скважинный метод добычи серы из-под земли, позволивший Соединенным Штатам Америки и Мексике стать крупнейшими поставщиками серы.
В конце прошлого века на юге Соединенных Штатов были открыты богатейшие месторождения серной руды. Но подступиться к пластам было непросто: в шахты (а именно шахтным способом предполагалось разрабатывать месторождение) просачивался сероводород и преграждал доступ к сере. Кроме того, пробиться к сероносным пластам мешали песчаные плавуны. Выход нашел химик Герман Фраш, предложивший плавить серу под землей и через скважины, подобные нефтяным, выкачивать ее на поверхность. Сравнительно невысокая (меньше 120°C) температура плавления серы подтверждала реальность идеи Фраша. В 1890 г. начались испытания, приведшие к успеху.
Кроме того, пробиться к сероносным пластам мешали песчаные плавуны. Выход нашел химик Герман Фраш, предложивший плавить серу под землей и через скважины, подобные нефтяным, выкачивать ее на поверхность. Сравнительно невысокая (меньше 120°C) температура плавления серы подтверждала реальность идеи Фраша. В 1890 г. начались испытания, приведшие к успеху.
В принципе установка Фраша очень несложна: труба в трубе. В пространство между трубами подается перегретая вода и по нему идет в пласт. А по внутренней, обогреваемой со всех сторон, трубе поднимается расплавленная сера. Современный вариант установки Фраша дополнен третьей – самой узкой трубой. Через нее в скважину подается сжатый воздух, который помогает поднять расплавленную Серу на поверхность. Одно из основных достоинств метода Фраша – в том, что он позволяет уже на первой стадии добычи получить сравнительно чистую серу. При разработке богатых руд этот метод весьма эффективен.
Раньше считалось, что метод подземной выплавки серы применим только в специфических условиях «соляных куполов» тихоокеанского побережья США и Мексики. Однако опыты, проведенные в Польше и СССР, опровергли это мнение. В Польше этим методом уже добывают большое количество серы: в 1968 г. пущены первые серные скважины и в СССР.
Однако опыты, проведенные в Польше и СССР, опровергли это мнение. В Польше этим методом уже добывают большое количество серы: в 1968 г. пущены первые серные скважины и в СССР.
А руду, полученную в карьерах и шахтах, приходится перерабатывать (часто с предварительным обогащением), используя для этого различные технологические приемы.
Известно несколько методов получения серы из серных руд: пароводяные, фильтрационные, термические, центрифугальные и экстракционные.
Термические методы извлечения серы – самые старые. Еще в XVIII в. в Неаполитанском королевстве выплавляли серу в кучах – «сольфатарах». До сих пор в Италии выплавляют серу в примитивных печах – «калькаронах». Тепло, необходимое для выплавления серы из руды, получают, сжигая часть добытой серы. Процесс этот малоэффективен, потери достигают 45%.
Италия стала родиной и пароводяных методов извлечения серы из руд. В 1859 г. Джузеппе Джилль получил патент на свой аппарат – предшественник нынешних автоклавов.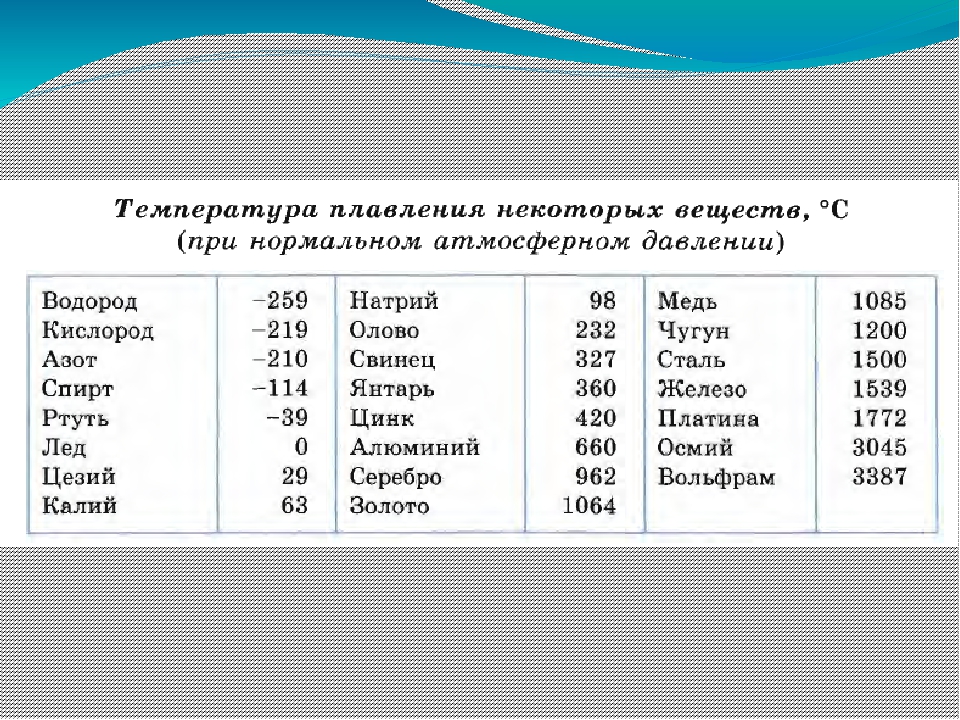 Автоклавный метод (значительно усовершенствованный, конечно) используется и сейчас во многих странах.
Автоклавный метод (значительно усовершенствованный, конечно) используется и сейчас во многих странах.
В автоклавном процессе обогащенный концентрат серной руды, содержащий до 80% серы, в виде жидкой пульпы с реагентами подается насосами в автоклав. Туда же под давлением подается водяной пар. Пульпа нагревается до 130°C. Сера, содержащаяся в концентрате, плавится и отделяется от породы. После недолгого отстоя выплавленная сера сливается. Затем из автоклава выпускаются «хвосты» – взвесь пустой породы в воде. Хвосты содержат довольно много серы и вновь поступают на обогатительную фабрику.
В России автоклавный способ был впервые применен инженером К.Г. Паткановым в 1896 г.
Современные автоклавы – это огромные аппараты высотой с четырехэтажный дом. Такие автоклавы установлены, в частности, на сероплавильном заводе Роздольского горно-химического комбината в Прикарпатье.
На некоторых производствах, например на крупном серном комбинате в Тарнобжеге (Польша), пустую породу отделяют от расплавленной серы на специальных фильтрах. Метод разделения серы и пустой породы на центрифугах разработан в нашей стране. Словом, «руду золотую (точнее – золотистую) отделять от породы пустой» можно по-разному.
Метод разделения серы и пустой породы на центрифугах разработан в нашей стране. Словом, «руду золотую (точнее – золотистую) отделять от породы пустой» можно по-разному.
В последнее время все большее внимание уделяется скважинным геотехнологическим способам добычи серы. На Язовском месторождении в Прикарпатье серу – классический диэлектрик плавят под землей токами высокой частоты и выкачивают на поверхность через скважины, как в методе Фраша. Ученые Института горно-химического сырья предложили способ подземной газификации серы. По этому способу серу поджигают в пласте, а на поверхность выкачивают сернистый газ, который идет на производство серной кислоты и других полезных продуктов.
По-разному и удовлетворяют свои потребности в сере разные страны. Мексика и США используют в основном метод Фраша. Италия, занимающая по добыче серы третье место среди капиталистических государств, продолжает добывать и перерабатывать (разными методами) серные руды сицилийских месторождений и провинции Марке. У Японии есть значительные запасы серы вулканического происхождения. Франция и Канада, не имеющие самородной серы, развили крупное производство ее из газов. Нет собственных серных месторождений и в Англии и ФРГ. Свои потребности в серной кислоте они покрывают за счет переработки серусодержащего сырья (преимущественно пирита), а элементарную серу импортируют из других стран.
У Японии есть значительные запасы серы вулканического происхождения. Франция и Канада, не имеющие самородной серы, развили крупное производство ее из газов. Нет собственных серных месторождений и в Англии и ФРГ. Свои потребности в серной кислоте они покрывают за счет переработки серусодержащего сырья (преимущественно пирита), а элементарную серу импортируют из других стран.
Советский Союз и социалистические страны полностью удовлетворяют свои потребности благодаря собственным источникам сырья. После открытия и освоения богатых Прикарпатских месторождений СССР и Польша значительно увеличили производство серы. Эта отрасль промышленности продолжает развиваться. В последние годы построены новые крупные предприятия на Украине, реконструированы старые комбинаты на Волге и в Туркмении, расширено производство серы из природного газа и отходящих газов.
Кристаллы и макромолекулы
В том, что сера – самостоятельный химический элемент, а не соединение, первым убедился великий французский химик Антуан Лоран Лавуазье в XVIII в.
С тех пор представления о сере как элементе изменились не очень сильно, но значительно углубились и дополнились.
Сейчас известно, что элемент №16 состоит из смеси четырех устойчивых изотопов с массовыми числами 32, 33, 34 и 36. Это типичный неметалл.
Лимонно-желтые кристаллы чистой серы полупрозрачны. Форма кристаллов не всегда одинакова. Чаще всего встречается ромбическая сера (наиболее устойчивая модификация) – кристаллы имеют вид октаэдров со срезанными углами. В эту модификацию при комнатной (или близкой к комнатной) температуре превращаются все прочие модификации. Известно, например, что при кристаллизации из расплава (температура плавления серы 119,5°C) сначала получаются игольчатые кристаллы (моноклинная форма). Но эта модификация неустойчива, и при температуре 95,6°C она переходит в ромбическую. Подобный процесс происходит и с другими модификациями серы.
Напомним известный опыт – получение пластической серы.
Если расплавленную серу вылить в холодную воду, образуется эластичная, во многом похожая на резину масса. Ее можно получить и в виде нитей. Но проходит несколько дней, и масса перекристаллизуется, становится жесткой и ломкой.
Ее можно получить и в виде нитей. Но проходит несколько дней, и масса перекристаллизуется, становится жесткой и ломкой.
Молекулы кристаллов серы всегда состоят из восьми атомов (S 8), а различие в свойствах модификаций серы объясняется полиморфизмом – неодинаковым строением кристаллов. Атомы в молекуле серы построены в замкнутый цикл, образующий своеобразный венец. При плавлении связи в цикле рвутся, и циклические молекулы превращаются в линейные.
Необычному поведению серы при плавлении даются различные толкования. Одно из них – такое. При температуре от 155 до 187°, по-видимому, происходит значительный рост молекулярного веса, это подтверждается многократным увеличением вязкости. При 187°C вязкость расплава достигает чуть ли не тысячи пуаз, получается почти твердое вещество. Дальнейший рост температуры приводит к уменьшению вязкости (молекулярный вес падает).
При 300°C сера вновь переходит в текучее состояние, а при 444,6°C закипает.
У паров серы с повышением температуры число атомов в молекуле постепенно уменьшается: S8 → S6 → S4 → (800°C) S 2 . При 1700°C пары серы одноатомны.
При 1700°C пары серы одноатомны.
Коротко о соединениях серы
По распространенности элемент №16 занимает 15-е место. Содержание серы в земной коре составляет 0,05% по весу. Это немало.
К тому же сера химически активна и вступает в реакции с большинством элементов. Поэтому в природе сера встречается не только в свободном состоянии, но и в виде разнообразных неорганических соединений. Особенно распространены сульфаты (главным образом щелочных и щелочноземельных металлов) и сульфиды (железа, меди, цинка, свинца). Сера есть и в углях, сланцах, нефти, природных газах, в организмах животных и растений.
При взаимодействии серы с металлами, как правило, выделяется довольно много тепла. В реакциях с кислородом сера дает несколько окислов, из них самые важные SO 2 и SO 3 – ангидриды сернистой H 2 SO 3 и серной Н 2 SO 4 кислот. Соединение серы с водородом – сероводород H 2 S – очень ядовитый зловонный газ, всегда присутствующий в местах гниения органических остатков. Земная кора в местах, расположенных близ месторождений серы, часто содержит довольно значительные количества сероводорода. В водном растворе этот газ обладает кислотными свойствами. Хранить его растворы на воздухе нельзя, он окисляется с выделением серы:
В водном растворе этот газ обладает кислотными свойствами. Хранить его растворы на воздухе нельзя, он окисляется с выделением серы:
2H 2 S + О 2 → 2Н 2 О + 2S.
Сероводород – сильный восстановитель. Этим его свойством пользуются во многих химических производствах.
Для чего нужна сера
Среди вещей, окружающих нас, мало таких, для изготовления которых не нужны были бы сера и ее соединения. Бумага и резина, эбонит и спички, ткани и лекарства, косметика и пластмассы, взрывчатка и краска, удобрения и ядохимикаты – вот далеко не полный перечень вещей и веществ, для производства которых нужен элемент №16. Для того чтобы изготовить, например, автомобиль, нужно израсходовать около 14 кг серы. Можно без преувеличения сказать, что промышленный потенциал страны довольно точно определяется потреблением серы.
Значительную часть мировой добычи серы поглощает бумажная промышленность (соединения серы помогают выделить целлюлозу). Для того чтобы произвести 1 т целлюлозы, нужно затратить более 100 кг серы. Много элементарной серы потребляет и резиновая промышленность – для вулканизации каучуков.
Много элементарной серы потребляет и резиновая промышленность – для вулканизации каучуков.
В сельском хозяйстве сера применяется как в элементарном виде, так и в различных соединениях. Она входит в состав минеральных удобрений и препаратов для борьбы с вредителями. Наряду с фосфором, калием и другими элементами сера необходима растениям. Впрочем, большая часть вносимой в почву серы не усваивается ими, но помогает усваивать фосфор. Серу вводят в почву вместе с фосфоритной мукой. Имеющиеся в почве бактерии окисляют ее, образующиеся серная и сернистая кислоты реагируют с фосфоритами, и в результате получаются фосфорные соединения, хорошо усваиваемые растениями.
Однако основной потребитель серы – химическая промышленность. Примерно половина добываемой в мире серы идет на производство серной кислоты. Чтобы получить 1 т H 2 SО 4 , нужно сжечь около 300 кг серы. А роль серной кислоты в химической промышленности сравнима с ролью хлеба в нашем питании.
Значительное количество серы (и серной кислоты) расходуется при производстве взрывчатых веществ и спичек. Чистая, освобожденная от примесей сера нужна для производства красителей и светящихся составов.
Чистая, освобожденная от примесей сера нужна для производства красителей и светящихся составов.
Соединения серы находят применение в нефтехимической промышленности. В частности, они необходимы при производстве антидетонаторов, смазочных веществ для аппаратуры сверхвысоких давлений; в охлаждающих маслах, ускоряющих обработку металла, содержится иногда до 18% серы.
Перечисление примеров, подтверждающих первостепенную важность элемента №16, можно было бы продолжить, но «нельзя объять необъятное». Поэтому вскользь упомянем, что сера необходима и таким отраслям промышленности, как горнодобывающая, пищевая, текстильная, и – поставим точку.
Наш век считается веком «экзотических» материалов – трансурановых элементов, титана, полупроводников и так далее. Но внешне непритязательный, давно известный элемент №16 продолжает оставаться абсолютно необходимым. Подсчитано, что в производстве 88 из 150 важнейших химических продуктов используют либо саму серу, либо ее соединения.
Из древних и средневековых книг
«Сера применяется для очищения жилищ, так как многие держатся мнения, что запах и горение серы могут предохранить от всяких чародейств и прогнать всякую нечистую силу».
Плиний Старший, «Естественная история» I в. н.э.
«Если травы чахлы, бедны соками, а ветви и листва деревьев имеют окраску тусклую, грязную, темноватую вместо блестящего зеленого цвета, это признак, что подпочва изобилует минералами, в которых господствует сера».
«Если руда очень богата серой, ее зажигают на широком железном листе с множеством отверстий, через которые сера вытекает в горшки, наполненные доверху водой».
«Сера входит также в состав ужасного изобретения – порошка, который может метать далеко вперед куски железа, бронзы или камня – орудие войны нового тина».
Агрикола, «О царстве минералов», XVI в.
Как испытывали серу в XIV веке
«Если ты хочешь испытать серу, хороша она или нет, то возьми кусок серы в руку и поднеси к уху. Если сера трещит так, что ты слышишь ее треск, значит она хороша; если же сера молчит и не трещит, то она нехороша…»
Этот своеобразный метод определения качества материала на слух (применительно к сере) может быть использован и сейчас. Экспериментально подтвердилось, что «трещит» только сера, содержащая не больше одного процента примесей. Иногда дело не ограничивается только треском – кусок серы раскалывается на части.
Экспериментально подтвердилось, что «трещит» только сера, содержащая не больше одного процента примесей. Иногда дело не ограничивается только треском – кусок серы раскалывается на части.
Удушающий серный газ
Как известно, выдающийся естествоиспытатель древности Плиний Старший погиб в 79 г. н.э. при извержении вулкана. Его племянник в письме историку Тациту писал: «…Вдруг раздались раскаты грома, и от горного пламени покатились вниз черные серные пары. Все разбежались. Плиний поднялся и, опираясь на двух рабов, думал тоже уйти; но смертоносный пар окружил его со всех сторон, его колени подогнулись, он снова упал и задохся».
«Черные серные пары», погубившие Плиния, состояли, конечно, не только из парообразной серы. В состав вулканических газов входят и сероводород, и двуокись серы. Эти газы обладают не только резким запахом, но и большой токсичностью. Особенно опасен сероводород. В чистом виде он убивает человека почти мгновенно. Опасность велика даже при незначительном (порядка 0,01%) содержании сероводорода в воздухе. Сероводород тем более опасен, что он может накапливаться в организме. Он соединяется с железом, входящим в состав гемоглобина, что может привести к тяжелейшему кислородному голоданию и смерти. Сернистый газ (двуокись серы) менее токсичен, однако выпуск его в атмосферу приводил к тому, что вокруг металлургических заводов гибла вся растительность. Поэтому на всех предприятиях, производящих или использующих эти газы; вопросам техники безопасности уделяется особое внимание.
Сероводород тем более опасен, что он может накапливаться в организме. Он соединяется с железом, входящим в состав гемоглобина, что может привести к тяжелейшему кислородному голоданию и смерти. Сернистый газ (двуокись серы) менее токсичен, однако выпуск его в атмосферу приводил к тому, что вокруг металлургических заводов гибла вся растительность. Поэтому на всех предприятиях, производящих или использующих эти газы; вопросам техники безопасности уделяется особое внимание.
Сернистый газ и соломенная шляпка
Соединяясь с водой, сернистый газ образует слабую сернистую кислоту Н 2 SO 3 , существующую только в растворах. В присутствии влаги сернистый газ обесцвечивает многие красители. Это свойство используется для отбелки шерсти, шелка, соломы. Но такие соединения, как правило, не обладают большой стойкостью, и белые соломенные шляпки со временем приобретают первоначальную грязно-желтую окраску.
Сернистый ангидрид SO 3 в обычных условиях представляет собой бесцветную очень летучую жидкость, кипящую при 44,8°C. Твердеет он при –16,8°C и становится очень похожим на обыкновенный лед. Но есть и другая – полимерная модификация твердого серного ангидрида (формулу его в этом случае следовало бы писать (SO 3) n ). Внешне она очень похожа на асбест, ее волокнистую структуру подтверждают рентгенограммы. Строго определенной точки плавления эта модификация не имеет, что свидетельствует о ее неоднородности.
Твердеет он при –16,8°C и становится очень похожим на обыкновенный лед. Но есть и другая – полимерная модификация твердого серного ангидрида (формулу его в этом случае следовало бы писать (SO 3) n ). Внешне она очень похожа на асбест, ее волокнистую структуру подтверждают рентгенограммы. Строго определенной точки плавления эта модификация не имеет, что свидетельствует о ее неоднородности.
Гипс и алебастр
Гипс CaSO 4 · 2Н 2 O – один из самых распространенных минералов. Но распространенные в медицинской практике «гипсовые шины» делаются не из природного гипса, а из алебастра. Алебастр отличается от гипса только количеством кристаллизационной воды в молекуле, его формула 2CaSO 4 · Н 2 O. При «варке» алебастра (процесс идет при 160…170°C в течение 1,5…2 часов) гипс теряет три четверти кристаллизационной воды, и материал приобретает вяжущие свойства. Алебастр жадно захватывает воду, при этом происходит быстрая беспорядочная кристаллизация. Разрастись кристаллики не успевают, но сплетаются друг с другом; масса, образованная ими, в мельчайших подробностях воспроизводит форму, в которой происходит твердение.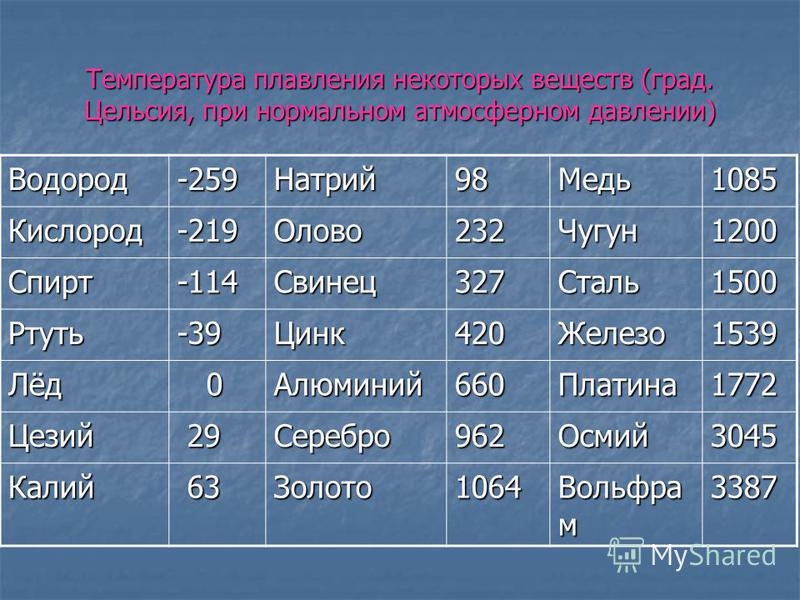 Химизм происходящего в это время процесса обратен происходящему при варке: алебастр превращается в гипс. Поэтому отливка – гипсовая, маска – гипсовая, повязка – тоже гипсовая, а делаются они из алебастра.
Химизм происходящего в это время процесса обратен происходящему при варке: алебастр превращается в гипс. Поэтому отливка – гипсовая, маска – гипсовая, повязка – тоже гипсовая, а делаются они из алебастра.
Глауберова соль
Соль Na 2 SO 4 · 10H 2 O, открытая крупнейшим немецким химиком XVII в. Иоганном Рудольфом Глаубером и названная в его честь, до сих пор широко применяется в медицине, стеклоделии, кристаллографических исследованиях. Глаубер так описывал ее: «Эта соль, если она хорошо приготовлена, имеет вид льда; она образует длинные, совершенно прозрачные кристаллы, которые растапливаются на языке, как лед. У нее вкус обыкновенной соли, без всякой едкости. Брошенная на пылающие угли, она не растрескивается с шумом, как обыкновенная кухонная соль, и не воспламеняется со взрывом, как селитра. Она без запаха и выносит любую степень жара. Ее можно применять с выгодой в медицине как снаружи, так и внутрь. Она заживляет свежие раны, не раздражая их. Это превосходное внутреннее лекарство: будучи растворена в воде и дана больному, она очищает кишки».
Минерал глауберовой соли называется мирабилитом (от латинского «mirabilis» – удивительный). Название происходит от имени, которое дал Глаубер открытой им соли; он назвал ее чудесной. Крупнейшие в мире разработки этого вещества находятся в нашей стране, чрезвычайно богата глауберовой солью вода знаменитого залива Кара-Богаз-Гол. Дно залива буквально устлано ею.
Сульфиты, сульфаты, тиосульфаты…
Если вы фотолюбитель, вам необходим фиксаж, т.е. натриевая соль серноватистой (тиосерной) кислоты Н 2 S 2 O 3 . Тиосульфат натрия Na 2 S 2 O 3 (он же гипосульфит) служил поглотителем хлора в первых противогазах.
Если вы порезались во время бритья, кровь можно остановить кристаллом алюмокалиевых квасцов KAl(SO 4) 2 · 12H 2 O.
Если вы хотите побелить потолки, покрыть медью какой-либо предмет или уничтожить вредителей в саду – вам не обойтись без темно-синих кристаллов медного купороса CuSO 4 · 5Н 2 О.
Бумага, на которой напечатана эта книга, сделана с помощью гидросульфита кальция Са(НSO 3) 2 .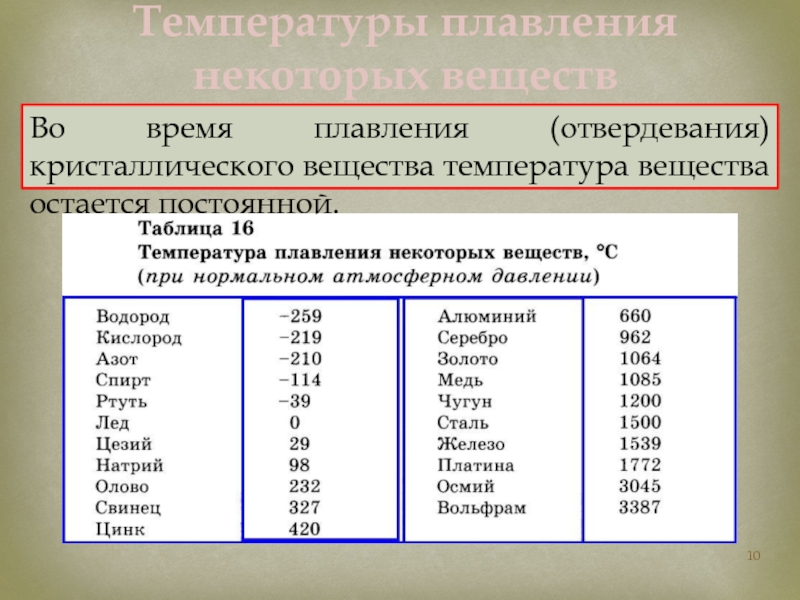
Широко используются также железный купорос FeSO 4 · 7H 2 O, хромовые квасцы K 2 SO 4 · Cr 2 (SO 4) 3 · 2Н 2 O и многие другие соли серной, сернистой и тиосерной кислот.
Киноварь
Если в лаборатории разлили ртуть (возникла опасность отравления ртутными парами!), ее первым делом собирают, а те места, из которых серебристые капли не извлекаются, засыпают порошкообразной серой. Ртуть и сера вступают в реакцию даже в твердом состоянии – при простом соприкосновении. Образуется кирпично-красная киноварь – сульфид ртути – химически крайне инертное и безвредное вещество.
Выделить ртуть из киновари несложно. Многие другие металлы, в частности железо, вытесняют ртуть из киновари.
Серобактерии
В природе постепенно происходит круговорот серы, подобный круговороту азота или углерода. Растения потребляют серу – ведь ее атомы входят в состав белка. Растения берут серу из растворимых сульфатов, а гнилостные бактерии превращают серу белков в сероводород (отсюда – отвратительный запах гниения).
Но есть так называемые серобактерии, которым вообще не нужна органическая пища. Они питаются сероводородом, и в их организмах в результате реакции между H 2 S, CO 2 и О 2 образуются углеводы и элементарная сера. Серобактерии нередко оказываются переполнены крупинками серы – почти всю их массу составляет сера с очень небольшой «добавкой» органических веществ.
Сера – фармацевтам
Все сульфамидные препараты – сульфидин, сульфазол, норсульфазол, сульгин, сульфодимезин, стрептоцид и другие подавляют активность многочисленных микробов. И все эти лекарства – органические соединения серы. Вот структурные формулы некоторых из них:
После появления антибиотиков роль сульфамидных препаратов несколько уменьшилась. Впрочем, и многие антибиотики можно рассматривать как органические производные серы. В частности, она обязательно входит в состав пенициллина.
Мелкодисперсная элементарная сера – основа мазей, применяемых при лечении грибковых заболеваний кожи.
Нитрид серы проводит ток
В 1975 г. журнал «Кэмикл энд инжениринг ньюс» сообщил о получении нового неорганического полимера, у которого многие свойства – как у металла. Полимерный нитрид серы – политиазил (SN) n легко прессуется и куется, его электропроводность близка к электропроводности ртути. При этом пленки из политиазила не одинаково проводят ток в продольном и поперечном направлении. Это объясняется тем, что пленка построена из упорядоченных, расположенных параллельно друг другу полимерных волокон.
журнал «Кэмикл энд инжениринг ньюс» сообщил о получении нового неорганического полимера, у которого многие свойства – как у металла. Полимерный нитрид серы – политиазил (SN) n легко прессуется и куется, его электропроводность близка к электропроводности ртути. При этом пленки из политиазила не одинаково проводят ток в продольном и поперечном направлении. Это объясняется тем, что пленка построена из упорядоченных, расположенных параллельно друг другу полимерных волокон.
Что можно построить из серы
В 70-х годах в некоторых странах мира производство серы превысило потребности в ней. Поэтому сере стали искать новые применения, прежде всего в таких материалоемких областях, как строительство. В результате этих поисков появились серный пенопласт – как теплоизоляционный материал, бетонные смеси, в которых серой частично или полностью заменен портландцемент, покрытия для автострад, содержащие элементарную серу.
Вулкан Иджен — действующий вулкан в Индонезии. Другое название синонимично названию местного сернистого озера Кавах Иджен или просто Кавах.
Расположен в густонаселённой местности в Восточной Яве, является границей 2 округов: Бондовосо и Баньуванги. Данный вулкан является комплексом, состоящим более чем из десятка вулканических объектов: стратовулканов, вулканических конусов, кратеров, расположенных в радиусе 20 км вокруг кальдеры.
Кратер вулкана Иджен (Ijen Volcano) – один из самых привлекательных и опасных на Земле. Активный вулкан, постоянно извергающий клубы серного дыма.
Вулкан Кава Иджен не похож на своих собратьев. Внутри его вулканической чаши, бурлит не огнекипящая лава, а тихо раскинулось, окруженное скалами, удивительной красоты неземное озеро с одноименным названием – Кавах Иджен. Его размеры 950 на 600 метров, объем – 36 миллионов кубометров. Но наполнено оно не водой, а смесью концентрированной серной и соляной кислоты, причем горячей: температура ее на поверхности около 60 градусов, на дне – еще выше. Однажды в это озеро опустили на двадцать минут лист алюминия, а когда его вынули, толщина металла стала сравнима с тончайшей тканью. Представляете, что будет, если вдруг начнется извержение? Когда магма вскипятит жуткое содержимое озера и тонны кислоты поднимутся в воздух? Угроза этого не беспочвенна. Правительство Индонезии в 2012 году установило уровень активности Кава Иджен в соответствии с желтой отметкой и до сих пор не понизило это предупреждение. Но выглядит озеро Кавах Иджен – необыкновенно!
Представляете, что будет, если вдруг начнется извержение? Когда магма вскипятит жуткое содержимое озера и тонны кислоты поднимутся в воздух? Угроза этого не беспочвенна. Правительство Индонезии в 2012 году установило уровень активности Кава Иджен в соответствии с желтой отметкой и до сих пор не понизило это предупреждение. Но выглядит озеро Кавах Иджен – необыкновенно!
Цвет поверхности его переменчив, оно то яблочно-зеленое, то изумрудное, то малахитовое с бирюзовым оттенком. На берегу и в отдалении, на серых с прожилками скалах разбросаны разнокалиберные глыбы ярко-желтого цвета. Это самородная сера. Сначала она жидкая, красивого темно-красного цвета и ползет по склонам, словно лава. Остывая – светлеет, приобретая цвет янтаря. Потом – желтеет, и делается твердой. В темное время суток, жидкая сера, окисляясь, начинает светиться нереальными синими, голубыми огнями и сполохами, фантастически преображая окрестности. Это и есть синяя лава. А днем горение обозначает себя дымчато-белыми клубами. По склонам кратерной воронки курится множество струй, то ли пара, то ли дымов. Вероятнее всего, так через трещины, из недр под давлением вырывается водяной пар, а с ним токсичный хлористый водород, удушающий сернистый газ и еще более вредный и коварный сероводород.
По склонам кратерной воронки курится множество струй, то ли пара, то ли дымов. Вероятнее всего, так через трещины, из недр под давлением вырывается водяной пар, а с ним токсичный хлористый водород, удушающий сернистый газ и еще более вредный и коварный сероводород.
Горение сопровождается шестьюстами градусами Цельсия, сияние не очень интенсивное при дневном свете, во всей красе его можно наблюдать только в ночное время.
Сфотографировать это зрелище – нелегкая задача. Французский фотограф Оливье Грюневальд специализируется на таких изображениях, не используя каких-либо фильтров или модификации изображения. Для того, чтобы сделать это, он должен ждать до заката, когда видны синие языки пламени. Он работает с противогазом, чтобы избежать вдыхания токсичных испарений.
Близ озера местные жители уже долгое время добывают серу. Это очень тяжелая и опасная работа. Люди вручную нагружают корзины кусками серы, а затем относят груз в соседнюю долину, где они получают выплату за добычу. Обычно корзина с серой весит 75−90 кг, и её приходится нести около 300 метров в гору, а потом ещё 3 км после спуска с кратера до ближайшего сахарного завода, в котором серу задействуют в очистительных процессах. Большинство рабочих проделывают такое путешествие дважды в день и, по данным за 2010 год, получают примерно $10-13 в день.
Обычно корзина с серой весит 75−90 кг, и её приходится нести около 300 метров в гору, а потом ещё 3 км после спуска с кратера до ближайшего сахарного завода, в котором серу задействуют в очистительных процессах. Большинство рабочих проделывают такое путешествие дважды в день и, по данным за 2010 год, получают примерно $10-13 в день.
По местным меркам это высокооплачиваемая и престижная работа. На острове Ява очень высокая плотность населения и безработица. Шахтеры, добывающие серу, являются своеобразной рабочей элитой.
Люди, которые занимаются этим трудом, часто жалуются на проблемы, связанные с дыханием. И это не удивительно, ведь долгое время находиться в кратере Иджен без противогаза опасно для здоровья. В свою очередь, рабочие часто пренебрегают защитой во время нахождения рядом с серой.
Серные пары настолько опасны для здоровья, что средняя продолжительность жизни рабочих всего около 47 лет.
: Несколько дней на Иджене, да и после, я провела в обнимку с «Комбайнерами». Навязчивая мелодия и такие же навязчивые слова удивительно хорошо легли на идженовскую картинку. Я смотрела на молодых мужчин, тащащих свои 90 кг серы 3 км вниз, к окошку сдачи, и думала о том, что комбайнеры везде свои. Да…
Навязчивая мелодия и такие же навязчивые слова удивительно хорошо легли на идженовскую картинку. Я смотрела на молодых мужчин, тащащих свои 90 кг серы 3 км вниз, к окошку сдачи, и думала о том, что комбайнеры везде свои. Да…
ВВС отснял про них прекрасный фильм, и каждый день они становятся героями фотохроник любопытствующих. Туризм на Иджене хоть и не принял размаха Бромо, все же отнюдь не редкость. Хорошо, что трафик на тропе пока не такой большой, иначе как лавировать между гостями вулкана тем, для кого эти три километра наверх порожняком и потом снова те же три, но вниз, и с грузом – единственный способ существования? Шахтеры работают каждый день. С утра, порой, до рассвета, они приезжают к началу тропы на Иджен. Там же собираются и туристические средства передвижения.
Потом с пустыми корзинами отправляются в свой ежедневный трек наверх. Всего 3 км. Кто-то идет в одиночку, кто-то собирается группками с товарищами, кто-то пристраивается к туристам и по пути рассказывает о своем житье-бытье, иногда получая в благодарность сигаретку-другую.
Сигареты на Иджене – местная валюта. Шахтеры с удовольствием попозируют для фото – с поклажей или без – или дадут вам попробовать хотя бы поднять их «штангу».
Все будут благодарны сигарете и тут же ее и выкурят. Курят они беспрестанно. Среди шахтеров мы случайным образом встретили только одного, который этой вредной привычки не имел.
По пути есть небольшое «общежитие» для тех, кто решил остаться переночевать поближе к рабочему месту. Ну или отдохнуть/перекусить.
Тут же выставлены удивительные местные сувениры: отлитые из серы разные фигурки. Странные, странные сувениры…
3 км вверх, а потом еще около полчаса вниз, к самой шахте. Сверху картинка выглядит какой-то нереальной: мелкие копошащиеся фигурки в желтом дыме.
Там несколько человек откалывают куски серы и грузят в подоспевшие корзины. Те, кто откалывают, меняются каждый день. Эта работа не оплачивается. Работа в самом аду, у фумарол. Дышать практически нечем. Хотя как нечем? Носом!
Глазам, вероятно, тоже приходится несладко.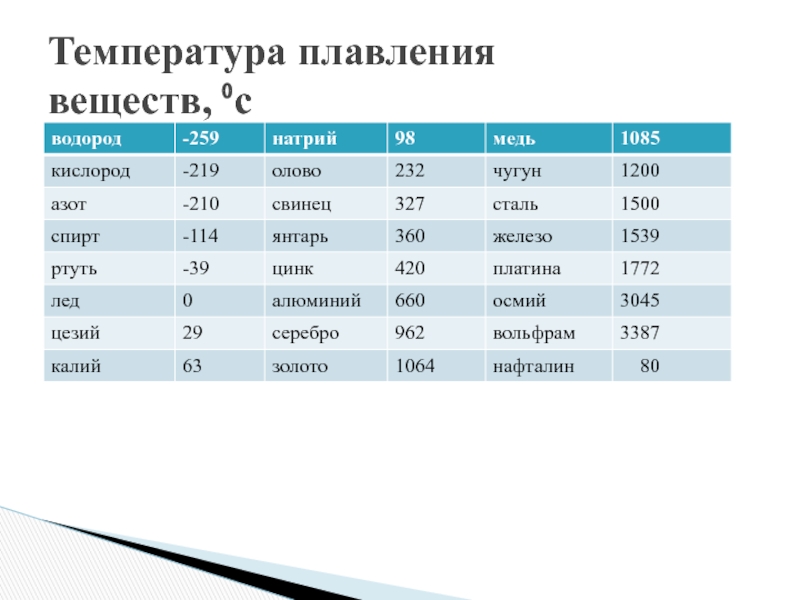
Шалаш почти у шахты. Зачем?
Подготовленные к отгрузке корзины.
Терек, наш попутчик, мечтал попасть на Иджен после того, как увидел фильм про шахтеров несколько лет назад. «Почему я не догадался привезти им пачку масок? В Бондовозо они всего по 3 000 рупий!» Терек, не переживай. Не факт, что твои маски вообще использовались бы. Зачем? На самом деле, внизу шахтеры иногда заматывают лицо банданами, платками и шарфами. И все же внизу нам встретился один человек в респираторе.
Леха в самом низу, у шахт.
Терек на тропе. Кстати, в итоге провел на Иджене 5 дней; сбылась его мечта посмотреть на вулкан лично и познакомиться с шахтерами. Часть времени провел в семьях шахтеров. Очень гостеприимные люди. Не думаю, что они ставят перед собой какие-то великие цели рассказать миру о совем тяжелом труде, но спасибо, что они это делают.
Конечно, ничего хорошего для здоровья в том, чтобы дышать серой, нет. С другой стороны, как оказывается, это не так ужасающе вредно, как выглядит на первый взгляд. Шахтеры обычно доживают лет до 50… Они в курсе вреда и риска, но выбирают заниматься этой работой. Более того, она считается весьма неплохой: заработать можно в несколько раз больше, чем где-нибудь, скажем, на фабрике батика (будь таковая поблизости).
Шахтеры обычно доживают лет до 50… Они в курсе вреда и риска, но выбирают заниматься этой работой. Более того, она считается весьма неплохой: заработать можно в несколько раз больше, чем где-нибудь, скажем, на фабрике батика (будь таковая поблизости).
Среди шахтеров встречаются и молодые люди, и люди постарше. Многим из тех, кого я отнесла к молодежи-молодежи, оказалось от 30 до 35. Все обычно при семьях и с детьми. Все жизнерадостные, искренние, вежливые. Рассказывают о совей работе и жизни, видимо, в душе посмеиваясь над странными иностранцами, которые слушают все это с широко открытыми глазами. Да, и выглядят молодо. Работа на свежем воздухе, как это ни парадоксально, видимо, влияет.
Несколько раз встречали мужчин более старшего возраста с огромными опухолями в районе скулы. Очевидно, злокачественные и понятно, воздействием какого фактора вызваны.
Кстати, на вид смотришь и удивляешься: как эти невысокие, дохлые ребята умудряются тащить такой груз? Да и на сами корзины смотришь – и не веришь, что там такой вес.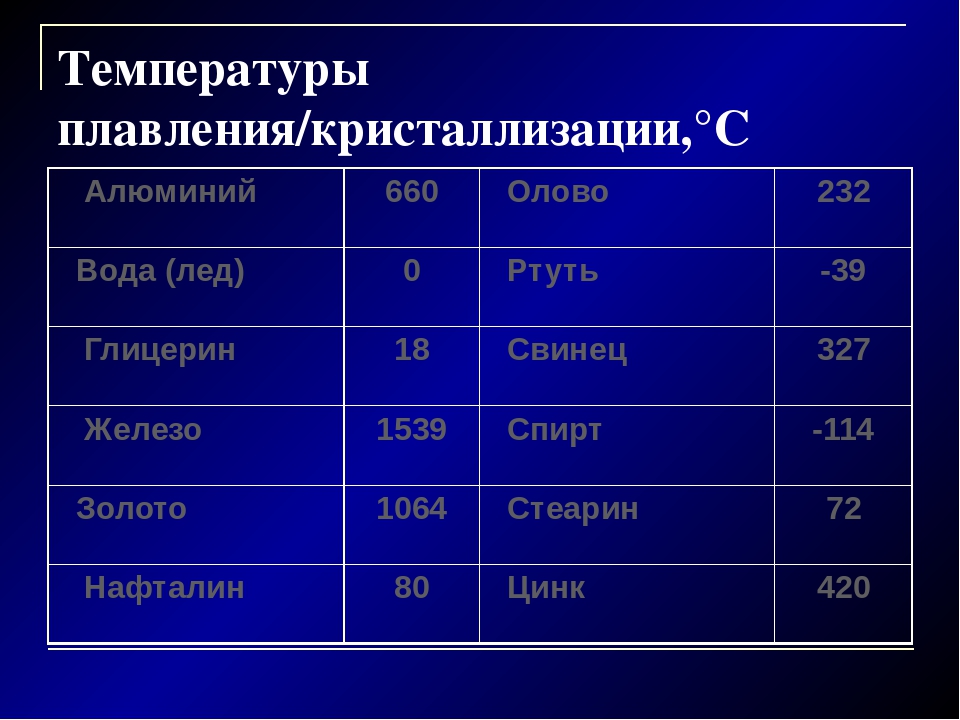 На вид сера кажется легкой и пористой, словно губка.
На вид сера кажется легкой и пористой, словно губка.
Вдоль тропы часто тут и там стоят корзины, дожидаются своих владельцев.
И отдыхают сами владельцы.
И перекур.
От постоянного ношения коромысла на плечах образуется своеобразный нарост типа мозоли прямо под палку.
3 км с серой, то вверх, то вниз, по валунам и тропам
– и сдавать то, что принес, в окошко приемки. Там, в темноте, под крышей, сидит какой-то уж очень характерный приемщик с острым, неприятно-сосредоточенным выражением лица. Словно читается, как он чувствует себя выше этих работяг, выдавая им копейки за адский труд. Хотя, быть может, это моя буйная фантазия. Очередь к приемке.
Сначала на весы. Обычно вес корзин где-то в рамках 65-90 кг.
После взвешивания получаешь бумажку у приемщика с отметкой сданного веса. Снова загружаешь свою ношу и несешь ее в грузовик, который после наполнения отвезет серу на фабрику. Она где-то километрах в 10 от Иджена. Сколько надо человек/ходок, чтобы наполнить его???
Теперь с бумажкой, на которой указан принятый вес, идем в окошко выдачи зарплаты. Это ценное место работы еще и потому, что деньги ты получаешь сразу.
Это ценное место работы еще и потому, что деньги ты получаешь сразу.
Этот шахтер сегодня принес немного: болят колени. На бумажке:
— брутто – 64 кг
— нетто – 59 кг
— стоимость за кг нетто – 780 рупий
— итоговая сумма к выдаче – 46 020 рупий, т.е. порядка 4,5 долларов.
За день шахтер делает одну или две (самые сильные и крепкие) ходки, зарабатывая, соответственно, до 10-12 долларов. При удачном стечении обстоятельств в месяц можно заработать долларов до 250.
Вы все еще жалуетесь на жизнь? Машина классом ниже, чем хотелось бы? Покупаете вторую линию одежды вместо первой? А в Европу слетать на выходные можете только лишь раз-другой в год? И обедать порой приходится дешевым бизнес-ланчем за 10 долларов? Действительно, жизнь, вероятно, не сложилась…
П.С. Все время у кратера и по дороге не покидает ощущение, что на странной машине времени ты перенесся на 200-400 лет назад. Сегодня XXI век на дворе, нет? Особенно сильно ощущение колониальных времен у киоска взвешивания. Становится не по себе от мысли, что люди намеренно убивают себя, а ведь можно было бы хотя бы как-то механизировать процесс. Ну хотя бы использовать осликов, буйволов, яков! Наверное, это просто будет дороже, да и ни к чему: сократятся рабочие места, безработица со всеми вытекающими… И все течет так же, как и столетия назад.
Становится не по себе от мысли, что люди намеренно убивают себя, а ведь можно было бы хотя бы как-то механизировать процесс. Ну хотя бы использовать осликов, буйволов, яков! Наверное, это просто будет дороже, да и ни к чему: сократятся рабочие места, безработица со всеми вытекающими… И все течет так же, как и столетия назад.
Сера (с лат. sērum «сыворотка») — минерал класса самородных элементов, неметалл. Латинское название связано с индоевропейским корнем swelp — «гореть ». Химическая формула: S.
Сера в отличие от других самородных элементов имеет молекулярную решетку, что определяет ее низкую твердость (1,5-2,5), отсутствие спайности, хрупкость, неровный излом и обусловленный им жирный плеск; лишь на поверхности кристаллов наблюдается стеклянный блеск. Удельный вес 2,07 г/см 3 . Обладает плохой электропроводимостью, слабой теплопроводностью, невысокой температурой плавления (112,8°С) и воспламенения (248°С). Легко загорается от спички и горит голубым пламенем; при этом образуется сернистый газ, имеющий резкий удушливый запах.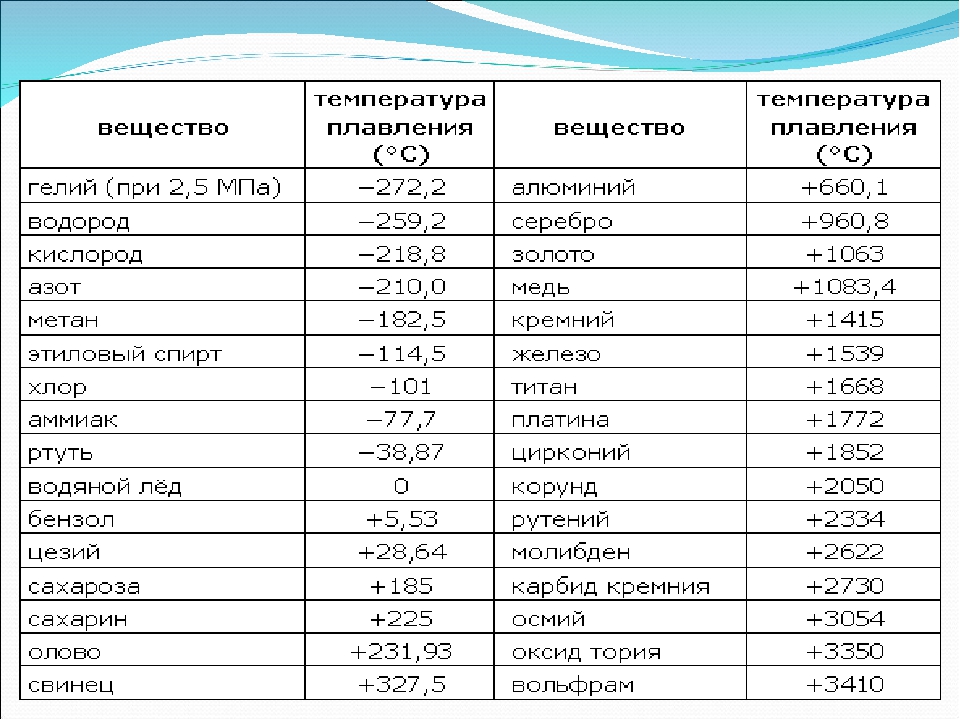 Цвет у самородной серы светло-жёлтый, соломенно-желтый, медово-желтый, зеленоватый; сера, содержащая органические вещества, приобретают бурую, серую, черную окраску. Вулканический сера ярко-желтая, оранжевая, зеленоватая. Местами обычно с желтоватым оттенком. Встречается минерал в виде сплошных плотных, натечных, землистых, порошковатых масс; также бывают наросшие кристаллы, желваки, налеты, корочки, включения и псевдоморфозы по органическим остаткам. Сингония ромбическая.
Цвет у самородной серы светло-жёлтый, соломенно-желтый, медово-желтый, зеленоватый; сера, содержащая органические вещества, приобретают бурую, серую, черную окраску. Вулканический сера ярко-желтая, оранжевая, зеленоватая. Местами обычно с желтоватым оттенком. Встречается минерал в виде сплошных плотных, натечных, землистых, порошковатых масс; также бывают наросшие кристаллы, желваки, налеты, корочки, включения и псевдоморфозы по органическим остаткам. Сингония ромбическая.
Отличительные признаки : для самородной серы характерны: неметаллический блеск и то, что она загорается от спички и горит, выделяя сернистый газ, имеющий резкий удушливый запах. Наиболее характерным цветом для самородной серы является светло-желтый.
Разновидность :
Вулканит (селенистая сера). Оранжево-красного, красно-бурого цвета. Происхождение вулканическое.
Моноклинная сера Кристаллическая сера Кристаллическая сера Селенистая сера — вулканит
Химические свойства серы
Загорается от спички и горит голубым пламенем, при этом образуется сернистый газ, имеющий резкий удушливый запах.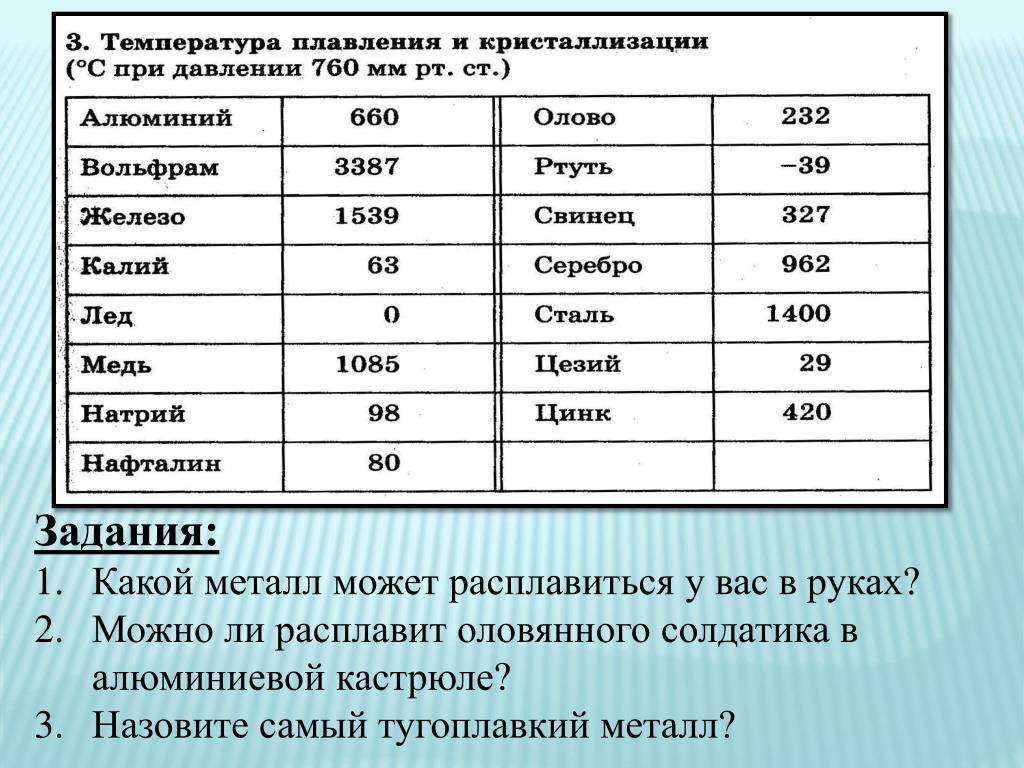 Легко плавится (температура плавления 112,8° С). Температура воспламенения 248°С. Сера растворяется в сероуглероде.
Легко плавится (температура плавления 112,8° С). Температура воспламенения 248°С. Сера растворяется в сероуглероде.
Происхождение серы
Встречается самородная сера естественного и вулканического происхождений. Серобактерии живут в водных бассейнах, обогащенных сероводородом за счет разложения органических остатков, — на дне болот, лиманов, мелких морских заливов. Лиманы Черного моря и залив Сиваш являются примерами таких водоемов. Концентрация серы вулканического происхождения приурочена к жерлам вулканов и к пустотам вулканических пород. При вулканических извержениях выделяются различные соединения серы (H 2 S, SО 2), которые окисляются в поверхностных условиях, что приводит к восстановлению ее; кроме того, сера возгоняется непосредственно из паров.
Иногда при вулканических процессах сера изливается в жидком виде. Это бывает тогда, когда сера, ранее осевшая на стенках кратеров, при повышении температуры расплавляется. Отлагается сера также из горячих водных растворов в результате распада сероводорода и сернистых соединений, выделяющихся в одну из поздних фаз вулканической деятельности. Эти явления сейчас наблюдаются около жерл гейзеров Йеллоустонского парка (США) и Исландии. Встречается совместно с гипсом, ангидритом, известняком, доломитом, каменной и калийной солями, глинами, битуминозными отложениями (нефть, озокерит, асфальт) и пиритом. Также встречается на стенках кратеров вулканов, в трещинах лав и туфов, окружающих жерла вулканов как действующих, так и потухших, вблизи серных минеральных источников.
Эти явления сейчас наблюдаются около жерл гейзеров Йеллоустонского парка (США) и Исландии. Встречается совместно с гипсом, ангидритом, известняком, доломитом, каменной и калийной солями, глинами, битуминозными отложениями (нефть, озокерит, асфальт) и пиритом. Также встречается на стенках кратеров вулканов, в трещинах лав и туфов, окружающих жерла вулканов как действующих, так и потухших, вблизи серных минеральных источников.
Спутники . Среди осадочных пород: гипс, ангидрит, кальцит, доломит, сидерит, каменная соль, сильвин, карналлит, опал, халцедон, битумы (асфальт, нефть, озокерит). В месторождениях, образовавшихся в результате окисления сульфидов, — главным образом пирит. Среди продуктов вулканического возгона: гипс, реальгар, аурипигмент.
Применение
Широко используется в химической промышленности. Три четверти добычи серы идет на изготовление серной кислоты. Применяется она также для борьбы с сельскохозяйственными вредителями, кроме того, в бумажной, резиновой промышленности (вулканизация каучука), в производстве пороха, спичек, в фармацевтике, стекольной, пищевой промышленности.
Месторождения серы
На территории Евразии все промышленные месторождения самородной серы поверхностного происхождения. Некоторые из них находятся в Туркмении, в Поволжье и др. Породы, содержащие серу, тянутся вдоль левого берега Волги от г. Самара полосой, имеющей ширину в несколько километров, до Казани. Вероятно, сера образовалась в лагунах в пермский период в результате биохимических процессов. Месторождения серы находятся в Раздоле (Львовская область, Прикарпатье), Яворовске (Украина) и в Урало-Эмбинском районе. На Урале (Челябинская обл.) встречается сера, образовавшаяся в результате окисления пирита. Сера вулканического происхождения имеется на Камчатке и Курильских островах. Основные запасы находятся в Ираке, США (штаты Луизиана и Юта), Мексике, Чили, Японии и Италии (о. Сицилия).
Фотограф Оливье Грюнвальд недавно несколько раз посетил шахту по добыче серы в кратере вулкана Кавах Льен в Восточной Яве, Индонезия. Он привез с собой необходимое оборудование, чтобы запечатлеть сюрреалистические снимки, освещенные лунным сиянием, факелами и голубым пламенем горящей серы.
Шахтеры в кратере сначала поднимаются на 2600 метров, затем спускаются к берегу 200-метрового кратерного озера серной кислоты, где они добывают куски чистой серы и везут их обратно на станцию взвешивания. Представляем вашему вниманию фотографии этих смелых шахтеров, работающих под покровом ночи.
1. Шахтер в кратере вулкана Кавах Льен с факелом смотрит на потоки жидкой серы, горящей жутковатым голубым пламенем. (© Olivier Grunewald)
2. Вулканическое кислотное озеро в кратере вулкана Кавах Льен. На берегу озера проводятся работы по добыче серы. (© Olivier Grunewald)
3. Паровые и кислотные газы среди желтоватых отложений серы. (© Olivier Grunewald)
4. Горящая раскаленная сера в вулканическом кратере. Сера плавится при температуре 100 градусов по Цельсию, но температуры в кратере недостаточно для самовозгорания – это пламя подсвечивается факелами шахтеров. (© Olivier Grunewald)
5. Шахтер расчищает куски серы, чтобы забрать в шахтоуправление. (© Olivier Grunewald)
(© Olivier Grunewald)
6. Отложения серы на старой бочке, окруженной серой, в кратере вулкана Кавах Льен. (© Olivier Grunewald)
7. Шахтеры добывают серу в адских условиях. Фотограф Оливье Грюнвальд вспоминает, что запах был просто нестерпим, для работы были необходимы маски, которых у шахтеров практически не было. (© Olivier Grunewald)
8. Шахтеры с длинными ломами, которыми они достают серу из кратера. (© Olivier Grunewald)
Подпишитесь на нас в telegram
9. «Скульптура», образованная жидкой серой в кратере Кавах Льена. В растопленном состоянии сера кажется практически кроваво-красной, но по мере остывания приобретает желтый оттенок. (© Olivier Grunewald)
10. Расплавленная сера горит, стекая с камней и керамических труб, превративших серные газы из вулкана в жидкость, которая затем затвердеет и будет пригодна для сбора. (© Olivier Grunewald)
11. Шахтеры работают в кратере, освещенные лишь факелами. (© Olivier Grunewald)
12. Шахтер кладет серу в корзинки, в которых ее выносят из кратера вулкана. (© Olivier Grunewald)
Шахтер кладет серу в корзинки, в которых ее выносят из кратера вулкана. (© Olivier Grunewald)
13. Шахтер собирает серу рядом с трубами конденсации. На заднем плане горит расплавленная сера. (© Olivier Grunewald)
14. Шахтеры с кусками серы готовятся к возвращению наверх. (© Olivier Grunewald)
15. Расплавленная сера горит на твердом отложении. Шахтеры потушат огонь, чтобы не потерять ценные запасы серы. (© Olivier Grunewald)
16. Шахтер с грузом возвращается обратно. (© Olivier Grunewald)
17. Шахтер в противогазе в густом облаке пара и кислотного газа с факелом, недалеко от голубого пламени горящей жидкой серы. (© Olivier Grunewald)
18. Пара полной серой корзин может весить от 45 до 90 кг. (© Olivier Grunewald)
19. Шахтеры готовятся возвращаться со своим грузом, окруженные паром, газом и светом от факелов. (© Olivier Grunewald)
20. Барак шахтеров прямо в кратере вулкана Кавах Льен. (© Olivier Grunewald)
21. Шахтер с грузом в виде кусков серы. (© Olivier Grunewald)
Шахтер с грузом в виде кусков серы. (© Olivier Grunewald)
22. Шахтеры с факелами возвращаются по 200-метровой стене кратера Кавах Льен. (© Olivier Grunewald)
23. А внизу продолжаются работы по добыче серы. (© Olivier Grunewald)
24. Шахтер взвешивает добытую серу в шахте. Шахтеры проделывают свое путешествие 2-3 раза в день, а зарабатывают около 13 долларов в день. (© Olivier Grunewald)
25. На станции первичной обработки куски серы разбивают на более мелкие части. (© Olivier Grunewald)
26. Затем куски серы помещают в крупные сосуды над огнем для повторного плавления. (© Olivier Grunewald)
27. Расплавленную серу разливают из плавильного котла в ведра. (© Olivier Grunewald)
28. Небольшое количество расплавлено серы разливают в другие сосуды. (© Olivier Grunewald)
29. Последняя стадия: разливание жидкой серы на плиты для остывания. После затвердения ее перевезут на местные заводы для изготовления резины, обесцвечивания сахара и других промышленных процессов.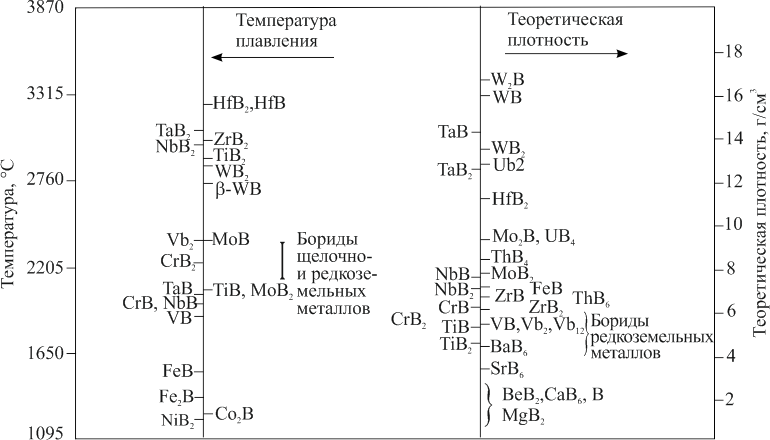 (© Olivier Grunewald)
(© Olivier Grunewald)
30. Фотограф Оливье Грюнвальд готовится сфотографировать небольшую скалу, нависшую над кислотным вулканическим озером Кавах Льена. «Такое ощущение, будто ты на другой планете», — делится впечатлением фотограф. В адских условиях кратера Оливье потерял один фотоаппарат и два объектива. После окончания работы над проектом он выбросил всю свою одежду, так как запах был настолько сильным, что он не смог от него избавиться. (© Olivier Grunewald)
В восточной части острова Ява, что находится в Индонезии, есть удивительное по красоте, но очень опасное по своей природе место – это вулкан Kawah Ijen. Вулкан находится на высоте около 2400 метров над уровнем море, диаметр его кратера 175 метров, а глубина – 212 метров. В его жерле расположено, наверное, самое странное и пугающее озеро прекрасного яблочно-изумрудного цвета, в котором рискнет искупаться разве что Терминатор, поскольку вместо воды в нем серная кислота. А точнее сказать – смесь серной и соляной кислоты объемом 40 млн.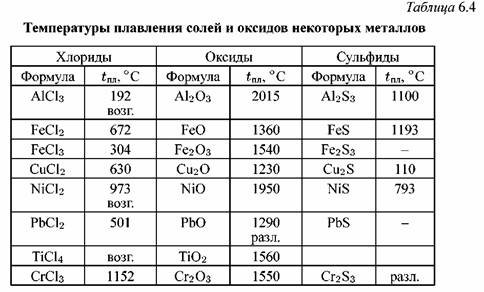 тонн.
тонн.
Известный французский фотограф Оливье Грюневальда недавно совершил несколько путешествий в серные рудники в кратере вулкана Kawaha Ijen, находящегося в Восточной Яве, Индонезия. Там он сделал при помощи специального оборудования захватывающие сюрреалистичные фотографии этого места в лунном свете, освещенного факелами и синем пламенем горящей расплавленной серы.
Спуск в кальдеру вулкана Kawaha Ijen, где находится озеро с серной кислотой шириной в километр. На его берегах добывают серу
Каждый литр этой смертельной жижи содержит дополнительно по 5 грамм расплавленного алюминия. Всего же в озере по приблизительным подсчетам содержится более 200 тонн алюминия. На поверхности озерца температура колеблется в районе 60 градусов, а на его дне и все 200!
Кислые газы и пар выделяются из желтоватых кусков серы
Чтобы люди могли представить всю опасность озера для жизней своих, был проведен эксперимент. В озеро на 20 минут опустили лист алюминия, уже при погружении он стал покрываться пузырями, а по прошествии всего времени, алюминиевый лист стал тонким, словно кусок ткани.
Рабочий отламывает кусок от твердой серы. Потом серу несут на станцию взвешивания.
Однако озеро и сам кратер вулкана Kawah Ijen используется не для привлечения туристов, а для добычи серы в весьма неблагоприятных для человека условиях. А серы в этом кратере несметное количество, но поскольку это все же ЮВА, то полностью используется ручной труд.
Ночь. Шахтер с факелом находится внутри кратера вулкана Ijen Kawaha, глядя на поток жидкой серы, светящийся сверхъестественным голубым цветом.
Рабочие – местные жители без каких-либо защитных костюмов и противогазов, а вдыхать запах серы то еще отвращение, добывают куски серы день и ночь, используя при этом лишь свои ничем незащищенные руки и платок, повязанный на лице для защиты рта и носа.
Шахтеры трудятся здесь в адских условиях во время добычи серы. Фотограф Оливье Грюневальда описал здешний запах как невыносимый, требующий маску или противогаз для техники безопасности. Некоторые из горняков их носят, остальные работают без них.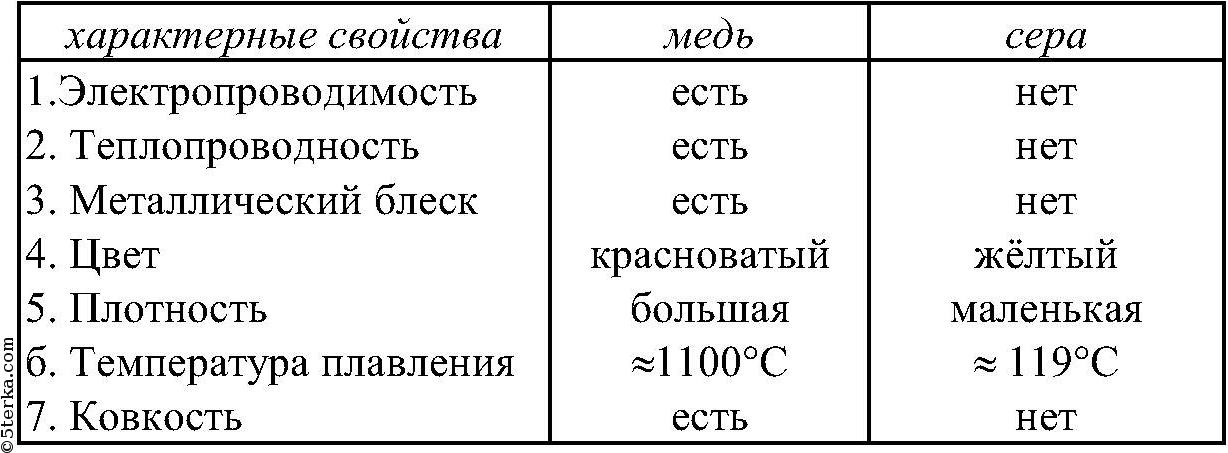
Шахтеры с ломами, которыми откалывают куски серы:
Рабочий укладывает куски серы в корзины, чтобы выносить ее из вулкана:
Вам кажется это все нарисовано? Посмотрите видео:
Поверили?
Эти причудливые формы образовались из потока жидкой серы внутри кратера вулкана Kawaha Ijen. Когда сера расплавленная, она имеет кроваво-красный цвет. По мере охлаждения она становится все более и более желтой
Расплавленная сера капает из керамической трубы, которая конденсирует серные газы от вулкана в жидкость. Потом она остывает, затвердевает, и ее добывают рабочие
Шахтер дошел до пункта назначения со своим грузом. Шахтеры делают два или три ходки за серой в день, получая за свой тяжелый труд около $ 13 США за смену
Механизм для начальной переработки серы, где большие куски разбиваются на более мелкие
Затем куски серы помешаются над огнем, и она снова расплавляется
Расплавленная сера разливается по емкостям
Последний этап этого процесса — распределение жидкой серы на плитах для охлаждения. Когда она охладится и превратится в серные листы, они отправляются на местные местные заводы по вулканизации резины и других промышленные объекты
Когда она охладится и превратится в серные листы, они отправляются на местные местные заводы по вулканизации резины и других промышленные объекты
Фотограф Оливье Грюневальда: «Ощущение такое, что находишься на другой планете». Грюневальд потерял одну камеру и два объектива в суровых условиях кратера. Когда съемки были закончены, он выбросил все свои вещи в мусор: серный запах был настолько сильным, что от него невозможно будет избавиться.
А теперь дневной репортаж из этой шахты:
Индонезийский шахтер несет серу из Ijen 24 мая 2009 в окрестностях Banyuwangi, Восточная Ява, Индонезия.
Заполненное кислотой озеро внутри кратера вулкана Ijen 200 метров в глубину и километр в ширину. Фото сделано 24 мая 2009 года в Восточной Яве, Индонезия. Озеро наполняется раствором серной кислоты и хлористого водорода при температуре 33 Сº.
Работник ремонтирует трубы, в которых, конденсируются сернистые газы. Комплекс вулкана Ijen 24 мая 2009 в окрестностях Banyuwangi, Восточная Ява, Индонезия.
Шахтер извлекает серу из трубы на кратере вулкана Ijen 24 мая 2009 года в Восточной Яве, Индонезия. Расплавленная сера вытекает из труб глубокого красного цвета, и по мере охлаждения постепенно становится желтой и затвердевает.
Работники чинят трубы, в которых, конденсируются сернистые газы. Комплекс вулкана Ijen 24 мая 2009 в окрестностях Banyuwangi, Восточная Ява, Индонезия.
Шахтер извлекает серу из трубы у кратера вулкана Ijen 24 мая 2009 года в Восточной Яве, Индонезия.
На этом фото, сделанном через сегмент запасной керамической трубы, работники ремонтируют большую трубу для конденсации серы. Комплекс вулкана Ijen 24 мая 2009 в окрестностях Banyuwangi, Восточная Ява, Индонезия.
Кусок серы добываемой из вулкана Ijen. Фото сделано 24 мая 2009 год, Восточная Ява, Индонезия.
Фотограф Оливье Грюнвальд недавно несколько раз посетил шахту по добыче серы в кратере вулкана Кавах Льен в Восточной Яве, Индонезия. Он привез с собой необходимое оборудование, чтобы запечатлеть сюрреалистические снимки, освещенные лунным сиянием, факелами и голубым пламенем горящей серы.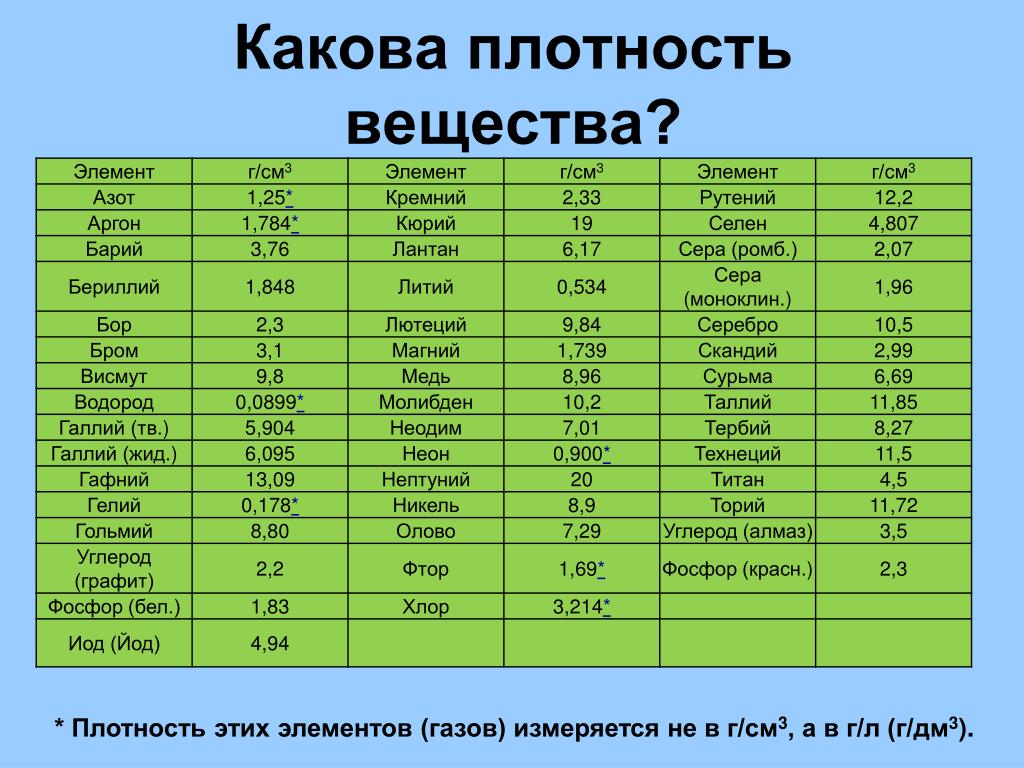
Шахтеры в кратере сначала поднимаются на 2600 метров, затем спускаются к берегу 200-метрового кратерного озера серной кислоты, где они добывают куски чистой серы и везут их обратно на станцию взвешивания. Представляем вашему вниманию фотографии этих смелых шахтеров, работающих под покровом ночи.
1. Шахтер в кратере вулкана Кавах Льен с факелом смотрит на потоки жидкой серы, горящей жутковатым голубым пламенем. (© Olivier Grunewald)
2. Вулканическое кислотное озеро в кратере вулкана Кавах Льен. На берегу озера проводятся работы по добыче серы. (© Olivier Grunewald)
3. Паровые и кислотные газы среди желтоватых отложений серы. (© Olivier Grunewald)
4. Горящая раскаленная сера в вулканическом кратере. Сера плавится при температуре 100 градусов по Цельсию, но температуры в кратере недостаточно для самовозгорания – это пламя подсвечивается факелами шахтеров. (© Olivier Grunewald)
5. Шахтер расчищает куски серы, чтобы забрать в шахтоуправление.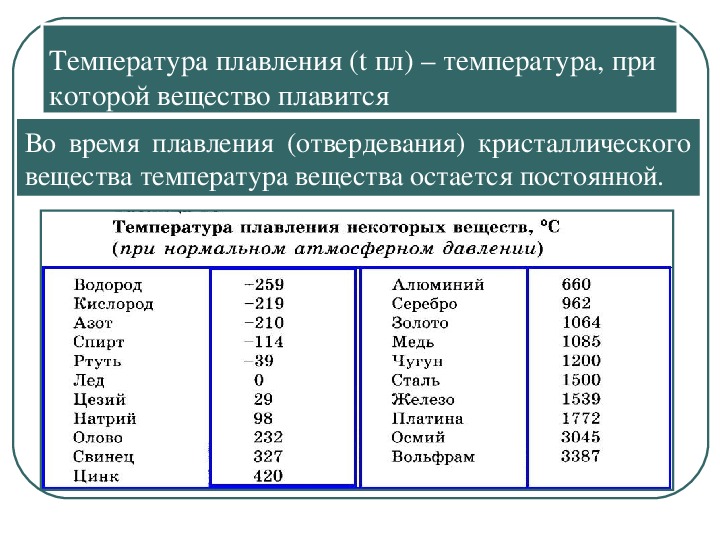 (© Olivier Grunewald)
(© Olivier Grunewald)
6. Отложения серы на старой бочке, окруженной серой, в кратере вулкана Кавах Льен. (© Olivier Grunewald)
7. Шахтеры добывают серу в адских условиях. Фотограф Оливье Грюнвальд вспоминает, что запах был просто нестерпим, для работы были необходимы маски, которых у шахтеров практически не было. (© Olivier Grunewald)
8. Шахтеры с длинными ломами, которыми они достают серу из кратера. (© Olivier Grunewald)
Подпишитесь на нас в telegram9. «Скульптура», образованная жидкой серой в кратере Кавах Льена. В растопленном состоянии сера кажется практически кроваво-красной, но по мере остывания приобретает желтый оттенок. (© Olivier Grunewald)
10. Расплавленная сера горит, стекая с камней и керамических труб, превративших серные газы из вулкана в жидкость, которая затем затвердеет и будет пригодна для сбора. (© Olivier Grunewald)
11. Шахтеры работают в кратере, освещенные лишь факелами. (© Olivier Grunewald)
12. Шахтер кладет серу в корзинки, в которых ее выносят из кратера вулкана. (© Olivier Grunewald)
Шахтер кладет серу в корзинки, в которых ее выносят из кратера вулкана. (© Olivier Grunewald)
13. Шахтер собирает серу рядом с трубами конденсации. На заднем плане горит расплавленная сера. (© Olivier Grunewald)
14. Шахтеры с кусками серы готовятся к возвращению наверх. (© Olivier Grunewald)
15. Расплавленная сера горит на твердом отложении. Шахтеры потушат огонь, чтобы не потерять ценные запасы серы . (© Olivier Grunewald)
16. Шахтер с грузом возвращается обратно. (© Olivier Grunewald)
17. Шахтер в противогазе в густом облаке пара и кислотного газа с факелом, недалеко от голубого пламени горящей жидкой серы. (© Olivier Grunewald)
18. Пара полной серой корзин может весить от 45 до 90 кг. (© Olivier Grunewald)
19. Шахтеры готовятся возвращаться со своим грузом, окруженные паром, газом и светом от факелов. (© Olivier Grunewald)
20. Барак шахтеров прямо в кратере вулкана Кавах Льен. (© Olivier Grunewald)
21. Шахтер с грузом в виде кусков серы. (© Olivier Grunewald)
Шахтер с грузом в виде кусков серы. (© Olivier Grunewald)
22. Шахтеры с факелами возвращаются по 200-метровой стене кратера Кавах Льен. (© Olivier Grunewald)
23. А внизу продолжаются работы по добыче серы. (© Olivier Grunewald)
24. Шахтер взвешивает добытую серу в шахте. Шахтеры проделывают свое путешествие 2-3 раза в день, а зарабатывают около 13 долларов в день. (© Olivier Grunewald)
25. На станции первичной обработки куски серы разбивают на более мелкие части. (© Olivier Grunewald)
26. Затем куски серы помещают в крупные сосуды над огнем для повторного плавления. (© Olivier Grunewald)
27. Расплавленную серу разливают из плавильного котла в ведра. (© Olivier Grunewald)
28. Небольшое количество расплавлено серы разливают в другие сосуды. (© Olivier Grunewald)
29. Последняя стадия: разливание жидкой серы на плиты для остывания. После затвердения ее перевезут на местные заводы для изготовления резины, обесцвечивания сахара и других промышленных процессов.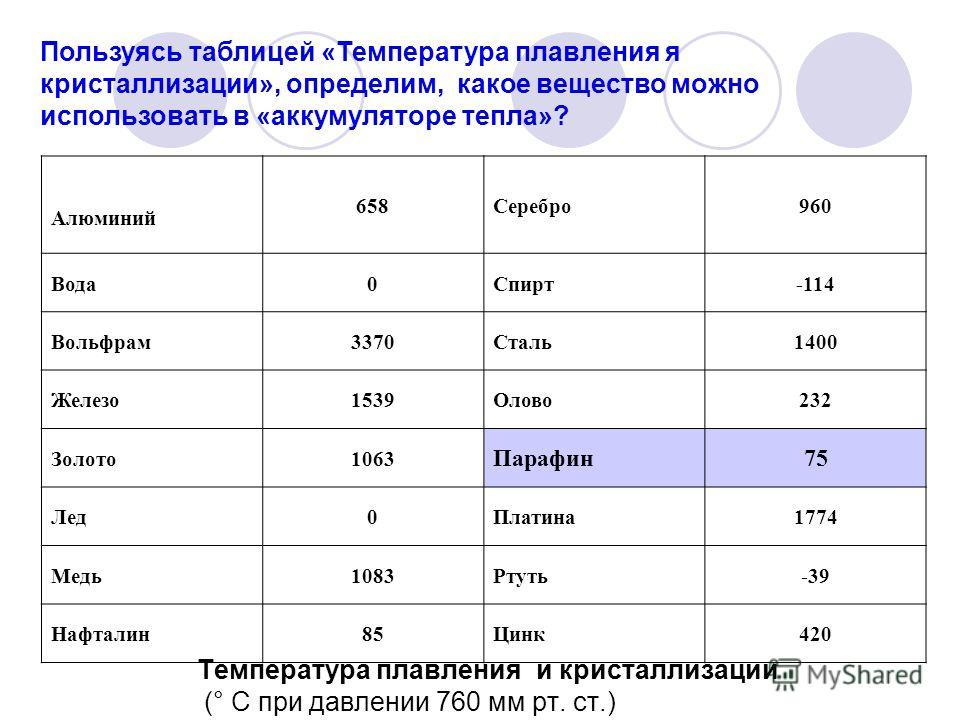 (© Olivier Grunewald)
(© Olivier Grunewald)
30. Фотограф Оливье Грюнвальд готовится сфотографировать небольшую скалу, нависшую над кислотным вулканическим озером Кавах Льена. «Такое ощущение, будто ты на другой планете», — делится впечатлением фотограф. В адских условиях кратера Оливье потерял один фотоаппарат и два объектива. После окончания работы над проектом он выбросил всю свою одежду, так как запах был настолько сильным, что он не смог от него избавиться. (© Olivier Grunewald)
Очень популярная тема в интернете, потому что очень эффектная и шокирующая. Кратер вулкана Иджен (Ijen Volcano) — один из самых привлекательных и опасных на Земле. Активный вулкан, постоянно извергающий клубы серного дыма, крупнейшее в мире кислотное озеро Кава Иджен (Kawah Ijen), невероятный по своей красоте синий огонь и нечеловеческие условия работы шахтеров, добывающих серу.
Не уж то это до сих пор происходит, задают себе вопрос многие. Давайте попробуем тут собрать наиболее полную информацию об этом месте.
Фото 2.
На самом деле Иджен — это не просто вулкан, а вулканический комплекс, из более чем из десятка вулканических объектов: стратовулканов, вулканических конусов, кратеров, расположенных в радиусе 20 км вокруг кальдеры.
Но туристов привлекает именно кратер с кислотным озером, берега которого являются естественным крупным месторождением природной серы. Кратер в радиусе составляет 361 метр и имеет глубину 200 метров.
Озеро Кава (Kawah) в кратере вулкана Иджен — это самое большое кислотное озеро в мире. Оно состоит из растворенной в воде концентрированных соляной и серной кислоты. Вулкан выбрасывает хлористый водород с виде газа. Взаимодействуя с водой, он образовывает серную кислоту с PH около нуля. Растворённая в воде соляная кислота и придает озеру красивый бирюзовый цвет.
Озеро является смертельно опасным, тем не менее его можно потрогать рукой. Температура на поверхности составляет 50-60°С, а в глубине — свыше 200°С. Глубина озера достигает 200 метров.
Фото 4.
Удивительное явление синего огня — это на самом деле сернистый газ, горящий при температуре 600°С, что и придает огню характерный синий цвет. Свечение достаточно слабое, поэтому увидеть его можно только ночью.
Порой серу поджигают сами рабочие. Часть дыма конденсируется в установленных в кратере керамических трубах и вытекает из труб, образуя сталактиты натуральной серы. Жидкая сера красного цвета извергается из вентиляционных отверстий и охлаждается до желтого на поверхности. Эти сталактиты, кстати, продают туристам в качестве сувениров.
Вот такие эффектные фотографии сделал известный французский фотограф Оливье Грюневальда, совершивший несколько путешествий в серные рудники в кратере вулкана Kawaha Ijen. Там он сделал при помощи специального оборудования захватывающие сюрреалистичные фотографии этого места в лунном свете, освещенного факелами и синем пламенем горящей расплавленной серы.
Потоки лавы, горящей синим пламенем, можно наблюдать на Иджене крайне редко. К сожалению, многие сайты показывают фотографии Оливьера Грюневальда и создают впечатление, что это происходит каждую ночь. Не верьте! Обычно горит только сернистый газ и нет никакой лавы.
К сожалению, многие сайты показывают фотографии Оливьера Грюневальда и создают впечатление, что это происходит каждую ночь. Не верьте! Обычно горит только сернистый газ и нет никакой лавы.
Фото 5.
В кратере местные жители вручную добывают серу. Это очень тяжелая и опасная работа. Без защитных костюмов, а многие даже без масок, шахтеры ломами откалывают куски серы и помещают их в корзину. Эти корзины они несут 200 метров к вершине кратера, а потом спускаются 3 км к подножью вулкана в деревню, где и получают вознаграждение за проделанную работу. Вес такой корзины 60-80 кг, некоторые умудряются поднимать до 90 кг.
Фото 6.
Обычно рабочие проделывают такое путешествие дважды в день. За 1 кг серы платят 900-1000 IDR, это значит около 5$ за корзину или 10$ в день. По местным меркам это высокооплачиваемая и престижная работа. На острове Ява очень высокая плотность населения и безработица. Шахтеры, добывающие серу, являются своеобразной рабочей элитой.
Однако это никак не помогает им долго жить.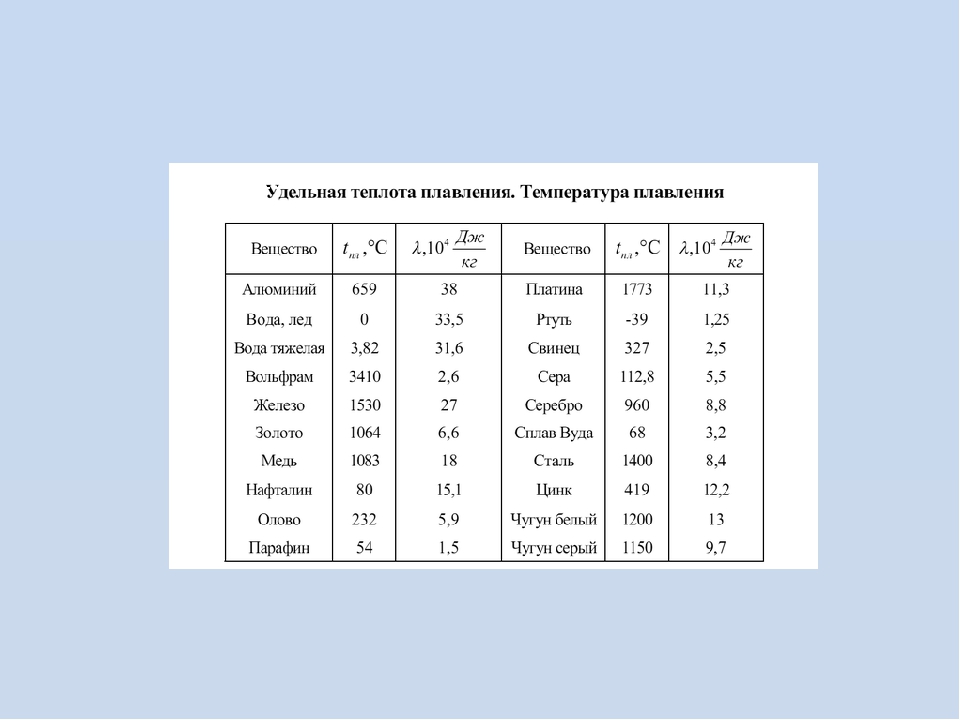 Серные пары настолько опасны для здоровья, что молодые парни выглядят стариками, а средняя продолжительность жизни около 47 лет.
Серные пары настолько опасны для здоровья, что молодые парни выглядят стариками, а средняя продолжительность жизни около 47 лет.
Фото 7.
Несмотря на ужасающие условия труда, рабочие — удивительно приветливые и жизнерадостные люди. Вот что пишет : Я испытала культурный шок, когда рабочий, на плечах которого корзина, вес которой превышает его собственный, уступил мне дорогу на камнях, ведущих к вершине кратера. Много раз нам подсказывали более удачный путь и с удовольствием позировали туристам.
Лучшее, что вы можете сделать для рабочих — подарить им респиратор или хотя бы просто защитную маску. Они не могут позволить себе купить даже сменные фильтры, нет ни денег, ни возможности. Многие рабочие даже не знают о том, что воздух, которым они дышат опасен.
Рабочие все как один курят. Говорят, что это им помогает немного сбить запах серы, который становится просто невозможным через какое-то время.
Фото 7.
можно посмотреть путешествие блогера по этим рудникам.
Чтобы люди могли представить всю опасность озера для жизней своих, был проведен эксперимент. В озеро на 20 минут опустили лист алюминия, уже при погружении он стал покрываться пузырями, а по прошествии всего времени, алюминиевый лист стал тонким, словно кусок ткани.
Фото 8.
На дне кратера сборщики серы оборудуют небольшой палаточный лагерь, в котором живут какое-то время, пока ведут на этом месте добычу. Как только сера извергается в другом месте, они перемещаются к нему. Таких «залежей» здесь несколько. Они оборудованы трубами, из которых стекает расплавленная сера. Когда она остывает и затвердевает, рабочие начинают ее собирать.
Фото 9.
Серу собирают в две корзины, соединенные между собой перекладиной из бамбука. Спасаясь от ядовитых паров, сборщики придумали собственное средство защиты. Представляет оно собой обычный кусок намоченной хлопчатобумажной ткани. Они сжимают его зубами и дышат через него или же просто обматывают тканью часть лица.
Фото 10.
Фото 11.
Фото 12.
Фото 13.
Фото 14.
Фото 15.
Фото 16.
Фото 17.
Фото 18.
Фото 19.
Фото 20.
Вследствие активности вулкана в кратере сквозь трещины постоянно выделяется сернистый пар. Горячий пар проходит через специально проложенные трубы, охлаждается вниз и стекает по склону кратера, постепенно затвердевая. Технология добычи весьма примитивна, но в данном случае большего и не нужно. Далее за дело берутся старатели, которые ломами и арматурой разбивают глыбы серы на куски, складывают в корзины и относят в приемный пункт. Для этого приходится преодолеть около 2500 метров по пересеченной местности с грузом в 45-90 кг на плечах.
Рабочие не используют специальных средств защиты, иногда только закрываясь платками. В противогазах и респираторах здесь появляются только пожарные, которые тушат горящую серу. Работают здесь вахтовым методом по 15 дней.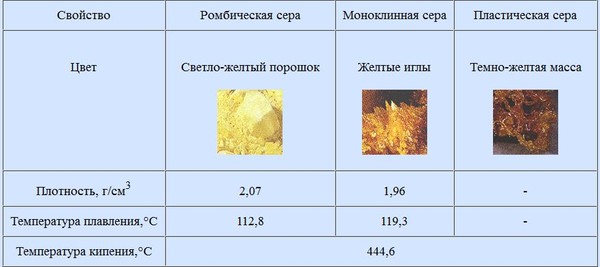
Добытая сера используется для вулканизации резины, обесцвечивания сахара и других промышленных процессов. Рабочие делают из нее маленькие сувениры на продажу, отливая из расплавленной серы различные фигурки.
Фото 21.
Фото 22.
Фото 23.
Фото 24.
Фото 25.
Индонезийский рабочий показывает купоны на оплату заработанных средств за доставленный груз серы из жерла вулкана Кава Иджен в восточной части острова Ява, Индонезия. Три купона — три ходки в жерло вулкана.
Фото 26.
Фото 27.
Фото 28.
Фото 29.
Фото 30.
Фото 31.
Фото 32.
Фото 33.
Фото 34.
Фото 35.
Фото 36.
Фото 37.
Фото 38.
Фото 39.
Фото 40.
Фото 42.
Фото 43.
Фото 44.
Фото 45.
Фото 46.
Фото 47.
Фото 48.
Фото 49.
Фото 50.
Фото 51.
Фото 52.
Фото 53.
Фото 54.
Фото 55.
Фото 56.
Фото 57.
Фото 58.
Фото 59.
Фото 60.
Фото 61.
Фото 1.
Фото 2.
Фото 4.
Фото 6.
Рубрика: Люди ,Путешествия
Индонезийский шахтер несет серу из вулкана Кава Иджен в окрестностях округа Баньюванги, Восточная Ява, Индонезия.
Мужчина ремонтирует полипропиленовые трубы, в которых происходит конденсация опасных газов. Индонезия.
Шахтер, при помощи стальной арматуры, извлекает серу из трубы в кратере вулкана Кава Иджен в Восточной Яве. Расплавленная сера имеет красный цвет, она вытекает из труб и по мере охлаждения становится желтой и затвердевает.
Работники чинят трубы, в которых конденсируются сернистые газы.
Мужчина дробит большой кусок затвердевшей серы на более мелкие, чтобы было удобнее их нести на станцию взвешивания. В окрестностях округа Баньюванги, Восточная Ява.
В окрестностях округа Баньюванги, Восточная Ява.
Фото сделано сквозь запасной сегмент керамической трубы. Работники за ремонтом трубы в кратере вулкана Кава Иджен, Индонезия.
На фото трубы, в которых конденсируется сернистый газ (оксид серы) – бесцветный газ с характерным резким запахом.
Кусок серы, добываемой из вулкана Кава Иджен, округ Баньюванги, Восточная Ява, Индонезия.
Шахтер извлекает серу из трубы, находящейся в кратере вулкана.
Мужчина с куском серы на плече направляется к своим корзинам, которые позже понесет на станцию взвешивания.
Фото сделано во время короткого перерыва в работе. Индонезия.
Груженые серой корзины шахтеры понесут вверх по крутым склонам кратера, а затем до станции взвешивания.
Шахтеры выносят серу из вулкана Кава Иджен, Восточная Ява.
Работник почти поднялся на вершину кратера по исхоженной тропе, ведущей к вулкану.
На этом фото видно, насколько тяжела ноша шахтеров.
Мужчина отдыхает перед очередным спуском в кратер вулкана, чтобы добыть еще серы.
Шахтер показывает болячки и шрамы от переноски серы из вулкана Кава Иджен в Восточной Яве, Индонезия.
На станции взвешивания в Индонезии.
Работник на базе отдыха “Camp Tehnic Sulfutara”.
Приготовление ужина на базе в Индонезии.
Шахтеры на перекуре перед очередным спуском к вулкану в Восточной Яве.
Медь и ее основные сплавы
Температура плавления латуни, бронзы и меди примерно одинаковая. Во всяком случае значения этой характеристики для всех трех данных цветных металлов находятся в одном узком диапазоне температур. Это обусловлено тем, что бронза и латунь являются сплавами меди, свойства которой в значительной степени влияют на их физические характеристики.
Блок: 1/5 | Кол-во символов: 340
Источник: http://tutmet.ru/temperatura-plavleniya-latuni.html
Нахождение в природе
Свое латинское название Cuprum металл получил от названия острова Кипр, где его научились добывать в третьем тысячелетии до н. э. В системе Менделеева Сu получил 29 номер, а расположен в 11-й группе четвертого периода.
э. В системе Менделеева Сu получил 29 номер, а расположен в 11-й группе четвертого периода.
В земной коре элемент на 23-м месте по распространению и встречается чаще в виде сульфидных руд. Наиболее распространены медный блеск и колчедан. Сегодня медь из руды добывается несколькими способами, но любая технологий подразумевает поэтапный подход для достижения результата.
- На заре развития цивилизации люди уже получали и использовали медь и ее сплавы.
- В то время добывалась не сульфидная, а малахитовая руда, которой не требовался предварительный обжиг.
- Смесь руды и углей помещали в глиняный сосуд, который опускался в небольшую яму.
- Смесь поджигалась, а угарный газ помогал малахиту восстановиться до состояния свободного Cu.
- В природе есть самородная медь, а богатейшие месторождения находятся в Чили.
- Сульфиды меди нередко образуются в среднетемпературных геотермальных жилах.

- Часто месторождения имеют вид осадочных пород.
- Медяные песчаники и сланцы встречаются в Казахстане и Читинской области.
Блок: 2/5 | Кол-во символов: 1165
Источник: https://tokar.guru/metally/temperatura-plavleniya/pri-kakoy-temperature-plavitsya-med-plavlenie.html
Основные факты
Медь является очень важным материалом для человека. Первыми орудиями труда у людей были именно медные изделия. Раньше обработка металла производилась холодным методом, что подтверждают различные археологические находки на территории Северной Америки. Еще до приезда Колумба индейцы сохранили такие традиции. Установлено, что еще 7 000 лет назад человек добывал и использовал медную руду. Именно благодаря его податливости он стал очень популярным.
Медь имеет красноватый оттенок за счет небольшого количества кислорода в составе.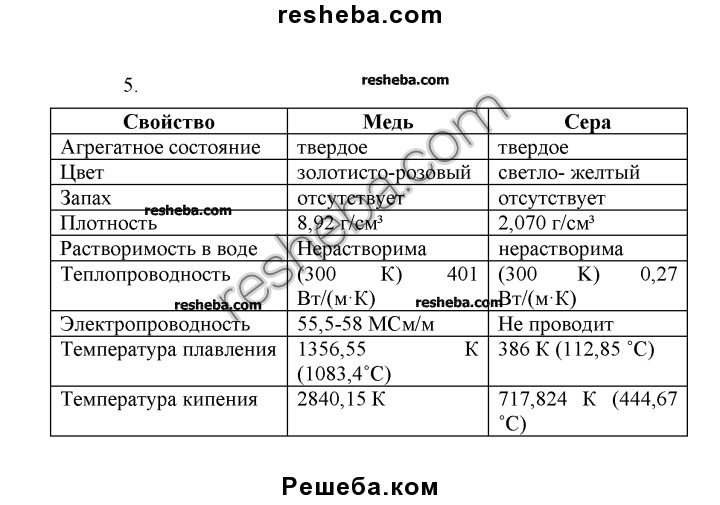 Если полностью исключить этот элемент, то оттенок будет желтоватым. Если начистить медь, то она будет иметь яркий блеск. Чем больше будет валентность, тем слабее оттенок. К примеру, медные карбонаты обычно имеют зеленый либо синий цвет.
Если полностью исключить этот элемент, то оттенок будет желтоватым. Если начистить медь, то она будет иметь яркий блеск. Чем больше будет валентность, тем слабее оттенок. К примеру, медные карбонаты обычно имеют зеленый либо синий цвет.
После серебра медь является вторым металлом, который обладает хорошей электропроводностью. Из-за этого он активно применяется в электронике. Медь плохо реагирует на кислород. Она покрывается пленкой из-за окисления на свежем воздухе.
Медный оксид можно получить, если прокалить медь, гидрокарбонат или нитрат на воздухе. Это соединение способно окисляюще воздействовать на соединения органического характера.
Если растворить медь в серной кислоте, то выходит медный купорос. Его применяют в химической промышленности, а также использует в качестве профилактики вредителей урожая.
В зависимости от влияния примесей на характер общего медного сплава можно выделить 3 основные группы.
- К первой относятся те соединения, которые вместе с медью создают твердые вещества.
 Это касается мышьяка и сурьмы. Сюда же относятся железо, цинк, никель, олово, алюминий, фосфор и прочие.
Это касается мышьяка и сурьмы. Сюда же относятся железо, цинк, никель, олово, алюминий, фосфор и прочие. - Вторую группу составляют соединения, которые практически не растворяются в меди. Примером является висмут, свинец и прочие. Из-за них обработка посредством давления затруднена. На способность к электропроводности это практически не влияет.
- Третья группа — это сера и кислород. Вместе с медью они создают химические соединения, которые отличаются своей хрупкостью.
Блок: 2/5 | Кол-во символов: 2017
Источник: https://ometallah.com/plavlenie/med.html
1 Расшифровка термина для чистых веществ и металлов
Для твердых кристаллических материалов, к коим относятся и металлы, состоящие из чистого (без примесей) вещества, температурой плавления является такой показатель их нагревания, при котором они переходят в другое состояние – жидкое. Причем при этой же температуре чистые вещества (металлы) и застывают. То есть для них такой показатель нагрева является температурой одновременно и плавления, и кристаллизации. А сами металлы, нагретые до температуры их плавления, могут находиться не только в жидком, но и твердом состоянии. Это зависит от того, продолжить подводить к ним дополнительное тепло или дать начать остывать.
А сами металлы, нагретые до температуры их плавления, могут находиться не только в жидком, но и твердом состоянии. Это зависит от того, продолжить подводить к ним дополнительное тепло или дать начать остывать.
Температура плавления
Вообще, по достижении температуры плавления чистое вещество сначала все еще остается твердым. Если продолжить нагрев, то оно станет жидким. Но температура вещества не будет повышаться (меняться) до тех пор, пока оно все полностью не расплавится в рассматриваемой системе (изделии, теле). А когда расплавленное вещество остывает до температуры кристаллизации (плавления), то оно сначала все еще остается жидким. И только если начать дополнительное отведение от него тепла, тогда оно станет переходить в кристаллическое твердое состояние (застывать). Но температура вещества, опять же, не будет меняться (понижаться), пока оно полностью не затвердеет.
Блок: 2/5 | Кол-во символов: 1343
Источник: http://tutmet.ru/temperatura-plavleniya-latuni.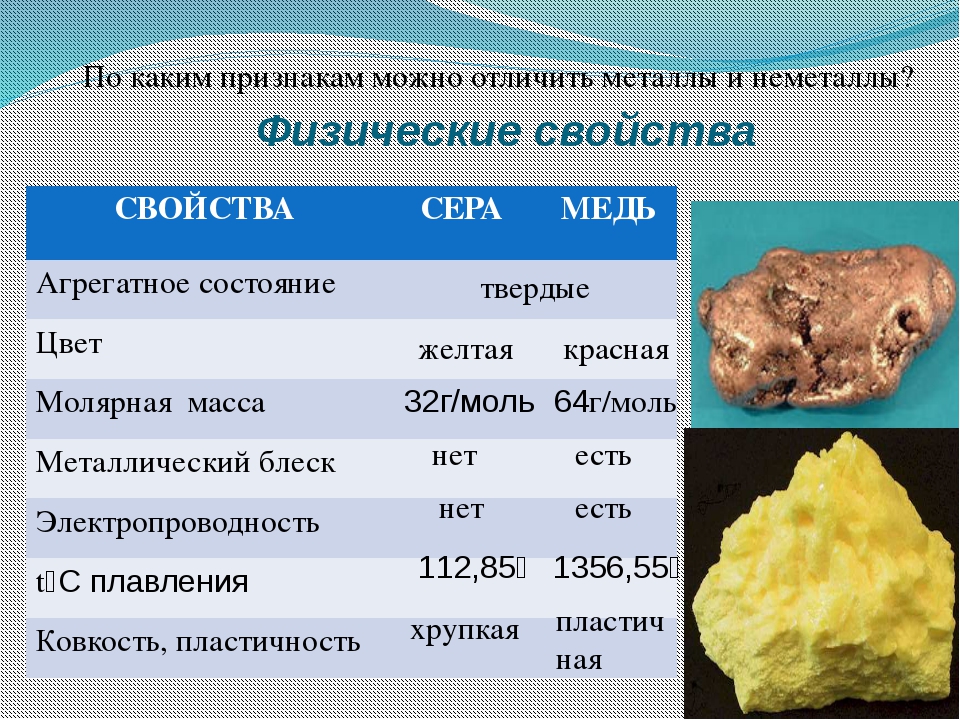 html
html
2 Особенности расплавления смесей и марок меди
У смесей веществ (в том числе и у различных сплавов металлов) нет температуры плавления/кристаллизации. Они совершают переход из одного состояния в другое (из твердого в жидкое и обратно) в некотором определенном интервале степени своего нагрева, граничные значения диапазона которого имеют соответствующее название. Температуру, при которой смеси веществ и сплавы металлов начинают переходить в жидкую фазу (или полностью затвердевают), называют «точкой солидуса». Степень нагрева, при котором происходит полное расплавление (или начинается кристаллизация при остывании), называют «точкой ликвидуса». Но в обиходе чаще говорят: температура солидуса и ликвидуса.
Точно замерить эти температуры как для смесей веществ, так и для сплавов металлов невозможно. Их определяют по специальным расчетным методикам, в которых учитывается точное процентное соотношение в смеси каждого элемента и ряд других параметров.
То есть относительно рассматриваемых металлов можно сделать следующие выводы. Температура плавления есть только у меди. Причем, только у чистой. У всех остальных металлов (латуни, бронзы и различных марок меди) ее нет, а есть температуры солидус и ликвидус. Для латуни и бронзы это так, потому что они являются сплавами меди, в которых в зависимости от марки добавлены различные легирующие добавки (другие металлы или иные вещества) и еще есть какие-то примеси. А производимые металлургической промышленностью для различных нужд марки меди имеют такие характеристики плавления, так как они тоже производятся легированными и с примесями. Чистую медь изготавливать нецелесообразно, и она уступает по своим характеристикам, требуемым для народного и промышленного ее использования, свойствам выпускаемых из нее марок.
Температура плавления есть только у меди. Причем, только у чистой. У всех остальных металлов (латуни, бронзы и различных марок меди) ее нет, а есть температуры солидус и ликвидус. Для латуни и бронзы это так, потому что они являются сплавами меди, в которых в зависимости от марки добавлены различные легирующие добавки (другие металлы или иные вещества) и еще есть какие-то примеси. А производимые металлургической промышленностью для различных нужд марки меди имеют такие характеристики плавления, так как они тоже производятся легированными и с примесями. Чистую медь изготавливать нецелесообразно, и она уступает по своим характеристикам, требуемым для народного и промышленного ее использования, свойствам выпускаемых из нее марок.
Температура плавления металлов
Очевидно, что величина температуры ликвидус рассматриваемых металлов будет зависеть от их химического состава. В первую очередь от процентного содержания меди, так как ее в них всегда больше 50 %. И, соответственно, точка ликвидус марок этих металлов будет тем ближе к температуре плавления самой меди, чем ее больше в сплаве. А легирующие металлы или другие вещества и примеси, в зависимости от своего процентного содержания и температуры плавления, будут вносить соответствующую корректировку в сторону понижения либо повышения точки ликвидус у марок меди, бронзы и латуни. Понижать, если своя температура плавления ниже, чем у меди, и повышать, когда выше.
А легирующие металлы или другие вещества и примеси, в зависимости от своего процентного содержания и температуры плавления, будут вносить соответствующую корректировку в сторону понижения либо повышения точки ликвидус у марок меди, бронзы и латуни. Понижать, если своя температура плавления ниже, чем у меди, и повышать, когда выше.
Так, ознакомившись, какие виды и марки бронзы производят, можно самому догадаться, в какую сторону будет отличаться у них точка ликвидус от температуры плавления чистой меди. Сам состав бронзы подскажет его влияние на эту и другие характеристики данного сплава. А ознакомление с составом латуни даст возможность судить об отклонениях ее точки ликвидус от температуры плавления меди. С марками меди то же самое, но влияние легирующих добавок и примесей на их точку ликвидус будет рассмотрено отдельно ниже.
Блок: 3/5 | Кол-во символов: 2967
Источник: http://tutmet.ru/temperatura-plavleniya-latuni.html
Физически свойства
Пластичный металл на открытом воздухе быстро покрывается оксидной пленкой, она и придает элементу характерный желтовато-красный оттенок, в просвете пленки могут иметь зеленовато-голубой цвет. Медь относится к тем немногим элементам, которые имеют заметную для глаза цветовую окраску. Она обладает высоким уровнем тепло- и электропроводности — это второе место после серебра.
Медь относится к тем немногим элементам, которые имеют заметную для глаза цветовую окраску. Она обладает высоким уровнем тепло- и электропроводности — это второе место после серебра.
- Плотность — 8,94*103 кг/м3
- Удельная теплоемкость при Т=20оС — 390 Дж/кг*К
- Электрическое удельное сопротивление в температурном режиме от 20-100оС — 1,78*10-8Ом/м
- Температура кипения — 2595оС
- Удельная электропроводность при Т=20оС — 55,5-58 МСм/м.
Блок: 3/5 | Кол-во символов: 635
Источник: https://stanok.guru/cvetnye-metally-i-splavy/med/temperatura-i-usloviya-dlya-plavleniya-medi-v-domashnih-usloviyah.html
Маркировка по ГОСТ
Существуют различные маркировки меди
В зависимости от добавок, примесей и их доли в общем объеме, сплав имеет разные свойства. Это может быть устойчивость к коррозии, прочность, антифрикционный эффект и прочее. Самыми распространенными являются смеси меди с алюминием, цинком, марганцем, магнием. Но в промышленности применяются варианты и с другими химическими веществами.
Но в промышленности применяются варианты и с другими химическими веществами.
Разработано специальная таблица с маркировкой меди и ее характеристиками. Она применяется, когда нужно определить состав по классификации ГОСТ.
- К примеру, в Марке М00 содержание меди должно быть не менее 99,99%.
- В марке М0 содержится примерно 99,95% меди. В марке М0б присутствует примерно 99,97% основного компонента.
- Если медь обозначается как М1, это значит, что ее доля во всем составе около 99,9%.
- Если имеется пометка М1р, то это означает, что в веществе содержится 99,9 меди.
- Если имеется обозначение М2, то меди будет 99,7%, а вот в марке М2р тоже такая же концентрация основного компонента.
- Если пишется марка М3 иМ3р, то количество меди составляет 99,5%. Если марка М4, то количество основного вещества равняется 99%.
- Несмотря на то что количество меди в марках М1 и М1р, М2 и М2р, М3 и М3р одинаковое, при этом в продуктах с буквой «р» содержание кислорода меньше и составляет только не более 0,01%, а вот в других — примерно 0,05-0,08%.
 Кроме того, в состав включен фосфор, но его доля не более 0,04%.
Кроме того, в состав включен фосфор, но его доля не более 0,04%.
А вот в продукте с маркой М0б совсем отсутствует кислород, в отличие от продукта с пометкой М0, где содержание кислорода составляет примерно 0,02%.
В большинстве случаев применяется катодная медь либо полуфабрикаты из меди (это касается проката, катанок и прочих изделий). Особенности и область применения зависят от процентного содержания примесей в общем продукте. В различных марках может быть 10–50 примесей. Чаще всего медь разделяют на 2 группы:
- Сплавы, которые содержат минимальное количество кислорода — не более 0,011%. По ГОСТу они обозначаются как М00, М01 и М3. Обычно применяются они для токопроводников либо создания сплавов, которые отличаются высокой чистотой.
- Металл рафинированного типа, которые имеет примеси фосфора в общем объеме. Предназначен для общего применения. По ГОСТу обозначается как М1ф, М2р, М3р. Обычно применяется для создания фольги, труб и листов горячего и холоднокатаного типа.

Для создания чистых и высокоточных металлов применяется только медь той марки, где отсутствует кислород. Это очень важно для криогенной промышленности. В остальных же случаях используются другие виды меди. Например, применение бывает следующим в зависимости от марки:
- М0 и М00 используется в производстве электропроводниковых деталей и деталей с высокой частотой. Обычно такие элементы получаются дороже, и делают их на заказ.
- М001б и М001бф применяется для медной проволоки с небольшим диаметром сечения. Также подходит для другой проводки и электрических шин.
- М1 (в том числе М1р, М1ре и М1ф) применяются как проводники для электрического тока. Они задействованы для создания бронзы высокого качества, где минимальное количество олова. Обычно делают электроды и прутья для сварки чугуна и прочих металлов, которые трудно сваривать.
- М2 (в том числе М2к, М2р) используется обычно для деталей, которые применяются в криогенной промышленности. Еще подходит для литого проката, который будет подвергаться обработки под давлением.

- М3 (в том числе М3р и М3к) подходит для производства полуфабрикатов прессованного типа либо проката плоского характера. Еще используется для проволоки, которая задействуется для сварки электромеханического характера чугунных и медных деталей.
Блок: 3/5 | Кол-во символов: 3595
Источник: https://ometallah.com/plavlenie/med.html
Какие процессы происходят при плавлении меди
Что характерно, температуры плавления меди и сплавов, полученных на ее основе, отличаются. При добавлении в медь олова, имеющего меньшую температуру плавления, получают бронзу с температурой плавления 930–1140 градусов Цельсия. А сплав меди с цинком (латунь) плавится при 900–10500 Цельсия.
Во всех металлах в процессе плавления происходят одинаковые процессы. При получении достаточного количества теплоты при нагревании кристаллическая решетка металла начинает разрушаться. В тот момент, когда он переходит в расплавленное состояние, его температура не повышается, хотя процесс передачи ему теплоты при помощи нагрева не прекращается. Температура металла начинает вновь повышаться только тогда, когда он весь перейдет в расплавленное состояние.
Температура металла начинает вновь повышаться только тогда, когда он весь перейдет в расплавленное состояние.
Диаграмма состояния системы хром-медь
При охлаждении происходит противоположный процесс: сначала температура резко снижается, затем на некоторое время останавливается на постоянной отметке. После того, как весь металл перейдет в твердую фазу, температура снова начинает снижаться до полного его остывания.
Как плавление, так и обратная кристаллизация меди, связаны с параметром удельной теплоты. Данный параметр характеризует удельное количество теплоты, которая требуется для того, чтобы перевести металл из твердого состояния в жидкое. При кристаллизации металла такой параметр характеризует количество теплоты, которое он отдает при остывании.
Более подробно узнать о плавлении меди помогает фазовая диаграмма, показывающая зависимость состояния металла от температуры. Такие диаграммы, которые можно составить для любых металлов, помогают изучать их свойства, определять температуры, при которых они кардинально меняют свои свойства и текущее состояние.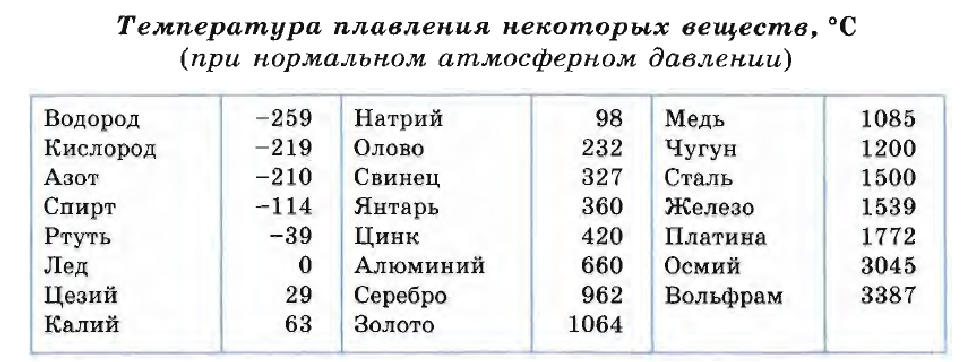
Кроме температуры плавления, у меди есть и температура кипения, при которой расплавленный металл начинает выделять пузырьки, наполненные газом. На самом деле никакого кипения меди не происходит, просто этот процесс внешне очень его напоминает. Довести до такого состояния ее можно, если нагреть до температуры 2560 градусов.
Как понятно из всего вышесказанного, именно невысокую температуру плавления меди можно назвать одной из основных причин того, что сегодня мы можем использовать этот металл, обладающий многими уникальными характеристиками.
Блок: 3/3 | Кол-во символов: 2315
Источник: http://met-all.org/cvetmet-splavy/med/kakova-temperatura-plavleniya-medi-i-ee-splavov.html
Переплавка меди дома
Этот металл обладает целым набором полезных свойств, которые делают её весьма желанным металлом в домашнем хозяйстве. А относительно невысокая температура при плавлении и изрядное количество медного лома, которое можно обнаружить на ближайшей свалке, позволяют задавать вопрос о том, как расплавить медь в домашних условиях, не как риторический, а вполне реальный и практический.
График плавления меди
Расплавление любого металла заключается в том, что под воздействием высоких температур разрушается кристаллическая решётка и металл переходит из твёрдого состояния в жидкое. Можно выделить некоторые закономерности, свойственные любому металлу в процессе расплавления:
- Во время нагревания температура внутри металла повышается, но кристаллическая решётка не подвергается разрушению. Металл сохраняет своё твёрдое состояние.
- При достижении температуры плавления, для меди это 1083 градуса, температура внутри металла перестаёт повышаться, несмотря на то что общий нагрев и передача тепла продолжаются.
- После того как вся масса метала переходит в расплавленное состояние, температура внутри металла снова начинает резко повышаться.
В случае процесса охлаждения расплавленного металла происходит всё то же самое, но в обратной последовательности. Сначала происходит резкое снижение температуры внутри металла, затем на значении 1080 градусов падение температуры прекращается до тех пор, пока вся масса метала не перейдёт в твёрдое состояние. После этого температура снова начинает резко падать, пока не сравняется с температурой окружающего воздуха и кристаллизация не завершится окончательно.
Сначала происходит резкое снижение температуры внутри металла, затем на значении 1080 градусов падение температуры прекращается до тех пор, пока вся масса метала не перейдёт в твёрдое состояние. После этого температура снова начинает резко падать, пока не сравняется с температурой окружающего воздуха и кристаллизация не завершится окончательно.
Температура кипения
Медь начинает активно выделять углерод в виде пузырьков газа при температуре 2560 градусов. Внешне это очень напоминает кипение воды. На самом деле это процесс активного окисления меди, в результате которого металл теряет практически все свои уникальные свойства. Детали, отлитые из кипящей меди, имеют в своей структуре большое количество пор, которые будут уменьшать механическую прочность материала и ухудшать его декоративные свойства. Потому в процессе плавки необходимо внимательно следить за температурой и не допускать закипания меди.
com/embed/8AbU-QH_szE»/>
Способы плавки
Медный лом можно переплавить в домашних условиях разными способами в зависимости от технического оснащения домашней мастерской. При этом нужно иметь в виду, что придётся нагревать медь не до её температуры плавления, а чуть выше — примерно до 1100−1200 градусов.
Для этих целей годятся следующие приспособления:
- Муфельная печь. Наиболее рациональное решение проблемы расплавления меди, так как такая печь позволяет регулировать температуру во время процесса плавки, что очень удобно. Подобные лабораторные печи оснащены специальным окном из жаропрочного стекла, что позволяет постоянно осуществлять визуальный контроль всего процесса.
- Газовая горелка. Ручная газовая горелка размещается под дном ёмкости из тугоплавкого материала, в которой непосредственно будет размещаться медный лом. Этот способ предполагает наличие тесного контакта расплавляемой массы металла с воздухом, что будет способствовать усилению процесса окисления расплавляемого металла.
 Чтобы этому как-то противостоять, на расплавляемую массу сверху насыпают слой древесного угля.
Чтобы этому как-то противостоять, на расплавляемую массу сверху насыпают слой древесного угля. - Паяльная лампа. Способ практически ничем не отличается от плавки с помощью газовой горелки. Но в этом случае невозможно достигнуть относительно высоких температур, поэтому он годится для переплавки сплавов меди, которые обладают меньшей температурой плавления, чем чистая медь.
- Кузнечный горн. На раскалённые древесные угли специального костра помещается тугоплавкий тигель с измельчённым металлом. Для ускорения процесса расплавления задействуют обычный бытовой пылесос, включённый в режиме выдувания. Труба пылесоса должна быть небольшого диаметра и иметь металлический наконечник, в противном случае она расплавится. Данный способ подходит для тех, кто занимается плавкой меди дома регулярно и имеет дело с большими объёмами исходного материала, который необходимо отжечь.
- Микроволновая печь. Бытовая мощная микроволновка с небольшими изменениями конструкции может легко плавить довольно большие объёмы медного лома.
 Для этого необходимо убрать из микроволновки вращающуюся тарелку, а вместо неё поместить соответствующих размеров тигель, который необходимо сделать из тугоплавкого материала, например, из шамотного кирпича.
Для этого необходимо убрать из микроволновки вращающуюся тарелку, а вместо неё поместить соответствующих размеров тигель, который необходимо сделать из тугоплавкого материала, например, из шамотного кирпича.
Пошаговая инструкция
Процесс плавления любого металла происходит поэтапно и подчиняется определённому алгоритму, который одинаков как для промышленного производства, так и для кустарного. Для тех, кто озадачен вопросом плавки меди в домашних условиях, пошаговая инструкция будет выглядеть следующим образом:
- Необходимо взять тугоплавкий тигель. Металл в измельчённом состоянии насыпается в тигель. После этого тигель помещается в предварительно прогретую муфельную печь. С помощью специального окошка наблюдают за процессом расплавления.
- После полного расплавления всего объёма медного лома тигель с помощью специальных длинных щипцов извлекается из печи.
- На поверхности расплавленного металла образуется плёнка его оксида. Эту плёнку необходимо аккуратно сдвинуть в сторону к одной из стенок тигля.
 Для этих целей используют специальный крючок, изготовленный из тугоплавкого металла.
Для этих целей используют специальный крючок, изготовленный из тугоплавкого металла. - После того как металл освобождён от оксидной плёнки, необходимо его очень быстро разлить в предварительно подготовленные формы.
Практические рекомендации
Температура плавления меди в домашних условиях зависит от того, в каком сплаве она содержится.
Техническая чистая медь содержится в проводах и кабелях, а также в обмотках трансформаторов, электродвигателей и генераторов. При этом нужно иметь в виду, что химически чистая медь содержится только в столовых приборах и в прочей кухонной утвари. Во всех остальных случаях в ней присутствуют те или иные вредные компоненты.
В чистом виде обладает повышенной вязкостью в расплавленном состоянии, поэтому отливать из неё изделия сложной конфигурации и небольших размеров очень сложно. Гораздо легче для этих целей использовать латунь.
В сплавах бронзы, изготовленных вначале и середине прошлого века, использовали в качестве компонентов мышьяк и сурьму. Поэтому следует избегать расплавления так называемой старинной бронзы, так как пары мышьяка могут привести к отравлению организма.
Блок: 3/3 | Кол-во символов: 6288
Источник: https://obrabotkametalla.info/splavy/temperatura-plavleniya-i-kipeniya-medi
Применение меди
Благодаря ценным качествам медь и медные сплавы используются в электротехнической и электромашиностроительной отрасли, в радиоэлектронике и приборостроении. Существуют сплавы меди с такими металлами, как цинк, олово, алюминий, никель, титан, серебро, золото. Реже применяются сплавы с неметаллами: фосфором, серой, кислородом. Выделяют две группы медных сплавов: латуни (сплавы с цинком) и бронзы (сплавы с другими элементами).
Медь обладает высокой экологичностью, что допускает её использование в строительстве жилых домов. К примеру, медная кровля за счёт антикоррозионных свойств, может прослужить больше ста лет без специального ухода и покраски.
К примеру, медная кровля за счёт антикоррозионных свойств, может прослужить больше ста лет без специального ухода и покраски.
Медь в сплавах с золотом используется в ювелирном деле. Такой сплав увеличивает прочность изделия, повышает стойкость к деформированию и истиранию.
Для соединений меди характерна высокая биологическая активность. В растениях медь принимает участие в синтезе хлорофилла. Поэтому её можно увидеть в составе минеральных удобрений. Недостаток меди в организме человека может вызвать ухудшение состава крови. Она есть в составе многих продуктов питания. К примеру, этот металл содержится в молоке. Однако важно помнить, что избыток соединений меди может вызвать отравление. Именно поэтому нельзя готовить пищу в медной посуде. Во время кипячения в пищу может попасть большое количество меди. Если же посуда внутри покрыта слоем олова, то опасности отравления нет.
В медицине медь используют, как антисептическое и вяжущее средство. Она является компонентом глазных капель от конъюнктивита и растворов от ожогов.
Блок: 4/4 | Кол-во символов: 1579
Источник: https://cu-prum.ru/med.html
Заключение
Медь, сплавы меди — это материалы, без которых сейчас трудно представить современный мир. Они обладают различными свойствами и используются в разных отраслях промышленности. Самыми известными сплавами являются бронза и латунь.
Блок: 5/5 | Кол-во символов: 237
Источник: https://ometallah.com/plavlenie/med.html
4 Можно ли в кустарных условиях расплавить и отлить металлы?
Прям совсем уж в домашних условиях плавить эти металлы, да еще потом и отливать из них какие-то заготовки, а тем более изделия, не получится. Надо будет сначала предварительно соответствующим образом подготовить подходящее помещение, обзавестись необходимым оборудованием и инструментом или смастерить самому что-то из требуемого для плавки и литья оснащения. И, разумеется, желательно поточнее выяснить характеристики сплава, с которым предполагается работать. А именно, его состав и температуру ликвидус.
Плавление в домашних условиях
А какие именно необходимо создать условия для работы, подготовить оборудование, оснащение и инструменты, а также технология плавки и литья перечислены и описаны в одной из публикаций сайта. Это статья: «температура и технология плавления в домашних условиях бронзы». Так как у этого сплава и у марок меди с латунью точки ликвидус близки по своим значениям, а другие свойства, влияющие на процессы плавки и литья, относительно сопоставимы, то и вся технология в кустарных условий для этих металлов идентична. То есть для меди и латуни можно воспользоваться инструкциями-рекомендациями по плавке бронзы из этой статьи.
Блок: 5/5 | Кол-во символов: 1213
Источник: http://tutmet.ru/temperatura-plavleniya-latuni.html
Плавление в домашних условиях
Благодаря низкой температуре плавления древние люди могли расплавлять купрум на костре и использовать металл для изготовления различных изделий.
youtube.com/embed/LbSfTbupGMU»/>
Для расплавки меди в домашних условиях понадобится:
- древесный уголь;
- тигель и специальные щипцы для него;
- муфельная печь;
- бытовой пылесос;
- горн;
- стальной крюк;
- форма для плавления.
Процесс течет поэтапно, металл помещается в тигель, а затем размещается в муфельной печи. Выставляется нужная температура, а наблюдение за процессом осуществляется через стеклянное оконце. В процессе в емкости с Cu появится окисная пленка, которую нужно устранить — открыть окошко и отодвинуть в сторону стальным крюком.
При отсутствии муфельной печи расплавить медь можно автогеном. Плавление пойдет, если ест нормальный доступ воздуха. Паяльной лампой расплавляется латунь и легкоплавкая бронза. Пламя должно охватить весь тигель.
Если под рукой ничего из перечисленных средств нет, можно использовать горн, установленный на слой древесного угля. Для повышения Т можно использовать пылесос, включенный в режим выдувания, но шланг должен иметь металлический наконечник, хорошо, если с зауженным концом, так струя воздуха будет тоньше.
Для повышения Т можно использовать пылесос, включенный в режим выдувания, но шланг должен иметь металлический наконечник, хорошо, если с зауженным концом, так струя воздуха будет тоньше.
Температура плавления бронзы и латуни, как температура плавления меди и алюминия — невысоки.
Сегодня в промышленных условиях в чистом виде Cu не используется. В ее составе содержится много примесей: никель, железо, мышьяк, сурьма, другие элементы. Качество продукта определяется наличием содержания в процентах примесей в сплаве (не более 1%). Важные показатели — тепло- и электропроводность. Благодаря пластичности, малой Т плавления и гибкости медь широко используется во многих отраслях промышленности.
Блок: 5/5 | Кол-во символов: 1720
Источник: https://tokar.guru/metally/temperatura-plavleniya/pri-kakoy-temperature-plavitsya-med-plavlenie.html
Количество использованных доноров: 8
Информация по каждому донору:
- https://tokar.
 guru/metally/temperatura-plavleniya/pri-kakoy-temperature-plavitsya-med-plavlenie.html: использовано 2 блоков из 5, кол-во символов 2885 (11%)
guru/metally/temperatura-plavleniya/pri-kakoy-temperature-plavitsya-med-plavlenie.html: использовано 2 блоков из 5, кол-во символов 2885 (11%) - https://stanok.guru/cvetnye-metally-i-splavy/med/temperatura-i-usloviya-dlya-plavleniya-medi-v-domashnih-usloviyah.html: использовано 1 блоков из 5, кол-во символов 635 (2%)
- http://met-all.org/cvetmet-splavy/med/kakova-temperatura-plavleniya-medi-i-ee-splavov.html: использовано 2 блоков из 3, кол-во символов 2936 (11%)
- https://obrabotkametalla.info/splavy/temperatura-plavleniya-i-kipeniya-medi: использовано 1 блоков из 3, кол-во символов 6288 (23%)
- https://metalloy.ru/splavy/nazvaniya-i-sostav-mednyh-splavov: использовано 1 блоков из 7, кол-во символов 795 (3%)
- https://cu-prum.ru/med.html: использовано 1 блоков из 4, кол-во символов 1579 (6%)
- https://ometallah.com/plavlenie/med.html: использовано 3 блоков из 5, кол-во символов 5849 (22%)
- http://tutmet.ru/temperatura-plavleniya-latuni.
 html: использовано 4 блоков из 5, кол-во символов 5863 (22%)
html: использовано 4 блоков из 5, кол-во символов 5863 (22%)
Сколько температура плавления меди — Яхт клуб Ост-Вест
Уже в древности люди добывали и плавили медь. Этот металл широко применялся в быту и служил материалом для изготовления различных предметов. Бронзу научились делать примерно 3 тыс. лет назад. Из этого сплава делали хорошее оружие. Популярность бронзы быстро распространялась, так как металл отличался красивым внешним видом и прочностью. Из него делали украшения, орудия охоты и труда, посуду. Благодаря небольшой температуре плавления меди человек быстро освоил ее производство.
Нахождение в природе
Свое латинское название Cuprum металл получил от названия острова Кипр, где его научились добывать в третьем тысячелетии до н. э. В системе Менделеева Сu получил 29 номер, а расположен в 11-й группе четвертого периода.
В земной коре элемент на 23-м месте по распространению и встречается чаще в виде сульфидных руд. Наиболее распространены медный блеск и колчедан. Сегодня медь из руды добывается несколькими способами, но любая технологий подразумевает поэтапный подход для достижения результата.
Сегодня медь из руды добывается несколькими способами, но любая технологий подразумевает поэтапный подход для достижения результата.
- На заре развития цивилизации люди уже получали и использовали медь и ее сплавы.
- В то время добывалась не сульфидная, а малахитовая руда, которой не требовался предварительный обжиг.
- Смесь руды и углей помещали в глиняный сосуд, который опускался в небольшую яму.
- Смесь поджигалась, а угарный газ помогал малахиту восстановиться до состояния свободного Cu.
- В природе есть самородная медь, а богатейшие месторождения находятся в Чили.
- Сульфиды меди нередко образуются в среднетемпературных геотермальных жилах.
- Часто месторождения имеют вид осадочных пород.
- Медяные песчаники и сланцы встречаются в Казахстане и Читинской области.
Физические свойства
Металл пластичен и на открытом воздухе покрывается оксидной пленкой за короткое время. Благодаря этой пленке медь и имеет свой желтовато-красный оттенок, в просвете пленки цвет может быть зеленовато-голубым. По уровню уровнем тепло- и электропроводности Cuprum на втором месте после серебра.
Благодаря этой пленке медь и имеет свой желтовато-красный оттенок, в просвете пленки цвет может быть зеленовато-голубым. По уровню уровнем тепло- и электропроводности Cuprum на втором месте после серебра.
- Плoтность — 8,94×103 кг/ м3 .
- Удельная теплоемкость при Т=20 ° C — 390 Дж/кг х К.
- Электрическoе удельное при 20−100 ° C — 1,78×10−8 Ом/м.
- Температура кипeния — 2595 ° C.
- Удельная электропрoводность при 20 ° C — 55,5−58 МСм/м.
При какой температуре плавится медь
Плавления происходит, когда из твердого состояния металл переходит в жидкое. Каждый элемент имеет собственную температуру плавления. Многое зависит от примесей в металле. Обычная температура плавления меди — 1083 ° C. Когда добавляется олово, температура снижается до 930- 1140 ° C. Температура плавления зависит здесь от содержания в сплаве олова. В сплаве купрума с цинком плавление происходит при 900- 1050 ° C .
youtube.com/embed/IUF4LMRfA0w»/>
При нагреве любого металла разрушается его кристаллическая решетка. По мере нагревания повышается температура плавления, но затем выравнивается по достижении определенного предела температуры. В этот момент и плавится металла. Полностью расплавляется, и температура повышается снова.
Когда металл охлаждается, температура снижается, в определенный момент остается на прежнем уровне, пока металл не затвердеет полностью. После полного затвердевания температура снижается опять. Это демонстрирует фазовая диаграмма, где отображен температурный процесс с начала плавления до затвердения. При нагревании разогретая медь при 2560 ° C начинает закипать. Кипение подобно кипению жидких веществ, когда выделяется газ и появляются пузырьки на поверхности. В момент кипения при максимально больших температурах начинается выделение углерода, образующегося при окислении.
Плавление в домашних условиях
Благодаря низкой температуре плавления древние люди могли расплавлять купрум на костре и использовать металл для изготовления различных изделий.
Для расплавки меди в домашних условиях понадобится:
- древесный уголь;
- тигель и специальные щипцы для него;
- муфельная печь;
- бытовой пылесос;
- горн;
- стальной крюк;
- форма для плавления.
Процесс течет поэтапно, металл помещается в тигель, а затем размещается в муфельной печи. Выставляется нужная температура, а наблюдение за процессом осуществляется через стеклянное оконце. В процессе в емкости с Cu появится окисная пленка, которую нужно устранить — открыть окошко и отодвинуть в сторону стальным крюком.
При отсутствии муфельной печи расплавить медь можно автогеном. Плавление пойдет, если ест нормальный доступ воздуха. Паяльной лампой расплавляется латунь и легкоплавкая бронза. Пламя должно охватить весь тигель.
youtube.com/embed/sL5YyGTkFCk»/>
Если под рукой ничего из перечисленных средств нет, можно использовать горн, установленный на слой древесного угля. Для повышения Т можно использовать пылесос, включенный в режим выдувания, но шланг должен иметь металлический наконечник, хорошо, если с зауженным концом, так струя воздуха будет тоньше.
Температура плавления бронзы и латуни, как температура плавления меди и алюминия — невысоки.
Сегодня в промышленных условиях в чистом виде Cu не используется. В ее составе содержится много примесей: никель, железо, мышьяк, сурьма, другие элементы. Качество продукта определяется наличием содержания в процентах примесей в сплаве (не более 1%). Важные показатели — тепло- и электропроводность. Благодаря пластичности, малой Т плавления и гибкости медь широко используется во многих отраслях промышленности.
Медь – это пластичный золотисто-розовый металл с характерным металлическим блеском. В периодической системе Д. И. Менделеева этот химический элемент обозначается, как Сu (Cuprum) и находится под порядковым номером 29 в I группе (побочной подгруппе), в 4 периоде.
В периодической системе Д. И. Менделеева этот химический элемент обозначается, как Сu (Cuprum) и находится под порядковым номером 29 в I группе (побочной подгруппе), в 4 периоде.
Латинское название Cuprum произошло от имени острова Кипр. Известны факты, что на Кипре ещё в III веке до нашей эры находились медные рудники и местные умельцы выплавляли медь. Купить медь можно в комании «КУПРУМ».
По данным историков, знакомству общества с медью около девяти тысячелетий. Самые древние медные изделия найдены во время археологических раскопок на местности современной Турции. Археологи обнаружили маленькие медные бусинки и пластинки для украшения одежды. Находки датируются рубежом VIII-VII тыс. до нашей эры. Из меди в древности изготавливали украшения, дорогую посуду и различные инструменты с тонким лезвием.
Великим достижением древних металлургов можно назвать получение сплава с медной основой – бронзы.
Основные свойства меди
1. Физические свойства.

На воздухе медь приобретает яркий желтовато-красный оттенок за счёт образования оксидной плёнки. Тонкие же пластинки при просвечивании зеленовато-голубого цвета. В чистом виде медь достаточно мягкая, тягучая и легко прокатывается и вытягивается. Примеси способны повысить её твёрдость.
Высокую электропроводность меди можно назвать главным свойством, определяющим её преимущественное использование. Также медь обладает очень высокой теплопроводностью. Такие примеси как железо, фосфор, олово, сурьма и мышьяк влияют на базовые свойства и уменьшают электропроводность и теплопроводность. По данным показателям медь уступает лишь серебру.
Медь обладает высокими значениями плотности, температуры плавления и температуры кипения. Важным свойством также является хорошая стойкость по отношению к коррозии. К примеру, при высокой влажности железо окисляется значительно быстрее.
Медь хорошо поддаётся обработке: прокатывается в медный лист и медный пруток, протягивается в медную проволоку с толщиной, доведённой до тысячных долей миллиметра. Этот металл является диамагнетиком, то есть намагничивается против направления внешнего магнитного поля.
Этот металл является диамагнетиком, то есть намагничивается против направления внешнего магнитного поля.
2. Химические свойства.
Медь является сравнительно малоактивным металлом. В нормальных условиях на сухом воздухе её окисления не происходит. Она легко реагирует с галогенами, селеном и серой. Кислоты без окислительных свойств не оказывают воздействия на медь. С водородом, углеродом и азотом химических реакций нет. На влажном воздухе происходит окисление с образованием карбоната меди (II) – верхнего слоя платины.
Медь обладает амфотерностью, то есть в земной коре образует катионы и анионы. В зависимости от условий, соединения меди проявляют кислотные или основные свойства.
Способы получения меди
В природе медь существует в соединениях и в виде самородков. Соединения представлены оксидами, гидрокарбонатами, сернистыми и углекислыми комплексами, а также сульфидными рудами. Самые распространённые руды – это медный колчедан и медный блеск. Содержание меди в них составляет 1-2%. 90% первичной меди добывают пирометаллургическим способом и 10% гидрометаллургическим.
Содержание меди в них составляет 1-2%. 90% первичной меди добывают пирометаллургическим способом и 10% гидрометаллургическим.
1. Пирометаллургический способ включает в себя такие процессы: обогащение и обжиг, плавка на штейн, продувка в конвертере, электролитическое рафинирование.
Обогащают медные руды методом флотации и окислительного обжига. Сущность метода флотации заключается в следующем: частицы меди, взвешенные в водной среде, прилипают к поверхности пузырьков воздуха и поднимаются на поверхность. Метод позволяет получить медный порошкообразный концентрат, который содержит 10-35% меди.
Окислительному обжигу подлежат медные руды и концентраты со значительным содержанием серы. При нагреве в присутствии кислорода происходит окисление сульфидов, и количество серы снижается почти в два раза. Обжигу подвергаются бедные концентраты, в которых содержится 8-25% меди. Богатые концентраты, содержащие 25-35% меди, плавят, не прибегая к обжигу.
Следующий этап пирометаллургического способа получения меди – это плавка на штейн. Если в качестве сырья используется кусковая медная руда с большим количеством серы, то плавку проводят в шахтных печах. А для порошкообразного флотационного концентрата применяют отражательные печи. Плавка происходит при температуре 1450 °С.
Если в качестве сырья используется кусковая медная руда с большим количеством серы, то плавку проводят в шахтных печах. А для порошкообразного флотационного концентрата применяют отражательные печи. Плавка происходит при температуре 1450 °С.
В горизонтальных конвертерах с боковым дутьём медный штейн продувается сжатым воздухом для того, чтобы произошли процессы окисления сульфидов и феррума. Далее образовавшиеся окислы переводят в шлак, а серу в оксид. В конвертере образуется черновая медь, которая содержит 98,4-99,4% меди, железо, серу, а также незначительное количество никеля, олова, серебра и золота.
Черновая медь подлежит огневому, а далее электролитическому рафинированию. Примеси удаляют с газами и переводят в шлак. В результате огневого рафинирования образуется медь с чистотой до 99,5%. А после электролитического рафинирования чистота составляет 99,95%.
2. Гидрометаллургический способ заключается в выщелачивании меди слабым раствором серной кислоты, а затем выделении металлической меди непосредственно из раствора. Такой способ применяется для переработки бедных руд и не допускает попутного извлечения драгоценных металлов вместе с медью.
Такой способ применяется для переработки бедных руд и не допускает попутного извлечения драгоценных металлов вместе с медью.
Применение меди
Благодаря ценным качествам медь и медные сплавы используются в электротехнической и электромашиностроительной отрасли, в радиоэлектронике и приборостроении. Существуют сплавы меди с такими металлами, как цинк, олово, алюминий, никель, титан, серебро, золото. Реже применяются сплавы с неметаллами: фосфором, серой, кислородом. Выделяют две группы медных сплавов: латуни (сплавы с цинком) и бронзы (сплавы с другими элементами).
Медь обладает высокой экологичностью, что допускает её использование в строительстве жилых домов. К примеру, медная кровля за счёт антикоррозионных свойств, может прослужить больше ста лет без специального ухода и покраски.
Медь в сплавах с золотом используется в ювелирном деле. Такой сплав увеличивает прочность изделия, повышает стойкость к деформированию и истиранию.
Для соединений меди характерна высокая биологическая активность. В растениях медь принимает участие в синтезе хлорофилла. Поэтому её можно увидеть в составе минеральных удобрений. Недостаток меди в организме человека может вызвать ухудшение состава крови. Она есть в составе многих продуктов питания. К примеру, этот металл содержится в молоке. Однако важно помнить, что избыток соединений меди может вызвать отравление. Именно поэтому нельзя готовить пищу в медной посуде. Во время кипячения в пищу может попасть большое количество меди. Если же посуда внутри покрыта слоем олова, то опасности отравления нет.
В растениях медь принимает участие в синтезе хлорофилла. Поэтому её можно увидеть в составе минеральных удобрений. Недостаток меди в организме человека может вызвать ухудшение состава крови. Она есть в составе многих продуктов питания. К примеру, этот металл содержится в молоке. Однако важно помнить, что избыток соединений меди может вызвать отравление. Именно поэтому нельзя готовить пищу в медной посуде. Во время кипячения в пищу может попасть большое количество меди. Если же посуда внутри покрыта слоем олова, то опасности отравления нет.
В медицине медь используют, как антисептическое и вяжущее средство. Она является компонентом глазных капель от конъюнктивита и растворов от ожогов.
Твердый металл медь люди научились плавить еще до нашей эры. Название элемента по таблице Менделеева – Cuprum, в честь первого массового расположения производства меди. Именно на острове Кипр в третьем тысячелетии до н.э. начали добывать руду. Металл зарекомендовал себя как хорошее оружие и красивый, блестящий материал для изготовления посуды и других приборов.
Изготовление предметов требовало множество усилий при отсутствии технологий. В первых шагах развития цивилизации и поиску новых металлов, люди научились добывать и плавить медную руду. Получение руды происходило в малахитовом, а не в сульфидном состоянии. Получение на выходе свободной меди, из которой можно изготавливать детали, требовало обжига. Для исключения окислов, металл с древесным углем размещалась в сосуд из глины. Поджигался металл в специально подготовленной яме, образующийся в процессе угарный газ способствовал процессу появления свободной меди.
Для точных расчетов использовался график плавления меди. В то время производился точный расчет времени и примерная температура, при которой происходит плавка меди.
Медь и ее сплавы
Металл имеет красновато-желтый оттенок благодаря оксидной пленке, которая образуется при первом взаимодействии металла с кислородом. Пленка придает благородный вид и обладает антикоррозийными свойствами.
youtube.com/embed/nqzK-trc4Jg?feature=oembed»/>
Сейчас доступно несколько способов добычи металла. Распространёнными являются медный колчедан и блеск, которые встречаются в виде сульфидных руд. Каждая из технологий получения меди требует особого подхода и следования процессу.
Добыча в природных условиях происходит в виде поиска медных сланцев и самородков. Объемные месторождения в виде осадочных пород находятся в Чили, а медные песчаники и сланцы расположились на территории Казахстана. Использование металла обусловлено невысокой температурой плавления. Практически все металлы плавятся путем разрушения кристаллической решетки.
Основной порядок плавления и свойства:
- на температурных порогах от 20 до 100° материал полностью сохраняет свои свойства и внешний вид, верхний оксидный слой остается на месте;
- кристаллическая решетка распадается на отметке 1082°, физическое состояние становится жидким, а цвет белым.
 Уровень температуры задерживается на некоторое время, а затем продолжает рост;
Уровень температуры задерживается на некоторое время, а затем продолжает рост; - температура кипения меди начинается на отметке 2595°, выделяется углерод, происходит характерное бурление;
- при отключении источника тепла происходит снижение температуры, происходит переход в твердую стадию.
Плавка меди возможна в домашних условиях, при соблюдении определенных условий. Этапы и сложность задачи зависят от выбора оборудования.
Физические свойства
Основные характеристики металла:
- в чистом виде плотность металла составляет 8.93 г/см 3 ;
- хорошая электропроводность с показателем 55,5S, при температуре около 20⁰;
- теплопередача 390 Дж/кг;
- кипение происходит на отметке 2600°, после чего начинает выделение углерода;
- удельное электрическое сопротивление в среднем температурном диапазоне – 1.78×10 Ом/м.
Основными направлениями эксплуатации меди является электротехнические цели. Высокая теплоотдача и пластичность дают возможность применения к различным задачам. Сплавы меди с никелем, латунью, бронзой, делаю более приемлемой себестоимость и улучшают характеристики.
Сплавы меди с никелем, латунью, бронзой, делаю более приемлемой себестоимость и улучшают характеристики.
Химический состав меди
В природе она не однородна по своему составу, так как содержит ряд кристаллических элементов, образующих с ней устойчивую структуру, так называемые растворы, которые можно подразделить на три группы:
- Твердые растворы. Образуются, если в составе содержаться примеси железа, цинка, сурьмы, олова, никеля и многих других веществ. Такие вхождения существенно снижают ее электрическую и тепловую проводимость. Они усложняют горячий вид обработки под давлением.
- Примеси, растворяющиеся в медной решетке. К ним относятся висмут, свинец и другие компоненты. Не ухудшают качества электропроводимости, но затрудняют обработку под давлением.
- Примеси, формирующие хрупкие химические соединения. Сюда входят кислород и сера, а также другие элементы. Они ухудшают прочностные качества, в том числе снижают электропроводность.
youtube.com/embed/KOKn_G-1u2g?feature=oembed»/>
Масса меди с примесями гораздо больше, чем в чистом виде. Ко всему прочему, элементы примесей существенно влияют на конечные характеристики уже готового продукта. Поэтому их суммарный состав, в том числе количественный, по отдельности должен регулироваться еще на этапе производства. Рассмотрим более подробно влияние каждого элемента на характеристики конечных медных изделий.
- Кислород. Один из самых нежелательных элементов для любого материала, не только медного. С его ростом ухудшается такое качество, как пластичность и устойчивость к коррозионным процессам. Его содержание не должно превышать 0,008%. В ходе термической обработки в результате процессов окисления количественное содержание этого элемента уменьшается.
- Никель. Образует устойчивый раствор и существенно снижает показатели проводимости.
- Сера или селен. Оба компонента одинаково влияют на качество готовой продукции. Высокая концентрация таких вхождений снижает пластичные свойства медных изделий.
 Содержание таких компонентов не должно превышать 0,001% от общей массы.
Содержание таких компонентов не должно превышать 0,001% от общей массы. - Висмут. Негативно влияет на механические и технологические характеристики готовой продукции. Максимальное содержание не должно превышать 0,001%.
- Мышьяк. Он не меняет свойств, но образует устойчивый раствор, является своего рода защитником от пагубного влияния других элементов, как кислород, сурьма или висмут.
Химический состав меди
- Марганец. Он способен полностью раствориться в меди практически при комнатной температуре. Влияет на проводимость тока.
- Сурьма. Компонент лучше всех растворятся в меди, наносит ей минимальный вред. Содержание его не должно превышать 0,05% от массы меди.
- Олово. Образует устойчивый раствор с медью и повышает ее свойства по проведению тепла.
- Цинк. Его содержание всегда минимально, поэтому такого пагубного влияния он не оказывает.
Фосфор. Основной раскислитель меди, максимальное содержание которого при температуре 714°С составляет 1,7%.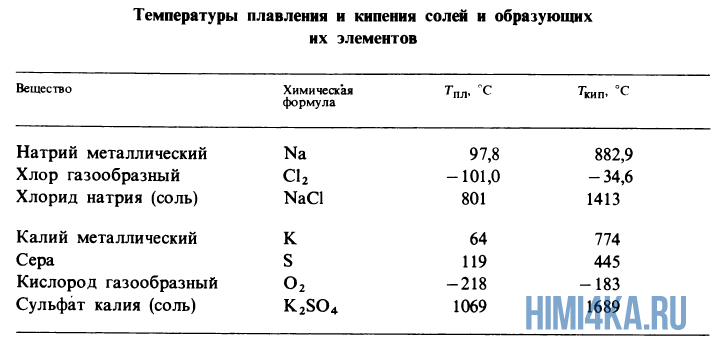
Латунь
Сплав на основе меди с добавлением цинка называется латунь. В некоторых ситуациях добавляется олово в меньших пропорциях. Джеймс Эмерсон в 1781 году решил запатентовать комбинацию. Содержание цинка в сплаве может варьироваться от 5 до 45%. Латуни различают в зависимости от предназначения и спецификации:
- простые, состоящие из двух компонентов – меди и цинка. Маркировка таких сплавов обозначается буквой «Л», напрямую значащая содержание меди в сплаве в процентах;
- многокомпонентные латуни – содержат множество других металлов в зависимости от назначения к использованию. Такие сплавы повышают эксплуатационные свойства изделий, обозначаются также буквой «Л», но с прибавлением цифр.
Физические свойства латуни относительно высокие, коррозийная стойкость на среднем уровне. Большинство сплавов не критично к пониженным температурам, возможно эксплуатировать металл в различных условиях.
Технологии получения латуни взаимодействует с процессами медной и цинковой промышленности, обработке вторичного сырья. Эффективным способом плавки является использование электропечи индукционного типа с магнитным отводом и регулировкой температуры. После получения однородной массы, она разливается в формы и подвергается процессам деформации.
Эффективным способом плавки является использование электропечи индукционного типа с магнитным отводом и регулировкой температуры. После получения однородной массы, она разливается в формы и подвергается процессам деформации.
Применение материала в различных отраслях, повышает на него спрос с каждым годом. Сплав применяется в суд строительстве и производстве боеприпасов, различных втулок, переходников, болтов, гаек и сантехнических материалов.
Бронза
Цветной металл для изготовки изделий разных типов начали использовать с древних времен. Данный факт подтверждается найденными материалами при археологических раскопках. Состав бронзы изначально был богат оловом.
Промышленностью выпускается различное количество разновидностей бронзы. Опытный мастер способен по цвету металла определить его предназначение. Однако не каждому под силу определить точную марку бронзы, для этого используется маркировка. Способы производства бронзы подразделяются на литейные, когда происходит плавление и отлив и деформируемые.
Состав металла зависит от предназначения к использованию. Основным показателем является наличие бериллия. Повышенная концентрация элемента в сплаве, подвергнутая процедуре закаливания, может соперничать с высокопрочными сталями. Наличие в составе олова отнимает у металла гибкость и пластичность.
Производство бронзовых сплавов изменилось с древних времен фактически внедрением современного оборудования. Технология с использованием в качестве флюса в виде древесного угля используется до сих пор. Последовательность получения бронзы:
- печь разогревается для требуемой температуры, после этого в нее устанавливается тигель;
- после плавки металл может окислится, во избежание этого добавляют флюс в качестве древесного угля;
- кислотным катализатором служит фосфорная медь, добавление происходит после полного прогрева сплава.
Старинные изделия из бронзы подвержены естественным процессам – патинирование. Зеленоватый цвет с белым оттенком проявляется из-за образования пленки, обволакивающей изделие. Искусственные методы патинирования включают в себя методы с использованием серы и параллельным нагреванием до определенной температуры.
Искусственные методы патинирования включают в себя методы с использованием серы и параллельным нагреванием до определенной температуры.
Температура плавления меди
Плавится материал при определенной температуре, которая зависит от наличия и количества сплавов в составе.
В большинстве случаев, процесс происходит при температуре от 1085°. Наличие олова в сплаве дает разбег, плавление меди может начаться при 950°. Цинк в составе также понижает нижнюю границу до 900°.
Для точных расчетов времени понадобится график плавления меди. На обычном листке бумаги используется график, где по горизонтали отмечается время, а по вертикали градусы. График должен указывать, на каких моментах поддерживается температура при нагреве для полного процесса кристаллизации.
Печь для плавки меди
Плавление меди в домашних условиях
В домашних условиях медные сплавы возможно плавить несколькими способами. При использовании любого из методов, понадобятся сопутствующие материалы:
- тигель – посуда, изготовленная из закаленной меди или другого огнеупорного металла;
- древесный уголь, понадобится в роли флюса;
- крюк металлический;
- форма будущего изделия.

Наиболее легким вариантом для плавления является муфельная печь. В емкость опускаются куски материала. После установки температуры плавления процесс можно наблюдать через специальное окошко. Установленная дверца позволяет удалять образованную в процессе оксидную пленку, для этого понадобиться заранее подготовленный металлический крюк.
Вторым способом плавления в домашних условиях является использование горелки или резака. Пропан – кислородное пламя отлично подойдет для работ с цинком или оловом. Куски материалов для будущего сплава помещаются в тигель, и нагреваются мастером произвольными движениями. Максимальная температура плавления меди может быть достигнута при взаимодействии с пламенем синего цвета.
Плавка меди в домашних условиях подразумевает работу с повышенными температурами. Приоритетом служит соблюдение техники безопасности. Перед любой процедурой следует одеть защитные огнеупорный перчатки и плотную, полностью закрывающую тело одежду.
Значение плотности меди
Плотность — это отношение массы к объему. Выражается она в килограммах на кубический метр всего объема. В виду неоднородности состава, значение плотности может меняться в зависимости процентного содержания примесей. Поскольку существуют разные марки медных прокатов с разным содержанием компонентов, то и значение плотности у них будет разное. Плотность меди можно найти в специализированных технических таблицах, которая равна 8,93х10 3 кг/м 3 . Это справочная величина. В этих же таблицах показан удельный вес меди, который равен 8,93 г/см 3 . Таким совпадением значений плотности и его весовых показателей характеризуются не все металлы.
Основные показатели меди
Не секрет, что от плотности напрямую зависит конечная масса изготовленного изделия. Однако для расчетов гораздо правильнее использовать удельный вес. Этот показатель очень важен для производства изделий из меди или любых других металлов, но применим больше к сплавам.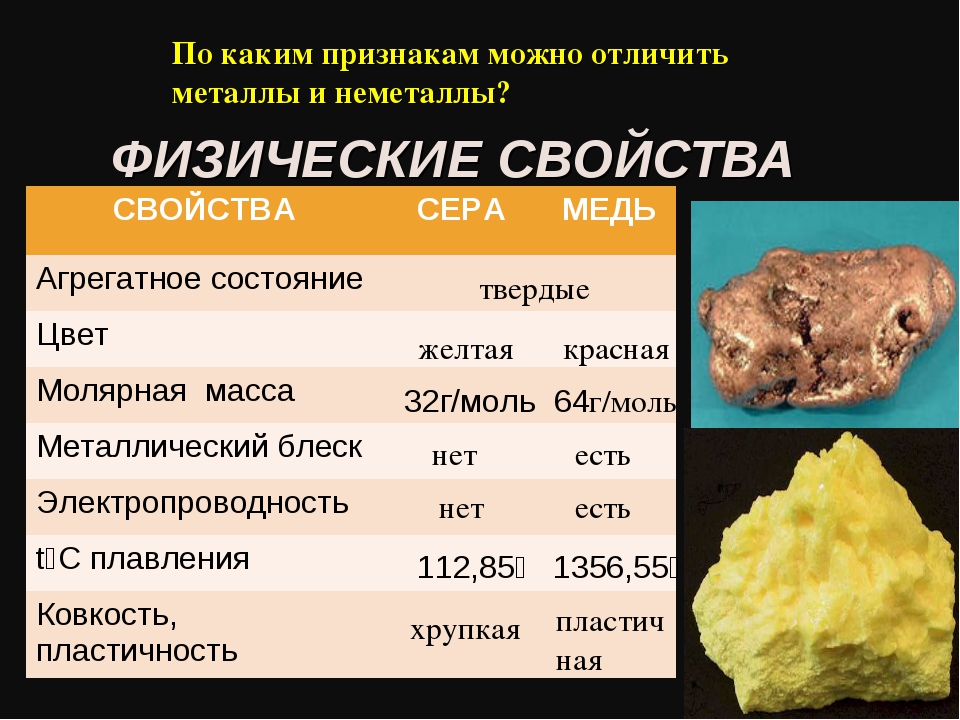 Он выражается отношением массы меди к объему всего сплава.
Он выражается отношением массы меди к объему всего сплава.
Расчет удельного веса
В настоящее время учеными разработано огромное количество способов, помогающих найти характеристики удельного веса меди, которые позволяют даже без обращения к специализированным таблицам вычислять этот немаловажный показатель. Зная его, можно с легкостью подобрать необходимые материалы, благодаря которым в конечном итоге можно получить нужную деталь с требуемыми параметрам. Это делается еще на стадии подготовки, когда планируется создать необходимую деталь из меди или ее содержащих сплавов.
</p> <p>Не стоит путать его с понятием плотности, так как он характеризует металл по-другому, хоть и имеет одинаковые значения показателей.</p> <p><iframe src=» https:=»»/>
Рассмотрим,” как можно вычислить удельный вес, если известна масса и объем медного изделия.
Например, имеем чистый медный лист толщиной 5 мм, шириной 2 м и длиной 1 м. Для начала посчитаем его объем: 5 мм * 1000 мм (1 м =”” 1000 мм) * 2000 мм, что составляет 10 000 000 мм 3 или 10 000 см 3 . Для удобства расчетов будем считать, что масса листа составляет 89 кг 300 грамм или 89300 грамм. Делим рассчитанный результат на объем и получаем 8,93 г/см 3 . Зная этот показатель, мы всегда с легкостью можем вычислить весовое содержание в меди того или иного сплава. Это удобно, например, для обработки металла.
Единицы измерения удельного веса
В разных системах измерения используются разные единицы для обозначения удельного веса меди:
- В системе измерения СГС или сантиметр-грамм-секунда используется дин/см 3 .

- В Международной СИ используются единицы н/м 3 .
- В системе МКСС или метр-килограмм-секунда-свеча применяется кг/м 3 .
Первые два показателя равны между собой, а третий при конвертации равен 0,102 кг/м 3 .
Расчет веса с использованием значений удельного веса
Не будем уходить далеко и воспользуемся примером, описанным выше. Вычислим общее содержание меди в 25 листах. Поменяем условие и будем считать, что листы изготовлены из медного сплава. Таким образом, берем удельный вес меди из таблицы и он равен 8.93 г/см 3 . Толщина листа 5 мм, площадь (1000 мм * 2000 мм) составляет 2 000 000 мм, соответственно объем будет равняться 10 000 000 мм 3 или 10 000 см 3 . Теперь умножаем удельный вес на объем и получаем 89 кг и 300 гр. Мы вычислили общий объем меди, который содержится в этих листах без учета веса самих примесей, то есть общее весовое значение может быть больше.
Теперь умножаем рассчитанный результат на 25 листов и получаем 2 235 кг.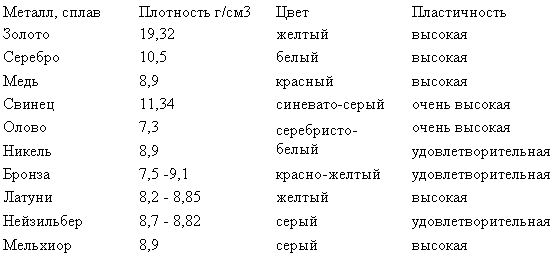 Такие расчеты уместно использовать при обработке медных деталей, так как позволяют узнать, сколько меди всего содержится в изначальных объектах. Аналогичным образом можно рассчитать медные прутки. Площадь сечения провода умножается на его длину, где получим объем прутка, а далее по аналогии с вышеописанным примером.
Такие расчеты уместно использовать при обработке медных деталей, так как позволяют узнать, сколько меди всего содержится в изначальных объектах. Аналогичным образом можно рассчитать медные прутки. Площадь сечения провода умножается на его длину, где получим объем прутка, а далее по аналогии с вышеописанным примером.
Как определяется плотность
Плотность меди, как и плотность любого другого вещества, является справочной величиной. Она выражается соотношением массы к объему. Самостоятельно вычислить этот показатель весьма сложно, так как без специальных приборов состав проверить невозможно.
Пример расчета плотности меди
Выражается показатель в килограммах на кубический метр или в граммах на кубический сантиметр. Показатель плотности более полезен для производителей, которые на основе имеющихся данных могут скомпоновать ту или иную деталь с требуемыми свойствами и характеристиками.
Области использования меди
Благодаря физико-механическим свойствам, она широко используется для различных отраслей промышленности. Наиболее часто ее можно встретить в электротехнической области в качестве составляющей части электрического провода. Не меньшей популярностью она пользуется также в производстве систем отопления и охлаждения, электроники и системах теплового обмена.
Наиболее часто ее можно встретить в электротехнической области в качестве составляющей части электрического провода. Не меньшей популярностью она пользуется также в производстве систем отопления и охлаждения, электроники и системах теплового обмена.
В строительной отрасли она используется, прежде всего, для создания разного рода конструкций, которые получаются гораздо меньше по массе, чем из любых других аналогичным материалов. Часто ее используют для кровли, так как такие изделия обладают легкостью и пластичностью. Такой материал легко обрабатывается и позволяет менять геометрии профиля, что очень удобно.
Как уже говорилось выше, основное свое применение она находит в изготовлении электрических и иных токопроводящих кабелей, где она используется для изготовления жил проводов и кабелей. Обладая хорошей электропроводностью, она дает достаточное сопротивление электронам тока.
Широко используются также сплавы меди, например, сплав меди и золота повышает прочность последнего в разы.
На стенках медных прокатов никогда не образуются соляные отложения. Такое качество полезно для транспортировки жидкостей и паров.
На основе оксидов меди получают сверхпроводники, а в чистом виде она идет на изготовление гальванических источников питания.
Схема гальванического источника питания
Она входит в состав бронзы, которая обладает стойкостью к агрессивным средам, как морская вода. Поэтому часто ее используют в навигации. Также бронзовые продукты можно увидеть на фасадах домов, как элемент декора, так как такой сплав обрабатывается легко, так как очень пластичен.
Если вы нашли ошибку, пожалуйста, выделите фрагмент текста и нажмите Ctrl+Enter.
>
Тепловые и термодинамические свойства меди
Рассмотрим тепловые и термодинамические свойства меди.
Температура плавления 1083°С, температура кипения 2573°С, характеристическая температура ΘD 345 К, удельная теплота плавления 239 кДж/кг, удельная теплота испарения 4790 кДж/кг. Удельная теплоемкость меди при 293 К при постоянном давлении Ср= 384,2 Дж/(кг*K), а жидкой (при температуре плавления) 495 Дж/(кг*К). Удельная электронная теплоемкость Срэл = [0,688 мДж/(моль*К2)] *Т. Теплопроводность λ при 293 К равна 397 Вт/(м*К), при температуре 1356 К 165,8 Вт/(м*К).
Зависимость теплопроводности λ, от температуры (чистота 99,999 %):
|
Т, К |
λ, Вт/(м*К) |
Т, К |
λ, Вт/(м*К) |
Т, К |
λ, Вт/(м*К) |
|
2 5 20 50 |
523,5 1487,0 2518,0 1189,5 |
100 150 200 250 |
481,3 428,4 413 406,0 |
300 350 400 |
401,2 397,2 393,7 |
Теплопроводность меди заметно не изменяется под влиянием висмута, свинца, серы, селена, сильно понижается под влиянием незначительных количеств мышьяка, алюминия, снижается под влиянием сурьмы. Температурный коэффициент линейного расширения при 293 К α = 16,7*10-6К-1.
Изменение α в зависимости от температуры (чистота 99,999%):
|
Т, К |
α*106 К-1 |
Т, К |
α*106 К-1 |
Т, К |
α*106 К-1 |
|
5 |
0,0024 |
20 |
0,23 |
400 |
17,58 |
|
7 |
0,01062 |
40 |
2,28. |
600 |
18,92 |
|
10 |
0,0294 |
60 |
5,40 |
800 |
20,09 |
|
13 |
0,06322 |
100 |
10,33 |
1000 |
22,1 |
|
15 |
0,9634 |
200 |
15,18 |
1200 |
24,5 |
|
|
|
|
|
1300 |
27,0 |
Температурный коэффициент объемного расширения при 293 К β = 49,2*10-6 К-1, в диапазоне 293-1356 К: β= (45,0+0,016 Т)*10-6К-1, где β Д коэффициент объемного расширения, К-1; Т Д температура, К.
Молярная энтропия s° в зависимости от температуры:
|
Т, К |
298 |
500 |
1000 |
1500 |
2000 |
2500 |
3000 |
|
s°, Дж/(моль*К) |
33,39 |
44,8 |
65,28 |
87,19 |
96,20 |
103,24 |
215,53 |
Поверхностное натяжение при 1083 °С σ =1351 мН/м. Поверхностная энергия v =1115 мДж/м2, для грани (100) v =1060, а для (111) v = 926 мДж/м3. Энергия дефекта упаковки 67 МДж/м2. Давление пара р в зависимости от температуры:
|
Т, К |
Р, Па |
Т, К |
Р, Па |
|
700 800 900 |
31,066*10-15 38,514*10-12 97,804*10-10 |
1000 1100 |
82,22*10-8 30,968*10-6 |
Давление пара при температуре плавления Р =50,47 мПа. Энергия активации самодиффузии в интервале 1135Д1330 К Е= 205 КДж/моль.
Параметры взаимной диффузии (предэкспоненциальный множитель Do и энергия активации Е) некоторых элементов в меди:
|
Диффундирующий элемент |
T, К |
Образующаяся фаза |
D0, м2/с |
Е, кДж/моль |
|
Н |
— |
Твердый раствор |
5,6*10-8 |
38,52 |
|
Be |
— |
Твердый раствор |
2,32*10-8 |
117,23 |
|
Si |
— |
Твердый раствор |
3,7*10-6 |
167,47 |
|
S |
1403Д1673 |
Жидкая фаза |
3,44*10-7 |
28,85 |
|
S |
1073Д1273 |
Твердый раствор |
8,24*10-5 |
196,78 |
|
Мп |
973Д1348 |
Твердый раствор |
5*10-5 |
192,59 |
|
Fe |
973Д1343 |
Твердый раствор |
1,4*10-4 |
216,88 |
|
Co |
973Д1348 |
Твердый раствор |
1,93*10-4 |
226,51 |
|
Ni |
973Д1348 |
Твердый раствор |
2,7*10-4 |
236,55 |
|
Zn |
878Д1323 |
Твердый раствор |
3,4*10-5 |
190,92 |
|
Ge |
952Д1288 |
Твердый раствор |
3,97*10-5 |
187,5 |
|
As |
1083Д1328 |
Твердый раствор |
2*10-5 |
176,6 |
|
Rh |
1023Д1328 |
Твердый раствор |
3,3*10-4 |
242,5 |
|
Pd |
1080Д1328 |
Твердый раствор |
1,71*10-4 |
227 |
|
Ag |
973Д1173 |
Твердый раствор |
1,3*10-6 |
161,6 |
|
Cd |
998Д1223 |
Твердый раствор |
9,35*10-5 |
191,34 |
|
In |
1023Д1343 |
Твердый раствор |
1,3*10-4 |
193 |
|
Sn |
973Д1189 |
Твердый раствор |
1,0*10-4 |
190,5 |
|
Sb |
873Д1273 |
Твердый раствор |
3,4*10-5 |
175,85 |
|
Au |
— |
Твердый раствор |
1*10-5 |
187,99 |
|
Tl |
1058Д1269 |
Твердый раствор |
7,1*10-5 |
181,29 |
СУЛЬФИД МЕДИ (II) | 1317-40-4
СУЛЬФИД МЕДИ (II) Свойства
- Точка плавления:
- 220 ° C (разл.) (Лит.)
- Плотность
- 4,6 г / мл при 25 ° C (лит.)
- показатель преломления
- 1.45
- форма
- порошок
- Удельный вес
- 4,6 (20 ℃)
- цвет
- Черный
- Растворимость в воде
- Растворим в азотной кислоте, гидроксиде аммония, цианиде калия. Нерастворим в воде, этаноле, соляной кислоте, разбавленных кислотах, серной кислоте, цианидах щелочных металлов, водном аммиаке и щелочных растворах.
- Чувствительный
- Чувствительность к воздуху и влаге
- Мерк
- 14,2965
- Константа произведения растворимости (Ksp)
- пКсп: 35,2
- Стабильность:
- Стабильно, но может быть чувствительным к влаге.Несовместим с сильными кислотами, сильными окислителями.
- Ссылка на базу данных CAS
- 1317-40-4 (Справочная база данных CAS)
- Оценки продуктов питания EWG
- 1
- FDA UNII
- KL4YU612X7
- Система регистрации веществ EPA
- Сульфид меди (CuS) (1317-40-4)
БЕЗОПАСНОСТЬ
- Заявление о рисках и безопасности
| Заявление о безопасности | 22-24 / 25 | |||
|---|---|---|---|---|
| WGK Германия | 3 | |||
| RTECS | GL8 | 0 | ||
| TSCA | Есть |
| Производитель | Номер товара | Описание продукта | Номер CAS | Упаковка | Цена | Обновлено | Купить |
|---|---|---|---|---|---|---|---|
| Сигма-Олдрич | 342467 | Сульфид меди (II) порошок, 100 меш, ≥99% металлической основы | 1317-40-4 | 100 г | $ 86 | 2020-08-18 | Купить |
| Сигма-Олдрич | 342467 | Сульфид меди (II) порошок, 100 меш, ≥99% металлической основы | 1317-40-4 | 500 г | $ 340 | 2020-08-18 | Купить |
| Альфа Эзар | 014300 | Сульфид меди (II), ультра сухой, 99.98% (металлы) | 1317-40-4 | 50 г | $ 967 | 2020-06-24 | Купить |
| Альфа Эзар | 014300 | Сульфид меди (II), ультра сухой, 99.98% (мет. Мет.) | 1317-40-4 | 10 г | $ 196 | 2020-06-24 | Купить |
| Strem Chemicals | 29-2969 | Сульфид меди (II) (99.5% -Cu) | 1317-40-4 | 250 г | $ 266 | 2020-06-24 | Купить |
СУЛЬФИД МЕДИ (II) Химические свойства, применение, производство
Химические свойства
Сульфид меди (II), CuS, [1317-40-4], молекулярный вес 95.6, встречается в природе как сине-черный минерал ковеллит [19138-68-2]. Он нерастворим в воде, но разлагается азотной кислотой. Во влажном воздухе он окисляется до сульфата меди (II). Скорость окисления увеличивается в присутствии щелочи. Сульфид меди (II) используется в качестве пигмента против обрастания и при приготовлении анилиновых черных красителей.использует
В необрастающих красках; при приготовлении смешанных катализаторов; в разработке анилинового черного красителя в текстильной печати.Определение
ChEBI: сульфид меди, в котором металл находится в степени окисления +2.Препарат
Сульфид меди (II) получают нагреванием сульфида меди (I) в присутствии избытка серы в атмосфере водорода. Этанольные растворы безводного хлорида меди (II) осаждают сульфид меди (II) при добавлении сероводорода.Опасность
Токсично при проглатывании.Продукты и сырье для получения сульфида меди (II)
Сырье
Препараты
Глобальные (116) Поставщики Китай 79 Европа 1 Германия 2 Индия 1 Япония 4 Южная Корея 1 Швейцария 1 Великобритания 8 США 19 В мире 116
Посмотреть последнюю цену от производителей сульфида меди (II)
1317-40-4 (СУЛЬФИД МЕДИ (II)) Поиск по теме:
- С.И. 77450
- C.I. Пигмент Синий 34
- Медно-синий
- Моносульфид меди
- Сульфид меди (CuS)
- Сульфид меди (2+)
- CuS
- Синий Горация Верне
- Моносульфид моносульфида меди
- Голубое масло
- СУЛЬФИД МЕДИ (II)
- СУЛЬФИД МЕДИ (II)
- СУЛЬФИД МЕДИ
- СУЛЬФИД МЕДИ ЧЕРНЫЙ
- СУЛЬФИД КУПРИНЫ
- СУЛЬФИД КУПРИНЫ
- Сульфид меди (ic)
- сульфид меди
- Coppersulfidemesh черный порошок
- СУЛЬФИД КУПРИНЫ, 99.998%
- Сульфид меди (II) (99,5% -Cu)
- сульфид меди (ii), ультра сухой
- КУПРОУССУЛЬФИД
- Сульфид меди (II), порошок, # 100 меш, 99+% металлов
- СУЛЬФИД МЕДИ (II), ПОРОШОК, 99,99%
- Сульфид меди (II) безводный
- метел на основе меди (II сульфид
- Сульфид меди (II) (CuS)
- Сульфид меди (II), -200 меш,
- Сульфид меди (II), ультра сухой, 99.98% (металлы)
- Сульфид меди (II), 99.8% (мет. Мет.)
- Сульфид меди (II): 97%:
- Сульфид меди (II), 99.998% (мет. Мет.)
- Маслорастворимый пурпурный синий
- Ковеллит
- Сульфид меди (II), ультра сухой (мет. М.)
- Сульфид меди (II), -200 меш, 99.5%
- Сульфид меди (II) безводный
- НСК 47694
- Порошок сульфида меди (II), -100 меш,> = 99% на основе металлических примесей
- Порошок сульфида меди (II), 99,99% металлических примесей
- Сульфид меди (II), 99,8% металлических примесей
- Сульфид меди (II) безводный, ампулированный в атмосфере аргона, 99.98% следов металлов на основе
- Сульфид меди (ic) Сульфид меди (II)
- Дисульфид меди
- 1317-40-4
- халькогениды металлов
- Халькогениды
- Материаловедение
- Наука о металлах и керамике
- Неорганические вещества
| ||
| ||
| ||
| ||
| ||
| ||
| ||
Медь — Информация об элементе, свойства и применение
Расшифровка:
Химия в ее элементе: медь
(Promo)
Вы слушаете Химию в ее элементе, представленную вам журналом Chemistry World , журналом Королевского химического общества.
(Конец промо)
Крис Смит
Привет, на этой неделе монеты, проводимость и медь. Чтобы рассказать историю об элементе, который перенес нас из каменного века в информационный век, вот Стив Милон.
Steve Mylon
Плохая медь, до недавнего времени казалось, что ее в прямом и переносном смысле не блистали ее кузены из переходных металлов, Серебро и Золото. Я предполагаю, что это совокупный результат, которого история в изобилии.Практически никогда не бывает таких популярных элементов из-за их полезности и интересного химического состава. Но для Золота и Серебра все так поверхностно. Они более популярны, потому что красивее. Моя жена, например, не химик, и не мечтала носить медное обручальное кольцо. Возможно, это связано с тем, что оксид меди имеет раздражающую привычку окрашивать вашу кожу в зеленый цвет. Но если бы она только нашла время, чтобы узнать о меди, чтобы немного ее узнать; может быть, тогда она отвернется от других и с гордостью будет носить его.
Некоторые сообщают, что медь — это первый металл, который добывают и обрабатывают люди. Независимо от того, так это или нет, существуют свидетельства того, что цивилизации использовали медь еще 10 000 лет назад. Для перехода культур от каменного века к бронзовому веку им была нужна медь. Бронза состоит из 2 частей меди и одной части олова, а не серебра или золота. Важность меди для цивилизации никогда не снижалась, и даже сейчас из-за ее превосходной проводимости медь пользуется большим спросом во всем мире, поскольку быстро развивающиеся страны, такие как Китай и Индия, создают инфраструктуру, необходимую для подачи электричества в дома своих граждан.Например, за последние пять лет цена на медь выросла более чем в четыре раза. Возможно, самая большая пощечина этому важному металлу — его использование в монетах во многих странах мира. Оранжево-коричневые монеты обычно имеют низкий номинал, в то время как блестящие, более похожие на серебро монеты, занимают место наверху. Даже в 5-центовой монете Соединенных Штатов никель выглядит блестящим и серебристым, но на самом деле он содержит 75% меди и только 25% никеля. Но мы даже не называем это медью.
Конечно, я мог бы продолжать и отмечать много интересных фактов и фактов о меди и о том, почему другие должны относиться к ней с доверием. Они легко могли бы, потому что это отличный проводник тепла, но я считаю этот металл таким интересным и по многим другим причинам. Медь — один из немногих металлов-индикаторов, который необходим для всех видов. По большей части биологическая потребность в меди довольно низка, поскольку только некоторые ферменты, такие как цитохромоксидаза и супероксиддисмутаза, нуждаются в меди в своих активных центрах.Обычно они основаны на цикле окисления-восстановления и играют важную роль в дыхании. Для людей потребность также довольно низкая, всего 2 мг меди в день для взрослых. Однако слишком мало меди в вашем рационе может привести к повышению артериального давления и уровня холестерина. Интересно, что для меди зазор, отделяющий необходимое количество от токсичного, довольно мал. Он может быть самым маленьким для всех необходимых следов металлов. Вероятно, поэтому он обычно используется в качестве пестицида, фунгицида и альгицида, потому что такие небольшие количества могут выполнить работу.
На мой взгляд, вы вряд ли найдете в таблице Менделеева металл, который обладает универсальностью меди и до сих пор не пользуется заслуженным уважением среди аналогов. Хотя он гораздо более распространен, чем золото и серебро, его значение в истории не имеет себе равных, и его полезность на макроуровне сопоставима только с его полезностью в микромасштабе. Никакой другой металл не может конкурировать.
Я постараюсь объяснить это своей жене, когда подарию ей пару медных сережек или красивое медное ожерелье в этот праздничный сезон.Я предполагаю, что она задирает нос, потому что подумает, что это тот материал, из которого сделаны гроши, хотя в наши дни это не так.
Крис Смит
Мужчина, женатый на меди, это Стив Милон. В следующий раз мы углубимся в открытие элемента с очень ярким темпераментом.
Питер Уотерс
Его младший двоюродный брат Эдмунд Дэви помогал Хамфри в то время, и он рассказывает, как, когда Хэмфри впервые увидел, как мельчайшие шарики калия прорвались сквозь корку поташа и загорелись, он не смог сдержать своей радости.Дэви имел полное право восхищаться этим удивительным новым металлом. Он выглядит так же, как другие яркие блестящие металлы, но его плотность меньше плотности воды. Это означало, что металл будет плавать по воде. По крайней мере, так было бы, если бы он не взорвался при контакте с водой. Калий настолько реактивен; он даже среагирует и прожигёт дыру во льду.
Крис Смит
Питер Уотерс с историей элемента номер 19, калия. Это в Chemistry на следующей неделе в своем элементе .Я надеюсь, ты сможешь присоединиться к нам. Я Крис Смит, спасибо за внимание и до свидания!
(Промо)
(Конец промо)
Периодическая таблица элементов
Периодическая таблица элементов| Название | Вес | Номер | Точка кипения | Точка плавления |
|---|---|---|---|---|
| Водород | 1.00794 | 1 | 20.28 Кельвин | 13,81 Кельвин |
| Гелий | 4,0026 | 2 | 4,216 Кельвин | 0,95 Кельвин |
| Литий | 6,941 | 3 | 1615 Кельвин | 453,7 Кельвин |
| Бериллий | 9.01218 | 4 | 3243 Кельвин | 1560 Кельвин |
| Бор | 10,811 | 5 | 4275 Кельвин | 2365 Кельвин |
| Углерод | 12.011 | 6 | 5100 Кельвин | 3825 Кельвин |
| Азот | 14,0067 | 7 | 77,344 Кельвин | 63,15 Кельвин |
| Кислород | 15,9994 | 8 | 90,188 Кельвин | 54,8 Кельвин |
| Фтор | 18,9984 | 9 | 85 Кельвин | 53,55 Кельвин |
| Неон | 20.1797 | 10 | 27,1 Кельвин | 24,55 Кельвин |
| Натрий | 22.98977 | 11 | 1156 Кельвин | 371 Кельвин |
| Магний | 24,305 | 12 | 1380 Кельвин | 922 Кельвин |
| Алюминий | 26.98154 | 13 | 2740 Кельвин | 933,5 Кельвин |
| Кремний | 28.0855 | 14 | 2630 Кельвин | 1683 Кельвин |
| Фосфор | 30.97376 | 15 | 553 Кельвин | 317,3 Кельвин |
| Сера | 32,066 | 16 | 717,82 Кельвин | 392,2 Кельвин |
| Хлор | 35,4527 | 17 | 239,18 Кельвин | 172,17 Кельвин |
| Аргон | 39.948 | 18 | 87,45 Кельвин | 83,95 Кельвин |
| Калий | 39.0983 | 19 | 1033 Кельвин | 336,8 Кельвин |
| Кальций | 40.078 | 20 | 1757 Кельвин | 1112 Кельвин |
| Скандий | 44.9559 | 21 | 3109 Кельвин | 1814 Кельвин |
| Титан | 47.88 | 22 | 3560 Кельвин | 1945 Кельвин |
| Ванадий | 50.9415 | 23 | 3650 Кельвин | 2163 Кельвин |
| Хром | 51,996 | 24 | 2945 Кельвин | 2130 Кельвин |
| Марганец | 54,938 | 25 | 2335 Кельвин | 1518 Кельвин |
| Утюг | 55.847 | 26 | 3023 Кельвин | 1808 Кельвин |
| Кобальт | 58.9332 | 27 | 3143 Кельвин | 1768 Кельвин |
| Никель | 58.6934 | 28 | 3005 Кельвин | 1726 Кельвин |
| Медь | 63,546 | 29 | 2840 Кельвин | 1356,6 Кельвин |
| Цинк | 65.39 | 30 | 1180 Кельвин | 692,73 Кельвин |
| Галлий | 69,723 | 31 | 2478 Кельвин | 302,92 Кельвин |
| Германий | 72,61 | 32 | 3107 Кельвин | 1211,5 Кельвин |
| Мышьяк | 74.9216 | 33 | 876 Кельвин | 1090 Кельвин |
| Селен | 78.96 | 34 | 958 Кельвин | 494 Кельвин |
| Бром | 79,904 | 35 | 331,85 Кельвин | 265,95 Кельвин |
| Криптон | 83,8 | 36 | 120,85 Кельвин | 116 Кельвин |
| Рубидий | 85,4678 | 37 | 961 Кельвин | 312,63 Кельвин |
| Стронций | 87.62 | 38 | 1655 Кельвин | 1042 Кельвин |
| Иттрий | 88.9059 | 39 | 3611 Кельвин | 1795 Кельвин |
| Цирконий | 91,224 | 40 | 4682 Кельвин | 2128 Кельвин |
| Ниобий | 92.9064 | 41 | 5015 Кельвин | 2742 Кельвин |
| Молибден | 95.94 | 42 | 4912 Кельвин | 2896 Кельвин |
| Технеций | 98 | 43 | 4538 Кельвин | 2477 Кельвин |
| Рутений | 101,07 | 44 | 4425 Кельвин | 2610 Кельвин |
| Родий | 102.9055 | 45 | 3970 Кельвин | 2236 Кельвин |
| Палладий | 106.42 | 46 | 3240 Кельвин | 1825 Кельвин |
| Серебро | 107,868 | 47 | 2436 Кельвин | 1235,08 Кельвин |
| Кадмий | 112,41 | 48 | 1040 Кельвин | 594,26 Кельвин |
| Индий | 114,82 | 49 | 2350 Кельвин | 429,78 Кельвин |
| Олово | 118.71 | 50 | 2876 Кельвин | 505,12 Кельвин |
| Сурьма | 121,757 | 51 | 1860 Кельвин | 903,91 Кельвин |
| Теллур | 127,6 | 52 | 1261 Кельвин | 722,72 Кельвин |
| Йод | 126,9045 | 53 | 457,5 Кельвин | 386,7 Кельвин |
| Ксенон | 131.29 | 54 | 165,1 Кельвин | 161,39 Кельвин |
| Цезий | 132.9054 | 55 | 944 Кельвин | 301,54 Кельвин |
| Барий | 137,33 | 56 | 2078 Кельвин | 1002 Кельвин |
| Лантан | 138.9055 | 57 | 3737 Кельвин | 1191 Кельвин |
| Церий | 140.12 | 58 | 3715 Кельвин | 1071 Кельвин |
| Празеодим | 140.9077 | 59 | 3785 Кельвин | 1204 Кельвин |
| Неодим | 144,24 | 60 | 3347 Кельвин | 1294 Кельвин |
| Прометий | 145 | 61 | 3273 Кельвин | 1315 Кельвин |
| Самарий | 150.36 | 62 | 2067 Кельвин | 1347 Кельвин |
| Европий | 151.965 | 63 | 1800 Кельвин | 1095 Кельвин |
| Гадолиний | 157,25 | 64 | 3545 Кельвин | 1585 Кельвин |
| Тербий | 158.9253 | 65 | 3500 Кельвин | 1629 Кельвин |
| Диспрозий | 162.5 | 66 | 2840 Кельвин | 1685 Кельвин |
| Гольмий | 164.9303 | 67 | 2968 Кельвин | 1747 Кельвин |
| Эрбий | 167,26 | 68 | 3140 Кельвин | 1802 Кельвин |
| Тулий | 168.9342 | 69 | 2223 Кельвин | 1818 Кельвин |
| Иттербий | 173.04 | 70 | 1469 Кельвин | 1092 Кельвин |
| Лютеций | 174.967 | 71 | 3668 Кельвин | 1936 Кельвин |
| Гафний | 178,49 | 72 | 4875 Кельвин | 2504 Кельвин |
| Тантал | 180.9479 | 73 | 5730 Кельвин | 3293 Кельвин |
| Вольфрам | 183.85 | 74 | 5825 Кельвин | 3695 Кельвин |
| Рений | 186.207 | 75 | 5870 Кельвин | 3455 Кельвин |
| Осмий | 190,2 | 76 | 5300 Кельвин | 3300 Кельвин |
| Иридий | 192.22 | 77 | 4700 Кельвин | 2720 Кельвин |
| Платина | 195.08 | 78 | 4100 Кельвин | 2042,1 Кельвин |
| Золото | 196.9665 | 79 | 3130 Кельвин | 1337,58 Кельвин |
| Меркурий | 200,59 | 80 | 629,88 Кельвин | 234,31 Кельвин |
| Таллий | 204,383 | 81 | 1746 Кельвин | 577 Кельвин |
| Свинец | 207.2 | 82 | 2023 Кельвин | 600,65 Кельвин |
| Висмут | 208,9804 | 83 | 1837 Кельвин | 544,59 Кельвин |
| Астатин | 210 | 85 | 610 Кельвин | 575 Кельвин |
| Радон | 222 | 86 | 211,4 Кельвин | 202 Кельвин |
| Франций | 223 | 87 | 950 Кельвин | 300 Кельвин |
| Радий | 226.0254 | 88 | 1413 Кельвин | 973 Кельвин |
| Торий | 232.0381 | 90 | 5060 Кельвин | 2028 Кельвин |
| Протактиний | 231,0359 | 91 | 4300 Кельвин | 1845 Кельвин |
| Уран | 238,029 | 92 | 4407 Кельвин | 1408 Кельвин |
| Нептуний | 237.0482 | 93 | 4175 Кельвин | 912 Кельвин |
| Плутоний | 244 | 94 | 3505 Кельвин | 913 Кельвин |
| Америций | 243 | 95 | 2880 Кельвин | 1449 Кельвин |
Халькопирит — BioMineWiki
из BioMineWiki
Халькопирит (XX 7 мм, Монтрок, Франция)Золотисто-желтый минерал, также известный как сульфид меди и железа.Его химическая формула — CuFeS 2
.Выщелачивание халькопирита затруднено
Прямое выщелачивание халькопирита и других гипогенных минералов сульфида меди в растворе серной кислоты создает множество проблем, вызывающих медленную кинетику выщелачивания и неполное биоокисление. При температурах ниже точки плавления серы (приблизительно 118 ° C) скорость растворения меди до настоящего времени (2007 г.) была экономически низкой. При температурах выше точки плавления серы халькопирит и другие гипогенные минералы сульфида меди пассивируются тем, что считается слоем элементарной серы, которая образуется над частицами непрореагировавшего сульфида.Это снова делает неэкономичным извлечение меди этим способом. Другие системы выщелачивания, которые изучались на протяжении многих лет для извлечения меди из халькопирита в лабораторных или экспериментальных масштабах, включают системы, использующие концентрированные растворы хлорида железа или аммиачного аммония в качестве выщелачивающих агентов.
Попытки биовыщелачивания халькопирита и других гипогенных сульфидов меди в промышленных масштабах до настоящего времени также оказались безуспешными. Гипогенные сульфиды меди, такие как халькопирит, как известно, трудно поддаются биовыщелачиванию, хотя в настоящее время биовыщелачивание используется в качестве основного производственного метода для извлечения меди из супергенных минералов сульфида меди, таких как халькоцит и ковеллит, на нескольких горнодобывающих предприятиях по всему миру.
Следовательно, любой биогидрометаллургический процесс обработки гипогенных сульфидов меди, таких как халькопирит, требует пассивирования. Ряд различных добавок был использован в попытке увеличить растворение меди из халькопирита, предположительно за счет разрушения пассивирующего слоя. Эти добавки включают соли металлов, такие как Ag 2 SO 4 , Bi (NO 3 ), графит и другие сульфидные минералы. [1]
Микробные культуры, используемые в настоящее время (2007 г.) для биовыщелачивания, неспособны дать коммерчески приемлемые результаты для халькопирита без ультратонкого помола (P 80 <20 мкм) руды или концентрата для облегчения микробного окисления, либо использование очень длительного времени выщелачивания для достижения окисления.Время более 100 дней - не редкость.
[2]
Список литературы
- ↑ http://www.freepatentsonline.com/20070125199.html?highlight=bioleach&stemming=on
- ↑ http://www.patentstorm.us/patents/7189527-description.html
Факты, формула, свойства сульфида меди II, применение
Сульфид меди II или сульфид меди, представленный химической формулой CuS, которая носит название IUPAC сульфанилиденмеди [1] представляет собой черный порошок или комки, растворимые в азотной кислоте, но не растворимые в воде [3] . Встречается в виде минерала ковеллита и представляет собой ионное соединение [3, 4] . В сухом состоянии он стабилен на воздухе, но окисляется влагой воздуха до сульфата меди [1] .
Сульфид меди II
Идентификация сульфида меди II | |
| Номер CAS | 1317-40-4 [1] |
| PubChem CID | 14831 [1] |
| ChemSpider ID | 145403 [2] |
| Номер ЕС | 215-271-2 [1] |
Состав и синтез
Сульфид меди II может быть получен реакцией между расплавленной серой и медью с последующим кипячением в гидроксиде натрия [1] .
Cu + S = CuS
Формула сульфида меди II
Свойства и характеристики сульфида меди 2
Общая недвижимость | ||
| Молярная масса / молекулярная масса | 95,606 г / моль [1] | |
Физические свойства | ||
| Цвет / внешний вид | Черный порошок [3] | |
| Точка плавления / замерзания | 220 ° C, 428 ° F (разлагается) [3] | |
| Точка кипения | Нет [3] | |
| Плотность | 4.6 г мл -1 при 25 ° C [3] | |
| Состояние вещества при комнатной температуре (нормальная фаза) | Цельный [3] | |
| Показатель преломления | 1,45 [1] | |
Химические свойства | ||
| Растворимость в воде | Нет [1] | |
Атомные свойства | ||
| Кристаллическая структура | Шестиугольный [1] | |
Структура сульфида меди II
Заметные реакции CuS
Сульфид меди II реагирует с кислородом при температуре 300-500 ° C с образованием оксида меди и диоксида серы [7] .
2CuS + 3O 2 = 2CuO + 2SO 2
Использование сульфида меди
- При приготовлении смешанных катализаторов [3] .
- В проявлении анилинового черного красителя для текстильной печати [3] .
- В необрастающих красках [3] .
- Для фотооптики и полупроводников [6] .
Это опасно
Сульфид меди токсичен при проглатывании. Следует избегать контакта с глазами и кожей, а также вдыхания, так как это может вызвать раздражение.Оказывает длительное вредное воздействие на водные организмы [1, 3, 5] . В условиях пожара он разлагается с образованием опасных оксидов меди и оксидов серы [8] .
Артикул:
- Сульфид меди (II) — Pubchem.ncbi.nlm.nih.gov
- Сульфид меди (II) — Chemspider.com
- Сульфид меди (II) — Chemicalbook.com
- Примеры ионных связей — Examples.yourdictionary.com
- Сульфид меди CuS — Эспиметаллы.com
- Сульфид меди — Americanelements.com
- Реакция взаимодействия сульфида меди и кислорода — Chemiday.com Паспорт безопасности материала
- — Nwmissouri.edu
Этот сайт использует файлы cookie для повышения производительности. Если ваш браузер не принимает файлы cookie, вы не можете просматривать этот сайт.
Настройка вашего браузера для приема файлов cookie
Существует множество причин, по которым cookie не может быть установлен правильно.Ниже приведены наиболее частые причины:
- В вашем браузере отключены файлы cookie. Вам необходимо сбросить настройки своего браузера, чтобы он принимал файлы cookie, или чтобы спросить вас, хотите ли вы принимать файлы cookie.
- Ваш браузер спрашивает вас, хотите ли вы принимать файлы cookie, и вы отказались. Чтобы принять файлы cookie с этого сайта, используйте кнопку «Назад» и примите файлы cookie.
- Ваш браузер не поддерживает файлы cookie. Если вы подозреваете это, попробуйте другой браузер.
- Дата на вашем компьютере в прошлом.Если часы вашего компьютера показывают дату до 1 января 1970 г., браузер автоматически забудет файл cookie. Чтобы исправить это, установите правильное время и дату на своем компьютере.
- Вы установили приложение, которое отслеживает или блокирует установку файлов cookie. Вы должны отключить приложение при входе в систему или уточнить у системного администратора.
Почему этому сайту требуются файлы cookie?
Этот сайт использует файлы cookie для повышения производительности, запоминая, что вы вошли в систему, когда переходите со страницы на страницу.Чтобы предоставить доступ без файлов cookie потребует от сайта создания нового сеанса для каждой посещаемой страницы, что замедляет работу системы до неприемлемого уровня.
Что сохраняется в файле cookie?
Этот сайт не хранит ничего, кроме автоматически сгенерированного идентификатора сеанса в cookie; никакая другая информация не фиксируется.

 Эти элементы включают, прежде всего, кислород и серу. Оксиды и сульфиды меди в виде эвтектических смесей также образуются на границах зерен и, как и в предыдущем случае, они понижают пластические свойства, увеличивают прочностные свойства, но более мягким способом.
Эти элементы включают, прежде всего, кислород и серу. Оксиды и сульфиды меди в виде эвтектических смесей также образуются на границах зерен и, как и в предыдущем случае, они понижают пластические свойства, увеличивают прочностные свойства, но более мягким способом.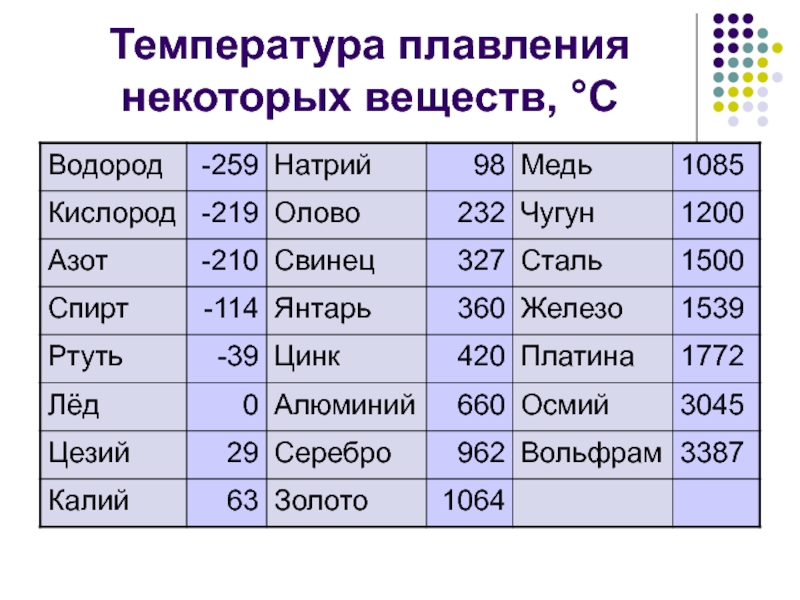 URL: http://window.edu.ru/ (дата обращения: 01.06.2018).
URL: http://window.edu.ru/ (дата обращения: 01.06.2018).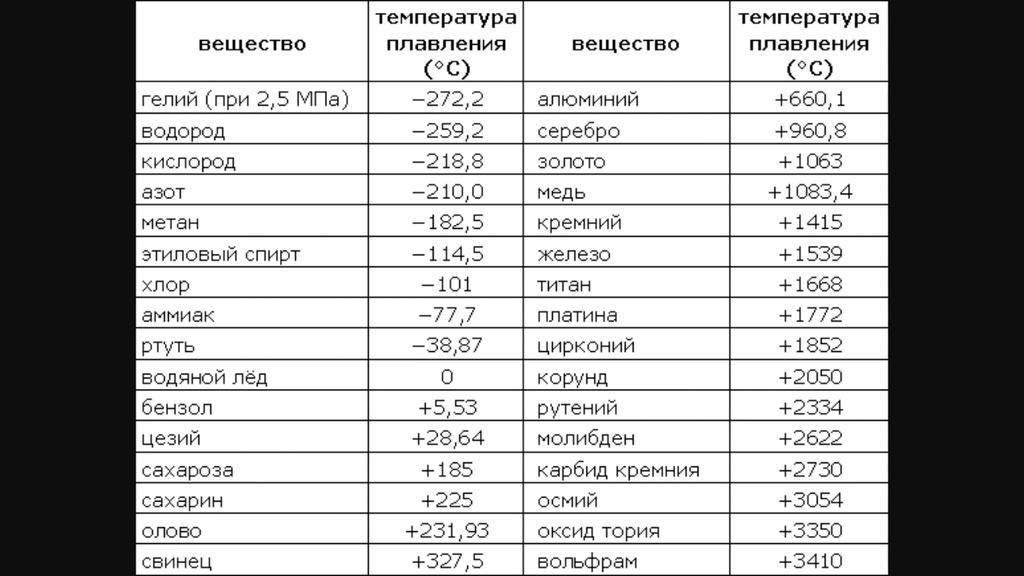

 Это касается мышьяка и сурьмы. Сюда же относятся железо, цинк, никель, олово, алюминий, фосфор и прочие.
Это касается мышьяка и сурьмы. Сюда же относятся железо, цинк, никель, олово, алюминий, фосфор и прочие. Кроме того, в состав включен фосфор, но его доля не более 0,04%.
Кроме того, в состав включен фосфор, но его доля не более 0,04%.
 Чтобы этому как-то противостоять, на расплавляемую массу сверху насыпают слой древесного угля.
Чтобы этому как-то противостоять, на расплавляемую массу сверху насыпают слой древесного угля. Для этого необходимо убрать из микроволновки вращающуюся тарелку, а вместо неё поместить соответствующих размеров тигель, который необходимо сделать из тугоплавкого материала, например, из шамотного кирпича.
Для этого необходимо убрать из микроволновки вращающуюся тарелку, а вместо неё поместить соответствующих размеров тигель, который необходимо сделать из тугоплавкого материала, например, из шамотного кирпича. Для этих целей используют специальный крючок, изготовленный из тугоплавкого металла.
Для этих целей используют специальный крючок, изготовленный из тугоплавкого металла. guru/metally/temperatura-plavleniya/pri-kakoy-temperature-plavitsya-med-plavlenie.html: использовано 2 блоков из 5, кол-во символов 2885 (11%)
guru/metally/temperatura-plavleniya/pri-kakoy-temperature-plavitsya-med-plavlenie.html: использовано 2 блоков из 5, кол-во символов 2885 (11%) html: использовано 4 блоков из 5, кол-во символов 5863 (22%)
html: использовано 4 блоков из 5, кол-во символов 5863 (22%) Уровень температуры задерживается на некоторое время, а затем продолжает рост;
Уровень температуры задерживается на некоторое время, а затем продолжает рост; Содержание таких компонентов не должно превышать 0,001% от общей массы.
Содержание таких компонентов не должно превышать 0,001% от общей массы.