Флюсы для пайки деталей — Пайка при индукционном нагреве
Флюсы для пайки деталей
Категория:
Пайка при индукционном нагреве
Флюсы для пайки деталей
Для того чтобы спаять деталь, недостаточно нагреть ее до необходимой температуры и подать припой в место спая; кроме этого нужно еще создать условия, при которых припой имел бы возможность затекать в зазор и смачивать поверхности спаиваемых деталей.
При нагреве металла до высоких температур кислород воздуха очень активно окисляет его поверхность, образуя окисную пленку, которая с увеличением температуры и продолжительности нагрева утолщается и уплотняется. Если детали с такими поверхностями попытаться спаять, то из этого ничего не получится, так как окислы не позволят припою смочить металл, при каких бы температурах ни происходил этот нагрев. Одной из главных задач при пайке является воспрепятствовать возникновению окислов или удалить их при нагреве. Для этих целей служат флюсующие вещества, или флюсы.
В процессе пайки флюс:
1) действует как растворитель и поглотитель окислов и грязи, препятствующих припою смачивать спаиваемую поверхность;
2) предохраняет, покрывая поверхность, от окисления при нагреве;
3) увеличивает жидкотекучесть расплавленного припоя, понижая его поверхностное натяжение.
По характеру поведения в процессе пайки флюсы можно разбить на две группы.
К первой группе относятся флюсы, которые активно вступают в химические реакции с окислами металлов, энергично очищая поверхность и растворяя пленки окислов. К ним относятся хлористый цинк, борная кислота, бура, тетрафторборат калия и т. д. Они применяются главным образом при пайке латуни, меди, стали и других металлов твердыми припоями.
Флюсы второй группы не вступают в какие-либо химические реакции с окислами, а служат лишь для защиты от окисления при пайке ранее очищенной механическим или химическим способом поверхности. Характерным представителем этой группы флюсов является канифоль.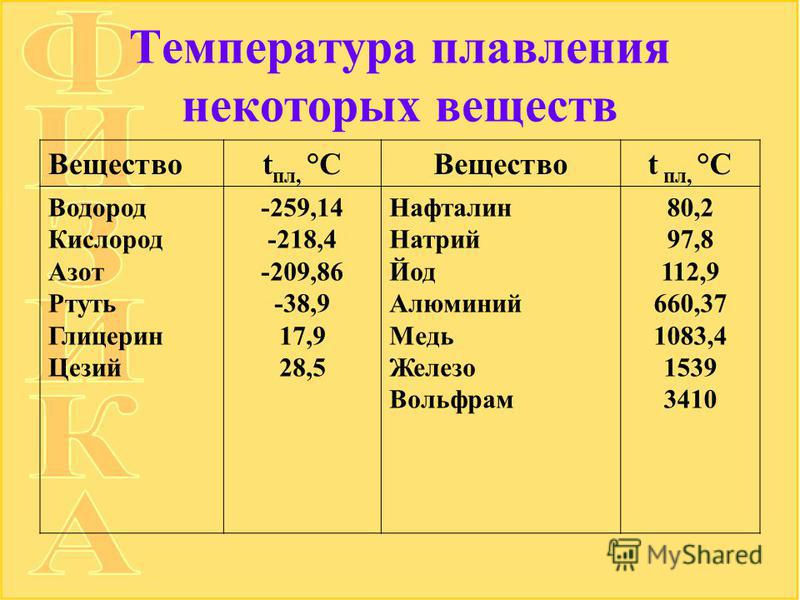 Такими флюсами пользуются преимущественно при пайке мягкими припоями.
Такими флюсами пользуются преимущественно при пайке мягкими припоями.
По возможности флюс должен удовлетворять следующим требованиям:
1) не должен вступать в химические реакции с металлами припоя и спаиваемых деталей;
3) при пайке из флюса не должны выделяться вредные газы;
4) желательно, чтобы остатки флюса легко удалялись с деталей после пайки.
Флюс наносится на место спая’ в виде порошка, концентрированного водного раствора или в виде пасты.
В отдельных случаях целесообразно наносить флюс на припой и пи деталь окунанием последних в кипящий концентрированный водный раствор флюса. Этот способ следует применять при пайке деталей, имеющих большие поверхности спая, особенно если эти поверхности плохо поддаются расконсервации или зачистке перед пайкой, а также в случае, если детали поступают на пайку уже собранными в узел и скрепленными каким-либо из способов фиксации.
Особенно большую роль при пайке твердыми припоями играет бура (тетраборат натрия: Na2B407). Чаще всего ее применяют в виде порошка, который получается из кристаллической буры путем расплавления и нагрева до 800—850 °С (температура плавления буры 783 °С). Просеянный, обезвоженный порошок буры хранят в герметически закрытых сосудах.
На приготовление буры для пайки должно быть обращено самое серьезное внимание, так как от качества буры очень сильно зависит качество пайки. Лучше всего буру нагревать в керамической или графитовой посуде. При этом, после разливки на палочки и охлаждения, получается обезвоженная бура в виде прозрачного или слегка желтоватого стекла. Прокалка буры в тиглях или коробках из хромоникелевой стали придает стекловидной буре слегка голубоватый или зеленоватый оттенок.
Отрицательным качеством буры является свойство ее при остывании образовывать прочную стекловидную массу, трудно удаляемую механическим путем. Обычно после пайки детали обрабатывают струей песка. При использовании буры в качестве флюса рекомендуется удалять ее кипячением детали в растворе содохром-пика в течение 5—10 мин. с последующей очисткой струей песка.
Обычно после пайки детали обрабатывают струей песка. При использовании буры в качестве флюса рекомендуется удалять ее кипячением детали в растворе содохром-пика в течение 5—10 мин. с последующей очисткой струей песка.
При напайке пластинок твердых сплавов на режущий инструмент активность буры как флюса оказывается недостаточной. В этом случае можно применить флюс, содержащий 40% фтористого калия, 50% буры и 10% борной кислоты.
В некоторых случаях, когда требуется повысить рабочую температуру флюса, т. е. сделать его активным при более высоких температурах, применяют флюсы, состоящие из смеси буры и борной кислоты (Н3ВО3). От изменения процентного содержания компонентов в таком флюсе зависит его температура плавления, которую можно определить по диаграмме состояния системы бура — борная кислота.
Борная кислота является хорошим флюсом. При нагреве она разлагается на борный ангидрид (В203) и воду. При высоких температурах борный ангидрид активно реагирует с окислами, способствуя процессу пайки.
Следует учитывать, что температура активного действия флюса значительно выше его температуры плавления. Для плавки тугоплавкими припоями нержавеющих сталей и жаропрочных сплавов, когда активности буры и борной кислоты бывает недостаточной, следует пользоваться флюсами № 200 и 201. Для пайки этих же сталей и сплавов серебряными припоями пригоден флюс № 209.
Для пайки латунных, медных и стальных изделий серебряными припоями следует применять флюс, содержащий тетрафторборат калия (KBF4) и борную кислоту или буру.
При пайке чугуна необходимо в качестве флюса использовать буру с добавкой к ней небольшого количества марганцевокислого калия, назначение которого, разлагаясь при нагреве, окислить поверхность и удалить с нее углерод и кремний и этим создать благоприятные условия для смачивания ее припоем.
Реклама:
Читать далее:
Припои для пайки деталей
Статьи по теме:
БУРА ДЛЯ ПАЙКИ ЛАТУНЬЮ [состав, видео, советы по выбору]
В настоящее время активно используют [буру для пайки] серебряным либо же латунным припоем.
Вообще любая пайка различных видов металлов представляет собой способ соединения между собой элементов металла при помощи высоких температур и самых разных припоев.
Если говорят о пайке бурой, то имеют в виду применение этого состава в качестве основного флюса.
Для спаивания металла в этом случае по большей части пользуются серебряным, а также латунным припоем.
Она выступает своеобразным электродом и позволяет работать со сталью, латунью, медью, а также серебром.
Пользоваться ей достаточно просто, если знать технологию процесса пайки и иметь представление о характеристиках различных групп металлов.
В процессе горения сама бура становится вязкой стеклянной массой.
Следует отметить, что температура плавления данного типа припоя составляет порядка девятисот градусов по Цельсию.
Этот высокотемпературный флюс в момент пайки образует на поверхности металла соли, удаление которых можно произвести только путем механической зачистки.
В настоящее время буру купить можно в любом строительном магазине по доступной цене.
Основные характеристики
Этот высокотемпературный флюс нашел широкое применение. Состав, главным образом, используют для спайки между собой таких металлов, как сталь и чугун, а также медь.
В этом случае припоем выступают латунь, медь, а также серебро или золото.
Бура в расплавленном виде достаточно успешно растворяет окислы самых разных металлов, а кроме этого, очищает поверхность от различных спаиваемых деталей из металла.
Видео:
Особенностью работы с бурой является то, что по окончанию процесса пайки необходимо в обязательном порядке произвести удаление остатков солевых отложений.
Данное вещество способно при смешивании с борной кислотой в равных долях образовать борный флюс.
В этом случае смешивание необходимо производить максимально тщательно и сделать это легче всего в фарфоровой ступке.
Далее следует хорошо нагреть используемый растворитель непосредственно в дистиллированной воде и выпарить до того момента, когда образуется твердый осадок.
Чтобы флюс получился более активным, в него добавляют соли, относящиеся к фтористой или хлористой группам.
Данный активный флюс преимущественно используется для пайки медных материалов. Собой бура представляет порошок, в котором полностью отсутствует вода.
Кристаллы этого вещества имеют прозрачный или сероватый оттенок с характерным жирным блеском.
Бура активно применяется в ювелирной сфере, как флюс, при помощи которого скрепляют между собой драгоценные металлы. Кроме этого, она также используется в медицинских целях и при производстве стекла.
При помощи буры в некоторых случаях ремонтируется техника. В ее состав входят те вещества, которые способны вступать во взаимодействие с различными группами металлов.
В зависимости от используемого металла, ее состав может изменяться и дополняться различными более активными компонентами. Состав буры является определяющим фактором при выборе этого материала.
Состав буры является определяющим фактором при выборе этого материала.
Пайка элементов из меди
Данный химический состав очень часто используют для выполнения пайки в домашних условиях труб из меди и других медных материалов.
Следует отметить, что практически в каждом доме можно найти некоторые элементы в системе водопровода, выполненные из меди.
Перед тем как выполнить ремонт таких элементов при помощи буры, рекомендуется изучить свойства этого материала и изучить технологию пайки.
Видео:
Данный высокотемпературный флюс имеет ряд достоинств. В первую очередь, им можно пользоваться при любой температуре изделия.
Кроме этого, пользуясь этим электродом, можно производить соединение металла с неметаллом. Соединения, которые получены этим припоем, можно в любой момент без каких-либо сложностей распаять.
Следует отметить и то, что сами детали и припой имеют отличное взаимодействие между собой.
Кроме этого, размеры и форма самого изделия никак не меняются, так как данным электродом основной металл не подвергается деформации и расплавлению.
Такая пайка металла обеспечивает прочное и достаточно надежное соединение.
Следует отметить, что пользоваться бурой следует в определенной последовательности. В первую очередь, следует тщательно подготовить к работе саму поверхность в месте пайки.
Для этого необходимо с поверхности полностью удалить все загрязнения, снять образовавшуюся оксидную пленку, что очень удобно сделать флюсом, в котором основным элементом выступает бура.
Далее следует в обязательном порядке, в образованный элементами зазор, аккуратно ввести припой в жидком состоянии.
В этот момент между самими деталями и непосредственно припоем осуществляется плотное взаимодействие. После этого припой начинает постепенно кристаллизоваться.
Если всю работу выполнить правильно и в соответствии с технологией, то соединение получиться прочным и надежным.
Подготовка инструмента и материала
Для того чтобы выполнить пайку бурой, следует подготовить для работы необходимое оборудование. В первую очередь, для выполнения соответствующих работ понадобится хороший резак исключительно для деталей из меди.
Также следует иметь под рукой специальную кисть, при помощи которой можно будет удобно наносить флюс-пасту из буры.
Кроме этого, понадобиться оловянный припой, непосредственно сама бура в виде пасты, а также горелка. Для пайки можно использовать горелки самых разных типов.
Видео:
Одинаково подойдут горелки, которые оснащены пьезорозжигом или газовыми баллончиками. Не стоит использовать дорогостоящие горелки без функции розжига, так как они не добавляют удобства при пайке.
При выполнении пайки с использованием бура следует выполнять определенный порядок действий.
Так, для начала необходимо тщательно зачистить поверхность в месте выполнения соединения, для чего можно воспользоваться специальной щеткой с металлическими волокнами.
Если пайке будут подвергаться трубы, то необходимо обязательно произвести и их внутреннюю очистку. Также рекомендуется выполнить чистовую зачистку до блеска металла.
Сделать это можно при помощи мелкой наждачной бумаги. Далее кистью следует нанести флюс из буры, причем, как на внутреннюю, так и на внешнюю поверхность трубы.
После этого необходимо спаиваемые детали максимально плотно сжать между собой.
Всю последующую работу необходимо производить с предельной осторожностью с соблюдением техники безопасности, так как будет использоваться открытый огонь.
Перед началом работ горелку следует зажечь, после чего тщательно прогреть место стыка в течение двадцати минут. Далее припоем обрабатывается место скрепления, после чего выполняется сама пайка.
Для присадки в этом случае следует использовать проволоку из латуни. В момент проведения пайки сама бура насыпается в необходимом количестве непосредственно на место спаивания материалов.
При проведении работ можно пользоваться графитовым электродом, соблюдая при этом предельную осторожность. Сам процесс пайки бурой не занимает много времени и выполняется достаточно просто.
На видео, которое размещено в начале нашей статьи, подробно показано, как работает бура.
Советы и рекомендации
Пайка бурой может без проблем производиться и в домашних условиях, но только на подготовленном месте и с соблюдением правил по технике безопасности.
Пользуясь электродом, лучше использовать и различные защитные средства. В том случае, если бура достаточно длительно хранилась, рекомендуется ее перед началом работ особым образом переплавить.
Для этих целей используют либо тигилек, либо шамот.
Видео:
Полученное в результате плавления вещество необходимо будет тщательно раздробить до порошкообразного состояния, после чего поместить для дальнейшего хранения в герметичную емкость.
Следует помнить, что наносить флюс следует только тогда, когда место пайки раскалиться докрасна.
Прогревать место пайки необходимо по всей его площади, аккуратно водя горелкой в разные стороны. Для пайки следует использовать небольшое количество буры.
Сама бура в момент пайки должна полностью расплавиться и плотно растечься по всему месту соединения и образовать специфическую пленку. Совместно с бурой лучше всего использовать латунь.
Оптимальным моментом для нанесения припоя является тот, при котором место соединения раскаляется докрасна, а расплавленная бура приобретает ярко выраженный синеватый оттенок.
Следует отметить, что и бура, и латунь имеют практически одинаковую температуру плавления.
Видео:
пайка, холодильник, ремонт, флюс, бура, температура
Прочность высокотемпературной пайки зависит, во многом, от чистоты поверхности соединения.
 При сильном нагреве многие металлы начинают взаимодействовать с кислородом воздуха и окисляться; плёнка оксида препятствует диффузии припоя в структуру поверхности и ухудшает качество пайки. Снижение характеристик соединения проявляется при работе с железом или сталями, но особенно сильно – при пайке мягких и благородных металлов. Поверхность меди, алюминия или серебра практически всегда покрыта плёнкой окисла, поэтому для этих металлов почти неприменима высокотемпературная пайка без использования дополнительных компонентов. Различные флюсы, которые наносят на металл, успешно очищают его поверхность от загрязнений и образуют тонкий предохранительный слой расплавления, препятствующий окислению. Подбор «правильного» флюса – один из важнейших этапов в процессе пайки: при верном выборе можно многократно улучшить качество соединения и добиться шва, по прочности не уступающего исходным материалам. Высокотемпературный флюс ФК-235 используется для пайки никеля, серебра, меди, сталей и различных сплавов этих металлов.
При сильном нагреве многие металлы начинают взаимодействовать с кислородом воздуха и окисляться; плёнка оксида препятствует диффузии припоя в структуру поверхности и ухудшает качество пайки. Снижение характеристик соединения проявляется при работе с железом или сталями, но особенно сильно – при пайке мягких и благородных металлов. Поверхность меди, алюминия или серебра практически всегда покрыта плёнкой окисла, поэтому для этих металлов почти неприменима высокотемпературная пайка без использования дополнительных компонентов. Различные флюсы, которые наносят на металл, успешно очищают его поверхность от загрязнений и образуют тонкий предохранительный слой расплавления, препятствующий окислению. Подбор «правильного» флюса – один из важнейших этапов в процессе пайки: при верном выборе можно многократно улучшить качество соединения и добиться шва, по прочности не уступающего исходным материалам. Высокотемпературный флюс ФК-235 используется для пайки никеля, серебра, меди, сталей и различных сплавов этих металлов. Отличается этот флюс, прежде всего, особенной эффективностью: он успешно заменяет стандартные флюсы ПВ 209 и ПВ 284 в массовом соотношении 1к4. В состав флюса входит около 40% фтора и 28-30% калия (собственно, поэтому он и носит маркировку ФК). Остальное – бор (10-12%) и различные примеси и связующие вещества.
Отличается этот флюс, прежде всего, особенной эффективностью: он успешно заменяет стандартные флюсы ПВ 209 и ПВ 284 в массовом соотношении 1к4. В состав флюса входит около 40% фтора и 28-30% калия (собственно, поэтому он и носит маркировку ФК). Остальное – бор (10-12%) и различные примеси и связующие вещества. Плавление ФК-235 начинается уже при 270-330С, а интервал максимальной активности вещества приходится на температуру 480-860С. По этой причине ФК-235 оптимально подходит для высокотемпературной пайки: к началу работ он уже находится в жидком состоянии и покрывает всю поверхность будущего шва. Невысокая температура плавления и широкий диапазон активности позволяют использовать флюс ФК-235 с большинством существующих припоев. При этом нет никаких особых требований к его использованию — достаточно соблюдать стандартные правила безопасности. Обычно флюс в твердом виде представляет собой мелкодисперсный порошок, который наносится на металл перед пайкой. Существует форма выпуска ФК-235 и в виде специальной пасты. В этом случае работа с флюсом облегчается: его проще наносить на поверхность; однако пасты для пайки требуется несколько больше, чем сухого порошка. Одна из сложнейших операций при пайке – соединение деталей из разнородных металлов. Применение ФК-235 в этом случае является одним из оптимальных решений: при использовании этого флюса можно получить отличные характеристики швов даже на пайках медь-сталь, никель-сталь или серебро-медь
В этом случае работа с флюсом облегчается: его проще наносить на поверхность; однако пасты для пайки требуется несколько больше, чем сухого порошка. Одна из сложнейших операций при пайке – соединение деталей из разнородных металлов. Применение ФК-235 в этом случае является одним из оптимальных решений: при использовании этого флюса можно получить отличные характеристики швов даже на пайках медь-сталь, никель-сталь или серебро-медь
Плавка металла
Поступающие для плавки частицы одного или нескольких металлов загружаются в специальные плавильные печи, под влиянием высокой температуры доводятся до жидкой однородной массы, которая отливается в формы для получения слитков.
Материал, поступающий в плавку, называется шихтовым, или шихтой. Шихта может быть в виде чистых металлов, бракованных слитков и изделий, лома, обрезков, стружки и опилок и других отходов ювелирного производства.
Шихтовый материал в зависимости от степени и характера загрязнения подвергается различной обработке.
Возвратные отходы от переработки драгоценных металлов своего производства (литники, высечка, стружка, обрезки и др.), не вызывающие сомнения в отношении содержания основных и легирующих компонентов, поступают в плавку без предварительной подготовки.
Отходы драгоценных металлов (опилки, мелкие обрезки, стружка), загрязненные в процессе работы, проходят очистительную обработку и только после этого поступают в плавку.
Шихтовые материалы, загрязненные вредными примесями (металлами, не отвечающими составу сплава; материалами, отрицательно влияющими на свойства сплава, и т.д.), подвергают предварительной плавке, а затем отправляют на аффинажные заводы или на заводы вторичных драгоценных металлов.
Очистка шихты. Отходы драгоценных металлов, возвращающиеся от рабочих (опилки, стружка, мелкие обрезки и т.д.), не могут быть не загрязнены. Очистительной обработкой этих отходов занимаются сами рабочие. Собранные опилки прокаливают в муфельной печи для удаления всех сгорающих примесей (дерева, воска, щетины от щеток, бумажной и другой пыли).
Сплавляют для различных целей — соединения частей одного металла в один слиток, приготовления сплавов и припоев (легкоплавких, легкотекучих сплавов), освежения сплава и т. д.
Плавку драгоценных металлов производят в индукционных печах с графитовым тиглем.
Шихтовый материал загружается в тигель — огнеупорный сосуд плавильной печи, в котором расплавляют металл. Последовательность загрузки зависит от величины и состояния шихты (крупные куски, слитки или мелкие обрезки, стружка и т.д.), состава и температурных характеристик компонентов, входящих в сплав.
Порядок загрузки и плавки шихты. При плавке однородного металла шихту можно загружать в тигель одновременно, если плавильная печь обеспечивает быстрый нагрев шихты. В противном случае, сначала загружают крупные куски или брикеты, а по мере их расплавления добавляют мелкие обрезки и другие отходы. Расплав из золота нагревают до 1200…1250°С, серебра — до 1100…1150оС.
В противном случае, сначала загружают крупные куски или брикеты, а по мере их расплавления добавляют мелкие обрезки и другие отходы. Расплав из золота нагревают до 1200…1250°С, серебра — до 1100…1150оС.
Для приготовления двойных золотосеребряных сплавов загрузку шихты начинают с серебра. Его загружают на дно тигля, а сверху засыпают золото и расплавку ведут одновременно, если куски шихты приблизительно одного размера. Если же величина шихтовых материалов различна, то загружают сначала крупные куски, а по мере их расплавки добавляют мелкие, серебряные или золотые. Температура нагрева расплава для золотых сплавов с содержанием до 30 % Ag- 1200…1250°С, для сплава с содержанием 40…70 % Ag- 1180…1240°С, для сплава с содержанием 80% Ag- 1170…1230°С.
При легировании золота медью (приготовление двойных золотомедных сплавов) плавку шихты начинают с золота. Если величина шихтовых материалов различна, то плавят раньше слитки и крупные куски золота, а затем догружают мелочь. Медь загружают только после того, как полностью расплавится золотая шихта. Для всех сплавов с содержанием меди в качестве медной лигатуры используют прокат марок не ниже M1. Расплав, содержащий до 2 % Сu, нагревают до 1190…1250°С; 8,4 % Сu- до 1180… 1240°С; 42,7% Сu- до 1150…1230°С.
Для всех сплавов с содержанием меди в качестве медной лигатуры используют прокат марок не ниже M1. Расплав, содержащий до 2 % Сu, нагревают до 1190…1250°С; 8,4 % Сu- до 1180… 1240°С; 42,7% Сu- до 1150…1230°С.
При приготовлении тройных золотосеребряномедных сплавов сначала загружают золото и серебро, а затем в золотосеребряный расплав — медь. Нагрев расплава производится: для сплава 958-й пробы до 1180…1240°С; 750-й — до 1180…1200 °С; 583-й — 1080…1200°С; 500-й — 1070…1160°С; для сплавов 375-й пробы до 1120…1230 °С.
Загрузку золотоникелевомедного сплава начинают с золота. После его расплавления догружают никель и медь. Тигель нагревают на 150…250° выше температуры полного расплавления.
При плавке серебряных сплавов загрузку тигля начинают с серебра и после полного расплавления загружают медь. Для сплавов серебра 875-й пробы и выше температура нагрева 1090…1140°С.
Плавку золотых припоев с содержанием легкоплавких металлов цинка и кадмия можно производить двумя способами: 1) цинк и кадмий вводят в расплав в последнюю очередь подогретыми до температуры 150°С; 2) сначала создают промежуточные лигатуры легкоплавких металлов с медью при постепенном нагревании металлов, а затем сплавляют весь набор сплава.
Защитные покровы, флюсы, раскислители. При плавке драгоценных металлов и сплавов для предохранения расплавов от окисления, насыщения кислородом и другими газами из окружающей среды, а также для верхней теплоизоляции расплавов (для сокращения расходов, теплоты на плавку) применяют следующие защитные покровы: древесный уголь, буру, борную кислоту, хлористый кальций, хлористый натрий, хлористый калий, хлористый барий.
Флюсы очищают расплавы от нежелательных компонентов, загрязнений и примесей путем окисления и перевода оксидов в шлаки. В большинстве случаев в качестве флюсов используются те же вещества, что и для защитных покровов.
Раскислители восстанавливают окисленные компоненты расплава до металлов для повышения его жидкотекучести и качества отливаемых слитков. Для драгоценных сплавов раскислителями являются цинк, фосфористая медь и марганцовокислый калий.
При выборе защитных покровов, флюсов и раскислителей необходимо учитывать характер их взаимодействия с расплавами и отдельными компонентами расплавов. Например, древесный уголь, один из лучших защитных покровов для серебра и его сплавов, не пригоден для платины, так как платина, металлы платиновой группы и никель, а также сплавы с содержанием этих металлов при плавке подвержены науглероживанию. Недопустимо также применение угля совместно с калиевой селитрой и поташом, так как эти флюсы при нагревании в присутствии углерода образуют взрывоопасные соединения.
Например, древесный уголь, один из лучших защитных покровов для серебра и его сплавов, не пригоден для платины, так как платина, металлы платиновой группы и никель, а также сплавы с содержанием этих металлов при плавке подвержены науглероживанию. Недопустимо также применение угля совместно с калиевой селитрой и поташом, так как эти флюсы при нагревании в присутствии углерода образуют взрывоопасные соединения.
Древесный уголь может выполнять роль как защитного покрова, так и флюса. Для плавок драгоценных металлов и сплавов лучшим считается хорошо прокаленный березовый уголь. Температура вспышки угля 250…300°С. Уголь прокаливается без доступа воздуха до вишнево-красного цвета. Хранится в сушильных шкафах при температуре на 20…50° выше температуры окружающей среды. В качестве защитного покрова может быть применен при плавке серебра, серебряно-медных сплавов, золота и золотых сплавов без содержания платины, металлов платиновой группы и никеля.
Бура (плавленая) используется в качестве флюса и защитного покрова при плавке драгоценных металлов. Обладает свойством хорошо отшлаковывать оксиды многих металлов и шлаковых включений. Расплавленная бура обладает хорошей смачиваемостью. Находясь в шихте, она обволакивает нерастворимые тугоплавкие включения и оксиды и поднимает их на поверхность. Переплавленную, мелкоистолченную и прокаленную при температуре 450°С буру хранят в сухой посуде с притертой пробкой. В качестве флюса и защитного покрова бура может применяться для всех драгоценных металлов и сплавов, как самостоятельно, так и в сочетании с другими флюсами. Для лучшего скольжения расплава по стенкам бурой покрывают рабочую часть тигля.
Обладает свойством хорошо отшлаковывать оксиды многих металлов и шлаковых включений. Расплавленная бура обладает хорошей смачиваемостью. Находясь в шихте, она обволакивает нерастворимые тугоплавкие включения и оксиды и поднимает их на поверхность. Переплавленную, мелкоистолченную и прокаленную при температуре 450°С буру хранят в сухой посуде с притертой пробкой. В качестве флюса и защитного покрова бура может применяться для всех драгоценных металлов и сплавов, как самостоятельно, так и в сочетании с другими флюсами. Для лучшего скольжения расплава по стенкам бурой покрывают рабочую часть тигля.
Борная кислота (плавленая) используется в качестве флюса при плавке золотых сплавов.
Буру или борную кислоту засыпают на дно прогретого тигля до загрузки шихты, таким образом, смачивая частицы металла до начала их окисления.
Смесь поташа с бурой (1:1 по массе) применяют как флюс при очистительных плавках. Смесь должна быть прокалена. Флюс вводят порциями. При загрязнении шихты нежелательными металлами применяют смесь буры с калиевой или натриевой селитрами.
При плавке драгоценных сплавов с селитрой можно повысить пробу сплава до 20 ед. При плавке с селитрой шихту нагревают под покровом буры до температуры отливки и в расплав двумя- тремя приемами вводят селитру.
Другие флюсы — хлористый кальций, хлористый барий, хлористый натрий, хлористый калий — также применяют при очистительных плавках. Свойства и действие флюсов однотипны. Температура плавления 772…925°С. Образуют хорошие защитные покровы для сплавов с температурой плавления до 1300°С. Хлористый кальций, хлористый барий, хлористый натрий или хлористый калий, как и буру, применяют в переплавленном, измельченном и прокаленном виде.
Лучший раскислитель для золотых сплавов — цинк. Его вводят из расчета 0,05…0,1 % от массы шихты. Для серебряных сплавов используют фосфористую медь.
Процесс плавки. Перед загрузкой шихты в тигель следует проверить исправность плавильной системы и подготовить для отливки слитка изложницы. Тигель перед загрузкой в него металла прогревают, на дно прогретого тигля засыпают флюс из расчета 1 % от массы шихты. Затем в тигель загружают шихту и задают нужную температуру. После расплавления шихты расплав покрывают небольшим количеством свежего флюса и перемешивают. Не понижая температуры нагрева, расплаву дают отстояться, чтобы флюс отшлаковал ненужные оксиды и примеси, вводят раскислитель. В расплавы припоев и сплавов, содержащих цинк, раскислитель не вводится в связи с достаточным количеством компонентов, выполняющих роль раскислителя. Изложницы, нагретые до 100°С для удаления следов влаги, натирают технологической смазкой и устанавливают для отливки. После этого расплав отливают через сливной желоб тигля в изложницы, и после полной кристаллизации и выдержки слиток извлекают.
Затем в тигель загружают шихту и задают нужную температуру. После расплавления шихты расплав покрывают небольшим количеством свежего флюса и перемешивают. Не понижая температуры нагрева, расплаву дают отстояться, чтобы флюс отшлаковал ненужные оксиды и примеси, вводят раскислитель. В расплавы припоев и сплавов, содержащих цинк, раскислитель не вводится в связи с достаточным количеством компонентов, выполняющих роль раскислителя. Изложницы, нагретые до 100°С для удаления следов влаги, натирают технологической смазкой и устанавливают для отливки. После этого расплав отливают через сливной желоб тигля в изложницы, и после полной кристаллизации и выдержки слиток извлекают.
На предприятиях, оборудованных плавильными комплексами, плавку и отливку производят в центробежных или вакуумных установках.
В условиях мастерских, не оборудованных плавильными печами, шихту нагревают газопламенной горелкой. Плавку проводят в специальных тигельках (плошках), рассчитанных для массы металла не более 30 г. Плошки изготовляют из смесей на основе огнеупорной глины, каолина, графита, шамота. В этих же целях можно использовать шамотный кирпич или кусок древесного угля, обмазанного огнеупорной глиной. Используют также плошки из кварцевого стекла. Но самой доступной в любых условиях является плошка, изготовленная из асбестового картона толщиной 6…8 мм. Обрезанный по размеру картон увлажняют и придают ему форму легкого прогиба (углубление не должно превышать 6…7 мм, чтобы не создать эффект отраженного пламени), сушат и перед плавкой глазуруют бурой. Асбестовый тигелек выдерживает 3…4 плавки. Однако все эти тигельки недолговечны, застывающая бура отслаивает глиняную обмазку, а кварцевый тигелек сразу после отливки резко охлаждают в воде, иначе, бура, остывая, разрывает поверхность кварца. Плавку припоя в плошках осуществляют с добавлением легкоплавкого компонента под слегка пристывший слиток с продолжением плавки.
Плошки изготовляют из смесей на основе огнеупорной глины, каолина, графита, шамота. В этих же целях можно использовать шамотный кирпич или кусок древесного угля, обмазанного огнеупорной глиной. Используют также плошки из кварцевого стекла. Но самой доступной в любых условиях является плошка, изготовленная из асбестового картона толщиной 6…8 мм. Обрезанный по размеру картон увлажняют и придают ему форму легкого прогиба (углубление не должно превышать 6…7 мм, чтобы не создать эффект отраженного пламени), сушат и перед плавкой глазуруют бурой. Асбестовый тигелек выдерживает 3…4 плавки. Однако все эти тигельки недолговечны, застывающая бура отслаивает глиняную обмазку, а кварцевый тигелек сразу после отливки резко охлаждают в воде, иначе, бура, остывая, разрывает поверхность кварца. Плавку припоя в плошках осуществляют с добавлением легкоплавкого компонента под слегка пристывший слиток с продолжением плавки.
Слитки трехкомпонентных сплавов «золото — медь — серебро» при охлаждении ниже 450°С сохраняют первоначальную кубическую гранецентрированную решетку и свойства твердого раствора, поэтому слитки необходимо подвергать резкому охлаждению. Это придает им мягкость и пластичность.
Это придает им мягкость и пластичность.
Для отливки слитков драгоценных металлов используют чугунные и стальные изложницы (рис. 3). Изложница, или ингус, представляет собой металлический брусок с выфрезерованным пазом по форме будущего слитка. Нерабочая стенка изложницы делается выше, она служит экраном, направляющим расплав в паз. Размеры изложниц и толщина их стенок зависят от размеров слитка. Изложницы для горизонтальной отливки делают сплошными. Они могут иметь несколько ячеек. Для вертикальной отливки изготовляют разъемные изложницы, с заливной воронкой с торца. Изложницы рекомендуется делать из серого гематитового чугуна с малым содержанием примесей серы и фосфора или низкосортных сталей (как правило, разъемные).
Изложницы прокаливают до температуры 500…550°С с технологическими смазками. Роль технологических смазок — обеспечить хорошее качество отливаемых слитков, т. е. хорошее растекание расплава по ячейке, препятствовать образованию раковин и наплывов и пригоранию расплава к стенкам изложницы. В качестве смазок употребляют: льняное, конопляное, подсолнечное, веретенное и машинное масла, пчелиный воск и водную эмульсию молотого мела.
В качестве смазок употребляют: льняное, конопляное, подсолнечное, веретенное и машинное масла, пчелиный воск и водную эмульсию молотого мела.
Перечисленные масла рекомендуются для отливки слитков из серебра, золота и припоев. Если смазку производят непосредственно перед отливкой, то перед использованием масло обязательно обезвоживают кипячением на водяной бане при 110… 120°С в течение 2 ч. Смазку наносят тонким слоем на рабочую поверхность изложницы, подогретой до температуры не более 100 °С.
Пчелиный воск — одна из лучших смазок. Используется в тех же случаях, что и масла. Наносится на рабочую поверхность изложницы, нагретой до 50…70оC.
Водная эмульсия молотого мела применяется при отливке высокотемпературных металлов и сплавов — золота, платины, палладия. После нанесения слоя эмульсии на рабочую поверхность изложницы, нагретой до 150…200°С, ее тщательно просушивают до полного удаления влаги. Просушенную изложницу рекомендуется прокаливать при температуре 550°С, тогда изложница выдерживает более 100 заливок. Делают это заранее, так чтобы к моменту отливки изложница имела рабочую температуру 150…200°С.
Делают это заранее, так чтобы к моменту отливки изложница имела рабочую температуру 150…200°С.
Плавка и отливка металлов — один из наиболее опасных процессов, при котором несоблюдение мер безопасности труда может вызвать серьезные травмы. Выполнять плавку можно только на полностью исправном и налаженном оборудовании. Вся плавильная оснастка должна быть заранее подготовлена и разложена на удобных для работы участках. Плавку следует проводить в защитных очках и с предельной осторожностью. Загружать шихту в нагретый тигель нужно при помощи специального жестяного совочка, размеры которого позволяют безопасно провести операцию. Помешивание расплава и снятие шлака осуществляют специальной графитовой или кварцевой мешалкой, длина которой обеспечивает удобство работы и надежную защиту рук от ожогов. Особой осторожности требует разлив металла в изложницы. Кроме того, что необходим навык, надо убедиться в правильности установки изложницы и степени смазки ее. Лишняя смазка может вызвать разбрызгивание сплава.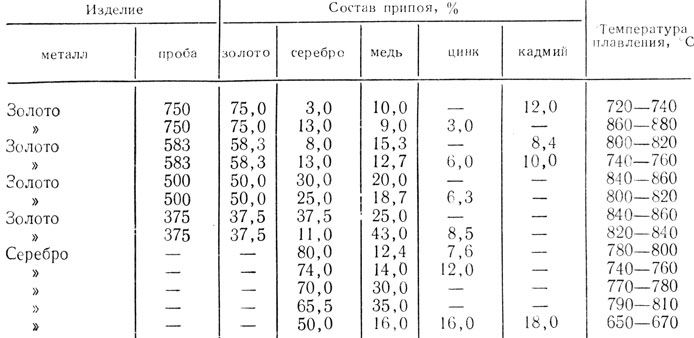 Плавильщик обязан работать в защитном фартуке из кожи, брезента или войлока. Выброс слитков из изложниц и охлаждение их производят в рукавицах.
Плавильщик обязан работать в защитном фартуке из кожи, брезента или войлока. Выброс слитков из изложниц и охлаждение их производят в рукавицах.
Бура техническая — Справочник химика 21
Бура техническая фасованная………163 [c.287]Для изготовления клея применяются следующие материалы декстрины кислотные (ГОСТ 6034—51) бура техническая (ГОСТ 8429—69) фенол синтетический технический (ГОСТ 236—68) конденсат пара или вода. [c.404]
Бура типическая (ГОСТ 8429—57 ) — тетраборат натрия десятиводный белый кристаллический порошок N328407 ЮН2О. Выпускается бура техническая и пищевая и получается взаимодействием борной кислоты и соды в кипящем растворе. В технической буре должно содержаться тетрабората натрия не менее 49,5% остатка нерастворимого в воде не более 0,3% сернокислого натрия не более 0,5%. Хлористые соли, тяжелые металлы, железо, мышьяк и рассев не нормируются. Применяется бура техническая для производства пятновыводных средств, производства стекла, при пайке и сварке металлов, производстве глазури и эмалей, добавляется в крахмалистые вещества для придания блеска накрахмаленным тканям. Упаковывается в четырехслойные бумажные мешки, вложенные один в другой емкостью по 30—40 кг, а для продажи населению — в двойные бумажные пакеты емкостью по 100 г. [c.209]
Упаковывается в четырехслойные бумажные мешки, вложенные один в другой емкостью по 30—40 кг, а для продажи населению — в двойные бумажные пакеты емкостью по 100 г. [c.209]
Бура техническа я—порошок, крупинки или кристаллы белого цвета. Получают из борной кислоты и соды. [c.105]
Содержащие бор порошки с величиной зерен 160—300 мкм предварительно прокаливают для удаления кристаллизационной воды (карбид бора при температуре 300—400° С, бор технический при 400° С, буру техническую при 600—ТОО С). С уменьшением размеров частиц порошка скорость процесса снижают, так как уменьшается газопроницаемость насыщающей среды. [c.40]
Аценафтен должен быть высшего качества, так как при применении бурого технического препарата образуются смолистые вещества, от которых трудно отделить хинон. Некоторые препараты аценафтена можно использовать, перекристаллизовав их из метилового спирта температура плавления очищенного вещества 94— 95°. [c.83]
[c.83]
Бура техническая, сорт 1………………0,2 [c.56]
Выпускают буру техническую и пищевую. Техническую буру получают при взаимодействии борной кислоты и соды в кипящем растворе. После отделения шлама на фильтре из охлажденного раствора выкристаллизовывается бура, которую отделяют на центрифуге и промывают. Пищевую буру получают путем перекристаллизации технической буры. [c.135]
Бура техническая. . 4,00 Желчь сгущенная. [c.175]
ГОСТ 8429-77. Бура. Технические условия ТУ 484-307-74. Концентрат дистен-силлиманитовый ТУ 2163-00142443823-97. Коагулянт-флокулянт алю-мокремниевый [c.72]
Бура техническая (по ГОСТ 8429—57 ) применяется в качестве флюса для пайки листов стали и медных сплавов и входит как составная часть флюсов при пайке чугуна и нержавеющей стали, а также при пайке серебряным припоем. [c.121]
Нашатырный спирт и бура техническая используются для приготовления казеинового клея.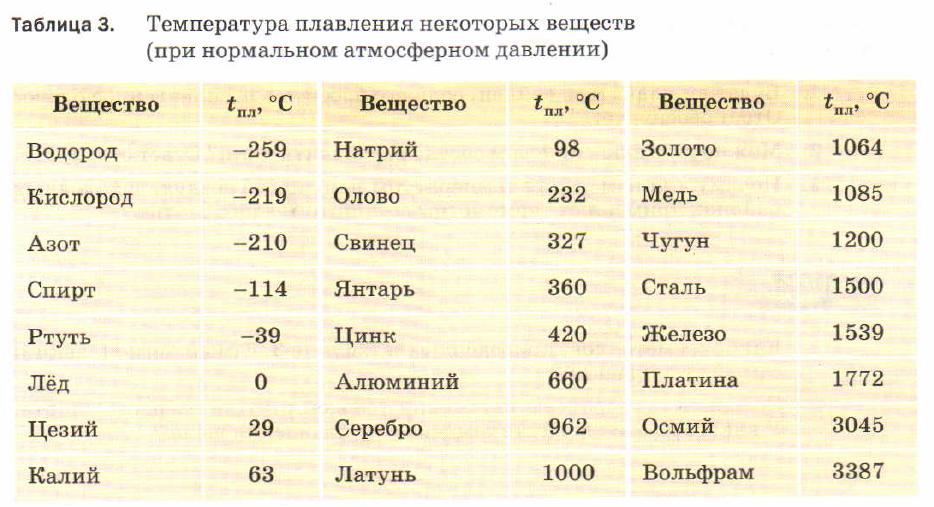 [c.40]
[c.40]
Бура техническая Белый порошок, крупинки или кристаллы. Фракционный состав не норм. ГОСТ 8429-77 Марка А N326407— IOh3O 99,5 Нераств. ост. — 0,04 СО, —0,1 804 — 0,1 РЬ —0,005 As —0,001 Взаимодействие борной кислоты и соды в кипящем растворе В четырехслойных бумажных мешках марки ВМ или ПМ, а также в специализированных мяг- В производстве специальных сортов стекла, эмалей, глазури при пайке и сварке металлов в составе флюсов и при- [c.233]
Бура техническая Марка Б Na2B407 IOh3O 94,0 Нераств. ост. — 0,1 СО2 —0,2 804 — 0,2 РЬ —0,01 Ак —0,001 ких контейнерах в соответствии с научно-технической документацией поев, при волочении проволоки, при изготовлении технического оборудования, сантехнических изделий [c.234]
На Буйском химзаводе разработка и внедреше н Jpм на погрузочно-разгрузочные мби Ш пересмотр но рм и расценок на произ-зодстэо зиднмх продукте для ВАЗа, буры технической, внедрение передевых приемов и методов труда высвободило 11 человек.
 [c.102]
[c.102]БЭКТ, реглон, грамоксон, хлориды натрия и калия, аммиачная селитра, сульфат аммония и другие удобрения, каустическая сода, бура техническая, эндотал, гидразид малеиновой кислоты, аминотриазол, цианамид кальция, эфиры, амиды и соли монохлоруксусной кислоты и многие другие [11, 14, 402—416]. Широко применяются смешанная соль роданида натрия, хлорат магния, хлорат-хлорид кальция, ДНОК, реглон и грамоксон. [c.123]
Буру техническую получают взаимодействием борной кислоты и соды в кипящем водном растворе. Используют для борьбы с бытовыми насекомыми. Буру применяют также в качестве борного удобрения и компонента боросуперфосфата. Выпускают два сорта. [c.112]
Бура (тетраборат натрия) — Титан-ПМ
| Синонимы | Формула | ГОСТ | CAS № |
| Тетраборат натрия 10-водный и 5-водный и безводный Пироборат натрия Боракс плавленый |
Na2B4O7 ·10H2O, Na2B4O7 ·5H2O |
ГОСТ 8429-77 | CAS 1303-96-4 CAS 1330-43-4 (безводный) |
| Синонимы | Тетраборат натрия 10-водный, 5-водный, безводный Пироборат натрия, Боракс плавленый, Бура |
| Международное название | Disodium tetraborate decahydrate, Borax decahydrate, Disodium tetraborate pentahydrate, Borax pentaborate, Borax anhydrous |
| Формула | Na2B4O7 ·10H2O , Na2B4O7 ·5H2O Na2B4O7 |
| Молекулярная масса | 381. 36 (10-водный), 36 (10-водный), 291,35 (5-водный) 201,21 (безводный) |
| ГОСТ/ТУ | ГОСТ 8429-77 |
| CAS | 1303-96-4 1330-43-4 (безводный) |
| EINECS | 215-540-4 |
| RTECS | VZ2275000 |
| Код ТНВЭД | 2840110000 — тетраборат динатрия безводный 2840191000 — пентагидрат тетрабората динатрия 2840199000 — декагидрат тетрабората динатрия |
| Код ГНГ | 28401910 |
| Код ЕТСНГ | 48300 |
Физ.
 -хим. данные
-хим. данныеПлотность: 1,73
Температура плавления: 741ºC
Температура кипения: 1575ºC
Растворимость в воде: 51 г/л
Бура 10-водная
| Наименование показателя | Норма |
| Внешний вид | Белый или бесцветный мелкокристаллический порошок. |
| Массовая доля (Na2B4O7·10H2O), % не менее | 99,90% |
| Массовая доля сульфатов (SO4), %, не более | 0,007 % |
| Содержание B2O3 | 36,47 % |
| Содержание Na2O | 16,48 % |
| Содержание хлоридов (Cl) | 0,005 % |
| Содержание железа (Fe) | 0,001 % |
| Размер частиц | >1 мм: 0,8% макс. <0,075 мм: 4% макс. |
Бура 5-водная Этибор-48
| Наименование показателя | Норма |
| Основного вещества | 99,90% мин. |
| Оксида бора (B2O3) | 47,75 % мин. |
| Оксида натрия: (Na2O) | 21,41 % мин. |
| Сульфатов (SO4) | 70 ppm |
| Хлора (Cl): | 50 ppm |
| Железа (Fe): | 10 ppm |
| Строение: | кристаллы |
| Размер частиц: | более 1 мм: 3% макс. менее 0,075 мм: 4% макс. |
Бура безводная Этибор-68
| Показатель | Норма |
|---|---|
| Оксида бора (B2O3), % масс., не менее | 68,0 |
| Оксида натрия (Na2O), % масс., не менее | 30,27 |
| Сульфатов (SO4), % масс., не более | 0,0200 |
| Хлоридов (Cl), % масс., не более | 0,0105 |
| Железа (Fe), % масс., не более | 0,0150 |
| Нерастворимых в воде веществ, % масс., не более | 0,0920 |
Остаток на сите +1,600 мм, % масс. , не более , не более |
1,00 |
| Остаток на сите -0,075 мм, % масс., не более | 5,00 |
Норма по ГОСТ 8429-77 марка А
| Наименование показателя | Норма по ГОСТ 8429-77 марка А |
| Внешний вид | Белый или бесцветный мелкокристаллический порошок. |
| Массовая доля (Na2B4O7·10H2O), % не менее | 99,5 |
| Массовая доля остатка не растворимого в воде, %, не менее | 0,04 |
| Массовая доля карбонатов, %, не более | 0,1 |
| Массовая доля сульфатов (SO4), %, не более | 0,1 |
| Массовая доля тяжелых металлов (Pb), %, не более | 0,005 |
| Массовая доля мышьяка (As), %, не более | 0,001 |
Упаковка и применение
Внешний вид: Белый или бесцветный мелкокристаллический порошок.
Применение: антисептик и консервант, протрава (предварительная пропитка) для окрашивания тканей, сырье для получения борной кислоты, гербицидов, средств замедления коррозии (ингибиторов), моющих средств (умягчитель воды). Кроме того, бура служит одним из компонентов шихты (исходной смеси веществ) при получении глазурей, стекла и керамики.
Упаковка: по 25 кг., мешки полипропиленовые или многослойные бумажные
Страна производитель: Турция
Бура для пайки
В процессе пайки может применяться множество видов припоя. Каждая из разновидностей обладает своими характеристиками и используется в определенной сфере. Одним из распространенных флюсов является бура, которая встречается при пайке сложных металлов, например, чугуна или меди. Данный вид расходного материала используют не только в крупном производстве, а также для соединения различных деталей в домашней обстановке. Ее можно приобрести в любом магазине по приемлемой цене. Она подходит для различных видов пайки. Бура содержит несколько компонентов, что упрощает процесс пайки. Она не только надежно скрепляет деталей между собой, но и служит для очищения рабочих поверхностей от оксидных налетов и пленок. Данный флюс расплавляется при высоких температурах, что составляет 800°С. Для получения более мягкого и пластичного материала его следует растворить в воде. От этого и будет зависеть температура плавления. Благодаря новейшим разработкам и технологиям, бура для пайки может использоваться в различных сферах. Эти данные, а также метод получения флюса подробно расписано в нормативной документации.
Она подходит для различных видов пайки. Бура содержит несколько компонентов, что упрощает процесс пайки. Она не только надежно скрепляет деталей между собой, но и служит для очищения рабочих поверхностей от оксидных налетов и пленок. Данный флюс расплавляется при высоких температурах, что составляет 800°С. Для получения более мягкого и пластичного материала его следует растворить в воде. От этого и будет зависеть температура плавления. Благодаря новейшим разработкам и технологиям, бура для пайки может использоваться в различных сферах. Эти данные, а также метод получения флюса подробно расписано в нормативной документации.
Достоинства
Преимуществами буры для пайки являются:
- данный флюс подходит для пайки различных металлов;
- широкая доступность;
- низкая стоимость, по сравнению с другими материалами;
- хорошая растворимость в воде, благодаря чему можно образовать необходимую консистенцию;
- длительный срок хранения.
Отрицательные стороны
Среди недостатков специалисты выделяют следующие:
- после окончания пайки на поверхности наблюдается налет, который следует убирать;
- бура должна храниться в месте, защищенном от влаги, в противном случае флюс начнет портиться;
- перед началом пайки необходимо правильно рассчитать количество флюса.

Основные виды
Бура для пайки выпускается в твердом и жидком состоянии. Это главный признак различия между ними. Первый вид поставляется в виде порошка с твердыми частицами белого цвета. Их можно выбрать достаточное количество, необходимое для покрытия всей поверхности металла, при этом гранулы не будут растекаться. Флюс перевозится в специальной герметичной упаковке, которая препятствует попаданию влаги.
Разведенная бура применяется для более легких металлов и их соединений. По химическому составу он ничем не отличается от предыдущего вида, только растворен в воде. Эта особенность позволяет выполнять пайку при низкой температуре. Как правило, она используется при работе с мелкими деталями, например, в ювелирной сфере, так как их можно поместить в емкость с растворимым флюсом перед пайкой, что является очень удобным. Флюс дает одинаковый эффект в любом агрегатном состоянии. Единственным отличием является технология его использования.
В промышленной сфере часто применяют еще одну разновидность – смесь, которая помимо бура содержит еще и другие флюсы. Она применяется, если не удается достичь желаемого результата при помощи одного вещества. Смешивание осуществляется с добавлением борной кислоты.
Она применяется, если не удается достичь желаемого результата при помощи одного вещества. Смешивание осуществляется с добавлением борной кислоты.
Состав бура и его химические свойства
Бура для пайки состоит из двух компонентов: ВаCl и NaСl. Иногда в него добавляют борную кислоту. Флюс не всегда применяют в чистом виде, так как он имеет высокую температуру плавления. Химические свойства он сохраняет независимо от концентрации, поэтому он быстро растворяет окислы и другие налеты, образовавшиеся на поверхности металла. Бура убирает и другие вещества и загрязнения, препятствующих нормальному спаиванию.
Основные характеристики
Бура для пайки производится двух марок: А и Б. Их характеристики и состав нормируется специальными документами. Первая марка применяется для пайки цветных металлов, фаяса и т.д. Второй вид используется для спаивания проводов, сантехнического оборудования, глазурей и т. д.
Единственной общей чертой является состояние бура – мелкий порошок. Процентное содержание флюса, мышьяка, сульфата, карбоната и остальных металлов отличается между собой.
Процентное содержание флюса, мышьяка, сульфата, карбоната и остальных металлов отличается между собой.
Технология пайки
При работе с данным видом флюса следует придерживаться определенного температурного режима, что составляет 400°С. В производственной сфере, часто встречается флюс, смешанный с борной кислотой. Такой материал является универсальным, так как возможно работать при более низких температурных рамках.
Обратите внимание! Воспламененная бура становится прозрачного цвета, похожую на кусочки стекла.
По окончанию пайки на поверхности конструкции образуется белый налет, который следует убирать. Это осуществляется механическим методом. При смешивании флюса с другим веществом придерживают пропорции 1:1. Если компоненты находятся в твердом состоянии, то их измельчают в специальной посуде.
Важно! Емкость и измельчительный инструмент должен быть изготовлен из материала, не способный к впитыванию.
Если бура находится в жидком состоянии, то перед началом пайки ее необходимо нагреть. При температуре 100°С жидкость испаряется, образуя твердый остаток белого цвета. Для повышения активности флюса в нее добавляют ВаCl или NaСl.
При температуре 100°С жидкость испаряется, образуя твердый остаток белого цвета. Для повышения активности флюса в нее добавляют ВаCl или NaСl.
Производители
Бура для пайки является доступным материалом и его можно приобрести в любом магазине. На современном рынке существует множество производителей. Многие специалисты рекомендуют использовать флюс компаний ХимПэк и Хиамен. Он поставляется в герметичных упаковках, в которые не проникает влага, поэтому материал сохраняет свои свойства.
Боракс — Энциклопедия Нового Света
| бура | |
|---|---|
| Общие | |
| Систематическое название | Тетраборат натрия декагидрат |
| Молекулярная формула | Na 2 B 4 O 7 • 10H 2 O |
| Молярная масса | 381,37 г / моль |
| Внешний вид | белое твердое вещество |
| Номер CAS | 1303-96-4 |
| Недвижимость | |
| Плотность и фаза | 1. 73 г / см³, твердый 73 г / см³, твердый |
| Растворимость в воде | 5,1 г / 100 мл (20 ° C) |
| Точка плавления | 75 ° С |
| Температура кипения | 320 ° С |
| Основность (p K b ) | см. Текст |
| Структура | |
| Координация геометрия | ? |
| Кристаллическая структура | Моноклиника |
| Термодинамические характеристики | |
| Стандартная энтальпия образования Δ f H | -3276.75 кДж / моль |
| Стандартная молярная энтропия S | 189,53 Дж · К −1 · моль −1 |
| Опасности | |
| Паспорт безопасности | Внешний паспорт безопасности материала |
| Классификация ЕС | нет в списке |
| NFPA 704 | 0 1 0 |
| Температура вспышки | негорючий |
| Страница дополнительных данных | |
| Строение и свойства | n , ε r и т. Д. Д. |
| Термодинамические данные | Фазовое поведение Твердое, жидкое, газовое |
| Спектральные данные | УФ, ИК, ЯМР, МС |
| Родственные соединения | |
| Анионы прочие | Алюминат натрия натрия галлат |
| Катионы прочие | Тетраборат калия |
| Родственные соединения | Борная кислота натрия перборат |
| Если не указано иное, данные приведены для материалов в их стандартном состоянии (при 25 ° C, 100 кПа) | |
Borax , также называемый боратом натрия , тетраборатом натрия или тетраборатом динатрия , является важным соединением бора, минералом и солью борной кислоты.Обычно это белый порошок, состоящий из мягких бесцветных кристаллов, легко растворяющихся в воде.
Borax имеет множество применений. Он входит в состав многих моющих средств, косметики и эмалевых глазурей. Он также используется для создания буферных растворов в биохимии, в качестве антипирена, противогрибкового соединения для стекловолоконной изоляции, инсектицида, флюса в металлургии и прекурсора для других соединений бора.
Термин бура используется для ряда тесно связанных минералов или химических соединений, которые различаются по содержанию кристаллической воды, но обычно относятся к декагидрату.Коммерчески продаваемая бура обычно частично обезвожена.
Этимология
Происхождение названия восходит к средневековому латинскому borax , которое происходит от арабского buraq , которое происходит от персидского burah [1] или среднеперсидского burak . [2]
событие
Бура встречается в естественных условиях в эвапоритовых отложениях, образовавшихся в результате многократного испарения сезонных озер. Наиболее коммерчески важные месторождения находятся в Турции, Тибете, пустыне Атакама в Чили, недалеко от Бора, Калифорния, и в других местах на юго-западе США.Бура также может быть произведена синтетическим путем из других соединений бора.
Наиболее коммерчески важные месторождения находятся в Турции, Тибете, пустыне Атакама в Чили, недалеко от Бора, Калифорния, и в других местах на юго-западе США.Бура также может быть произведена синтетическим путем из других соединений бора.
Известные характеристики
Структура аниона [B 4 O 5 (OH) 4 ] 2- в буреТермин бура часто используется для ряда близкородственных минералов или химических соединений, которые различаются по содержанию кристаллической воды:
- Бура безводная (Na 2 B 4 O 7 )
- Пентагидрат буры (Na 2 B 4 O 7 • 5H 2 O)
- Декагидрат буры (Na 2 B 4 O 7 • 10H 2 O)
Бура обычно описывается как Na 2 B 4 O 7 • 10H 2 O.Однако его лучше сформулировать как Na 2 [B 4 O 5 (OH) 4 ] • 8H 2 O, поскольку бура содержит [B 4 O 5 (OH) 4 ] 2- ион. В этой структуре присутствуют два четырехкоординированных атома бора (два тетраэдра BO 4 ) и два трехкоординированных атома бора (два треугольника BO 3 ).
В этой структуре присутствуют два четырехкоординированных атома бора (два тетраэдра BO 4 ) и два трехкоординированных атома бора (два треугольника BO 3 ).
Бура также легко превращается в борную кислоту и другие бораты, которые находят множество применений.Если оставить его на сухом воздухе, он медленно теряет гидратационную воду и становится белым и меловым минералом тинкальконитом (Na 2 B 4 O 7 • 5H 2 O).
При сжигании буры образуется яркое оранжевое пламя. Из-за этого его иногда используют для самодельной пиротехники.
использует
Буфер
Борат натрия используется в биохимических и химических лабораториях для приготовления буферных растворов, например для гель-электрофореза ДНК.Он имеет более низкую проводимость, дает более четкие полосы и может работать с более высокими скоростями, чем гели, изготовленные из буфера TBE или буфера TAE (от 5 до 35 В / см по сравнению с 5–10 В / см). При заданном напряжении выделение тепла и, следовательно, температура геля намного ниже, чем при использовании буферов TBE или TAE, поэтому напряжение может быть увеличено для ускорения электрофореза, так что прогон геля занимает лишь часть обычного времени. Последующие приложения, такие как выделение ДНК из среза геля или Саузерн-блот-анализ, работают, как и ожидалось, с гелями бората натрия.Боратные буферы (обычно при pH 8) также используются в качестве предпочтительного уравновешивающего раствора в реакциях сшивания на основе DMP.
При заданном напряжении выделение тепла и, следовательно, температура геля намного ниже, чем при использовании буферов TBE или TAE, поэтому напряжение может быть увеличено для ускорения электрофореза, так что прогон геля занимает лишь часть обычного времени. Последующие приложения, такие как выделение ДНК из среза геля или Саузерн-блот-анализ, работают, как и ожидалось, с гелями бората натрия.Боратные буферы (обычно при pH 8) также используются в качестве предпочтительного уравновешивающего раствора в реакциях сшивания на основе DMP.
Борат лития похож на борат натрия и имеет все его преимущества, но позволяет использовать даже более высокие напряжения из-за более низкой проводимости ионов лития по сравнению с ионами натрия. [3] Однако борат лития намного дороже.
Флюс
Смесь буры и хлорида аммония используется в качестве флюса при сварке чугуна и стали.Он снижает температуру плавления нежелательного оксида железа (окалина) , позволяя ему стекать. Бура также используется в смеси с водой в качестве флюса при пайке ювелирных металлов, таких как золото или серебро. Это позволяет расплавленному припою равномерно течь по рассматриваемому стыку. Бура также является хорошим флюсом для «предварительного лужения» вольфрама цинком, что делает его пригодным для мягкой пайки. [4]
Бура также используется в смеси с водой в качестве флюса при пайке ювелирных металлов, таких как золото или серебро. Это позволяет расплавленному припою равномерно течь по рассматриваемому стыку. Бура также является хорошим флюсом для «предварительного лужения» вольфрама цинком, что делает его пригодным для мягкой пайки. [4]
Пищевая добавка
Borax используется в качестве пищевой добавки в некоторых странах с номером E E285 , но запрещен в Соединенных Штатах.Его использование похоже на соль, и оно присутствует во французской и иранской икре.
Другое применение
- компонент моющих средств
- компонент косметики
- ингредиент эмалевых глазурей
- Стекло, гончарные изделия и керамика
- огнестойкий
- противогрибковый состав для стекловолоконной и целлюлозной изоляции
- компонент слизи
- инсектицид для уничтожения муравьев и блох
- прекурсор моногидрата пербората натрия, который используется в моющих средствах, а также борной кислоты и других боратов
- лечение молочницы в копытах лошади
- используется для изготовления несмываемых чернил для погружных ручек путем растворения шеллака в нагретой боре.

Токсичность
По оценкам, смертельная доза борной кислоты, бората натрия и пербората натрия составляет от 0.От 1 до 0,5 г / кг. [5] Эти вещества токсичны для всех клеток и медленно выводятся через почки. Наибольшая токсичность почек проявляется жировой дегенерацией печени, отеком мозга и гастроэнтеритом. Растворы борной кислоты, используемые для промывания глаз или на истерзанной коже, особенно токсичны для младенцев, особенно после многократного использования из-за медленной скорости ее выведения. [6]
См. Также
Банкноты
- ↑ Dictionary.com, дата обращения 3 сентября 2007 г.
- ↑ Bartleby.com Проверено 3 сентября 2007 г.
- ↑ Цифровой идентификатор объекта (DOI): 10.1016 / j.ab.2004.05.054 Аналитическая биохимия 2004; 333: 1-13. Проверено 3 сентября 2007 года.
- ↑ Цифровой идентификатор объекта (DOI): 10.1119 / 1.1972398 Am. J. Phys. 34, xvi, 1966. Проверено 3 сентября 2007 г.

- ↑ Справочник по отравлениям . Роберт Х. Дрейсбэк. издание восьмое, с.314.
- ↑ Goodman and Gillman’s: The Pharmacological Basis of Therapeutics, 6-е издание
Список литературы
- Фарндон, Джон. Практическая энциклопедия горных пород и минералов: как находить, идентифицировать, собирать и поддерживать лучшие образцы в мире, с более чем 1000 фотографиями и произведениями искусства . Лондон: Lorenz Books, 2006. ISBN 0754815412
- Кляйн, Корнелис и Барбара Датроу. Руководство по минеральным наукам . 23-е изд. Нью-Йорк: Джон Вили, 2007. ISBN 978-0471721574
- Пеллант, Крис. Камни и минералы . Смитсоновские справочники. Нью-Йорк: Дорлинг Киндерсли, 2002. ISBN 07894
- Шаффер, Пол Р., Герберт С. Зим и Раймонд Перлман. Камни, драгоценные камни и минералы . Ред. Ред. Нью-Йорк: St. Martin’s Press, 2001. ISBN 1582381321
- Спирс, Джон Рэндольф и Дуглас В.
 Стиплз. Иллюстрированные зарисовки Долины Смерти и других пустынь Боракс на Тихоокеанском побережье . Американская лэнд-классика. Балтимор: Johns Hopkins University Press, 2001. ISBN 0801865077
Стиплз. Иллюстрированные зарисовки Долины Смерти и других пустынь Боракс на Тихоокеанском побережье . Американская лэнд-классика. Балтимор: Johns Hopkins University Press, 2001. ISBN 0801865077 - Трэвис, Норман Дж. И Э. Дж. Кокс. Тинкальская тропа: история Буры . Лондон: Харрап, 1984.ISBN 0245537988
Внешние ссылки
Все ссылки получены 17 июня 2016 г.
Кредиты
Энциклопедия Нового Света Писатели и редакторы переписали и завершили статью Википедия в соответствии со стандартами New World Encyclopedia . Эта статья соответствует условиям лицензии Creative Commons CC-by-sa 3.0 (CC-by-sa), которая может использоваться и распространяться с указанием авторства. Кредит предоставляется в соответствии с условиями этой лицензии, которая может ссылаться как на участников Энциклопедии Нового Света, , так и на самоотверженных добровольцев Фонда Викимедиа.Чтобы процитировать эту статью, щелкните здесь, чтобы просмотреть список допустимых форматов цитирования. История более ранних публикаций википедистов доступна исследователям здесь:
История более ранних публикаций википедистов доступна исследователям здесь:
История этой статьи с момента ее импорта в New World Encyclopedia :
Примечание. Некоторые ограничения могут применяться к использованию отдельных изображений, на которые распространяется отдельная лицензия.
Бура безводная
Бура безводнаяАльтернативные названия : Кальцинированная бура, обезвоженная бура, пиробор
Примечания
Высококонцентрированный источник оксида бора для глазурей (который также приносит Na 2 O, это борат натрия).Безводная бура получается путем плавления гидратированной буры в стекле и его переточки. Таким образом, он содержит мало или совсем не содержит кристаллизационной воды. Порошок не подвергается регидратации при нормальных условиях сухого хранения. Он до некоторой степени растворим в воде, но значительно хуже, чем сырая бура (таким образом, в водном растворе он может обеспечить медленное выделение бора).
Этот материал не вздувается и не набухает во время плавления (сводит к минимуму потери порошка в печах с сильной тягой) и легче плавится (набухание в других формах может создать пористое состояние с фактором изоляции, который замедляет плавление).Безводная бура является прекрасным стеклообразователем, поскольку в ней очень высокое содержание бора (а сопутствующий натрий представляет собой сильный флюс).
Этот материал используется в качестве источника B 2 O 3 при производстве многих различных типов боросиликатного стекла, включая термостойкие и химически стойкие очки, осветительные очки, оптические линзы, медицинские и косметические контейнеры, полые микросферы и т. Д. стеклянные бусины. Он имеет более высокую насыпную плотность и плавится быстрее, чем сырые формы буры.
Связанная информация
Ссылки
| URL-адреса | http://www.borax.com/pdfs/dist/Profile_Dehybor_Anhydrous_Borax. pdf pdf Лист технических данных Dehybor |
|---|---|
| Минералы | Боратные минералы |
| Материалы | Борная кислота |
| Материалы | Пентагидрат буры |
| Материалы | Бура декагидрат |
| Материалы | Оксид бора |
| Материалы | Тетрагидрат октабората динатрия |
| Опасности | Соединения бора и их токсичность |
| Коды типов | Общий материал Общие материалы — это материалы без торговой марки.Обычно они теоретические, химия показывает, каким был бы образец, если бы в нем не было загрязнений. Общие материалы полезны в образовательных ситуациях, когда студентам необходимо изучать теорию материалов (позже они перейдут к работе с материалами из реального мира).  Они также полезны, когда химический состав фактического материала неизвестен. Часто точность расчетов бывает достаточной при использовании стандартных материалов. Они также полезны, когда химический состав фактического материала неизвестен. Часто точность расчетов бывает достаточной при использовании стандартных материалов. |
| Коды типов | Источник потока Материалы, которые являются источниками Na2O, K2O, Li2O, CaO, MgO и других флюсов, но не являются полевыми шпатами или фриттами.Помните, что материалы могут быть источниками потока, но также выполнять множество других функций. Например, тальк — это флюс в высокотемпературных глазурах, но матирующий агент в низкотемпературных. Также это может быть флюс, наполнитель и усилитель расширения тел. |
Данные
Борат натрия — обзор
3.2 Перборат натрия
Перборат натрия был выделен в 1898 году в результате реакции буры, гидроксида натрия и пероксида водорода ( 3 ), а также электролитически (4 ) .В 1904 году Жобер сообщил о получении пербората натрия из борной кислоты и пероксида натрия с последующей обработкой промежуточного продукта в виде Na 2 B 4 O 8 · 10H 2 O ограниченным количеством соляной кислоты. . В следующем году Брюа и Дюбуа описали получение пербората натрия всеми тремя способами (7) . Они и Жобер охарактеризовали свой продукт как тетрагидрат NaBO 3 · 4H 2 O.Жобер отметил медленное разложение его водного раствора при температуре выше 50 ° C; он определил растворимость при 11, 22 и 32 ° C (5) . Тетрагидрат пербората натрия плавится с разложением примерно при 65 ° C. Тригидрат пербората натрия был впервые описан ван Гелдером в 1956 году. Он был получен кристаллизацией водного раствора тетрагидрата; плавится при 81,7 ° C. Тетрагидрат представляет собой метастабильную форму при температуре выше 15 ° C; ниже этой температуры тригидрат самопроизвольно превращается в тетрагидрат при контакте с водой (155) .Моногидрат пербората натрия представляет собой белый кристаллический порошок без запаха, более легко растворимый в воде, чем тетрагидрат.
. В следующем году Брюа и Дюбуа описали получение пербората натрия всеми тремя способами (7) . Они и Жобер охарактеризовали свой продукт как тетрагидрат NaBO 3 · 4H 2 O.Жобер отметил медленное разложение его водного раствора при температуре выше 50 ° C; он определил растворимость при 11, 22 и 32 ° C (5) . Тетрагидрат пербората натрия плавится с разложением примерно при 65 ° C. Тригидрат пербората натрия был впервые описан ван Гелдером в 1956 году. Он был получен кристаллизацией водного раствора тетрагидрата; плавится при 81,7 ° C. Тетрагидрат представляет собой метастабильную форму при температуре выше 15 ° C; ниже этой температуры тригидрат самопроизвольно превращается в тетрагидрат при контакте с водой (155) .Моногидрат пербората натрия представляет собой белый кристаллический порошок без запаха, более легко растворимый в воде, чем тетрагидрат.
Первая открытая форма пербората натрия долгое время была сформулирована как NaBO 3 · 4H 2 O, иногда записывалась как NaBO 2 · H 2 O 2 · 3H 2 O. Однако, в 1961 году было показано, что перборат-анион является биядерным с двумя мостиковыми пероксидными группами, [B 2 (O 2 ) 2 (OH) 4 ] 2 — (156) ; соль фактически представляет собой гексагидрат Na 2 [B 2 (O 2 ) 2 (OH) 4 ] · 6H 2 O (157,158) .В настоящее время его часто называют гексагидратом пероксобората натрия, но также часто называют тетрагидратом пербората натрия. Также было показано, что так называемый тригидрат содержит бис-μ-пероксобиядерный анион [B 2 (O 2 ) 2 (OH) 4 ] 2- и должен быть сформулирован как тетрагидрат, Na 2 [B 2 (O 2 ) 2 (OH) 4 ] · 4H 2 O. Так называемый моногидрат NaBO 3 · H 2 O снова содержит биядерный анион и должен быть сформулирован в виде Na 2 [B 2 (O 2 ) 2 (OH) 4 ], поэтому на самом деле не является гидратом.
Однако, в 1961 году было показано, что перборат-анион является биядерным с двумя мостиковыми пероксидными группами, [B 2 (O 2 ) 2 (OH) 4 ] 2 — (156) ; соль фактически представляет собой гексагидрат Na 2 [B 2 (O 2 ) 2 (OH) 4 ] · 6H 2 O (157,158) .В настоящее время его часто называют гексагидратом пероксобората натрия, но также часто называют тетрагидратом пербората натрия. Также было показано, что так называемый тригидрат содержит бис-μ-пероксобиядерный анион [B 2 (O 2 ) 2 (OH) 4 ] 2- и должен быть сформулирован как тетрагидрат, Na 2 [B 2 (O 2 ) 2 (OH) 4 ] · 4H 2 O. Так называемый моногидрат NaBO 3 · H 2 O снова содержит биядерный анион и должен быть сформулирован в виде Na 2 [B 2 (O 2 ) 2 (OH) 4 ], поэтому на самом деле не является гидратом. Встречается в двух кристаллических модификациях (157) . Таким образом, пербораты натрия содержат настоящие пероксоанионы, в отличие от большинства перкарбонатов, которые, как подробно описано ниже, на самом деле являются карбонатами с перекисью водорода при кристаллизации.
Встречается в двух кристаллических модификациях (157) . Таким образом, пербораты натрия содержат настоящие пероксоанионы, в отличие от большинства перкарбонатов, которые, как подробно описано ниже, на самом деле являются карбонатами с перекисью водорода при кристаллизации.
Относительное коммерческое значение гекса- (тетра) — и моногидратов заметно изменилось за последние годы — моногидрат имеет значительно более высокое содержание доступного кислорода, чем тетрагидрат / гексагидрат. Содержание активного кислорода в моногидрате (т.е.е., безводный) составляет 16,0%, тригидрата (т.е. тетрагидрата) 11,8% и тетрагидрата (т.е. гексагидрата) 10,4%. Превращение тетрагидрата в моногидрат имеет экономически привлекательное преимущество, заключающееся в значительном увеличении доступного содержания кислорода. Более того, утверждается, что моногидрат имеет более длительный срок хранения и легче растворяется, чем тетра (гекса) гидрат. Тетра (гекса) гидрат можно превратить в моногидрат путем дегидратации в псевдоожиженном слое (159) или, в меньшем масштабе, путем микроволнового нагрева (160) . Непосредственное приготовление и гранулирование моногидрата в промышленном масштабе осуществляется реакцией метабората натрия и пероксида водорода в псевдоожиженном слое на воздухе (161) . Впоследствии этот подход был распространен на производство гранулированных пероксокарбонатов, пероксофосфатов и пероксомоносульфата (162) .
Непосредственное приготовление и гранулирование моногидрата в промышленном масштабе осуществляется реакцией метабората натрия и пероксида водорода в псевдоожиженном слое на воздухе (161) . Впоследствии этот подход был распространен на производство гранулированных пероксокарбонатов, пероксофосфатов и пероксомоносульфата (162) .
Термическое разложение пербората натрия включает дегидратацию и последующее разложение тетра (гекса) гидрата и происходит в три отдельные стадии. Первая стадия, потеря воды с образованием моногидрата, имеет место примерно до 150 ° C; затем разложение происходит в две стадии, до 165 ° C и выше, с образованием метабората натрия (159) .Кинетика этой сложной многоступенчатой реакции была изучена (163) .
Растворимость пербората натрия в воде определялась многими исследователями. Существенное разложение во время установления равновесия твердое тело — раствор, особенно при более высоких температурах, затрудняет точные измерения. Приблизительные оценки, усредненные из различных источников, предполагают растворимость ~ 2 г в 100 г воды при 20 ° C, ~ 3 г в 100 г воды при 25 ° C, ~ 30 г в 100 г воды при 60 ° C.Сравнительно недавнее подробное исследование показало, что растворимость NaBO 3 · 4H 2 O увеличивается с 1,81 при 11,2 ° C до 3,28 при 25 ° C до 4,05 г на 100 г раствора при 30 ° C. Растворимость снижается при добавлении бората натрия, проходя минимум 1,71 г на 100 г раствора в 2,5% (мас. / Мас.) (Мас.%) NaBO 2 , затем увеличивается до 2,22 г на 100 г раствора в 5,5% (мас. w) (мас.%) NaBO 2 , при 25 ° C (164) . Эти результаты разумно согласуются с гораздо более разреженными более ранними данными из 1898 (3) , 1904 (5) , 1949 (14 ) , 1956 (155) , 1986 (165) , 1990 (- 9.От 7 до 29,0 ° C) (166) и 1993 (167) . Две последние процитированные ссылки также документируют эффекты добавленного метабората натрия; последний расширяет исследования различных добавок на растворимость и рост кристаллов.
Приблизительные оценки, усредненные из различных источников, предполагают растворимость ~ 2 г в 100 г воды при 20 ° C, ~ 3 г в 100 г воды при 25 ° C, ~ 30 г в 100 г воды при 60 ° C.Сравнительно недавнее подробное исследование показало, что растворимость NaBO 3 · 4H 2 O увеличивается с 1,81 при 11,2 ° C до 3,28 при 25 ° C до 4,05 г на 100 г раствора при 30 ° C. Растворимость снижается при добавлении бората натрия, проходя минимум 1,71 г на 100 г раствора в 2,5% (мас. / Мас.) (Мас.%) NaBO 2 , затем увеличивается до 2,22 г на 100 г раствора в 5,5% (мас. w) (мас.%) NaBO 2 , при 25 ° C (164) . Эти результаты разумно согласуются с гораздо более разреженными более ранними данными из 1898 (3) , 1904 (5) , 1949 (14 ) , 1956 (155) , 1986 (165) , 1990 (- 9.От 7 до 29,0 ° C) (166) и 1993 (167) . Две последние процитированные ссылки также документируют эффекты добавленного метабората натрия; последний расширяет исследования различных добавок на растворимость и рост кристаллов. PH водных растворов перборатов составляет ∼ 10,1, около этого pH отношение перборатов к пероксиду водорода является максимальным. Таким образом, условия в домашних стиральных машинах, где pH составляет от 9,5 до 10, являются оптимальными в отношении отношения пербората к пероксиду, хотя фактическая концентрация перборатов будет очень низкой (см.Раздел 4.1.2). PH составов для полоскания рта с тартратным или цитратным буфером составляет около 9, где опять же значительная часть пероксогенных форм будет перборатом, но в полости рта (pH слюны около 6,5) перекись водорода будет по существу присутствуют только пероксо виды.
PH водных растворов перборатов составляет ∼ 10,1, около этого pH отношение перборатов к пероксиду водорода является максимальным. Таким образом, условия в домашних стиральных машинах, где pH составляет от 9,5 до 10, являются оптимальными в отношении отношения пербората к пероксиду, хотя фактическая концентрация перборатов будет очень низкой (см.Раздел 4.1.2). PH составов для полоскания рта с тартратным или цитратным буфером составляет около 9, где опять же значительная часть пероксогенных форм будет перборатом, но в полости рта (pH слюны около 6,5) перекись водорода будет по существу присутствуют только пероксо виды.
Перборат натрия нерастворим в большинстве органических растворителей, включая метанол, этанол, изопропанол, t -бутиловый спирт, глицерин, 2-бутоксиэтанол, диметилформамид, ацетонитрил и диоксан.Он умеренно растворим в этиленгликоле и легко растворим в ледяной уксусной кислоте, но в этой среде он медленно реагирует с образованием перуксусной кислоты (168,169) .
Borax — обзор | ScienceDirect Topics
3.2 Перборат натрия
Перборат натрия был выделен в 1898 году в результате реакции буры, гидроксида натрия и перекиси водорода ( 3 ), а также электролитически (4) . В 1904 году Жобер сообщил о получении пербората натрия из борной кислоты и пероксида натрия с последующей обработкой промежуточного продукта в виде Na 2 B 4 O 8 · 10H 2 O ограниченным количеством соляной кислоты. .В следующем году Брюа и Дюбуа описали получение пербората натрия всеми тремя способами (7) . Они и Жобер охарактеризовали свой продукт как тетрагидрат NaBO 3 · 4H 2 О. Жобер отметил медленное разложение его водного раствора при температуре выше примерно 50 ° C; он определил растворимость при 11, 22 и 32 ° C (5) . Тетрагидрат пербората натрия плавится с разложением примерно при 65 ° C. Тригидрат пербората натрия был впервые описан ван Гельдером в 1956 году. Его получали кристаллизацией водного раствора тетрагидрата; плавится при 81,7 ° C. Тетрагидрат представляет собой метастабильную форму при температуре выше 15 ° C; ниже этой температуры тригидрат самопроизвольно превращается в тетрагидрат при контакте с водой (155) . Моногидрат пербората натрия представляет собой белый кристаллический порошок без запаха, более легко растворимый в воде, чем тетрагидрат.
Его получали кристаллизацией водного раствора тетрагидрата; плавится при 81,7 ° C. Тетрагидрат представляет собой метастабильную форму при температуре выше 15 ° C; ниже этой температуры тригидрат самопроизвольно превращается в тетрагидрат при контакте с водой (155) . Моногидрат пербората натрия представляет собой белый кристаллический порошок без запаха, более легко растворимый в воде, чем тетрагидрат.
Первая открытая форма пербората натрия долгое время формулировалась как NaBO 3 · 4H 2 O, иногда записываемая как NaBO 2 · H 2 O 2 · 3H 2 O.Однако в 1961 году было показано, что перборат-анион является биядерным с двумя мостиковыми пероксидными группами: [B 2 (O 2 ) 2 (OH) 4 ] 2 — (156) ; соль фактически представляет собой гексагидрат Na 2 [B 2 (O 2 ) 2 (OH) 4 ] · 6H 2 O (157,158) . В настоящее время его часто называют гексагидратом пероксобората натрия, но также часто называют тетрагидратом пербората натрия.Также было показано, что так называемый тригидрат содержит бис-μ-пероксобиядерный анион [B 2 (O 2 ) 2 (OH) 4 ] 2- и должен быть сформулирован как тетрагидрат, Na 2 [B 2 (O 2 ) 2 (OH) 4 ] · 4H 2 O. Так называемый моногидрат NaBO 3 · H 2 O снова содержит биядерный анион и должен быть сформулирован в виде Na 2 [B 2 (O 2 ) 2 (OH) 4 ], поэтому на самом деле не является гидратом.Встречается в двух кристаллических модификациях (157) . Таким образом, пербораты натрия содержат настоящие пероксоанионы, в отличие от большинства перкарбонатов, которые, как подробно описано ниже, на самом деле являются карбонатами с перекисью водорода при кристаллизации.
В настоящее время его часто называют гексагидратом пероксобората натрия, но также часто называют тетрагидратом пербората натрия.Также было показано, что так называемый тригидрат содержит бис-μ-пероксобиядерный анион [B 2 (O 2 ) 2 (OH) 4 ] 2- и должен быть сформулирован как тетрагидрат, Na 2 [B 2 (O 2 ) 2 (OH) 4 ] · 4H 2 O. Так называемый моногидрат NaBO 3 · H 2 O снова содержит биядерный анион и должен быть сформулирован в виде Na 2 [B 2 (O 2 ) 2 (OH) 4 ], поэтому на самом деле не является гидратом.Встречается в двух кристаллических модификациях (157) . Таким образом, пербораты натрия содержат настоящие пероксоанионы, в отличие от большинства перкарбонатов, которые, как подробно описано ниже, на самом деле являются карбонатами с перекисью водорода при кристаллизации.
Относительное коммерческое значение гекса- (тетра) — и моногидратов заметно изменилось за последние годы — моногидрат имеет значительно более высокое содержание доступного кислорода, чем тетрагидрат / гексагидрат. Содержание активного кислорода в моногидрате (т.е.е., безводный) составляет 16,0%, тригидрата (т.е. тетрагидрата) 11,8% и тетрагидрата (т.е. гексагидрата) 10,4%. Превращение тетрагидрата в моногидрат имеет экономически привлекательное преимущество, заключающееся в значительном увеличении доступного содержания кислорода. Более того, утверждается, что моногидрат имеет более длительный срок хранения и легче растворяется, чем тетра (гекса) гидрат. Тетра (гекса) гидрат можно превратить в моногидрат путем дегидратации в псевдоожиженном слое (159) или, в меньшем масштабе, путем микроволнового нагрева (160) .Непосредственное приготовление и гранулирование моногидрата в промышленном масштабе осуществляется реакцией метабората натрия и пероксида водорода в псевдоожиженном слое на воздухе (161) . Впоследствии этот подход был распространен на производство гранулированных пероксокарбонатов, пероксофосфатов и пероксомоносульфата (162) .
Впоследствии этот подход был распространен на производство гранулированных пероксокарбонатов, пероксофосфатов и пероксомоносульфата (162) .
Термическое разложение пербората натрия включает дегидратацию и последующее разложение тетра (гекса) гидрата и происходит в три отдельные стадии. Первая стадия, потеря воды с образованием моногидрата, имеет место примерно до 150 ° C; затем разложение происходит в две стадии, до 165 ° C и выше, с образованием метабората натрия (159) .Кинетика этой сложной многоступенчатой реакции была изучена (163) .
Растворимость пербората натрия в воде определялась многими исследователями. Существенное разложение во время установления равновесия твердое тело — раствор, особенно при более высоких температурах, затрудняет точные измерения. Приблизительные оценки, усредненные из различных источников, предполагают растворимость ~ 2 г в 100 г воды при 20 ° C, ~ 3 г в 100 г воды при 25 ° C, ~ 30 г в 100 г воды при 60 ° C. Сравнительно недавнее подробное исследование показало, что растворимость NaBO 3 · 4H 2 O увеличивается с 1,81 при 11,2 ° C до 3,28 при 25 ° C до 4,05 г на 100 г раствора при 30 ° C. Растворимость снижается при добавлении бората натрия, проходя минимум 1,71 г на 100 г раствора в 2,5% (мас. / Мас.) (Мас.%) NaBO 2 , затем увеличивается до 2,22 г на 100 г раствора в 5,5% (мас. w) (мас.%) NaBO 2 , при 25 ° C (164) . Эти результаты разумно согласуются с гораздо более разреженными более ранними данными из 1898 (3) , 1904 (5) , 1949 (14 ) , 1956 (155) , 1986 (165) , 1990 (- 9.От 7 до 29,0 ° C) (166) и 1993 (167) . Две последние процитированные ссылки также документируют эффекты добавленного метабората натрия; последний расширяет исследования различных добавок на растворимость и рост кристаллов. PH водных растворов перборатов составляет ∼ 10,1, около этого pH отношение перборатов к пероксиду водорода является максимальным.
Сравнительно недавнее подробное исследование показало, что растворимость NaBO 3 · 4H 2 O увеличивается с 1,81 при 11,2 ° C до 3,28 при 25 ° C до 4,05 г на 100 г раствора при 30 ° C. Растворимость снижается при добавлении бората натрия, проходя минимум 1,71 г на 100 г раствора в 2,5% (мас. / Мас.) (Мас.%) NaBO 2 , затем увеличивается до 2,22 г на 100 г раствора в 5,5% (мас. w) (мас.%) NaBO 2 , при 25 ° C (164) . Эти результаты разумно согласуются с гораздо более разреженными более ранними данными из 1898 (3) , 1904 (5) , 1949 (14 ) , 1956 (155) , 1986 (165) , 1990 (- 9.От 7 до 29,0 ° C) (166) и 1993 (167) . Две последние процитированные ссылки также документируют эффекты добавленного метабората натрия; последний расширяет исследования различных добавок на растворимость и рост кристаллов. PH водных растворов перборатов составляет ∼ 10,1, около этого pH отношение перборатов к пероксиду водорода является максимальным. Таким образом, условия в домашних стиральных машинах, где pH составляет от 9,5 до 10, являются оптимальными в отношении отношения пербората к пероксиду, хотя фактическая концентрация перборатов будет очень низкой (см.Раздел 4.1.2). PH составов для полоскания рта с тартратным или цитратным буфером составляет около 9, где опять же значительная часть пероксогенных форм будет перборатом, но в полости рта (pH слюны около 6,5) перекись водорода будет по существу присутствуют только пероксо виды.
Таким образом, условия в домашних стиральных машинах, где pH составляет от 9,5 до 10, являются оптимальными в отношении отношения пербората к пероксиду, хотя фактическая концентрация перборатов будет очень низкой (см.Раздел 4.1.2). PH составов для полоскания рта с тартратным или цитратным буфером составляет около 9, где опять же значительная часть пероксогенных форм будет перборатом, но в полости рта (pH слюны около 6,5) перекись водорода будет по существу присутствуют только пероксо виды.
Перборат натрия нерастворим в большинстве органических растворителей, включая метанол, этанол, изопропанол, t -бутиловый спирт, глицерин, 2-бутоксиэтанол, диметилформамид, ацетонитрил и диоксан.Он умеренно растворим в этиленгликоле и легко растворим в ледяной уксусной кислоте, но в этой среде он медленно реагирует с образованием перуксусной кислоты (168,169) .
Введение, формула, структура, свойства и применение
×
Извините !, эта страница сейчас недоступна для добавления в закладки.
Мы используем буру для очистки с давних времен.Он был впервые обнаружен на дне высохших озер в Тибете и оставался единственным его источником до 1776 года, затем Италия стала его основным источником до 1860-х годов. В 1889 году в Долине Смерти, Калифорния, США, была основана знаменитая компания по производству буры, состоящей из 20 упряжных мулов. Она долгое время правила рынком буры.
СМОТРЕТЬ БОЛЬШЕ
Что такое бура?
Бура — природный минерал и соль борной кислоты.Он также известен как борат натрия, тетраборат натрия или тетраборат динатрия. Это важное соединение бора. Несколько близкородственных минералов, которые различаются по содержанию кристаллической воды, такие как декагидратные, пентагидратные и октагидратные соли, также называются бурами. Даже его безводная форма также называется бура.
Даже его безводная форма также называется бура.
Формула буры — Как мы знаем, термин бура используется для обозначения многих близкородственных кристаллов. Таким образом, он имеет различные формулы в зависимости от его кристаллизационной воды —
Название IUPAC | Формула | |
Тетраборат натрия (безводный) | 4Пентагидрат тетрабората натрия | Na2B4O7 · 5h3O |
Октагидрат тетрабората натрия | Na2 [B4O5 (OH) 4] · 8h3O7 | 926 9 декартов натрия10h3O |
Структура буры (изображение скоро будет обновлено)
Свойства буры
Физические свойства буры —
Его молярная масса составляет 202,22 (безводный) и 381,38 (декагидрат).

Это твердое вещество белого цвета.
Его плотность составляет 2,4 г / см3 (безводный) и 1,73 г / см3 (декагидрат).
Его температура плавления составляет 743 ℃ (безводный) и 75 ℃ (декагидрат).
Растворим в воде.
Его температура кипения составляет 1575 ℃ (безводный).
Химические свойства буры —
Na2B4O7 · 10h3O + 2HCl → 4B (OH) 3 + 2NaCl + 5h3O
Горючий материал с желто-зеленым пламенем.
Хорошо растворяется в этиленгликоле и слабо растворяется в ацетоне.
Реакция с гидроксидом натрия —
Na2B4O7 + 7h3O + 2NaOH 🡪 4Na [B (OH) 4]
Появление буры
Бура образует естественные отложения в сезонных озерах в результате их многократного испарения. Чаще всего он встречается в Турции, Борон (Калифорния), озере Сирлс, на юго-западе США, в пустыне Атакама в Чили, Боливии, Тибете и Румынии и т.д.
Чаще всего он встречается в Турции, Борон (Калифорния), озере Сирлс, на юго-западе США, в пустыне Атакама в Чили, Боливии, Тибете и Румынии и т.д.
В качестве чистящего средства — Различные свойства буры помогают повысить ее очищающую способность. Он превращает воду в перекись водорода во время очистки. Он очень простой, поэтому он делает горячую воду основной, что повышает эффективность отбеливателя или других чистящих средств.
Как убийца насекомых — бура останавливает метаболические процессы многих организмов. Это свойство буры делает ее лучшим дезинфицирующим средством.
Используется в тесте на сахарный диабет.
Используется в качестве смягчителя воды.
Для сварки чугуна и стали в качестве флюса используется смесь буры и хлорида аммония.

Borax Formula
Borax, также известный как тетраборат натрия или борат натрия, представляет собой минеральную и неорганическую соль, широко используемую в качестве ингредиентов в средствах для стирки и чистки.
Формула и структура: Бура бывает безводной, пентагидратной или декагидратной. Наиболее распространены безводная и декагидратная формы. Химическая формула декагидрата буры: Na 2 B 4 O 7 .10H 2 O (также обозначается как Na 2 [B 4 O 5 (OH) 4 ] · 8H 2 O) и его молекулярная формула H 20 B 4 Na 2 O 17 . Молярная масса безводного буры составляет 201.22 г моль -1 , а молярная масса декагидратной соли составляет 381,38 г моль -1 . Декагидрат буры представляет собой комплекс, образованный ионом [B 4 O 5 (OH) 4 ] -2 , который имеет 4 атома бора, координированных с 7 атомами кислорода и образующий бициклическую структуру. Химические структуры безводной (плоской и трехмерной) и декагидрированной соли можно записать следующим образом:
Химические структуры безводной (плоской и трехмерной) и декагидрированной соли можно записать следующим образом:
Происшествие: Бура может быть найдена в отложениях высохших озер в Калифорнии, США и Турции.Кроме того, эти озера также содержат другие боратные минералы, которые можно обрабатывать для получения буры.
Приготовление: Бура в основном добывается из природных источников. Следовательно, существует несколько промышленных процессов для его получения синтетическими способами. Другой важный источник буры — это боратные минералы, обнаруженные в тех же озерах, что и бура. Бура и родственные ей боратные минералы очищаются перекристаллизацией.
Физические свойства: Бура представляет собой белый кристаллический порошок. Его температуры плавления и кипения составляют 75 ºC и 320 ºC соответственно.Плотность буры 1,73 г / мл -1 . Хорошо растворяется в воде.
Химические свойства: Бура в воде образует щелочные растворы. В кислотном растворе бура реагирует с образованием других боратов, таких как перборат натрия (PBS), соединение, широко используемое в химической промышленности. Также может образовывать борную кислоту:
В кислотном растворе бура реагирует с образованием других боратов, таких как перборат натрия (PBS), соединение, широко используемое в химической промышленности. Также может образовывать борную кислоту:
Na 2 B 4 O 7 · 10H 2 O + 2 HCl → 4 H 3 BO 3 + 2 Na + + 2 Cl — + 5 H 2 O
Использование: Бура широко используется в химической, пищевой и фармацевтической промышленности.Бура используется как противогрибковая добавка в медицине и пищевой промышленности; он также используется в этих отраслях для приготовления буферного раствора для регулирования pH продуктов. Он широко используется в составе многих моющих, стиральных и чистящих средств. Бура является альтернативой использованию ртути в золотодобыче, а также используется для улавливания нейтронов в ядерных реакторах.
Воздействие на здоровье / опасность для здоровья: Бура не токсична при проглатывании и не вызывает раздражения. Тем не менее, некоторые исследования проводятся, чтобы показать его возможные канцерогенные эффекты и риск нарушения фертильности и беременности.Он не горюч и не вступает в реакцию с другими химическими соединениями.
Тем не менее, некоторые исследования проводятся, чтобы показать его возможные канцерогенные эффекты и риск нарушения фертильности и беременности.Он не горюч и не вступает в реакцию с другими химическими соединениями.




 Стиплз. Иллюстрированные зарисовки Долины Смерти и других пустынь Боракс на Тихоокеанском побережье . Американская лэнд-классика. Балтимор: Johns Hopkins University Press, 2001. ISBN 0801865077
Стиплз. Иллюстрированные зарисовки Долины Смерти и других пустынь Боракс на Тихоокеанском побережье . Американская лэнд-классика. Балтимор: Johns Hopkins University Press, 2001. ISBN 0801865077


 Затем есть трифторид — помните, что кислоты сначала были классифицированы как вещества, которые могут давать протоны, но BF 3 — это архетипическая кислота Льюиса, у которой нет протона в поле зрения, но она способна координироваться с неподеленными парами, что позволяет это катализировать множество реакций.Он может достичь этой химии, потому что у бора действительно есть две стороны — он настроен на образование 3 связей с соседними атомами, но даже в этом состоянии легко образует дополнительную связь, чтобы завершить основную оболочку 2 nd . 8 электронов. но когда он это делает, он приобретает отрицательный заряд и может восстановить нейтралитет, только потеряв одну из своих связей — у него действительно есть раздвоение личности.
Затем есть трифторид — помните, что кислоты сначала были классифицированы как вещества, которые могут давать протоны, но BF 3 — это архетипическая кислота Льюиса, у которой нет протона в поле зрения, но она способна координироваться с неподеленными парами, что позволяет это катализировать множество реакций.Он может достичь этой химии, потому что у бора действительно есть две стороны — он настроен на образование 3 связей с соседними атомами, но даже в этом состоянии легко образует дополнительную связь, чтобы завершить основную оболочку 2 nd . 8 электронов. но когда он это делает, он приобретает отрицательный заряд и может восстановить нейтралитет, только потеряв одну из своих связей — у него действительно есть раздвоение личности. Но на этом этапе мы просто посмотрим, как шизофреническая сторона бора может быть использована для хорошего эффекта — добавьте BH 3 к алкену, затем добавьте немного щелочной перекиси водорода, и кислород сначала присоединится к бору, а затем улетит. на соседний углерод, все благодаря этому балансу между 3- и 4-валентным бором. Эта довольно сложная реакция (механически) очень надежна и уже несколько десятилетий используется как простой способ превращения алкенов в спирты.Основываясь на этой идее, существует множество хитроумных вариантов, позволяющих вводить спирт очень избирательно, включая мой любимый реагент, полученный при взаимодействии борана с циклоокта-1,5-диеном; Получающийся в результате диалкилборан невероятно селективен при атаке только наименее замещенного углерода алкена, и его часто схематично сокращают до единицы BH, свисающей с двух дуг, что привело к его прозвищу молекула парашюта.
Но на этом этапе мы просто посмотрим, как шизофреническая сторона бора может быть использована для хорошего эффекта — добавьте BH 3 к алкену, затем добавьте немного щелочной перекиси водорода, и кислород сначала присоединится к бору, а затем улетит. на соседний углерод, все благодаря этому балансу между 3- и 4-валентным бором. Эта довольно сложная реакция (механически) очень надежна и уже несколько десятилетий используется как простой способ превращения алкенов в спирты.Основываясь на этой идее, существует множество хитроумных вариантов, позволяющих вводить спирт очень избирательно, включая мой любимый реагент, полученный при взаимодействии борана с циклоокта-1,5-диеном; Получающийся в результате диалкилборан невероятно селективен при атаке только наименее замещенного углерода алкена, и его часто схематично сокращают до единицы BH, свисающей с двух дуг, что привело к его прозвищу молекула парашюта. См, только для того, чтобы обнаружить, что он меняется с 0 до 60 в 3.5 секунд. Позвольте мне объяснить — название бор происходит от минерала бура, который является солью действительно скучной кислоты, называемой борной кислотой. Вы можете купить его у любого фармацевта, это слабокислый антисептик, и он по существу содержит атом бора, присоединенный к трем ОН-группам. И вот сюрприз — вы можете довольно легко заменить один ОН на арильную группу, и вы получите арилбороновую кислоту, способную связываться с целым рядом арилгалогенидов с использованием палладиевого катализа. Это был долгожданный процесс, который многие считали невозможным с высоким выходом, пока химик по имени Сузуки (отсюда и связь с мотоциклами) не обнаружил, что бор может решить эту проблему.
См, только для того, чтобы обнаружить, что он меняется с 0 до 60 в 3.5 секунд. Позвольте мне объяснить — название бор происходит от минерала бура, который является солью действительно скучной кислоты, называемой борной кислотой. Вы можете купить его у любого фармацевта, это слабокислый антисептик, и он по существу содержит атом бора, присоединенный к трем ОН-группам. И вот сюрприз — вы можете довольно легко заменить один ОН на арильную группу, и вы получите арилбороновую кислоту, способную связываться с целым рядом арилгалогенидов с использованием палладиевого катализа. Это был долгожданный процесс, который многие считали невозможным с высоким выходом, пока химик по имени Сузуки (отсюда и связь с мотоциклами) не обнаружил, что бор может решить эту проблему. А затем в одной из историй типа «Просто Уильям», когда мальчик побеждает старших, Кристофер Лонге-Хиггинс, тогда студент Кембриджа, придумал решение во время учебного курса, опубликовав знаменательную статью со своим наставником. пока еще только 20.Их объяснение также предсказало несколько новых гидридов бора, которые были должным образом открыты, а также увлекательную область химии кластеров бора, в которой трех / четырехвалентная шизофрения бора допускает обмен партнерами и множественные связи. но я не буду вдаваться в подробности — вам придется выяснить это сами. Но помните, не судите элементы только по их первому появлению — в них могут быть скрытые секреты и неожиданные таланты.
А затем в одной из историй типа «Просто Уильям», когда мальчик побеждает старших, Кристофер Лонге-Хиггинс, тогда студент Кембриджа, придумал решение во время учебного курса, опубликовав знаменательную статью со своим наставником. пока еще только 20.Их объяснение также предсказало несколько новых гидридов бора, которые были должным образом открыты, а также увлекательную область химии кластеров бора, в которой трех / четырехвалентная шизофрения бора допускает обмен партнерами и множественные связи. но я не буду вдаваться в подробности — вам придется выяснить это сами. Но помните, не судите элементы только по их первому появлению — в них могут быть скрытые секреты и неожиданные таланты.