температура плавления и кипения, добыча, месторождения, марки, масса
Раньше олово как чистый металл не был знаком человечеству. Оно использовалось в сплаве со свинцом, соединение которых образовывало оловянистую бронзу. Сейчас этот легкий металл применяется в разных сферах промышленности. Температура плавления олова позволяет эффективно использовать его для изготовления припоев.
Краткое описание
Олово — химический элемент, который в таблице Менделеева находится в группе легких металлов под номером 50. Это пластичный, ковкий материал, с естественным металлическим блеском.
Структура и характеристики
Аллотропные модификации:
- b-Sn — стандартное белое. Имеет объемноцентрированную тетрагональную кристаллическую решетку.
- a-Sn — серое олово. Имеет гранецентрированную кубическую кристаллическую решетку.
Чистый металл может рассыпаться в порошок при низких температурах, но этот процесс замедляется при наличии примесей в составе.
История открытия и изучения
По археологическим находкам ученые смогли установить, что с оловом человечество познакомилось еще в 4 тысячелетии до н. э. Письменные напоминания об этом металле можно встретить в Четвертой Книге Моисея, Библии.
Сначала олово было малодоступным. Его можно было встретить только у правителей, полководцев, богатых граждан, купцов. Он был главным компонентом оловянистой бронзы, которая появилась в середине 3 тысячелетия до н. э. Тогда бронза считалась самым прочным сплавом. Компоненты для его изготовления имели исключительную ценность в период «бронзового века».
Олово руда (Фото: Instagram / ferroprofi)Отдельно от примесей, чистый металл было получено в 12 веке. Его упоминания есть в работах Р. Бэкона.
Получение из руды и месторождения
Процесс получения сплава зависит от того, в какой форме его нашли. Олово в виде руды не имеет значительных отличий от производства других цветных металлов.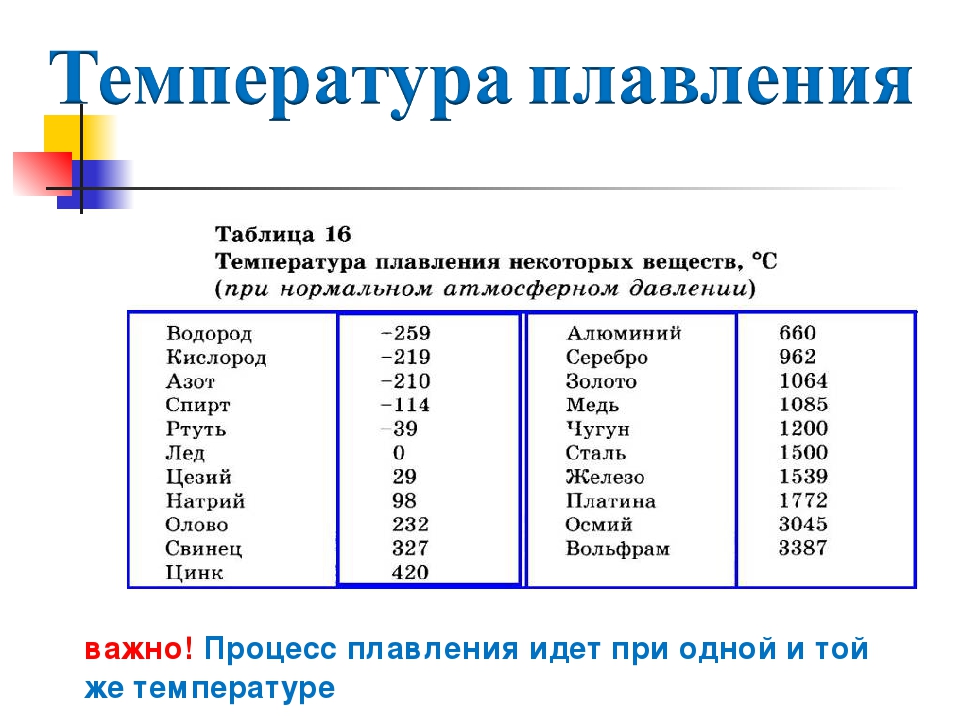 Процесс состоит из трех этапов:
Процесс состоит из трех этапов:
- Добыча, обработка расходного сырья (руды).
- Восстановительная плавка для получения чернового металла.
- Рафинирование подготовленного сырья допустимыми способами.
Разработка россыпных месторождений осуществляется с помощью промышленных песковых насосов.
Промышленное получение
Существует две технологии промышленного получения олова:
- Восстановительная плавка. Для проведения этой технологии применяется 2 типа аппаратов — отражательные печи, шахтное оборудование для плавки.
- Рафинирование. Бывает термическим, электролитическим.
Марки
Марки:
- О1, О1пч. Это обозначение указывает на то, что в сплаве содержится 99,9% Sn. Изготавливается в виде проволоки, прутков, чушек.
- ОВЧ-000. Сплав высокой чистоты. Содержание Sn в составе — 99,99%. Изготавливается в виде прутков, чушек.
- О2. Содержание Sn в составе — 99,565%. Производится в виде прутков, проволоки, чушек.

- О3. Сплав содержит 98,49% Sn. Изготавливается чушками.
- О4. Самое «грязное» соединение. Содержит большое количество сторонних примесей. Их примерное количество — 3,5% от общей массы.
Оловянные прутки (Фото: Instagram / ferroprofi)Маркировка указывается на готовых изделиях с помощью штампа.
Свойства
Чтобы понять, где лучше применять олово, нужно знать характеристики, свойства химического элемента.
Химические
Олово — химический элемент периодической таблицы Менделеева с атомным номером 50. Оно относится к группе легких металлов. Химические свойства:
- Электроотрицательность — 1,8.
- Температура плавления — 231°C.
- Температура кипения — 2630°C.
- Плотность — 7300 кг/м³.
- Атомная масса химического элемента — 118,71.
- Теплоемкость — 0,226 кДж/(кг·°С).
Олово инертно к воздействию воды, воздуха, если в помещении комнатная температура. На поверхности заготовки, которая находится на открытом воздухе, образуется оксидная пленка, защищающая металл от окисления, образования ржавчины.
Физические
Свойства:
- Плотность — 7,31 г/см3.
- Металлический блеск — есть.
- Прозрачность —нет.
- Цвет — серо-белый.
- Спайность — нет.
- Прочность — ковкий металл.
- Твердость — до 2 по шкале Мооса.
- Высокая электропроводность.
Белое олово является парамагнетиком, а серое диамагнетиком.
Сковорода из белого олова (Фото: Instagram / artprohome)Оптические
Свойства:
- Умеренная анизотропия.
- Не плеохроирует.
- Тип металла — изотропный.
- Олово не флуоресцентный материал.
Кристаллографические
Свойства:
- Тетрагональная сингония.
- Пространственная группа металла — I 41/amd.
- Точечная группа — 4/mmm.
Типы
Виды олова для пайки:
- ПОС-18. Содержит несколько основных компонентов — олово (18%), свинец (около 81), сурьму (2,5%). Применяется при лужении металлов. Подходит для создания швов при низких стандартах.
 Температура плавления — 270°C.
Температура плавления — 270°C. - ПОС-30. Содержит олово (28%), свинец (около 70%), сурьму (2%). Применяется для пайки меди, стали, латуни. Температура плавления — 270°C.
- ПОС-50. Содержит олово (50%), свинец (около 50%), сурьму (0,8%). Применяется для спаивания радиодеталей, получения высокого качества шва. Температура плавления — 230°С.
- ПОС-90. Содержит олово (90%), свинец (9–10%), сурьму (0,15%).
Отдельные виды оловянных припоев — ПОС-40, ПОС-60. Применяются для пайки радиодеталей.
Пайка радиодеталей (Фото: Instagram / remont_pc_gelendzhik)Сферы применения
Сферы применения:
- Защита металлических поверхностей. Применяется в виде специального покрытия. Оно не выделяет вредных веществ при эксплуатации, устойчиво к образованию ржавчины.
- Изготовление белой жести (второе название луженое железо). Используется для производства дымовых труб, тары для хранения пищевых продуктов, подшипников.
- Производство сантехники, запорной арматуры, фурнитуры.

- Изготовление сплавов.
- Производство припоев.
- Изготовление ограждений, лестничных перил.
- Производство скульптур, скамеек, вешалок, светильников для украшения интерьера.
Больше 50% добытого металла применяется для получения белой жести, предметов из стали с дополнительным защитным покрытием.
Преимущества и недостатки
Преимущества:
- Пластичность. Из олова изготавливают сложные изделия для украшения интерьера.
- Инертность. Металл применяется в пищевой промышленности для изготовления посуды, тар для хранения продуктов.
- Низкая температура плавления. Олово используется для нанесения на металлические детали в виде защитного покрытия.
Недостатки:
- Низкий показатель прочности. Сплав не подходит для изготовления деталей, которые будут подвергаться большим нагрузкам.
- Редкость. Из-за этого увеличивается цена на материал.
Сплавы
Сплавы:
- баббиты;
- пьютер;
- бронза.

Отдельная группа — припои с разными характеристиками.
Олово — редкий металл. Благодаря своим химическим, физическим особенностям оно применяется во многих сферах деятельности. Наиболее популярное направление — изготовление припоев для пайки других металлов, сплавов.
Температура — плавление — олово
Температура — плавление — олово
Cтраница 4
Гомогенное освинцовывание является более дорогим, но более надежным способом покрытия свинцом п применяется для защиты обогреваемых аппаратов и аппаратов, работающих при вакууме По этому способу слой свинца наплавляется на луженую поверхность металла. Освинцовываемая поверхность, предварительно очищенная от ржавчины и грязи, подвергается травлению соляной кислотой, затем нагревается до температуры плавления олова. Луженую поверхность нагревают до температуры плавления свинца и наносят на нее металл, расплавленный в пламени водородной горелки.
[46]
Луженую поверхность нагревают до температуры плавления свинца и наносят на нее металл, расплавленный в пламени водородной горелки.
[46]
Однако потребителю часто важен не источник информации, а краткий и точный ответ на возникший вопрос типа: Какова температура плавления олова. На информационные запросы такого типа отвечают фактографические И. [47]
Кроме того, ампулы можно применять неоднократно. При концентрировании примесей в олове более удобно пользоваться бромидом олова, чем хлоридом, так как температура плавления бромида ниже температуры плавления олова. В этом случае олово кристаллизуется внутри жидкой оболочки бромида олова, покрывающей вращающийся контейнер. Форма слитка повторяет форму контейнера. Последний торец слитка плоский, в то время как при кристаллизации олова в хлориде он получается зауженным. Процесс концентрирования проводится при температуре 500 С.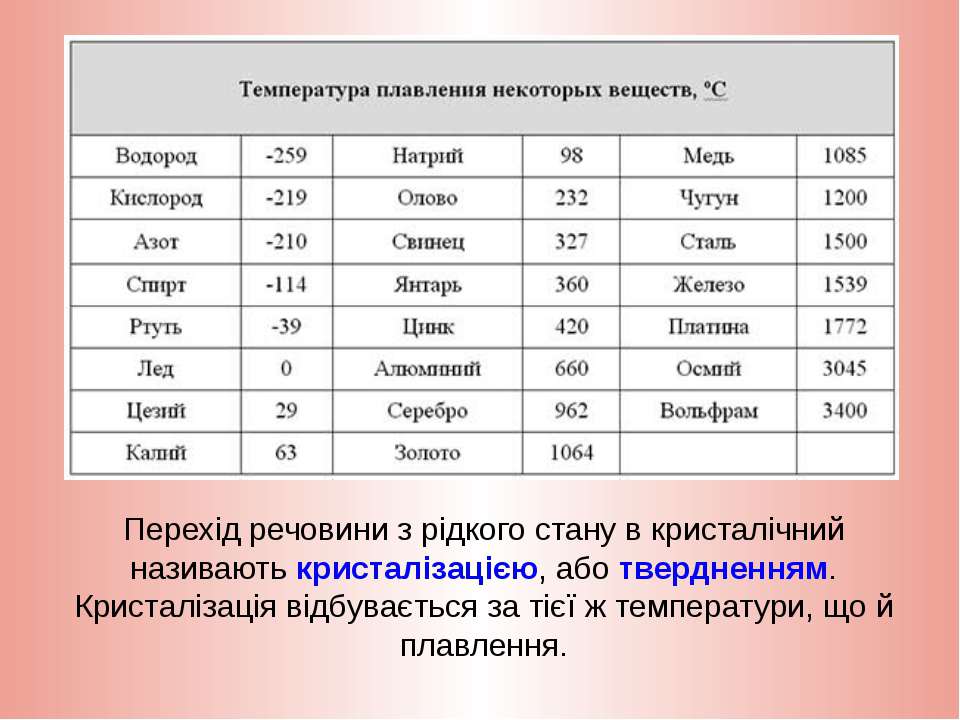 SnCb, используемые в качестве экстрагента, подвергаются предварительной глубокой очистке зонной плавкой.
[48]
SnCb, используемые в качестве экстрагента, подвергаются предварительной глубокой очистке зонной плавкой.
[48]
Исследованиями последних лет установлено, что это явление обусловлено присутствием в олове примесей, которые образуют с оловом эвтектики или твердые растворы, плавящиеся при температурах ниже точки плавления олова. Для олова чистотой 99 99 % кривая изменения твердости по Бринелю с температурой идет совершенно плавно и не обнаруживает никаких перегибов вплоть до температуры плавления олова. [49]
Требования к защитным покрытиям в отношении их способности сопротивляться резким сменам температур являются, большей частью, весьма жесткими. Бытовые силикатные эмали, например, считаются выдержавшими испытания, если они не отскакивают от изделия при однократном резком охлаждении от 232 С (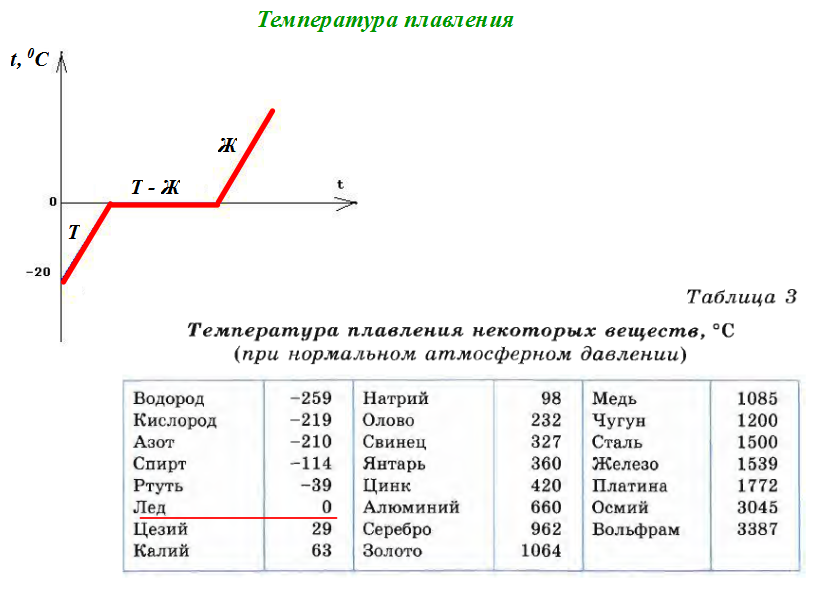 [50]
[50]
Опубликовано несколько исследований о влиянии давления на температуру плавления олова. Зависимость температуры плавления олова от внешнего давления характеризуют приведенные ниже цифры. [51]
Поэтому в современных закрытых предохранителях с медными вставками применяют искусственные методы снижения температуры плавления вставок. Наиболее простым и рациональным способом является нанесение на проволочки плавкой вставки металлического растворителя в виде напаянных на них небольших шариков из олова или свинца. При нагреве плавкой вставки до температуры плавления олова или свинца на проволочках вставки образуются капельки расплавленного олова или свинца. Расплавленное олово или свинец растворяют в себе более тугоплавкий металл вставки ( медь, латунь, серебро), в результате чего вставка в месте нанесения шариков разрушается и разрывается. Образующаяся в месте разрыва дуга расплавляет вставку по всей ее длине.
Для улучшения характеристики предохранителя ПН в центре каждой ленточки ( в перешейке между выштампснван-ными отверстиями) вставки наплавлен оловянный шарик. Оловянный шарик предназначен для снижения температуры плавления элементов плавкой вставки предохранителя. При агреве плавкой вставки до температуры плавления олова шар
| ЗАДАЧНИК ОНЛ@ЙН БИБЛИОТЕКА 1 БИБЛИОТЕКА 2 | Удельная теплота плавления. Удельная теплота парообразования (испарения). Критические параметры некоторых веществ. Удельная теплота сгорания.Удельная теплота плавления металлов
Удельная теплота плавления некоторых веществ (при нормальном атмосферном давлении)
Изменение объемов веществ при их плавленииВ таблице укзан объем жидкости V
Большинство веществ при переходе из твердого состояния
в жидкое увеличивает свой объем. Удельная теплота испарения (парообразования) воды при различной температуре | ||||
t, oC | Удельная теплота испарения | t, oC | Удельная теплота испарения | ||
кДж/кг | калл/кг | кДж/кг | калл/кг | ||
| 0 | 2501 | 597 | 80 | 2308 | 551 |
| 5 | 2489 | 594 | 100 | 2256 | 539 |
| 10 | 2477 | 592 | 160 | 2083 | 497 |
| 15 | 2466 | 589 | 200 | 1941 | 464 |
| 18 | 2458 | 587 | 300 | 1404 | 335 |
| 20 | 2453 | 370 | 438 | 105 | |
| 30 | 2430 | 580 | 374 | 115 | 27 |
| 50 | 2382 | 569 | 374,15* | 0 | 0 |
* При температуре 374,15 oC и давлении
22,13 Па (225,64 ат) вода находится в критическом состоянии. В этом состоянии
жидкость и ее насыщенный пар обладают одиноковыми свойствами — разница между
водой и ее насыщенным паром исчезает.
В этом состоянии
жидкость и ее насыщенный пар обладают одиноковыми свойствами — разница между
водой и ее насыщенным паром исчезает.
Изменение объемов жидкостей при испарении и газов (паров) при конденсации
Испаряющаяся жидкость | Vг, л | Конденсирующийся газ (пар) | Vж, л |
| Азот | 716 | Азот | 1,42 |
| Вода (при ) | 1780 | Водяной пар | 0,737 |
| Воздух | 749 | Воздух | 1,38 |
| Гелий | 774 | Гелий | 1,31 |
| Кислород | 886 | Кислород | 1,15 |
| Метан | 656 | Метан | 1,55 |
В таблице указан объем газа (пара), образующегося при
испарении 1л жидкости, взятой при температу ре 20 oС и нормальном
атмосферном давлении, а также объем жидкости образующейся при конденсации 1
м3 газа (пара).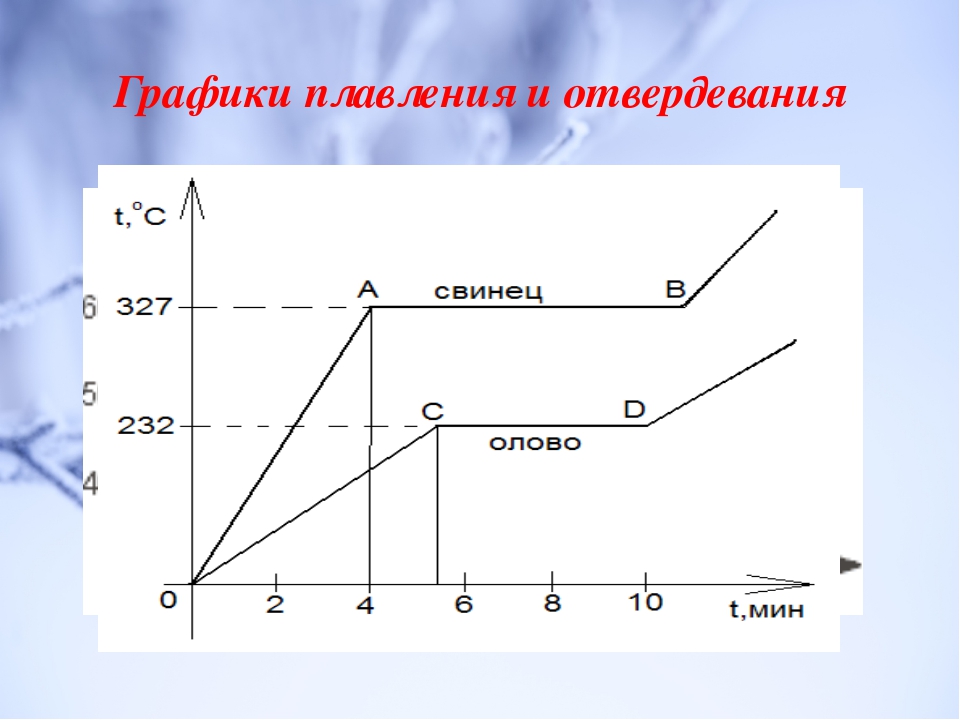
Удельная теплота парообразования жидкостей и расплавленных металлов
(при температуре кипения и нормальном атмосферном давлении)Жидкость | Удельная теплота испарения | Жидкость | Удельная теплота испарения | ||
кДж/кг | кал/кг | кДж/кг | кал/кг | ||
| Азот жидкий | 201 | 48 | Водород жидкий | 450 | 108 |
| Алюминий | 9200 | 2200 | Воздух | 197 | 47 |
| Бензин | 230-310 | 55-75 | Гелий жидкий | 23 | 5,5 |
| Висмут | 840 | 200 | Железо | 6300 | 1500 |
| Вода (при t=0 oC) | 2500 | 597 | Керосин | 209-230 | 50-55 |
| Вода (при t=20 oC) | 2450 | 586 | Кислород жидкий | 214 | 51 |
| Вода (при t=100 oC) | 2260 | 539 | Магний | 5440 | 1300 |
| Вода (при t=370 oC) | 440 | 105 | Медь | 4800 | 1290 |
| Вода (при t=374,15 oC) | 0 | 0 | Олово | 3010 | 720 |
| Ртуть | 293 | 70 | |||
| Свинец | 860 | 210 | |||
| Спирт этиловый | 906 | 216 | |||
| Эфир этиловый | 356 | 85 | |||
Удельная теплота испарения (парообразования) некоторых твердых веществ
Вещество | Удельная теплота испарения | Вещество | Удельная теплота испарения | ||
кДж/кг | калл/кг | кДж/кг | калл/кг | ||
| Йод | 226 | 54 | Мышяк | 427 | 102 |
| Камфара | 387,2 | 92,5 | Сухой лед | 586 | 140 |
| Лед | 2834 | 677 | |||
Примечание.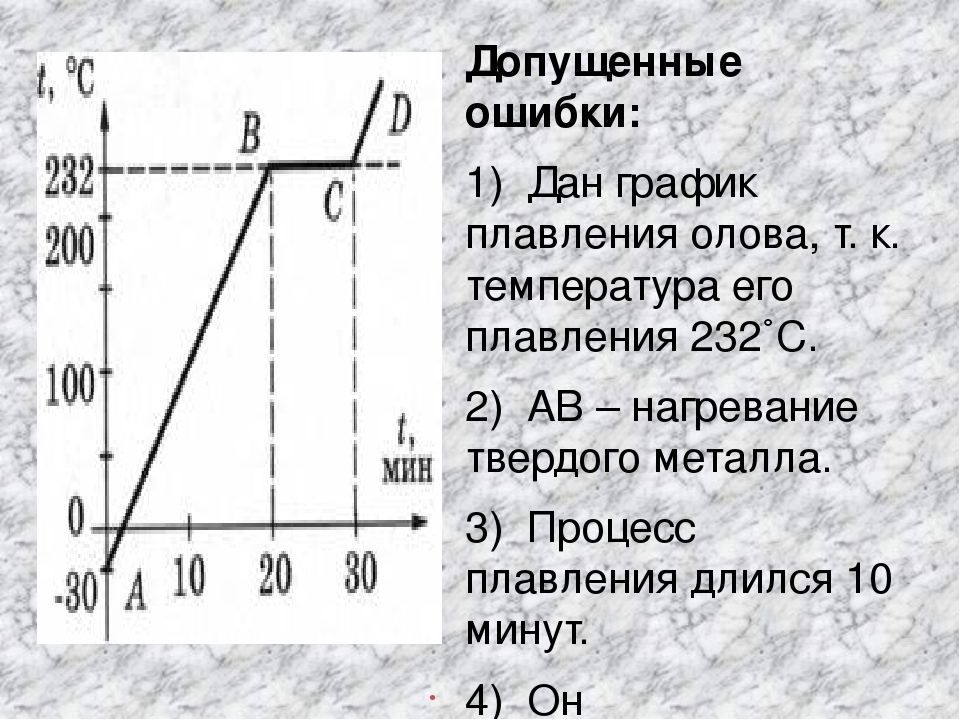 Непосредственный переход вещества из твердого состояния в газообразное, минуя превращение в жидкое состояние, называется сублимацией.
Непосредственный переход вещества из твердого состояния в газообразное, минуя превращение в жидкое состояние, называется сублимацией.
Критические параметры некоторых веществ
Вещество | Критическая температура, oC | Критическая плотность, кг/м3 | Критическое давление | |
МПа | ат | |||
| Азот | -147.1 | 311 | 3.39 | 34.6 |
| Аммиак | 132.4 | 235 | 11.5 | 117 |
| Ацетилен | 35.7 | 231 | 6.24 | 63.7 |
| Вода | 374.2 | 307 | 22.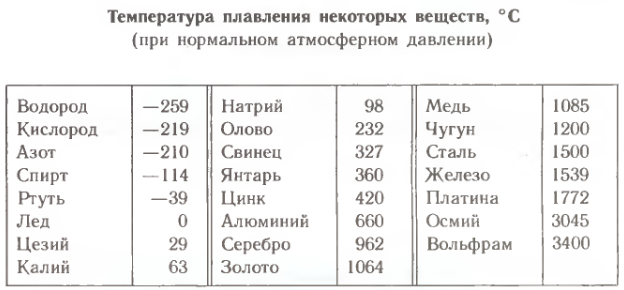 13 13 | 225.65 |
| Водород | -239.9 | 31.0 | 1.30 | 13.5 |
| Воздух | -140.7 | 350 | 3.77 | 38.5 |
| Гелий | -267.9 | 69.3 | 0.23 | 2.3 |
| Кислород | -118.8 | 430 | 5.04 | 51.4 |
| Нафталин | 469 | 314 | 3.98 | 40.6 |
| Оксид углерода (II) | -139 | 301 | 3.5 | 36 |
| Оксид углерода (IV) | 31.0 | 460 | 7.35 | 75.0 |
| Спирт | 243.5 | 276 | 6.38 | 65.2 |
| Хлор | 144.0 | 573 | 7.70 | 78.5 |
| Эфир | 193.8 | 260 | 3. 60 60 | 37.0 |
Удельная теплота сгорания некоторых пищевых продуктов
Продукт | Удельная теплота сгорания | Продукт | Удельная теплота сгорания | ||
кДж/кг | калл/кг | кДж/кг | калл/кг | ||
| Батоны простые | 10470 | 2500 | Мясо куриное | 5380 | 1280 |
| Виноград | 2400 | 700 | Огурцы свежие | 570 | 140 |
| Говядина | 7520 | 1800 | Окунь, щука | 3520 | 840 |
| Земляника садовая | 1730 | 443 | Сахар | 17150 | 4100 |
| Картофель | 3770 | 900 | Сметана | 14800 | 3530 |
| Кефир | 2700 | 640 | Смородина черная | 2470 | 590 |
| Малина | 1920 | 460 | Хлеб пшеничный | 8930 | 2130 |
| Масло сливочное | 32700 | 7800 | Хлеб ржаной | 8620 | 2060 |
| Молоко | 2800 | 670 | Яблоки | 2010 | 480 |
| Морковь | 1720 | 400 | Яйца | 6900 | 1650 |
| Мороженое сливочное | 7500 | 1790 | |||
Удельная теплота сгорания различных видов топлива и некоторых веществ
Топливо, вещество | Удельная теплота сгорания | |
МДж/кг | калл/кг | |
| Условное топливо | 29,3 | 7000 |
Твердое | ||
| Антрацит | 26,8-31,4 | 6400-7500 |
| Древесный уголь | 31,5-34,4 | 7500-8200 |
| Дрова (воздушно-сухие) | 8,4-11 | 2000-2500 |
| Каменный уголь | ≈ 27 | ≈ 6500 |
| Порох | 3,8 | 900 |
| Сланцы горючие | 7,5-15,0 | 1800-3600 |
| Твердые ракетные топлива | 4,2-10,5 | 100-2500 |
| Торф | 10,5-14,5 | 2500-3500 |
| Тротил (взрывчатое вещество) | 15 | 3600 |
| Уголь: | ||
| канско-акчинский | 15,5 | 3700 |
| подмосковный | 10,5 | 2500 |
| челябинский | 14,6 | 3500 |
| экибастузский | 16,1 | 3840 |
Жидкое | ||
| Бензин | 44-47 | 10500-11200 |
| Дизельное автотракторное | 42,7 | 10200 |
| Керосин | 44-46 | 10500-11000 |
| Нефть | 43,5-46 | 10400-11000 |
| Спирт | 27,0 | 6450 |
| Топливо для ЖРД (керосин + жидкий кислород) | 9,2 | 2200 |
| Топливо для реактивных двигателей самолетов (ТС-1) | 42,9 | 10250 |
Газообразное | ||
| Ацетилен | 48,1 | 11500 |
| Водород | 120 | 28600 |
| Газ природный | 41-49 | 9800-11700 |
| Метан | 50,0 | 11950 |
| Оксид углерода (II) | 10,1 | 2420 |
.
 ..
..Температура плавления олова
Олово – один из первых металлов, известных человечеству с древних времен. С этим металлом с момента открытия его связано развитие человеческого общества.
Олово наряду с серебром, медью, золотом, ртутью, свинцом и железом получило известность уже в доисторические времена. Археологические раскопки и другие исторические находки говорят о том, что люди научились получать олово несколько тысячелетий назад. Из него уже в те времена изготавливали украшения и посуду, но металл был достаточно дорог. Упоминание о нем находят даже в первых экземплярах Ветхого Завета.
В наше время олово известно в чистом виде как серебристо-белый металл. Чаще всего оно встречается в виде окисного соединения (оловянного камня). Температура плавления олова среди металлов считается самой низкой, благодаря этому материал легко выплавляют из оловосодержащих руд. Олово — пластичный мягкий металл, хорошо обрабатывается (ковка, прокат, механическая обработка и пр. ), имеет достаточно большой удельный вес и плотность. Он обладает низкой тепло- и электропроводностью, слабо подвержен атмосферному воздействию.
), имеет достаточно большой удельный вес и плотность. Он обладает низкой тепло- и электропроводностью, слабо подвержен атмосферному воздействию.
При низкой температуре металл не только меняет цвет, но и подвержен явлению «оловянной чумы». При этом происходит разрушение оловянных изделий. Так, в 1812 г. под воздействием русских морозов у французских солдат разрушились оловянные пуговицы. Учитывая, что температура плавления олова достаточно низкая, печи для выплавки его обычно просты по своей конструкции.
Олово – довольно редкий металл. Выплавляли его раньше из руды, которая находилась непосредственно в верхних слоях земной коры. В сегодняшних условиях таких ископаемых практически нет, поэтому технология получения олова довольно сложная и трудоемкая.
Все оловосодержащие россыпи и руды проходят процесс обогащения, затем концентрат направляют в обжиговые печи и только потом — в плавильное отделение. При нагревании металл начинает плавиться. Температура плавления олова находится в пределах 232 градусов. В ходе плавки, используя флюсы, шлаки и различные присадки, получают нужного сорта и качества материал.
В ходе плавки, используя флюсы, шлаки и различные присадки, получают нужного сорта и качества материал.
Диапазон применения олова достаточно широкий, этот элемент широко используется в различных отраслях. По своей важности и полезности он стал стратегическим металлом, ведь он дает возможность образования сплавов с различными материалами, к тому же предельно легко обрабатывается. И, конечно, важную роль играет и низкая температура плавления олова.
Олово является нетоксичным, устойчивым против коррозии материалом. Иизобретенный в прошлом столетии способ изготовления белой жести (покрытие листового металла слоем олова) позволил изготавливать безопасную тару для консервации продуктов питания. Использование луженого железа сделало переворот в пищевой промышленности.
Способность к смачиванию других металлов и низкая температура плавления свинца и олова дала возможность изготавливать легкоплавкие сплавы (припои). Использование таких сплавов позволяет соединять разные конструктивные узлы и детали, иметь герметичный шов.
Способность олова исполнять роль защитного слоя используется в атомной промышленности. Кроме того, в современной стекольной промышленности его используют для полировки стекла. С этой целью из печи выливается жидкая масса стекла в емкость с расплавом олова. Температура затвердевания олова при медленном остывании начинается после перехода ее ниже точки плавления. Полученная смесь в виде ленты поступает вначале в обжиговую печь, а затем на участок раскроя.
Большим спросом во все времена пользуется сплав олова и меди — бронза.В старину до появления железа именно из нее изготавливали различные изделия вплоть до оружия. Когда люди узнали о прочностных и износостойких качествах бронзы, ее стали использовать для изготовления подшипников, работающих в сложных условиях с большой нагрузкой.
Сегодня трудно найти сферу деятельности человека, где бы ни применялось олово в чистом виде или в сплавах.
Температура плавления — Википедия
Плавление льдаТемпература плавления и кристаллизации — температура, при которой твёрдое кристаллическое тело совершает переход в жидкое состояние и наоборот.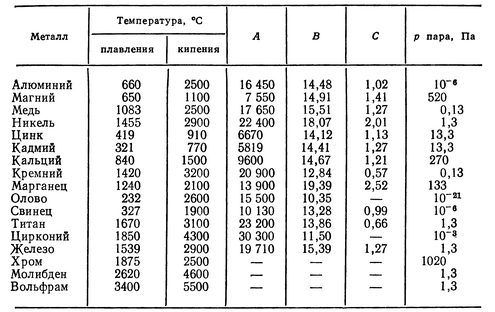 При температуре плавления вещество может находиться как в жидком, так и в твёрдом состоянии. При подведении дополнительного тепла вещество перейдёт в жидкое состояние, а температура не будет изменяться, пока всё вещество в рассматриваемой системе не расплавится. При отведении лишнего тепла (охлаждении) вещество будет переходить в твёрдое состояние (застывать) и, пока оно не застынет полностью, его температура не изменится.
При температуре плавления вещество может находиться как в жидком, так и в твёрдом состоянии. При подведении дополнительного тепла вещество перейдёт в жидкое состояние, а температура не будет изменяться, пока всё вещество в рассматриваемой системе не расплавится. При отведении лишнего тепла (охлаждении) вещество будет переходить в твёрдое состояние (застывать) и, пока оно не застынет полностью, его температура не изменится.
Температура плавления/отвердевания и температура кипения/конденсации считаются важными физическими свойствами вещества. Температура отвердевания совпадает с температурой плавления только для чистого вещества. На этом свойстве основаны специальные калибраторы термометров для высоких температур. Так как температура застывания чистого вещества, например олова, стабильна, достаточно расплавить и ждать, пока расплав не начнёт кристаллизоваться. В это время, при условии хорошей теплоизоляции, температура застывающего слитка не изменяется и в точности совпадает с эталонной температурой, указанной в справочниках.
Смеси веществ не имеют температуры плавления/отвердевания вовсе и совершают переход в некотором диапазоне температур (температура появления жидкой фазы называется точкой солидуса, температура полного плавления — точкой ликвидуса). Поскольку точно измерить температуру плавления такого рода веществ нельзя, применяют специальные методы (ГОСТ 20287 и ASTM D 97). Но некоторые смеси (эвтектического состава) обладают определенной температурой плавления, как чистые вещества.
Аморфные (некристаллические) вещества, как правило, не обладают чёткой температурой плавления. С ростом температуры вязкость таких веществ снижается, и материал становится более жидким.
Поскольку при плавлении объём тела изменяется незначительно, давление мало влияет на температуру плавления. Зависимость температуры фазового перехода (в том числе и плавления, и кипения) от давления для однокомпонентной системы даётся уравнением Клапейрона-Клаузиуса. Температуру плавления при нормальном атмосферном давлении (101 325 Па, или 760 мм ртутного столба) называют точкой плавления.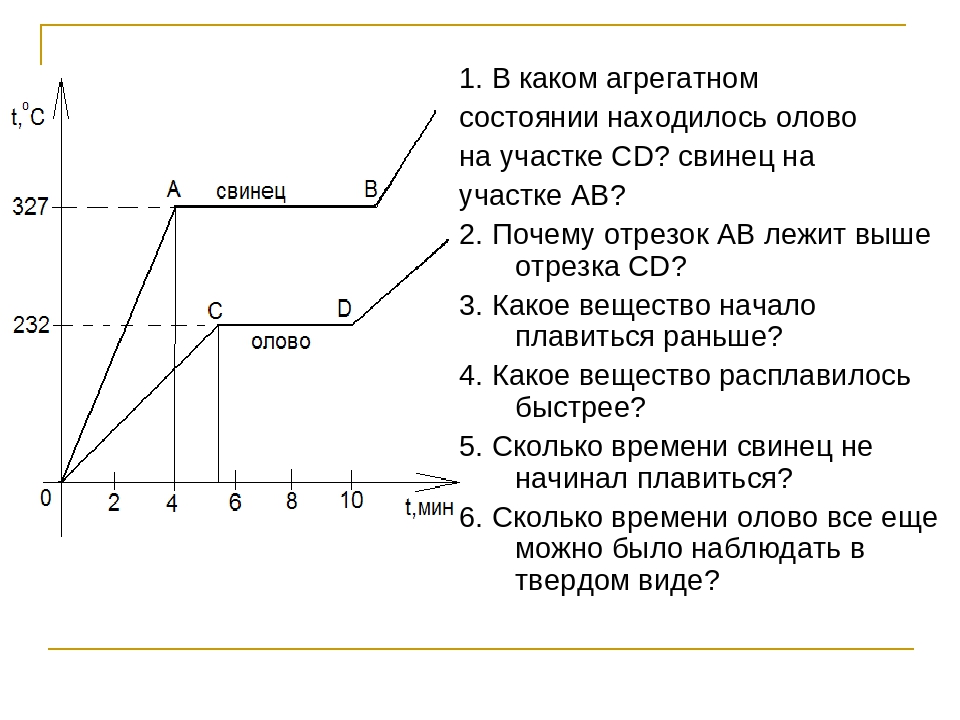 {2}}
{2}}
где rs{\displaystyle r_{s}} — средний радиус элементарной ячейки, θ{\displaystyle \theta } — температура Дебая, а параметр xm{\displaystyle x_{m}} для большинства материалов меняется в интервале 0,15-0,3.
Температура плавления – Расчет
Формула Линдемана выполняла функцию теоретического обоснования плавления в течение почти ста лет, но развития не имела из-за низкой точности.
В 1999г. И.В. Гаврилиным было получено новое выражение для расчёта температуры плавления:
Тпл = DHпл / 1,5 N0 k, (1)
где Тпл – температура плавления; DHпл – скрытая теплота плавления; N0 – скрытая теплота плавления; k – константа Больцмана.
Впервые получено исключительно компактное выражение (1) для расчёта температуры плавления металлов, связывающее эту температуру с известными физическими константами: скрытой теплотой плавления, числом Авогадро и константой Больцмана.
Точность расчетов по (1) можно оценить по данным таблицы.
Таблица.
Температура плавления некоторых металлов. Расчет по (1)
| Me | Al | V | Mn | Fe | Ni | Cu | Zn | Sn | Mo | ||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| DHпл ккал моль-1 | 2,5 | 5,51 | 3,5 | 4,4 | 4,18 | 3,12 | 1,7 | 1,7 | 8,7 | ||||||||
| Тпл, К по (1) | 876 | 1857 | 1179 | 1428 | 1406 | 1051 | 583 | 529 | 2945 | ||||||||
| Тпл, К Эксп. [1] | 933 | 2190 | 1517 | 1811 | 1728 | 1357 | 692 | 505 | 2890 | ||||||||
По этим данным, точность расчетов Тпл меняется от 2 до 30%, что в расчетах такого рода вполне приемлемо.
Формула (1) выведена как одно из следствий новой теории плавления и кристаллизации, опубликованной в 2000г.[1].
[1]- Гаврилин И.В. Плавление и кристаллизация металлов и сплавов. Изд. ВлГУ. Владимир. 2000. 256 с.
Температуры плавления некоторых веществ[2]
| вещество | температура плавления (°C) |
|---|---|
| гелий (при 2,5 МПа) | −272,2 |
| водород | −259,2 |
| кислород | −219 |
| азот | −210,0 |
| метан | −182,5 |
| спирт | −114,5 |
| хлор | −101 |
| аммиак | −77,7 |
| ртуть | −38,87 |
| водяной лёд | 0 |
| бензол | +5,53 |
| цезий | +28,64 |
| галлий | +29,8 |
| сахароза | +185 |
| сахарин | +225 |
| олово | +231,93 |
| свинец | +327,5 |
| алюминий | +660,1 |
| серебро | +960,8 |
| золото | +1063 |
| медь | +1083,4 |
| кремний | +1415 |
| железо | +1539 |
| титан | +1668 |
| платина | +1772 |
| цирконий | +1852 |
| корунд | +2050 |
| рутений | +2334 |
| молибден | +2622 |
| карбид кремния | +2730 |
| карбид вольфрама | +2870 |
| осмий | +3054 |
| оксид тория | +3350 |
| вольфрам | +3422 |
| углерод (сублимация) | +3547 |
| карбид гафния | +3890 |
| карбид тантала-гафния | +3942 |
Примечания
- ↑ Жирифалько Л. Статистическая физика твердого тела. — М.: Мир, 1975. — С. 15.
- ↑ Дрица М. Е., Будберг П. Б., Бурханов Г. С., Дриц А. М., Пановко В. М. Свойства элементов. — Металлургия, 1985. — С. 672.
ФИЗИКА: ЗАДАЧИ на плавление и отвердевание
Задачи на плавление и отвердевание с решениями
Формулы, используемые на уроках «Задачи на плавление и отвердевание».
Название величины | Обозначение | Единица измерения | Формула |
Масса | m | кг | m = Q / λ |
Температура | t | °С | |
Температура плавления | tпл | °С | |
Удельная теплоемкость | с | Дж/кг°С | |
Удельная теплота плавления | λ | Дж/кг | λ = Q / m |
Количество теплоты при нагревании | Q | Дж | Q=cm(t2–t1) |
Количество теплоты при плавлении | Q | Дж | Q = λm |
ПРИМЕРЫ РЕШЕНИЯ ЗАДАЧ
Задача № 1. Для приготовления чая турист положил в котелок лёд массой 2 кг, имеющий температуру 0°С. Какое количество теплоты необходимо для превращения этого льда в кипяток при температуре 100°С? Энергию, израсходованную на нагревание котелка, не учитывать.
Задача № 2. Сколько энергии нужно затратить, чтобы расплавить лёд массой 4 кг при температуре 0°С?
Задача № 3. Сколько энергии требуется затратить, чтобы расплавить свинец массой 20 кг при температуре плавления? Сколько энергии понадобится для этого, если начальная температура свинца 27 °С?
Задача № 4. Какую энергию нужно затратить, чтобы расплавить кусок льда массой 5 кг, взятый при температуре -10 °С?
Задача № 5. Какую энергию нужно затратить, чтобы расплавить кусок меди массой 2 кг, взятый при температуре 25 °С?
Задача № 6. Алюминиевый и медный бруски массой 1 кг каждый нагреты до температуры их плавления. Для плавления какого тела потребуется больше количества теплоты? На сколько больше?
Задача № 7. Во сколько раз плавление куска железа массой 1 кг требует больше энергии, чем плавление той же массы белого чугуна, серебра, серого чугуна и ртути, нагретых до своей температуры плавления?
Задача № 8. Какое количество теплоты поглощает при плавлении кусок свинца массой 1 г, начальная температура которого 27 °С; олова массой 10 г, взятого при температуре 32 °С?
Задача № 9. Объем формы для пищевого льда равен 750 см3. Сколько энергии отдают вода и лед форме и окружающему ее воздуху в холодильнике, если у воды начальная температура 12 °С, а температура образовавшегося льда равна -5 °С?
Задача № 10. Железная заготовка, охлаждаясь от температуры 800 до 0 °С, растопила лед массой 3 кг, взятый при 0 °С. Какова масса заготовки, если вся энергия, выделенная ею, пошла на плавление льда?
Краткая теория для решения Задачи на плавление и отвердевание.
Это конспект по теме «Задачи на плавление и отвердевание». Выберите дальнейшие действия:
Температура кристаллизации | Scientific.Net
Гидролитическое сопротивление Na 2 O – SiO 2 –SnO 2 Стеклянная системаАвторы: И. Ковязина, Светлана Григорьевна Власова, Федор Капустин.
Реферат: Исследовано влияние SnO 2 на химическую стабильность натриево-силикатных стекол.Синтезированы шесть составов стекол системы ySnO 2 –37.9Na 2 O– (62.1-y) SiO 2 , y = 1–8 мол.%. Термическое поведение стекол исследовали методами дилатометрии и ДСК. Показано, что гидролитическая стойкость увеличивается при увеличении концентрации SnO 2 в составе стекла при постоянном содержании Na 2 O.
54
Настройка свойств HDPE для 3D-печатиАвторы: Павизини Чаткунакасем, Паниса Луангджунтавонг, Афиват Понгвисутирухте, Чуанчом Аумнат, Пранут Потиярадж
Аннотация: Целью данного исследования является улучшение свойств полиэтилена высокой плотности (HDPE) для 3D-печати путем добавления графена и полиэтилена низкой плотности (LDPE).Графен был получен модифицированным методом Хаммера. Полученный графен охарактеризован методами инфракрасной спектроскопии и рентгеноструктурного анализа (XRD). Композиты графен / HDPE и LDPE / HDPE были успешно получены методом смешивания в расплаве с использованием двухшнекового экструдера. Индекс текучести расплава (MFI) и дифференциальная сканирующая калориметрия (DSC) были использованы для характеристики чистого HDPE и модифицированного HDPE. Результаты FTIR и XRD показывают, что графит был успешно превращен в графен, и MFI графена / HDPE и LDPE / HDPE уменьшилось по мере увеличения количества графена и LDPE в композиционных смесях.Результаты ДСК показывают, что добавление низкокристаллических полимеров может снизить температуру кристаллизации и содержание кристалличности.
67
Приготовление порошков (K, Na) NbO 3 с широким гранулометрическим составомАвторы: Ю Хуа Чжэнь, Кай Ли Цзя, Линь Лин Ли, Ю Си Цяо, Фу Хуа Сун, Мин Чжан
Аннотация: Целью данной работы является получение порошков (K, Na) NbO 3 с широкими методами гранулометрического состава.Порошки (K, Na) NbO 3 были успешно синтезированы различными способами, включая гидротермальный метод, золь-гель метод и метод расплава солей. Результаты экспериментов показали, что гидротермальный и золь-гель методы не позволяют эффективно контролировать размер зерен порошков (K, Na) NbO 3 . Размер зерен порошков (K, Na) NbO 3 может быть изменен только методом расплавленной соли путем регулирования морфологии исходного оксидного порошка, а также температуры кристаллизации.На размер зерна не влияли экспериментальные параметры, независимо от того, измельчались ли исходные порошки или нет. Кроме того, было обнаружено, что температура кристаллизации может монотонно изменять размер зерен порошков. Порошки (K, Na) NbO 3 , синтезированные методом расплавленных солей, распределены от нанометрового до микронного уровня, что может заложить основу для дальнейших исследований влияния размера зерна (K, Na) NbO 3 пьезокерамики без свинца .
1603
Исследование материалов Ge-Te, легированных никелем, для высокотемпературной памяти с фазовым переходомАвторы: Лян Лян Цао, Лян Цай Ву, Чжи Тан Сон, Вэнь Цин Чжу, Юн Хуэй Чжэн, Ян Ченг, Сан Нянь Сон, Чжун Юань Ма, Лин Сюй
Аннотация: Материал Ge-Te (Ni-GT), легированный никелем, был предложен и исследован для приложений с произвольной памятью с фазовым переходом (PCRAM).С добавлением Ni температура кристаллизации, способность сохранять данные и скорость кристаллизации, очевидно, улучшились. Шероховатость поверхности кристаллических пленок Ni-GT была уменьшена введением Ni. Кроме того, для исследования поведения пленок Ni-GT с фазовым переходом применялась температурно-зависимая просвечивающая электронная микроскопия (ПЭМ). Все экспериментальные результаты показали, что материал Ni-GT имеет потенциал для применения в высокоскоростной PCRAM в условиях высоких температур.
460
Влияние температуры нагрева формы на скорость охлаждения расплава при кристаллизации бронзыАвторы: Никита Мартюшев, Юрий Н.Петренко
Аннотация: В статье представлены кривые охлаждения расплава оловянной бронзы (состоит из 10% свинца, 10% олова и 80% меди), разливаемого в изложницы с различной теплопроводностью: массивный чугунный кокиль ( с соотношением массы отливки к массе формы 1: 8) и графитовой изложницы. Кривые построены для форм, предварительно нагретых до 20; 200; 400; 600; 800 ° С. Построение кривых производилось с помощью прибора «Термограф», созданного в Томском политехническом университете.Устройство регистрирует значения термоэлектродвижущей силы хромель-алюмелевой термопары и преобразует их в значения температуры. Кривые охлаждения используются для определения скорости охлаждения расплава в диапазоне температур, включающем диапазон кристаллизации. Показано, что в аналогичных условиях скорость охлаждения при отливке в чугунную изложницу на 30-40% выше, чем при отливке в графитовой изложнице. Приведенные в статье данные свидетельствуют о том, что предварительный нагрев кристаллизатора позволяет значительно снизить скорость охлаждения отливки и продлить время нахождения расплава в жидком состоянии.Следует отметить, что значения скорости охлаждения предварительно нагретых и неотапливаемых литейных форм наиболее ярко проявляются в начальные моменты после заливки расплава. При уменьшении охлаждения отливок до 300-400 ° С скорости охлаждения становятся одинаковыми. В статье представлены численные данные по скоростям охлаждения для различных температур нагрева пресс-формы.
231
Влияние содержания Na 2 WO 4 на температуру кристаллизации NaCl-KCl-Na 2 WO 4 Система расплавленных солейАвторы: Цзе Ли, Ян Пей, Я Бинь Лю, Юн Ган Ли
Резюме: Температуру ликвидуса расплавленной соли системы Nacl-Kcl-Na 2 WO 4 измеряли методом дифференциального термического анализа.Результаты показывают, что, i
Коэффициент теплового расширения — Простая английская Википедия, бесплатная энциклопедия
Твердые тела в основном [1] расширяются при нагревании и сжимаются при охлаждении. [2] Эта реакция на изменение температуры выражается как коэффициент теплового расширения .
Коэффициент теплового расширения используется:
Эти характеристики тесно связаны. Коэффициент объемного теплового расширения может быть измерен для всех веществ в конденсированных средах (жидкостей и твердых тел).Линейное тепловое расширение может быть измерено только в твердом состоянии и широко используется в инженерных приложениях.
Коэффициенты теплового расширения для некоторых распространенных материалов [изменить | изменить источник]
Расширение и сжатие материала необходимо учитывать при проектировании больших конструкций, при использовании ленты или цепи для измерения расстояний для геодезических изысканий, при проектировании форм для литья горячего материала и в других инженерных приложениях, когда ожидаются большие изменения размеров из-за температуры. .Диапазон для α составляет от 10 -7 для твердых тел до 10 -3 для органических жидкостей. α меняется в зависимости от температуры, а некоторые материалы имеют очень большие колебания. Некоторые значения для обычных материалов, указанные в миллионных долях на градус Цельсия: (ПРИМЕЧАНИЕ: это также может быть в градусах Кельвина, поскольку изменения температуры имеют соотношение 1: 1)
Для приложений, использующих свойство теплового расширения, см. Биметаллический и ртутный термометр.
Тепловое расширение также используется в механических приложениях для прилегания деталей друг к другу, например.грамм. втулка может быть установлена на вал, сделав ее внутренний диаметр немного меньше диаметра вала, затем нагревая ее до тех пор, пока она не войдет на вал, и позволяя ей остыть после того, как она была надета на вал, таким образом достигая термоусадочная посадка ‘
Существуют сплавы с очень маленьким КТР, используемые в приложениях, требующих очень малых изменений физических размеров в диапазоне температур. Одним из них является инвар 36 с коэффициентом в диапазоне 0,6х10 -6 .Эти сплавы полезны в аэрокосмической отрасли, где возможны большие колебания температуры.
- ↑ Некоторые вещества имеют отрицательный коэффициент расширения и расширяются при охлаждении (например, замерзшая вода
- ↑ Причина в том, что при теплопередаче изменяется энергия, запасенная в межмолекулярных связях между атомами. Когда запасенная энергия увеличивается, увеличивается и длина молекулярной связи.
Кристаллизация
Весь глоссарий
Керамические глазури образуют кристаллы при охлаждении, если химический состав правильный и скорость охлаждения достаточно мала, чтобы обеспечить движение молекул к предпочтительной ориентации.
Детали
При охлаждении керамические расплавы предпочитают затвердевать в виде организованной молекулярной структуры. При наличии достаточного количества времени и симпатической химии они сформируют кристаллическую структуру. Но если охлаждение происходит быстрее, они затвердевают, как стекло.
Кристаллы могут расти в охлаждающих расплавах глазури при наличии одного или нескольких из следующих условий: расплав глазури жидкий, скорость охлаждения низкая, присутствуют оксиды, которые любят образовывать кристаллы (например, ZnO, TiO), оксиды, которые могут образовывать кристаллы присутствуют в большом количестве (например,грамм. CaO, Fe 2 O 3 ), оксиды, повышающие жесткость расплава, не присутствуют или присутствуют в небольших количествах (например, Al 2 O 3 , Zr, MgO). Кристаллы обычно представляют собой силикатные или боратные соединения, поэтому SiO 2 и B 2 O 3 должны присутствовать в значительных количествах. Кристаллы можно высеять, включив их в замес. Глазури, обычно не склонные к кристаллизации, иногда могут быть частично кристаллизованы путем медленного охлаждения, а глазури, склонные к кристаллизации, часто можно быстро охлаждать, чтобы предотвратить это.
Кристаллизация может быть очень декоративной, но ее сложно сохранить единообразие (и поэтому часто используется в уникальной художественной посуде). Нежелательная кристаллизация, происходящая в глазури во время охлаждения при обжиге, называется расстеклованием, она портит глянцевые поверхности и может стать настоящей бедой для промышленности. С этим можно справиться за счет более быстрого охлаждения или корректировки химии (например, более высокое содержание Al 2 O 3 , замена некоторого количества CaO на MgO, восстановление B 2 O 3 ).
Очень глянцевые или хорошо расплавленные глазури могут быть подвержены этому, потому что они, вероятно, содержат много SiO 2 (который соединяется с другими оксидами с образованием кристаллов силиката) или имеют очень жидкий расплав (что дает кристаллам большую свободу для форма). Когда требуется расстекловывание, это просто называется кристаллизацией. Химический состав основной глазури является ключевым фактором, поскольку он определяет степень плавления и присутствие оксидов, благоприятных для кристаллов или препятствующих кристаллизации (например,грамм. Al 2 O 3 , MgO). Многие маты — это просто глянцевые глазури, вся поверхность которых покрыта микрокристаллами. Чисто декоративные высококристаллические глазури почти всегда содержат большое количество Na 2 O и, таким образом, почти всегда плохо повреждаются.
Яркий пример кристаллизации может быть продемонстрирован путем плавления (и охлаждения) порошкообразной смеси 50:50 ферро-фритты 3134 и оксида кобальта в тигле на конусе 6. Фритта является очень активным расплавителем (не содержит глинозема) и кобальт также является активным плавителем, вместе они могут творить настоящее волшебство!
Связанная информация
Alberta Slip GA6-A глазурь с 6 конусами, медленное охлаждение
GA6-A Базовая глазурь Alberta Slip (80 Alberta Slip: 20 Frit 3134), обожженная с использованием режима медленного охлаждения Plainsman с конусом 6 на железной красной глине Plainsman M390.Если его охладить на нормальной скорости, он превратится в блестящее прозрачное янтарное стекло без кристаллов.
Множество способов восстановления оксида железа
Оксид железа — прекрасная добавка для восстановления глазури. Он производит селадон с низким процентом, затем переходит в прозрачное янтарное стекло на 5%, затем до непрозрачного коричневого на 7%, тенмоку на 9% и, наконец, до металлического кристалла со все более крупными кристаллами размером более 13%. Эти образцы охлаждались естественным путем в большой восстановительной печи, механизм кристаллизации был бы намного тяжелее, если бы они охлаждались медленнее.
Быстрое охлаждение и медленное охлаждение Прозрачная основа Alberta Slip GA6-A
Эти две кружки имеют внутри глазурь Alberta Slip base cone 6 GA6-A. Левый охлаждается нормально (после замачивания сушится на конусе 6). Для кружки справа печь вымачивалась в течение получаса при 1800F по пути вниз. Это было сделано для проявления рутилово-голубой глазури снаружи, но в этот период внутри происходила кристаллизация. Если вам нужно медленно охладить (для рутилово-синего цвета Alberta Slip), но вы хотите, чтобы глазурь для лайнера была прозрачной, добавьте 0.5-1% оксида олова к GA6-A, чтобы препятствовать росту кристаллов.
Тонкая титановая лента, напыленная на глазури с конусом 6, демонстрирует кристаллизацию
Первый — на GA6-A, остальные — на GA6-C (скользящие глазури Alberta). Последний нанесен слишком густо, коричневая полоса сухая и покрыта волдырями.
Как оксиды металлов соотносятся по степени плавления?
Оксиды металлов с 50% ферро-фритты 3134 в тиглях на конусе 6ox. Хром и рутил не плавятся, медь и кобальт — чрезвычайно активные плавители.Кобальт и медь кристаллизовались при охлаждении, марганец образовал радужное стекло.
Та же железная глазурь. Одно кристаллизуется, а другое — нет. Зачем?
Обе кружки имеют одинаковый конус 6 оксидирования с высоким содержанием железа (9%), высоким содержанием бора, глянцевой глазурью. Кристаллы силиката железа полностью вторглись на поверхность кристалла справа, превратив почти черный глянцевый в желто-матовый. Зачем? Три вещи. Она охлаждалась медленно, а другая — свободным падением (обжиг проводился в той же печи).Глазурь имеет жидкий расплав (он течет), а процент железа в ней достаточно высок, чтобы она могла выпадать из раствора в расплаве (учитывая время). У чувствительных глазурей есть температура, при которой кристаллы формируются лучше всего, и эта температура может быть на сотни градусов ниже конуса обжига (или выше, если происходит осаждение). В промышленности расстекловывание считается дефектом. Но гончары называют это кристаллизацией. Понимание (особенно химии и материалов) и экспериментальных обжигов необходимы, чтобы научиться контролировать и использовать эффект в глазури.
Молекулярная структура кристаллического и стекловидного кремнезема
Для кристаллизации глазурей с высоким содержанием кремнезема при остывании необходимо несколько вещей. Сначала достаточно текучий расплав, в котором молекулы могут быть достаточно подвижными, чтобы предполагать свои предпочтительные связи. Во-вторых, достаточно медленно остыть, чтобы дать им время сделать это. В-третьих, медленное охлаждение должно происходить при температуре, при которой это лучше всего происходит. Кремнезем хорошо кристаллизуется, расплав чистого кремнезема необходимо очень быстро охлаждать, чтобы предотвратить кристаллизацию.Но Al 2 O 3 и другие оксиды нарушают гексагональную структуру силиката, делая глазурь более устойчивой к кристаллизации.
Что могло заставить глазурь вырастить эти невероятные кристаллы?
Крупный план кристаллической глазури Фары Шимбо. Кристаллы этого типа могут достигать очень больших (сантиметров) размеров. Они растут, потому что химия глазури и обжига настроены так, чтобы их поощрять. Это включает в себя расплавы, которые являются очень текучими (много флюсов) с добавлением оксидов металлов и катализатора.Обычно потоки составляют B 2 O 3 , K 2 O и Na 2 O (из фритт), катализатор — оксид цинка (много). Поскольку Al 2 O 3 увеличивает жесткость расплавов глазури, предотвращая рост кристаллов, в этих глазурах он очень низкий (глины и полевые шпаты содержат Al 2 O 3 , поэтому в этих глазури почти нет). Обжиг имеет строго контролируемый цикл охлаждения, включающий быстрые спуски и удержания (иногда несколько циклов). Между циклами иногда бывают небольшие подъемы.Каждый разрыв кривой охлаждения создает определенные эффекты в росте кристалла. Тысячи гончаров по всему миру исследовали сложные химические процессы, обжиг и бесконечный диапазон добавок оксидов металлов.
Борово-синий в прозрачной глазури при слабом воспламенении
В этой глазури с конусом 04 с высоким содержанием бора во время охлаждения образуются кристаллы бората кальция (так называемый борно-синий). Это обычная проблема и причина контролировать уровень бора в прозрачных глазури; используйте ровно столько, чтобы хорошо растопить.Если требуется большая текучесть расплава, уменьшите процентное содержание CaO. Для непрозрачных глазурей этот эффект может фактически позволить использовать меньше глушителя.
Пестрый эффект напыленного слоя из 100% диоксида титана
Указанная поверхность — это внешняя сторона этой большой чаши. Базовая глазурь (внутри и снаружи) — это глазурь GA6-D Alberta Slip, нанесенная на конус 6 на керамограните полированного цвета. Тонкость рутила необходимо тщательно контролировать, единственный практический метод нанесения — распыление.Драматический эффект является реальным свидетельством разнообразия свойств TiO 2 . Преимущество этого метода — это источник: диоксид титана вместо того, чтобы получать TiO 2 из часто проблемного рутила.
Cone 10R пестрота и кристальная магия
Это пример кристаллизации штейна с высоким содержанием MgO. MgO обычно увеличивает жесткость расплава глазури, образуя некристаллический штейн, но при конусе 10R с оксидами металлов происходит много интересных вещей, даже при низких процентах.Доломит и тальк являются ключевыми источниками MgO.
Пестрота и разделение фаз с содержанием рутила около 5%
Глазурь представляет собой доломитовый штейн, обожженный до конуса 10R. Сильное снижение пламени — один из лучших способов использования разнообразной магии рутила.
Кристаллизация рутила на конусе 6 полностью подавлена? Как?
Обе глазури на 80% состоят из Alberta Slip, но в той, что справа, используется 20% ферро-фритты 3249, ускоряющей плавление (в то время как левая содержит 20% фритты 3134).Несмотря на то, что во фритте 3249 больше бора и он должен плавиться лучше, его высокое содержание MgO делает расплав глазури жестким, что лишает его подвижности, необходимой для роста кристаллов.
Великолепный рецепт глазури для конуса 10R
Эта глазурь из кристаллов железа представляет собой шликер Ravenscrag плюс 10% оксида железа, обожженный до конуса 10R на полированном керамограните (Plainsman H550). Поскольку шликер Ravenscrag сам по себе является глазурью на конусе 10, он является идеальной основой для изготовления широкого ассортимента глазурей. У него есть собственный сайт по адресу http: // ravenscrag.com. Первоначально он был разработан с использованием программного обеспечения Digitalfire Insight. Проект построен на достоинствах особой илистой глины, которая, как было отмечено, сочетает очень хорошие суспензионные и сушильные свойства с низкой температурой обжига. Процесс включал вычисление, какие минералы необходимо добавить к нему, чтобы получить химический состав глазури с шелковистым конусом 10 среднего качества; продукт был Ravenscrag Slip.
Глазурь для унитаза и пестрая глазурь (на конусе 6)
Большинство художников и гончаров хотят визуального разнообразия в своей глазури.Кружка справа демонстрирует несколько типов. Изменение непрозрачности в зависимости от толщины: внешний синий цвет меняется (прерывается) до коричневого на краях контуров, где слой глазури тоньше. Фазовые изменения: рутилово-синий цвет закручивается внутри из-за фазовых изменений в стекле (зоны разного химического состава). Кристаллизация: внутренняя глазурь обычно прозрачного янтарного цвета, но из-за медленного охлаждения при обжиге железо в стекле кристаллизовалось на поверхности. Цвет глины: кружки сделаны из коричневой глины, железо внутри нее перетекает в синий цвет и усиливает изменение цвета на тонких срезах.
Откуда доверие к онлайн-рецептам?
Эти испытания рецепта под названием «Магия кристаллов стронция». Гончар пробовал его на разных телах и обжигах. Но вместо того, чтобы производить волшебные кристаллы, как на картинках, поверхности были полностью матовыми. Рассуждая, «зачем кому-то выкладывать рецепт, который не работает», она обвинила один из материалов. Другие подпитывали это слухами о заявленных проблемах с его постоянством. Это ошибочное доверие к продаваемым рецептам (рецептам с недостаточной документацией).Хрустальные глазури по необходимости должны иметь высокую текучесть расплава. Кристаллы лучше всего развиваются с определенной кривой охлаждения, имеющей контролируемое падение в узком диапазоне температур. Быстрее остывают, не растут, медленнее и матируют всю поверхность. Другие факторы, такие как глиняное тело, толщина глазури, также участвуют. Люди, которые публикуют такие рецепты глазури, часто не полностью понимают их механизмы.
Кристаллическая глазированная ваза от Rod and Denise Simair
Та же глазурь, та же печь, та же глина: правильная кристаллизовалась.Зачем?
Ну на самом деле они не совсем такие. Это 80% Alberta Slip и 20% фритта. Но фритта слева — это Ferro 3195, а справа — 3134. Сравнивая рассчитанный химический состав этих двух, мы можем сказать, что вероятной причиной разницы является содержание Al 2 O 3 . Frit 3134 почти не имеет, тогда как 3195 имеет 12%. Al 2 O 3 укрепляет расплав глазури, что препятствует росту кристаллов. Но это стабилизирует расплав от растекания во время обжига.Frit 3195 содержит больше бора, поэтому тот, что слева, должен работать больше. Но на самом деле работает меньше. Зачем? Опять же, потому что повышенное содержание Al 2 O 3 делает расплав жестким.
Чашка Cone 10R Tenmoku Ron Roy обеспечивает хрупкое равновесие
У каждого гончара, использующего Тэнмоку, есть свои предпочтения относительно того, как должна выглядеть глазурь. Рону явно нравится, что кристаллы железа хорошо развиваются по краям контуров. Он научился тонкой стрельбе и рецепту баланса для достижения этого эффекта.Если процентное содержание железа слишком велико, или глазурь нанесена слишком тонкой, восстановление будет слишком сильным или охлаждение будет слишком медленным, произойдет слишком сильная кристаллизация. Если утюг слишком низкий, охлаждение идет слишком быстро или глазурь слишком толстая, он будет сплошного черного цвета. Кроме того, этот эффект зависит от жидкого расплава глазури (железо — это сильный флюс), если глазурь слишком густая, она будет стекать вниз во время обжига.
Хорошая матовая глазурь. Плохая матовая глазурь.
Сравнение текучести расплава двух матовых глазурей Cone 6.G2934 — это флюсовая глазурь, насыщенная бором MgO, которая плавится до нужной степени, образует хорошее стекло, имеет низкое тепловое расширение, сопротивляется выщелачиванию и не оставляет следов на столовых приборах. G2000 — это широко распространенный рецепт конуса 6, он флюсован цинком для создания поверхностной сетки из микрокристаллов, которая не только матирует, но и делает глазурь непрозрачной. Но из него получается плохое стекло, он слишком много течет, столовые приборы плохо оставляют пятна, легко пачкаются, смываются и, вероятно, небезопасны для пищевых продуктов! Рецепт G2934 доступен для поиска в Google и является хорошей демонстрацией того, как механизм матирования с высоким содержанием MgO (из талька) создает шелковистую поверхность при окислении конуса 6 так же, как и при восстановлении конуса 10 (из доломита).Однако, чтобы он был белым, нужно добавить олово или циркон.
Восстановительная высокотемпературная глазурь из кристаллов железа
Это то, что может сделать около 10% железа, немного титана и рутила в прозрачной глазури с медленным охлаждением на конусе 10R на очищенном фарфоре.
Девитрификация прозрачной глазури
Эта глазурь состоит из мелкодисперсного диоксида кремния, кальцинированного каолина EP, фритты Ferro Frit 3249 MgO и Ferro Frit 3134. Ее измельчали в шаровой мельнице в течение 1, 3 и 6 часов с теми же результатами.Обратите внимание на происходящую кристаллизацию. Вероятно, это продукт MgO во фритте 3249. Эта фритта с высоким содержанием бора вводит его в гораздо более подвижном и текучем состоянии, чем тальк или доломит, а MgO является матирующим агентом (благодаря микрокристаллизации, которую он может производить). Жидкий расплав и мелкодисперсный кремнезем еще больше усиливают эффект.
Проблема с ярко окрашенными жидкими глазури: микрокристаллы
Кристаллизация (также называемая девритрификацией). Вы можете увидеть крошечные кристаллы на поверхности этой окрашенной медью глазури Cone 6 (G3806C).Предпочтительная ориентация оксидов металлов — кристаллическая. Когда печи быстро остывают, оксидам в средней глазури просто не хватает времени, чтобы организовать себя предпочтительным образом, и поэтому кристаллы не растут. Но если у глазури есть текучий расплав и она медленно остывает до температуры, при которой кристаллы хотят образовываться, они будут. Здесь также есть еще одна проблема: на поверхности есть крошечные ямочки. Это связано с тем, что здесь вместо оксида меди был использован карбонат меди. Во время обжига выделяется углекислый газ (потому что это карбонат), который пузырится из расплава, оставляя после себя ямочки, которые могут или не могут зажить во время охлаждения.
Сколько рутила может выдержать глазурь, прежде чем она станет нестабильной?
База скольжения Alberta с основанием 80:20 становится овсяной при перенасыщении рутилом или титаном (слева: 6% рутила, 3% титана; справа: 4% рутила, 2% титана справа). Эффект овсянки на самом деле заключается в кристаллизации избытка титана из раствора в расплаве при охлаждении печи. Хотя визуальные эффекты могут быть интересными, микрокристаллическая поверхность часто подвержена маркировке и вымыванию столовых приборов. Это потому, что кристаллы не такие стабильные и долговечные, как стекло глазури.
Оксид олова останавливает кристаллизацию в основной глазури GA6-A Alberta Slip
Обе эти кружки вымачивали 15 минут в конусе 6 (2200 ° F), затем охлаждали со скоростью 100 ° F в час до 2100 ° F и замачивали в течение 30 минут, а затем охлаждали со скоростью 200 ° F / час до 1500 ° F. Этот график обжига был разработан для устранения дефектов глазури, таких как отверстия и пузыри. Обычно глазурь GA6-A сильно кристаллизуется (расстекловывается) при этом типе обжига, но добавление 1% оксида олова к оксиду слева предотвратило такое поведение.
Пример того, как кобальт может осаждаться в глазури из жидкого расплава на конусе 6
Эта глазурь содержит значительное количество карбоната кобальта, и во время охлаждения избыток осаждается в виде розовых кристаллов во время охлаждения в печи. Этот эффект нежелателен, поскольку в данном случае он производит неприятную поверхность и цвет (на фото не ясно, насколько он розовый). Эта проблема может быть решена путем сочетания более быстрого охлаждения печи, увеличения содержания Al 2 O 3 в глазури (это делает расплав более жестким и предотвращает рост кристаллов) или более низкого обжига.
Идеальный шторм для создания бордово-синего помутнения при слабом пламени
Две прозрачные глазури, обожженные в одной печи с медленным охлаждением на одном теле с одинаковой толщиной. Почему один страдает борно-синим (1916Q), а другой нет? Химия и поиск материалов. Синие кристаллы бора растут лучше всего, когда имеется много бора (и других потоков энергии), содержание оксида алюминия мало, имеется достаточное количество кремнезема и охлаждение происходит достаточно медленно, чтобы дать им время для роста. В глазури слева B 2 O 3 выше, уровни борьбы с кристаллами Al 2 O 3 и MgO намного ниже, флюсование KNaO значительно выше, в нем больше SiO 2 и охлаждение идет медленно.Кроме того, он получает B 2 O 3 из фритты, что делает бор еще более доступным для образования кристаллов (глазурь справа — G2931F, он получает бор из улексита).
Конусная глазурь с высоким содержанием железа 10R потекла с вазы во время обжига. И кристаллизовался.
Железо — один из самых мощных флюсов при восстановительном обжиге. Обычно это глянцевая глазурь, но печь охлаждалась медленно, что приводило к полной кристаллизации поверхности. Кристаллы крупнее и многослойны на шейке.Их присутствие в виде тонкого слоя сверху полностью матировало остальную поверхность. С куска стекла стекало достаточно глазури, и ваза осталась стоять в луже расплавленного стекла.
Ссылки
| Глоссарий | Стекло против кристалла В керамике понимание разницы между стеклом и кристаллом обеспечивает основу для понимания физического присутствия глазури и глиняных тел. |
|---|---|
| Глоссарий | Аморфный |
| Глоссарий | Базовая глазурь Понимание вашей прозрачной глазури и умение регулировать ее текучесть расплава, тепловое расширение, цветовой отклик и т. Д. — это основа для создания всех ваших других глазурей. |
| Глоссарий | Бор синий Борсодержащий синий — это дефект глазури, связанный с кристаллизацией соединений кальция, бора и силикатов. Ее можно решить с помощью химии керамики. |
| Глоссарий | Кристаллические глазури Тип керамической глазури, изготовленной гончарами. Гигантские разноцветные кристаллы, выращенные на глянцевой глазури с низким содержанием глинозема путем управления несколькими выдержками и выдержками во время охлаждения |
| Глоссарий | Прозрачные глазури Каждая глянцевая керамическая глазурь — это на самом деле прозрачная основа с добавлением глушителей и красителей.Итак, разберитесь, как сделать хорошую прозрачную, а затем наложите на нее другие глазури. |
| Глоссарий | Матовая глазурь Случайные смеси материалов, которые хорошо тают, в подавляющем большинстве случаев хотят быть глянцевыми, поэтому создание матовой глазури, которая также является функциональной, — непростая задача. |
| Глоссарий | Витрификация Термин «застеклованный» относится к обожженному состоянию куска фарфора или керамики. Стеклокерамическая посуда была обожжена на достаточно высокой температуре, чтобы сделать ее очень прочной, твердой и плотной. |
| Недвижимость | Пестрота глазури |
| Недвижимость | Кристаллизация глазури |
Тони Хансен
Авторские права 2008, 2015, 2017 https://digitalfire.com, Все права защищены.
Типы кристаллизации — SoliQz
Кристаллизация с охлаждением является привлекательной, если растворимость продукта значительно увеличивается с повышением температуры. В таких случаях холодная кристаллизация обычно более энергоэффективна, чем испарительная кристаллизация.В процессе кристаллизации с охлаждением сырье охлаждается в теплообменнике, который может быть расположен внутри кристаллизатора или во внешнем контуре. Стенка кристаллизатора может использоваться как внутренний теплообменник, но теплообменник также может быть интегрирован в кристаллизатор в виде охлаждаемых трубок или пластин. Кристаллизация может происходить, когда жидкость охлаждается до температуры ниже равновесной растворимости. Самая низкая температура в системе — у поверхности теплообменника.Поэтому охлаждение необходимо проводить осторожно, чтобы предотвратить образование зародышей на холодной поверхности теплообменника, которое приведет к образованию корки. Обычно меры по предотвращению этого нежелательного явления состоят в уменьшении разницы температур между хладагентом и кристаллизующим раствором, в увеличении скорости жидкости вдоль поверхности теплообменника для выравнивания разницы температур по длине теплообменника или в использовании скребок для защиты поверхности теплообменника от твердых частиц.Альтернативными методами охлаждения, которые не требуют теплообменника, являются мгновенное охлаждение, которое включает (частичное) испарение растворителя, или прямое охлаждение путем введения холодного газа или охлаждающей жидкости.
Кристаллизацию расплава можно рассматривать как особую форму процесса кристаллизации при охлаждении. Основное отличие от кристаллизации при охлаждении из раствора заключается в отсутствии растворителей, что означает, что большинство процессов кристаллизации из расплава протекают вблизи точки плавления чистого продукта.Сырьем для процесса кристаллизации расплава является нечистый расплав. Охлаждение этого расплава ниже температуры равновесия обычно приводит к образованию твердой фазы, которая чище, чем сырье, в то время как примеси предпочитают оставаться в нечистом маточном растворе. В разделе 2.2 дается более подробная информация о кристаллизации расплава, которая также известна как фракционная кристаллизация.
Кристаллизационная вода — Infogalactic: ядро планетарного знания
В кристаллографии кристаллизационная вода или гидратная вода или кристаллизационная вода — это вода, которая находится внутри кристаллов.Для образования кристаллов часто необходима вода. [1] В некоторых случаях кристаллизационная вода представляет собой общий вес воды в веществе при данной температуре и в основном присутствует в определенном (стехиометрическом) соотношении. Классически «кристаллизационная вода» относится к воде, которая находится в кристаллическом каркасе металлического комплекса или соли, которая не связана напрямую с катионом металла
.При кристаллизации из воды или влажных растворителей многие соединения включают молекулы воды в свои кристаллические структуры.Кристаллизационную воду обычно можно удалить нагреванием образца, но кристаллические свойства часто теряются.
По сравнению с неорганическими солями, белки кристаллизуются с необычно большим количеством воды в кристаллической решетке. Содержание воды 50% не редкость.
Номенклатура
В молекулярных формулах кристаллизационная вода может обозначаться по-разному:
- « гидратированное соединение ⋅ n H 2 O » или « гидратированное соединение × n H 2 O »
- Это обозначение используется, когда соединение содержит только решетчатую воду или когда кристаллическая структура не определена.Например, хлорид кальция: CaCl 2 · 2H 2 O
- « гидратированный состав (H 2 O) n »
- Гидрат с координированной водой. Например, хлорид цинка: ZnCl 2 (H 2 O) 4
Положение в кристаллической структуре
Соль с связанной кристаллизационной водой известна как гидрат .Структура гидратов может быть довольно сложной из-за наличия водородных связей, определяющих полимерные структуры. [2] [3] Исторически структура многих гидратов была неизвестна, и точка в формуле гидрата использовалась для определения состава без указания того, как вода связана. Примеры:
- CuSO 4 • 5H 2 O — пентагидрат сульфата меди (II)
- CoCl 2 • 6H 2 O — гексагидрат хлорида кобальта (II)
- SnCl 2 • 2H 2 O — дигидрат хлорида олова (II) ( или олова)
Для многих солей точное связывание воды не имеет значения, потому что молекулы воды лабилизируются при растворении.Например, водный раствор, приготовленный из CuSO 4 • 5H 2 O и безводного CuSO 4 , ведут себя одинаково. Следовательно, знание степени гидратации важно только для определения эквивалентного веса: один моль CuSO 4 • 5H 2 O весит больше, чем один моль CuSO 4 . В некоторых случаях степень гидратации может иметь решающее значение для получаемых химических свойств. Например, безводный RhCl 3 не растворяется в воде и относительно бесполезен в металлоорганической химии, тогда как RhCl 3 • 3H 2 O универсален.Точно так же гидратированный AlCl 3 является слабой кислотой Льюиса и, следовательно, неактивен в качестве катализатора реакций Фриделя-Крафтса. Поэтому образцы AlCl 3 должны быть защищены от атмосферной влаги, чтобы предотвратить образование гидратов.
Кристаллы вышеупомянутого гидратированного сульфата меди (II) состоят из центров [Cu (H 2 O) 4 ] 2+ , связанных с ионами SO 4 2-. Медь окружена шестью атомами кислорода, представленными двумя различными сульфатными группами и четырьмя молекулами воды.Пятая вода находится в другом месте каркаса, но не связывается напрямую с медью. [4] Вышеупомянутый хлорид кобальта встречается как [Co (H 2 O) 6 ] 2+ и Cl —. В хлориде олова каждый центр Sn (II) является пирамидальным (средний угол O / Cl-Sn-O / Cl составляет 83 °) и связан с двумя ионами хлора и одним водой. Вторая вода в формульной единице связана водородными связями с хлоридом и координированной молекулой воды. Кристаллизационная вода стабилизируется электростатическим притяжением, следовательно, гидраты обычны для солей, содержащих катионы +2 и +3, а также анионы -2.В некоторых случаях большая часть веса соединения приходится на воду. Глауберова соль, Na 2 SO 4 (H 2 O) 10 , представляет собой белое кристаллическое твердое вещество с более чем 50% воды по весу.
Рассмотрим случай гексагидрата хлорида никеля (II). Этот вид имеет формулу NiCl 2 (H 2 O) 6 . Кристаллографический анализ показывает, что твердое вещество состоит из субъединиц [ транс -NiCl 2 (H 2 O) 4 ], связанных водородными связями друг с другом, а также из двух дополнительных молекул H 2 O.Таким образом, 1/3 молекул воды в кристалле не связаны напрямую с Ni 2+ , и их можно назвать «кристаллизационной водой».
Анализ
Содержание воды в большинстве соединений можно определить, зная его формулу. Неизвестный образец может быть определен с помощью термогравиметрического анализа (ТГА), когда образец сильно нагревается, а точный вес образца наносится на график в зависимости от температуры. Затем количество удаленной воды делится на молярную массу воды, чтобы получить количество молекул воды, связанных с солью.
Растворители кристаллизации прочие
Вода является особенно распространенным растворителем, который можно найти в кристаллах, поскольку он маленький и полярный. Но все растворителей можно найти в некоторых кристаллах-хозяевах. Вода заслуживает внимания, потому что она реакционноспособна, тогда как другие растворители, такие как бензол, считаются химически безвредными. Иногда в кристалле обнаруживается более одного растворителя, и часто стехиометрия варьируется, что отражается в кристаллографической концепции «частичного заполнения».«Химик обычно« сушит »образец в сочетании с вакуумом и нагреванием« до постоянного веса ».
Для других растворителей кристаллизации анализ удобно выполнять путем растворения образца в дейтерированном растворителе и анализа образца на наличие сигналов растворителя с помощью ЯМР-спектроскопии. Рентгеновская кристаллография монокристаллов часто может также обнаружить присутствие этих растворителей кристаллизации. В настоящее время могут быть доступны другие методы.
Таблица кристаллизационной воды в некоторых неорганических галогенидах
В таблице указано количество молекул воды на металл в различных солях. [5] [6]
| Формула гидратированных галогенидов металлов | Координационная сфера металлическая | Эквиваленты кристаллизационной воды , не связанные с M | Замечания |
|---|---|---|---|
| VCl 3 (H 2 O) 6 | транс- [VCl 2 (H 2 O) 4 ] + | два | |
| VBr 3 (H 2 O) 6 | транс- [VBr 2 (H 2 O) 4 ] + | два | бромидов и хлоридов обычно аналогичны |
| VI 3 (H 2 O) 6 | [V (H 2 O) 6 ] 3+ | нет | йодид плохо конкурирует с водой |
| CrCl 3 (H 2 O) 6 | транс- [CrCl 2 (H 2 O) 4 ] + | два | темно-зеленый изомер, он же соль Бьеррумса |
| CrCl 3 (H 2 O) 6 | [CrCl (H 2 O) 5 ] 2+ | один | сине-зеленый изомер |
| CrCl 2 (H 2 O) 4 | транс- [CrCl 2 (H 2 O) 4 ] | нет | квадратное плоское / тетрагональное искажение |
| CrCl 3 (H 2 O) 6 | [Cr (H 2 O) 6 ] 3+ | нет | фиолетовый изомер |
| MnCl 2 (H 2 O) 6 | транс- [MnCl 2 (H 2 O) 4 ] | два | |
| MnCl 2 (H 2 O) 4 | цис- [MnCl 2 (H 2 O) 4 ] | нет | note цис-молекулярный |
| MnBr 2 (H 2 O) 4 | цис- [MnBr 2 (H 2 O) 4 ] | нет | note цис-молекулярный |
| MnCl 2 (H 2 O) 2 | транс- [MnCl 4 (H 2 O) 2 ] | нет | полимерный с мостиковым хлоридом |
| MnBr 2 (H 2 O) 2 | транс- [MnBr 4 (H 2 O) 2 ] | нет | полимерный с мостиковым бромидом |
| FeCl 2 (H 2 O) 6 | транс- [FeCl 2 (H 2 O) 4 ] | два | |
| FeCl 2 (H 2 O) 4 | транс- [FeCl 2 (H 2 O) 4 ] | нет | молекулярный |
| FeBr 2 (H 2 O) 4 | транс- [FeBr 2 (H 2 O) 4 ] | нет | молекулярный |
| FeCl 2 (H 2 O) 2 | транс- [FeCl 4 (H 2 O) 2 ] | нет | полимерный с мостиковым хлоридом |
| FeCl 3 (H 2 O) 6 | транс- [FeCl 2 (H 2 O) 4 ] | два | только гидрат хлорида железа, изоструктурный аналогу Cr |
| CoCl 2 (H 2 O) 6 | транс- [CoCl 2 (H 2 O) 4 ] | два | |
| CoBr 2 (H 2 O) 6 | транс- [CoBr 2 (H 2 O) 4 ] | два | |
| CoI 2 (H 2 O) 6 | [Co (H 2 O) 6 ] 2+ | нет [7] | йодид плохо конкурирует с водой |
| CoBr 2 (H 2 O) 4 | транс- [CoBr 2 (H 2 O) 4 ] | нет | молекулярный |
| CoCl 2 (H 2 O) 4 | цис- [CoCl 2 (H 2 O) 4 ] | нет | примечание: цис-молекулярный |
| CoCl 2 (H 2 O) 2 | транс- [CoCl 4 (H 2 O) 2 ] | нет | полимерный с мостиковым хлоридом |
| CoBr 2 (H 2 O) 2 | транс- [CoBr 4 (H 2 O) 2 ] | нет | полимерный с мостиковым бромидом |
| NiCl 2 (H 2 O) 6 | транс- [NiCl 2 (H 2 O) 4 ] | два | |
| NiCl 2 (H 2 O) 4 | цис- [NiCl 2 (H 2 O) 4 ] | нет | примечание: цис-молекулярный |
| NiBr 2 (H 2 O) 6 | транс- [NiBr 2 (H 2 O) 4 ] | два | |
| NiI 2 (H 2 O) 6 | [Ni (H 2 O) 6 ] 2+ | нет [7] | йодид плохо конкурирует с водой |
| NiCl 2 (H 2 O) 2 | транс- [NiCl 4 (H 2 O) 2 ] | нет | полимерный с мостиковым хлоридом |
| CuCl 2 (H 2 O) 2 | [CuCl 4 (H 2 O) 2 ] 2 | нет | тетрагонально искаженный два длинных расстояния Cu-Cl |
| CuBr 2 (H 2 O) 4 | [CuBr 4 (H 2 O) 2 ] n | два | тетрагонально искаженный два больших расстояния Cu-Br |
См. Также
Список литературы
- ↑ Гринвуд, Норман Н.; Эрншоу, Алан (1997). Химия элементов (2-е изд.). Баттерворт-Хайнеманн. ISBN 0-08-037941-9 .
- ↑ Yonghui Wang et al. «Новые трехмерные сети с водородными связями, инкапсулирующие одномерные ковалентные цепи: …» Inorg. Chem. , 2002, 41 (24), стр. 6351–6357. DOI: 10.1021 / ic025915o
- ↑ Кармен Р. Мальдонадоа, Мигель Кирос и Дж. М. Салас: «Формирование двумерной морфологии воды в решетке соли… « Inorganic Chemistry Communications Volume 13, Issue 3, March 2010, p. 399–403; doi: 10.1016 / j.inoche.2009.12.033
- ↑ Меллер, Теральд (1 января 1980 г.). Химия: с неорганическим качественным анализом . Academic Press Inc (London) Ltd. стр. 909. ISBN 0-12-503350-8 . Проверено 15 июня 2014 г.
- ↑ К. Вайзуми, Х. Масуда, Х. Отаки, «Рентгеноструктурные исследования FeBr 2 4H 2 O, CoBr 2 4H 2 O, NiCl 2 4H 2 O , и CuBr 2 4H 2 O.Цис / транс-селективность в тетрагидрате дигалогенида переходного металла (I1) » Inorganica Chimica Acta , 1992 том 192, страницы 173–181.
- ↑ B. Morosin «Рентгеноструктурное исследование дигидрата хлорида никеля (II)» Acta Cryst. 1967. том 23, стр. 630-634. DOI: 10.1107 / S0365110X67003305
- ↑ 7,0 7,1 «Кристаллическая структура и термическое расширение жидкого гексагидрата никеля» (Кристаллическая структура и тепловое расширение гексагидрата иодида никеля (II)) Louër, Michele; Гранджан, Дэниел; Вейгель, Журнал Доминика по химии твердого тела (1973), 7 (2), 222-8.DOI: 10.1016 / 0022-4596 (73) -6
Кристаллизация белка — Creative Biostructure
- Дом
- Услуги
- Структурная биология
Рентгеновская кристаллография в настоящее время является наиболее популярным методом определения структуры белков и других макромолекул.Необходимым условием успешного применения в рентгеновской кристаллографии является получение монокристаллов целевого белка. Затем данные собираются путем дифракции рентгеновских лучей от монокристалла, который имеет упорядоченный образец ориентации атомов. Сборка атомов и молекул в кристалле может быть выведена из измерения рассеяния рентгеновских лучей.
В настоящее время более 120 000 белковых структур, разрешенных в экспериментах по рентгеновской кристаллографии, депонированы в банке данных белков, что составляет почти 90% разрешенных белков, что свидетельствует о преобладающей популярности рентгеновской кристаллографии в определении структуры.
Рисунок 1. Рост структур из экспериментов по рентгеновской кристаллографии, депонированных в PDB
Creative Biostructure предоставляет услуги по кристаллографии белков и рентгеновской кристаллографии на нашем современном оборудовании, а также разработала конвейер рентгеновской кристаллографии, охватывающий все технические этапы от синтеза гена до определения структуры. Наши опытные ученые работают в тесном сотрудничестве с клиентами, чтобы обеспечить быстрое выполнение и надежные результаты.
Ключевые особенности этой услуги?
- Получить трехмерную структуру белок / комплекс белок-белок / комплекс белок-небольшая молекула с высоким атомным разрешением; и предоставление структурной информации полезно для понимания функции белков и ускоряет процесс рационального дизайна лекарств.
- Он не ограничен молекулярной массой образца.
- Это помогает снизить технический барьер для получения монокристаллов определенных белков, таких как мембранный белок, которые трудно обрабатывать обычными методами.
- Алгоритм анализа структуры белков хорошо разработан, а установленная модель имеет высокую достоверность.
Что мы делаем — Интегрированный ген в структурные службы
Шаг 1. Оптимизация дизайна и выражения
| |
Этап 2: Очистка белка кристаллизационной степени
| |
Шаг 3. Кристаллизация и оптимизация белка
| |
Шаг 4: рентгеновский скрининг и сбор данных
| |
Шаг 5: Анализ данных и определение структуры
|
Creative Biostructure не только предоставляет качественные услуги по рентгеновской кристаллографии для клиентов по всему миру, но также предоставляет de novo подготовку кристаллов белка по запросу.Наши планы обслуживания содержат четко определенные методологии и инструменты, но при этом обладают большой гибкостью. Пожалуйста, свяжитесь с нами для получения дополнительной информации.
Creative Biostructure может предоставить множество стратегий кристаллизации, особенно для кристаллизации мембранных белков. Подробные услуги резюмируются следующим образом.
| Сервис | Характеристика |
| Совместная кристаллизация | Совместная кристаллизация сохраняет уникальные кристаллические структуры с их многочисленными компонентами (например,г., белки, ДНК / РНК, химические соединения, ионы металлов). |
| Кристаллизация бицелл-белка | Обеспечение более двухслойной среды для мембранных белков, чем в мицеллах детергентов, что позволяет использовать стандартную методологию скрининга кристаллизации для мембранных белков. |
| Кристаллизация липидной кубической фазы (LCP) | LCP имеет мембранно-миметическую матрицу, подходящую для стабилизации и кристаллизации мембранных белков в липидной среде. |
| Управляемая В мезо-фазе Кристаллизация (CIMP) | CIMP стабилизирует мембранные белки в мезо-фазе и позволяет осуществлять прямой мониторинг фазовых превращений и процессов кристаллизации. |
| Кристаллизация для флуоресцентной маркировки | Отлично подходит для обнаружения и идентификации кристаллов путем ковалентной маркировки флуоресцентного зонда на белке.Флуоресцентный зонд концентрируется вместе с образованием кристаллов, производя флуоресценцию, которую можно визуально обнаружить в микроскопическом поле. |
| Стратегии кристаллизации шаперона | Совместная кристаллизация сложных белковых мишеней с растворимыми белковыми шаперонами. |
| Кристаллизация с использованием библиотеки мутантов | Улучшение растворимости и кристаллизации белков благодаря созданию и скринингу мутантной библиотеки. |
Решения по оптимизации кристаллов
Ваши особые типы проб для кристаллизации
Не стесняйтесь обращаться к нам, чтобы обсудить ваш проект!
Процесс заказа
Список литературы
- Дарси, Аллан, и др. .(2014) «Скрининг матрикса микросемян для оптимизации кристаллизации белка: что мы узнали?» Acta crystallographica. Раздел F, Структурные биологические коммуникации 70 (Pt 9): 1117-1126.
- Мартин Р. Хедигер, и др. . (2012) «Веб-интерфейс BioFET-SIM: реализация и два приложения» PLOS one https://doi.org/10.1371/journal.pone.0045379.



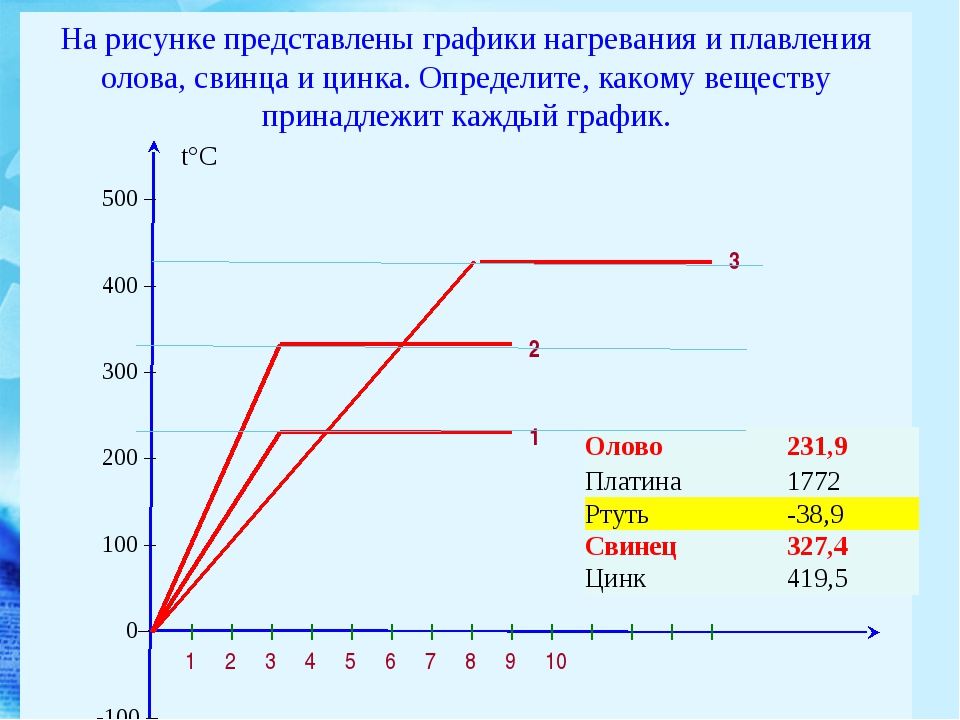
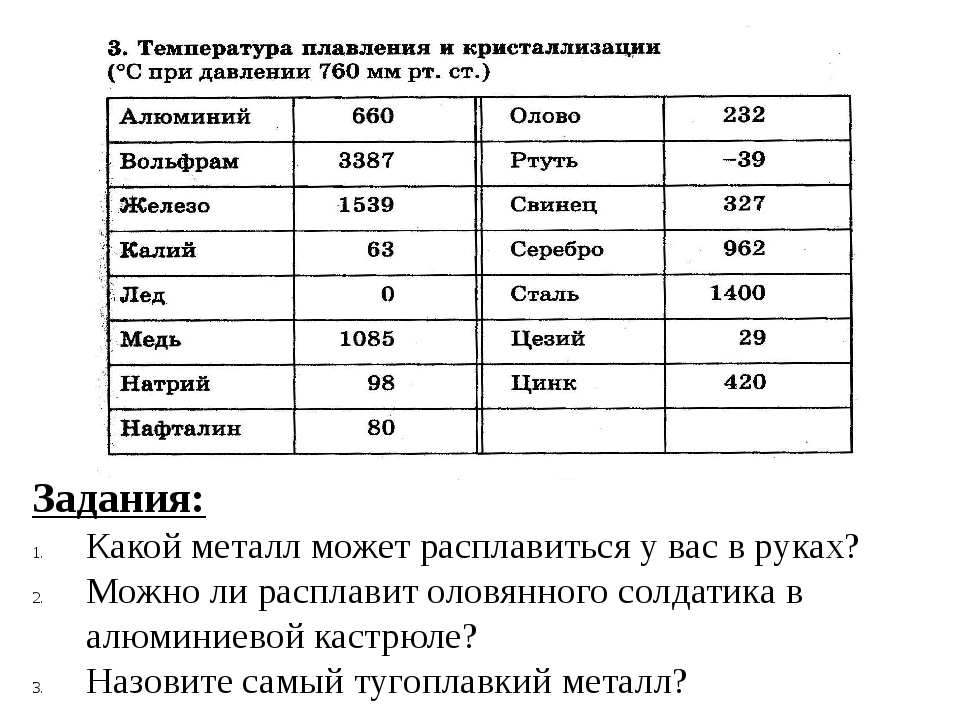 Температура плавления — 270°C.
Температура плавления — 270°C.

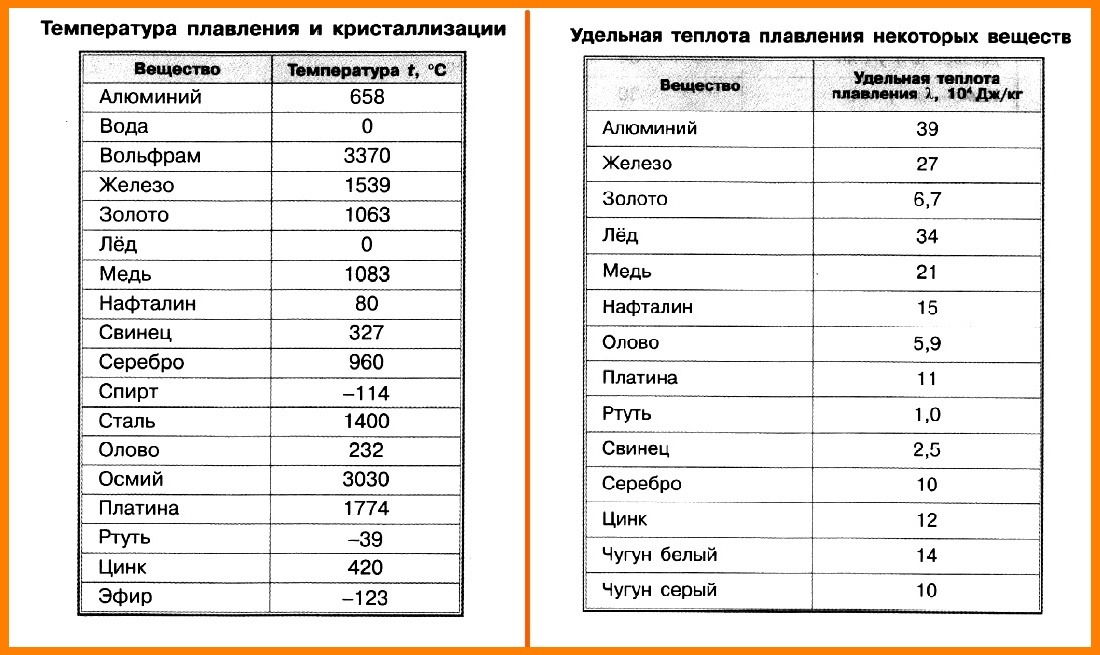 Исключение составляют лед, висмут и некоторые
другие вещества.
Исключение составляют лед, висмут и некоторые
другие вещества.