Самовозгорание парафина
Описание:
Наполняем пробирку стружками парафина от свечи. В пламени горелки расплавляем его (переводим в жидкое состояние). Продолжаем нагревать парафин до кипения. Температура кипения парафина 400°С. Затем выливаем кипящий парафин тонкой струйкой. При соприкосновении с поверхностью стола парафин испарился в виде большого облака, которое в воздухе самовоспламеняется. Получается достаточно красивый эффект огненного облака.
Объяснение:
Горение – это экзотермическая реакция окисления, протекающая с достаточно большой скоростью.
Схематически процесс окисления можно выразить следующим образом:
Парафин в твердом виде не горит, впрочем, как и в жидком. Горят пары парафина.
В общем виде химическая реакция горения парафина описывается следующим образом:
CnH2n+2 + (1,5n+0,5) O2 = nCO2 + (n+1) H2O
где n – количество атомов углерода (для парафина n = от 18 до 35)
(т. е. сам парафин представляет собой смесь углеводородов C18H38…C35H72)
е. сам парафин представляет собой смесь углеводородов C18H38…C35H72)
При нагревании до 400 градусов молекулы парафина рвутся на куски (углеводородные радикалы).
(Радикал — вид атома или молекулы, имеющий один или два неспаренных электрона на внешней электронной оболочке. Наличие неспаренного электрона способно значительно усилить реакционную способность данного элемента. )
Радикалы углеводорода (пары парафина) легко вступают в реакцию с кислородом воздуха. Происходит радикальное окисление парафина кислородом с выделением большого количества тепла в виде пламени.
Почему пары парафина не воспламеняются в пробирке? Да потому, что у них малая площадь соприкосновения с кислородом (недостаточная для реакции быстрого окисления). Но когда выливаем раскаленный парафин на холодную поверхность, он быстро испаряется в облако парафина, которое распыляясь в воздухе контактирует с достаточным количеством кислорода для воспламенения.
Лекция 2
ИСХДНЫЕ ВЕЩЕСТВА ДЛЯ ПРОЦЕССОВ
ОРГАНИЧЕСКОГО СИНТЕЗА
ПАРАФИНЫ
Промышленность органического синтеза базируется на трех видах ископаемого сырья: каменном угле, нефти и природном газе. Переработкой которых получают пять главных групп исходных веществ для синтеза других соединений: парафины, олефины, ароматические углеводороды, ацетилен, оксид углерода и синтез-газ (смесь СО и Н2).
Парафины
разделяют на низшие (от С
Парафиновые
углеводороды от метана до бутанов при
обычных условиях являются газообразными
веществами, пентаны – низкокипящие
жидкости. Парафины до С16 при комнатной температуре представляют
собой жидкости, свыше С16 – твердые вещества.
Парафины до С16 при комнатной температуре представляют
собой жидкости, свыше С16 – твердые вещества.
В
гомологическом ряду
алканов постепенно повышаются температуры
кипения, плавления,
а также относительные плотности. Это
позволяет предвидеть сволйства
неизвестного члена ряда, основываясь
на свойствах его
соседей. Например, т. кип. гексана 68,6 °С,
гептана 98,4 °С. Разница
в составе на одну группу СН
 Алканы с разветвленной цепью
кипят при более
низкой температуре, чем изомеры с
нормальной цепью.
Алканы с разветвленной цепью
кипят при более
низкой температуре, чем изомеры с
нормальной цепью.В неполярных жидкостях между поверхностями молекул действуют ван-дер-ваальсовы силы. Чем больше молекула и ее поверхность, тем сильнее межмолекулярное взаимодействие. С увеличением относительной молекулярной массы температуры кипения повышаются. Форма разветвленной молекулы стремится к сферической, площадь ее поверхности уменьшается, уменьшаются и межмолекулярные силы, которые легче преодолеваются при более низких температурах.
Температуры плавления постепенно возрастает с удлинением углеродной цепи.
Плотности всех алканов меньше единицы. Они практически нерастворимы в воде, однако растворимы в эфире и других органических растворителях. Метан и этан почти лишены запаха, углеводороды С3 — C15 имеют всем хорошо известный запах бензина или керосина, высшие члены ряда лишены запаха из-за малой летучести
Способность
низших парафинов сорбироваться возрастает
с увеличением молекулярной массы
парафина, что используют для разделения
парафинов С1,
С2,
С3 и С4 адсорбцией и десорбцией.
Низшие парафины образуют с воздухом взрывоопасные смеси. Токсичность низших парафинов не столь велика по сравнению с другими углеводородами, но при постоянном вдыхании постепенно развиваются наркотические явления.
В химическом отношении алканы мало активны, за что и были названы парафинами (от лат. раrum affinis — лишенные сродства). Известный русский химик М. И. Коновалов (1858—1906 гг.) образно называл парафины «химическими мертвецами» за их пассивность.
Химическое
поведение насыщенных углеводородов
определяется характером
и прочностью имеющихся в их молекулах
связей. Устойчивость
углерод-углеродной (С—С) связи обусловлена
малым размером атома углерода и его
тетраэдрической конфигурацией
в состоянии sр σ-Связь в молекулах
алканов мало поляризована вследствие
близкой электроотрицательности
углерода и водорода (2,5 и 2,1 соответственно).
В силу этого предельные углеводороды
— вещества, мало полярные и трудно
поляризуемые. Они не проявляют склонности
к гетеролитическому
разрыву. Атаки нуклеофильных и
электрофильных реагентов
затруднены, поэтому к ионным реагентам
парафины устойчивы. На
них не действуют при обычных температурах
концентрированные
кислоты (азотная, серная и др.), расплавленные
и концентрированные
щелочи, обычные окислители (перманганат
калия, хромовая
смесь). Металлы, даже щелочные, не
вытесняют водород из
этих соединений. Эти свойства используются
на практике, например, щелочные
металлы хранят в керосине, различные
металлические
изделия с целью предохранения их от
коррозии покрывают
смазочными маслами, концентрированную
серную кислоту и концентрированные
щелочи используют для очистки
нефтепродуктов
и др.
σ-Связь в молекулах
алканов мало поляризована вследствие
близкой электроотрицательности
углерода и водорода (2,5 и 2,1 соответственно).
В силу этого предельные углеводороды
— вещества, мало полярные и трудно
поляризуемые. Они не проявляют склонности
к гетеролитическому
разрыву. Атаки нуклеофильных и
электрофильных реагентов
затруднены, поэтому к ионным реагентам
парафины устойчивы. На
них не действуют при обычных температурах
концентрированные
кислоты (азотная, серная и др.), расплавленные
и концентрированные
щелочи, обычные окислители (перманганат
калия, хромовая
смесь). Металлы, даже щелочные, не
вытесняют водород из
этих соединений. Эти свойства используются
на практике, например, щелочные
металлы хранят в керосине, различные
металлические
изделия с целью предохранения их от
коррозии покрывают
смазочными маслами, концентрированную
серную кислоту и концентрированные
щелочи используют для очистки
нефтепродуктов
и др.
Для
насыщенных углеводородов возможен лишь
гомолитический,
радикальный разрыв связей, при этом
происходит замещение атомов
водорода, расщепление углеродного
скелета (крекинг), окисление
частичное или полное (сгорание). Все это
определяет круг
реакций, к которым способны парафины;
это в первую очередь радикальные
реакции замещения, идущие
в довольно жестких условиях
(действие света, высокой температуры и
др.) К реакциям
присоединения алканы
не способны. В этом их принципиальное
отличие от непредельных углеводородов.
Все это
определяет круг
реакций, к которым способны парафины;
это в первую очередь радикальные
реакции замещения, идущие
в довольно жестких условиях
(действие света, высокой температуры и
др.) К реакциям
присоединения алканы
не способны. В этом их принципиальное
отличие от непредельных углеводородов.
Выделение низших парафинов
Главным источником низших парафинов (С1-С5) являются природный и попутный газы, газ газоконденсатных месторождений, а также нефтезаводские газы от процессов переработки нефтепродуктов в присутствии водорода (риформинг).
Природными
называют газы, добываемые из чисто
газовых месторождений. Иногда они
содержат большие количества диоксида
углерода, азота, гелия. Для газоконденсатных
месторождений обычно характерно высокое
давление, и при его снижении происходит
сепарация и выделяется газ и жидкий
конденсат. Природный газ выгодно
использовать только как источник метана.
Попутными называют газы, выделяющиеся вместе с нефтью при ее добыче из нефтяных скважин. Часть этих газов отделяется в сепараторах, а другая остается растворенной в нефти и отделяется при ее стабилизации, т.е. отгонке летучих компонентов (газы-стабилизации). Удаляемые из нефти газы и легкие фракции (газы стабилизации) состоят главным образом из низших парафиновых углеводородов C1—С5. Газы стабилизации представляют собой ценное химическое сырье; их можно разделять на индивидуальные углеводороды и перерабатывать затем в различные продукты органического синтеза.
Типичный состав разных газов представлен в табл. 1.1
Таблица
1.1 Состав
углеводородных газов (в %
об.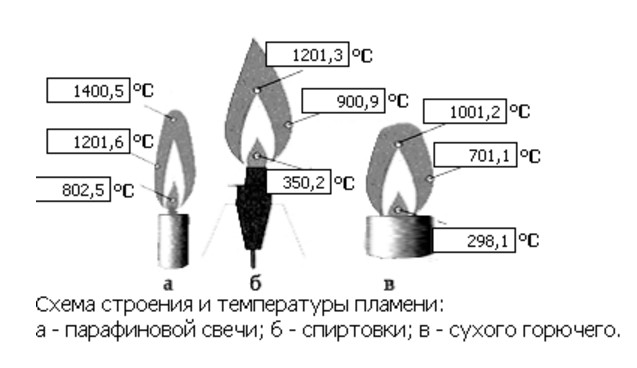 )
)
Газ | СН4 | С2Н6 | С3Н8 | С4Н10 | С5Н12 | N2 и др. |
Природный газ | 70-97,5 | 0,1-8 | 0,1- 4 | 0,01- 1 | 0 — 0,3 | 1-15 |
Газоконденсатное | 75-95 | 3-9 | 1-3 | 0,5-1 | 0,5-1 | 1-4 |
Попутный газ после сепаратора | 35-90 | 4-20 | 3-30 | 2-13 | 1-4 | 0,5-11 |
После стабилизации | 1-5 | 5-15 | 20-30 | 30-40 | 15-25 | — |
Для
разделения попутного газа можно
использовать способы абсорбции,
адсорбции, конденсации и ректификации.
Низшие парафины плохо растворяются в воде и полярных жидкостях (в низших спиртах, кетонах, альдегидах), но поглощаются другими углеводородами и твердыми адсорбентами (активным углем). Их способность сорбироваться возрастает с увеличением молекулярной массы парафина, что используют для разделения парафинов С1 С2, С3 и С4 абсорбцией и адсорбцией.
Абсорбцией называют процесс избирательного извлечения одного или нескольких компонентов из газовой смеси жидким компонентом (абсорбентом). В абсорбционных процессах участвуют две фазы – жидкая и газовая. При их контактировании один компонент ( либо несколько) переходит из одной фазы в другую. При наличии в газовой фазе компонента (компонентов), практически не растворяющегося в жидкой фазе, его называют инертом, или газом-носителем. Растворяющийся компонент — это абсорбируемый компонент, или поглощаемый компонент.
Абсорбция
весьма широко применяется в химической
и смежных отраслях промышленности. При
этом преследуется две главные цели:
извлечение ценных компонентов из газовой
смеси; очистки газовых смесей от примесей
перед их выбросом в атмосферу.
При
этом преследуется две главные цели:
извлечение ценных компонентов из газовой
смеси; очистки газовых смесей от примесей
перед их выбросом в атмосферу.
Основные проблемы при осуществлении абсорбции связаны с подбором абсорбента и созданием рациональных условий контактирования газа и жидкости.
Наибольшее
распространение нашел ректификационный
метод, в котором при отделении трудно
конденсирующихся газов используют
не только повышенное давление (2—4
МПа), но и достаточно глубокий холод,
например пропанового холодильного
цикла. При отделении от других
углеводородов этана и особенно метана
низкотемпературную ректификацию
нередко комбинируют с абсорбцией, чтобы
избежать применения слишком глубокого
и дорогостоящего холода. При этом методе
выделения парафинов предусматривается
выделение достаточно чистых фракций
нормального и изобутана, нормального
и изопентана, в то время как низшие
углеводороды могут выпускаться в виде
смеси или фракций С1-С2 с разным содержанием других углеводородов.
На комбинатах, базирующихся на переработке попутного газа, разделение его осуществляют на газофракционирующих (ГФУ) или центральных газофракционирующих установках (ЦГФУ). Они работают по разным схемам с числом колонн 6—10 и суммарным количеством в них тарелок от 400 до 700. При этом предусматривается выделение достаточно чистых фракций н- и изобутана, н- и изопентана, в то время как низшие углеводороды могут выпускаться в виде смеси (сухой газ) или фракций С1 и С2 с разным содержанием других углеводородов
Метан и этан, содержащиеся в сухом газе, можно разделить низкотемпературной ректификацией, при которой флегма создается путем охлаждения жидким пропаном и этаном при давлении 4,0—4,5 МПа. Кроме того, природный газ, содержащий 96—97 % СН4, может непосредственно применяться в качестве технического метана.
ЦГФУ.
ЦГФУ работают по разным схемам с числом
колонн 6-10 и суммарным количеством в них
тарелок от 400 до 700. Существенно, что
разница в температурах кипения бутана
и изобутана (-0,5 и -11,7), а также пентана и
изопентана достаточно велика, и это
позволяет разделять изомеры ректификацией.
Существенно, что
разница в температурах кипения бутана
и изобутана (-0,5 и -11,7), а также пентана и
изопентана достаточно велика, и это
позволяет разделять изомеры ректификацией.
Разделение низших парафинов происходит при давлении 0,7-1,8 МПа.
Область применения низших парафинов. Из низших парафинов в качестве сырья для органического синтеза больше всего используют метан, н-бутан и изобутан, изопентан. Значительно меньше применяют этан и особенно пропан.
Выделение высших парафинов
Главным источником жидких и твердых парафинов, используемых в процессах органического синтеза, является нефть. Нефть состоит главным образом из парафиновых, нафтеновых и ароматических углеводородов с большей или меньшей примесью кислород- и серосодержащих соединений. В зависимости от месторождения я соотношение в нефти упомянутых углеводородов значительно меняется.
Начальной стадией переработки нефти является прямая перегонка при атмосферном давлении (атмосферная перегонка), при которой из нефти выделяют следующие фракции:
бензиновые 40-200
лигроиновые 150-250
керосиновые 180-300
газойлевые
250-360.
Остаток от атмосферной перегонки (мазут) подвергают далее вакуумной перегонке для получения смазочных масел с разной летучестью и вязкостью.
В газойлевых и керосиновых фракциях, в смазочных маслах может содержаться до 30% н-парафинов. Для выделения парафинов применяют несколько методов.
Производство жидких парафинов. Жидкие параифны С11-С20 с молекулярной массой 150-280, перегоняющиеся в пределах 195-340 0С, получают в результате депарафинизации прямогонных фракций керосина и дизельного топлива. С этой целью используют карбамидную депарафинизацию и адсорбционной выделение парафинов на цеолитах.
Карбамидная
депарафинизация.
Карбамидная депарафинизация основана
на способности карбамида в определенных
условиях образовывать с нормальными
парафинами нерастворимые в углеводородах
твердые комплексы (аддукты, клатраты),
разлагающиеся при повышенной температуре.
Образование комплексов карбамида с н-парафинами можно рассматривать как своеобразную химическую реакцию.
RH + nCO(NH2)2RH∙ nCO(NH2)2.
Кроме н-парафинов карбамид образует комплексы и с другими соединениями, имеющими линейное строение молекул – олефинами, эфирами, кислотами. Свойствами образовывать комплексы с углеводородами нормального строения обладают и другие соединения – некоторые производные карбамида, а также гидрохинон. Однако на практике для выделения н-парафинов из нефтяных фракций используют только карбамид.
Желательно, чтобы в сырье для процесса карбамидной депарафинизации не было смол и серосодержащих соединений, так как они являются ингибиторами комплексообразования. Поэтому, как правило, проводят предварительную гидроочистку сырья.
При
этом для увеличения скорости и полноты
процесса комплексообразования используют
активирующие добавки (алифатические
спирты, кетоны). Активаторы препятствуют
адсорбции ингибиторов на кристаллах
карбамида. Кроме того, активаторы,
растворяя часть карбамида, способствуют
протеканию процесса в гомогенной среде
с большей скоростью.
Активаторы препятствуют
адсорбции ингибиторов на кристаллах
карбамида. Кроме того, активаторы,
растворяя часть карбамида, способствуют
протеканию процесса в гомогенной среде
с большей скоростью.
К исходной смеси добавляют растворитель для снижения вязкости, обеспечения тесного контакта карбамида с н-парафинами, облегчения транспортирования образующихся суспензий. Проведение процесса с растворителем повышает чистоту выделяемых н-парафинов.
Технологические приемы осуществления карбамидной депарафинизации весьма разнообразны. Суть процессов заключается в
— контактировании сырья с карбамидом при 10-50 0С,
— отделении кристаллического комплекса (осадка),
— разложении комплекса при 70-100 0С.
В
промышленной практике используют три
варианта ведения процесса карбамидной
депарафинизации, в которых для
комплексообразования используются: 1)
водно-спиртовой раствор карбамида, 2)
водный раствор карбамида, 3) кристаллический
карбамид.
Адсорбционное выделение на цеолитах. Кристаллические алюмосиликаты – цеолиты – обладают способностью сорбировать вещества, у которых поперечный размер молекул меньше диаметра входных отверстий в полости кристаллической структуры цеолита. Молекулы нормальных парафинов обладают наименьшим поперечным размером среди всех предельных углеводородов (0,49 нм). Поперечный размер молекул изопарафинов, алициклических или ароматических углеводородов превышает 0,6-0,7 нм. Поэтому при контактировании смесей углеводородов с цеолитами, имеющимиразмер входных окон ≈0,5 нм, нормальные парафины селективно адсорбируются. На этом явлении основываются процессы выделения нормальных парафинов из различных нефтяных фракций, широко используемые в промышленной практике в различных модификациях.
В
принципе, любой процесс адсорбционного
извлечения нормальных парафинов
складывается из трех последовательно
осуществляемых операций: 1) адсорбции,
во время которой происходит поглощение
цеолитом н-парафинов; 2) продувки, цель
которой заключается в удалении сырья,
удержанного между гранулами цеолита и
примесей, слабо адсорбированных на
внешней поверхности гранул; 3) десорбции
н-парафинов.
Наиболее сложная и энергоемкая стадия процесса – десорбция парафинов, которая может осуществляться термическим методом, а также за счет понижения давления или отдувки парафинов неадсорбирующимся газом. Наиболее эффективной считается вытеснительная десорбция, когда в качестве десорбента используют вещества, способные адсорбироваться цеолитом – низкомолекулярные н-парафины, двуокись углерода, аммиак.
Производство твердых парафинов. Для получения твердых парафинов на практике используется, главным образом, метод кристаллизации с применением селективных растворителей. Сущность процесса заключается в отфильтровывании кристаллов парафина, образующихся при охлаждении прямогонных или гидроочищенных масляных дистиллятов. Добавляемые в масло перед охлаждением растворители снижают его вязкость. К растворителям предъявляются следующие требования:
— применяемые растворители должны полностью растворять масляную часть и, по возможности, не растворять парафины;
— не вступать в химическое взаимодействие с перерабатываемыми продуктами;
— легко регенерироваться;
— иметь низкую коррозионную активность;
—
обладать низкой токсичностью, пожаро-
и взрывоопасностью.
Применяемые на практике растворители представляют собой, обычно, смеси из двух или нескольких полярных и неполярных компонентов. В качестве полярных компонентов используют кислородсодержащие соединения (кетоны, спирты), хлорпарафины, а в качестве неполярных – парафины С5-С6 или ароматические углеводороды (бензол, толуол). На заводах при выделении твердых парафинов из масел в качестве растворителей используются, в основном, смеси ацетона с бензолом и толуолом.
Область
применения высших парафинов.
Практические значение в качестве
исходных веществ для органического
синтеза имеют в основном парафины с
прямой цепью углеродных атомов. Спектр
применения парафинов в народном хозяйстве
весьма широк. Они используются для
пропитки древесины, бумаги и картона,
применяются в резинотехнической,
электротехнической и радиотехнической
промышленности, в медицине, косметике
и некоторых других областях (изготовление
свечей, изоляционных лент, чернил и
т. д.). В нефтехимии н-парафины применяются,
в основном, в качестве сырья для
производства алкилбензолов,
алкансульфонатов, синтетических жирных
кислот.
д.). В нефтехимии н-парафины применяются,
в основном, в качестве сырья для
производства алкилбензолов,
алкансульфонатов, синтетических жирных
кислот.
Парафин в дизельном топливе: как убрать, температура кристаллизации, содержание по ГОСТу
Дизельное топливо представляет собой сложную смесь различных групп углеводородов и химических соединений — ароматических, нафтеновых, парафиновых, сернистых, азотных, кислородных и других. В зависимости от марки нефти и места её добычи концентрации составляющих веществ могут меняться.
Откуда в дизельном топливе парафин
Парафиновые группы изначально присутствуют в нефти и при перегонке благополучно перекочёвывают в дизтопливо. Их положительным свойством является повышение скорости возгорания топлива. Отрицательная функция намного более значима — именно парафины являются причиной замерзания топлива при наступлении отрицательных температур.
В дизельном топливе парафин образуется только с наступлением морозов. Обычно при температуре -5 ºС топливо начинает мутнеть. Это и есть признак начала кристаллизации парафина, и температура помутнения отмечается в каждом паспорте на дизельное топливо.
Обычно при температуре -5 ºС топливо начинает мутнеть. Это и есть признак начала кристаллизации парафина, и температура помутнения отмечается в каждом паспорте на дизельное топливо.
Пока кристаллы малы, они проходят сквозь сетку топливного фильтра, и двигатель продолжает работать. При дальнейшем снижении (до -7 ºС) кристаллы парафина начинают слипаться в агломераты, и наступает точка температуры предельной фильтруемости, при которой сгустки становятся настолько большими, что не проходят через фильтр, поступление топлива прекращается, машина останавливается. Это состояние наступает при температуре застывания топлива — примерно при -10 ºС.
Как убрать парафин из дизельного топлива
Есть несколько способов избежать появления парафина в баке и фильтре или избавиться от него.
- Самый действенный — следить за погодой и при приближении мороза заменить летнее топливо зимним, которое можно использовать при отрицательных температурах до -20 ºС без дополнительных хлопот.

- Можно не заменять топливо зимним, если в баке остаётся ещё много летнего. Нужно добавить в него депрессорную присадку (антигель), которая не позволит кристаллам парафина слипаться, и вы сможете дожечь это топливо в двигателе даже при морозах. Нужно только определить объём оставшегося горючего, чтобы правильно рассчитать количество добавки. Операцию нужно выполнять при температуре топлива не ниже +5 ºС, иначе эффекта не будет — присадка не растворяет уже образовавшиеся сгустки.
- Машину с забившимся фильтром на эвакуаторе отвозят в тёплый бокс с tº > +5 ºС и выдерживают до полного растворения парафина, затем сливают топливо или добавляют в него присадку.
- Используют размораживатель — специальный препарат, который вводят в фильтр и в бак. Он эффективно растворяет агломераты.
- Крайний случай. Временно исключают магистраль забившегося фильтра, чтобы добраться до места ремонта.
С 2014 года в России введён ГОСТ Р 55475-2013 на дизельное топливо, содержание в котором парафина ограничено, поскольку горючее очищают методом каталитической депарафинизации. Речь идёт о зимних и арктических сортах. Очистка, конечно, увеличивает стоимость топлива, но позволяет ездить зимой без проблем.
Речь идёт о зимних и арктических сортах. Очистка, конечно, увеличивает стоимость топлива, но позволяет ездить зимой без проблем.
Звоните по номеру +7 (812) 426-10-10. С нами удобно, доставка 24/7
Температура вспышки — Карта знаний
- Температура вспышки — наименьшая температура летучего конденсированного вещества, при которой пары над поверхностью вещества способны вспыхивать в воздухе под воздействием источника зажигания, однако устойчивое горение после удаления источника зажигания не возникает. Вспышка — быстрое сгорание смеси паров летучего вещества с воздухом, сопровождающееся кратковременным видимым свечением. Температуру вспышки следует отличать как от температуры воспламенения, при которой горючее вещество способно самостоятельно гореть после прекращения действия источника зажигания, так и от температуры самовоспламенения, при которой для инициирования горения или взрыва не требуется внешний источник зажигания.

По температуре вспышки из группы горючих жидкостей выделяют легковоспламеняющиеся. Легковоспламеняющимися называются горючие жидкости с температурой вспышки не более 61 °C в закрытом тигле (з. т.) или 66 °C в открытом тигле (о. т.). Жидкости с температурой вспышки не более 28 °C называют особо опасными.
Для определения температуры вспышки применяются расчётные или экспериментальные методы. Как правило, при отсутствии указания на метод измерения используется метод Пенского — Мартенса.
Источник: Википедия
Связанные понятия
Температура воспламенения — наименьшая температура вещества, при которой пары над поверхностью горючего вещества выделяются с такой скоростью, что при воздействии на них источника зажигания наблюдается воспламенение. Воспламенение — пламенное горение вещества, инициированное источником зажигания и продолжающееся после его удаления, то есть возникает устойчивое горение (ср. Температура вспышки, Температура самовоспламенения).
Температура самовоспламене́ния — наименьшая температура горючего вещества, при нагреве до которой происходит резкое увеличение скорости экзотермических объёмных реакций, приводящее к возникновению пламенного горения или взрыва.
Горе́ние — сложный физико-химический процесс превращения исходных веществ в продукты сгорания в ходе экзотермических реакций, сопровождающийся интенсивным выделением тепла. Химическая энергия, запасённая в компонентах исходной смеси, может выделяться также в виде теплового излучения и света. Светящаяся зона называется фронтом пламени или просто пламенем.
Ацетилендинитрил — иначе субнитрид углерода, дицианоацетилен C4N2, представляет собой бесцветное вещество способное легко растворяться в углеводородах.
Температура вспышки, Температура самовоспламенения).
Температура самовоспламене́ния — наименьшая температура горючего вещества, при нагреве до которой происходит резкое увеличение скорости экзотермических объёмных реакций, приводящее к возникновению пламенного горения или взрыва.
Горе́ние — сложный физико-химический процесс превращения исходных веществ в продукты сгорания в ходе экзотермических реакций, сопровождающийся интенсивным выделением тепла. Химическая энергия, запасённая в компонентах исходной смеси, может выделяться также в виде теплового излучения и света. Светящаяся зона называется фронтом пламени или просто пламенем.
Ацетилендинитрил — иначе субнитрид углерода, дицианоацетилен C4N2, представляет собой бесцветное вещество способное легко растворяться в углеводородах.Упоминания в литературе
Керосин является легковоспламеняющимся продуктом, так как температура вспышки у него 57° С при открытом тигле, а самовоспламенение происходит при 216° С. При этом воспламенение керосина происходит в температурных пределах 35–75° С, а его пары взрываются в пределах 1,4–7,5% объема.
Температурой вспышки называют температуру, при которой пары мазута в смеси с воздухом вспыхивают при контакте с открытым пламенем. У разных марок мазута температура вспышки меняется в широком диапазоне. Мазуты, не содержащие парафинов, имеют температуру вспышки от 135 до 234 °С, а температура вспышки парафинистых мазутов близка к 60 °С. При выборе схемы подогрева мазута следует учитывать температуру вспышки, чтобы не допустить пожароопасной ситуации.
Битумно-полимерные мастики относятся к группе нетоксичных горючих материалов (группа Г4 ГОСТ 30244) с температурой вспышки не ниже 220 °C и температурой самовоспламенения не ниже 300 °C.
При этом воспламенение керосина происходит в температурных пределах 35–75° С, а его пары взрываются в пределах 1,4–7,5% объема.
Температурой вспышки называют температуру, при которой пары мазута в смеси с воздухом вспыхивают при контакте с открытым пламенем. У разных марок мазута температура вспышки меняется в широком диапазоне. Мазуты, не содержащие парафинов, имеют температуру вспышки от 135 до 234 °С, а температура вспышки парафинистых мазутов близка к 60 °С. При выборе схемы подогрева мазута следует учитывать температуру вспышки, чтобы не допустить пожароопасной ситуации.
Битумно-полимерные мастики относятся к группе нетоксичных горючих материалов (группа Г4 ГОСТ 30244) с температурой вспышки не ниже 220 °C и температурой самовоспламенения не ниже 300 °C.Связанные понятия (продолжение)
Газофазный синтез с конденсацией паров или метод испарения и конденсации (англ. gas-phase synthesis with vapour condensation или evaporation-condensation method) — метод получения нанопорошков металлов, сплавов или соединений путём конденсации их паров при контролируемой температуре в атмосфере инертного газа низкого давления.
Водород считается одним из наиболее перспективных топлив как эффективный и экологически чистый энергоноситель. С практической точки зрения горение водорода связано с его использованием в энергетических установках и топливных элементах и безопасностью соответствующих технологических процессов и устройств. Удельная теплота сгорания водорода составляет примерно 140 МДж/кг (верхняя) или 120 МДж/кг (нижняя), что в несколько раз превышает удельную теплоту сгорания углеводородных топлив (для метана — около…
gas-phase synthesis with vapour condensation или evaporation-condensation method) — метод получения нанопорошков металлов, сплавов или соединений путём конденсации их паров при контролируемой температуре в атмосфере инертного газа низкого давления.
Водород считается одним из наиболее перспективных топлив как эффективный и экологически чистый энергоноситель. С практической точки зрения горение водорода связано с его использованием в энергетических установках и топливных элементах и безопасностью соответствующих технологических процессов и устройств. Удельная теплота сгорания водорода составляет примерно 140 МДж/кг (верхняя) или 120 МДж/кг (нижняя), что в несколько раз превышает удельную теплоту сгорания углеводородных топлив (для метана — около…Подробнее: Горение водорода
Пересы́щенный пар — пар, давление которого превышает давление насыщенного пара при данной температуре.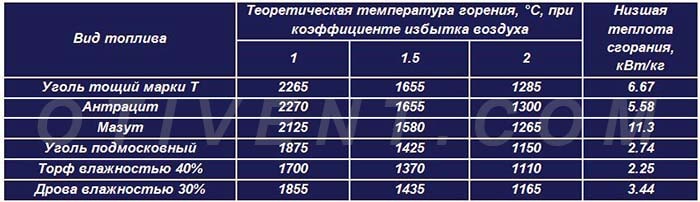 Может быть получен путём увеличения давления пара в объёме, свободном от центров конденсации (пылинок, ионов, капелек жидкости малых размеров и т. д.). Другой способ получения — охлаждение насыщенного пара при тех же условиях. В связи с последним способом получения насыщенного пара применительно к нему используется также наименование переохлаждённый пар. Кроме того, иногда в литературе встречается…
Жи́дкий ге́лий — жидкое агрегатное состояние гелия. Представляет собой бесцветную прозрачную жидкость, кипящую при температуре 4,2 К (для изотопа 4He при нормальном атмосферном давлении). Плотность жидкого гелия при температуре 4,2 К составляет 0,13 г/см³. Обладает малым показателем преломления, из-за чего его трудно увидеть.
Благоро́дные га́зы (также ине́ртные или ре́дкие га́зы) — группа химических элементов со схожими свойствами: при нормальных условиях они представляют собой одноатомные газы без цвета, запаха и вкуса с очень низкой химической реактивностью.
Может быть получен путём увеличения давления пара в объёме, свободном от центров конденсации (пылинок, ионов, капелек жидкости малых размеров и т. д.). Другой способ получения — охлаждение насыщенного пара при тех же условиях. В связи с последним способом получения насыщенного пара применительно к нему используется также наименование переохлаждённый пар. Кроме того, иногда в литературе встречается…
Жи́дкий ге́лий — жидкое агрегатное состояние гелия. Представляет собой бесцветную прозрачную жидкость, кипящую при температуре 4,2 К (для изотопа 4He при нормальном атмосферном давлении). Плотность жидкого гелия при температуре 4,2 К составляет 0,13 г/см³. Обладает малым показателем преломления, из-за чего его трудно увидеть.
Благоро́дные га́зы (также ине́ртные или ре́дкие га́зы) — группа химических элементов со схожими свойствами: при нормальных условиях они представляют собой одноатомные газы без цвета, запаха и вкуса с очень низкой химической реактивностью. К благородным газам относятся гелий (He), неон (Ne), аргон (Ar), криптон (Kr), ксенон (Xe) и радиоактивный радон (Rn). Формально к этой группе также причисляют недавно открытый оганесон (Og), однако его химические свойства почти не исследованы.
Дистилля́ция (лат. distillatio — стекание каплями) — перегонка, испарение жидкости с последующим охлаждением и конденсацией паров.
Крипто́н — химический элемент с атомным номером 36. Принадлежит к 18-й группе периодической таблицы химических элементов (по устаревшей короткой форме периодической системы принадлежит к главной подгруппе VIII группы, или к группе VIIIA), находится в четвёртом периоде таблицы. Атомная масса элемента 83,798(2) а. е. м.. Обозначается символом Kr (от лат. Krypton). Простое вещество криптон — инертный одноатомный газ без цвета, вкуса и запаха.
Криоге́ника (от слов греч.
К благородным газам относятся гелий (He), неон (Ne), аргон (Ar), криптон (Kr), ксенон (Xe) и радиоактивный радон (Rn). Формально к этой группе также причисляют недавно открытый оганесон (Og), однако его химические свойства почти не исследованы.
Дистилля́ция (лат. distillatio — стекание каплями) — перегонка, испарение жидкости с последующим охлаждением и конденсацией паров.
Крипто́н — химический элемент с атомным номером 36. Принадлежит к 18-й группе периодической таблицы химических элементов (по устаревшей короткой форме периодической системы принадлежит к главной подгруппе VIII группы, или к группе VIIIA), находится в четвёртом периоде таблицы. Атомная масса элемента 83,798(2) а. е. м.. Обозначается символом Kr (от лат. Krypton). Простое вещество криптон — инертный одноатомный газ без цвета, вкуса и запаха.
Криоге́ника (от слов греч. κρύος «холод, мороз» + γένος «род, происхождение») — раздел физики низких температур, изучающий закономерности изменения свойств различных веществ в условиях крайне низких («криогенных») температур. Кроме этого, этим термином обозначают технологии и аппаратно-методические средства работы в условиях низких температур. Также определяется как область науки, охватывающая исследование, развитие и применение криогенной техники.
Пар — газообразное состояние вещества в условиях, когда газовая фаза может находиться в равновесии с жидкой или твёрдой фазами того же вещества, то есть при температурах ниже критической температуры вещества. Процесс возникновения пара из жидкой (твёрдой) фазы называется «парообразованием». Обратный процесс называется конденсация. При низких давлениях и высоких температурах свойства пара приближаются к свойствам идеального газа. В разговорной речи под словом «пар» почти всегда понимают водяной пар…
Переохлаждённая жидкость — жидкость, имеющая температуру ниже температуры кристаллизации при данном давлении.
κρύος «холод, мороз» + γένος «род, происхождение») — раздел физики низких температур, изучающий закономерности изменения свойств различных веществ в условиях крайне низких («криогенных») температур. Кроме этого, этим термином обозначают технологии и аппаратно-методические средства работы в условиях низких температур. Также определяется как область науки, охватывающая исследование, развитие и применение криогенной техники.
Пар — газообразное состояние вещества в условиях, когда газовая фаза может находиться в равновесии с жидкой или твёрдой фазами того же вещества, то есть при температурах ниже критической температуры вещества. Процесс возникновения пара из жидкой (твёрдой) фазы называется «парообразованием». Обратный процесс называется конденсация. При низких давлениях и высоких температурах свойства пара приближаются к свойствам идеального газа. В разговорной речи под словом «пар» почти всегда понимают водяной пар…
Переохлаждённая жидкость — жидкость, имеющая температуру ниже температуры кристаллизации при данном давлении. Является одним из неустойчивых (метастабильных) состояний жидкости, наряду с перегретой жидкостью.
Адиабатическое горение — горение, происходящее при постоянном давлении или объёме, при котором отсутствуют потери энергии в окружающую среду. Адиабатическая температура горения — это температура продуктов, достигаемая при полном протекании химических реакций и установлении термодинамического равновесия. Адиабатическая температура горения при постоянном давлении ниже адиабатической температуры горения при постоянном объёме, так как в первом случае часть производимой при реакции энергии затрачивается…
Зако́ны Рау́ля — общее название открытых французским химиком Ф. М. Раулем в 1887 году количественных закономерностей, описывающих некоторые коллигативные (зависящие от концентрации, но не от природы растворённого вещества) свойства растворов.
Кипе́ние — процесс интенсивного парообразования, который происходит в жидкости, как на свободной её поверхности, так и внутри её структуры.
Является одним из неустойчивых (метастабильных) состояний жидкости, наряду с перегретой жидкостью.
Адиабатическое горение — горение, происходящее при постоянном давлении или объёме, при котором отсутствуют потери энергии в окружающую среду. Адиабатическая температура горения — это температура продуктов, достигаемая при полном протекании химических реакций и установлении термодинамического равновесия. Адиабатическая температура горения при постоянном давлении ниже адиабатической температуры горения при постоянном объёме, так как в первом случае часть производимой при реакции энергии затрачивается…
Зако́ны Рау́ля — общее название открытых французским химиком Ф. М. Раулем в 1887 году количественных закономерностей, описывающих некоторые коллигативные (зависящие от концентрации, но не от природы растворённого вещества) свойства растворов.
Кипе́ние — процесс интенсивного парообразования, который происходит в жидкости, как на свободной её поверхности, так и внутри её структуры. При этом в объёме жидкости возникают границы разделения фаз, то есть на стенках сосуда образуются пузырьки, которые содержат воздух и насыщенный пар. Кипение, как и испарение, является одним из способов парообразования. В отличие от испарения, кипение может происходить лишь при определённой температуре и давлении. Температура, при которой происходит кипение жидкости…
Электровзрыв (англ. electric explosion) — метод получения тонкодисперсных металлических, оксидных, нитридных и карбидных порошков с помощью электрического взрыва проводника (металлической проволоки диаметром 0,1-1,0 мм) при прохождении по нему мощного импульса тока длительностью 10-5-10-7 с и плотностью 104-106 А·мм-2.
Температура плавления (обычно совпадает с температурой кристаллизации) — температура, при которой твёрдое кристаллическое тело совершает переход в жидкое состояние и наоборот. При температуре плавления вещество может находиться как в жидком, так и в твёрдом состоянии.
При этом в объёме жидкости возникают границы разделения фаз, то есть на стенках сосуда образуются пузырьки, которые содержат воздух и насыщенный пар. Кипение, как и испарение, является одним из способов парообразования. В отличие от испарения, кипение может происходить лишь при определённой температуре и давлении. Температура, при которой происходит кипение жидкости…
Электровзрыв (англ. electric explosion) — метод получения тонкодисперсных металлических, оксидных, нитридных и карбидных порошков с помощью электрического взрыва проводника (металлической проволоки диаметром 0,1-1,0 мм) при прохождении по нему мощного импульса тока длительностью 10-5-10-7 с и плотностью 104-106 А·мм-2.
Температура плавления (обычно совпадает с температурой кристаллизации) — температура, при которой твёрдое кристаллическое тело совершает переход в жидкое состояние и наоборот. При температуре плавления вещество может находиться как в жидком, так и в твёрдом состоянии.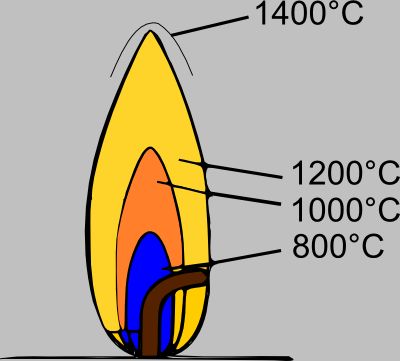 При подведении дополнительного тепла вещество перейдёт в жидкое состояние, а температура не будет изменяться, пока всё вещество в рассматриваемой системе не расплавится. При отведении лишнего тепла (охлаждении) вещество будет переходить…
Водоро́д (H, лат. hydrogenium) — химический элемент периодической системы с обозначением H и атомным номером 1. Обладая 1 а. е. м., водород является самым легким элементом в периодической таблице. Его одноатомная форма (H) — самое распространённое химическое вещество во Вселенной, составляющее примерно 75% всей барионной массы. Звезды, кроме компактных, в основном состоят из водородной плазмы. Самый распространенный изотоп водорода, называемый протием (название редко употребляется; обозначение…
Жи́дкий кислоро́д (ЖК, жO2, LOX) — жидкость бледно-синего цвета, которая относится к сильным парамагнетикам. Является одним из четырёх агрегатных состояний кислорода.
При подведении дополнительного тепла вещество перейдёт в жидкое состояние, а температура не будет изменяться, пока всё вещество в рассматриваемой системе не расплавится. При отведении лишнего тепла (охлаждении) вещество будет переходить…
Водоро́д (H, лат. hydrogenium) — химический элемент периодической системы с обозначением H и атомным номером 1. Обладая 1 а. е. м., водород является самым легким элементом в периодической таблице. Его одноатомная форма (H) — самое распространённое химическое вещество во Вселенной, составляющее примерно 75% всей барионной массы. Звезды, кроме компактных, в основном состоят из водородной плазмы. Самый распространенный изотоп водорода, называемый протием (название редко употребляется; обозначение…
Жи́дкий кислоро́д (ЖК, жO2, LOX) — жидкость бледно-синего цвета, которая относится к сильным парамагнетикам. Является одним из четырёх агрегатных состояний кислорода. Жидкий кислород обладает плотностью 1,141 г/см³ и имеет умеренно криогенные свойства с точкой замерзания 50,5 K (−222,65 °C) и точкой кипения 90,188 K (−182,96 °C).
Плавле́ние — это процесс перехода тела из кристаллического твёрдого состояния в жидкое, то есть переход вещества из одного агрегатного состояния в другое. Плавление происходит с поглощением теплоты плавления и является фазовым переходом первого рода, которое сопровождается скачкообразным изменением теплоёмкости в конкретной для каждого вещества температурной точке превращения — температура плавления.
Пла́мя — раскаленная газообразная среда, образующаяся при горении и электроразрядах, состоящая в значительной степени из частично ионизированных частиц, в которой происходят химические взаимодействия и физико-химические превращения составных частиц среды (в т.ч. горючего, окислителя, примесных частиц, продуктов их взаимодействия).
Жидкий кислород обладает плотностью 1,141 г/см³ и имеет умеренно криогенные свойства с точкой замерзания 50,5 K (−222,65 °C) и точкой кипения 90,188 K (−182,96 °C).
Плавле́ние — это процесс перехода тела из кристаллического твёрдого состояния в жидкое, то есть переход вещества из одного агрегатного состояния в другое. Плавление происходит с поглощением теплоты плавления и является фазовым переходом первого рода, которое сопровождается скачкообразным изменением теплоёмкости в конкретной для каждого вещества температурной точке превращения — температура плавления.
Пла́мя — раскаленная газообразная среда, образующаяся при горении и электроразрядах, состоящая в значительной степени из частично ионизированных частиц, в которой происходят химические взаимодействия и физико-химические превращения составных частиц среды (в т.ч. горючего, окислителя, примесных частиц, продуктов их взаимодействия). Сопровождается интенсивным излучением (в УФ, ИК, видимой части спектра — «свечением») и выделением тепла.
Сжиже́ние га́зов включает в себя несколько стадий, необходимых для перевода газа в жидкое состояние. Эти процессы используются для научных, промышленных и коммерческих целей.
Азеотро́пная смесь — смесь двух или более жидкостей, состав которой не меняется при кипении, то есть смесь с равенством составов равновесных жидкой и паровой фаз. Смесь, в которой данное условие, напротив, не выполняется ни при каком соотношении количеств компонентов, называется зеотропной. Зеотропы (называемые иногда неазеотропами), то есть раздельно кипящие системы, при заданных температуре или давлении в состоянии равновесия имеют различные составы жидкости и пара во всём интервале концентраций…
Жи́дкий водоро́д (ЖВ, жh3, жh3, Lh3, Lh3) — жидкое агрегатное состояние водорода, с низкой плотностью − 0,07 г/см³, и криогенными свойствами с точкой замерзания 14,01 K (−259,14 °C) и точкой кипения 20,28 K (−252,87 °C).
Сопровождается интенсивным излучением (в УФ, ИК, видимой части спектра — «свечением») и выделением тепла.
Сжиже́ние га́зов включает в себя несколько стадий, необходимых для перевода газа в жидкое состояние. Эти процессы используются для научных, промышленных и коммерческих целей.
Азеотро́пная смесь — смесь двух или более жидкостей, состав которой не меняется при кипении, то есть смесь с равенством составов равновесных жидкой и паровой фаз. Смесь, в которой данное условие, напротив, не выполняется ни при каком соотношении количеств компонентов, называется зеотропной. Зеотропы (называемые иногда неазеотропами), то есть раздельно кипящие системы, при заданных температуре или давлении в состоянии равновесия имеют различные составы жидкости и пара во всём интервале концентраций…
Жи́дкий водоро́д (ЖВ, жh3, жh3, Lh3, Lh3) — жидкое агрегатное состояние водорода, с низкой плотностью − 0,07 г/см³, и криогенными свойствами с точкой замерзания 14,01 K (−259,14 °C) и точкой кипения 20,28 K (−252,87 °C). Является бесцветной жидкостью без запаха, которая при смешивании с воздухом относится к взрывоопасным веществам с диапазоном коэффициента воспламенения 4—75 %. Спиновое соотношение изомеров в жидком водороде составляет: 99,79 % — параводород; 0,21 % — ортоводород. Коэффициент расширения…
Газовая хроматография — физико-химический метод разделения веществ, основанный на распределении компонентов анализируемой смеси между двумя несмешивающимися и движущимися относительно друг друга фазами, где в качестве подвижной фазы выступает газ (газ-носитель), а в качестве неподвижной фазы — твердый сорбент или жидкость, нанесенная на инертный твердый носитель или внутренние стенки колонки.
Концентрационным переохлаждением (КП) называют явление, которое возникает при направленной кристаллизации расплава, содержащего примесь, и заключающееся в том, что в результате перераспределения примеси в расплаве перед фронтом кристаллизации образуется некий слой, в пределах которого расплав оказывается переохлаждённым.
Является бесцветной жидкостью без запаха, которая при смешивании с воздухом относится к взрывоопасным веществам с диапазоном коэффициента воспламенения 4—75 %. Спиновое соотношение изомеров в жидком водороде составляет: 99,79 % — параводород; 0,21 % — ортоводород. Коэффициент расширения…
Газовая хроматография — физико-химический метод разделения веществ, основанный на распределении компонентов анализируемой смеси между двумя несмешивающимися и движущимися относительно друг друга фазами, где в качестве подвижной фазы выступает газ (газ-носитель), а в качестве неподвижной фазы — твердый сорбент или жидкость, нанесенная на инертный твердый носитель или внутренние стенки колонки.
Концентрационным переохлаждением (КП) называют явление, которое возникает при направленной кристаллизации расплава, содержащего примесь, и заключающееся в том, что в результате перераспределения примеси в расплаве перед фронтом кристаллизации образуется некий слой, в пределах которого расплав оказывается переохлаждённым.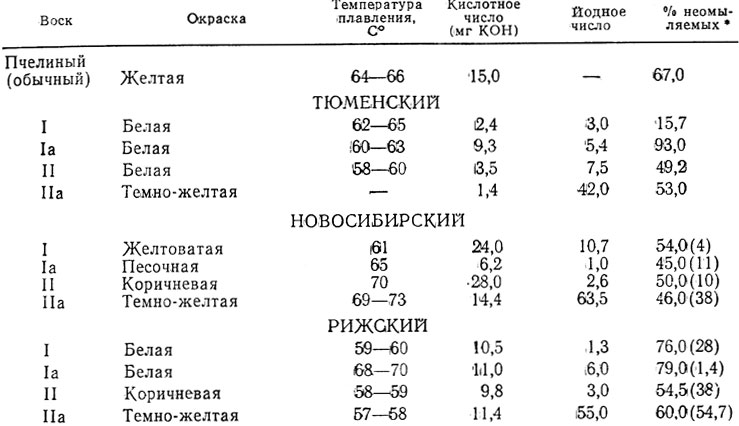 Этот участок расплава называется зоной КП.
Этот участок расплава называется зоной КП.Подробнее: Концентрационное переохлаждение
«Пентабора́н» — также называемый «нонагидри́д пентабо́ра», «стабильный пентабора́н» и «Пентабора́н(9)» для того, чтобы отличать его от соединения бора B5h21 — химическое соединение, которое рассматривалось военными 1950-х годов в США и СССР, в качестве перспективного ракетного/самолетного топлива, называемого также «экзотическим горючим». Молекула состоит из пяти атомов бора и девяти атомов водорода (B5H9) и является одним из бороводородов. В обычных условиях имеет вид бесцветной жидкости с едким… Область воспламенения газа, пара или взвеси — интервал концентрации горючего вещества, равномерно распределённого в данной окислительной среде (обычно в воздухе), в пределах которого вещество способно воспламеняться от источника зажигания с последующим распространением самостоятельного горения по смеси. Пар-жидкость-кристалл или ПЖК (в английской литературе — vapor-liquid-solid — VLS)) — механизм роста одномерных структур, таких как нановискеры в процессе химического осаждения из газовой фазы. Рост кристалла вследствие осаждения из газовой фазы обычно протекает очень медленно. Однако возможно введение на поверхность капель катализатора, способного адсорбировать вещество из газа до состояния пересыщенного расплава, из которого и будет происходить его кристаллизация на подложку. Таким образом, физические…
Озонатор — устройство для получения озона (O3). Озон является аллотропной модификацией кислорода, содержащей в молекуле три атома кислорода. В большинстве случаев исходным веществом для синтеза озона выступает молекулярный кислород (O2), а сам процесс описывается уравнением 3O2 → 2O3. Эта реакция является эндотермичной и легко обратимой. Поэтому на практике применяются меры, способствующие максимальному смещению её равновесия в сторону целевого продукта.
Пар-жидкость-кристалл или ПЖК (в английской литературе — vapor-liquid-solid — VLS)) — механизм роста одномерных структур, таких как нановискеры в процессе химического осаждения из газовой фазы. Рост кристалла вследствие осаждения из газовой фазы обычно протекает очень медленно. Однако возможно введение на поверхность капель катализатора, способного адсорбировать вещество из газа до состояния пересыщенного расплава, из которого и будет происходить его кристаллизация на подложку. Таким образом, физические…
Озонатор — устройство для получения озона (O3). Озон является аллотропной модификацией кислорода, содержащей в молекуле три атома кислорода. В большинстве случаев исходным веществом для синтеза озона выступает молекулярный кислород (O2), а сам процесс описывается уравнением 3O2 → 2O3. Эта реакция является эндотермичной и легко обратимой. Поэтому на практике применяются меры, способствующие максимальному смещению её равновесия в сторону целевого продукта. Газосигнализатор — автоматический прибор для непрерывного или периодического контроля за состоянием воздуха и выдачи сигналов о появлении в нём токсических веществ в газо- и парообразном состоянии. Применяется как носимое или стационарное устройство. Подает сигнал-предупреждение (световой, звуковой, передачу сигнала во внешние цепи) о том, что значение контролируемого параметра превосходит заданный предел или находится вне заданного интервала значений. Отличается от анализатора газа (газоанализатора…
Газосигнализатор — автоматический прибор для непрерывного или периодического контроля за состоянием воздуха и выдачи сигналов о появлении в нём токсических веществ в газо- и парообразном состоянии. Применяется как носимое или стационарное устройство. Подает сигнал-предупреждение (световой, звуковой, передачу сигнала во внешние цепи) о том, что значение контролируемого параметра превосходит заданный предел или находится вне заданного интервала значений. Отличается от анализатора газа (газоанализатора…Парафины и алканы — характеристики горения
Для получения полной таблицы с максимальной скоростью пламени, адиабатической температурой пламени, температурой воспламенения, температурой вспышки и пределами воспламеняемости LEL UEL — поверните экран!
| Парафин или алканы | Химическая формула | Более высокая теплотворная способность (БТЕ / фунт м ) | Соотношение воздух / топливо | Максимальная скорость пламени (фут / с) | Температура адиабатического пламени Температура воспламенения ( o F) | Температура вспышки ( o F) | Пределы воспламеняемости | ||
|---|---|---|---|---|---|---|---|---|---|
| LEL | UEL | ||||||||
| Этан | C 2 H 6 | 22323 | 15. 899 899 | 1,3 | 3540 | 968-1166 | *) | 3,0 | 12,5 |
| н-бутан | C 4 H 10 | 21321 | 14,984 | 1,2 | 3583 | 761 | -76 | 1,9 | 8,4 |
| изобутан | C 4 H 10 | 21271 | 14.984 | 1.2 | 3583 | 864 | -117 | 1,8 | 8,4 |
| н-гептан | C 7 H 16 | 20854 | 14,141 | 1,3 | 3985 | 433 | 25 | 1,0 | 6,0 |
| н-гексан | C 6 H 14 | 20966 | 15,238 | 1,3 | 4030 | 478 | -7 | 1.3 | 7,0 |
| Метан | CH 4 | 23875 | 17,195 | 1,1 | 3484 | 1301 | *) | 5,0 | 15,0 |
| C Неопентан | 5 H 12 | 20978 | 15,323 | 1,1 | 4060 | 842 | *) | 1,4 | 7.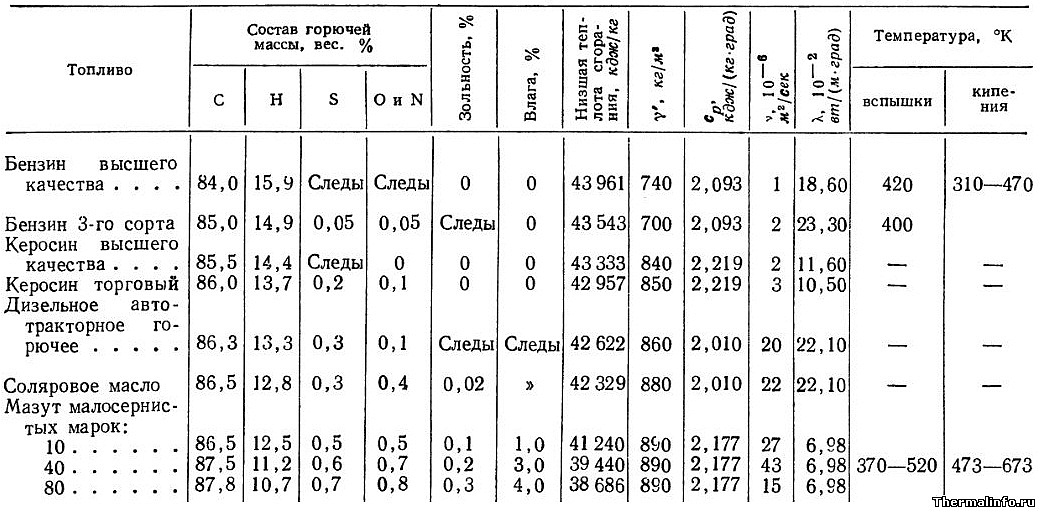 2 2 |
| Неогексан | C 6 H 14 | 20931 | 15,238 | 1,2 | 4055 | 797 | -54 | 1,2 | 7,6 |
| н-октан | C 8 H 18 | 20796 | 15,093 | 428 | 56 | 0,9 | 3,2 | ||
| изо-октан | C 8 H 18 | 20770 | 15.093 | 1,1 | 837 | 10 | 0,8 | 5,9 | |
| н-пентан | C 5 H 12 | 21095 | 15,323 | 1,3 | 4050 | 588 | <-40 | 1,4 | 7,8 |
| изопентан | C 5 H 12 | 21047 | 15,323 | 1,2 | 4055 | 788 | <- 60 | 1.3 | 9,2 |
| Пропан | C 3 H 8 | 21669 | 15,246 | 1,3 | 3573 | 871 | *) | 2,1 | 10,1 |
*) газ
- LEL — нижний предел взрывоопасности или воспламеняемости
- UEL — верхний предел взрывоопасности или воспламеняемости
- 1 фут / с = 0,3048 м / с
- T ( o C) = 5/9 [T ( o F) — 32]
- 1 БТЕ / фунт м = 2326.
 1 Дж / кг = 0,55556 ккал / кг
1 Дж / кг = 0,55556 ккал / кг
Удельная теплоемкость некоторых жидкостей
Удельная теплоемкость некоторых широко используемых жидкостей и жидкостей приведена в таблице ниже.
Для преобразования единиц используйте онлайн-конвертер единиц удельной теплоемкости.
См. Также табличные значения удельной теплоемкости газов, пищевых продуктов и продуктов питания, металлов и полуметаллов, обычных твердых веществ и других обычных веществ, а также значения молярной теплоемкости обычных органических и неорганических веществ.



 1 Дж / кг = 0,55556 ккал / кг
1 Дж / кг = 0,55556 ккал / кг  3
3 165
165 02
02 97
97 34
34 Требуемое тепло можно рассчитать как
Требуемое тепло можно рассчитать как Инкапсулирование PPCM подразделяется на три основные части: объемное или макроинкапсулирование, микрокапсулирование и наноинкапсулирование.
Инкапсулирование PPCM подразделяется на три основные части: объемное или макроинкапсулирование, микрокапсулирование и наноинкапсулирование. Д. [31]. Цилиндрические трубки — одна из самых известных форм макроинкапсулированных ППКМ.Этот тип инкапсуляции чаще всего используется в зданиях или в системах хранения солнечной энергии.
Д. [31]. Цилиндрические трубки — одна из самых известных форм макроинкапсулированных ППКМ.Этот тип инкапсуляции чаще всего используется в зданиях или в системах хранения солнечной энергии. В этой макроинкапсулированной системе, представленной в виде цилиндрических модулей, к парафину добавлен плавающий камень в качестве усилителя теплопроводности.В этом исследовании исследуется влияние различных параметров, таких как диаметр трубы, на теплопередачу, а результаты экспериментальной части сравниваются с результатами моделирования [34].
В этой макроинкапсулированной системе, представленной в виде цилиндрических модулей, к парафину добавлен плавающий камень в качестве усилителя теплопроводности.В этом исследовании исследуется влияние различных параметров, таких как диаметр трубы, на теплопередачу, а результаты экспериментальной части сравниваются с результатами моделирования [34].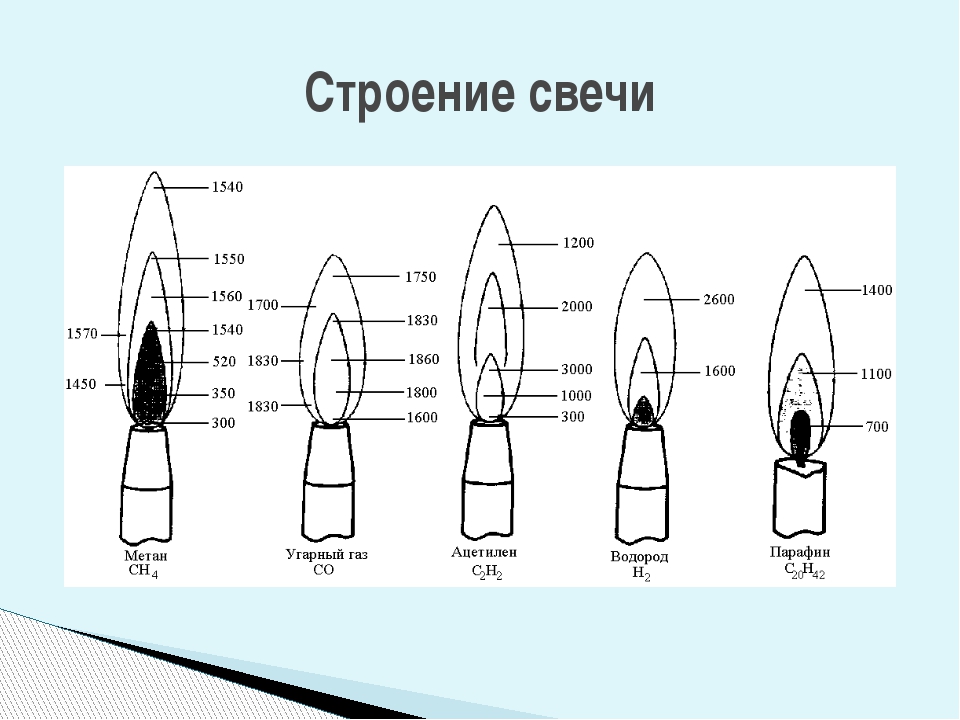 Для оболочечной части микрокапсулятов используются различные материалы.
Для оболочечной части микрокапсулятов используются различные материалы. Размер этих капсул зависит от размера эмульсии или суспензии капелек парафина. Иногда в среду добавляют определенные добавки для улучшения некоторых свойств полимера. Например, в некоторых исследованиях поливиниловый спирт (ПВС) был добавлен в среду с m
Размер этих капсул зависит от размера эмульсии или суспензии капелек парафина. Иногда в среду добавляют определенные добавки для улучшения некоторых свойств полимера. Например, в некоторых исследованиях поливиниловый спирт (ПВС) был добавлен в среду с m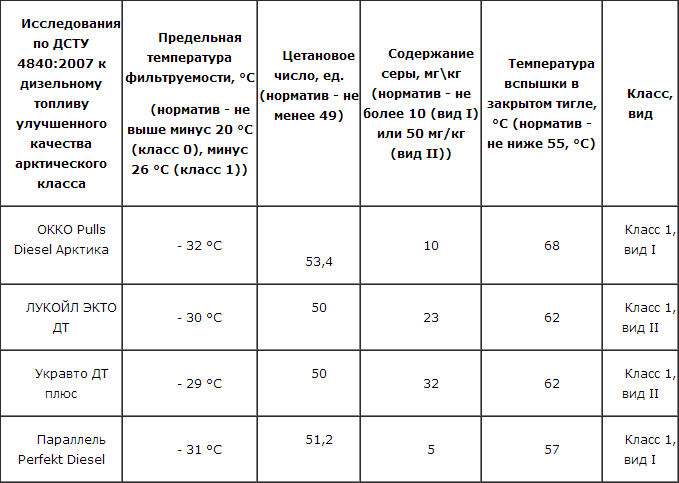 [ необходима ссылка ]
[ необходима ссылка ]