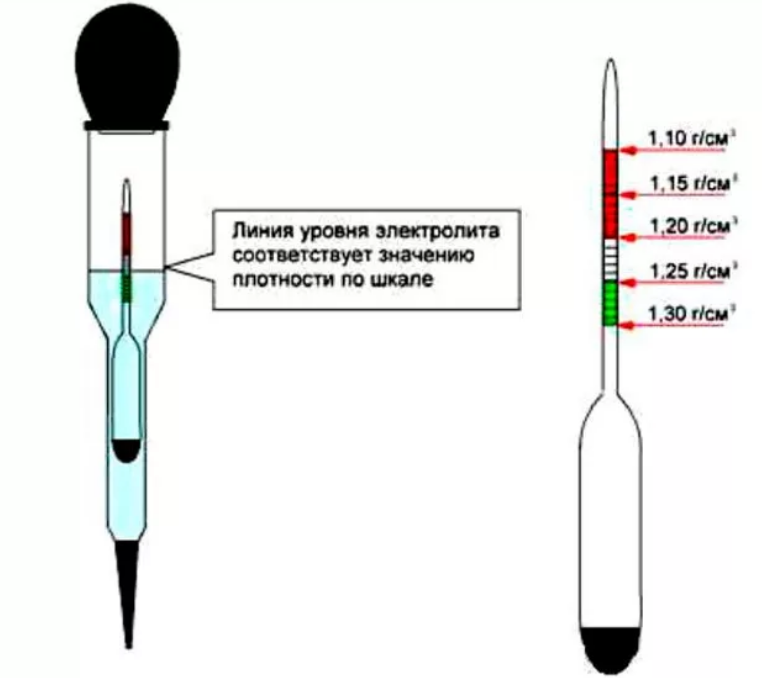
Какая должна быть плотность электролита в аккумуляторе автомобиля?
Оптимальные показатели в зависимости от времени года
Плотность является важным параметром всех аккумуляторных батарей, значение которого рекомендуется удерживать на оптимальном уровне. Такое положение объясняется двумя основными причинами. Во-первых, значение параметра зависит от периода времени, в течение которого батарея будет стабильно функционировать. Во-вторых, уровень плотности определяет качество ёмкости АКБ, которое может постепенно падать из-за неоптимальной величины параметра.
Плотность электролита в аккумуляторе равна 1,27–1,31 г/см3. Однако такие значения соответствуют норме в регионах с умеренным климатическим режимом. Если эксплуатировать автомобиль в районах, в которых температурный режим может достигать -50, то плотность электролита в АКБ там от 1,29 до 1,31 г/см3. Норма устанавливается в зависимости от климатических особенностей района и времени года.
Также у водителей может появиться вопрос, какая плотность электролита в аккумуляторе должна быть в разное время года.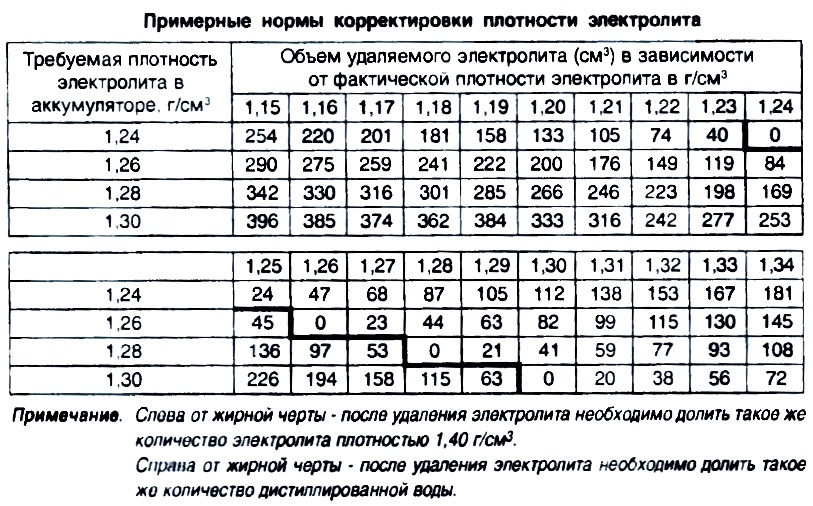 Проанализируем этот показатель летом и зимой.
Проанализируем этот показатель летом и зимой.
Летом
Нормальная плотность электролита в аккумуляторе изменяется в интервале от 1,25 до 1,27 г/см3 в жаркий сезон. Но летом АКБ может работать нестабильно, так как существует вероятность возникновения проблем, связанных с потерей значительного количества жидкости. Специалисты советуют удерживать значение параметра на 0,02–0,03 г/см3 ниже оптимального. Нельзя не отметить, что данная рекомендация преимущественно относится к южным регионам нашей страны.
Приводим таблицу плотности электролита в аккумуляторе в летнее время.
| Регион | Величина плотности, г/см3 |
|---|---|
| Центральный | 1,27 |
| Южный | 1,25 |
| Северный | 1,27 |
| Крайний Север | 1,27 |
Зимой
Какая должна быть плотность аккумулятора в зимний сезон? Она не должна опускаться ниже 1,27 г/см3. Исключением являются южные регионы, в которых значение показателя может составлять 1,25 г/см3.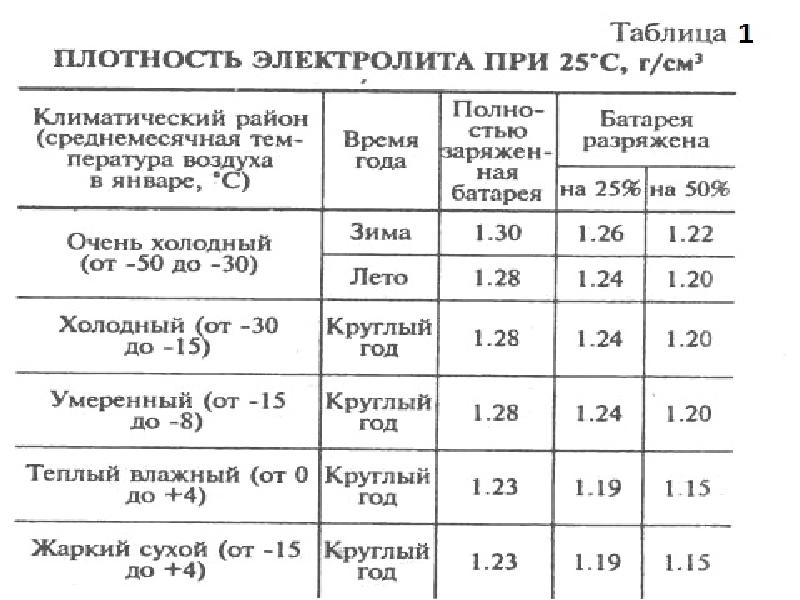
Если рассматривать районы Крайнего Севера, то плотность аккумулятора должна находиться в промежутке от 1,31 г/см3 до 1,35 г/см3. Такое положение объясняется несколькими причинами. Во-первых, если значение показателя будет слишком маленьким, то электролит внутри АКБ при крепком морозе может превратиться в ледышку, так как доля жидкости в нём в несколько раз превышает норму. Во-вторых, основные части и механизмы автотранспортного средства замерзают при минусовых температурах. Чтобы этого не произошло, необходимо усилить электродвижущую силу, с помощью которой можно осуществить запуск двигателя внутреннего сгорания. Даже современные машины не смогут это реализовать без дополнительной энергии. Следовательно, если уменьшить значение показателя, то произойдёт замерзание АКБ.
Таким образом, отвечая на вопрос о том, сколько должно быть электролита в аккумуляторе, приведём следующую таблицу плотности.
| Регион | Величина плотности, г/см3 |
|---|---|
| Центральный | 1,27 |
| Южный | 1,25 |
| Северный | 1,29 |
| Крайний Север | 1,31 |
Но нужно помнить, что представленные цифры относятся лишь к АКБ с полным зарядом. Если он находится на недостаточном уровне, то значения показателя будут больше на несколько единиц.
Если он находится на недостаточном уровне, то значения показателя будут больше на несколько единиц.
Почему происходит изменение плотности электролита?
Даже многие водители со стажем не знают, почему падает плотность электролита в аккумуляторе. Это происходит в результате уменьшения заряда АКБ. Подобные перемены характерны для зимы, когда при потере значительной величины энергии значение рассматриваемого показателя становится критическим. Единственным решением этой проблемы является регулярный контроль состояния аккумулятора.
Специалисты рекомендуют время от времени отслеживать взаимосвязь между уровнем заряда и водным соотношением в составе электролита. К примеру, рассмотрим возможное развитие событий при сокращении аккумулятора на 25 % и 50 %:
- При первоначальной плотности в 1,30 г/см3 она снизится до 1,26 г/см3 и 1,22 г/см3.
- При начальном значении показателя в 1,27 г/см3 объём уменьшится до 1,23 г/см3 и 1,19 г/см3.
- При исходной величине в 1,23 г/см3 плотность упадёт до 1,19 г/см3 и 1,15 г/см3.

Таким образом, необходимо своевременно осуществлять зарядку аккумулятора, чтобы избежать падения показателя. Однако перед этим рекомендуется обратить внимание на уровень жидкости, который мог уменьшиться в процессе функционирования автомобиля. Если это произошло, требуется долить очищенную воду без содержания каких-либо добавок.
Как можно откорректировать плотность электролита в банках батареи?
Часто возникают ситуации, в которых наблюдается разная плотность электролита в банках аккумулятора. Эту проблему нужно решать незамедлительно. Как тогда выровнять плотность электролита в банках аккумулятора? Рекомендуется два варианта действий:
- Применить электролит, обладающий высокой концентрацией серы.
- Долить кислоты вспомогательного характера.
Корректировка плотности электролита в аккумуляторе осуществляется с использованием следующих предметов:
- специальная ёмкость с делениями;
- резервуар для образования новой субстанции;
- кислота, электролит;
- очищенная жидкость.

Инструкция по изменению значения показателя включает в себя следующие действия:
- Взять небольшое количество электролита с банки аккумуляторной батареи.
- Добавить корректирующий раствор в количестве, которое соответствует взятому на первом действии – если необходимо увеличить плотность электролита. Для противоположного результата регулирующий раствор замените на дистиллированную жидкость.
- Аккумулятор следует подзарядить специальным устройством, так как номинальный ток позволит поступившей воде перемешаться.
- Отключив АКБ от батареи, целесообразно выждать в районе 2 часов. Это позволит плотности во всех банках встать на один уровень, что сделает вероятность возникновения погрешностей при контрольном измерении минимальной.
- Заново измерить значение электролита. Если оно прежнее – повторить предыдущие действия сначала.
Не всегда можно изменить показатель. И тогда единственное решение – купить новый аккумулятор. Если электролит приобретает чёрный оттенок при осуществлении зарядки, то это свидетельствует о невозможности восстановления работы АКБ.
Чем грозит повышенная или пониженная плотность электролита?
Если рассматриваемый показатель выше допустимого значения, то значит, норма превышена, что отрицательно сказывается на функционировании авто. Это в большинстве случаев приводит к возникновению различных неисправностей АКБ. Следовательно, слишком высокая плотность электролита в аккумуляторе опасна для состояния автомобиля.
Если значение показателя занижено, машина может просто не завестись. В первую очередь это касается зимнего сезона, так как батарея замёрзнет при минусовых температурах.
Таким образом, необходимо осуществлять регулярную проверку плотности электролита. Это поможет избежать возникновения непредвиденных обстоятельств. Однако сделать подобное проблематично, так как плотность изменяется при разных уровнях заряда аккумулятора. Например, при её уменьшении происходит поглощение дистиллированной жидкости батареей, что приводит к увеличению концентрации показателя. В обратных ситуациях возникает процесс сульфатации, ведущий к снижению уровня плотности. Главный исход – выход из строя АКБ.
В обратных ситуациях возникает процесс сульфатации, ведущий к снижению уровня плотности. Главный исход – выход из строя АКБ.
Как проверить плотность электролита в аккумуляторе авто?
У кислотных аккумуляторов есть весомое преимущество по сравнению с более современными батареями, что обусловлено возможностью реанимировать их. Благодаря возможности обслуживать такие АКБ, можно восстановить плотность электролита и вернуть батарее ее свойства. Поэтому, обслуживая аккумулятор, плотность электролита в обязательном порядке требуется замерять, потому что от этого параметра зависит корректная работа АКБ. Не стоит избегать решения этой задачи, так как рано или поздно данная проблема даст о себе знать.
Рекомендуется обратиться в автосервис, если руки не доходят до самостоятельного обслуживания батареи. Его особенность заключается в том, что измерить плотность электролита аккумуляторе можно самостоятельно, имея под рукой ареометр и зная, каким параметрам она должна соответствовать. Параллельно с этим замером выявляется уровень электролита, затем данные сравниваются с выходным напряжением батареи. Это дает общую картину о состоянии АКБ, что необходимо для правильного выполнения восстановительных работ.
Параллельно с этим замером выявляется уровень электролита, затем данные сравниваются с выходным напряжением батареи. Это дает общую картину о состоянии АКБ, что необходимо для правильного выполнения восстановительных работ.
Для тех кто не знает, как измерить плотность аккумулятора, сразу оговоримся, что это необходимо делать в каждой банке со свинцовыми пластинами, так как они не зависят друг от друга. Поэтому плотность и уровень электролита, а также выходное напряжение у них будет отличаться. Рассмотрим детально, как измерить плотность электролита с учетом всех технических нюансов, которые необходимо знать.
Когда должна выполняться проверка плотности автомобильного аккумулятора
Кроме того, что плотность электролита автомобильного аккумулятора проверяется при каждом плановом обслуживании машины, существует ряд признаков, указывающих на снижение этого параметра.
Самый распространенный заключается в уменьшении периодичности заряд/разряд. Это значит, что АКБ стал хуже держать заряд, а так происходит в результате снижения уровня электролита или его свойств.
 Это повод проверить плотность автомобильного аккумулятора, не дожидаясь планового техосмотра.
Это повод проверить плотность автомобильного аккумулятора, не дожидаясь планового техосмотра.Также следует выполнить эту работу, если в последнее время батарея систематически перезаряжалась. Это способствует выкипанию электролита и снижению его уровня. В зимнее время эту задачу приходится выполнять чаще, так как плотность АКБ при отрицательной температуре быстрее снижается.
Как проверить плотность автомобильного аккумулятора
Если вы знаете, как проверить плотность АКБ и уже сделали это, значит вы понимаете, что нужно быть готовым к необходимости восстановления этого параметра, если он не будет соответствовать требованиям. Поэтому необходимо подготовить следующее:
ареометр;
мерный стакан;
грушу-клизму;
емкость, чтобы развести новый электролит;
кислоту или корректирующий электролит.
Посредством ареометра сначала нужно проверить плотность автомобильного аккумулятора. Это выполняется с помощью груши, изготовленной из мягкой резины, в которую вставлена трубка из стекла с ареометром внутри. Для выполнения замера необходимо набрать немного жидкости из банки, сжав грушу. Затем нужно следить, чтобы ареометр не касался стенок трубки. Вся полученная информация записывается, потому что данная задача выполняется в каждой банке, но перед этим необходимо полностью зарядить батарею. Дальнейшие действия зависят от того, повышена плотность или понижена. В последнем случае необходимо сделать следующее:
Это выполняется с помощью груши, изготовленной из мягкой резины, в которую вставлена трубка из стекла с ареометром внутри. Для выполнения замера необходимо набрать немного жидкости из банки, сжав грушу. Затем нужно следить, чтобы ареометр не касался стенок трубки. Вся полученная информация записывается, потому что данная задача выполняется в каждой банке, но перед этим необходимо полностью зарядить батарею. Дальнейшие действия зависят от того, повышена плотность или понижена. В последнем случае необходимо сделать следующее:
отобрать немного жидкости из банки, и в таком же объеме залить корректирующий электролит;
поставить АКБ на 30 минут заряжаться;
снять с зарядки и дать батарее остыть в течение 2 часов;
повторно замерить плотность.
Если вы знаете, как проверить плотность аккумулятора автомобиля, значит понимаете зачем это делать. С добавлением коррекционного электролита повышается плотность жидкости.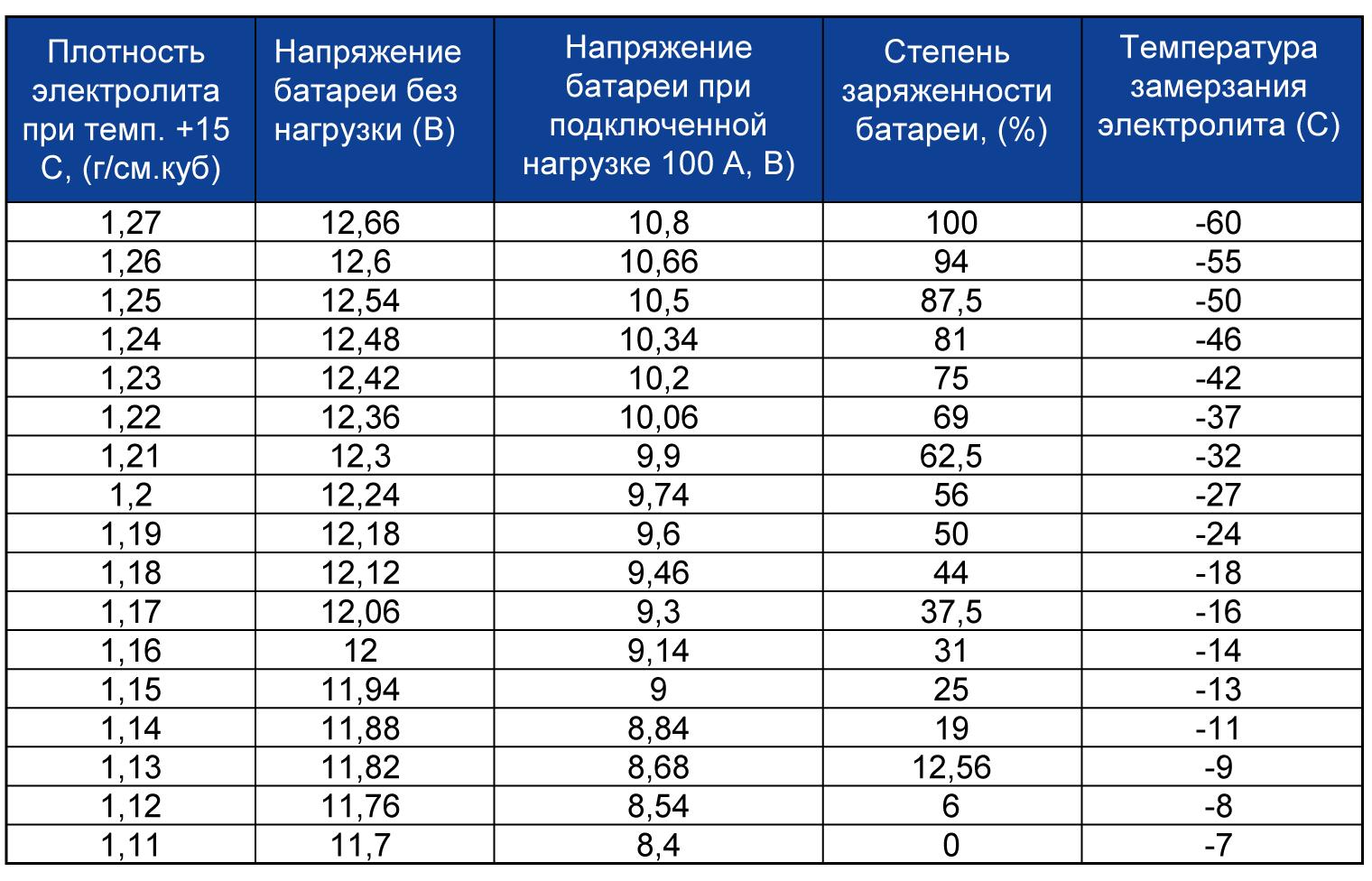 Чтобы замеры ареометром были точны, необходимо смешать жидкости, что происходит во время зарядки батареи. Остывать ей нужно потому, что максимальная точность замера ареометром возможна только при холодной батарее.
Чтобы замеры ареометром были точны, необходимо смешать жидкости, что происходит во время зарядки батареи. Остывать ей нужно потому, что максимальная точность замера ареометром возможна только при холодной батарее.
Если проверка плотности электролита автомобильного аккумулятора покажет увеличение данного показателя, необходимо выполнить все также, как в вышеуказанной последовательности, но вместо коррекционного электролита добавить дистиллированную воду. За счет этого плотность снизится. Если после первого раза электролит не достигнет нужного состояния, необходимо повторить процедуру еще раз. И так до тех пор, пока не нормализуется электролит, плотность при этом должна соответствовать нужному значению.
Что значит, если плотность аккумулятора автомобиля не соответствует заводским значениям
Если замеры покажут, что плотность электролита АКБ не соответствует параметрам в банках, значит батарея уже выработала свой ресурс и пластины подвергались сульфатации. Придется заменить АКБ, потому что восстановлению он не подлежит.
Сульфатация – это необратимый процесс, который настигает каждую батарею, отработавшую свой ресурс, заявленный производителем. Если плотность электролита аккумулятора напротив, выше нормы, это тоже плохо для батареи. Скорее всего он закипел, и повышение его плотности необходимо скорректировать способом, описанным выше. Рекомендуется в будущем не допускать повторного закипания, потому что это может окончательно вывести устройство из эксплуатации.
Если проверка плотности электролита в аккумуляторе показывает, что она низкая в одной из банок, значит между электродами произошло замыкание. В такой ситуации тоже требуется замена батареи, так как содержимое банок не подлежит восстановлению.
Какой должна быть плотность аккумулятора авто
Тот кто знает, как проверить плотность электролита в АКБ, должен понимать, как зависит это значение от параметров аккумулятора. На него влияет и такие технические характеристики, как емкость батареи и сила выходного тока. Поэтому не следует ориентироваться общепринятыми стандартами, лучше изучить этикетку изделия, чтобы выяснить, какая необходима плотность. Также стоит оговориться, что проверка плотности электролита в АКБ должна определяться с учетом температуры окружающей среды. Для определения погрешности, зависящей от температуры, необходимо пользоваться специальной таблицей. Найти данную информацию можно в техническом паспорте автомобиля или руководстве производителя, прилагаемом к аккумуляторной батарее. Зная, как проверить плотность электролита в аккумуляторе, не стоит торопиться делать этого без оценки цвета жидкости.
Также стоит оговориться, что проверка плотности электролита в АКБ должна определяться с учетом температуры окружающей среды. Для определения погрешности, зависящей от температуры, необходимо пользоваться специальной таблицей. Найти данную информацию можно в техническом паспорте автомобиля или руководстве производителя, прилагаемом к аккумуляторной батарее. Зная, как проверить плотность электролита в аккумуляторе, не стоит торопиться делать этого без оценки цвета жидкости.
То, какой она имеет оттенок, поможет предварительно определить состояние батареи. Коричневый цвет предупреждает о скором выходе из строя аккумулятора, а если это происходит еще и в канун зимы, первые морозы он может и не пережить. Если оттенок темный, значит активная масса осыпалась с электродов в раствор, что затрудняет протекание электрохимических реакций. В этом случае замена батареи неизбежна, так как восстановить плотность электролита в автомобильном аккумуляторе не получится. Учитывая то, что активная масса осыпается после длительного срока эксплуатации, это вполне оправдывает затраты на покупку нового устройства.
Как говорилось выше, проверка плотности АКБ выполняется во всех банках, и в каждой из них это значение должно быть одинаковым. Допускается погрешность, но не более 1 г/см3. Критический показатель плотности аккумулятора – менее 1:18 г/см3. Но и в такой ситуации возможна реанимация, если цвет не обрел коричневый или темный оттенок. Только в данной ситуации те, кто знает, какая плотность электролита должна быть в аккумуляторе, используют не коррекционный электролит, а серную кислоту 1:18 г/см3. Чтобы работать с данным веществом, необходим опыт, так как можно добавить его слишком много, сделав плотность больше, чем требуется. В результате неумелое обращение с веществом потребует много времени на решение данной задачи. Даже тем, кто может проверить плотность аккумулятора автомобиля, понимая как ее вернуть, нелегко добиться одинаковой плотности в каждой из банок, используя кислоту. Поэтому рекомендуется обращаться в автосервисы Oiler, чтобы выполнить обслуживание аккумуляторной батареи.
Чем поможет автосервис?
В условиях любого СТО нашей компании имеются все необходимые устройства и опытные специалисты, которые сумеют проверить плотность электролита и скорректировать ее в день обращения. Особенность наших услуг заключается в том, что мы решаем технические задачи в день обращения. Кроме того, услуги предлагаются по фиксированной цене, что позволяет предварительно рассчитать бюджет на обслуживание и ремонт своего автомобиля.
Мы рассмотрели, как проверить электролит в АКБ, и что делать, если его плотность отклонилась от нормы. Детально узнать о состоянии аккумуляторной батареи вы сможете, посетив автосервис Oiler в Киеве, предварительно записавшись на прием на нашем сайте.
Плотность электролита зимой и летом
Всем привет! С Вами аккумуляторщик. Сегодня я бы хотел развеять миф про плотность электролита зимой и летом. Многие люди, особенно старой «советской» закалки, которые приходят в магазин или просто приходят со своим аккумулятором и просят им сделать зимнюю или летнюю плотность.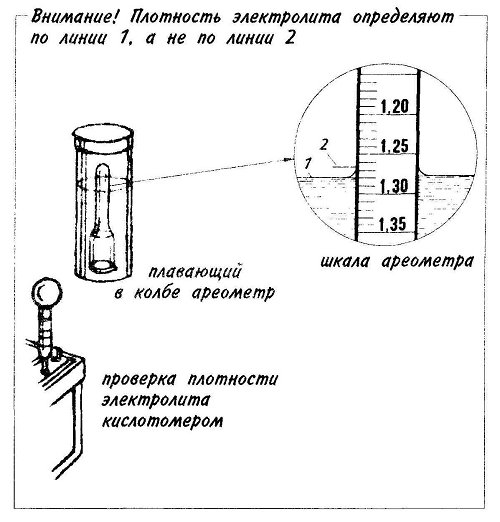 Сразу скажу, сейчас это уже не актуально.
Сразу скажу, сейчас это уже не актуально.Сейчас во все аккумуляторные батареи, в частности для наших широт заливают электролит плотностью 1,27- 1,28 г/см3. И менять её не требуется, это запрещено вообще! Коррекцию электролита самостоятельно тоже нельзя делать ни в коем случае. Это может сделать только специалист по ремонту аккумуляторов, и то в крайнем случае, например, при восстановлении АКБ.
Если Вы измерите плотность на новом полностью заряженном аккумуляторе, то плотность в нем будет 1,27 ровно. Ничего подливать туда не надо! Дело в том, что многие люди думают что на зиму надо сделать поядрёнее такой покрепче электролит. На самом деле, этого не требуется. При плотности 1,27 г/см
Слишком большая плотность делает среду чрезмерно агрессивной.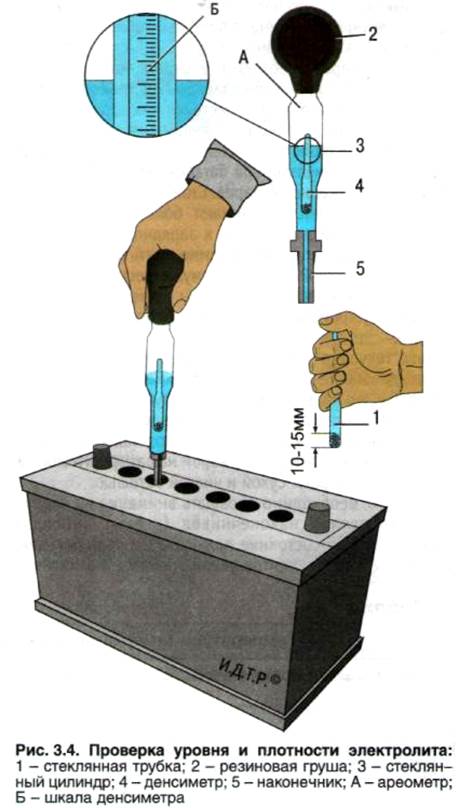 И соответственно, идет быстрее осыпания пластин аккумулятора. Потому что аккумуляторная батарея на автомобиле – это сбалансированное устройство, вмешиваться в его электролит значит выводить из баланса АКБ. Как некоторые делают по старинке: доливают дистиллированную воду на лето, а зимой доливают электролит. Ничего этого делать не нужно!
И соответственно, идет быстрее осыпания пластин аккумулятора. Потому что аккумуляторная батарея на автомобиле – это сбалансированное устройство, вмешиваться в его электролит значит выводить из баланса АКБ. Как некоторые делают по старинке: доливают дистиллированную воду на лето, а зимой доливают электролит. Ничего этого делать не нужно!
Лучше позаботьтесь о другом. Например, качественно зарядите аккумулятор перед холодами хорошим зарядным устройством. Для того, чтобы плотность выровнялась по банкам АКБ и вышла у Вас к номинальной 1,27- 1,28 г/см3. С такой плотностью электролита можно ездить и летом и зимой, так скажем всесезонный аккумулятор.
Вот поэтому никогда не проводите самостоятельно манипуляций с электролитом. Только корректируем уровень дистиллированной водой. То есть, подливая воду в банки до номинального уровня. Напомню, для легковых АКБ это полтора сантиметра над свинцовыми пластинами аккумулятора, для грузовых 2-3 см. Вот и все! Ну и соответственно, заряжаем для того, чтоб достигнуть рабочей плотности.
Надеюсь наши советы по эксплуатации автомобильного аккумулятора помогут Вам в жизни. Не совершайте ошибок.
Также на эту тему:
Условия эксплуатации автоаккумуляторов
1. Указание мер безопасности.
1.1. Заряд батареи производите в помещении, оборудованном приточно-вытяжной вентиляцией.
1.2. Во время заряда и обслуживания аккумуляторных батарей запрещается курить и пользоваться открытым пламенем.
1.3. Для приготовления электролита применяйте стойкую к действию серной кислоты посуду (керамическую, эбонитовую, освинцованную), в которую заливайте сначала воду, а затем при непрерывном помешивании серную кислоту. Вливать воду в концентрированную серную кислоту запрещается во избежание несчастного случая.
1.5. При случайном попадании брызг серной кислоты на кожу немедленно, до оказания медицинской помощи, осторожно снимите кислоту ватой, промойте пораженные места обильной струей воды и затем 5% раствором кальцинированной соды или аммиака.
1.6. При работе с металлическим инструментом не допускайте коротких замыканий одновременным прикосновением к разнополярным выводам аккумулятора.
2. Приведение в рабочее состояние сухозаряженных аккумуляторов.
2.1. Снять блок пробок.
2.2. Залить батарею электролитом.
2.3. Залить каждый элемент до требуемого уровня электролитом (метки уровня указаны на тыльной стороне АКБ), имеющим плотность при температуре 25 С: (1,28+-0,01) г/см3 для батарей «нормального исполнения», (1,23+-0,01) г/см3 для батарей «тропического исполнения».
2.4. Электролит для заливки батарей готовьте из серной кислоты (ГОСТ667-73 сорт высший или первый) и дистиллированной воды (ГОСТ 6709-72). Плотность электролита измеряйте ареометром аккумуляторным ГОСТ 18481-81.
Примечание: при повышении температуры на 1 С, плотность электролита уменьшается на 0,0007 г/куб.
 см, а при понижении температуры плотность увеличивается. Исходной считается температура 25 С.
см, а при понижении температуры плотность увеличивается. Исходной считается температура 25 С.Операции приведения в рабочее состояние должны производиться при температуре 25 +/- 10 С.
После заливки электролита через 20 минут проверить напряжение батареи без нагрузки. Если напряжение не менее 12.5 вольт, АКБ готова к работе. Если напряжение менее 12.5 вольт, но более 10.5 вольт АКБ необходимо подзарядить до напряжения, указанного изготовителем. При напряжении менее 10,5 вольт аккумулятор бракуется.
3. Заряд батареи.
3.1. Присоединить батарею к источнику постоянного тока, соединяя положительный полюсной вывод с положительным зажимом источника и аналогично, отрицательный полюсной вывод с отрицательным зажимом источника тока.
3.2. Заряжать током равным 10 % номинальной емкости батареи (5,5 А для 6СТ55, 6,6 А для 6СТ66 и т.д.).
3.3. Время зарядки ориентировочно до начала газовыделения. Плотность электролита после зарядки должна быть 1.
4. Приведение в рабочее состояние залитых батарей.
Измерить плотность и напряжение, которые должны быть не ниже 1,27 г/куб. см и 12,6 вольт соответственно.
Если напряжение и плотность не соответствуют указанным в п. 3.3., АКБ необходимо зарядить до плотности 1.27 г/куб.см.
4.1. Снять блок пробок.
4.2. Заряд АКБ производить согласно пункту 2.5.
5. Техническое обслуживание.
Не реже одного раза в две недели:
5.1. Проверяйте надежность крепления батареи в гнезде и плотность контакта наконечников проводов с выводами батареи, при необходимости снимите оксидную пленку с выводов.
5.3. При падении уровня электролита ниже отметки min на корпусе батареи доводите его до нормы дистиллированной водой непосредственно перед запуском двигателя для быстрого перемешивания с электролитом.

5.4. В зимнее время, особенно при температуре воздуха ниже -30 С, а также в случаях ненадежного запуска двигателя, периодически проверяйте плотность электролита. Не оставляйте на морозе частично разряженную батарею. При эксплуатации батареи при температуре ниже 30 С, плотность электролита в ней должна быть 1.30 г/куб.см.
Примечание: Неисправности в реле-регуляторе двигателя автомобиля влияют на качество и работоспособность батареи. Если напряжение генератора будет чрезмерно, высоким может произойти перезаряд батареи. Признаками этого являются: преждевременное разрушение аккумуляторных пластин (электродов) и, как следствие, быстрое уменьшение фактической емкости батареи и сокращение срока ее службы. При перезарядке резко снижается уровень электролита. Недостаточное напряжение генератора, особенно при эксплуатации при низких температурах, может привести к недозарядке батареи и ухудшению ее стартерных свойств.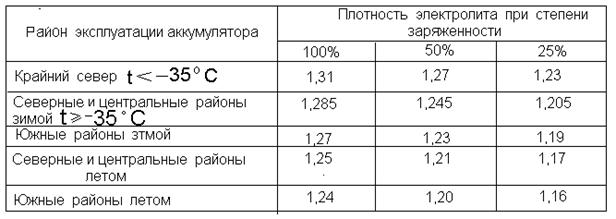
5.6. Доливать электролит в батарею разрешается только в случае, если произошло его выплескивание из АКБ.
5.7. Пуск стартера производить короткими включениями, но не более чем на 15 секунд. Езда при помощи стартера не допускается.
5.9. Батареи, временно снятые с машин хранить только в заряженном состоянии. Благоприятная температура хранения — от 0 С до — 10 С, но не ниже — 30 С.
5.10. Если батарея находится в периоде «бездействия» при положительных температурах необходимо заряжать ее раз в месяц, при отрицательных, только в случае, если падение плотности электролита более чем на 0,04 г/куб.см. В таком состоянии батареи могут находиться при положительных температурах не более 9 месяцев.
Часто задаваемые вопросы
Какой минимально допустимый уровень электролита? Что делать если уровень электролита слишком низкий?• Уровень электролита над верхним краем пластин должен быть в пределах от 18 до 45 мм (в зависимости от модели АКБ).
 Минимально допустимый уровень электролита 10мм. Важно помнить, что при понижении уровня электролита в процессе эксплуатации, в батарею следует доливать исключительно дистиллированную воду, а не электролит.
Минимально допустимый уровень электролита 10мм. Важно помнить, что при понижении уровня электролита в процессе эксплуатации, в батарею следует доливать исключительно дистиллированную воду, а не электролит.
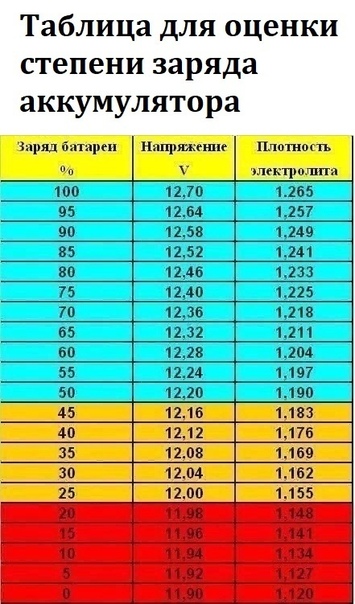
Какова должна быть плотность электролита?
• Плотность электролита должна быть в пределах (1,27÷1,30) г/см3 при 25˚С. При плотности электролита ниже 1,26 г/см3 при 25˚С, АКБ необходимо зарядить.
У меня на аккумуляторе маркировка вида 6X71D09UC, что она обозначает? Как определить дату производства АКБ?
• Маркировка вида 6X71D09UC наносится для производственной логистики и не несет информации для владельца аккумулятора. Дата изготовления нанесена на верхнюю часть крышки, состоит из 6 цифр и одной буквы, расшифровывается следующим образом: первые две цифры это месяц, вторая группа цифр это год и третья это день изготовления, буква — шифр смены. Например, маркировка 01 15 02 Т будет читаться как 02 января 2015г. Места нанесения маркировки можно найти у нас на сайте: Маркировка аккумуляторов АКОМ
Места нанесения маркировки можно найти у нас на сайте: Маркировка аккумуляторов АКОМ
У вас на сайте написано, что гарантия на аккумулятор 3 года, а продавец поставил гарантию 1 год? Правильно ли он поступил?
• Гарантийный срок на АКБ производства ЗАО «АКОМ» составляет от 12 до 48 месяцев при пробеге не более 50 000км – 100 000км (в зависимости от модели батареи), данная информация указана как на этикетках самой батареи, так и в инструкции по эксплуатации.
Обращаем Ваше внимание на то, что гарантийный срок всех АКБ производства ЗАО «АКОМ» начинается от даты изготовления. Также обратите внимание на пункт 6.2 инструкции по эксплуатации, где указаны случаи, при которых претензии не удовлетворяются.
В Вашем случае продавец поступил неправильно. В соответствии со ст.5 Закона РФ «О защите прав потребителей» гарантийный срок – период, в течение которого в случае обнаружения в товаре недостатка изготовитель (исполнитель, продавец, уполномоченная организация или уполномоченный индивидуальный предприниматель, импортер) обязаны удовлетворить требования потребителя, установленные статьями 18 и 29 Закона «О защите прав потребителей». В связи с этим продавец не имел права снижать срок гарантии, предоставляемый производителем.
В связи с этим продавец не имел права снижать срок гарантии, предоставляемый производителем.
Гарантийные обязательства выполняются в любом регионе РФ, при обращении к официальному представителю. При наличии производственного дефекта в приобретенной Вами батарее, гарантийные обязательства будут исполнены в полном объеме.
У меня вопрос по зарядке аккумулятора
• Инструкция по заряду АКБ находится на нашем сайте: зарядка аккумулятора
Машина всю ночь простояла на морозе, с утра не завелась. Снял аккумулятор и обнаружил, что электролит замерз. Почему это случилось? Что теперь делать с АКБ?
• Если электролит замёрз во всех банках одновременно, батарею необходимо поместить в помещение с температурой 25˚С не менее чем на 24 часа, после чего произвести заряд по инструкции. Данный случай не является гарантийным, т.к. замерзание электролита говорит о понижении его плотности – разряд АКБ не является дефектом завода изготовителя.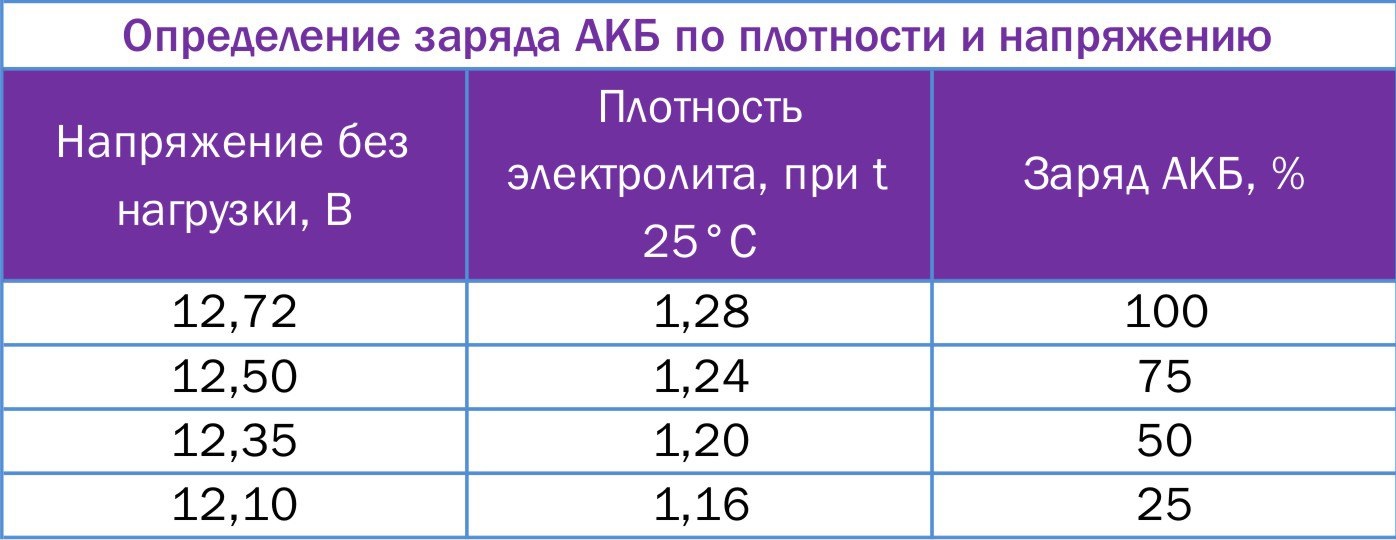
• Если электролит замерз в одной из банок АКБ, необходимо также отогреть батарею в течение суток, далее провести контрольный заряд. Если под нагрузкой замерзшая банка начинает кипеть, то вероятнее всего в ней присутствует дефект в виде короткого замыкания. В этом случае батарея подлежит замене по гарантии.
Я купил новый автомобиль, в нем стоит ваш аккумулятор. К кому мне обращаться в случае возникновения проблем с ним?
• В виду того, что аккумуляторная батарея была приобретена в составе автомобиля, все гарантийные обязательства перед Вами несет производитель в лице своего дилера, у которого был приобретен автомобиль.
Рекомендуем Вам ознакомиться с условиями предоставления гарантии на АКБ в сервисной книге. Если Ваш автомобиль находится в гарантийном периоде — обратитесь к дилеру для проведения диагностики АКБ и автомобиля.
Как поднять плотность электролита в аккумуляторе? Как заменить электролит в аккумуляторе? Что такое «плотность аккумулятора»?
Аккумуляторные батареи автомобилей созданы не только для пуска двигателя, но и для питания электрических приборов машины в тот момент, когда зажигание выключено. По невнимательности водитель с легкостью может забыть о включенных в автомобиле фарах или работающей магнитоле, громкость которой сведена к нулю. Вернувшись к машине на следующий день, можно обнаружить, что она не заводится, и причина тому севший источник питания. Завести машину при разряженном аккумуляторе можно, но через раз-два экстренные методы запуска двигателя начинают надоедать, и явно возникает необходимость вернуть в рабочее состояние аккумулятор.
По невнимательности водитель с легкостью может забыть о включенных в автомобиле фарах или работающей магнитоле, громкость которой сведена к нулю. Вернувшись к машине на следующий день, можно обнаружить, что она не заводится, и причина тому севший источник питания. Завести машину при разряженном аккумуляторе можно, но через раз-два экстренные методы запуска двигателя начинают надоедать, и явно возникает необходимость вернуть в рабочее состояние аккумулятор.
«Плотность аккумулятора» или соотношение серной кислоты и воды в электролите
В простонародье распространен такой термин как «плотность аккумулятора». По сути, он является ошибочным, поскольку никто не измеряет плотность непосредственно источника питания. Любой автомобильный любитель скажет, что под понятием «плотность аккумулятора» подразумевается плотность электролита, который залит в батарею. Именно от того какой плотности электролит находится в аккумуляторе, зависит его возможность заряжаться и сохранять накопленную энергию.
Если аккумулятор разрядился по невнимательности водителя или другим причинам, следует попробовать вернуть ему работоспособное состояние при помощи зарядного устройства. Перед тем как заряжать аккумулятор, в него доливают дистиллированную воду, которая могла испариться в процессе работы источника питания. Вода в аккумуляторе смешивается с готовым электролитом, что приводит к понижению его плотности, то есть к уменьшению процентного содержания серной кислоты в итоговом растворе. Через некоторое время плотность электролита в аккумуляторе, из-за постоянного разбавления его дистиллированной водой, снижается, и опускается ниже комфортного уровня. Эксплуатация батареи становится невозможно, и в таких ситуациях возникает необходимость в повышение плотности электролита в аккумуляторе.
Как поднять плотность электролита в аккумуляторе самостоятельно?
Плотность аккумулятора, а если говорить точнее, то электролита в нем, повысить можно довольно просто без обращения к специалистам сервисного центра.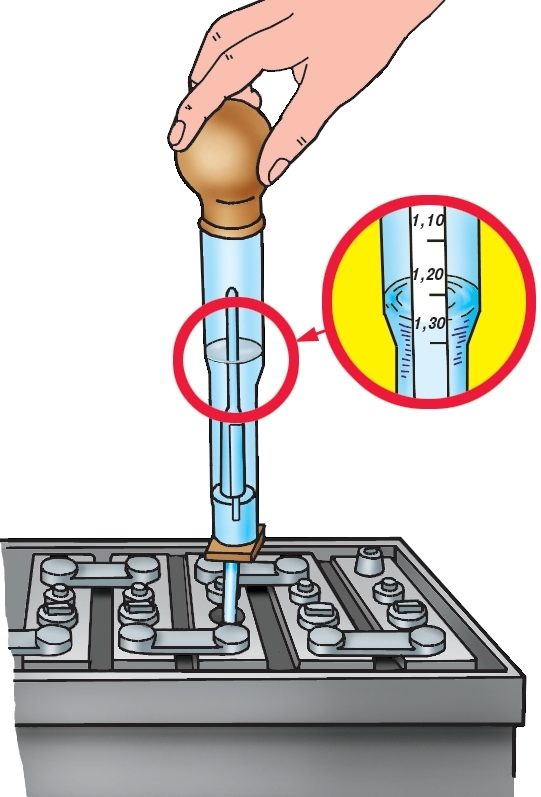 Первым делом необходимо провести ряд подготовительных процедур:
Первым делом необходимо провести ряд подготовительных процедур:
- Подготовьте емкости, которые понадобятся для слива части старого электролита из аккумулятора;
- Обзаведитесь средствами личной защиты – перчатки, очки, одежда (которую не страшно испортить). Помните: Электролит аккумулятора частично состоит из серной кислоты, которая опасна, и при попадании на кожу способна вызвать ожог, а одежду серьезно испортить;
- Возьмите инструменты, которые понадобятся, чтобы поднять плотность электролита в аккумуляторе: ареометр, клизма-груша, мерный стакан, воронка;
- Купите необходимые расходные материалы: дистиллированная воды, аккумуляторная кислота или готовый электролит.
Чтобы поднять плотность электролита в аккумуляторе, придется самостоятельно полностью заменить весь электролит, который уже залит в батарею, на новый раствор. Сделать это довольно просто, если выполнять все по инструкции и соблюдать необходимые меры предосторожности.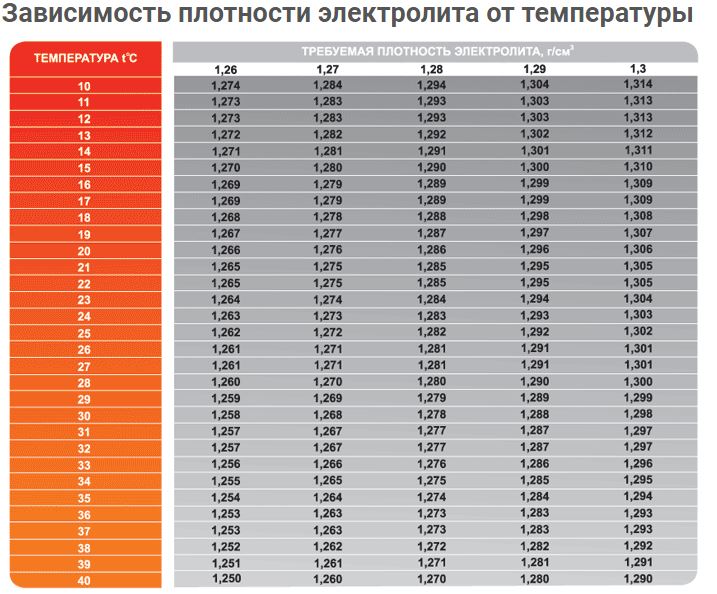
Как поменять электролит в аккумуляторе?
Большинство современных аккумуляторов выпускаются разборными, и они предусматривают возможность замены электролита самостоятельно. Неразборные аккумуляторы – большая редкость, и в них нельзя при необходимости отвинтить пробки для удаления старого электролита и заливки нового. При желании можно залить электролит и в неразборную батарею, но для этого необходимо в каждой банке с помощью сверла проделать отверстие. После замены электролита на место отверстий напаивается пластмасса, и аккумулятор вновь становится рабочим.
Сам процесс замены электролита довольно простой, и он состоит из следующих пунктов:
- Первым делом необходимо снять аккумулятор с автомобиля и найти подходящее место для замены электролита в нем и зарядки;
- Далее необходимо снять защиту с аккумулятора, если она имеется, и открутить пробки с банок;
- После этого берем клизму-грушу и вставляем ее конец в одну из банок аккумулятора.
 Пользуясь данным резиновым прибором, выкачиваем из аккумулятора старый электролит и сливаем его в заранее подготовленную емкость. Внимание: Ни в коем случае не выливайте электролит на землю, если вы выполняете работы на улице;
Пользуясь данным резиновым прибором, выкачиваем из аккумулятора старый электролит и сливаем его в заранее подготовленную емкость. Внимание: Ни в коем случае не выливайте электролит на землю, если вы выполняете работы на улице; - Выкачав практически весь старый электролит из всех банок, необходимо почистить пластины аккумулятора от его остатков. Сделать это можно с помощью дистиллированной воды, которая не вызовет внутри аккумулятора нежелательные реакции. Для этого дистиллированную воду заливают в каждую банку аккумулятора, после чего его поднимают и трясут. Хорошо удерживайте аккумулятор, чтобы в процессе тряски он не выпал. После этого сливаем получившийся раствор.
Стоит отметить, что некоторые автолюбители рекомендуют для «чистоты» будущего электролита в батарее не только промыть ее дистиллированной водой, но и использовать различные растворы. К примеру, рекомендуется залить в батарею раствор воды с содой и оставить его там на 4 часа. После этого также рекомендуется заливать на час в аккумулятор раствор поваренной соли.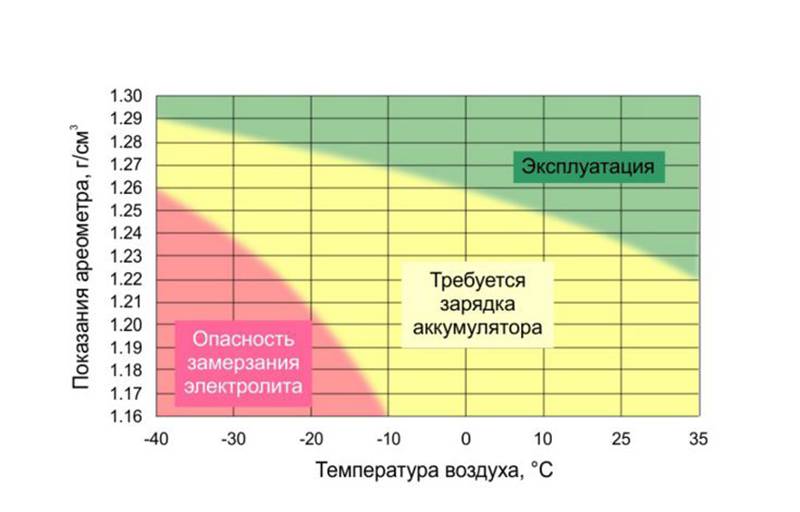
- Очистив банки аккумулятора от старого электролита, необходимо залить в него новый. Хорошо, если вы приобрели готовый электролит в магазине, тогда достаточно залить его с помощью воротки до указанных граней в каждую банку. В случае если у вас аккумуляторная кислота и дистиллированная вода, требуется предварительно сделать раствор электролита с плотностью в 1,27-1,28 грамм на сантиметр кубический;
- После этого закрываем банки и начинаем процесс зарядки аккумулятора;
- Сменив электролит в батарее, необходимо выполнять процесс заряда батареи по циклу «зарядка-разрядка» с силой тока не более 0,1 Ампер до тех пор, пока плотность аккумулятора (плотность электролита) не достигнет рабочих значений. Внимание: Зарядку можно окончить и начать использовать аккумулятор только после того как на концах клемм аккумулятора удастся замерить 14 Вольт.
Если вы решили поменять электролит в аккумуляторе самостоятельно, настоятельно рекомендуем соблюдать все меры предосторожности.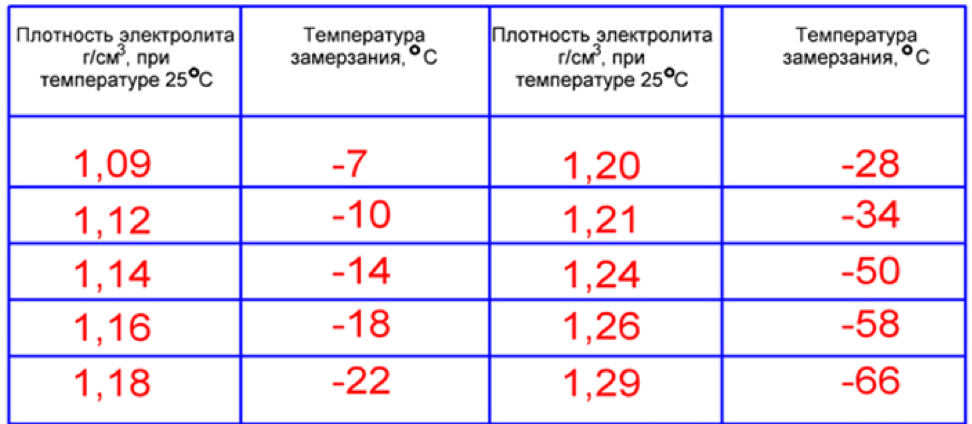 Кислотная среда, которой является электролит, вредна не только при попадании на кожу, но и в дыхательные пути. Менять электролит следует исключительно в хорошо проветриваемых помещениях с предельной осторожностью.
Кислотная среда, которой является электролит, вредна не только при попадании на кожу, но и в дыхательные пути. Менять электролит следует исключительно в хорошо проветриваемых помещениях с предельной осторожностью.
Советы по обслуживанию и эксплуатации автомобильных аккумуляторных батарей
По статистике примерно 20-30% неисправностей автомобиля относятся к неисправностям в электрооборудовании. Именно аккумуляторная батарея является сердцем системы электрооборудования, и именно от нее зависит работа всей системы. Долговечность и исправность работы аккумулятора зависит не только от его качества изготовления и применяемой при его производстве технологии, но и от правильного и своевременного ухода.
В первую очередь, аккумулятор должен быть чистым, потому, что грязь, скопившаяся на его поверхности, неминуемо приведет к повышенному саморазряду батареи. По этой причине при обслуживании аккумулятора его поверхность нужно протереть 10% раствором соды или нашатырного спирта, после чего вытереть насухо чистой ветошью.
По этой причине при обслуживании аккумулятора его поверхность нужно протереть 10% раствором соды или нашатырного спирта, после чего вытереть насухо чистой ветошью.
Не забывайте регулярно прочищать вентиляционные отверстия в пробках аккумулятора, так как во время его заряда выделяются газы, и им нужно обеспечить свободный выход. Кстати выделяющиеся газы, перемешиваясь между собой, образуют гремучий газ, поэтому очень опасно находится возле аккумулятора с источником открытого пламени, особенно если в это время аккумулятор заряжается.
Периодически нужно очищать контактные штыри аккумулятора и клеммы. После пробега каждых 2 000 км. нужно проверять уровень электролита в банках аккумуляторной батареи. Если уровень электролита ниже нормы, нужно долить в банки дистиллированную воду, но, ни в коем случае не электролит, потому, что испаряется именно вода, а кислота остается в электролите, в результате чего ее концентрация увеличивается.
Для проверки степени заряженности аккумуляторной батареи периодически нужно проверять плотность электролита в каждой банке. Делают это с помощью специального прибора – кислотомера. При проверке плотности, наконечник кислотомера вставляют в заливное отверстие аккумулятора, погружают его в электролит, и с помощью резиновой груши засасывают электролит. Внутри колбы располагается специальный поплавок, который может погружаться на различную глубину, в зависимости от плотности электролита. На поплавке нанесены деления, по которым и определяется плотность. Чтобы измерения были точными нельзя измерять плотность, если электролит «кипит» (во время заряда), или если он горячий. Нормальной считается плотность электролита 1, 28 гсм. при температуре + 25˚С. Понижение плотности от нормы на 0,01 г/см, соответствует разряду аккумулятора на 6%.
Делают это с помощью специального прибора – кислотомера. При проверке плотности, наконечник кислотомера вставляют в заливное отверстие аккумулятора, погружают его в электролит, и с помощью резиновой груши засасывают электролит. Внутри колбы располагается специальный поплавок, который может погружаться на различную глубину, в зависимости от плотности электролита. На поплавке нанесены деления, по которым и определяется плотность. Чтобы измерения были точными нельзя измерять плотность, если электролит «кипит» (во время заряда), или если он горячий. Нормальной считается плотность электролита 1, 28 гсм. при температуре + 25˚С. Понижение плотности от нормы на 0,01 г/см, соответствует разряду аккумулятора на 6%.
Часто причиной выхода из строя аккумулятора является сульфатация пластин. Такое происходит, если эксплуатировать аккумулятор с низким уровнем электролита, а также, если аккумулятор долго был разряженным, или не полностью заряженным. Небольшую сульфатацию можно устранить несколькими циклами заряда и разряда аккумулятора.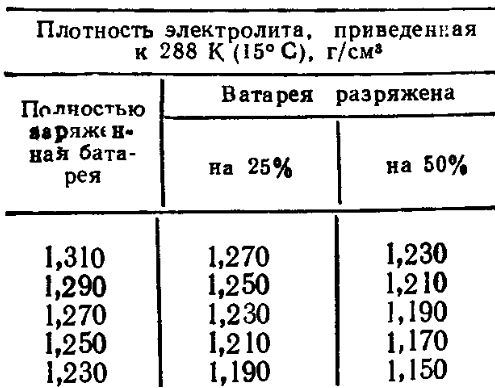 Доверять эту работу лучше специалистам, так как здесь много тонкостей. Если аккумулятор сильно сульфатирован, то восстановить его работоспособность вообще невозможно – его нужно менять.
Доверять эту работу лучше специалистам, так как здесь много тонкостей. Если аккумулятор сильно сульфатирован, то восстановить его работоспособность вообще невозможно – его нужно менять.
Как измерить удельный вес
Что такое удельный вес и как его проверить?
Удельный вес используется для проверки состояния заряда аккумулятора, по сути, это отношение веса раствора к весу равного объема воды. Проверка удельного веса ячейки выполняется с помощью ареометра, лучший из которых автоматически компенсирует температуру. Поскольку соотношение воды и серной кислоты внутри батареи изменяется в зависимости от активности, изменяется и плотность электролита, это то, что измеряет ареометр.Другой тест, который следует провести вместе с тестами на удельную плотность, — это проверка напряжения холостого хода вашей батареи. Trojan Battery рекомендует следующие шаги для проведения тестов на удельный вес своих аккумуляторов:
Проверка удельного веса
(используется только для заливных батарей) - Не добавляйте воду в это время.

- Перед отбором пробы наполните и слейте воду из ареометра 2–4 раза.
- В ареометре должно быть достаточно пробы электролита, чтобы полностью поддерживать поплавок.
- Снимите показания, запишите их и верните электролит обратно в ячейку.
- Чтобы проверить другую ячейку, повторите 3 шага выше.
- Проверьте все элементы в аккумуляторной батарее.
- Установите на место вентиляционные колпачки и сотрите пролившийся электролит.
- Исправьте показания до 80 ° F:
- Добавить 0,004 к показаниям на каждые 10 ° выше 80 ° F
- Вычтите 0,004 на каждые 10 ° ниже 80 ° F.
- Сравните показания.
- Проверьте уровень заряда по таблице ниже
- Проверить и записать уровни напряжения.
- Полностью зарядите аккумулятор (и).

- Снова снимите показания удельного веса.
- Проверить уровень (-а) напряжения.
- Выполните уравнительный заряд. Обратитесь к разделу «Уравновешивание батарей», чтобы узнать о правильной процедуре.
- Снова снимите показания удельного веса.
- Батарея старая, срок ее службы подходит к концу.
- Аккумулятор слишком долго оставался в разряженном состоянии.
- Электролит был потерян из-за пролива или перелива.
- Развивается слабая или плохая клетка.
- Аккумулятор перед тестированием был чрезмерно полив.
Проверка напряжения холостого хода
- Отключите все нагрузки от аккумуляторов.
- Измерьте напряжение с помощью вольтметра постоянного тока.
- Проверьте уровень заряда по таблице 1.
- Зарядите аккумулятор, если уровень заряда составляет от 0% до 70%.
- Аккумулятор слишком долго находился в разряженном состоянии.
- Батарея неисправна.
Показания должны быть на уровне 1,277 +/- .007 или выше заводской спецификации. Если какое-либо значение удельного веса окажется низким, выполните следующие действия.
Если какие-либо значения удельного веса по-прежнему низкие, выполните следующие действия.
Если какое-либо значение удельного веса по-прежнему ниже заводской спецификации 1,277 +/- .007, то может существовать одно или несколько из следующих условий:

Для получения точных показаний напряжения батареи должны оставаться в режиме ожидания (без зарядки и разрядки) не менее 6 часов, предпочтительно 24 часа.
Если уровень заряда батареи ниже значений, указанных в таблице 1, могут существовать следующие условия:
Батареи в этих условиях следует доставить к специалисту для дальнейшей оценки или снять с эксплуатации.
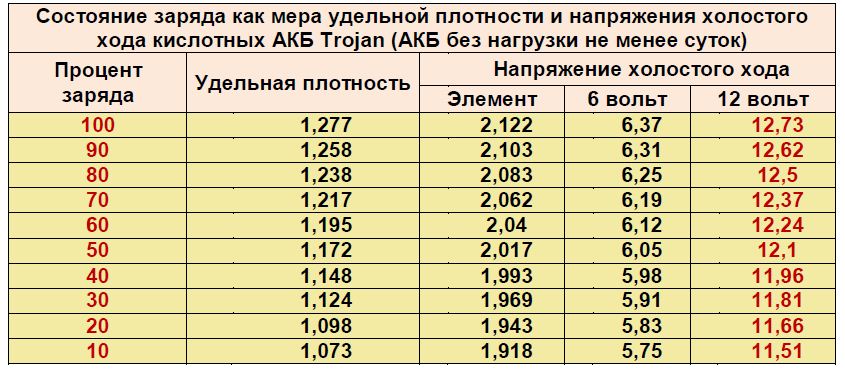
ТАБЛИЦА 1.Состояние заряда в зависимости от удельного веса и напряжения холостого хода
| Процент заряда | Удельный вес с поправкой на 80 ° F | Напряжение холостого хода | |||||
| 6В | 8В | 12 В | 24 В | 36 В | 48 В | ||
| 100 | 1,277 | 6,37 | 8,49 | 12,73 | 25,46 | 38,20 | 50. 93 93 |
| 90 | 1,258 | 6.31 | 8,41 | 12,62 | 25,24 | 37,85 | 50,47 |
| 80 | 1,238 | 6,25 | 8,33 | 12,50 | 25,00 | 37,49 | 49,99 |
| 70 | 1,217 | 6,19 | 8,25 | 12,37 | 24,74 | 37,12 | 49.49 |
| 60 | 1,195 | 6,12 | 8,16 | 12,24 | 24,48 | 36,72 | 48,96 |
| 50 | 1,172 | 6,05 | 8,07 | 12,10 | 24,20 | 36,31 | 48,41 |
| 40 | 1,148 | 5,98 | 7,97 | 11,96 | 23,92 | 35,87 | 47.83 |
| 30 | 1,124 | 5,91 | 7,88 | 11,81 | 23,63 | 35,44 | 47,26 |
| 20 | 1,098 | 5,83 | 7,77 | 11,66 | 23,32 | 34,97 | 46,63 |
| 10 | 1,073 | 5,75 | 7,67 | 11,51 | 23,02 | 34,52 | 46. 03 03 |
Как работает электролит? — Батарейный университет
Узнайте больше о катализаторе, который охватывает электроды батареи и обеспечивает поток электричества.
Электролит служит катализатором, делающим батарею проводящей, способствуя перемещению ионов от катода к аноду при зарядке и в обратном направлении при разряде. Ионы — это электрически заряженные атомы, которые потеряли или приобрели электроны. Электролит батареи состоит из растворимых солей, кислот или других оснований в жидком, гелеобразном и сухом форматах.Электролит также бывает в виде полимера, который используется в твердотельной батарее, твердой керамики и расплавленных солей, как в натрий-серной батарее.
В свинцовой кислоте используется серная кислота . При зарядке кислота становится более плотной, так как оксид свинца (PbO 2 ) образуется на положительной пластине, а затем превращается почти в воду при полном разряде. Удельный вес серной кислоты измеряется ареометром. (См. Также BU-903: Как измерить заряд). Свинцово-кислотные батареи бывают залитых и герметичных форматов, также известных как свинцово-кислотные с регулируемым клапаном (VRLA) или необслуживаемые.
Удельный вес серной кислоты измеряется ареометром. (См. Также BU-903: Как измерить заряд). Свинцово-кислотные батареи бывают залитых и герметичных форматов, также известных как свинцово-кислотные с регулируемым клапаном (VRLA) или необслуживаемые.
Серная кислота бесцветна с легким желто-зеленым оттенком, растворима в воде и обладает высокой коррозионной активностью. Обесцвечивание до коричневатого оттенка может быть вызвано ржавчиной в результате анодной коррозии или попаданием воды в аккумуляторный блок.
Свинцово-кислотные батареи бывают разной плотности (SG). В батареях глубокого цикла используется плотный электролит с удельной массой до 1,330 для достижения высокой удельной энергии, стартерные батареи имеют средний удельный вес около 1,265, а стационарные батареи имеют низкий удельный вес около 1.От 225 до умеренной коррозии и увеличения срока службы. (См. BU-903: Как измерить заряд.).
Серная кислота находит широкое применение, а также содержится в очистителях канализации и различных чистящих средствах.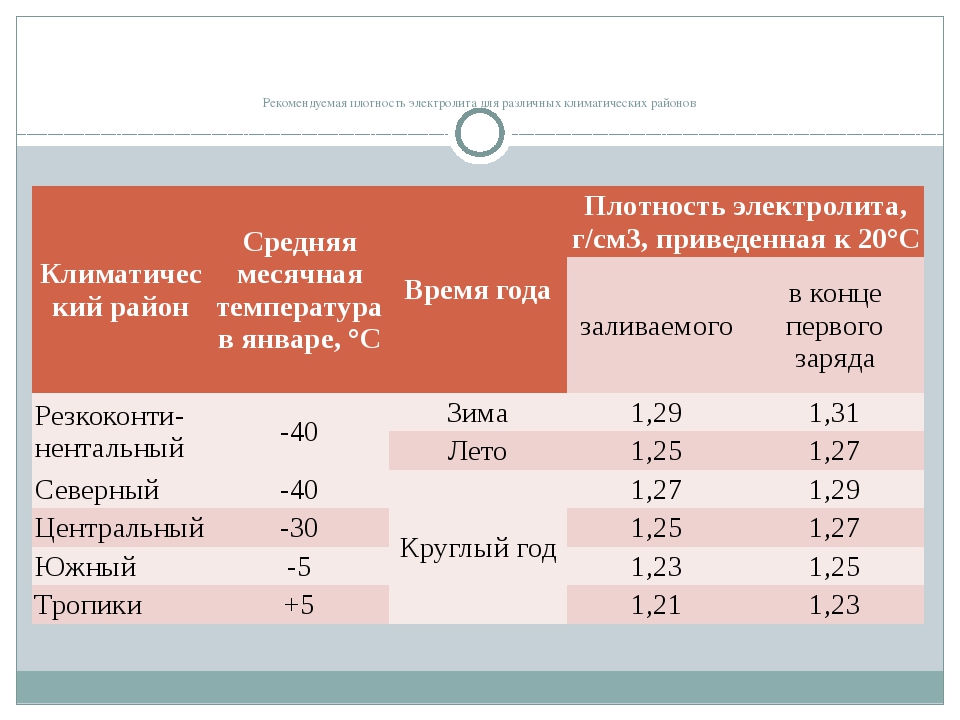 Кроме того, он служит для переработки минерального сырья, переработки минерального сырья, производства удобрений, нефтепереработки, очистки сточных вод и химического синтеза.
Кроме того, он служит для переработки минерального сырья, переработки минерального сырья, производства удобрений, нефтепереработки, очистки сточных вод и химического синтеза.
| ВНИМАНИЕ: | Серная кислота может вызвать серьезные повреждения при контакте с кожей и привести к необратимой слепоте при попадании в глаза.Проглатывание серной кислоты вызывает необратимые повреждения. |
Электролитом в NiCd является щелочной электролит (гидроксид калия) . Большинство никель-кадмиевых батарей имеют цилиндрическую форму, в которой несколько слоев положительных и отрицательных материалов намотаны в рулон желе. Версия NiCd для заливки используется в качестве судовой батареи в коммерческих самолетах и в системах ИБП, работающих в жарком и холодном климате, требующих частой езды на велосипеде. NiCd дороже свинцово-кислотной, но служит дольше.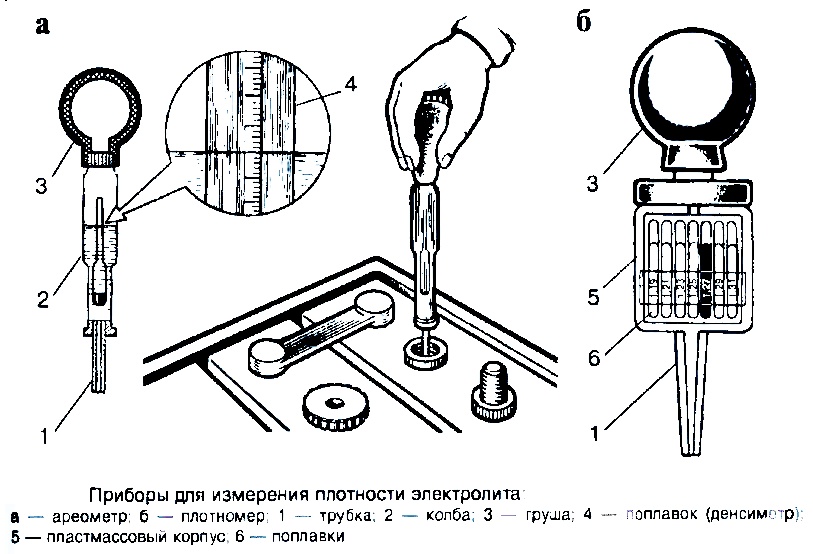
NiMH использует тот же или аналогичный электролит, что и NiCd, который обычно представляет собой гидроксид калия. Электроды NiMH уникальны и состоят из никеля, кобальта, марганца, алюминия и редкоземельных металлов, которые также используются в Li-ion. NiMH доступен только в герметичных версиях.
Гидроксид калия — это неорганическое соединение с формулой КОН, обычно называемое едким калием. Электролит бесцветен и имеет множество промышленных применений, например, в качестве ингредиента в большинстве мягких и жидких мыл.КОН вреден при проглатывании.
В Li-ion используется жидкий, гелевый или сухой полимерный электролит. Жидкая версия представляет собой горючий органический, а не водный тип, раствор солей лития с органическими растворителями, подобными этиленкарбонату. Смешивание растворов с различными карбонатами обеспечивает более высокую проводимость и расширяет температурный диапазон. Другие соли могут быть добавлены для уменьшения выделения газов и улучшения высокотемпературного цикла.
Литий-ионный аккумулятор с гелеобразными электролитами содержит множество добавок для увеличения проводимости, также как и литий-полимерный аккумулятор.Настоящий сухой полимер становится проводящим только при повышенных температурах, и эта батарея больше не используется в коммерческих целях. Добавки также вводятся для достижения долговечности и уникальных характеристик. Рецепт засекречен и у каждого производителя есть свой секретный соус. (См. Также BU-808b: Что вызывает смерть Li-ion?)
Электролит должен быть стабильным, но это не относится к Li-ion. На аноде образуется пассивирующая пленка, которая называется границей раздела твердого электролита (SEI) .Этот слой отделяет анод от катода, но позволяет ионам проходить сквозь него подобно сепаратору. По сути, слой SEI должен формироваться, чтобы батарея могла работать. Пленка стабилизирует систему и продлевает срок службы литий-ионного аккумулятора, но это приводит к снижению емкости. На катоде также происходит окисление электролита, что постоянно снижает емкость. (См. Также BU-701: Как заправить батареи)
(См. Также BU-701: Как заправить батареи)
Чтобы пленки не становились слишком ограничивающими, добавки смешиваются с электролитом, который расходуется во время формирования слоя SEI.При проведении судебно-медицинской экспертизы отследить их присутствие сложно, а то и невозможно. При этом патентованные добавки являются коммерческой тайной, как их состав, так и используемое количество.
Хорошо известная добавка — виниленкарбонат (ВК). Это химическое вещество увеличивает срок службы литий-ионных аккумуляторов, особенно при более высоких температурах, и сохраняет внутреннее сопротивление на низком уровне с возрастом и использованием. VC также поддерживает стабильную пленку SEI на аноде без побочных эффектов окисления электролита на катоде (Aurbach et al).Говорят, что академические и исследовательские сообщества отстают от производителей ячеек в знаниях и выборе добавок, отсюда и большой секрет. (См. Также «Добавки и их влияние на эффективность кулоновского цинка» в документе BU-808b: Что вызывает умиротворение литий-ионных аккумуляторов?
Для большинства коммерческих литий-ионных аккумуляторов слой SEI разрушается при температуре ячейки 75–90 ° C (167–194 ° F). Тип элемента и состояние заряда (SoC) влияют на пробой при повышенной температуре. Может возникнуть самонагревание, которое может привести к тепловому разгоне, если не охладить должным образом.Лабораторные тесты, проведенные на ячейках 18650, показали, что такое тепловое явление может развиться в течение двух дней.
Тип элемента и состояние заряда (SoC) влияют на пробой при повышенной температуре. Может возникнуть самонагревание, которое может привести к тепловому разгоне, если не охладить должным образом.Лабораторные тесты, проведенные на ячейках 18650, показали, что такое тепловое явление может развиться в течение двух дней.
Воспламеняемость литий-ионного электролита является еще одной проблемой, и проводятся эксперименты по получению негорючих или восстановленных легковоспламеняющихся электролитов с помощью добавок или разработки неорганических ионных жидкостей. Также проводятся исследования по работе литий-ионных аккумуляторов при низких температурах. На момент написания ни один из этих электролитов не находился в широком коммерческом использовании.
Высыхание или медленное превращение жидкого электролита в твердую форму является еще одним явлением старения, которое снижает производительность литий-ионных аккумуляторов.«Когда жидкость уходит, батареи разряжены», — говорит Джефф Дан, специалист по литий-ионным батареям и профессор физики. Жидкость электролита — еще один показатель состояния, который относится ко всем химическим свойствам аккумуляторов.
Жидкость электролита — еще один показатель состояния, который относится ко всем химическим свойствам аккумуляторов.
Последнее обновление: 26 фев 2020
*** Пожалуйста, прочтите комментарии ***
Комментарии предназначены для «комментирования», открытого обсуждения среди посетителей сайта. Battery University отслеживает комментарии и понимает важность выражения точек зрения и мнений на общем форуме.Однако при общении необходимо использовать соответствующий язык, избегая спама и дискриминации.
Если у вас есть предложение или вы хотите сообщить об ошибке, воспользуйтесь формой «свяжитесь с нами» или напишите нам по адресу: [email protected]. Нам нравится получать от вас известия, но мы не можем ответить на все запросы. Мы рекомендуем размещать свой вопрос в разделах комментариев, чтобы Battery University Group (BUG) могла поделиться им.
Предыдущий урок Следующий урокИли перейти к другой артикуле
Батареи как источник питанияМониторинг состояния заряда батареи (SOC)
Мониторинг состояния заряда батареи (SOC), вероятно, является самой важной задачей, которую нужно выполнять с солнечной системой.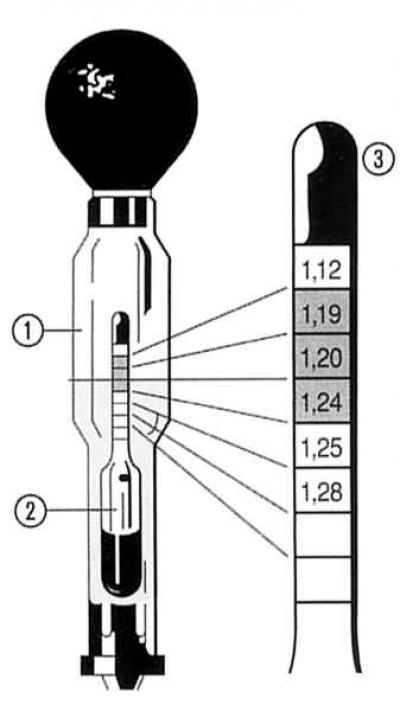 К сожалению, это трудно оценить с высокой степенью точности, особенно для новичков. Существует три основных метода определения SOC аккумулятора.
К сожалению, это трудно оценить с высокой степенью точности, особенно для новичков. Существует три основных метода определения SOC аккумулятора.
| Напряжение | SOC | |||||||
|---|---|---|---|---|---|---|---|---|
| 12,57 | 100% | |||||||
| 12,36 | 80% | |||||||
| 12,15 | 60% | |||||||
| 20% |
1.Напряжение: напряжение необходимо измерять, когда батарея находится в состоянии покоя. Это означает, что батарея не заряжается и нагрузка не выходит. В идеале батарея должна находиться в состоянии покоя в течение 20-30 минут перед измерением напряжения. Приблизительные значения для 12-вольтовой батареи:
Как видите, диапазон напряжений довольно узок, поэтому для измерения этих значений вам понадобится неплохой цифровой мультиметр.
2. Удельный вес: вы можете использовать ареометр для измерения плотности электролита, чтобы дать вам представление о SOC. Это также подвержено интерпретации и оценке. Когда батарея разряжается, электролит становится светлее. Когда вы заряжаете аккумулятор, этот более легкий электролит будет плавать сверху и давать очень пессимистичные показания. Это называется расслоением электролита и преодолевается только тогда, когда электролит снова перемешивается под действием пузырьков хорошего заряда. Добавление в аккумулятор дистиллированной воды также повлияет на показания. Также есть проблемы с чтением ареометров и качеством ареометров.Грязный ареометр может загрязнить аккумулятор. Чтобы получить точные показания, вам необходимо откорректировать значения температурной компенсации. Различные производители аккумуляторов могут использовать в своих аккумуляторах кислоты разной концентрации. Итак, в заключение, оценка SOC батареи по показаниям ареометра также сопряжена с множеством трудностей и неточностей.
Это также подвержено интерпретации и оценке. Когда батарея разряжается, электролит становится светлее. Когда вы заряжаете аккумулятор, этот более легкий электролит будет плавать сверху и давать очень пессимистичные показания. Это называется расслоением электролита и преодолевается только тогда, когда электролит снова перемешивается под действием пузырьков хорошего заряда. Добавление в аккумулятор дистиллированной воды также повлияет на показания. Также есть проблемы с чтением ареометров и качеством ареометров.Грязный ареометр может загрязнить аккумулятор. Чтобы получить точные показания, вам необходимо откорректировать значения температурной компенсации. Различные производители аккумуляторов могут использовать в своих аккумуляторах кислоты разной концентрации. Итак, в заключение, оценка SOC батареи по показаниям ареометра также сопряжена с множеством трудностей и неточностей.
Plasmatronics PL регулятор: последний метод включал мониторинг ампер-часов на входе и выходе из вашей батареи. Цитата из Руководства по плазматронным устройствам:
Цитата из Руководства по плазматронным устройствам:
SOC (Состояние заряда) следует читать как процентную оценку того, насколько полная батарея.
Оценка основана на счетчике баланса ампер-часов. Этот счетчик поддерживает текущий баланс ампер-часов в ампер-часах в ампер-часах в отключенном состоянии. Дисплей SOC показывает этот баланс в процентах от емкости батареи. Обратите внимание, что размер батареи должен быть введен установщиком с настройкой BCAP (емкость батареи), прежде чем SOC станет значимым.
Со временем счетчик баланса в ампер-часах будет отклоняться от реального состояния заряда батареи. Для перенастройки счетчика PL делает две поправки:
1.Когда состояние регулятора изменяется с Absorb на Float И рабочий цикл заряда меньше 25%, SOC сбрасывается на 100%.
2. SOC может считывать более 100%, однако, как только будет записан 1 Ач разрядки, он будет снова установлен на 100%.
Примечание. К цифре SOC следует относиться с осторожностью, поскольку она может быть неточной по нескольким причинам:
* PL автоматически не получает информацию обо всей системе. Чтобы SOC вообще работал, PL должен измерять весь заряд (Ah in) и разряд (Ah out).Если аккумулятор может заряжаться или разряжаться без знания PL, SOC не будет иметь смысла.
Чтобы SOC вообще работал, PL должен измерять весь заряд (Ah in) и разряд (Ah out).Если аккумулятор может заряжаться или разряжаться без знания PL, SOC не будет иметь смысла.
* Различия в эффективности заряда означают, что SOC будет немного оптимистичным.
* Эффективная емкость аккумулятора уменьшается с возрастом. В старых батареях необходимо уменьшить BCAP, чтобы приспособиться к этому.
* Саморазряд и колебания температуры также могут вызывать некоторую неточность.
Неэффективность батареи и потери на саморазряд проявляются, когда SOC показывает более 100%.Так что нет ничего необычного в том, чтобы увидеть SOC на уровне, скажем, 112%, когда ваша батарея переходит в состояние плавающего режима. 12% представляют собой дополнительную мощность, которую ваши источники зарядки должны были вложить, чтобы компенсировать потери батареи.
Если ваша батарея находится в разряженном состоянии — скажем, показывает 112% — она упадет до 99% после разрядки одного ампер-часа.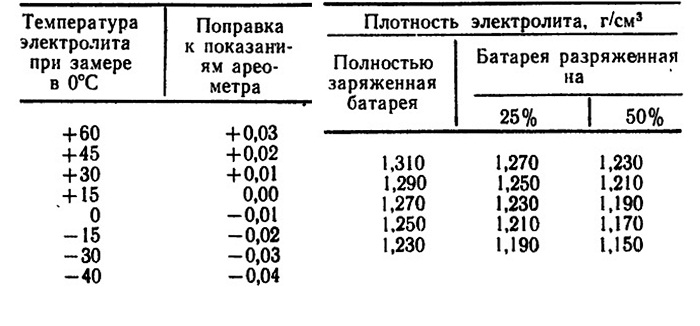 Скажем, она снижается до 80%, а на следующий день поднимается только до 90%. К сожалению, потраченные 10% не учитывают потери при зарядке аккумулятора. Так что, вероятно, он заряжен только на 89%, а не на 90%.Это довольно мелочь. Однако при продолжительной пасмурной погоде или при зарядке в течение нескольких дней подряд без достижения поплавка ошибка становится накопительной. Таким образом, подобная зарядка на второй день приведет к заряду только до 88% и т. Д. Пару недель в пасмурную погоду легко могут привести к ошибке в 15-20% (с оптимистичной стороны). Неэффективность зарядки уменьшается по мере того, как батарея разряжается, поэтому эта ошибка в некоторой степени уменьшается по мере разряда батареи.
Скажем, она снижается до 80%, а на следующий день поднимается только до 90%. К сожалению, потраченные 10% не учитывают потери при зарядке аккумулятора. Так что, вероятно, он заряжен только на 89%, а не на 90%.Это довольно мелочь. Однако при продолжительной пасмурной погоде или при зарядке в течение нескольких дней подряд без достижения поплавка ошибка становится накопительной. Таким образом, подобная зарядка на второй день приведет к заряду только до 88% и т. Д. Пару недель в пасмурную погоду легко могут привести к ошибке в 15-20% (с оптимистичной стороны). Неэффективность зарядки уменьшается по мере того, как батарея разряжается, поэтому эта ошибка в некоторой степени уменьшается по мере разряда батареи.
Итак, в заключение, мы считаем, что отображение% SOC чрезвычайно полезно.В большинстве случаев мы считаем, что это более точно, чем измерение напряжения или удельного веса батареи. Однако через несколько дней, когда аккумулятор не переходит в плавающее положение, дисплей может ввести в заблуждение. В этом случае мы также рекомендуем вам взглянуть на минимальное и максимальное напряжение, чтобы лучше оценить состояние заряда аккумулятора.
В этом случае мы также рекомендуем вам взглянуть на минимальное и максимальное напряжение, чтобы лучше оценить состояние заряда аккумулятора.
Полив свинцово-кислотной батареи: основы
Точно так же, как вы не можете обойтись без воды, так же как и ваша батарея. Полив свинцово-кислотного аккумулятора — важный этап обслуживания, который нельзя пропустить.Это сохраняет вашу батарею в оптимальном состоянии и безопасно для ее использования. Несвоевременный полив свинцово-кислотной батареи может привести к серьезным повреждениям, но не всегда легко понять, когда лучше поливать батарею. Следуйте этим инструкциям по поливу свинцово-кислотной батареи.
Почему батареи нужно поливать
Свинцово-кислотные батареи состоят из плоских свинцовых пластин, погруженных в бассейн с электролитом. Электролит состоит из воды и серной кислоты. Размер пластин аккумулятора и количество электролита определяют количество заряда, которое может сохранить свинцово-кислотный аккумулятор, или количество часов использования. Вода — ключевая часть функционирования свинцовой батареи.
Вода — ключевая часть функционирования свинцовой батареи.
Кроме того, во время процесса перезарядки, когда электричество проходит через водную часть электролита, вода превращается в свои исходные элементы, водород и кислород. Эти газы очень легковоспламеняющиеся, поэтому из вашего жилого автофургона или морских аккумуляторов необходимо вывести наружу. Выделение газов приводит к потере воды, поэтому в свинцово-кислотные батареи необходимо периодически добавлять воду. Батареи, не требующие особого обслуживания, такие как батареи AGM, являются исключением, поскольку они способны компенсировать потерю воды.
Чрезмерный полив и недостаточный полив могут повредить аккумулятор. Чтобы свинцовый аккумулятор работал на максимальном уровне, следуйте этим рекомендациям по поливу.
Первое — начните с безопасностиДля начала обязательно используйте средства индивидуальной защиты, такие как защитные очки и перчатки, при работе с аккумуляторами. Кроме того, очень важно понимать, что некоторые батареи требуют регулярного полива, в то время как другие батареи не требуют обслуживания.
Обязательно найдите информацию на этикетке аккумулятора, которая указывает, можно ли открыть аккумулятор и отремонтировать. В зависимости от типа батареи, которую вы используете, предупреждающие надписи на батарее должны направлять вас «НЕ ОТКРЫВАТЬ» батарею или «ЗАДЕРЖИВАЙТЕ ВЕНТИЛЯЦИОННЫЕ КОЛПАЧКИ ПОСЛЕ ПОЛИВА». Обязательно следуйте инструкциям на этикетке с предупреждением.
Как полить аккумулятор
Хотя аккумулятор следует заряжать только после полной зарядки, вы также должны проверять уровень воды перед зарядкой, чтобы убедиться, что воды достаточно, чтобы покрыть все открытые пластины.После зарядки добавьте достаточно воды, чтобы довести уровень до дна вентиляционного отверстия, примерно на ¾ ниже верха элемента.
Важно отметить, что владельцы аккумуляторов никогда не должны добавлять в аккумуляторы серную кислоту. При нормальной работе батареи потребляют только воду, а не серную кислоту. Когда уровень электролита в вашей батарее низкий, заполнение батареи водой сохранит батарею здоровой и безопасной для использования.
Не над водойВо время зарядки аккумулятора плотность раствора электролита увеличивается.Если перед зарядкой было добавлено слишком много воды, уровень электролита увеличится, что приведет к переполнению аккумулятора и повреждению аккумулятора. Кроме того, чрезмерный полив аккумулятора может привести к дополнительному разбавлению электролита, что приведет к снижению производительности аккумулятора.
Когда следует поливать аккумулятор
Как часто вы добавляете воду в аккумулятор, зависит от того, как часто вы им пользуетесь. Аккумулятор для тележки для гольфа, который используется только по выходным, может потребовать полива только раз в месяц.Вилочный погрузчик, который используется весь день, каждый день, может нуждаться в поливе аккумулятора каждую неделю. В жаркую погоду увеличивается потребность в поливе. Важно регулярно проверять уровень жидкости в аккумуляторе — лучше всего это делать после того, как аккумулятор зарядится.
Какую воду следует использоватьИзбегайте использования водопроводной воды. При заправке аккумулятора обычная водопроводная вода не подойдет. Водопроводная вода содержит минералы, которые вредны для аккумуляторов, даже если их добавляют в небольших количествах.Это особенно верно для воды, умягченной с помощью умягчителей, содержащих хлориды. На всякий случай лучше всего подойдет дистиллированная вода, которая требует гораздо меньших вложений, чем новая батарея.
Помните, что вода будет находиться поверх раствора кислоты в вашей батарее, пока он не смешается с пузырьками, возникающими при зарядке. Если вы снимаете показания ареометра электролита, лучше всего снимать их после завершения зарядки.
Не допускайте обезвоживания аккумулятора. Поливайте в жаркие месяцы и круглый год.
Свинцово-кислотные батареи | PVEducation
5 свинцово-кислотных аккумуляторов
Свинцово-кислотные батареи — наиболее часто используемый тип батарей в фотоэлектрических системах. Хотя свинцово-кислотные батареи имеют низкую плотность энергии, умеренную эффективность и высокие требования к техническому обслуживанию, они также имеют длительный срок службы и низкие затраты по сравнению с другими типами батарей. Одним из исключительных преимуществ свинцово-кислотных аккумуляторов является то, что они являются наиболее часто используемой формой аккумуляторов для большинства аккумуляторных батарей (например, для запуска двигателей автомобилей) и, следовательно, имеют хорошо зарекомендовавшую себя зрелую технологическую базу.
Рисунок: Изменение напряжения в зависимости от степени заряда для нескольких различных типов батарей.
Свинцово-кислотная батарея состоит из отрицательного электрода из губчатого или пористого свинца. Свинец пористый, что способствует образованию и растворению свинца. Положительный электрод состоит из оксида свинца. Оба электрода погружены в электролитический раствор серной кислоты и воды. В случае, если электроды входят в контакт друг с другом в результате физического движения батареи или изменения толщины электродов, два электрода разделяет электрически изолирующая, но химически проницаемая мембрана.Эта мембрана также предотвращает короткое замыкание через электролит. Свинцово-кислотные батареи накапливают энергию за счет обратимой химической реакции, показанной ниже.
Общая химическая реакция:
PbO2 + Pb + 2h3SO4⇔заряженный разряд2PbSO4 + 2h3O
На минусовой клемме реакции заряда и разряда:
Pb + SO42-заряженныйразрядPbSO4 + 2e-
На положительном выводе реакции заряда и разряда:
PbO2 + SO42- + 4H ++ 2e-заряженный разрядPbSO4 + 2h3O
Как показывают приведенные выше уравнения, разрядка батареи вызывает образование кристаллов сульфата свинца как на отрицательной, так и на положительной клеммах, а также высвобождение электронов из-за изменения валентного заряда свинца.Для образования этого сульфата свинца используется сульфат сернокислотного электролита, окружающего аккумулятор. В результате электролит становится менее концентрированным. Полный разряд приведет к тому, что оба электрода будут покрыты сульфатом свинца и водой, а не серной кислотой, окружающей электроды. При полном разряде два электрода сделаны из одного материала, и между двумя электродами отсутствует химический потенциал или напряжение. На практике, однако, разряд прекращается при напряжении отсечки, задолго до этого момента.Поэтому аккумулятор не должен разряжаться ниже этого напряжения.
Между полностью разряженным и заряженным состояниями свинцово-кислотная батарея будет испытывать постепенное снижение напряжения. Уровень напряжения обычно используется для обозначения степени заряда аккумулятора. Зависимость аккумулятора от уровня заряда показана на рисунке ниже. Если аккумулятор оставить на низком уровне заряда в течение длительного периода времени, могут вырасти крупные кристаллы сульфата свинца, что необратимо снижает емкость аккумулятора.Эти более крупные кристаллы не похожи на типичную пористую структуру свинцового электрода, и их трудно преобразовать обратно в свинец.
В результате реакции зарядки сульфат свинца на отрицательном электроде превращается в свинец. На положительном конце реакция превращает свинец в оксид свинца. В качестве побочного продукта этой реакции выделяется водород. Во время первой части цикла зарядки преобладающей реакцией является превращение сульфата свинца в свинец и оксид свинца. Однако по мере того, как происходит зарядка и большая часть сульфата свинца превращается либо в свинец, либо в диоксид свинца, зарядный ток электролизует воду из электролита, и выделяются водород и газообразный кислород, процесс, известный как «выделение газа» из батареи.Если ток подается в батарею быстрее, чем может быть преобразован сульфат свинца, то выделение газа начинается до того, как весь сульфат свинца будет преобразован, то есть до того, как батарея будет полностью заряжена. Газообразование создает несколько проблем в свинцово-кислотной батарее. Газовыделение батареи не только вызывает проблемы безопасности из-за взрывоопасной природы производимого водорода, но также снижает количество воды в батарее, которую необходимо заменять вручную, вводя в систему компонент для обслуживания.Кроме того, выделение газа может вызвать отделение активного материала от электролита, что приведет к необратимому снижению емкости аккумулятора. По этим причинам аккумулятор не следует регулярно заряжать выше напряжения, которое вызывает газообразование. Напряжение газовыделения изменяется в зависимости от скорости заряда.
Сульфат свинца является изолятором, и поэтому способ образования сульфата свинца на электродах определяет, насколько легко можно разрядить аккумулятор.
Для большинства систем возобновляемой энергии наиболее важными характеристиками батареи являются срок службы батареи, глубина разряда и требования к обслуживанию батареи.Этот набор параметров и их взаимосвязь с режимами зарядки, температурой и возрастом описаны ниже.
Глубина разряда в сочетании с емкостью батареи является фундаментальным параметром в конструкции блока батарей для фотоэлектрической системы, поскольку энергия, которая может быть извлечена из батареи, определяется умножением емкости батареи на глубину разряда. Батареи классифицируются как батареи глубокого или мелкого цикла. Глубина разряда батареи глубокого цикла может превышать 50%, а может достигать 80%.Чтобы достичь такой же полезной емкости, аккумуляторная батарея с малым циклом должна иметь большую емкость, чем аккумуляторная батарея с глубоким циклом.
Помимо глубины разряда и номинальной емкости аккумулятора, мгновенная или доступная емкость аккумулятора сильно зависит от скорости разряда аккумулятора и рабочей температуры аккумулятора. Емкость аккумулятора падает примерно на 1% на градус ниже примерно 20 ° C. Однако высокие температуры также не идеальны для аккумуляторов, поскольку они ускоряют старение, саморазряд и расход электролита.На приведенном ниже графике показано влияние температуры и скорости разряда аккумулятора на емкость аккумулятора.
Рисунок: Взаимосвязь между емкостью батареи, температурой и скоростью разряда.
Со временем емкость батареи снижается из-за сульфатирования батареи и выделения активного материала. Ухудшение емкости аккумулятора наиболее сильно зависит от взаимосвязи следующих параметров:
- режим зарядки / разрядки аккумулятора
- DOD батареи за весь срок ее службы
- его подверженность длительным периодам низкого разряда
- средняя температура аккумулятора за весь срок его службы
На следующем графике показано изменение функции батареи в зависимости от количества циклов и глубины разряда для свинцово-кислотной батареи с малым циклом.Свинцово-кислотная батарея глубокого разряда должна иметь срок службы более 1000 циклов даже при глубине разряда более 50%.
Рисунок: Взаимосвязь между емкостью батареи, глубиной разряда и сроком службы для батареи с малым циклом разряда.
Помимо DOD, режим зарядки также играет важную роль в определении срока службы батареи. Перезаряд или недозаряд батареи приводит либо к потере активного материала, либо к сульфатированию батареи, что значительно сокращает срок ее службы.
Рисунок: Влияние режима зарядки на емкость аккумулятора.
Окончательное влияние на зарядку аккумулятора связано с температурой аккумулятора. Хотя емкость свинцово-кислотной батареи снижается при работе при низких температурах, работа при высоких температурах увеличивает скорость старения батареи.
Рисунок: Взаимосвязь между емкостью батареи, температурой и сроком службы для батареи глубокого цикла.
Кривые разряда при постоянном токе для свинцово-кислотной батареи емкостью 550 Ач при различных скоростях разряда с ограничивающим напряжением 1.85 В на ячейку (Mack, 1979). Более длительное время разряда увеличивает емкость аккумулятора.
Производство водорода и кислорода из батареи приводит к потере воды, поэтому в свинцово-кислотных батареях необходимо регулярно заменять воду. Другие компоненты аккумуляторной системы не требуют регулярного обслуживания, поэтому потеря воды может стать серьезной проблемой. Если система находится в удаленном месте, проверка потери воды может увеличить затраты. Батареи, не требующие обслуживания, ограничивают потребность в регулярном внимании, предотвращая или уменьшая количество газа, выходящего из батареи.Однако из-за коррозионной природы электролита все батареи в некоторой степени вносят дополнительный компонент для технического обслуживания в фотоэлектрическую систему.
Свинцово-кислотные батареи обычно имеют кулоновский КПД 85% и КПД по энергии порядка 70%.
В зависимости от того, какая из вышеперечисленных проблем является наиболее важной для конкретного приложения, соответствующие модификации базовой конфигурации батареи улучшают ее характеристики. В случае использования возобновляемых источников энергии указанные выше проблемы повлияют на глубину разряда, срок службы батареи и требования к техническому обслуживанию.Изменения в батарее обычно включают модификацию в одной из трех основных областей:
- изменения состава и геометрии электродов
- замен на раствор электролита
- модификации корпуса или клемм аккумуляторной батареи для предотвращения или уменьшения утечки образующегося газообразного водорода.
Залитые свинцово-кислотные батареи характеризуются длительным циклом работы и длительным сроком службы. Однако залитые батареи требуют периодического обслуживания. Необходимо не только регулярно контролировать уровень воды в электролите, измеряя его удельный вес, но эти батареи также требуют «ускоренной зарядки».
Ускоренная зарядка
Ускоренная или выравнивающая зарядка включает в себя кратковременную периодическую перезарядку, при которой выделяется газ и смешивается электролит, предотвращая расслоение электролита в батарее. Кроме того, ускоренная зарядка также помогает поддерживать одинаковую емкость всех аккумуляторов. Например, если одна батарея развивает более высокое внутреннее последовательное сопротивление, чем другие батареи, тогда батарея с более низким SR будет постоянно недозаряжаться во время нормального режима зарядки из-за падения напряжения на последовательном сопротивлении.Однако, если батареи заряжаются более высоким напряжением, это позволяет полностью зарядить все батареи.
Удельный вес (SG)
Залитая батарея подвержена потере воды из электролита из-за выделения водорода и газообразного кислорода. Удельный вес электролита, который можно измерить ареометром, укажет на необходимость добавления воды в батареи, если батареи полностью заряжены. В качестве альтернативы ареометр точно укажет уровень заряда батареи, если известно, что уровень воды правильный.SG периодически измеряется после ускоренной зарядки, чтобы убедиться, что в батарее достаточно воды в электролите. Удельный вес батареи должен быть предоставлен производителем.
Особые рекомендации для гелевых герметичных свинцово-кислотных аккумуляторов
Свинцово-кислотные батареив гелеобразном состоянии или AGM (которые обычно герметичны или регулируются с помощью клапана) имеют несколько потенциальных преимуществ:
- они могут быть подвергнуты глубокому циклу с сохранением срока службы батареи
- ускоренная зарядка не нужна
- они требуют меньшего обслуживания.
Однако эти батареи обычно требуют более точного режима зарядки и более низкого напряжения. Режим зарядки с более низким напряжением обусловлен использованием свинцово-кальциевых электродов для минимизации выделения газов, но требуется более точный режим зарядки, чтобы минимизировать выделение газов от батареи. Кроме того, эти батареи могут быть более чувствительными к колебаниям температуры, особенно если режим зарядки не компенсирует температуру или не предназначен для этих типов батарей.
Аккумулятор для фотоэлектрической системы будет рассчитан на определенное количество циклов при определенном DOD, режиме зарядки и температуре.Однако батареи могут преждевременно терять емкость или внезапно выходить из строя по разным причинам. Внезапный отказ может быть вызван внутренним коротким замыканием батареи из-за отказа электрического разделителя внутри батареи. Короткое замыкание в батарее снизит напряжение и емкость всего блока батарей, особенно если секции батареи соединены параллельно, а также приведет к другим потенциальным проблемам, таким как перезаряд оставшихся батарей.Батарея также может выйти из строя из-за разрыва цепи (то есть может происходить постепенное увеличение внутреннего последовательного сопротивления), и любые батареи, подключенные последовательно с этой батареей, также будут затронуты. Замораживание аккумулятора, в зависимости от типа используемого свинцово-кислотного аккумулятора, также может вызвать необратимый выход аккумулятора из строя.
Постепенное снижение емкости может усугубляться неправильной эксплуатацией, в частности, ухудшением DOD. Однако работа одной части аккумуляторной батареи в условиях, отличных от другой, также приведет к снижению общей емкости и увеличению вероятности отказа батареи.Батареи могут непреднамеренно эксплуатироваться в разных режимах либо из-за колебаний температуры, либо из-за выхода из строя батареи в одной цепочке батарей, что приводит к неравномерной зарядке и разрядке в цепочке.
Установка
Батареи должны устанавливаться в соответствии с действующим стандартом страны, в которой они устанавливаются. В настоящее время существуют австралийские стандарты AS3011 и AS2676 для установки батарей. Существует также проект стандарта для батарей для приложений RAPS, который в конечном итоге станет австралийским стандартом.
Среди других факторов, которые необходимо учитывать при установке аккумуляторной системы, являются вентиляция, необходимая для конкретного типа аккумуляторной батареи, условия заземления, на которых должна быть размещена аккумуляторная батарея, и меры, принятые для обеспечения безопасности тех, кто может иметь доступ к аккумуляторной батарее. Кроме того, при установке блока батарей необходимо следить за тем, чтобы температура батареи находилась в пределах допустимых условий эксплуатации батареи и чтобы температура батарей в большем блоке батарей была такой же.Батареи в очень холодных условиях могут замерзать при низком уровне заряда, поэтому зимой вероятность того, что батарея будет разряжена, будет более низкой. Чтобы предотвратить это, аккумуляторную батарею можно закопать под землю. Аккумуляторы, регулярно подвергающиеся воздействию высоких рабочих температур, также могут иметь сокращенный срок службы.
Батареи потенциально опасны, и пользователи должны знать о трех основных опасностях: Серная кислота в электролите вызывает коррозию. При работе с батареями важна не только защита ног и глаз, но и защитная одежда.
Батареи обладают способностью генерировать большой ток. Если металлический предмет случайно попадает на клеммы батареи, через этот предмет могут протекать большие токи. При работе с батареями следует свести к минимуму присутствие ненужных металлических предметов (например, украшений), а инструменты должны иметь изолированные ручки.
Опасность взрыва из-за выделения газообразного водорода и кислорода. Во время зарядки, особенно при перезарядке, некоторые батареи, включая большинство батарей, используемых в фотоэлектрических системах, могут выделять потенциально взрывоопасную смесь водорода и кислорода.Чтобы снизить риск взрыва, используется вентиляция для предотвращения скопления этих газов, а потенциальные источники воспламенения (т. Е. Цепи, которые могут генерировать искры или дуги) исключаются из корпуса аккумуляторной батареи.
Аккумуляторы вводят компонент периодического обслуживания в фотоэлектрическую систему. Для всех аккумуляторов, включая «необслуживаемые», требуется график технического обслуживания, который должен обеспечивать:
- клеммы АКБ не корродированы
- соединения аккумулятора затянуты
- корпус аккумуляторной батареи не должен иметь трещин и коррозии.
Залитые батареи требуют дополнительного и более частого обслуживания. Для залитых аккумуляторов уровень электролита и удельный вес электролита для каждой батареи необходимо регулярно проверять. Проверка удельного веса аккумулятора с помощью ареометра должна выполняться не менее чем через 15 минут после выравнивания или ускоренного заряда. В аккумуляторы следует добавлять только дистиллированную воду. Водопроводная вода содержит минералы, которые могут повредить электроды батареи.
Свинец в свинцово-кислотных аккумуляторах представляет опасность для окружающей среды, если он не утилизируется надлежащим образом.Свинцово-кислотные батареи следует утилизировать, чтобы можно было восстановить свинец без ущерба для окружающей среды.
Материалы, из которых изготовлены электроды, имеют большое влияние на химический состав батареи и, следовательно, влияют на напряжение батареи и ее характеристики зарядки и разрядки. Геометрия электрода определяет внутреннее последовательное сопротивление, а также скорость зарядки и разрядки.
Основными материалами анода и катода в свинцово-кислотной батарее являются свинец и диксоди свинца (PbO2).Свинцовый электрод выполнен в виде губчатого свинца. Губчатый свинец желателен, поскольку он очень пористый, и поэтому площадь поверхности между свинцом и электролитом серной кислоты очень велика. Добавление небольших количеств других элементов в свинцовый электрод для образования сплавов свинца может уменьшить некоторые недостатки, связанные со свинцом. Основными типами используемых электродов являются свинец / сурьма (с использованием нескольких процентов сурьмы), сплавы свинец / кальций и сплавы свинец / сурьма / кальций.
Аккумуляторы из свинцового сплава с сурьмой имеют несколько преимуществ перед электродами из чистого свинца.К этим преимуществам относятся: более низкая стоимость свинца / сурьмы; повышенная прочность свинцово-сурьмянистого электрода; и возможность получить глубокую разрядку в течение короткого периода времени. Однако сплавы свинец / сурьма склонны к сульфатированию, и их не следует оставлять при низком уровне заряда в течение длительных периодов времени. Кроме того, сплавы свинец / сурьма увеличивают выделение газа в батарее во время зарядки, что приводит к значительным потерям воды. Поскольку в эти батареи необходимо добавлять воду, они требуют более серьезного обслуживания.Кроме того, свинцово-сурьмянистые батареи отличаются высокой скоростью разряда и коротким сроком службы. Эти проблемы (xx — проверьте, вызваны ли обе проблемы металлизацией)) вызваны растворением сурьмы с одного электрода и ее осаждением или осаждением на другом электроде. (xx повышенная адгезия PbO2 xx)
Свинцово-кальциевые батареи — это технология со средней стоимостью. Как и сурьма, кальций также увеличивает прочность свинца отрицательного электрода, но, в отличие от сурьмы, добавление кальция снижает выделение газа в батарее, а также снижает скорость саморазряда.Однако свинцово-кальциевые батареи не следует сильно разряжать. Следовательно, эти типы аккумуляторов можно считать «необслуживаемыми», но это только аккумуляторы с малым циклом заряда.
Добавление сурьмы, а также кальция в электроды дает некоторые преимущества как сурьмы, так и свинца, но при более высокой стоимости. Батареи глубокого разряда, подобные этим, также могут иметь длительный срок службы. Кроме того, к электродам могут быть добавлены следовые количества других материалов, чтобы повысить производительность батареи.
Помимо материала, из которого изготовлены электродные пластины, физическая конфигурация электродов также влияет на скорость зарядки и разрядки, а также на срок службы. Тонкие пластины обеспечивают более быструю зарядку и разрядку, но они менее прочные и более склонны к отслаиванию материала с пластин. Поскольку высокие зарядные или разрядные токи обычно не являются обязательной характеристикой аккумуляторов для систем возобновляемой энергии, можно использовать более толстые пластины, которые имеют меньшее время зарядки и разрядки, но также имеют более длительный срок службы.
В открытой залитой аккумуляторной батарее любой образующийся газ может улетучиваться в атмосферу, вызывая проблемы как безопасности, так и технического обслуживания. Герметичный свинцово-кислотный (SLA), свинцово-кислотный (VRLA) с регулируемым клапаном или рекомбинированный свинцово-кислотный аккумулятор предотвращает потерю воды из электролита, предотвращая или сводя к минимуму утечку газообразного водорода из аккумулятора. В герметичной свинцово-кислотной батарее (SLA) водород не улетучивается в атмосферу, а скорее перемещается или мигрирует к другому электроду, где он рекомбинирует (возможно, с помощью процесса каталитического преобразования) с образованием воды.Эти батареи не являются полностью герметичными, а имеют вентиляционное отверстие, предотвращающее накопление избыточного давления в батарее. Герметичные батареи требуют строгого контроля заряда, чтобы предотвратить накопление водорода быстрее, чем он может рекомбинировать, но они требуют меньше обслуживания, чем открытые батареи.
Свинцово-кислотные батареи с клапанным регулированием (VRLA) по своей концепции аналогичны герметичным свинцово-кислотным (SLA) аккумуляторным батареям, за исключением того, что клапаны должны выделять водород почти полностью.Батареи SLA или VRLA обычно имеют дополнительные конструктивные особенности, такие как использование гелеобразных электролитов и использование свинцово-кальциевых пластин для сведения к минимуму выделения газообразного водорода.
Несмотря на разнообразие типов батарей и областей применения, особенно важными характеристиками фотоэлектрических систем являются требования к обслуживанию батареи и способность глубоко заряжать батарею при сохранении длительного срока службы. Для обеспечения длительного срока службы при глубоком разряде батареи глубокого разряда могут быть либо открытого типа, с избытком электролитического раствора и толстыми пластинами, либо иммобилизованного электролитического типа.Герметичные гелевые батареи могут быть классифицированы как батареи глубокого разряда, но они обычно выдерживают меньшее количество циклов и меньшие разряды, чем специально разработанные батареи с заливной пластиной или батареи AGM. В аккумуляторах с мелким циклом обычно используются более тонкие пластины из свинцово-кальциевых сплавов, и обычно глубина разряда не превышает 25%.
Батареи для фотоэлектрических или удаленных источников питания (RAPS)
Строгие требования к батареям, используемым в фотоэлектрических системах, побудили нескольких производителей изготавливать батареи, специально предназначенные для фотоэлектрических или других удаленных систем питания.В автономных фотоэлектрических системах чаще всего используются батареи свинцово-кислотного типа с глубоким циклом или необслуживаемые батареи с меньшим циклом. Батареи глубокого цикла могут быть батареями с открытым заливом (которые не требуют обслуживания) или батареями AGM с невыпадающим электролитом, которые не требуют обслуживания (но которые требуют осторожности при выборе регулятора). Специальные необслуживаемые батареи с малым циклом работы, которые выдерживают нечастую разрядку, также могут использоваться в фотоэлектрических системах, и при условии, что аккумуляторная батарея спроектирована надлежащим образом, никогда не требуется DOD более 25%.Аккумулятор с длительным сроком службы в правильно спроектированной фотоэлектрической системе при правильном обслуживании может прослужить до 15 лет, но использование батарей, которые не предназначены для длительного срока службы, или условий в фотоэлектрической системе, или являются частью плохой конструкции системы может привести к выходу из строя аккумуляторного блока всего через несколько лет.
Доступны несколько других типов батарей специального назначения, которые описаны ниже.
Пусковые, осветительные батареи зажигания (SLI). Эти аккумуляторы используются в автомобилях и отличаются высокой скоростью разряда и заряда.Чаще всего используются электродные пластины, упрочненные либо свинцово-сурьмяной в затопленной конфигурации, либо свинцово-кальциевой в герметичной конфигурации. Эти батареи имеют хороший срок службы в условиях малого цикла, но имеют очень низкий срок службы в условиях глубокого цикла. Батареи SLI не следует использовать в фотоэлектрической системе, поскольку их характеристики не оптимизированы для использования в системе возобновляемых источников энергии, поскольку срок службы фотоэлектрической системы очень мал.
Тяговые или тяговые аккумуляторные батареи. Тяговые или двигательные батареи используются для обеспечения электроэнергией небольших транспортных средств, таких как тележки для гольфа.По сравнению с батареями SLI, они обладают большей способностью выдерживать глубокий цикл при сохранении длительного срока службы. Хотя эта особенность делает их более подходящими для фотоэлектрической системы, чем та, которая использует батареи SLI, двигательные батареи не должны использоваться в каких-либо фотоэлектрических системах, поскольку их скорость саморазряда очень высока из-за использования свинцово-сурьмяных электродов. Высокая скорость саморазряда фактически приведет к большим потерям мощности в батарее и сделает общую фотоэлектрическую систему неэффективной, если батареи не будут испытывать большой DOD на ежедневной основе.Способность этих аккумуляторов выдерживать глубокую цикличность также намного ниже, чем у настоящих аккумуляторов глубокого цикла. Поэтому эти батареи не подходят для фотоэлектрических систем.
Жилые или морские батареи. Эти батареи обычно представляют собой компромисс между батареями SLI, тяговыми батареями и настоящими батареями глубокого цикла. Хотя они и не рекомендуются, в некоторых небольших фотоэлектрических системах используются двигательные и морские батареи. Срок службы таких батарей будет ограничен в лучшем случае несколькими годами, так что экономия на замене батарей означает, что такие батареи, как правило, не являются долгосрочным рентабельным вариантом.
Стационарные аккумуляторы. Стационарные батареи часто используются для аварийного питания или источников бесперебойного питания. Это батареи мелкого цикла, предназначенные для того, чтобы оставаться почти полностью заряженными в течение большей части своего срока службы с лишь редкими глубокими разрядами. Их можно использовать в фотоэлектрических системах, если размер аккумуляторной батареи не должен опускаться ниже DOD от 10% до 25%.
Батареи глубокого разряда. Батареи глубокого разряда должны обеспечивать срок службы в несколько тысяч циклов при высокой глубине разряда (80% или более).Значительные различия в характеристиках цикла могут наблюдаться с двумя типами батарей глубокого разряда, поэтому следует сравнивать срок службы и степень разряда различных батарей глубокого разряда.
Свинцово-кислотный аккумулятор состоит из электродов из оксида свинца и свинца, погруженных в раствор слабой серной кислоты. Возможные проблемы со свинцово-кислотными аккумуляторами включают:
Газообразование: выделение водорода и кислорода. Выделение аккумулятора газом приводит к проблемам с безопасностью и потере воды из электролита.Потеря воды увеличивает требования к обслуживанию батареи, поскольку воду необходимо периодически проверять и заменять.
Повреждение электродов. Вывод отрицательного электрода мягкий и легко повреждается, особенно в тех случаях, когда аккумулятор может постоянно или сильно двигаться.
Расслоение электролита. Серная кислота — тяжелая вязкая жидкость. По мере разряда батареи концентрация серной кислоты в электролите снижается, а во время зарядки концентрат серной кислоты увеличивается.Это циклическое изменение концентрации серной кислоты может привести к расслоению электролита, при котором более тяжелая серная кислота остается на дне батареи, а менее концентрированный раствор, вода, остается наверху. Непосредственная близость электродных пластин внутри батареи означает, что при физическом встряхивании серная кислота и вода не смешиваются. Однако контролируемое выделение газа электролита способствует смешиванию воды и серной кислоты, но его необходимо тщательно контролировать, чтобы избежать проблем безопасности и потери воды.В большинстве свинцово-кислотных аккумуляторов требуется периодическая, но нечастая подача газа в аккумулятор для предотвращения или обращения вспять расслоения электролита в процессе, называемом «ускоренной» зарядкой.
Сульфатирование аккумулятора. При низком уровне заряда на свинцовом электроде могут расти крупные кристаллы сульфата свинца, в отличие от мелкозернистого материала, который обычно образуется на электродах. Сульфат свинца — изоляционный материал.
Разлив серной кислоты. Если серная кислота вытечет из батарейного отсека, это представляет серьезную угрозу безопасности.Желирование или иммобилизация жидкой серной кислоты снижает вероятность разливов серной кислоты.
Зависание АКБ при низком уровне разряда. Если аккумулятор находится на низком уровне разряда после превращения всего электролита в воду, точка замерзания электролита также падает.
Потеря активного материала электродов. Потеря активного материала электродов может происходить в результате нескольких процессов. Одним из процессов, который может вызвать необратимую потерю емкости, является отслаивание активного материала из-за изменений объема между xxx и сульфатом свинца.Кроме того, xxx. Неправильные условия зарядки и выделение газа могут вызвать отслоение активного материала от электродов, что приведет к необратимой потере емкости.
В зависимости от того, какая из вышеперечисленных проблем является наиболее важной для конкретного приложения, соответствующие модификации базовой конфигурации батареи улучшают ее характеристики. В случае использования возобновляемых источников энергии указанные выше проблемы повлияют на глубину разряда, срок службы батареи и требования к техническому обслуживанию.Изменения в батарее обычно включают модификацию в одной из трех основных областей:
- изменения состава и геометрии электродов
- замен на раствор электролита
- модификации корпуса или клемм аккумуляторной батареи для предотвращения или уменьшения утечки образующегося газообразного водорода.
Коррозия состоит из областей набора или восстановления / окисления, в которых обе реакции происходят на одном и том же электроде. Для аккумуляторной системы коррозия приводит к нескольким пагубным последствиям.Один из эффектов заключается в том, что он превращает металлический электрод в оксид металла.
Все химические реакции протекают как в прямом, так и в обратном направлении. Чтобы обратная реакция протекала, реагенты должны набирать достаточно энергии, чтобы преодолеть электрохимическую разницу между реагентами и продуктами, а также перенапряжение. Обычно в аккумуляторных системах вероятность возникновения обратной реакции мала, так как имеется несколько молекул с достаточно большой энергией. Однако некоторые частицы, хотя и маленькие, обладают достаточной энергией.В заряженной батарее существует процесс, с помощью которого батарея может быть разряжена даже при отсутствии нагрузки, подключенной к батарее. Количество разряжаемого аккумулятора при стоянии называется саморазрядом. Саморазряд увеличивается с увеличением температуры, потому что у большей части продуктов будет достаточно энергии для протекания реакции в обратном направлении.
Идеальный набор химических реакций для батареи — это тот, в котором существует большой химический потенциал, который высвобождает большое количество электронов, имеет низкое перенапряжение, спонтанно протекает только в одном направлении и является единственной химической реакцией, которая может произойти.Однако на практике есть несколько эффектов, которые ухудшают характеристики батареи из-за нежелательных химических реакций, таких как изменение фазы объема реагентов или продуктов, а также физическое движение реагентов и продуктов внутри батареи.
В процессе химических реакций многие материалы претерпевают изменение либо в фазе, либо, если они остаются в одной и той же фазе, объем и плотность материала могут быть изменены в результате химической реакции. Наконец, материалы, используемые в батарее, в первую очередь анод и катод, могут изменить свою кристалличность или структуру поверхности, что, в свою очередь, повлияет на реакции в батарее.Многие компоненты в окислительно-восстановительных реакциях претерпевают изменение фазы во время окисления или восстановления. Например, в свинцово-кислотной батарее сульфат-ионы меняются с твердой формы (в виде сульфата свинца) на раствор (в виде серной кислоты). Если сульфат свинца перекристаллизовывается где-нибудь, кроме анода или катода, то этот материал теряется для аккумуляторной системы. Во время зарядки только материалы, соединенные с анодом и катодом, могут участвовать в электронном обмене, и поэтому, если материал не касается анода или катода, он больше не может заряжаться.Образование газовой фазы в батарее также представляет особые проблемы. Прежде всего, газовая фаза обычно имеет больший объем, чем исходные реагенты, что вызывает изменение давления в батарее. Во-вторых, если предполагаемые продукты находятся в газовом переходе, они должны быть ограничены анодом и катодом, иначе они не смогут заряжаться.
Изменение громкости также обычно отрицательно сказывается на работе от батареи.
В стандартной свинцово-кислотной батарее с залитой водой электроды погружены в жидкую серную кислоту.Несколько модификаций электролита используются для улучшения характеристик батареи в одной из нескольких областей. Ключевыми параметрами электролита, которые контролируют производительность батареи, являются объем и концентрация электролита, а также образование «пленочного» электролита.
Изменения объема электролита можно использовать для повышения надежности батареи. Увеличение объема электролита делает батарею менее чувствительной к потерям воды и, следовательно, делает регулярное техническое обслуживание менее критичным.Увеличение объема батареи также увеличит ее вес и снизит удельную энергию батареи.
В батареях с «плененным» электролитом серная кислота иммобилизуется либо путем «гелеобразования» серной кислоты, либо с помощью «абсорбирующего стеклянного мата». Оба имеют меньшее выделение газа по сравнению с затопленными свинцово-кислотными аккумуляторами и, следовательно, часто встречаются в герметичных свинцово-кислотных аккумуляторах, не требующих обслуживания.
Желирование. В «гелеобразной» свинцово-кислотной батарее электролит может быть иммобилизован путем гелеобразования серной кислоты с использованием силикагеля.Загустевший электролит имеет преимущество в том, что снижается газообразование, и, следовательно, батареи не требуют особого обслуживания. Кроме того, расслоение электролита не происходит с гелевыми батареями, и поэтому ускоренная зарядка не требуется, а поскольку электролит загустевает, вероятность просыпания серной кислоты также снижается. Однако для того, чтобы еще больше снизить газообразование, в этих «гелевых» аккумуляторах также обычно используются свинцово-кальциевые пластины, что делает их непригодными для применения в условиях глубокого разряда.Еще один недостаток состоит в том, что условия зарядки гелеобразной свинцово-кислотной батареи необходимо более тщательно контролировать, чтобы предотвратить перезаряд и повреждение батареи.
Абсорбирующее матирование стекла. Вторая технология, которая может быть использована для иммобилизации серной кислоты, — это «абсорбирующий стеклянный мат» или аккумуляторы AGM. В аккумуляторе AGM серная кислота поглощается матом из стекловолокна, который помещается между пластинами электродов. Аккумуляторы AGM обладают многочисленными преимуществами, включая способность глубоко разряжаться без ущерба для срока службы, обеспечивая высокую скорость заряда / разряда и расширенный температурный диапазон для работы.Ключевым недостатком этих аккумуляторов является необходимость более тщательно контролируемых режимов зарядки и более высокая начальная стоимость.
Термический разгон литий-ионных аккумуляторов с концентрированными электролитами на основе LiN (SO 2 F) 2
Циклические и термические свойства электролитов
На рисунке 1a показано, что пакетный элемент Gr | NMC811 0,93 Ач с концентрированным электролитом LiFSI / DMC обеспечивает стабильную зарядно-разрядную емкость более 300 циклов при C / 3. Средняя кулоновская эффективность 96.6% и сохранение емкости 94,5% (рис. 1b), что указывает на подавленное растворение Al и стабильный SEI на графите во время циклирования 20,24,29 . Ячейка с обычным электролитом 1 M LiPF 6 / EC: EMC (3: 7 по объему) показывает сравнимые электрохимические характеристики, сохранение емкости после 300 циклов составило 93,9%. Концентрированный электролит LiFSI / TMP в ячейке мешочка также исследовали в течение двух циклов перед оценкой безопасности, и он показал кулоновскую эффективность 99.5% (рис. 1а). Для карманных ячеек Gr | NMC532 кривые заряда и разряда также продемонстрировали стабильные электрохимические характеристики с концентрированными электролитами (дополнительный рисунок 1 и дополнительное примечание 1).
Рис. 1: Электрохимические и физические свойства концентрированных электролитов.a Графики заряда и разряда батареи Gr | NMC811 с LiFSI / DMC (1: 1,9 по молярности), LiFSI / TMP (1: 1,9 по молярности) и обычным 1 M LiPF 6 / EC: EMC (3: 7 по объему).Все батареи имеют реверсивную емкость 0,93 Ач, что приблизительно соответствует проектной емкости 0,95 Ач. b Циклические характеристики батареи Gr | NMC811 с концентрированным электролитом LiFSI / DMC и 1 M LiPF 6 / EC: EMC. c Кривые ТГА показали потерю веса концентрированных электролитов LiFSI / DMC и LiFSI / TMP и электролита 1 M LiPF 6 / EC: EMC. d Воспламеняемость концентрированных электролитов LiFSI / DMC и LiFSI / TMP и 1 M LiPF 6 / EC: электролит EMC.Испытания на зажигание проводились с использованием полиэтиленовых сепараторов, насыщенных электролитами. Воспламенитель создавал пламя с температурой выше 1400 ° C. На фотографиях отображен момент, когда электролиты горели наиболее сильным пламенем.
Кривые ТГА (см. Рис. 1c) показывают, что потеря веса концентрированного электролита LiFSI / TMP составила всего 0,7 мас.% Ниже 180 ° C, что значительно ниже, чем у электролита LiFSI / DMC (18,2 мас.%). и разбавленный карбонатный электролит (26.5 мас.%). Эти результаты также показывают, что воспламеняемость концентрированного электролита LiFSI / DMC ниже, чем у разбавленного обычного электролита, поскольку использовалось меньше растворителя, а жизнеспособность DMC была значительно изменена структурой сольватации. Затем на рис. 1г представлены фотографии сепараторов, насыщенных электролитами во время испытания на зажигание. По сравнению с обычным электролитом, концентрированный электролит с DMC все еще был воспламеняющимся, но с умеренным пламенем, тогда как концентрированный электролит с самозатухающим растворителем TMP не сгорел полностью, что доказывает, что концентрированный LiFSI / TMP не является негорючим. -горючие (подробности см. в дополнительной таблице 1 и дополнительном примечании 2).Согласно приведенной выше термической оценке, концентрированные электролиты демонстрируют лучшую термическую стабильность и, возможно, более низкую воспламеняемость, чем разбавленные электролиты, что согласуется с предыдущими отчетами 24,29,30 .
Однако сообщалось, что прямые окислительно-восстановительные реакции между заряженным катодом и анодом являются серьезными для химического состава аккумуляторов с высокой плотностью энергии, что может привести к тепловому разгоне даже без электролитов или ISC 12,13 . Таким образом, оценки безопасности батареи только на основе использованных электролитов недостаточно, и необходимо систематически учитывать взаимодействие между электролитами и заряженными электродами.
Характеристики безопасности LiFSI / DMC в батареях Gr | NMC
Характеристики теплового разгона аккумуляторов Gr | NMC с концентрированным LiFSI / DMC и обычных 1 M LiPF 6 / EC: Электролиты EMC сравниваются на рис. Наблюдается, что все батареи были доведены до точки теплового разгона, хотя термическая стабильность концентрированного электролита была явно выше. Три характеристических температуры { T 1 , T 2 , T 3 } были определены для описания теплового поведения батарей с различными электролитами 7,11,13 .В этом исследовании, в случае концентрированных и обычных электролитов, T 1 находился при ~ 130 ° C, а T 3 находился между 650 ° C и 730 ° C, тогда как T 2 показал совершенно другое значение (рис. 2). T 2 была определена как температура срабатывания теплового разгона. В этой критической точке и после нее температура батареи экспоненциально увеличивалась и не могла быть отключена никакими мерами по рассеиванию тепла.Причинами могут быть как тяжелые экзотермические реакции, так и ISC. Если T 2 вызвано одной химической реакцией или группой химических реакций, эту или эти реакции можно определить как инициирующую реакцию теплового разгона. Огромное тепло, генерируемое при T 2 реакцией запуска, немедленно вызовет единственную экзотермическую реакцию или группу новых экзотермических реакций между компонентами батареи, вызывая резкое повышение (на сотни градусов в секунду) температуры батареи.Понимание механизмов, лежащих в основе T 2 , имеет решающее значение для разработки более безопасных литий-ионных батарей.
Рис. 2: Сравнение характеристик теплового разгона аккумуляторов Gr | NMC с концентрированными LiFSI / DMC и обычными электролитами 1 M LiPF 6 / EC: EMC.Аккумулятор Gr | NMC811 с концентрированным электролитом LiFSI / DMC. На вставке показана воспламеняемость батареи при испытании на боковой нагрев. b Gr | NMC811 аккумулятор с обычным электролитом 1 М. c Gr | NMC532 аккумулятор с концентрированным электролитом LiFSI / DMC. d Gr | NMC532 аккумулятор с обычным электролитом 1 М. d T / d t — T Кривые аккумуляторов Gr | NMC811 и Gr | NMC532, основанные на тесте ARC, были построены в логарифмических координатах. T 1 была определена как начальная температура самонагрева, которая возникает в результате начала цепных реакций внутри батареи, приводит к самопроизвольному и непрерывному повышению температуры, если батарея находится в условиях плохого рассеивания тепла. или почти адиабатическое состояние. T 2 была определена как предустановленная температура срабатывания теплового разгона при d T / d t 1 ° C с -1 . T 3 была определена как максимальная температура во время теплового разгона, которая является ключевым параметром при оценке разрушительной силы теплового разгона.
Для батареи Gr | NMC811 с концентрированным электролитом LiFSI / DMC (рис. 2а) температура T 2 находилась при 200,5 ° C. Падение OCV произошло при T 2 , что совпадает с резким повышением температуры.Однако T 2 ячейки с обычным электролитом достигли 213,1 ° C и одновременно с падением OCV (см. Рис. 2b), что на 12,6 ° C выше, чем в случае с концентрированным электролитом. T 2 и OCV отображали повторяющиеся символы (дополнительный рисунок 2), а OCV не падал до ~ 213,1 / 214,8 ° C, что позволяет предположить, что разделители в ячейках могли выдерживать 213,1 ° C / 214,8 ° C или даже более высокая температура без ISC.Кроме того, тепло, выделяемое ISC, было оценено на основе внутреннего сопротивления батареи около T 2 . ISC просто может внести a (d T / d t ) ISC 0,06 ° C с −1 , что намного ниже 1 ° C с −1 при T 2 (см. в дополнительном примечании 3). Таким образом, делается вывод, что для батарей Gr | NMC811 с концентрированным электролитом экзотермический процесс, который приводит к T 2 , вызван внутренними реакциями, а не ISC.Аккумулятор выделил большое количество тепла. Как следствие, нарушение целостности сепаратора или вздутие аккумулятора, сопровождающееся бурными экзотермическими реакциями, привело бы к резкому падению напряжения 1,12 . После T 2 температура АКБ резко повысилась до максимальной температуры ( T 3 = 652,2 ° C) за 15,4 с. Максимальное значение d T / d t во время теплового разгона составило 401,2 ° C с −1 .Между тем, сильное пламя наблюдалось при испытании на боковой нагрев (вставка на рис. 2a), а общий процесс показан в дополнительном фильме 1, что указывает на то, что батарея с концентрированным электролитом LiFSI / DMC была горючей даже во время теплового разгона. хотя электролит показал низкую воспламеняемость.
Также были исследованы тепловые характеристики батареи Gr | NMC532 с концентрированным электролитом LiFSI / DMC (см. Рис. 2c). Было также доказано, что химическая реакция является спусковым механизмом для теплового разгона (см. Подробности в дополнительном примечании 3). T 2 оказалась равной 202,3 ° C, что близко к температуре батареи Gr | NMC811 с концентрированным электролитом LiFSI / DMC. Однако батарея Gr | NMC532 с обычным электролитом по-прежнему показывала T 2 при более высокой температуре (241,1 ° C, см. Рис. 2d). Сообщалось, что перекрестные помехи между катодом и анодом NMC532 возникли, когда реакции произошли при T 2 12 . В момент или после T 2 были инициированы наиболее экзотермические реакции, в которых катод выступал в качестве основного реагента.Таким образом, было понятно, что батареи Gr | NMC811 всегда демонстрировали более низкую T 2 , чем батареи Gr | NMC532, когда с тем же электролитом 35 .
Интересно, что значение T 2 в батарее Gr | NMC811 было очень близко к значению T 2 в батарее Gr | NMC532, когда тот же концентрированный электролит LiFSI / DMC использовался в оба они, и оба значения были ниже, чем у T 2 в батарее с обычным электролитом.Эти явления указывают на то, что концентрированный электролит LiFSI / DMC не может повысить внутреннюю безопасность батареи, даже несмотря на то, что концентрированный электролит был более термически стабильным, чем обычный электролит. Затем довольно похожие T 2 аккумуляторов NMC811 и NMC532 с концентрированным электролитом LiFSI / DMC показывают, что аналогичные химические реакции происходили при ~ 200 ° C и что эти реакции привели обе батареи к точке теплового разгона. Чтобы исследовать триггерные реакции в батареях, были использованы частичные элементы для моделирования всех возможных экзотермических реакций в батарее.
Вклад экзотермических реакций в тепловой разгон
Для обнаружения экзотермических реакций концентрированного электролита LiFSI / DMC в батарее Gr | NMC811, сравнение температурной зависимости d T / d t между полной ячейкой а частичные ячейки показаны на фиг. 3. В отличие от частичных ячеек AnEly и CaAn, частичные ячейки CaEly не подвергались тепловому разгоном. На кривой ARC не наблюдалось резкого повышения температуры, и ее T 3 составляло 290 ° C.Между тем, максимальное значение d T / d t было даже ниже 0,1 ° C с -1 , что намного ниже 1 ° C с -1 . Эти результаты показывают, что тепло, генерируемое реакциями внутри частичного элемента CaEly, включая разложение материала катода и окисление электролита катодным материалом, было относительно небольшим до 290 ° C и не могло вызвать тепловой разгон батареи. Этот результат совпадает с низкой воспламеняемостью концентрированного электролита, поскольку горение отражало интенсивность, когда электролит окислялся кислородом воздуха, а результат ARC частичной ячейки CaEly отражал максимальную интенсивность, когда электролит окислялся кислородом воздуха. заряженный катод или кислород, выделяемый заряженным катодом.Частичные клетки AnEly и CaAn, напротив, могли быть доведены до теплового разгона (см. Рис. 3). T 2 достиг 200,5 ° C, 202,5 ° C и 225,1 ° C в случае полной ячейки, AnEly и частичной ячейки CaAn, соответственно. Кроме того, максимальное (d T / d t ) max для полной ячейки, AnEly и частичных ячеек CaAn составляло 401,2 ° C с -1 , 882,9 ° C с -1 и 164,0 ° С с −1 соответственно. Таким образом, можно приблизительно сделать вывод, что как частичные ячейки AnEly, так и CaAn могут вносить вклад в тепловой разгон в полной ячейке, но необходим дальнейший анализ, чтобы точно определить, какие из них вызывали инициирующую реакцию, а какая из них обеспечивала основную реакцию во время тепловой разгон.
Рис. 3: Сравнение характеристик теплового разгона частичных ячеек CaEly, AnEly и CaAn с полной ячейкой. Частичные элементыAnEly, CaEly и CaAn были приготовлены из полностью заряженных батарей Gr | NMC811 для исследования вклада различных экзотермических реакций во время процесса теплового разгона батареи. Сравнивали температурную зависимость d T / d t между полной ячейкой (пунктирная линия серого цвета) и частичными ячейками. В ячейке CaAn не было электролита, в то время как концентрированный электролит LiFSI / DMC использовался для всех других частичных элементов и полной батареи.
Для анализа триггерных реакций сравнивали значения d T / d t всех ячеек при 200,5 ° C ( T 2 полной ячейки). Было обнаружено, что d T / d t частичной ячейки CaAn составляло 0,1 ° C с -1 (см. Треугольник на рис. 3), когда d T / d t полная ячейка достигла 1 ° C с -1 (см. кружок на рис. 3), что означает, что тепло, выделяемое частичной ячейкой из CaAn при этой температуре, составляло не более 1/10 от общего тепла полной ячейки.Фактически, d T / d t частичной ячейки CaAn всегда составляло ~ 1/10 этого значения для полной ячейки. Поскольку при разложении катодного материала выделяется мало тепла, реакции внутри частичной ячейки из CaAn вносят небольшой вклад в T 2 и накопление тепла перед T 2 для полной ячейки. В результате частичная ячейка CaAn не может обеспечить пусковую реакцию. Напротив, d T / d t частичной ячейки AnEly было близко к 1 ° C s −1 при T 2 , а кривые d T / d t AnEly и полная ячейка почти перекрывались около T 2 .Это показывает, что динамика тепловыделения AnEly и полной ячейки была практически одинаковой. Таким образом, химические реакции между анодом и электролитом были точно такими же, как и в полной ячейке. Поскольку батарея была нагрета равномерно, а элемент был настолько маленьким, что его теплопроводность была достаточно хорошей, реакции должны происходить равномерно внутри элемента. Кроме того, экспоненциальный рост d T / d t с температурой можно отнести к экзотермическим химическим реакциям.То есть между анодом и электролитом происходили множественные реакции, и они также инициировались одна за другой с повышением температуры. В свою очередь, выделившееся тепло приводило к непрерывному повышению температуры полной ячейки. Когда температура ячейки стала близкой к T 2 , была инициирована группа энергичных реакций, что привело к полному скачку температуры ячейки на уровне T 2 . Эта цепная реакция очень сложна, и ее анализ будет прекрасным шансом для будущих исследований.В целом, рост температурных кривых AnEly и полных ячеек был очень похожим ниже T 2 , что доказывает, что ячейка AnEly была ответственна за инициирующую реакцию, которая привела к тепловому разгону батареи.
Всплеск после T 2 , очевидно, можно было наблюдать в полных, AnEly и CaAn ячейках. Затем значение d T / d t постепенно уменьшалось, пока температура ячейки не достигла максимального значения. Хотя максимальная температура ( T 3 ) трех типов ячеек различается, максимальная температура d T / d t ячеек AnEly и CaAn была доведена до сотен порядков величины, что указывает на что реакции в клетках AnEly и CaAn в основном ответственны за экзотермические реакции во время теплового разгона.Кроме того, T 3 каждого из ячеек AnEly и CaAn было выше, чем у целого элемента, потому что некоторые из компонентов батареи не существовали в частичных ячейках AnEly и CaAn.
Q TR использовалось для обозначения интенсивного тепловыделения во время теплового разгона, и его можно рассчитать по формуле. (1) 13 , где M обозначает массу ячейки (г), а C p обозначает удельную теплоемкость (Дж · г −1 K −1 ; Дополнительная таблица 2 и дополнительное примечание 4).Диапазон температур для расчета тепла: Δ T (Δ T = T 3 — T 1 ). В таблице 1 показаны характеристические температуры и Q TR элементов, а также эквивалентное повышение температуры полной батареи (Δ T экв. ), которое было вызвано реакциями в частичных элементах. Δ T экв. был рассчитан по формуле. (2). Частичная ячейка AnEly выпустила Q TR из 7.0 кДж с Δ T eq , равным 312,6 ° C, тогда как полная ячейка высвободила Q TR с 11,5 кДж с Δ T , равным 516,9 ° C. Между тем, частичная ячейка из CaAn генерировала Q TR 11,3 кДж с ΔT экв 507,9 ° C, что означает, что окислительно-восстановительные реакции между анодом и катодом также могут генерировать огромное количество тепла от T 2 до T 3 12,13 . Частичная ячейка AnEly среди трех частичных ячеек была сначала доведена до теплового разгона.Если бы неполная ячейка AnEly передавала все тепло полной ячейке, реакция в ячейке CaAn могла бы обеспечить тепло, по крайней мере, 4,5 кДж для полной ячейки. Это указывает на то, что реакции как в клетках AnEly, так и в CaAn были основными реакциями во время теплового разгона. Кроме того, даже если катод был полностью инертен при всех температурах, тепло, выделяемое в результате реакций между анодом и электролитом, может привести полную батарею в состояние теплового разгона (см. Подробности в дополнительной таблице 3 и дополнительном примечании 5).Точно так же полный элемент может быть доведен до теплового разгона, но при более высокой температуре, если электролит остается полностью инертным.
$$ Q _ {{\ mathrm {TR}}} = {\ mathrm {{\ Delta}}} T {\ sum} ({M \ cdot C _ {\ mathrm {p}}}) $$
(1)
$$ {\ mathrm {{\ Delta}}} T _ {{\ mathrm {eq}}} = \ frac {{Q _ {{\ mathrm {TR}}}}} {{{\ sum} ({M \ cdot C _ {\ mathrm {p}}})}} $$
(2)
Таблица 1 Характеристики теплового разгона частичных и целых ячеек.На основании приведенного выше анализа можно сделать три вывода о тепловом разгоне Gr | NMC811. Во-первых, реакции между катодом и анодом мало способствовали T 2 и аккумулированию тепла до T 2 , что совпадает с низкой воспламеняемостью концентрированного электролита. Во-вторых, реакции в частичной ячейке AnEly были ответственны за накопление тепла ниже T 2 , а также за запуск реакции теплового разгона.В-третьих, реакции как в частичных ячейках AnEly, так и в CaAn были основными реакциями во время теплового разгона. В следующем разделе оценивается термическая стабильность отдельных материалов и их смесей для дальнейшего исследования инициирующих реакций и основных экзотермических реакций во время теплового разгона.
Термическая стабильность LiFSI / DMC в батарее Gr | NMC811
Тест DSC-TG-MS использовался для характеристики термостабильности компонентов элемента. Перечисляя все тепловые реакции отдельных и смешанных компонентов ячеек, можно исключить реакции внутри батареи во время развития теплового разгона.Поскольку химические реакции в частичной ячейке AnEly были нацелены на запускающую реакцию теплового разгона. Затем, во-первых, были измерены все возможные реакции между литированным анодом, концентрированным электролитом LiFSI / DMC, компонентами электролита и делитированным катодом (рис. 4 и дополнительная таблица 4).
Рис. 4: Термическая стабильность компонентов элементов и их смесей в батарее Gr | NMC811.a ДСК-следы литиированного анода, концентрированных компонентов электролита LiFSI / DMC и их смесей для батареи Gr | NMC811.На вставке — увеличенные пики An и An + DMC. b NO 2 ( m / z = 46) выделение газа LiFSI, литированного анода и их смеси во время измерения DSC. c SO 2 ( m / z = 64) выделение газа LiFSI, литированного анода и их смеси во время измерения DSC. d Потеря массы литиированного анода, LiFSI и их смеси. и ДСК-следы катода, катода, смешанного с концентрированным LiFSI / DMC, и катода, смешанного с анодом.
И литированный анод (An), и смесь An + DMC показали широкий и умеренный экзотермический пик при ~ 289 ° C (пунктирная рамка и вставка на рис. 4a), где соответствующие Δ H для обоих из их было ~ 70 Дж г -1 . Этот экзотермический пик может быть отнесен к реакции между литированным графитом и связующим на основе поливинилиденфторида 12 , что совпадает с тем, что показано на кривой ТГА на плате (рис. 4d). В частности, вес поддерживали постоянным в диапазоне температур от комнатной температуры до 550 ° C, что согласуется с тем фактом, что в реакциях между литированным графитом и связующим не образовывались газы или улетучивающиеся жидкости.Добавление DMC не изменило его, что указывает на отсутствие реакции между An и DMC. Для LiFSI эндотермический пик при ~ 145 ° C можно отнести к плавлению LiFSI, так как потери веса при этой температуре не происходило (рис. 4d). Что касается концентрированного электролита, то пик при ~ 145 ° C исчезает (кривые LiFSI / DMC и An + LiFSI / DMC на рис. 4а). Экзотермический пик при ~ 350 ° C может быть связан с термическим разложением FSI — 36,37 , поскольку 65% потери веса можно определить согласно рис.4d, а газы NO 2 ( м / z = 46) и SO 2 ( м / z = 64) выделялись при ~ 350 ° C из-за S – F и Обрыв S – N в ФСИ — 36,37 (рис. 4б, в). Концентрированный электролит и LiFSI показали довольно похожий экзотермический пик при ~ 350 ° C, что указывает на высокую термическую стабильность между LiFSI и DMC. Кроме того, переход из состояния кристалла в состояние раствора не изменил поведения LiFSI при разложении.
Однако добавление литиированного анода приводит к очевидным изменениям теплового поведения LiFSI, что означает реакцию между ними. Как видно на рис. 4a, для смеси LiFSI и An , , когда литиированный анод находился в контакте с концентрированным электролитом LiFSI / DMC, образец показал резкий экзотермический пик (602,9 Дж / г -1 ) при 209,6 ° C, что в восемь раз больше, чем у анода, в то время как экзотермические пики не наблюдались при 350 ° C.Аналогично, для An + LiFSI газы NO 2 и SO 2 выделялись при 210,9 ° C, и они сопровождались интенсивным Δ H , равным 757,9 Дж / г -1 . Кроме того, кривая ТГА (рис. 4d) показала, что потеря веса почти 20% произошла при ~ 210 ° C, в то время как потеря веса при ~ 350 ° C была <3%, что указывает на то, что большинство порошков LiFSI реагировали с литированным анодом и полученным газом или летучими продуктами. Разумно, что кривая ДСК образца An + LiFSI / DMC не показала разложения LiFSI, так как тепла, выделяемого 3% -ным остатком LiFSI, было слишком мало.Кроме того, для свежего графита (Li 0 C 6 ) Li 0 C 6 + LiFSI показал эндотермический пик при 145 ° C без интенсивного экзотермического поведения при ~ 210 ° C, демонстрируя значительный нагрев произведен в LiC 6 + LiFSI в результате химической реакции между интеркалированным литием и LiFSI. Об этом также сообщается в исх. 38 видно, что батарея, в которой используется электролит на основе LiFSI, показала экзотермический пик 1300 Дж / г -1 при ~ 200 ° C, связанный с химическим восстановлением аниона FSI — литиированным анодом 38 .Для сравнения были исследованы тепловые режимы LiPF 6 и An + LiPF 6 , они показали, что LiPF 6 не участвовал в пусковых или основных реакциях теплового разгона, совпадали с разными T 2 значений концентрированных и обычных электролитов (см. Подробности в дополнительном рис. 3 и дополнительном примечании 7).
Как показано на рис. 4e, катод NMC811 в состоянии полного заряда (Ca) показал небольшое значение Δ H , равное 100.6 Дж г −1 при 235,1 ° C, что можно отнести к фазовому переходу. Термическое поведение Ca + LiFSI / DMC означает, что катод NMC811 практически не реагирует с концентрированным электролитом LiFSI / DMC до 320 ° C (см. Подробности в дополнительном примечании 6). Экзотермический пик при 350 ° C и 380 ° C в Ca + LiFSI / DMC может не сработать в частичной ячейке CaEly, поскольку система ARC перейдет в режим охлаждения, если ячейка не перейдет в режим теплового разгона при предварительно установленной температуре 290 ° С. Таким образом, экзотермическая реакция после 320 ° C вносит меньший вклад в тепловой разгон, который совпадает с термическим разгоном частичной ячейки CaEly.Кроме того, был исследован Ca + сепаратор с небольшим тепловыделением (дополнительный рисунок 4 и дополнительное примечание 8). Образец Ca + An показал два основных экзотермических пика, которые были сосредоточены при 239,5 ° C и 279,4 ° C соответственно. Были рассчитаны значения Δ H для двух экзотермических реакций, и они оказались в сумме 834,0 Дж / г -1 , причем предполагалось, что они возникли в результате потребления кислорода, образовавшегося на катоде, анодом 12 .Реакция между катодом и анодом также вносила значительный вклад в нагрев во время теплового разгона, но это не была инициирующая реакция, которая совпадает с анализом Q TR и поведением при тепловом разгоне частичной ячейки CaAn.
Из рис. 4 можно сделать два вывода. Во-первых, LiFSI может быть уменьшен за счет заряженного анода с выделением газа и выделением интенсивного тепла при ~ 210 ° C, что было триггерной реакцией, которая довела батарею до точки. тепловой разгон.Во-вторых, реакция между полностью заряженным катодом и анодом генерировала большое количество тепла, которое в значительной степени способствовало выделению тепла во время теплового разгона, но это не была инициирующая реакция.
Термическая стабильность LiFSI / DMC в батарее Gr | NMC532
Широко признано, что заряженные катоды принимают участие в процессе теплового разгона и что батарея NMC532 более термически и химически стабильна, чем батарея NMC811, когда другие материалы батареи являются тоже самое.Согласно исследованию батареи NMC811 с концентрированным электролитом LiFSI / DMC, заряженный катод участвовал только в тепловом разгоне, в то время как инициирующая реакция вызывалась анодом и концентрированным электролитом. Кроме того, батарея Gr | NMC532 была дополнительно использована для подтверждения теплового разгона при использовании концентрированных электролитов LiFSI / DMC (рис. 5). Как и в случае батареи Gr | NMC811, отдельные образцы An и Ca дали очень слабый экзотермический пик со значениями Δ H , равными 68.2 и 46,8 Дж / г -1 , соответственно (вставка на рис. 5a и в дополнительной таблице 5), что указывает на то, что без сильного окислителя или восстановителя An и Ca не могут причинить большой ущерб в результате термического разложения. Что касается их смесей, два пика появились при 272,1 ° C и 394,3 ° C с общим Δ H , равным 709,3 Дж / г -1 . Считалось, что это интенсивное нагревание приведет батарею Gr | NMC532 с обычным электролитом к тепловому разгону 12 . Однако для концентрированного электролита LiFSI показал пик энергии ~ 350 ° C (рис.5а). Напротив, смесь An + LiFSI показала только один экзотермический пик при 210,5 ° C с Δ H 767,8 Дж / г -1 и с одновременным выделением газов NO 2 и SO 2 (см. Рис. 5а – в). Это изменение указывает на то, что между An и LiFSI имели место реакции. Подобно результатам в батарее Gr | NMC811, где An вызывал повреждение связей S – F и S – N в LiFSI с интенсивным тепловыделением ~ 210 ° C, нагрев был значительно большим, чтобы вызвать тепловой разгон. .На рис. 5г показаны кривые ТГА литиированного анода и LiFSI и их смеси. DSC-TG-MS характеристики литиированного анода, компонентов электролита и их смесей в батарее Gr | NMC532 совпали с таковой для батареи Gr | NMC811. Здесь для батареи Gr | NMC532 с концентрированным LiFSI / DMC также была продемонстрирована реакция запуска LiC 6 + LiFSI.
Рис. 5: Термическая стабильность компонентов элементов и их смесей в батарее Gr | NMC532.a ДСК-следы литированного анода, катода, компонентов концентрированного электролита LiFSI / DMC и их смесей для батареи Gr | NMC532.На вставке — увеличенные пики Ca и An. b NO 2 ( m / z = 46) выделение газа литированным анодом, LiFSI, и их смесью во время измерения DSC. c SO 2 ( m / z = 64) выделение газа литированным анодом, LiFSI, и их смесью во время измерения DSC. d Потеря массы литиированного анода, LiFSI и их смеси.
Негорючий LiFSI / TMP в батарее Gr | NMC811
Выпуск DMC ниже T 2 был фактором помех при анализе горения батареи Gr | NMC с концентрированным электролитом LiFSI / DMC, так как небольшое количество свободного ДМК легко воспламеняется, хотя воспламеняемость значительно снижается.Затем негорючий концентрированный электролит LiFSI / TMP был также исследован в батарее Gr | NMC811, чтобы дополнительно подтвердить интенсивные реакции между литированным графитом и LiFSI. К сожалению, батарея была доведена до теплового разгона при T 2 195,2 ° C (рис. 6a), что даже меньше, чем T 2 батареи с концентрированным электролитом LiFSI / DMC. Как показано на рис. 6b, c, образец An + LiFSI / TMP показал интенсивный экзотермический пик при ~ 210 ° C, который сопровождался выделением газов NO 2 и SO 2 .Δ H оказалось равным 540,4 Дж / г -1 , что ниже, чем у концентрированного электролита LiFSI / DMC. Однако ТМП не смог предотвратить экзотермические реакции LiC 6 + LiFSI. В результате тепловой разгон батареи все еще может быть инициирован, а затем продолжен даже с негорючим электролитом. Между тем, сильное пламя все еще можно было наблюдать при испытании на боковой нагрев (вставка на рис. 6а и дополнительный ролик 2). Это указывает на то, что, хотя концентрированный электролит LiFSI / TMP был негорючим, реакции между анодом и электролитом, а также реакции между катодом и анодом были достаточно интенсивными, чтобы вызвать сильный пожар.Известно, что горение происходит в результате реакции электролита с кислородом. В данном случае для концентрированных электролитов на основе LiFSI инициирующая реакция происходила между анодом и электролитом (рис. 6d), а реакция, которая способствовала тепловому разгоне, была окислительно-восстановительной реакцией между катодом и анодом. Обе реакции не имели ничего общего с воспламеняемостью электролитов. Таким образом, безопасность аккумулятора не может быть оценена на основании воспламеняемости использованных электролитов.В целом, при оценке безопасности батареи следует тщательно учитывать сложные реакции между компонентами ячеек.
Рис. 6: Термический разгон батареи Gr | NMC811 с негорючим концентрированным LiFSI / TMP.a Температурная зависимость d T / d t батареи Gr | NMC811 с концентрированным LiFSI / TMP. На вставке показана воспламеняемость батареи при испытании на боковой нагрев. b Кривая ДСК и кривая ТГА образца An + LiFSI / TMP. c NO 2 ( m / z = 46) и SO 2 ( m / z = 64) газовыделение образца An + LiFSI / TMP. d Иллюстрация предлагаемого механизма теплового разгона концентрированных электролитов на основе LiFSI в батареях Gr | NMC. Значительное количество тепла, выделяемого при реакции LiFSI + LiC 6 , приводит к тепловому разгону аккумуляторов Gr | NMC.
Посттестовый анализ
XPS-анализ был проведен на остатке DSC для дальнейшего подтверждения механизма теплового разгона.Во время измерения DSC реакция LiFSI с литированным анодом прекращалась при 230 ° C, что было в конце экзотермического пика (дополнительный рис. 5a). После охлаждения до комнатной температуры образец был передан для анализа XPS (дополнительный рис. 5b – e). Побочные продукты подтвердили химические реакции между LiFSI и LiC 6 во время теплового разгона, предполагая, что огромное тепло было инициировано разрывом связей SF и SN с образованием Li 2 CO 3 , Li 2 SO 3 , Li 2 SO 4 , LiF и т. Д. (Подробности см. В дополнительном примечании 9).XPS-анализ An + LiFSI / TMP также был исследован (дополнительный рисунок 6 и дополнительное примечание 10).
Последние достижения в области высоковольтных и высокоэнергетических водных аккумуляторных батарей
Водные литиевые аккумуляторные батареи (ARLB)
Водные аккумуляторные литиевые батареи (ARLB) разрабатываются с 1994 года [4]. Они имеют среднее напряжение разряда около 1,5 В и работают обратимо. Они могут обеспечить плотность энергии 75 Вт · ч · кг −1 (исходя из общей массы активных материалов), что сопоставимо с характеристиками свинцово-кислотных и никель-кадмиевых аккумуляторов.Как указано в этой новаторской исследовательской работе, окислительно-восстановительные потенциалы выделения водорода (HER) и кислорода (OER) являются важными контрольными факторами при выборе материалов для двух электродов для ARLB. Иными словами, рабочий потенциал материала электрода должен быть между OER и HER, чтобы избежать реакции электролиза воды. В последнее время появилось много подробных обзоров электродных материалов ARLB [3, 5, 6, 7, 8, 9]. Поэтому мы не будем здесь подробно останавливаться на этом. В этой части мы только резюмируем текущую работу по ARLB высокого напряжения и плотности энергии.
Для создания ARLB высокого напряжения и высокой плотности энергии существует несколько стратегий: (1) улучшение электролита, например использование сверхконцентрированных электролитов, и (2) использование материалов отрицательных электродов (таких как сера, литий, цинк и др.). графит) с высокой удельной емкостью и / или низким окислительно-восстановительным потенциалом [10].
Сверхконцентрированные электролиты
Электролиты «вода в соли» / «вода в бисоле»
Электролит «вода в соли» (WiS) впервые был использован в ARLB в 2015 году Ван и его коллегами, что расширило окно электрохимической стабильности до прибл.3,0 В (1,9–4,9 В по сравнению с Li + / Li) и открыли новые возможности в водной электрохимии [11]. Бис (трифторметансульфонил) имид лития (LiTFSI) был выбран в качестве соли из-за его высокой растворимости в воде (> 20 м; в этой статье единица m относится к моль кг -1 ), а также из-за его высокой концентрации с гидратированная вода, обладающая высокой гидролитической стабильностью. Определение WiS применяется, когда вес и объем соли превышают вес и объем растворителя в бинарной системе. Когда концентрация LiTFSI достигает 21 м, окно его электрохимической стабильности увеличивается до 3 В (рис.2а). В этом отчете LiMn 2 O 4 и Mo 6 S 8 были использованы в качестве материалов отрицательного электрода для сборки ARLB, что подтвердило возможность использования 21-метрового электролита WiS. Стоит отметить, что окислительно-восстановительные потенциалы этих электродных материалов переходят в положительный потенциал с увеличением концентрации соли. Согласно уравнению Нернста, это в основном связано с изменением в нем активности Li + . Эти ARLB могут выдавать до 2,3 В и иметь среднее напряжение разряда 1.83 В, что значительно выше, чем у традиционных ARLB или ARLB 1-го поколения, использующих обычные водные растворы электролитов. Существует две причины, по которым электролит WiS имеет такой широкий диапазон напряжений (см. Рис. 2b). С одной стороны, свободных молекул воды достаточно, чтобы полностью гидратировать ионы лития в разбавленном водном растворе. С увеличением концентрации соли становится доступным меньше некоординированных молекул воды, и сольватация или гидратированный слой иона лития резко изменяется.Когда концентрация увеличивается до 21 мкм, отношение воды к иону лития составляет всего 2,6, что означает, что Li + частично обезвоживается, и электростатическое поле, создаваемое формальным зарядом на ионе лития, больше не может нейтрализоваться координацией с водой. В результате ионы TFSI — попадают в сольватационный слой Li + . Поскольку потенциал восстановления TFSI — ниже, чем у воды, TFSI — разлагается на поверхности материала отрицательного электрода с образованием плотного защитного слоя SEI (в основном LiF) перед разложением воды.С другой стороны, активность воды снижается из-за небольшого количества свободных молекул воды после высокой концентрации, что помогает повысить электрохимическую стабильность положительных и отрицательных электродов. Следовательно, можно видеть, что взаимодействие этих двух факторов значительно расширяет диапазон напряжений электролита. Однако материалы положительного и отрицательного электрода, выбранные для батареи, не полностью используют окно напряжения электролита LiTFSI WiS. Аккумулятор Mo 6 S 8 / LiFePO 4 [12] и аккумулятор TiS 2 / LiMn 2 O 4 [13] ведут себя аналогичным образом.Следовательно, необходима дальнейшая оптимизация материалов положительного и отрицательного электродов для дальнейшего повышения напряжения и плотности энергии ARLB. Для материалов положительного электрода могут быть выбраны материалы с более высоким потенциалом и / или более высокой удельной емкостью, такие как LiVPO 4 F, LiCoO 2 и LiNi 0,5 Mn 1,5 O 4 . Для отрицательных электродов также могут быть выбраны материалы с более низким потенциалом и / или более высокой удельной емкостью, такие как LiVPO 4 F, TiO 2 и сера.
Рис. 2a Окно электрохимической стабильности электролитов LiTFSI-H 2 O с различной концентрацией. b Схематическая диаграмма эволюции оболочки первичной сольватации Li + в разбавленном растворе и водно-солевом электролите. Воспроизведено с разрешения Ref. [11]. Авторские права 2015, AAAS. c Профили напряжения заряда и разряда полных элементов LiVPO 4 F при различных скоростях. d Длительная цикличность полных ячеек LiVPO 4 F при 20 C.Воспроизведено с разрешения Ref. [14]. Copyright 2017, John Wiley and Sons
LiVPO типа таворит 4 F может использоваться как материал для положительных и отрицательных электродов для ARLB [14]. Кривая заряда-разряда при постоянном токе (рис. 2в) показывает, что LiVPO 4 F имеет два набора плато заряда и разряда, которые, соответственно, соответствуют интеркаляции и деинтеркаляции ионов лития. Группа с высоким потенциалом соответствует редокс-паре V 4+ / V 3+ (около 4.26 В относительно Li + / Li), а группа с низким потенциалом соответствует редокс-паре V 3+ / V 2+ (около 1,8 В относительно Li + / Li). Используя этот материал в качестве положительного и отрицательного электродов, соответственно, и гелевого электролита LiTFSI «вода-в-соли», была собрана гибкая симметричная батарея с выходным напряжением 2,46 В (среднее напряжение разряда до 2,4 В), показав отличные характеристики. .
Характеристики симметричной ячейки с 21-метровым электролитом LiTFSI WiS неудовлетворительны, а кулоновский КПД составляет 96% всего после 50 циклов.Гелевый электролит LiTFSI WiS размером 25 мкм был приготовлен путем добавления ПВС, и окно стабильности напряжения было расширено. Собранная таким образом симметричная батарея циклически перерабатывалась с низкой скоростью 0,2 ° С. Всего через десять циклов кулоновский КПД достиг 100%. При температуре 20 ° C емкость батареи все еще составляла 87% после 4000 циклов, а кулоновский КПД был близок к 100% в течение всего цикла (рис. 2d). Также впервые было обнаружено, что пленка SEI на поверхности материала положительного электрода в электролите LiTFSI WiS представляет собой смесь 49% Li 2 CO 3 и 51% LiF.Это открытие раскрыло секрет того, как Li + может транспортироваться в SEI, поскольку LiF является изолятором как для ионной, так и для электронной проводимости. Если SEI состоит в основном из LiF, очевидно, что он не будет способствовать передаче Li + . Поскольку Li 2 CO 3 имеет лучшую проводимость, чем LiF, область носителей сверхвысокой концентрации создается пространственным зарядом на границе раздела между Li 2 CO 3 и LiF, который является каналом быстрого Li . + ионный транспорт.Следовательно, даже в плотной пленке SEI ионы Li + все еще могут быстро транспортироваться вдоль границы зерен LiF / Li 2 CO 3 , что объясняет хорошие характеристики LiVPO 4 F. Результаты импеданса переменного тока испытания показывают, что сопротивление интерфейса отрицательного электрода увеличивается только на 50% после 20 циклов, что показывает, что LiF – Li 2 CO 3 –SEI по-прежнему обеспечивает высокую проводимость для ионов Li + .
Layered LiCoO 2 электрода обеспечивают удельную емкость 140 мАч g −1 при зарядке до 4.2 В (по сравнению с Li + / Li), что соответствует 50% экстракции Li в Li 0,5 CoO 2 , который считается относительно стабильным материалом положительного электрода в ARLB [15,16,17,18 ]. В органических электролитах при зарядке до 4,5 В (по сравнению с Li + / Li) обеспечивается более высокая удельная емкость 180 мАч g -1 (соответствует 70% экстракции Li). Однако электрод страдает от серьезного снижения емкости во время циклирования в водных электролитах из-за растворения Co и побочной реакции между Li 0.3 CoO 2 и электролит. Трис (триметилсилил) борат (TMSB) вводился в электролит WiS в качестве добавки и непрерывно окислялся и разлагался с образованием стабильной межфазной пленки катод-электролит (CEI) на поверхности положительного электрода LiCoO 2 во время процесса зарядки. . Wang et al. обнаружили, что после окисления TMSB образует защитную межфазную поверхность на положительном электроде LiCoO 2 [19]. При высоком напряжении отсечки LiCoO 2 с межфазной защитой обеспечивал высокую емкость 170 мАч g −1 с замечательной стабильностью при циклическом переключении.ARLB, соединяющий положительный электрод LiCoO 2 с отрицательным электродом Mo 6 S 8 , показал напряжение холостого хода 2,50 В и напряжение средней точки 1,95 В, достигая плотности энергии до 120 Втч кг -1 и низкой скорость снижения емкости 0,013% за цикл, поскольку защитная межфазная поверхность эффективно подавляет OER и растворение кобальта с положительного электрода в растворе электролита.
Техническая шпинель LiNi 0,5 Mn 1.5 O 4 имеет две кристаллические структуры, P4332 и fd-3 m. Среди них P4332 LiNi 0,5 Mn 1,5 O 4 имеет более высокое плато окислительно-восстановительного потенциала литиации / делитирования, а из-за высокой концентрации соли в электролите WiS платформа окислительно-восстановительного потенциала интеркаляции / делитирования LiNi 0,5 Mn 1,5 O 4 имеет положительный сдвиг примерно от 0,2 В до 4,8–5,0 В (по сравнению с Li / Li + ), что находится за пределами окна стабильности электролита WiS.Редокс-потенциал fd-3 m LiNi 0,5 Mn 1,5 O 4 ниже, чем у P4332 LiNi 0,5 Mn 1,5 O 4 . Редокс-потенциал fd-3 m LiNi 0,5 Mn 1,5 O 4 отличается от потенциала P4332 LiNi 0,5 Mn 1,5 O 4 из-за небольшого количества Mn 3+ в fd-3 м LiNi 0,5 Mn 1,5 O 4 , а ионный радиус Mn 3+ больше, чем у Mn 4+ , что приводит к расширению решетки и диффузии Li + прибавка.В электролите WIS две платформы напряжения fd-3 m LiNi 0,5 Mn 1,5 O 4 перемещаются до 4,8–5,0 В. Хотя они превышают окно стабильности напряжения электролитов, они могут полностью использовать свои емкости путем регулирования значения pH электролитов для подавления реакции выделения кислорода. Хорошо известно, что с понижением pH потенциал HER и OER в водных электролитах будет повышаться. Когда 0,1% (в объемных долях) 1 м бис (трифторметилсульфонил) имида (HN (SO 2 CF 3 ) 2 , HTFSI) было добавлено в электролит WiS, значение pH электролита WiS снизилось до 5 и окно сдвинулось на 0.1 В. Однако самый низкий окислительно-восстановительный потенциал (2,1 В) Mo 6 S 8 все еще выше, чем у HER (1,9 В) электролитов WiS (pH доведен до 5). Положительный материал fd-3 m LiNi 0,5 Mn 1,5 O 4 можно заряжать до 5,05 В (по сравнению с Li + / Li), и он может работать стабильно. Таким образом, Mo 6 S 8 // LiNi 0,5 Mn 1,5 O 4 полных элемента , которые имеют среднее напряжение разряда до 2.35 В и плотность энергии 126 Втч кг −1 [20].
Когда 7 м LiOTf (трифторметансульфонат лития) непрерывно добавлялся к 21 м электролитам LiTFSI WiS (обратите внимание, что первоначальный термин «растворять» не подходит, поскольку невозможно получить такой настоящий водный раствор), чтобы получить «вода в бисальте». (WibS) электролиты, в которых концентрация ионов Li + достигала 28 мкм, соответствующее отношение молекул воды к ионам соли составляло около 2 [21]. Из-за более высокой концентрации соли плотность слоя SEI увеличивалась, а активность воды снижалась еще больше, так что он имел более широкое окно электрохимической стабильности около 3.1 В (рис. 3а). На основе этого электролита WibS был приготовлен ARLB с TiO 2 в качестве отрицательного электрода и LiMn 2 O 4 в качестве положительного электрода, с напряжением холостого хода 2,5 В, плато напряжения 2,07 В и энергией. плотность 100 Вт · ч кг −1 (рассчитано на основе общей массы электродов) (рис. 3б). Электролит WibS на основе ацетата был сконструирован путем смешивания неорганических солей LiOAc и KOAc, которые имели отношение воды к катионам всего 1.3 [22]. Результаты показывают, что обычные материалы отрицательного электрода, такие как Li 4 Ti 5 O 12 и TiO 2 , могут обратимо интеркалировать / деинтеркалировать Li + в этом электролите WibS, и собранный TiO 2 / Mn 2 O 4 ARLB имеет плоское разрядное плато 2,10 В (рис. 3c). Электролит недорогой, экологически чистый, легко регулируется, легко адаптируется и универсален.
Фиг.3a Электрохимические окна электролитов WibS и WiS при скорости сканирования 10 мВ с −1 и первые следы CV активных электродов (C-TiO 2 и LiMn 2 O 4 ) при скорости сканирования 0,1 мВ с −1 в электролитах WibS. b Профили заряда-разряда батарей C-TiO 2 / LiMn 2 O 4 аккумуляторов в 5-м и 100-м циклах. Воспроизведено с разрешения Ref. [21].Авторское право 2016, Wiley – VCH. c Профиль заряда-разряда c-TiO 2 / LiMn 2 O 4 батареи при 0,5 C в электролитах WibS на основе ацетата. Воспроизведено с разрешения Ref. [22]. Авторское право 2018, Королевское химическое общество
Электролиты гидрат-расплав
Определение плавления гидрата аналогично определению WibS. Фактически, конструкция электролита WibS была вдохновлена электролитом гидрат-расплав [23]. Электролит гидрат-расплав на самом деле является продолжением сверхконцентрированного электролита в системе, в которой вода является растворителем.Сверхконцентрированные электролиты использовались в литий-ионных батареях. Было обнаружено, что они могут не только улучшить стабильность батарей, но и увеличить рабочее напряжение (4 В). Эта концепция была впервые применена Yamada et al. в водные системы хранения энергии и известен как «гидрат-расплав». Исследовали эвтектический состав литиевых солей Li (SO 2 CF 3 ) 2 (LiTFSI) и литиевых солей Li (SO 2 C 2 F 5 ) 2 (LiBETI), оба имеют органический имидный анион.Результаты показывают, что, когда состав представляет собой Li (TFSI) 0,7 (BETI) 0,3 , растворимость смеси с водой является максимальной, может быть получен стабильный прозрачный раствор, а концентрация молекулы воды составляет всего 10,1 м ( Рис. 4а). Большое количество анионов TFSI / BETI изолируют свободные молекулы воды друг от друга, и все молекулы воды могут участвовать в гидратной оболочке ионов лития, тем самым снижая активность молекул воды и расширяя окно электрохимической стабильности электролитов.В этом растворе все молекулы воды скоординированы с ионами лития, а внутримолекулярные водородные связи практически незначительны (рис. 4б). Кроме того, было обнаружено, что равновесный потенциал реакции внедрения / отслаивания иона лития составлял 0,25 В в электролите гидрат-расплав, что было больше, чем значение в 22-метровом LiTFSI (рис. 4с). Термодинамический механизм (который снижает уровни ВЗМО) и кинетический механизм (пассивация, вызванная анионами) еще больше увеличивают разность потенциалов между анодом и катодом, тем самым расширяя окно напряжения до 3.8 В (рис. 4г). На основе электролита гидрат-расплав: Li 4 Ti 5 O 12 // LiCoO 2 и Li 4 Ti 5 O 12 // LiNi 0,5 Mn 1,5 O 4 Было установлено полных ARLB, которые демонстрировали плато высокого напряжения разрядной ячейки при 2,26 В и 3,10 В, соответственно. На данный момент существует немного других исследований по применению электролитов расплава гидрата в водных батареях. Недавно Wu et al. применили электролиты к батареям Li-O 2 , которые, как было показано, эффективно предотвращают разложение растворителя и образование побочных продуктов, тем самым увеличивая срок службы Li-O 2 батарей [24].Для дальнейшей оценки и улучшения применимости электролита необходимы все более и более глубокие исследования.
Рис. 4a Линия ликвидуса смесей LiTFSI + LiBETI в воде. b Первопринципный DFTMD моделирует снимок равновесной траектории Li (TFSI) 0,7 (BETI) 0,3 · 2H 2 O гидратный расплав и разбавленный LiTFSI / H 2 O. c Взаимосвязь между изменение равновесного потенциала интеркаляции лития и Li + -концентрации электролитов. d Окна напряжений обычных электролитов LiTFSI / H 2 O и гидратированных электролитов расплава, а также окислительно-восстановительный потенциал Li 4 Ti 5 O 12 , LiCoO 2 , LiNi 0,5 Mn 1.5 O 4 в гидратированных электролитах расплава. Воспроизведено с разрешения Ref. [23]. Copyright 2016, Nature Publishing Group
Гибридный водный / неводный электролит (HANE)
Путем введения неводного растворителя, диметилкарбоната (DMC), в электролит WiS, гибридный водно-неводный электролит (HANE) с расширенным электрохимическим окном 4.1 В. Это нейтральный растворитель, который менее чувствителен к отталкиванию отрицательного электрода и, следовательно, легче участвует в межпространственной химии, чем анионы [25]. На основе этого гибридного электролита был создан ARLB, состоящий из LiNi 0,5 Mn 1,5 O 4 положительного электрода и отрицательного электрода Li 4 Ti 5 O 12 . Этот ARLB с плоским плато разряда при 3,2 В (рис. 5а) имел плотность энергии до 165 Вт · ч · кг −1 и циклическую стабильность более 1000 циклов (рис.5б). В аналогичном подходе также сообщалось о гибридной системе «ацетонитрил (AN) / вода-в-соли» электролита (AN-WiS), обеспечивающей повышенную ионную проводимость, пониженную вязкость и расширенный диапазон температур [26]. Увеличение концентрации соли LiTFSI в AN – WiS до уровня сверхконцентрации (15,3 м) расширяет окно электрохимической стабильности до 4,5 В [27]. Эти ARLB с поддержкой AN – WiSE, такие как Li 4 Ti 5 O 12 / LiMn 2 O 4 и Li 4 Ti 5 O 12 / LiNi 0.8 Co 0,15 Al 0,05 O 2 полных аккумулятора , с высоким напряжением, высокой плотностью энергии и отличными характеристиками при езде на велосипеде.
Рис. 5a Кривые разряда ячейки LTO-LNMO при различных скоростях. b Циклические характеристики полных ячеек LTO-LNMO при 6 C. Воспроизведено с разрешения Ref. [25]. Copyright 2018, Elsevier B.V. c Сравнение напряжения прекращения зарядки различных солей для ARLB. d Кривые заряда-разряда элемента TiO 2 / LiMn 2 O 4 элемента при 5 C; вставленный график — это циклическая производительность батареи [28].Воспроизведено с разрешения Ref. [28]. Авторские права 2018, Nature Publishing Group
Электролит «вода в иономере»
Новый тип электролитов «вода в иономере» был представлен He et al. [28]. Электролит «вода в иономере», содержащий 50 мас.% Иономера, имеет окно электрохимической стабильности 2,7 В (рис. 5c). Полный элемент LiTi 2 (PO 4 ) 3 / LiMn 2 O 4 , основанный на этом электролите, показал отличные циклические характеристики и обеспечил среднее напряжение разряда> 1.5 В и удельной энергией 77 Втч кг −1 . Кроме того, с использованием алюминиевого токосъемника была получена полная батарея TiO 2 / LiMn 2 O 4 со средним выходным напряжением 2,1 В и начальной удельной энергией 124,2 Втч кг -1 (рис. 5d). .
Роль SEI
Разложение добавок к электролиту
Добавление добавок к электролиту также может формировать на месте защитную, подобную SEI фазу интерфейса. Добавки должны соответствовать следующим требованиям: (1) иметь химическую стабильность, то есть стабильность в данном растворе электролита, и (2) иметь электрохимическую стабильность, чтобы электрохимический процесс мог происходить во время разложения с образованием межфазных компонентов.
Гель LiTFSI-HFE (высокофторированный эфир) был нанесен на поверхности отрицательных электродов в качестве межфазного покрытия-предшественника, которое было использовано для получения твердой межфазной границы, состоящей как из органических фторированных углеводородов, так и неорганических фторидов, что позволило получить высокую емкость / низкую производительность. потенциальные материалы отрицательных электродов (такие как кремний, графит и металлический Li) для обратимого цикла в гелевых полимерных электролитах (GPE) 21 м LiTFSI + 7 м LiOTf WibS (рис. 6a) [29]. Соединение отрицательных электродов с покрытием с различными материалами положительных электродов, серия из 4 штук.Были получены ARLB 0 В с высокой эффективностью и обратимостью, сопоставимые с коммерческими литий-ионными батареями (рис. 6b – d). Кроме того, был разработан ARLB со сверхвысокой плотностью энергии 460 Вт · ч кг -1 путем соединения отрицательного электрода из гелевого графита HFE и положительного электрода типа преобразования-интеркаляции (LiBr 0,5 Cl 0,5 ) -графит (LBC –G) (рис. 6д, е) [30].
Рис. 6a Зарядно-разрядные кривые графитовых электродов, предварительно покрытых гелем LiTFSI-HFE.Профили напряжения b Li / LiVPO 4 батареи F, c графит / LiVPO 4 батареи F и d Li / LiMn 2 O 4 батареи при 0,3 C. e Типичные кривые заряда-разряда (третьи циклы) аккумуляторов графит // LiBr / LiCl (синий) или графитовых // аккумуляторов с моногидратами LiBr / LiCl (красный). f Устойчивость этих полностью заряженных аккумуляторов во время езды на велосипеде. Воспроизведено с разрешения Ref. [29]. Авторские права 2017, Elsevier B.V. г Схематическое изображение металлического лития LISICON с пленочным покрытием. ч Кривая постоянного тока заряда-разряда Li / LiMn 2 O 4 аккумуляторов в первом цикле. Воспроизведено с разрешения Ref. [31]. Авторское право 2013, Исследования природы. i Кривые постоянного тока заряда-разряда во втором и десятом циклах Li / LiCoO 2 аккумулятора. Воспроизведено с разрешения Ref. [32]. Авторское право 2013 г., Королевское химическое общество
Искусственный SEI
Для реализации функционального металлического литиевого электрода в водной электролитной системе на его поверхность можно нанести тонкий и компактный защитный интерфейсный слой или искусственный SEI.Этот искусственный SEI должен не только иметь высокую ионную проводимость, чтобы можно было проводить электрохимический процесс, но и предотвращать проникновение воды, чтобы молекулы воды не могли проходить сквозь него, чтобы избежать реакции между молекулами воды и металлическим литием.
Наша группа представила пленку литиевого суперионного проводника (LISICON) на отрицательном электроде из металлического лития (рис. 6g) [31]. В этом исследовании LISICON использовался как комбинированный сепаратор и твердый электролит с ионной проводимостью при комнатной температуре около 0.1 мСм см −1 . С LiMn 2 O 4 в качестве положительного электрода и 0,5 M Li 2 SO 4 (единица M — традиционная молярная концентрация, которая составляет -1 моль) в качестве электролитов, ионы лития переносятся через водный электролит со стороны положительного электрода, проходят через слой покрытия LISICON и достигают отрицательного электрода из металлического лития. Благодаря низкому потенциалу зачистки / покрытия металлического лития рабочее напряжение полученных ARLB увеличилось до более чем 4 В с плато на уровне 4.06 В и 3,85 В (рис. 6h). Подобные высоковольтные ARLB с высокой плотностью энергии также были разработаны на основе гелевой полимерной мембраны с литиево-графитовым отрицательным электродом с покрытием LISICON и положительным электродом LiCoO 2 / LiFePO 4 [32, 33]. Однако неудовлетворительная ионная проводимость LISICON может стать проблемой для достижения хороших скоростных характеристик. Ионная проводимость электрода со структурой перовскита, Al-замещенного литий-лантана-титанита (A-LLTO), разработанного Ле и соавторами, была увеличена до 0.317 мСм см −2 , что намного больше, чем 0,1 мСм см −2 , полученное с помощью LISICON [34]. Когда A-LLTO применялся в качестве искусственного SEI к отрицательному электроду из металлического лития, и он был объединен с положительным электродом LiCoO 2 , полученный ARLB имел напряжение холостого хода около 4,2 В и высокую удельную емкость 164 мА · ч. −1 при 0,1 C (рис. 6i). Тем не менее, его скоростные характеристики все еще не были сопоставимы с характеристиками обычных ARLB, и проблема низкой ионной проводимости искусственного SEI все еще требует решения.Более того, для создания искусственного SEI на поверхности металлического лития обычно требуется дополнительный слой для предотвращения прямого контакта между металлическим литием и проводящим разделительным слоем (LISICON, A-LLTO, LATP и т. Д.), Поскольку в противном случае последний был бы восстановлены металлическим литием из-за их химической нестабильности. Дополнительный слой обычно представляет собой гелевый полимерный электролит, состоящий из такого тонкого полимерного слоя (PVDF / PMMA / PVDF и PEO и т. Д.), Насыщенного органическими электролитами (1 M LiClO 4 в EC / DMC).
Система перезаряжаемых Ni – Li батарей была изготовлена с использованием 1 M LiClO 4 в этиленкарбонате / диметилкарбонате (EC / DMC) в качестве органических электролитов для металлического литиевого отрицательного электрода и 1 M LiOH + 1 M KOH в качестве водных электролитов. для положительного электрода Ni (OH) 2 [35]. Органический и водный электролиты были разделены тонкой пленкой LISICON. Батарея имела напряжение плато 3,47 В и удельную емкость 268 мАч g -1 , что приводило к очень высокой плотности энергии 935 Втч кг -1 на основе объединенной массы активных материалов.В этой батарее использовались положительный электрод NiO / CNT конверсионного типа и отрицательный металлический литиевый электрод с гибридным водно-органическим электролитом, разделенные литий-ионной проводящей пленкой LATP (Li 1+ x + y Al x Ti 2- x Si y P 3- y O 12 ) [36]. У него было стабильное плато разряда при 3,38 В, но необходимы дальнейшие разработки, чтобы повысить его устойчивость к циклическим нагрузкам.
Использование отрицательных материалов с высокой удельной емкостью или низким окислительно-восстановительным потенциалом
Водная перезаряжаемая гибридная батарея (ARHB), использующая положительный электрод LiMn 2 O 4 положительный электрод и металлический отрицательный электрод из цинка, была впервые предложена в 2012 году и работает примерно при 2 В с приемлемой плотностью энергии (50–80 Вт · ч, кг −1 ) и хорошими характеристиками при циклических нагрузках (сохранение емкости 95% после 4000 циклов) [37]. Однако его электрохимические свойства, такие как кулоновский КПД, нуждаются в дальнейшем улучшении.К настоящему времени предприняты следующие меры: (1) модификация поверхности и защита материалов положительных электродов; (2) улучшение электролитов; и (3) обработка цинкового отрицательного электрода.
Из-за низкой проводимости LiMn 2 O 4 и структурных изменений, вызванных искажением Яна – Теллера, гибридная батарея Zn / LiMn 2 O 4 имеет низкие энергетические характеристики и подвергается серьезной деградации емкости. Поскольку углерод обычно может использоваться для изготовления композитов, было обнаружено, что использование графеновых пленок в качестве искусственных SEI на поверхности LiMn 2 O 4 эффективно подавляет структурные искажения LiMn 2 O 4 . и значительно увеличивает ионную проводимость LiMn 2 O 4 , тем самым улучшая цикличность и быстродействие гибридной батареи [38, 39].
Из-за ограничения окна электрохимической стабильности, образования дендритов цинка и коррозии отрицательного цинкового электрода модификация электролита является еще одним эффективным способом улучшения электрохимических характеристик водного раствора Zn / LiMn 2 O 4 гибридных аккумулятора . Многие добавки, включая тиомочевину (TU) [40], SiO 2 [41], циклодекстрин (CD) [42] и коллоидальный диоксид кремния (FS) [43], были введены в электролит для улучшения электрохимических характеристик гибридного батареи.Хотя есть некоторые улучшения, эффекты все еще неудовлетворительны, и требуется дальнейшее улучшение.
Недавно Ван и его сотрудники сообщили об электролите WiS, состоящем из 1 м Zn (TFSI) 2 + 20 м LiTFSI, в котором цинковый отрицательный электрод является очень обратимым. Гибридная батарея Zn / LiMn 2 O 4 достигла наивысшей плотности энергии, когда массовое отношение Zn / LiMn 2 O 4 было уменьшено до 0,25: 1. Кроме того, кривые заряда / разряда для разных циклов гибридной батареи сильно совпадают, что показывает ее хорошую электрохимическую обратимость.При температуре 4 ° C сохранение емкости после 4000 циклов составило 85%, при этом CE достигает 99,9%, что лучше, чем все ранее описанные работы с Zn-Li-батареями [44]. Однако высокая стоимость использования больших количеств органической соли может препятствовать применению смешанных ионно-цинковых аккумуляторов в крупномасштабных системах хранения энергии.
Сообщалось о новом электролите «глубокой эвтектики» (WiDES), который может ингибировать реакцию отрицательного цинкового электрода, уменьшать коррозию и пассивацию цинкового отрицательного электрода, увеличивать коэффициент использования цинка, и улучшить жизненный цикл [45].Следовательно, гибридная батарея Zn / LiMn 2 O 4 , в которой используется этот электролит WiDES, демонстрирует отличные характеристики при циклической работе.
В дополнение к LiMn 2 O 4 , другие коммерческие материалы положительных электродов для литий-ионных батарей, такие как LiFePO 4 , LiNi 1/3 Co 1/3 Mn 1/3 O 2 , Li 3 V 2 (PO 4 ) 3 (LVP) и LiMn 0,8 Fe 0,2 PO 4 , также были изучены в качестве материалов потенциальных положительных электродов для водных аккумуляторов. Zn – Li гибридные батареи.Поскольку в нескольких статьях рассматривалась соответствующая работа в этой области, мы не будем здесь подробно останавливаться. Эти работы сведены в Таблицу 1 и Рис. 7а.
Таблица 1 Электрохимические свойства различных ARLB с высоким напряжением и плотностью энергии Рис.7Плотность энергии и средняя разрядная емкость различных a ARLB, b ASIB, AKIBS и ANIB с высоким напряжением и плотностью энергии
Водные Na-ионные батареи
Развитие водных натрий-ионных батарей (ASIB) в основном связано с тем, что ресурсы натрия в земной коре намного больше, чем ресурсы лития.Кроме того, для ASIB доступно множество материалов для положительных и отрицательных электродов, которые показывают очень хорошие электрохимические характеристики [49,50,51,52]. О ходе исследований электродных материалов написано много обзоров, и они также являются исчерпывающими [3, 6, 9]. Однако нет никаких систематических исследований того, как построить ASIB с высокой плотностью энергии. В таблице 2 и на рис. 7b представлены подробные сведения о характеристиках ASIB, о которых сообщалось на сегодняшний день.
Таблица 2 Электрохимические свойства различных ASIB, AKIBS и ANIB с высоким напряжением и плотностью энергииКак упоминалось выше, есть два способа улучшить энергетическую плотность химического состава водных аккумуляторов.Один заключается в расширении окна напряжения, а другой — в выборе подходящих материалов для отрицательного и положительного электродов с большой разностью потенциалов и высокой удельной емкостью.
Сверхконцентрированные электролиты
Разработка соответствующих натриевых электролитов WiS остается серьезной проблемой для разработки натрий-ионных батарей в водных растворах, поскольку существующие натриевые электролиты еще не отвечают требованиям высокой растворимости солей, содержащих химические источники (фтор). -содержащие соли), высокая химическая и электрохимическая стабильность в воде.Подобно ARLB, электролиты WiS также можно наносить на ASIB для расширения электрохимического окна. Установлено, что сила между Na + и TFSI — намного сильнее, чем сила между Li + и TFSI —, поэтому, хотя водный раствор соли NaTFSI может достигать только 9,26 м, он может образовывать SEI проводимости Na + , а окно электрохимической стабильности может достигать 2,5 В [53]. На основе этого электролита NaTi 2 (PO 4 ) 3 // Na 0.66 [Mn 0,66 Ti 0,34 ] O 2 была собрана полная батарея со стабильной производительностью при циклической работе и удельной энергией 31 Втч кг -1 . При комнатной температуре концентрации растворов трифторида натрия (NaOTf) и бис (трифторметансульфонил) имида (NaTFSI) низкие (9–10 м), и нельзя полностью использовать преимущество суперконцентрированных электролитов. Следовательно, для дальнейшего развития высоковольтных ASIB необходимы соответствующие натриевые соли для производства высококонцентрированных электролитов WiS.Установлено, что NaFSI обладает высокой растворимостью (до 37 моль) в водном растворе и стабильным электрохимическим окном 2,6 В при концентрации до 35 моль. Дальнейшие исследования показывают, что катоды NaTi 2 (PO 4 ) 3 и катоды Na 3 (VOPO 4 ) 2 F могут использоваться в ASIB с напряжением более 2 В [54] . Смешанные катионные смеси динатрия могут использоваться для приготовления электролитов с более высокими концентрациями, например, 9 м NaOTf + 8 м KOTf и 22 м KOTf + 4 м NaOTf.Однако присутствие нескольких катионов может привести к встраиванию смешанных катионов в материал электрода, влияя на характеристики элемента. Чтобы решить эту проблему, исследователи разработали новый класс электролитов WiS с поддержкой взаимодействия, содержащих соли трифторида тетраэтиламмония (TEAOTf), которые из-за большого ионного радиуса TEA + трудно внедрить в большинство электродных материалов [включая прусские Синий аналог (PBA)], что позволяет избежать совместной интеркаляции мультикатионов в циклическом процессе [55].Этот активированный взаимодействием электролит WiS имеет концентрацию до 31 м (9 м NaOTf – 22 м TEAOTf) и окно электрохимической стабилизации до 3,3 В (рис. 8a). A Na 1,88 Mn [Fe (CN) 6 ] 0,97 · 1,35H 2 O // IC-WiS на основе Na // NaTiOPO 4 полная батарея с высоким напряжением отсечки (2,5 В) и Установлена высокая плотность энергии 71 Вт · ч кг -1 , которая показала выдающуюся стабильность при циклических нагрузках как на низких, так и на высоких скоростях (рис. 8b – e).
Фиг.8a Окно электрохимической стабильности 9 моль кг -1 электролитов NaOTf и электролитов Na IC-WiS (9 м NaOTf + 22 м TEAOTf) при скорости сканирования 10 мВ с -1 , в которой Ti и Al используются как положительный и отрицательный коллекторы соответственно. b Кривые заряда-разряда первого цикла для положительных электродов NaMnHCF (1 C) и отрицательных электродов NaTiOPO 4 (0,2 C) в электролитах 9 m NaOTf и 9 m NaOTf + 22 mTEAOTf, соответственно. c CV-кривые отрицательных электродов NaTiOPO 4 и положительных электродов NaMnHCF при 1 мВ с -1 в 22 м TEAOTf и 9 м NaOTf + 22 м TEAOTf, соответственно. d Зарядно-разрядные кривые NaMnHCF // NaTiOPO 4 аккумуляторов в первом, четвертом и десятом циклах. e Циклические характеристики батареи NaMnHCF // NaTiOPO 4 при 1 ° C [55]. Воспроизведено с разрешения Ref. [55]. Copyright 2019, Wiley – VCH
Теоретические расчеты показали, что нанесение пленки Al 2 O 3 на Al или пленки TiO 2 на Ti может увеличить энергетический барьер расщепления воды (рис.9а) [56]. При толщине около 3 нм и 5 нм соответственно для пленок Al 2 O 3 и TiO 2 окно электрохимической стабильности расширяется до 3,5 В, когда металлы, покрытые этими оксидными пленками, используются в качестве коллекторы и 15 м водный раствор NaClO 4 используется в качестве электролита (рис. 13б). Кроме того, в концентрированных электролитах (15 м NaClO 4 ) на поверхностях TiS 2 образуется плотная межфазная фаза электрод – электролит.Таким образом, TiS 2 , который имеет низкий реакционный потенциал, был впервые продемонстрирован в качестве материала отрицательного электрода в водной батарее (рис. 9c). Полученный в результате ASIB с использованием TiS 2 в качестве отрицательного электрода и MFCN (гексацианоферрата марганца натрия) в качестве положительного электрода обеспечивает плотность энергии 100 Вт · ч кг -1 с напряжением холостого хода (OCV) до 2,6 В. работал с почти 100% кулоновской эффективностью до 1000 циклов (рис. 9d).
Фиг.9a Окно электрохимической стабильности 15 м водного раствора NaClO 4 водный раствор, когда используются Pt, Ti, Al с покрытием из Al 2 O 3 с разной толщиной и Ti с покрытием TiO 2 с разной толщиной как токоприемники. b Энергия адсорбции O * и HO * на поверхности Ti или TiO 2 и H 2 O * и H * на поверхности Al или Al 2 O 3 соответственно. c CV-кривая TiS 2 отрицательных электродов при использовании алюминиевой фольги с регулируемым временем термообработки в качестве токоприемников. d Циклическая работа батарей TiS 2 / MFCN при 5 ° C [56]. Воспроизведено с разрешения Ref. [56]. Copyright 2019, Elsevier BV
Гибридные батареи Zn – Na
Поскольку натриевые соли дешевле, чем соли лития, гибридные ионные аккумуляторы Zn – Na на водной основе представляют собой очень многообещающую перспективу для замены гибридных аккумуляторов Zn – Li на водной основе и стали привлекательными. устойчивое устройство хранения энергии. Первый водный гибридный ионный аккумулятор Zn – Na был зарегистрирован нашей группой и состоял из стержнеобразного Na 0.95 MnO 2 материал положительного электрода и металлический отрицательный электрод из цинка, которые показали среднее напряжение разряда 1,4 В и плотность энергии до 78 Втч кг -1 (рис. 10a, b) [57].
Рис.10a CV-кривые Zn и Na 0,95 MnO 2 в 0,5 M Zn (CH 3 COO) 2 + 0,5 M CH 3 Водный раствор COONa (0,5 мВ с −1 ). b Цикличность цинка // Na 0.95 MnO 2 ASIB при скорости 4 ° C [56]. Воспроизведено с разрешения Ref. [57]. Авторское право 2014 г., Королевское химическое общество. c CV-кривая Na 2 MnFe (CN) 6 положительных электродов в электролитах с добавлением SDS (5 мВ с -1 ). d Кривые заряда / разряда Na 2 MnFe (CN) 6 положительных электродов в электролитах с добавлением SDS (0,5 C) [59]. Воспроизведено с разрешения Ref. [59]. Copyright 2017, Королевское химическое общество
Na + -ионный суперионный проводник (NASICON) -структурированный Na 3 V 2 (PO 4 ) 3 (NVP) с высокой теоретической емкостью 118 мАч g -1 стал новым потенциальным кандидатом в качестве положительного электрода для водных Na-Zn гибридных батарей.Гибридная батарея Zn-NVP может обеспечить плотность энергии 67 Втч кг -1 . Однако емкость Na 3 V 2 (PO 4 ) 3 в гибридных водных перезаряжаемых батареях Zn – Na остается серьезной проблемой. Помимо материалов положительного электрода NVP / C, другие полианионные соединения [такие как покрытый углеродом Na 3 V 2 (PO 4 ) 2 F 3 ] были рассмотрены в качестве положительных электродов для дальнейшего улучшения напряжение водных гибридных аккумуляторов Na – Zn [58].Гибридный Zn – Na 3 В 2 O 2 x (PO 4 ) 2 F 3−2 x батарея обладает высоким выходным напряжением 1,7 В и высокой энергией плотность 84 Втч кг −1 .
берлинская лазурь и ее аналоги являются наиболее привлекательными материалами для гибридных батарей на водной основе из-за их большого канала и структуры открытого каркаса, которая способствует быстрой диффузии ионов. Рабочее напряжение гибридных аккумуляторов Na-Zn на водной основе высокое, и на срок службы аккумулятора в значительной степени влияет побочная реакция выделения водорода или выделения кислорода.Было обнаружено, что окно электрохимической стабильности электролита может быть увеличено с 1,8 до 2,55 В путем добавления поверхностно-активных веществ в смешанный электролит (рис. 10а, б) [59]. С помощью моделирования теории функционала плотности было обнаружено, что энергетический барьер молекул воды, проходящих через адсорбционный слой SDS, выше, чем барьер ионов натрия, проходящих через адсорбционный слой SDS. Ионы натрия легче проходят через гидрофобный слой, чем молекулы воды, тем самым подавляя разложение воды, тем самым улучшая окно электрохимической стабильности электролита.На основе этого электролита была успешно собрана водная перезаряжаемая ионно-цинковая аккумуляторная батарея с нанокубцами Na 2 MnFe (CN) 6 в качестве катодов и листами цинка в качестве отрицательных электродов. Аккумулятор имеет рабочее напряжение до 2 В и высокую плотность энергии 170 Втч кг -1 (рис. 10c, d). Стратегия проектирования улучшения окна электрохимической стабильности электролитов путем добавления добавок обеспечивает эффективность, близкую к эффективности электролитов WiS, и низкую стоимость.Он обеспечивает новое понимание для дальнейшего развития недорогих и высоковольтных батарей на водных растворах в будущем.
Водные K-ионные батареи (AKIB)
Высокий потенциал ионизации и большой ионный радиус (0,138 нм) K являются основными причинами ограниченного развития высокоэффективных электродных материалов AKIB. На сегодняшний день наиболее перспективными материалами положительных электродов для AKIB являются аналоги берлинской голубой (PBA).
Среди различных материалов положительных электродов PBA имеет широкие перспективы применения благодаря своей стабильности в воде, простоте приготовления и отличным электрохимическим характеристикам.Сообщается о разнообразных положительных электродах из ПБА в AKIB, но лишь немногие материалы обладают полностью удовлетворительными свойствами. Из-за отсутствия материалов-кандидатов с подходящими окислительно-восстановительными потенциалами, несколько многообещающих материалов были описаны в качестве материала отрицательного электрода AKIB. Ранее сообщалось, что электролит WiS на основе ацетата калия имеет широкий диапазон электрохимической стабильности, но pH электролита является слабощелочным (pH = 9), что не подходит для материалов положительных электродов.Поэтому очень важно изучить новый тип электродов с лучшей совместимостью с электролитом WiS на основе K + . В целом, из-за ограничений электродов и электролитов сообщений о разнообразии AKIB немного. Недавно был изготовлен полный AKIB, который состоял из Fe-замещенного Mn-богатого PBA {K x Fe y Mn 1- y [Fe (CN) 6 ] w · z H 2 O} положительный электрод, отрицательный электрод из органического 3,4,9,10-перилентетракарбоновой диимида (PTCDI) и 22 м KCF 3 SO 3 WiS электролит [60].22-метровый электролит KCF 3 SO 3 WiS имеет широкий диапазон напряжений 3 В, который не только препятствует растворению как положительных, так и отрицательных электродов во время цикла, обеспечивая хорошую циклическую стабильность всей батареи, но также позволяет полная батарея должна работать при напряжении выше 2 В при низком токе 0,1 C (рис. 11a). Кроме того, как положительный, так и отрицательный электроды обладают высокой емкостью, высокими скоростными характеристиками и хорошей стабильностью при переключении. Таким образом, полная батарея обеспечивает высокую плотность энергии 80 Вт · ч · кг −1 и отличную стабильность при циклической работе с сохранением емкости 73% за 2000 циклов при 4 ° C (рис.11б). Несмотря на то, что эта аккумуляторная система имеет много преимуществ, есть еще много областей, в которых требуется дальнейшее совершенствование для содействия ее практическому применению. Прежде всего, для электродных материалов, хотя Fe является лучшим выбором для замены положительного электрода PBA, богатого Mn, материалы отрицательного электрода должны быть оптимизированы с высокой емкостью и низким окислительно-восстановительным потенциалом для дальнейшего увеличения плотности энергии AKIB. Кроме того, чтобы снизить стоимость всей батареи и в то же время для обеспечения ее превосходных мощных характеристик и высокого рабочего напряжения, следует изучить менее дорогие соли с высокой растворимостью, такие как снижение концентрации электролита путем изменения интерфейса и использования смешанные вода / неводные растворители.
Рис. 11a Окно электрохимической стабильности 1 м и 22 м KCF 3 SO 3 электролитов при скорости сканирования 10 мВ с −1 при использовании Ti-сетки в качестве токосъемника. b Циклические характеристики PTCDI / K x Fe y Mn 1- y [Fe (CN) 6 ] w · z H O полные ячейки при 4 ° C. Воспроизведено с разрешения Ref.{+} \) ионная батарея была описана Ву с коллегами в 2017 году с (NH 4 ) 1,47 Ni [Fe (CN) 6 ] 0,88 в качестве положительного электрода и PTCDI (3,4 , 9,10-перилентетракарбоновый диимид) в качестве отрицательного электрода (рис. 12) [61]. Эта батарея имела среднее рабочее напряжение всего 1,0 В и низкую плотность энергии 43 Втч кг -1 . Водно-аммониевый двухионный аккумулятор с максимальным рабочим напряжением 1,9 В и высокой плотностью энергии 51,3 Вт · ч. Кг -1 был построен с использованием электродов из органического полимера [62].{+} \) положительные электроды имеют более высокий окислительно-восстановительный потенциал.
Рис. 12a Принципиальная схема работы водных ионных аккумуляторов NH 4 + на основе положительных электродов Prussian White и отрицательных электродов PTCDI. b Зарядно-разрядные кривые водного NH 4 + -ионный аккумулятор в первом, втором, пятом и десятом циклах (60 мА г −1 ). c Производительность при езде на велосипеде при скорости 3 C [61].Воспроизведено с разрешения Ref. [61]. Авторское право 2017, Wiley – VCH. d Окно электрохимической стабильности 1 M и 25 m AmAc электролитов (1 мВ с -1 ). e Циклические характеристики TiO 1,85 (OH) 0,30 · 0,28H 2 O-электрод в 25 м AmAc (1 A g −1 ) [63]. Воспроизведено с разрешения Ref. [63]. Авторские права 2017, Wiley – VCH. (е) ЦВА электродов Zn и Na-FeHCF в 1 M (NH 4 ) 2 SO 4 + 20 мМ ZnSO 4 водный раствор при скорости сканирования 3 мВ с −1 . г Кривые заряда-разряда гибридных аккумуляторов Zn / Na-FeHCF. Воспроизведено с разрешения Ref. [64]. Авторское право 2019, John Wiley and Sons. ч Кривые заряда-разряда при различных плотностях тока и циклические характеристики и гибридных аккумуляторов Zn / CuHCF при плотности тока 1800 мА г −1 . Воспроизведено с разрешения Ref. [65]. Авторское право 2019 г., Американское химическое общество
Как и в случае с ARLB, электролиты WiS могут использоваться для расширения диапазона напряжений.Недавно новый электролит WiS (25 м CH 3 COONH 4 ) был использован в AAIB, который имеет потенциальное окно 2,95 В (рис. {+} \) также является эффективным способом увеличения плотности энергии AAIB [64, 65].Наша группа была первой, кто сообщил о водной перезаряжаемой гибридной аммонийно-цинковой батарее (ARAHB), содержащей высокопрочный гексацианоферрат натрия и железа NaFe III Fe II (CN) 6 (Na-FeHCF) положительный электрод нанокуба и низко- недорогой цинковый отрицательный электрод, с рабочим напряжением 1,3 В и высокой плотностью энергии 81,7 Вт · ч. кг −1 (в расчете на общую массу активных материалов) (рис. 12f, g). Затем мы дополнительно увеличили плотность энергии ARAHB до 114 Вт · ч · кг -1 , используя наночастицы CuHCF в качестве материала положительного электрода (рис.12h, i).
Водные Zn-ионные батареи (AZIB)
Цинк является наиболее идеальным материалом для отрицательных электродов для водных аккумуляторов из-за его низкого окислительно-восстановительного потенциала (-0,76 В по сравнению с SHE) и высокой удельной емкости (820 мАч г −1 ) , богатые запасы и нетоксичные свойства. Он широко используется в качестве отрицательных электродов в щелочных батареях на основе цинка (таких как щелочные цинк-MnO 2 батареи [66], цинк-никелевые батареи [67, 68] и Zn // Co 3 O 4 батареи [69, 70], воздушно-цинковые батареи [71, 72], ионно-цинковые батареи и гибридные цинковые батареи.В последнее время было много обзоров по этим аспектам, поэтому мы не будем подробно останавливаться на них с точки зрения электродных материалов [73,74,75,76,77,78,79,80,81,82,83,84,85 , 86]. Здесь мы суммируем недавний прогресс в области цинковых батарей с высоким напряжением и высокой плотностью энергии. В Таблице 3 и на Рисунке 13 представлены подробные данные о показателях работы АЗИБ на сегодняшний день.
Таблица 3 Электрохимические свойства различных AZIB, AMIB, ACIB и AAIB с высоким напряжением и плотностью энергии Рис.13Плотность энергии и средняя разрядная емкость различных AZIB, AMIB, ACIB и AAIB с высоким напряжением и плотностью энергии
Zn – MnO 2 Батареи на основе водных электролитов на основе слабой соли цинка в настоящее время являются важной темой исследований [87, 88,89]. Несмотря на значительный прогресс, механизм реакции хранения Zn 2+ в материалах на основе Mn остается спорным. Предыдущий обзор суммировал три механизма накопления заряда [73]: (а) обратимое введение / извлечение ионов Zn в объемных материалах; (б) обратимые протонные реакции, сопровождающиеся отложением сульфата гидроксида цинка; и (c) H + и Zn 2+ , последовательно внедряемые / удаляемые на разных стадиях заряда-разряда.Основываясь на этих механизмах (рис. 14a), батарея Zn – MnO 2 использует только емкость и напряжение, обеспечиваемые окислительно-восстановительной реакцией пары Mn 4+ / Mn 3+ , ограничивая емкость батареи и выходную мощность. Напряжение. Это выдвигает новые требования к электрохимии цинка и марганца. Поскольку ион Mn поливалентен (+2, +3 и +4), двухэлектронная реакция Mn 4+ / Mn 2+ емкостью 616 мА г −1 и платформа с более высоким напряжением можно постулировать.Недавно был предложен новый механизм, который включает обратимое осаждение / растворение Mn 2+ / MnO 2 , химическое превращение (между MnO 2 и MnOOH) и введение Zn 2+ [90]. На основе уникальной двухэлектронной окислительно-восстановительной реакции Mn 4+ / Mn 2+ была собрана высоковольтная электролитическая цинково-марганцевая батарея с высоким разрядным плато 1,95 В и высокой плотностью энергии 409 Вт · ч · кг. −1 , а также отличные циклические характеристики (сохранение емкости 92% после 1800 циклов) (рис.14б, в).
Рис. 14a Схема трехступенчатых процессов гальваностатического разряда. b Кривые гальваностатического разряда. c Циклические характеристики при 30 мА см −2 . Электролитические ячейки Zn – MnO 2 заряжаются при постоянном напряжении 2,2 В (по сравнению с Zn / Zn 2+ ) [91]. Воспроизведено с разрешения Ref. [91]. Авторское право 2017 г., Американское химическое общество)
Чтобы еще больше увеличить напряжение и удельную энергию Zn-MnO 2 батареи, мы можем использовать гибридный электролит с разными значениями pH, например щелочно-нейтральный электролит и щелочно-кислотный электролит.Недавно наша группа сообщила о батарее Zn // MnO 2 с щелочным (1 M NaOH и 0,01 M Zn (Ac) 2 ) -нейтральным (2 M ZnSO 4 + 0,1 M MnSO 4 ) гибридом. электролит и мембрана Na + – Nafion от DKJ Co. Ltd. Принцип ее работы показан на рис. 15а. Использование Zn / Zn (OH) 2- 4 отрицательный электрод в щелочном растворе, который имеет относительно низкий окислительно-восстановительный потенциал, напряжение батареи значительно увеличивается.Аккумулятор в сборе имеет среднее плато разрядного напряжения 1,7 В и удельную энергию 487 Вт · ч · кг −1 [92]. Кроме того, за счет объединения двух окислительно-восстановительных реакций электрода растворения / осаждения MnO 2 / Mn 2+ и Zn / Zn (OH) 2− 4 с использованием двойных кислотно-щелочных электролитов и ионоселективной мембраны была сконструирована высокоэнергетическая батарея Zn-MnO 2 [93]. Рабочий механизм показан на рис. 15б.При зарядке Zn (OH) 2- 4 восстанавливается до Zn, а Mn 2+ окисляется до MnO 2 . В то же время катионы (K + ) и анионы (SO 4 2- ), хранящиеся в BPM, возвращаются на положительный и отрицательный электроды соответственно, достигая баланса заряда. В процессе разряда эти два процесса развиваются в противоположном направлении. Батарея Zn – Mn 2+ имела высокое рабочее напряжение 2.44 В, высокий кулоновский КПД 98,4% и сохранение разрядной емкости 97,5% после 1500 циклов. В частности, его удельная энергия чрезвычайно высока (≈ 1503 Вт · ч · кг -1 , рассчитана на основе материала положительного электрода), что является самым высоким показателем среди всех водных аккумуляторов на основе цинка, о которых сообщалось до сих пор, и даже сравнимо с таковыми из Zn- воздушные батареи.
Рис. 15a Принципиальная схема разработанной водной цинково-марганцевой батареи [92]. Воспроизведено с разрешения [92].Авторское право 2020, Американское химическое общество. b Принципиальная схема и механизм Zn – MnO 2 аккумулятора, использующего двойной кислотно-щелочной электролит в условиях заряда и разряда. [93] Воспроизведено с разрешения Ref. [93]. Copyright 2020, Wiley – VCH
PBA имеют трехмерный открытый каркас и структуру с большим зазором и считаются обратимыми Zn 2+ материалами-хозяевами интеркаляции / деинтеркаляции с быстрой зарядкой и разрядкой, высоким рабочим потенциалом и идеальным электрохимические свойства.В материалах электродов PBA обычно только один ион переходного металла (в большинстве случаев железа) считается электрохимически активным в водной системе электролита, что приводит к его ограниченной удельной емкости в водном растворе Zn 2+ (≈ 60 мАч г −1 ), тогда как в большинстве случаев напряжение низкое (~ 1,2 В Zn / Zn 2+ ) и, следовательно, удельная энергия батареи мала. Недавно был разработан новый вид кубиков Co / Fe PBA (гексацианоферрат кобальта, CoFe (CN) 6 ), в которых ожидается, что ионы Co и Fe будут эффективно участвовать в процессе двухэлектронного накопления энергии, что приведет к усилению удельной емкости [94].Как проиллюстрировано на фиг. 16a, вакансии, образованные в результате извлечения ионов K из каркаса CoFe (CN) 6 , имеют тенденцию отдавать предпочтение интеркаляции Zn 2+ . Интеркаляция / деинтеркаляция Zn 2+ требует двух стадий из-за разной энергии активации активных пар Co (III) / Co (II) и Fe (III) / Fe (II), что подтверждается кривыми CV (рис. . 16b). Собранная батарея Zn / CoFe (CN) 6 не только имела отличные показатели скорости и цикличности, но также работала на плато 1.75 В (рис. 16c) и показал плотность энергии 250 Вт · ч · кг -1 .
Рис. 16a Принципиальная схема обратимой интеркаляции / деинтеркаляции Zn 2+ в структуре CoFe (CN) 6 во время процессов зарядки и разрядки. b Первые три цикла кривых CV (1 мВ с −1 ). c Кривые постоянного тока заряда – разряда при различных плотностях тока [94]. Воспроизведено с разрешения Ref. [94]. Авторское право 2019, Wiley – VCH. d Принципиальная схема взаимосвязи между энергией и плотностью состояний (DOS) в Co 0,247 V 2 O 5 · 0,944H 2 O и V 2 O 5 · n H 2 O положительные электроды. Воспроизведено с разрешения Ref. [102]. Copyright 2019, Wiley – VCH
Оксиды на основе ванадия, которые обладают несколькими степенями окисления и высокой емкостью (> 300 мАч г −1 ), широко используются в качестве материалов положительных электродов для водных цинк-ионных аккумуляторов.Существуют различные оксиды на основе ванадия, которые обеспечивают значительную емкость и отличную циклическую стабильность, которые интенсивно изучаются, такие как V 2 O 5 · n H 2 O [95], NaV 3 O 8 · 1,5H 2 O [96], Ca 0,24 V 2 O 5 · 0,83H 2 O [97], H 2 V 3 O 8 [98, 99], K 2 V 6 O 16 · 2,7H 2 O [100] и ванадат алюминия [101].Однако неприятным аспектом является то, что 80% их емкости находится ниже 1,0 В, что приводит к низкой плотности энергии (<250 Вт · ч, кг -1 ), что резко контрастирует с их большой емкостью. Чжи и его коллеги сообщили о цинково-ионной батарее на основе положительного электрода с нанолентой Co 0,247 V 2 O 5 · 0,944H 2 O, который обеспечивал 52,5% общей емкости выше 1,0 В и, следовательно, была получена высокая плотность энергии 432 Втч кг −1 [102].Результаты показывают, что большая емкость Co 0,247 V 2 O 5 · 0,944H 2 O обусловлена его более высокой адсорбционной способностью для Zn 2+ , а высокое напряжение аккумулятора в основном из-за взаимодействия между орбиталями Co 3d и V 3d , которое перемещает относительный окислительно-восстановительный потенциал пары V 5+ / V 4+ на более высокий уровень (рис. 16d).
Материалы типа NASICON имеют большие каналы и способность к быстрой диффузии ионов и очень привлекательны в качестве узлов хранения Zn 2+ -ion.Na 3 В 2 (PO 4 ) 3 описывался как положительный электрод Zn-ионной батареи на водной основе, с напряжением 1,1 В, 97,5 мАч г после 100 циклов) [103]. Недавно сообщалось о другом материале типа NASICON, Na 3 V 2 (PO 4 ) 2 F 3 , как высоковольтный положительный электрод (более 1,6 В) для ионов цинка. аккумулятор, с окислительно-восстановительным потенциалом 0.На 5 В выше, чем у Na 3 V 2 (PO 4 ) 3 [104]. Цинк-ионная батарея в сборе имеет высокий потенциал 1,62 В и высокую плотность энергии 97,5 Вт · ч кг -1 (рис. 17a). Что еще более важно, при плотности тока 1 A g −1 цинк-ионная батарея показала очень стабильную производительность при циклических нагрузках, сохраняя 95% емкости в течение 4000 циклов (рис. 17b).
Рис.17a Кривые заряда-разряда первых трех циклов CFF-Zn // Na 3 V 2 (PO 4 ) 2 F 3 @C батареи ( 0.08 A г −1 ). b Циклические характеристики CFF-Zn (углеродная пленка, функционализирующая Zn) // Na 3 V 2 (PO 4 ) 2 F 3 батареи @C (1 A g −1 ) [104]. Воспроизведено с разрешения Ref. [104]. Copyright 2018, Elsevier BV Сравнение производительности Zn / Co (III) rich-Co 3 O 4 батареи в 1 M KOH и 2 M ZnSO 4 с 0,2 M CoSO 4 : a заряд-разряд кривые, b производительность первых 500 циклов (1 A g −1 ) [105].Воспроизведено с разрешения Ref. [105]. Авторское право 2018, Королевское химическое общество
Как правило, в цинково-кобальтовых батареях используется щелочной электролит, который демонстрирует плохую устойчивость к циклическим нагрузкам и вызывает загрязнение окружающей среды. Окислительно-восстановительная реакция между CoO и Co 3 O 4 была обнаружена в батарее Zn / Co 3 O 4 с мягким водным электролитом [105]. Слой CoO, сформированный во время процесса разряда, показывает процесс преобразования вставки ионов H + в Co 3 O 4 .Батарея с высоким содержанием Zn / Co (III) Co 3 O 4 , использующая слабый водный электролит, показала окно напряжения около 2,2 В (рис. 17c, d), что намного шире, чем у батареи с щелочными электролитами ( около 1,9 В).
Водные магниево-ионные аккумуляторы (AMIB)
Магниево-ионные аккумуляторы постепенно становятся еще одной популярной областью исследований, поскольку ресурсы Земли богаты магнием, который недорого стоит и подходит для разработки устройств хранения энергии.Ион магния похож на ион лития. Однако основные проблемы, связанные с неводными перезаряжаемыми Mg-ионными батареями, препятствуют их развитию: (а) их электролит чувствителен к воде и имеет сложные химические свойства; (b) отсутствие высокоэффективных электродных материалов также ограничивает практическую применимость Mg-батарей из-за медленной диффузии Mg 2+ в твердых телах. Напротив, водные магниево-ионные батареи (AMIB) имеют много преимуществ, таких как низкая стоимость, отсутствие коррозии, хорошая безопасность и хорошая проводимость.Однако из-за отсутствия подходящих материалов для отрицательного и положительного электрода, большинство заявленных электродных материалов для AMIB оценивались только на полуэлементной установке. Ограниченные окном стабильности напряжения традиционных водных электролитов (1,23 В), напряжение и плотность энергии AMIB также очень ограничены [106]. Общеизвестно, что Mg трудно обратимо осаждать и отделять в водном растворе, поскольку Mg является активным металлом и имеет низкий окислительно-восстановительный потенциал (-2,37 В противОНА). Недавние исследования показали, что обратимое осаждение / удаление металлического магния в электролите, содержащем H 2 O, возможно путем введения искусственной твердой поверхности раздела. Наша группа сообщила о гибридной батарее Mg / LiFePO 4 , в которой реактив Гриньяра на основе магния применялся в качестве отрицательного электрода для неводного электролита, а LISICON служил в качестве комбинированного сепаратора / твердого электролита. Эта гибридная батарея продемонстрировала среднее напряжение разряда 2,1 В, стабильное плато разряда и хорошую цикличность (рис.18а – в) [107].
Рис. 18a Схематическое изображение водной батареи Mg / LiFePO 4 . b Кривая заряда – разряда первого цикла (50 мАч g –1 , 1,7–3,4 В). c Циклические характеристики (50 мАч g −1 , 1,7–3,4 В) [107]. Воспроизведено с разрешения Ref. [107]. Авторские права 2015, Издательская группа Nature. d Сравнение циклических характеристик Mg / V 2 O 5 и Mg (с межфазной защитой) / V 2 O 5 in 0.5 M Mg (TFSI) 2 / PC электролиты без / с водой. e Кривые заряда-разряда Mg / V 2 O 5 и Mg (с межфазной защитой) / V 2 O 5 в 0,5 M Mg (TFSI) 2 / PC + 3 MH 2 электролита O (0,5–2,5 В, 29,4 мА г –1 ). Воспроизведено с разрешения Ref. [108]. Copyright 2018, Nature Publishing Group
Недавно искусственная Mg 2+ -проводящая граница раздела на поверхности отрицательного электрода из Mg была синтезирована термоциклированием полиакрилонитрила и Mg (OTf) 2 .Искусственная межфазная фаза позволила осуществить обратимый цикл полной ячейки Mg / V 2 O 5 в водосодержащем электролите на карбонатной основе (рис. 18d, e) [108]. В таблице 3 и на рис. 18 приведены подробные сведения о производительности AMIB, о которых сообщалось на сегодняшний день.
Водные Ca-ионные батареи (ACIB)
Химические свойства Ca 2+ очень похожи на свойства Mg 2+ . Хотя радиус катиона Ca 2+ (0,100 нм) больше, чем у Li + (0.076 нм) и катионов Mg 2+ (0,072 нм), его окислительно-восстановительный потенциал низкий (–2,87 В по сравнению с SHE), богат запасами и низкая плотность ионного заряда, что делает его альтернативным анодным материалом для пост-литий-ионных аккумуляторов. ионные батареи. ACIB также является потенциальной электрохимической системой. Известно немного материалов для электродов с интеркаляцией кальция, в основном из-за медленной диффузии Ca 2+ . В настоящее время немногие зарегистрированные материалы положительных электродов для ACIB представляют собой в основном PBA [включая NiHCF [109], K 2 BaFe (CN) 6 [110] и CuHCF [111]]), а указанные отрицательные материалы в основном являются органическими. электродные материалы, такие как PNDIE {поли- [N, N ‘- (этан-1,2-диил) -1,4,5,8-нафталинтетракарбоксиимид]} [112].
До сих пор сообщалось только об одном ACIB, состоящем из отрицательного электрода PNDIE и PBA, гексацианоферрата меди {CuHCF, K 0,02 Cu [Fe (Cu) 6 ] 0,66 · 3,7H 2 O }, в качестве положительного электрода и водный раствор Ca (NO 3 ) 2 в качестве электролита (рис. 19) [112]. Полная батарея продемонстрировала удельную емкость 40 мАч g −1 при 1 ° C (1 C = 40 мАч g −1 ) со средним рабочим напряжением 1,24 В, что соответствует плотности энергии 54 Втч кг — 1 , и сохранение емкости 88% с почти 100% кулоновским КПД после 1000 циклов при 10 ° C.
Рис. 19a Принципиальная схема зарядки и разрядки водной перезаряжаемой Ca-ионной батареи (PNDIE // Ca 0,3 CuHCF). b CV-кривые электродов и электрохимическая стабильность электролита [2,5 M Ca (NO 3 ) 2 , 1 мВ с -1 ]. c Напряжение-время для аккумуляторов PNDIE // Ca 0,3 CuHCF (450 мАч g −1 ). d Циклические характеристики PNDIE // Ca 0.3 батареи CuHCF (400 мАч g −1 ). Воспроизведено с разрешения Ref. [112]. Copyright 2017, Wiley – VCH
Водные алюминиево-ионные батареи (AAIB)
Алюминий обладает высокой удельной объемной емкостью (8046 мАч см −3 ) и высокой гравиметрической емкостью (2980 мАч г −1 ), что составляет сравним с металлическим литием, имеет высокое содержание (около 8 мас.% земной коры) и является самым дешевым в производстве, за исключением железа. Кроме того, металлический алюминий имеет лучшую стабильность на воздухе, чем литий, что снижает потенциальные риски безопасности, а также является экологически чистым.Введение ионных жидкостей при комнатной температуре (RTIL) с широким электрохимическим окном стабильности улучшило обратимость процесса удаления / нанесения покрытия из Al — прорыв, открывающий жизнеспособный путь для перезаряжаемых алюминиево-ионных батарей (AIB) [113, 114, 115]. В последние годы успешное приготовление новых электролитов и лучшее понимание природы SEI привело к разработке AAIB [116, 117]. Многие исследователи исследовали новые электродные материалы для AAIB, такие как TiO 2 [118,119,120,121], MoO 3 [122, 123], WO 3 [124], FeVO 4 [125] и PBA [126,127,128]) , и некоторые обзоры всесторонне резюмировали эту работу [129,130,131,132].Поэтому мы обсудим этот аспект только кратко и сосредоточимся на недавнем прогрессе в исследованиях высокоэнергетических перезаряжаемых AAIB на основе металлического алюминия. В таблице 3 представлены подробные сведения о производительности AAIB, о которых сообщалось на сегодняшний день.
Использование алюминия в качестве отрицательного электрода AAIB — захватывающий прорыв. 5 м водный раствор трифторметансульфоната алюминия [Al (OTf) 3 ] описан как электролит с потенциальным окном от — 0,3 до 3,3 В (по сравнению с Al 3+ / Al) и способностью получать обратимое осаждение / удаление алюминий (рис.20) [116]. На основе этого электролита был собран AAIB с металлическим отрицательным электродом из алюминия и положительным электродом из алюминия x MnO 2 · n H 2 O, который имел средний потенциал (1,1 В) и выдающаяся плотность энергии 481 Втч кг −1 [117].
Рис.20a Окно электрохимической стабильности 5 м водного раствора Al (OTF) 3 (стеклоуглерод, 10 мВ с −1 ). b Кривая постоянного тока для заряда-разряда симметричного элемента Al – Al (5 м Al (OTF) 3 ). c График заряда-разряда первых пяти циклов батареи Al-MnO 2 . d Циклические характеристики батареи Al – MnO 2 . Воспроизведено с разрешения Ref. [117], Copyright 2019 Nature Publishing Group
Хорошо известно, что пассивирующий слой Al 2 O 3 быстро и необратимо образуется на поверхности металлического Al в воздухе, что препятствует усилиям по превращению воды в воду с высокой степенью обратимости. электрохимические ячейки на основе алюминия.Недавно сообщалось, что обогащенная ионной жидкостью (ИЖ) межфазная фаза на поверхности Al может быть получена путем погружения Al в кислый электролит ИЖ, состоящий из AlCl 3 — [EMIm] Cl, на более чем 1 день, что приводит к коррозии пассивирующая пленка из Al 2 O 3 и предотвращала ее последующее образование [117]. Кроме того, этот вид интерфейса является постоянным и способствует миграции Al 3+ . Используя этот искусственный SEI, была создана водная батарея T – Al (обработанный ИЖ Al анод) // MnO 2 с использованием водного Al (CF 3 SO 3 ) 3 электролитов, которые могли быть переработан и не показал значительного выделения водорода.Этот AAIB показал среднее напряжение 1,37 В и напряжение плато 1,40 В, обеспечивая удельную энергию около 500 Вт · ч · кг -1 (рис. 21). Производительность была дополнительно улучшена за счет предварительного добавления 0,5 м MnSO 4 в водный электролит Al (OTf) 3 , который аналогичен батарее Zn / MnO 2 , где соль Mn 2+ улучшает оба емкость и циклические характеристики электрода из оксида марганца [133]. Эта батарея T-Al / 0,5Mn / Bir-MnO 2 продемонстрировала замечательную плотность энергии (620 Вт · ч · кг -1 на основе массы MnO 2 типа бирнессита) и высокую сохраняющуюся емкость.
Рис. 21СЭМ-изображение Al фольги (слева) и фольги T – Al (справа). b Кривая постоянного тока для заряда-разряда симметричных элементов Al – Al и T – Al / T – Al [2 м Al (CF 3 SO 3 ) 3 ]. Воспроизведено с разрешения Ref. [116]. Авторское право 2018, AAAS. c Кривые гальваностатического разряда / заряда водных алюминиевых батарей [2 м Al (CF 3 SO 3 ) 3 , 100 мА г -1 ]. d Вторые кривые разряд – заряд при постоянном токе для Al / Bir-MnO 2 , T – Al / Bir-MnO 2 и T – Al / 0.5Mn / Bir-MnO 2 аккумулятора (100 мАч г −1 ). e Циклические характеристики батарей T – Al / Bir-MnO 2 и T – Al / 0,5Mn / Bir-MnO 2 . Воспроизведено с разрешения Ref. [133]. Copyright 2019, Wiley – VCH
WiS водный AlCl 3 в качестве электролитов был применен для создания AAIB на основе металлического Al, состав которого позволил снизить начальный потенциал реакции выделения водорода до прибл. –2,3 В (по сравнению с Ag / AgCl), что позволило Al 3+ осесть на алюминиевый отрицательный электрод и расширить окно электрохимической стабильности AAIB примерно до 4 В [134].На основе этого электролита была успешно собрана алюминиевая / графитовая батарея с высокой удельной емкостью до 165 мАч g −1 , превосходной стабильностью с сохранением емкости почти 99% и удельной энергией 220 Втч кг −1 . (Рис.22).
Рис. 22a Принципиальная схема алюминиево-графитовой батареи во время разряда. b Зарядно-разрядные кривые постоянного тока алюминиевых графитовых ячеек при различных плотностях тока. c Циклические характеристики алюминиевых графитовых батарей (500 мА г −1 ).Воспроизведено с разрешения Ref. [134]. Авторское право 2019, Королевское химическое общество
Из-за ограниченной растворимости Al (OTf) 3 в воде очень трудно получить аналогичный электролит WiS для AAIB. Однако другие хорошо растворимые соли, такие как LiTFSI, могут быть введены для образования электролитов WiS. Например, смешанный электролит, содержащий 1 м Al (OTf) 3 + 17 м LiTFSI + 0,02 м HCl, был использован для создания перезаряжаемой водной батареи Al – S [135].



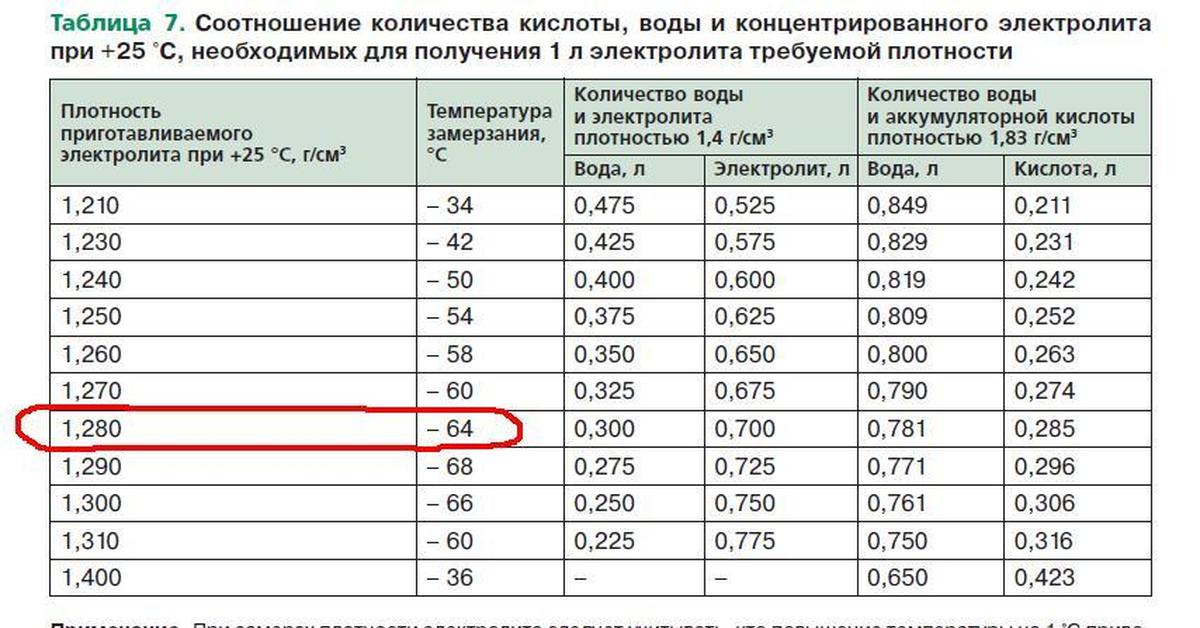 Это повод проверить плотность автомобильного аккумулятора, не дожидаясь планового техосмотра.
Это повод проверить плотность автомобильного аккумулятора, не дожидаясь планового техосмотра. Пользуясь данным резиновым прибором, выкачиваем из аккумулятора старый электролит и сливаем его в заранее подготовленную емкость. Внимание: Ни в коем случае не выливайте электролит на землю, если вы выполняете работы на улице;
Пользуясь данным резиновым прибором, выкачиваем из аккумулятора старый электролит и сливаем его в заранее подготовленную емкость. Внимание: Ни в коем случае не выливайте электролит на землю, если вы выполняете работы на улице;