Свойства атома Меди | |
Название | Медь / Cuprum |
Символ | Cu |
Номер | 29 |
Атомная масса (молярная масса) | 63,546 (3)а. е. м. (г/моль) |
Электронная конфигурация | [Ar] 3d10 4s1 |
Радиус атома | 128 пм |
Химические свойства Меди | |
Ковалентный радиус | 117 пм |
Радиус иона | (+2e) 73 (+1e) 77 (K=6) пм |
Электроотрицательность | 1,90 (шкала Полинга) |
Электродный потенциал | +0,337 В/ +0,521 В |
Степени окисления | 3, 2, 1, 0 |
Энергия ионизации (первый электрон) | 745,0 (7,72) кДж/моль (эВ) |
Термодинамические свойства простого вещества | |
Плотность (при н. | 8,92 г/см3 |
Температура плавления | 1356,55 K (1 083,4 °С) |
Температура кипения | 2840,15 K |
Уд. теплота плавления | 13,01 кДж/моль |
Уд. теплота испарения | 304,6 кДж/моль |
Молярная теплоёмкость | 24,44 Дж/(K·моль) |
Молярный объём | 7,1 см3/моль |
Кристаллическая решётка простого вещества | |
Структура решётки | кубическая гранецентрированая |
Параметры решётки | 3,615 Å |
Температура Дебая | 315 K |
Прочие характеристики Меди | |
Теплопроводность | (300 K) 401 Вт/(м·К) |
Номер CAS | 15158-11-9 |
Химические свойства переходных металлов (меди, цинка, хрома, железа).
Химические свойства меди
Медь (Cu) относится к d-элементам и расположена в IB группе периодической таблицы Д.И.Менделеева. Электронная конфигурация атома меди в основном состоянии записывается виде 1s22s22p63s23p63d104s1 вместо предполагаемой формулы 1s22s22p63s23p63d94s2. Другими словами, в случае атома меди наблюдается так называемый «проскок электрона» с 4s-подуровня на 3d-подуровень. Для меди, кроме нуля, возможны степени окисления +1 и +2. Степень окисления +1 склонна к диспропорционированию и стабильна лишь в нерастворимых соединениях типа CuI, CuCl, Cu2O и т. д., а также в комплексных соединениях, например, [Cu(NH3)2]Cl и [Cu(NH3)2]OH. Соединения меди в степени окисления +1 не имеют конкретной окраски. Так, оксид меди (I) в зависимости от размеров кристаллов может быть темно-красный (крупные кристаллы) и желтый (мелкие кристаллы), CuCl и CuI — белыe, а Cu2S — черно-синий. Более химически устойчивой является степень окисления меди, равная +2. Соли, содержащие медь в данной степени окисления, имеют синюю и сине-зеленую окраску.
Более химически устойчивой является степень окисления меди, равная +2. Соли, содержащие медь в данной степени окисления, имеют синюю и сине-зеленую окраску.
Медь является очень мягким, ковким и пластичным металлом с высокой электро- и теплопроводностью. Окраска металлической меди красно-розовая. Медь находится в ряду активности металлов правее водорода, т.е. относится к малоактивным металлам.
Взаимодействие с простыми веществами
с кислородом
В обычных условиях медь с кислородом не взаимодействует. Для протекания реакции между ними требуется нагрев. В зависимости от избытка или недостатка кислорода и температурных условий может образовать оксид меди (II) и оксид меди (I):
с серой
Реакция серы с медью в зависимости от условий проведения может приводить к образованию как сульфида меди (I), так и сульфида меди (II). При нагревании смеси порошкообразных Cu и S до температуры 300-400оС образуется сульфид меди (I):
При избытке серы и проведении реакции при температуре более 400оС образуется сульфид меди (II). Однако, более простым способом получения сульфида меди (II) из простых веществ является взаимодействие меди с серой, растворенной в сероуглероде:
Однако, более простым способом получения сульфида меди (II) из простых веществ является взаимодействие меди с серой, растворенной в сероуглероде:
Данная реакция протекает при комнатной температуре.
с галогенами
С фтором, хлором и бромом медь реагирует, образуя галогениды с общей формулой CuHal2, где Hal – F, Cl или Br:
Cu + Br2 = CuBr2
В случае с йодом — самым слабым окислителем среди галогенов — образуется иодид меди (I):
С водородом, азотом, углеродом и кремнием медь не взаимодействует.
Взаимодействие со сложными веществами
с кислотами-неокислителями
Кислотами-неокислителями являются практически все кислоты, кроме концентрированной серной кислоты и азотной кислоты любой концентрации. Поскольку кислоты-неокислители в состоянии окислить только металлы, находящиеся в ряду активности до водорода; это означает, что медь с такими кислотами не реагирует.
с кислотами-окислителями
— концентрированной серной кислотой
С концентрированной серной кислотой медь реагирует как при нагревании, так и при комнатной температуре. При нагревании реакция протекает в соответствии с уравнением:
При нагревании реакция протекает в соответствии с уравнением:
Поскольку медь не является сильным восстановителем, сера восстанавливается в данной реакции только до степени окисления +4 (в SO2).
— с разбавленной азотной кислотой
Реакция меди с разбавленной HNO3 приводит к образованию нитрата меди (II) и монооксида азота:
3Cu + 8HNO3(разб.) = 3Cu(NO3)2 + 2NO↑ + 4H2O
— с концентрированной азотной кислотой
Концентрированная HNO3 легко реагирует с медью при обычных условиях. Отличие реакции меди с концентрированной азотной кислотой от взаимодействия с разбавленной азотной кислотой заключается в продукте восстановления азота. В случае концентрированной HNO3 азот восстанавливается в меньшей степени: вместо оксида азота (II) образуется оксид азота (IV), что связано с большей конкуренцией между молекулами азотной кислоты в концентрированной кислоте за электроны восстановителя (Cu):
Cu + 4HNO3 = Cu(NO3)2 + 2NO2 + 2H2O
с оксидами неметаллов
Медь реагирует с некоторыми оксидами неметаллов. Например, с такими оксидами, как NO2, NO, N2O медь окисляется до оксида меди (II), а азот восстанавливается до степени окисления 0, т.е. образуется простое вещество N2:
Например, с такими оксидами, как NO2, NO, N2O медь окисляется до оксида меди (II), а азот восстанавливается до степени окисления 0, т.е. образуется простое вещество N2:
В случае диоксида серы, вместо простого вещества (серы) образуется сульфид меди(I). Связано это с тем, что медь с серой, в отличие от азота, реагирует:
с оксидами металлов
При спекании металлической меди с оксидом меди (II) при температуре 1000-2000 оС может быть получен оксид меди (I):
Также металлическая медь может восстановить при прокаливании оксид железа (III) до оксида железа (II):
с солями металлов
Медь вытесняет менее активные металлы (правее нее в ряду активности) из растворов их солей:
Cu + 2AgNO3 = Cu(NO3)2 + 2Ag↓
Также имеет место интересная реакция, в которой медь растворяется в соли более активного металла – железа в степени окисления +3. Однако противоречий нет, т. к. медь не вытесняет железо из его соли, а лишь восстанавливает его со степени окисления +3 до степени окисления +2:
к. медь не вытесняет железо из его соли, а лишь восстанавливает его со степени окисления +3 до степени окисления +2:
Fe2(SO4)3 + Cu = CuSO4 + 2FeSO4
Cu + 2FeCl3 = CuCl2 + 2FeCl2
Последняя реакция используется при производстве микросхем на стадии травления медных плат.
Коррозия меди
Медь со временем подвергается коррозии при контакте с влагой, углекислым газом и кислородом воздуха:
2Cu + H2O + СО2 + О2 = (CuOН)2СO3
В результате протекания данной реакции медные изделия покрываются рыхлым сине-зеленым налетом гидроксокарбоната меди (II).
Химические свойства цинка
Цинк Zn находится в IIБ группе IV-го периода. Электронная конфигурация валентных орбиталей атомов химического элемента в основном состоянии 3d104s2. Для цинка возможна только одна единственная степень окисления, равная +2. Оксид цинка ZnO и гидроксид цинка Zn(ОН)2 обладают ярко выраженными амфотерными свойствами.
Оксид цинка ZnO и гидроксид цинка Zn(ОН)2 обладают ярко выраженными амфотерными свойствами.
Цинк при хранении на воздухе тускнеет, покрываясь тонким слоем оксида ZnO. Особенно легко окисление протекает при высокой влажности и в присутствии углекислого газа вследствие протекания реакции:
2Zn + H2O + O2 + CO2 → Zn2(OH)2CO3
Пар цинка горит на воздухе, а тонкая полоска цинка после накаливания в пламени горелки сгорает в нем зеленоватым пламенем:
При нагревании металлический цинк также взаимодействует с галогенами, серой, фосфором:
С водородом, азотом, углеродом, кремнием и бором цинк непосредственно не реагирует.
Цинк реагирует с кислотами-неокислителями с выделением водорода:
Zn + H2SO4 (20%) → ZnSO4 + H2↑
Zn + 2HCl → ZnCl2 + H2↑
Особенно легко растворяется в кислотах технический цинк, поскольку содержит в себе примеси других менее активных металлов, в частности, кадмия и меди.![]() Высокочистый цинк по определенным причинам устойчив к воздействию кислот. Для того чтобы ускорить реакцию, образец цинка высокой степени чистоты приводят в соприкосновение с медью или добавляют в раствор кислоты немного соли меди.
Высокочистый цинк по определенным причинам устойчив к воздействию кислот. Для того чтобы ускорить реакцию, образец цинка высокой степени чистоты приводят в соприкосновение с медью или добавляют в раствор кислоты немного соли меди.
При температуре 800-900oC (красное каление) металлический цинк, находясь в расплавленном состоянии, взаимодействует с перегретым водяным паром, выделяя из него водород:
Zn + H2O = ZnO + H2↑
Цинк реагирует также и с кислотами-окислителями: серной концентрированной и азотной.
Цинк как активный металл может образовывать с концентрированной серной кислотой сернистый газ, элементарную серу и даже сероводород.
Zn + 2H2SO4 = ZnSO4 + SO2↑ + 2H2O
Состав продуктов восстановления азотной кислоты определяется концентрацией раствора:
Zn + 4HNO3(конц.) = Zn(NO3)2 + 2NO2↑ + 2H2O
3Zn + 8HNO3(40%) = 3Zn(NO3)2 + 2NO↑ + 4H2O
4Zn +10HNO3(20%) = 4Zn(NO3)2 + N2O↑ + 5H2O
5Zn + 12HNO3(6%) = 5Zn(NO3)2 + N2↑ + 6H2O
4Zn + 10HNO3(0,5%) = 4Zn(NO3)2 + NH4NO3 + 3H2O
На направление протекания процесса влияют также температура, количество кислоты, чистота металла, время проведения реакции.
Цинк реагирует с растворами щелочей, при этом образуются тетрагидроксоцинкаты и водород:
Zn + 2NaOH + 2H2O = Na2[Zn(OH)4] + H2↑
Zn + Ba(OH)2 + 2H2O = Ba[Zn(OH)4] + H2↑
С безводными щелочами цинк при сплавлении образует цинкаты и водород:
В сильнощелочной среде цинк является крайне сильным восстановителем, способным восстанавливать азот в нитратах и нитритах до аммиака:
4Zn + NaNO3 + 7NaOH + 6H2O → 4Na2[Zn(OH)4] + NH3↑
Благодаря комплексообразованию цинк медленно растворяется в растворе аммиака, восстанавливая водород:
Zn + 4NH3·H2O → [Zn(NH3)4](OH)2 + H2↑ + 2H2O
Также цинк восстанавливает менее активные металлы (правее него в ряду активности) из водных растворов их солей:
Zn + CuCl2 = Cu + ZnCl2
Zn + FeSO4 = Fe + ZnSO4
Химические свойства хрома
Хром — элемент VIB группы таблицы Менделеева.![]() Электронная конфигурация атома хрома записывается как 1s 22s 22p 63s 23p63d54s1, т.е. в случае хрома, также как и в случае атома меди, наблюдается так называемый «проскок электрона»
Электронная конфигурация атома хрома записывается как 1s 22s 22p 63s 23p63d54s1, т.е. в случае хрома, также как и в случае атома меди, наблюдается так называемый «проскок электрона»
Наиболее часто проявляемыми степенями окисления хрома являются значения +2, +3 и +6. Их следует запомнить, и в рамках программы ЕГЭ по химии можно считать, что других степеней окисления хром не имеет.
При обычных условиях хром устойчив к коррозии как на воздухе, так и в воде.
Взаимодействие с неметаллами
с кислородом
Раскаленный до температуры более 600 oС порошкообразный металлический хром сгорает в чистом кислороде образуя окcид хрома (III):
4Cr + 3O2 =ot=> 2Cr2O3
Медь — химические свойства » HimEge.ru
Место меди в Периодической системе химических элементов Д.И. Менделеева
Медь расположена в 11 группе Периодической системы химических элементов Д.
Физические свойства меди
На воздухе медь покрывается плотной зелено-серой пленкой основного карбоната, которая защищает её от дальнейшего окисления.
Химические свойства меди
С кислородом в зависимости от температуры взаимодействия медь образует два оксида:
2Cu + O2 = 2CuO (черный цвет)
При температуре около 150 оС металл покрывается темно-красной пленкой оксида меди (I):
При нагревании с фтором, хлором, бромом образуются галогениды меди (II):
Cu + Br2 = CuBr2;
с йодом – образуется йодид меди (I):
2Cu + I2 = 2CuI.
Cu + S = CuS
4Cu + SO2= Cu2S + 2CuO
4Cu + 2NO2 = 4CuO + N2
Взаимодействие с кислотами
В электрохимическом ряду напряжений металлов медь расположена после водорода, поэтому она не взаимодействует с растворами разбавленной соляной и серной кислот и щелочей.
Растворяется в разбавленной азотной кислоте с образованием нитрата меди (II) и оксида азота (II):
3Cu + 8HNO3 = 3Cu(NO3)2 + 2NO + 4H2O.
Реагирует с концентрированными растворами серной и азотной кислот с образованием солей меди (II) и продуктов восстановления кислот:
Cu + 2H2SO4 = CuSO4 + SO2 + 2H2O;
Cu + 4HNO3 = Cu(NO3)2 + 2NO2 + 2H2O.
С концентрированной соляной кислотой медь реагирует с образованием трихлорокупрата (II) водорода:
Cu + 3HCl = H[CuCl3] + H2
Как отличить лом меди в домашних условиях
У большинства из нас знания о меди и ее свойствах ограничиваются школьным курсом химии, что на бытовом уровне вполне достаточно. Однако иногда возникает необходимость достоверно определить, является ли материал чистым элементом, сплавом или даже композитным материалом. Мнение, что эта информация нужна лишь тем, кто занимается приемом или сдачей металлолома, ошибочно: к примеру, на форумах радиолюбителей и очень часто поднимаются темы, как отличить медь в проводах от омедненного алюминия.![]()
Коротко об элементе №29
Чистая медь (Cu) – золотисто-розовый металл, обладающий высокой пластичностью, тепло- и электропроводностью. Химическую инертность в обычной неагрессивной среде обеспечивает тончайшая оксидная пленка, которая придает металлу интенсивный красноватый оттенок.
Главное отличие меди от других металлов – окраска. На самом деле окрашенных металлов не так много: внешне похожи лишь золото, цезий и осмий, а все элементы, входящие в группу цветных металлов (железо, олово, свинец, алюминий, цинк, магний и никель) обладают серым цветом с различной интенсивностью блеска.
Абсолютную гарантию химического состава любого материала можно получить лишь с помощью спектрального анализа. Оборудование для его проведения очень дорогое, и даже многие экспертные лаборатории могут о нем лишь мечтать. Однако, существует немало способов, как отличить медь
1. Определение по цвету
Итак, перед нами кусок неизвестного материала, который необходимо идентифицировать как медь. Упор на термин «материал», а не «металл», сделан специально, так как в последнее время появилось немало композитов, которые по внешним признакам и тактильным ощущениям очень похожи на металлы.
Упор на термин «материал», а не «металл», сделан специально, так как в последнее время появилось немало композитов, которые по внешним признакам и тактильным ощущениям очень похожи на металлы.
В первую очередь рассматриваем цвет. Это желательно делать при дневном свете или «теплом» светодиодном освещении (под «холодными» светодиодами красноватый оттенок меняется на желто-зеленый). Идеально, если для сравнения есть медная пластинка или проволока – в этом случае ошибка в цветовосприятии практически исключена.
Важно: старые медные изделия могут быть покрыты окислившимся слоем (зеленовато-голубым рыхлым налетом): в этом случае цвет металла нужно смотреть на срезе или спиле.
2. Определение магнитом
Совпадение по цвету – достоверный, но не достаточный способ идентификации. Вторым шагом самостоятельных экспериментов будет проба с магнитом. Химически чистая медь относится к диамагнетикам – т.е. к веществам, не реагирующим на магнитное воздействие. Если исследуемый материал притягивается к магниту, то это – сплав, в котором содержание основного вещества не более 50%.
3. Определение по реакции на пламя
Еще один способ распознать медь – раскалить образец на открытом огне (газовая плита, зажигалка или обычная спичка). Медная проволока при накаливании сначала потеряет блеск, а затем окрасится в черно-бурый цвет, покрывшись оксидом. Этим способом можно отсечь и композитные материалы, которые при накаливании начинают дымить с образованием газа с резким запахом.
4. Определение посредством химических экспериментов
Показательной является реакция с концентрированной азотной кислоты: если последнюю капнуть на поверхность медного изделия, произойдет окрашивание в зелено-голубой цвет.
Качественной реакцией на медь является растворение в соляной кислоте с последующим воздействием аммиаком. Если медный образец оставить в растворе HCl до полного или частичного растворения, а потом капнуть туда обычный аптечный нашатырный спирт, раствор окрасится в интенсивно синий цвет.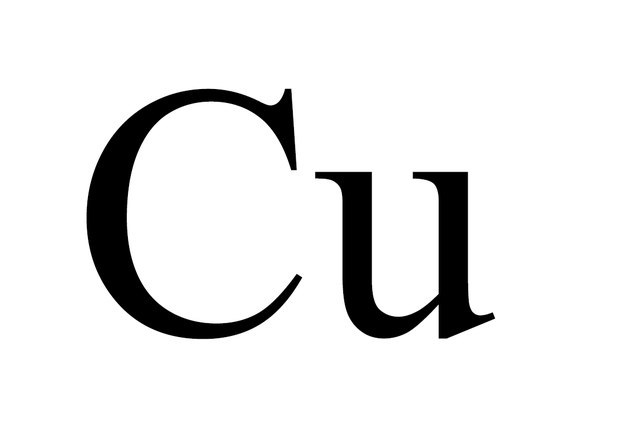
Важно: работа с химическими реактивами требует соблюдения мер предосторожности. Самостоятельные эксперименты нужно проводить в хорошо проветриваемом помещении с применением средств индивидуальной защиты (резиновые перчатки, фартук, очки).
Как различить медь и сплавы на ее основе?
В промышленности широко распространены медные сплавы. За многие годы исследований удалось получить немало материалов с уникальными свойствами: высокой пластичностью, электропроводностью, химической стойкостью, прочностью (все зависит от легирующих добавок). Самыми распространенными являются бронзы (с добавкой олова, алюминия, кремния, марганца, свинца и бериллия), латуни (с добавлением 10-45% цинка), а также медно-никелевые сплавы (нейзильбер, мельхиор, копель, манганин).
Сложность в плане идентификации представляют лишь бронзы и латуни, поскольку медно-никелевые сплавы значительно отличаются цветом из-за низкого содержания меди.
Медь или латунь?
В латуни может содержаться от 10 до 45% цинка – металла серебристо-серого цвета. Естественно, чем больше цинка, тем бледнее сплав. Однако, высокомедные латуни, в которых количество добавок не превышает 10%, мало отличаются по цвету от медного образца. В этом случае остается лишь доверять своим ощущениям: латунь намного тверже, труднее поддается изгибу (для большей достоверности желательно сравнение с эталонным образцом). Можно попробовать снять стружку: медная будет иметь форму завитка, латунная – прямолинейную, игольчатую. При помещении образцов в раствор соляной кислоты реакции с медью не наблюдается, а на поверхности латуни образуется белый налет хлорида цинка.
Естественно, чем больше цинка, тем бледнее сплав. Однако, высокомедные латуни, в которых количество добавок не превышает 10%, мало отличаются по цвету от медного образца. В этом случае остается лишь доверять своим ощущениям: латунь намного тверже, труднее поддается изгибу (для большей достоверности желательно сравнение с эталонным образцом). Можно попробовать снять стружку: медная будет иметь форму завитка, латунная – прямолинейную, игольчатую. При помещении образцов в раствор соляной кислоты реакции с медью не наблюдается, а на поверхности латуни образуется белый налет хлорида цинка.
Медь или бронза?
Как и латуни, бронзы гораздо прочнее, что объясняется присутствием в сплаве более твердых металлов. Самой достоверной будет проба «на зубок» — на поверхности бронзы вряд ли останется след от надавливания.
Можно также поэкспериментировать с горячим солевым раствором (200 г поваренной соли на 1 литр воды). Медный образец через 10-15 минут приобретет более интенсивный оттенок, чем бронзовый.
Для тех, кто знаком с электротехникой
Очень часто в качестве лома цветных металлов сдаются медные жилы от электрических кабелей, и нередки случаи, когда при производстве электротехнической продукции используется медненый алюминий. Этот материал имеет значительно меньшую плотность, но из-за неправильной геометрической формы определить объем для расчета плотности довольно сложно. В этом случае определить медь можно по электрическому сопротивлению (естественно, при наличии соответствующих приборов – вольтметра, амперметра, реостата). Измеряем сечение и длину жилы, снимаем показания приборов, и – закон Ома вам в помощь. Удельное сопротивление – достаточно точная характеристика, по которой можно с высокой долей достоверности идентифицировать любой металл.
Заключение
Точно определить качество медного лома или содержание основного вещества в сплаве можно только после проведения экспертизы: все вышеприведенные методы являются приблизительными. Если рассматривать ценообразование при покупке металлолома, то дороже всего стоит электротехническая медь, самые дешевые – сплавы латунной группы. Окончательную стоимость сделки можно уточнить у менеджеров компаний, занимающихся скупкой лома цветных металлов.
Окончательную стоимость сделки можно уточнить у менеджеров компаний, занимающихся скупкой лома цветных металлов.
14 различных типов металлов | New-Science.ru
Термин «металл» происходит от греческого слова «metalléuō», что означает выкапываю или добываю из земли. Наша планета содержит много металла. На самом деле из 118 элементов периодической системы порядка 95 являются металлами.
Это число не является точным, потому что граница между металлами и неметаллами довольно расплывчата: нет стандартного определения металлоида, как нет и полного согласия относительно элементов, соответствующим образом классифицированных как таковые.
Сегодня мы используем различные виды металлов, даже не замечая их. Начиная с зажимов в сантехнике и заканчивая устройством, которое вы используете для чтения этой статьи, все они сделаны из определенных металлов. Фактически, некоторые металлические элементы необходимы для биологических функций, таких как приток кислорода и передача нервных импульсов. Некоторые из них также широко используются в медицине в виде антацидов.
Некоторые из них также широко используются в медицине в виде антацидов.
Все металлы в периодической таблице можно классифицировать по их химическим или физическим свойствам. Ниже мы перечислили некоторые различные типы металлов вместе с их реальным применением.
Классификация по физическим свойствам
14. Легкие металлы
Сплав титана 6AL-4VПримеры: Алюминий, титан, магний
Легкие металлы имеют относительно низкую плотность. Формального определения или критериев для идентификации этих металлов нет, но твердые элементы с плотностью ниже 5 г/см³ обычно считаются легкими металлами.
Металлургия легких металлов была впервые развита в середине 19 века. Хотя большинство из них происходит естественным путем, значительная их часть образуется при электротермии и электролизе плавленых солей.
Их сплавы широко используются в авиационной промышленности благодаря их низкой плотности и достаточным механическим свойствам. Например, сплав титана 6AL-4V составляет почти 50 процентов всех сплавов, используемых в авиастроении. Он используется для изготовления роторов, лопастей компрессоров, мотогондол, компонентов гидравлических систем.
Он используется для изготовления роторов, лопастей компрессоров, мотогондол, компонентов гидравлических систем.
13. Тяжелые металлы
Окисленные свинцовые конкреции и кубик размером 1 см3Примеры: железо, медь, кобальт, галлий, олово, золото, платина.
Тяжелые металлы — это элементы с относительно высокой плотностью (обычно более 5 г/см³ ) и атомным весом. Они, как правило, менее реактивны и содержат гораздо меньше растворимых сульфидов и гидроксидов, чем более легкие металлы.
Эти металлы редки в земной коре, но они присутствуют в различных аспектах современной жизни. Они используются в солнечных батареях, сотовых телефонах, транспортных средствах, антисептиках и ускорителях частиц.
Тяжелые металлы часто смешиваются в окружающей среде из-за промышленной деятельности, ухудшая качество почвы, воды и воздуха, а затем вызывая проблемы со здоровьем у животных и растений. Выбросы транспортных средств, горнодобывающие и промышленные отходы, удобрения, свинцово-кислотные батареи и микропластики, плавающие в океанах, являются одними из наиболее распространенных источников тяжелых металлов в этом контексте.
12. Белый металл
Подшипники из белого металлаПримеры: Обычно изготавливается из олова, свинца, висмута, сурьмы, кадмия, цинка.
Белые металлы — это различные светлые сплавы, используемые в качестве основы для украшений или изделий из серебра. Например, многие сплавы на основе олова или свинца используются в ювелирных изделиях и подшипниках.
Белый металлический сплав изготавливается путем объединения определенных металлов в фиксированных пропорциях в соответствии с требованиями конечного продукта. Основной металл для ювелирных изделий, например, формуется, охлаждается, экстрагируется, а затем полируется, чтобы придать ему точную форму и блестящий вид.
Они также используются для изготовления тяжелых подшипников общего назначения, подшипников внутреннего сгорания среднего размера и электрических машин.
11. Хрупкий металл
Хрупкое разрушение чугунаПримеры: сплавы углеродистой стали, чугуна и инструментальной стали.
Металл считается хрупким, если он твердый, но не может противостоять ударам или вибрации под нагрузкой. Такие металлы под воздействием напряжения ломаются без заметной пластической деформации. Они имеют низкую прочность на разрыв и часто издают щелкающий звук при поломке.
Многие стальные сплавы становятся хрупкими при низких температурах, в зависимости от их обработки и состава. Чугун, например, твердый, но хрупкий из-за высокого содержания углерода. Напротив, керамика и стекло гораздо более хрупки, чем металлы, из-за их ионных связей.
Галлий, висмут, хром, марганец и бериллий также хрупки. Они часто используются в различных гражданских и военных целях, связанных с высокими деформационными нагрузками. Чугун, устойчивый к повреждениям в результате окисления, используется в машинах, трубах и деталях автомобильной промышленности, таких как корпуса коробок передач и головки цилиндров.
10. Тугоплавкий металл
Микроскопическое изображение вольфрамовой нити в лампе накаливанияПримеры: молибден, вольфрам, тантал, рений, ниобий.
Тугоплавкие металлы имеют чрезвычайно высокие температуры плавления (более 2000 °С) и устойчивы к износу, деформации и коррозии. Они являются хорошими проводниками тепла и электричества и имеют высокую плотность.
Другой ключевой характеристикой является их термостойкость: они не расширяются и не растрескиваются при многократном нагревании и охлаждении. Однако они могут деформироваться при высоких нагрузках и окисляться при высоких температурах.
Благодаря своей прочности и твердости они идеально подходят для сверления и резки. Карбиды и сплавы тугоплавких металлов используются почти во всех отраслях промышленности, включая горнодобывающую, автомобильную, аэрокосмическую, химическую и ядерную.
Металлический вольфрам, например, используется в ламповых нитях. Сплавы рения используются в гироскопах и ядерных реакторах. А ниобиевые сплавы используются для форсунок жидкостных ракетных двигателей.
9. Черные и цветные металлы
Валы-шестерни из (черной) нержавеющей сталиЧерные металлы: Сталь, чугун, сплавы железа.
Цветные металлы: Медь, алюминий, свинец, цинк, серебро, золото.
Термин «железо» происходит от латинского слова «Ferrum», что переводится как «железо». Таким образом, термин «черный металл» обычно означает «содержащий железо», тогда как «цветной металл» означает металлы и сплавы, которые не содержат достаточного количества железа.
Поскольку черные металлы могут иметь широкий спектр легирующих элементов, которые значительно изменяют их характеристики, очень трудно поместить свойства всех черных металлов под один зонт. Тем не менее, некоторые обобщения могут быть сделаны, например, большинство черных металлов являются твердыми и магнитными.
Черные металлы используются для применения с высокой нагрузкой и низкой скоростью, в то время как цветные металлы предпочтительны для применения с высокой скоростью и нулевой нагрузкой для применения с низкой нагрузкой.
Сталь является наиболее распространенным черным металлом. Она составляет около 80% всего металлического материала благодаря своей доступности, высокой прочности, низкой стоимости, простоте изготовления и широкому спектру свойств. Она широко используется в строительстве и обрабатывающей промышленности. Фактически, рост производства стали показывает общее развитие промышленного мира.
Она широко используется в строительстве и обрабатывающей промышленности. Фактически, рост производства стали показывает общее развитие промышленного мира.
8. Цветные и благородные металлы
Ассортимент благородных металловЦветные металлы: медь, алюминий, олово, никель, цинк
Благородные металлы: родий, ртуть, серебро, рутений, осмий, иридий
Цветные металлы — это обычные и недорогие металлы, которые корродируют, окисляются или тускнеют быстрее, чем другие металлы, когда подвергаются воздействию воздуха или влаги. Они в изобилии встречаются в природе и легко добываются.
Они широко используются в промышленных и коммерческих целях и имеют неоценимое значение для мировой экономики благодаря своей полезности и повсеместности. Некоторые цветные металлы обладают отличительными характеристиками, которые не могут быть продублированы другими металлами. Например, цинк используется для гальванизации стали, чтобы защитить ее от коррозии, а никель — для изготовления нержавеющей стали.
Благородные металлы, с другой стороны, устойчивы к окислению и коррозии во влажном воздухе. Согласно атомной физике, благородные металлы имеют заполненный электрон d-диапазона. В соответствии с этим строгим определением, медь, серебро и золото являются благородными металлами.
Они находят применение в таких областях, как орнамент, металлургия и высокие технологии. Их точное использование варьируется от одного элемента к другому. Некоторые благородные металлы, такие как родий, используются в качестве катализаторов в химической и автомобильной промышленности.
7. Драгоценные металлы
Родий: 1 грамм порошка, 1 грамм прессованного цилиндра и 1 г аргонодуговой переплавленной гранулыПримеры: палладий, золото, платина, серебро, родий.
Драгоценные металлы считаются редкими и имеют высокую экономическую ценность. Химически они менее реакционноспособны, чем большинство элементов (включая благородные металлы). Они также пластичны и имеют высокий блеск.
Несколько веков назад эти металлы использовались в качестве валюты. Но сейчас они в основном рассматриваются как промышленные товары и инвестиции. Многие инвесторы покупают драгоценные металлы (в основном золото), чтобы диверсифицировать свои портфели или победить инфляцию.
Серебро — второй по популярности драгоценный металл для ювелирных изделий (после золота). Однако его значение выходит далеко за рамки красоты. Оно обладает исключительно высокой тепло- и электропроводностью и чрезвычайно низким контактным сопротивлением. Именно поэтому серебро широко используется в электронике, батареях и противомикробных препаратах.
Классификация по химическим свойствам
6. Щелочные металлы
Твердый металлический натрийПримеры: натрий, калий, рубидий, литий, цезий и франций.
Щелочь относится к основной природе гидроксидов металлов. Когда эти металлы реагируют с водой, они образуют сильные основания, которые легко нейтрализуют кислоты.
Они настолько реактивны, что обычно встречаются в природе в слиянии с другими веществами. Карналлит (хлорид калия-магния) и сильвин (хлорид калия), например, растворимы в воде и, таким образом, легко извлекаются и очищаются. Нерастворимые в воде щелочи, такие как фторид лития, также существуют в земной коре.
Карналлит (хлорид калия-магния) и сильвин (хлорид калия), например, растворимы в воде и, таким образом, легко извлекаются и очищаются. Нерастворимые в воде щелочи, такие как фторид лития, также существуют в земной коре.
Одно из самых популярных применений щелочных металлов — использование цезия и рубидия в атомных часах, наиболее точных из известных эталонов времени и частоты. Литий используется в качестве анода в литиевых батареях, композиты калия используются в качестве удобрений, а ионы рубидия используются в фиолетовых фейерверках. Чистый металлический натрий широко используется в натриевых лампах, которые очень эффективно излучают свет.
5. Щелочноземельные металлы
Изумрудный кристалл, основной минерал бериллия.Примеры: бериллий, кальций, магний, барий, стронций и радий.
Щелочноземельные металлы в стандартных условиях мягкие и серебристо-белые. Они имеют низкую плотность, температуру кипения и температуру плавления. Хотя они не так реакционноспособны, как щелочные металлы, они очень легко образуют связи с элементами. Как правило, они вступают в реакцию с галогенами, образуя галогениды щелочноземельных металлов.
Как правило, они вступают в реакцию с галогенами, образуя галогениды щелочноземельных металлов.
Все они встречаются в земной коре, кроме радия, который является радиоактивным элементом. Радий уже распадался в ранней истории Земли из-за относительно короткого периода полураспада (1600 лет). Современные образцы поступают из цепочки распада урана и тория.
Щелочноземельные металлы имеют широкий спектр применения. Бериллий, например, используется в полупроводниках, теплопроводниках, электрических изоляторах и в военных целях. Магний часто сплавляют с цинком или алюминием для получения материалов со специфическими свойствами. Кальций в основном используется в качестве восстановителя, а барий используется в вакуумных трубках для удаления газов.
4. Переходные металлы
Примеры: титан, ванадий, хром, никель, серебро, вольфрам, платина, кобальт.
Большинство элементов используют электроны из своей внешней оболочки для связи с другими элементами. Переходные металлы, однако, могут использовать две крайние оболочки для соединения с другими элементами. Это химическая особенность, которая позволяет им связываться со многими различными элементами в различных формах.
Переходные металлы, однако, могут использовать две крайние оболочки для соединения с другими элементами. Это химическая особенность, которая позволяет им связываться со многими различными элементами в различных формах.
Они занимают среднюю часть таблицы Менделеева, служа мостом между (или переходом) между двумя сторонами таблицы. Более конкретно, есть 38 переходных металлов в группах с 3 по 12 периодической таблицы. Все они являются пластичными, податливыми и хорошими проводниками тепла и электричества.
Многие из этих металлов, такие как медь, никель, железо и титан, используются в конструкциях и в электронике. Большинство из них образуют полезные сплавы друг с другом и с другими металлическими веществами. Некоторые из них, включая золото, серебро и платину, называются благородными металлами, потому что они крайне инертны и устойчивы к кислотам.
3. Постпереходные металлы
Висмут в виде синтетических кристалловПримеры: алюминий, галлий, олово, свинец, таллий, индий, висмут.
Постпереходные металлы в периодической таблице — это элементы, расположенные справа от переходных металлов и слева от металлоидов. Из-за своих свойств они также называются «бедными» или «другими» металлами.
Физически они хрупки (или мягки) и имеют более низкую температуру плавления и механическую прочность, чем переходные металлы. Их кристаллическая структура довольно сложна: они проявляют ковалентные или направленные эффекты связи.
Различные металлы этого семейства имеют различное применение. Алюминий, например, используется для изготовления оконных рам, кухонной посуды, банок, фольги, деталей автомобилей. Оловянные сплавы используются в мягких припоях, оловянных и сверхпроводящих магнитах.
Индиевые сплавы используются для изготовления плоских дисплеев и сенсорных экранов, а галлий — в топливных элементах и полупроводниках.
2. Лантаноиды
1-сантиметровый кусок чистого лантанаПримеры: лантан, церий, прометий, гадолиний, тербий, иттербий, лютеций.
Лантаноиды — это редкоземельные металлы с атомными номерами от 57 до 71. Впервые они были обнаружены в 1787 году в необычном черном минерале (гадолините), обнаруженном в Иттербю, Швеция. Позже минерал был разделен на различные элементы лантаноидов.
Лантаноиды — это металлы с высокой плотностью, плотность которых колеблется от 6,1 до 9,8 г/см³, и они, как правило, имеют очень высокие температуры кипения (1200-3500 °C) и очень высокие температуры плавления (800-1600 °C).
Сплавы лантаноидов используются в металлургии из-за их сильных восстановительных способностей. Около 15 000 тонн лантаноидов ежегодно расходуется в качестве катализаторов и при производстве стекол. Они также широко используются в лазерах и оптических усилителях.
Некоторые исследования показывают, что лантаноиды могут быть использованы в качестве противораковых средств. Лантан и церий, в частности, могут подавлять пролиферацию раковых клеток и способствовать цитотоксичности.
1. Актиниды
Металлический уран, высокообогащенный ураном-235Примеры: актиний, уран, торий, плутоний, фермий, нобелий, лоренций
Подобно лантаноидам, актиниды образуют семейство редкоземельных элементов с аналогичными свойствами. Они представляют собой серию из 15 последовательных химических элементов в периодической системе от атомных номеров 89 до 103.
Они представляют собой серию из 15 последовательных химических элементов в периодической системе от атомных номеров 89 до 103.
Все они радиоактивны по своей природе. Синтетически произведенный плутоний, а также природные уран и торий являются наиболее распространенными актинидами на Земле. Первым актинидом, который был открыт в 1789 году, был уран. И большая часть существующих продуктов актинидов была произведена в 20 веке.
Их свойства, такие как излучение радиоактивности, пирофорность, токсичность и ядерная критичность, делают их опасными для обращения. Сегодня значительная часть (кратковременных) актинидов производится ускорителями частиц в исследовательских целях.
Некоторые актиниды нашли применение в повседневной жизни, например, газовые баллоны (торий) и детекторы дыма (америций), большинство из них используются в качестве топлива в ядерных реакторах и для изготовления ядерного оружия. Уран-235 является наиболее важным изотопом для применения в ядерной энергетике, который широко используется в тепловых реакторах.
Химия меди
Химия меди ИсторияИнформация о история меди доступен в Медном Development Association, Inc., где они отмечают, что:
«В течение почти 5000 лет медь была единственным металлом, известным человеку. Сегодня это один из наиболее часто используемых и повторно используемых наших современных металлы ».
Люди впервые использовали медь около 10 000 лет назад. кулон, обнаруженный в Северном Ираке, считается датируемым около 8700 г. до н.э.Доисторический человек, вероятно, использовал медь для оружия изготовление. Древние египтяне, похоже, тоже ценили коррозионная стойкость металла. Они использовали медные ленты и гвозди в судостроении и медные трубы использовались для передачи вода. Некоторые из этих артефактов сохранились до наших дней в хорошем состоянии. Оценка общего объема производства меди в Египте за 1500 лет составляет 10 000 тонн.
Спустя годы появились медные сплавы. Бронзы (медно-оловянные сплавы) возникла сначала, а гораздо позже появилась латунь (медно-цинковая сплавы).
 «Бронзовый век» видел широкое использование меди и
бронза для оружия, монет, домашней утвари, мебели и др.
Предметы. Самый ранний известный пример использования латуни — римская монета.
чеканили во время правления Августа 27 г. до н.э. — 14 г. н.э.
сыграли важную роль в появлении электричества и сегодня
по-прежнему остается одним из наших самых ценных материалов.
«Бронзовый век» видел широкое использование меди и
бронза для оружия, монет, домашней утвари, мебели и др.
Предметы. Самый ранний известный пример использования латуни — римская монета.
чеканили во время правления Августа 27 г. до н.э. — 14 г. н.э.
сыграли важную роль в появлении электричества и сегодня
по-прежнему остается одним из наших самых ценных материалов.Использование соединений меди также восходит к 4000 г. до н.э. Например, сульфат меди был особенно важным соединением. в ранние времена.Древние египтяне использовали его как протраву в своих процесс окрашивания. Соединение также использовалось для изготовления мазей и другие подобные препараты. Позже лекарственное использование медного купороса появился с его рецептом от легочных заболеваний. Медь сульфат по-прежнему широко используется и не имеет вредных побочных эффектов Сообщалось о эффектах его предписанного использования .
Происхождение
Медь является самым распространенным элементом Земли 25 -й , но
один из менее распространенных переходных металлов первого ряда. Это происходит как
мягкий красноватый металл, который можно найти как большие валуны
весом несколько сотен тонн или в виде сульфидных руд. Последние
сложные смеси меди, железа и серы в сочетании с
другие металлы, такие как мышьяк, цинк и серебро. Медь
концентрация в таких рудах обычно составляет 0,5-2%.
Это происходит как
мягкий красноватый металл, который можно найти как большие валуны
весом несколько сотен тонн или в виде сульфидных руд. Последние
сложные смеси меди, железа и серы в сочетании с
другие металлы, такие как мышьяк, цинк и серебро. Медь
концентрация в таких рудах обычно составляет 0,5-2%.
Самая распространенная руда — халькопирит, CuFeS 2 , латунь. желтая руда, на долю которой приходится примерно 50% мировых месторождения меди.Множество других медных руд разного цвета и композиции существуют. Примеры — малахит, Cu 2 CO 3 (OH) 2 , руда ярко-зеленая, и краснорудный куприт, Cu 2 O.
Международный центр экологических и ядерных наук (ICENS)
имеет постоянную программу составления карт геохимического содержания Ямайки. «Геохимический атлас Ямайки» был опубликован в 1995 г. и доступен на Amazon или ICENS.
Результаты, полученные для меди, показаны ниже (любезно предоставлено профессором Г. К. Лалором).
К. Лалором).
Красный пигмент в мягкоклювый T (o) uraco Bird содержит медно-порфириновый комплекс.Пигмент сильно водный растворим в щелочных условиях и был сообщается в 1952 г. что в результате попыток смотрителей зоопарка помыть птицу вода становится окрашенным в красный цвет.
T (o) uracos считаются единственными птицами, обладающими истинно красным и зеленым окрасом. Обычно цвет, который вы воспринимаете, наблюдая за птицами, обусловлен отражениями. производится структурой пера. Красный и зеленый пигменты (турацин и тураковердин) обнаруженные в перьях T (o) uraco, оба содержат медь.
Свойства меди
Отличный сайт для определения свойств элементов, в том числе медь —
Еще одна полезная ссылка на
Страницы проекта геологии
в Univ. Невады, Рино.
Невады, Рино.
Добыча меди
Медь извлекается из руды двумя основными способами:
- Пирометаллургическим методом
- Гидрометаллургический метод
Этот метод часто используется при добыче сульфидных руд.Выделяют четыре основных этапа:
- Mining and Milling
- Руда измельчается и измельчается в порошок.
обычно содержит менее 1% меди.
Минералы концентрируются в суспензии около 15%. медь.
Медные минералы отделяются от бесполезного материала путем флотации. с использованием пенообразующих растворов. - Плавка
- Выплавка медного концентрата и извлечение теплом, потоком и добавлением кислорода.Сера, железо и прочее удаляются нежелательные элементы и товар называется черновая медь.
- Нефтепереработка
- Это заключительный этап процесса
получение меди высокого качества.
 Методы огневого и электрорафинирования
используются методы. Последний производит медь высокой чистоты.
подходит для электрического использования.
Методы огневого и электрорафинирования
используются методы. Последний производит медь высокой чистоты.
подходит для электрического использования.
Гидрометаллургический метод -SX / EW
Экстракция растворителем / электрохимическое извлечение является наиболее распространенным выщелачиванием процесс, используемый сегодня для восстановления меди из химических решения.Как следует из названия, метод включает два основных Этапы:
Экстракция растворителем — процесс выщелачивания ионов меди или иным образом извлеченные из сырой руды с использованием химических агенты.
Электролиз — электролиз раствора, содержащего ионы металлов так, что ионы Cu внутри него наносятся на катод и после этого удаляется в элементарной форме.
Процесс проходит в следующие этапы:
- Выщелачивающий раствор (выщелачивающий раствор) выбирается для использования в
выщелачивание ионов Cu из руды.Обычные реагенты — слабые кислоты
например H 2 SO 4 , H 2 SO 4 +
Fe 2 (SO 4 ) 3 , хлорид кислоты
решения например FeCl 2 , хлорид аммония и аммоний
солевые составы.

- При нанесении на руду выбранный выщелачивающий агент растворяет ионы меди, присутствующие в выщелачивающем продукте, называемом «беременным» выщелачивающий раствор ».
- Затем выбирается органический экстрагент для удаления ионов Cu из водный раствор.Предпочтительные органические экстрагенты состоят из гидроксифенилоксимы, имеющие основную химическую формулу:
- C 6 H 3 (R) (OH) CNOHR *, R = C 9 H 19 или C 12 H 25 и R * = H, CH 3 или C 6 H 5
| Структура 5-нонилсалицилальдоксима |
Примерами таких экстрагентов являются 5-нонилсалицилальдоксим и смесь этого соединения и 2-гидрокси-5-нонилацетофенона оксим.Коммерчески доступные реагенты обычно содержат 5-10% оксима в 90-95% нефтяном разбавителе, таком как керосин.
Перед смешиванием с выщелачивающим средством экстрагент будет
содержат мало или совсем не содержат меди и на этой стадии называют
«бесплодный органический экстрагент».
- Ионы меди переносятся из выщелачивающего раствора в органический экстрагент при смешивании двух реагентов. Фаза разделение происходит с образованием водной и органической фаз названы соответственно первой водной и первой органической фазами.Первая водная фаза, «рафинат», представляет собой выщелачивающий агент. лишенный ионов меди, в то время как первая органическая фаза представляет собой «насыщенный органический экстрагент», т.е. экстрагент с ионами меди подарок.
- Рафинат возвращается на площадку для выщелачивания, в то время как
загруженный органический экстрагент смешивается с раствором электролита
называется «обедненный электролит» (т.е. не содержащий меди).
Типичные электролиты — это кислотные растворы, такие как серная кислота,
Н 2 СО 4 .Ионы меди, присутствовавшие в
таким образом органический экстрагент растворяется в растворе электролита
чтобы получить медь, содержащую «богатый электролит». Здесь снова там
это фазовое разделение.
 Вторая органическая фаза — бесплодная
органический экстрагент, тогда как вторая водная фаза представляет собой «богатую
электролит ». Бесплодный органический экстрагент затем рециркулируют для
повторное использование в приложении к выщелачиванию.
Вторая органическая фаза — бесплодная
органический экстрагент, тогда как вторая водная фаза представляет собой «богатую
электролит ». Бесплодный органический экстрагент затем рециркулируют для
повторное использование в приложении к выщелачиванию. - Заключительный этап процесса — электролиз
кислотный раствор иона металлов.В результате растворенные ионы меди
осаждаются на катоде, и элементарная медь удаляется.
На этом процесс восстановления завершен.
Примечание о примесях
Присутствие взвешенных загрязняющих веществ в системе SX / EW может значительно снижают эффективность его работы. Такие загрязняющие вещества могут попадать в систему из руды или из окрестностей. Система подвержена загрязнению от дождя, ветра и других факторов окружающей среды с первого защитный сосуд, в котором хранится выщелачивающий продукт, обычно открыты и расположены на открытом воздухе.Таким образом, твердые отходы в форма грязи, песка, каменной пыли, растительных веществ, минеральных остатков и взвешенные твердые частицы часто попадают в систему в на ранних стадиях и сохраняется на последующих стадиях процесс.
Воздействие этих загрязняющих веществ является значительным и включают:
- увеличенное время разделения фаз на стадиях, когда органические и смешиваются водные растворители.
- Отсутствие полного разделения фаз после экстракции,
это приводит к потере дорогостоящего органического экстрагента, поскольку многие его остается в водном растворе. - снижение КПД по току и уменьшение чистота плакированного медного продукта при электролизе этап.
Использование меди и ее соединений
Медь на протяжении веков уступала только железу по полезности. Металл и его соединения используются во всех сферах жизни от электротехническая, лекарственная и сельскохозяйственная.
Использование металлической меди
Электротехническая промышленность является бенефициаром большинства стран мира. выпуск меди.Металл используется в производстве электрических такие аппараты, как катоды и провода.
Другое применение:
— Кровля
-Посуда
-Монеты
-Металл работы
-Сантехника
Змеевики холодильника и кондиционера
-Сплавы напр. бронза, латунь
Применение соединений меди
Соединения меди находят наиболее широкое применение в сельском хозяйстве. С момента открытия их токсичности для некоторых насекомых, грибки и водоросли эти соединения использовались в инсектицидах, фунгициды и предотвратить развитие водорослей в питьевой воде водохранилища.Поэтому они используются для борьбы с животными и болезни растений. Удобрения также часто дополняют соединения меди, например сульфат меди, чтобы увеличить почву плодородие и, следовательно, рост урожая.
Соединения меди также используются в фотографии и в качестве красителей. для стекла и фарфора.
Медь для хорошего здоровья
Медь — один из многих микроэлементов, необходимых для хорошего здоровья. Это входит в простетические группы многих белков и ферментов и таким образом, необходим для их правильного функционирования.Поскольку тело может не синтезирует медь, ее необходимо принимать с пищей. Орехи, семена, злаки, мясо (например, печень) и рыба — хорошие источники медь.
Медь нашла применение и в медицине. Он использовался с самого начала раз при лечении ран груди и очистке воды. Это недавно было высказано предположение, что медь помогает предотвратить воспаление, связанное с артритом и такими заболеваниями. Продолжаются исследования лекарств, содержащих медь, для лечения этого и других условий.
Для получения дополнительной информации о важности меди для здоровья и дефицит меди см .: МатьПрирода и / или исследования витаминов Продукция
Соединения меди
Медь содержит множество соединений, многие из которых цветные. Две основные степени окисления меди — +1 и +2, хотя известны некоторые +3 комплексы. Соединения меди (I) являются ожидается, что они диамагнитны по природе и обычно бесцветны, кроме случаев, когда цвет возникает в результате переноса заряда или анион.Ион +1 имеет тетраэдрическую или квадратную плоскую геометрию. В твердые соединения, медь (I) часто является более стабильным состоянием при умеренные температуры.
Ион меди (II) обычно является более стабильным состоянием в водной среде. решения. Соединения этого иона, часто называемые соединениями меди, обычно окрашены. На них влияет Искажения Яна Теллера и демонстрируют широкий спектр стереохимии с Преобладают четыре, пять и шесть координационных соединений. +2 ion часто демонстрирует искаженную тетраэдрическую геометрию.
Галогениды меди
Известно, что все галогениды меди (I) существуют, хотя фторид в чистом виде пока не получен. Медь хлориды, бромиды и йодиды бесцветны, диамагнитны соединения. Они кристаллизуются при обычных температурах с структура цинковой обманки, в которой атомы Cu тетраэдрически связаны до четырех галогенов. Хлорид и бромид меди (I) представляют собой производится кипячением кислого раствора ионов меди (II) в избыток меди.При разбавлении белый CuCl или бледно-желтый CuBr производится. Добавление растворимого йодида к водной раствор ионов меди (II) приводит к образованию осадок иодида меди (I), который быстро разлагается до Cu (I) и йод.
Галогениды меди (I) плохо растворимы в воде и большей части медь в водном растворе находится в состоянии Cu (II). Даже так, плохая растворимость соединений меди (I) увеличивается при добавление галогенид-ионов.В таблице ниже показаны некоторые свойства галогениды меди (I).
| Формула | Цвет | МП | БП | Структура |
|---|---|---|---|---|
| CuCl | белый | 430 | 1359 | – |
| CuBr | белый | 483 | 1345 | – |
| CuI | белый | 588 | 1293 | Цинковая обманка |
Приготовлен восстановлением CuX 2 -> CuX;
за исключением F, который не был получен в чистом виде.
| Формула | Цвет | МП | БП | м (БМ) | Структура |
|---|---|---|---|---|---|
| CuF 2 | белый | 950 разложить | – | 1,5 | |
| CuCl 2 | коричневый | 632 | 993разложить | 1.75 | CdCl 2 |
| CuBr 2 | черный | 498 | – | 1,3 |
Известны все четыре галогенида меди (II), хотя йодид меди быстро разлагается до йодида меди и йода. Желтый хлорид меди (II) и почти черный бромид меди (II) являются общие галогениды. Эти соединения принимают структуру с бесконечные параллельные полосы квадрата CuX 4 ед.Куприк хлориды и бромиды хорошо растворимы в воде и донорном растворители, такие как ацетон, спирт и пиридин.
Галогениды меди (II) являются умеренными окислителями из-за Пара Cu (I) / Cu (II). В воде, где потенциал в значительной степени аква-комплексов, здесь не так много разница между ними, но в неводных средах окислительные (галогенирующая) мощность увеличивается последовательно; CuF 2 << CuCl 2 << CuBr 2 .
Их можно получить прямой реакцией с соответствующими
галогены:
Cu + F 2 → CuF 2 ;В качестве альтернативы они могут быть получены из CuX 2 .aq путем нагрев -> CuX 2
Cu + Cl 2 /450 C → CuCl 2 ;
Cu + Br 2 → CuBr 2
Оксиды меди
Оксиды меди (I) более стабильны, чем оксиды меди (II) при высокие температуры.Оксид меди (I) является самородным как красный куприт. В лаборатории снижение Решение Фелинга с редуцирующим сахаром, таким как глюкоза, образует красный осадок. Тест достаточно чувствителен, чтобы произвести даже 1 мг сахара. характерный красный цвет соединения. Закись меди может также может быть приготовлен в виде желтого порошка путем контролируемого восстановления щелочная соль меди (II) с гидразином. Термическое разложение оксид меди (II) также дает оксид меди (I), поскольку последний имеет большая термическая стабильность.Таким же способом можно приготовить соединение из нитрата, карбоната меди (II) и гидроксид.
Оксид меди (II) встречается в природе в виде тенорита. Этот черный кристаллическое твердое вещество может быть получено пиролизом нитратные, гидроксидные или карбонатные соли. Он также образуется при порошковая медь нагревается на воздухе или в кислороде. В таблице ниже показаны некоторые характеристики оксидов меди.
| Формула | Цвет | Состояние окисления | МП |
|---|---|---|---|
| CuO | черный | Cu 2+ | 1026 разложить |
| Cu 2 O | красный | Cu + | 1230 |
Редокс-химия меди
Cu 2+ + e- → Cu + E = 0.15 В
Cu + + e- → Cu E = 0,52 В
Cu 2+ + 2e- → Cu E = 0,34 В
При рассмотрении этих данных будет видно, что любой окислитель достаточно силен, чтобы скрыть Cu в Cu + более чем достаточно силен, чтобы преобразовать Cu + в Cu 2+ (0,52 ср. 0,14 В). Нет, это не так поэтому ожидается, что любые стабильные соли Cu + будут существовать в водный раствор.
Также может происходить диспропорционирование:
2Cu + → Cu 2+ + Cu E = 0.37 В или К = 10 6Координационные комплексы
Реакция EDTA 4- с медью (II) дает комплекс
где EDTA оказалась пентадентной НЕ гексадентной, в отличие от
другие ионы M (II).
Cu (ЭДТА) 2-
Структура иона [Cu (ox) 2 ] 2- может быть описана как плоский квадрат или как искаженный октаэдр, когда упаковка в кристаллическая решетка.В случае натриевой соли отдельные блоки параллельны в ячейке с медью связаны с кислородом, координированным с медью в единицы, сидящие как сверху, так и снизу, тогда как в калийная соль, единицы не параллельны и если смотреть на три единиц центральный почти под прямым углом к двум другим. Здесь медь связана с одним из некоординированных атомов кислорода. в блоках над и под ним.
Na + и K + соли [Cu (ox) 2 ] 2-
Cu (OH) 2 реагирует с NH 3 с образованием раствора который будет растворять целлюлозу.Это эксплуатируется в промышленная подготовка района. Решения содержат тетраммины и пентаммины. С пиридином только тетрамины являются образуется, например, Cu (py) 4 SO 4 .
Взаимодействие меди (II) с аминокислотами широко изучено. Почти во всех случаях продукт содержит группы из trans конфигурация, которая, как ожидается, будет более стабильной. В случае глицина, первым осажденным продуктом всегда является изомер цис- который преобразуется в транс- при нагреве.Увидеть Лабораторное руководство для C31L Больше подробностей.
Аналитическое определение меди (II)
Полезный реагент для аналитического определения
Ион меди (II) представляет собой натриевую соль N, N-диэтилдитиокарбамата.
В разбавленных спиртовых растворах наличие следов
Cu 2+ обозначен желтым цветом, который может быть
измеряется спектрофотометром, а концентрация определяется
из сюжета Закона Пива.Комплекс
Cu (Et 2 dtc) 2 , который можно выделить как
коричневое твердое вещество.
Cu (Et 2 dtc) 2
«Комплексы и переходные элементы первого ряда», Д. Николлс
«Основы неорганической химии», Ф.А. Коттон, Г. Уилкинсон и П.Л. Gaus
«Продвинутая неорганическая химия», Ф.А. Коттон, Дж. Уилкинсон, К.А. Мурильо и М. Бохманн
«Химия элементов», Гринвуд и Эрншоу
вернуться на курс CHEM2101 (C21J) наброски
Вернуться в химию, UWI-Mona, Домашняя страница
Авторские права © 2000-2020 Роберт Джон Ланкашир, все права защищены.
Создано и поддерживается профессором Робертом Дж. Ланкашир(с благодарностью Клиффа Райли и Джоди-Энн Сваби),
Кафедра химии Вест-Индского университета,
Кампус Мона, Кингстон 7, Ямайка.
Дата создания: июнь 2000 г. Ссылки проверены и / или последние изменен 28 сентября 2020 г.
URL http://wwwchem.uwimona.edu.jm/courses/copper.html
WebElements Periodic Table »Медь» реакции элементов
Ni Cu Zn Pd Ag Cd - Актиний ☢
- Алюминий
- Алюминий
- Америций ☢
- Сурьма
- Аргон
- Мышьяк
- Астатин ☢
- Барий
- Берклий ☢
- Бериллий
- Висмут
- Бориум ☢
- Бор
- Бром
- Кадмий
- Цезий
- Кальций
- Калифорний ☢
- Углерод
- Церий
- Цезий
- Хлор
- Хром
- Кобальт
- Copernicium ☢
- Медь
- Кюрий ☢
- Дармштадтиум ☢
- Дубний ☢
- Диспрозий
- Эйнштейний ☢
- Эрбий
- Европий
- Фермий ☢
- Флеровий ☢
- фтор
- Франций
- Гадолиний
- Галлий
- Германий
- Золото
- Гафний
- Калий ☢
- Гелий
- Гольмий
- Водород
- Индий
- Йод
- Иридий
- Утюг
- Криптон
- Лантан
- Лоуренсий ☢
- Свинец
- Литий
- Ливерморий ☢
- Лютеций
- Магний
- Марганец
- Мейтнерий ☢
- Менделевий ☢
- Меркурий
- молибден
- Московский ☢
- Неодим
- Неон
- Нептуний
- Никель
- Нихоний ☢
- Ниобий
- Азот
- Нобелий
- Оганессон ☢
- Осмий
- Кислород
- Палладий
- фосфор
- Платина
- Плутоний ☢
- полоний
- Калий
- празеодим
- Прометий ☢
- Протактиний ☢
- Радий ☢
- Радон ☢
- Рений
- Родий
- Рентгений ☢
- Рубидий
- Рутений
- Резерфорд ☢
- Самарий
- Скандий
- Сиборгий ☢
- Селен
- Кремний
- Серебро
НЕКОТОРЫЕ ФАКТЫ О ХИМИИ
ХИМИЯ
1
ВВЕДЕНИЕ
Химия — это наука о материалах, их свойствах и трансформациях, которым они подвергаются.Таким образом, химия — это изучение состава и свойств материи, их изменений, условий, в которых происходят такие изменения, и сопровождающих их изменений энергии.
Химия изучает природу огня и структуру воды, она имеет дело с цветами, катализом и кристаллической структурой, с физическими свойствами и химической реакционной способностью.
Химия — одна из фундаментальных наук. Он играет важную роль в развитии биохимии, физики, геологии и многих других областей науки.Зарождение химии восходит к глубокой древности, с производства бронзы, железа, керамики, стекла.
Теперь все понимают важность химии. Будущее химии практически безгранично. Быстрое развитие химической промышленности позволит создать много новых товаров, машин, пластиков, полимеров; это поможет понять многие новые явления.
Изучая химию, вы узнаете много нового о веществах, соединениях, материалах, химических и физических изменениях, химических свойствах, реакциях и многих других интересных и важных вещах.Напомним, что:
1. Химия — это изучение веществ, их структуры, свойств и реакций.
2. Материя существует в виде твердых тел, жидкостей или газов.
3. Однородный материал — это материал с одинаковыми свойствами.
4. Неоднородный материал — это материал, состоящий из частей с разными свойствами.
5. Соединение — это вещество, которое может разлагаться на два или более веществ.
6. Вещество — это однородное вещество с определенным химическим составом.
7. Химические реакции — это процессы, при которых одни вещества превращаются в другие вещества.
8. Сплав — это металлический материал, содержащий два или более элементов.
Запоминающихся слов:
для работы с разнородными
пройти химический состав
origin для преобразования
Быстрый сплав
соединение, содержащее
однородный
2
НЕКОТОРЫЕ ФАКТЫ О ХИМИИ
Химическая наука занимается веществами.Химия — это исследование и обсуждение свойств веществ.
Общие примеры веществ: вода, сахар, соль, медь, железо и многие другие.
Химики изучают вещества, чтобы узнать как можно больше об их свойствах и реакциях, которые превращают их в другие вещества. Эти знания очень важны, так как они могут сделать мир лучше для жизни, сделать людей счастливее и повысить их уровень жизни.
Химики открыли множество законов, исследовали многие важные явления в жизни. Они произвели много искусственных веществ, обладающих ценными свойствами.
У химии два основных аспекта: описательная химия, открытие химических фактов, и теоретическая химия, формулировка теорий.
Широкую область химии можно разделить и другими способами. Важным разделом химии является органическая химия и неорганическая химия.
Органическая химия — это химия соединений углерода, которые встречаются в растениях и животных.
Неорганическая химия — это химия соединений других элементов, кроме углерода. Обе эти области химии являются частично описательными, а частично теоретическими.
Аналитическая химия занимается методами разделения. Синтетическая химия занимается методами, с помощью которых сложные тела могут быть построены из более простых веществ.Физическая химия занимается изменениями состояния и движениями молекул. Но в настоящее время ученые не придерживаются этого определения.
Открытие рентгеновских лучей, электрона и радиоактивности ознаменовало новую эру во всех науках и в химии. Это было очень важное открытие в науке. Он играет важную роль в развитии геологии и физиологии, технологий и инженерии.
Химия занимается медициной и сельским хозяйством, поскольку все они связаны со свойствами и изменениями химических веществ.
Запоминающихся слов:
следственное отделение
для движения
явлений, которые необходимо учитывать
соединения искусственного углерода
отдел
3
НЕКОТОРЫЕ ФАКТЫ ОБ АТОМАХ (I)
Об атоме можно говорить как о самой маленькой частице любого вещества.Если атомы нельзя увидеть, это не обязательно означает, что их не существует. Это означает, что любая частица, если она присутствует, должна быть очень маленькой. Существуют методы, с помощью которых можно определить размеры атомов и их расположение в молекулах. Один из этих методов использует дифракцию рентгеновских лучей.
Результаты ряда исследований показывают, что когда атомы находятся в контакте с другими атомами в молекулах, их радиус достигает 0,1 м (0,1 нм).
Некоторое представление о том, насколько малы атомы, можно получить, представив один миллион атомов меди на радиус = 0,13 м (0,13 нм).Если эти атомы меди уложены один поверх другого, высота стопки будет достигать точки в конце этого предложения.
В ходе многих исследований химики пришли к выводу, что все атомы различных элементов состоят по существу из трех простых типов единиц, которые назывались протонами, нейтронами и электронами.
Следующая диаграмма показывает нам составные части атомов. Атомы содержат следующие структурные единицы:
Электронов Протонов Нейтронов
Заряд 1, Заряд +1, Нулевой заряд,
очень малая относительная масса 1 относительная масса 1
масса
Примечания к тексту:
точка — в процессе -,
Запоминающихся слов:
частиц с помощью
необходимое расположение
означает вывод
для обозначения составляющей
чрезвычайно заряжен
4
НЕКОТОРЫЕ ФАКТЫ ОБ АТОМАХ (II)
Расположение и номера этих структурных единиц в атоме показаны ниже:
Электроны заполняют пространство вокруг ядра.Количество электронов = атомный номер. Очень маленькое ядро. Количество протонов = атомный номер. Число протонов + Число нейтронов = Относительная масса атома.
Число электронов, протонов и нейтронов в атоме элемента можно вычислить, если известны атомный номер и относительная атомная масса элемента:
Число электронов + Число протонов = атомный номер элемента.
Число протонов + Число нейтронов = Относительная атомная масса элемента.
Было также обнаружено, что многие элементы и соединения состоят из небольшого числа атомов, которые удерживаются вместе в регулярном порядке. Эти группы атомов называются молекулами. Газообразный водород, например, состоит из пар атомов водорода, каждая пара называется молекулой, а ее формула h3.
Другой пример — двуокись углерода, состоящая из молекул, формула CO2.
Запоминающихся слов:
место будет состоять из
ядро водорода
относительный диоксид углерода
рассчитать
Примечание к тексту:
обычное размещение —
5
АТОМНАЯ МОДЕЛЬ
Электрон, протон и нейтрон собираются вместе в то, что можно назвать атомом.
Наша концепция атома возникла в результате серии наблюдений. В результате этих наблюдений мы теперь считаем, что атом состоит из облака электронов, которое вращается вокруг центрального ядра, состоящего из протонов или протонов и нейтронов. Повторные эксперименты, упомянутые выше, показывают, что каждый атом имеет одинаковое количество электронов и протонов. Положительно заряженные протоны образуют ядро атома и уравновешивают положительные заряды протонов в ядре атома.Нейтроны также находятся в ядре атома. Нейтроны также находятся в ядре атома.
Об атоме уже говорилось как о наименьшей единице элемента. Известно, что девяносто два элемента встречаются в природе, а ряд других был создан человеком в лаборатории. Каждый элемент представляет собой особую комбинацию протонов, нейтронов и электронов. Каждый элемент идентифицируется по количеству протонов в его ядре и обозначается именем и символом.
Элемент номер 1 представляет собой комбинацию одного протона и одного электрона. Задолго до того, как была известна его атомная структура, этот элемент назывался водородом, или «водообразователем», потому что вода образуется, когда водород горит на воздухе. Его символ — H. Водород занимает первое место в списке элементов, потому что в его ядре находится один протон. За элементом 1 следует элемент номер 2. Он состоит из двух протонов и двух электронов. Он был назван гелием с символом He.
Запоминающихся слов:
концепция для идентификации
вращается для обозначения
Ядродля обозначения
а также сжечь
до возникновения остатка
6
Дата: 03.01.2016; вид: 1974
Frontiers | Торговля медью в растениях и ее влияние на динамику клеточной стенки
Минеральный гомеостаз растений
Для метаболизма растений требуется не только свет, но также вода и определенные элементы для роста и развития.На протяжении эволюции у растений развились специализированные структуры и функции, обеспечивающие эффективный доступ к этим элементам и их сбалансированное распределение в организме. Семнадцать элементов считаются необходимыми для всех сосудистых растений, сгруппированных в два основных класса в зависимости от того, являются ли они необходимыми при низких концентрациях (обычно ниже 100 мг / кг DW), микронутриентов или если требуемые концентрации выше (более 1000 мг / кг DW), макроэлементы. Появилась группа специфических, но относительно хорошо сохраняемых транспортеров, каналов и насосов, позволяющая растениям регулировать способность к поглощению, перемещению и распределению минералов в ответ на колебания окружающей среды.Такой минеральный транспорт включает в себя различные механизмы, основанные на белках, включая членов регулируемых цинком транспортеров (ZRT), семейства регулируемых железом транспортеров (IRT)-подобных белков (ZIP), белков АТФаз тяжелых металлов (HMA) из семейства P 1B семейство АТФаз -типа и члены семейства катионов-посредников (CDF) или переносчиков, подобных желтой полосе (YSL).
Появление Cu в окружающей среде
Естественное содержание меди в земной коре составляет 60 мг / кг.В Европе средние фоновые концентрации Cu в почвах колеблются от 11,4 до 17 мг Cu / кг (Alloway, 2013). Рекомендуемое потребление меди для людей обычно составляет от 0,2 мг / день на человека для младенцев до 1,3 мг / день на человека для женщин в период лактации (Trumbo et al., 2001). Хотя потребности человека в Cu невысоки, дефицит Cu может возникать из-за его низкой концентрации в съедобных тканях растений, особенно когда растения выращивают на известковых или щелочных почвах в засушливых и полузасушливых средах (White and Broadley, 2009).Повышение фитодоступности Cu за счет модуляции молекулярных и физиологических процессов, участвующих в поглощении, распределении и накоплении Cu, впоследствии было интегрировано в программы биофортификации (White and Broadley, 2009). Напротив, использование Cu в качестве фунгицида широко используется в сельском хозяйстве с конца 19 века (Alloway, 2013). В виноградарстве фунгициды на основе Cu используются при типичных применениях 2–4 кг Cu / га / год, что приводит к концентрации Cu в почве, которая может достигать значений выше 3000 мг Cu / кг почвы, тем самым превышая допустимый диапазон концентраций для большинство возделываемых культур и тем самым препятствует их росту (Alloway, 2013).
Роль Cu в биологии растений
Рост фотосинтезирующих организмов на Земле привел к постепенному накоплению кислорода в окружающей среде. Эта окислительная атмосфера привела к снижению растворимости железа за счет образования оксидов железа и к постепенному высвобождению растворимой меди (II) из нерастворимых солей сульфида меди (Burkhead et al., 2009). С тех пор железо в биологических молекулах постепенно заменяется Cu, способным выполнять аналогичные функции.Это объясняет, почему многие Cu-белки имеют функциональный аналог, который использует Fe в качестве кофактора, и почему рост на субстрате с токсичным уровнем Cu обычно связан со снижением содержания Fe в корнях и листьях (Pätsikkä et al., 2002; Burkhead et al. др., 2009; Festa, Thiele, 2011). Следовательно, фенотипы растений, связанные с токсичностью Cu, имеют общие черты с фенотипами, связанными с дефицитом железа, например наличие хлороза листьев, снижение содержания хлорофилла в листьях и усиление окислительного стресса (Pätsikkä et al., 2002). Напротив, у растений с дефицитом меди появляются хлоротические симптомы, которые сначала появляются на кончиках молодых листьев, а затем образуются некротические поражения. У растений, выращенных в условиях дефицита Cu, также наблюдается нарушение фотосинтетической транспортной цепи и снижение нефотохимического тушения, что согласуется с отсутствием функции пластоцианина (PC) (Abdel-Ghany and Pilon, 2008).
В физиологических условиях переходный металл Cu присутствует в двух обычных формах: восстановленном состоянии Cu (I) и окисленном состоянии Cu (II).В зависимости от этого состояния Cu может связывать разные субстраты. В своей восстановленной форме Cu (I) предпочтительно связывает серосодержащие соединения, имеющие тиольную или тиоэфирную группу, тогда как окисленная форма Cu (II) координируется в основном с кислородными или имидазольными азотными группами (Cohu and Pilon, 2010). Эта двойная химия Cu позволяет ей взаимодействовать с широким кругом молекул, в частности с белками, для запуска биохимических реакций или стабилизации структурных особенностей (Festa and Thiele, 2011). Однако, будучи окислительно-восстановительной активностью, свободная Cu может напрямую привести к образованию активных форм кислорода (ROS) посредством химии Фентона, тем самым вызывая повреждение белков, ДНК и других биомолекул (Hänsch and Mendel, 2009).
В живых организмах основными функциями Cu являются транспорт электронов в митохондриях и хлоропластах (наиболее распространенным белком Cu является пластоцианин, белок, связанный с фотосинтезом, участвующий в переносе электронов от цитохрома f к P700 +), контроль окислительно-восстановительное состояние клеток (основным Cu-связывающим белком является супероксиддисмутаза Cu / Zn), а также ремоделирование клеточной стенки (Cohu and Pilon, 2010).
Гомеостаз меди опосредован Регламентом SPL7
Наибольший прогресс в понимании регуляции гомеостаза Cu был достигнут в результате исследований, в которых растения были подвержены дефициту Cu.В фотосинтезирующих организмах депривация Cu вызывает каскад реакций, направленных на строгую экономию использования Cu, чтобы оптимизировать его доставку к наиболее важным клеточным процессам.
Гомеостаз меди в основном регулируется центральным гомеостатическим механизмом Cu, который включает Cu-чувствительный фактор транскрипции SPL7 (для SQUAMOSA промотор-связывающий белок-подобный протеину), принадлежащий к семейству SQUAMOSA промотор-связывающих белков (SBP). SPL7 является функциональным гомологом регулятора 1 ответа Cu (CRR1), являясь аналогичным фактором транскрипции SBP-домена, участвующим в передаче сигналов Cu у Chlamydomonas reinhardtii. SBP-домены представляют собой высококонсервативные ДНК-связывающие домены, способные распознавать сайт TNCGTACAA и, более конкретно, коровую последовательность GTAC (рис. 1). SBP-домен содержит две структуры, похожие на цинковые пальцы (ZF1 и ZF2), причем каждый ион Zn координирован четырьмя остатками Cys или His (Yamasaki et al., 2004; Kropat et al., 2005; Sommer et al., 2010). . Связывание Zn (II) с ZF1 необходимо для правильной укладки домена SBP, тогда как связывание Zn (II) с ZF2 обеспечивает высокое сродство к связыванию ДНК (Sommer et al., 2010). В C. reinhardtii высокие концентрации Cu устраняют высокоаффинное связывание SBP ДНК за счет специфического взаимодействия с двумя остатками His (Sommer et al., 2010). У растений до сих пор отсутствуют доказательства прямого взаимодействия между SPL7 и Cu. Однако была выдвинута гипотеза, что в присутствии достаточного количества Cu SPL7 может связывать Cu, взаимодействуя со специфическими Cu-комплексами, что приводит к неспособности SPL7 связывать мотив GTAC в промоторе генов-мишеней (Garcia-Molina et al. ., 2014б). Этот важный аспект SPL7-регуляции Cu-гомеостаза требует дальнейшего изучения.
РИСУНОК 1. SPL7-регуляторная сеть и существующие взаимодействия на заводах. HY5, фактор транскрипции BZip ELONGATED HYPOCOTYL 5; KIN17, ДНК и РНК-связывающий белок Kin17; NLS — сигнал ядерной локализации; SBP-домен, домен связывания с промотором SQUAMOSA; СОД, супероксиддисмутаза; SPL7, фактор транскрипции, связанный с промотором SQUAMOSA, подобным белку 7; TMD, трансмембранный домен.
Было показано, чтоSPL7 конститутивно экспрессируется в растениях — хотя в основном в корнях — независимо от наличия меди в почве. Следовательно, часть его регуляции может происходить на посттранскрипционном уровне (Yamasaki et al., 2009; Garcia-Molina et al., 2014a). Гарсия-Молина и др. (2014a) идентифицировали KIN17, ядерный белок, способный взаимодействовать с SPL7 in vivo , который может участвовать в такой регуляции (Рисунок 1). Изучая развитие фенотипа растений двойного мутанта Arabidopsis kin17-1 spl7-2 в различных Cu-условиях, согласованное действие KIN17 и SPL7, по-видимому, необходимо для облегчения дефектов роста и окислительного стресса в случае депривации Cu. (Гарсия-Молина и др., 2014а). Иммунолокализация SPL7 и ER-маркера дополнительно выявила возможную двойную субклеточную локализацию SPL7 как в ядре, так и в ER (Garcia-Molina et al., 2014b). Было высказано предположение, что дефицит Cu вызывает стресс ER, тем самым способствуя активации SPL7. Кроме того, SPL7 может гомодимеризоваться вне ядра, предотвращая его проникновение в ядерную пору из-за большего размера или маскировки сигнала ядерной локализации (NLS), необходимого для ядерного импорта, в качестве механизма отрицательной обратной связи (Рисунок 1; Birkenbihl et al. ., 2005; Гарсия-Молина и др., 2014b).
Более того, было продемонстрировано, чтоSPL7 физически и генетически взаимодействует с ELONGATED HYPOCOTYL5 (HY5), который кодирует фактор транскрипции bZIP-типа, который функционирует ниже нескольких фоторецепторов, способствуя фотоморфогенезу (Zhang et al., 2014). Это двойное взаимодействие обеспечивает механизм обратной связи для связывания светочувствительных и чувствительных к Cu генных сетей и подтверждает, что жесткая пространственно-временная регуляция гомеостаза Cu является частью целостной клеточной циркадной системы (Рисунок 1; Andrés-Colás et al., 2010; Zhang et al., 2014).
Недостаток меди побуждает перейти из оптимального режима в «экономичный»
Чтобы справиться с дефицитом меди в почвах, растения разработали две стратегии. Первый состоит в увеличении усвоения Cu за счет активации высокоаффинных транспортеров Cu, таких как члены семейства белков COPT / Ctr, а также в экспрессии специфических шаперонов Cu (CCH; Рисунок 1; Himelblau et al., 1998; Abdel-Ghany и Пилон, 2008). Вторая стратегия основана на синтезе не содержащих Cu белков, способных выполнять функции, аналогичные купропротеинам.Например, накопление супероксиддисмутазы железа 1 (FSD1) может уравновесить снижение цитозольных и стромальных Cu / Zn-супероксиддисмутаз (соответственно CSD1 и CSD2) в случае депривации Cu (Рисунок 1; Abdel-Ghany and Pilon, 2008 ). Этот переход в «экономичный» режим почти полностью осуществляется посредством посредничества miRNA (Figure 1; Abdel-Ghany and Pilon, 2008). Cu-чувствительный фактор транскрипции SPL7 активирует транскрипцию транспортеров из семейства COPT / Ctr и продукцию miRNA (обозначенных Cu-microRNA), которые нацелены на транскрипты «менее важных» купропротеинов, чтобы способствовать выделению Cu в пластоцианин, самый важный белок Cu в хлоропласте (Tapken et al., 2012). В Arabidopsis регуляция miRNA включает несколько miRNA (miR397, miR398, miR408 и miR857), которые, как предполагается, нацелены на транскрипты белков Cu, таких как CSD, Cox5b-1, субъединица цитохром-с оксидазы, плантацианина и семейство генов лакказы (Abdel-Ghany, Pilon, 2008). В этом режиме хлоропластный Cu-шаперон к супероксиддисмутазе Cu / Zn (CCS) и CSD2 также подавляется, тогда как Cu-транспортная АТФаза PAA2, необходимая для доставки Cu в просвет, стабилизируется и накапливается (Tapken et al., 2012).
Незаконный оборот меди на заводах
Во время роста и развития растения ионы захватываются клетками корня эпидермиса, переносятся в центр корня через паренхиму и энтодерму и загружаются в ксилему. Этот однонаправленный транспорт переходных металлов в ксилему осуществляется разными транспортерами. Скоординированная активность этих переносчиков и других секвестраторов / хелаторов необходима для адекватного распределения минералов во всех тканях на всех стадиях развития.
Поглощение меди в корневом сайте двудольных растений
ПриобретениеCu включает оксидазы редуктазы железа и белки COPT у Arabidopsis thaliana
Механизмы захвата Cu в растениях до конца не выяснены, однако предполагается сильное перекрытие между механизмами захвата Fe и Cu (Ryan et al., 2013). В двудольных и незлокачественных однодольных — называемых растениями стратегии I — анализ изотопного фракционирования поглощения Cu корнями указывает на преимущественное поглощение легкого изотопа Cu.Было высказано предположение, что такое наблюдение является результатом восстановительных механизмов поглощения Cu на поверхности корня и, таким образом, поддерживает идею о том, что восстановление Cu (II) до Cu (I) происходит на мембране корневых клеток растений стратегии I (рис. al., 2012; Jouvin et al., 2012; Ryan et al., 2013).
РИСУНОК 2. Обзор системы транспорта меди, возникающей в верхушке корня двудольных растений. Медь поглощается корнями в восстановленной форме Cu + белками COPT, высокоселективными переносчиками меди.Альтернативная, но все еще спорная система захвата Cu может представлять собой неселективные белки ZIP, тогда как поток Cu 2+ -e опосредуется антипортерами H + / Cu 2+ . В цитозоле свободный Cu + индуцирует генерацию ROS, тем самым открывая NSCC, позволяя проникать Ca 2+ и вызывая рост корней. Cu может дополнительно модулировать рост корней посредством взаимодействия с переносчиком потока ауксина PIN1 и с мульти-медьоксидазами LPR1 / 2. В случае, если чрезмерное количество Cu попадает в корни, массовое образование ROS также активирует поток K + через NSCC, вызывая активацию запрограммированной смерти клеток (PCD).АФК может быть подавлена активностью CSD1, который приобретает Cu из CCS. Для предотвращения образования АФК Cu + обычно хелатируется внутриклеточными МТ или специфическими шаперонами ATX1. Транспорт Cu во внеклеточные компартменты опосредуется белками HMA5. Во флоэме и ксилеме Cu транспортируется в комплексах Cu (II) или комплексах Cu (I) -MT. ATX1, антиоксидантный белок 1; COPT1 / 2, транспортер меди 1/2; CCS, Cu-шапероны к супероксиддисмутазе Cu / Zn; CSD1, цитозольная Cu / Zn-супероксиддисмутаза; FRO 4/5, оксидаза редуктазы железа 4/5; LPR1 / 2, мульти-медьоксидаза 1/2 с низким фосфатным ответом; МТ, металлотионеины; NSCC, неселективные катионные каналы; OsHMA5 / AtHMA5, Oryza sativa АТФаза тяжелого металла 5/ Arabidopsis thaliana АТФаза тяжелого металла 5; PCD, запрограммированная гибель клеток; PIN1, штыревой 1; ROS, активные формы кислорода; ZIP, Zrt- и Irt-подобный белок.
Путем анализа активности Cu (II) -хелатредуктазы в корнях мутантов Arabidopsis SPL7 в сравнении с диким типом при различной доступности Cu, Bernal et al. (2012) обнаружили, что депривация Cu индуцирует высокую активность Cu (II) -хелатредуктазы на поверхности корня и что эта активность транскрипционно регулируется SPL7. Интересно, что эти Cu (II) -хелатредуктазы кодируются оксидазами 4 и 5 редуктазы железа (FRO4 / 5), которые, по-видимому, опосредуют специфическое восстановление ионов двухвалентной меди, в частности, на кончиках корней (Bernal et al., 2012).
В своей восстановленной форме Cu транспортируется через корни белками, поглощающими Cu, из ранее упомянутого семейства белков переносчиков Cu COPT / Ctr-подобных. Члены этого семейства содержат три трансмембранных домена (TMD), His- и / или Met-богатый N-конец, Mx 3 Mx 12 Gx 3 G-сигнатурный мотив, встроенный в TMD2 и TMD3, за исключением COPT6, цистеин / гистидиновый Cu + -связывающий мотив, обращенный к цитоплазме на С-конце (Puig, 2014).Ограничение Cu индуцирует экспрессию трех генов COPT1 / 2/6 , но Cu-опосредованная регуляция COPT3 / 5 не наблюдается. Роль COPT4, у которых отсутствуют классические остатки Met, необходимые для транспорта Cu (I), еще предстоит выяснить (Puig, 2014). Профиль экспрессии членов COPT также указывает на то, что их регуляция зависит не только от доступности катионов, но и от рассматриваемой ткани, от стадии развития растения и от среды, в которой растения растут, что позволяет предположить, что Cu- приобретение регулируется с точки зрения окружающей среды и развития (Yuan et al., 2011).
ПриобретениеCu из почвы существенно зависит от белка COPT1. COPT1 представляет собой локализованный в плазматической мембране высокоаффинный переносчик Cu (I), присутствующий во многих органах и в Arabidopsis , расположенный, в частности, на кончиках корней. При ограничениях по Cu растение активирует экспрессию COPT1 SPL7-зависимым образом, обеспечивая высокоэффективное поглощение Cu из культуральной среды (Sancenón et al., 2004). Предполагается, что попадание меди в цитозоль вызывает образование ОН в цитозольной части клетки посредством реакций Фентона и Габера-Вейсса (Родриго-Морено и др., 2013). Прямое взаимодействие OH ⋅ с цитозольным OH ⋅-связывающим сайтом неселективных катионных каналов (NSCC), являющихся ионными каналами плазматической мембраны, может затем активировать приток Ca 2+ , чтобы позволить корню расти и, таким образом, увеличить корень. разведочная площадка на добычу полезных ископаемых. Однако, когда доступно избыточное количество Cu, массовое проникновение Cu (I) генерирует всплеск радикалов OH leading, что приводит к активации каналов притока Ca 2+ с одной стороны и к открытию потока K + каналы на другой стороне, тем самым активируя управляемую каспазами запрограммированную гибель клеток (PCD) и подавляя удлинение корня (Rodrigo-Moreno et al., 2013). Кроме того, избыток Cu может нарушать удлинение корня, предотвращая перераспределение ауксина посредством взаимодействия с Pinformed1 (PIN1), переносчиком потока ауксина, ответственным за поток акропетального ауксина в стеле корня (Figure 2; Yuan et al., 2013).
COPT2, др. Член семейства COPT / Ctr-подобных, локализован в плазматической мембране и обнаруживает повышенную экспрессию в ответ на депривацию Cu SPL7-зависимым образом (Perea-García et al., 2013). COPT2 экспрессируется в зеленых тканях, а также в зоне дифференцировки корней, в эпидермисе боковых корней и корневых волосках, но отсутствует в зонах удлинения и меристемы (Perea-García et al., 2013; Пуч, 2014). Анализ активности COPT2 в репродуктивных органах A. thaliana также выявил экспрессию в рыльцах молодых и старых стручков, в сосудистой сети и канатике старых стручков, а также в пыльниках и пыльцевых зернах (Gayomba et al., 2013 ). Подобно COPT1, активность COPT2 изменяется доступностью Cu. Однако приобретение Cu из почвы с помощью COPT2 кажется ограниченным, и этот транспортер может представлять собой только вторичный путь для включения Cu в корнях (Puig, 2014).В дополнение к мотивам GTAC, распознаваемым SBP-доменом SPL7, COPT2 имеет в своей промоторной области предполагаемый E-бокс, участвующий во взаимодействии с факторами транскрипции bHLH-типа, среди которых Fe-чувствительный белок FIT, что делает этот ген чувствительным к обоим Дефицит Cu и Fe (Colangelo, Guerinot, 2004; Perea-García et al., 2013). Интересно, что, опосредуя доставку Cu к мульти-медьоксидазам LPR1 и LPR2 (корни с низким содержанием фосфата 1 и 2), участвующим в реакции роста корней на низкий уровень фосфата, COPT2 также может играть роль в восприятии фосфатов (рис. 2; Svistoonoff et al. al., 2007; Переа-Гарсия и др., 2013; Пуч, 2014). Таким образом, предполагается, что COPT2 работает на пересечении многих основных процессов между гомеостазом Cu и Fe и метаболизмом фосфатов, но связь между этими тремя процессами все еще плохо изучена (Puig, 2014).
Рядом с этой COPT / Ctr-подобной системой движения Cu, экспрессия двух транспортеров семейства ZIP, ZIP2 и ZIP4, способных опосредовать транспорт двухвалентных катионов, модулируется доступностью Cu (Wintz et al., 2003; Дель Посо и др., 2010). Эти данные получены из профилей экспрессии ранних генов A. thaliana , культивируемых в условиях дефицита минералов, которые показали индукцию экспрессии ZIP2 и ZIP4 в случае ограничения Cu и репрессию избытка Cu (Wintz et al., 2003 ). Однако более поздние исследования частично противоречивы, поскольку было обнаружено, что избыток Cu имеет тенденцию опосредовать повышающую регуляцию ZIP4 , тогда как экспрессия ZIP2 индуцируется депривацией Cu (Yamasaki et al., 2009; Wu et al., 2015). Это очевидное противоречие в регуляции ZIP4 при дефиците Cu может быть объяснено различными условиями культивирования и средами, используемыми в различных исследованиях. Кроме того, поскольку экспрессия ZIP4 и регулируется уровнями Zn, между абсорбцией Cu и Zn могут существовать перекрестные помехи (Рисунок 2). Роль ZIP транспортеров в Cu (II) транспортный остается, однако, спорным, так как ни один из этих транспортеров спасательного Cu поглощения дефицита меди поглощения дефицитных CTR1 / CTR3 дрожжевых мутантов (Мильнер и др., 2013).
Снижение токсичности меди за счет хелатирования и секвестрации в вакуоль
У растений развились отдельные системы, участвующие в контроле количества свободных цитозольных ионов. Первая стратегия — это подавление ион-специфической системы захвата, вторая стратегия основана на удалении свободных ионов и комплексов ион-лиганд в вакуоли или на их потоке через плазматические мембраны в клеточную стенку (Krämer, 2005). .
Чтобы избежать образования АФК, внутриклеточная Cu должна быть хелатирована и доставлена к своим партнерским белкам с помощью специфических шаперонов.В Arabidopsis два специфических шаперона [CCH и ATX1 (для Antioxidant Protein 1)] опосредуют перенос Cu к Cu-транспортным АТФазам (Shin et al., 2012). Изучение линий с повышенной экспрессией ATX1 при различных условиях доступности Cu указывает на роль ATX1 в поддержании роста растений при избытке Cu и умеренном дефиците Cu (Shin and Yeh, 2012; Shin et al., 2012). В частности, ATX1, по-видимому, играет решающую роль в поддержании гомеостаза Cu путем хелатирования Cu посредством взаимодействия с консервативным доменом MxCxxC.Интересно отметить, что нанесенная в избытке Cu также индуцирует дозозависимым образом специфическую экспрессию HMA5 (для АТФазы 5 тяжелых металлов), являющейся АТФазой типа P IB . Что касается сильного взаимодействия, наблюдаемого между Arabidopsis ATX1 и HMA5, металло-шапероны ATX1 могут играть фундаментальную роль в доставке Cu к HMA5 (Andrés-Colás et al., 2006; Del Pozo et al., 2010). Однако, поскольку точная локализация AtHMA5 не выяснена, можно предположить роль в секвестрации Cu в вакуоль и / или в доставке в апоплазму (Рисунок 2).В недавнем исследовании, посвященном функциональной и биохимической характеристике Cu-АТФаз огурца, было показано, что два предполагаемых гомолога этого белка, CsHMA5.1 и CsHMA5.2, связаны с вакуолярной мембраной, в отличие от локализации OsHMA5 в плазматической мембране. в рисе (Deng et al., 2013; Migocka et al., 2015). Однако дифференциальная регуляция CsHMA5.2 , но не CsHMA5.1 в ответ на вариации в доступности Cu, в частности, его высокий уровень экспрессии при высокой доступности Cu, предполагает, что CsHMA5.2 отвечает за повышенную секвестрацию Cu в случае токсичности Cu (Migocka et al., 2015). В отличие от этого предполагается, что локализованный в плазматической мембране гомолог риса OsHMA5 участвует в потоке металла, а не в секвестрации металла в вакуоль, что подчеркивает видозависимую роль, которую играют эти гомологичные HMA5, и, в частности, различные стратегии, которые могут существовать между двудольные и однодольные (рисунок 2).
После корневой абсорбции Cu и связывания Cu в вакуоль ионы Cu могут быть экспортированы из этого отсека для хранения.Функциональная характеристика COPT5 у Arabidopsis показала, что этот белок расположен в тонопласте (Garcia-Molina et al., 2011; Klaumann et al., 2011). Анализ комплементации мутантов дрожжей также показал, что COPT5 способен восстанавливать фенотип роста мутантов, неспособных опосредовать мобилизацию Cu из хранилища Cu. Было высказано предположение, что ионы Cu, импортированные в клетки корня через COPT1, хранятся в вакуоли до тех пор, пока не потребуется транспорт к репродуктивным органам. В этом случае вакуолярная Cu высвобождается через COPT5 и выводится из клетки для удовлетворения потребностей органов-поглотителей (Рисунок 2; Klaumann et al., 2011).
Поток меди на плазменной мембране может повысить устойчивость к меди
Анализ везикул плазматической мембраны, выделенных из корней растений Cu-чувствительных и Cu-толерантных популяций Silene vulgaris показал, что растения из Cu-толерантных популяций могут опосредовать отток Cu из клетки через специфические переносчики плазматической мембраны (Van Hoof et al. др., 2001). Доказательства существования системы транспорта меди, способной опосредовать поток меди, были получены Burzyński et al. (2005) при изучении очищенных экстрактов плазматической мембраны корней огурца.Такой поток, по-видимому, опосредован антипортерами H + / Cu (II), где входящий поток H + компенсируется потоком Cu 2+ . Хотя эти антипортеры кажутся насыщаемыми, эта система экспорта Cu может способствовать устойчивости растений к металлам, в частности, ограничивая концентрацию токсичных металлов внутри клетки (Рисунок 2; Burzyński et al., 2005; Parrotta et al., 2015).
Транслокация Cu вдоль стержня
Cu транспортируется в соке в виде Cu (II) -хелатов
В растениях Cu может транспортироваться в форме свободных Cu (I) или Cu (II), но обычно это происходит в виде комплексов Cu.Нагрузка ксилемы является ключевым фактором, контролирующим перемещение минералов от корня к побегу. Однако загрузка ксилемы Cu у двудольных растений плохо изучена, и современные знания в основном основаны на данных, полученных на рисе. В нокаутных мутантах риса по АТФазе OsHMA5 P 1B более высокие концентрации Cu, наблюдаемые в корнях по сравнению с диким типом, предполагают участие OsHMA5 в транслокации этого металла от корней к побегам (Deng и др., 2013). OsHMA5 локализуется в перицикле зрелых корней и в области сосудистых тканей у риса и транспортирует Cu в форме Cu (I) как на вегетативной, так и на репродуктивной стадиях (рис. 2; Deng et al., 2013).
У двудольных растений предполагалось, что возможное повторное окисление Cu (I) до Cu (II) происходит, как это наблюдалось у томатов, во время транслокации Cu от корня к побегу, что позволяет образовывать комплексы с переносчиками на большие расстояния (Ryan et al. , 2013). Действительно, убедительные доказательства предполагают, что, попав в ксилемный сок, Cu транспортируется в форме Cu (II) специфическими хелаторами металлов. Ранние исследования по поиску лигандов Cu в ксилемном соке были сосредоточены на способности аминокислот образовывать стабильные комплексы с Cu. Из этих анализов следует, что свободные аминокислоты могут опосредовать транспорт Cu (Liao et al., 2000; Irtelli et al., 2009). Кроме того, непротеиногенная аминокислота никотианамин (NA), синтез которой опосредуется NA-синтазами (NAS), играет важную роль в минеральном гомеостазе (Hofmann, 2012). NA синтезируется путем ферментативной конденсации трех амино-карбоксилпропильных групп трех молекул S -аденозилметионина с помощью NAS (Curie et al., 2009). In vitro NA может связывать широкий спектр переходных металлов, таких как Mn, Fe, Co, Zn, Ni и Cu (Curie et al., 2009). При pH ксилемного сока NA и гистидин демонстрируют самые высокие константы связывания для Cu, что позволяет предположить, что они могут быть предпочтительными лигандами для переноса этого элемента на большие расстояния, особенно в ксилеме (Pich and Scholz, 1996). Однако образование хелаторов может происходить в зависимости от доступности Cu, например, более активное участие НА в случае Cu голодания, чем в случае избытка Cu (Irtelli et al., 2009). В отличие от риса, транспорт Cu в ксилемном соке может зависеть от 2′-дезоксимугиновой кислоты (DMA) в качестве специфического хелатора Cu, тогда как NA и His могут быть Cu-связывающими соединениями в соке флоэмы (Ando et al., 2012; Рисунок 3).
РИСУНОК 3. Модель системы дальней связи для транспортировки меди. Ионы меди транспортируются в сосудистой сети в форме Cu (I) -MT или Cu (II) -комплексов. Перед захватом клетками листа Cu 2+ восстанавливается до Cu + с помощью FRO4 и попадает в клетку листа с помощью белков COPT6. Ремобилизация Cu из стареющих тканей осуществляется через белки YSL. В частности, белки YSL, подобные YSL16 в O. sativa , участвуют в транспорте Cu из комплексов Cu (II) из стареющих органов во флоэму.Предполагается также возможное участие CCH в ремобилизации Cu из старых тканей в молодые. Ремобилизованная Cu переносится в приемные органы через белки YSL, такие как YSL2, для транспорта комплексов Cu (II) и, вероятно, YSL1 / 3 для транспорта Cu (I) -MT. CCH, Cu шаперон; COPT6, транспортер Cu 6; FRO4, оксидаза редуктазы железа 4; МТ, металлотионеины; YSL, желтая полоса нравится.
Транспортировка комплексов металлов осуществляется членами семейства Yellow Stripe-Like (YSL), подсемейства переносчиков семейства OPT (Lubkowitz, 2011; Zheng et al., 2012). OPT представляют собой интегральные мембранные белки, являющиеся связанными с протонами симпортерами, которые связываются с хелатором металлов NA или родственным набором хелаторов семейства мугиновых кислот (Chu et al., 2010). Лучше всего охарактеризованный OPT — это транспортер AtOPT3 Arabidopsis , который выполняет множество функций, таких как загрузка Fe во флоэму, облегчение циркуляции Fe из ксилемы во флоэму, регулирование транслокации Fe от побегов к корням и участие в перераспределении железа из зрелых растений. к развивающимся тканям (Zhai et al., 2014).
Семейство OPT подразделяется на две группы, желтые полосоподобные (YSL) и олигопептидные транспортеры (PT), которые участвуют в транспорте хелатов металлов. Геном A. thaliana содержит восемь генов YSL, среди которых три ( AtYSL1, AtYSL2 и AtYSL3 ) экспрессируются в паренхиме ксилемы листьев и подавляются дефицитом Fe (DiDonato et al., 2004 ; Waters et al., 2006; Chu et al., 2010). Локализация белков AtYSL1, AtYSL2 и AtYSL3 в planta с использованием методов зеленой флуоресценции показала, что AtYSL1 / 2/3 являются белками плазматической мембраны (DiDonato et al., 2004; Чу и др., 2010). В частности, AtYSL2 и AtYSL3 локализуются совместно в латеральной плазматической мембране скорее, чем в базальных и апикальных конечностях клетки (DiDonato et al., 2004; Chu et al., 2010). Помимо участия в поддержании гомеостаза Fe, мембранный белок AtYSL2, как было показано, способен транспортировать комплексы Cu-NA (DiDonato et al., 2004). Сверхэкспрессия AtYSL3 в вегетативных тканях индуцировала более высокое накопление Cu в листьях, тогда как Zn и Fe не были затронуты, что предполагает также роль AtYSL3 в перемещении Cu.Однако функциональная комплементация дрожжей с AtYSL1 и AtYSL3 не показала доказательств поглощения Cu-NA (Figure 3; Chu et al., 2010). В рисе транспорт Cu-хелата был продемонстрирован для локализованного во флоэме транспортера OsYSL16. Он выполняет функцию загрузки комплекса металлов во флоэму, но не участвует в поглощении из среды. В частности, он служит для переноса Cu из стареющих органов в самые молодые участки растений и семена (Zheng et al., 2012). OsYSL16 также участвует в гомеостазе железа, подтверждая связь между приобретением / перераспределением Cu и гомеостазом железа (Рисунок 3; Lee et al., 2012). Регуляция транспортеров YSL при вариациях доступности Cu была частично раскрыта путем анализа мутанта siz1 , демонстрирующего гиперчувствительность к избытку меди из-за неспособности подавлять экспрессию YSL1 и YSL3 при избыточных уровнях Cu. (Chen et al., 2011). Анализ двойных мутантов для SIZ1 / YSL3 и SIZ1 / YSL1 показал, что YSL3 играет главную роль в накоплении Cu в побегах и что SIZ1 может участвовать в регуляции перемещения Cu от корня к побегу при стрессе Cu.Поскольку SIZ1 участвует в процессе сумоилирования, подавление YSL1 и YSL3 при высокой доступности меди у дикого типа, по-видимому, опосредовано SIZ1-зависимым сумоилированием (Chen et al., 2011).
Достигнув листьев, Cu (II) из комплексов Cu (II) восстанавливается до Cu (I) за счет активности FRO4 до поглощения клетками листа (Рисунок 3; Bernal et al., 2012; Ryan et al., 2013).
MT, CCH и COPT6 опосредуют транспорт, ремобилизацию и перераспределение меди от стареющих органов к тонким органам
Металлотионеины (МТ) — это богатые цистеином белки, способные координировать ионы Cu (I), Zn (II) и Cd (II) через свои тиоловые группы (Guo et al., 2003; Wan et al., 2013). В Arabidopsis гены MT подразделяются на четыре типа ( MT1, MT2, MT3 и MT4 ), и их накопление изменяется в ответ на изменения доступности Cu (Guo et al., 2003). MT1a и MT2b Экспрессия в основном локализована во флоэме как в листьях, так и в корнях и индуцируется Cu, тогда как MT2a и MT3 в основном экспрессируются в клетках мезофилла и сильно индуцируются повышением уровня Cu в молодых тканях. такие как развивающиеся листья или верхушка корня (рис. 2).MT участвуют в мобилизации Cu из органов старения. Об этом свидетельствует специфическая экспрессия MT1a и MT2b в тканях сосудов; где MT2b — это служебный MT, тогда как MT1a может помочь растению справиться с быстрыми изменениями концентрации Cu (Guo et al., 2003). В то время как растения дикого типа A. thaliana ремобилизуют Cu из стареющих листьев, A. thaliana quad MT-мутанты mt1a-2 / mt2a-1 / mt2b-1 / mt3-1 этого не делают.Мутант quad-MT также показывает более низкую концентрацию Cu в семенах по сравнению с мутантом дикого типа. Оба эти наблюдения предполагают, что MTs участвуют в перераспределении Cu от стареющих листьев к поглощающим органам, таким как развивающиеся листья или семена (Benatti et al., 2014). Интересно, что аналогичный фенотип накопления Cu наблюдался для мутанта A. thaliana ysl1 / ysl3 , лишенного транспортеров YSL1 / 3, что позволяет предположить, что MT и YSL могут взаимодействовать (Рисунок 3; Waters et al., 2006; Chu et al. , 2010).
Кроме того, было замечено, что во время старения листьев небольшие Cu-связывающие белки (CCH) накапливаются в сосудистых жилках средней жилки (жилка класса I) и черешке стареющих листьев у A. thaliana (Mira et al., 2001). ). Иммуногистохимическое мечение выявило определенное накопление CCH в элементах стволовых сит, но не в их клетках-компаньонах (Mira et al., 2001). Это, вместе с присутствием CCH в экссудате флоэмы, предполагает роль CCH в транспорте меди на большие расстояния в сосудистых растениях.Фактически, CCH может быть синтезирован в клетках-компаньонах и импортирован в ситовые элементы через зрелые плазмодесмы, где он опосредует транспорт Cu от старения к органам-приемникам (Рисунок 3; Mira et al., 2001; Sancenón et al., 2003; Andrés- Colás et al., 2006).
Наконец, Jung et al. (2012) охарактеризовали A. thaliana COPT6, недавно идентифицированного члена семейства Ctr / COPT (Jung et al., 2012; Garcia-Molina et al., 2013). В отличие от COPT1 и COPT2, COPT6 лишен Cys / His-Cu-связывающего мотива на С-конце, но сохраняет свою способность опосредовать транспорт Cu (Jung et al., 2012). COPT6 — это локализованный на плазматической мембране белок, играющий главную роль в гомеостазе Cu в надземных органах, а точнее в соответствующем распределении Cu в листьях и семенах при ограниченной доступности Cu (Jung et al., 2012; Garcia- Молина и др., 2013). Интересно, что подобно Cu шаперону CCH, было предложено участие COPT6 в ремобилизации и перераспределении Cu от зеленых тканей к репродуктивным органам (Figure 3; Garcia-Molina et al., 2013).
Внутриклеточный транспорт меди
Доставка Cu в хлоропласт включает различные АТФазы P1B-типа
Центральными компонентами доставки Cu являются небольшие растворимые белки, называемые шаперонами Cu, способные опосредовать доставку Cu к его правильному месту (Blaby-Haas et al., 2014). У растений хлоропластная Cu должна переноситься на металлат пластоцианин, пластидную супероксиддисмутазу Cu / Zn (CSD2) и другие белки, такие как полифенолоксидазы. Правильное выделение Cu требуется для фотосинтеза и защиты от окислительного стресса. В хлоропластах транспорт Cu опосредуется системой, включающей две АТФазы типа P 1B , транспортирующие Cu [AtHMA6 (также известные как PAA1 (АТФазы P-типа для Arabidopsis ) и AtHMA8 (также известные как PAA2)] соответственно, расположенные во внутренней оболочке и тилакоидной мембране (Shikanai et al., 2003; Абдель-Гани и др., 2005; Catty et al., 2011; Blaby-Haas et al., 2014). Эти два белка действуют в тандеме; PAA1 импортирует цитозольную Cu в строму и PAA2 в просвет (Blaby-Haas et al., 2014). И PAA1, и PAA2 имеют высококонсервативные домены, консенсусный металл-связывающий мотив MxCxxC (HMBD) в N-концевой области, домен трансдукции CPC, домен фосфорилирования, домен связывания АТФ и домен фосфатазы (Abdel-Ghany et al. , 2005). Мутанты Arabidopsis для PAA2 и PAA1 имеют дефекты фотосинтеза, но фенотип частично восстанавливается добавлением Cu в питательную среду, что свидетельствует о наличии альтернативных низкоаффинных транспортных маршрутов Cu, которые функционируют независимо от PAA1 и PAA2. (Абдель-Гани и др., 2005). Доказательства этой второй транспортной системы были описаны в 2006 году: HMA1, другая АТФаза типа P 1B- , расположенная в оболочке хлоропластов, участвует в обеспечении Cu для фотосинтеза. Мутанты hma1 содержат меньше хлоропластной Cu, демонстрируют более низкую активность СОД и проявляют высокую светочувствительность в условиях высокой освещенности (Seigneurin-Berny et al., 2006), что позволяет предположить, что HMA1 играет особую роль в обеспечении роста растений в неблагоприятных условиях. световые условия (Seigneurin-Berny et al., 2006).
Доставка Cu к Cu-транспортирующему PAA1 опосредуется специфичным для растений Cu-шапероном, пластидным шапероном 1 (PCh2), кодируемым либо в результате альтернативного сплайсинга пре-мРНК PAA1 , либо отдельным локусом, который сохраняют N-концевую растворимую часть PAA1 и Cu-связывающий мотив MxCxxC. В связи с возможностью импорта небольших свернутых белков через внешнюю оболочку, было высказано предположение, что PCh2 может связывать Cu в цитозоле, проходить через внешнюю оболочку перед доставкой Cu в PAA1 (Blaby-Haas et al., 2014). Транспорт Cu к PAA2, напротив, может включать стромальные CCS, предназначенные для доставки Cu + к CSD (в цитозоле и в строме), но которые также могут развиваться параллельно, чтобы взаимодействовать с PAA2 в Arabidopsis , обеспечивая доставку Cu + к незаменимым купропротеинам ПК, а не только к несущественным CSD (Blaby-Haas et al., 2014). В случае высокой доступности Cu хлоропласт способен регулировать транспорт Cu в тилакоид за счет специфической деградации PAA2 через систему казеинолитической протеазы (Clp) хлоропласта (Tapken et al., 2015a, b), что указывает на непосредственное участие PAA2 в гомеостатической регуляции Cu в хлоропласте.
Доставка Cu в митохондрии
Мало что известно о транспорте Cu в митохондрии растений. Большинство знаний получается из сравнения с гомологами дрожжей. Баландин и Кастресана (2002) обнаружили AtCOX17, белок Arabidopsis , который имеет примерно 60, 33 и 51% идентичности с COX17 из риса, дрожжей и человека, соответственно (Balandin and Castresana, 2002).AtCOX17 успешно дополняет респираторный дефицит нулевого мутанта COX17 дрожжей, указывая на то, что AtCOX17 является функциональным гомологом дрожжевого COX17, т.е. что он может опосредовать доставку Cu в митохондрии (Balandin and Castresana, 2002). Тщательное изучение генома A. thaliana показало, что два гена кодируют аналогичные дрожжевые гомологи COX17, соответственно, AtCOX17-1 и AtCOX17-2, функции которых еще предстоит выяснить. Однако, поскольку COX17 является высококонсервативным белком, можно предположить, что шесть консервативных остатков цистеина Cox17, которые участвуют в лигировании Cu (I) как у дрожжей, так и у млекопитающих, выполняют аналогичную функцию у растений, обеспечивая перенос Cu из цитозоля в митохондриальное межмембранное пространство (Palumaa et al., 2004; Giegé, 2007).
В дрожжах SCO1 (синтез цитохром с оксидазы 1) кодирует белок внутренней мембраны митохондрий, необходимый для правильной сборки комплекса IV. SCO1 представляет собой Cu-связывающий белок, имеющий субъединицу 2 цитохром-с-оксидазы (COX) в качестве прямого взаимодействующего партнера. В A. thaliana были идентифицированы два гомолога SCO1 и названы соответственно HCC1 (At3g08950) и HCC2 (At4g39740) (для гомолога Cu Chaperone SCO; Steinebrunner et al., 2011). Хотя сообщается о высокой гомологии для двух AtHCC, мотив CxxxC и один остаток гистидина, которые необходимы для лигирования Cu, не консервативны в HCC2, что указывает на различную роль обоих белков.В частности, потеря функции HCC1, как было показано, нарушает активность COX, тогда как HCC2 может довольно косвенно действовать в окислительно-восстановительной регуляции (Attallah et al., 2011; Steinebrunner et al., 2014). Наконец, присутствие гомолога COX11 в геноме Arabidopsis , потенциально способного связывать Cu (I) и участвовать в образовании металлического центра COX B Cu , предполагает роль этого позже в некоторых случаях. терминальная стадия синтеза цитохром-с-оксидазы, особенно при вставке Cu в субъединицу I (Horng et al., 2004; Giegé, 2007).
У растений несколько членов семейства Arabidopsis FRO локализуются на мембранах органелл, подтверждая функциональную роль в субклеточных компартментах и подтверждая идею, что FROs могут выполнять функции, отличные от восстановления Fe / Cu на поверхности корня (Jeong and Connolly, 2009). Гистохимическое окрашивание растений FRO3-GUS показало, что FRO3 преимущественно экспрессируется в сосудистом цилиндре корней, и субклеточное предсказание этой редуктазы указывает на митохондриальную локализацию.Поскольку ограничение Cu вызывает экспрессию этого белка в корнях и побегах, эта еще не охарактеризованная редуктаза может участвовать в гомеостазе меди в митохондриях (Mukherjee et al., 2006; Jain and Connolly, 2013; Jain et al., 2014).
Транспорт меди секреторным путем: внимание к рецепторам этилена
Этилен представляет собой фитогормон, контролирующий различные аспекты развития растений, такие как рост и форма клеток, утолщение стебля, созревание плодов и ответы растений на биотические и абиотические стрессы (Bleecker and Kende, 2000).Этилен воспринимается растениями через взаимодействие со своим белковым рецептором, гомодимером этиленового рецептора 1 (ETR1; Rodriguez et al., 1999). Этот рецептор состоит из (1) нескольких TMD, образующих богатый электронами гидрофобный карман, участвующий в связывании Cu и этилена, и (2) C-концевой домен, расположенный в цитозоле, необходимый для передачи сигнала (Rodriguez et al., 1999) . Доставка меди к рецепторам этилена осуществляется с помощью белков, транспортирующих Cu, подобных АТФазам P-типа класса CPx, таким как белок CCC2 из Saccharomyces cerevisiae , способный опосредовать перенос Cu во внецитоплазматические компартменты.Этот перенос подразумевает, что этот переносчик и рецептор находятся в одном и том же месте во время биогенеза рецептора (Binder et al., 2010). Однако доказательства совместной локализации отсутствуют (Garcia-Molina et al., 2014b). В Arabidopsis этот класс переносчиков АТФазы P-типа включает ответ на белок-антагонист 1 (RAN1, также известный как AtHMA7), который, как было показано, имеет важное значение для биогенеза рецепторов этилена и имеет решающее значение для нормального роста и развития. (Биндер и др., 2010). Приобретение меди RAN1 может включать систему, аналогичную передаче Cu (I) от ATX1 к апо-CCC2 в дрожжах, где Cu (I) индуцирует образование межмолекулярного комплекса с металлическими мостиками, состоящего из металлохаперона и АТФазы (Banci et al ., 2006; Puig et al., 2007). В частности, AtATX1 взаимодействует in vivo с металл-связывающим доменом RAN1, тогда как его гомолог AtCCH, который имеет расширенный специфичный для растений карбоксиконцевой домен, не взаимодействует (Puig et al., 2007). Недавно было показано, что RAN1 индуцируется добавлением Cu у Cu-толерантных и Cu-чувствительных экотипов S.vulgaris , подтверждая предполагаемую роль этого белка в глобальном гомеостазе Cu скорее, чем в механизмах толерантности к Cu (Baloun et al., 2014).
Открытие TaCT1, нового переносчика Cu Post-golgi, обнаруженного в мягкой пшенице
Рядом с двумя классическими группами переносчиков Cu, переносчиками Cu Ctr / COPT и АТФазами типа P 1B- , в переносе Cu в пшенице участвует третий класс белков, переносчик Cu типа главного фасилитатора суперсемейства (MFS). (Ли Х.и др., 2014). Этот белок, названный TaCT1 (для Triticum aestivum Cu транспортер 1), имеет домен MxCxxC, аналогичный АТФазам типа P 1B . Однако в этом случае он расположен внутри мембраны компартмента после Гольджи, что делает его неспособным взаимодействовать с растворимыми белками ATX1 (Li H. et al., 2014). У мягкой пшеницы TaCT1 регулирует гомеостаз Cu и улучшает устойчивость к стрессу Cu (Li H. et al., 2014).
Влияние меди на компоненты клеточной стенки
Основными местами накопления Cu в растениях являются хлоропласт, вакуоль, цитоплазма и клеточная стенка (Bernal et al., 2006; Burkhead et al., 2009). Клеточная стенка является основным местом контакта минералов и характеризуется сложной структурой, состоящей из целлюлозы, гемицеллюлозы и белков, встроенных в матрицу пектинов с различной степенью метилэстерификации. При pH апопласта неметилированные остатки пектина заряжены отрицательно и ионно взаимодействуют с катионами. Таким образом, клеточная стенка играет важную роль в реакции тяжелых металлов как секвестратор ионов, но в свою очередь может серьезно пострадать ее синтез и состав (Parrotta et al., 2015).
В следующей части подчеркивается роль Cu в основных белках клеточной стенки и купропротеинах и подчеркивается, как тонкая настройка компонентов клеточной стенки, в частности пектиновой фракции, способствует устойчивости растений к Cu (рис. 4).
РИСУНОК 4. Обзор некоторых механизмов разрыхления / укрепления клеточной стенки, основанных на присутствии Cu.
Лакказы представляют собой Cu-связывающие белки, участвующие в полимеризации лигнина
Стенка растительной клетки представляет собой сложную структуру, секретируемую клетками и образующую каркас, в котором клетка развивается.У молодых растущих клеток образуется первичная стенка, в основном состоящая из целлюлозы и гемицеллюлозы, заключенная в матрицу пектинов. В зрелых клетках образуется вторичная стенка, состоящая из фибрилл целлюлозы с более высокой степенью полимеризации и лигнина, которая может особенно развиваться в специализированных клетках, таких как сосуды ксилемы (Cosgrove, 2001). У растений фенольные соединения образуются в результате шикиматного пути, продукты которого либо направляются на синтез белка, либо превращаются во вторичные метаболиты в метаболизме фенилпропаноидов.Путь фенилпропаноидов продуцирует, среди других соединений, основные строительные блоки лигнина [гваяцильные (G), сирингильные (S) и п-гидроксифенильные (H) звенья]. После биосинтеза единицы лигнина могут быть (1) перенесены на клеточную стенку с помощью переносчиков специфических АТФ-связывающих кассет (ABC), которые перекачивают монолигнол через плазматическую мембрану для окислительной полимеризации на основе свободных радикалов, или (2) импортированы в вакуоли посредством аналогичные переносчики ABC после стадии гликозилирования (Alejandro et al., 2012; Sibout and Höfte, 2012; Zhao et al., 2013; Дима и др., 2015). Известно, что тяжелые металлы влияют на отложение лигнина у самых разных видов растений. В проростках перца ( Capsicum annuum L. ) избыток Cu вызывает повышение активности шикиматдегидрогеназы (SKDH, EC 1.1.1.25), фермента, который катализирует четвертую стадию пути шикимата и активности пероксидазы (EC 1.11.1.7). как в корнях, так и в гипокотиле, что приводит к увеличению количества фенолов и лигнина (Diaz et al., 2001).
Монолигнолы окисляются в апопласте членами Cu-содержащих семейств лакказы и / или пероксидазы (рис. 4).Полимеризация монолигнолов в лигнин — это процесс, во время которого окисленные фенолы, присутствующие в зоне лигнификации, вступают в процесс лигнификации путем связывания на основе свободных радикалов (Zhao et al., 2013). В лакказах ионы Cu связаны в нескольких сайтах, называемых центрами типа I («синие» белки меди), типа II («не-синие» белки меди) или типа III (димеры), в зависимости от окружения металла. ионные и спектроскопические характеристики. Активность семейства лакказы зависит от координации четырех ионов Cu в трех спектроскопически разных центрах (типы I, II и III), что позволяет одноэлектронное окисление восстанавливающего субстрата в сочетании с четырехэлектронным восстановлением кислорода. в воду (Sedbrook et al., 2002). Arabidopsis тройные мутанты по генам лакказы lac4lac11lac7 демонстрируют крайне карликовый фенотип и почти полностью лишены лигнина в своих сосудистых элементах. Однако полоска Каспариана, структура на основе лигнина, не затрагивается у этого тройного мутанта, вероятно, потому что полимеризация лигнина в эндодерме опосредуется согласованной активностью пероксидаз (по крайней мере, PER64) и специфической НАДФН-оксидазы, называемой гомологами оксидазы респираторного взрыва. (RBOH), а не лакказы (Lee et al., 2013). В корнях воздействие Cu в диапазоне от 1 до 100 мкМ Cu вызывает увеличение содержания АФК, усиление активности каталазы, лакказы и пероксидазы и стимулирует выработку лигнина, тогда как удлинение корня значительно уменьшается (Lin et al., 2005 ; Wang et al., 2011; Liu et al., 2014).
В Arabidopsis семь членов семейства генов лакказы являются предполагаемыми мишенями для miR408 (LAC3, LAC12 и LAC13), miR397 (LAC2, LAC4 и LAC17) и miR857 (LAC7), 3 miRNA, которые накапливаются в Cu-ограничивающих условиях. .Интересно, что депривация Cu индуцирует экспрессию этих miRNAs и отрицательно коррелирует с накоплением транскриптов для лакказ (Bernal et al., 2012). Поскольку доступность Cu также влияет на лакказы, которые, как предполагается, не нацелены на miR408, miR397 и miR857, Abdel-Ghany et al. (2005) предположили, что другие малые РНК могут регулировать эти транскрипты лакказы. Однако снижение количества транскриптов LAC , вызванное дефицитом Cu, может не вносить или только частично вносить вклад в общую экономию Cu в корнях и побегах (Bernal et al., 2012). Поскольку miR398 и miR408 также активируются в ответ на дефицит воды в Medicago truncatula , предполагается связь между ответом растений на дефицит воды, гомеостазом Cu и лигнификацией (Trindade et al., 2009).
В отличие от лакказ мультикоппероксидазы, аминокислотные остатки, действующие как лиганды для меди типа I и типа III, отсутствуют в белке SKU5, родственном мультикоппероксидазе (Sedbrook et al., 2002). Однако, поскольку присутствуют два остатка His, которые координируют один Cu типа II, этот белок способен связывать один Cu.Из-за этой разницы в способности связывания Cu лакказ и SKU5 можно отнести к разной ферментативной активности. В частности, поскольку в SKU5 отсутствуют ионы Cu типа I и типа III, необходимые для осуществления переноса электронов, он может работать в тандеме с окислительно-восстановительным кофактором (Sedbrook et al., 2002). Это повсеместно экспрессируемый гликозилированный GPI-заякоренный белок, локализованный как в клеточной стенке, так и в плазматической мембране, что позволяет предположить, что он может высвобождаться из GPI in vivo . Sku5 Мутанты Arabidopsis продемонстрировали волнообразное движение и скручивание корней, меньшую длину корня, а также более высокое скручивание гипокотиля по сравнению с диким типом.Хотя четкой функциональной характеристики по-прежнему нет, были созданы разные модели для объяснения функции SKU5. Среди них было предположено, что SKU5 играет роль в модификации, прямо или косвенно, связей между структурными компонентами клеточной стенки (Sedbrook et al., 2002). SKU5 также может действовать, изменяя свойства средней ламеллы, позволяя клеткам скользить мимо друг друга во время роста или влиять на компоненты сигнального пути в клеточной стенке (Sedbrook et al., 2002).
Cu 2+ Влияет на пероксидазы растений (POX) класса III, фенилаланин-аммиак-лиазу (PAL) и содержание лигнина
Секретированные POX (EC 1.11.1.7) могут окислять различные субстраты (фенольные соединения, предшественники лигнина, ауксин и т. Д.) В присутствии H 2 O 2 , но также производить ROS, такие как H 2 O 2 , O2 • — или OH • благодаря их окислительной функции (рис. 4; Cosio and Dunand, 2009; Hadži-Tašković Šukalović et al., 2010). ПОХ представляют собой гем-содержащие гликопротеины, кодируемые мультигенным семейством, которое содержит три разных класса пероксидаз. ПОХ реагируют с соединениями, содержащими гидроксильные группы, присоединенные к ароматическому кольцу, такими как предшественники лигнина или суберина. POX превращают мономеры в нестабильные фенокси-радикалы, способные соединяться, что приводит к неферментативной полимеризации мономеров в лигнин, соответственно, суберин. В клеточной стенке ПОХ могут также окислять ферулоилированные полисахариды или структурные белки, что приводит к образованию макромолекул более высокой сложности, тем самым придавая структурную прочность клетке и растению (Ishii, 1997; Hiraga et al., 2001; Хаджи-Ташкович Шукалович и др., 2010). Поскольку пероксидазы участвуют в широком диапазоне процессов, проявляют пероксидазную и оксидазную активности и присутствуют в многочисленных изоформах как с консервативными, так и с вариабельными последовательностями, им трудно приписать какую-либо роль (Cosio and Dunand, 2009). Исследования показали, что лечение Cu одновременно влияет как на метаболизм лигнина, так и на активность POX. У редиса обработка Cu ингибировала удлинение корня, но увеличивала активность катионных и анионных ПОГ.Точно так же обработка соевых бобов и подсолнечника Cu ингибирует удлинение и ветвление корней и вызывает снижение продукции биомассы (Chen et al., 2002; Lin et al., 2005; Jouili et al., 2008). Это снижение связано с увеличением активности ПОХ, более высокой активностью лакказ и повышенным содержанием лигнина в корнях (Lin et al., 2005). В корнях люпина Cu влияет на метаболизм лигнина с первых шагов синтеза его предшественников, о чем свидетельствует повышенная активность PAL при избытке Cu (Chmielowska-Bak et al., 2008)
Связанные с клеточной стенкой белки плантацианина Blue Cu являются мишенью для Cu-чувствительной миРНК
Плантацианины принадлежат к семейству фитоцианинов голубых белков Cu с сайтом фиксации Cu, состоящим из четырех аминокислот (2 His, 1 Cys, 1 Met / Gln / Leu). Плантацинанины располагаются в клеточной стенке, имеют размер около 10–22 кДа, классифицируются как белки меди типа I на основании их спектроскопических и магнитных свойств и, как считается, участвуют в переносе электронов между донором и акцептором (Sakurai and Катаока, 2007; Feng et al., 2013). Присутствие Cu на поверхности белка может способствовать их участию в продукции ROS (Dong et al., 2005). Этим белкам приписывают разные роли. Во время опыления плантацианин играет центральную роль в развитии пыльцевых трубок и пыльников (рис. 4). В частности, хемоцианин лилии, который был первым плантацианином, функционально охарактеризованным, сильно выражен в стигме и стиле и вызывает хемотропизм пыльцевых трубок (Kim et al., 2003). Наряду с этой важной ролью в воспроизводстве растений плантацианины обычно индуцируются при стрессовом воздействии (тяжелые металлы, низкая температура и высокая соленость), что позволяет предположить, что они участвуют в защите растений (Ma et al., 2011; Монури и Вошере, 2011 г .; Feng et al., 2013). Последовательности транскриптов плантацианинов Arabidopsis обнаруживают сильную комплементарность с Cu-микроРНК (Andrés-Colás et al., 2010; Zhang et al., 2014). В частности, ген TaCLP1 , который кодирует предполагаемый белок плантацианина пшеницы, является мишенью для miR408 (Feng et al., 2013). Добавка меди в пшеницу и Arabidopsis вызывает подавление активности miR408 и сопутствующую активацию генов плантацианина, тем самым подтверждая опосредование, осуществляемое miRNA, и наличие перекрестной связи между доступностью меди и накоплением транскриптов плантацианина (Abdel-Ghany and Pilon , 2008; Feng et al., 2013). Интересно, что молчание гена плантацианина TaCLP1 в пшенице индуцировало снижение устойчивости к полосатой ржавчине, предполагая, что TaCLP1 участвует в пути устойчивости к этому патогену. Однако подробный механизм еще предстоит изучить (Feng et al., 2013).
Степень метилэстерификации пектина контролирует допуск
тяжелого металлаСтенки растительных клеток богаты полисахаридами, способными связывать двухвалентные и трехвалентные катионы металлов посредством взаимодействия с их функциональными группами –COOH, –OH и –SH (Krzesłowska, 2010).У растений эти взаимодействия в основном связаны с полисахаридами, богатыми карбоксильными группами, такими как гомогалактуронаны (HGA). После их синтеза в Golgi, HGA секретируются во внеклеточную область, где они следуют определенным модификациям, управляемым пектинметилэстеразами (PMEs, EC 3.1.1.11) и пектинацетилазами, что в конечном итоге влияет на их способность связываться с металлами (Krzesłowska, 2010).
Накопление металлов в апопласте в основном изучается у видов или популяций растений, демонстрирующих замечательную способность выживать на металлоносных почвах.У металлоискателя S. paradoxa в апоплазме корня Cu-толерантных растений обычно накапливается меньше Cu, чем у чувствительных, и это, по-видимому, связано с уменьшением общего количества пектинов и повышенной степенью метилирования пектина (Colzi et al. , 2011). Аналогичным образом сообщалось о высокой степени метилэтерифицированных пектинов и, следовательно, меньшем количестве остатков свободной пектиновой кислоты в клеточной стенке у устойчивой к Al кукурузы (Eticha et al., 2005). Исключение меди толерантным к металлам S. paradoxa , по-видимому, связано с тонким ремоделированием полисахаридов клеточной стенки, по крайней мере, в корнях.Поскольку более высокая концентрация пектина коррелирует с более высоким накоплением Cu как в апопласте, так и в симпласте, снижение концентрации пектина и повышение уровня пектинов с высоким содержанием метилэстерифицированных этерифицированных металлов у устойчивых к металлам видов может привести к снижению поглощения Cu корнями. , тем самым ограничивая его накопление в растении и повышая устойчивость (Colzi et al., 2012). В наиболее устойчивых к Cu популяциях S. paradoxa Cu также влияет на лигнификацию корней, дифференциацию сосудов и выработку слизи (Colzi et al., 2012, 2015).
Фактически, метилэстерификация пектина является важным фактором в модуляции толерантности к различным металлам, в исключителях металлов растений и в гипераккумуляторах. В корне Cd-гипераккумулирующего экотипа Sedum alfredii сообщалось о более высокой степени метилированных пектинов по сравнению с негипераккумулирующим экотипом. Это было связано с более низкой активностью пектинметилэстеразы у гипераккумулирующего экотипа в присутствии и в отсутствие Cd и с шестикратным увеличением концентрации Cd в ксилемном соке.В глобальном масштабе это предполагает, что Cd более плотно удерживается в клеточной стенке корня негипераккумулирующего экотипа из-за большего количества свободных остатков пектиновой кислоты, тем самым отрицательно влияя на загрузку металлов в ксилему этого растения (Li T. et al. , 2014).
Аскорбат-индуцированные гидроксильные радикалы вызывают окислительное расщепление полисахаридов стенок клеток растений
Помимо незаменимой роли Cu в ряде окислительно-восстановительных белков, свободная Cu может генерировать гидроксильные радикалы, способные вызывать неферментативное разрушение полимеров клеточной стенки, что приводит к разрыхлению клеточной стенки.Основными требованиями для разрыхления клеточной стенки, вызванного OH • , являются присутствие O 2 , переходного металла, такого как Cu 2+ , и соответствующего донора электронов, такого как аскорбат, способного восстанавливать апопластный Cu 2+ до Cu + и O 2 до H 2 O 2 (Fry, 1998; Fry et al., 2002). Такое образование гидроксильных радикалов, индуцированных аскорбатом, может особенно происходить во время созревания плодов, когда согласованное действие аскорбата и Cu (II) генерирует гидроксильные радикалы в апопласте, тем самым вызывая неферментативное расщепление комплексов арабиногалактан-пектин с высоким содержанием Gal. (Рисунок 4; Дамвилл и Фрай, 2003). In vivo доказательства продукции OH • в апопласте и расщепления специфических полисахаридов клеточной стенки были описаны в удлиненных колеоптилях кукурузы, корешках и крышечках эндосперма прорастающих семян кресс-салата (Müller et al., 2009). Увеличение отношения заряда к массе деэтерифицированного пектина, в дополнение к увеличению его восприимчивости к индуцированному аскорбатом расщеплению гидроксильных радикалов. Поскольку деэтерификация катализируется РМЕ, увеличение активности РМЕ может, таким образом, привести к более высокой чувствительности клеточной стенки к неферментативному расщеплению пектиновых полисахаридов (Dumville and Fry, 2003).
Заключение
За последние годы знания о регулировании поглощения, транспорта и распределения Cu по всему предприятию значительно расширились, и все больше и больше выясняются основные зависящие от меди и контролирующие процессы. Однако большая часть информации по-прежнему отсутствует, особенно в отношении того, как медь импортируется в митохондрии и как она достигает своих молекулярных мишеней в этой органелле. Хотя широкий процесс транспорта меди в стволе изучается, многие детали этих процессов еще предстоит объяснить, особенно в отношении природы переносчиков и хелаторов, которые обеспечивают циркуляцию меди между клетками мезофилла и сосудистой сетью.Неясно, как эти игроки развиваются в течение жизненного цикла растения и как оно эволюционировало в царстве растений.
В целом кажется, что регулирование поглощения, транспорта и секвестрации Cu тесно связано с другими путями регуляции развития и окружающей среды. Молекулярные акторы в этой интеграции частично известны, однако то, как эта интеграция влияет на фенотип растений, требует дальнейшего изучения. Фактически, большинство достижений в последние годы было достигнуто за счет использования целевого анализа.Построение метаболических карт с использованием методов высокой пропускной способности может предоставить дополнительную ценную информацию, касающуюся полной интеграции сигналов, которые изменяются доступностью Cu.
Авторские взносы
Все перечисленные авторы внесли существенный, прямой и интеллектуальный вклад в работу и одобрили ее к публикации.
Заявление о конфликте интересов
Авторы заявляют, что исследование проводилось в отсутствие каких-либо коммерческих или финансовых отношений, которые могут быть истолкованы как потенциальный конфликт интересов.
Благодарность
Авторы благодарят частичную финансовую поддержку, полученную через Национальный исследовательский фонд, проект FNR CANCAN C13 / SR / 5774202.
Список литературы
Абдель-Гани, С. Э., Мюллер-Муле, П., Нийоги, К. К., Пилон, М., и Шиканаи, Т. (2005). Две АТФазы Р-типа необходимы для доставки меди в хлоропласты Arabidopsis thaliana . Растительная клетка 17, 1233–1251. DOI: 10.1105 / tpc.104.030452
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Абдель-Гани, С.Э. и Пилон М. (2008). Опосредованное микроРНК системное подавление экспрессии белка меди в ответ на низкую доступность меди в Arabidopsis . J. Biol. Chem. 283, 15932–15945. DOI: 10.1074 / jbc.M801406200
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Alejandro, S., Lee, Y., Tohge, T., Sudre, D., Osorio, S., Park, J., et al. (2012). AtABCG29 является переносчиком монолигнола, участвующим в биосинтезе лигнина. Curr. Биол. 22, 1207–1212.DOI: 10.1016 / j.cub.2012.04.064
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Аллоуэй, Б. Дж. (2013). «Источники тяжелых металлов и металлоидов в почвах» в «Тяжелые металлы в почвах. Загрязнение окружающей среды», , изд. Б. Дж. Аллоуэй (Дордрехт: Springer, Нидерланды), 11–50.
Google Scholar
Андо Ю., Нагата С., Янагисава С. и Йонеяма Т. (2012). Медь в соках ксилемы и флоэмы риса ( Oryza sativa ): влияние умеренных концентраций меди в ростовой среде на накопление пяти основных металлов и анализ видового состава медьсодержащих соединений. Функц. Plant Biol. 40, 89–100. DOI: 10.1071 / FP12158
CrossRef Полный текст | Google Scholar
Андрес-Колас, Н., Переа-Гарсия, А., Пуиг, С., и Пеньяррубиа, Л. (2010). Дерегулированный транспорт меди влияет на развитие Arabidopsis , особенно при отсутствии экологических циклов. Plant Phy
Определение меди и синонимов меди (английский)
| Внешний вид | |||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| красно-оранжевый металлический блеск Самородная медь (размер ~ 4 см) | |||||||||||||||
| Общая недвижимость | |||||||||||||||
| Имя, символ, номер | медь, Cu, 29 | ||||||||||||||
| Произношение | / ˈkɒpər / KOP -ər | ||||||||||||||
| Категория элемента | переходный металл | ||||||||||||||
| Группа, период, блок | 11, 4, д | ||||||||||||||
| Стандартный атомный вес | 63.546 (3) | ||||||||||||||
| Электронная конфигурация | [Ar] 3d 10 4s 1 | ||||||||||||||
| Электронов на оболочку | 2, 8, 18, 1 (Изображение) | ||||||||||||||
| Физические свойства | |||||||||||||||
| Фаза | цельный | ||||||||||||||
| Плотность (около комнатной) | 8,94 г · см −3 | ||||||||||||||
| Плотность жидкости при т.пл. | 8,02 г · см −3 | ||||||||||||||
| Температура плавления | 1357.77 К, 1084,62 ° С, 1984,32 ° F | ||||||||||||||
| Температура кипения | 2835 К, 2562 ° С, 4643 ° F | ||||||||||||||
| Теплота плавления | 13,26 кДж · моль -1 | ||||||||||||||
| Теплота испарения | 300,4 кДж · моль −1 | ||||||||||||||
| Молярная теплоемкость | 24,440 Дж · моль −1 · K −1 | ||||||||||||||
| Давление пара | |||||||||||||||
| |||||||||||||||
| Атомные свойства | |||||||||||||||
| Степени окисления | +1, +2 , +3, +4 (слабощелочная окись) | ||||||||||||||
| Электроотрицательность | 1.90 (шкала Полинга) | ||||||||||||||
| Энергии ионизации (подробнее) | 1-я: 745,5 кДж · моль -1 | ||||||||||||||
| 2-я: 1957,9 кДж · моль -1 | |||||||||||||||
| 3-я: 3555 кДж · моль −1 | |||||||||||||||
| Атомный радиус | 128 вечера | ||||||||||||||
| Ковалентный радиус | 132 ± 4 вечера | ||||||||||||||
| Радиус Ван-дер-Ваальса | 140 вечера | ||||||||||||||
| Разное | |||||||||||||||
| Кристаллическая структура | гранецентрированная кубическая | ||||||||||||||
| Магнитный заказ | диамагнитный [1] | ||||||||||||||
| Удельное электрическое сопротивление | (20 ° С) 16.78 нОм · м | ||||||||||||||
| Теплопроводность | 401 Вт · м −1 · K −1 | ||||||||||||||
| Тепловое расширение | (25 ° C) 16,5 мкм · м −1 · K −1 | ||||||||||||||
| Скорость звука (тонкий стержень) | (r.t.) (отожженный) 3810 м · с -1 | ||||||||||||||
| Модуль Юнга | 110–128 ГПа | ||||||||||||||
| Модуль сдвига | 48 ГПа | ||||||||||||||
| Объемный модуль | 140 ГПа | ||||||||||||||
| Коэффициент Пуассона | 0.34 | ||||||||||||||
| Твердость по Моосу | 3,0 | ||||||||||||||
| Твердость по Виккерсу | 369 МПа | ||||||||||||||
| Твердость по Бринеллю | 874 МПа | ||||||||||||||
| Регистрационный номер CAS | 7440-50-8 | ||||||||||||||
| Наиболее стабильные изотопы | |||||||||||||||
| Основная статья: Изотопы меди | |||||||||||||||
| · р | |||||||||||||||
Медь (/ ˈkɒpər / KOP -ər ) представляет собой химический элемент с символом Cu (от латинского: Curum ) и атомным номером 29.Это пластичный металл с очень высокой теплопроводностью и электропроводностью. Чистая медь мягкая и податливая; свежая поверхность имеет красновато-оранжевый цвет. Он используется как проводник тепла и электричества, строительный материал и входит в состав различных металлических сплавов.
Металл и его сплавы использовались тысячи лет. В римскую эпоху медь в основном добывалась на Кипре, отсюда и название металла — сyprium (металл Кипра), позднее сокращенное до сuprum .Его соединения обычно встречаются в виде солей меди (II), которые часто придают синий или зеленый цвет минералам, таким как бирюза, и исторически широко использовались в качестве пигментов. Архитектурные конструкции, построенные из меди, корродируют, давая зеленую зелень (или патину). В декоративном искусстве заметно выделяется медь как сама по себе, так и в составе пигментов.
Ионы меди (II) растворимы в воде, при низкой концентрации они действуют как бактериостатические вещества, фунгициды и консерванты для древесины.В достаточном количестве они ядовиты для высших организмов; в более низких концентрациях он является незаменимым микроэлементом для всех высших растений и животных. Основные области, где медь содержится в организме животных, — это печень, мышцы и кости.
Характеристики
Физический
Медь чуть выше точки плавления сохраняет свой розовый блеск, когда достаточно света затмевает оранжевый цвет накала.
Медь, серебро и золото входят в группу 11 Периодической таблицы, и у них есть определенные атрибуты: у них есть один s-орбитальный электрон на вершине заполненной d-электронной оболочки, и они характеризуются высокой пластичностью и электропроводностью.Заполненные d-оболочки в этих элементах не вносят большой вклад в межатомные взаимодействия, в которых преобладают s-электроны через металлические связи. В отличие от металлов с неполными d-оболочками, металлические связи в меди не имеют ковалентного характера и являются относительно слабыми. Этим объясняется низкая твердость и высокая пластичность монокристаллов меди. [2] В макроскопическом масштабе введение протяженных дефектов в кристаллическую решетку, таких как границы зерен, препятствует течению материала под действием приложенного напряжения, тем самым увеличивая его твердость.По этой причине медь обычно поставляется в мелкозернистой поликристаллической форме, которая имеет большую прочность, чем монокристаллические формы. [3]
Низкая твердость меди отчасти объясняет ее высокую электрическую (59,6 × 10 6 См / м) и, следовательно, высокую теплопроводность, которые являются вторыми по величине среди чистых металлов при комнатной температуре. [4] Это связано с тем, что сопротивление переносу электронов в металлах при комнатной температуре в основном возникает из-за рассеяния электронов на тепловых колебаниях решетки, которые относительно слабы для мягкого металла. [2] Максимально допустимая плотность тока меди на открытом воздухе составляет приблизительно 3,1 × 10 6 А / м 2 площади поперечного сечения, при превышении которой она начинает чрезмерно нагреваться. [5] Как и в случае с другими металлами, если медь приложить к другому металлу, произойдет гальваническая коррозия. [6]
Вместе с осмием (голубоватым) и золотом (желтым) медь является одним из трех элементарных металлов с естественным цветом, отличным от серого или серебра. [7] Чистая медь имеет оранжево-красный цвет и на воздухе приобретает красноватый оттенок.Характерный цвет меди возникает в результате электронных переходов между заполненными 3d и полупустыми 4s-оболочками атомов — разность энергий между этими оболочками такова, что соответствует оранжевому свету. Тот же механизм учитывает желтый цвет золота. [2]
Химическая промышленность
Неокисленный медный провод (слева) и окисленный медный провод (справа).
Восточная башня Королевской обсерватории в Эдинбурге. Отчетливо виден контраст между отремонтированной медью, установленной в 2010 году, и зеленым цветом оригинальной меди 1894 года.Медь образует множество соединений со степенями окисления +1 и +2, которые часто называют меди и меди соответственно. [8] Не реагирует с водой, но медленно реагирует с кислородом воздуха, образуя слой коричнево-черного оксида меди. В отличие от окисления железа влажным воздухом, этот оксидный слой останавливает дальнейшую объемную коррозию. Зеленый слой зелени (карбоната меди) часто можно увидеть на старых медных конструкциях, таких как Статуя Свободы, самая большая медная статуя в мире, построенная с использованием репуссе и чеканки. [9] Сероводород и сульфиды реагируют с медью с образованием различных сульфидов меди на поверхности. В последнем случае медь корродирует, как это видно, когда медь подвергается воздействию воздуха, содержащего соединения серы. [10] Кислородсодержащие растворы аммиака образуют водорастворимые комплексы с медью, а также кислород и соляная кислота с образованием хлоридов меди и подкисленный пероксид водорода с образованием солей меди (II). Хлорид меди (II) и пропорциональный состав меди с образованием хлорида меди (I). [11]
Изотопы
Основная статья: Изотопы медиЕсть 29 изотопов меди. 63 Cu и 65 Cu стабильны, причем 63 Cu составляет примерно 69% меди природного происхождения; у них обоих есть спин 3/2. [12] Остальные изотопы радиоактивны, наиболее стабильным из них является 67 Cu с периодом полураспада 61,83 часа. [12] Было охарактеризовано семь метастабильных изотопов, из которых 68m Cu — самый долгоживущий с периодом полураспада 3.8 мин. Изотопы с массовым числом выше 64 распадаются на β — , а изотопы с массовым числом ниже 64 распадаются на β + . 64 Cu с периодом полураспада 12,7 часа распадается в обоих направлениях. [13]
62 Cu и 64 Cu имеют важное применение. 64 Cu представляет собой радиоконтраст для рентгеновских изображений и в комплексе с хелатом может использоваться для лечения рака. 62 Cu используется в 62 Cu-PTSM, который является радиоактивным индикатором для позитронно-эмиссионной томографии. [14]
происшествие
Медь может быть найдена как самородная медь, так и в составе минералов. Самородная медь представляет собой поликристалл, размер самого большого из описанных монокристаллов составляет 4,4 × 3,2 × 3,2 см. [15] Самая большая масса элементарной меди весила 420 тонн и была обнаружена в 1857 году на полуострове Кевино в Мичигане, США. [16] Существует множество примеров медьсодержащих минералов: халькопирит и халькоцит — сульфиды меди, азурит и малахит — карбонаты меди, а куприт — оксид меди. [4] Медь присутствует в земной коре в концентрации около 50 частей на миллион (ppm), [16] , а также синтезируется в массивных звездах. [17]
Производство
Тенденции мирового производства
Производство меди в 2005 г.
Цены на медь в 2003–2011 гг., Долл. США за тонну
Большая часть меди добывается или извлекается в виде сульфидов меди из крупных карьеров в медно-порфировых месторождениях, содержащих 0.От 4 до 1,0% меди. Примеры включают Chuquicamata в Чили, Bingham Canyon Mine в Юте, США и Эль-Чино Mine в Нью-Мексико, США. По данным Британской геологической службы, в 2005 году Чили занимала первое место по добыче меди с долей не менее одной трети в мире, за ней следовали США, Индонезия и Перу. [4] Количество используемой меди увеличивается, а доступного количества едва хватает, чтобы позволить всем странам достичь уровня использования в развитых странах мира. [18]
Запасы
Медь использовалась не менее 10 000 лет, но более 95% всей меди, когда-либо добытой и выплавленной, было извлечено с 1900 года. Как и во многих природных ресурсах, общее количество меди на Земле огромно (около 10 14 тонн только в верхнем километре земной коры, что составляет около 5 миллионов лет при нынешних темпах добычи). Однако лишь малая часть этих запасов экономически жизнеспособна с учетом нынешних цен и технологий.Различные оценки существующих запасов меди, доступных для добычи, варьируются от 25 до 60 лет, в зависимости от основных предположений, таких как темпы роста. [19] Переработка — основной источник меди в современном мире. [20] Из-за этих и других факторов будущее производства и поставок меди является предметом многочисленных дискуссий, включая концепцию пиковой меди, аналогичной пиковой массе.
Цена на медь исторически была нестабильной, [21] , и она выросла в пять раз по сравнению с 60-летним минимумом в 0 долларов США.60 / фунт (1,32 доллара США / кг) в июне 1999 года до 3,75 доллара США за фунт (8,27 доллара США / кг) в мае 2006 года. В феврале 2007 года цена упала до 2,40 доллара США за фунт (5,29 доллара США / кг), а затем вновь выросла до 3,50 доллара США за фунт. фунт (7,71 доллара США / кг) в апреле 2007 года. [22] В феврале 2009 года ослабление мирового спроса и резкое падение цен на сырьевые товары после пиков прошлого года оставили цены на медь на уровне 1,51 доллара США за фунт. [23]
Методы
Основная статья: Методы извлечения медиСреднее содержание меди в рудах составляет всего 0.6%, и большинство промышленных руд составляют сульфиды, особенно халькопирит (CuFeS 2 ) и в меньшей степени халькоцит (Cu 2 S). [24] Эти минералы концентрируются из измельченных руд до уровня 10–15% меди путем пенной флотации или биовыщелачивания. [25] Нагревание этого материала с кремнеземом при взвешенной плавке удаляет большую часть железа в виде шлака. В этом процессе используется более легкое преобразование сульфидов железа в его оксиды, которые, в свою очередь, реагируют с кремнеземом с образованием силикатного шлака, который плавает поверх нагретой массы.Полученный медный штейн , состоящий из Cu 2 S, затем обжигается для превращения всех сульфидов в оксиды: [24]
- 2 Cu 2 S + 3 O 2 → 2 Cu 2 O + 2 SO 2
Закись меди превращается в черновая медь при нагревании:
- 2 Cu 2 O → 4 Cu + O 2
В процессе производства штейна Садбери только половина сульфида превращается в оксид, а затем этот оксид используется для удаления остальной серы в виде оксида.Затем он был подвергнут электролитической очистке, и анодный шлам был использован для получения содержащихся в нем платины и золота. На этом этапе используется относительно легкое восстановление оксидов меди до металлической меди. Природный газ продувается через блистер для удаления большей части оставшегося кислорода, а полученный материал подвергается электрорафинированию с получением чистой меди: [26]
- Cu 2+ + 2 e — → Cu
Переработка
Медь, как и алюминий, на 100% пригодна для вторичной переработки без потери качества как в сыром виде, так и в готовом продукте.По объему медь является третьим по величине перерабатываемым металлом после железа и алюминия. По оценкам, 80% когда-либо добытой меди до сих пор используется. [27] Согласно отчету International Resource Panel «Запасы металлов в обществе», глобальные запасы меди на душу населения, используемой в обществе, составляют 35–55 кг. В основном это происходит в более развитых странах (140–300 кг на душу населения), а не в менее развитых странах (30–40 кг на душу населения).
Процесс переработки меди проходит примерно так же, как и при извлечении меди, но требует меньшего количества шагов.Медный лом высокой чистоты плавится в печи, затем восстанавливается и разливается в заготовки и слитки; Лом более низкой чистоты очищается гальваническим способом в ванне с серной кислотой. [28]
Соединения
Бинарные соединения
Что касается других элементов, то простейшие соединения меди — это бинарные соединения, т.е. содержащие только два элемента. Основные из них — оксиды, сульфиды и галогениды. Известны как оксиды меди, так и оксиды меди. Среди множества сульфидов меди важными примерами являются сульфид меди (I) и сульфид меди (II).
Галогениды меди с хлором, бромом и йодом известны, как и галогениды меди с фтором, хлором и бромом. Попытки получить йодид меди (II) дают йодид меди и йод. [8]
- 2 Cu 2+ + 4 I — → 2 CuI + I 2
Координационная химия
Медь, как и все металлы, образует координационные комплексы с лигандами. В водном растворе медь (II) существует как [Cu (H 2 O) 6 ] 2+ .Этот комплекс демонстрирует самую быструю скорость водообмена (скорость присоединения и отрыва водных лигандов) для любого комплекса переходного металла. Добавление водного гидроксида натрия вызывает осаждение светло-голубого твердого гидроксида меди (II). Упрощенное уравнение:
- Cu 2+ + 2 OH — → Cu (OH) 2
Водный раствор аммиака дает такой же осадок. При добавлении избытка аммиака осадок растворяется с образованием тетраамминмеди (II):
- Cu (H 2 O) 4 (OH) 2 + 4 NH 3 → [Cu (H 2 O) 2 (NH 3 ) 4 ] 2 + + 2 H 2 O + 2 OH —
Многие другие оксианионы образуют комплексы; к ним относятся ацетат меди (II), нитрат меди (II) и карбонат меди (II).Сульфат меди (II) образует синий кристаллический пентагидрат, который является наиболее известным соединением меди в лаборатории. Он используется в фунгициде, называемом бордосской смесью. [29]
Полиолы, соединения, содержащие более одной спиртовой функциональной группы, обычно взаимодействуют с солями двухвалентной меди. Например, соли меди используются для проверки восстанавливающих сахаров. В частности, при использовании реагента Бенедикта и раствора Фелинга о присутствии сахара свидетельствует изменение цвета с синего Cu (II) на красноватый оксид меди (I). [30] Реагент Швейцера и родственные ему комплексы с этилендиамином и другими аминами растворяют целлюлозу. [31] Аминокислоты образуют очень стабильные хелатные комплексы с медью (II). Существует множество влажных химических тестов на ионы меди, в том числе с участием ферроцианида калия, который дает коричневый осадок с солями меди (II).
Медьорганическая химия
Основная статья: Медноорганическое соединениеСоединения, содержащие связь углерод-медь, известны как медноорганические соединения.Они очень реактивны по отношению к кислороду с образованием оксида меди (I) и имеют много применений в химии. Их синтезируют обработкой соединений меди (I) реактивами Гриньяра, концевыми алкинами или литийорганическими реагентами; [32] , в частности, последняя описанная реакция дает реагент Гилмана. Они могут подвергаться замещению алкилгалогенидами с образованием продуктов сочетания; как таковые, они важны в области органического синтеза. Ацетилид меди (I) очень чувствителен к ударам, но является промежуточным звеном в таких реакциях, как сочетание Кадио-Ходкевича [33] и сочетание Соногашира. [34] Добавление конъюгата к енонам [35] и карбокупрация алкинов [36] также может быть достигнуто с помощью медноорганических соединений. Медь (I) образует множество слабых комплексов с алкенами и оксидом углерода, особенно в присутствии аминных лигандов. [37]
Медь (III) и медь (IV)
Медь (III) наиболее характерна для оксидов. Простым примером является купрат калия, KCuO 2 , сине-черное твердое вещество. Наиболее изученными соединениями меди (III) являются купратные сверхпроводники.Оксид иттрия-бария-меди (YBa 2 Cu 3 O 7 ) состоит из центров Cu (II) и Cu (III). Как и оксид, фторид является высокоосновным анионом и, как известно, стабилизирует ионы металлов в высоких степенях окисления. Действительно, известны как фториды меди (III), так и даже фториды меди (IV), K 3 CuF 6 и Cs 2 CuF 6 соответственно. [8]
Некоторые белки меди образуют оксокомплексы, в состав которых также входит медь (III). [38] С ди- и трипептидами комплексы меди (III) пурпурного цвета стабилизируются депротонированными амидными лигандами. [39]
Комплексы меди (III) также встречаются в качестве промежуточных продуктов в реакциях медноорганических соединений.
История
Медный век
Ржавый медный слиток из Закроса, Крит, в форме шкуры животного, типичной для той эпохи.Медь встречается в природе как самородная медь и была известна некоторым из древнейших известных цивилизаций. Его история использования насчитывает не менее 10 000 лет, и, по оценкам, он был обнаружен в 9000 году до нашей эры на Ближнем Востоке; [40] Медный кулон был найден в северном Ираке и датируется 8700 годом до нашей эры. [41] Есть свидетельства того, что золото и метеоритное железо (но не плавление железа) были единственными металлами, которые использовались людьми до меди. [42] Считается, что история металлургии меди следовала следующей последовательности: 1) холодная обработка самородной меди, 2) отжиг, 3) плавка и 4) метод потери парафина. В юго-восточной Анатолии все четыре металлургических метода появляются более или менее одновременно в начале неолотического века c. 7500 г. до н.э. [43] Однако так же, как сельское хозяйство было независимо изобретено в нескольких частях мира (включая Пакистан, Китай и Америку), выплавка меди была изобретена локально в нескольких разных местах.Вероятно, он был независимо обнаружен в Китае до 2800 г. до н.э., в Центральной Америке примерно в 600 г. н.э. и в Западной Африке примерно в 9–10 веке нашей эры. [44] Литье по выплавляемым моделям было изобретено в 4500–4000 годах до нашей эры в Юго-Восточной Азии. [40] и углеродное датирование установило добычу в Олдерли Эдж в Чешире, Великобритания, в период с 2280 по 1890 год до нашей эры. [45] Эци Ледяной человек, мужчина, датируемый 3300–3200 гг. До н.э., был найден с топором с медной головкой чистотой 99,7%; высокий уровень мышьяка в его волосах предполагает его участие в плавке меди. [46] Опыт работы с медью помог в разработке других металлов; в частности, плавка меди привела к открытию плавки железа. [46] Производство на старом медном комплексе в Мичигане и Висконсине датируется 6000–3000 гг. До н. Э. [47] [48] Природная бронза, разновидность меди, сделанная из руд, богатых кремнием, мышьяком и (реже) оловом, стала широко использоваться на Балканах примерно в 5500 году до нашей эры. Раньше единственным инструментом, сделанным из меди, было шило, которое использовалось для пробивания отверстий в коже и проделывания отверстий под колышки для соединения дерева.Однако введение более прочной формы меди привело к широкому использованию и крупномасштабному производству инструментов из тяжелых металлов, включая топоры, тесла и топоры-тесла. [ необходима ссылка ]
Бронзовый век
Впервые легирование меди с оловом для получения бронзы было начато примерно через 4000 лет после открытия плавки меди и примерно через 2000 лет после того, как «естественная бронза» стала широко использоваться. Бронзовые артефакты из шумерских городов и египетские артефакты из меди и бронзовых сплавов датируются 3000 годом до нашей эры. [49] Бронзовый век начался в Юго-Восточной Европе около 3700 — 3300 гг. До н.э., в Северо-Западной Европе около 2500 г. до н.э. Он закончился началом железного века, 2000–1000 гг. До н.э. на Ближнем Востоке, 600 г. до н.э. в Северной Европе. Переход между периодом неолита и бронзовым веком ранее назывался периодом энеолита (медь-камень), когда медные орудия использовались с каменными. Этот термин постепенно потерял популярность, потому что в некоторых частях мира кальхолит и неолит совпадают с обоих концов.Латунь, сплав меди и цинка, возникла гораздо позже. Он был известен грекам, но во времена Римской империи стал значительным дополнением к бронзе. [49]
Античность и средневековье
В алхимии символ меди был также символом богини и планеты Венеры.В Греции медь была известна под названием chalkos (χαλκός). Это был важный ресурс для римлян, греков и других древних народов. В римские времена он был известен как aes Cyprium , aes — общий латинский термин для медных сплавов и Cyprium с Кипра, где добывалось много меди.Фраза была упрощена до меди , отсюда и английское меди . Афродита и Венера представляли медь в мифологии и алхимии из-за ее сияющей красоты, ее древнего использования в производстве зеркал и ее связи с Кипром, который был священным для богини. Семь небесных светил, известных древним, были связаны с семью металлами, известными в древности, а Венера — с медью. [50]
Первое использование латуни в Британии произошло примерно в III – II веках до нашей эры.В Северной Америке добыча меди началась с незначительной добычи коренными американцами. Известно, что самородная медь добывалась на островах Айл Рояль с помощью примитивных каменных орудий между 800 и 1600. [51] Медная металлургия процветала в Южной Америке, особенно в Перу около 1000 года нашей эры; на других континентах это происходило гораздо медленнее. Были обнаружены медные погребальные украшения 15 века, но коммерческое производство металла началось только в начале 20 века.
Медь играет важную роль в культуре, особенно в денежном выражении. Римляне в VI-III веках до нашей эры использовали куски меди в качестве денег. Сначала ценилась сама медь, но постепенно форма и внешний вид стали более важными. У Юлия Цезаря были свои монеты, сделанные из латуни, а монеты Октавиана Августа Цезаря были сделаны из сплавов Cu-Pb-Sn. Предполагаемый годовой объем производства около 15 000 тонн, римская деятельность по добыче и плавке меди достигла непревзойденного до времен промышленной революции масштаба; наиболее интенсивно заминированы провинции Испании, Кипра и Центральной Европы. [52] [53]
В воротах Иерусалимского храма использована коринфская бронза, изготовленная методом истощения золочения. Это было наиболее распространено в Александрии, где, как считается, началась алхимия. [54] В древней Индии медь использовалась в целостной медицинской науке Аюрведе для хирургических инструментов и другого медицинского оборудования. Древние египтяне (~ 2400 г. до н.э.) использовали медь для стерилизации ран и питьевой воды, а затем при головных болях, ожогах и зуде. Багдадская батарея с медными цилиндрами, припаянными к свинцу, восходит к 248 г. до н.э. — 226 г. н.э. и напоминает гальванический элемент, что наводит на мысль, что это была первая батарея; претензия не проверена. [55]
Современный период
Великая Медная гора — рудник в Фалуне, Швеция, который действовал с 10 века по 1992 год. Он производил две трети потребности Европы в меди в 17 веке и помогал финансировать многие войны Швеции в то время. [56] Он упоминался как национальная сокровищница; В Швеции была валюта, обеспеченная медью. [57]
Использование меди в искусстве не ограничивалось денежными средствами: ее использовали скульпторы эпохи Возрождения в фотографической технике, известной как дагерротип, и в Статуе Свободы.
GCSE CHEMISTRY — Что такое государственные символы? — (s) — (l) — (g) — (aq)
GCSE CHEMISTRY — Что такое государственные символы? — (s) — (l) — (g) — (aq) — НАУКА ЗА РУБЕЖОМ.gcsescience.com 21 год gcsescience.com
Атомная структура
Государство Символы, используемые в химических уравнениях.
Уравнения из двух предыдущих страницы
(3) 2K + Класс 2 2KCl
(4)
4Li
+ O 2 2Li 2 O
все еще требуется состояние
символы должны быть полными.
Полные уравнения словами и символами
будет
калий + хлор
хлорид калия.
2K (т) +
Класс 2 (г) 2KCl (т)
литий +
кислород оксид лития.
4Li (s) +
O 2 (г) 2Li 2 O (т)
Государство
символы в скобках показывают физическое состояние
вещество при температуре реакции.
Твердое (е), жидкое (л), газовое (г),
или растворенный в воде (водн.).
водный называется водным, который составляет
от латинского
слово аква означает воду.
Если вы не знаете
состояние вещества
см плавления
и кипячение
точки.
Если температура плавления выше температуры реакции
температура,
вещество твердое (а).
Если точка кипения ниже температуры реакции
температура,
вещество — газ (г).
Если температура плавления ниже температуры реакции
температура
и точка кипения выше реакции
температура,
тогда вещество жидкое (л).
Ссылки Проверочные тесты Вопросы по пересмотру
gcsescience.com Периодическая таблица Индекс Викторина по уравнениям балансировки gcsescience.com
Дом GCSE химия GCSE Физика
Авторские права © 2015 gcsescience.com. Все права защищены.
.
 у.)
у.)
 Методы огневого и электрорафинирования
используются методы. Последний производит медь высокой чистоты.
подходит для электрического использования.
Методы огневого и электрорафинирования
используются методы. Последний производит медь высокой чистоты.
подходит для электрического использования. 
 Вторая органическая фаза — бесплодная
органический экстрагент, тогда как вторая водная фаза представляет собой «богатую
электролит ». Бесплодный органический экстрагент затем рециркулируют для
повторное использование в приложении к выщелачиванию.
Вторая органическая фаза — бесплодная
органический экстрагент, тогда как вторая водная фаза представляет собой «богатую
электролит ». Бесплодный органический экстрагент затем рециркулируют для
повторное использование в приложении к выщелачиванию.