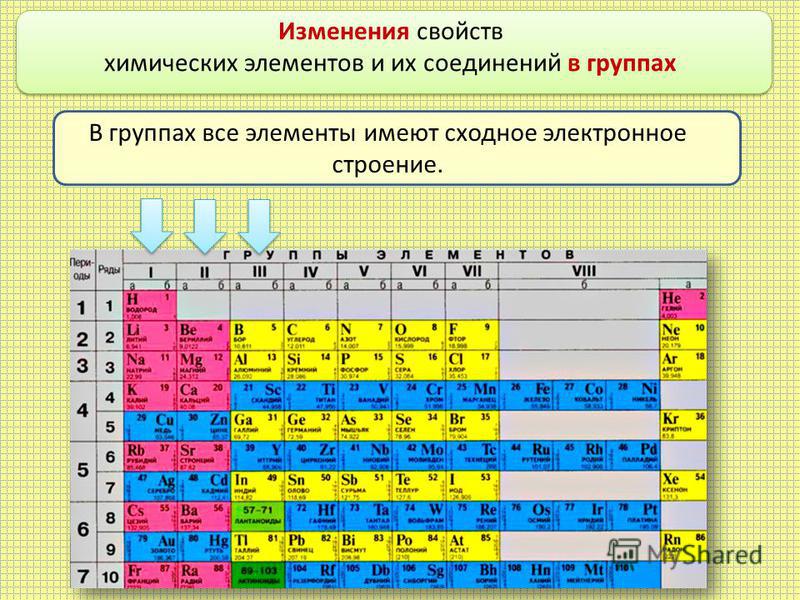
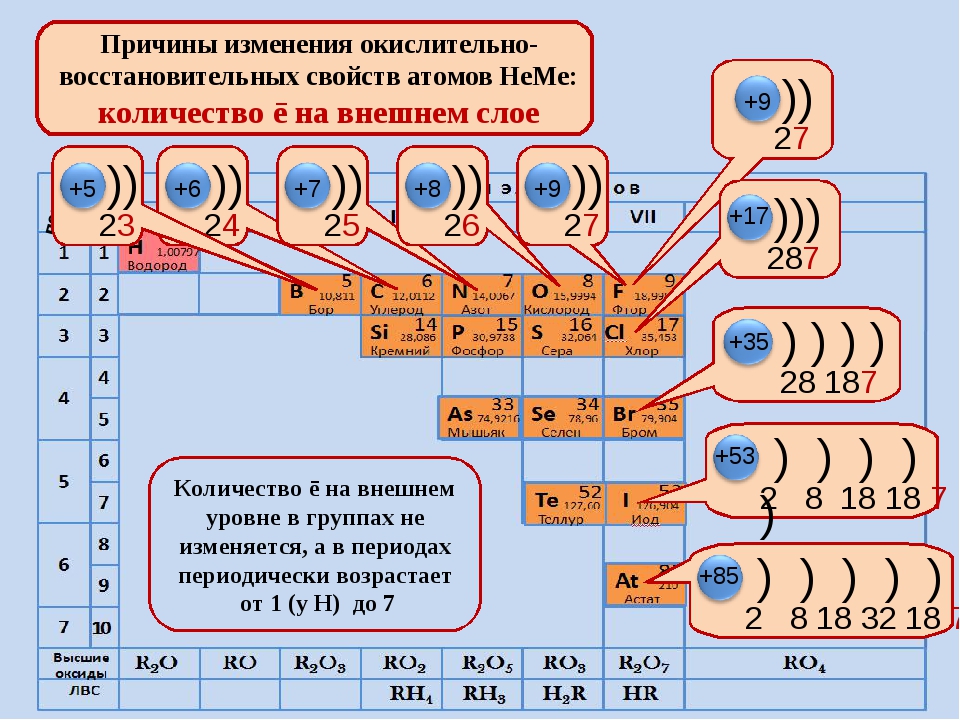
Металлические и неметаллические свойства простых веществ
У атомов металлов малых периодов (I—III) на внешнем электронном слое находится от 1 до 3 электронов, а у атомов неметаллов — от 4 до 8. Исключение составляют атомы водорода — 1 электрон и бора — 3 электрона.
Зная характер изменения радиусов атомов по группам и периодам, а также их электронную структуру, можно объяснить причину изменения металлических и неметаллических свойств атомов элементов, точнее, их простых веществ.
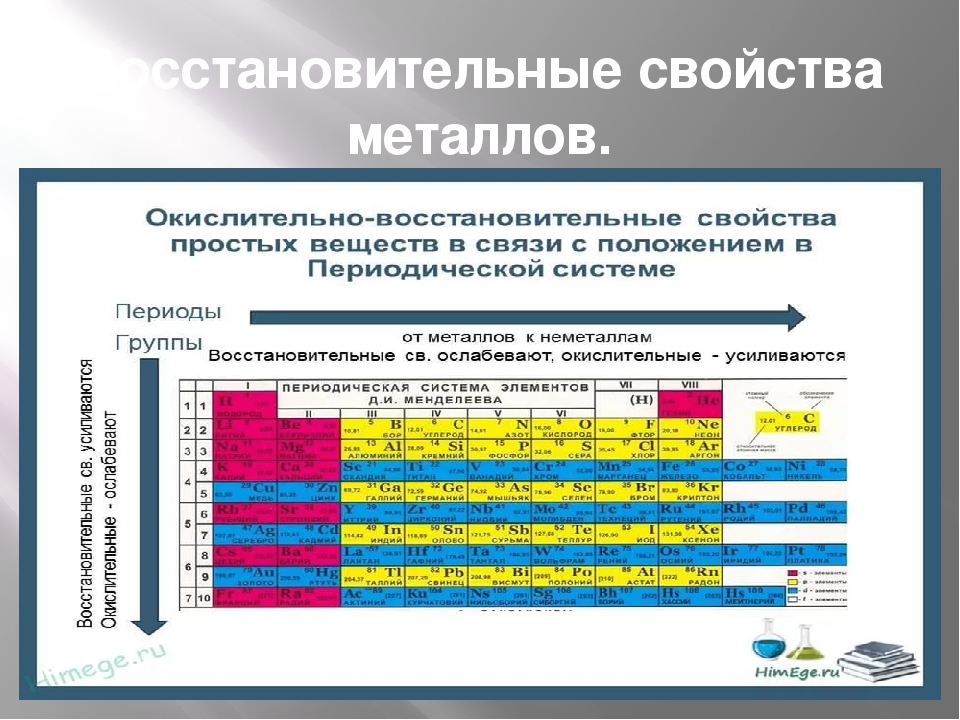
Проявление металлических свойств определяется, прежде всего, способностью атомов данного элемента отдавать электроны с внешнего электронного слоя. Именно наличием у металлов свободных электронов обусловлена их высокая электропроводность.
И наоборот, способность атомов данного элемента присоединять электроны определяет неметаллические свойства его простого вещества.
Усиление металлических свойств щелочных металлов с возрастанием атомного номера элемента связано прежде всего с увеличением радиусов их атомов, т.
В противоположность этому неметаллические свойства элементов группы галогенов ослабевают с увеличением зарядов ядер их атомов, так как растет число электронных слоев. Внешний слой находится все дальше от ядра, поэтому электроны, находящиеся на этом слое, слабее связаны с ядром. Кислотные свойства у оксидов и гидроксидов этих элементов также ослабляются.
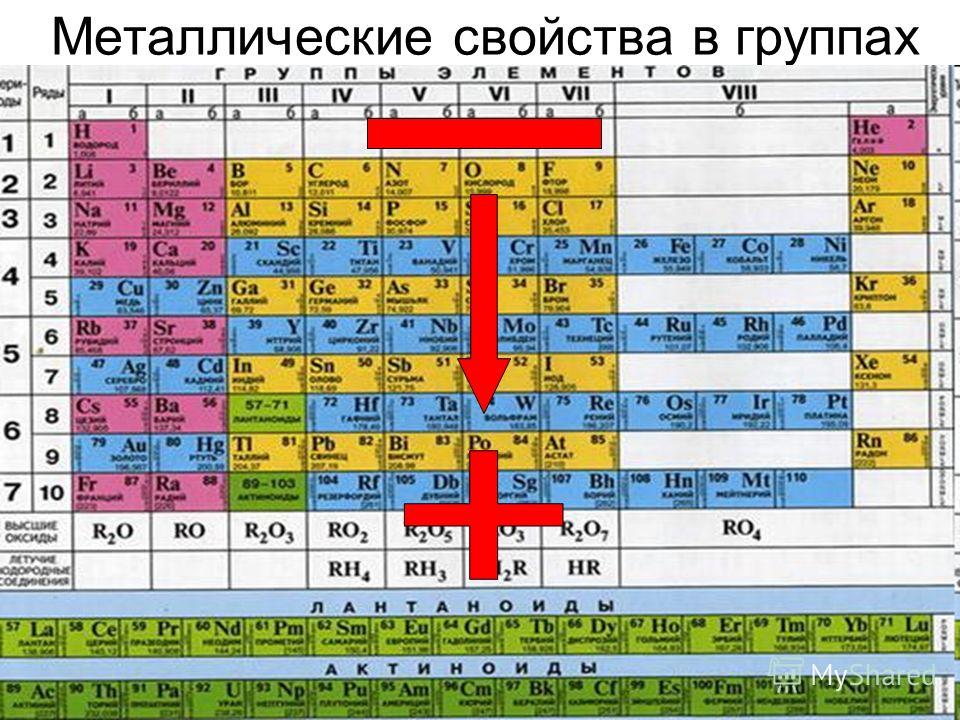
Таким образом, в главных группах (группах А) периодической системы с ростом зарядов ядер атомов химических элементов усиливаются металлические свойства их простых веществ и, соответственно, ослабевают неметаллические. Это особенно наглядно проявляется в группе IVA. В ней свойства простых веществ химических элементов изменяются от неметаллических (у углерода и кремния) к металлическим (у олова и свинца).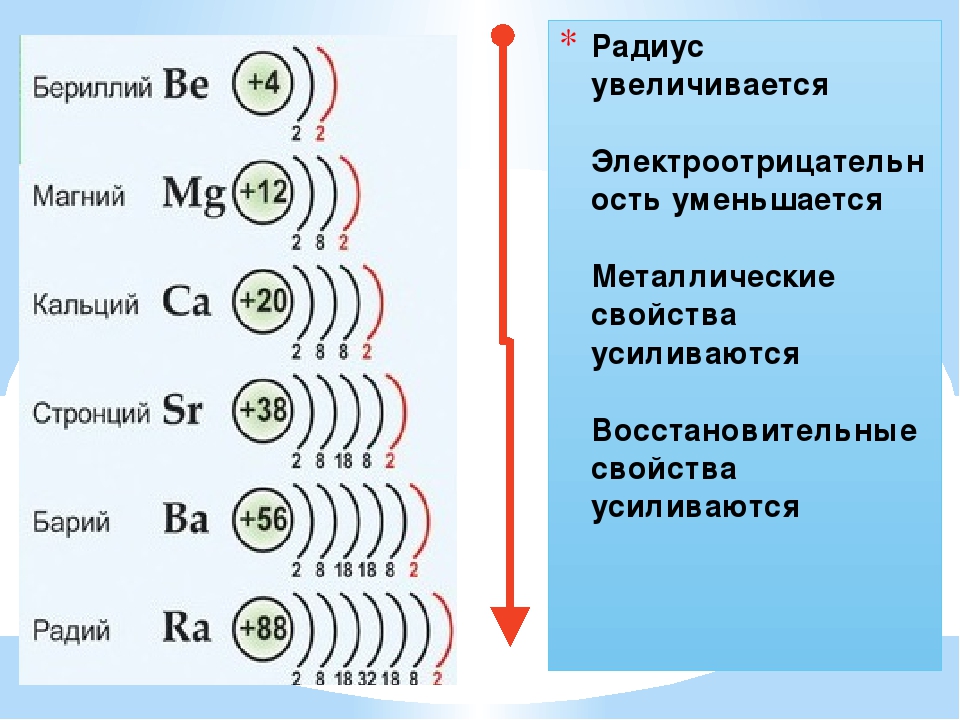
Закономерности изменения различных характеристик химических элементов в малых периодах и главных группах периодической системы на примере IVA-группы показаны в таблице ниже.
| Номер периода | Символ элемента | Заряд ядра атома | Число электронных слоев | Число электронов на внешнем слое | Валентность в высших оксидах |
|---|---|---|---|---|---|
| 1 | — | — | — | — | — |
| 2 | C | 6+ | 2 | 4 | IV |
| 3 | Si | 14+ | 3 | 4 | IV |
| 4 | Ge | 32+ | 4 | 4 | IV |
| 5 | Sn | 50+ | 5 | 4 | IV |
| 6 | Pb | 82+ | 6 | 4 | IV |
В малых периодах с ростом зарядов ядер атомов увеличивается и число электронов на внешнем слое. Они сильнее притягиваются к ядру, поэтому атомам все труднее отдавать электроны и легче присоединять их.
Металлические свойства — Справочник химика 21
Почему у элемента VII группы — марганца преобладают металлические свойства, тогда как стоящие в той же группе галогены являются типичными неметаллами Дать ответ, исходя из строения атомов указанных элементов.Металлические свойства от лития к цезию возрастают, а электропроводность уменьшается. Как это объяснить [c.151]
В подгруппу титана входят элементы побочной подгруппы IV группы — титан, цирконий, гафний и искусственно полученный (см. стр. 112) курчатовий. Металлические свойства выражены у этих элементов сильнее, чем у металлов главной подгруппы четвертой группы — олова и свинца. Атомы элементов подгруппы титана имеют в наружном слое по два электрона, а во втором снаружи слое — по 10 электронов, из которых два — на -подуровне. Поэтому наиболее характерная степень окисленности металлов подгруппы титана равна +4.
Атомы элементов подгруппы титана имеют в наружном слое по два электрона, а во втором снаружи слое — по 10 электронов, из которых два — на -подуровне. Поэтому наиболее характерная степень окисленности металлов подгруппы титана равна +4.
Какой элемент, Ве или Ва, обладает более выраженными металлическими свойствами На основании каких фактов вы отвечаете на этот вопрос Объясните ваш ответ исходя из рассмотрения электронных конфигураций атомов. [c.458]
К подгруппе ванадия относятся элементы побочной подгруппы пятой группы ванадий, ниобий и тантал. Имея в наружном электронном слое атома два или один электрон, эти элементы отличаются от элементов главной подгруппы (азота, фосфора и др.) преобладанием металлических свойств и отсутствием водородных соединений. Но производные элементов обеих подгрупп в высшей степени окисленности имеют значительное сходство.
Сходство между элементами одной группы становится еще менее очевидным в группе 1УА. Углерод представляет собой неметалл, который почти всегда образует четыре ковалентные связи с другими элементами. Его атомы полимеризуются в цепи, давая так называемые органические соединения, и могут образовывать друг с другом не только простые, но и кратные ковалентные связи. Кремний-неметалл, обладающий некоторыми металлическими свойствами, включая серебристый блеск. Он образует ограниченное число гидридов, называемых силанами, которые являются аналогами углеводородов и имеют общую формулу 51 Н2 + 2- Но такие цепи ограничены предельным значением х = 6, и даже силаны с низкой молекулярной массой реагируют с галогенами и кислородом со взрывом. Кремний образует еще один класс полимеров-силоксаны, в которых атомы 81 связаны через мостиковые атомы кислорода
Углерод представляет собой неметалл, который почти всегда образует четыре ковалентные связи с другими элементами. Его атомы полимеризуются в цепи, давая так называемые органические соединения, и могут образовывать друг с другом не только простые, но и кратные ковалентные связи. Кремний-неметалл, обладающий некоторыми металлическими свойствами, включая серебристый блеск. Он образует ограниченное число гидридов, называемых силанами, которые являются аналогами углеводородов и имеют общую формулу 51 Н2 + 2- Но такие цепи ограничены предельным значением х = 6, и даже силаны с низкой молекулярной массой реагируют с галогенами и кислородом со взрывом. Кремний образует еще один класс полимеров-силоксаны, в которых атомы 81 связаны через мостиковые атомы кислорода
Наличие легко теряемого валентного электрона обусловливает металлические свойства щелочных металлов. Поскольку на каждый атом прихо- [c.433]
Аналогичное поведение обнаруживается и у элементов группы VA, но граница между металлами и неметаллами в этой группе проходит ниже. Азот и фосфор являются неметаллами, химия их ковалентных соединений и возможные состояния окисления определяются наличием пяти валентных электронов в конфигурации Азот и фосфор чаще всего имеют степени окисления — 3, -Ь 3 и +5. Мыщьяк As и сурьма Sb-семи-металлы, образующие амфотерные оксиды, и только висмут обладает металлическими свойствами. Для As и Sb наиболее важным является состояние окисления + 3. Для Bi оно единственно возможное, если не считать степеней окисления, проявляемых в некоторых чрезвычайно специфических условиях. Висмут не может терять все пять валентных электронов требуемая для этого энергия слишком велика. Однако он теряет три бр-электро-на, образуя ион Bi .
Азот и фосфор являются неметаллами, химия их ковалентных соединений и возможные состояния окисления определяются наличием пяти валентных электронов в конфигурации Азот и фосфор чаще всего имеют степени окисления — 3, -Ь 3 и +5. Мыщьяк As и сурьма Sb-семи-металлы, образующие амфотерные оксиды, и только висмут обладает металлическими свойствами. Для As и Sb наиболее важным является состояние окисления + 3. Для Bi оно единственно возможное, если не считать степеней окисления, проявляемых в некоторых чрезвычайно специфических условиях. Висмут не может терять все пять валентных электронов требуемая для этого энергия слишком велика. Однако он теряет три бр-электро-на, образуя ион Bi .
В главных подгруппах с увеличением порядкового номера уменьшаются неметаллические свойства и увеличиваются металлические свойства. В периодах с увеличением порядкового номера металлические свойства уменьшаются, а неметаллические свойства возрастают.
 [c.42]
[c.42] Вопросы химического взаимодействия металлов между собой, а также о неметаллами, если продукты их взаимодействия сохраняют металлические свойства, изучает один из разделов неорганической химии — металлохимия.
У электронов одного и того же периода при переходе от щелочного металла к благородному газу заряд ядра постепенно возрастает, а радиус атома уменьшается. Поэтому потенциал ионизации постепенно увеличивается, а металлические свойства ослабевают. Иллюстрацией этой закономерности могут служить первые потенциалы ионизации элементов второго и третьего периодов (табл. б). [c.102]
В своих соединениях сурьма обнаруживает большое сходств с мышьяком, но отличается от него более сильно выраженным металлическими свойствами.
Однородные системы, состоящие из двух или оолее металлов с характерными металлическими свойствами [c.547]
Какие же вещества являются элементами Первыми правильно установленными элементами были металлы-золото, серебро, медь, олово, железо, платина, свинец, цинк, ртуть, никель, вольфрам, кобальт, И вообще из 105 известных к настоящему времени элементов только 22 не обладают металлическими свойствами. Пять неметаллов (гелий, неон, аргон, криптон и ксенон) были обнаружены в смеси газов, остающейся после удаления из воздуха всего имеющегося в нем азота и кислорода. Химики считали эти благородные газы инертными до 1962 г., когда было показано, что ксенон дает соединения со фтором, наиболее активным в химическом отнощении неметаллом. Другие химически активные неметаллы представляют собой либо газы (например, водород, азот, кислород и хлор), либо хрупкие кристаллические вещества (например, углерод, сера, фосфор, мыщьяк и иод). При обычных условиях лишь один неметаллический элемент-бром-находится в жидком состоянии,
Пять неметаллов (гелий, неон, аргон, криптон и ксенон) были обнаружены в смеси газов, остающейся после удаления из воздуха всего имеющегося в нем азота и кислорода. Химики считали эти благородные газы инертными до 1962 г., когда было показано, что ксенон дает соединения со фтором, наиболее активным в химическом отнощении неметаллом. Другие химически активные неметаллы представляют собой либо газы (например, водород, азот, кислород и хлор), либо хрупкие кристаллические вещества (например, углерод, сера, фосфор, мыщьяк и иод). При обычных условиях лишь один неметаллический элемент-бром-находится в жидком состоянии,
Окрашенные кристаллические неметаллы (Те обладает частично металлическими свойствами) [c.304]
Металлы Элементы с металл. Неметаллы и неметалл, свойствами Металлические свойства возрастают- [c.43]
Все лантаноиды и актиноиды обладают типичными металлическими свойствами, характерным блеском и высокой электропроводностью. Они имеют больщую реакционную способность, и их окислительные потенциалы принимают значения порядка 2-3 В. Из-за наличия высоких окислительных потенциалов (и низкой первой энергии ионизации) эти металлы быстро тускнеют на воздухе и легко реагируют с водой, вытесняя из нее водород. [c.451]
Они имеют больщую реакционную способность, и их окислительные потенциалы принимают значения порядка 2-3 В. Из-за наличия высоких окислительных потенциалов (и низкой первой энергии ионизации) эти металлы быстро тускнеют на воздухе и легко реагируют с водой, вытесняя из нее водород. [c.451]
Какое из нескольких различных состояний окисления переходного металла обычно характеризуется наиболее металлическими свойствами в его соединениях Приведите пример. [c.458]
Металлические соединения водорода. Металлическими свойствами обладают водородные соединения (1- и /-элементов. Эти соединения получаются в виде металлоподобных темных порошков или хрупкой массы, их электрическая проводимость и теплопроводность типичны для металлов. Это гидриды нестехиометрического состава. Идеализированный состав металлических гидридов чаще всего отвечает формулам МН (УН, NbH, ТаН), МН, 2гНг, HfHa, ЗсН ) и МН3 (иНз, РаНз). [c.279]
При комнатной температуре газообразный азот не взаимодействует с такими активными металлами, как Na, К, Rb и s. Несмотря на то что при переходе вниз по подгруппе металлические свойства усиливаются, азот реагирует с литием уже при комнатной температуре. Как это объяснить [c.154]
Несмотря на то что при переходе вниз по подгруппе металлические свойства усиливаются, азот реагирует с литием уже при комнатной температуре. Как это объяснить [c.154]
В ряду Се — РЬ наблюдается усиление металлических свойств -и уменьшение доли ковалентной связи в соединениях. Поэтому уменьшается устойчивость ковалентных гидридов ЭН . [c.381]
Свойства. В ряду Se —Те —Ро усиливаются металлические свойства. Если сера — диэлектрик, то селен и теллур имеют как неметаллические, так и полупроводниковые и металлические модификации, а полоний по физическим свойствам похож на свинец и висмут. [c.456]
Усиление металлических свойств следует и из того, что если для серы переход в металлическую модификацию требует давления 23 ГПа, то для теллура необходимо 3 ГПа. Кроме того, реакция [c.456]
Чем больше в атомах данного элемента слабо связанных электронов и чем слабее они связаны с атомами, тем в общем более резко проявляются у него металлические свойства.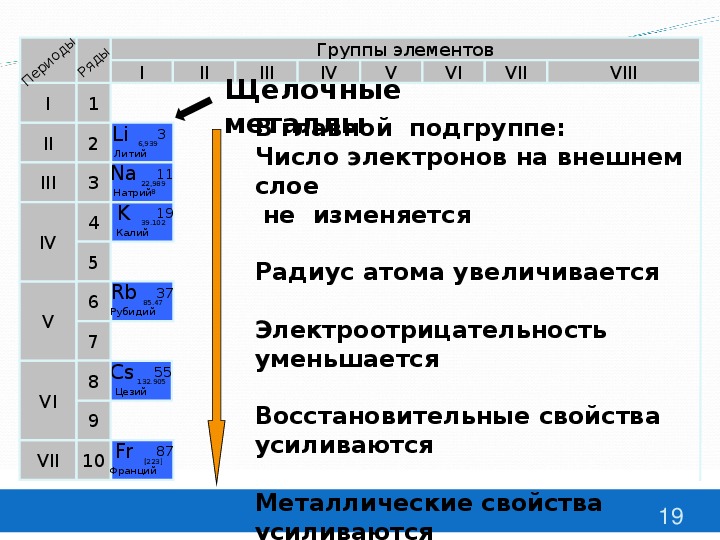 (Конечно, на различные свойства оказывают влияние и разные другие факторы.) [c.135]
(Конечно, на различные свойства оказывают влияние и разные другие факторы.) [c.135]
Это положение справедливо и для нефтяного кокса. При преимущественном росте плоскостных (двухмерных) углеродных сеток возрастают его металлические свойства которые выражаются в увеличении плотности и электропроводности. При этом следует ожидать наименьших характерных для полупроводников значений термоэлектродвижущей силы и минимального уменьшения удельного электросопротивления при нагревании. [c.235]
Нетрудно сообразить, что поскольку щелочноземельные металлы Ве, Mg, Са, 8г и Ва очень сходны по своим химическим свойствам, их следует расположить друг под другом, как это и сделано на рис. 7-3. Каждый период завершается элементами с неметаллическими свойствами, и О, 8, 8е и Те образуют семейство элементов с валентностью 2, у которых при переходе от О к Те постепенно нарастают металлические свойства О-типичный неметалл, а Те располагается в особой пограничной зоне таблицы между металлами и неметаллами, где находятся так называемые семиме-таллы ( полуметаллы ), или металлоиды. Элементы К, Р, Аз, 8Ь и В1 образуют семейство, отличительной особенностью элементов в котором является способность присоединять три электрона в некоторых соединениях, а также постепенный переход от неметаллических свойств у N и Р к семиметаллическим у Аз и металлическим у 8Ь и В1, Элементы С, 81, Се, 8п и РЬ также образуют семейство, характерным свойством элементов в котором является валентность 4. Для этих элементов пограничная линия между металлами и неметаллами располагается на один период выше С-типичный неметалл, 81 и Ое-семиметаллы, а 8п и РЬ металлы. Наконец, семейство элементов В, А1, Са, 1п и Т1 образует ионы с зарядами + 3 [c.314]
Элементы К, Р, Аз, 8Ь и В1 образуют семейство, отличительной особенностью элементов в котором является способность присоединять три электрона в некоторых соединениях, а также постепенный переход от неметаллических свойств у N и Р к семиметаллическим у Аз и металлическим у 8Ь и В1, Элементы С, 81, Се, 8п и РЬ также образуют семейство, характерным свойством элементов в котором является валентность 4. Для этих элементов пограничная линия между металлами и неметаллами располагается на один период выше С-типичный неметалл, 81 и Ое-семиметаллы, а 8п и РЬ металлы. Наконец, семейство элементов В, А1, Са, 1п и Т1 образует ионы с зарядами + 3 [c.314]
Весьма разнообразны нитриды d-элементов. Это кристаллические иеш,ества переменного состава. Чаш,е всего встречаются нитриды типа MN(TiN, VN, rN), MjN(Nb N, raN, MojN). Они проявляют металлические свойства имеют металлический блеск н электронную проводимость. Нитриды этого типа отличаются высокой твердостью и тугоплавкостью, часто превышаюш,ей тугоплавкость исходного металла [c.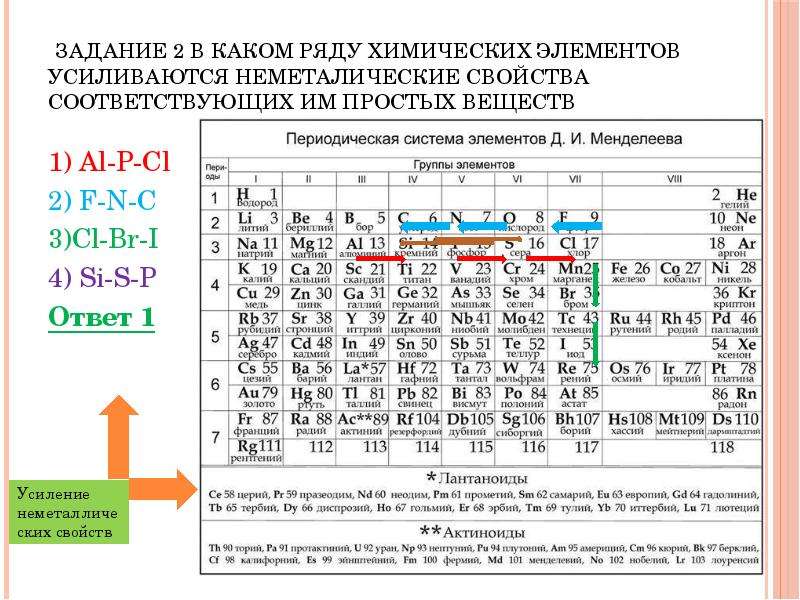 346]
346]
В главную подгруппу II группы входят гулементы бериллий, магний, кальций, стронций, барий н радий. Все этп элементы, кроме бериллия, обладают ярко выражеипыми металлическими свойствами. В свободном состоянии оии представляют собой серебристо-белые вещества, более твердые, чем ш,елочные металлы, с довольно высокими температурами плавления. По плотности все они, кроме радия, относятся к легким металлам. Их важнейшие свойства приведены в табл. 32. [c.607]
Простые вещества. В ряду Ое—5п—РЬ отчетливо усиливаются металлические свойства простых веществ. Германий — серебристо-белый с желтоватым оттенком, внешне похож на металл, но имеет алмазоподобную решетку. Олово полиморфно. В обычных условиях оно существует в виде 8-модификацни (белое олово), устойчивой выше 13,2°С это — серебристо-белый металл, кристаллическая решетка его тетрагональной структуры с октаэдрической координацией атомов. При охлаждении белое олово переходит в -модификацию (серое олово) со структурой типа алмаза (пл. 5,85 г/см ). Переход (3-> -сопровождается увеличением удельного объема (на 25,6 %), в связи с чем олово рассыпается в пороиюк. Свинец — темно-серый металл с типичной для металлов структурой гранецентрированного куба. [c.422]
5,85 г/см ). Переход (3-> -сопровождается увеличением удельного объема (на 25,6 %), в связи с чем олово рассыпается в пороиюк. Свинец — темно-серый металл с типичной для металлов структурой гранецентрированного куба. [c.422]
Физические и химические свойства элементов подгруппы азота зменяются с увеличением порядкового номера в той же пееледо-ательности, которая наблюдалась в ранее рассмотренных fpyn-lax. Но так как неметаллические свойства выражены у аэот ла-iee, чем у кислорода и тем более фтора, то ослабление йтия войств при переходе к следующим элементам влечет за собой ио-(вление и нарастание металлических свойств. Последние заметны [c.397]
Соли угольной кислоты — карбонаты обычно лс раетворимы в воде. Хорошо растворяются в воде карбонаты На, К, КЬ, Сз, Т1+ и карбонат аммония. При нагревании карбонаты разлагаются, образуя оксид металла и СОа. Чем сильнее выражены металлические свойства элемента, тем более устойчив карбонат. Так, Нв СОз плавится без разложения, СаСОз разлагается при 825 °С, а АдаСОз при 100°С. [c.361]
[c.361]
При переходе от углерода к свиину размеры атомов возрастают. Поэтому следует ожидать, что способность к присоединению элек-тронов, а следовательио, н неметаллические свойства будут прл зтом ослабевать, легкость же отдачи электронов — возрастать. Действительно, уже у ге мання проявляются металлические свойства, а у олова и свинца они преобладают над неметаллическими. Таким образом, только первые два члена описываемой группы являются неметаллами, германий причисляют н к металлам, и к неметаллам, олово и свинец — металлы. [c.431]
Одинаковое строение не только наружного, по и предпоследнего электронного слоя атомов всех ш,елочных металлов, кроме лигия, обусловливает большое сходство свойств этих элементов. В то же время увеличение заряда ядра и общего числа электро- нов в атоме при переходе сверху вниз по подгруппе создает некоторые различия в их свойствах. Как и б других группах, ти различия проявляются главным образом в увеличении легкости отдачи валентных электронов и усилении металлических свойств с возрастанием порядкового номера. [c.562]
[c.562]
С увеличением порядкового номера металлические свойства рассматриваемых элементов, как и в других главных подгруппах, заметно усиливаются. Так, окснд бора нмеет кислотный характер, оксиды алюминия, галлия и нндия — амфотерны, а оксид тал-лия(1П) имеет основной характер. [c.630]
Одинаковое строение внешнего электронного слоя атомов бора и алюминия обусловливает сходство в свойствах этих элементов. Так, для алюминия, как и для бора, характерна только степень окисленности +3. Однако при переходе от бора к алюминию сильно возрастает радиус атома (от 0,091 до 0,143 нм) и, кроме того, появляется enie один промежуточный восьмиэлектронный слой, экранирующий ядро. Все это приводит к ослаблению свя 1 внешних электронов с ядром и к уменьшению энергии ионизации атома (см. табл. 35). Поэтому у алюминия металлические свойства выражены гораздо сильнее, чем у бора. Тем ие менее, химические связн, образуемые алюминием с другими элементами, имеют в основном ковалентный характер. Рис. 165. С.хема простра стсеи- [c.635]
Рис. 165. С.хема простра стсеи- [c.635]
Щелочноземельные металлы более электроотрицательны по сравнению со щелочными металлами, тем не менее все их соединения, за исключением некоторых соединений Ве, являются ионными. Бериллий представляет собой первый пример общей закономерности, согласно которой в пределах любой группы элементы с валентными электронами, характеризуемыми меньщим главным квантовым числом, обладают менее ярко выраженными металлическими свойствами, потому что их валентные электроны расположены ближе к ядру и связаны с ним более прочно. Эта закономерность проявляется в повышении электроотрицательности при переходе к элементам с меньшими атомами в пределах одной группы (табл. 10-4). Бериллий имеет меньщий окислительный потенциал, т. е. более [c.435]
У элементов группы VIIA утрачиваются все металлические свойства все галогены-типичные неметаллы. Их атомам не хватает всего одного электрона для завершения замкнутой электронной оболочки, присущей атомам благородных газов, и они легко восстанавливаются до анионов с электронной конфигурацией s»p . Приведем восстановительные потенциалы галогенов [c.455]
Приведем восстановительные потенциалы галогенов [c.455]
В периодической таблице, показанной на рис. 14-8, кристаллы элементарных веществ подразделяются на металлические, ковалентные каркасные и молекулярные. В табл. 14-1 устанавливается зависимость между координационным числом атомов в кристалле и структурой элементарных твердых веществ. Большинство элементов кристаллизуются с образованием какой-либо металлической структуры, в которой каждый атом имеет высокое координационное число. К металлам отнесены и такие элементы, как олово и висмут, кристаллизующиеся в структуры со сравнительно низким атомным координационным числом, но все же обладающие ярко выраженными металлическими свойствами. Светлоокрашенная область периодической таблицы включает элементы со свойствами, промежуточными между металлами и неметаллами. Хотя германий кристаллизуется в алмазоподобную структуру, в которой координационное число каждого атома равно только 4, по некоторым из своих свойстг он напоминает металлы.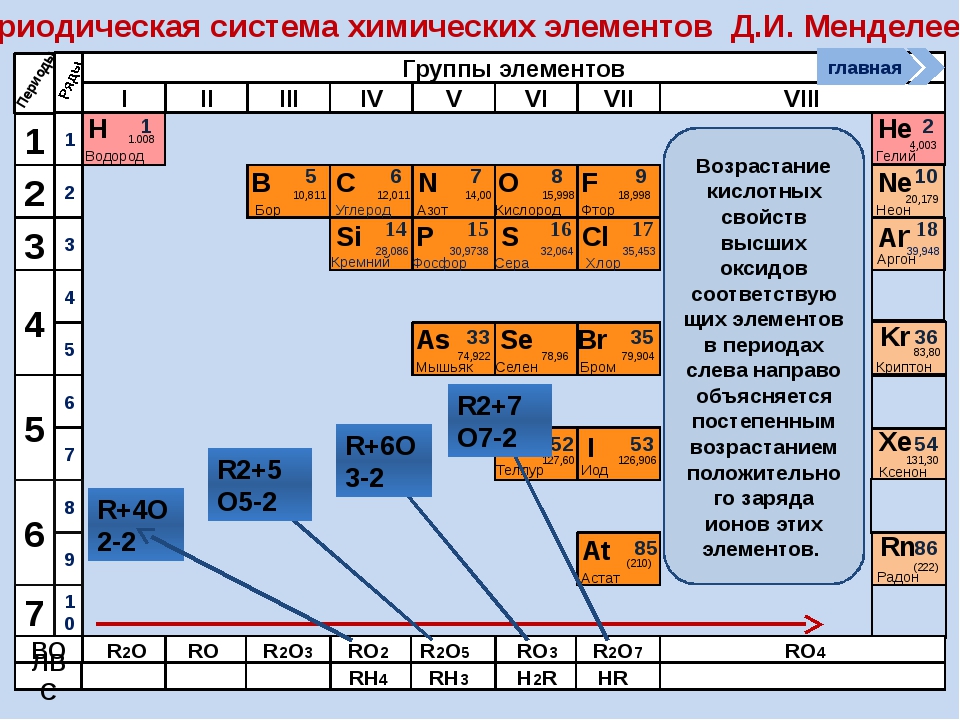 [c.605]
[c.605]
РЗЭ иногда подразделяют на две подгруппы цериевую (La — — Ей) и иттриевую (Y, Gd — Lu). Эти группы характеризуют также терминами легкие и тяжелые лантаноиды. У элементов цериевой подгруппы более выражены металлические свойства. [c.604]
Известно [87], что в направлении плоскостных углеродных сеток (по оси а) графит, т. е. предельно упорядоченное углеродное образование, проявляет металлические свойства, а в нашравлении, перпендикулярном к этой плоскости (по оси с), он полупроводник. [c.234]
Между окислительными и металлическими элементами нет резкой границы. Утрата металлического. характера неизбежно сопряжена с появлением окислительных свойств. Однако среди элементов встречаются такие, у которых металлические свойства кра 11с ослаблены, а окислительные свойства з , явлены недостаточно. Для таких элементов промежуточного характера целесообразно использовать название металлоиды. К этому классу элементов относятся по два элемента из каждого периода, а иметию бор, углерод, кремний, фосфор, германий, мышьяк, сурьма, сл. тур, висмут, полоний. У всех этих элементов проявляются если неметаллические, то во всяком случае ясно выраженные восстановительные свойства. Следует отметить, что у окислительных элементов (сера, селен, бром, под, астат) проявляются также и восстановительные свойства, и в этом отношении от них резко не отличаются следующие за ними инертные элементы—криитон, ксенон, радон. Однако инертные элементы характеризуются йодным отсутствием окислительных свойств. [c.109]
тур, висмут, полоний. У всех этих элементов проявляются если неметаллические, то во всяком случае ясно выраженные восстановительные свойства. Следует отметить, что у окислительных элементов (сера, селен, бром, под, астат) проявляются также и восстановительные свойства, и в этом отношении от них резко не отличаются следующие за ними инертные элементы—криитон, ксенон, радон. Однако инертные элементы характеризуются йодным отсутствием окислительных свойств. [c.109]
Периодическая система химических элементов
Дидактический материал
Тренировочные тесты ЕГЭ по химии
Закономерности изменения свойств химических элементов и их соединений по периодам и группам. Общая характеристика металлов IA-IIIA групп в связи с их положением в Периодической системе химических элементов Д.И. Менделеева и особенностями строения их атомов. Характеристика переходных элементов: меди, цинка, хрома, железа — по их положению в Периодической системе химических элементов Д.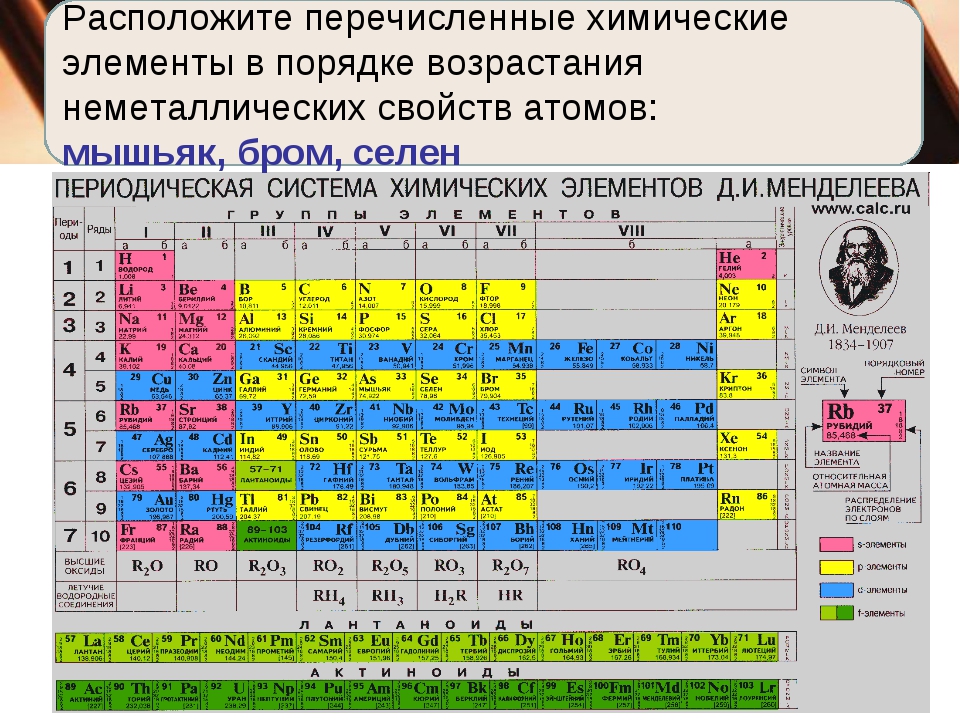 И. Менделеева и особенностями строения их атомов. Общая характеристика неметаллов VIA-VIIA групп в связи с их положением в Периодической системе химических элементов Д.И. Менделеева и особенностями строения их атомов.
И. Менделеева и особенностями строения их атомов. Общая характеристика неметаллов VIA-VIIA групп в связи с их положением в Периодической системе химических элементов Д.И. Менделеева и особенностями строения их атомов.
1. В ряду Na —>Mg —>Al —>Si
1) увеличивается число энергетических уровней в атомах
2) усиливаются металлические свойства элементов
3) уменьшается высшая степень окисления элементов
4) ослабевают металлические свойства элементов
2. У элементов подгруппы углерода с увеличением атомного номера уменьшается
1) атомный радиус
2) заряд ядра атома
3) число валентных электронов в атомах
4) электроотрицательность
3. В ряду элементов азот — кислород — фтор возрастает
1) валентность по водороду
2) число энергетических уровней
3) число внешних электронов
4) число неспаренных электронов
4. В ряду химических элементов бор — углерод — азот возрастает
1) способность атома отдавать электроны
2) высшая степень окисления
3) низшая степень окисления
4) радиус атома
5. Какой элемент имеет более выраженные неметаллические свойства, чем кремний?
Какой элемент имеет более выраженные неметаллические свойства, чем кремний?
1) углерод 2) германий 3) алюминий 4) бор
6. С ростом заряда ядра атомов кислотные свойства оксидов в ряду
N2O5 —> P2O5 —> As2O5 —> Sb2O5
1) ослабевают
2) усиливаются
3) не изменяются
4) изменяются периодически
7. В порядке возрастания неметаллических свойств элементы расположены в ряду:
1) O,N,C,B
2) Cl,S,P,Si
3) C,Si,Ge,Sn
4) B,C,O,F
8. В порядке усиления металлических свойств элементы расположены в ряду:
1) А1,Са,К 2) Ca.Ga.Fe 3) K,Al,Mg 4) Li,Be,Mg
9. В каком ряду элементы расположены в порядке возрастания их атомного радиуса?
1) Si,P, S.C1
2) O,S,Se,Te
3) At,I,Br,Cl
4) Mg,Al,Si, P
10. Какой элемент образует газообразное водородное соединен соответствующее общей формуле RH2?
Какой элемент образует газообразное водородное соединен соответствующее общей формуле RH2?
1) бор 2) калий 3) сера 4) хром
11. В главных подгруппах периодической системы восстановительная способность атомов химических элементов растет с
1) уменьшением радиуса атомов
2) увеличением числа энергетических уровней в атомах
3) уменьшением числа протонов в ядрах атомов
4) увеличением числа валентных электронов
12. В какой группе периодической системы находится элемент Э, входящий в состав кислоты НЭО4?
1) IV 2) V 3) VI 4) VII
13. В ряду оксидов SiO2 — Р2О5 — SO2 — Cl2O7 кислотные свойства
1) возрастают
2) убывают
3) не изменяются
4) сначала уменьшаются, потом увеличиваются
14. В каком ряду простые вещества расположены в порядке усиления металлических свойств?
В каком ряду простые вещества расположены в порядке усиления металлических свойств?
1) Mg, Ca, Ва
2) Na, Mg, A1
3) K,Ca,Fe
4) Sc, Ca, Mg
15. По периоду слева направо уменьшается(-ются)
1) атомный радиус элементов
2) число валентных электронов в атомах
3) электроотрицательность элементов
4) кислотные свойства гидроксидов
16. В порядке увеличения электроотрицательности химические элементы расположены в раду:
1) С, N, О 2) Si.Al.Mg 3) Mg,Ca, Ва 4) Р, S, Si
17. Химический элемент расположен в IV периоде, IA группе. Распределению электронов в атоме этого элемента соответствует ряд чисел:
1) 2,8,8,2
2) 2, 8, 18, 1
3) 2, 8, 8, 1
4) 2,8, 18,2
18. Электроотрицательность химических элементов с возрастанием заряда ядра атома
1) увеличивается и в периодах, и в группах
2) уменьшается и в периодах, и в группах
3) увеличивается в периодах, а в группах уменьшается
4) уменьшается в периодах, а в группах увеличивается
19. В каком ряду химические элементы расположены в порядке возрастания их атомного радиуса?
В каком ряду химические элементы расположены в порядке возрастания их атомного радиуса?
1) Rb,K,Na,Li
2) Na,Mg,Al, S
3) F, Cl, Br, I
4) C,N, О, F
20. Среди элементов третьего периода наименьший атомный радиус имеет
1) натрий
2) алюминий
3) фосфор
4) сера
21. В главных подгруппах периодической системы восстановительная способность атомов химических элементов растет с
1) уменьшением радиуса атомов
2) увеличением числа энергетических уровней в атомах
3) уменьшением числа протонов в ядрах атомов
4) увеличением числа валентных электронов
22. По периоду слева направо уменьшается
1) число валентных электронов в атомах
2) атомный радиус элементов
3) электроотрицательность элементов
4) кислотность гидроксидов элементов
23. Наиболее сильное основание образует
1) цезий 2) натрий 3} литий 4) цинк
24. Оксид с наиболее выраженными кислотными свойствами образует
Оксид с наиболее выраженными кислотными свойствами образует
1) кремний 2) фосфор 3) сера 4) хлор
25. Наиболее сильное основание образует
1) магний 2) стронций 3) барий 4) кадмий
26. Кислотный характер наиболее выражен у высшего оксида, образованного элементом:
1) Sn 2) А1 3) С 4) S
27. Кислотный характер наиболее выражен у высшего оксида, образованного
1) бериллием 2) бором 3) фосфором 4) кремнием
28. Сила бескислородных кислот неметаллов VIIА группы соответственно возрастанию заряда ядра атомов элементов
1) | увеличивается |
2) | уменьшается |
3) | не изменяется |
4) | изменяется периодически
|
29. Одинаковое значение валентности в водородном соединении и высшем оксиде имеет элемент
Одинаковое значение валентности в водородном соединении и высшем оксиде имеет элемент
1) | хлор |
2) | германий |
3) | мышьяк |
4) | селен |
30. Кислотные свойства оксидов в ряду SiO2 —> P2O5 —>SО3
1) ослабевают
2) усиливаются
3) не изменяются
4) изменяются периодически
31. Газообразные водородные соединения состава ЭН3 образуют
1) Be, Ca, Sr 2) P, As, Sb 3) Ga, Al, B 4) Te, S, Sc
32. В ряду элементов
В ряду элементов
Cl ® S ® P ® Si
1) уменьшается число электронных слоев в атомах
2) увеличивается число внешних электронов в а томах
3) возрастают радиусы атомов
4) усиливаются неметаллические свойства
33. Неметаллические свойства наиболее выражены у
1) серы 2) кислорода 3) кремния 4) фосфора
34. Наибольший радиус имеет атом
1) олова 2} кремния 3) свинца 4) углерода
35. В ряду химических элементов
Li —>Be —> B —> C
1) увеличивается число валентных электронов в атомах
2) уменьшается число электронных слоев а атомах
3) уменьшается число протонов в ядрах атомов
4) увеличиваются радиусы атомов
36.Наибольший радиус имеет атом
1) брома 2) мышьяка 3) бария 4) олова
37. Электронную конфигурацию 1s22s22р63.s2Зр63d1 имеет ион
Электронную конфигурацию 1s22s22р63.s2Зр63d1 имеет ион
1) Са2+ 2) А13+ 3) K+ 4) Sc2+
38. Какую электронную конфигурацию имеет атом наиболее активного металла?
1) | 1s22s22p1 |
2) | 1s22s22p63s1 |
3) | 1s22s2 |
4) | 1s22s22p63s23p1 |
39. В порядке увеличения восстановительной способности металлы расположены в ряду:
В порядке увеличения восстановительной способности металлы расположены в ряду:
1) K,Al,Cr,Sn
2) Sn,Cr,Al,Zn
3) Sn,Ca,Al,K
4) Au,Al,Ca,Li
40. В ряду элементов: натрий —>магний —>алюминий
возрастает их
1) атомный радиус
2) восстановительная способность
3) химическая активность
4) электроотрицательность
41. У магния металлические свойства выражены
1) слабее, чем у бериллия
2) сильнее, чем у алюминия
3) сильнее, чем у кальция
4) сильнее, чем у натрия
42. В порядке уменьшения восстановительных свойств металлы расположены в ряду:
1) Al,Zn,Fe
2) Al,Na,K
3) Fе,Zn,Mg
4) Fe,Zn,Al
43. Наибольший радиус имеет атом
1) лития 2) натрия 3) кальция 4) калия
44. У элементов II А группы сверху вниз
1) уменьшаются радиусы атомов,
2) увеличивается число валентных электронов в атоме
3) увеличиваются радиусы атомов
4) уменьшается число валентных электронов в атоме
45. Сила оснований возрастает в ряду:
Сила оснований возрастает в ряду:
1) Ве(ОН)2, Mg(OH)2, Ca(OH)2
2) Ва(ОН)2, Са(ОН)2, Ве(ОН)2
3) Са(ОН)2, Mg(OH)2, Ве(ОН)2
4) Sr(OH)2, Ca(OH)2, Mg(OH)2
46. У элементов I А группы сверху вниз
1) усиливаются окислительные свойства
2) ослабевают восстановительные свойства
3) увеличиваются радиусы атомов
4) уменьшаются радиусы атомов
47. Валентные электроны наиболее легко отдают атомы
1) алюминия 2) натрия 3) бериллия 4) магния
48. Восстановительные свойства наиболее выражены у
1) алюминия 2) магния 3) натрия 4) калия
49. Основные свойства веществ ослабевают в ряду:
1) NaОН —> КОН —>RbOH
2) А1(ОН)3 —>Mg(OH)2 —> NaOH
3) Са(ОН)2 —> Mg(OH)2 —>Be(OH)2
4) В(ОН)3 —>Ве(ОН)2 —> LiOH
50. Верны ли следующие суждения?
Верны ли следующие суждения?
А. И хром, и железо образуют устойчивые оксиды в степени окисления +3.
Б. Оксид хрома (III) является амфотерным.
1) верно только А
2) верно только Б
3) верны оба суждения
4) оба суждения неверны
51. Верны ли следующие суждения?
А. Только s-элементы содержит IA группа.
Б. Все элементы IA группы взаимодействуют с водой при комнатной температуре.
1) верно только А
2) верно только Б
3) верны оба суждения
4) оба суждения неверны
52. Оксид хрома (VI) является
1) основным
2) кислотным
3) амфотерным
4) несолеобразующим
53. Только основные свойства проявляет
1) Сr2O3 2) Сr(ОН)2 3) СrO3 4) Сr(ОН)3
54. Сильные окислительные свойства характерны для
1) оксида меди (I)
2) оксида железа (II)
3) оксида хрома (III)
4) оксида хрома (VI)
55. Верны ли следующие суждения об оксидах железа?
Верны ли следующие суждения об оксидах железа?
А. Степень окисления железа в высшем оксиде равна + 3.
Б. Высший оксид железа относится к основным оксидам.
1) верно только А
2) верно только Б
3) верны оба суждения
4) оба суждения неверны
56. В ряду оксидов
CrO — Сr2О3 — СrОз
происходит
1) уменьшение степени окисления хрома
2) усиление восстановительных свойств
3) увеличение массовой доли хрома
4) усиление кислотных свойств
57. Оцените справедливость суждений о металлах:
А. Чем сильнее атом удерживает валентные электроны, тем ярче
выражены металлические свойства элемента.
Б. Чем сильнее выражены металлические свойства элемента, тем
более основный характер имеет его гидроксид.
1) верно только А
2) верно только Б
3) верны оба суждения
4) оба суждения неверны
58. Оцените справедливость суждений о металлах:
Оцените справедливость суждений о металлах:
А. Для атомов металлов характерно малое число валентных
электронов и слабое их притяжение к ядру.
Б. Чем выше степень окисления металла в его гидроксиде, тем
более основными свойствами обладает гидроксид.
1) верно только А
2) верно только Б
3) верны оба суждения
4) оба суждения неверны
59. Оцените справедливость суждений о металлах:
А. Атомы металла могут образовывать только ионные связи.
Б. Оксиды и гидроксиды металлов всегда имеют основный
характер.
1) верно только А
2) верно только Б
3) верны оба суждения
4) оба суждения неверны
60. Верны ли следующие суждения о неметаллах?
А. В периодической системе химических элементов Д.И. Менделеева все неметаллы располагаются в главных подгруппах.
Б. Все неметаллы являются р-элементами.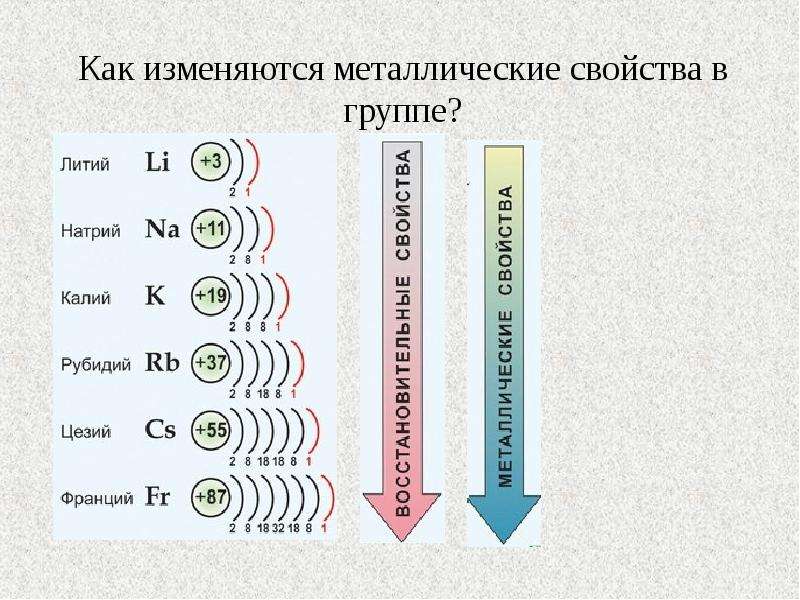
1) верно только А
2) верно только Б
3) верны оба суждения
4) оба суждения неверны
61. У атомов химических элементов, расположенных в ряду: P-S-C1, увеличивается
1) радиус
2) окислительная способность
3) восстановительная способность
4) число неспаренных электронов
62. Соединения состава NaHЭO3 и NaHЭO4 может образовать
1) углерод 2) сера 3) хлор 4) фосфор
63. Наиболее сильными кислотными свойствами обладает
1) НС1О4 2) H2SO3 3) Н3РО4 4) H2SiО3
64 Соединения состава КЭО2 и КЭО3 образует элемент
1) азот 2) фосфор 3) сера 4) марганец
65. Способность атомов химических элементов принимать электроны усиливается в ряду:
1)F —>O —>N
2) N —>F —>О
3) N —>O —>F
4) O —>N —>F
66. Степени окисления хлора, брома и йода в высших оксидах и водородных соединениях соответственно равны:
Степени окисления хлора, брома и йода в высших оксидах и водородных соединениях соответственно равны:
1)+1и-1 2)+7и-1 3)+7и-7 4)+5и-1
67. Сера проявляет как окислительные, так и восстановительные свойства при взаимодействии с
1) водородом и железом
2) углеродом и цинком
3) хлором и фтором
4) натрием и кислородом
68. В ряду: Si —>Р —> S —> С1
электроотрицательность элементов
1) увеличивается
2) уменьшается
3) не изменяется
4) сначала уменьшается, потом увеличивается
69. В ряду элементов мышьяк —>селен —> бром возрастает
1) атомный радиус
2) число неспаренных электронов в атоме
3) число электронных слоев в атоме
4) электроотрицательность
70. Водородное соединение состава Н2Э2 образует
1) углерод
2) кремний
3) бор
4) азот
71. Высшему гидроксиду элемента VIIA группы соответствует формула
Высшему гидроксиду элемента VIIA группы соответствует формула
1) Н2ЭО3 2) Н2ЭО4 3) НЭО3 4) НЭО4
72. Фосфор проявляет окислительные свойства при реакции с
1) кальцием 2) серой 3) хлором 4) кислородом
73. При взаимодействии высшего оксида хлора с водой образуется кислота
1) НС1O 2) НС1O2 3) НСlO3 4) HClO4
74. Характерными степенями окисления хлора в его соединениях являются:
1) -1, +1, +3, +5, +7
2) — 2, +4, +6, +8
3) -3, +3, +5
4) -1, +2, +5
75. Кислотные свойства наиболее выражены у высшего гидроксида
1) азота
2) фосфора
3) мышьяка
4) сурьмы
76. Только восстановительные свойства азот проявляет в соединении
Только восстановительные свойства азот проявляет в соединении
1) N2
2) NНз
3) NО2
4) НNОз
77. Верны ли следующие суждения о свойствах соединений элемента, электронная конфигурация атома которого 1s22s22p6 3s2 Зр1 ?
А. Этот элемент образует гидроксид с ярко выраженными кислотными свойствами.
Б. Степень окисления этого элемента в высшем гидроксиде равна (+ 4).
1) верно только А
2) верно только Б
3) верны оба суждения
4) оба суждения неверны
78. Верны ли следующие суждения о соединениях натрия и бериллия?
А. Оксид натрия проявляет основные свойства
Б. Гидроксид бериллия проявляет амфотерные свойства
1) верно только А
2) верно только Б
3) верны оба суждения
4) оба суждения неверны
Ответы 1-4, 2-4, 3-3, 4-2, 5-1, 6-1, 7-4, 8-1, 9-2, 10-3, 11-2, 12-4, 13-1, 14-1, 15-1, 16-1, 17-3, 18-3, 19-3, 20-4, 21-2, 22-2, 23-1, 24-4, 25-3, 26-4, 27-3, 28-1, 29-2, 30-2, 31-2, 32-3, 33-2, 34-3, 35-1, 36-3, 37-4, 38-2, 39-4, 40-4, 41-2, 42-1, 43-4, 44-3, 45-1, 46-3, 47-2, 48-4, 49-3, 50-3, 51-1, 52-2, 53-2, 54-4, 55-1, 56-4, 57-2, 58-1, 59-4, 60-1, 61-2, 62-2, 63-1,64-1, 65-3, 66-2, 67-4, 68-1, 69-4, 70-1, 71-4, 72-1, 73-4, 74-1, 74-3, 76-2, 77-4, 78-3
Периодический закон и система Д.
 И. Менделеева
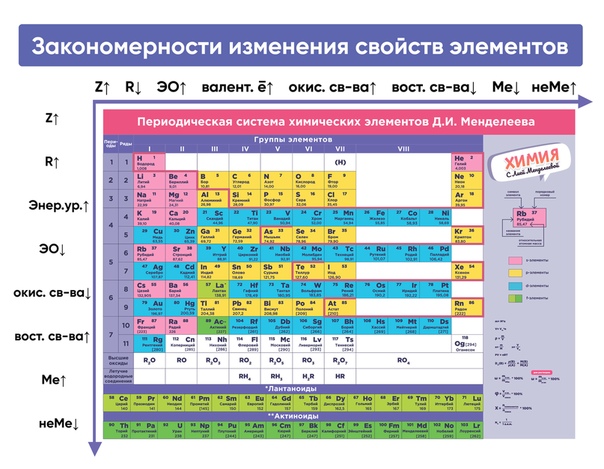
И. Менделеева1. Слева направо по периоду (см. Таблица Менделеева):
-
- металлические свойства простых веществ ослабевают (уменьшаются)
- неметаллические свойства усиливаются (увеличиваются)
- радиус атома уменьшается (атомное сжатие из-за увеличения заряда ядра)
- электроотрицательность элементов возрастает (самый ЭО элемент — фтор)
- восстановительные свойства уменьшаются
- окислительные свойства увеличиваются
- основные свойства оксидов и гидроксидов уменьшаются
- Кислотные свойства оксидов и гидроксидовусиливаются
- идет увеличение числа электронов на внешнем уровне
- увеличивается максимальная валентность элементов
2. Сверху вниз по группе (см. Таблица Менделеева) (для главной подгруппы):
-
- металлические свойства простых веществ усиливаются
- неметаллические свойства ослабевают
- радиус атома увеличивается
- электроотрицательность элементов уменьшается
- основные свойства оксидов и гидроксидов усиливаются
- кислотные свойства оксидов и гидроксидов убывают
- Число электронов на внешнем уровне не меняется
3. К основным оксидам относятся оксиды металлов со степенью окисления +1 и +2
К основным оксидам относятся оксиды металлов со степенью окисления +1 и +2
4. К кислотным оксидам относятся оксиды неметаллов и оксиды металлов со степенью окисления +5, +6, +7
5. К амфотерным оксидам относятся Al2O3, BeO, ZnO, Cr2O3
Давайте порассуждаем вместе
1. Как изменяется радиус атома в ряду Be — Mg — Ca ?
1) уменьшается
2) увеличивается
3) не изменяется
4) сначала уменьшается, потом увеличивается
Ответ: все элементы находятся в одной группе, сверху вниз, значит радиус атома увеличивается
2. Как изменяются металлические свойства в ряду Li — Be — B?
1) не изменяются
2) сначала усиливаются, потом уменьшаются
3) ослабевают
4) усиливаются
Ответ: все элементы находятся в одном периоде слева направо, значит металлические свойства ослабевают
3. Как изменяется электроотрицательность в ряду F — O — N?
Как изменяется электроотрицательность в ряду F — O — N?
1) сначала усиливается, потом ослабевает
2) уменьшается
3) не изменяется
4) усиливается
Ответ: все элементы находятся в одном периоде справа налево, значит электроотрицательность уменьшается.
4. Как изменяются неметаллические свойства в ряду As — P — N?
1) уменьшаются
2) не изменяются
3) сначала усиливаются, потом уменьшаются
4) усиливаются
Ответ: все элементы находятся в одной группе снизу вверх, значит неметаллические свойства усиливаются
5. Как изменяется число валентных электронов в ряду Li — Na — K?
1) не изменяется
2) увеличивается
3) уменьшается
4) сначала уменьшается, затем увеличивается
Ответ: все элементы находятся в одной группе сверху вниз, значит число валентных электронов не изменяется
6. Как изменяются окислительные свойства в ряду O — S — Se?
Как изменяются окислительные свойства в ряду O — S — Se?
1) увеличиваются
2) сначала уменьшаются, затем увеличиваются
3) не изменяются
4) уменьшаются
Ответ: все элементы находятся в одной группе сверху вниз, значит окислительные свойства уменьшаются
7. Как изменяются восстановительные свойства в ряду Si — Al — Mg?
1) сначала уменьшаются, затем усиливаются
2) увеличиваются
3) не изменяются
4) уменьшаются
Ответ: все элементы находятся в одном периоде справа налево, значит восстановительные свойства усиливаются
8. Как изменяются свойства оксидов в ряду MgO -> Al2O3 —> SiO2
1) от основных к кислотным
2) от кислотных к основным
3) от кислотных к амфотерным
4) от основных к амфотерным
Ответ: все элементы находятся в одном периоде слева направо, значит свойства оксидов изменяются от основных к кислотным
Задания повышенной сложности
1.
В главных подгруппах периодической системы с увеличением заряда ядра атомов химических элементов происходит:
1) усиление неметаллических свойств
2) усиление металлических свойств
3) высшая валентность элементов остается постоянной
4) изменяется валентность в водородных соединениях
5) уменьшается радиус атомов
Ответ: 2, 3
2. В главных подгруппах периодической системы восстановительная способность атомов увеличивается по мере
1) уменьшения радиуса атома
2) увеличения числа электронных слоев в атомах
3) уменьшения заряда ядра атомов
4) увеличения числа валентных электронов
5) увеличения порядкового номера элемента
Ответ: 2, 5
3.
В ряду химических элементов Be, Mg, Ca, Sr
1) усиливается способность атомов отдавать электроны
2) уменьшается заряд ядра атомов
3) усиливается восстановительная способность
4) уменьшаются металлические свойства
5) усиливается способность атомов принимать электроны
Ответ: 1, 3
4. В ряду химических элементов I, Br, Cl, F восстановительная способность атомов уменьшается, потому что
1) увеличивается радиус атома
2) увеличивается заряд ядра атомов
3) увеличивается число электронных слоев в атомах
4) уменьшается число электронных слоев в атомах
5) уменьшается способность атомов отдавать электроны
Ответ: 4, 5
5.
В ряду химических элементов As, P, N
1) увеличивается радиус атома
2) увеличивается электроотрицательность
3) усиливаются кислотные свойства их высших оксидов
4) возрастает значение высшей степени окисления
5) увеличивается число электронов во внешнем электронном слое атомов
Ответ: 2, 3
6. В ряду химических элементов P, N, O
1) уменьшается число электронов во внешнем электронном слое
2) увеличивается электроотрицательность
3) возрастает значение высшей валентности
4) ослабевают неметаллические свойства
5) усиливается способность атомов принимать электроны
Ответ: 2, 5
7.
В ряду гидроксидов NaOH, Ca(OH)2, Al(OH)3
1) увеличивается термическая стойкость
2) ослабевают основные свойства
3) увеличивается способность к электролитической диссоциации
4) ослабевают окислительные свойства
5) уменьшается растворимость в воде
Ответ: 2,5
вариант 1 1. Продолжите фразу. Неметаллические свойства химического элемента ─ это __________________ _____________________________________________________________________ _____________________________________________________________________ 2. В периоде слева направо 1) не изменяется заряд ядра атома 2) увеличивается атомный радиус 3) увеличивается число электронов на внешнем уровне 4) уменьшается число энергетических уровней 3. 1) увеличиваются 2) ослабевают 3) не изменяются 4) изменяются периодически 4. Наиболее ярко выражены металлические свойства у атома: 1) Mg 2) Rb 3) Al 4) Na 5. Наиболее ярко выражены неметаллические свойства у атома: 1) Al 2) S 3) P 4) Cl 6. Распределите химические элементы на металлы (А) и не металлы (Б). 1) Fe2) N 3) Li 4) Cr 5) Se 6) I |
| вариант 2 1. Продолжите фразу. Металлические свойства химического элемента ─ это __________________ _____________________________________________________________________ _____________________________________________________________________ 2. В группе сверху вниз 1) уменьшается атомный радиус 2) увеличивается электроотрицательность 3) увеличивается число энергетических уровней 4) уменьшается заряд ядра атома 3. Слева направо в периоде металлические свойства элементов 1) не изменяются 2) изменяются периодически 3) ослабевают 4) усиливаются 4. 1) S 2) C 3) P 4) O 5. Наиболее ярко выражены металлические свойства у атома: 1) Ca 2) Be 3) Ba 4) Sr 6. Распределите химические элементы на металлы (А) и не металлы (Б). 1) Mn2) Ca 3) Rb 4) C 5) O 6) Br |
|
Взаимосвязь между размещением элементов
Взаимосвязь между размещением элементов в Периодической системы и свойствами химических элементов, простых веществ, соединений элементов с водородом и кислорода. Понятие о радиусе атома и электроотрицательность элементов
Рассмотрим взаимосвязь между положением элементов в Периодической системы и такими свойствами химических элементов, как атомный радиус, электроотрицательность, металлические и неметаллические свойства.
Атомный радиус является величиной, которая показывает размер электронной оболочки атома. Это очень важная величина, от которой зависят свойства атомов химических элементов. В главных подгруппах с увеличением заряда ядра атома происходит увеличение числа электронных уровней, поэтому атомный радиус с увеличением порядкового номера в главных подгруппах увеличивается.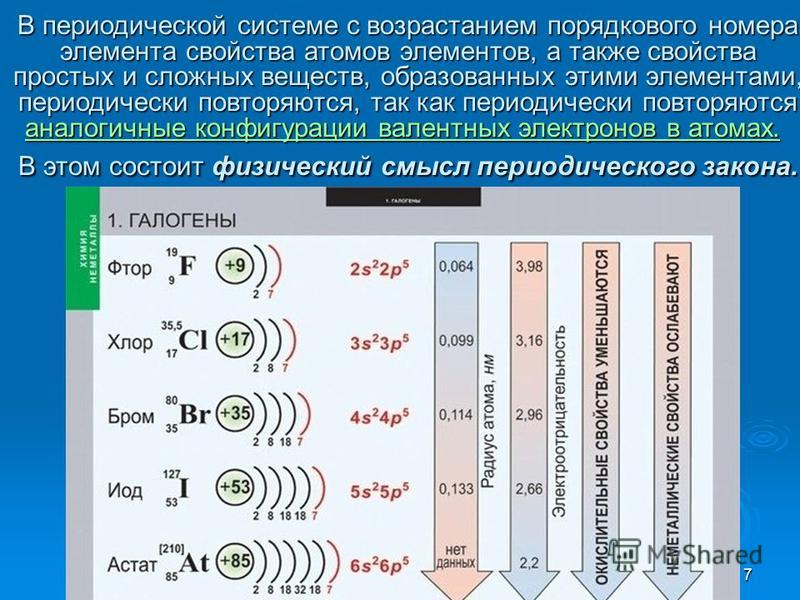 В периодах происходит увеличение заряда ядра атома химического элемента, что приводит к усилению притяжения внешних электронов к ядру. Кроме того, с увеличением заряда ядра увеличивается число электронов на внешнем уровне, однако число электронных уровней не увеличивается. Указанные закономерности приводят к зжаття электронной оболочки вокруг ядра. Поэтому атомный радиус с увеличением порядкового номера в периодах уменьшается.
В периодах происходит увеличение заряда ядра атома химического элемента, что приводит к усилению притяжения внешних электронов к ядру. Кроме того, с увеличением заряда ядра увеличивается число электронов на внешнем уровне, однако число электронных уровней не увеличивается. Указанные закономерности приводят к зжаття электронной оболочки вокруг ядра. Поэтому атомный радиус с увеличением порядкового номера в периодах уменьшается.
Например, расположим химические элементы O (кислород), C (Карбон), Li (литий), F (фтора), N (азот) в порядке уменьшения атомных радиусов. Приведенные химические элементы находятся во втором периоде. В периоде атомные радиусы с увеличением порядкового номера уменьшаются. Следовательно, указанные химические элементы надо записать в порядке возрастания их порядковых номеров: Li, C, N, O, F (Литий, Карбон, азот, кислород, фтора)
Электроотрицательность — это способность атома в соединениях притягивать к себе валентные электроны, т.е. те электроны, с помощью которых образуются химические связи между атомами.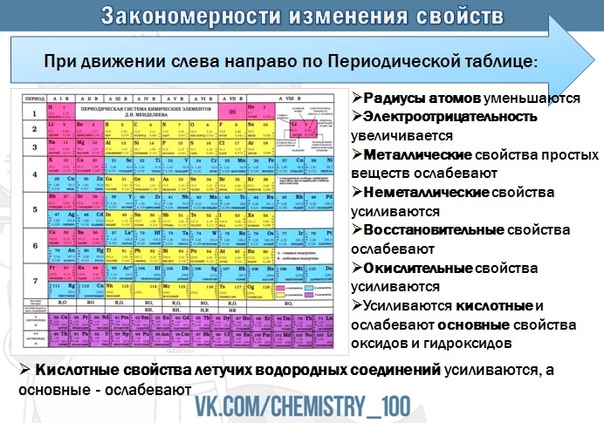 Электроотрицательность зависит от способности атомного ядра притягивать электроны внешнего энергетического уровня. Чем притяжения является сильным, тем электроотрицательность больше. Сила притяжения электронов внешнего энергетического уровня тем больше, чем меньше атомный радиус. Следовательно, изменение электроотрицательности в периодах и главных подгруппах будет противоположная изменении атомных радиусов. Поэтому, в главных подгруппах электроотрицательность с увеличением порядкового номера уменьшается. В периодах с увеличением порядкового номера электроотрицательность увеличивается.
Электроотрицательность зависит от способности атомного ядра притягивать электроны внешнего энергетического уровня. Чем притяжения является сильным, тем электроотрицательность больше. Сила притяжения электронов внешнего энергетического уровня тем больше, чем меньше атомный радиус. Следовательно, изменение электроотрицательности в периодах и главных подгруппах будет противоположная изменении атомных радиусов. Поэтому, в главных подгруппах электроотрицательность с увеличением порядкового номера уменьшается. В периодах с увеличением порядкового номера электроотрицательность увеличивается.
Например, расположим химические элементы Br (Бром), F (фтора), I (Йод), Cl (Хлор) в порядке увеличения электроотрицательности. Приведенные химические элементы находятся в главной подгруппе седьмой группы. В главных подгруппах электроотрицательность с увеличением порядкового номера уменьшается. Следовательно, указанные химические элементы надо записать в порядке уменьшения их порядковых номеров: I, Br, Cl, F (Йод, Бром, Хлор, фтора).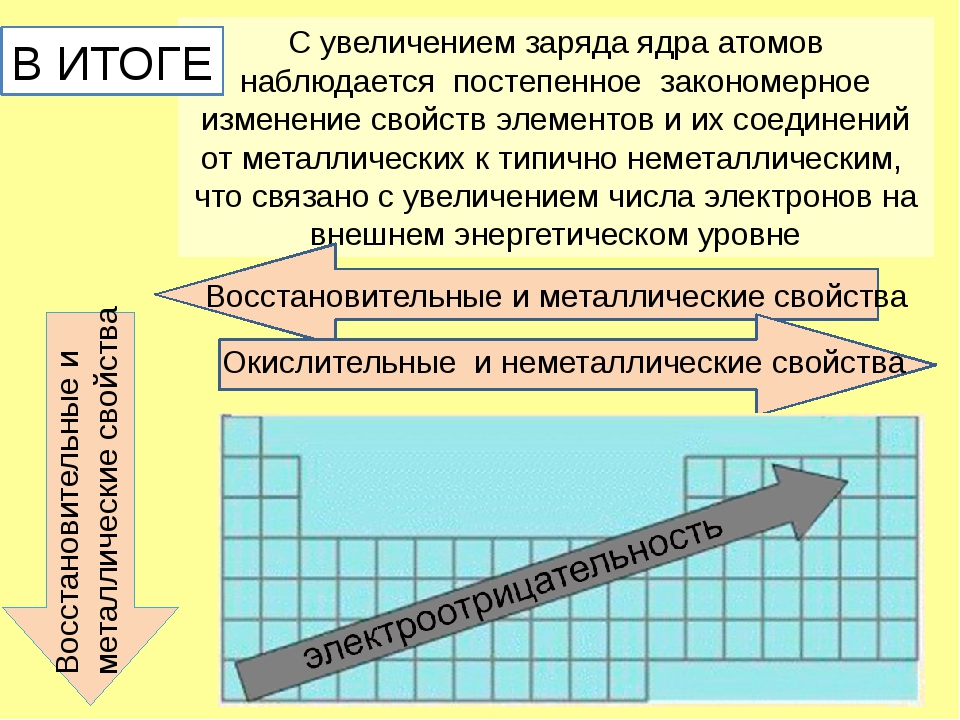
Металлические свойства — это свойства атомов химических элементов отдавать электроны. Химические элементы, которые обнаруживают металлические свойства, как правило, имеют на внешнем уровне от одного до трех электронов. Неметаллические свойства — это свойства атомов химических элементов принимать электроны. Химические элементы, которые проявляют неметаллические свойства, как правило, имеют на внешнем уровне от четырех до восьми электронов. Металлические свойства тем больше и, соответственно, неметаллические свойства тем меньше, чем легче отдается электрон с внешнего энергетического уровня. Отдать электрон с внешнего энергетического уровня тем легче, чем больше атомный радиус благодаря тому, что сила притяжения ядра и электронов уменьшается с ростом расстояния между ними. Следовательно, изменение металлических свойств химических элементов будет аналогична изменению их атомных радиусов. Поэтому в главных подгруппах металлические свойства с увеличением порядкового номера увеличиваются, а в периодах с увеличением порядкового номера металлические свойства уменьшаются. Неметаллические свойства, наоборот, в главных подгруппах с увеличением порядкового номера уменьшаются, а в периодах с увеличением порядкового номера увеличиваются.
Неметаллические свойства, наоборот, в главных подгруппах с увеличением порядкового номера уменьшаются, а в периодах с увеличением порядкового номера увеличиваются.
Например, расположим химические элементы Al, S, Mg, Cl, Na в порядке увеличения неметаллических свойств. Приведенные химические элементы находятся в третьем периоде. В периодах неметаллические свойства с увеличением порядкового номера увеличиваются. Следовательно, указанные химические элементы надо записать в порядке возрастания их порядковых номеров: Na, Mg, Al, S, Cl Рассмотрим взаимосвязь между положением химических элементов в Периодической системы и свойствами оксидов и соответствующих гидроксидов, образующих эти химические элементы, на примере элементов третьего периода. К третьему периоду относятся химические элементы: Na, Mg, Al, Si, P, S, Cl, Ar
Эти элементы образуют высшие оксиды следующего состава (инертный химический элемент Аргон оксид не образует): Na2O, MgO, Al2O3, SiO2, P2O5, SO3, Cl2O7.
Натрий оксид и магний оксид проявляют свойства основных оксидов, алюминий оксид являются амфотерными оксидом, все оксиды (кремний (IV) оксид, фосфор (V) оксид, серы (VI) оксид, хлор (VII) оксид) проявляют свойства кислотных оксидов. Кроме того, в ряде Na2O — MgO основные свойства ослабевают, а в ряде SiO2 — P2O5 — SO3 — Cl2O7 кислотные свойства усиливаются.
Кроме того, в ряде Na2O — MgO основные свойства ослабевают, а в ряде SiO2 — P2O5 — SO3 — Cl2O7 кислотные свойства усиливаются.
Так же можно проанализировать характер изменения в периоде свойств гидроксидов, которые соответствуют высшим оксидам: NaOH, Mg (OH)2, Al (OH)3, h3SiO3, h4PO4, h3SO4, HClO4.
Натрий гидроксид и магния гидроксид проявляют свойства оснований, алюминий гидроксид являются амфотерными гидроксидом, все остальные гидроксиды проявляют свойства кислот: силикатный кислота, ортофосфатна кислота, серная кислота, хлорутна кислота. Кроме того, в ряде NaOH — Mg (OH)2 основные свойства ослабевают, а в ряде h3SiO3 — h4PO4 — h3SO4 — HClO4 кислотные свойства усиливаются.
Так, в ряду элементов определенного ослабляются свойства основных оксидов и соответствующих им гидроксидов, а кислотные свойства в том же направлении усиливаются. Переход от основных к кислотным оксидам, и, соответственно, от основ до кислот осуществляется в периоде из-за амфотерный оксид или гидроксид. Такая закономерность справедлива для второго и третьего периодов периодической системы. Для элементов больших периодов наблюдаются сложные закономерности.
Такая закономерность справедлива для второго и третьего периодов периодической системы. Для элементов больших периодов наблюдаются сложные закономерности.
Ответы | § 28. Периодическая система химических элементов — Химия, 8 класс
1. Как называл Д. И. Менделеев естественную классификацию химических элементов?
Он назвал её периодической системой химических элементов.
2.
 Назовите основные структурные единицы периодической системы элементов.
Назовите основные структурные единицы периодической системы элементов.
Основные структурные единицы периодической системы химических элементов — периоды (горизонтальные ряды) и группы (вертикальные ряды). В периодах слева направо увеличиваются неметаллические свойства, уменьшаются — металлические.
3. Что такое период? Что общего у больших и малых периодов и чем они различаются? Какие свойства химических элементов закономерно изменяются в периоде?
Период — горизонтальный ряд химическиъ элементов, расположенных в порядке возрастания их относительных атомных масс, начинающийся щелочным металлом и заканчивающийся благородным газом.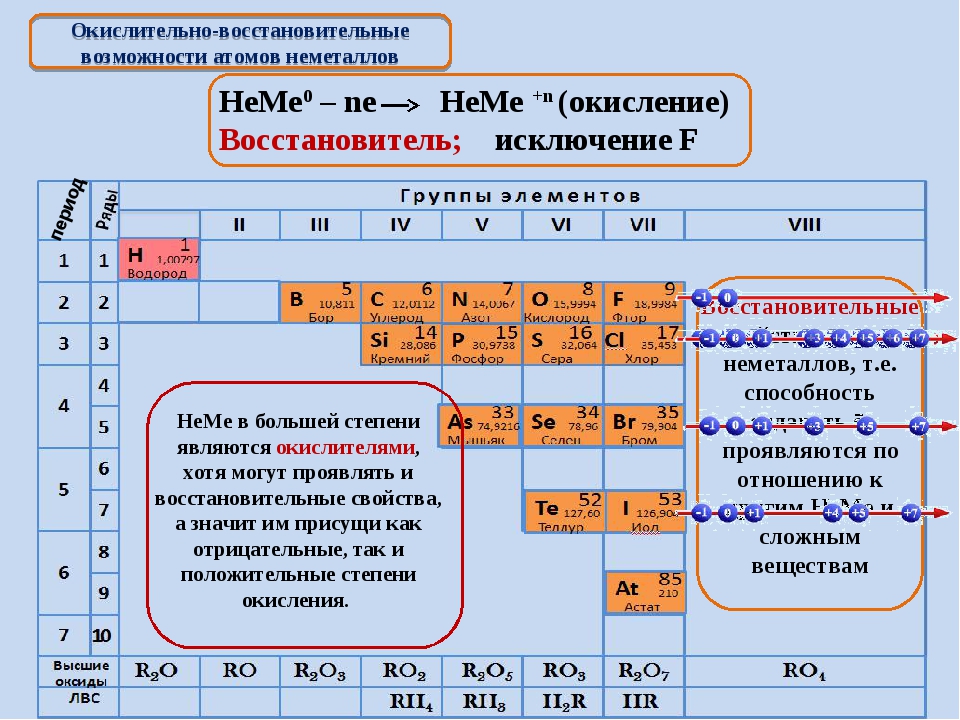
Общее у больших и малых периодов то, что они начинаются щелочным металлом (исключение — первый период) и заканчиваются благородным газом. Различное то, что в малых периодах находится менее 8 элементов, в больших — более 18 элементов.
В периодах закономерно изменяются металлические и неметаллические свойства химических элементов.
4. Дайте определение понятия «группа». Укажите различия между группами А и В.
Группа — вертикальный ряд химических элементов в периодической системе, атомы которых обладают сходными свойствами.
Различие между группами A и B заключается в том, что в группы A могут входить как металлы, так и неметаллы, а в группы B — только металлы.
5. Простое вещество какого химического элемента из каждой пары имеет более ярко выраженные металлические свойства: а) K или Ca, б) Mg или Al; в) Cs или Pb?
6.
 Простое вещество какого химического элемента из каждой пары имеет более ярко выраженные неметаллические свойства: а) S или Cl; б) C или N; в) Se или Br?
Простое вещество какого химического элемента из каждой пары имеет более ярко выраженные неметаллические свойства: а) S или Cl; б) C или N; в) Se или Br?
7. Разделите указанные элементы на металлы и неметаллы, укажите их положение в периодической системе (группа, период, атомный номер): кислород, натрий, серебро, неон, ртуть, бром, золото, ксенон, хром.
| Элемент | Металл или неметалл | Группа | Период | Атомный номер |
| кислород | неметалл | VIA | 2 | 9 |
| натрий | металл | IA | 3 | 11 |
| серебро | металл | IB | 5 | 47 |
| неон | неметалл | VIIIA | 2 | 10 |
| ртуть | металл | IIB | 6 | 80 |
| бром | неметалл | VIIA | 4 | 35 |
| золото | металл | IB | 6 | 79 |
| ксенон | неметалл | VIIIB | 5 | 54 |
| хром | металл | VIB | 4 | 24 |
8.
 Заполните таблицу в тетради:
Заполните таблицу в тетради:
| Символ элемента | Атомный номер | Относительная атомная масса | Номер и тип группы | Номер периода | Формула высшего оксида | Формула гидроксида |
| Ca | 20 | 40 | IIA | 4 | CaO | Ca(OH)2 |
| Al | 13 | 24 | IIIA | 3 | Al2O3 | Al(OH)3 |
| Se | 34 | 79 | VIA | 4 | SeO3 | H2SeO4 |
| N | 7 | 14 | VA | 2 | N2O5 | HNO3 |
| K | 19 | 39 | IA | 4 | K2O | KOH |
| As | 33 | 75 | VA | 4 | As2O5 | HAsO3 |
9.
 Готовимся к олимпиадам. Составьте уравнения реакций, с помощью которых можно осуществить следующие превращения:
Готовимся к олимпиадам. Составьте уравнения реакций, с помощью которых можно осуществить следующие превращения:
а) Mg→MgCl2→Mg(OH)2→MgSO4→MgCO3→MgO:\mathrm{Mg → MgCl_2 → Mg(OH)_2 → MgSO_4 → MgCO_3 → MgO:}Mg→MgCl2→Mg(OH)2→MgSO4→MgCO3→MgO:
Mg+Cl2=MgCl2;\mathrm{Mg + Cl_2 = MgCl_2;}Mg+Cl2=MgCl2;
MgCl2+2KOH=Mg(OH)2↓+2KCl;\mathrm{MgCl_2+2KOH=Mg(OH)_2↓+2KCl;}MgCl2+2KOH=Mg(OH)2↓+2KCl;
Mg(OH)2+h3SO4=MgSO4+2h3O;\mathrm{Mg(OH)_2+H_2SO_4=MgSO_4+2H_2O;}Mg(OH)2+h3SO4=MgSO4+2h3O;
MgSO4+Na2CO3=MgCO3↓+Na2SO4;\mathrm{MgSO_4+Na_2CO_3=MgCO_3↓+Na_2SO_4;}MgSO4+Na2CO3=MgCO3↓+Na2SO4;
MgCO3=MgO+CO2↑;\mathrm{MgCO_3=MgO+CO_2↑;}MgCO3=MgO+CO2↑;
б) S→SO2→CaSO3→h3SO3→SO2→Na2SO3:\mathrm{S → SO_2 → CaSO_3 → H_2SO_3 → SO_2 → Na_2SO_3:}S→SO2→CaSO3→h3SO3→SO2→Na2SO3:
S+O2=SO2;\mathrm{S+O_2=SO_2;}S+O2=SO2;
SO2+CaO=CaSO3;\mathrm{SO_2+CaO=CaSO_3;}SO2+CaO=CaSO3;
CaSO3+2HCl=CaCl2+h3O;\mathrm{CaSO_3+2HCl=CaCl_2+H_2O;}CaSO3+2HCl=CaCl2+h3O;
h3SO3=SO2+h3O;\mathrm{H_2SO_3=SO_2+H_2O;}h3SO3=SO2+h3O;
SO2+2NaOH=Na2SO3+h3O. \mathrm{SO_2+2NaOH=Na_2SO_3+H_2O.}SO2+2NaOH=Na2SO3+h3O.
\mathrm{SO_2+2NaOH=Na_2SO_3+H_2O.}SO2+2NaOH=Na2SO3+h3O.
Свойства и тенденции металлического характера
Не все металлические элементы одинаковы, но все они обладают определенными качествами. Здесь вы узнаете, что подразумевается под металлическим характером элемента и как изменяется металлический характер при перемещении по периоду или группе вниз в периодической таблице.
Что такое металлический характер?
Металлический символ — это название набора химических свойств, связанных с элементами, являющимися металлами. Эти химические свойства являются результатом того, насколько легко металлы теряют свои электроны с образованием катионов (положительно заряженных ионов).
Физические свойства, связанные с металлическим характером, включают металлический блеск, блестящий вид, высокую плотность, высокую теплопроводность и высокую электропроводность. Большинство металлов ковкие и пластичные, их можно деформировать без разрушения. Хотя многие металлы твердые и плотные, на самом деле существует широкий диапазон значений этих свойств, даже для элементов, которые считаются сильно металлическими.
Большинство металлов ковкие и пластичные, их можно деформировать без разрушения. Хотя многие металлы твердые и плотные, на самом деле существует широкий диапазон значений этих свойств, даже для элементов, которые считаются сильно металлическими.
Металлические символы и тенденции в таблице Менделеева
При перемещении по таблице Менделеева и вниз по таблице Менделеева появляются тенденции в металлическом характере.Металлический характер уменьшается по мере того, как вы перемещаетесь по периоду в периодической таблице слева направо. Это происходит потому, что атомы с большей готовностью принимают электроны для заполнения валентной оболочки, чем теряют их, удаляя незаполненную оболочку.
Металлический характер увеличивается по мере продвижения вниз по группе элементов в периодической таблице. Это связано с тем, что электроны становится легче терять по мере увеличения атомного радиуса, когда между ядром и валентными электронами меньше притяжение из-за увеличения расстояния между ними.
Распознавание элементов с металлическими символами
Вы можете использовать периодическую таблицу, чтобы предсказать, будет ли элемент отображать металлический характер, даже если вы ничего об этом не знаете. Вот что вам нужно знать:
- Металлический характер отображают металлы, которые находятся в левой части таблицы Менделеева. Исключение составляет водород, который в обычных условиях не является металлом. Даже водород ведет себя как металл, когда он жидкий или твердый, но для большинства целей его следует рассматривать как неметаллический.
- Элементы с металлическим характером встречаются в определенных группах или столбцах элементов, включая щелочные металлы, щелочноземельные металлы, переходные металлы (включая лантаноиды и актиниды, расположенные ниже основной части таблицы Менделеева) и основные металлы. Другие категории металлов включают неблагородные металлы, благородные металлы, черные металлы, тяжелые металлы и драгоценные металлы.
 Металлоиды имеют металлический характер, но эта группа элементов также имеет неметаллические свойства.
Металлоиды имеют металлический характер, но эта группа элементов также имеет неметаллические свойства.
Примеры элементов с металлическими символами
К металлам, хорошо проявляющим свой характер, относятся:
- франций (элемент с наивысшим металлическим характером)
- цезий (следующий наивысший уровень металлического характера)
- натрий
- медь
- серебро
- железо
- золото
- алюминий
Сплавы и металлические свойства
Хотя термин металлический знак обычно применяется к чистым элементам, сплавы также могут иметь металлический характер.Например, бронза и большинство сплавов меди, магния, алюминия и титана обычно обладают высокой металличностью. Некоторые металлические сплавы состоят исключительно из металлов, но большинство из них также содержат металлоиды и неметаллы, но сохраняют свойства металлов.
Периодические тенденции в свойствах металлов
Цель обучения
- Опишите соединение металлических элементов.

Ключевые моменты
- Названия групп в периодической таблице дают представление о металлических свойствах элементов.
- Металлические элементы находятся в левой части таблицы Менделеева.
- Простая концепция металлов описывает их как решетку положительных ионов, погруженных в море электронов.
Условия
- Семейство
- , также известное как группа, столбец элементов в периодической таблице, которые имеют одинаковую реакционную способность из-за их аналогичной электронной конфигурации валентной оболочки.
- электроотрицательный: стремление притягивать электроны для образования химической связи.
Напомним, что в периодической таблице каждая строка называется точкой. Строки выровнены таким образом, что элементы в каждом вертикальном столбце имеют определенные характеристики. Каждый из столбцов периодической таблицы называется группой. Химики давно сочли удобным называть элементы разных групп, а в некоторых случаях и промежутков групп, именами, приведенными в таблице. Имейте в виду, что названия групп могут дать подсказку о металлических свойствах элементов.
Имейте в виду, что названия групп могут дать подсказку о металлических свойствах элементов.
Когда два элемента соединены химической связью, элемент, который сильнее притягивает общие электроны, имеет большую электроотрицательность. Элементы с низкой электроотрицательностью обычно обладают более металлическими свойствами. Таким образом, металлические свойства элементов имеют тенденцию уменьшаться с течением времени и увеличиваться по группе. Тот факт, что металлические элементы находятся в левой части таблицы Менделеева, дает важный ключ к пониманию того, как они соединяются вместе, образуя твердые тела.Все эти элементы обладают низкой электроотрицательностью и легко образуют положительные ионы.
Металлы имеют тенденцию образовывать положительные ионы и отталкиваться друг от друга, так как же атомы металлов остаются связанными в твердом теле? Самая простая концепция металлов — это решетка положительных ионов, погруженных в «море электронов», которые могут свободно перемещаться по твердому телу. Фактически, электроположительная природа металлических атомов позволяет их валентным электронам существовать как подвижная жидкость. Это приводит к их высокой электропроводности.Поскольку каждый ион окружен электронной жидкостью во всех направлениях, связь не имеет направленных свойств; Этим объясняется высокая пластичность и пластичность металлов.
Фактически, электроположительная природа металлических атомов позволяет их валентным электронам существовать как подвижная жидкость. Это приводит к их высокой электропроводности.Поскольку каждый ион окружен электронной жидкостью во всех направлениях, связь не имеет направленных свойств; Этим объясняется высокая пластичность и пластичность металлов.
Boundless проверяет и курирует высококачественный контент с открытой лицензией из Интернета. Этот конкретный ресурс использовал следующие источники:
Металлический и неметаллический символ | Химия для неосновных
Цели обучения
- Определите металлический характер.
- Определите неметаллический характер.
- Опишите тенденции в металлическом характере в периодической таблице.
- Опишите тенденции неметаллического характера в периодической таблице.
График выше показывает некоторые тенденции в нашем питании за 30-летний период.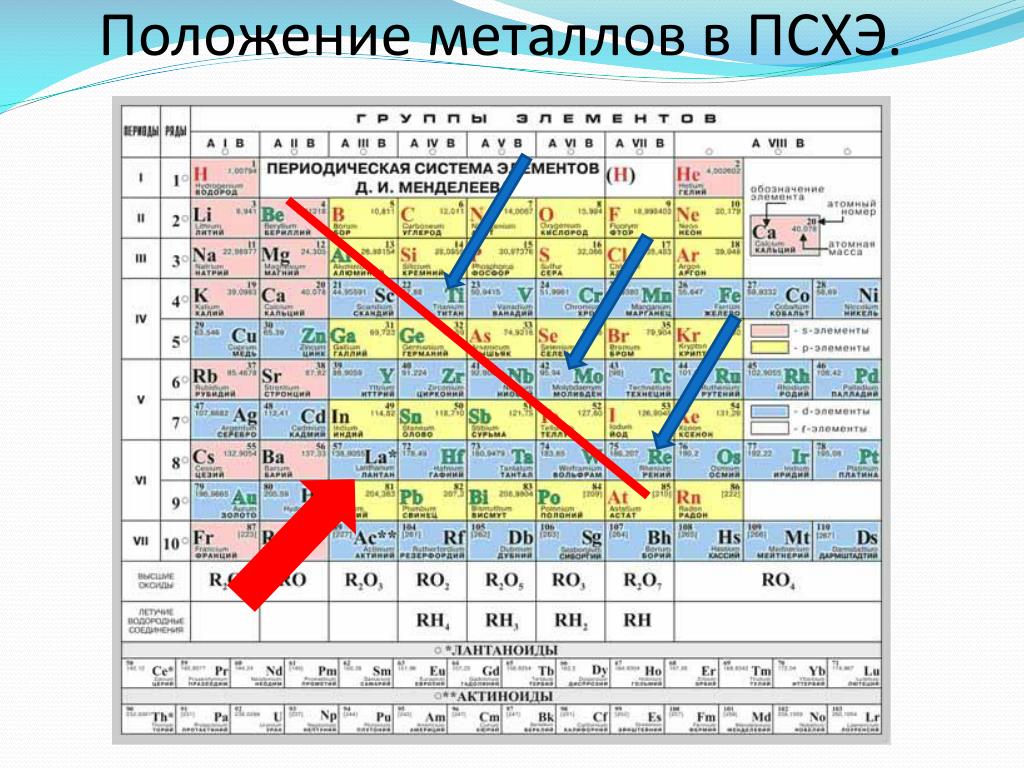 Наблюдая за направлением наших пищевых привычек, мы можем предпринять шаги, чтобы помочь предотвратить вредные привычки в еде и уменьшить такие проблемы, как высокое кровяное давление и сердечные приступы.
Наблюдая за направлением наших пищевых привычек, мы можем предпринять шаги, чтобы помочь предотвратить вредные привычки в еде и уменьшить такие проблемы, как высокое кровяное давление и сердечные приступы.
Разработка таблицы Менделеева помогла систематизировать химическую информацию во многих отношениях. Теперь мы можем видеть тенденции в свойствах различных атомов и делать прогнозы относительно поведения конкретных материалов.
Металлический символ обозначает уровень реакционной способности металла. Металлы имеют тенденцию терять электроны в химических реакциях, на что указывает их низкая энергия ионизации. В составе соединения атомы металлов имеют относительно низкое притяжение электронов, на что указывает их низкая электроотрицательность.Следуя сводке тенденций на рисунке ниже, вы можете увидеть, что наиболее химически активные металлы будут находиться в левой нижней части периодической таблицы. Самый реактивный металл — цезий, который не встречается в природе как свободный элемент. Он взрывоопасен с водой и самовозгорается на воздухе. Франций ниже цезия в группе щелочных металлов, но он настолько редок, что большинство его свойств никогда не наблюдались.
Он взрывоопасен с водой и самовозгорается на воздухе. Франций ниже цезия в группе щелочных металлов, но он настолько редок, что большинство его свойств никогда не наблюдались.
Рис. 1. Тенденции в поведении элементов.
Реакционная способность металлов основана на таких процессах, как образование галогенидных соединений с галогенами и на том, насколько легко они вытесняют водород из разбавленных кислот.
Металлический персонаж увеличивается по мере того, как вы спускаетесь по группе. Поскольку энергия ионизации уменьшается при движении вниз по группе (или увеличивается при движении вверх по группе), повышенная способность металлов, находящихся ниже в группе, терять электроны, делает их более реактивными. Вдобавок атомный радиус увеличивается по мере движения вниз по группе, размещая внешние электроны дальше от ядра и делая этот электрон менее притягиваемым ядром.
Неметаллы имеют тенденцию приобретать электроны в химических реакциях и имеют сильное притяжение для электронов внутри соединения. Наиболее реактивные неметаллы находятся в верхней правой части таблицы Менделеева. Поскольку благородные газы представляют собой особую группу из-за их низкой реакционной способности, элемент фтор является наиболее реактивным неметаллом. Он не встречается в природе как свободный элемент. Газообразный фтор вступает во взрывоопасную реакцию со многими другими элементами и соединениями и считается одним из самых опасных известных веществ.
Наиболее реактивные неметаллы находятся в верхней правой части таблицы Менделеева. Поскольку благородные газы представляют собой особую группу из-за их низкой реакционной способности, элемент фтор является наиболее реактивным неметаллом. Он не встречается в природе как свободный элемент. Газообразный фтор вступает во взрывоопасную реакцию со многими другими элементами и соединениями и считается одним из самых опасных известных веществ.
Обратите внимание, что нет четкого разделения между металлическим символом и неметаллическим символом .По мере того, как мы перемещаемся по периодической таблице, наблюдается возрастающая тенденция к принятию электронов (неметаллических) и уменьшение вероятности того, что атом отдаст один или несколько электронов.
Сводка
- Металлический знак относится к уровню химической активности металла.
- Неметаллический характер относится к тенденции принимать электроны во время химических реакций.
- Металлическая тенденция усиливается при движении вниз по группе.

- Неметаллическая тенденция возрастает слева направо по таблице Менделеева.
Практика
Воспользуйтесь ссылкой ниже, чтобы ответить на следующие вопросы:
http://www.chem.tamu.edu/class/majors/tutorialnotefiles/metals.htm
- Перечислите три характеристики металлов.
- Перечислите три характеристики неметаллов.
- Укажите два различия между металлами и неметаллами, которые могут повлиять на металлические и неметаллические свойства.
Обзор
- Определите «металлический характер».
- Определите «неметаллический характер».”
- Опишите тенденцию к снижению металлического характера в группе.
- Опишите тенденцию появления неметаллических элементов в периодической таблице.
- Почему металлический характер усиливается по мере того, как вы спускаетесь по группе?
Глоссарий
- металлик: Относится к уровню реакционной способности металла.

- неметаллический: Относится к тенденции принимать электроны во время химических реакций.
Свойства металлов Урок
Для большинства людей металл — это другое слово, обозначающее железо, сталь или подобное твердое блестящее вещество.
Но соответствует ли это определение истинным свойствам металлов?
Да… и нет.
Прежде чем мы объясним, вы должны знать, что большинство элементов в периодической таблице — металлы.
Металлы находятся в центре и в левой части таблицы Менделеева. Их можно дополнительно классифицировать как щелочные металлы, щелочноземельные металлы, переходные металлы и основные металлы.
Урок «Металловедение»
Свойства металлов
Элемент — это вещество, состоящее из одного вида атомов; его нельзя разделить на более простые части.Например, элемент гелий (вспомните воздушные шары) состоит исключительно из атомов гелия.
Элементы обычно классифицируются как металлы или неметаллы (хотя некоторые элементы имеют характеристики обоих; они называются металлоидами ).
Три свойства металлов:
- Блеск: Металлы блестят при резке, царапинах или полировке.
- Ковкость: Металлы прочные, но податливые, а это значит, что их можно легко согнуть или придать форму.На протяжении веков кузнецы могли формировать металлические предметы, нагревая металл и ударяя по нему молотком. Если бы они попробовали это с неметаллами, материал бы лопнул! Большинство металлов также пластичны, , что означает, что их можно вытягивать для изготовления проволоки.
- Электропроводность: Металлы отлично проводят электричество и тепло. Поскольку они также пластичны, они идеально подходят для электропроводки. (Вы можете проверить это, используя некоторые предметы домашнего обихода. Продолжайте читать, чтобы узнать, как это сделать!)
Дополнительные свойства металлов
Высокая температура плавления : Большинство металлов имеют высокие температуры плавления, и все, кроме ртути, являются твердыми при комнатной температуре.
Звонкий : Металлы часто издают звенящий звук при ударе.
Реакционная способность : Некоторые металлы подвергаются химическому изменению (реакции) сами по себе или с другими элементами и выделяют энергию. Эти металлы никогда не встречаются в чистом виде, и их трудно отделить от минералов, в которых они содержатся. Калий и натрий являются наиболее химически активными металлами. Они бурно реагируют с воздухом и водой; калий воспламеняется при контакте с водой!
Другие металлы вообще не вступают в реакцию с другими металлами.Это означает, что их можно найти в чистом виде (например, золото и платина). Поскольку медь относительно недорога и имеет низкую реакционную способность, ее можно использовать для изготовления труб и проводки.
Пять групп металлов:
Благородные металлы встречаются как чистые металлы, потому что они нереактивны и не соединяются с другими элементами с образованием соединений.
Поскольку они не реагируют, они не подвержены коррозии. Это делает их идеальными для украшений и монет. Благородные металлы включают медь, палладий, серебро, платину и золото.
Щелочные металлы очень реактивны. Они имеют низкую температуру плавления и достаточно мягкие, чтобы их можно было разрезать ножом. Калий и натрий — два щелочных металла.
Щелочноземельные металлы содержатся в соединениях с множеством различных минералов. Они менее реактивны, чем щелочные металлы, а также тверже и имеют более высокие температуры плавления. В эту группу входят кальций, магний и барий.
Переходные металлы — это то, о чем мы обычно думаем, когда думаем о металлах.Они твердые и блестящие, прочные и легко поддаются форме. Они используются во многих промышленных целях. В эту группу входят железо, золото, серебро, хром, никель и медь, некоторые из которых также являются благородными металлами.
Poor Metals довольно мягкие, и большинство из них не используются сами по себе.
Однако они становятся очень полезными при добавлении к другим веществам. Бедные металлы включают алюминий, галлий, олово, таллий, сурьму и висмут.
Сплавы: сильные комбинации
Свойства этих разных металлов можно комбинировать, смешивая два или более из них вместе.Полученное вещество называется сплавом . Некоторые из наших самых полезных строительных материалов на самом деле являются сплавами. Сталь, например, представляет собой смесь железа и небольшого количества углерода и других элементов; комбинация, которая одновременно сильна и проста в использовании. (Добавьте хром, и вы получите нержавеющую сталь. Проверьте свои кухонные кастрюли и сковороды, чтобы узнать, сколько из них сделано из нержавеющей стали!)
Другие сплавы, такие как латунь (медь и цинк) и бронза (медь и олово), легко формуются и красивы.Бронза также часто используется в судостроении, поскольку она устойчива к коррозии в морской воде.
Титан намного легче и менее плотный, чем сталь, но такой же прочный; и хотя он тяжелее алюминия, он вдвое прочнее.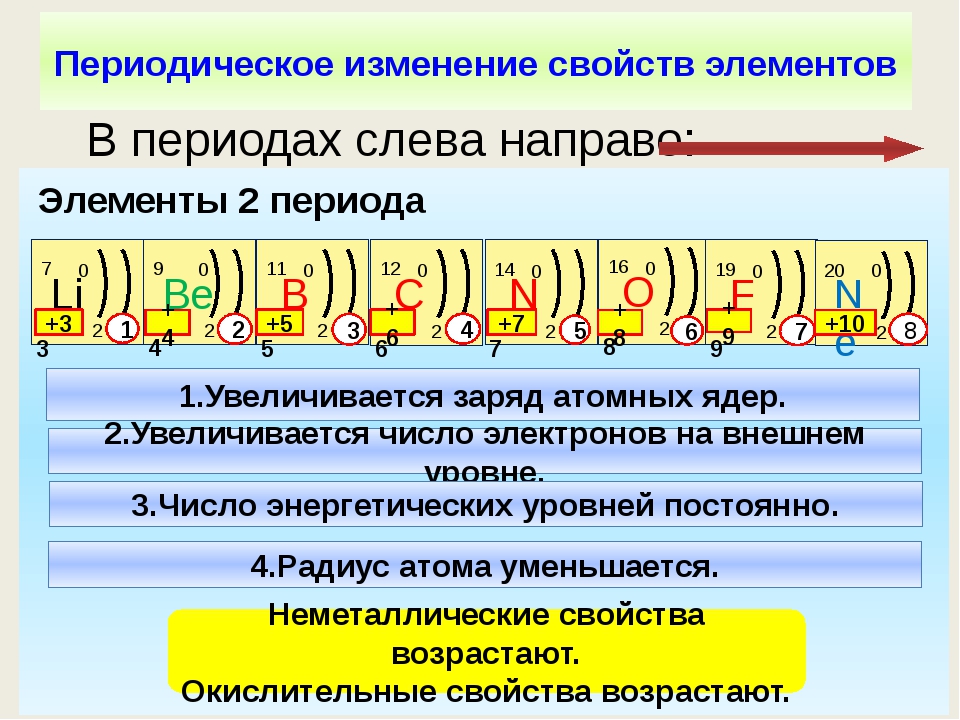 Кроме того, он очень устойчив к коррозии. Все эти факторы делают его отличным сплавом. Титановые сплавы используются в самолетах, кораблях и космических кораблях, а также в красках, велосипедах и даже портативных компьютерах!
Кроме того, он очень устойчив к коррозии. Все эти факторы делают его отличным сплавом. Титановые сплавы используются в самолетах, кораблях и космических кораблях, а также в красках, велосипедах и даже портативных компьютерах!
Золото, как чистый металл, настолько мягкое, что при изготовлении ювелирных изделий оно всегда смешивается с другим металлом (обычно серебром, медью или цинком).Чистота золота измеряется в карат . Самое чистое, что вы можете получить в ювелирных изделиях, — это 24 карата, что составляет около 99,7% чистого золота. Золото также можно смешивать с другими металлами, чтобы изменить его цвет; белое золото, популярное для ювелирных украшений, представляет собой сплав золота и платины или палладия.
Металл из руды
Руды — это горные породы или минералы, из которых можно извлечь ценное вещество — обычно металл. Некоторые распространенные руды включают галенит (свинцовая руда), борнит и малахит (медь), киноварь (ртуть) и боксит (алюминий). Наиболее распространенными железными рудами являются магнетит и гематит (минерал ржавого цвета, образованный железом и кислородом), которые содержат около 70% железа.
Наиболее распространенными железными рудами являются магнетит и гематит (минерал ржавого цвета, образованный железом и кислородом), которые содержат около 70% железа.
Существует несколько процессов очистки железа от руды. Более старый процесс заключается в сжигании железной руды с использованием древесного угля (углерода) и кислорода, обеспечиваемого сильфонами. Углерод и кислород, включая кислород в руде, соединяются и покидают железо. Однако железо не нагревается настолько, чтобы полностью расплавиться, и содержит силикаты, оставшиеся от руды.Его можно нагреть и выковать из кованого железа .
В более современном процессе используется доменная печь для нагрева железной руды, известняка и кокса (угольный продукт, а не безалкогольный напиток). В результате реакции происходит отделение железа от кислорода в руде. Этот «чугун» необходимо дополнительно перемешать, чтобы получить кованое железо. Его также можно использовать для другой важной цели: при нагревании углеродом и другими элементами он становится более прочным металлом, называемым сталью .
Принимая во внимание этот процесс, неудивительно, что железо не использовалось примерно до 1500 г. до н.э. Но некоторые чистые металлы — золото, серебро и медь — использовались и раньше, а легированная бронза, как полагают, была открыта шумерами около 3500 г. до н.э. Но алюминий, один из важнейших металлов в современном мире, не был открыт до 1825 года нашей эры и не использовался широко до 20 века!
Коррозия: процесс и предотвращение
Вы когда-нибудь видели кусок серебра, который потерял свой блеск, или железо с красноватой ржавчиной на нем или даже с дырками в результате коррозии? Это происходит, когда кислород (обычно из воздуха) вступает в реакцию с металлом.Металлы с более высокой реакционной способностью (такие как магний, алюминий, железо, цинк и олово) гораздо более склонны к такому виду химического разрушения или коррозии .
Когда кислород вступает в реакцию с металлом, он образует оксид на поверхности металла. Для некоторых металлов, например алюминия, это хорошо. Оксид образует защитный слой, предохраняющий металл от дальнейшей коррозии.
Для некоторых металлов, например алюминия, это хорошо. Оксид образует защитный слой, предохраняющий металл от дальнейшей коррозии.
С другой стороны, у чугуна и стали возникают серьезные проблемы, если они не обрабатываются для предотвращения коррозии.Красноватый оксидный слой, образующийся на железе или стали при реакции с кислородом, называется ржавчиной . Слой ржавчины постоянно отслаивается, подвергая большую часть металла коррозии, пока металл в конечном итоге не проедает.
Один из распространенных способов защиты железа — это покрытие его специальной краской, которая препятствует взаимодействию кислорода с металлом под краской. Другой метод — цинкование : в этом процессе сталь покрывается цинком. Кислород, молекулы воды и углекислый газ в воздухе вступают в реакцию с цинком, образуя слой карбоната цинка, который защищает от коррозии.Посмотрите вокруг своего дома, двора и гаража, чтобы увидеть примеры коррозии, а также гальванизации и других средств защиты металла от ржавчины.
Технология: фейерверки и химия
Если вы посмотрите фейерверк Четвертого июля, то увидите прекрасные сочетания цветов и искр.
Как работает этот удивительный пиротехнический дисплей? Короткий ответ — химия. Более длинный включает в себя обзор свойств металлов.
Один из основных ингредиентов петард, наземных и воздушных фейерверков (которые взрываются в небе) — это черный порошок , изобретенный китайцами около 1000 лет назад.Это смесь нитрата калия (селитры), древесного угля и серы в соотношении 75:15:10. Черный порох используется для запуска антенн, а также вызывает взрывы, необходимые для создания специальных эффектов, таких как шум или цветной свет.
В бенгальских огнях черный порошок смешивают с металлическими порошками и другими химическими соединениями в форме, которая будет гореть медленно, сверху вниз. В простых ракетах-фейерверках черный порох находится в трубке вокруг взрывателя. При зажигании порошок создает силу, которая приводит к равной и противоположной реакции, отталкивая фейерверк от земли, а затем заставляя соединения внутри него взорваться в воздухе.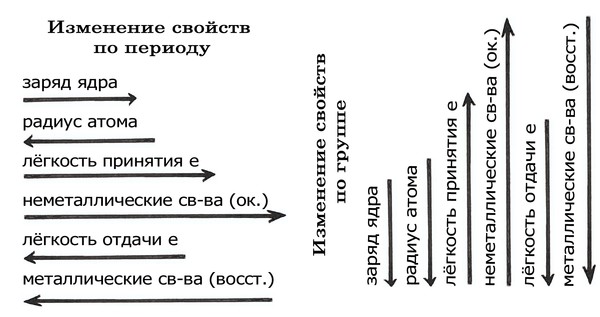
Более сложные снаряды для фейерверков запускаются из миномета, трубы с черным порохом, которая при зажигании вызывает реакцию взрыва. Запал фейерверк-снаряда загорается, когда он поднимается в воздух, и в нужный момент взрыв внутри снаряда вызывает взрыв его зарядов со специальными эффектами.
Яркая, красочная часть фейерверка вызвана «возбужденными» электронами в атомах различных соединений металлов и солей. Эти соединения находятся в маленьких шариках, называемых звездочкой , сделанных из того же соединения, что и бенгальский огонь.
Металлы как красители
Различные металлы горят разными цветами; например, если горит соединение меди, его пламя будет сине-зеленого цвета. Кальций горит красным цветом, а калий горит пурпурным. В фейерверках металлы комбинируются для создания разных цветов.
Когда звезды внутри фейерверка нагреваются, возбужденные атомы излучают световую энергию. Этот свет делится на две категории: лампы накаливания и люминесценции. Накаливание — это свет, производимый теплом: в фейерверках химически активные металлы, такие как алюминий и магний, при нагревании вызывают вспышку очень яркого света — иногда при температуре выше 5000 ° F!
Накаливание — это свет, производимый теплом: в фейерверках химически активные металлы, такие как алюминий и магний, при нагревании вызывают вспышку очень яркого света — иногда при температуре выше 5000 ° F!
Менее реактивные соединения не нагреваются до такой степени, что искры становятся тусклее. Люминесценция , с другой стороны, возникает из других источников и может возникать даже при низких температурах. Электроны в соединении поглощают энергию, делая их «возбужденными». Однако электроны не могут поддерживать этот высокий уровень, поэтому они возвращаются на более низкий уровень, высвобождая при этом световую энергию (фотоны).
Хлорид бария — это химическое соединение, придающее фейерверкам люминесцентный зеленый цвет, а хлорид меди — синий. Для любого типа света важно использовать чистые ингредиенты, поскольку следы других соединений будут затемнять цвет.
Дополнительная литература по металлам:
Metal: Chemistry Guide
Любой химический элемент, который является эффективным проводником электричества и тепла, можно определить как металл.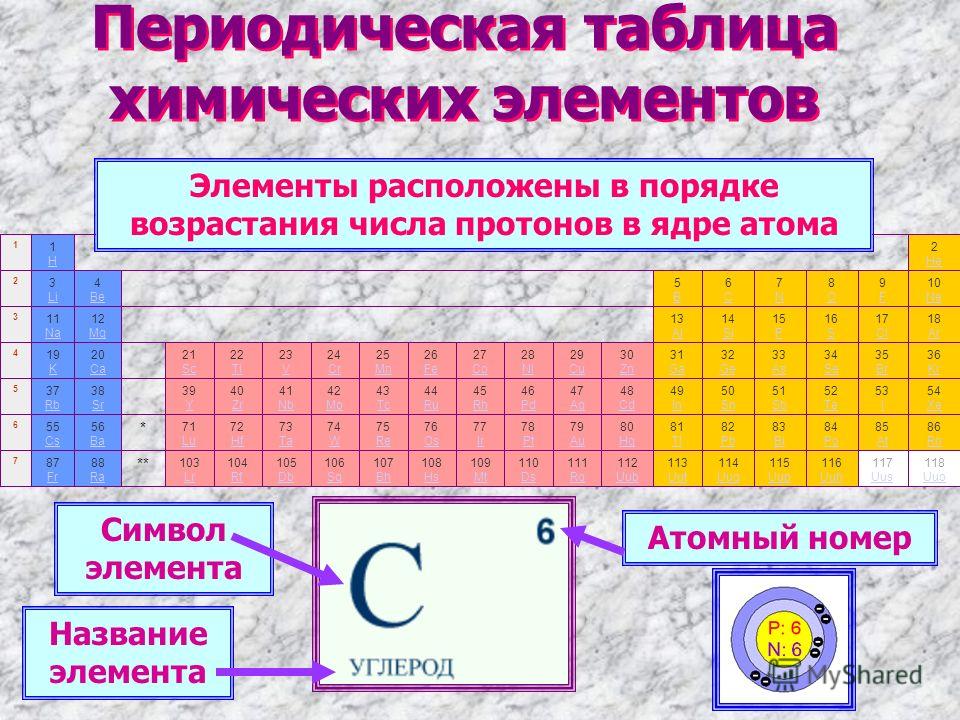 Металл также хорош в образовании связей и катионов с неметаллами. Атомы внутри металла быстро теряют электроны, чтобы образовались положительные ионы или катионы. Ионы, в свою очередь, окружены делокализованными электронами, которые придают металлу его электропроводность.
Металл также хорош в образовании связей и катионов с неметаллами. Атомы внутри металла быстро теряют электроны, чтобы образовались положительные ионы или катионы. Ионы, в свою очередь, окружены делокализованными электронами, которые придают металлу его электропроводность.
Различные типы металлов в периодической таблице
Ниже мы более подробно рассмотрим различные типы металлов в периодической таблице, их свойства и способы использования.
Щелочные металлы
Какие элементы в таблице Менделеева относятся к щелочным металлам? Щелочные металлы — это группа металлов в периодической таблице, известная как элементы Группы 1. К щелочным металлам относятся калий, натрий, литий, цезий, рубидий и затем франций. Один элемент, водород, который обычно входит в эту группу металлов, часто не проявляет поведения, сравнимого с поведением остальных щелочных металлов. Для остальных щелочных металлов они демонстрируют один из лучших примеров групповых тенденций в свойствах элементов в периодической таблице.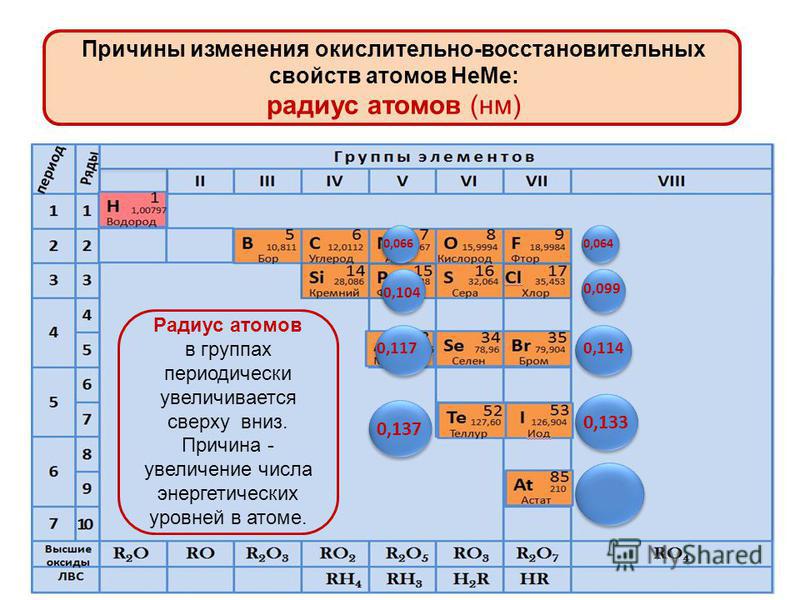
Щелочная земля
Щелочноземельные металлы относятся к элементам 2 группы Периодической таблицы Менделеева и состоят из радия, бария, стронция, кальция, магния и бериллия. Название этой специфической группы металлов происходит от их собственных оксидов, которые, в свою очередь, являются основными щелочными растворами. Помимо магния и бериллия, щелочноземельные металлы обладают опознаваемым цветом пламени. Эти цвета пламени — малиново-красный для радия, зеленый для бария, ярко-красный для стронция и оранжевый для кальция.
Лантаноиды
Лантаноиды — это 15 элементов, которые составляют атомные номера от 57 до 71 в периодической таблице. Ряд элементов варьируется от лантана до лютеция. Все элементы лантаноидов являются элементами f-блока, что означает, что они коррелируют с заполнением электронной оболочки 4f. Несмотря на то, что элемент, называемый лютецием, является элементом d-блока, он также в основном считается элементом d-блока. Группа элементов в целом называется лантаноидом, потому что более легкие элементы в их ряду химически подобны лантану.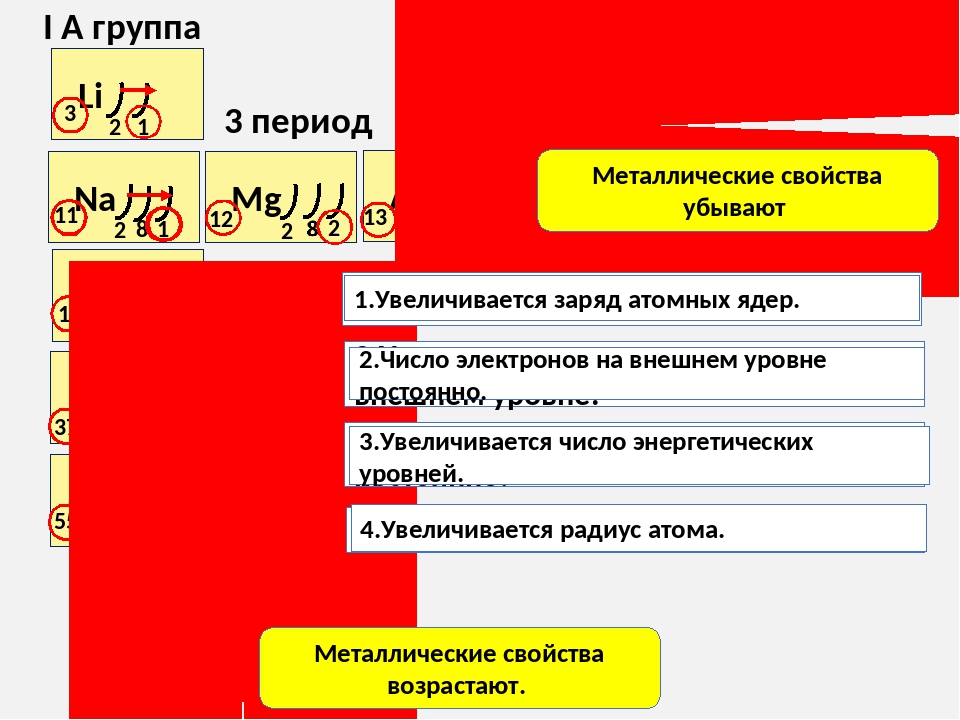
Актиниды
Актиниды — это 15 химических элементов с номерами от 89 до 103, которые соответствуют актинию и лоуренсию. Название этой серии элементов происходит от элемента актиний. Хотя большинство актинидных элементов в списке актинидных элементов являются синтетическими элементами, уран и торий можно найти в природе не только в следовых количествах. Одно свойство, которым славятся эти элементы, — это радиоактивность, которая присутствует во всех них; плутоний, торий и уран используются в ядерном оружии и реакторах.
Переходные металлы
Переходные металлы — это элементы, в которых атомы имеют незавершенную подоболочку. Переходные металлы или элементы отличаются от других элементов своими общими свойствами. Одно из их свойств состоит в том, что они образуют множество соединений в нескольких степенях окисления. Еще одним свойством, которым они известны, является их склонность к образованию множества парамагнитных соединений, в основном из-за низкой реакционной способности их неспаренных d-электронов.
Металлоиды
Металлоиды — это химические элементы, которые лучше всего определять по двум критериям.Они часто образуют амфотерные оксиды и ведут себя так же, как полупроводники. Кремний, бор, германий, теллур, сурьма и мышьяк обычно относятся к металлоидам. Иногда элемент под названием полоний также включается в классификацию металлоидов, но по этому поводу все еще ведутся споры среди экспертов.
Химия металлов — другие металлы
Другие металлы, или постпереходные металлы, представляют собой группу элементов в периодической таблице, которые расположены справа от переходных элементов.До сих пор ведутся серьезные споры о том, какие элементы следует включить в эту группу. Обычно цинк, галлий, кадмий, индий, олово, ртуть, таллий, свинец и висмут включаются в состав других металлов периодической таблицы. С разной консистенцией ртуть, кадмий и цинк (так называемые элементы группы 12) как включаются, так и исключаются из списков этих других металлов.
Руководства по другим металлам и металлопродукции
Химия и химические изделия прочие
Больше от Metals & Metal Products
минералов и элементов | Коалиция по образованию в области полезных ископаемых
Минерал — это встречающийся в природе неорганический элемент или соединение, имеющее упорядоченную внутреннюю структуру и характерный химический состав, кристаллическую форму и физические свойства. Минералы могут быть металлическими, например золото, или неметаллическими, например тальком.
Минералы могут быть металлическими, например золото, или неметаллическими, например тальком.
| Золото | Тальк |
Месторождение полезных ископаемых — это месторождение полезных ископаемых достаточного размера и содержания (концентрации), которое при самых благоприятных обстоятельствах может рассматриваться как имеющее экономический потенциал.
Проявление полезных ископаемых — это скопление минерала (обычно рассматриваемого с точки зрения какого-либо товара, например, золота), которое где-то считается ценным или представляет научный или технический интерес.В редких случаях концентрация продукта может даже не превышать его среднее содержание в земной коре.
Дополнительные условия минеральных ресурсов:
Заполнитель — это горная порода или минеральный материал, используемый отдельно и в качестве наполнителя в цементе, асфальте, гипсе и других материалах.
Сплав — это вещество, обладающее металлическими свойствами и состоящее из двух или более химических элементов, из которых по крайней мере один является металлом.
Элемент — это вещество, атомы которого имеют одинаковый атомный номер и не могут быть разложены на более простые вещества обычными химическими процессами.
Металл — это класс химических элементов, таких как железо, золото и алюминий. Металлы имеют характерный блеск, являются хорошими проводниками тепла и электричества, непрозрачны, плавки и, как правило, ковкие и пластичные.
Руда — это природный материал, из которого можно извлечь полезный минерал или полезные ископаемые.
ПРОЧИЙ ПРОМЫШЛЕННЫЙ МАТЕРИАЛ *
В базе данных минеральных ресурсов MEC этот общий термин используется для различения некоторых геологических сыпучих продуктов, таких как песок и гравий, которые не вписываются в отдельные категории элементов, минералов или горных пород, а также цемент, который был изготавливается из нескольких видов геологических продуктов.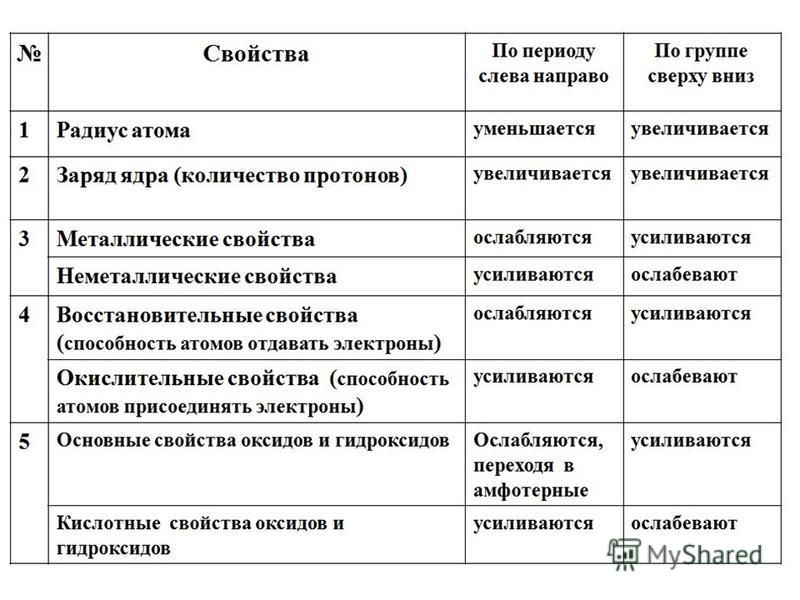
Камень — это материал естественной формы, состоящий из минерала или минералов; любой твердый консолидированный материал, полученный с Земли.
( Источники: USGS, Жизненный цикл месторождения полезных ископаемых, 2005 г .; * указывает на добавление MEC)
База данных полезных ископаемых
Минералы в вашей жизни
Периодическая таблица элементов
Статистика использования минералов
Химические свойства элементов и соединений
Атомный номер
Атомный номер указывает количество протонов в ядре атома.Атомный номер — важное понятие химии и квантовой механики. Элемент и его место в периодической таблице выводятся из этой концепции.
Когда атом обычно электрически нейтрален, атомный номер будет равен количеству электронов в атоме, которые можно найти вокруг ядра. Эти электроны в основном определяют химическое поведение атома. Атомы, несущие электрические заряды, называются ионами.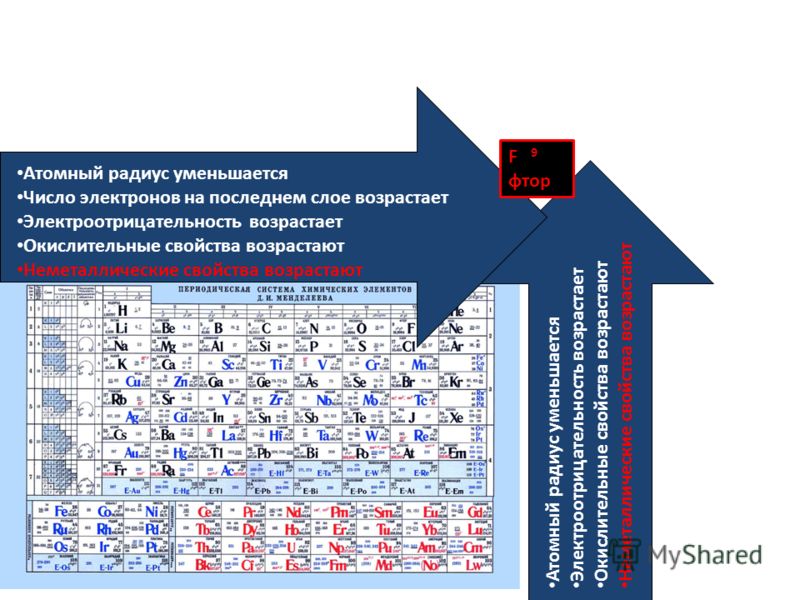 Ионы имеют либо количество электронов, большее (отрицательно заряженное), либо меньшее (положительно заряженное), чем атомный номер.
Ионы имеют либо количество электронов, большее (отрицательно заряженное), либо меньшее (положительно заряженное), чем атомный номер.
Атомная масса
Название указывает на массу атома, выраженную в атомных единицах массы (а.е.м.). Большая часть массы атома сосредоточена в протонах и нейтронах, содержащихся в ядре. Каждый протон или нейтрон весит около 1 а.е.м., поэтому атомная масса всегда очень близка к массовому (или нуклонному) числу , которое указывает количество частиц в ядре атома; это означает протоны и нейтроны. Каждый изотоп химического элемента может различаться по массе.Атомная масса изотопа указывает количество нейтронов, которые присутствуют в ядре атомов. Полная атомная масса элемента эквивалентна единицам массы его изотопов. Относительное присутствие изотопов в природе является важным фактором при определении общей атомной массы элемента. Что касается определенного химического элемента, то атомная масса, указанная в периодической таблице, представляет собой среднюю атомную массу всех стабильных изотопов химического элемента.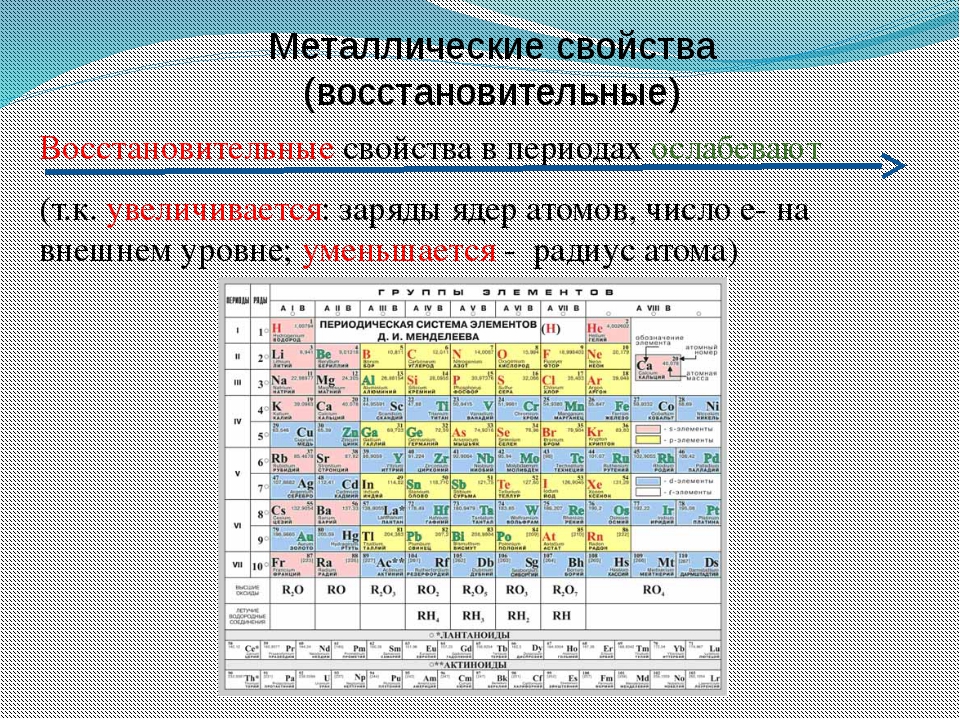 Среднее значение взвешено по относительному естественному содержанию изотопов элемента.
Среднее значение взвешено по относительному естественному содержанию изотопов элемента.
Электроотрицательность согласно Полингу
Электроотрицательность измеряет наклон атома, чтобы тянуть электронное облако в своем направлении во время химической связи с другим атомом.
Шкала Полинга — широко используемый метод для упорядочивания химических элементов по их электроотрицательности. Лауреат Нобелевской премии Линус Полинг разработал эту шкалу в 1932 году.
Значения электроотрицательности не рассчитываются на основе математических формул или измерений.Это больше похоже на прагматический диапазон.
Полинг дал элементу с максимально возможной электроотрицательностью, фтору, значение 4,0. Францию, элементу с минимально возможной электроотрицательностью, было присвоено значение 0,7. Всем остальным элементам дается значение где-то между этими двумя крайностями.
Плотность
Плотность элемента указывает количество единиц массы элемента, которые присутствуют в определенном объеме среды. Традиционно плотность выражается греческой буквой ро (пишется как r).В системе единиц СИ плотность выражается в килограммах на кубический метр (кг / м 3 ). Плотность элемента обычно выражается графически с помощью температуры и давления воздуха, поскольку эти два свойства влияют на плотность.
Традиционно плотность выражается греческой буквой ро (пишется как r).В системе единиц СИ плотность выражается в килограммах на кубический метр (кг / м 3 ). Плотность элемента обычно выражается графически с помощью температуры и давления воздуха, поскольку эти два свойства влияют на плотность.
Точка плавления
Точка плавления элемента или соединения означает температуры, при которых твердая форма элемента или соединения находится в равновесии с жидкой формой. Обычно мы предполагаем, что давление воздуха составляет 1 атмосферу.
Например: температура плавления воды составляет 0 o C или 273 K.
Точка кипения
Точка кипения элемента или соединения означает температуру, при которой жидкая форма элемента или соединения в равновесии с газообразной формой. Обычно мы предполагаем, что давление воздуха составляет 1 атмосферу.
Например: температура кипения воды составляет 100 o C или 373 K.
При температуре кипения давление пара элемента или соединения составляет 1 атмосферу.
Радиус Вандервальса
Даже когда два атома, которые находятся рядом друг с другом, не связываются, они все равно будут притягиваться друг к другу. Это явление известно как взаимодействие Вандервальса.
Силы Вандервальса вызывают силу между двумя атомами. Эта сила становится сильнее по мере сближения атомов. Однако, когда два атома приближаются слишком близко друг к другу, срабатывает отталкивающая сила, как следствие чрезмерного отталкивания между отрицательно заряженными электронами обоих атомов.В результате между двумя атомами образуется определенное расстояние, известное как радиус Вандервальса.
Путем сравнения радиусов Вандервальса нескольких различных пар атомов мы разработали систему радиусов Вандервальса, с помощью которой мы можем предсказать радиус Вандервальса между двумя атомами путем сложения.
Ионный радиус
Ионный радиус — это радиус, который ион имеет в ионном кристалле, где ионы упакованы вместе до точки, в которой их внешние электронные орбитали находятся в контакте друг с другом. Орбиталь — это область вокруг атома, где, согласно теории орбиталей, вероятность нахождения электрона наибольшая.
Орбиталь — это область вокруг атома, где, согласно теории орбиталей, вероятность нахождения электрона наибольшая.
Изотопы
Атомный номер не определяет количество нейтронов в ядре атома. В результате количество нейтронов в атоме может варьироваться. Тогда атомы с одинаковым атомным номером могут отличаться по атомной массе. Атомы одного и того же элемента, различающиеся атомной массой, называются изотопами.
В основном с более тяжелыми атомами, которые имеют более высокий атомный номер, количество нейтронов в ядре может превышать количество протонов.
Изотопы одного и того же элемента часто встречаются в природе попеременно или в смесях.
Пример: хлор имеет атомный номер 17, что в основном означает, что все атомы хлора содержат 17 протонов внутри своего ядра. Есть два изотопа. Три четверти атомов хлора, встречающихся в природе, содержат 18 нейтронов, а одна четверть — 20 нейтронов. Массовые числа этих изотопов 17 + 18 = 35 и 17 + 20 = 37.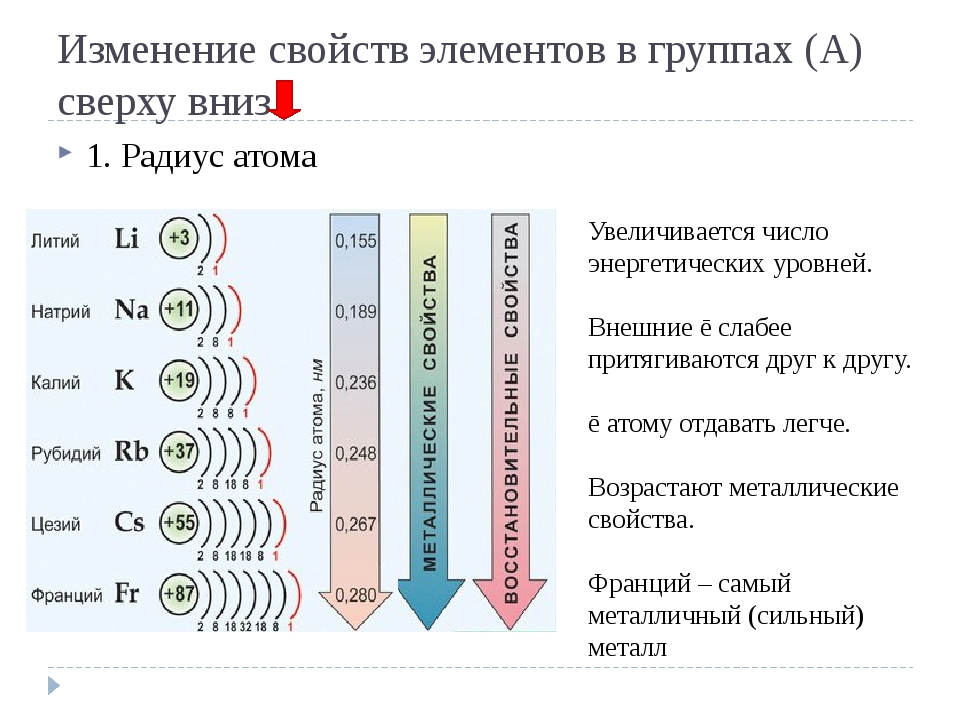 Изотопы записываются следующим образом: 35Cl и 37Cl.
Изотопы записываются следующим образом: 35Cl и 37Cl.
Когда изотопы указаны таким образом, количество протонов и нейтронов не нужно упоминать отдельно, потому что символ хлора в периодической таблице (Cl) расположен на семнадцатом месте.Это уже указывает количество протонов, так что всегда можно легко вычислить количество нейтронов с помощью массового числа.
Большое количество изотопов нестабильно. Они развалятся в процессе радиоактивного распада. Радиоактивные изотопы называются радиоизотопами.
Электронная оболочка
Электронная конфигурация атома — это описание расположения электронов по кругу вокруг ядра. Эти круги не совсем круглые; они содержат волнообразный узор.Для каждого круга вероятность присутствия электрона в определенном месте описывается математической формулой. Каждый из кругов имеет определенный уровень энергии по сравнению с ядром. Обычно уровни энергии электронов выше, когда они находятся дальше от ядра, но из-за своего заряда электроны также могут влиять на уровни энергии друг друга.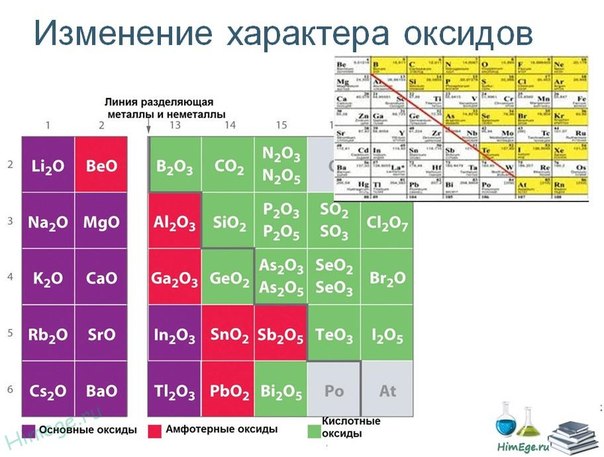 Обычно сначала заполняются средние кружки, но могут быть исключения из-за отказов.
Обычно сначала заполняются средние кружки, но могут быть исключения из-за отказов.
Круги разделены на оболочки и части, которые можно пронумеровать с помощью количества.
Энергия первой ионизации
Энергия ионизации означает энергию, которая требуется, чтобы свободный атом или молекула потеряли электрон в вакууме. Другими словами; энергия ионизации является мерой прочности электронных связей с молекулами. Это касается только электронов внешнего круга.
Энергия второй ионизации
Помимо энергии первой ионизации, которая показывает, насколько сложно удалить первый электрон из атома, существует также мера энергии для второй ионизации.Эта энергия второй ионизации указывает на степень сложности удаления второго атома.
Таким образом, существует также энергия третьей ионизации, а иногда даже энергия четвертой или пятой ионизации.
Стандартный потенциал
Стандартный потенциал означает потенциал окислительно-восстановительной реакции, когда он находится в равновесии, по отношению к нулю.

 В главных подгруппах периодической системы с увеличением заряда ядра атомов химических элементов происходит:
В главных подгруппах периодической системы с увеличением заряда ядра атомов химических элементов происходит: В ряду химических элементов Be, Mg, Ca, Sr
В ряду химических элементов Be, Mg, Ca, Sr В ряду химических элементов As, P, N
В ряду химических элементов As, P, N В ряду гидроксидов NaOH, Ca(OH)2, Al(OH)3
В ряду гидроксидов NaOH, Ca(OH)2, Al(OH)3 Сверху вниз в главных подгруппах неметаллические свойства элементов
Сверху вниз в главных подгруппах неметаллические свойства элементов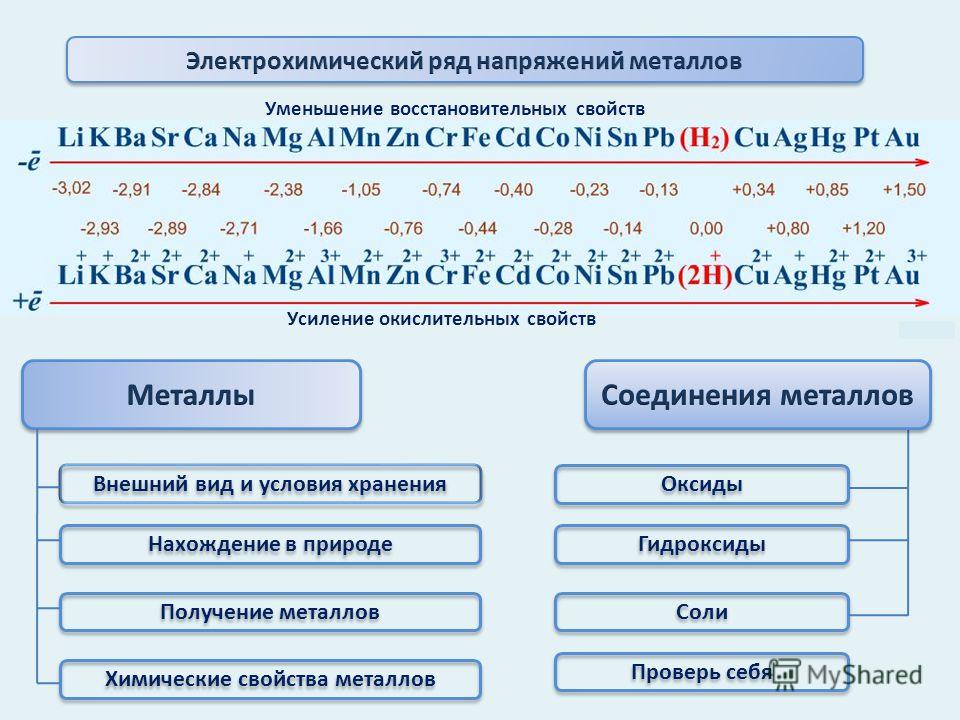 Расположите химические элементы в порядке уменьшения металлических
Расположите химические элементы в порядке уменьшения металлических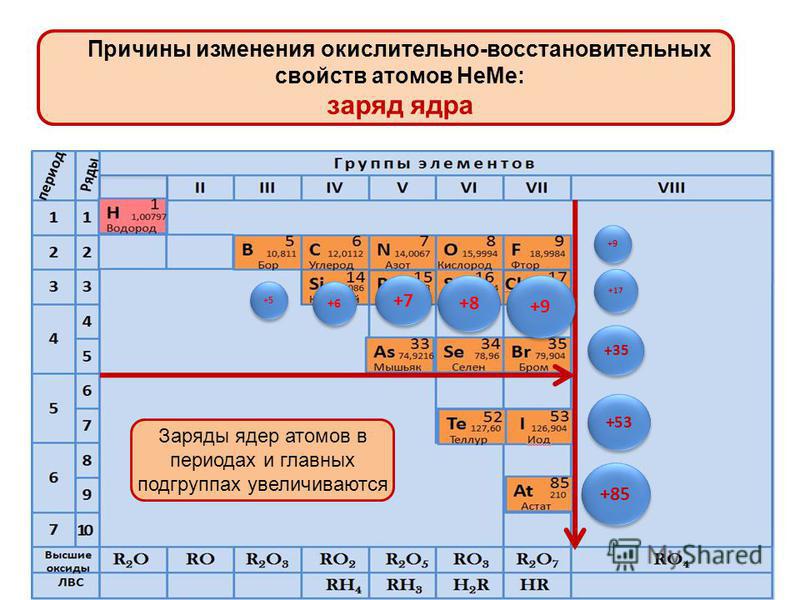 Наиболее ярко выражены неметаллические свойства у атома:
Наиболее ярко выражены неметаллические свойства у атома: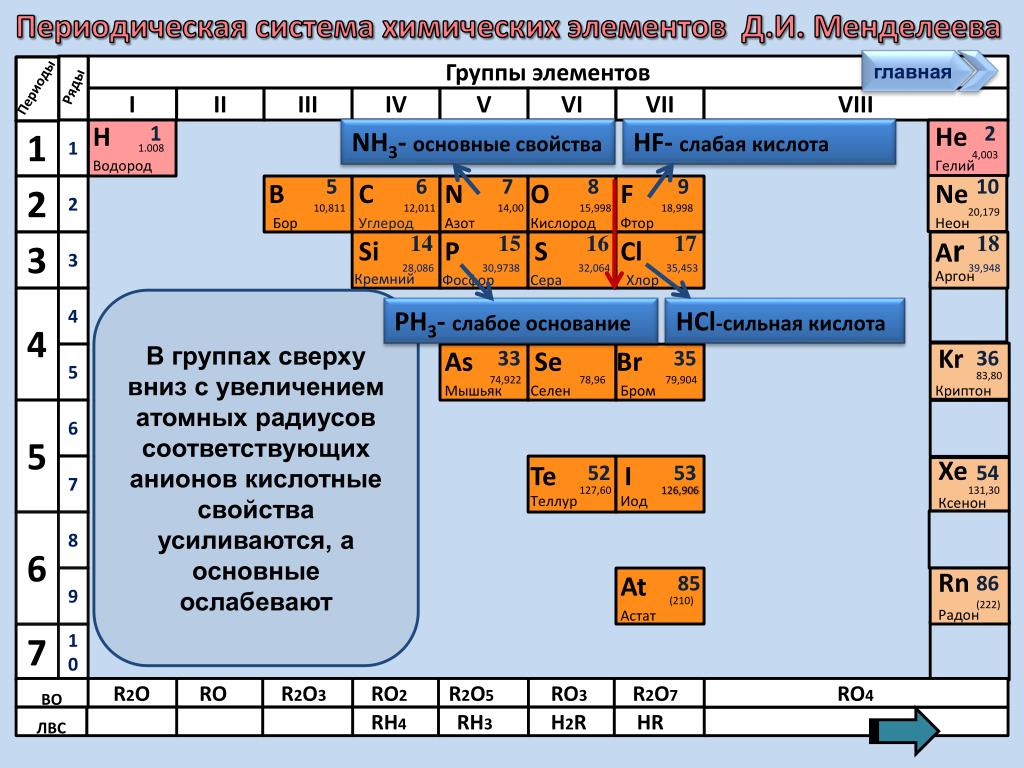 Радиус атома в ряду Br ─ Se ─ As
Радиус атома в ряду Br ─ Se ─ As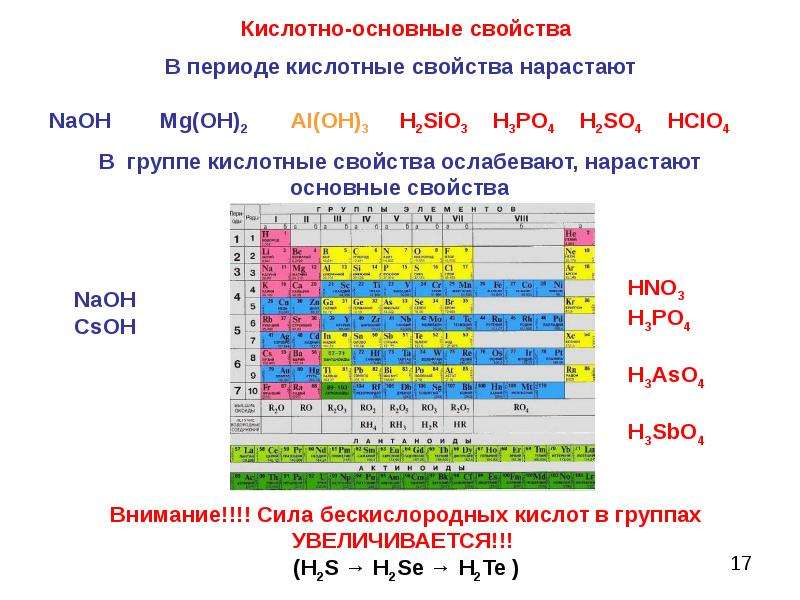 Металлоиды имеют металлический характер, но эта группа элементов также имеет неметаллические свойства.
Металлоиды имеют металлический характер, но эта группа элементов также имеет неметаллические свойства.
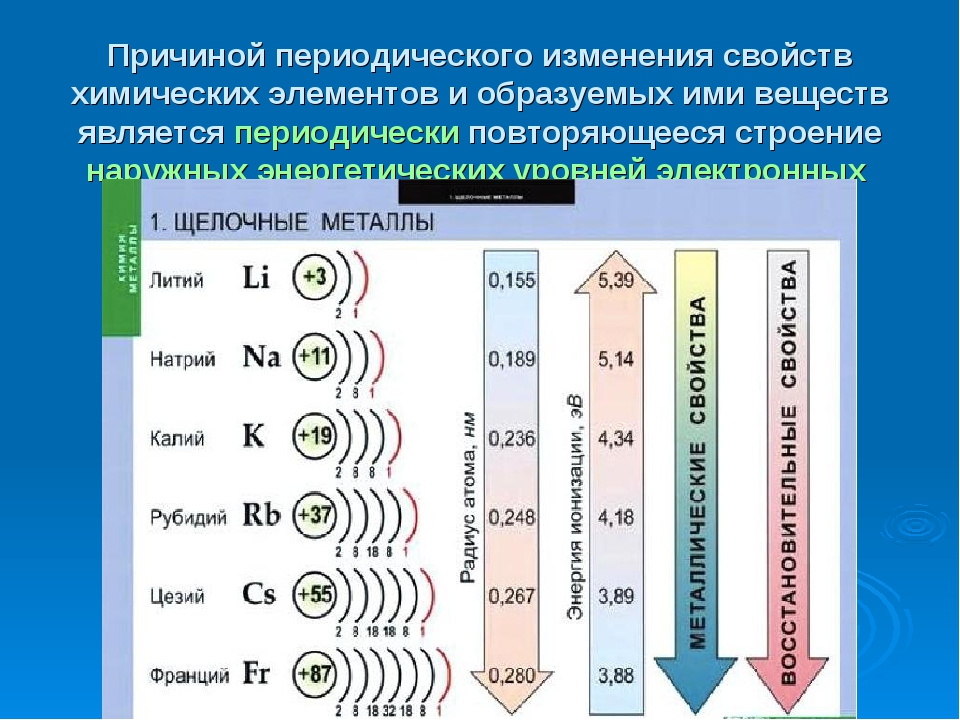

 Поскольку они не реагируют, они не подвержены коррозии. Это делает их идеальными для украшений и монет. Благородные металлы включают медь, палладий, серебро, платину и золото.
Поскольку они не реагируют, они не подвержены коррозии. Это делает их идеальными для украшений и монет. Благородные металлы включают медь, палладий, серебро, платину и золото.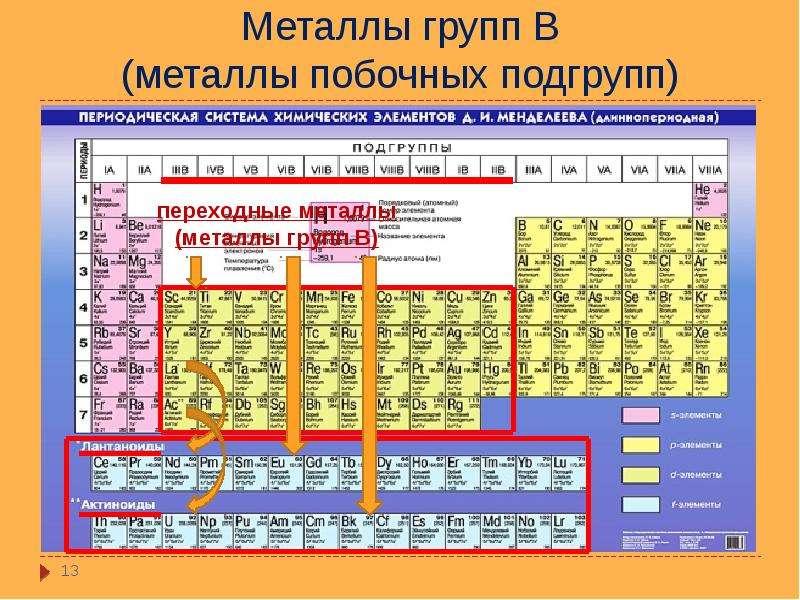 Однако они становятся очень полезными при добавлении к другим веществам. Бедные металлы включают алюминий, галлий, олово, таллий, сурьму и висмут.
Однако они становятся очень полезными при добавлении к другим веществам. Бедные металлы включают алюминий, галлий, олово, таллий, сурьму и висмут.