Медь — химические свойства » HimEge.ru
Место меди в Периодической системе химических элементов Д.И. Менделеева
Медь расположена в 11 группе Периодической системы химических элементов Д.И. Менделеева . В четвертом периоде медь является предпоследним d-элементом, её валентные электроны 3 d 9 4 s 2 , однако вследствие устойчивости d 10 -состояния энергетическим более выгодным оказывается переход одного d-электрона на 4s-подуровень, поэтому валентные электроны меди имеют следующую конфигурацию:
 В соединениях для меди характерная степень окисления +2, возможно проявление степеней окисления +1 и +3.
В соединениях для меди характерная степень окисления +2, возможно проявление степеней окисления +1 и +3.Физические свойства меди
Медь – пластичный, розовато-красный металл с металлическим блеском. Обладает высокой тепло- и электропроводностью, по значению электропроводности уступает только серебру. Температура плавления 1083°С, температура кипения 2567°С, плотность 8,92 г/см
На воздухе медь покрывается плотной зелено-серой пленкой основного карбоната, которая защищает её от дальнейшего окисления.
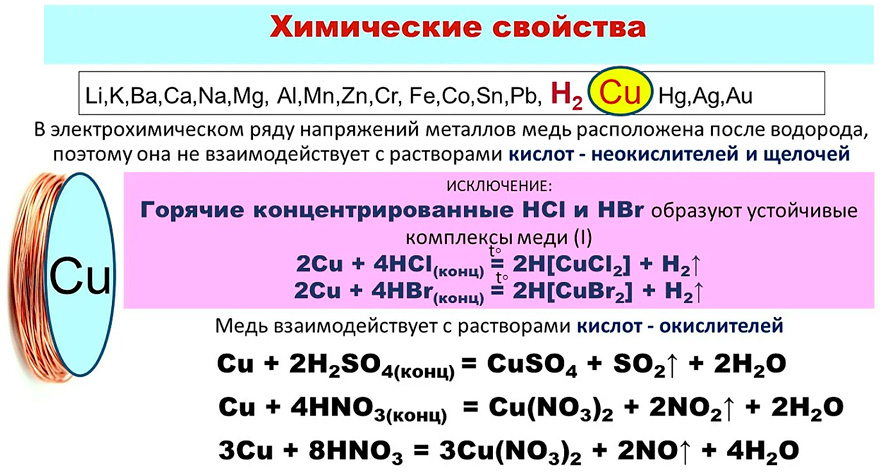
Химические свойства меди
С кислородом в зависимости от температуры взаимодействия медь образует два оксида:
2Cu + O 2 = 2CuO (черный цвет)
При температуре около 150 о С металл покрывается темно-красной пленкой оксида меди (I):
При нагревании с фтором, хлором, бромом образуются галогениды меди (II):
Cu + Br 2 = CuBr 2 ;
с йодом – образуется йодид меди (I):
2Cu + I 2 = 2CuI.
Cu + S = CuS
4Cu + SO 2 = Cu 2 S + 2CuO
4Cu + 2NO 2 = 4CuO + N 2
Взаимодействие с кислотами
В электрохимическом ряду напряжений металлов медь расположена после водорода, поэтому она не взаимодействует с растворами разбавленной соляной и серной кислот и щелочей.
Растворяется в разбавленной азотной кислоте с образованием нитрата меди (II) и оксида азота (II):
3Cu + 8HNO 3 = 3Cu(NO 3 ) 2 + 2NO + 4H 2 O.
Реагирует с концентрированными растворами серной и азотной кислот с образованием солей меди (II) и продуктов восстановления кислот:
Cu + 2H 2
Cu + 4HNO 3 = Cu(NO 3 ) 2 + 2NO 2 + 2H 2 O.
С концентрированной соляной кислотой медь реагирует с образованием трихлорокупрата (II) водорода:
Cu + 3HCl = H[CuCl 3 ] + H 2
Чтобы понять, с чем реагирует медь, нужно провести химические реакции в лабораторных условиях
Медь является одним из наиболее популярных представителей группы цветных металлов, используемых в промышленности. В таблице Менделеева элемент имеет порядковый номер 29 и обозначается как Cu.
В таблице Менделеева элемент имеет порядковый номер 29 и обозначается как Cu.
Физические свойства
Данный металл имеет следующие физические характеристики, отличающие его от других элементов:
- Цвет – ярко-рыжий, с розоватым оттенком. При обнаружении медной руды можно принять ее за ржавый предмет.
- При механической обработке или переплавке обладает характерным блеском.
- Характеризуется повышенной пластичностью, легко поддается обработке, штамповке и вытягиванию в проволоку.
- Имеет один из самых высоких показателей электропроводности, что позволяет широко использовать металл при изготовлении проводов.
- Плотность 8920 кг/м3, что почти на 1000 кг больше промышленной стали.
- Начинает плавиться при температуре свыше 1100оС, а закипает при достижении 2500оС.
- При контакте с атмосферным воздухом длительное время начинает покрываться характерной пленкой с зеленым оттенком.
Таким образом, металл имеет свойство самостоятельно противостоять окислению, и изделия из меди пользуются повышенным спросом во многих отраслях промышленности.
Химические реакции с участием меди
В металлургической индустрии медь используется в различных соединениях, вступая в реакцию с другими веществами, что способствует улучшению ее эксплуатационных качеств:
- Оксидные соединения данного металла получаются на основе 2 базовых реакций:
- 2Cu + O2 = 2CuO.
- 4Cu + O2 = 2Cu2O – реакция проходит при нагревании Cu до 140оС и выше.
- Сульфиды меди выделяются при соединении элемента с серой
2Cu + S = Cu2S, активность соединения наступает при повышении температуры.
- Чтобы понять, с чем реагирует медь, необходимо провести реакции с галогенами, например, с бромом, фтором или хлором:
- Cu + Br2 = CuBr2;
- Cu + F2 = CuF2;
- Cu + Cl2 = CuCl2; –
из этих примеров видно, что общая формула реакции выглядит как Cu + Hal2 = CuHal2.
- Данный металл хорошо реагирует с некоторыми концентрированными или разбавленными кислотами, образуя соли, летучие газы и воду:
- с азотной кислотой – 3Cu + 8HNO3 = 3Cu(NO3)2 + 2NO + 4h3O;
- с дигидрогенсульфатом – Cu + 2h3SO4 = CuSO4 + SO2 + 2h3O;
- с хлороводородным соединением – Cu + 3HCl = H(CuCl3) + h3.

- При спекании меди с оксидами таких же или других металлов получаются кислородные соединения, обладающие иными свойствами и валентностью:
- с бинарной связью меди и кислорода – Cu + CuO = Cu2O;
- с оксидом железа – Cu + Fe2O3 = 2FeO + CuO.
- При взаимодействии с солями других металлов медь позволяет выделить чистый элемент из жидкого раствора:
- с нитратом серебра – Cu + 2AgNO3 = Cu(NO3)2 + 2Ag, где чистое серебро выпадает в осадок;
- с сульфатом железа – Cu + Fe2(SO4)3 = CuSO4 + 2FeSO4.
Медь также подвергается коррозии под воздействием воды, углекислого газа и кислорода, содержащихся в атмосфере: 2Cu + h3O + CO2 + O2 = (CuOH)2CO3, и данное вещество образует упомянутую выше карбонатную пленку с зелено-серым оттенком.
Медь и ее производные используются во многих отраслях промышленности – при производстве проводов, труб, фитингов, деталей для бытового, медицинского и другого оборудования. Кроме того, данный элемент применяется как катализатор многих химических реакций с целью получения ценных материалов и веществ для смежных индустрий.
Кроме того, данный элемент применяется как катализатор многих химических реакций с целью получения ценных материалов и веществ для смежных индустрий.
Последовательность химических реакций
Превращение меди: последовательность химических реакций- Цели
- Реакции
- Процедура
Цели
- Укажите разнообразие веществ, частью которых может быть элемент:
металл —> синий раствор —> синее твердое вещество —> черное твердое вещество —> синий раствор (снова) —> металл (снова).
- Сохранение массы и кротов:
- Мы должны добыть столько меди, сколько начали.
- Одинаковое количество меди на каждой стадии: одинаковое количество молей.
- Опыт работы со стандартными химическими методами: фильтрация и количественные переносы.
Реакции
Cu(тв) —> [Cu(H 2 O) 6 ] 2+ (водн.) —> Cu(OH) 2 (тв) —> CuO(тв) —> [Cu(H 2 O) 6 ] 2+ (водный) —> Cu(s)- Металлическая медь «растворяется» в азотной кислоте (HNO 3 ).
 Фактически ион нитрата окисляет металлическую медь до иона меди (II), в то время как сам превращается в газ NO 2 в процессе; затем ион меди (II) связывается с шестью молекулами воды. Физическое изменение, которое вы должны наблюдать, заключается в исчезновении металла медного цвета по мере того, как раствор становится синим (от [Cu(H 2 O) 6 ] 2+ , иона гексааквамеди) и коричневого газа (NO 2 ) развивается.
Фактически ион нитрата окисляет металлическую медь до иона меди (II), в то время как сам превращается в газ NO 2 в процессе; затем ион меди (II) связывается с шестью молекулами воды. Физическое изменение, которое вы должны наблюдать, заключается в исчезновении металла медного цвета по мере того, как раствор становится синим (от [Cu(H 2 O) 6 ] 2+ , иона гексааквамеди) и коричневого газа (NO 2 ) развивается.Cu (т) + 4 H 3 O + (водн.) + 2 NO 3 — (водн.) —> [Cu(H 2 O) 6 ] + 2 5 (водн.) + 2 NO 2 (г)
- Ион гидроксида (ОН — ) связывается с ионом меди (II) даже сильнее, чем вода. В результате ион гидроксида может вытеснять воду из иона меди (II), образуя гидроксид меди, Cu(OH) 2 , синий осадок.
[Cu(H 2 O) 6 ] 2+ (водн.
 ) + 2 OH — —> Cu(OH) 2 (т) + 6 H 2 O (ж)
) + 2 OH — —> Cu(OH) 2 (т) + 6 H 2 O (ж) - При нагревании гидроксида меди образуется оксид меди, CuO, a черный твердый.
Cu(OH) 2 (т) —> CuO (т) + H 2 O (ж)
- Оксид меди растворяется в кислоте, регенерируя ион меди (II), который снова связывается с вода.
CuO (т) + 2 H 3 O + (водн.) + 3 H 2 O (ж) —> [Cu(H 2 O) 6 ] 2+ (водн.)
- Наконец, металлический цинк восстанавливает гидратированный ион меди (II) обратно в металлическую медь, в то время как сам окисляется до ионов цинка (II). Мы видели эту реакцию раньше в лаборатории хлорида меди).
[Cu(H 2 O) 6 ] 2+ (водн.) + Zn (тв.) —> Cu (тв.) + Zn 2+ (водн.) + 6 H 2 O ( тел.)
В то же время часть металлического цинка, находящегося в избытке, восстанавливает ионы гидроксония до H 2 .
Zn (тв) + 2 H 3 O + (водн.) —> Zn 2+ (водн.) + H 2 (г) + 2 H 2 O (л)
- 4
- 4
- 4
- 4
Процедура
Я не буду подробно описывать процедуру шаг за шагом, но подчеркну некоторые аспекты безопасности и (выделено жирным шрифтом ) некоторые места, где наша процедура отличается от процедуры в лабораторном пакете.- Преобразование Cu(s) в [Cu(H 2 O) 6 ] 2+ (водный)
- Возьмите кусок медной проволоки и взвесьте его с точностью до 0,01 г . Кусочки проволоки ближе к 0,50 г, чем к 0,35 г. Это нормально: используйте детали, которые мы предоставляем.
- Используйте около 4-5 мл концентрированного раствора HNO 3 .
- Будьте осторожны с азотной кислотой: как и другие сильные кислоты, она вызывает жжение при попадании на кожу и может повредить одежду; в отличие от большинства других кислот, он также окрашивает пораженный участок в желтый цвет.

- Если некоторое количество меди останется нерастворенным к моменту окончания производства газа, то поставьте химический стакан на горячие плиты в вытяжных шкафах, чтобы ускорить реакцию.
- Важно выполнять этот шаг в вытяжном шкафу, поскольку коричневый газ NO 2 является раздражителем. Держите смеси в вытяжном шкафу до тех пор, пока не добавите 10 мл дистиллированной воды после полного растворения меди.
- Преобразование [Cu(H 2 O) 6 ] 2+ (водн.) в Cu(OH) 2 (s)
- Будьте осторожны при обращении с NaOH, так как это сильное основание, которое вызывает жжение при контакте с кожей. Добавьте по каплям раствор NaOH к раствору меди.
- После образования синего осадка периодически проверяйте кислотность раствора, погружая палочку для перемешивания в раствор и касаясь ею красной лакмусовой бумажки. Старайтесь не переносить синий осадок на лакмусовую бумагу: это приведет к некоторой потере меди и, возможно, к ложному синему цвету на лакмусовой бумаге.
 Сначала раствор становится кислым из-за избытка азотной кислоты на предыдущем этапе, поэтому первый добавленный ОН- идет на нейтрализацию кислоты; как только кислота нейтрализуется, следующий OH 9Добавление 0034 — идет на образование голубого осадка Cu(OH) 2 . Только после этого добавленные OH — будут болтаться без дела, и только в это время красная лакмусовая бумажка станет синей. Мы хотим убедиться, что вся присутствующая медь превратилась в Cu(OH) 2 , поэтому мы добавляем OH — до тех пор, пока раствор не окрасит лакмусовую бумажку в синий цвет.
Сначала раствор становится кислым из-за избытка азотной кислоты на предыдущем этапе, поэтому первый добавленный ОН- идет на нейтрализацию кислоты; как только кислота нейтрализуется, следующий OH 9Добавление 0034 — идет на образование голубого осадка Cu(OH) 2 . Только после этого добавленные OH — будут болтаться без дела, и только в это время красная лакмусовая бумажка станет синей. Мы хотим убедиться, что вся присутствующая медь превратилась в Cu(OH) 2 , поэтому мы добавляем OH — до тех пор, пока раствор не окрасит лакмусовую бумажку в синий цвет.
- Преобразование Cu(OH) 2 (т) в CuO(т)
- Добавить воду в реакционную смесь, полученную на предыдущем этапе, и добавьте также один или два кипящих камня .
- Содержимое стакана нагреть, но не кипятить . Кипячение делает черный CuO настолько мелким, что этап фильтрации становится чрезмерно долгим. Нагревайте химический стакан, пока весь синий Cu(OH) 2 не исчезнет и не заменится черным CuO.

- Отфильтровать и промыть CuO, как описано в процедуре (часть C). Держите твердое вещество на фильтровальной бумаге, а фильтрат выбросьте.
- Преобразование CuO(s) обратно в [Cu(H 2 O) 6 ] 2+ (водный)
- Растворите CuO на фильтровальной бумаге, как описано в процедуре (часть D).
- Раствор серной кислоты вызывает коррозию и вызывает жжение кожи при контакте с ней.
- Преобразование [Cu(H 2 O) 6 ] 2+ (водный) обратно в Cu(s)
- Добавьте около 1 г Zn к синему раствору, полученному на предыдущем шаге, и после того, как раствор полностью потеряет свой синий цвет, вам может понадобиться добавить немного серной кислоты, чтобы прореагировать избыток Zn.
- Металлическую медь трижды промыть дистиллированной водой и перенести в чашку для выпаривания, как описано в процедуре (часть Е), а затем трижды промыть изопропанолом порциями по 5 мл.
 Промывка изопропанолом сократит время, необходимое для этапа сушки.
Промывка изопропанолом сократит время, необходимое для этапа сушки. - Высушите медь над стаканом с кипящей водой, как описано в процедуре (Е). Взвесьте сухую медь и запишите массу. Вычислите процент восстановленной меди.
Реагирует ли медь с кислотой?
Медь — очень ценный химический элемент с символом «Cu». он классифицируется как металл, который существует в природе в металлической форме, пригодной для непосредственного использования. У многих студентов возникает вопрос о том, реагирует ли медь с кислотой или нет. В этой статье я подробно отвечу на этот вопрос, а также затрону окружающие темы.
Итак, реагирует ли медь с кислотой? Нет, медь не реагирует с неокисляющими кислотами, такими как разбавленная серная кислота, гидрохлорид, гидробромид и т. д., поскольку ее восстановительный потенциал выше, чем у водорода. Следовательно, в ряду реакционной способности металла медь находится ниже водорода. Медь в чистом виде не может вытеснять атомы водорода из кислоты. Но медь легко реагирует с кислотами-окислителями, такими как концентрированная и горячая серная кислота, азотная кислота.
Но медь легко реагирует с кислотами-окислителями, такими как концентрированная и горячая серная кислота, азотная кислота.
Медь имеет латинское название Cuprum и ее атомный номер 29. Этот металл не вступает в реакцию с другими соединениями. Атом меди имеет один-единственный электрон на своей вакантной оболочке. Электронная конфигурация этого металла 3d10 4s1.
Все кислоты содержат атомы водорода, и они получают депротонат, когда реагируют с каким-либо металлом. Сильная кислота депротонируется легче, чем слабая. Депротонирование кислоты происходит, когда атомы металла замещают атомы водорода. По сути, это замещающая окислительно-восстановительная реакция.
Следует отметить, что металлы, стоящие выше водорода в ряду реакционной способности, могут замещать атомы водорода. Поэтому в случае меди она не реагирует с кислотой, так как медь находится ниже водорода в ряду электрохимической активности.
Восстановительный потенциал меди выше, чем у водорода. Стандартный восстановительный потенциал определяется по отношению к потенциалу восстановления водорода как 0 В. А восстановительный потенциал меди оказывается положительным (больше, чем у водорода).
Стандартный восстановительный потенциал определяется по отношению к потенциалу восстановления водорода как 0 В. А восстановительный потенциал меди оказывается положительным (больше, чем у водорода).
Стандартный восстановительный потенциал является мерой сродства к электронам/водороду при стандартных внешних условиях. Чем больше восстановительный потенциал химического элемента, тем больше сродство к электрону.
Положительный восстановительный потенциал меди означает, что она восстанавливается быстрее, чем водород. Другими словами, медь отдает электроны медленнее, чем водород.
Стандартный восстановительный потенциал элемента определяется при следующих внешних условиях::
- Температура должна быть 25 градусов Цельсия.
- Металлы должны присутствовать в чистом виде.
- Парциальное давление должно быть 1 атм для всех газов, участвующих в реакции.
- Концентрация каждого иона, участвующего в реакции, должна составлять 1М.
Тип реакции меди и азотной кислоты
youtube.com/embed/pJSQq494oV4″ frameborder=»0″ allowfullscreen=»allowfullscreen»>Медь, будучи нереакционноспособным металлом, не реагирует с кислотами при нормальных условиях. Но в случае с азотной кислотой (HNO3) медь реагирует с азотной кислотой, так как она является сильным окислителем и реакция не такая простая, как металл + кислота.
Медь растворяется в азотной кислоте, и на катодной части происходит восстановление азотной кислоты с образованием газа NO. И потенциал этой полуреакции больше, чем потенциал окисления полуреакции меди с образованием ионов Cu2+.
В этой реакции выделяются газы NO, NO2. Это зависит от концентрации азотной кислоты. Ниже приведена реакция взаимодействия металлической меди с азотной кислотой в разбавленном и концентрированном виде.
Разбавленная азотная кислота
8HNO3 +3CU ——–> 3CU (NO3) 2 +4H3O +2NO (G) (оксид азота)
Концентрированная азотная кислота
4HNO3 (aq) +cu (s) — — -> cu (no3) (s) + 2h3O(l) + 2NO2(g) (двуокись азота)
Реагирует ли медь с серной кислотой?
youtube.com/embed/arlYPz3EP7A» frameborder=»0″ allowfullscreen=»allowfullscreen»>Медь не реагирует с разбавленной серной кислотой из-за ее положительного восстановительного потенциала. Он не может заменить атомы водорода в разбавленной серной кислоте.
Но если серная кислота горячая и концентрированная, то она может подвергнуться восстановлению. В концентрированном виде h3SO4 является окислителем меди. Поэтому, если концентрированную серную кислоту нагревают с металлической медью, кислота подвергается восстановлению и приводит к окислительно-восстановительной реакции.
Реакция, в которой происходит окислительно-восстановительный процесс и степень окисления атома, иона или молекулы изменяется путем переноса электронов, известна как окислительно-восстановительная реакция.
В реакции между концентрированной серной кислотой и металлической медью выделяется газообразный диоксид серы, оставляя после себя сульфат меди(ii) и воду в виде остатка.
Вот реакция
Cu + 2h3SO4 (конц. ) —–тепло-> CuSO4 + SO2(g) + 2h3O
) —–тепло-> CuSO4 + SO2(g) + 2h3O
Реагирует ли медь с водой?
Как теперь выяснилось, медь не легко реагирует с кислотой и, следовательно, нет никаких шансов, что медь прореагирует и с водой.
Хотя медь не реагирует с водой, она медленно реагирует с кислородом, присутствующим в атмосфере, и образует на своей поверхности коричнево-черный слой оксида меди.
Этот слой не следует путать со слоем ржавчины, как в железе. Коричнево-черный слой оксида меди действует как щит, защищающий медь от дальнейшей коррозии.
Должно быть ясно, что медь не вступает в реакцию ни с горячей, ни с холодной водой.
Физические свойства меди
- Медь существует в мягком состоянии
- Он податлив и пластичен по своей природе.
- На воздухе чистая медь имеет оранжево-розоватую окраску.
- Является хорошим проводником тепла и электричества.
- Температура плавления меди составляет около 1083,4 +/- 0,2 градуса Цельсия.

- Температура кипения меди 2567 градусов Цельсия.
- Плотность этого металла 8,96 г/куб.см.
Химические свойства меди
- Металлическая медь не вступает в реакцию с водой.
- Не подвержен коррозии. При воздействии воздуха он медленно корродирует по сравнению с другими металлами.
- Соединения меди при горении дают зеленоватое пламя.
- В некоторых соединениях медь имеет степень окисления +1, а в некоторых — +2.
- Водный раствор меди со степенью окисления +1 бесцветен, со степенью окисления +2 имеет голубоватый цвет.
Использование меди
- Металлическая медь используется для изготовления сплавов. Бронза и латунь — несколько примеров сплавов, изготовленных из меди.
- Металлическая медь широко используется в электротехнической промышленности.
- Медь используется в производстве посуды, поскольку она может уменьшить воспаление в желудке и убить бактерии.



 Фактически ион нитрата окисляет металлическую медь до иона меди (II), в то время как сам превращается в газ NO 2 в процессе; затем ион меди (II) связывается с шестью молекулами воды. Физическое изменение, которое вы должны наблюдать, заключается в исчезновении металла медного цвета по мере того, как раствор становится синим (от [Cu(H 2 O) 6 ] 2+ , иона гексааквамеди) и коричневого газа (NO 2 ) развивается.
Фактически ион нитрата окисляет металлическую медь до иона меди (II), в то время как сам превращается в газ NO 2 в процессе; затем ион меди (II) связывается с шестью молекулами воды. Физическое изменение, которое вы должны наблюдать, заключается в исчезновении металла медного цвета по мере того, как раствор становится синим (от [Cu(H 2 O) 6 ] 2+ , иона гексааквамеди) и коричневого газа (NO 2 ) развивается. ) + 2 OH — —> Cu(OH) 2 (т) + 6 H 2 O (ж)
) + 2 OH — —> Cu(OH) 2 (т) + 6 H 2 O (ж)

 Сначала раствор становится кислым из-за избытка азотной кислоты на предыдущем этапе, поэтому первый добавленный ОН- идет на нейтрализацию кислоты; как только кислота нейтрализуется, следующий OH 9Добавление 0034 — идет на образование голубого осадка Cu(OH) 2 . Только после этого добавленные OH — будут болтаться без дела, и только в это время красная лакмусовая бумажка станет синей. Мы хотим убедиться, что вся присутствующая медь превратилась в Cu(OH) 2 , поэтому мы добавляем OH — до тех пор, пока раствор не окрасит лакмусовую бумажку в синий цвет.
Сначала раствор становится кислым из-за избытка азотной кислоты на предыдущем этапе, поэтому первый добавленный ОН- идет на нейтрализацию кислоты; как только кислота нейтрализуется, следующий OH 9Добавление 0034 — идет на образование голубого осадка Cu(OH) 2 . Только после этого добавленные OH — будут болтаться без дела, и только в это время красная лакмусовая бумажка станет синей. Мы хотим убедиться, что вся присутствующая медь превратилась в Cu(OH) 2 , поэтому мы добавляем OH — до тех пор, пока раствор не окрасит лакмусовую бумажку в синий цвет.
 Промывка изопропанолом сократит время, необходимое для этапа сушки.
Промывка изопропанолом сократит время, необходимое для этапа сушки.