это тело или вещество? Свойства меди
Приблизительно III тысячелетие до нашей эры считается переходным от камня как основного промышленного вещества к бронзе. Период перестройки принято считать медным веком. Ведь именно это соединение на тот период времени было самым главным в строительстве, в изготовлении предметов быта, посуды и прочих процессах.
На сегодняшний день медь своей актуальности не потеряла и по-прежнему считается очень важным металлом, часто используемым в разных нуждах. Медь — это тело или вещество? Какими свойствами она обладает и для чего нужна? Попробуем разобраться далее.
Общая характеристика элемента медь
Как химический элемент, медь имеет свое местоположение в периодической системе. Оно следующее.
- Четвертый большой период, первый ряд.
- Первая группа, побочная подгруппа.
- Порядковый номер 29.
- Атомный вес — 63,546.
- Электронная конфигурация внешнего слоя выражается формулой 3d104s1.

Элемент имеет два стабильных природных изотопа с массовыми числами 63 и 65. Латинское название элемента cuprum, что объясняет его химический символ Cu. В формулах читается как «купрум», русское наименование — медь.
Медь — это тело или вещество?
Чтобы ответить на данный вопрос, следует для начала определиться с понятиями «вещество» и «тело». Они изучаются еще на школьных ступенях, так как являются основополагающими. С точки зрения науки химии и физики, веществом считаются все материалы, из которых изготавливаются те или иные предметы. То есть примерами веществ могут служить все химические соединения как органической, так и неорганической природы.
Тело — это сам предмет, который состоит как раз из какого-то вещества. Они могут быть искусственно сконструированы человеком, либо же иметь природное происхождение. Примеры тел: гвозди, окна, пластинки, стол, шкаф, цветочный горшок и прочее.
Чтобы различить эти два понятия, приведем несколько сравнительных примеров.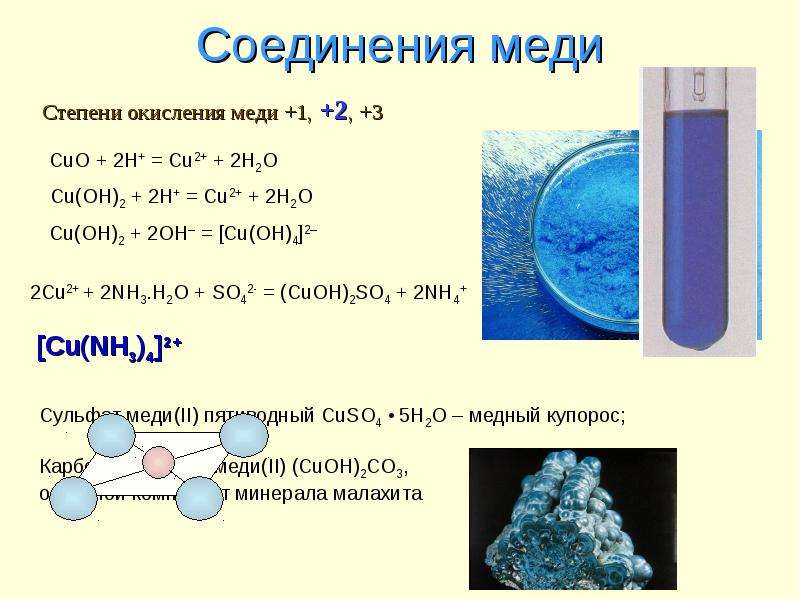
- Сахар — вещество, леденец на палочке — тело.
- Железо — вещество, гвоздь — тело.
- Окно — тело, стекло — вещество.
Очевидно из этих рассуждений, что на вопрос: «Медь — это тело или вещество?» — ответ однозначен. Это вещество. Вот если речь пойдет о медной пластинке или медном колечке, тогда, безусловно, следует говорить о них как о теле.
С точки зрения химии, медь — это вещество, относящееся к категории металлов. Оно обладает рядом очень ценных свойств, которые лежат в основе широкого использования данного соединения.
Простое вещество медь — это цветной металл
Как мы уже обозначили, медь — металл. Однако не все представители этой группы веществ одинаковы по своим характеристикам. Существуют мягкие и твердые, белые и желтые, красные металлы и прочее. Медь же относится к цветным мягким металлам.
Электронное строение ее атома позволяет точно определить, медь — это металл или неметалл. Ведь на внешнем уровне у нее всего один электрон, это значит, что его она способна легко отдавать, проявляя типичные металлические восстановительные свойства. Следовательно, в том, что она должна относиться к категории именно металлов, сомнений быть не может. Об этом же говорят и физические свойства ее простого вещества.
Следовательно, в том, что она должна относиться к категории именно металлов, сомнений быть не может. Об этом же говорят и физические свойства ее простого вещества.
Физические свойства
Медь — это вещество или тело? Полностью убедиться в правильности ответа можно лишь рассмотрев ее физические свойства. Если мы говорим о данном элементе как о простом веществе, то для него характерен следующий набор свойств.
- Металл красного цвета.
- Мягкий и очень ковкий.
- Отличный теплопроводник и электропроводник.
- Не тугоплавкий, температура плавления составляет 1084,5 0С.
- Плотность составляет 8,9 г/см3.
- В природе встречается в основном в самородном виде.
Таким образом, получается, что медь — это вещество, причем известное с самой древности. На основе нее издревле создаются многие архитектурные сооружения, изготовляется посуда и предметы быта.
Химические свойства
С точки зрения химической активности, медь — это тело или вещество, обладающее низкой способностью к взаимодействию. Существует две основные степени окисления этого элемента, которые он проявляет в соединениях. Это:
Существует две основные степени окисления этого элемента, которые он проявляет в соединениях. Это:
Очень редко можно встретить вещества, в которых данные значения заменяются на +3.
Итак, медь может взаимодействовать с:
- воздухом;
- углекислым газом;
- соляной кислотой и некоторыми другими соединениями только при очень высоких температурах.
Все это объясняется тем, что на поверхности металла формируется защитная оксидная пленка. Именно она предохраняет его от дальнейшего окисления и придает стабильность и малоактивность.
Из простых веществ медь способна взаимодействовать с:
- галогенами;
- селеном;
- цианидами;
- серой.
Часто формирует комплексные соединения либо двойные соли. Практически все сложные соединения данного элемента, кроме оксидов — ядовитые вещества. Те молекулы, которые образует одновалентная медь, легко окисляются до двувалентных представителей.
Области применения
Медь — это смесь или чистое вещество, которое в любом из этих состояний находит широкое применение в промышленности и быту. Можно обозначить несколько основных отраслей использования соединений меди и чистого металла.
Можно обозначить несколько основных отраслей использования соединений меди и чистого металла.
- Кожевенная промышленность, в которой используются некоторые соли.
- Производство меха и шелка.
- Изготовление удобрений, средств защиты растений от вредителей (медный купорос).
- Сплавы меди находят широкое применение в автомобилестроении.
- Судостроение, авиаконструкции.
- Электротехника, в которой медь используется, благодаря хорошей антикоррозионной устойчивости и высокой электро- и теплопроводности.
- Различное приборостроение.
- Изготовление посуды и бытовых предметов хозяйственного значения.
Очевидно, что несмотря на долгие сотни лет, рассматриваемый металл только укрепил свои позиции и доказал состоятельность и незаменимость в применении.
Сплавы меди и их свойства
Существует много сплавов на основе меди. Она сама отличается высокими техническими характеристиками, так как легко поддается ковке и прокатке, является легкой и достаточно прочной. Однако при добавлении определенных компонентов свойства значительно улучшаются.
Однако при добавлении определенных компонентов свойства значительно улучшаются.
В данном случае следует задать вопрос: «Медь — это вещество или физическое тело, когда речь идет о ее сплавах?» Ответ будет такой: это вещество. Все равно она является именно им до тех пор, пока из сплава не будет изготовлено какое-либо физическое тело, то есть определенный продукт.
Какие сплавы меди бывают?
- Практически равное сочетание меди и цинка в одном составе принято называть латунью. Этот сплав отличается высокой прочностью и устойчивостью к химическим воздействиям.
- Оловянистая бронза — сочетание меди и олова.
- Мельхиор — никель и медь в соотношении 20/80 из 100. Используется для изготовления украшений.
- Константан — сочетание никеля, меди и добавка марганца.
Биологическое значение
Не столь важно, медь — это вещество или тело. Значимо другое. Какую роль играет медь в жизни живых организмов? Оказывается, весьма немаловажную. Так, ионы рассматриваемого металла выполняют следующие функции.
- Участвуют в преобразовании ионов железа в гемоглобин.
- Являются активными участниками процессов роста и размножения.
- Позволяют усваиваться аминокислоте тирозину, следовательно влияют на проявление цвета волос, кожи.
Если организм недополучает данный элемент в нужном количестве, то могут возникать неприятные заболевания. Например, анемия, облысение, болезненная худоба и прочее.
Медь — Большая советская энциклопедия
(лат. Cuprum)
Cu, химический элемент I группы периодической системы Менделеева; атомный номер 29, атомная масса 63,546; мягкий, ковкий металл красного цвета. Природная М. состоит из смеси двух стабильных изотопов — 63Cu (69,1 % ) и 65Cu (30,9 % ).
Историческая справка. М. относится к числу металлов, известных с глубокой древности. Раннему знакомству человека с М. способствовало то, что она встречается в природе в свободном состоянии в виде самородков (см. Медь самородная), которые иногда достигают значительных размеров. М. и её сплавы сыграли большую роль в развитии материальной культуры (см. Бронзовый век). Благодаря лёгкой восстановимости окислов и карбонатов М. была, по-видимому, первым металлом, который человек научился восстановлять из кислородных соединений, содержащихся в рудах. Латинское название М. происходит от названия острова Кипр, где древние греки добывали медную руду. В древности для обработки скальной породы её нагревали на костре и быстро охлаждали, причём порода растрескивалась. Уже в этих условиях были возможны процессы восстановления. В дальнейшем восстановление вели в кострах с большим количеством угля и с вдуванием воздуха посредством труб и мехов. Костры окружали стенками, которые постепенно повышались, что привело к созданию шахтной печи. Позднее методы восстановления уступили место окислительной плавке сульфидных медных руд с получением промежуточных продуктов — штейна (сплава сульфидов), в котором концентрируется М., и шлака (сплава окислов).
М. и её сплавы сыграли большую роль в развитии материальной культуры (см. Бронзовый век). Благодаря лёгкой восстановимости окислов и карбонатов М. была, по-видимому, первым металлом, который человек научился восстановлять из кислородных соединений, содержащихся в рудах. Латинское название М. происходит от названия острова Кипр, где древние греки добывали медную руду. В древности для обработки скальной породы её нагревали на костре и быстро охлаждали, причём порода растрескивалась. Уже в этих условиях были возможны процессы восстановления. В дальнейшем восстановление вели в кострах с большим количеством угля и с вдуванием воздуха посредством труб и мехов. Костры окружали стенками, которые постепенно повышались, что привело к созданию шахтной печи. Позднее методы восстановления уступили место окислительной плавке сульфидных медных руд с получением промежуточных продуктов — штейна (сплава сульфидов), в котором концентрируется М., и шлака (сплава окислов).
Распространение в природе.
М. — важный элемент жизни, она участвует во многих физиологических процессах. Среднее содержание М. в живом веществе 2·10 малоподвижна; на участках месторождений М. наблюдается её избыток в почвах и растениях, отчего болеют домашние животные.
малоподвижна; на участках месторождений М. наблюдается её избыток в почвах и растениях, отчего болеют домашние животные.
В речной воде очень мало М., 1·10-7 %. Приносимая в океан со стоком М. сравнительно быстро переходит в
МЕДЬ | Энциклопедия Кругосвет
МЕДЬ – элемент 11 группы Периодической системы, плотность 8,9 г см–3, один из первых металлов, ставших известными человеку. Считают, что медь начали использовать около 5000 до н.э. В природе медь изредка встречается в виде металла. Из медных самородков, возможно, с помощью каменных топоров, были изготовлены первые металлические орудия труда. У индейцев, живших на его берегах оз. Верхнее (Сев. Америка), где есть очень чистая самородная медь, способы ее холодной обработки были известны до времен Колумба.
Около 3500 до н.э. на Ближнем Востоке медь научились извлекать из руд, ее получали восстановлением углем. Медные рудники были и в Древнем Египте.
К 3000 до н.э. в Индии, Месопотамии и Греции для выплавки более твердой бронзы в медь стали добавлять олово. Открытие бронзы могло произойти случайно, однако ее преимущества по сравнению с чистой медью быстро вывели этот сплав на первое место. Так начался «бронзовый век».
Изделия из бронзы были у ассирийцев, египтян, индусов и других народов древности. Однако цельные бронзовые статуи древние мастера научились отливать не раньше 5 в. до н.э. Около 290 до н.э. Харесом в честь бога солнца Гелиоса был создан Колосс Родосский. Он имел высоту 32 м и стоял над входом во внутреннюю гавань древнего порта острова Родоса в восточной части Эгейского моря. Гигантская бронзовая статуя была разрушена землетрясением в 223 н.э. (
Предки древних славян, жившие в бассейне Дона и в Приднепровье, применяли медь для изготовления оружия, украшений и предметов домашнего обихода. Русское слово «медь», по мнению некоторых исследователей, произошло от слова «мида», которое у древних племен, населявших Восточную Европу, обозначало металл вообще.
Русское слово «медь», по мнению некоторых исследователей, произошло от слова «мида», которое у древних племен, населявших Восточную Европу, обозначало металл вообще.
Символ Cu происходит от латинского aes cyproum (позднее, Cuprum), так как на Кипре (Cyprus) находились медные рудники древних римлян.
Относительное содержание меди в земной коре составляет 6,8·10–3%. Самородная медь встречается очень редко. Обычно элемент находится в виде сульфида, оксида или карбоната. Важнейшими рудами меди являются халькопирит CuFeS2, который, по оценкам, составляет около 50% всех месторождений этого элемента, медный блеск (халькоцит) Cu2S, куприт Cu2O и малахит Cu2CO3(OH)2. Большие месторождения медных руд найдены в различных частях Северной и Южной Америк, в Африке и на территории нашей страны. В 18–19 вв. близ Онежского озера добывали самородную медь, которую отправляли на монетный двор в Петербург. Открытие промышленных месторождений меди на Урале и в Сибири связано с именем Никиты Демидова.
Богатые месторождения меди давно выработаны. Сегодня почти весь металл добывается из низкосортных руд, содержащих не более 1% меди. Некоторые оксидные руды меди могут быть восстановлены непосредственно до металла нагреванием с коксом. Однако большая часть меди производится из железосодержащих сульфидных руд, что требует более сложной переработки. Эти руды сравнительно бедные, и экономический эффект при их эксплуатации может обеспечиваться лишь ростом масштабов добычи. Руду обычно добывают в огромных карьерах, где используются экскаваторы с ковшами до 25 м
2CuFeS2 + 5O2 + 2SiO2 = 2Cu + 2FeSiO3 + 4SO2
Cu+I + 1e– = Cu0 |
FeIII + 1e– = FeII | –10e–
2S–II – 12e– = 2SIV |
O2 + 4e– = 2O–II
Большую часть полученной черновой меди очищают электрохимическим методом, отливая из нее аноды, которые затем подвешивают в подкисленном растворе сульфата меди CuSO
Около 1/3 используемой меди представляет собой вторичную медь, выплавленную из лома. Годовое производство нового металла составляет около 8 млн. т. Лидируют по производству меди Чили (22%), США (20%), СНГ (9%), Канада (7,5%), Китай (7,5%) и Замбия (5%).
т. Лидируют по производству меди Чили (22%), США (20%), СНГ (9%), Канада (7,5%), Китай (7,5%) и Замбия (5%).
Главное применение металла – в качестве проводника электрического тока. Кроме того, медь используется в монетных сплавах, поэтому ее часто называют «монетным металлом». Она также входит в состав традиционных бронзы (сплавы меди с 7–10% олова) и латуни (сплав меди с цинком) и специальных сплавов, таких как монель (сплав никеля с медью). Металлообрабатывающий инструмент из медных сплавов не искрит и может использоваться во взрывоопасных цехах. Сплавы на основе меди служат для изготовления духовых инструментов и колоколов.
В виде простого вещества медь обладает характерной красноватой окраской. Медь металл мягкий и пластичный. По электро- и теплопроводности медь уступает только серебру. Металлическая медь, как и серебро, обладает антибактериальными свойствами.
Медь устойчива в чистом сухом воздухе при комнатной температуре, однако при температуре красного каления образует оксиды.
2Cu + 8NH3·H2O + O2 = 2[Cu(NH3)4](OH)2 + 6H2O
В соответствии с положением меди в Периодической системе, ее единственная устойчивая степень окисления должна быть (+I), но это не так. Медь способны принимать более высокие степени окисления, причем наиболее устойчивой, особенно в водных растворах, является степень окисления (+II). В биохимических реакциях переноса электрона, возможно, участвует медь(III). Эта степень окисления редко встречается и очень легко понижается под действием даже слабых восстановителей. Известно несколько соединений меди(+IV).
Известно несколько соединений меди(+IV).
При нагревании металла на воздухе или в кислороде образуются оксиды меди: желтый или красный Cu2O и черный CuO. Повышение температуры способствует образованию преимущественно оксида меди(I) Cu2O. В лаборатории этот оксид удобно получать восстановлением щелочного раствора соли меди(II) глюкозой, гидразином или гидроксиламином:
2CuSO4 + 2NH2OH + 4NaOH = Cu2O + N2 + 2Na2SO4 + 5H2O
Эта реакция – основа чувствительного теста Фелинга на сахара и другие восстановители. К испытываемому веществу добавляют раствор соли меди(II) в щелочном растворе. Если вещество является восстановителем, появляется характерный красный осадок.
Поскольку катион Cu+ в водном растворе неустойчив, при действии кислот на Cu2O происходит либо дисмутация, либо комплексообразование:
Cu2O + H2SO4 = Cu + CuSO4 + H2O
Cu2O + 4HCl = 2 H[CuCl2] + H2O
Оксид Cu2O заметно взаимодействует со щелочами. При этом образуется комплекс:
При этом образуется комплекс:
Cu2O + 2NaOH + H2O 2Na[Cu(OH)2]
Для получения оксида меди(II) CuO лучше всего использовать разложение нитрата или основного карбоната меди(II):
2Cu(NO3)2 = 2CuO + 4NO2 + O2
(CuOH)2CO3 = 2CuO + CO2 + H2O
Оксиды меди не растворимы в воде и не реагируют с ней. Единственный гидроксид меди Cu(OH)2 обычно получают добавлением щелочи к водному раствору соли меди(II). Бледно-голубой осадок гидроксида меди(II), проявляющий амфотерные свойства (способность химических соединений проявлять либо основные, либо кислотные свойства), можно растворить не только в кислотах, но и в концентрированных щелочах. При этом образуются темно-синие растворы, содержащие частицы типа [Cu(OH)4]2–. Гидроксид меди(II) растворяется также в растворе аммиака:
Cu(OH)2 + 4NH3. H2O = [Cu(NH3)4](OH)2 + 4H2O
H2O = [Cu(NH3)4](OH)2 + 4H2O
Гидроксид меди(II) термически неустойчив и при нагревании разлагается:
Cu(OH)2 = CuO + H2O
Есть сведения о существовании темно-красного оксида Cu2O3, образующегося при действии K2S2O8 на Cu(OH)2. Он является сильным окислителем, при нагревании до 400° С разлагается на CuO и О2.
Большой интерес к химии оксидов меди в последние два десятилетия связан с получением высокотемпературных сверхпроводников, из которых наиболее известен YBa2Cu3O7. В 1987 было показано, что при температуре жидкого азота это соединение является сверхпроводником. Главные проблемы, препятствующие его широкомасштабному практическому применению, лежат в области обработки материала. Сейчас наиболее перспективным считается изготовление тонких пленок.
Многие из халькогенидов меди – нестехиометрические соединения. Сульфид меди(I) Cu2S образуется при сильном нагревании меди в парах серы или в среде сероводорода. При пропускании сероводорода через водные растворы, содержащие катионы Cu2+, выделяется коллоидный осадок состава CuS. Однако, CuS – не простое соединение меди(II). Оно содержит группу S2 и лучше описывается формулой CuI2CuII(S2)S. Селениды и теллуриды меди проявляют металлические свойства, а CuSe2, CuTe2, CuS и CuS2 при низких температурах являются сверхпроводниками.
Сульфид меди(I) Cu2S образуется при сильном нагревании меди в парах серы или в среде сероводорода. При пропускании сероводорода через водные растворы, содержащие катионы Cu2+, выделяется коллоидный осадок состава CuS. Однако, CuS – не простое соединение меди(II). Оно содержит группу S2 и лучше описывается формулой CuI2CuII(S2)S. Селениды и теллуриды меди проявляют металлические свойства, а CuSe2, CuTe2, CuS и CuS2 при низких температурах являются сверхпроводниками.
При нагревании меди с галогенами можно синтезировать безводные дифторид, дихлорид и дибромид. Растворы галогенидов меди(II) удобнее получать взаимодействием металла, его оксида, гидроксида или карбоната с соответствующей галогеноводородной кислотой. Из водных растворов всегда выделяются кристаллогидраты.
Попытки получить иодид меди(II) приводят к образованию иодида меди(I) CuI:
2Cu2+ + 4I– = 2CuI + I2
При этом раствор и осадок окрашиваются в бурый цвет за счет присутствия иода. Образовавшийся иод можно удалить действием тиосульфат-иона:
Образовавшийся иод можно удалить действием тиосульфат-иона:
I2 + 2SO3S2– = 2I– + S4O62–
Однако при добавлении избытка тиосульфат-иона иодид меди(I) растворяется:
CuI + 2SO3S2– = [Cu(SO3S)2]3– + I–
Точно так же попытки получить цианид меди(II) приводят к образованию CuCN. С другой стороны, с электроотрицательным фтором не удается получить соль меди(I). Три других галогенида меди(I), представляющие собой белые нерастворимые соединения, осаждаются из водных растворов при восстановлении галогенидов меди(II).
В водных растворах бесцветный ион меди(I) очень неустойчив и диспропорционирует
2CuI CuII + Cu(р)
Возможно, причиной этого является размер атома. Ион CuII меньше, чем CuI, и, имея вдвое больший заряд, намного сильнее взаимодействует с водой (теплоты гидратации составляют ~2100 и ~580 кДж моль–1, соответственно). Разница является существенной, так как она перевешивает вторую энергию ионизации для меди. Это делает ион CuII более стабильным в водном растворе (и ионных твердых веществах), чем CuI, несмотря на устойчивую конфигурацию d10 последнего. Тем не менее, CuI может стабилизироваться в соединениях с очень низкой растворимостью или за счет комплексообразования. Комплексы легко образуются в водном растворе при взаимодействии Cu2O с соответствующими лигандами. В водных растворах хлоро- и амминкомплексы меди(I) медленно окисляются кислородом воздуха до соответствующих соединений меди(II).
Разница является существенной, так как она перевешивает вторую энергию ионизации для меди. Это делает ион CuII более стабильным в водном растворе (и ионных твердых веществах), чем CuI, несмотря на устойчивую конфигурацию d10 последнего. Тем не менее, CuI может стабилизироваться в соединениях с очень низкой растворимостью или за счет комплексообразования. Комплексы легко образуются в водном растворе при взаимодействии Cu2O с соответствующими лигандами. В водных растворах хлоро- и амминкомплексы меди(I) медленно окисляются кислородом воздуха до соответствующих соединений меди(II).
Катион меди(II), напротив, в водном растворе вполне устойчив. Соли меди(II), в основном, растворимы в воде. Голубой цвет их растворов связан с образованием иона [Cu(H2O)4]2+. Они часто кристаллизуются в виде гидратов. Водные растворы в небольшой степени подвержены гидролизу и из них часто осаждаются основные соли. Основный карбонат есть в природе – это минерал малахит, основные сульфаты и хлориды образуются при атмосферной коррозии меди, а основный ацетат (ярь-медянка) используется в качестве пигмента.
Ярь-медянка известна со времен Плиния Старшего (23–79 н.э.). В русских аптеках ее начали получать в начале 17 в. В зависимости от способа получения она может быть зеленого или голубого цвета. Ею были окрашены стены царских палат в Коломенском в Москве.
Наиболее известную простую соль – пентагидрат сульфата меди(II) CuSO4·5H2O – часто называют медным купоросом. Слово купорос, по-видимому, происходит от латинского Cipri Rosa – роза Кипра. В Росси медный купорос называли синим, кипрским, затем турецким. То, что купорос содержит медь, было впервые установлено в 1644 Ван Гельмонтом. В 1848 Р.Глаубер впервые получил медный купорос из меди и серной кислоты. Сульфат меди широко используется в электролитических процессах, при очистке воды, для защиты растений. Он является исходным веществом для получения многих других соединений меди.
Тетрааммины легко образуются при добавлении аммиака к водным растворам меди(II) до полного растворения первоначально выпавшего осадка. Темно-синие растворы тетраамминов меди растворяют целлюлозу, которую можно вновь осадить при подкислении, что используется в одном из процессов для получения вискозы. Приливание этанола к раствору вызывает осаждение [Cu(NH3)4]SO4·H2O. Перекристаллизация тетраамминов из концентрированного раствора аммиака приводит к образованию фиолетово-синих пентаамминов, однако пятая молекула NH3 легко теряется. Гексааммины можно получить только в жидком аммиаке, и их хранят в атмосфере аммиака.
Медь(II) образует плоско-квадратный комплекс с макроциклическим лигандом фталоцианином. Его производные используются для получения ряда пигментов от синего до зеленого, которые устойчивы вплоть до 500° С и широко используются в чернилах, красках, пластиках и даже в цветных цементах.
Медь имеет важное биологическое значение. Ее окислительно-восстановительные превращения участвуют в различных биохимических процессах растительного и животного мира.
Высшие растения легко переносят сравнительно большое поступление соединений меди из внешней среды, низшие же организмы, наоборот, чрезвычайно чувствительны к этому элементу. Самые незначительные следы соединений меди их уничтожают, поэтому растворы сульфата меди или их смеси с гидроксидом кальция (бордосская жидкость) применяют как противогрибковые средства.
Из представителей животного мира наибольшие количества меди содержатся в телах осьминогов, устриц и других моллюсков. В их крови она играет ту же роль, что железо в крови других животных. В составе белка гемоцианина она участвует в переносе кислорода. Неокисленный гемоцианин бесцветен, а в окисленном состоянии он приобретает голубовато-синюю окраску. Поэтому не зря говорят, что у осьминогов – голубая кровь.
Организм взрослого человека содержит около 100 мг меди, сосредоточенной, в основном, в белках, только содержание железа и цинка выше. Ежедневная потребность человека в меди составляет около 3–5 мг. Дефицит меди проявляется в анемии, однако избыток меди также опасен для здоровья.
Елена Савинкина
химический элемент Медь Cuprum — «Химическая продукция»
Что такое Медь, cuprum, характеристики, свойства
Медь — это химический элемент Cu (Cu от лат. Cuprum) — элемент одиннадцатой группы четвёртого периода (побочной подгруппы первой группы) периодической системы химических элементов Д. И. Менделеева, с атомным номером 29. Простое вещество медь — это пластичный переходный металл золотисто-розового цвета (розового цвета при отсутствии оксидной плёнки). C давних пор широко используется человеком.
Медь класс химических элементов
Элемент Cu — относится к группе, классу хим элементов (элемент одиннадцатой группы четвёртого периода (побочной подгруппы первой группы) периодической системы химических элементов Д. И. Менделеева, с атомным номером 29)
Элемент Cu свойство химического элемента Медь Cuprum
Основные характеристики и свойства элемента Cu…, его параметры.
формула химического элемента Медь Cuprum
Химическая формула Медьа:
Атомы Медь Cuprum химических элементов
Атомы Cuprum хим. элемента
Cuprum Медь ядро строение
Строение ядра химического элемента Cuprum — Cu,
История открытия Медь Cuprum
Открытие элемента Cuprum — один из первых металлов, хорошо освоенных человеком из-за доступности для получения из руды и малой температуры плавления. Этот металл встречается в природе в самородном виде чаще, чем золото, серебро и железо. Одни из самых древних изделий из меди, а также шлак — свидетельство выплавки её из руд — найдены на территории Турции, при раскопках поселения Чатал-Гююк.
Медный век
значительное распространение получили медные предметы, следует во всемирной истории за каменным веком. Несмотря на мягкость меди, медные орудия труда по сравнению с каменными дают значительный выигрыш в скорости рубки, строгания, сверления и распилки древесины, а на обработку кости затрачивается примерно такое же время, как для каменных орудий.
В древности медь применялась также в виде сплава с оловом — бронзы — для изготовления оружия и т. п., бронзовый век пришёл на смену медному. Сплав меди с оловом (бронзу) получили впервые за 3000 лет до н. э. на Ближнем Востоке. Бронза привлекала людей прочностью и хорошей ковкостью, что делало её пригодной для изготовления орудий труда и охоты, посуды, украшений. Все эти предметы находят в археологических раскопах. На смену бронзовому веку относительно орудий труда пришёл железный век.
Первоначально медь добывали из малахитовой руды, а не из сульфидной, так как она не требует предварительного обжига. Для этого смесь руды и угля помещали в глиняный сосуд, сосуд ставили в небольшую яму, а смесь поджигали. Выделяющийся угарный газ восстанавливал малахит до свободной меди:
На Кипре уже в 3 тысячелетии до нашей эры существовали медные рудники и производилась выплавка меди.
На территории России и сопредельных стран медные рудники появились за два тысячелетия до н. э. Остатки их находят на Урале (наиболее известное месторождение — Каргалы), в Закавказье, в Сибири, на Алтае, на территории Украины.
В XIII—XIV вв. освоили промышленную выплавку меди. В Москве в XV в. был основан Пушечный двор, где отливали из бронзы орудия разных калибров. Много меди шло на изготовление колоколов. Из бронзы были отлиты такие произведения литейного искусства, как Царь-пушка (1586 г.), Царь-колокол (1735 г.), Медный всадник (1782 г.), в Японии была отлита статуя Большого Будды (храм Тодай-дзи) (752 г.).
С открытием электричества в XVIII—XIX вв. большие объёмы меди стали идти на производство проводов и других связанных с ним изделий. И хотя в XX в. провода часто стали делать из алюминия, медь не потеряла значения в электротехнике.
Медь Cuprum происхождение названия
Откуда произошло название Cuprum Латинское название меди Cuprum (древн. Aes cuprium, Aes cyprium) произошло от названия острова Кипр, где было богатое месторождение.
У Страбона медь именуется халкосом, от названия города Халкиды на Эвбее. От этого слова произошли многие древнегреческие названия медных и бронзовых предметов, кузнечного ремесла, кузнечных изделий и литья. Второе латинское название меди Aes (санскр. ayas, готское aiz, герм. erz, англ. ore) означает руда или рудник.
Слова медь и медный встречаются в древнейших русских литературных памятниках. Славянское *mědь «медь» не имеет чёткой этимологии, возможно, исконное слово. В. И. Абаев предполагал происхождение слова от названия страны Мидия: *Мѣдь из ир. Мādа- через посредство греч. Μηδία[8]. Согласно этимологии М. Фасмера, слово «медь» родственно др-герм. smid «кузнец», smîdа «металл».
Медь обозначалась алхимическим символом «♀» — «зеркало Венеры», и иногда сама медь именовалась алхимиками тоже как «венера». Это связано с тем, что богиня красоты Венера (Афродита), являлась богиней Кипра, и из меди делались зеркала. Этот символ Венеры также был изображён на брэнде Полевского медеплавильного завода, им с 1735 по 1759 годы клеймилась полевская медь, и изображён на современном гербе города Полевской. С Гумёшевским рудником Полевского, — крупнейшим в XVIII—XIX веках месторождением медных руд Российской империи на Среднем Урале, — связан известный персонаж сказов П. П. Бажова — Хозяйка медной горы, покровительница добычи малахита и меди. По одной из гипотез, она является преломленным народным сознанием образом богини Венеры[
Распространённость Медь Cuprum
Как любой хим. элемент имеет свою распространенность в природе, Cu …
Получение Медь Cuprum
Cuprum — получение элемента
Физические свойства Медь Cuprum
Основные свойства Cuprum —
Медь — золотисто-розовый пластичный металл, на воздухе быстро покрывается оксидной плёнкой, которая придаёт ей характерный интенсивный желтовато-красный оттенок. Тонкие плёнки меди на просвет имеют зеленовато-голубой цвет.
Наряду с осмием, цезием и золотом, медь — один из четырёх металлов, имеющих явную цветовую окраску, отличную от серой или серебристой у прочих металлов. Этот цветовой оттенок объясняется наличием электронных переходов между заполненной третьей и полупустой четвёртой атомными орбиталями: энергетическая разница между ними соответствует длине волны оранжевого света.{28}}(атом/м³).
Изотопы Cuprum Медь
Наличие и определение изотопов Cuprum — природная медь состоит из двух стабильных изотопов — 63Cu (изотопная распространённость 69,1 %) и 65Cu (30,9 %). Известны более двух десятков нестабильных изотопов, самый долгоживущий из которых 67Cu с периодом полураспада 62 часа.
Медь-64
64Cu имеет период полураспада 12,7 часа и распадается по одной из четырех схем:
- Позитронный распад: вероятность 17,8 %, дочерний изотоп стабильный 64Ni.
- Бета-распад: вероятность 39 %, дочерний изотоп стабильный 64Zn.
- Электронный захват: вероятность 43 %, дочерний изотоп стабильный 64Ni.
- Внутренняя конверсия: вероятность 0,47 %, дочерний изотоп стабильный 64Ni.
Cu свойства изотопов Медь Cuprum
| Символ нуклида | Z(p) | N(n) | Масса изотопа (а. е. м.) | Период полураспада (T1/2) | Спин и чётность ядра |
|---|---|---|---|---|---|
| Энергия возбуждения | |||||
| 52Cu | 29 | 23 | 51,99718 | 3+ | |
| 53Cu | 29 | 24 | 52,98555 | 300 нс | 3/2- |
| 54Cu | 29 | 25 | 53,97671 | 75 нс | 3+ |
| 55Cu | 29 | 26 | 54,96605 | 40 мс | 3/2- |
| 56Cu | 29 | 27 | 55,95856 | 93 мс | 4+ |
| 57Cu | 29 | 28 | 56,949211 | 196,3 мс | 3/2- |
| 58Cu | 29 | 29 | 57,9445385 | 3,204 с | 1+ |
| 59Cu | 29 | 30 | 58,9394980 | 81,5 с | 3/2- |
| 60Cu | 29 | 31 | 59,9373650 | 23,7 мин | 2+ |
| 61Cu | 29 | 32 | 60,9334578 | 3,333 ч | 3/2- |
| 62Cu | 29 | 33 | 61,932584 | 9,673 мин | 1+ |
| 63Cu | 29 | 34 | 62,9295975 | стабилен | 3/2- |
| 64Cu | 29 | 35 | 63,9297642 | 12,700 ч | 1+ |
| 65Cu | 29 | 36 | 64,9277895 | стабилен | 3/2- |
| 66Cu | 29 | 37 | 65,9288688 | 5,120 мин | 1+ |
| 67Cu | 29 | 38 | 66,9277303 | 61,83 ч | 3/2- |
| 68Cu | 29 | 39 | 67,9296109 | 31,1 с | 1+ |
| 68mCu | 721,6 кэВ | 3,75 мин | 6- | ||
| 69Cu | 29 | 40 | 68,9294293 | 2,85 мин | 3/2- |
| 69mCu | 2,7418 МэВ | 360 нс | 13/2+ | ||
| 70Cu | 29 | 41 | 69,9323923 | 44,5 с | 6- |
| 70m1Cu | 101,1 кэВ | 33 с | 3- | ||
| 70m2Cu | 242,6 кэВ | 6,6 с | 1+ | ||
| 71Cu | 29 | 42 | 70,9326768 | 19,4 с | 3/2- |
| 71mCu | 2,756 МэВ | 271 нс | 19/2- | ||
| 72Cu | 29 | 43 | 71,9358203 | 6,6 с | 1+ |
| 72mCu | 270 кэВ | 1,76 мкс | 4- | ||
| 73Cu | 29 | 44 | 72,936675 | 4,2 с | 3/2- |
| 74Cu | 29 | 45 | 73,939875 | 1,594 с | 1+ |
| 75Cu | 29 | 46 | 74,94190 | 1,224 с | 3/2- |
| 76Cu | 29 | 47 | 75,945275 | 641 мс | 3 |
| 76mCu | 0 кэВ | 1,27 с | 1 | ||
| 77Cu | 29 | 48 | 76,94785 | 469 мс | 3/2- |
| 78Cu | 29 | 49 | 77,95196 | 342 мс | |
| 79Cu | 29 | 50 | 78,95456 | 188 мс | 3/2- |
| 80Cu | 29 | 51 | 79,96087 | 100 мс | |
| 81Cu | 29 | 52 | > 632 нс | ||
| 82Cu | 29 | 53 | > 636 нс | ||
Химические свойства Медь Cuprum
Определение химических свойств Cuprum
Меры предосторожности Медь Cuprum
Внимание! Внимательно ознакомьтесь с мерами безопасности при работе с Cuprum
Стоимость Медь Cuprum
Рыночная стоимость Cu, цена Медь Cuprum
Примечания
Список примечаний и ссылок на различные материалы про хим. элемент Cu
Свойства меди, ее получение и область применения
Свойства меди, которая в природе встречается и в виде достаточно крупных самородков, люди изучили еще в древние времена, когда из этого металла и его сплавов делали посуду, оружие, украшения, различные изделия бытового назначения. Активное использование данного металла на протяжении многих лет обусловлено не только его особыми свойствами, но и простотой обработки. Медь, которая присутствует в руде в виде карбонатов и окислов, достаточно легко восстанавливается, что и научились делать наши древние предки.
Медный слиток
Интересное о меди
Изначально процесс восстановления этого металла выглядел очень примитивно: медную руду просто нагревали на кострах, а затем подвергали резкому охлаждению, что приводило к растрескиванию кусков руды, из которых уже можно было извлекать медь. Дальнейшее развитие такой технологии привело к тому, что в костры начали вдувать воздух: это повышало температуру нагревания руды. Затем нагрев руды стали выполнять в специальных конструкциях, которые и стали первыми прототипами шахтных печей.
О том, что медь используется человечеством с древних времен, свидетельствуют археологические находки, в результате которых были найдены изделия из данного металла. Историками установлено, что первые изделия из меди появились уже в 10 тысячелетии до н.э, а наиболее активно она стала добываться, перерабатываться и использоваться спустя 8–10 тысяч лет. Естественно, предпосылками к такому активному использованию данного металла стали не только относительная простота его получения из руды, но и его уникальные свойства: удельный вес, плотность, магнитные свойства, электрическая, а также удельная проводимость и др.
В наше время уже сложно найти медь в природе в виде самородков, обычно ее добывают из руды, которая подразделяется на следующие виды.
- Борнит — в такой руде медь может содержаться в количестве до 65%.
- Халькозин, который также называют медным блеском. В такой руде меди может содержаться до 80%.
- Медный колчедан, также называемый халькопиритом (содержание до 30%).
- Ковеллин (содержание до 64%).
Халькопирит
Медь также можно извлекать из множества других минералов (малахит, куприт и др.). В них она содержится в разных количествах.
Физические свойства
Медь в чистом виде представляет собой металл, цвет которого может варьироваться от розового до красного оттенка.
Радиус ионов меди, имеющих положительный заряд, может принимать следующие значения:
- если координационный показатель соответствует 6-ти — до 0,091 нм;
- если данный показатель соответствует 2 — до 0,06 нм.
Радиус атома меди составляет 0,128 нм, также он характеризуется сродством к электрону, равном 1,8 эВ. При ионизации атома данная величина может принимать значение от 7,726 до 82,7 эВ.
Медь — это переходный металл, показатель электроотрицательности которого составляет 1,9 единиц по шкале Полинга. Кроме этого, его степень окисления может принимать различные значения. При температурах, находящихся в интервале 20–100 градусов, его теплопроводность составляет 394 Вт/м*К. Электропроводность меди, которую превосходит лишь серебро, находится в интервале 55,5–58 МСм/м.
Так как медь в потенциальном ряду стоит правее водорода, она не может вытеснять этот элемент из воды и различных кислот. Ее кристаллическая решетка имеет кубический гранецентрированный тип, величина ее составляет 0,36150 нм. Плавится медь при температуре 1083 градусов, а температура ее кипения — 26570. Физические свойства меди определяет и ее плотность, которая составляет 8,92 г/см3.
Самородная медь
Из ее механических свойств и физических показателей стоит также отметить следующие:
- термическое линейное расширение — 0,00000017 единиц;
- предел прочности, которому медные изделия соответствуют при растяжении, составляет 22 кгс/мм2;
- твердость меди по шкале Бринелля соответствует значению 35 кгс/мм2;
- удельный вес 8,94 г/см3;
- модуль упругости составляет 132000 Мн/м2;
- значение относительного удлинения равно 60%.
Совершенно уникальными можно считать магнитные свойства данного металла, который является полностью диамагнитным. Именно эти свойства, наряду с физическими параметрами: удельным весом, удельной проводимостью и другими, в полной мере объясняют широкую востребованность данного металла при производстве изделий электротехнического назначения. Похожими свойствами обладает алюминий, который также успешно используется при производстве различной электротехнической продукции: проводов, кабелей и др.
Основную часть характеристик, которыми обладает медь, практически невозможно изменить, за исключением предела прочности. Данное свойство можно улучшить практически в два раза (до 420–450 МН/м2), если осуществить такую технологическую операцию, как наклеп.
Химические свойства
Химические свойства меди определяются тем, какое положение она занимает в таблице Менделеева, где она имеет порядковый номер 29 и располагается в четвертом периоде. Что примечательно, она находится в одной группе с благородными металлами. Это лишний раз подтверждает уникальность ее химических свойств, о которых следует рассказать более подробно.
Оттенки медных сплавов
В условиях невысокой влажности медь практически не проявляет химическую активность. Все меняется, если изделие поместить в условия, характеризующиеся высокой влажностью и повышенным содержанием углекислого газа. В таких условиях начинается активное окисление меди: на ее поверхности формируется зеленоватая пленка, состоящая из CuCO3, Cu(OH)2 и различных сернистых соединений. Такая пленка, которая называется патиной, выполняет важную функцию защиты металла от дальнейшего разрушения.
Окисление начинает активно происходить и тогда, когда изделие подвергается нагреву. Если металл нагреть до температуры 375 градусов, то на его поверхности формируется оксид меди, если выше (375-1100 градусов) — то двухслойная окалина.
Медь достаточно легко реагирует с элементами, которые входят в группу галогенов. Если металл поместить в пары серы, то он воспламенится. Высокую степень родства он проявляет и к селену. Медь не вступает в реакцию с азотом, углеродом и водородом даже в условиях высоких температур.
Внимание заслуживает взаимодействие оксида меди с различными веществами. Так, при его взаимодействии с серной кислотой образуется сульфат и чистая медь, с бромоводородной и иодоводородной кислотой — бромид и иодид меди.
Иначе выглядят реакции оксида меди с щелочами, в результате которых образуется купрат. Получение меди, при котором металл восстанавливается до свободного состояния, осуществляют при помощи оксида углерода, аммиака, метана и других материалов.
Медь при взаимодействии с раствором солей железа переходит в раствор, при этом железо восстанавливается. Такая реакция используется для того, чтобы снять напыленный медный слой с различных изделий.
Одно- и двухвалентная медь способна создавать комплексные соединения, отличающиеся высокой устойчивостью. Такими соединениями являются двойные соли меди и аммиачные смеси. И те и другие нашли широкое применение в различных отраслях промышленности.
Бухты медной проволоки
Области применения меди
Применение меди, как и наиболее схожего с ней по своим свойствам алюминия, хорошо известно — это производство кабельной продукции. Медные провода и кабели, характеризуются невысоким электрическим сопротивлением и особыми магнитными свойствами. Для производства кабельной продукции применяются виды меди, характеризующиеся высокой чистотой. Если в ее состав добавить даже незначительное количество посторонних металлических примесей, к примеру, всего 0,02% алюминия, то электрическая проводимость исходного металла уменьшится на 8–10%.
Невысокий вес меди и ее высокая прочность, а также способность поддаваться различным видам механической обработки — это те свойства, которые позволяют производить из нее трубы, успешно использующиеся для транспортировки газа, горячей и холодной воды, пара. Совершенно не случайно именно подобные трубы применяются в составе инженерных коммуникаций жилых и административных зданий в большинстве европейских стран.
Медь, кроме исключительно высокой электропроводности, отличается способностью хорошо проводить тепло. Благодаря этому свойству она успешно используется в составе следующих систем:
- тепловые трубки;
- кулеры, использующиеся для охлаждения элементов персональных компьютеров;
- системы отопления и охлаждения воздуха;
- системы, обеспечивающие перераспределение тепла в различных устройствах (теплообменники).
Металлические конструкции, в которых использованы медные элементы, отличаются не только небольшим весом, но и исключительной декоративностью. Именно это послужило причиной их активного использования в архитектуре, а также для создания различных интерьерных элементов.
Шина электротехническая медная
Оценка статьи:
Загрузка…Поделиться с друзьями:
это тело или вещество? Свойства меди
Приблизительно III тысячелетие до нашей эры считается переходным от камня как основного промышленного вещества к бронзе. Период перестройки принято считать медным веком. Ведь именно это соединение на тот период времени было самым главным в строительстве, в изготовлении предметов быта, посуды и прочих процессах.
На сегодняшний день медь своей актуальности не потеряла и по-прежнему считается очень важным металлом, часто используемым в разных нуждах. Медь — это тело или вещество? Какими свойствами она обладает и для чего нужна? Попробуем разобраться далее.
Общая характеристика элемента медь
Как химический элемент, медь имеет свое местоположение в периодической системе. Оно следующее.
- Четвертый большой период, первый ряд.
- Первая группа, побочная подгруппа.
- Порядковый номер 29.
- Атомный вес — 63,546.
- Электронная конфигурация внешнего слоя выражается формулой 3d104s1.
Элемент имеет два стабильных природных изотопа с массовыми числами 63 и 65. Латинское название элемента cuprum, что объясняет его химический символ Cu. В формулах читается как «купрум», русское наименование — медь.
Медь — это тело или вещество?
Чтобы ответить на данный вопрос, следует для начала определиться с понятиями «вещество» и «тело». Они изучаются еще на школьных ступенях, так как являются основополагающими. С точки зрения науки химии и физики, веществом считаются все материалы, из которых изготавливаются те или иные предметы. То есть примерами веществ могут служить все химические соединения как органической, так и неорганической природы.
Тело — это сам предмет, который состоит как раз из какого-то вещества. Они могут быть искусственно сконструированы человеком, либо же иметь природное происхождение. Примеры тел: гвозди, окна, пластинки, стол, шкаф, цветочный горшок и прочее.
Чтобы различить эти два понятия, приведем несколько сравнительных примеров.
- Сахар — вещество, леденец на палочке — тело.
- Железо — вещество, гвоздь — тело.
- Окно — тело, стекло — вещество.
Очевидно из этих рассуждений, что на вопрос: «Медь — это тело или вещество?» — ответ однозначен. Это вещество. Вот если речь пойдет о медной пластинке или медном колечке, тогда, безусловно, следует говорить о них как о теле.
С точки зрения химии, медь — это вещество, относящееся к категории металлов. Оно обладает рядом очень ценных свойств, которые лежат в основе широкого использования данного соединения.
Простое вещество медь — это цветной металл
Как мы уже обозначили, медь — металл. Однако не все представители этой группы веществ одинаковы по своим характеристикам. Существуют мягкие и твердые, белые и желтые, красные металлы и прочее. Медь же относится к цветным мягким металлам.
Электронное строение ее атома позволяет точно определить, медь — это металл или неметалл. Ведь на внешнем уровне у нее всего один электрон, это значит, что его она способна легко отдавать, проявляя типичные металлические восстановительные свойства. Следовательно, в том, что она должна относиться к категории именно металлов, сомнений быть не может. Об этом же говорят и физические свойства ее простого вещества.
Физические свойства
Медь — это вещество или тело? Полностью убедиться в правильности ответа можно лишь рассмотрев ее физические свойства. Если мы говорим о данном элементе как о простом веществе, то для него характерен следующий набор свойств.
- Металл красного цвета.
- Мягкий и очень ковкий.
- Отличный теплопроводник и электропроводник.
- Не тугоплавкий, температура плавления составляет 1084,5 0С.
- Плотность составляет 8,9 г/см3.
- В природе встречается в основном в самородном виде.
Таким образом, получается, что медь — это вещество, причем известное с самой древности. На основе нее издревле создаются многие архитектурные сооружения, изготовляется посуда и предметы быта.
Химические свойства
С точки зрения химической активности, медь — это тело или вещество, обладающее низкой способностью к взаимодействию. Существует две основные степени окисления этого элемента, которые он проявляет в соединениях. Это:
Очень редко можно встретить вещества, в которых данные значения заменяются на +3.
Итак, медь может взаимодействовать с:
- воздухом;
- углекислым газом;
- соляной кислотой и некоторыми другими соединениями только при очень высоких температурах.
Все это объясняется тем, что на поверхности металла формируется защитная оксидная пленка. Именно она предохраняет его от дальнейшего окисления и придает стабильность и малоактивность.
Из простых веществ медь способна взаимодействовать с:
- галогенами;
- селеном;
- цианидами;
- серой.
Часто формирует комплексные соединения либо двойные соли. Практически все сложные соединения данного элемента, кроме оксидов — ядовитые вещества. Те молекулы, которые образует одновалентная медь, легко окисляются до двувалентных представителей.
Области применения
Медь — это смесь или чистое вещество, которое в любом из этих состояний находит широкое применение в промышленности и быту. Можно обозначить несколько основных отраслей использования соединений меди и чистого металла.
- Кожевенная промышленность, в которой используются некоторые соли.
- Производство меха и шелка.
- Изготовление удобрений, средств защиты растений от вредителей (медный купорос).
- Сплавы меди находят широкое применение в автомобилестроении.
- Судостроение, авиаконструкции.
- Электротехника, в которой медь используется, благодаря хорошей антикоррозионной устойчивости и высокой электро- и теплопроводности.
- Различное приборостроение.
- Изготовление посуды и бытовых предметов хозяйственного значения.
Очевидно, что несмотря на долгие сотни лет, рассматриваемый металл только укрепил свои позиции и доказал состоятельность и незаменимость в применении.
Сплавы меди и их свойства
Существует много сплавов на основе меди. Она сама отличается высокими техническими характеристиками, так как легко поддается ковке и прокатке, является легкой и достаточно прочной. Однако при добавлении определенных компонентов свойства значительно улучшаются.
В данном случае следует задать вопрос: «Медь — это вещество или физическое тело, когда речь идет о ее сплавах?» Ответ будет такой: это вещество. Все равно она является именно им до тех пор, пока из сплава не будет изготовлено какое-либо физическое тело, то есть определенный продукт.
Какие сплавы меди бывают?
- Практически равное сочетание меди и цинка в одном составе принято называть латунью. Этот сплав отличается высокой прочностью и устойчивостью к химическим воздействиям.
- Оловянистая бронза — сочетание меди и олова.
- Мельхиор — никель и медь в соотношении 20/80 из 100. Используется для изготовления украшений.
- Константан — сочетание никеля, меди и добавка марганца.
Биологическое значение
Не столь важно, медь — это вещество или тело. Значимо другое. Какую роль играет медь в жизни живых организмов? Оказывается, весьма немаловажную. Так, ионы рассматриваемого металла выполняют следующие функции.
- Участвуют в преобразовании ионов железа в гемоглобин.
- Являются активными участниками процессов роста и размножения.
- Позволяют усваиваться аминокислоте тирозину, следовательно влияют на проявление цвета волос, кожи.
Если организм недополучает данный элемент в нужном количестве, то могут возникать неприятные заболевания. Например, анемия, облысение, болезненная худоба и прочее.
медь — Информация о веществе — ECHA
В разделе «Классификация и маркировка опасностей» показаны опасности вещества на основе стандартизированной системы заявлений и пиктограмм, установленной в соответствии с Регламентом CLP (Классификационная маркировка и упаковка). Регламент CLP гарантирует, что об опасностях, связанных с химическими веществами, четко сообщается рабочим и потребителям в Европейском Союзе. В Регламенте CLP используются Глобальная гармонизированная система ООН (GHS) и Заявления об особых опасностях Европейского Союза (EUH).
Этот раздел основан на трех источниках информации (гармонизированная классификация и маркировка (CLH), регистрации REACH и уведомления CLP). Источник информации указан во вводном предложении краткой характеристики опасности. Когда информация доступна во всех источниках, первые два отображаются как приоритетные.
Обратите внимание:
Целью информации, представленной в этом разделе, является выделение опасности вещества в удобочитаемом формате.Он не представляет собой новую маркировку, классификацию или заявление об опасности, а также не отражает других факторов, которые влияют на восприимчивость описанных эффектов, таких как продолжительность воздействия или концентрация вещества (например, в случае потребительского и профессионального использования). Другая важная информация включает следующее:
- Вещества могут содержать примеси и добавки, которые приводят к различным классификациям. Если хотя бы одна компания указала, что на классификацию веществ влияют примеси или добавки, это будет указано в информативном предложении.Однако уведомления о веществах в InfoCard агрегируются независимо от примесей и добавок.
- Формулировки опасностей были адаптированы для облегчения чтения и могут не соответствовать тексту описания кодов формулировок опасности в Заявлениях об особых опасностях Европейского Союза (EUH) или Глобальной гармонизированной системе ООН (GHS).
Чтобы увидеть полный список заявленных классификаций и получить дополнительную информацию о примесях и добавках, относящихся к классификации, пожалуйста, обратитесь к Реестру C&L.
Более подробная информация о классификации и маркировке доступна в разделе «Правила» на веб-сайте ECHA.
Дополнительная помощь доступна здесь.
Гармонизированная классификация и маркировка (CLH)
Гармонизированная классификация и маркировка — это юридически обязательная классификация и маркировка вещества, согласованная на уровне Европейского сообщества. Гармонизация основана на оценке физической, токсикологической и экотоксикологической опасности вещества.
В разделе «Классификация и маркировка опасностей» в качестве основного источника информации используются сигнальное слово, пиктограмма (пиктограммы) и сведения об опасности вещества в соответствии с Согласованной классификацией и маркировкой (CLH).
Если вещество охвачено более чем одной записью CLH (например, тетраборат динатрия EC № 215–540–4, охватывается тремя гармонизациями & двоеточие; 005–011–00–4; 005–011–01–1 и 005– 011–02–9), информация о CLH не может быть отображена в InfoCard, поскольку различие между классификациями CLH требует ручной интерпретации или проверки. Если вещество классифицируется по нескольким записям CLH, предоставляется ссылка на реестр C&L, чтобы пользователи могли просматривать информацию CLH, связанную с веществом, и текст для InfoCard автоматически не создается.
Возможно, что гармонизация будет введена путем внесения поправки в Регламент CLP. В этом случае отображается номер ATP (адаптация к техническому прогрессу).
Более подробную информацию о CLH можно найти здесь.
Классификация и маркировка согласно REACH
Дополнительная информация о классификации и маркировке (C&L), если таковая имеется, получена из регистрационных досье REACH, представленных отраслями промышленности. Эта информация не проверялась и не проверялась ECHA и может быть изменена без предварительного уведомления.Регистрационные досье REACH содержат более строгие требования к данным (например, подтверждающие исследования), чем к уведомлениям согласно CLP.
Уведомления в соответствии с Положением о классификационной маркировке и упаковке (CLP)
Если не существует гармонизированной классификации и маркировки ЕС и вещество не было зарегистрировано в соответствии с REACH, информация, полученная из уведомлений о классификации и маркировке (C&L) в ECHA в соответствии с Регламентом CLP, является отображается в этом разделе. Эти уведомления могут быть предоставлены производителями, импортерами и последующими пользователями.ECHA ведет реестр C&L, но не проверяет и не проверяет точность информации.
Обратите внимание, что для удобства чтения только пиктограмма
Simple English Wikipedia, бесплатная энциклопедия
Substance [ sub’-stuns ] является материалом или материей, из которой что-то сделано. Вещества — это физические предметы, которые можно увидеть, потрогать или измерить. Они состоят из одной или нескольких элементарных частей. Железо, алюминий, вода и воздух — примеры веществ.
Пар и жидкая вода — это две разные формы одного и того же химического вещества, воды.Основная проблема четкого определения того, что такое субстанция, что если, например, рассматривать не только вселенную (космос), бытие и небытие, а вообще все, то возникает вопрос, что является постоянным основным принципом (атрибут) — это основа субстанции, которая обычно состоит из всего (то есть материи, разума, чувств, пространства, души и т. д.).
Латинское слово субстанция — это перевод греческого слова, обозначающего сущность (ousia), а с латыни для описания сущности используется слово essentia.В античной философии субстанция трактуется как субстрат, первооснова всего (например, «вода» Фалеса, «огонь» Гераклита).
В наше время понятие вещества трактуется и широко распространяется. Первая точка зрения связана с онтологическим пониманием субстанции как конечного базового бытия (Фрэнсис Бэкон, Бенедикт Спиноза, Готфрид Вильгельм Лейбниц). Центральная категория метафизики в философии субстанция отождествляется с Богом и с природой и определяется как причина самой себя (лат. Causa sui).Основные характеристики (атрибуты) вещества от Бенедикта Спинозы — мышление и растяжка. По аналогии с философией Бенедикта Спиноза субстанция рассматривается в свете концепции Рене Декарта и Лейбница. Первая субстанция — это единство субъекта и объекта, а вторая — те же атомы — простые существа, которые теряют свою протяженность, но получают атрибутные устремления (фр. Аппетит) и множественность. Благодаря Лейбницу вещество начинает ассоциироваться с материей.
Вторая точка зрения на сущность — это гносеологическое понимание концепции, ее возможностей и потребности в научном познании (Джон Локк, Дэвид Хьюм).Иммануил Кант считал, что закон, согласно которому любое изменение сущности событий и количества хранящихся в нем в природе остается неизменным, можно отнести к «аналогиям опыта». Георг Вильгельм Фридрих Гегель определил субстанцию как целостность изменчивой, преходящей стороны вещей, как «важный шаг в развитии воли». Для Артура Шопенгауэра субстанция — материя, для Дэвида Юма — фикция, свойства сосуществования.
% PDF-1.4 % 9 0 obj> endobj xref 9 76 0000000016 00000 н. 0000002188 00000 п. 0000002265 00000 н. 0000002443 00000 н. 0000002828 00000 н. 0000002943 00000 н. 0000003519 00000 н. 0000004080 00000 н. 0000004209 00000 н. 0000004759 00000 п. 0000004802 00000 н. 0000004836 00000 н. 0000004879 00000 н. 0000004922 00000 н. 0000004965 00000 н. 0000005008 00000 н. 0000005255 00000 н. 0000005508 00000 н. 0000005584 00000 н. 0000005880 00000 н. 0000006127 00000 н. 0000008810 00000 н. 0000008939 00000 н. 0000009068 00000 н. 0000009380 00000 п. 0000009733 00000 н. 0000013909 00000 п. 0000017777 00000 п. 0000017911 00000 п. 0000018059 00000 п. 0000018355 00000 п. 0000022241 00000 п. 0000022371 00000 п. 0000025864 00000 п. 0000026028 00000 п. 0000029934 00000 н. 0000033881 00000 п. 0000044859 00000 н. 0000045057 00000 п. 0000045254 00000 п. 0000045462 00000 п. 0000054744 00000 п. 0000058376 00000 п. 0000084678 00000 п. 0000084776 00000 п. 0000092403 00000 п. 0000092655 00000 п. 0000092851 00000 п. 0000093099 00000 п. 0000108815 00000 н. 0000109106 00000 п. 0000118089 00000 н. 0000131694 00000 н. 0000131885 00000 н. 0000132131 00000 н. 0000150949 00000 н. 0000151156 00000 н. 0000158601 00000 н. 0000158847 00000 н. 0000159033 00000 н. 0000182286 00000 н. 0000182535 00000 н. 0000183074 00000 н. 0000185743 00000 н. 0000185977 00000 н. 0000186280 00000 н. 0000200091 00000 н. 0000200391 00000 п. 0000201363 00000 н. 0000201584 00000 н. 0000208705 00000 н. 0000208934 00000 н. 0000209117 00000 н. 0000209405 00000 н. 0000222012 00000 н. 0000001816 00000 н. трейлер ] >> startxref 0 %% EOF 84 0 obj> поток xb«f«Oe`g`Ыab @
1.Физические свойства характеристика вещества, которое можно наблюдать или измерять без образования нового вещества.
Презентация на тему: «1. Физические свойства характеристика вещества, которое можно наблюдать или измерять без образования нового вещества» — стенограмма презентации:
1
2 1.Физические свойства характеристика вещества, которое можно наблюдать или измерять без образования нового вещества.
3 Физические свойства Физические свойства могут быть следующими: Качественные Количественные В чем разница?
4 Качественные физические свойства Качественные свойства — характеристика, которую можно описать, но не измерить. т.е. цвет, запах, текстура.
5 Количественные физические свойства Количественное свойство — свойство, измеренное. Вес — 50 кг Объем — 100 мл Температура плавления — 0 ° C Температура кипения — 100 ° C Температура замерзания — 0 ° C Плотность — 1 г / мл
6 2. Химические свойства Химические свойства — поведение вещества, когда оно становится новым. Например. — Горючесть / воспламеняемость — Реакция с кислотой
7 Практические вопросы 1. Определите свойство, описанное в каждом из приведенных ниже утверждений. Напишите P для физического или C для химического в строке перед данным признаком. пробка плавает по воде. медь превращается в проволоку для использования в электрических цепях. стальным лезвием можно поцарапать стекло. вода закипает при 100 ºC. алкоголь легко воспламеняется. Лимонад принимает форму емкости и имеет постоянный объем.металлические инструменты могут заржаветь, если они попадут на улицу под дождем. P P P P P C C
ФИЗИКА ЧАСТИЦ — Тематические тексты
Главная → ФИЗИКА ЧАСТИЦ — Тематические текстыТекст 1
Все состоит из крошечных атомов, которые состоят из еще более мелких частиц. Физика элементарных частиц — это изучение этих более мелких частиц, которые образуют самые основные строительные блоки всей материи во Вселенной. Изучение частиц позволяет ученым больше узнать о Вселенной и природе всей материи.Ученые в целом согласны с тем, что Вселенная началась с огромного взрыва в космосе, который они называют «большим взрывом».
Текст 2
Материя — это все, что занимает пространство, включая все на Земле и во всей Вселенной. Капли воды и пылинки — это разновидности материи, а также растения, животные и даже планеты. Всякая материя имеет массу, которая является мерой частиц (атомов и молекул), из которых состоит. Частицы могут группироваться множеством разных способов, изменяя структуру материи.Вот почему существует так много разных видов материи. Все виды можно разделить на твердые, жидкие или газообразные.
Текст 3
Многие вещества могут существовать более чем в одном состоянии — в твердом, жидком или газообразном состоянии. В каком состоянии они находятся, зависит от их температуры и давления. При определенных температурах, при нормальном атмосферном давлении некоторые вещества меняют состояние. Жидкости, например, и газы могут конденсироваться в жидкости. Элементы изменяют свое состояние под нормальным давлением при определенных температурах, известных как точки плавления (или замерзания) и кипения (или конденсации).
Текст 4
Все вещества состоят из крошечных частиц, называемых атомами; они являются строительными блоками всего на Земле. Атомы настолько малы, что в булавочной головке их около 60 миллиардов. Древние греки впервые предположили, что материя может состоять из мелких частиц. Атомы содержат еще более мелкие частицы, называемые протонами, нейтронами и электронами.
Текст 5
Элемент — это вещество, которое содержит только один вид атомов. Атомы не могут быть расщеплены химическими средствами, поэтому невозможно разбить элемент на более простые вещества химическими изменениями.На данный момент открыто 109 элементов; 92 являются естественными, остальные 17 являются искусственными элементами, которые могут быть изготовлены только в лаборатории. Есть два основных вида элементов — металлы и неметаллы. Некоторые элементы химически соединяются с другими элементами с образованием веществ, называемых соединениями.
Текст 6
Соединение — это вещество, в котором атомы двух или более элементов соединены химическими связями. Из-за этих связей очень сложно разделить соединение на отдельные элементы.Тип и количество образующихся связей зависят от электронов (частиц с отрицательным электрическим зарядом) в каждом атоме. Свойства соединения могут сильно отличаться от свойств содержащихся в нем элементов. Например, соль, которую мы используем в еде, безвредна, но состоит из двух опасных элементов: натрия, который бурно реагирует с воздухом; и хлор, который в больших количествах ядовит.
Текст 7
Молекула — это группа атомов, соединенных химическими связями.Молекулы элемента идентичны и содержат атомы только одного типа. Кислородный газ, например, имеет молекулы, состоящие из двух атомов кислорода. Молекулы соединения также идентичны, но в этом случае каждая молекула содержит атомы более чем одного типа. В воде, например, каждая молекула состоит из двух атомов водорода и одного атома кислорода. Все газы, большинство жидкостей и многие неметаллические твердые тела состоят из молекул.
аминов в качестве оснований
Самый простой способ взглянуть на основные свойства аминов — представить амин как модифицированную молекулу аммиака.В амине один или несколько атомов водорода в аммиаке заменены углеводородной группой.
Замена атомов водорода по-прежнему оставляет неподеленную пару на азоте неизменной — и именно неподеленная пара на азоте придает аммиаку его основные свойства. Следовательно, амины будут вести себя так же, как аммиак, во всех случаях, когда задействована неподеленная пара.
Реакции аминов с кислотами
Их легче всего рассмотреть, используя теорию кислот и оснований Бренстеда-Лоури — основание является акцептором ионов водорода.Мы проведем прямое сравнение аминов и знакомых нам реакций аммиака.
Напоминание о реакциях аммиака
Аммиак реагирует с кислотами с образованием ионов аммония. Молекула аммиака захватывает ион водорода из кислоты и присоединяет его к неподеленной паре азота.
Если реакция протекает в растворе в воде (с использованием разбавленной кислоты), аммиак забирает ион водорода (протон) у иона гидроксония.(Помните, что ионы водорода, присутствующие в растворах кислот в воде, переносятся молекулами воды в виде ионов гидроксония, H 3 O + .)
Если бы кислота была, например, соляной кислотой, вы бы получили раствор, содержащий хлорид аммония — ионы хлора, конечно, происходят из соляной кислоты.
Вы также можете записать это последнее уравнение как:
. . . но если вы сделаете это таким образом, вы должны включить государственные символы.Если вы напишете H + отдельно, это будет означать неприсоединенный ион водорода — протон. Такие вещи не существуют сами по себе в растворе в воде.
Если реакция происходит в газообразном состоянии, аммиак принимает протон непосредственно от хлористого водорода:
На этот раз вы создаете облака из белого твердого хлорида аммония.
Соответствующие реакции с аминами
Неподеленная пара азота ведет себя точно так же.Тот факт, что один (или несколько) атомов водорода в аммиаке заменен углеводородной группой, не имеет значения.
Например, с этиламином:
Если реакция проводится в растворе, амин берет ион водорода у иона гидроксония и образует ион этиламмония.
или:
Раствор должен содержать хлорид или сульфат этиламмония или что-то еще.
В качестве альтернативы амин будет реагировать с хлористым водородом в газообразном состоянии с образованием белого дыма того же типа, что и аммиак, но на этот раз хлорида этиламмония.
Эти примеры включают первичный амин. Не имеет значения, используете ли вы вторичный или третичный. Уравнения выглядели бы более сложными.
Ионами продукта диэтиламина и триэтиламина будут ионы диэтиламмония и ионы триэтиламмония соответственно.
Реакции аминов с водой
Опять же, проще всего использовать теорию Бронстеда-Лоури, и, опять же, полезно провести прямое сравнение с аммиаком.
Напоминание о реакции аммиака с водой
Аммиак является слабым основанием и берет ион водорода из молекулы воды, чтобы произвести ионы аммония и ионы гидроксида.
Однако аммиак — это всего лишь слабое основание , и он не очень хорошо удерживает ион водорода. Реакция обратима, при этом большая часть аммиака в любой момент времени присутствует в виде свободного аммиака, а не ионов аммония.
Присутствие гидроксид-ионов в этой реакции делает раствор щелочным.
Соответствующая реакция с аминами
Амин по-прежнему содержит неподеленную пару азота и делает то же самое.
Например, с этиламином вы получаете ионы этиламмония и ионы гидроксида.
Однако есть разница в положении равновесия. Амины обычно являются более сильными основаниями, чем аммиак. (Однако из этого правила есть исключения — особенно, если аминогруппа присоединена непосредственно к бензольному кольцу.)
.
