Купрум — это… Что такое Купрум?
Медь / Cuprum (Cu) | |
|---|---|
| Атомный номер | 29 |
| Внешний вид простого вещества | пластичный металл золотисто-розового цвета |
| Свойства атома | |
| Атомная масса (молярная масса) | 63,546 а. е. м. (г/моль) |
| Радиус атома | 128 пм |
| Энергия ионизации (первый электрон) | 745,0 (7,72) кДж/моль (эВ) |
| Электронная конфигурация | [Ar] 3d10 4s1 |
| Химические свойства | |
| Ковалентный радиус | 117 пм |
| Радиус иона | (+2e) 72 (+1e) 96 пм |
| Электроотрицательность (по Полингу) | 1,90 |
| Электродный потенциал | +0,337 В/ +0,521 В |
| Степени окисления | 2, 1 |
| Термодинамические свойства простого вещества | |
| Плотность | 8,96 г/см³ |
| Удельная теплоёмкость | 24,465 Дж/(K·моль) |
| Теплопроводность | 401 Вт/(м·K) |
| Температура плавления | 1356,6 K |
| Теплота плавления | 13,01 кДж/моль |
| Температура кипения | 2840 K |
| Теплота испарения | 304,6 кДж/моль |
| Молярный объём | 7,1 см³/моль |
| Кристаллическая решётка простого вещества | |
| Структура решётки | кубическая гранецентрированая |
| Период решётки | 3,615 Å |
| Отношение c/a | n/a |
| Температура Дебая | 315,00 K |
Медь — химический элемент с атомным номером 29 в периодической системе, обозначается символом Cu (лат. Cuprum от названия острова Кипр где добывали медь), красновато-золотистого цвета (розовый при отсутствии оксидной пленки). Простое вещество медь — это пластичный переходный металл, с давних пор широко применяемый человеком.
История и происхождение названия
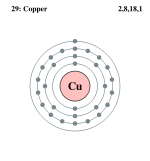
Схема атома меди
Из-за сравнительной доступности для получения из руды и малой температуры плавления медь — один из первых металлов, широко освоенных человеком. В древности применялась в основном в виде сплава с оловом — бронзы для изготовления оружия и т. п. (см бронзовый век).
Нахождение в природе

Самородная медь
Медь встречается в природе как в соединениях, так и в самородном виде. Промышленное значение имеют халькопирит CuFeS2, также известный как медный колчедан, халькозин Cu2S и борнит Cu5FeS4. Вместе с ними встречаются и другие минералы меди: ковеллин CuS, куприт Cu2O, азурит Cu3(CO3)2(OH)2, малахит Cu2CO3(OH)2. Сульфиды меди образуются в основном в среднетемпературных гидротермальных жилах. Также нередко встречаются месторождения меди в осадочных породах — медистые песчаники и сланцы. Наиболее известные из месторождений такого типа — Удокан в Читинской области, Джезказган в Казахстане, Меденосный пояс Центральной Африки и Мансфельд в Германии.
Большая часть медной руды добывается открытым способом. Содержание меди в руде составляет от 0,4 до 1,0 %.
Физические свойства
Медь — золотисто-розовый пластичный металл, на воздухе быстро покрывается оксидной плёнкой, которая придаёт ей характерный интенсивный желтовато-красный оттенок. Медь обладает высокой тепло- и электропроводностью (занимает второе место по электропроводности после серебра). Имеет два стабильных изотопа — 63Cu и 65Cu, и несколько радиоактивных изотопов. Самый долгоживущий из них, 64Cu, имеет период полураспада 12,7 ч и два различных варианта распада с различными продуктами.
Плотность — 8,94*10³ кг/м³
Удельная теплоёмкость при 20 °С — 390 Дж/кг*К
Удельное электрическое сопротивление при 20-100 °С — 1,78·10-8 Ом·м
Существует ряд сплавов меди: латунь — сплав меди с цинком, бронза — сплав меди с оловом, мельхиор — сплав меди и никеля, и некоторые другие.
Химические свойства
Хорошо проводит тепло. На воздухе покрывается оксидной плёнкой.
Соединения

Медный купорос
В соединениях медь бывает двух степеней окисления: менее стабильную степень Cu+ и намного более стабильную Cu2+, которая даёт соли синего и сине-зелёного цвета. В необычных условиях можно получить соединения со степенью окисления +3 и даже +5. Последняя встречается в солях купраборанового аниона Cu(B
Карбонат меди(II) имеет зелёную окраску, что является причиной позеленения элементов зданий, памятников и изделий из меди. Сульфат меди(II) при гидратации даёт синие кристаллы медного купороса CuSO4∙5H2O, используется как фунгицид. Также существует нестабильный сульфат меди(I) Существует два стабильных оксида меди — оксид меди(I) Cu2O и оксид меди(II) CuO. Оксиды меди используются для получения оксида иттрия бария меди (YBa
Соединения меди(I)
Многие соединения меди(I) имеют белую окраску либо бесцветны. Это объясняется тем, что в ионе меди(I) все пять Зd-орбиталей заполнены парами электронов. Однако оксид Cu20 имеет красновато-коричневую окраску. Ионы меди(I) в водном растворе неустойчивы и легко подвергаются диспропорционированию:
2Cu+(водн.) → Cu2+(водн.) + Cu(тв.)
В то же время медь(I) встречается в форме соединений, которые не растворяются в воде, либо в составе комплексов. Например, дихлорокупрат(I)-ион [CuCl2]— устойчив. Его можно получить, добавляя концентрированную соляную кислоту к хлориду меди(I):
CuCl(тв.) + Cl—(водн.) → [CuCl]— (водн.)
Хлорид меди(I) — белое нерастворимое твердое вещество. Как и другие галогениды меди(I), он имеет ковалентный характер и более устойчив, чем галогенид меди (II). Хлорид меди(I) можно получить при сильном нагревании хлорида меди(II):
CuCl2(тв.) → 2CuCl(тв.) + Cl
Другой способ его получения заключается в кипячении смеси хлорида меди(II) с медью в концентрированной соляной кислоте. В этом случае сначала образуется промежуточное соединение — комплексный дихлорокупрат(I)-ион [CuCl2]—. При выливании раствора, содержащего этот ион, в воду происходит осаждение хлорида меди(I). Хлорид меди(I) реагирует с концентрированным раствором аммиака, образуя комплекс диамминмеди(I) [Cu(NH3)2]+. Этот комплекс не имеет окраски в отсутствие кислорода, но в результате реакции с кислородом превращается в синее соединение.
Аналитическая химия меди
- Традиционно количественное выделение меди из слабокислых растворов проводилось с помощью сероводорода.
- В растворах, при отсутствии мешающих ионов медь может быть определена комплексонометрически или потенциометрически, ионометрически.
- Микроколичества меди в растворах определяют кинетическими методами.
Применение
В электротехнике
Из-за низкого удельного сопротивления (уступает лишь серебру), медь широко применяется в электротехнике для изготовления силовых кабелей, проводов или других проводников, например, при печатном монтаже. Медные провода, в свою очередь, также используются в обмотках энергосберегающих электроприводов (быт: электродвигателях) и силовых трансформаторов.
Теплообмен
Другое полезное качество меди — высокая теплопроводность. Это позволяет применять её в различных теплоотводных устройствах, теплообменниках, к числу которых относятся и широко известные радиаторы охлаждения, кондиционирования и отопления.
Для производства труб
В связи с высокой механической прочностью, но одновременно пригодностью для механической обработки, медные бесшовные трубы круглого сечения получили широкое применение для транспортировки жидкостей и газов: во внутренних системах водоснабжения, отопления, газоснабжения, системах кондиционирования и холодильных агрегатах. В ряде стран трубы из меди являются основным материалом, применяемым для этих целей: во Франции, Великобритании и Австралии для газоснабжения зданий, в Великобритании, США, Швеции и Гонконге для водоснабжения, в Великобритании и Швеции для отопления. В России производство водопроводных труб из меди нормируется национальным стандартом ГОСТ Р 52318-2005 [3], а применение в этом качестве федеральным Сводом Правил СП 40-108-2004. Кроме того, трубопроводы из меди и сплавов меди широко используются в судостроении и энергетике для транспортировки жидкостей и пара.
Наиболее распространённые сплавы — бронза и латунь
В разнообразных областях техники широко используются сплавы с использованием меди, самыми широкораспространёнными из которых являются упоминавшиеся выше бронза и латунь. Оба сплава являются общими названиями для целого семейства материалов, куда помимо олова и цинка могут входить никель, висмут и другие металлы. Например, в состав так называемого пушечного металла, который в XVI—XVIII вв. действительно использовался для изготовления артиллерийских орудий, входят все три основных металла — медь, олово, цинк; рецептура менялась от времени и места изготовления орудия. В наше время находит применение в военном деле в кумулятивных боеприпасах благодаря высокой пластичности, большое количество латуни идёт на изготовление оружейных гильз. Медноникелевые сплавы используются для чеканки разменной монеты. Медноникелиевые сплавы, в том числе т. н. «адмиралтейский» сплав широко используются в судостроении и областях применения, связанных с возможностью агрессивного воздействия морской воды из-за образцовой коррозионной устойчивости.
Ювелирные сплавы
В ювелирном деле часто используются сплавы меди с золотом для увеличения прочности изделий к деформациям и истиранию, так как чистое золото очень мягкий металл и нестойко к этим механическим воздействиям.
Соединения меди
Оксиды меди используются для получения оксида иттрия бария меди YBa2Cu3O7-δ, который является основой для получения высокотемпературных сверхпроводников. Медь применяется для производства медно-окисных гальванических элементов, и батарей.
Другие сферы применения
Медь самый широкоупотребляемый катализатор полимеризации ацетилена. Из-за этого трубопроводы из меди применять для транспортировки ацетилена можно только при содержании меди в сплаве материала труб не более 64 %.
Широко применяется медь в кровельном деле. Кровли из тонкой листовой меди из-за автозатухания процесса коррозии медного листа служат безаварийно по 100—150 лет. В России использование медного листа для кровель и фасадов нормируется федеральным Сводом Правил СП 31-116-2006 [4]
Прогнозируемым новым массовым применением меди обещает стать ее применение в качестве бактерицидных поверхностей в лечебных учереждениях для снижения внутрибольничного бактериопереноса: дверей, ручек, водозапорной арматуры, перил, поручней кроватей, столешниц — всех поверхностей, к которым прикасается рука человека.
Биологическая роль
Медь является необходимым элементом для всех высших растений и животных. В токе крови медь переносится главным образом белком церулоплазмином. После усваивания меди кишечником она транспортируется к печени с помощью альбумина. Медь встречается в большом количестве ферментов, например, в цитохром-с-оксидазе, в содержащем медь и цинк ферменте супероксид дисмутазе, и в переносящем кислород белке гемоцианине. В крови большинства моллюсков и членистоногих медь используется вместо железа для транспорта кислорода.
Предполагается, что медь и цинк конкурируют друг с другом в процессе усваивания в пищеварительном тракте, поэтому избыток одного из этих элементов в пище может вызвать недостаток другого элемента. Здоровому взрослому человеку необходимо поступление меди в количестве 0,9 мг в день.
Токсичность
Некоторые соединения меди могут быть токсичны при превышении ПДК в пище и воде. Содержание меди в питьевой воде не должно превышать 2 мг/л (средняя величина за период из 14 суток), однако недостаток меди в питьевой воде также нежелателен. Всемирная Организация Здравоохранения (ВОЗ) сформулировала в 1998 году это правило так: «Риски для здоровья человека от недостатка меди в организме многократно выше, чем риски от ее избытка».
В 2003 году в результате интенсивных исследований ВОЗ пересмотрела прежние оценки токсичности меди. Было признано, что медь не является причиной расстройств пищеварительного тракта [5].
Существовали опасения, что Гепатоцеребральная дистрофия (болезнь Вильсона — Коновалова) сопровождается накоплением меди в организме, так как она не выделяется печенью в желчь. Эта болезнь вызывает повреждение мозга и печени. Однако причинно-следственная связь между возникновением заболевания и приёмом меди внутрь подтверждения не нашла[1]. Установлена лишь повышенная чувствительность лиц, в отношении которых диагностировано это заболевание к повышенному содержанию меди в пище и воде. Общее число лиц, поражённых заболеванием, например, в США, составляет ок. 35 000 человек, то есть 0,01 % от общего числа водопользователей.
Бактерицидность
Бактерицидные свойства меди и ее сплавов были известны человеку давно. В 2008 году после длительных исследований Федеральное Агентство по Охране Окружающей Среды США (US EPA) [6] официально присвоило меди и нескольким сплавам меди статус веществ с бактерицидной поверхностью [7]. Особено выраженно бактерицидное действие поверхностей медных (и сплавов меди) проявляется в отношении метициллин-устойчивого штамма стафилококка золотистого, извесного как «супермикроб» MRSA [8]:
Органолептические свойства
Ионы меди придают излишку меди в воде отчётливый «металлический вкус». У разных людей порог органолептического определения меди в воде составляет приблизительно 2-10 мг/л. Естественная способность к такому определению повышенного содержания меди в воде является природным механизмом защиты от приема внутрь воды с излишним содержанием меди.
Производство, добыча и запасы меди
Мировая добыча меди в 2000 году составляла около 15 млн т., a в 2004 году — около 14 млн т. [2][3]. Мировые запасы в 2000 году составляли, по оценке экспертов, 954 млн т., из них 687 млн т. подтверждённые запасы [2], на долю России приходилось 3.2 % общих и 3.1 % подтверждённых мировых запасов [2]. Таким образом, при нынешних темпах потребления запасов меди хватит примерно на 60 лет.
Производство рафинированной меди в России в 2006 году составило 1,009 тыс. тонн, потребление — 714 тыс. тонн[4]. Основными производителями меди в России являются:
Как добывают медь Этот металл встречается в природе в самородном виде чаще, чем золото, серебро и железо. Нашли однажды самородок, который весил 420 т. Наверняка медь была первым металлом, с которым познакомились древние люди. Первые свои орудия делали они из кремниевой и железной руды, из меди, и уже потом научились изготовлять их из бронзы и железа. Сплав меди с оловом (бронзу) получили впервые за 3000 лет до н.э. на Ближнем Востоке. Бронза привлекала людей прочностью и хорошей ковкостью, что делало ее пригодной для изготовления орудий труда и охоты, посуды, украшений. Все эти предметы находят в археологических раскопах. Добычу меди называют прабабушкой металлургии. Ее добыча и выплавка были налажены еще в Древнем Египте, во времена фараона Рамзеса II (1300—1200 гг. до н.э.). Древние египтяне нагнетали воздух в плавильные печи с помощью мехов, а древесный уголь получали из акации и финиковой пальмы. Они выплавили около 100 т чистой меди. На территории России и сопредельных стран медные рудники появились за два тысячелетия до н.э. Остатки их находят на Урале, в Закавказье, на Украине, в Сибири, на Алтае. В XIII—XIV вв. освоили промышленную выплавку меди. В Москве в XV в. был основан Пушечный двор, где отливали из бронзы орудия разных калибров. О нем напоминает теперешняя Пушечная улица в Москве. Сейчас известно более 170 минералов, содержащих медь, но из них только 14—15 имеют промышленное значение. Это — халькопирит (он же медный колчедан), малахит, встречается и самородная медь. В медных рудах часто в качестве примесей встречаются молибден, никель, свинец, кобальт, реже — золото, серебро. Обычно мед-ные руды обогащаются на фабриках, прежде чем поступают на медеплавильные комбинаты. Богаты медью Казахстан, США, Чили, Канада, африканские страны — Заир, Замбия, Южно-Африканская республика. Очень крупное Удоканское месторождение медной руды сравнительно недавно обнаружено на севере Читинской области.
Большая часть добываемой меди используется в электротехнике, потому что медь обладает высокой электропроводностью, уступая в этом только серебру, которое, конечно, намного дороже. Миллионы километров проводов опутали земной шар, и большинство из них медные. Медь нужна для производства двигателей, телевизоров, телефонных аппаратов, различных электроприборов, автомобилей, электровозов, холодильников и даже музыкальных инструментов. Ее используют в химической промышленности для борьбы с вредителями садов и огородов, для подкормки растений и животных. Всюду нужна медь. По объему мирового производства и потребления медь занимает третье место после железа и алюминия.
Ссылки
Примечания
- ↑ [1]
- ↑ 1 2 3 http://www.ecsocman.edu.ru/db/msg/142462.html
- ↑ http://www.metalinfo.ru/ru/news/12150
- ↑ Минпромэнерго РФ, «Стратегия развития металлургической промышленности Российской Федерации на период до 2015 года» [2]
Wikimedia Foundation. 2010.
Медь — свойства, характеристики | Cu-prum.ru
 Медь – это пластичный золотисто-розовый металл с характерным металлическим блеском. В периодической системе Д. И. Менделеева этот химический элемент обозначается, как Сu (Cuprum) и находится под порядковым номером 29 в I группе (побочной подгруппе), в 4 периоде.
Медь – это пластичный золотисто-розовый металл с характерным металлическим блеском. В периодической системе Д. И. Менделеева этот химический элемент обозначается, как Сu (Cuprum) и находится под порядковым номером 29 в I группе (побочной подгруппе), в 4 периоде.
Латинское название Cuprum произошло от имени острова Кипр. Известны факты, что на Кипре ещё в III веке до нашей эры находились медные рудники и местные умельцы выплавляли медь. Купить медь можно в комании «КУПРУМ».
По данным историков, знакомству общества с медью около девяти тысячелетий. Самые древние медные изделия найдены во время археологических раскопок на местности современной Турции. Археологи обнаружили маленькие медные бусинки и пластинки для украшения одежды. Находки датируются рубежом VIII-VII тыс. до нашей эры. Из меди в древности изготавливали украшения, дорогую посуду и различные инструменты с тонким лезвием.
Великим достижением древних металлургов можно назвать получение сплава с медной основой – бронзы.
Основные свойства меди
1. Физические свойства.
На воздухе медь приобретает яркий желтовато-красный оттенок за счёт образования оксидной плёнки. Тонкие же пластинки при просвечивании зеленовато-голубого цвета. В чистом виде медь достаточно мягкая, тягучая и легко прокатывается и вытягивается. Примеси способны повысить её твёрдость.
Высокую электропроводность меди можно назвать главным свойством, определяющим её преимущественное использование. Также медь обладает очень высокой теплопроводностью. Такие примеси как железо, фосфор, олово, сурьма и мышьяк влияют на базовые свойства и уменьшают электропроводность и теплопроводность. По данным показателям медь уступает лишь серебру.
Медь обладает высокими значениями плотности, температуры плавления и температуры кипения. Важным свойством также является хорошая стойкость по отношению к коррозии. К примеру, при высокой влажности железо окисляется значительно быстрее.
Медь хорошо поддаётся обработке: прокатывается в медный лист и медный пруток, протягивается в медную проволоку с толщиной, доведённой до тысячных долей миллиметра. Этот металл является диамагнетиком, то есть намагничивается против направления внешнего магнитного поля.

2. Химические свойства.
Медь является сравнительно малоактивным металлом. В нормальных условиях на сухом воздухе её окисления не происходит. Она легко реагирует с галогенами, селеном и серой. Кислоты без окислительных свойств не оказывают воздействия на медь. С водородом, углеродом и азотом химических реакций нет. На влажном воздухе происходит окисление с образованием карбоната меди (II) – верхнего слоя платины.
Медь обладает амфотерностью, то есть в земной коре образует катионы и анионы. В зависимости от условий, соединения меди проявляют кислотные или основные свойства.

Способы получения меди
В природе медь существует в соединениях и в виде самородков. Соединения представлены оксидами, гидрокарбонатами, сернистыми и углекислыми комплексами, а также сульфидными рудами. Самые распространённые руды — это медный колчедан и медный блеск. Содержание меди в них составляет 1-2%. 90% первичной меди добывают пирометаллургическим способом и 10% гидрометаллургическим.
1. Пирометаллургический способ включает в себя такие процессы: обогащение и обжиг, плавка на штейн, продувка в конвертере, электролитическое рафинирование.
Обогащают медные руды методом флотации и окислительного обжига. Сущность метода флотации заключается в следующем: частицы меди, взвешенные в водной среде, прилипают к поверхности пузырьков воздуха и поднимаются на поверхность. Метод позволяет получить медный порошкообразный концентрат, который содержит 10-35% меди.
Окислительному обжигу подлежат медные руды и концентраты со значительным содержанием серы. При нагреве в присутствии кислорода происходит окисление сульфидов, и количество серы снижается почти в два раза. Обжигу подвергаются бедные концентраты, в которых содержится 8-25% меди. Богатые концентраты, содержащие 25-35% меди, плавят, не прибегая к обжигу.
Следующий этап пирометаллургического способа получения меди – это плавка на штейн. Если в качестве сырья используется кусковая медная руда с большим количеством серы, то плавку проводят в шахтных печах. А для порошкообразного флотационного концентрата применяют отражательные печи. Плавка происходит при температуре 1450 °С.
В горизонтальных конвертерах с боковым дутьём медный штейн продувается сжатым воздухом для того, чтобы произошли процессы окисления сульфидов и феррума. Далее образовавшиеся окислы переводят в шлак, а серу в оксид. В конвертере образуется черновая медь, которая содержит 98,4-99,4% меди, железо, серу, а также незначительное количество никеля, олова, серебра и золота.
Черновая медь подлежит огневому, а далее электролитическому рафинированию. Примеси удаляют с газами и переводят в шлак. В результате огневого рафинирования образуется медь с чистотой до 99,5%. А после электролитического рафинирования чистота составляет 99,95%.
2. Гидрометаллургический способ заключается в выщелачивании меди слабым раствором серной кислоты, а затем выделении металлической меди непосредственно из раствора. Такой способ применяется для переработки бедных руд и не допускает попутного извлечения драгоценных металлов вместе с медью.

Применение меди
Благодаря ценным качествам медь и медные сплавы используются в электротехнической и электромашиностроительной отрасли, в радиоэлектронике и приборостроении. Существуют сплавы меди с такими металлами, как цинк, олово, алюминий, никель, титан, серебро, золото. Реже применяются сплавы с неметаллами: фосфором, серой, кислородом. Выделяют две группы медных сплавов: латуни (сплавы с цинком) и бронзы (сплавы с другими элементами).
Медь обладает высокой экологичностью, что допускает её использование в строительстве жилых домов. К примеру, медная кровля за счёт антикоррозионных свойств, может прослужить больше ста лет без специального ухода и покраски.
Медь в сплавах с золотом используется в ювелирном деле. Такой сплав увеличивает прочность изделия, повышает стойкость к деформированию и истиранию.
Для соединений меди характерна высокая биологическая активность. В растениях медь принимает участие в синтезе хлорофилла. Поэтому её можно увидеть в составе минеральных удобрений. Недостаток меди в организме человека может вызвать ухудшение состава крови. Она есть в составе многих продуктов питания. К примеру, этот металл содержится в молоке. Однако важно помнить, что избыток соединений меди может вызвать отравление. Именно поэтому нельзя готовить пищу в медной посуде. Во время кипячения в пищу может попасть большое количество меди. Если же посуда внутри покрыта слоем олова, то опасности отравления нет.
В медицине медь используют, как антисептическое и вяжущее средство. Она является компонентом глазных капель от конъюнктивита и растворов от ожогов.
«Купрум» — большое медиа о медицине и качестве жизни. Научно и просто
Чтобы вопросы о здоровье нестрашно было гуглить.
Привет! Меня зовут Алена Буренина, и я со своей командой развиваю издание «Купрум» в «Севергрупп Медицина». Мы хотим сделать такое медиа о здоровье, где люди могли бы спокойно доверять информации из интернета. В статье рассказываю, как мы идем к своей цели.
Что мы задумали
«Купрум» — это большое медиа о здоровье и медицине, которое будет писать научно и просто о том, с чем сталкивается каждый. Мы хотим сделать глобальный информационный справочник о медицине и здоровье именно на русском. Дать возможность тем, кто не знает английского, читать проверенную информацию на родном языке.
Сейчас мы начали работу и общение с подписчиками в соцсетях: в Instagram, Telegram и «ВКонтакте», а в июле официально запустим веб-версию.
Но сначала протестировали идею: запустили блог на сайте клиники
Мы решили попробовать переводить с медицинского на человеческий и в прошлом году запустили блог, где рассматриваем самые актуальные вопросы здоровья, отношения с телом, взаимодействия с врачами.
Блог развивали на сайте сети клиник «Скандинавия», которая принадлежит компании «Севергрупп Медицина».
Медь (Cu, Cuprum) — влияние на организм, польза и вред, описание
История меди
Медь называют одним из первых металлов, которые человек освоил в древности и пользуется им до сегодняшнего дня. Добыча меди была доступной, потому что руду необходимо было плавить при сравнительно невысокой температуре. Первой рудой, из которой стали добывать медь, была малахитовая руда (calorizator). Каменный век в истории человечества сменился именно медным, когда предметы быта, орудия труда и оружие из меди получили самое широкое распространение.
Общая характеристика меди
Медь является элементом XI группы IV периода периодической системы химических элементов Д.И. Менделеева, имеет атомный номер 29 и атомную массу 63,546. Принятое обозначение – Cu (от латинского Cuprum).

Нахождение в природе
Медь достаточно широко представлена в земной коре, в осадочных породах, в водах морских и пресных водоёмах, в сланцах. Распространена как в виде соединений, так и в самостоятельном варианте.
Физические и химические свойства
Медь является пластичным, так называемым переходным металлом, имеет золотисто-розовый цвет. При контакте с воздухом на поверхности меди образуется оксидная плёнка, придающая металлу желтовато-красный оттенок. Известны основные сплавы меди – с цинком (латунь), с оловом (бронза), с никелем (мельхиор).
Суточная потребность в меди
Потребность в меди у взрослого человека составляет 2 мг в день (около 0,035 мг/ 1 кг веса).
Продукты питания богатые медью
Медь – один из самых важных микроэлементов для организма, поэтому продукты питания, богатые медью, должны быть в рационе каждого. Это:
Признаки нехватки меди
Признаками недостаточного количества меди в организме служат: анемия и ухудшение дыхания, потеря аппетита, расстройства желудка, нервозность, депрессивные состояния, быстрая утомляемость, нарушения пигментации кожи и волос, ломкость и выпадение волос, сыпи на кожных покровах, частые инфекции. Возможны внутренние кровотечения.
Признаки избытка меди
Переизбыток меди характеризуется бессонницей, нарушениями мозговой активности, эпилепсией, проблемами с менструальным циклом.
Взаимодействия с другими
Предполагается, что медь и цинк конкурируют друг с другом в процессе усваивания в пищеварительном тракте, поэтому избыток одного из этих элементов в пище может вызвать недостаток другого элемента.
Применение меди в жизни
Медь имеет огромное значение в народном хозяйстве, её основное применение – электротехника, но металл широко используется для чеканки монет, часто – в произведениях искусства. Медь также используется в медицине, архитектуре и строительстве.

Полезные свойства меди и его влияние на организм
Требуется для превращения железа организма в гемоглобин. Делает возможным использование аминокислоты тирозин, позволяя ей проявлять свое действие как фактору пигментации волос и кожи. После усваивания меди кишечником она транспортируется к печени с помощью альбумина. Медь также участвует в процессах роста и размножения. Принимает участие в образовании коллагена и эластина и синтезе эндорфинов – гормонов «счастья».
Автор: Виктория Н. (специально для Calorizator.ru)
Копирование данной статьи целиком или частично запрещено.
Медь (Cu, Cuprum) — влияние на организм, польза и вред, описание
История меди
Медь называют одним из первых металлов, которые человек освоил в древности и пользуется им до сегодняшнего дня. Добыча меди была доступной, потому что руду необходимо было плавить при сравнительно невысокой температуре. Первой рудой, из которой стали добывать медь, была малахитовая руда (calorizator). Каменный век в истории человечества сменился именно медным, когда предметы быта, орудия труда и оружие из меди получили самое широкое распространение.
Общая характеристика меди
Медь является элементом XI группы IV периода периодической системы химических элементов Д.И. Менделеева, имеет атомный номер 29 и атомную массу 63,546. Принятое обозначение – Cu (от латинского Cuprum).
Нахождение в природе
Медь достаточно широко представлена в земной коре, в осадочных породах, в водах морских и пресных водоёмах, в сланцах. Распространена как в виде соединений, так и в самостоятельном варианте.
Физические и химические свойства
Медь является пластичным, так называемым переходным металлом, имеет золотисто-розовый цвет. При контакте с воздухом на поверхности меди образуется оксидная плёнка, придающая металлу желтовато-красный оттенок. Известны основные сплавы меди – с цинком (латунь), с оловом (бронза), с никелем (мельхиор).
Суточная потребность в меди
Потребность в меди у взрослого человека составляет 2 мг в день (около 0,035 мг/ 1 кг веса).
Продукты питания богатые медью
Медь – один из самых важных микроэлементов для организма, поэтому продукты питания, богатые медью, должны быть в рационе каждого. Это:
Признаки нехватки меди
Признаками недостаточного количества меди в организме служат: анемия и ухудшение дыхания, потеря аппетита, расстройства желудка, нервозность, депрессивные состояния, быстрая утомляемость, нарушения пигментации кожи и волос, ломкость и выпадение волос, сыпи на кожных покровах, частые инфекции. Возможны внутренние кровотечения.
Признаки избытка меди
Переизбыток меди характеризуется бессонницей, нарушениями мозговой активности, эпилепсией, проблемами с менструальным циклом.
Взаимодействия с другими
Предполагается, что медь и цинк конкурируют друг с другом в процессе усваивания в пищеварительном тракте, поэтому избыток одного из этих элементов в пище может вызвать недостаток другого элемента.
Применение меди в жизни
Медь имеет огромное значение в народном хозяйстве, её основное применение – электротехника, но металл широко используется для чеканки монет, часто – в произведениях искусства. Медь также используется в медицине, архитектуре и строительстве.
Полезные свойства меди и его влияние на организм
Требуется для превращения железа организма в гемоглобин. Делает возможным использование аминокислоты тирозин, позволяя ей проявлять свое действие как фактору пигментации волос и кожи. После усваивания меди кишечником она транспортируется к печени с помощью альбумина. Медь также участвует в процессах роста и размножения. Принимает участие в образовании коллагена и эластина и синтезе эндорфинов – гормонов «счастья».
Автор: Виктория Н. (специально для Calorizator.ru)
Копирование данной статьи целиком или частично запрещено.
Медь (Cuprum) — Знаешь как
Медь
 Ат. вес 63,54. Медь встречается в природе в самородном состоянии, но главным образом в виде соединений. Важнейшие минералы, входящие в состав медных руд: халькозин, или медный блеск, Cu2S; халькопирит, или медный колчедан, CuFeS2; куприт Cu2О и малахит СuСО3 • Сu(ОН)2. По характеру соединений, образующих медные руды, последние подразделяют на окисленные и сульфидные. Сульфидные руды имеют наибольшее значение, поскольку из них выплавляется 80% всей добываемой меди. Общее содержание меди в земной коре сравнительно невелико (0,01 весовых процента), но она чаще, чем другие металлы, встречается в самородном состоянии, причем самородки меди достигают значительной величины. Этим, а также сравнительной легкостью обработки меди объясняется то, что она ранее других металлов была использована человеком для изготовления орудий и предметов обихода.
Ат. вес 63,54. Медь встречается в природе в самородном состоянии, но главным образом в виде соединений. Важнейшие минералы, входящие в состав медных руд: халькозин, или медный блеск, Cu2S; халькопирит, или медный колчедан, CuFeS2; куприт Cu2О и малахит СuСО3 • Сu(ОН)2. По характеру соединений, образующих медные руды, последние подразделяют на окисленные и сульфидные. Сульфидные руды имеют наибольшее значение, поскольку из них выплавляется 80% всей добываемой меди. Общее содержание меди в земной коре сравнительно невелико (0,01 весовых процента), но она чаще, чем другие металлы, встречается в самородном состоянии, причем самородки меди достигают значительной величины. Этим, а также сравнительной легкостью обработки меди объясняется то, что она ранее других металлов была использована человеком для изготовления орудий и предметов обихода.
В настоящее время медь добывают только из руд. По выплавке меди первое место среди капиталистических стран занимают США. Значительные количества меди добываются также в Чили, Северной Родезии, Канаде и в Бельгийском Конго. В 1957 г. общая выплавка меди из руд составила, только в капиталистических странах, 3 млн. т.
В России годовая выплавка меди в середине XIX в. составляла 6,5 тыс. г, а к 1913 г. — 34 тыс. т.В годы индустриализации наша медная промышленность быстро развивалась. Особенно сильно увеличилась выплавка меди в течение послевоенных пятилеток.
В СНГ богатые месторождения медных руд находятся на Урале, в Казахстане и в Закавказье. В Казахстане в 1928 г. было открыто одно из самих крупных в мире месторождений меди — Коунрадское месторождение у озера Балхаш.
Медные руды, как правило, содержат такое количество примесей, что непосредственное получение из них меди экономически невыгодно. Поэтому в металлургии меди особенно важную роль играет флотационный способ обогащения руд, позволяющий использовать руды с очень небольшим содержанием меди.
Из окисленных руд медь получают обычным способом — восстановлением руды углем. Обработка же сульфидных руд, особенно содержащих железо, гораздо сложнее. В этом случае руду сперва подвергают неполному обжигу, чтобы удалить часть серы в виде SO2 и превратить содержащийся в руде сульфид железа в закись железа FeO. Выделяющийся сернистый газ обычно используют для производства серной кислоты или для переработки на серу.
Обожженную руду сплавляют в шахтных или отражательных печах с кремнеземом и коксом. При этом большая часть железа переходит в шлак в виде FeSiО3, медь же превращается в сульфид Cu2S, который вместе с остающимся еще в руде сульфидом железа образует штейн, собирающийся на дне печи под слоем шлака.
Дальнейшая обработка штейна с целью удаления из него оставшегося железа ведется в конверторах, сходных с конверторами, применяемыми при выплавке стали . Сквозь находящийся в конверторе расплавленный штейн, к которому добавлено необходимое количество песка, продувают воздух или, что более эффективно, кислород.
Химические процессы, происходящие в конверторе, довольно сложны. Находящийся в штейне сульфид железа превращается в закись железа и удаляется в виде силиката в шлаке.
2FeS + 3О2 = 2РеО + 2SО2 2FeO + 2SiО2 = 2FeSiО3
Медь восстанавливается до металла. При этом, вероятно, происходят следующие реакции:
2Cu2S + 3О2 = 2Cu2О + 2SО2 2Cu2О + Cu2S = 6Cu + SО2
Выделяющееся при этих реакциях тепло поддерживает в конверторе тем-пературу 1100—1200° и делает излишним расход топлива.
Вдувание воздуха продолжают до тех пор, пока не восстановится вся медь, о чем можно судить по характеру вырывающегося из конвертора пламени. Расплавленную медь выпускают из конвертора в песчаные формы, где она и застывает в виде толстых пластин.
Руды, содержащие менее 0,5% меди, подвергают гидрометаллургической переработке .
Полученная выплавкой из руды сырая или черновая медь содержит еще от 2 до 3% различных примесей (цинк, никель, железо, свинец, серебро, золото и др.) и нуждается в дальнейшей очистке, или рафинировании, что производят либо так называемым сухим путем, либо с помощью электролиза.
При рафинировании сухим путем черновую медь сплавляют в токе воздуха. Часть меди окисляется до Cu2О, растворяющейся в расплавленной меди и отдающей свой кислород на окисление примесей неблагородных металлов. Избыток образовавшейся Cu2О восстанавливают путем введения в расплавленную массу дерева или угля. В результате получается рафинированная медь, содержащая всего около 0,5% примесей и идущая на изготовление бронз, латуней и других сплавов.
Для некоторых целей и прежде всего для изготовления электрических проводов требуется медь высокой степени чистоты, так как даже незначительное количество примесей посторонних веществ сильно понижает электропроводность меди, чем вызывается бесполезная трата электрической энергии при передаче ее по проводам. Весьма чистая медь получается из сырой меди путем электролиза.
При электролитическом рафинировании меди толстые пластины сырой меди подвешивают в ванне, содержащей раствор медного купороса, и соединяют с анодом источника тока. Катодом служат тонкие пластины чистой меди, расположенные в промежутках между анодными пластинами и покрытые графитом, благодаря чему отложившаяся при электролизе медь легко от них отделяется. Электролиз ведется при очень низком напряжении тока, не превышающем 0,4 вольта. В этих условиях с анода в раствор переходят только ионы меди и тех металлов, которые стоят впереди меди в ряду напряжений (например: цинка, железа, никеля). Все же остальные примеси, содержащиеся в сырой меди, выпадают на дно ванны в виде осадка, называемого анодным шламом. У катода ввиду низкого напряжения тока разряжаются только ионы меди, и таким образом катод покрывается чистой медью. Из анодного шлама добывают серебро, золото, селен и другие ценные вещества, стоимость которых часто окупает все расходы производства.
Чистая медь — тягучий вязкий металл светлорозового цвета, легко прокатываемый в тонкие листы. Удельный вес меди 8,9, темп. пл. 1083,2°. Медь очень хорошо проводит тепло и электрический ток, уступая в этом отношении только серебру. В сухом воздухе медь почти не изменяется, так как образующаяся на ее поверхности тончайшая пленка окислов (придающая меди более темный цвет) служит хорошей защитой от дальнейшего окисления, но в присутствии влаги и углекислого газа поверхность меди покрывается зеленоватым налетом основного карбоната меди Сu2(ОН)2СО3. При нагревании на воздухе медь превращается в черную окись меди, которая при более высокой температуре разлагается, теряя кислород и переходя в закись меди Cu2О.
Ввиду высокой тепло- и электропроводности, ковкости, хороших литейных качеств, большого сопротивления на разрыв и стойкости к коррозии медь широко используется в промышленности, занимая по масштабу своего применения первое место среди металлов после железа.
Огромные количества чистой электролитической меди (около 40% всей добываемой меди) идут на изготовление электрических проводов и кабелей. Из более или менее чистой меди выделывают различную заводскую аппаратуру: котлы, чаны для выпаривания, перегонные кубы и т. п. Широкое применение в машиностроительной промышленности, а также в электротехнике и других производствах имеют различные сплавы, содержащие медь в комбинации с другими металлами. Важнейшими из них являются: латуни (сплавы меди с цинком), бронзы (сплавы меди с оловом), нейзильбер (65% меди, 20% цинка и 15% никеля) и мельхиор (80% меди и 20% никеля), похожие по внешнему виду на серебро, константан (60% меди и 40% никеля), применяемый в магазинах сопротивлений и термоэлементах, и многие другие.
В химическом отношении медь является малоактивным металлом, хотя и соединяется непосредственно с кислородом, серой, галогенами и некоторыми другими элементами.
Стоя в ряду напряжений позади водорода, медь не вытесняет его из кислот, Поэтому соляная и разбавленная серная кислоты сами по себе не действуют на медь. Однако в присутствии кислорода воздуха медь растворяется в них с образованием соответствующих солей:
2Cu + 4НСl + O2 = 2СuСl2 + 2Н2O
Можно представить, что эта реакция идет в две стадии: сначала кислород окисляет медь в окись меди, а затем окись меди, как и всякий основной окисел, взаимодействует с соляной кислотой с образованием соли и воды. В таких условиях даже самые слабые кислоты могут постепенно растворять медь. Очень легко растворяется медь в азотной кислоте и в концентрированной серной кислоте при нагревании.
Все летучие соединения меди окрашивают несветящее пламя газовой горелки в синий или зеленый цвет.
Медь образует два ряда соединений, являющихся соответственно производными двух окислов: закиси меди Сu2О и окиси меди СuО. В первом ряду соединений медь одновалентна, во втором — двухвалентна. Соединения одновалентной меди в общем менее устойчивы, чем соединения двухвалентной меди, и не имеют большого практического значения.
Соединения одновалентной меди. Закись меди Сu2О встречается в природе в виде красной медной руды, или куприта. Искусственно она может быть получена путем нагревания раствора соли двухвалентной меди со щелочью и каким-нибудь сильным восстановителем, например формалином или виноградным сахаром. Сперва появляется желтый осадок, относительно которого еще не установлено, является ли он гидратом закиси меди СuОН или аморфным гелем закиси меди; при более сильном нагревании осадок переходит в красную закись меди.
Закись меди получается также при сильном накаливании меди на воздухе. Образующаяся первоначально черная окись меди при температуре около 800° разлагается, превращаясь в красную закись меди.
При действии на закись меди соляной кислоты получается бесцветный раствор хлористой меди CuCl. Если влить этот раствор в воду, то хлористая медь выпадает в виде белого творожистого осадка, нерастворимого в воде. Она может быть получена также кипячением раствора СuСl2 с соляной кислотой и медными стружками:
CuCl2 + Сu = 2СuСl
Отметим еще очень устойчивое соединение одновалентной меди — полусернистую медь Cu2S, образующуюся при непосредственном соединении меди с серой.
Соединения двухвалентной меди. Окись меди СuО — черное вещество, приготовляемое обычно путем нагревания на воздухе медных обрезков, стружек или опилок до температуры красного каления. Она легко может быть получена также прокаливанием некоторых солей меди, например: основного карбоната меди (II) Cu2(OH)2CO3 или нитрата меди (II) Сu(NO3)2. Окись меди является довольно энергичным окислителем. При нагревании с различными органическими веществами окись меди окисляет их, превращая углерод в углекислый газ, а водород — в воду, причем сама восстанавливается в металлическую медь. Этой реакцией широко пользуются при так называемом элементарном анализе органических веществ дли определения содержания в них углерода и водорода.
Гидрат окиси меди Сu(ОН)2 осаждается из растворов солей окиси меди при действии щелочей в виде голубой студенистой
массы. Уже при слабом нагревании даже под водой он разлагается, превращаясь в черную окись меди. Гидрат окиси меди — очень слабое основание. Поэтому растворы солей двухвалентной меди в большинстве случаев имеют кислую реакцию, а со слабыми кислотами медь образует основные соли.
Важнейшими из солей двухвалентной меди являются следующие:
1. Сульфат меди (II), или сернокислая медь CuSO4. В безводном состоянии представляет собой белый порошок, который? при поглощении воды синеет и поэтому часто применяется для обнаруживания следов влаги в различных органических жидкостях. Водный раствор сульфата меди имеет характерный сине-голубой цвет. Эта окраска свойственна гидратированным ионам [Сu(Н2O)4]••, поэтому такую же окраску имеют все разбавленные растворы солей двухвалентной меди, если только они не содержат каких-либо окрашенных анионов. Из водных растворов сульфат меди кристаллизуется с пятью молекулами воды, образуя прозрачные синие кристаллы триклинической системы. В таком виде он называется медным купоросом.
Медный купорос получают растворением медных отбросов или в горячей концентрированной серной кислоте, или в теплой разбавленной серной кислоте при свободном доступе кислорода. Применяется медный купорос для покрытия металлов медью, для приготовления некоторых минеральных красок, как средство борьбы с вредителями растений в сельском хозяйстве.
2. Хлорид меди (II), или хлорная медь СuСl2 • 2Н2O. Обра- зует темнозеленые кристаллы, легко растворимые в воде. Получается обычно растворен ней основного карбоната меди в соляной кислоте. Очень концентрированные растворы СuСl2 имеют зеленый цвет, разбавленные, как обычно, — сине-голубой. Хлорид
меди (II) окрашивает бесцветное пламя газовой горелки в интенсивный зеленый цвет.
3. Нитрат меди (II), или азотнокислая медь Сu(NO3)2 • 3Н2О. Получается при растворении меди в азотной кислоте. Синие кристаллы нитрата меди при нагревании сперва теряют’воду, а затем легко разлагаются с выделением кислорода и бурых окислов азота, переходя в черную окись меди. Применяется для получения окиси меди, а также для приготовления некоторых красок.
4. Основной карбонат меди (II) Сu2(ОН)2СОз. Встречается в природе в виде минерала малахита, имеющего красивый изум-рудио-зеленый цвет. Искусственно приготовляется действием соды на растворы солей двухвалентной меди,
2CuSO4 + 2Na2CO3 + Н2O = ↓ Cu2(OH)2CO3 + 2Na2SО4 + CО2
Применяется для получения хлорной меди, для приготовления синих и зеленых минеральных красок, а также в пиротехнике.
5. Ацетат меди, или уксуснокислая медь Сu(СН3СОО)2 • Н2О. Получается обработкой металлической меди или окиси меди уксусной кислотой. Продажный продукт обычно представляет собой смесь основных солей различного состава и цвета (зеленого и сине-зеленого). Под названием ярь-медянка применяется для приготовления масляной краски.
Двойная уксусно-мышьяковистокислая соль меди (так называемая «парижская зелень») Сu(СН3СОО)2 • Сu3(АsО3)2 применяется для уничтожения вредителей сельскохозяйственных культур.
Из солей меди вырабатывают большое количество минеральных красок, разнообразных по цвету: зеленых, синих, коричневых, фиолетовых и черных.
Все соли меди ядовиты, поэтому медную посуду лудят, т. е. покрывают изнутри слоем олова, чтобы предотвратить возможность образования медных солей.
Комплексные соединения меди. Чрезвычайно характерным свойством ионов двухвалентной меди является их способность соединяться с молекулами аммиака с образованием так называемых комплексных ионов.
Если к раствору сернокислой меди приливать раствор аммиака, то выпадает голубой осадок основной соли, который легко растворяется в избытке аммиака, окрашивая жидкость в интенсивный синий цвет. Прибавление щелочи к полученному раствору не вызывает образования осадка Сu(ОН)2; следовательно, в этом растворе или совсем нет ионов Сu••, или их так мало, что даже при большом количестве гидроксильных ионов не может быть достигнута величина произведения растворимости Сu(ОН)2. Отсюда можно заключить, что ионы меди вступают во взаимодействие с прибавленным аммиаком и образуют какие-то новые ионы, которые не дают нерастворимого соединения с ионами ОН’. В то же время ионы SO4» остаются неизмененными, так как опыт показывает, что прибавление к аммиачному раствору хлористого бария тотчас же вызывает образование осадка BaSO4 (характерная реакция на ион SO4«).
Исследованиями установлено, что темно-синяя окраска аммиачного раствора обусловлена присутствием в нем сложных. ионов [Cu(NH3)4]•• образовавшихся путем присоединения к иону меди четырех молекул аммиака. При испарении воды ионы [Cu(NH3)4]•• связываются с ионами SO4» и из раствора выделяются темно-синие кристаллы, состав которых выражается формулой [Сu(NH3) 4]SO4 • Н2O.
Таким образом, при взаимодействии сульфата меди (II) с аммиаком происходит реакция
CuSO4 + 4NH3 = [Cu(NH3)4]SO4
или в ионной форме
Cu•• + 4NH3 = [Cu(NH3)4]••
Ионы, которые, подобно [Сu(NH3)4]••, образуются путем присоединения к данному иону нейтральных молекул или других ионов, способных к самостоятельному существованию в растворах, называются комплексными ионами. Соли, в состав которых входят такие ионы, получили название комплексных солей. Известны также комплексные кислоты и комплексные основания, диссоциирующие в растворах с отщеплением комплексных ионов.
При написании формул комплексных соединений комплексный ион обычно заключают в квадратные скобки. Этим отмечается, что при растворении данного соединения в воде комплексный ион остается в растворе, не распадаясь на составные части.
Подобно сульфату меди (II), реагируют с аммиаком и другие соли двухвалентной меди. Во всех этих случаях получаются темно-синие растворы, содержащие комплексные ионы [Cu(NH3)4]••
Одновалентная медь дает с аммиаком бесцветные комплексные ионы состава [Cu(NH3)2]•.
Гидрат окиси меди тоже растворяется в аммиаке с образованием темно-синего раствора, содержащего ионы [Cu(NH3)4]•• и гидроксильные ионы:
Cu(OH)2 + 4NH3 = [Cu(NH3)4]•• + 2OН’
Получающийся раствор обладает способностью растворять клетчатку (вату, фильтровальную бумагу и т. п.) и применяется при изготовлении одного из видов искусственного волокна .
Гидрат окиси меди растворяется также в очень концентрированных растворах щелочей, образуя сине-фиолетовые растворы купритов — солей, содержащих комплексный ион [Сu(ОН)4]»:
Cu(OH)2 + 2NaOH ⇄ Na2[Cu(OH)4]
или в ионной форме
Cu(OH)2 + 2OН’ ⇄ [Сu(ОН)4]»
В отличие от аммиачных комплексов меди в этом случае ион Сu•• присоединяет к себе не электронейтральные молекулы, а четыре отрицательных иона ОН’, вследствие чего получаются комплексные анионы, а не катионы.
Куприты очень неустойчивы и при разбавлении щелочных растворов водой полностью разлагаются, снова выделяя гидрат окиси меди в осадок. Таким образом, хотя гидрат окиси меди, растворяясь в щелочах, и проявляет до некоторой степени кислотные свойства, но в очень слабой степени.
Из других комплексных анионов двухвалентной меди отметим еще ионы [CuCl4]», образующиеся в концентрированных растворах хлорной меди и обусловливающие их зеленую окраску:
CuCl2 + 2Cl’ ⇄ [CuCl4]»
При разбавлении растворов водой ионы [СuСl4]» превращаются в обычные гидратированные ионы меди [Сu(Н2O)4]•• и зеленая окраска растворов переходит в сине-голубую:
[CuCl4]» + 4Н2O = [Cu(H2O)4]•• + 4Сl»
210 211 212
Вы читаете, статья на тему Медь (Cuprum)
Купрум Металликум в гомеопатии — показания к применению, отзывы о Cuprum metallicum
Синонимы: Cuprum metallicum
Патогенез Купрум металликум описывал еще Ганеман в трактате по хроническим болезням. Препарат используют в гомеопатии и сегодня. Помимо чистой металлической меди активно применяют и уксуснокислую, и углекислую, и мышьяковистокислую нейтральную соль меди.
Чистую получить сложнее всего. Для этого проводят многократную кристаллизацию сернокислой меди, погружая ее одновременно с кусочком железа в раствор. В осадок выпадает именно чистая медь. Ее помещают непосредственно в соляную кислоту для удаления остатков железа, затем промывают, справляют с окисью буры и меди.
Содержание статьи
Воздействие на организм
Купрум металликум в настоящее время можно применять в гомеопатии. Однако, следует понимать, что прием меди зачастую сопровождается спазмами и судорогами по телу, которые начинаются от пальцев рук. Человек ощущает чрезмерную утомляемость, слабость. Болевые ощущения локализуются слева. Возникает сильнейшая тошнота, давит в желудке, непроизвольно сгибаются большие пальцы рук.
Даже разовый прием медной соли провоцирует сильнейшее расстройство желудка, начинается рвота. Рвотные массы отличаются характерной голубой или зеленой окраской. Это зависит от разновидности проглоченной соли. В некоторых случаях в рвоте видны полоски крови. Пациенту не дает покоя привкус меди во рту. Причем, это ощущение не проходит в течение нескольких дней. Состояние сопровождается обильным слюнотечением.
В ротовой полости, в пищеводе и в животе возникают острейшие боли. Выраженные колики сопровождаются слизистым, резко кровянистым поносом. В некоторых случаях все это дополняется нервными симптомами. В основном, они проявляются судорогами нижних конечностей. В течение нескольких дней у пациента развивается токсический нефрит. В результате моча выделяется незначительно. В ней содержится белок, а также эпителиальные цилиндры. Красящего вещества крови или самой крови не видно, хоть моча может стать темной.
Зачастую на второй-третий день возникает желтуха. Это обусловлено тем, что Купрум металликум попросту рушит красные кровяные тельца. В некоторых случаях специалисты обнаруживают в моче гемоглобин и гематин. При благополучном исходе такого отравления, начинается медленное выздоровление, хотя зачастую долгое время пациенту не дает покоя диспепсия с поносами, которые сменяются запорами.
Бывают ситуации, когда при выздоровлении констатируют дрожания и параличи. Они могут тянутся до нескольких лет. При вскрытии у пациента в желудке обнаруживают явления гастрита. В кишках — язвы и гиперемия. Больше всего страдает прямая кишка. Равным образом отмечается набухание и гипертрофия Пейеровых бляшек. Участки атрофии стенок всех кишок ограничиваются. Это зависит от степени выделения яда непосредственно через слизистую кишок. Страдает и пищеварительный тракт. Профессиональное отравление по симптоматике уступает интоксикации свинцом или мышьяком.
Например, считается, что свинец способен больше навредить, а вот медь — лишь пугает. Во всяком случае этого мнения придерживается Бушара. Однко, рабочие, которые долгие годы вдыхают на заводах пыль медных солей, все-таки страдают приступами так называемой медной колики. Их мучают гастралгии и расстройства пищеварения. Со временем рабочие заметно теряют силы, худеют, кашляют, ночью им не дает покоя повышенное выделение пота. Такие люди внешне становятся похожими на туберкулезных. Однако при выслушивании их легкие вполне здоровы. Зубы со временем обнажаются.
Показания к применению
В гомеопатии Купрум металликум применяют прежде всего при спазмах и судорожных симптомах. Практика показала, что для облегчения дискомфорта именно чистая медь считается лучшим средством. Она способна в кратчайшие сроки облегчить состояние пациента. Купрум металликум в большинстве случаев назначают при следующих показаниях:
- Астма, приступы которой прерываются безудержной рвотой;
- Эпилепсия с криками, схожим на “кваканье лягушки” и ночные припадки;
- Судороги, вызванные испугом матери или ребенка;
- Непрерывный продолжительный кашель;
- Мышечные судороги, возникающие при холере;
- Трудности с прорезыванием зубов у малыша;
- Сильное истощение организма, которое приводит к выраженной недостаточности каких-либо психических или физических реакций;
- Зеленый понос у ребенка;
- Бессонница или одышка, возникающая при хроническом аортите;
- Колики, спровоцированные воспалительными или нервными симптомами.
Однако важно понимать, что опасность передозировки достаточно велика. Поэтому курс лечения и количество соответствующего вещества должен назначить опытный гомеопат. Прежде чем начать прием Купрум металликум пациент обязан изучить инструкцию.
Важно понимать, что вышеописанное средство назначают не так уж часто. И главным гомеопатическим назначением препарата является наличие выраженных судорог и спазмов, которые могут возникать при менингите, судорогах, хорее, эпилепсии, астме, коклюше. Судороги бывают клоническими или тоническими, общими или местными. Они могут выражаться затруднением дыхания или спазматическим кашлем. Этот нюанс немаловажно учесть.
Так при коклюше преобладают именно судорожные симптомы. Человек краснеет, у него слезятся глаза. Купрум металликум подходит, если спазматическая форма резко выражена, заметны спазматические сокращения и сжимание кистей. Если же медь не дает результата, назначают другой вариант. Как правило, это Купрум ацетикум.
Приступы астмы тоже не всегда являются показанием к применению вышеописанного средства. Как правило, Купрум металликум рекомендуют, если выраженные приступы периодически прерывает непроизвольная рвота. Отдельного внимания заслуживает эпилепсия. Ее проявления обусловлены сжиманием гортани и глотки. Это провоцирует характерный квакающий звук. Ночные приступы могут начать с ног, поднимаясь к животу. Причем, пронзительный крик зачастую предшествует моментальной слепоте. О начале судорог, требующих использования Купрум металликум, сигнализирует большой согнутый палец судорожно сжатой руки.
Следует также упомянуть о кашле. Наличие непрерывных, продолжительных приступов нельзя игнорировать. Купрум металликум могут назначать при осложненном прорезывании зубов у малышей, но есть одна важная поправка. Данный препарат подойдет, если не помогла даже белладонна.
У людей, которые истощены психически и физически, при частой бессоннице замедляется реакция. Купрум металликум в этом плане позволяет решить проблему. Не стоит забывать и про колики, требующие вмешательства вышеупомянутым препаратом. Они представляют собой воспалительные и нервные симптомы. Живот становится крепким, словно камень. Изначально у пациента наблюдается упорный запор. Но вот после этого проявляется кровянистый, зеленоватый, водянистый понос. Рвота спазмолитического характера не дает покоя. Такую симптоматику недопустимо игнорировать.
Дозировки препарата
Как правило, Купрум металликум применяют в высоких разведениях, то есть один к тридцати или один к двенадцати. Однако использовать такой подход можно лишь по назначению опытного гомеопата. Самолечение средством недопустимо. Более того, оно опасно для жизни пациента. Даже незначительное превышение дозировки чревато жуткими последствиями для организма.
Купрум металликум может быть представлен и в форме гомеопатических гранул. В большинстве случаев Купрум металликум употребляют по 8 гранул трижды в день до еды. Их рассасывают под языком. Продолжительность использования может быть от трех до четырех недель, затем требуются поддерживающие курсы. Кратность приема и точные дозировки в каждому из случаев нужно согласовывать с врачом.
Взаимодействие с другими медикаментами
Производитель допускает применение Купрум металликум в составе комбинированной терапевтической схемы, его можно сочетать с другими лекарствами. Однако, кратность приема, точные дозировки и продолжительность использования выбранных препаратов в каждом из случаев целесообразно согласовать с лечащим врачом. Грамотный специалист после точной постановки диагноза и тщательного обследования пациента подберет оптимальную терапевтическую схему, которая даст результат и избавит от выявленной проблемы со здоровьем.
Конституционный тип
Специалисты сходятся в однозначном мнении, что типу меди соответствуют общительные, энергичные и много работающие люди. При физическом или психическом перенапряжении их порой одолевает высокая утомляемость, меланхолия, слабость. Характерна также пугливость, пробуждение ночью от беспокоящих снов.
Заболевания у таких людей, как правило, начинают охватывать левую сторону. Возникает склонность к спазмам и судорогам. Они начинаются с пальцев ног и рук. Большие пальцы чрезмерно выгибаются даже в сильно сжатом кулаке. Пациент чувствует, словно на голову ему налили ледяной воды. На зубах возникает пурпурно-красная или серая полоска. Перед менструациями, в холодную или в слишком жаркую погоду состояние ухудшается. Улучшение наступает лишь от холодного питья и повышения давления.
Побочные действия
Такой гомеопатический монокомпонентный препарат может вызывать аллергические реакции. Более того, при его приеме ранее выявленная симптоматика нередко обостряется. В такой ситуации требуется перерыв в использовании на пять-семь дней. Если эффекта от приема Купрум металликум не наблюдается в течение первой недели приема, а побочные эффекты выражены, целесообразно поспешить в медучреждение. После обследования врач назначит симптоматическое лечение, а также дезинтоксикационную медикаментозную терапию.
Купрум металликум: противопоказания
Важно понимать, что такой препарат сложно назвать безопасным. Производитель акцентирует внимание пациентов на том, что Купрум металликум подойдет далеко не каждому. Применять препарат недопустимо при гиперчувствительности к активному веществу. Назначение Купрум металликум допускается только после тщательного обследования пациента.
Условия хранения
Производитель настоятельно рекомендует хранить препарат в оригинальной упаковке, подальше от детей, вдали от света. Температурный режим играет здесь особую роль. Нельзя допускать, чтобы температура помещения, в котором находится Купрум металликум, превышала 25°С.
Срок годности данного препарата составляет пять лет. По его истечению использовать Купрум металликум категорически запрещено.
Аналоги препарата
В качестве аналогов вместо Купрум металликум могут применять препараты из группы гомеопатических монокомпонентных средств. Как правило, это прутовидный эвкалипт, перечная мята, розовая родиола, птичий горец. Все они имеют свои особенности воздействия, противопоказания, побочные эффекты. Чтобы их избежать, требуется согласовать все нюансы с квалифицированным специалистом после постановки точного диагноза. Поэтому замену назначенных препаратов может осуществить лишь опытный врач.
Заключение экспертов
Специалисты сходятся во мнении, что существуют две базовые характеристики Купрум металликум, которые являются основным показанием при недугах, сопровождающихся спазматическими или судорожными симптомами. Но нельзя забывать и о главной, своеобразной характеристике — ощущению ледяной воды, которую вылили на голову. В некоторых случаях Купрум металликум действительно позволяет избавить пациента от выраженного дискомфорта, причем в кратчайшие сроки. Но использовать препарат самостоятельно недопустимо.
Отзывы
О гомеопатическом препарате Купрум металликум на форумах и тематических сайтах имеются нейтральные отзывы, так как отсутствует сильный эффект. Как отмечают пациенты, назначает лечение только специалист, так как нередко встречаются осложнения при из-за неправильного следования инструкции. Были описаны следующие осложнения: увеличение температуры, головная боль, тошнота или рвота.
Многие клиенты применяли лечение курсом в один месяц, затем следовал месячный перерыв. Пациенты также отмечают, что на астматический кашель и одышки препарат не влияет без дополнительного лечения, так как эффект слишком низкий. Но помогает препарат людям старше 40 лет, у которых часто случаются боли в суставах, а также судороги. Как это проявляется: судорога становится менее болезненной и проходит быстрее. Но не рекомендуют специалисты принимать средство людям, перенесшим серьезный инсульт, но на слабых типах заболевания врач может рекомендовать гомеопатический препарат. Люди, принимающие вещество с сильными антибиотиками отмечали незначительное изменение лекарственного воздействия, что характеризовалось бессонницей.

Материал подготовлен совместно с врачом-гомеопатом Галиевым Владимиром Алексеевичем и медиа-агентством Е-Медика.
Узнать больше об авторах можно по этой ссылке.
Что такое Cuprum Metallicum? (с иллюстрациями)
Cuprum metallicum или медь — это минерал, который часто используется в гомеопатических средствах. Считается, что он лечит широкий спектр симптомов, таких как спазмы, судороги, эмоциональное подавление, умственное истощение, проблемы с дыханием и сыпь. Он также используется в традиционном медицинском сообществе для лечения дефицита меди. Первоначально он использовался для лечения ран, но из-за боязни отравления медью он стал менее распространенным минеральным средством во многих гомеопатических и медицинских группах.
 Cuprum metallicum используется для облегчения судорог.
Cuprum metallicum используется для облегчения судорог.Красный минерал Cuprum metallicum, найденный в горных породах по всему миру, легко добывается.Помимо использования в качестве минерального средства, его также можно легировать для создания более твердых металлов, таких как бронза. Его также можно использовать для изготовления инструментов и он является важным элементом многих продуктов, таких как субпродукты, орехи, морепродукты и цельные зерна. При употреблении в пищу он может поддерживать рост костей, предотвращать остеопороз и повышать уровень меди в организме для основного обслуживания.
 Cuprum metallicum может использоваться для лечения психического истощения.
Cuprum metallicum может использоваться для лечения психического истощения.Практикующие гомеопаты могут рекомендовать своим пациентам принимать небольшие дозы Cuprum metallicum, особенно если они страдают артритом. Считается, что боли в суставах и подергивания мышц лучше контролировать, употребляя микродозы минерала.Другим пациентам, страдающим спазмами, тиками или заиканием, также можно прописать медные добавки. Некоторые практикующие используют его для очищения и детоксикации организма. Они считают, что употребление капсул из Cuprum metallicum очистит почки, печень, сердечно-сосудистую и лимфатическую системы.
 Небольшие дозы медного металла могут быть прописаны людям, страдающим артритом.
Небольшие дозы медного металла могут быть прописаны людям, страдающим артритом.Хотя Cuprum metallicum — хорошо известное спазмолитическое средство, многие врачи колеблются, прежде чем прописать минерал своим пациентам. Хроническое отравление меди может вызвать серьезные проблемы со здоровьем, такие как проблемы с глотанием пищи, диарея, колики и резкий кашель.Острое отравление медью еще хуже, вызывая паралич, судороги и, в конечном итоге, смерть.
 Cuprum metallicum может использоваться для облегчения проблем с дыханием.
Cuprum metallicum может использоваться для облегчения проблем с дыханием.Хотя изначально Cuprum metallicum использовался в виде мази, сегодня его обычно принимают в виде таблеток или капсул.Чтобы приготовить минерал, его сначала растирают с лактозным сахаром. Затем его снова и снова измельчают, пока он не превратится в мелкий порошок. Порошок обычно можно растворить в воде после завершения процесса измельчения. Затем его фильтруют, разбавляют и встряхивают или встряхивают до тех пор, пока не будет создана соответствующая смесь.
 Отравление медью может вызвать резкий кашель.
Отравление медью может вызвать резкий кашель.Как и в случае с любым лекарством или гомеопатическим средством, перед применением Cuprum metallicum следует проконсультироваться с врачом или практикующим гомеопатом. Людям с определенными заболеваниями, такими как болезнь Вильсона, токсикоз меди и цирроз, следует избегать его использования.Отравление медью — серьезный побочный эффект, к которому нельзя относиться легкомысленно. При подозрении на отравление медью следует немедленно обратиться к врачу.
 Cuprum metallicum, который встречается в горных породах по всему миру, легко добывается..
Cuprum metallicum, который встречается в горных породах по всему миру, легко добывается..Купрум — No Man’s Sky Wiki
| Тема этой статьи взята из обновления Foundation. Информация в этой статье актуальна по состоянию на 7 марта 2017 года. |
Тема этой статьи взята из обновления Foundation.
Информация в статье актуальна по состоянию на 7 марта 2017 года.
| Купрум | |
|---|---|
| Звездная система | Ехтинскив-Миас |
| Регион | Cakuapanyo |
| Луна (а) | 0 |
| Погода | Радиоактивный распад |
| Sentinels | Пассивный |
| Флора | Многочисленные |
| Фауна | Недостаток |
| Обнаружил | палеопарадокс |
| Фонд | |
| Купрум | |
|---|---|
| Звездная система | Ехтинскив-Миас |
| Регион | Cakuapanyo |
| Луна (а) | 0 |
| Погода | Радиоактивный распад |
| Sentinels | Пассивный |
| Флора | Многочисленные |
| Фауна | Недостаток |
| Обнаружил | палеопарадокс |
| Фонд | |
Купрум — планета в звездной системе Эхтинскив-Миас в версии для ПК Вселенной No Man’s Sky.
.определение Cuprum в медицинском словаре
медь
(Cu) копер химический элемент, атомный номер 29, атомная масса 63,54. (См. Приложение 6.) Он необходим для образования костей и крови, потому что он присутствует в нескольких окислительных ферментах, включая один, участвующий в превращении неорганического железа в гемоглобин. Существует небольшая опасность дефицита в обычных диетах из-за относительно большого количества и незначительных ежедневных потребностей. Избыток меди в организме может быть токсичным, вызывать рвоту, желтуху, гипотонию и иногда кому; это может происходить при чрезмерном потреблении медицинских солей меди или при метаболических состояниях, таких как синдром Менкеса или болезнь Вильсона.медь 67 радиоизотоп меди, атомная масса 67, с периодом полураспада 2,58 суток; используется в лучевой терапии, а также для визуализации, радиоизотопных кинетических исследований и дозиметрии.
медь · пер (Cu),
(копьер),Металлический элемент, атомный номер 29, атомный вес. 63,546; несколько его солей используются в медицине. Биоэлемент, содержащийся в ряде белков.
[Л. купрум, ориг. Cyprium, фр. Кипр, где была добыта]
медь
(kŏp′ər) n.Пластичный ковкий металлический элемент с атомным номером 29, который является компонентом различных ферментов, используется в его солевых формах как вяжущее, дезодорирующее и противогрибковое средство, радиоизотоп которого используется при сканировании мозга и для диагностики болезни Вильсона.
медь
БиохимияМеталлический элемент (атомный номер 29; атомный вес 63,56), который является важным микроэлементом, связанным с ключевыми метаболическими реакциями, включая абсорбцию и метаболизм железа, а также образование красных кровяных телец и нервов; он присутствует в моллюсках, мясных субпродуктах, орехах, бобовых и семенах.
Гомеопатия
Cuprum встретил, смотри там; Cuprum metallicum.
медь
Металлический элемент — атомный номер 29; атомный вес 63,56; это важный микроэлемент, необходимый в некоторых метаболических реакциях, например, в абсорбции и метаболизме железа, а также в образовании эритроцитов, нервовкоп · на
(Cu) (kop’ĕr)1. Металлический элемент, атомарный нет. 29, атомный вес. 63,546; несколько его солей используются в медицине.
2. Биоэлемент, содержащийся в ряде белков.
[Л. купрум, ориг. Cyprium, фр. Кипр, где добывалась]
коп · пер
(копьр)Металлический элемент; несколько его солей используются в медицине.
[Л. купрум, ориг. Cyprium, фр. Кипр, где добывали]
Обсуждение с пациентом меди
В. Где я могу добавить медь в свой рацион? У меня артрит, и недавно я услышал, что медь может уменьшить боль, откуда я могу добавить медь в свой рацион?
А. Устрицы и другие моллюски, цельные зерна, бобы, орехи, картофель и мясные субпродукты (почки, печень) являются хорошими источниками меди. Темно-листовая зелень, сухофрукты, такие как чернослив, какао, черный перец и дрожжи, также являются источниками меди в рационе. будьте осторожны в больших количествах, медь ядовита.
Больше обсуждений о меди .It’s Elemental — Элемент Медь
Что в названии? От латинского слова cuprum , что означает «с острова Кипр».
Сказать что? Медь произносится как КОП-эр .
Археологические данные свидетельствуют о том, что люди использовали медь как минимум 11000 лет. Относительно простые в добыче и переработке, люди открыли методы извлечения меди из руд по крайней мере 7000 лет назад. Римская империя добывала большую часть своей меди с острова Кипр, откуда и произошло название меди.Сегодня медь в основном получают из руд куприта (CuO 2 ), тенорита (CuO), малахита (CuO 3 · Cu (OH) 2 ), халькоцита (Cu 2 S), ковеллита (CuS ) и борнит (Cu 6 FeS 4 ). Крупные месторождения медной руды находятся в США, Чили, Замбии, Заире, Перу и Канаде.
Медь, которая в больших количествах используется в электротехнической промышленности в виде проволоки, уступает только серебру по электропроводности. Поскольку медь противостоит коррозии из-за воздуха, влаги и морской воды, она широко используется в производстве монет.Американские пенни, которые когда-то делались почти полностью из меди, теперь делают из цинка, покрытого медью. Медь также используется для изготовления водопроводных труб и украшений, а также других предметов.
Чистая медь обычно слишком мягкая для большинства применений. Люди впервые узнали около 5000 лет назад, что медь может быть усилена, если ее смешать с другими металлами. Два самых известных сплава меди — это бронза и латунь. Бронза, первый сплав, созданный людьми, представляет собой смесь меди, содержащую до 25% олова.Ранние люди использовали бронзу для изготовления инструментов, оружия, контейнеров и декоративных предметов. Латунь, смесь меди, содержащая от 5% до 45% цинка, была впервые использована около 2500 лет назад. Римляне первыми начали широко использовать латунь для изготовления монет, чайников и декоративных предметов. Сегодня латунь также используется в некоторых музыкальных инструментах, винтах и другом оборудовании, которое должно противостоять коррозии.
Гидратированный сульфат меди (CuSO 4 · H 2 O), также известный как голубой купорос, является наиболее известным соединением меди.Он используется как сельскохозяйственный яд, как альгицид при очистке воды и как синий пигмент для чернил. Хлорид меди (CuCl 2 ), еще одно соединение меди, используется для закрепления красителей на тканях. Хлорид меди (CuCl) — это ядовитый белый порошок, который в основном используется для поглощения диоксида углерода (CO 2 ). Цианид меди (CuCN) обычно используется в гальванике.
.

