Как покрыть медью металл в домашних условиях?
- Для чего это нужно?
- Сферы использования гальваностегии
- Гальваностегия электролитным раствором
- Гальваностегия другим способом
- Видеоматериал
Для того чтобы подготовить металлический предмет к дальнейшей обработке, его нужно покрыть медью — такой процесс называют гальваностегией. Принцип его действия заключается в осаждении на поверхность обрабатываемой детали из другого металла, который растворен подходящим средством. Из данной статьи вы узнаете, как покрыть медью металл в домашних условиях, чтобы реализовать все последующие свои задумки с заготовкой.
к содержанию ↑
Для чего это нужно?
Технология гальваностегии включает в себя создание раствора и образование различных электродов. Во время этого процесса медные ионы, которые растворены в электролите, притягиваются минусовым полюсом обрабатываемой детали на свою поверхностную точку.
Гальваностегия металлических деталей в промышленности применяется не только как завершающий обрабатывающий процесс. Она может применяться для того, чтобы подготовить детали к последующей операции (к примеру, хромированию, никелированию, серебрению каких-либо предметов).
В домашних условиях чаще всего проводится химическое меднение деталей. Также стоит заметить, что есть множество способов проведения такой процедуры, каждый из которых имеет свои преимущества и недостатки.
к содержанию ↑
Сферы использования гальваностегии
Покрывать медью металл в домашних условиях в последнее время стало очень полезно. Чаще всего к такой процедуре подходят в следующих целях:
- В декоративных. Например, таким способом состаривают различные детали для того, чтобы придать винтажный вид.
- В гальванопластике. Очень часто наносят медный слой на сувениры, ювелирные украшения.
- В отрасли техники. Это связано с низкой стоимостью омеднения.

- Для нанесения защитно-декоративной прослойки того или иного изделия.
- Для того чтобы реставрировать или восстанавливать какие-либо детали.
к содержанию ↑
Гальваностегия электролитным раствором
Таким способом можно покрыть медью сталь в домашних условиях, а также другие детали за исключением алюминия и цинка.
Для дальнейшей процедуры необходимо подготовить следующие материалы:
- Небольшие пластины из меди.
- Токопроводящая проволока (лучше запастись несколькими метрами).
- Источник тока, напряжение которого не должно быть более, чем 6 В.
- Реостат, чтобы регулировать ток.
- Амперметр.
- Электролит.
Важно! Последний компонент можно приобрести в специальном магазине, а можно и изготовить самостоятельно. Для этого нужно сделать раствор серной кислоты и дистиллированной воды при соотношении 2/100 мл. Нужный раствор получится, когда вы добавите к составу не больше 20 г медного купороса.

Суть работы заключается в следующем:
- Очистить обрабатываемую деталь наждачной бумагой — это нужно для того, чтобы снять оксидную пленку. Далее покрыть медью металл в домашних условиях будет не так трудно.
- Обезжирить металлическим предмет горячим раствором соды, промыть его чистой водой.
- В подходящую по объему емкость из стекла налить приготовленный электролит.
- Опустить в жидкость две пластины из меди на подготовленных токопроводящих проводках. Между двумя пластинками из меди подвешивается уже обезжиренная деталь на таком же проводке.
Важно! Проследите за тем, чтобы пластины из меди были полность погружены в электролит.
- Далее концы проводов от пластин из меди присоединяются к положительной клемме источника тока, а деталь — к отрицательной. Далее в созданную электросеть нужно подключить амперметр с реостатом. После того, как ток подключится к цепи, реостатом нужно установить его примерно 15 мА на 1 см площади детальной поверхности.

- Далее деталь выдерживается примерно 15-20 минут.
- По истечении времени нужно отключить электропитание и вытащить обрабатываемый металл из раствора.
В конечном итоге вы заметите, что смогли покрыть медью металл в домашних условиях, ведь он полностью покроется тонкой блестящей пленкой.
Важно! Толщина медного слоя будет зависеть от того, как долго была выдержана деталь в электролите.
к содержанию ↑
Гальваностегия другим способом
Данный способ отлично подойдет для металлов-исключений, что были названы ранее — цинка и алюминия.
Алгоритм работы:
- Вооружиться многожильным проводом из меди, снять изоляцию с обоих его концов.
- Растеребить мягкий провод с одной стороны, получив имитированную кисточку. Привязать к этому концу предмет, похожий на рукоятку.
- Противоположную сторону провода необходимо соединить к плюсовой клемме источника электротока.

Важно! Напряжение должно быть не более, чем 6 В.
- Подготовить электролит описанным выше способом, вылить его в широкую тару — это нужно для удобства макания туда “кисточки”.
- Положить внутрь подготовленной емкости небольшую деталь из металла. Соединить ее, используя при этом провод, к отрицательной клемме токового источника также с напряжением 6 В.
Важно! Деталь должна быть предварительно очищена и обезжирена.
- Процесс покрытия алюминия медью в домашних условиях заключается в следующем: кистообразный конец провода нужно промакивать электролитным раствором и проводить им по поверхности обрабатываемого металлического предмета, не касаясь его. Дальше — отрицательно заряженный металл притянет к себе медные ионы и ее поверхность приобретет медную пленку.
Важно! Следите за тем, чтобы между концом растеребленной проволоки и металла был маленький слой электролитного раствора (и катод, и анод обязательно должны быть смочены этим раствором).

- После того, как деталь приобретет нужный цвет, ее нужно тщательно высушить, после чего натереть до блеска.
к содержанию ↑
Видеоматериал
youtube.com/embed/51GucXrZUp8?feature=oembed» frameborder=»0″ allow=»autoplay; encrypted-media» allowfullscreen=»»>Покрыть тонкой медной пленкой можно практически каждую металлическую деталь, при этом она будет отлично защищена от нежелательных внешних факторов. О том, как покрыть медью металл самостоятельно, условиях вы узнали из данной статьи, и теперь сможете все сделать как положено.
Как в домашних условиях провести меднение металла
Содержание
- 1 Понятие процесса
- 2 В каких случаях применяется?
- 3 Особенности проведения в бытовых условиях
- 4 Требуемые материалы и оборудование
- 5 Различные типы меднения
- 5.1 Омеднение с помещением в электролит
- 5.2 Омеднение без помещения в раствор
- 6 Техника безопасности
Процесс омеднения поверхностей разнообразных металлов может проводиться не только как завершающая процедура металлообработки, но и как подготовка к последующей чистовой обработке. Технология, реализованная в промышленности, предполагает применение специализированного оборудования, растворов и умений. Но процедуру покрытия обмеднения металла возможно проводить и в быту. В этой статье разберем, как покрыть металл медью в домашних условиях, что для этого необходимо и какие существуют нюансы.
Технология, реализованная в промышленности, предполагает применение специализированного оборудования, растворов и умений. Но процедуру покрытия обмеднения металла возможно проводить и в быту. В этой статье разберем, как покрыть металл медью в домашних условиях, что для этого необходимо и какие существуют нюансы.
Содержание
- Понятие процесса
- В каких случаях применяется?
- Особенности проведения в бытовых условиях
- Требуемые материалы и оборудование
- Различные типы меднения
- Омеднение с помещением в электролит
- Омеднение без помещения в раствор
- Техника безопасности
Понятие процесса
Обмеднение — это процедура, при которой на поверхность предмета наносится незначительный слой меди. Обычно применяется гальванический способ, предполагающий перенесение медных ионов от положительного источника к отрицательному на обрабатываемые поверхности. Как правило, покрытие медью производят для последующего наложения никеля или хрома, но не редко эта процедура становится самостоятельной технологической операцией для завершающей отделки. Это активно применяемая гальванопластика, требующая создания медного покрытия.
Это активно применяемая гальванопластика, требующая создания медного покрытия.
В каких случаях применяется?
Можно выделить несколько ситуаций, в которых требуется меднение:
- Декорирование. С помощью технологии можно придавать поверхностям особый «состаренный» вид.
- Гальваническое обмеднение. Этот метод применяется при производстве копий определенный деталей из меди разнообразной формы и габаритов. Предполагается создание восковых или пластиковых основ, которые в последующем покрываются электролитами и медными слоями. Техника активно используется во время создания сувениров, ювелирных продуктов, декоров.
- Электротехника. Благодаря невысокой стоимости технология выгодно выделяется на фоне покрытия золотом или серебром. Омедненые элементы используются в качестве контактов или электродов.
Технология может совмещаться с разнообразными задачами при гальванизации:
- Во время создания многослойных декоров с незначительной защитой.
 Как правило, применяется медь совместно с хромом и никелем. Благодаря этому повышается уровень сцепления с основой поверхностью.
Как правило, применяется медь совместно с хромом и никелем. Благодаря этому повышается уровень сцепления с основой поверхностью. - В процессе формирования защиты определенных участков деталей при цементации.
- При реставрации. Восстанавливая детали омеднением, создаются промежуточные слои, служащие впоследствии базой для напыления более прочных хромированных и никелированных покрытий.
Особенности проведения в бытовых условиях
Гальваностегия – именно так называется процедура обмеднения изделий из металла. Ее суть в том, что обрабатываемый предмет погружается в электролит с осаженным медным купоросом. Не всем известно, что гальванизация может проводиться своими руками дома и при этом не потребуется специальных приспособлений и умений. Благодаря ей можно готовить поверхность к следующей стадии обработки или провести промежуточную стадию перед нанесением хрома, никеля или латуни.
Металл после такой обработки повышает свою устойчивость к агрессивным воздействиям.
В домашних условиях, как правило, проводится химическая гальванизация незначительных деталей, т.к. при этом не потребуются серьезные траты и дополнительные приспособления.
Требуемые материалы и оборудование
Для осуществления покрытия медным слоем следует заранее приготовить требуемую основу в виде материалов и оборудования. Обязательно требуется источник постоянного тока. Исходя из опыта и предпочтений, мастера рекомендуют использование различных диапазонов тока. Может использоваться «Крона» с напряжением 9 Вольт или КБС-Л с 4,5 Вольтами. Также подойдет автомобильная АКБ. Также добиться необходимого напряжения с помощью выпрямителя небольшой мощности.
Для размещения электролитического раствора нужно подготовить емкости. Подойдут стеклянные или пластиковые предметы подходящих размеров. Нужно учесть габариты заготовки, чтобы она поместилась в подготовленную емкость. При этом посуда должна выдержать нагрев более 80 градусов.
Кроме этого потребуются аноды, способные покрыть всю заготовку. Они необходимы для подачи электротока в электролит и растекания его по всей площади изделия.
Также потребуются химреактивы для подготовки электролитического раствора:
- Медный купорос.
- Соляная кислота.
- Дистиллированная вода.
После подготовки необходимой основы, можно начинать работу.
Различные типы меднения
Меднение в домашних условиях могут выполнять даже новички в этом направлении. Чтобы получить качественное покрытие необходимо изучить все нюансы процедуры. Она может проводиться по одной из 2 технологий:
- Погружение в электролит. Заготовка погружается в жидкость и подается электроток. Обычно, используется в тех ситуациях, когда ее габариты не значительны.
- Без погружения в раствор. Более сложный процесс, но позволяющий достигать лучшего качества обмедненных поверхностей.
Во всех случаях необходимо подведение электричества, которое активизирует вещество.
Оптимальный метод выбирается в соответствии с поставленной целью:
- Формирование защитных и декоративных покрытий. Зачастую происходит смешение с никелем, хромом и медью. Получаются прочные и надежные поверхности.
- Защита при цементировании.
- Реставрация изделий.
Рассмотрим подробнее каждый из вариантов.
Омеднение с помещением в электролит
Наиболее доступный способ обмеднения в быту. Необходимы:
- Небольшого размера пластинки из меди.
- Проволока для проведения тока.
- Источник тока.
- Устройство для регулирования и измерения тока.
Последовательность действий:
- Чтобы растворить медь используется обыкновенный электролит, свободно продающийся или легко готовящийся своими руками. Для приготовления следует делать смесь серной кислоты с дистиллированной водой в пропорциях 3 к 100 миллилитрам. Нужная смесь получается после добавления в него 20 г медного купороса.
- Деталь следует очистить щеткой и наждачкой, чтобы удалить оксидную пленку.

- Провести обезжиривание раствором соды и промыть.
- Подготовленная емкость заполняется электролитическим раствором.
- В емкости размещаются 2 пластинки, подключенные к токопроводящей проволоке. Меж ними помещается деталь, которой предполагается омеднение. Нужно проверить полное закрытие смесью и пластинок, и заготовки.
- Затем пластины подключаются к плюсовому полюсу источника, а заготовка садится на минус. Предварительно желательно подключать амперметр и реостат. Выставить диапазон тока до 15 мА на 1см2 площади поверхности изделия.
- Выдержать в течение 20 минут.
- Выключается питание, заготовка извлекается из раствора. В итоге получается тонкое покрытие из меди. Продолжительность процесса оказывает влияние на толщину напыления. Благодаря технологии можно добиваться слоя до 300 мкм и более.
Метод возможно применять для обновления алюминиевых вещей, используемых в быту. Например, столовая утварь из алюминия после омеднения обретет вторую молодость.
Омеднение без помещения в раствор
Метод не предполагает залитие детали жидкостью. Он прекрасно подходит обработки цинковых или алюминиевых изделий.
Последовательность действий:
- Необходим провод – многожильный, медный. Снять изоляцию. Одна сторона распушается, делая подобие кисточки. Можно сделать что-то вроде рукояти для большего комфорта в работе. Другой край провода подключается к положительному полюсу источника тока. Напряжение — не больше 6 Вольт.
- Вышеописанным методом подготавливается электролит с медным купоросом. Посуда может использоваться любого типа, но лучше подобрать ту, которая позволит беспроблемно погружать кисточку из провода. Обрабатываемая деталь очищается от загрязнений. После этого проводами садится на отрицательный полюс источника тока.
- Процедура проводится следующим образом. Распушенный край-кисточка время от времени помещается в раствор.
 Ей следует проводить вдоль заготовки, не прикасаясь к ней. Поверхность нужно смочить электролитическим раствором. Во время обработки за счет отрицательного заряда деталь будет подтягивать ионы меди, покрываясь ими.
Ей следует проводить вдоль заготовки, не прикасаясь к ней. Поверхность нужно смочить электролитическим раствором. Во время обработки за счет отрицательного заряда деталь будет подтягивать ионы меди, покрываясь ими.
Это меднение металла подойдет для габаритных вещей, которые затруднительно поместить в емкость.
Техника безопасности
Даже учитывая то, что гальваника и меднение доступны даже новичкам, про безопасность нужно помнить все время. В работе используются токсичные вещества, которые могут подвергаться значительному нагреву. Поэтому бдительность терять не стоит.
В первую очередь нужно придерживаться главного правила – работать в нежилых и отлично проветриваемых помещениях. Во-вторых, используемое в работе оборудование необходимо заземлять. В-третьих, несоблюдение личной безопасности чревато травмированием.
Чтобы обеспечить собственную защиту следует:
- Использовать респиратор.

- Работать в прорезиненных перчатках.
- Надевать специальную защитную одежду и обувь. Не лишним будет использование клеенчатого фартука.
- Защиту глаз обеспечить очками.
- Не употреблять еду и питье.
Рекомендуем внимательно изучить технологию на видео и после этого приступать к началу работ.
Добыча и переработка меди: переработка медных руд
Перейти к навигации
Просмотреть PDF Загрузить PowerPoint
Оксидные и сульфидные руды подвергаются различным процессам очистки до меди с чистотой 99,99%. Обработка меди — это сложный процесс, который начинается с добычи руды (менее 1% меди) и заканчивается получением листов меди с чистотой 99,99%, называемых катодами , которые в конечном итоге будут превращены в изделия для повседневного использования. Наиболее распространенные типы руд, оксид меди и сульфид меди подвергаются двум различным процессам, гидрометаллургии и пирометаллургии, соответственно, из-за различного химического состава руды.
Первые этапы переработки меди одинаковы для обеих руд: добыча и транспортировка. Добыча меди обычно осуществляется открытым способом , при котором ряд ступенчатых уступов выкапывается все глубже и глубже в землю с течением времени. Для извлечения руды используется буровое оборудование, которое просверливает отверстия в твердой породе, а взрывчатые вещества вставляются в отверстия для взрыва и разрушения породы. Полученные валуны готовы к транспортировке; специализированные самосвалы, конвейеры, поезда и вагоны-челноки могут использоваться для перевозки руды с места взрывных работ на место переработки. Размеры оборудования, необходимого для перевозки тонн и тонн руды, огромны. Затем большая часть руды проходит через первичную дробилку, которая обычно располагается очень близко к карьеру, а иногда и в нем. Эта первичная дробилка уменьшает размер руды от валунов до камней размером с мяч для гольфа.
Для извлечения руды используется буровое оборудование, которое просверливает отверстия в твердой породе, а взрывчатые вещества вставляются в отверстия для взрыва и разрушения породы. Полученные валуны готовы к транспортировке; специализированные самосвалы, конвейеры, поезда и вагоны-челноки могут использоваться для перевозки руды с места взрывных работ на место переработки. Размеры оборудования, необходимого для перевозки тонн и тонн руды, огромны. Затем большая часть руды проходит через первичную дробилку, которая обычно располагается очень близко к карьеру, а иногда и в нем. Эта первичная дробилка уменьшает размер руды от валунов до камней размером с мяч для гольфа.
A. Переработка оксидной руды
Оксидные руды обычно перерабатываются с использованием гидрометаллургии . В этом процессе используются водные растворы (на водной основе) для извлечения и очистки меди из руд оксида меди при обычных температурах, обычно в три этапа: кучное выщелачивание, экстракция растворителем и электролиз.
Кучное выщелачивание — это процесс использования перколяционных химических растворов для выщелачивания металлов. Кучное выщелачивание очень часто используется для руды с низким содержанием золота, которую в противном случае было бы нецелесообразно направлять на процесс измельчения. После добычи, транспортировки и дробления до размера гравия или мяча для гольфа дробленая руда складывается в кучу поверх непроницаемого слоя на небольшом уклоне. Выщелачивающий реагент (разбавленная серная кислота) разбрызгивается через разбрызгиватели на вершине отвала и просачивается вниз через отвал, где он растворяет медь из руды. Полученный «богатый» выщелачивающий раствор серной кислоты и медного купороса собирается в небольшой бассейн. Соединение меди теперь можно увидеть в концентрациях от 60 до 70%.
Вторым этапом является экстракция растворителем , при которой две несмешивающиеся (несмешивающиеся) жидкости перемешиваются и разделяются, в результате чего медь переходит из одной жидкости в другую. Насыщенный выщелачивающий раствор энергично смешивают с растворителем. Медь мигрирует из выщелачивающего раствора в растворитель. Затем две жидкости разделяют по растворимости, при этом медь остается в растворе в растворителе, а примеси остаются в выщелачивающем растворе. Затем оставшийся выщелачивающий раствор рециркулируют, добавляя дополнительную кислоту и отправляя ее обратно в спринклеры в процессе кучного выщелачивания.
Насыщенный выщелачивающий раствор энергично смешивают с растворителем. Медь мигрирует из выщелачивающего раствора в растворитель. Затем две жидкости разделяют по растворимости, при этом медь остается в растворе в растворителе, а примеси остаются в выщелачивающем растворе. Затем оставшийся выщелачивающий раствор рециркулируют, добавляя дополнительную кислоту и отправляя ее обратно в спринклеры в процессе кучного выщелачивания.
Последний этап называется электролизом , разновидностью электролиза. Электрический ток проходит через инертный анод (положительный электрод) и через раствор меди из предыдущего этапа, который действует как электролит . Положительно заряженные ионы меди (называемые катионами) выходят из раствора и наносятся на катод (отрицательный электрод) в виде меди чистотой 99,99%.
B. Переработка сульфидной руды
Сульфидные руды обычно перерабатываются с использованием пирометаллургии , извлечения и очистки металлов с помощью процессов, включающих применение тепла. В этом процессе используется ряд физических стадий и высоких температур для извлечения и очистки меди из медных сульфидных руд в четыре основных этапа: 1) пенная флотация, 2) сгущение, 3) плавка и 4) электролиз.
В этом процессе используется ряд физических стадий и высоких температур для извлечения и очистки меди из медных сульфидных руд в четыре основных этапа: 1) пенная флотация, 2) сгущение, 3) плавка и 4) электролиз.
После добычи, транспортировки и дробления до размера гравия или мяча для гольфа измельченная руда далее перерабатывается на мельнице с использованием вторичных дробилок и измельчается до гальки и, наконец, до мелкого песка. После измельчения медной руды в нее добавляют жидкость, превращающую ее в суспензию. Шлам представляет собой смесь ценных минералов медной руды и «бесполезной» породы, называемой пустой породой (произносится «банда»). Суспензия помещается в резервуар, и процесс называется пенная флотация используется для отделения медных минералов от пустой породы. Химические реагенты, называемые «сборщиками», добавляются в суспензию и связываются с частицами меди, делая их гидрофобными или водонепроницаемыми. Трубы используются для подачи воздуха на дно резервуара для создания пузырьков, которые поднимаются на поверхность, увлекая за собой водостойкие частицы сульфида меди. Затем пена богатых медью пузырьков в верхней части резервуара снимается для дальнейшей обработки. Пустая порода опускается на дно резервуара и удаляется или утилизируется как хвостохранилище .
Затем пена богатых медью пузырьков в верхней части резервуара снимается для дальнейшей обработки. Пустая порода опускается на дно резервуара и удаляется или утилизируется как хвостохранилище .
Следующей стадией после пенной флотации является стадия сгущения . Пена выливается в большие резервуары, называемые сгустителями. Пузырьки лопаются, и твердые частицы пенного раствора оседают на дне резервуара. Затем твердые вещества фильтруют для удаления избыточной воды, которую можно повторно использовать при переработке дополнительных партий сульфидной руды. Конечный продукт стадии сгущения представляет собой комбинацию 30% меди и других металлов; этот медный концентрат затем направляется на плавильный завод.
Аноды на шахте Багдад в Аризоне. (Фото предоставлено: Фотоархив ADMMR, Геологическая служба Аризоны). На плавильном заводе используются высокие температуры для дальнейшей очистки руды в серии стадий плавки . Медный концентрат сначала направляют в плавильную печь, где он нагревается до 2300 °F и превращается в расплавленную жидкость. Нагретую жидкость заливают в шлакоотстойную печь. На этом этапе получается комбинация штейна, смеси меди, серы и железа, и шлака, плотного стекловидного материала, состоящего из железа, кремнезема и других примесей. Медный штейн, созданный плавильной печью, содержит 58-60% меди. Затем расплавленный штейн направляется в другую печь, называемую конвертером, для сжигания оставшегося железа и серы; продукт упоминается как черновая медь, которая содержит 98% меди, и доставили в анодную плавку. Черновая медь желтая; когда кислород в меди выгорает в анодной плавке, она становится сине-зеленой. Полученный продукт, расплавленную анодную медь, заливают в формы, называемые колесами для литья анодов. Охлажденные пластины анода состоят из 99% чистой меди, теперь окрашены в медный цвет, имеют две отлитые сверху ручки, имеют толщину два дюйма, ширину три фута, высоту три с половиной фута и вес 750 фунтов.
Нагретую жидкость заливают в шлакоотстойную печь. На этом этапе получается комбинация штейна, смеси меди, серы и железа, и шлака, плотного стекловидного материала, состоящего из железа, кремнезема и других примесей. Медный штейн, созданный плавильной печью, содержит 58-60% меди. Затем расплавленный штейн направляется в другую печь, называемую конвертером, для сжигания оставшегося железа и серы; продукт упоминается как черновая медь, которая содержит 98% меди, и доставили в анодную плавку. Черновая медь желтая; когда кислород в меди выгорает в анодной плавке, она становится сине-зеленой. Полученный продукт, расплавленную анодную медь, заливают в формы, называемые колесами для литья анодов. Охлажденные пластины анода состоят из 99% чистой меди, теперь окрашены в медный цвет, имеют две отлитые сверху ручки, имеют толщину два дюйма, ширину три фута, высоту три с половиной фута и вес 750 фунтов.

Затем пластины медных анодов очищают на заключительном этапе, называемом электролизом . Анодные плиты подвешиваются в большой емкости, наполненной раствором электролита, состоящим из сульфата меди и серной кислоты. Между анодами подвешиваются тонкие листы чистой меди, которые называются катодами и весят около 15 фунтов каждый. Подается электрический ток, и положительно заряженные ионы меди (называемые катионами) покидают анод (положительный электрод) и перемещаются в растворе через раствор электролита для нанесения покрытия на катод (отрицательный электрод). Другие металлы и примеси также покидают анод и падают на дно резервуара или остаются в растворе электролита. Эти примеси собираются и могут быть очищены для извлечения других металлов, таких как серебро и золото. После 14 дней электролиза аноды постепенно исчезли, а медные катоды теперь весят 375 фунтов каждый и содержат 9Медь чистотой 9,99%. Катоды вынимают из бака и промывают водой, чтобы предотвратить дальнейшую реакцию. Готовые медные катоды затем можно превратить в провода, пластины, трубки и другие медные изделия.
Готовые медные катоды затем можно превратить в провода, пластины, трубки и другие медные изделия.
C. Переработка меди
Помимо переработки медных руд, новый и старый медный лом или медные сплавы могут быть переплавлены, повторно очищены и переработаны в новые компоненты. По оценкам, такая переработка обеспечивает 50% меди, используемой в медной промышленности (Scott, 2011). В 2010 г. было переработано 770 000 метрических тонн меди на сумму около шести миллиардов долларов (Papp, 2010).
21.12A: Металлическая медь — Химия LibreTexts
- Последнее обновление
- Сохранить как PDF
- Идентификатор страницы
- 34468
- Роберт Дж.
 Ланкашир
Ланкашир - Университет Вест-Индии в Моне
Информация об истории меди доступна в Ассоциации развития меди, Inc., где они отмечают, что: «В течение почти 5000 лет медь была единственным металлом, известным человеку. металлы». Люди впервые использовали медь около 10 000 лет назад. Считается, что медный кулон, обнаруженный в Северном Ираке, датируется примерно 8700 годом до нашей эры. Доисторический человек, вероятно, использовал медь для изготовления оружия. Древние египтяне, похоже, тоже ценили коррозионную стойкость металла. Они использовали медные ленты и гвозди в судостроении, а медные трубы использовались для транспортировки воды. Некоторые из этих артефактов сохранились до наших дней в хорошем состоянии. По оценкам, общий объем производства меди в Египте за 1500 лет составляет 10 000 тонн.
Спустя годы появились медные сплавы. Сначала появились бронзы (сплавы меди и олова), а гораздо позже — латуни (сплавы меди и цинка). В «бронзовом веке» медь и бронза широко использовались для изготовления оружия, монет, домашней утвари, мебели и других предметов. Самым ранним известным примером использования латуни является римская монета, отчеканенная во время правления Августа с 27 г. до н.э. по 14 г. н.э. Позже медь сыграла важную роль в появлении электричества и сегодня по-прежнему остается одним из самых ценных материалов.
Самым ранним известным примером использования латуни является римская монета, отчеканенная во время правления Августа с 27 г. до н.э. по 14 г. н.э. Позже медь сыграла важную роль в появлении электричества и сегодня по-прежнему остается одним из самых ценных материалов.
Использование соединений меди также восходит к периоду до 4000 г. до н.э. Сульфат меди, например, был особенно важным соединением в ранние времена. Древние египтяне использовали его в качестве протравы в процессе окрашивания. Соединение также использовалось для изготовления мазей и других подобных препаратов. Позже медный купорос стал применяться в лечебных целях с его назначением при легочных заболеваниях. Сульфат меди по-прежнему широко используется сегодня, и о вредных побочных эффектах его , предписанного , не сообщалось.
Распространение
Медь является 25 th наиболее распространенным элементом Земли, но одним из менее распространенных переходных металлов первого ряда. Он встречается в виде мягкого красноватого металла, который можно найти в виде больших валунов весом в несколько сотен тонн или в виде сульфидных руд. Последние представляют собой сложные смеси меди, железа и серы в сочетании с другими металлами, такими как мышьяк, цинк и серебро. Концентрация меди в таких рудах обычно составляет 0,5-2%.
Он встречается в виде мягкого красноватого металла, который можно найти в виде больших валунов весом в несколько сотен тонн или в виде сульфидных руд. Последние представляют собой сложные смеси меди, железа и серы в сочетании с другими металлами, такими как мышьяк, цинк и серебро. Концентрация меди в таких рудах обычно составляет 0,5-2%.
Самая распространенная руда — халькопирит, CuFeS 2 , желтая латунная руда, на долю которой приходится примерно 50% мировых месторождений меди. Существует множество других медных руд разного цвета и состава. Примерами являются малахит Cu 2 CO 3 (OH) 2 , ярко-зеленая руда и красный рудный куприт Cu 2 O.
Медь встречается в биологических системах как часть простетической группы. определенных белков. Примеры белков, содержащих медь, см. в статье Университета Лидса, факультета биохимии и молекулярной биологии Института Скриппса. Красный пигмент мягкоклювой птицы T(o)uraco содержит медно-порфириновый комплекс. Пигмент хорошо растворяется в воде в щелочных условиях, о чем сообщалось в 1952, попытки работников зоопарка помыть птицу привели к тому, что вода окрасилась в красный цвет. Говорят, что Т(о)урако — единственные птицы, обладающие настоящим красным и зеленым цветом. Как правило, цвет, который вы воспринимаете, наблюдая за птицами, обусловлен отражениями, создаваемыми структурой пера. Красный и зеленый пигменты (турацин и тураковердин), содержащиеся в перьях Т(о)урако, содержат медь.
Пигмент хорошо растворяется в воде в щелочных условиях, о чем сообщалось в 1952, попытки работников зоопарка помыть птицу привели к тому, что вода окрасилась в красный цвет. Говорят, что Т(о)урако — единственные птицы, обладающие настоящим красным и зеленым цветом. Как правило, цвет, который вы воспринимаете, наблюдая за птицами, обусловлен отражениями, создаваемыми структурой пера. Красный и зеленый пигменты (турацин и тураковердин), содержащиеся в перьях Т(о)урако, содержат медь.
Добыча меди
Медь извлекается из руды двумя основными способами:
- Пирометаллургический метод
- Гидрометаллургический метод
Пирометаллургический метод
Этот метод часто используется при добыче сульфидных руд. Существует четыре основных этапа:
- Добыча полезных ископаемых и измельчение: руда дробится и измельчается в порошок, обычно содержащий менее 1% меди. Минералы концентрируются в суспензию, содержащую около 15% меди.
 Минералы меди отделяют от бесполезного материала флотацией с использованием пенообразующих растворов.
Минералы меди отделяют от бесполезного материала флотацией с использованием пенообразующих растворов. - Плавка: Плавка медного концентрата и экстракция с помощью тепла, флюса и добавления кислорода. Сера, железо и другие нежелательные элементы удаляются, и продукт называется черновой медью.
- Рафинирование: это заключительный этап процесса получения высококачественной меди. Используются методы огневого и электрорафинирования. Последний производит медь высокой чистоты, пригодную для использования в электротехнике.
Гидрометаллургический метод – SX/EW
Экстракция растворителем/Электровыделение – наиболее распространенный процесс выщелачивания, используемый в настоящее время для извлечения меди из химических растворов. Как следует из названия, метод включает в себя два основных этапа:
- Экстракция растворителем – процесс, при котором ионы меди выщелачиваются или иным образом извлекаются из сырой руды с использованием химических реагентов.

- Электровыделение — электролиз раствора, содержащего ионы металла, так что содержащиеся в нем ионы меди оседают на катоде, а затем удаляются в виде элемента.
Процесс происходит в следующие этапы:
- Выщелачивающий раствор (выщелачивающий раствор) выбран для использования при выщелачивании ионов Cu из руды. Обычными реагентами являются слабые кислоты, т.е. Н 2 SO 4 , H 2 SO 4 + Fe 2 (SO 4 ) 3 , растворы кислых хлоридов, например FeCl 2 , композиции хлорида аммония и соли аммония.
- При нанесении на руду выбранный выщелачиватель растворяет присутствующие ионы меди с образованием выщелачивающего продукта, называемого «содержащим выщелачивающим раствором».
- Затем выбирается органический экстрагент для удаления ионов меди из водного раствора. Предпочтительные органические экстрагенты состоят из гидроксифенилоксимов, имеющих основную химическую формулу:
- C 6 H 3 (R)(OH) CNOHR*, R= C 9 H 19 или C 12 H 25 и R* или C 3 , CH 6 Н 5
Примерами таких экстрагентов являются 5-нонилсалицилальдоксим и смесь этого соединения и 2-гидрокси-5-нонилацетофеноноксима. Имеющиеся в продаже реагенты обычно содержат 5-10% оксима в 90-95%-ном нефтяном разбавителе, таком как керосин.
Имеющиеся в продаже реагенты обычно содержат 5-10% оксима в 90-95%-ном нефтяном разбавителе, таком как керосин.
Перед смешиванием с выщелачивающим продуктом экстрагент будет содержать мало меди или совсем не содержать ее, и на этой стадии его называют «бесплодным органическим экстрагентом».
- Ионы меди переходят из выщелачивающего раствора в органический экстрагент при смешивании двух реагентов. Происходит разделение фаз с получением водной и органической фаз, называемых соответственно первой водной и первой органической фазами. Первая водная фаза, «рафинат», представляет собой выщелачиватель, лишенный ионов меди, в то время как первая органическая фаза представляет собой «загруженный органический экстрагент», т.е. экстрагент с присутствующими ионами меди.
- Рафинат рециркулируется на площадку выщелачивания, в то время как загруженный органический экстрагент смешивается с раствором электролита, называемым «тощим электролитом» (т.е. не содержащим меди).
 Типичными электролитами являются кислые растворы, такие как серная кислота, H 2 СО 4 . Таким образом, ионы меди, которые присутствовали в органическом экстрагенте, растворяются в растворе электролита, образуя медьсодержащий «богатый электролит». Здесь снова происходит фазовое разделение. Вторая органическая фаза представляет собой обедненный органический экстрагент, тогда как вторая водная фаза представляет собой «богатый электролит». Бесплодный органический экстрагент затем рециркулируют для повторного использования при применении к выщелачивающему продукту.
Типичными электролитами являются кислые растворы, такие как серная кислота, H 2 СО 4 . Таким образом, ионы меди, которые присутствовали в органическом экстрагенте, растворяются в растворе электролита, образуя медьсодержащий «богатый электролит». Здесь снова происходит фазовое разделение. Вторая органическая фаза представляет собой обедненный органический экстрагент, тогда как вторая водная фаза представляет собой «богатый электролит». Бесплодный органический экстрагент затем рециркулируют для повторного использования при применении к выщелачивающему продукту. - Заключительной стадией процесса является электролиз кислого раствора ионов металлов. В результате растворенные ионы меди оседают на катоде, а элементарная медь удаляется. Таким образом, процесс восстановления завершен.
Примечание о примесях
Присутствие взвешенных загрязняющих веществ в системе SX/EW может значительно снизить эффективность ее работы. Такие загрязнители могут попасть в систему из руды или из окружающей среды. Система подвержена загрязнению дождем, ветром и другими факторами окружающей среды, поскольку первая защитная оболочка, в которой хранится выщелачивающий продукт, обычно не накрыта и расположена снаружи. Таким образом, твердые отходы в виде грязи, песка, каменной пыли, растительных остатков, минеральных остатков и взвешенных твердых частиц часто попадают в систему на ранних стадиях и сохраняются на последующих стадиях процесса.
Система подвержена загрязнению дождем, ветром и другими факторами окружающей среды, поскольку первая защитная оболочка, в которой хранится выщелачивающий продукт, обычно не накрыта и расположена снаружи. Таким образом, твердые отходы в виде грязи, песка, каменной пыли, растительных остатков, минеральных остатков и взвешенных твердых частиц часто попадают в систему на ранних стадиях и сохраняются на последующих стадиях процесса.
Воздействие этих загрязняющих веществ значительно и включает:
- увеличение времени разделения фаз на стадиях, когда органические и водные растворители смешиваются. Отсутствие полного разделения фаз после экстракции приводит к потере дорогостоящего органического экстрагента, так как большая его часть остается в водном растворе.
- снижение выхода по току и снижение чистоты гальванического изделия из меди на стадии электролиза.
В большинстве систем SX/EW для решения этой проблемы введены этапы очистки. В патенте США (номер 573341), например, по меньшей мере часть второй органической фазы фильтруется для удаления твердых загрязняющих примесей перед повторным использованием при обработке выщелачивающего продукта. Таким образом, рециркулируемый органический экстрагент содержит мало или совсем не содержит примесей в зависимости от того, была ли отфильтрована часть второй органической фазы или вся вторая органическая фаза. Было обнаружено, что эта стадия фильтрации значительно повышает эффективность работы, даже когда обрабатывается только часть экстрагента.
В патенте США (номер 573341), например, по меньшей мере часть второй органической фазы фильтруется для удаления твердых загрязняющих примесей перед повторным использованием при обработке выщелачивающего продукта. Таким образом, рециркулируемый органический экстрагент содержит мало или совсем не содержит примесей в зависимости от того, была ли отфильтрована часть второй органической фазы или вся вторая органическая фаза. Было обнаружено, что эта стадия фильтрации значительно повышает эффективность работы, даже когда обрабатывается только часть экстрагента.
Использование меди и ее соединений
Медь на протяжении веков уступает по полезности только железу. Металл и его соединения используются во всех сферах жизни от электротехники до медицины и сельского хозяйства.
Использование металлической меди
Электротехническая промышленность является бенефициаром большей части производства меди в мире. Металл используется в производстве электрических приборов, таких как катоды и провода. Другое использование включает:
Другое использование включает:
- Кровля
- Посуда
- Монеты
- Металлообработка
- Сантехника
- Катушки холодильника и кондиционера
- Сплавы напр. бронза, латунь
Использование соединений меди
Соединения меди наиболее широко используются в сельском хозяйстве. С тех пор как была обнаружена их токсичность для некоторых насекомых, грибков и водорослей, эти соединения использовались в инсектицидах, фунгицидах и для предотвращения развития водорослей в резервуарах с питьевой водой. Поэтому они используются для борьбы с болезнями животных и растений. Удобрения также часто дополняют соединениями меди, т.е. медный купорос для повышения плодородия почвы и, следовательно, ускорения роста сельскохозяйственных культур. Соединения меди также используются в фотографии и в качестве красителей для стекла и фарфора.
Медь для хорошего здоровья
Медь является одним из многих микроэлементов, необходимых для хорошего здоровья. Он является частью простетических групп многих белков и ферментов и, таким образом, необходим для их правильного функционирования. Поскольку организм не может синтезировать медь, ее необходимо принимать с пищей. Орехи, семечки, крупы, мясо (например, печень) и рыба являются хорошими источниками меди.
Он является частью простетических групп многих белков и ферментов и, таким образом, необходим для их правильного функционирования. Поскольку организм не может синтезировать медь, ее необходимо принимать с пищей. Орехи, семечки, крупы, мясо (например, печень) и рыба являются хорошими источниками меди.
Медь также нашла применение в медицине. С давних времен он использовался для лечения ран грудной клетки и очистки воды. Недавно было высказано предположение, что медь помогает предотвратить воспаление, связанное с артритом и другими подобными заболеваниями. Продолжаются исследования лекарственных средств, содержащих медь, для лечения этого и других заболеваний.
Соединения меди
Медь состоит из множества соединений, многие из которых окрашены. Двумя основными степенями окисления меди являются +1 и +2, хотя известны некоторые комплексы +3. Ожидается, что соединения меди (I) будут диамагнитными по своей природе и обычно бесцветны, за исключением случаев, когда цвет возникает в результате переноса заряда или аниона. Ион +1 имеет тетраэдрическую или плоскоквадратную геометрию. В твердых соединениях медь (I) часто находится в более стабильном состоянии при умеренных температурах.
Ион +1 имеет тетраэдрическую или плоскоквадратную геометрию. В твердых соединениях медь (I) часто находится в более стабильном состоянии при умеренных температурах.
Ион меди(II) обычно находится в более стабильном состоянии в водных растворах. Соединения этого иона, часто называемые соединениями меди, обычно окрашены. На них влияют ян-теллеровские искажения, и они демонстрируют широкий спектр стереохимии с преобладанием четырех-, пяти- и шестикоординационных соединений. Ион +2 часто имеет искаженную тетраэдрическую геометрию.
Галогениды меди
Известно, что все галогениды меди(I) существуют, хотя фторид еще не получен в чистом виде. Хлорангидриды, бромиды и йодиды меди — бесцветные диамагнитные соединения. Они кристаллизуются при обычных температурах со структурой цинковой обманки, в которой атомы Cu тетраэдрически связаны с четырьмя галогенами. Соли хлорида и бромида меди (I) получают кипячением кислого раствора ионов меди (II) в избытке меди. При разбавлении образуется белый CuCl или бледно-желтый CuBr. Добавление растворимого йодида к водному раствору ионов меди(II) приводит к образованию осадка йодида меди(I), который быстро разлагается на Cu(I) и йод.
При разбавлении образуется белый CuCl или бледно-желтый CuBr. Добавление растворимого йодида к водному раствору ионов меди(II) приводит к образованию осадка йодида меди(I), который быстро разлагается на Cu(I) и йод.
Галогениды меди(I) умеренно растворимы в воде, и большая часть меди в водном растворе находится в состоянии Cu(II). Тем не менее, плохая растворимость соединений меди (I) увеличивается при добавлении ионов галогенидов. В таблице ниже показаны некоторые свойства галогенидов меди (I).
| Формула | цвет | МП | БП | м (БМ) | Структура |
|---|---|---|---|---|---|
| CuF 2 | белый | 950разложение | — | 1,5 | |
| CuCl 2 | коричневый | 632 | 993разложить | 1,75 | CdCl 2 |
| CuBr 2 | черный | 498 | — | 1,3 |
Известны все четыре галогенида меди(II), хотя йодид меди быстро разлагается на йодид меди и йод. Желтый хлорид меди (II) и почти черный бромид меди (II) являются обычными галогенидами. Эти соединения имеют структуру с бесконечными параллельными квадратными полосами CuX 4 ед. Хлорангидриды и бромиды меди хорошо растворимы в воде и донорных растворителях, таких как ацетон, спирт и пиридин.
Желтый хлорид меди (II) и почти черный бромид меди (II) являются обычными галогенидами. Эти соединения имеют структуру с бесконечными параллельными квадратными полосами CuX 4 ед. Хлорангидриды и бромиды меди хорошо растворимы в воде и донорных растворителях, таких как ацетон, спирт и пиридин.
Галогениды меди(II) являются умеренными окислителями из-за пары Cu(I)/Cu(II). В воде, где потенциал в большей степени, чем у аквакомплексов, большой разницы между ними нет, но в неводных средах окислительная (галогенирующая) способность возрастает в ряду;
\[\ce{CuF2 \ll CuCl2 \ll CuBr2}\]
Могут быть получены прямой реакцией с соответствующими галогенами:
\[\ce{Cu + F2 → CuF2}\]
\[\ce{Cu + Cl2 / 450 C → CuCl2}\]
\[\ce{Cu + Br2 → CuBr2}\]
В качестве альтернативы их можно получить из CuX 2 .aq путем нагревания -> CuX 2
| Формула | цвет | МП | БП | Структура |
|---|---|---|---|---|
| CuCl | белый | 430 | 1359 | — |
| CuBr | белый | 483 | 1345 | — |
| CuI | белый | 588 | 1293 | Цинковая смесь |
Получено восстановлением CuX 2 -> CuX;
, за исключением F, который не был получен в чистом виде.
Обратите внимание, что CuI 2 не был выделен из-за легкости восстановления до CuI.
Оксиды меди
Оксиды меди(I) более стабильны, чем оксиды меди(II) при высоких температурах. Оксид меди(I) встречается в самородном виде в виде красного куприта. В лаборатории восстановление раствора Фелинга восстанавливающим сахаром, таким как глюкоза, дает красный осадок. Тест достаточно чувствителен даже для 1 мг сахара, чтобы получить характерный красный цвет соединения. Закись меди также можно получить в виде желтого порошка контролируемым восстановлением щелочной соли меди (II) гидразином. Термическое разложение оксида меди(II) также дает оксид меди(I), так как последний обладает большей термической стабильностью. Тот же метод можно использовать для получения соединения из нитрата, карбоната и гидроксида меди (II).
Оксид меди(II) встречается в природе в виде тенорита. Это черное кристаллическое твердое вещество может быть получено пиролизом нитратных, гидроксидных или карбонатных солей. Он также образуется при нагревании порошкообразной меди на воздухе или в кислороде. В таблице ниже приведены некоторые характеристики оксидов меди.
Он также образуется при нагревании порошкообразной меди на воздухе или в кислороде. В таблице ниже приведены некоторые характеристики оксидов меди.
| Формула | цвет | Степень окисления | МП |
|---|---|---|---|
| CuO | черный | Медь 2+ | 1026разложить |
| Медь 2 О | красный | Медь + | 1230 |
Окислительно-восстановительная химия меди
Cu 2+ + e- → Cu + E=0,15 В
Cu + + e- → Cu E=0,52 В
Cu 2+ + 2e- → Cu E=0,34 В
При рассмотрении этих данных будет видно, что любой окислитель, достаточно сильный для превращения Cu в Cu + , более чем достаточно силен для превращения Cu + в Cu 2+ (0,52 по сравнению с 0,14 В). Поэтому не ожидается, что какие-либо стабильные соли Cu + будут существовать в водном растворе.
Поэтому не ожидается, что какие-либо стабильные соли Cu + будут существовать в водном растворе.
Диспропорционирование также может происходить:
2Cu + → Cu 2+ + Cu E=0,37 В или K=10 6
Координационные комплексы
Реакция ЭДТА 4- с медью(II) дала комплекс, в котором ЭДТА оказался пентадентатным, а НЕ гексадентатным, в отличие от других ионов M(II).
Cu(ЭДТА) 2-
Структура иона [Cu(ox) 2 ] 2- может быть описана как плоскоквадратная или как искаженный октаэдр, если рассматривать упаковку в кристаллической решетке . В случае соли натрия отдельные единицы параллельны в ячейке с медью, связанной с атомами кислорода, координированными с медью в единицах, расположенных как вверху, так и внизу, тогда как в соли калия единицы не параллельны и при взгляде в трех единицах центральная находится почти под прямым углом к двум другим. Здесь медь связана с одним из некоординированных атомов кислорода в единицах выше и ниже ее.
Na+ и K+ соли [Cu(ox) 2 ] 2-
Cu(OH) 2 реагирует с NH 3 с образованием раствора, растворяющего целлюлозу. Это используется в промышленной подготовке района. Растворы содержат тетраммины и пентамины. С пиридином образуются только тетрамины, например, Cu(py) 4 SO 4 .
Взаимодействие меди(II) с аминокислотами широко изучено. Почти во всех случаях продукт содержит группы в -транс-, которая, как ожидается, будет более стабильной. В случае глицина первым осаждаемым продуктом всегда является цис- изомер, который при нагревании превращается в транс-. Для получения более подробной информации см. лабораторное руководство для C31L.
Аналитическое определение меди(II)
Полезным реагентом для аналитического определения иона меди(II) является натриевая соль N,N-диэтилдитиокарбамата. В разбавленных спиртовых растворах наличие следовых количеств Cu 2+ обозначается желтым цветом, который можно измерить спектрофотометром, а концентрацию определяют по графику закона Бера.






 Как правило, применяется медь совместно с хромом и никелем. Благодаря этому повышается уровень сцепления с основой поверхностью.
Как правило, применяется медь совместно с хромом и никелем. Благодаря этому повышается уровень сцепления с основой поверхностью.
 Ей следует проводить вдоль заготовки, не прикасаясь к ней. Поверхность нужно смочить электролитическим раствором. Во время обработки за счет отрицательного заряда деталь будет подтягивать ионы меди, покрываясь ими.
Ей следует проводить вдоль заготовки, не прикасаясь к ней. Поверхность нужно смочить электролитическим раствором. Во время обработки за счет отрицательного заряда деталь будет подтягивать ионы меди, покрываясь ими.
 Ланкашир
Ланкашир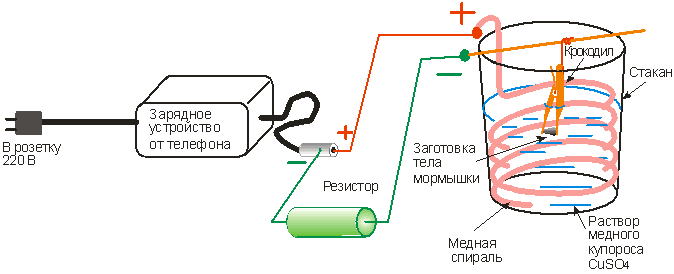 Минералы меди отделяют от бесполезного материала флотацией с использованием пенообразующих растворов.
Минералы меди отделяют от бесполезного материала флотацией с использованием пенообразующих растворов.
 Типичными электролитами являются кислые растворы, такие как серная кислота, H 2 СО 4 . Таким образом, ионы меди, которые присутствовали в органическом экстрагенте, растворяются в растворе электролита, образуя медьсодержащий «богатый электролит». Здесь снова происходит фазовое разделение. Вторая органическая фаза представляет собой обедненный органический экстрагент, тогда как вторая водная фаза представляет собой «богатый электролит». Бесплодный органический экстрагент затем рециркулируют для повторного использования при применении к выщелачивающему продукту.
Типичными электролитами являются кислые растворы, такие как серная кислота, H 2 СО 4 . Таким образом, ионы меди, которые присутствовали в органическом экстрагенте, растворяются в растворе электролита, образуя медьсодержащий «богатый электролит». Здесь снова происходит фазовое разделение. Вторая органическая фаза представляет собой обедненный органический экстрагент, тогда как вторая водная фаза представляет собой «богатый электролит». Бесплодный органический экстрагент затем рециркулируют для повторного использования при применении к выщелачивающему продукту.