Медь, свойства атома, химические и физические свойства
Медь, свойства атома, химические и физические свойства.
Cu 29 Медь
63,546(3) 1s2 2s2 2p6 3s2 3p6 3d10 4s1
Медь — элемент периодической системы химических элементов Д. И. Менделеева с атомным номером 29. Расположен в 11-й группе (по старой классификации — побочной подгруппе первой группы), четвертом периоде периодической системы.
Атом и молекула меди. Формула меди. Строение атома меди
Цена на медь
Изотопы и модификации меди
Свойства меди (таблица): температура, плотность, давление и пр.
Физические свойства меди
Химические свойства меди. Взаимодействие меди. Химические реакции с медью
Получение меди
Применение меди
Таблица химических элементов Д.И. Менделеева
Атом и молекула меди. Формула меди. Строение атома меди:
Медь (лат. Cuprum) – химический элемент периодической системы химических элементов Д. И. Менделеева с обозначением Cu и атомным номером 29. Расположен в 11-й группе (по старой классификации – побочной подгруппе первой группы), четвертом периоде периодической системы.
Cuprum) – химический элемент периодической системы химических элементов Д. И. Менделеева с обозначением Cu и атомным номером 29. Расположен в 11-й группе (по старой классификации – побочной подгруппе первой группы), четвертом периоде периодической системы.
Медь – металл. Относится к переходным металлам, а также к группе тяжёлых, цветных металлов.
Медь обозначается символом Cu.
Как простое вещество медь при нормальных условиях представляет собой пластичный металл золотисто-розового цвета (либо розового цвета при отсутствии оксидной плёнки). Наряду с осмием, цезием и золотом, медь – один из четырёх металлов, имеющих явную цветовую окраску, отличную от серой или серебристой у прочих металлов.
Молекула меди одноатомна.
Химическая формула меди Cu.
Электронная конфигурация атома меди 1s2 2s2 2p6 3s2 3p6 3d10 4s1. Потенциал ионизации (первый электрон) атома меди равен 745,48 кДж/моль (7,726380(4) эВ).
Строение атома меди. Атом меди состоит из положительно заряженного ядра (+29), вокруг которого по четырем оболочкам движутся 29 электронов. При этом 28 электронов находятся на внутреннем уровне, а 1 электрон – на внешнем. Поскольку медь расположен в четвертом периоде, оболочек всего четыре. Первая – внутренняя оболочка представлена s-орбиталью. Вторая – внутренняя оболочка представлена s- и р-орбиталями. Третья – внутренняя оболочка представлена s-, р- и d-орбиталями. Четвертая – внешняя оболочка представлена s-орбиталью. На внешнем энергетическом уровне атома меди – на s-орбитали находится один неспаренный электрон. В свою очередь ядро атома меди состоит из 29 протонов и 35 нейтронов.
В свою очередь ядро атома меди состоит из 29 протонов и 35 нейтронов.
Радиус атома меди (вычисленный) составляет 145 пм.
Атомная масса атома меди составляет 63,546(3) а. е. м.
Медь с давних пор широко используется человеком.
Медь, свойства атома, химические и физические свойства
Изотопы и модификации меди:
Свойства меди (таблица): температура, плотность, давление и пр.:
Подробные сведения на сайте ChemicalStudy.ru
| 100 | Общие сведения | |
| 101 | Название | Медь |
| 102 | Прежнее название | |
| 103 | Латинское название | Cuprum |
| 104 | Английское название | Copper |
| 105 | Символ | Cu |
| 106 | Атомный номер (номер в таблице) | 29 |
| 107 | Тип | Металл |
| 108 | Группа | Переходный, тяжёлый, цветной металл |
| 109 | Открыт | Известна с глубокой древности |
| 110 | Год открытия | 9000 г. до н. э. до н. э. |
| 111 | Внешний вид и пр. | Пластичный металл золотисто-розового цвета (либо розового цвета при отсутствии оксидной плёнки) |
| 112 | Происхождение | Природный материал |
| 113 | Модификации | |
| 114 | Аллотропные модификации | |
| 115 | Температура и иные условия перехода аллотропных модификаций друг в друга | |
| 116 | Конденсат Бозе-Эйнштейна | |
| 117 | Двумерные материалы | |
| 118 | Содержание в атмосфере и воздухе (по массе) | 0 % |
| 119 | Содержание в земной коре (по массе) | 0,0068 % |
| 120 | Содержание в морях и океанах (по массе) | 3,0·10-7 % |
| 121 | Содержание во Вселенной и космосе (по массе) | 6,0·10-6 % |
| 122 | Содержание в Солнце (по массе) | 0,00007 % |
| 123 | Содержание в метеоритах (по массе) | 0,011 % |
| 124 | Содержание в организме человека (по массе) | 0,0001 % |
| 200 | Свойства атома | |
| 201 | Атомная масса (молярная масса) | 63,546(3) а.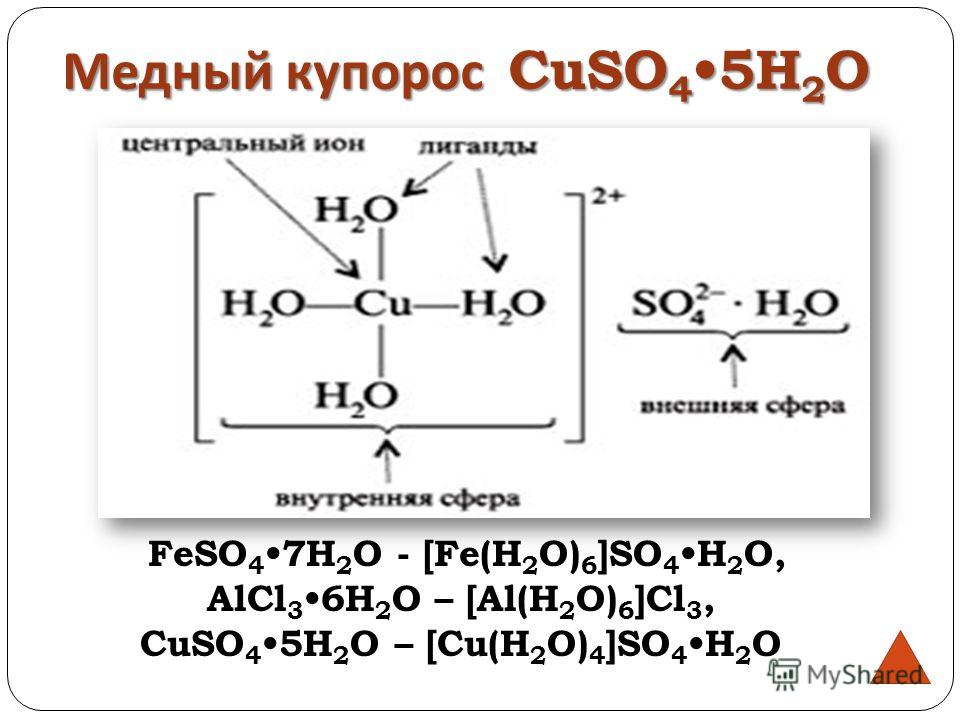 е. м. (г/моль) е. м. (г/моль) |
| 202 | Электронная конфигурация | 1s2 2s2 2p6 3s2 3p6 3d10 4s1 |
| 203 | Электронная оболочка | K2 L8 M18 N1 O0 P0 Q0 R0
|
| 204 | Радиус атома (вычисленный) | 145 пм |
| 205 | Эмпирический радиус атома* | 135 пм |
| 206 | Ковалентный радиус* | 132 пм |
| 207 | Радиус иона (кристаллический) | Cu+ 60 (2) пм, 74 (4) пм, 91 (6) пм, 71 (4) пм, 87 (6) пм, Cu3+ 68 (6) пм (в скобках указано координационное число – характеристика, которая определяет число ближайших частиц (ионов или атомов) в молекуле или кристалле) |
| 208 | Радиус Ван-дер-Ваальса | 140 пм |
| 209 | Электроны, Протоны, Нейтроны | 29 электронов, 29 протонов, 35 нейтронов |
| 210 | Семейство (блок) | элемент d-семейства |
| 211 | Период в периодической таблице | 4 |
| 212 | Группа в периодической таблице | 11-ая группа (по старой классификации – побочная подгруппа 1-ой группы) |
| 213 | Эмиссионный спектр излучения | |
| 300 | Химические свойства | |
| 301 | Степени окисления | -2, 0, +1, +2 , +3, +4 |
| 302 | Валентность | I, II |
| 303 | Электроотрицательность | 1,90 (шкала Полинга) |
| 304 | Энергия ионизации (первый электрон) | 745,48 кДж/моль (7,726380(4) эВ) |
| 305 | Электродный потенциал | Cu+ + e– → Cu, Eo = +0,520 В, Cu2+ + e– → Cu+, Eo = +0,153 В, Cu2+ + 2e– → Cu, Eo = +0,337 В |
| 306 | Энергия сродства атома к электрону | 119,235(4) кДж/моль (1,23578(4) эВ) |
| 400 | Физические свойства | |
| 401 | Плотность* | 8,96 г/см3 (при 20 °C и иных стандартных условиях, состояние вещества – твердое тело), 8,02 г/см3 (при температуре плавления 1084,62 °C и иных стандартных условиях, состояние вещества – жидкость), 7,962 г/см3 (при 1127 °C и иных стандартных условиях, состояние вещества – жидкость), 7,471 г/см3 (при 1727 °C и иных стандартных условиях, состояние вещества – жидкость), 7,307 г/см3 (при 1927 °C и иных стандартных условиях, состояние вещества – жидкость), 7,225 г/см3 (при 2027 °C и иных стандартных условиях, состояние вещества – жидкость), |
| 402 | Температура плавления* | 1084,62 °C (1357,77 K, 1984,32 °F) |
| 403 | Температура кипения* | 2562 °C (2835 K, 4643 °F) |
| 404 | Температура сублимации | |
| 405 | Температура разложения | |
| 406 | Температура самовоспламенения смеси газа с воздухом | |
| 407 | Удельная теплота плавления (энтальпия плавления ΔHпл)* | 13,26 кДж/моль |
| 408 | Удельная теплота испарения (энтальпия кипения ΔHкип)* | 300,4 кДж/моль |
| 409 | Удельная теплоемкость при постоянном давлении | 0,384 Дж/г·K (при 20 °C) |
| 410 | Молярная теплоёмкость | 24,44 Дж/(K·моль) |
| 411 | Молярный объём | 7,12399 см³/моль |
| 412 | Теплопроводность | 401 Вт/(м·К) (при стандартных условиях), 401 Вт/(м·К) (при 300 K) |
| 500 | Кристаллическая решётка | |
| 511 | Кристаллическая решётка #1 | |
| 512 | Структура решётки | Кубическая гранецентрированная
|
| 513 | Параметры решётки | 3,615 Å |
| 514 | Отношение c/a | |
| 515 | Температура Дебая | 315 K |
| 516 | Название пространственной группы симметрии | Fm_ 3m |
| 517 | Номер пространственной группы симметрии | 225 |
| 900 | Дополнительные сведения | |
| 901 | Номер CAS | 7440-50-8 |
Примечание:
205* Эмпирический радиус атома меди согласно [1] и [3] составляет 128 пм.
206* Ковалентный радиус меди согласно [1] и [3] составляет 132±4 пм и 117 пм соответственно.
401* Плотность меди согласно [3] составляет 8,92 г/см3 (при 0 °C и при иных
402* Температура плавления меди согласно [3] и [4] составляет 1083,4 °С (1356,55 K, 1982,12 °F) и 1083 °С (1356,15 K, 1981,4 °F) соответственно.
403* Температура кипения меди согласно [3] и [4] составляет 2567 °С (2840,15 K, 4652,6 °F) и 2543 °C (2816,15 К, 4609,4 °F) соответственно.
407* Удельная теплота плавления (энтальпия плавления ΔHпл) меди согласно [3] и [4] составляет 13,01 кДж/моль и 13 кДж/моль соответственно.
408* Удельная теплота испарения (энтальпия кипения ΔHкип) меди согласно [3] и [4] составляет 304,6 кДж/моль и 302 кДж/моль соответственно.
Физические свойства меди:
Химические свойства меди. Взаимодействие меди. Химические реакции с медью:
Получение меди:
Применение меди:
Таблица химических элементов Д.
- 1. Водород
- 2. Гелий
- 3. Литий
- 4. Бериллий
- 5. Бор
- 6. Углерод
- 7. Азот
- 8. Кислород
- 9. Фтор
- 10. Неон
- 11. Натрий
- 12. Магний
- 13. Алюминий
- 14. Кремний
- 15. Фосфор
- 16. Сера
- 17. Хлор
- 18. Аргон
- 19. Калий
- 20. Кальций
- 21. Скандий
- 22. Титан
- 23. Ванадий
- 24. Хром
- 25. Марганец
- 26. Железо
- 27. Кобальт
- 28. Никель
- 29. Медь
- 30. Цинк
- 31. Галлий
- 32. Германий
- 33. Мышьяк
- 34.
 Селен
Селен - 35. Бром
- 36. Криптон
- 37. Рубидий
- 38. Стронций
- 39. Иттрий
- 40. Цирконий
- 41. Ниобий
- 42. Молибден
- 43. Технеций
- 44. Рутений
- 45. Родий
- 46. Палладий
- 47. Серебро
- 48. Кадмий
- 49. Индий
- 50. Олово
- 51. Сурьма
- 52. Теллур
- 53. Йод
- 54. Ксенон
- 55. Цезий
- 56. Барий
- 57. Лантан
- 58. Церий
- 59. Празеодим
- 60. Неодим
- 61. Прометий
- 62. Самарий
- 63. Европий
- 64. Гадолиний
- 65. Тербий
- 66. Диспрозий
- 67.
 Гольмий
Гольмий - 68. Эрбий
- 69. Тулий
- 70. Иттербий
- 71. Лютеций
- 72. Гафний
- 73. Тантал
- 74. Вольфрам
- 75. Рений
- 76. Осмий
- 77. Иридий
- 78. Платина
- 79. Золото
- 80. Ртуть
- 81. Таллий
- 82. Свинец
- 83. Висмут
- 84. Полоний
- 85. Астат
- 86. Радон
- 87. Франций
- 88. Радий
- 89. Актиний
- 90. Торий
- 91. Протактиний
- 92. Уран
- 93. Нептуний
- 94. Плутоний
- 95. Америций
- 96. Кюрий
- 97. Берклий
- 98. Калифорний
- 99. Эйнштейний
- 100.
 Фермий
Фермий - 101. Менделеевий
- 102. Нобелий
- 103. Лоуренсий
- 104. Резерфордий
- 105. Дубний
- 106. Сиборгий
- 107. Борий
- 108. Хассий
- 109. Мейтнерий
- 110. Дармштадтий
- 111. Рентгений
- 112. Коперниций
- 113. Нихоний
- 114. Флеровий
- 115. Московий
- 116. Ливерморий
- 117. Теннессин
- 118. Оганесон
Таблица химических элементов Д.И. Менделеева
Источники:
- https://en.wikipedia.org/wiki/Copper
- https://de.wikipedia.org/wiki/Kupfer
- https://ru.wikipedia.org/wiki/Медь
- http://chemister.ru/Database/properties.php?dbid=1&id=239
- https://chemicalstudy.ru/med-svoystva-atoma-himicheskie-i-fizicheskie-svoystva/
Примечание: © Фото https://www. pexels.com, https://pixabay.com
pexels.com, https://pixabay.com
медь атомная масса степень окисления валентность плотность температура кипения плавления физические химические свойства структура теплопроводность электропроводность кристаллическая решетка
атом нарисовать строение число протонов в ядре строение электронных оболочек электронная формула конфигурация схема строения электронной оболочки заряд ядра состав масса орбита уровни модель радиус энергия электрона переход скорость спектр длина волны молекулярная масса объем атома
электронные формулы сколько атомов в молекуле меди
сколько электронов в атоме свойства металлические неметаллические термодинамические
Коэффициент востребованности 3 486
Медь — свойства, характеристики | Cu-prum.ru
Медь – это пластичный золотисто-розовый металл с характерным металлическим блеском. В периодической системе Д. И. Менделеева этот химический элемент обозначается, как Сu (Cuprum) и находится под порядковым номером 29 в I группе (побочной подгруппе), в 4 периоде.
Латинское название Cuprum произошло от имени острова Кипр. Известны факты, что на Кипре ещё в III веке до нашей эры находились медные рудники и местные умельцы выплавляли медь. Купить медь можно в комании «КУПРУМ».
По данным историков, знакомству общества с медью около девяти тысячелетий. Самые древние медные изделия найдены во время археологических раскопок на местности современной Турции. Археологи обнаружили маленькие медные бусинки и пластинки для украшения одежды. Находки датируются рубежом VIII-VII тыс. до нашей эры. Из меди в древности изготавливали украшения, дорогую посуду и различные инструменты с тонким лезвием.
Великим достижением древних металлургов можно назвать получение сплава с медной основой – бронзы.
Основные свойства меди
1. Физические свойства.
На воздухе медь приобретает яркий желтовато-красный оттенок за счёт образования оксидной плёнки. Тонкие же пластинки при просвечивании зеленовато-голубого цвета. В чистом виде медь достаточно мягкая, тягучая и легко прокатывается и вытягивается. Примеси способны повысить её твёрдость.
В чистом виде медь достаточно мягкая, тягучая и легко прокатывается и вытягивается. Примеси способны повысить её твёрдость.
Высокую электропроводность меди можно назвать главным свойством, определяющим её преимущественное использование. Также медь обладает очень высокой теплопроводностью. Такие примеси как железо, фосфор, олово, сурьма и мышьяк влияют на базовые свойства и уменьшают электропроводность и теплопроводность. По данным показателям медь уступает лишь серебру.
Медь обладает высокими значениями плотности, температуры плавления и температуры кипения. Важным свойством также является хорошая стойкость по отношению к коррозии. К примеру, при высокой влажности железо окисляется значительно быстрее.
Медь хорошо поддаётся обработке: прокатывается в медный лист и медный пруток, протягивается в медную проволоку с толщиной, доведённой до тысячных долей миллиметра. Этот металл является диамагнетиком, то есть намагничивается против направления внешнего магнитного поля.
2.
 Химические свойства.
Химические свойства.Медь является сравнительно малоактивным металлом. В нормальных условиях на сухом воздухе её окисления не происходит. Она легко реагирует с галогенами, селеном и серой. Кислоты без окислительных свойств не оказывают воздействия на медь. С водородом, углеродом и азотом химических реакций нет. На влажном воздухе происходит окисление с образованием карбоната меди (II) – верхнего слоя платины.
Медь обладает амфотерностью, то есть в земной коре образует катионы и анионы. В зависимости от условий, соединения меди проявляют кислотные или основные свойства.
Способы получения меди
В природе медь существует в соединениях и в виде самородков. Соединения представлены оксидами, гидрокарбонатами, сернистыми и углекислыми комплексами, а также сульфидными рудами. Самые распространённые руды — это медный колчедан и медный блеск. Содержание меди в них составляет 1-2%. 90% первичной меди добывают пирометаллургическим способом и 10% гидрометаллургическим.
1. Пирометаллургический способ включает в себя такие процессы: обогащение и обжиг, плавка на штейн, продувка в конвертере, электролитическое рафинирование.
Обогащают медные руды методом флотации и окислительного обжига. Сущность метода флотации заключается в следующем: частицы меди, взвешенные в водной среде, прилипают к поверхности пузырьков воздуха и поднимаются на поверхность. Метод позволяет получить медный порошкообразный концентрат, который содержит 10-35% меди.
Окислительному обжигу подлежат медные руды и концентраты со значительным содержанием серы. При нагреве в присутствии кислорода происходит окисление сульфидов, и количество серы снижается почти в два раза. Обжигу подвергаются бедные концентраты, в которых содержится 8-25% меди. Богатые концентраты, содержащие 25-35% меди, плавят, не прибегая к обжигу.
Следующий этап пирометаллургического способа получения меди – это плавка на штейн. Если в качестве сырья используется кусковая медная руда с большим количеством серы, то плавку проводят в шахтных печах. А для порошкообразного флотационного концентрата применяют отражательные печи. Плавка происходит при температуре 1450 °С.
А для порошкообразного флотационного концентрата применяют отражательные печи. Плавка происходит при температуре 1450 °С.
В горизонтальных конвертерах с боковым дутьём медный штейн продувается сжатым воздухом для того, чтобы произошли процессы окисления сульфидов и феррума. Далее образовавшиеся окислы переводят в шлак, а серу в оксид. В конвертере образуется черновая медь, которая содержит 98,4-99,4% меди, железо, серу, а также незначительное количество никеля, олова, серебра и золота.
Черновая медь подлежит огневому, а далее электролитическому рафинированию. Примеси удаляют с газами и переводят в шлак. В результате огневого рафинирования образуется медь с чистотой до 99,5%. А после электролитического рафинирования чистота составляет 99,95%.
2. Гидрометаллургический способ заключается в выщелачивании меди слабым раствором серной кислоты, а затем выделении металлической меди непосредственно из раствора. Такой способ применяется для переработки бедных руд и не допускает попутного извлечения драгоценных металлов вместе с медью.
Применение меди
Благодаря ценным качествам медь и медные сплавы используются в электротехнической и электромашиностроительной отрасли, в радиоэлектронике и приборостроении. Существуют сплавы меди с такими металлами, как цинк, олово, алюминий, никель, титан, серебро, золото. Реже применяются сплавы с неметаллами: фосфором, серой, кислородом. Выделяют две группы медных сплавов: латуни (сплавы с цинком) и бронзы (сплавы с другими элементами).
Медь обладает высокой экологичностью, что допускает её использование в строительстве жилых домов. К примеру, медная кровля за счёт антикоррозионных свойств, может прослужить больше ста лет без специального ухода и покраски.
Медь в сплавах с золотом используется в ювелирном деле. Такой сплав увеличивает прочность изделия, повышает стойкость к деформированию и истиранию.
Для соединений меди характерна высокая биологическая активность. В растениях медь принимает участие в синтезе хлорофилла. Поэтому её можно увидеть в составе минеральных удобрений. Недостаток меди в организме человека может вызвать ухудшение состава крови. Она есть в составе многих продуктов питания. К примеру, этот металл содержится в молоке. Однако важно помнить, что избыток соединений меди может вызвать отравление. Именно поэтому нельзя готовить пищу в медной посуде. Во время кипячения в пищу может попасть большое количество меди. Если же посуда внутри покрыта слоем олова, то опасности отравления нет.
Недостаток меди в организме человека может вызвать ухудшение состава крови. Она есть в составе многих продуктов питания. К примеру, этот металл содержится в молоке. Однако важно помнить, что избыток соединений меди может вызвать отравление. Именно поэтому нельзя готовить пищу в медной посуде. Во время кипячения в пищу может попасть большое количество меди. Если же посуда внутри покрыта слоем олова, то опасности отравления нет.
В медицине медь используют, как антисептическое и вяжущее средство. Она является компонентом глазных капель от конъюнктивита и растворов от ожогов.
Химическая формула меди. Степени окисления, свойства и ответы на часто задаваемые вопросы валюты. В химии химическая формула меди обозначается как Cu. поскольку медь принадлежит к группе переходных металлов в периодической таблице, которая имеет подоболочку d и обозначается как (n — 1) d переход. Имеет атомный номер 29., таким образом, химическая формула меди обычно записывается как Cu29. Медь очень мягкая, ковкая, пластичная, а свежая открытая поверхность меди имеет розовато-оранжевый цвет.
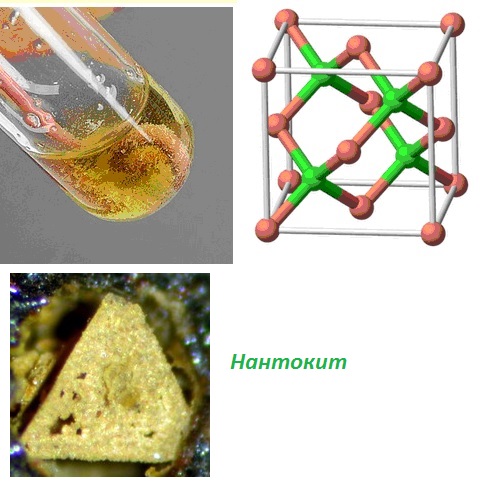
Они являются хорошими проводниками электричества с высокой теплопроводностью и поэтому широко используются в качестве металла в электропроводке. Различные сплавы также используются для изготовления ювелирных изделий, где используется стерлинговое серебро, медно-никелевый сплав используется для изготовления монет и морского оборудования, термопар для измерения температуры и тензодатчика из медного сплава константана. Необработанная металлическая форма меди показана ниже.
[Изображение будет загружено в ближайшее время]
Степени окисления меди
Хотя медь демонстрирует несколько степеней окисления из-за наличия d-подоболочек в диапазоне +1, +2,+3,+4, наиболее стабильной является степень окисления +2. Распределение электронов валентной оболочки переходного металла меди [Xe] 4s1 3d10. Таким образом, подоболочка 4s как 1 электрон вместе с 3d-электронами вместе действует как электроны валентной оболочки. Таким образом, получение стабильных степеней окисления относится к энергетическому балансу. Таким образом, потеря электронов из валентных оболочек требует энергии, а получение сильного окисления означает потерю валентных электронов, которые требуют большей энергии. Таким образом, затраты энергии на достижение определенной степени окисления должны компенсироваться сродством к электрону неметалла и электростатическими силами притяжения диполей и связывания отрицательных ионов.
Таким образом, потеря электронов из валентных оболочек требует энергии, а получение сильного окисления означает потерю валентных электронов, которые требуют большей энергии. Таким образом, затраты энергии на достижение определенной степени окисления должны компенсироваться сродством к электрону неметалла и электростатическими силами притяжения диполей и связывания отрицательных ионов.
Таким образом, металлическая медь может потерять дополнительный одиночный электрон из подоболочки 3d с одним 4s-электроном, энергия которого компенсируется, но переход к более высокому окислению требует большей энергии, которая компенсируется сродством к электрону неметалла и электростатическими силами притяжения диполей и отрицательных ионов. и поэтому неустойчивы по своей природе. Но для более электроотрицательных атомов, таких как фтор и кислород, которые обладают более высоким сродством к электрону, при образовании соединения возникает более высокая степень окисления меди. Но большинство известных соединений меди проявляют степень окисления меди +2, например CuSO4, которая представляет собой формулу сульфата меди.
Так как сульфатная группа в формуле сульфата меди сама по себе имеет степень окисления +2, и только один атом меди уравновешивает один атом сульфата в формуле сульфата меди. Таким образом, ясно, что CuSO 4 имеет степень окисления Cu (II). Другим распространенным соединением окисления меди Cu (II) является оксид меди или оксид меди, который является названием соединения CuO. Химически формула оксида меди или формула оксида меди CuO.
Производство и метод
Большая часть меди добывается из крупных карьеров медно-порфировых месторождений в виде сульфидов меди, содержащих около 0,5-1,0 % меди. Большинство этих медных рудников расположены в Чили, штат Юта в США и Мексике. По данным Британской геологической службы, перец чили был одним из крупнейших производителей медной руды в 2005 году, за ним следуют США, Индонезия и Перу. С 1900 использование меди резко увеличилось, и с учетом чистого количества меди, доступного по всему миру, было трудно сопоставить использование меди с использованием в развитых странах. Таким образом, появилась альтернатива меди, которая представляет собой полиметаллические конкреции, также известные как марганцевые конкреции, которые извлекаются из концентрических слоев меди и гидроксида марганца, присутствующих на дне океана.
Таким образом, появилась альтернатива меди, которая представляет собой полиметаллические конкреции, также известные как марганцевые конкреции, которые извлекаются из концентрических слоев меди и гидроксида марганца, присутствующих на дне океана.
На протяжении многих лет, начиная с 1900 года, некоторые методы используются для добычи меди. Для извлечения меди из конкреций используются такие методы, как серное выщелачивание, плавка с последующим применением меднокислотного процесса. Таким образом, медь, присутствующая в рудах земли, восстанавливается до 10-15% меди путем пенной флотации и процесса отбеливания. Таким образом, чтобы удалить большую часть железа, присутствующего в рудном взвеси, проводят плавление материала с кремнеземом, так что железо удаляется в виде шлака. Этот метод превращает сульфиды железа в оксиды, которые реагируют с кремнеземом с образованием силикатного шлака, всплывающего на поверхность нагретого материала. Таким образом, неиспользованный медный штейн находится в форме сульфида меди, который является названием соединения Cu2S, и подвергается обжигу для преобразования сульфидов в оксид меди (l), который представляет собой еще одну формулу оксида меди со стадией окисления +1, которая нестабильна по своей природе и легко разлагается при нагревании до чистой меди.
2 Cu2S + 3 O2 → 2 Cu2O + 2 SO2
2 Cu2O → 4 Cu + O2
[Изображение будет загружено в ближайшее время] формула оксида меди. В этой реакции оксид меди восстанавливается в присутствии водорода, где он теряет свой кислород, который присоединяется к водороду с образованием воды, и поэтому также называется гидролизом CuO.
CuO + h3 → Cu + h3O
Еще один жизнеспособный процесс: формула сульфата меди помещается в контейнер, называемый автоклавом, и подвергается воздействию газообразного водорода под давлением 25 бар (где давление газа h3 составляет около 30 бар). Затем раствор сульфата меди (который на самом деле является названием соединения CuSO4) нагревают примерно до 150 oC в течение часа, что приводит к образованию меди, которая будет осаждаться в виде медного порошка.
CUSO4 (AQ) + H3 (G) → Cu (S) + H3SO4 (AQ)
Физико -химические свойства медного
Values
Atomic weight
63. 546 g/ mol
546 g/ mol
Atomic number
29
phase
solid
Melting point
1084.62 oC or 1357.77 K
Boiling point
2562 oC or 2835 K
Density
8,96 г/см3
8,02 г/см3 в жидкости
Теплота плавления
13,26 кДж/моль
Тепла испаривания
300,4 кДж / моль
Молярная теплоемкость
24,440 J (моль ・ K)
Ионизационная энергия
1 -й: 745,5 кДж / моль
2 -е: 1957,9 кДж / моль
3 -й: 3555 кДж / моль
 0003
0003128 pm
Thermal expansion
16.5 μm / (m・K) at 25 oC
Thermal conductivity
401 W / (m・K)
hardness
3.0 Mohs scale
Molar magnetic susceptibility
-5.46 x 10-6 cm3 / mol
Electrical resistivity
16.78 nΩ • m at 20oC
Young’s modulus
110-128 GPa
Spectra lines of copper
[Image will be uploaded soon]
Химическая формула меди: символ, свойства, формулы, примеры
- Автор Анкита Сахай
- Последнее изменение 19-07-2022
Химическая формула меди: Медь — это металл, имеющий символ «\({\rm{Cu}}\). » Медь является третьим наиболее широко используемым металлом в мире. Это элемент d-блока в периодической таблице с атомным номером \(29\). Он кажется красноватым и является чрезвычайно пластичным металлом. Медь также известна как «чеканочный металл», потому что она использовалась для изготовления монет в древние времена. Это один из хорошо известных металлов, который используется во многих областях по всему миру.
» Медь является третьим наиболее широко используемым металлом в мире. Это элемент d-блока в периодической таблице с атомным номером \(29\). Он кажется красноватым и является чрезвычайно пластичным металлом. Медь также известна как «чеканочный металл», потому что она использовалась для изготовления монет в древние времена. Это один из хорошо известных металлов, который используется во многих областях по всему миру.
Медь является чрезвычайно хорошим проводником тепла и электричества, и это свойство меди объясняет ее широкое использование в производстве посуды и электрических проводов. Медь также является необходимым микроэлементом, необходимым человеческому организму. Медь обычно извлекается из руд Халькопирит, также известный как медный колчедан и подобные сульфидные руды. Медь в основном встречается в Чили и Перу, расположенных в Южной Америке. В Индии основными производителями меди являются Джаркханд, Раджастхан и Мадхья-Прадеш. После того, как медные руды извлечены, они обрабатываются в несколько этапов для извлечения из них чистой и рафинированной металлической меди.
Химическая формула меди
Узнайте, как написать химическую формулу
Название происходит от латинского слова cuprum , обозначающего Кипр, остров, где римляне впервые получили медь. Поскольку медь является элементом, вместо химической формулы у нее есть символ. Символ меди: \({\rm{‘Cu’}}\). Символ \({\rm{‘Cu’}}\) происходит от самого купрума . Этот элемент известен с доисторических времен.
Медь — это металл, который используется в различных сферах жизни и занимает важное место в цивилизации. Медь находится в группе \(11\) и периоде \(4\) современной периодической таблицы. Его атомный номер \(29{\text {th}}\) элемент современной периодической таблицы, также известный как переходный элемент, поскольку он является элементом d-блока. Некоторые важные физические свойства меди приведены ниже:
- Медь имеет характерный красновато-коричневый цвет.
- Медь — чрезвычайно мягкий, пластичный и ковкий металл. Таким образом, ему можно придать нужную форму или согнуть в соответствии с нашими потребностями.

- Является хорошим проводником тепла и электричества. По этой причине из него изготавливают электрические провода и посуду. 9{65} \mathrm{Cu}\)
Химические свойства меди
1. Как и другие металлы, медь реагирует с влажной атмосферой, что приводит к коррозии. Медь тускнеет до сине-зеленого цвета, образуя гидроксид меди и карбонат меди. Но процесс коррозии в меди протекает крайне медленно, так как под воздействием влаги и воздуха на поверхности металлической меди образуется защитный оксидный слой и основные соли.
2. Медь растворяется в азотной кислоте.
3. Медь реагирует с кислородом воздуха с образованием оксида меди (II).
\({\rm{2Cu}}\left( {\rm{s}} \right){\rm{ + }}{{\rm{O}}_{\rm{2}}}\left ( {\rm{g}} \right) \to {\rm{2CuO}}\left( {\rm{s}} \right)\)
4. Медь реагирует с галогенами с образованием галогенидов меди разных цветов. , такие как хлорид меди (желто-коричневое твердое вещество в безводном и сине-зеленое твердое вещество в дигидрате), фторид меди (белый цвет) и бромид меди (черный цвет).
5. В ряду реакционной способности металлов медь занимает нижнее положение. Таким образом, он менее реактивен. Медь вытесняется железом, когда железный гвоздь опускают в раствор медного купороса. Это приводит к образованию сульфата железа и меди.
\(\mathrm{CuSO}_{4}(\mathrm{aq})+\mathrm{Fe}(\mathrm{s}) \rightarrow \mathrm{FeSO}_{4}(\mathrm{aq} )+\mathrm{Cu}(\mathrm{s})\)
Использование меди
1. Они используются в электроприборах – Поскольку медь является отличным проводником электричества и имеет низкое удельное сопротивление. Серебро — еще один металл, который является отличным проводником электричества, даже лучше, чем медь. Его доступная цена делает его широко используемым во всем мире в производстве электроэнергии, передаче электроэнергии, телекоммуникациях, электронных схемах, производстве электрических проводов, кабелей и т. д.
2. Используется для изготовления посуды – Благодаря высокой теплопроводности, высокой температуре плавления и кипения, а также высокой пластичности медь широко используется для изготовления посуды различных форм и размеров. Как и другие металлы, медные сосуды легко проводят тепло к хранящейся в них пище и быстро готовят ее.
Как и другие металлы, медные сосуды легко проводят тепло к хранящейся в них пище и быстро готовят ее.
3. Медь также используется в теплообменниках кондиционеров, радиаторах компьютеров, автомобильных радиаторах, термосварочных машинах и телевизорах, поскольку этот металл является хорошим проводником тепла.
4. Медь очень полезна в водопроводных трубопроводах и соединительных шинах, которые являются жизненно важными элементами систем распределения электроэнергии, поскольку ее можно легко соединить пайкой, болтами или клеем.
5. Медь является одним из основных питательных веществ для человеческого организма. Он обеспечивает образование эритроцитов в организме вместе с железом. Достаточное количество меди в рационе очень важно, поскольку она помогает поддерживать здоровье костей, кровеносных сосудов, нервов и иммунной системы. Медь помогает предотвратить сердечно-сосудистые заболевания и остеопороз. Медью богаты моллюски, орехи и семечки, крупы с пшеничными отрубями, цельнозерновые продукты, шоколад, мясо и т. д.
д.
6. Медь также используется при изготовлении скульптур и статуй из-за легкости соединения. Он также используется ювелирами и другими ремесленниками.
7. Медь широко используется в автомобилях в качестве высокочистого медного провода, по которому проходит ток от автомобильного аккумулятора по всему автомобилю к оборудованию, такому как фары, центральный замок, цифровой экран и системы спутниковой навигации. Он также используется в электромобилях.
8. Медь также используется в трубопроводах. Он используется для транспорт вода хозяйственно-бытового назначения; он также используется для подачи природного газа в дома и другие места, где это необходимо.
9. Изготавливаются различные сплавы из меди, такие как бронза (медь и олово), латунь (медь и цинк), никель-серебро (медь, цинк и никель). Эти сплавы прочнее и устойчивы к коррозии, чем металлическая медь.
Резюме
В двух словах, медь — это металл, представленный как ‘\({\rm{Cu}}\)’. Это переходный металл, поскольку он присутствует в \ ({\ rm {d}} \) -блоке периодической таблицы. Атомный номер \({\rm{Cu}}\) равен \(29\). Он имеет характерный красновато-коричневый цвет и добывается из руды «Куприт», которая в основном добывается в Южной Америке. Медные рудники также есть в некоторых частях Индии, таких как Джаркханд, Раджастхан и т. д. С древних времен медь была необходима для различных видов жизнедеятельности.
Это переходный металл, поскольку он присутствует в \ ({\ rm {d}} \) -блоке периодической таблицы. Атомный номер \({\rm{Cu}}\) равен \(29\). Он имеет характерный красновато-коричневый цвет и добывается из руды «Куприт», которая в основном добывается в Южной Америке. Медные рудники также есть в некоторых частях Индии, таких как Джаркханд, Раджастхан и т. д. С древних времен медь была необходима для различных видов жизнедеятельности.
Это хороший проводник электричества, поэтому в основном используется для изготовления электрических проводов, кроме меди. Серебро — еще один металл, который является отличным проводником электричества, но медь дешевле серебра, поэтому ее используют для изготовления электрических проводов. Медь поставляет электричество и чистую воду в наши дома и города и играет важную роль в достижении устойчивого развития. Более того, это необходимо для самой жизни, поскольку нашему телу нужны следы меди в качестве минералов, чтобы выжить. 9{1}\)
Q. 2. Откуда произошло химическое название меди?
2. Откуда произошло химическое название меди?
Ответ: Химически медь обозначается как ‘\({\rm{Cu}}\)’. Его символ происходит от латинского слова cuprum , обозначающего Кипр, остров, где римляне впервые получили медь. Таким образом, символ \({\rm{‘Cu’}}\) происходит от первых двух букв самого купрума .
Q.3. Что такое медь?
Ответ: Медь — это металл, присутствующий в d-блоке периодической таблицы. Атомный номер \({\rm{Cu}}\) равен \(29\). Он имеет характерный красновато-коричневый цвет и добывается из руды «Куприт». Медь — очень ковкий и пластичный металл. Кроме того, это отличный проводник электричества и тепла. Благодаря этим уникальным свойствам медь широко используется в производстве электрических проводов и посуды. Он используется в различных сферах жизни и имеет древнюю историю. Медь также известна как «металл для монет», потому что в древние времена люди использовали медные монеты.
Q. 4. Каковы два химических свойства меди?
4. Каковы два химических свойства меди?
Ответ: Два химических свойства меди: (i) Медь реагирует с кислородом воздуха с образованием оксида меди (II). (ii) Медь тускнеет до сине-зеленого цвета с образованием гидроксида меди и карбоната меди.
Q.5. Из чего делают медь?
Ответ: Медь является элементом. Это природный ресурс, обнаруженный в виде руды, известной как куприт, найденной глубоко в земле. После добычи медь проходит несколько этапов очистки и рафинирования, чтобы обойти \(99,9%\) чистого металла.
«Мы надеемся, что эта статья «Химическая формула меди» помогла вам. Если у вас есть какие-либо вопросы, оставьте комментарий ниже, и мы свяжемся с вами».
Последние обновления
Структура оплаты за 12 класс CBSE: Проверьте важные детали
Структура оплаты за 12 класс CBSE: Центральный совет по среднему образованию (CBSE) является крупнейшим советом по образованию в Индии. Многие учащиеся стремятся получить с его помощью свое среднее образование или 12-й класс. Принимаются отметки CBSE Class 12…
Многие учащиеся стремятся получить с его помощью свое среднее образование или 12-й класс. Принимаются отметки CBSE Class 12…
Подробнее
Решения NCERT для политологии 9 класса Глава 2
Решения NCERT для политологии 9 класса Глава 2: Конституционный дизайн является одной из важных тем политологии 9 класса. Он рассказывает учащимся о Конституции, роли лидеров в создании Конституции,…
Читать дальше
Решения NCERT для 6-го класса «Социальная география», глава 4
NCERT Solutions for Class 6 Social Science Geography Chapter 4: В главе 4 Class 6 Social Science мы изучаем использование карт для различных целей. Карта представляет собой изображение или рисунок земной поверхности или…
Подробнее
Решения NCERT для класса 8 по географии социальных наук, глава 6
Решения NCERT для класса 8 по географии социальных наук Глава 6: Глава 6 книги NCERT 8-го класса CBSE — это человеческие ресурсы.

 Селен
Селен Гольмий
Гольмий Фермий
Фермий