Серый чугун: применение, свойства, структура, состав
Серый чугун своим названием обязан графитовым включениям, дающим на изломе характерный оттенок. Хорошие литейные свойства обеспечили сплаву широкое применение в машиностроении. Из него получают отливки, требующие высокой прочности и износостойкости.
Химический состав
Основные свойства и химический состав серого чугуна регламентируются ГОСТом 1412-85.
Оптимальное содержание углерода составляет 2,4-3,7%. При более низкой концентрации он полностью растворится в железе, а ее превышение приведет к потере твердости и упругости.
Кремний – 1,2-2,5%. Он участвует в процессе графитизации, повышая твердость металла и снижая его вязкость. Влияние углерода и кремния рассматривается в совокупности, с учетом их суммарной концентрации.
Сера соединяется с железом с образованием сульфида FeS, который снижает свойства прочности и пластичности сплава. Допускается содержание серы не более 0,12-0,15%.
Марганец смягчает вредное влияние серы и способствует образованию свободных карбидов железа. Его количество определяется содержанием серы, и обычно составляет 0,5-1.1%.
Его количество определяется содержанием серы, и обычно составляет 0,5-1.1%.
Концентрация фосфора не превышает 0,2-0,3%. Элемент образует включения фосфидной эвтектики, увеличивая твердость и износоустойчивость.
В зависимости от марки допускается включение в состав серого чугуна:
- хрома – он увеличивает карбидообразование, а с этим процессом повышаются твердость и прочность материала;
- олова, способствующего равномерному распределению твердости по разным сечениям;
- никеля и молибдена – для повышения сопротивляемости коррозийным процессам и улучшения обрабатываемости;
- меди – ее присутствие способствует ускорению графитизации, увеличению упругости и стойкости к коррозии, улучшению обрабатываемости;
- сурьмы – до 0,08%, оказывает влияние на процессы кристаллизации.
Структура сплава
Свойства и применение серого чугуна зависят от его состава и структуры. Один из важных факторов, влияющих на формирование металлической основы – скорость охлаждения после отвердевания. В зависимости от нее формируется металлическая основа структуры сплава.
В зависимости от нее формируется металлическая основа структуры сплава.
Перлитная основа. Чем быстрее охлаждается заготовка, тем большую долю составляет в ней перлитная структура, состоящая из феррита и карбида наряду с тонкими пластинками графита. Она отличается высокой твердостью и прочностью.
Ферритно-перлитная. При щадящем охлаждении в структуре серого чугуна возрастает доля феррита – сплава железа с оксидами Fe2O3 и других металлов. Образуется основа, состоящая из феррита, перлита и пластинчатого графита. Обладает более высокой пластичностью.
Ферритная основа образуется при быстром охлаждении. Она состоит из вязкого феррита и свободного углерода в виде пластинок графита. Их присутствие ухудшает механические свойства металла, снижает его прочность и сопротивляемость растяжению. В то же время графит:
- повышает износоустойчивость сплава, действуя подобно смазке;
- улучшает обрабатываемость;
- снижает усадку в процессе литья;
- гасит вибрацию деталей.

Механические свойства
Главные характеристики, обеспечивающие применение сплава в литейном производстве:
- небольшая температура отвердевания;
- высокая текучесть в жидком состоянии;
- отсутствие склонности к образованию раковин;
- малая объемная усадка.
Важное значение имеют показатели:
- прочности серого чугуна;
- износостойкости при трении;
- герметичности, то есть устойчивости к образованию трещин и пор.
Они зависят от его структуры и твердости. Чем меньше размеры графитовых пластинок, тем выше эти показатели. Особенно высокой твердостью должны обладать детали, которые подвергаются постоянным ударно-абразивным нагрузкам. Высокие требования герметичности предъявляются к изделиям, эксплуатирующимся в условиях большого давления жидкостей или газов:
- трубопроводам;
- насосам и компрессорам;
- гидравлическим приводам.
Степень герметичности зависит:
- от параметров текучести;
- изменения давления;
- наличия транзитной микропористости.

Наибольшими прочностными характеристиками обладает перлитный серый чугун, что позволяет применять его в производстве нагруженных деталей машин.
Сплав склонен к растрескиванию при сварке, к ней прибегают только при необходимости:
- восстановления сильно изношенных механизмов;
- изготовления комбинированных узлов с другими металлами;
- устранения имеющихся в отливках дефектов.
Некоторые сорта вообще не поддаются сварке.
Расшифровка маркировки
ГОСТом 1412-85 установлена группа марок серого чугуна. Они маркируются буквенно-числовым обозначением:
- буквы СЧ постоянны для всех сплавов;
- за ними следуют цифры, обозначающие наименьший показатель предела прочности на растяжение в кг/мм2.
Например, для марки СЧ24 предел прочности составляет 24 кг/мм2 или 240 МПа. Для высокопрочных сплавов применяется маркировка ВЧ с указанием предела прочности и процента относительного удлинения – ВЧ60-2. Каждому типу сплава соответствует свой интервал значений предела прочности:
Каждому типу сплава соответствует свой интервал значений предела прочности:
- марки до СЧ10 относятся к ферритным чугунам;
- СЧ10-СЧ18 – ферритноперлитным;
- выше СЧ25 – перлитным.
Физические и технологические свойства металла изменяются в зависимости от типа структуры и марки. С увеличением количества углерода:
- плотность снижается с 6,8 до 7,4 г/см3;
- предел прочности повышается с 240 до 400 МПа;
- линейная усадка растет с 1,0 до 1,3%.
Область применения
Серый чугун является одним из самых востребованных продуктов черной металлургии. Его доля в общем объеме производства составляет не менее 80%. В машиностроении применяются марки с высоким содержанием графита, так как они способны поглощать вибрационные колебания, возникающие при работе механизмов. Сплав используется для получения ответственных деталей:
- втулок;
- станин для станков
- тяжелых оснований.
Необходимые свойства серому чугуну придают при помощи легирования молибденом или хромом.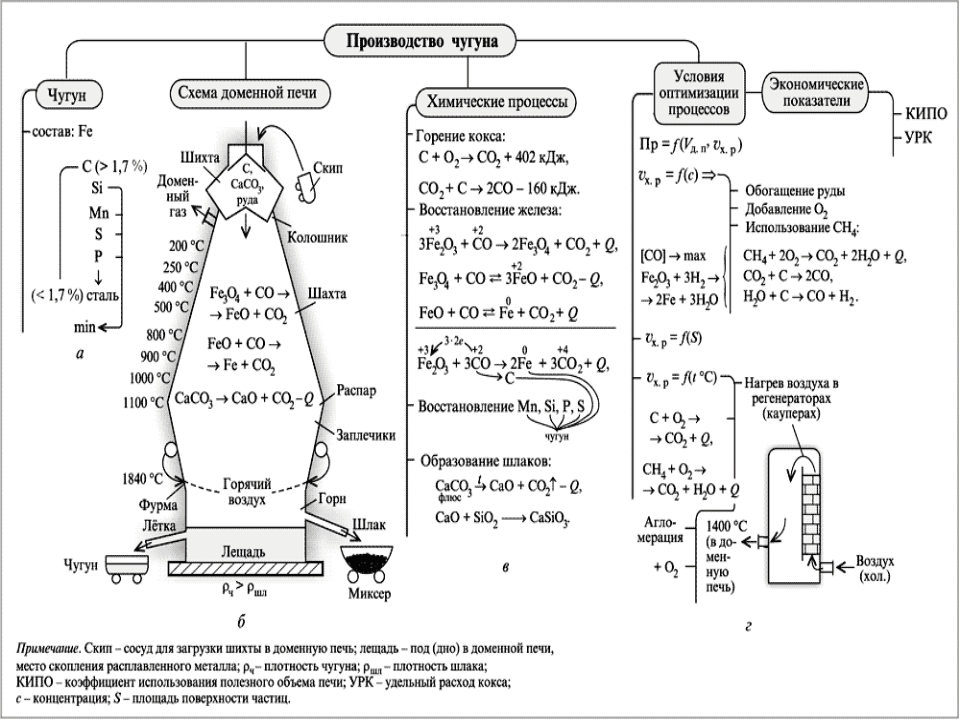 Высокая износостойкость при трении в отсутствие смазки необходима:
Высокая износостойкость при трении в отсутствие смазки необходима:
- для нажимных дисков сцепления;
- блоков;
- крышек подшипников;
- тормозных дисков или барабанов.
Из марок с перлитной структурой производят детали, испытывающие большие нагрузки: гильзы и головки цилиндров; распределительные валы.
И сегодня остаются востребованными чугунные изделия различного назначения:
- сантехника для дома;
- кухонная посуда;
- трубы и радиаторы отопления;
- чугунные ограждения и скульптуры.
Отливки 1 класса
Для производства каждой детали из серого чугуна подбирается марка, соответствующая по своим характеристикам условиям эксплуатации. К 1 классу относятся изделия, которые должны обладать:
- пределом прочности на растяжение – 25-30 кг/мм2;
- модулем упругости – 1,15-1.30*10-6 МПа;
- стабильностью геометрической формы.
Отливки 1 класса подвергаются высоким нагрузкам, давлению или трению скольжения:
- зубчатые колеса;
- поперечины и ползуны;
- кронштейны;
- станины шлифовальных станков;
- гидроцилиндры;
- пневматическое оборудование.

В зависимости от толщины изделий, для их изготовления используются марки:
- СЧ21-СЧ40;
- СЧ28-СЧ48.
Детали 1 класса, подвергающиеся сильному износу, должны иметь мелкопластинчатую структуру перлита и твердость до 180 НВ. Для ответственных деталей допустимо применение серого чугуна марки СЧ32-СЧ-52.
Детали 2 класса
К отливкам 2 класса относят корпусные части и базовые детали, не работающие на износ:
- станины токарных или револьверных станков;
- листопрокатные валки;
- детали сменного оборудования.
Однако к ним тоже предъявляются повышенные требования предела прочности – до 20-25 кг/мм2. Для достижения таких показателей рекомендуется использовать марки:
- СЧ15-СЧ32;
- СЧ21-СЧ40.
Изделия, изготовленные из литого чугуна, характеризуются большим сроком эксплуатации, при этом – минимальной стоимостью.
Механические и технологические свойства чугуна
Чугун является своеобразным композитным материалом, механические и эксплуатационные свойства которого зависят от характеристик металлической основы (прочность, пластичность, твердость и др. ), а также формы, размеров, количества и распределения Графитовых включений. При этом решающее значение в ряде случаев Имеет либо графит, либо металлическая основа. Например, модуль упругости чугуна в решающей степени зависит от формы и величины графитовых включений, а твердость в основном определяется свойствами металлическое основы. Такие свойства, как ременное сопротивление разрыву, Ударная вязкость, длительная прочесть, зависят как от свойств металлической основы, так и от формы или размеров и количества графитовых включений. Свойства структурных составляющих металлической основы чугуна приведены в табл. 1.
), а также формы, размеров, количества и распределения Графитовых включений. При этом решающее значение в ряде случаев Имеет либо графит, либо металлическая основа. Например, модуль упругости чугуна в решающей степени зависит от формы и величины графитовых включений, а твердость в основном определяется свойствами металлическое основы. Такие свойства, как ременное сопротивление разрыву, Ударная вязкость, длительная прочесть, зависят как от свойств металлической основы, так и от формы или размеров и количества графитовых включений. Свойства структурных составляющих металлической основы чугуна приведены в табл. 1.
Получение той или иной структуры чугуна в отливках зависит от многих факторов: химического состава чугуна, вида шихтовых материалов, технологии плавки и внепечной обработки металла, скорости кристаллизации и охлаждения расплава в форме, а следовательно, толщины стенки отливки, теплофизических свойств материала формы и др. Структуру металлической основы чугуна можно изменять также термической обработкой отливок, общие закономерности влияния которой аналогичны возникающим при термической обработке углеродистой стали, а особенности связаны с сопутствующими изменениями металлической основы процессами графитизации.
Среди элементов химического состава С и Si определяют формирование структуры чугуна, а при заданной технологии литья приведенный размер стенки отливки
где К≤4,5 — для перлитно-цементной структуры;
К=4,5⁄6,0 для перлитно-графитной структуры;
К=10⁄14 для перлитно-ферритно-графитной структуры;
К≥14 для ферритно-графитной структуры.
Наряду с Si большое значение как графитизирующий элемент имеет Аl, который иногда частично или полностью заменяет Si. Это улучшает свойства чугуна, особенно пластичность. Наиболее благоприятное сочетание характеристик прочности, вязкости и пластичности достигается и алюминиевых чугунах при содержании в них Si≤1,0%.
По влиянию небольших добавок других элементов на структуру чугуна и, следовательно, свойства добавки можно разбить на три группы.
Первая группа элементов (Ni, Со, Сu) аналогично Si оказывает графитизирующее влияние, способствует размельчению выделений графита. Одновременно эти элементы стимулируют получение более дисперсных перлитных игольчатых и мартенситных структур даже при сравнительно медленном охлаждении.
| Структурные составляющие чугуна | σв, МПа | δ, % | HB∗10-1, МПа |
|---|---|---|---|
| Феррит | 250-400 | 30-50 | 110-140 |
| Перлит | 800-1000 | 15-20 | 200-260 |
| Сорбит | 1200-1400 | 10-15 | 240-300 |
| Тростит | — | — | 280-320 |
| Бейнит | — | — | 300-350 |
| Мартенсит | 1400-1800 | — | 350-550 |
| Аустенит | 400-800 | 40-60 | 140-160 |
| Цементит | 30-50 | — | 750-800 |
| Фосфидная эвтектика | — | — | 300-400 |
| Графит | 17-35 | — | 130-180 |
При легировании фаз металлической основы свойства их повышаются.

Вторая группа элементов (Сr, Мо, W, V и др.) в противоположность первой препятствует графитизации с интенсивностью, пропорциональной концентрации. При содержании, превышающем предел растворимости; их в цементите или феррите, они образуют специальные карбиды.
К третьей группе элементов можно отнести Ti, Zr, Се, Са, Mg, В и др. Эти элементы характеризуются высокой химической активностью, почти целиком расходуются на образование тугоплавких карбидов, сульфидов, оксидов, нитридов, которые могут служить зародышами в процессе последующей кристаллизации и повышать дисперсность металлической основы. Более того, элементы этой группы Alg, Са, Се и др. редкоземельные металлы (РЗМ) входят в состав лигатур для модифицирования чугуна с целью получения графита веринкулярной или шаровидной формы.
Влияние графитовых включений на различные эксплуатационные свойства чугуна также многообразно и не однозначно.
При нагружении чугуна графитовые включения, являясь «надрезами», снижают его прочность и пластичность. Это происходит, во-первых, вследствие некоторого уменьшения живого сечения металлической основы из-за полостей, занятых графитом, имеющим небольшую прочность на разрыв, и, во-вторых, что наиболее важно, из-за высокой концентрации напряжений, возникающей в местах графитовых включений, особенно при пластинчатой форме графита. Чем длиннее пластинки графита, тем больше коэффициент концентрации напряжений. Все это приводит к резкой локализации пластических деформации в металлической основе, исчерпанию пластичности материала в этих местах, развитию трещин и в итоге — к квазихрупкому разрушению материала при средних напряжениях и показателях пластичности, более низких, чем прочность и пластичность металлической основы чугуна.
Кроме того, из-за разного коэффициента термического расширения графита и металлической основы при охлаждении отливок в чугуне возникают структурные напряжения II рода, которые, постепенно возрастая, достигают предела упругости материала в местах концентрации напряжений (при пластинчатой форме графита). Поэтому дополнительная внешняя нагрузка любой ветчины вызывает необратимые пластические деформации в материале, и чугун с пластинчатым графитом в литом состоянии, по существу, не имеет предела упругости. Однако он может приобрести это свойство в результате «тренировки» различными нагрузками, приводящими к упрочнению металлической основы в местах концентрации напряжений. Этой же цели могут служить различные варианты термомеханической или термоциклической обработки, что особенно важно для высокоточных деталей прецизионных станков и других подобных машин.
Упрочнение металлической основы в местах концентрации напряжений происходит при естественном старении отливок из чугуна с пластинчатым графитом (вылеживании) даже при отсутствии напряжений I рода, из-за протекания релаксационных процессов высоких напряжений II рода. В результате возрастает сопротивляемость образованию пластических деформаций при нагружении небольшими нагрузками. Указанный процесс интенсифицируется при вылеживании отливок на воздухе, когда добавляется термо-циклическое воздействие изменений погодных условий.
Модуль упругости чугуна Е из-за графитовых включений ниже, чем у его металлической основы, так как образуются дополнительные обратимые деформации полостей, занятых графитом, особенно заметные при больших нагрузках. Поэтому значение
Все отмеченные явления становятся менее заметными при увеличении дисперсности пластинчатого графита до 100—200 мкм и особенно при его компактных формах (вермикулярный, шаровидный графит). Поэтому ковкий и высокопрочный чугуны при одинаковой структуре металлической основы имеют более высокую прочность, модуль упругости, пластичность; у них появляется предел упругости.
Наличие графитовых включений делает чугун, особенно с пластинчатым графитом, практически не чувствительным к надрезам, что позволяет конкурировать ему с более прочной сталью по сопротивлению усталости и пределу выносливости. Включения графита обеспечивают высокую износостойкость чугуна в условиях трения скольжения со смазкой и т. д.
Механические свойства серого чугуна
В (табл. 1) — приведены механические свойства и рекомендуемый химический состав серого чугуна по ГСТ 1412-85, а в (табл. 2) — некоторые, не предусмотрены этим стандартам свойств чугуна. В общем случае, чем меньше графита, мельче и благоприятнее по распределению его включения, дисперснее перлит, мельче эвтектическое зерно, тем выше указанные свойства. Однако если σв, τ-1, τтв, φ зависят как от графита, так и 1 металлической основы, то
| σв, МПа | 140 | 175 | 210 | 255 | 300 |
|---|---|---|---|---|---|
| σ-1, МПа: без надреза |
65 | 84 | 105 | 140 | 163 |
| с надрезом | 65 | 80 | 95 | 120 | 130 |
| Чугун | σв, МПа | Твердость HB∗10-1, МПа | Мас. доля элементов, % | ||||
|---|---|---|---|---|---|---|---|
| C | Si | Mn | P | S | |||
| не более | |||||||
| СЧ10 | 98 | 143-229 | 3,5-3,7 | 2,2-2,6 | 0,5-0,8 | 0,3 | 0,15 |
| СЧ15 | 147 | 163-229 | 3,5-3,7 | 2,0-2,4 | 0,5-0,8 | 0,2 | 0,15 |
| СЧ18 | 176 | 170-241 | 3,4-3,6 | 1,9-2,3 | 0,5-0,7 | 0,2 | 0,15 |
| СЧ20 | 196 | 170-241 | 3,3-3,5 | 1,4-2,2 | 0,7-1,0 | 0,2 | 0,15 |
| СЧ21 | 206 | 170-241 | 3,3-3,5 | 1,4-2,2 | 0,7-1,0 | 0,2 | 0,15 |
| СЧ24 | 235 | 170-241 | 3,2-3,4 | 1,4-2,2 | 0,7-1,0 | 0,2 | 0,15 |
| СЧ25 | 245 | 180-250 | 3,2-3,4 | 1,4-2,2 | 0,7-1,0 | 0,2 | 0,15 |
| СЧ30 | 294 | 181-255 | 3,0-3,2 | 1,0-1,3 | 0,7-1,0 | 0,2 | 0,12 |
| СЧ35 | 343 | 197-269 | 2,9-3,0 | 1,0-1,1 | 0,7-1,1 | 0,2 | 0,12 |
Чугуны марок СЧ25 И выше обычно модифицируют FeSi. Для них содержание Si в таблице дано после введения модификатора.
| Чугун | При растяжении | При сжатии | ||||||
|---|---|---|---|---|---|---|---|---|
| E∗10-3, МПа | δ, % | σ-1p, МПа | σc, МПа | E∗10-3, МПа | μ | ψ, % | δ-1c, МПа | |
| СЧ10-СЧ18 | 60-80 | 0,2-1,0 | 50-70 | 500-800 | 65-90 | 0,28-0,29 | 20-40 | 70-90 |
| СЧ20-СЧ30 | 85-125 | 0,4-0,65 | 90-115 | 850-1000 | 93-130 | 0,28-0,29 | 15-30 | 120-145 |
| СЧ30-СЧ35 | 125-145 | 0,65-0,9 | 115-140 | 1000-1200 | 130-155 | 0,28-0,29 | 15-30 | 145-170 |
| Чугун | При кручении | При срезе | φ, %, при вибрации с нагрузкой, равной 1/3σ0,2 | αн, кДж/М2 | При изгибе | |||
|---|---|---|---|---|---|---|---|---|
| τв, МПа | τ-1, МПа | τв, МПа | G∗10-3, МПа | σ-1, МПа | σи, МПа | |||
| СЧ10-СЧ18 | 240-320 | 60-80 | 150-220 | 40-44 | 30-32 | 40-70 | 58-66 | 240-360 |
| СЧ20-СЧ30 | 280-360 | 100-120 | 250-355 | 45-54 | 23-30 | 80-100 | 67-133 | 400-500 |
| СЧ30-СЧ35 | 360-400 | 120-140 | 355-400 | 54-64 | 23-25 | 80-90 | 133-155 | 500-540 |
φ — циклическая вязкость, характеризующая скорость затухания вибрации, а значит чувствительность к надрезам.
Влияние легирующих элементов на механические свойства чугуна марок СЧ показано на рис. 1, а изменение прочности серого чугуна в зависимости от толщины стенки отливки, получаемой в песчаной форме — на рис. 2.
Для различных групп отливок путем варьирования содержания химического состава основных элементов и легирования чугуна небольшими добавками обеспечивают комплекс оптимальных эксплуатационных свойств. Так, для блоков цилиндров карбюраторных двигателей чугун легируют Сr (0,2— 0,5 %) и Ni (до 0,2 %), а для автомобильных дизелей дополнительно Си (0,2—0,4%). Необходимые свойства Для тракторных двигателей обеспечивают повышенным (до 1,4 %) содержанием Мn.
Гильзы карбюраторных двигателей изготовляют из чугуна СЧ25 с обычным (0,14%) и повышенным (0,17— 0,22 %) содержанием фосфора.
Для ребристых цилиндров двигателей воздушного охлаждения используют чугун, легированный Sb (0,5—0,08%), Сr (0,4-0,6%) и Nl (0,1—0,3%) или Ni (0,65%) н Р (0,65—75%).
В станкостроении для повышения твердости средних по развесу отливок наряду с модифицированием чугуна FeSi и SiCa применяют ковшовое легирование Сu (0,3—0,4%) и Сr (0,2—0,3%). При толщине стенки более 15—20 мм используют легирование Сu (0,8—1,0%) и Сг (0,3—0,5%). Для средних и тяжелых отливок, в которых допускается наличие в микроструктуре карбидных включений, применяют комплексное легирование чугуна Мо (0,3—0,8%), Ni (0,7—1,2%) и Сr (0,2—0,6%). В отдельных случаях для повышения твердости применяют легирование В (0,04%) совместно с Сu (0,4—0,6%) или Ni (0,5—0,6%).
Рис. 1. Влияние легирующих элементов на прочность и твердость чугуна с пластинчатым графитом состава: 3,2% С; 1,85% Si; 0,7% Мn; 0,14% РРис. 2. Изменение прочности серого чугуна различных марок в зависимости от толщины стенки отливки
Максимальная прочность чугуна при плавке в индукционных печах достигается при отношении Si/C=0,85÷l,0 (при постоянной степени эвтектичности). При получении чугунов СЧЗО, СЧ35, в случае ваграночной плавки, более низкое отношение Si/C=0,6÷0,7 компенсируют повышенным содержанием Мп (1,0—1,5%).
Герметичность отливок из чугуна зависит как от графитовой, так и от усадочной пористости; при этом, чем ниже эвтектичность серого чугуна, тем большее значение приобретают условия эффективного питания при затвердевании отливок (градиент температур, обеспечивающий направленное затвердевание, достаточный металлостатический напор).
Несмотря на наличие графита, герметичность чугуна достаточно велика, если в отливке отсутствуют литейные дефекты. Так, при испытании водой или керосином при давлении до 10—15 МПа втулки толщиной 2 мм имеют полную герметичность. Чугунные отливки с мелким графитом и низким содержанием Р при отсутствии волосяных трещин могут противостоять давлению жидкости до 100 МПа и газов до 70 МПа.
Свариваемость серого чугуна значительно хуже, чем у углеродистой стали; поэтому газовая и дуговая сварка, как и заварка дефектов (особенно крупных) на отливках, проводится по особой технологии.
Обрабатываемость серого чугуна обратно пропорциональна его твердости. Она улучшается по мере увеличения количества феррита в структуре, а также по мере повышения однородности структуры, т. е. при отсутствии в ней включений фосфид-иой эвтектики, карбидов, обладающих повышенной твердостью. Наличие графита полезно, так как стружка получается крошащейся и давление на инструмент уменьшается.
Формула чугуна | Справочник конструктора-машиностроителя
?Однако для нас, современных, значительно важнее осознание беспрецедентности трудового подвига, понимание причастности к нему, надобности продолжать традиции.
В диалоге перед началом митинга, посвященного юбилейной дате комбината, начальник доменного цеха Александр Мавров высказал правильную мысль : « За десятилетия формула чугуна не изменилась – сплав железа с углеродом.
Но ведь это еще и сплав с людским нравом и мужеством : либо целую жизнь делать с редким металлом, либо сразу уходить в места поспокойнее ».
p-126853-gallery
КИНО/ВИНО@LoftWineBar Советская пропаганда в анимации
« Я родом из Магнитки, с комбината » – применительно к большинству горожан это, казалось бы, ставшее расхожим утверждение имеет самое непосредственное касательство.
Например, председатель городского Собрания Александр Морозов вспоминает собственного дедушку – орденоносца Зиновия Светлякова.
Тот целую жизнь отработал в знаменитой « шатилинской бригаде ».
Сидел на главной домне еще до битвы, во время нее и после.
Поэтому прозвучавшее накануне юбилея поздравление Президента РФ Владимира Путина адресует и ему, собственному деду — доменщику Зиновию Ивановичу.
Применение серого чугуна в станкостроении.
К главному классу отливок относятся базовые, корпусные и прочие подробности высокой крепости или износостойкости.
Чугун в доминирующих по толщине участках отливок, которые назначают в основном крепость и жесткость деталей, необходим иметь предел крепости на растяжение около 25 — 30 кГ/мм — и модуль упругости около ( 1, 15 — 1, 35 ) 10 4.
В зависимости от конкретных толщин стен для обеспечения в отливках этой заданной прочности рекомендуются для предпочтительного использования следующие марки серого чугуна : СЧ 21 — 40, СЧ 28 — 48, СЧ 32 — 52.
Распределительные валы ( табл.
39 ).
Тенденция к замене стальных распределительных валов литыми чугунными связана с длинными служебными свойствами низколегированного чугуна по сравнению со сталью, которые определяются особенностями структуры.
Наличие графита в чугунных кулачках способствует удержанию смазки, что само по себе уменьшает износ кулачков.
Меньший модуль упругости чугуна обусловливает и меньшие контактные напряжения в нем.
Наилучшей износостойкостью обладают распределительные валы из низколегированного чугуна, в структуре которого содержатся первичные карбиды в виде шипов, строк или ячеек.
При этом игольчатая структура карбидов наиболее желательна.
Последующая тепловая обработка ( закалка ) кулаков должна обеспечить наибольшую твердость, не изменяя структуры первичных карбидов.
Непозволительно содержание остаточного аустенита свыше 10%.
Металлическая матрица закаленного чугуна состоит из игольчатого мартенсита и обеспечивает надежное удерживание карбидных зерен при влиянии на них циклических нагрузок.
Химический состав чугуна должен обеспечить получение оптимальной исходной структуры в отливке и его хорошую прокаливаемость и закаливаемость.
Высокая твердость кулачков может быть извлечена и в литье ( отбеленные кулачки ), при этом носки кулачков оформляются кокилем.
Следует заметить, что распределительные чугунные закаленные валы более технологичны и обладают выше эксплуатационными свойствами.
Поэтому не по случаю на юбилейную вахту у горна наряду с сегодняшними работниками цеха : мастерами Валерием Юхловым, Юрием Зориным, старшим горновым Сергеем Крыгиным, горновыми Альбертом Хасановым, Ромазаном Жалкановым, Александром Михиным, Виктором Клемешевым, газовщиком Сергеем Атановым и другими специалистами – заступили ветераны — доменщики Николай Ерофеев, Хамит Хайбулов, Лев Маркелов, Василий Сапожников.
В этом факте и закономерность, и тот самый « удивительный » момент, о котором на митинге говорил вице-президент ООО « Управляющая компания ММК » по операционной деятельности–исполнительный директор ОАО « ММК », депутат Законодательного собрания Челябинской области Геннадий Сеничев :
Чугуны
САНКТ-ПЕТЕРБУРГСКОЕ
ГОСУДАРСТВЕННОЕ БЮДЖЕТНОЕ ПРОФЕССИОНАЛЬНОЕ ОБРАЗОВАТЕЛЬНОЕ УЧРЕЖДЕНИЕ
«МАЛООХТИНСКИЙ КОЛЛЕДЖ»
УЧЕБНО-МЕТОДИЧЕСКОЕ ПОСОБИЕ
ПО ПРЕДМЕТУ МАТЕРИАЛОВЕДЕНИЕ
ЧУГУНЫ
Преподаватель спецдисциплин: Н.Н. Годова
Санкт-Петербург
2013
Настоящее пособие предназначено для профессионально – технических заведений, подготавливающих квалифицированных рабочих по профессиям, связанных с ремонтом и обслуживанием машин и механизмов и обработкой различных материалов. Пособие содержит общие и частные цели, информацию об изучаемой теме, задания на проверку достижения цели, контрольные вопросы.
Содержание
1.Введение………………………..………………………………………3
2.Чугуны
2.1. получение чугуна……………………………….. …………………..4—6
2.2 методы получения отливок………………………………………..6—9
2.3. классификация чугунов……………………………………………….9-11
2.4. влияние «С» и вредных примесей на свойства чугуна…12-14
2.5.свойства чугунов. Применение…………………………………..14—16
2.6.марки чугунов……………………………………………………….17-20
3. Контрольные вопросы и контрольные задания………………..20-21
4. Литература ……………………………………… ……………………….22
5. Приложения……………………………………………………………22-24
ВВЕДЕНИЕ
Пособие выполнено в виде модуля
Структура пособия в целом соответствует структуре учебника. Каждая подтема (учебный элемент) пособия состоит из:
— краткого содержания;
— практических упражнений, включающих цели конкретного упражнения
Общие цели
После изучения модуля обучающиеся смогут:
— раскрыть основные понятия, связанные с чугунами
— классифицировать чугуны
— указать свойства чугунов и их применение
— расшифровать марки чугунов
Частные цели
После изучения учебных элементов обучающиеся смогут:
— раскрыть понятие чугун
— назвать исходные материалы для получения чугуна
— указать назначение флюса, шлака, кокса
— описать три стадии получения чугуна
— указать цель обогащения руды
— раскрыть понятия: отливка, литниковая система, лигатура, металлическая шихта
— назвать способы получения отливок
— сопоставить процессы, проводимые для улучшения свойств литейных сплавов
— классифицировать чугуны в зависимости от состояния углерода и химического состава, назначения
— назвать примеси
— определить зависимость свойств чугунов от влияния углерода и постоянных примесей
— назвать свойства чугунов
— указать применение чугунов в зависимости от их свойств
— расшифровать марки чугунов
Учебные элементы, входящие в состав модуля:
УЭ 03-01- Получение чугуна.
УЭ 03-02- Методы получения отливок
УЭ 03-03- Классификация чугунов
УЭ 03-04- Влияние углерода и постоянных примесей на свойства чугуна
УЭ 03-05- Свойства чугунов.
УЭ 03-06- Марки чугунов
Рекомендуемая последовательность изучения учебных элементов:
03-01 → ( 03-02 ↔ 03-03 ↔ 03-04 ) → ( 03-05 ↔ 03-06 )
Имеется контрольная карта преподавателя
УЭ 03 – 01 ПОЛУЧЕНИЕ ЧУГУНА
Цели:
Изучив данный учебный элемент, вы сможете
— раскрыть понятие чугун
— назвать исходные материалы для получения чугуна
— указать назначение флюса, шлака, кокса, ферросплавов
— описать три стадии получения чугуна
— указать цель обогащения руды
— назвать печь, в которой выплавляют чугун
Оборудование, материалы и вспомогательные средства
|
Наименование |
Количество |
|
презентация |
|
|
|
|
УЭ 03 – 01 ПОЛУЧЕНИЕ ЧУГУНА.
Чугун получают из железной руды с помощью топлива и флюсов. Железная руда в основном состоит из оксидов железа и пустой породы (песок, глина, минеральные примеси). Для частичного удаления из руды вредных примесей (серы и фосфора) и получения легкоплавких шлаков применяется флюс –известняк СаСО. Шлак защищает металл от печных газов и воздуха при плавке. В качестве топлива применяется кокс, который получают из
высококачественного угля (антрацита) нагревом без доступа воздуха до 1000… 1100°С, а также природный газ.
Чугун выплавляют в доменных печах. Процесс получения чугуна состоит из трех стадий:
1. восстановление железа из окислов
2. науглероживание ( насыщение железа углеродом)
3. шлакообразование
Восстановление железа из руды идет по схеме:Fe2O3— Fe3O4– FeO-Fe.
(Часть окислов железа восстанавливается твердым углеродом кокса.)
Полученное железо соединяется с углеродом кокса или вступает с ним в химическое соединение ( 3Fe+С =Fe3C). Получается сплав железа с углеродом — чугун. В процессе плавки в чугун попадают из руды кремний, марганец и фосфор, из кокса – сера. Таким образом чугун – это сплав железа ( до 92%) с углеродом ( от 2,14 до 5 %) и примесями кремния, марганца, серы и фосфора. Кроме чугуна в процессе доменной плавки получают шлак, ферросплавы и доменные газы. Шлак используется в строительстве, ферросплавы – при производстве стали и для
раскисления, а доменные газы после очистки – как топливо.
УЭ 03 – 01 ПОЛУЧЕНИЕ ЧУГУНА
Проверка достижения целей
1. Выберите правильный ответ:
Чугун – это:
а) сплав железа с углеродом ( менее 2,14% ) и примесями кремния, марганца, серы, фосфора.
б) сплав железа с углеродом ( до 2,14% ) и примесями кремния, марганца, серы.
в) сплав железа с углеродом ( более 2,14% ) и примесями кремния, марганца, серы и фосфора.
г) сплав железа с углеродом ( от 2,14% ) и примесями марганца, серы и фосфора.
2. Выберите правильный ответ (+)
Для выплавки чугуна необходимо:
|
Шлак |
|
|
Железная руда |
|
|
Флюсы |
|
|
Модификаторы |
|
|
Топливо |
|
3. Сопоставьте понятие и его назначение
|
понятие |
назначение |
|||
|
1 |
Шлак |
А |
Раскисление стали |
|
|
2 |
флюс |
Б |
Защита металла от печных газов |
|
|
3 |
Кокс |
В |
Удаление вредных примесей из руды |
|
|
4 |
Ферросплавы |
Г |
Топливо |
|
|
1 |
2 |
3 |
4 |
|
|
|
|
|
4. Выбрать и расположить по порядку стадии получения чугуна
( есть лишние ответы )
|
А |
Шлакообразование |
|
Б |
Формование |
|
В |
Восстановление железа из окислов |
|
Г |
Науглероживание железа |
|
Д |
Спекание железа |
|
Е |
Легирование железа |
5. Дополните:
Цель обогащения руды – повышение концентрации … и удаление … .
6. Выберите правильный ответ ( + )
Чугун выплавляют в:
|
Конвертерах |
|
|
Газовых печах |
|
|
Доменных печах |
|
|
Томасовских печах |
|
УЭ 03 – 02 МЕТОДЫ ПОЛУЧЕНИЯ ОТЛИВОК
Цели:
Изучив данный учебный элемент, вы сможете:
— раскрыть понятия: отливка, литниковая система, лигатура, металлическая шихта
— назвать методы получения отливок
— сопоставить процессы, проводимые для улучшения свойств литейных сплавов
Оборудование, материалы и вспомогательные средства
|
Наименование |
Количество |
|
презентация |
|
|
|
|
УЭ 03 – 02 МЕТОДЫ ПОЛУЧЕНИЯ ОТЛИВОК
Отливкой называют литую деталь или заготовку, полученную заливкой расплавленного металла в литейную форму, полость которой имеет конфигурацию детали или заготовки. Литейную форму заливают жидким металлом через систему каналов,называемую литниковой системой.
Способы литья отливок можно разделить на две группы. К первой относят способы получения отливок в разовых формах, заполняемых расплавом однократно, после чего их разрушают для извлечения отливки (литье в песчаные сухие или сырые формы, литье в оболочковые формы). Ко второй группе относят способы получения отливок в многократных металлических формах, заполняемых расплавом от нескольких сотен до десятков тысяч раз (центробежное литье, литье в кокиль, под давлением). Каждый из перечисленных способов изготовления отливок имеет свое назначение и область применения.
При выплавке литейных сплавов в плавильные печи загружают металлическую шихту, ферросплавы, лигатуры и флюсы. Металлическая шихта – слитки технически чистых металлов, лом, отходы производства. Лигатура – вспомогательный сплав, вводимый в расплавленный металл с целью восполнения угарающих в процессе плавки химических элементов. Например, для выплавки чугуна и стали лигатурой служат ферросплавы (ферромарганец, ферросилиций и др.), которые одновременно раскисляют металл. Флюсы служат для образования шлака с требуемыми физико- химическими свойствами (для плавки чугуна и стали флюсом служит известняк). Шлак предохраняет в процессе плавки металл от окисления, служит для удаления неметаллических включений, попадающих в металл вместе с шихтой и образующихся в процессе плавки.
Для улучшения свойств литейных сплавов в процессе плавки, после плавки, в литейном раздаточном ковше, или непосредственно в литейной форме производят модифицирование, легирование и рафинирование.
Модифицирование – введение в жидкий сплав после его плавки специальных добавок – модификаторов, которые служат дополнительными центрами кристаллизации, обеспечивая более мелкозернистое строение сплава и более высокие его механические свойства. Для чугунов и стали модификаторами являются силикокальций, ферросилиций и др.
Легирование – введение в жидкий сплав различных добавок химических элементов для придания сплаву требуемых свойств (жаропрочности, зносостойкости, коррозионной стойкости т.п.). Рафинирование – очистка сплавов от ненужных и вредных примесей. Удаление вредных примесей (серы и фосфора) из чугуна и стали выполняют рафинированием их марганцем и известняком.
УЭ 03 -02 МЕТОДЫ ПОЛУЧЕНИЯ ОТЛИВОК
Проверка достижения целей:
1. Сопоставьте понятие и определение
|
понятие |
определение |
||
|
1 |
Лигатура |
А |
Литая деталь или заготовка, полученная заливкой расплава в литейную форму |
|
2 |
Металлическая шихта |
Б |
Система каналов, через которые заливают жидкий металл |
|
3 |
Литниковая система |
В |
Вспомогательный сплав, вводимый в расплав с целью восполнения угорающих химических элементов |
|
4 |
Отливка |
Г |
Отходы производства |
|
1 |
2 |
3 |
4 |
|
|
|
|
|
2. Дополните схему
Методы получения отливок
… многократные формы
литье в оболоч … литье в …
ковые формы кокиль
3. Сопоставьте названия процессов и их назначение
|
название процесса |
назначение |
||
|
1 |
Легирование |
А |
Обеспечение высоких механических свойств сплава |
|
2 |
Рафинирование |
Б |
Для придания сплаву особых свойств |
|
3 |
Модифицирование |
В |
Очистка сплавов от ненужных и вредных примесей |
УЭ 03 – 03 КЛАССИФИКАЦИЯ ЧУГУНОВ
Цели:
Изучив данный учебный элемент, вы сможете:
— классифицировать чугуны в зависимости от состояния углерода и химического состава, назначения
Оборудование, материалы и вспомогательные средства
|
Наименование |
Количество |
|
презентация |
|
|
|
|
УЭ 03 – 03 КЛАССИФИКАЦИЯ ЧУГУНОВ
Классификация чугунов осуществляется по следующим признакам:
— по назначению – передельные, ферросплавы, литейные
— по состоянию углерода – свободный и связанный
— по химическому составу – нелегированные ( общего назначения) и легированные (специльного назначения)
По назначению : Передельный (белый) чугун предназначен для переработки на сталь в плавильных агрегатах, называемых конверторами, а также мартеновских и электрических печах.
Ферросплавы выплавляют с высоким процентом кремния или марганца, применяют в качестве специальных добавок (раскислителей) при выплавлении стали. Литейный чугун предназначается главным образом для производства литых заготовок (литья). Он поступает в литейные цеха в виде небольших слитков (чушек) весом до 25кг. Характерной особенностью чугунов является то, что углерод в сплаве может находиться не только в растворенном и связанном состоянии ( в виде химического соединения – цементита Fe C), но также в свободном состоянии – в виде графита. В зависимости от состояния углерода различают:
— белый чугун, в котором весь углерод находится в связанном состоянии в виде цементита Fe C;
— серый чугун, в котором весь углерод или большая его часть находится в свободном состоянии – в виде графита ;
— ковкий чугун, который получают из белого путем отжига, углерод находится в виде графита;
— высокопрочный чугун, который получают из серого путем модифицирования, углерод – в виде графита
В зависимости от химического состава различают:
1. нелегированные чугуны
— белый чугун
— серый чугун ( СЧ)
— ковкий чугун (КЧ)
— высокопрочный чугун (ВЧ)
2. легированные чугуны (Ч)- чугуны со специальными свойствами
— жаростойкий чугун
— жаропрочный
— износостойкий
— антифрикционный
УЭ 03 – 03 КЛАССИФИКАЦИЯ ЧУГУНОВ
Проверка достижения целей
1. Дополните схему классификации чугунов в зависимости от
состояния углерода
Чугуны
… Белый чугун
Высокопрочный …
2. Сопоставьте виды чугунов с их характерными признаками
|
виды чугунов |
признаки |
||
|
1 |
Высокопрочный |
А |
Весь углерод в свободном состоянии |
|
2 |
Белый |
Б |
Получаемый из белого путем отжига |
|
3 |
Ковкий |
В |
Весь углерод в виде цементита |
|
4 |
Серый |
Г |
Получаемый модифицированием |
|
1 |
2 |
3 |
4 |
|
|
|
|
|
3. Сопоставьте классификацию чугуна по химическому составу и названия чугунов:
|
классификация чугуна по химическому составу |
|
|
легированный |
нелегированный |
|
|
|
|
|
|
|
|
|
|
|
|
1. белый
2. жаростойкий
3. серый
4. износостойкий
5. высокопрочны
6. ковкий
7. жаропрочный
8. антифрикционный
4. Соотнесите данные виды чугунов и их назначение
| виды чугунов |
назначение |
||
|
1 |
передельный |
А |
Производство чугунного литья |
|
2 |
ферросплавы |
Б |
Переплавка в сталь |
|
3 |
литейный |
В |
Раскисление стали |
УЭ 03 – 04 ВЛИЯНИЕ «С» И ПРИМЕСЕЙ НА СВОЙСТВА ЧУГУНА
Изучив данный учебный элемент, вы сможете:
— назвать постоянные примеси чугуна
— определить зависимость свойств чугунов от влияния углерода и постоянных примесей
Оборудование, материалы и вспомогательные средства
|
Наименование |
Количество |
|
презентация |
|
|
|
|
УЭОЗ-04 ВЛИЯНИЕ УГЛЕРОДА И ПРИМЕСЕЙ НА СВОЙСТВА ЧУГУНА.
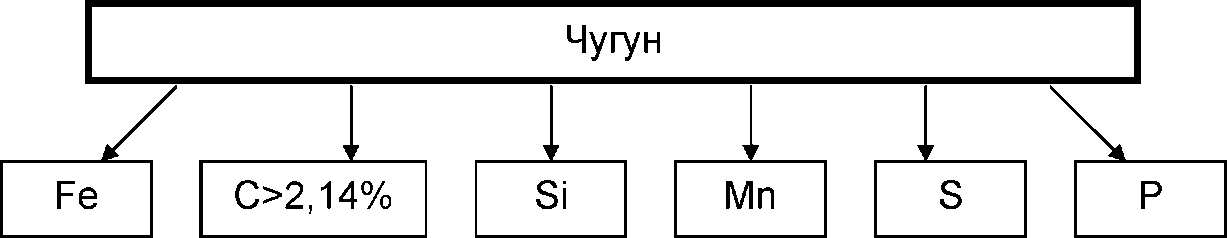
Входящие в состав чугуна элементы определяют его структуру и свойства.
Углерод — важнейшая составляющая чугуна. Если углерод находится в сплаве в свободном состоянии в виде графита, то чугун становится мягким и хорошо обрабатывается резанием. Если углерод находится в виде цементита (в химически связанном с железом состоянии — Ре2С), то чугун имеет высокую твердость и плохо обрабатывается. В машиностроительных чугунах углерод присутствует в виде графита. Так как графит обладает очень низкими механическими свойствами, поэтому чем больше его в чугуне, тем хуже свойства чугуна. Но он способствует повышению обрабатываемости чугунов резанием, придает им антифрикционные свойства при трении и гасит влияние вибраций и ударов. Прочные чугуны содержат 2,8-3 % С.
Кремний является важнейшей после углерода примесью в чугуне, способствует выделению углерода в виде графита. Улучшает литейные свойства чугуна (жидкотекучесть, усадка) и делает чугун более мягким.
Марганец препятствует графитообразованию, так как связывает углерод в виде цементита. При содержании до 1 % марганец очень полезен, так как повышает прочность чугуна и способствует удалению серы из сплава, образуя сернистый марганец (МпS), который, всплывая, уходит в шлак. Этим частично нейтрализует вредное действие серы.
Сера в чугуне является вредной примесью, так как вызывает явление красноломкости (в отливках в горячем состоянии образуются трещины). Кроме того, присутствие серы ухудшает жидкотекучесть чугуна, вследствие чего он плохо заполняет литейные формы.
Фосфор повышает жидкотекучесть чугуна, но понижает механические свойства чугуна,ухудшает обрабатываемость и вызывает хладноломкость, т. е. склонность к образованию трещин в отливках в холодном состоянии.
Государственные стандарты строго регламентируют массовую долю полезных и вредных примесей в чугунах. Как правило, содержание этих элементов ограничивается следующими верхними пределами, %:
Марганец 0,3 – 1,5
Кремний 0,3 – 5,0
Фосфор 0,20 – 0,65
Сера 0,08 – 0,12
УЭ 03 -04 ВЛИЯНИЕ «С» И ПРИМЕСЕЙ НА СВОЙСТВА ЧУГУНА
Проверка достижения целей:
1. Допишите
Примеси чугуна
Химический состав ВЧШГ. Влияние элементов на свойства чугуна
В статье Виноградова О.Н. описаны требования предъявляемые к химическому составу высокопрочного чугуна с шаровидным графитом и влияние отдельных элементов на физико-механические свойства.
Физико-механические свойства материала отливки из ВЧШГ определяются химическим составом, технологией получения, условиями охлаждения, наличием легирующих элементов и др. Состав металла является одним из основных факторов, определяющих ме¬ханические свойства ВЧШГ. Рекомендуемый ГОСТ 7293-85 химический состав чугуна приведен в табл. 1.
Некоторые элементы – деглобуляторы препятствуют сфероидизации графита, поэтому их содержание в чугуне не должно превышать указанных значений (РЬ < 0,009%; Вi < 0,003%; Sb < 0,026%; As < 0,08%; Ti < 0,04; Sn < 0,013%; Al < 0,3%). При постоянном производстве ВЧШГ периодически, хоть раз в две недели стоит контролировать чугун на содержание этих элеметов.
Таблица 1. Рекомендуемый химический состав ВЧШГ
| Марка чугуна | Массовая доля элементов, % | |||||||||||
| C | Si | Mn | P | S | Cr | Cu | Ni | |||||
| Толщина стенки отливки, мм | Не более | |||||||||||
| до 50 | св. 50 до 100 | св. 100 | до 50 | св. 50 до 100 | св. 100 | |||||||
| ВЧ 35 | 3,3-3,8 | 3,0-3,5 | 2,7-3,2 | 1,9-2,9 | 1,3-1,7 | 0,8-1,5 | 0,2-0,6 | 0,1 | 0,02 | 0,05 | — | — |
| ВЧ 40 | 3,3-3,8 | 3,0-3,5 | 2,7-3,2 | 1,9-2,9 | 1,2-1,7 | 0,5-1,5 | 0,2-0,6 | 0,1 | 0,02 | 0,1 | — | — |
| ВЧ 45 | 3,3-3,8 | 3,0-3,5 | 2,7-3,2 | 1,9-2,9 | 1,3-1,7 | 0,5-1,5 | 0,3-0,7 | 0,1 | 0,02 | 0,1 | — | — |
| ВЧ 50 | 3,2-3,7 | 3,0-3,3 | 2,7-3,2 | 1,9-2,9 | 2,2-2,6 | 0,8-1,5 | 0,3-0,7 | 0,1 | 0,02 | 0,15 | — | — |
| ВЧ 60 | 3,2-3,6 | 3,0-3,3 | — | 2,4-2,6 | 2,4-2,8 | — | 0,4-0,7 | 0,1 | 0,02 | 0,15 | 0,3 | 0,4 |
| ВЧ 70 | 3,2-3,6 | 3,0-3,3 | — | 2,6-2,9 | 2,6-2,9 | — | 0,4-0,7 | 0,1 | 0,15 | 0,15 | 0,4 | 0,6 |
| ВЧ 80 | 3,2-3,6 | — | — | 2,6-2,9 | — | — | 0,4-0,7 | 0,1 | 0,01 | 0,15 | 0,6 | 0,6 |
| ВЧ 100 | 3,2-3,6 | — | — | 3,0-3,8 | — | — | 0,4-0,7 | 0,1 | 0,01 | 0,15 | 0,6 | 0,8 |
Магний
Является основным элементом – сфероидезатором. Для образования графита шаровидной формы остаточное содержание магния в чугуне должно быть не ниже 0,03%, в противном случае графит кристаллизуется в шаровидной форме только частично, вследствие чего механические свойства чугуна снижаются. При более низком содержании магния часть графита кристаллизуется в виде пластинок, что снижает механические свойства сплава. Толщина стенок отливок, а следовательно и и скорость охлаждения вносят коррективы на минимальное содержание магния в чугуне, чем выше толщина стенки отливки – тем требуется более высокое содержание Mg. Обычно магния в ВЧШГ поддерживают в пределах 0,04-0,08%.
Углерод
Содержание углерода обычно поддерживают на уровне 3,2—3,6%, Увеличение содержания углерода улучшает литейные свойства ЧШГ.
Кремний
Кремний оказывает значительное влияние на микроструктуру и на механические свойства ВЧШГ. При содержании З,0—3,3% кремний способствует получению устойчивой ферритной структуры в сыром состоянии; однако пластичность чугуна при этом снижается. С точки зрения пластичности лучше выдерживать содержание кремния в пределах 2,0-2,4%.
Марганец
С повышением содержания марганца уменьшается доля феррита и увеличивается количество перлита; при этом повышается предел прочности при растяжении и уменьшается относительное удлинение. При производстве ВЧШГ с ферритной структурой в литом состоянии содержание марганца не должно превышать 0,4%. Для повышения износостойкости содержание марганца увеличивают до 1,0-1,3%.
Никель
Никель способствует увеличению количества перлита в ВЧШ, причем полностью перлитная структура получается уже при 4,8% Ni, а бейнитная структура — при 6,4% Ni. Влияет на тепло- и электропроводность, коррозионную стойкость и жаростойкость чугуна. С увеличением содержания никеля эти свойства повышаются.
Медь
Си в количестве 1,0—1,5% приводит к образованию перлита, повышая прочность чугуна и понижая его пластичность. Содержание меди более 2% препятствует образованию в структуре сплава шаровидного графита.
Алюминий
Оказывает вредное влияние на ВЧШГ, способствуя образованию ПГ уже при содержании 0,2% и особенно при 0,25—0,6%.
Молибден
Способствует измельчению перлита и графитовых включений.
Сера
Самая вредная примесь. Чем выше содержание серы в “исходном чугуне”, тем труднее получить полностью (идеально) шаровидную форму графита и, следовательно, высокие механические свойства. Содержание серы в исходном жидком чугуне до модифицирования не должно превышать 0,03%, для внутриформенного модифицирования желательно иметь значение не выше 0,02% или даже ниже.
Фосфор
Примесь. Оказывает существенное влияние на структуру и механические свойства, образую фосфидную эвтектику (ФЭ), снижает относительное удлинение и ударную вязкость. Чтобы получить чугун с высокой пластичностью, содержание фосфора не должно превышать 0,08%.
Хром
Примесь. С увеличением содержания хрома, в определенных пределах, повышаются жаростойкость, коррозионная стойкость и износостойкость. Способствует образованию карбидов потому его содержание в ЧШГ не должно превышать 0,1%.
Литература
- Энциклопедия неорганических материалов. В 2-х томах, том 1. Киев, «Высшая школа», 1977 г.
- Могилёв В.К., Лев О.И. Справочник литейщика. М.: Машиностроение, 1988. – 272 с.
- Справочник по чугунному литью./Под редакцией д.т.н. Н.Г. Гиршовича. – 3-е изд. перераб. и дополн. Л.: Машиностроение, 1978 – 758 с.
- Отливки из чугуна с шаровидным и вермикулярным графитом/Захарченко Э.В., Левченко Ю.Н., Горенко В.Г., Вареник П.А. – Киев: Наукова думка, 1986 – 248 с.
Tags:
Получение ВЧШГМарки и стандарты чугуна SG
Чугун SG известен как чугун с шаровидным графитом, а также чугун с шаровидным графитом, чугун с шаровидным графитом или чугун с шаровидным графитом.
SG Iron — это тип чугуна, который в расплавленном состоянии обрабатывают таким элементом, как магний или церий, чтобы вызвать образование свободного графита в виде конкреций или сферолитов.
Ниже приведены требования к маркам по химическим компонентам и физическим свойствам, а также таблица сравнения марок.В то же время мы перечислили основное содержание стандартов материалов, используемых в США, Китае, Германии, Европе и за рубежом.
Обратите внимание, что химические компоненты являются только справочным, а не строгим стандартом для материала. Литейный завод мог регулировать свои химические компоненты в соответствии со своим опытом, чтобы соответствовать физическим свойствам. Итак, физические свойства должны быть единственным стандартом для материалов.
Химические компоненты чугуна SG
США | Германия | ISO | К% | Si% | млн% | П% | S% | Мг% | Cu% | Sn% |
60-40-18 | GGG40 | 400-18 | 3.50-3,78 | 2,80–2,85 | 0,2-0,5 | 0,03–0,06 | 0,02-0,035 | 0,020-0,060 | – | – |
65-45-12 | GGG40 | 450-10 | 3.30-3.80 | 2,40–2,90 | 0,2-0,5 | 0,03–0,06 | 0,02-0,040 | 0,020-0,060 | – | – |
70-50-05 | GGG50 | 500-7 | 3.20-3.60 | 2.30–2.90 | 0,4-0,6 | 0,03–0,06 | 0,02-0,040 | 0,030-0,055 | <0,4 | – |
80-60-03 | GGG60 | 600-3 | 3.00–3,50 | 2,40–2,80 | 0,3–0,5 | 0,03–0,06 | 0,02-0,040 | 0,035-0,050 | 0,30–0,40 | – |
100-70-03 | GGG70 | 700-2 | 3.65-3,90 | 1,70–1,90 | 0,3–0,5 | <0,06 | <0,03 | 0,035-0,050 | 0,30–0,40 | 0,03–0,06 |
120-90-02 | GGG80 | 800-2 | – | – | – | – | – | – | – | – |
Эквивалентные марки чугуна с шаровидным графитом (литье из высокопрочного чугуна / чугуна с шаровидным графитом)
Страна | Стандарт | Эквивалентные марки высокопрочного чугуна (чугун с шаровидным графитом, чугун с шаровидным графитом) | ||||||
ISO | ISO 1083 | 400-15 | 450-10 | 500-7 | 600-3 | 700-2 | 800-2 | 900-2 |
Китай | ГБ 1348 | QT400-18 | QT450-10 | QT500-7 | QT600-3 | QT700-2 | QT800-2 | QT900-2 |
США | ASTM A536 | 60-40-18 | 60-42-10 | 70-50-05 | 80-55-06 | 100-70-03 | 120-90-02 | – |
Германия | DIN 1693 | GGG40 | – | GGG50 | GGG60 | GGG70 | GGG80 | – |
Европейский | EN 1563 | EN-GJS-400-15 | EN-GJS-450-10 | EN-GJS-500-7 | EN-GJS-600-3 | EN-GJS-700-2 | EN-GJS-800-2 | EN-GJS-900-2 |
Япония | JIS G5502 | FCD400 | FCD450 | FCD500 | FCD600 | FCD700 | FCD800 | – |
Италия | UNI 4544 | GS370-17 | GS400-12 | GS500-7 | GS600-2 | GS700-2 | GS800-2 | – |
Франция | НФ A32-201 | ФГС370-17 | ФГС400-12 | ФГС500-7 | ФГС600-2 | ФГС700-2 | ФГС800-2 | – |
Великобритания | BS 2789 | 400/17 | 420/12 | 500/7 | 600/7 | 700/2 | 800/2 | 900/2 |
Индия | IS 1865 | SG370 / 17 | SG400 / 12 | SG500 / 7 | SG600 / 3 | SG700 / 2 | SG800 / 2 | – |
Испания | UNF | FGE38-17 | FGE42-12 | FGE50-7 | FGE60-2 | FGE70-2 | FGE80-2 | – |
Бельгия | НБН 830-02 | FNG38-17 | ФНГ42-12 | FNG50-7 | ФНГ60-2 | ФНГ70-2 | ФНГ80-2 | – |
Австралия | КАК 1831 | 300-17 | – | 500-7 | 600-3 | 700-2 | 800-2 | – |
Швеция | СС 14 07 | 0717-02 | – | 0727-02 | 0732-03 | 0737-01 | 0864-03 | – |
Норвегия | NS11 301 | SJK-400.3 | – | SJK-500 | SJK-600 | SJK-700 | SJK-800 | – |
ТАБЛИЦА МАРКИРОВКИ ЧУГУНА
ASTM A536 1993 (США)
Марка | Прочность на разрыв | Предел текучести | Относительное удлинение | |
ANSI / ASTM | UNS | |||
60-40-18 | F32800 | 414 | 276 | 18 |
65-45-12 | F33100 | 448 | 310 | 12 |
80-55-06 | F33800 | 552 | 379 | 6.0 |
100-70-03 | F34800 | 689 | 483 | 3,0 |
120-90-02 | F36200 | 827 | 621 | 2.0 |
Специального назначения | ||||
60-42-10 | 415 | 290 | 10 | |
70-50-05 | 485 | 345 | 5.0 | |
80-60-03 | 555 | 415 | 3,0 | |
ГБ / т 1348 1998 (Китай)
Марка | Прочность на разрыв | Предел текучести | Относительное удлинение | Твердость |
QT400-18 | 400 | 250 | 18 | 130 ~ 180 |
QT400-15 | 400 | 250 | 15 | 130 ~ 180 |
QT450-10 | 450 | 310 | 10 | 160 ~ 210 |
QT500-7 | 500 | 320 | 7 | 170 ~ 230 |
QT600-3 | 600 | 370 | 3 | 190 ~ 270 |
QT700-2 | 700 | 420 | 2 | 225 ~ 305 |
QT800-2 | 800 | 480 | 2 | 245 ~ 335 |
QT900-2 | 900 | 600 | 2 | 280 ~ 360 |
* Низкотемпературные испытания на удар с V-образным надрезом (-20 ± 2 ℃)
DIN 1693 1997 (Германия)
Марка | Материал № | Предел прочности при растяжении | Предел текучести | Относительное удлинение |
GGG-40 | 0,7040 | 400 | 250 | 15 |
GGG-50 | 0.7050 | 500 | 320 | 7 |
GGG-60 | 0,7060 | 600 | 380 | 3 |
GGG-70 | 0.7070 | 700 | 400 | 2 |
GGG-80 | 0,7080 | 800 | 500 | 2 |
EN 1563 1997 (Европейский стандарт)
Марка | Прочность на разрыв | Предел текучести | Относительное удлинение | |
Символ | Номер | |||
EN GJS 350-22 | EN JS1010 | 350 | 220 | 22 |
EN GJS 350-22-LT * | EN JS1015 | 350 | 220 | 22 |
EN GJS 400-18 | EN JS1020 | 400 | 250 | 18 |
EN GJS 400-18-LT * | EN JS1025 | 400 | 240 | 18 |
EN GJS 400-15 | EN JS1030 | 400 | 250 | 15 |
EN GJS 450-10 | EN JS1040 | 450 | 310 | 10 |
EN GJS 500-7 | EN JS1050 | 500 | 320 | 7 |
EN GJS 600-3 | EN JS1060 | 600 | 370 | 3 |
EN GJS 700-2 | EN JS1070 | 700 | 420 | 2 |
EN GJS 800-2 | EN JS1080 | 800 | 480 | 2 |
EN GJS 900-2 | EN JS1090 | 900 | 600 | 2 |
* Низкотемпературные испытания на удар с V-образным надрезом (-20 ± 2 ℃)
ISO 1083 1987 (международный)
Марка | Предел прочности при растяжении | Предел текучести | Относительное удлинение | Твердость |
900-2 | 900 | 600 | 2 | 280 ~ 360 |
800-2 | 800 | 480 | 2 | 245-335 |
700-2 | 700 | 420 | 2 | 225 ~ 305 |
600-3 | 600 | 370 | 3 | 190 ~ 270 |
500-7 | 500 | 320 | 7 | 170 ~ 230 |
450-10 | 450 | 320 | 10 | 160 ~ 210 |
400-15 | 400 | 250 | 15 | 130 ~ 180 |
400-18 | 400 | 250 | 18 | 130 ~ 180 |
350-22 | 350 | 220 | 22 | ≤150 |
* Испытано на удар при низкой температуре с V-образным надрезом (-20 ± 2 ℃)
Факты о железе, символ, открытие, свойства, применение
Что такое железо
Железо (известное как EYE-ren) — твердый металл с высокой коммерческой ценностью, принадлежащий к семейству переходных металлов.Обозначается химическим обозначением Fe, он химически активен и легко подвержен коррозии на воздухе, образуя красноватый слой, называемый ржавчиной, при воздействии влажного воздуха [1, 2] .
Железный символ
Где найдено железо
Это четвертый по содержанию металл в земной коре, обычно связанный с другими минеральными рудами, такими как гематит, таконит и магнетит, обнаруженными в горнодобывающих месторождениях Украины, Бразилии, России, Австралии и Китая. Его промышленное производство осуществляется в доменной печи путем нагрева руды с коксом и известняком [1] .
Происхождение его названия: Название элемента происходит от англосаксонского слова «железо».
Кто это открыл: Неизвестно
Когда, где и как было обнаружено
Считалось, что около 3500 г. до н.э. египтяне использовали железные предметы. Известно, что хетты из Малой Азии выплавляли металл из его руд в течение 1500 г. до н.э. В 1722 году французский энтомолог Рене Антуан Фершо де Реомюр опубликовал книгу, описывающую значение различных железных сплавов [1] .
Железо Металл
Идентификация | |||
| Атомный номер | 26 [1] | ||
| Номер CAS | 7439-89-6 [1] | ||
| Позиция в таблице Менделеева [1] | Группа | Период | Блок |
| 8 | 4 | д | |
Где находится железо в периодической таблице
Классификация, свойства и характеристики железа
Общая недвижимость | ||
| Относительная атомная масса | 55.845 [1] | |
| Атомная масса / вес | 55,845 атомных единиц массы [3] | |
| Молярная масса / молекулярный вес | 55,845 г / моль [6] | |
| Массовое число | 56 | |
Физические свойства | ||
| Цвет / внешний вид | Серебристо-серый [1] | |
| Температура плавления / замерзания | 1538 ° C (2800 ° F) [1] | |
| Температура кипения | 2861 ° C (5182 ° F) [1] | |
| Плотность | 7.87 г / см 3 [1] | |
| Стандартное / естественное состояние при комнатной температуре (твердое тело / жидкость / газ) | Цельный [1] | |
| Пластичность | Есть | |
| Пластичность | Есть | |
| Твердость | 4-5 Моос [7] | |
| Удельная теплоемкость | 0,444 Дж г -1 o C [8] | |
| Теплопроводность | 80.4 Втм -1 К -1 [3] | |
Химические свойства | ||
| Воспламеняемость | Не горюч [9] | |
| Степени окисления (числа) | 6, 3, 2, 0, -2 [1] | |
Атомные данные железа (элемент 26)
| Электронная конфигурация (конфигурация благородного газа) | [Ar] 3d 6 4s 2 [1] | ||||||
| Атомная структура [5] | |||||||
| — Количество электронов | 26 | ||||||
| — Количество нейтронов | 30 | ||||||
| — Количество протонов | 26 | ||||||
| Радиус атома | |||||||
| — Атомный радиус | 2.04 Å [1] | ||||||
| — Ковалентный радиус | 1,24 Å [1] | ||||||
| Энергия ионизации [1] (кДжмоль -1 ) | 1-й | 2-я | 3-й | 4-я | 5-й | 6-й | 7-й |
| 762,466 | 1561.876 | 2957.469 | 5287,4 | 7236 | 9561.7 | 12058,74 | |
Атомная структура железа (модель Бора)
Как обычно используется железо?
- Железо используется в производстве различных типов стали путем легирования другими элементами, такими как углерод, никель, хром и вольфрам, для изготовления режущего оборудования, велосипедных цепей, стволов винтовок, опор трансмиссии, мостовых балок и железобетона [1 ] .
- Нержавеющая сталь, содержащая высокий процент железа наряду с другими металлами, обладает огромной прочностью и лучшими функциями, что полезно при изготовлении хирургических инструментов, канцелярских скрепок, столовых приборов, шариковых подшипников и ювелирных изделий [1, 2] .
- Другая форма Fe, называемая кованым железом, полученная путем плавки, используется для изготовления столярных инструментов, подъемных крюков, цепей, ограждений и ворот [10] .
- Железные наполнители применяются в научных экспериментах по электромагнетизму для оценки силы магнитов, а также в энергетической металлургии, художественных работах, фейерверках и пескоструйной очистке [11] .
- Fe действует как эффективный катализатор в некоторых промышленных химических процессах, таких как процесс Хабера и Фишера-Тропша [1] .
Железный пруток
Обладает ли элемент токсическим действием?
Случайное проглатывание Fe было связано с рвотой, диареей и другими желудочно-кишечными заболеваниями, распространенным типом отравления металлами. Длительное накопление в организме может привести к респираторным заболеваниям и сердечным заболеваниям [12] . Вдыхание металлической пыли или паров может вызвать тяжелую легочную реакцию [13] .
Интересные факты
- Считается, что метеориты имеют высокое содержание железа [5] .
- Древние мореплаватели использовали железо в качестве магнитного металла в виде магнитных камней для изготовления компасов [3] .
- В среднем человеческом теле присутствует 4 грамма Fe, связанного с гемоглобином, который, в свою очередь, помогает переносить кислород в легкие [1] .
Железный порошок
Железо Металл Цена
Стоимость чистого железа может варьироваться от 0,24 до 0,30 доллара за фунт.
Ссылки
- http: // www.rsc.org/periodic-table/element/26/iron
- https://education.jlab.org/itselemental/ele026.html
- https://www.chemicool.com/elements/iron.html
- https://www.radiochemistry.org/periodictable/elements/26.html
- https://www.oughttco.com/iron-facts-606548
- https://www.tedpella.com/company_html/hardness.htm
- https://www.tedpella.com/company_html/hardness.htm
- http://www2.ucdsb.on.ca/tiss/stretton/database/specific_heat_capacity_table.HTML
- https://www.angelo.edu/faculty/kboudrea/demos/burning_iron/burning_iron.htm
- https://extrudesign.com/wasted-iron-properties-applications/
- http://www.iron-filing.com/
- https://www.clinicaladvisor.com/labmed/toxicity-associated-with-iron/article/614895/
- https://www.ncbi.nlm.nih.gov/pubmed/15
PhysicalGeology.lectures 3-4
6
18
12
недостаточно информации
6
18
12
недостаточно информации
полиморфы
аморфные
кристаллические
минералы
2
3
4
8
-4
+4
-2
+2
анион
катион
21
44
23
65
кремний-кислородный октаэдр
кремний-кислородный тетраэдр
кремний-алюминиевый тетраэдр
кремний-азотный тетраэдр
количество протонов
количество нейтронов
количество протонов плюс нейтроны
количество электронов
Верно
Неверно
алюминий
железо
кислород
кремний
оливин
кварц
щелочной полевой шпат
пироксен
твердый раствор
полиморфизм
твердый раствор
полиморфизм
изотопы
твердый раствор
полиморфизм
изотопов
графит и алмаз имеют одинаковую плотность.
графит и плотность имеют разные минеральные структуры.
графит и алмаз оба состоят из атомов углерода.
графит устойчив в коре, тогда как алмаз устойчив в мантии. конструкции.
каркас
одиночные цепи
листовые силикаты
изолированные тетраэдры
развитие граней кристаллов во время роста минерала
раскалывание минерала вдоль плоских поверхностей
развитие неправильных трещин при разрушении минерала
плотность или удельный вес минерала
плотность зависит от атомного веса ионов в минерале
плотность зависит от плотности атомной упаковки
плотность уменьшается с увеличением давления
плотность уменьшается с повышением температуры
минерал с самой высокой твердостью
минерал с самой низкой твердостью
минерал с самой низкой плотностью
минерал с самой высокой плотностью
атомы углерода имеют 6 протонов и 12,011 нейтронов
атомов углерода имеют 6 протонов и плотность 12,011 граммов на кубический сантиметр
атомов углерода имеют 6 нейтронов и 12,011 протонов
атомов углерода имеют 6 протонов и различное количество нейтронов
очки
минералов
кристаллов
полиморфов
протонов
нейтронов
электронов
все эти
количество протонов
количество нейтронов
количество протонов плюс нейтроны
ни один из этих
полиморфы
ионов
изотопов
изобар
электрон кальция
катион кальция
анион кальция
изотоп кальция
количество электронов во внешней оболочке увеличивается
атомный номер уменьшается
количество электронов во внешней оболочке уменьшается
количество изотопов увеличивается
водород
кремний
кислород
железо
ковалентный
ионный
металлический
залог
плотность
соединение
плавление
кристаллизация
расплавленная порода быстро охлаждается.
горных пород плавятся.
минералов имеют пространство для роста, например, в открытых полостях, и время для медленного роста.
вулканов извергается со взрывом.
железо и магний легко связываются
железо и магний разделяют электроны
железо и магний превращаются в полиморфы
железо и магний заменяют друг друга в минералах
ионы
полиморфов
электронов
изотопов
полевой шпат
слюда
оливин
пироксен
карбонаты
оксиды
силикаты
сульфиды
кальций и углерод
кислород и азот
железо и никель
кремний и кислород
каркас
одноцепочечный
лист
кольцо
карбонат
одноцепочечный силикат
двухцепочечный силикат
кольцевой силикат
полевой шпат
каолинит
оливин
пироксен
корунд
полевой шпат
кварц
тальк
полевой шпат
кальцит
кварц
галит
твердость
спайность
цвет
плотность
спайность
габитус
плотность
штрих
изотопный состав твердость
спайность
штрих
минерал с более высокой твердостью
минерал с более низкой твердостью
минерал с более высокой плотностью
минерал с более низкой плотностью
морская вода
каменная соль
чугун
растительность
пироксены и амфиболы являются силикатами
пироксенов и амфиболов имеют расщепления под разными углами
пироксены и амфиболы представляют собой полиморфы
пироксенов, а амфиболы состоят из цепей (1 или 2) силикатных тетраэдров
Попробуйте заполнить пробелы
Вернуться на главную страницу Physical Geology
Естественные науки 9 класс
Обзор главы
1.5 недель
В этой главе учащиеся снова столкнутся с реакциями выбранных металлов с кислородом, которые использовались в качестве примеров в предыдущей главе. В этой главе, однако, больше внимания будет уделено действительным реакциям — они должны быть продемонстрированы классу — и общности между ними. И снова написание химических уравнений будет поддерживаться процессом, начиная со словарного уравнения (макроскопическое представление) и переходя через графическое уравнение (субмикроскопическое представление) к химическому уравнению (символическое представление).
Содержание также было представлено в несколько ином порядке, чем CAPS, в том смысле, что сначала исследуются примеры реакций, а затем объясняется общая реакция металлов с кислородом, когда учащиеся уже видели примеры химических уравнений.
3.1 Реакция железа с кислородом (1 час)
Задачи | Навыки | Рекомендация |
Деятельность: Три различных уровня интерпретации в науке | 62 Необязательно (Редакция) | |
Действие: Реакция железа с кислородом | Демонстрация горения стальной ваты, наблюдение, запись, общение, описание | Предлагается CAPS |
3.2 Реакция с магнием и кислородом (1 час)
Задачи | Навыки | Рекомендация |
Деятельность: Реакция магния с кислородом | Демонстрация связи описание | Предлагается CAPS |
3.3 Общая реакция металлов с кислородом (0.5 часов)
(Вопросы по тексту)
3,4 Образование ржавчины (1,5 часа)
Задачи | Навыки | Рекомендация |
Действия: реакция между железом и кислородом в воздухе | Демонстрация | Необязательно (рекомендуется) |
Действие: Почему ржавчина является проблемой? | Выявление проблем и проблем | Дополнительно (рекомендуется) |
3.5 способов предотвращения ржавчины (0,5 часа)
(Вопросы по тексту)
- Что происходит, когда металл вступает в реакцию с кислородом?
- Как называется товар?
- Как мы можем представить общую реакцию между металлом и кислородом?
- Что такое реакция горения?
- Что такое ржавчина и как она образуется?
- Как сделать железо более устойчивым к ржавчине?
В предыдущей главе мы научились писать и балансировать уравнения.Мы узнали о трех примерах:
магний + кислород → оксид магния
железо + кислород → оксид железа
медь + кислород → оксид меди
Из каких групп происходят магний, железо и медь?
Магний — группа 2, железо — группа 8, а медь — группа 11. Это важно, поскольку элементы одной группы будут реагировать одинаково.
В этих реакциях все элементы, которые реагируют с кислородом, — это металлы .Если вы не уверены в этом, найдите их в Периодической таблице ниже в начале вашей книги. Вы видите, что все они находятся в области, занятой металлами? Где находятся металлы в Периодической таблице?
Названия продуктов трех вышеуказанных реакций имеют нечто общее. Запишите имена. Вы видите, что у них общего?
Продукция: оксид магния, оксид железа, оксид меди. Все они имеют в своем названии слово «оксид».
Продукция состоит из оксидов металлов . Что такое оксиды металлов? Как мы увидим позже, когда будем рисовать диаграммы и писать формулы для представления этих реакций, они представляют собой соединения, в которых металл соединяется с кислородом в некотором фиксированном соотношении.
Металлы будут реагировать аналогичным образом с другими элементами той же группы, что и кислород (группа 16).
В этой главе мы собираемся более подробно рассмотреть две реакции, показанные ранее. Помните, что это не единственные реакции металлов с кислородом; это как раз те, которые были выбраны в качестве примеров.
Сначала мы понаблюдаем за собственными реакциями. Ваш учитель продемонстрирует, а вы сделаете наблюдения. Впоследствии мы напишем об этих реакциях, используя «научный язык», поскольку мы будем писать уравнения реакций для каждой из них. Прежде чем мы начнем, напомним кое-что, что мы обсуждали в главе 1.
В первой главе Гр. 9 Материя и материалы, мы узнали, что ученые интерпретируют химические реакции на трех разных уровнях. Эти три уровня:
- макроскопический уровень;
- субмикроскопический уровень; и
- символический уровень.
Проверьте, помните ли вы, к чему относится каждый уровень, заполнив следующую таблицу.
Когда мы делаем следующее: | Мы работаем на этом уровне: (Макроскопический / субмикроскопический / символический) |
Наблюдайте за реальными реакциями (видеть, слышать, обонять, осязать, вкус). Опишите словами то, что мы видим. | |
Представьте себе поведение частиц во время реакций. Нарисуйте изображения частиц в веществах. | |
Напишите химические формулы. Напишите уравнения реакций. |
Когда мы делаем следующее: | Мы работаем на этом уровне: (Макроскопический / субмикроскопический / символический) |
Наблюдайте за реальными реакциями (видеть, слышать, обонять, осязать, вкус). Опишите словами то, что мы видим. | Макроскопический |
Представьте себе поведение частиц во время реакций. Нарисуйте изображения частиц в веществах. | Субмикроскопия |
Напишите химические формулы. Напишите уравнения реакций. | Символическое |
Вскоре ваш учитель продемонстрирует две реакции, а вы будете делать наблюдения.На каком из трех уровней вы будете работать?
Цель этих демонстраций — дать вам возможность сделать макроскопические наблюдения за химическими изменениями, происходящими во время реакций. Эта глава также поможет вам связать макроскопические наблюдения с изображениями и уравнениями, которые вы научились писать в предыдущей главе.
Реакция железа с кислородом
Мы рассмотрим, как железо реагирует с кислородом. В некоторых случаях для этих экспериментов можно использовать стальную вату.Вы знаете, что такое стальная вата? Это проволочная вата из очень тонких стальных нитей. Сталь — это сплав, состоящий в основном из железа. Итак, когда мы смотрим на то, как стальная вата горит в кислороде, мы фактически смотрим на то, как железо реагирует с кислородом.
Металлический сплав — это твердая смесь двух или более различных металлических элементов. Примеры — сталь и латунь.
Прядение стальной ваты создает интересные фотографии, поскольку утюг горит в кислороде и образует оранжевые искры. http://www.flickr.com/photos/rockandrollfreak/7697586652/ Железные стружки выглядят как искры, когда они горят в голубом пламени горелки Бунзена.Вы можете посмотреть видео сжигания стальной ваты здесь:
Ваш учитель проведет демонстрацию, в которой железо сжигается на воздухе. Когда вещество горит на воздухе, реакция называется реакцией горения . Когда вещество горит на воздухе, оно действительно вступает в реакцию с кислородом.
Рекомендуется продемонстрировать эту реакцию учащимся из-за опасностей, связанных с сжиганием металлов.
Меры предосторожности, которые необходимо соблюдать во время демонстраций:
- Надевайте защитные очки и защитное пальто.
- Соблюдайте осторожность при сжигании стальной мочалки, так как это может вызвать искры. Следует предостеречь учащихся от того, чтобы они не стояли слишком близко во время демонстрации.
- Подставьте под него чистый стакан или часовое стекло, чтобы уловить любой оксид металла, образующийся во время реакции. Студенты могут впоследствии изучить продукт реакции, чтобы сформулировать свои наблюдения.
МАТЕРИАЛЫ:
- Горелка Бунзена или спиртовка
- совпадений
- защитные очки
- стальная вата
- щипцы
ИНСТРУКЦИЯ:
- Ваш учитель продемонстрирует горение железа в кислороде (который присутствует в воздухе).
- Вам следует внимательно наблюдать во время демонстрации и записывать их в отведенных ниже полях. Чтобы помочь вам, были предоставлены некоторые вопросы.
ВОПРОСЫ:
В этой демонстрации мы использовали стальную вату, но из чего она в основном состоит?Стальная вата — это сплав, в основном состоящий из железа. ПРИМЕЧАНИЕ: Другие элементы в стали включают углерод, марганец, фосфор, серу, кремний и следы кислорода, азота и алюминия.Учащимся не нужно знать названия других элементов стальной ваты.
Посмотрите на металл, прежде чем он сгорит. Опишите, как это выглядит.Наблюдения учащихся могут включать любое из следующего: Стальная вата состоит из тонких железных нитей. Похоже на волосы из металла. В зависимости от состояния стальной ваты учащиеся могут описать ее как блестящую, тускло-серую, металлическую или даже ржавую. Поощряйте творческие описания.
Вы видите кислород, с которым будет реагировать металл? Вы можете это описать?Газообразный кислород нельзя увидеть или непосредственно наблюдать, поэтому его невозможно описать.
Что вы наблюдаете во время реакции? Опишите все, что вы видите, слышите или чувствуете запах.- Учащиеся могут видеть горящую стальную вату и падающие ярко-оранжевые искры. Они могут даже заметить дым.
- Учащиеся могут слышать потрескивающий звук горящей стальной ваты.
- Учащиеся могут заметить металлический запах в воздухе.
- Учащиеся могут ощущать тепло от реакции горения.
Продукт красновато-коричневого цвета, рассыпчатый.
Оксид железа используется в качестве пигмента в красках, поскольку он бывает коричневого и красного цвета.
Если вы думаете, что реакция при горении железа в кислороде впечатляющая, следующая демонстрация вас поразит!
Реакция магния с кислородом
Ваш учитель проведет демонстрацию, в которой магний сжигается на воздухе.
Магний горит ярким белым пламенем.Видео, показывающее горение магния в кислороде
Рекомендуется продемонстрировать учащимся реакцию из-за опасностей, связанных с горением металлов.
Инструкции :
- Надевайте защитные очки и защитное пальто.
- Предупредите учащихся, чтобы они не смотрели прямо на сильное белое пламя горящего магния.
- Подставьте под него чистый стакан или часовое стекло, чтобы улавливать оксиды металлов, образующиеся во время каждой реакции. Студенты могут впоследствии изучить продукт реакции, чтобы сформулировать свои наблюдения.
Вы можете оставить продукт реакции горения магния для последующего эксперимента в главе Реакции кислот с оксидами металлов.
- На этом этапе также можно смешать продукт с водой и проверить, является ли он кислотой или основанием.
МАТЕРИАЛЫ:
- Горелка Бунзена или спиртовка
- совпадений
- защитные очки
- магниевая лента
- щипцы
- стекло для часов или стакан
ИНСТРУКЦИЯ:
- Ваш учитель продемонстрирует горение магния в кислороде.
- Вам следует внимательно наблюдать во время демонстрации и записывать их в отведенных ниже полях.
ВОПРОСЫ:
Опишите физическую форму (форму) металла в этом эксперименте.Магний находится в форме магниевой ленты.
Что мы называем реакциями, при которых вещество горит на воздухе?Как бы вы описали внешний вид или цвет металла до его обжига?
Наблюдения учащихся могут включать любое из следующего: Магниевая лента выглядит как тонкая полоска металла. Похоже на металлическую ленту.В зависимости от состояния ленты учащиеся могут описать ее как блестящую, темно-серую, черную, металлическую или даже потускневшую. Поощряйте творческие описания.
Вы видите кислород, с которым будет реагировать металл? Вы можете это описать?Газообразный кислород нельзя увидеть или непосредственно наблюдать, поэтому его невозможно описать.
Что вы наблюдаете во время реакции? Опишите все, что вы видите, слышите или чувствуете запах.- Учащиеся могут увидеть горящий магний в ослепляющем белом свете.Они могут заметить дым.
- Учащиеся могут слышать потрескивание или шипение во время горения магния.
- Учащиеся могут заметить горячий металлический запах в воздухе.
- Учащиеся могут ощущать тепло от реакции горения.
Продукт представляет собой мягкое белое порошкообразное твердое вещество.
Магний находится во 2-й группе Периодической таблицы. Вы помните, как мы говорили, что элементы в одной группе будут вести себя одинаково.Это означает, что они будут реагировать аналогичным образом. Мы изучили, как магний реагирует с кислородом, но кальций, например, ведет себя аналогичным образом. Вы можете посмотреть видео по ссылке для посещения, чтобы подтвердить это.
Видео, показывающее реакцию кальция с кислородом
Следующая диаграмма объединяет макроскопические, субмикроскопические и символические представления реакции, которую вы только что наблюдали.
Чтобы сделать фото в темноте, нам понадобится вспышка камеры.В наши дни большинство камер имеют встроенные вспышки. Но самые ранние вспышки работали с порошком для вспышек, который содержал зерна магния. Их нужно было зажечь вручную и гореть очень ярко в течение очень короткого периода времени.
Фотограф использует старинную камеру и вспышку, работающую с магниевым порошком. http://en.wikipedia.org/wiki/File:1909_Victor_Flash_Lamp.jpgТеперь, когда мы провели макроскопические наблюдения этих двух реакций, мы готовы написать об этих реакциях научным языком.
Общая реакция металлов с кислородом
- слово уравнение
- уравнение изображения
- химическое уравнение
- реактивы
- товар
- оксид металла
Давайте начнем с написания словесных уравнений для двух реакций, которые мы только что провели. Словесные уравнения часто легче писать, чем графические уравнения или химические уравнения, поэтому они являются хорошей отправной точкой, когда мы хотим писать реакции.
Напишите словесное уравнение для реакции между железом и кислородом и для реакции между магнием и кислородом.
Уравнения слов:
Вы можете написать это на доске.
Слово уравнение
Мы можем написать общее словесное уравнение для реакций, в которых металл реагирует с кислородом:
металл + кислород → оксид металла
Когда мы используем слова для описания реакции, мы все еще действуем на макроскопическом уровне. Далее мы собираемся перевести наше словесное уравнение в графическое уравнение.
Уравнение изображения
Когда мы представляем химическую реакцию в виде диаграммы частиц, такой как в приведенном ниже уравнении, мы работаем на субмикроскопическом уровне.
Можете ли вы определить реагенты в приведенном выше уравнении? Пурпурные атомы — это магний, а атомы кислорода — красные. Запишите название и химическую формулу продукта реакции.
Продукт оксид магния (MgO)
Картина не одинакова для всех реакций металлов с кислородом.
Химическое уравнение
Мы можем пойти дальше и перевести уравнение реакции между магнием и кислородом в химическое уравнение:
2 Mg + O 2 → 2 MgO
Поскольку химическое уравнение состоит из символов, мы можем рассматривать его как символическое представление.
Можете ли вы вспомнить, как называются числа перед формулами в химическом уравнении? Вы можете вспомнить, как называются числа в химической формуле?
Коэффициенты и индексы соответственно.
Как мы уже говорили, металлы одной группы будут реагировать с кислородом таким же образом, как и друг друга. Итак, кальций реагирует с кислородом так же, как магний реагирует с кислородом. Химические уравнения также показывают сходство. Химическое уравнение реакции между кальцием и кислородом:
2Ca + O 2 → 2CaO
Как называется продукт в этой реакции?
Из какой группы входят кальций и магний?
Оксид металла имеет общую формулу MO или M 2 O.В формуле M представляет собой атом металла, а O представляет собой кислород. Таким образом, мы можем сказать, что металлы из группы 2 будут реагировать с кислородом и будут иметь следующее общее уравнение, где M представляет металл группы 2:
2M + O 2 → 2MO
Также встречаются оксиды металлов типа M 2 O 3 и MO 2 , но мы ограничимся рассмотрением первых двух типов.
Чтобы узнать, какая формула будет правильной: MO или M 2 O, вам следует запомнить два простых правила:
Это рекомендуемый способ помочь учащимся писать формулы.Как только учащиеся узнают о валентностях в гр. 10-12, они смогут использовать эту информацию для написания формул соединений. на данный момент этого достаточно.
Оксиды металлов из группы 1 Периодической таблицы будут иметь формулу M 2 O.
Можете написать два примера? Посмотрите на Периодическую таблицу в начале книги, выберите два любых металла из группы 1 и напишите их формулы, используя это правило.
Любые два из следующих: Li 2 O, Na 2 O, K 2 O, Rb 2 O, Cs 2 O
Оксиды металлов группы 2 будут иметь формулу MO.
Можете написать 2 примера?
Любые два из следующих: BeO, MgO, CaO, SeO, BaO
Металлы группы 1 обозначаются как щелочные металлы , а металлы группы 2 обозначаются как щелочноземельные металлы .
Железо из группы 8. Вот графическое уравнение реакции между железом и кислородом (железо — зеленое, а кислород — красное).
Напишите химическое уравнение и словесное уравнение этой реакции под уравнением-изображением.
Учащиеся должны написать следующее в соответствии с соответствующими картинками на приведенной выше диаграмме:
В следующем разделе мы собираемся вернуться в макроскопический мир, чтобы увидеть еще один пример реакции между железом и кислородом, с которым вы должны быть хорошо знакомы — образование ржавчины.
Образование ржавчины
- ржавчина
- коррозия
- коррозионный
- нержавеющая
- сталь
Вы знаете, что такое ржавчина? Рисунки ниже дадут некоторые подсказки.
Различные предметы, которые ржавеют. http://www.flickr.com/photos/flattop341/347445202/Предлагаем вам упражнение, чтобы показать, как образуется ржавчина. CAPS этого не требует. Его можно настроить как демонстрацию. Затем вы можете сравнить эту реакцию с той, которую вы проводили ранее, когда железо сжигалось в кислороде в реакции горения.
Для этого эксперимента потребуется место, где он может оставаться нетронутым в течение двух или трех дней. Возможно, стоит настроить этот эксперимент в начале этого раздела. Обратите внимание: пробирка может быть трудно очистить в конце этого эксперимента.
МАТЕРИАЛЫ:
- пробирка
- зажим
- стойка реторт
- блюдо
- железные опилки
- вода
ИНСТРУКЦИЯ:
- Промойте пробирку водой, чтобы смочить внутреннюю часть.
- Осторожно посыпьте шпателем железные опилки по бокам пробирки.
- Переверните пробирку в посуду с водой. Используйте зажим, прикрепленный к стойке для реторты, чтобы удерживать пробирку на месте.
- В течение трех дней вода должна оставаться над краем пробирки.
Вот простая схема, показывающая экспериментальную установку с зажимом, удерживающим пробирку в вертикальном положении.
ВОПРОСЫ:
Как выглядят железные опилки в начале эксперимента?Они серебристого цвета.
Какие реагенты в этом эксперименте?Железо и кислород (и вода).
Есть ли что-то, что помогает или ускоряет реакцию?Как выглядит продукт в конце реакции?
Коричнево-красный цвет.
Ржавчина — это слово, обозначающее шелушащийся, твердый красновато-коричневый продукт, который образуется на железе при реакции с кислородом воздуха.
Когда учитель сжигал железо раньше, он быстро реагировал с кислородом с образованием оксида железа.Вот изображение оксида железа, чтобы напомнить вам, как он выглядел.
Образец оксида железа.Ржавчина — это форма оксида железа
Когда железо подвергается воздействию кислорода воздуха, происходит аналогичная реакция, но гораздо медленнее. Железо постепенно «съедается», поскольку оно медленно вступает в реакцию с кислородом. Во влажных условиях железо быстрее ржавеет.
Ржавчина на самом деле представляет собой смесь различных оксидов железа, но Fe 2 O 3 из нашего предыдущего примера является важной частью этого.Ржавчина железа — хороший пример процесса коррозии.
Напомните учащимся, где еще они слышали термин «коррозионный», использованный ранее в «Материи и материалах». Он используется для описания сильных кислот и оснований, с которыми учащиеся впервые познакомились на гр. 7 Материя и материалы и еще раз рассмотрим их позже в этом семестре.
Ржавчина, как правило, происходит намного быстрее у океана. Мало того, что есть капли воды, в них есть соль, что делает их еще более агрессивными.Ржавчина также происходит быстрее в присутствии кислот. Внутри лабораторий или фабрик, где используются или хранятся кислоты, воздух также очень агрессивен. Когда воздух в определенной области содержит влагу, смешанную с кислотой или солью, мы называем эту область агрессивным климатом .
Брошенная машина у моря быстро ржавеет и разъедает. http://www.flickr.com/photos/mikebaird/4585328947/Если вы живете в агрессивном климате, например у океана, часто лучше делать оконные рамы и двери вашего дома из дерева, а не из железа и стали, потому что дерево не ржавеет.Многие люди также используют алюминий, поскольку этот металл не ржавеет.
Проблема с ржавчиной
Ржавчина — это естественный процесс, и его эффекты могут быть очень красивыми.
Садовая скульптура, которая должна была ржаветь, чтобы придать ей больше текстуры. http://www.flickr.com/photos/lizjones/449708229/Однако железо и ржавчина (оксид железа) — совершенно разные материалы и, следовательно, имеют разные свойства.
Это ссылка на то, что учащиеся сделали в предыдущих классах в отношении свойств материалов.
Представим, что мы изготовили что-то из железа. Какие свойства железа мы хотим использовать?Железо — это металл, поэтому он твердый, прочный и гибкий.
Как вы думаете, какие предметы мы делаем из железа, если эти свойства желательны?Инструменты, замки, петли, шурупы и гвозди, гаражные ворота … перечень предметов практически бесконечен!
Когда предмет сделан из железа, мы можем защитить его от ржавчины, чтобы он не потерял желаемые свойства.Как вы думаете, ржавая цепь и дверная ручка на следующих фотографиях будут такими же прочными и гибкими, как когда они были новыми? Почему нет?
Ржавая цепь. http://www.flickr.com/photos/a2gemma/2373078360/ Ржавая дверная петля. http://www.flickr.com/photos/49889874@N05/4883527730/Нет, они не будут такими сильными. Ржавчина — это другое соединение по сравнению с железом, поэтому она имеет другие свойства. Это начинает ослаблять предметы.
Вы, возможно, узнали из предыдущих классов, что железо можно укрепить и сделать более устойчивым к ржавчине, смешивая его с другими элементами, чтобы превратить его в сталь .
Сталь используется при строительстве зданий, потому что она очень прочная. Однако сталь не является полностью устойчивой к ржавчине, и ее необходимо защищать от ржавчины, особенно во влажном и агрессивном климате.
Строящееся здание. Вы можете увидеть каркас из стали. http://www.flickr.com/photos/ell-r-brown/5375682861/ Стальная арматура для поддержки здания. Как видите, сталь тоже может ржаветь. http://www.flickr.com/photos/sbeebe/5225048839/В следующем разделе мы узнаем о различных способах защиты железа и стали от ржавчины.
Способы предотвращения ржавчины
- столкновение
- барьер
- выставлено
- пористый
- проникнуть
- хромированный металл
- металл оцинкованный
- гальваника
- оксидный
Ржавчина образуется на поверхности железного или стального предмета, когда эта поверхность контактирует с кислородом. Молекулы кислорода сталкиваются с атомами железа на поверхности объекта и реагируют с образованием оксида железа. Если бы мы хотели предотвратить это, что бы мы должны были делать?
Нам нужно поместить что-нибудь между кислородом и железом, чтобы они не могли контактировать.
Краска защищает от ржавчины
Если бы мы хотели предотвратить контакт атомов железа и молекул кислорода, нам нужно было бы установить между ними барьер. Вот что мы делаем, когда красим железную поверхность, чтобы защитить ее от ржавчины.
Однако краскане является главным препятствием. Если поверхность краски поцарапана или начнет отслаиваться, металл обнажится, и ржавчина все еще может образоваться.
Другие металлы как барьеры для ржавчины
Ржавчина — пористый материал.Это означает, что воздух и вода могут проникать сквозь ржавчину на поверхности предмета и достигать утюга под ним. Утюг будет продолжать разъедать, даже если он покрыт толстым слоем ржавчины. Таким образом, даже если поверхность железа покрыта, она не защищена, потому что молекулы кислорода все еще могут достичь железа, чтобы вступить с ним в реакцию.
Есть несколько других способов остановить или замедлить ржавчину. Один из способов защитить поверхность железа — это покрыть ее металлом, который не подвержен коррозии, например, хромом.Краны и сантехника часто изготавливаются из «хромированного» железа. Они были покрыты слоем хрома, чтобы защитить поверхность железа от контакта с воздухом.
Хромированные краны в раковину. http://www.flickr.com/photos/a_mason/3212274/Спросите учащихся, почему, по их мнению, особенно важно защищать смесители в ванных комнатах и раковинах от ржавчины. Это связано с тем, что они находятся во влажной среде, и вода делает железо более подверженным ржавчине.
Цинк также реагирует с кислородом с образованием оксида цинка:
2 Zn + O 2 → 2 ZnO
В какой группе находится цинк?
Цинк принадлежит к группе, отличной от железа в Периодической таблице.Это говорит нам о том, что оно не реагирует так же, как железо с кислородом.
Оксид цинка (ZnO) не является пористым оксидом, а образует плотный защитный слой, через который не может проникнуть кислород или вода. На железо можно нанести тонкий слой цинка в процессе, называемом гальванизация . Слой цинка быстро реагирует с кислородом, образуя оксид цинка. Этот слой защищает цинк под ним от дальнейшего окисления. Он также защищает железо под цинком от контакта с кислородом.
Коррозия и ржавчина (видео)
На следующем рисунке показан сегмент из оцинкованной стали с царапиной на защитном покрытии. Как вы думаете, что произойдет со сталью, подвергшейся воздействию воздуха из-за царапины на покрытии?
Открытая сталь со временем заржавеет.
Сегмент из оцинкованной стали с повреждением цинкового покрытия.Оцинкованное железо используется для различных целей. Скорее всего, вы видели, как его используют в качестве оцинкованных кровельных панелей или других оцинкованных строительных материалов, таких как винты, гвозди, трубы или полы.
Образование ржавчины и как его предотвратить (видео)
Оцинкованные панели для стен или крыш. Оцинкованная лейка. http://www.flickr.com/photos/cwisnieski/54467/ Оцинкованные гайки и болты. http://www.flickr.com/photos/johnloo/52890/ Оцинкованный пол. http://www.flickr.com/photos/ants88/6846263748/В этой главе мы узнали, как образуются оксиды металлов. Мы видели две демонстрации реакций, в которых оксиды металлов образовывались как продукты. Наконец, мы узнали об оксиде металла (оксид железа или ржавчину) из нашего повседневного опыта, а также о способах предотвращения ржавчины предметов, особенно тех, которые используются в зданиях и промышленности.
Нарезанные ломтики яблока становятся коричневыми, так как соединения железа в мякоти яблока вступают в реакцию с кислородом воздуха! Реакции способствует фермент в яблоке, поэтому капание лимонного сока на ломтики разрушит фермент и предотвратит их потемнение.
Почему яблоки становятся коричневыми? (видео)
Резюме
- Когда металл реагирует с кислородом, образуется оксид металла.
Общее уравнение этой реакции: металл + кислород → оксид металла.
Некоторые металлы при горении вступают в реакцию с кислородом. Эти реакции называются реакциями горения. Два примера реакций горения:
- Ржавчина — это форма оксида железа, которая медленно образуется при контакте железа с воздухом.
- Железо можно превратить в сталь (сплав), которая более устойчива к ржавчине.
- Ржавчину можно предотвратить, покрывая железные поверхности краской или нержавеющими металлами, такими как хром или цинк.
Концептуальная карта
Какое собственное название означает «сжигание»? Заполните это на концептуальной карте. Введите примеры металлов, которые вы изучили в этой главе. Вам нужно будет посмотреть на сформированные продукты, чтобы знать, куда поставить. Наконец, приведите два примера металлов, о которых вы узнали в этой главе, которые не ржавеют.
Это законченная концептуальная карта.
Прочтите предложения и заполните пропущенные слова. Напишите пропущенное слово в строке ниже.[9 баллов]
Химическая реакция, при которой соединение и кислород вступают в реакцию во время горения с образованием нового продукта, называется реакцией ____________.
Магний + ____________ → оксид магния
____________ + кислород → оксид железа
медь + кислород → ____________
Другое название оксида железа — ____________.
Металл, покрытый тонкими слоями цинка и оксида цинка, называется ____________ металл.
Постепенное разрушение материалов (обычно металлов) в результате химической реакции с окружающей средой называется ____________.
Когда воздух в определенной области содержит влагу, смешанную с кислотой или солью, мы называем эту область климатом ____________.
Продукт реакции между металлом и кислородом называется ____________.
- горение
- кислород
- Утюг
- оксид меди
- ржавчина
- оцинковка
- коррозия
- коррозионный
- оксид металла
Заполните таблицу, указав недостающие уравнения реакции между железом и кислородом [4 балла] Заполните таблицу, указав недостающие уравнения реакции между магнием и кислородом [4 балла]
Словесное уравнение | магний + кислород → оксид магния | |
Химическое уравнение | 2 Mg + O 2 → 2 MgO | |
Словесное уравнение | медь + кислород → оксид меди |
Химическое уравнение | 2 Cu + O 2 → 2 CuO |
Графическое уравнение16 |
Словесное уравнение | цинк + кислород → оксид цинка |
Химическое уравнение | 2 Zn + O 2 → 2 ZnO |
Итого [30 баллов]
Химические формулы
2.2 Химические формулы
Цель обучения
- Для описания химического состава.
Когда химики синтезируют новое соединение, они могут еще не знать его молекулярную или структурную формулу. В таких случаях они обычно начинают с определения его эмпирической формулы Формула для соединения, состоящего из атомного символа для каждого составляющего элемента, сопровождаемого нижним индексом, указывающим относительное число атомов этого элемента в соединении, уменьшенное до наименьшего целого. числа. относительных чисел атомов элементов в соединении, уменьшенных до наименьших целых чисел. Поскольку эмпирическая формула основана на экспериментальных измерениях количества атомов в образце соединения, она показывает только отношения количества присутствующих элементов. Различие между эмпирической формулой и молекулярной формулой можно проиллюстрировать на примере бутана, ковалентного соединения, используемого в качестве топлива в одноразовых зажигалках. Молекулярная формула бутана: C 4 H 10 .Отношение атомов углерода к атомам водорода в бутане составляет 4:10, которое может быть уменьшено до 2: 5. Таким образом, эмпирическая формула для бутана: C 2 H 5 . Формульная единица Абсолютная группировка атомов или ионов, представленная эмпирической формулой. представляет собой абсолютную группу атомов или ионов, представленную эмпирической формулой соединения, ионного или ковалентного. Бутан, например, имеет эмпирическую формулу C 2 H 5 , но он содержит две формульные единицы C 2 H 5 , что дает молекулярную формулу C 4 H 10 .
Поскольку ионные соединения не содержат дискретных молекул, для обозначения их состава используются эмпирические формулы. Все соединения, ионные или ковалентные, должны быть электрически нейтральными. Следовательно, положительный и отрицательный заряды в формульной единице должны точно компенсировать друг друга. Если катион и анион имеют одинаковые заряды, такие как Na + и Cl —, то соединение должно иметь соотношение катионов к анионам 1: 1, а эмпирическая формула должна быть NaCl.Если заряды различаются по величине, то для получения нейтрального соединения необходимо соотношение катион: анион, отличное от 1: 1. В случае Mg 2+ и Cl —, например, необходимы два иона Cl — для уравновешивания двух положительных зарядов на каждом ионе Mg 2+ , что дает эмпирическую формулу MgCl 2 . Точно так же формула ионного соединения, содержащего ионы Na + и O 2-, — Na 2 O.
Обратите внимание на образец
Ионные соединения не содержат дискретных молекул, поэтому для обозначения их состава используются эмпирические формулы.
Бинарные ионные соединения
Ионное соединение, которое содержит только два элемента, один присутствует в виде катиона, а другой — в виде аниона, называется бинарным ионным соединением. Ионное соединение, которое содержит только два элемента, один присутствует в виде катиона, а другой — в виде аниона. MgCl 2, коагулянт, используемый при приготовлении тофу из соевых бобов. Для бинарных ионных соединений индексы в эмпирической формуле также могут быть получены путем пересечения зарядов: используйте абсолютное значение заряда одного иона в качестве индекса для другого иона.Этот метод схематически показан следующим образом:
Транспортные расходы. Один из методов получения индексов в эмпирической формуле — это пересечение зарядов.
При пересечении сборов иногда бывает необходимо уменьшить индексы до их простейшего отношения, чтобы написать эмпирическую формулу. Рассмотрим, например, соединение, образованное Mg 2+ и O 2-. Использование абсолютных значений зарядов на ионах в качестве индексов дает формулу Mg 2 O 2 :
Это упрощает правильную эмпирическую формулу MgO.Эмпирическая формула имеет один ион Mg 2+ и один ион O 2-.
Пример 4
Напишите эмпирическую формулу для простейшего бинарного ионного соединения, образованного из каждого иона или пары элементов.
- Ga 3+ и As 3-
- Eu 3+ и O 2-
- кальций и хлор
Дано: ионов или элементов
Запрошено: эмпирическая формула бинарного ионного соединения
Стратегия:
A Если не указано, определите ионные заряды на основе расположения элементов в периодической таблице.
B Используйте абсолютное значение заряда каждого иона в качестве индекса для другого иона. Уменьшите индексы до наименьших чисел, чтобы написать эмпирическую формулу. Убедитесь, что эмпирическая формула электрически нейтральна.
Решение:
B Использование абсолютных значений зарядов на ионах в качестве индексов дает Ga 3 As 3 :
Уменьшение индексов до наименьших целых чисел дает эмпирическую формулу GaAs, которая электрически нейтральна [+3 + (−3) = 0].В качестве альтернативы мы могли бы признать, что Ga 3+ и As 3- имеют заряды одинаковой величины, но противоположные знаки. Один ион Ga 3+ уравновешивает заряд одного иона As 3-, и соединение 1: 1 не будет иметь чистого заряда. Поскольку мы пишем индексы, только если число больше 1, эмпирическая формула — GaAs. GaAs — это арсенид галлия, который широко используется в электронной промышленности в транзисторах и других устройствах.
B Поскольку Eu 3+ имеет заряд +3, а O 2- имеет заряд −2, соединение 1: 1 будет иметь чистый заряд +1.Следовательно, мы должны найти кратные списаниям, которые отменяются. Мы перекрестно заряжаем, используя абсолютное значение заряда одного иона в качестве индекса для другого иона:
Нижний индекс для Eu 3+ равен 2 (из O 2-), а индекс для O 2- равен 3 (из Eu 3+ ), что дает Eu 2 O 3 ; нижние индексы не могут быть далее уменьшены. Эмпирическая формула содержит положительный заряд 2 (+3) = +6 и отрицательный заряд 3 (−2) = −6 для чистого заряда 0.Соединение Eu 2 O 3 нейтрально. Оксид европия отвечает за красный цвет экранов телевизоров и компьютеров.
A Поскольку заряды на ионах не указаны, мы должны сначала определить ожидаемые заряды для наиболее распространенных ионов, полученных из кальция и хлора. Кальций находится в группе 2, поэтому он должен потерять два электрона, чтобы сформировать Ca 2+ . Хлор находится в группе 17, поэтому он должен получить один электрон, чтобы образовать Cl — .
B Два иона Cl — необходимы для балансировки заряда одного иона Ca 2+ , что приводит к эмпирической формуле CaCl 2 . Мы также могли бы перекрестно заряжать, используя абсолютное значение заряда для Ca 2+ в качестве индекса для Cl и абсолютное значение заряда для Cl — в качестве индекса для Ca:
Нижние индексы в CaCl 2 не подлежат дальнейшему уменьшению.Эмпирическая формула электрически нейтральна [+2 + 2 (−1) = 0]. Это соединение хлорид кальция, одно из веществ, используемых в качестве «соли» для таяния льда на дорогах и тротуарах зимой.
Упражнение
Напишите эмпирическую формулу для простейшего бинарного ионного соединения, образованного из каждого иона или пары элементов.
- Li + и N 3-
- Al 3+ и O 2-
- литий и кислород
Ответ:
- Li 3 N
- Al 2 O 3
- Li 2 O
Многоатомные ионы
Многоатомные ионы Группа из двух или более атомов, обладающая чистым электрическим зарядом.представляют собой группы атомов, которые несут общий электрический заряд, хотя атомы в многоатомном ионе удерживаются вместе теми же ковалентными связями, которые удерживают атомы вместе в молекулах. Подобно тому, как существует намного больше видов молекул, чем простых элементов, существует гораздо больше видов многоатомных ионов, чем одноатомных ионов. Двумя примерами многоатомных катионов являются ионы аммония (NH 4 + ) и метиламмония (CH 3 NH 3 + ). Многоатомных анионов гораздо больше, чем многоатомных катионов; некоторые общие примеры приведены в таблице 2.4 «Общие многоатомные ионы и их названия».
Таблица 2.4 Общие многоатомные ионы и их названия
| Формула | Имя Иона |
|---|---|
| NH 4 + | аммоний |
| CH 3 NH 3 + | метиламмоний |
| ОН — | гидроксид |
| O 2 2- | перекись |
| CN — | цианид |
| SCN — | тиоцианат |
| НЕТ 2 — | нитрит |
| НЕТ 3 — | нитрат |
| CO 3 2- | карбонат |
| HCO 3 — | гидрокарбонат или бикарбонат |
| СО 3 2− | сульфит |
| СО 4 2− | сульфат |
| HSO 4 — | гидросульфат или бисульфат |
| PO 4 3- | фосфат |
| HPO 4 2− | гидрофосфат |
| H 2 PO 4 — | дигидрофосфат |
| ClO — | гипохлорит |
| ClO 2 — | хлорит |
| ClO 3 — | хлорат |
| ClO 4 — | перхлорат |
| MnO 4 — | перманганат |
| CrO 4 2- | хромат |
| Cr 2 O 7 2- | дихромат |
| C 2 O 4 2- | оксалат |
| HCO 2 — | формиат |
| CH 3 CO 2 — | ацетат |
| C 6 H 5 CO 2 — | бензоат |
Метод, который мы использовали для предсказания эмпирических формул для ионных соединений, содержащих одноатомные ионы, можно также использовать для соединений, содержащих многоатомные ионы.Общий заряд катионов должен уравновешивать общий заряд анионов в формульной единице. Таким образом, ионы K + и NO 3 — объединяются в соотношении 1: 1 с образованием KNO 3 (нитрата калия или селитры), основного ингредиента черного пороха. Точно так же Ca 2+ и SO 4 2- образуют CaSO 4 (сульфат кальция), который соединяется с различными количествами воды с образованием гипса и гипса. Многоатомные ионы NH 4 + и NO 3 — образуют NH 4 NO 3 (нитрат аммония), который является широко используемым удобрением и, в чужих руках, взрывчатым веществом.Одним из примеров соединения, в котором ионы имеют заряды разной величины, является фосфат кальция, который состоит из ионов Ca 2+ и PO 4 3-; это основной компонент костей. Соединение электрически нейтрально, поскольку ионы объединяются в соотношении три иона Ca 2+ [3 (+2) = +6] на каждые два иона [2 (−3) = −6], что дает эмпирическую формулу Ca 3 (PO 4 ) 2 ; круглые скобки вокруг PO 4 в эмпирической формуле указывают, что это многоатомный ион.Запись формулы фосфата кальция в виде Ca 3 P 2 O 8 дает правильное число каждого атома в формульной единице, но это скрывает тот факт, что соединение содержит легко идентифицируемый PO 4 3- ионы.
Пример 5
Напишите эмпирическую формулу соединения, образованного каждой ионной парой.
- Na + и HPO 4 2-
- катион калия и анион цианида
- Катион кальция и анион гипохлорита
Дано: ионов
Запрошено: эмпирическая формула для ионного соединения
Стратегия:
A Если не указан, определите заряд одноатомного иона по его положению в периодической таблице.Используйте Таблицу 2.4 «Общие многоатомные ионы и их названия», чтобы найти заряд многоатомного иона.
B Используйте абсолютное значение заряда каждого иона в качестве индекса для другого иона. При написании эмпирической формулы сократите индексы до наименьших целых чисел.
Решение:
- B Поскольку HPO 4 2− имеет заряд -2, а Na + имеет заряд +1, эмпирическая формула требует, чтобы два иона Na + уравновешивали заряд многоатомного иона, что дает Na 2 HPO 4 .Нижние индексы уменьшены до наименьших чисел, поэтому эмпирическая формула: Na 2 HPO 4 . Это соединение представляет собой гидрофосфат натрия, который используется для придания текстуры плавленому сыру, пудингам и быстрым завтракам.
- A Катион калия — K + , а анион цианида — CN — . B Поскольку величина заряда на каждом ионе одинакова, эмпирическая формула — KCN. Цианистый калий очень токсичен, и одно время его использовали как крысиный яд.Однако это использование было прекращено, поскольку слишком много людей были случайно отравлены.
- A Катион кальция — это Ca 2+ , а анион гипохлорита — ClO — . B Два иона ClO — необходимы для уравновешивания заряда одного иона Ca 2+ , что дает Ca (ClO) 2 . Нижние индексы не могут быть далее уменьшены, поэтому эмпирическая формула Ca (ClO) 2 . Это гипохлорит кальция, «хлор», используемый для очистки воды в плавательных бассейнах.
Упражнение
Напишите эмпирическую формулу соединения, образованного каждой ионной парой.
- Ca 2+ и H 2 PO 4 —
- катион натрия и анион бикарбоната
- Катион аммония и сульфат-анион
Ответ:
- Ca (H 2 PO 4 ) 2 : дигидрофосфат кальция является одним из ингредиентов разрыхлителя.
- NaHCO 3 : бикарбонат натрия содержится в антацидах и разрыхлителе; в чистом виде продается как пищевая сода.
- (NH 4 ) 2 SO 4 : сульфат аммония является обычным источником азота в удобрениях.
Гидраты
Многие ионные соединения встречаются в виде гидратов — соединения, которое содержит определенные соотношения слабосвязанных молекул воды, называемых водами гидратации., соединения, которые содержат определенные соотношения слабосвязанных молекул воды, называемые водами гидратации — это слабосвязанные молекулы воды в гидратных соединениях. Эти гидратные воды часто можно удалить, просто нагревая состав. Гидратные воды часто можно удалить простым нагреванием. Например, дигидрофосфат кальция может образовывать твердое вещество, которое содержит одну молекулу воды на единицу Ca (H 2 PO 4 ) 2 , и используется в качестве разрыхлителя в пищевой промышленности для повышения уровня выпечки.Эмпирическая формула твердого вещества: Ca (H 2 PO 4 ) 2 · H 2 O. Напротив, сульфат меди обычно образует синее твердое вещество, которое содержит пять гидратных вод на формульную единицу, с эмпирической формулой CuSO 4 · 5H 2 O. При нагревании все пять молекул воды теряются, давая белое твердое вещество с эмпирической формулой CuSO 4 (Рисунок 2.9 «Потеря воды из гидрата при нагревании») ).
Рисунок 2.9 Потеря воды из гидрата при нагревании
При нагревании синего CuSO 4 · 5H 2 O две молекулы воды теряются при 30 ° C, еще две при 110 ° C и последняя при 250 ° C с образованием белого CuSO 4 .
Соединения, различающиеся только количеством гидратных вод, могут иметь самые разные свойства. Например, CaSO 4 · ½H 2 O — гипс из Парижа, который часто использовался для изготовления прочных слепков для сломанных рук или ног, тогда как CaSO 4 · 2H 2 O — менее плотный, более хлопьевидный гипс. , минерал, используемый в панелях гипсокартона для жилищного строительства.После схватывания гипса смесь гипса и воды кристаллизовалась, давая твердый CaSO 4 · 2H 2 O. Подобные процессы используются при схватывании цемента и бетона.
Сводка
Эмпирическая формула дает относительных чисел атомов элементов в соединении, уменьшенных до наименьших целых чисел. Формульная единица — это абсолютная группа , представленная эмпирической формулой соединения, ионного или ковалентного.Эмпирические формулы особенно полезны для описания состава ионных соединений, которые не содержат легко идентифицируемых молекул. Некоторые ионные соединения встречаются в виде гидратов , которые содержат определенные соотношения слабосвязанных молекул воды, называемых гидратных вод .
Ключевые вынос
- Состав соединения представлен эмпирической или молекулярной формулой, каждая из которых состоит по крайней мере из одной формульной единицы.
Концептуальные проблемы
Каковы различия и сходства между многоатомным ионом и молекулой?
Классифицируйте каждое соединение как ионное или ковалентное.
- Zn 3 (PO 4 ) 2
- C 6 H 5 CO 2 H
- K 2 Cr 2 O 7
- CH 3 CH 2 SH
- NH 4 Br
- CCl 2 F 2
Классифицируйте каждое соединение как ионное или ковалентное.Какие органические соединения и какие неорганические соединения?
- CH 3 CH 2 CO 2 H
- CaCl 2
- Y (НЕТ 3 ) 3
- H 2 S
- NaC 2 H 3 O 2
Как правило, невозможно определить молекулярную формулу непосредственно из эмпирической формулы.Какая еще информация нужна?
Приведите две части информации, которую мы получаем из структурной формулы, которую мы не можем получить из эмпирической формулы.
Формулы спиртов часто записываются как ROH, а не как эмпирические формулы. Например, метанол обычно записывается как CH 3 OH, а не как CH 4 O.Объясните, почему предпочтительнее обозначение ROH.
Соединение диметилсульфида имеет эмпирическую формулу C 2 H 6 S и структурную формулу CH 3 SCH 3 . Какую информацию мы получаем из структурной формулы, чего не получаем из эмпирической формулы? Напишите сокращенную структурную формулу соединения.
Какова правильная формула гидроксида магния — MgOH 2 или Mg (OH) 2 ? Зачем?
Цианид магния обозначается как Mg (CN) 2 , а не MgCN 2 .Зачем?
Всегда ли данный гидрат содержит одинаковое количество гидратных вод?
Ответ
Структурная формула дает нам возможность соединения атомов в молекуле или ионе, а также схематическое представление их расположения в пространстве.Эмпирические формулы говорят нам только отношения присутствующих атомов. Конденсированная структурная формула диметилсульфида: (CH 3 ) 2 S.
Числовые задачи
Напишите формулы для каждого соединения.
- сульфат магния, содержащий 1 атом магния, 4 атома кислорода и 1 атом серы
- этиленгликоль (антифриз), содержащий 6 атомов водорода, 2 атома углерода и 2 атома кислорода
- уксусная кислота, которая имеет 2 атома кислорода, 2 атома углерода и 4 атома водорода
- хлорат калия, содержащий 1 атом хлора, 1 атом калия и 3 атома кислорода
- пентагидрат гипохлорита натрия, который имеет 1 атом хлора, 1 атом натрия, 6 атомов кислорода и 10 атомов водорода
Напишите формулы для каждого соединения.
- ацетат кадмия, содержащий 1 атом кадмия, 4 атома кислорода, 4 атома углерода и 6 атомов водорода
- цианид бария, который имеет 1 атом бария, 2 атома углерода и 2 атома азота
- дигидрат фосфата железа (III), который имеет 1 атом железа, 1 атом фосфора, 6 атомов кислорода и 4 атома водорода
- гексагидрат нитрата марганца (II), который имеет 1 атом марганца, 12 атомов водорода, 12 атомов кислорода и 2 атома азота
- фосфат серебра, содержащий 1 атом фосфора, 3 атома серебра и 4 атома кислорода
Заполните следующую таблицу, заполнив формулу ионного соединения, образованного каждой парой катион-анион.
Ион К + Fe 3+ NH 4 + Ba 2+ Класс — KCl СО 4 2− PO 4 3- НЕТ 3 — ОН — Напишите эмпирическую формулу бинарного соединения, образованного наиболее распространенными одноатомными ионами, образованными каждой парой элементов.
- цинк и сера
- барий и йод
- магний и хлор
- кремний и кислород
- натрий и сера
Напишите эмпирическую формулу бинарного соединения, образованного наиболее распространенными одноатомными ионами, образованными каждой парой элементов.
- литий и азот
- цезий и хлор
- германий и кислород
- рубидий и сера
- мышьяк и натрий
Напишите эмпирическую формулу для каждого соединения.
- Na 2 S 2 O 4
- B 2 H 6
- C 6 H 12 O 6
- P 4 O 10
- КМно 4
Напишите эмпирическую формулу для каждого соединения.
- Al 2 Класс 6
- K 2 Cr 2 O 7
- C 2 H 4
- (NH 2 ) 2 CNH
- CH 3 COOH
ответы
- MgSO 4
- C 2 H 6 O 2
- C 2 H 4 O 2
- KClO 3
- NaOCl · 5H 2 O
Ион К + Fe 3+ NH 4 + Ba 2+ Класс – KCl FeCl 3 NH 4 Класс BaCl 2 SO 4 2− K 2 SO 4 Fe 2 (SO 4 ) 3 (NH 4 ) 2 SO 4 BaSO 4 PO 4 3– K 3 PO 4 FePO 4 (NH 4 ) 3 PO 4 Ba 3 (PO 4 ) 2 НЕТ 3 — КНО 3 Fe (№ 3 ) 3 NH 4 NO 3 Ba (№ 3 ) 2 OH – КОН Fe (OH) 3 NH 4 OH Ba (OH) 2 - Li 3 N
- CsCl
- GeO 2
- руб 2 S
- Na 3 As
- AlCl 3
- K 2 Cr 2 O 7
- CH 2
- CH 5 N 3
- CH 2 O