Россина_Коррозия и защита.indd
%PDF-1.3 % 1 0 obj >]/Pages 3 0 R/Type/Catalog/ViewerPreferences>>> endobj 2 0 obj >stream 2019-03-19T12:51:32+05:002019-03-19T12:51:39+05:002019-03-19T12:51:39+05:00Adobe InDesign CS6 (Windows)uuid:8b32fa80-6bae-4b0b-a86d-4bb445199172xmp.did:BF81B306D74DE411B24FB20E6B9967A1xmp.id:04AA05BE1B4AE9118244B94C31D4EB63proof:pdf1xmp.iid:03AA05BE1B4AE9118244B94C31D4EB63xmp.did:E3B0011FA439E5118436ED2ED37270DDxmp.did:BF81B306D74DE411B24FB20E6B9967A1default
Коррозия металлов
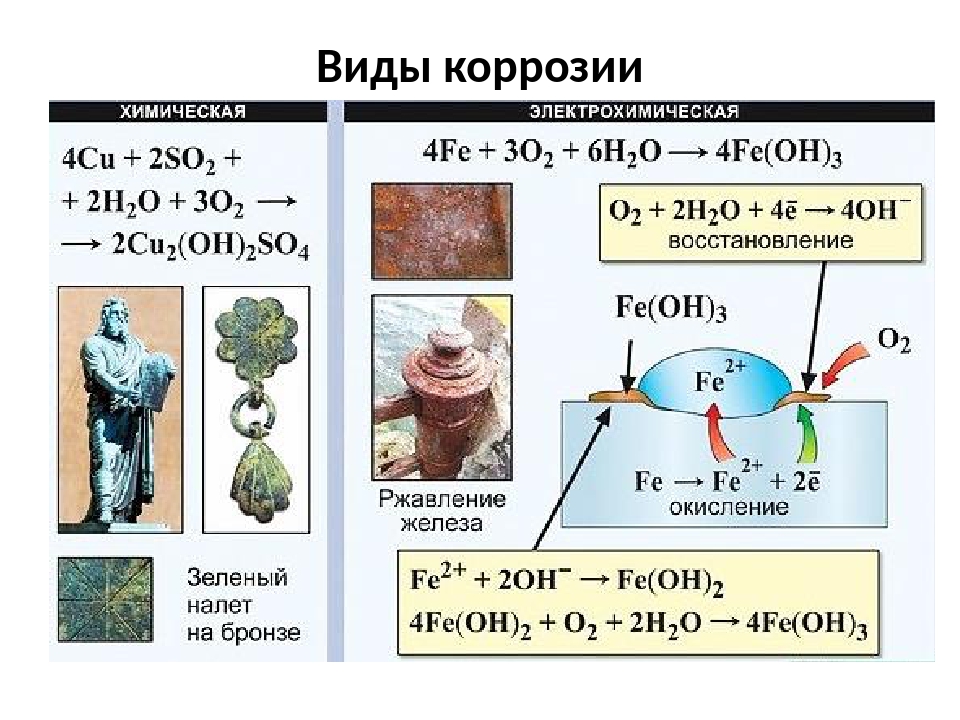
Коррозия – это самопроизвольный окислительно-восстановительный процесс разрушения металлов и сплавов вследствие взаимодействия с окружающей средой.
Различают два вида коррозии – химическую и электрохимическую. Химическая коррозия обусловлена взаимодействием металлов с веществами, содержащимися в окружающей среде. В производственных условиях такими веществами, помимо О2, являются SO2, CO2, H2S, NH3 и др.
Химическую коррозию, обусловленную взаимодействием металлов с газами, называют газовой
 Оксидные пленки других металлов (например, Fe) представляют собой рыхлые, пористые, механически непрочные образования. Они не предохраняют металл от доступа к нему газов и жидкостей. Поэтому такие металлы корродируют особенно быстро.
Оксидные пленки других металлов (например, Fe) представляют собой рыхлые, пористые, механически непрочные образования. Они не предохраняют металл от доступа к нему газов и жидкостей. Поэтому такие металлы корродируют особенно быстро.Процесс химической коррозии Fe схематически можно представить следующими уравнениями:
2Fe + O2=2FeO
4Fe + 3O2 = 2Fe2O3
3Fe + 2O2 =FeO · Fe2O3
4Fe + 3O2 +6H2O=4Fe(OH)3
Fe(OH)3=t H2O+FeOOH (ржавчина)
Однако наибольший вред приносит не химическая, а электрохимическая коррозия, связанная с переходом электронов от одних участков металла к другим. Химическая коррозия сопровождает электрохимическую и усиливает ее.
Сущность электрохимической коррозии
Металлы обычно содержат примеси других металлов и неметаллов. При соприкосновении таких металлов с электролитом (которым может служить Н2О, адсорбированная из воздуха, поскольку в ней как правило имеются ионы растворенных веществ) на поверхности металла возникает множество микрогальванических пар. В этих парах атомы более активного металла (обычно Fe) играют роль анода
При соприкосновении таких металлов с электролитом (которым может служить Н2О, адсорбированная из воздуха, поскольку в ней как правило имеются ионы растворенных веществ) на поверхности металла возникает множество микрогальванических пар. В этих парах атомы более активного металла (обычно Fe) играют роль анода
На катоде идет процесс восстановления молекул О2 в нейтральной и щелочной средах, или ионов Н+ – в кислой среде.
На аноде происходит окисление атомов металла, из которых состоит анод, с образованием катионов Men+.
Последние переходят в электролит (растворение анода) и соединяются с ионами ОН–, с образованием гидроксида Me(OH)n и других продуктов. Называемых ржавчиной. В результате металл, играющий роль анода, разрушается.
Скорость электрохимической коррозии тем больше, чем дальше друг от друга расположены металлы в ряду напряжений, и чем выше температура окружающей среды.
Чистые металлы устойчивы к коррозии. Однако, так ка абсолютно чистым металлов нет, а также вследствие того, что гальваническая пара может быть образована отдельными участками одного и того же металла, находящимися в различных условиях (под разными электролитами или под одним и тем же электролитом разной концентрации), то электрохимическая коррозия имеет место всегда при соприкосновении металла с электролитом (атмосферной влагой).
Роль катода при электрохимической коррозии могут выполнять не только менее активные металлы, но и примеси неметаллов, способных принимать электроны.
Коррозия – процесс поверхностный и при отсутствии трещин внутри металла развиваться не может. Поэтому одним из способов защиты от коррозии является нанесение на поверхность металла металлических и неметаллических покрытий.
В качестве металлических покрытий используются пленки Au, Ag, Ni, Cr, Zn и других металлов, которые мало подвергаются коррозии из-за своей индифферентности или по причине образования прочных оксидных пленок. Некоторые из этих металлов (
Различают два вида металлических покрытий – анодное и катодное. Покрытие называется
- анодным, если оно изготовлено из металла более активного, чем защищаемый;
- катодным, если изготовлено из менее активного металла.
Примером анодных покрытий для изделий из железа являются пленки из Cr, Zn, примером катодных – пленки из Ni, Sn, Ag,  Катодные покрытия не защищают металлы в случае нарушения их целостности (трещины, царапины), так как при наличии электролита возникает гальваническая пара, роль растворимого анода в которой играет защищаемый металл.
Катодные покрытия не защищают металлы в случае нарушения их целостности (трещины, царапины), так как при наличии электролита возникает гальваническая пара, роль растворимого анода в которой играет защищаемый металл.
Неметаллические покрытия также делятся на два вида: неорганические и органические. В качестве органических покрытий используются пленки лаков, красок, пластмасс, резины, битума, в качестве неорганических – эмали.
Протекторная защита заключается в соединении защищаемого изделия проводником с протектором – пластиной из более активного металла (Al,
Электрохимическая (катодная) защита заключается в соединении защищаемого изделия с катодом внешнего источника тока, вследствие чего изделие становится катодом. Анодом служит вспомогательный, обычно стальной, электрод (кусок металла), который и разрушается в процессе коррозии.
Автор: Метельский А.В.
Источник: Метельский А.В., Химия в Экзаменационных вопросах и ответах, Минск, изд. «Беларуская энцыклапедыя», 1999 год
Примеры электрохимической коррозии — Цветные металлы
Примеры электрохимической коррозии
Категория:
Цветные металлы
Примеры электрохимической коррозии
В качестве примеров электрохимической коррозии можно рассмотреть работу гальванических микропар, коррозию под каплей влаги и разрушение подземных конструкций.
Гальванические микропары. В основе развития процессов электрохимической коррозии сплава при наличии в нем двух или нескольких разнородных фаз лежит деятельность большого числа микрогальванических элементов или микропар. Процессы, протекающие на микроэлектродах, аналогичны ранее рассмотренным процессам работы гальванической пары из двух различных металлов. Так, например, в отожженном алюминиево-медном сплаве, имеющем двухфазную структуру и находящемся в соприкосновении с 3%-м раствором NaCl (рис. 1,а), коррозионному разрушению подвергается твердый раствор, имеющий потенциал—0,60 в и являющийся анодом по отношению к включениям СиА12, потенциал которых — 0,37 в. Химическое соединение, являющееся катодом, не разрушается. Процесс протекает с кислородной деполяризацией на катоде. При работе микропары с анода в раствор переходят ионы алюминия. На катоде образуются гидроксильные ионы ОН. Продукт коррозии представляет собой гидрат окиси алюминия А1(ОН)3.
1,а), коррозионному разрушению подвергается твердый раствор, имеющий потенциал—0,60 в и являющийся анодом по отношению к включениям СиА12, потенциал которых — 0,37 в. Химическое соединение, являющееся катодом, не разрушается. Процесс протекает с кислородной деполяризацией на катоде. При работе микропары с анода в раствор переходят ионы алюминия. На катоде образуются гидроксильные ионы ОН. Продукт коррозии представляет собой гидрат окиси алюминия А1(ОН)3.
Рис. 1. Схема электрохимической коррозии: а — двухфазного сплава; б — чистого металла под каплей влаги
Коррозия под каплей влаги. При эксплуатации изделий на поверхности металла возможно оседание мелких водяных капель. При растворении в этих каплях атмосферных газов образуется электролит. Особенно вредными являются: для стали — сернистый газ, сероводород и хлористый водород; для алюминиевых и магниевых сплавов — хлористый водород; для медных сплавов — аммиак.
Коррозия под каплей влаги (рис. 1,б) развивается в результате неоднородности пассивирования отдельных участков поверхности металла под каплей по причине неодинакового доступа кислорода воздуха. Вследствие большого притока кислорода к периферийным участкам поверхности под каплей последние находятся в более пассивном состоянии, чем центральные участки. Железо, например, в активном состоянии имеет потенциал от —0,4 до —0,5 в, а в пассивном +1,0 в и более. Поэтому разрушению подвергаются центральные участки, потенциал которых имеет более отрицательное значение.
Вследствие большого притока кислорода к периферийным участкам поверхности под каплей последние находятся в более пассивном состоянии, чем центральные участки. Железо, например, в активном состоянии имеет потенциал от —0,4 до —0,5 в, а в пассивном +1,0 в и более. Поэтому разрушению подвергаются центральные участки, потенциал которых имеет более отрицательное значение.
Разрушение подземных конструкций. Увлажненная земля обычно является проводником тока и, находясь в контакте с металлическими конструкциями, способствует развитию в них электрохимической коррозии. Большое влияние на коррозию подземных сооружений оказывают «блуждающие токи». Вредное влияние имеет только постоянный ток, ответвляющийся, например, от рельсовых путей электрических железных дорог, заземлений установок, питаемых постоянным током, и т. д. При этом участок вхождения тока является катодной зоной и коррозионному разрушению не подвергается, а участок выхода блуждающих токов из металла в почву представляет собой анодную зону, подверженную коррозионному разрушению в виде глубоких местных раковин.
Реклама:
Читать далее:
Выбор химического состава и обработки
Статьи по теме:
что это и как с ней бороться
Коррозия — процесс разрушения металла под воздействием влаги, агрессивных веществ, с которым контактирует покрытие или изделие в процессе эксплуатации. Это явление распространено, его можно увидеть дома, на улице и на работе. Когда металл оказывается в щелочной, кислой среде начинается окисление, которое со временем преобразуется в ржавчину. Другими словами, происходит химическая коррозия.
Сегодня поговорим о другом типе коррозии, которая образуется из-за «блуждающих токов». Именно она появляется на кранах, полотенцесушителях и прочем сантехническом оборудовании. Разрушение металла «блуждающими токами» называют электрохимической коррозией.
Этому коррозийному процессу подвержены многие металлы, включая надёжную и долговечную нержавеющую сталь. Под воздействием электромеханического влияния изделие быстро теряет привлекательность, происходит разрушение швов, соединений, стенок металла. В результате возникает угроза аварийных ситуаций, вплоть до серьезных протечек, грозящих соседям снизу затоплением и порчей имущества.
В результате возникает угроза аварийных ситуаций, вплоть до серьезных протечек, грозящих соседям снизу затоплением и порчей имущества.
Как определить электрохимическую коррозию
Рассмотрим пример образования признаков электрохимкоррозии на полотенцесушителе.
Оборудование производят из всевозможного сырья. Лучшим вариантом считаются модели из нержавейки, так как эксплуатационный период такого изделия гораздо продолжительней, нежели срок использования аналогов из других металлов. Однако, нержавеющая сталь не всегда способна справиться с агрессивным воздействием электрохимической коррозии.
На начальный процесс разрушения указывают практически незаметные пятна ржавчины, которая образуется на поверхности изделия, далее они добавляют в размерах, а значит — процесс прогрессирует и становится глубже.
Если очистить ржавчину грубым абразивом, то под ней прячется черная точка, говорящая об активном развитии разрушения. Так, ржавчина «поедает» металл снаружи и изнутри, создавая небольшое отверстие. В подобных случаях повреждениям подвергаются все изделие, включая фитинги. Коррозия, как правило, начинает развиваться на слабых участках, которыми являются сварные швы.
В подобных случаях повреждениям подвергаются все изделие, включая фитинги. Коррозия, как правило, начинает развиваться на слабых участках, которыми являются сварные швы.
Если ржавчина обнаружена на изделии, изготовленном из стали высокого класса, то наверняка проблема заключается в наличии в воде электричества.
Электрохимкоррозия работает при поддержке «помощников», например, хлора, который используется предприятиями для обеззараживания воды, окислителя кислорода, солей кальция, магния и прочие вещества. Ржавчина активно распространяется под воздействием горячей воды — если жидкость внутри трубы нагревается свыше 70°С, разрушающее действие ускоряется.
Почему появляется коррозия?
Чтобы понимать всю схему появления ржавчины на сантехническом оборудовании, стоит знать, откуда в воде появляется электричество.
Среди причин:
- Если дом относится к старым постройкам, в нем может быть нереализованным качественное заземление, которое обязательно, если в квартире установлено множество бытовых приборов и современная сантехника, например, ванна с гидромассажем, водонагреватели и пр.
 Заземление обеспечивает безопасность использования техники.
Заземление обеспечивает безопасность использования техники.При эксплуатации оборудования, которое имеет те или иные дефекты, происходит утечка токов, которые отправляются в стояки и взаимодействуют с водой. Таким образом появляются точечные «пробои», которые провоцируют образование ржавчины.
Если заземление выполнено в соответствии с нормативами, подобные неприятности не появятся.
- Если в доме проживают любители сэкономить на оплате коммунальных счетов за электроэнергию, появляется проблема электрохимической коррозии. Так, недобросовестные жильцы используют стояк как нулевой провод или же применяют специальные приборы, чтобы «скрутить» показатели счетчика электроэнергии. В результате этих и других манипуляций высоки риски образования коррозийных процессов. Также ситуация небезопасна для жизни — при прикосновении к трубе существует риск удара током.
- Разница потенциалов между металлами провоцирует образование неприятности. Токи возникают, если два разных металла плотно контактируют друг с другом.
 Если проектирование дома выполнено с соблюдением норм и стандартов, подобной проблемы возникнуть не должно, ведь токопроводящие компоненты подвергаются заземлению. Защитные меры способствуют уравниванию потенциалов.
Если проектирование дома выполнено с соблюдением норм и стандартов, подобной проблемы возникнуть не должно, ведь токопроводящие компоненты подвергаются заземлению. Защитные меры способствуют уравниванию потенциалов. - Сегодня широко распространены новые материалы, используемые для изготовления труб и сантехнического оборудования: металлопластик, полиэтилен и пр. Вместе с этим появились и новые проблемы. Так, если при замене части трубы применяется пластиковый аналог, может образоваться разница потенциалов, способствующая появлению «блуждающих токов». Несмотря на то, что пластик относится к группе диэлектриков, он находится в водной среде, которая становится проводником — появление ржавчины в этом случае практически неизбежно.
- Образованию токов подвержены не только стояки, но и коммуникации, находящиеся под землей. Блуждающее электричество, находящееся в них, может попасть и в квартиру. На подземные системы оказывают воздействие электрический транспорт (трамвай, троллейбус, поезда метро). Появляются токи утечки, а устранить проблему смогут только эксплуатирующие компании, обязанные проводить тщательные проверки.
- Проблемы нередко возникают, если невдалеке от труб, отвечающих за подачу воды и отопление, присутствует электропроводка с некачественной изоляцией. Повреждения провоцируют появление токов, которые блуждают по трубам водоснабжения.
- Среди причин коррозии — статическое электричество, накапливающееся на металле при контакте с водой.
Произвести контроль над соответствием рекомендованных норм и соблюдением правил монтажа и использования оборудования в высотном доме не представляется возможным. Зачастую подобные работы выполняют мастера без опыта или с его минимальным наличием.
Как следствие — аварийные ситуации и неприятные последствия для жильцов дома. Если полотенцесушитель подвергается коррозии, вы можете не иметь к этому отношения, а также не приостановите процесс из-за разрушения инженерного оборудования по причинам, независящим от вас.
Как предотвратить электрохимическую коррозию
Существует несколько мер, которые помогут предотвратить разрушение металла:
- Приобретая полотенцесушитель, откажитесь от его установки. Работу стоит доверить опытным мастерам, которые имеют допуск к проведению подобных мероприятий.
- Конструкции в обязательном порядке нуждается в заземлении, что особенно актуально для тех, кто врезал пластиковые трубы, расположенные между общим стояком и полотенцесушителем.
Для заземления оборудования можно предпринять несколько вариантов:
- Если стояк и его элементы изготовлены из металла, необходимо соединить стояк, например, с помощью хомута и медного провода, сечение которого не меньше 4 мм2. Затем от стояка горячего водоснабжения подключаются проводом к PE-шине и электрическому щиту, находящемуся на этаже. Для обеспечения полной безопасности при эксплуатации полотенцесушителя проводят заземления других токопроводящих объектов, включая ванны, изготовленные из нержавеющей стали и чугуна.
- Когда стояк и его компоненты изготовлены из полимеров, необходимо установить металлическую вставку, отвечающую диаметру трубы. Деталь вставляют между соединением полотенцесушителя и шаровым краном. На вставку монтируют зажим заземления. Используя провод из меди, подключаются к электрощиту.
- В случае, когда стояк состоит из пластиковых и металлических элементов, устанавливают вставку из металла между монтируемым оборудованием и шаровым краном. На нее крепят зажим и посредством медного кабеля подключаются к щиту.
- Еще одно решение задачи — установка системы для уравнивания потенциалов. Монтаж выполняют непосредственно в ванной. Такой шаг позволит избежать коррозии, а также минимизирует риски, связанные с ударом тока. Если за систему водоснабжения отвечают трубы из полимеров, то к ближайшему электрощиту также выполняются подключение заземляющих повод.
- В продаже представлено множество моделей полотенцесушителей. Эксперты рекомендуют не приобретать слишком дешевые конструкции. Для безопасной и длительной эксплуатации стоит обратить внимание на оборудование, снабженное защитой от «блуждающих токов». Полотенцесушители работают на базе полимера, которым обрабатывают внутреннюю часть трубы. Он ликвидирует контакт воды с металлом.
- Полимер полностью безопасен, так как не содержит вредных веществ, способных навредить человеку. Он не боится чрезмерно высокой температуры, не подвержен разрушению. Стоимость подобной продукции немногим выше стандартных изделий, при этом срок службы превышает период работы аналогов в несколько раз.
- Электрическая коррозия устраняется также заменой оборудования на электрическое. В этом случае нагрев полотенцесушителя начинается при подключении устройства к розетке. Как правило, на корпусе присутствует кнопка, позволяющая включать или отключать его. Это хорошее решение для многих людей, ищущих безопасный и долговечный вариант. Прибор функционирует автономно, не зависит от работоспособности системы водоснабжения, а значит — вы сможет прогреть помещение и высушить вещи даже в том случае, если горячей воды в кране нет. Минус прибора — потребление электроэнергии, за которую придется платить.
Важно! Если выбор пал на электрическое оборудование, следует знать, что оно имеет невысокую мощность, поэтому может работать от стационарного источника питания — розетки. Однако, учитывайте, что прибор работает в ванной, где преобладает высокая влажность, а значит его подключение должно проводиться через УЗО и автомат.
Мы попытались рассказать все самое важное об электрохимической коррозии и методах ее предотвращения/устранения. Вероятно, вы не столкнетесь с подобной проблемой, но, если она уже обнаружена, лучше сразу заявить о неприятности инженеру управляющей компании.
Специалист должен рассказать, какие меры стоит предпринять, какое оборудование станет оптимальным вариантом для вашей ванной комнаты. После установки инженер выполнит проверку полотенцесушителя на предмет герметичности, а также подпишет акт ввода прибора в эксплуатации.
Монтаж полотенцесушителя желательно поручить опытному мастеру, ведь от корректности установки во многом зависит долговечность прибора, а также безопасность и комфорт пользователей.
Виды коррозии, защита и хранение металлических изделий
Виды коррозии, защита и хранение металлических изделий
Несоблюдение правил хранения может привести к порче продукции. Гарантия производителя на изделия из оцинкованной стали предоставляется только в том случае, если соблюдены все условия транспортировки, хранения и монтажа изделий.
Основой оцинкованных изделий служит стальной лист, на котором под внешним воздействием атмосферы возможно возникновение коррозии. Чтобы этого избежать тонколистый стальной прокат обработан несколькими защитными слоями: цинковым и несколькими полимерными покрытиями, которые препятствуют прямому контакту стали с внешней средой.
Если оцинкованная сталь подвергается воздействию влаги (дождь, роса, конденсат) в среде, где не хватает кислорода, то вода быстро реагирует с цинком и постепенно разъедает покрытие. Наиболее распространённые условия, в которых появляется белая ржавчина, — изделия хранятся в заводской упаковке и/или плотно прижатыми друг к другу.
Физико-химические процессы разрушения металла
Коррозия — это самопроизвольно протекающий процесс разрушения металла, вследствие химического или электрохимического взаимодействия металла с окружающей средой.
Различают химическую и электрохимическую коррозию.
Химическая коррозия — коррозия металла в газовой и жидкостной среде, не проводящей ток. Коррозия этого вида состоит в окислении металла в результате непосредственного его химического взаимодействия с окружающей средой. В таких средах, как воздух, продукты сгорания каменного угля и других видов топлива (нефть, бензин, керосин, смазочные масла) обычно развивается химическая коррозия.
Но наличие даже небольших количеств влаги в указанных веществах может в большей или меньшей степени сообщить коррозии электрохимический характер. Химическая коррозия в чистом виде — достаточно специфическое явление, преобладающее в средах, достаточно закрытых для окружающего природного воздействия. Большое практическое значение имеет электрохимическая коррозия.
Электрохимическая коррозия
Электрохимическая коррозия имеет характер анодного окисления металла, которое может протекать по двум различным механизмам:
– гальванокоррозия — окисление металла, являющегося анодом самопроизвольно возникающей гальванической цепи;
– электрокоррозия — окисление металла, являющегося анодом своеобразной электролизной системы, самопроизвольно возникающей под влиянием тока от внешнего источника.
Гальванокоррозия
При гальванокоррозии основная масса металла обычно играет роль анода. В качестве материала катода могут служить самые разнообразные вещества, но обязательно являющиеся электронными проводниками. Сюда относятся более электронофильные металлы, чем анод. Например, по отношению к железному аноду такими металлами являются Sn, Pb, Cu, Hg, Ag и т.п. Роль катодов может выполнять и ряд электропроводящих неметаллических материалов, среди которых назовём ржавчину, зёрна графита, угля, цементита (карбида железа Fe3C), шлаковые включения в металл и т.д.
Процессы, протекающие при гальванокоррозии, рассмотрим на двух примерах, представляющих практический интерес: коррозию железа в контакте: а) с цинком и б) с оловом во влажном воздухе.
а) Коррозионный процесс в гальванопаре Zn/Fe. Цинк, как сравнительно более химически активный металл, подвергается анодному окислению и переходит в состояние ионов.
Реакция на аноде**: 2Zn – 4e- → 2Zn** (окисление).
Реакция на катоде: 2h3O + O2 + 4e- → 4OH’ (восстановление).
Вторичная реакция: 2Zn** + 4OH’ → 2Zn(OH)2.
В процессе работы коррозионной гальванопары Zn/Fe окисляется, разрушается цинк. За счёт электронов последнего железо предохраняется от коррозии.
б) Коррозионный процесс в гальванопаре Sn/Fe. В данном случае железо более химически активный металл, чем олово. Катодом гальванопары будет олово, а анодом — железо.
Реакция на аноде**: 2Fe – 4e- → 2Fe** (окисление).
Реакция на катоде: 2h3O + O2 + 4e- → 4OH’ (восстановление).
Они приводят к образованию бурой ржавчины.
Таким образом, в процессе работы рассматриваемой гальванопары окисляется и разрушается железо, а олово остается без изменения.
На практике подобные явления встречаются при коррозии оцинкованного и луженого железа. В случае нанесения на железо менее химически активного металла (Sn, Cu, Ni, Cr, Ag, Au), для придания поверхности декоративных и других полезных свойств, защита железа происходит путем его изоляции от внешней среды. При повреждении внешнего защитного слоя начинают протекать описанные реакции и железо ржавеет.
Коррозионные элементы могут возникать во всех случаях, когда в присутствии электролита соприкасаются металлы, различающиеся между собой электродными потенциалами.
Особо нужно отметить влияние температуры. Повышение температуры ускоряет физические и химические процессы. В водной среде это особенно заметно при температуре около 60°С. При температуре около 70°С в гальванопаре Zn/Fe может произойти изменение потенциала цинка, в результате чего цинковое покрытие становится катодам, а железо анодом. Отмечают, что изменению полярности цинка способствуют низкое содержание в воде кислорода и высокое бикарбонатов. В таких условиях коррозировать будет железо.
Электрокоррозия
К электрокоррозии относятся случаи электрохимической коррозии металлов, протекающие под влиянием электрического тока от внешнего источника. Здесь в основе явления, как уже отмечалось, лежит самопроизвольно возникающий процесс электролиза. В качестве примера рассмотрим электрокоррозию под влиянием так называемых блуждающих токов.
Металлические листы с полимерным покрытием, сложенные в пачку, представляют собой электрический конденсатор, где металлическая основа листа представляет собой обкладки конденсатора, а полимерное покрытие — диэлектрический слой между обкладками. В следствие неравномерности нагрева листов, воздействия внешних источников энергии и других факторов окружающей среды между различными листами пачки могут возникать разности электрического потенциала.
В воде любого типа в большем или меньшем количестве содержатся растворенные соли, коллоидные и взвешенные вещества, живые микроорганизмы, в воду попадают частицы пыли и дыма. Поэтому при изучении поведения цинка и цинковых покрытий в водных средах воду следует рассматривать как коррозионный электролит. Если торцевую часть листов с разностью электрических потенциалов поместить в раствор соли, которым могут являться атмосферные осадки и конденсат, то возникает естественный процесс электролиза. На одном из листов, на его торцевой части, будет происходить анодное окисление металла, т.е. его коррозия.
Состав электролита, в особенности величина его рН, существенно влияет на скорость коррозии. Так, повышение концентрации Н’-ионов (кислая среда), как правило, резко убыстряет разрушение металла.
Повышение концентрации ОН’-ионов (щелочная среда) в электролите замедляет коррозию таких металлов, как Fe, Mg в следствии образования гидроокисных защитных плёнок.
У металлов Al, Zn, Pb повышение щелочности среды на разрушение этих металлов действует убыстряющим образом т.к. гидроокиси этих металлов растворимы в щелочах. Описанная особенность этих металлов является причиной такого явления как белая ржавчина.
Белая ржавчина на цинковом покрытии
Цинк — сравнительно реактивный металл, он активно реагирует с кислотами и щелочами. Лучше всего он проявляет свои антикоррозионные свойства в рН нейтральной среде. Долговечность цинкового покрытия зависит от формирования оксидно-карбонатной пленки. После окончательного формирования оксидно-карбонатной пленки уровень коррозии цинковых покрытий становится очень низким — не более двух микрон в год в нейтральной среде.
Химические реакции, требуемые для формирования этой плёнки, занимают некоторое время (от нескольких недель до нескольких месяцев):
1. Фаза окисления 2Zn + O2 = 2ZnO
2. Фаза гидратации 2Zn = 2h3O + O2 = 2Zn(OH)2
3. Карбонизации 5Zn(OH)2 = 2CO2 + 2ZnCO3.3Zn(OH)2 + 2h3O
На последнем этапе окончательно формируется трудно растворимый основной карбонат цинка, который обеспечивает надежную антикоррозионную защиту цинковому слою при негативном воздействии влаги. В условиях относительно сухой среды протекают все три реакции, и на поверхности оцинкованного изделия формируется оксидно-карбонатная плёнка, будучи почти непроницаемой для кислорода и влаги, резко ограничивает дальнейший процесс взаимодействия цинка с кислородом.
Иное происходит, если изделие свежеоцинкованное или на нём присутствуют места без сформированного плёночного покрытия (в частности, срезы профилированной продукции) хранится в условиях, когда на него воздействует дождь, роса, конденсат, а подвод углекислого газа и кислорода, способствующего образованию плотной оксидно-карбонатной пленки затруднен. В этом случает происходят только фазы окисления и гидратации. В результате получаются гидроксид и оксид цинка — вещества в виде белого порошка, обладающие низкой адгезионной способностью к поверхности, легко пропускающие кислород к цинку, допускающие его последующее окисление и развитие процессов образования белой ржавчины.
Еще одним случаем, представляющим опасность образования белой ржавчины, являются участки соприкасающихся между собой поверхностей оцинкованных изделий с уже окончательно сформировавшейся оксидно-карбонатной плёнкой. В этих местах задерживается дождевая влага (или конденсируется влага из воздуха при нахождении изделий на воздухе при температуре ниже точки росы), а испаряется она в последнюю очередь. Во всех природных водах присутствует углекислота, которая может находиться в воде в виде растворенного газа СО2 и недиссоциированных молекул Н2СО3 или ионов НСО3- и СО3в2-. Углекислота и присутствующие в воде нитраты, сульфаты, хлориды без доступа кислорода разрушают образующуюся на поверхности цинка оксидно-карбонатную пленку и тем самым усиливают коррозию, приводящую к образованию белой ржавчины.
При очень длительном хранении (от полугода) оцинкованных изделий с полимерным покрытием в неблагоприятных условиях, оксид и гидроксид цинка — вещества в виде белого порошка может выделяться и на поверхности полимерного покрытия (в особенности на обратной стороне листа, который как правило покрыт только грунтовым полимерным слоем).
В благоприятных (для белой ржавчины) условиях разъедание цинка может происходить при уровнях коррозии в 20–50 раз больших, чем обычно предполагается.
Условия хранения и эксплуатации
Из всего вышеизложенного можно сделать следующие выводы.
Цинковое покрытие стальных изделий хорошо работает как защитный слой в нейтральной сухой или влажной воздушной среде и при кратковременном воздействии воды со свободным доступом кислорода. При таких условиях работает эффект гальванопары Zn/Fe — эффект оксидно-карбонатной пленки. Такие условия соответствуют нормальным условиям эксплуатации изделий.
В случае долговременного нахождения стальных оцинкованных изделий, сложенных в пачку, в водной среде при ограниченном доступе кислорода и повышенной температуре (более 70°С), начинают протекать реакции, при которых защитные эффекты перестают работать. Происходит активное разрушение защитного слоя. Как правило, такие негативные условия складываются при неправильном хранении изделий. При нарушении условий хранения риск поражения коррозией значительно выше, чем при неправильной эксплуатации или монтаже.
Правила хранения оцинкованных изделий:
• Изделия хранятся в заводской упаковке НЕ более 1 (одной) недели с даты поставки. Пачки в заводской упаковке укладываются на ровное место на бруски с шагом 0,5 м.
• При необходимости хранения профилированной продукции более 1 (одной) недели ее размещают под навесами или в крытых неотапливаемых, сухих помещениях без прямого воздействия солнечных лучей и осадков (в соответствии с ГОСТ 7566).
Изделия следует распаковать (снять заводскую упаковку), расположить на ровной поверхности и переложить каждый лист одинаковыми рейками (штабель высотой до 70 см).
• Хранение на открытом воздухе допускается только на период монтажных работ. Изделия должны быть расположены под небольшим наклоном в 3° так, чтобы между ними обеспечивались свободная циркуляция воздуха и слив воды.
• Максимальный срок хранения во всех вышеперечисленных условиях не должен превышать 2 (двух) месяцев с даты поставки.
Используемая литература:
- «Общая химия» учебники и учебные пособия для высших сельскохозяйственных учебных заведений. А.Г. Кульман. Издательство «Колос» 1968.
- «Курс общей химии» учебник для студентов вузов. Коровин Н.В., Масленникова Г.Н., Гуськова Л.Г. и др. под ред. Коровина Н.В. Высш. школа 1981.
- «Защита от коррозии, старения и биоповреждений машин, оборудовани и сооружений» Справочник в 2т. Т1. Под ред. Герасименко А.А. М. Машиностроение. 1987.
- «Основы учения о коррозии и защите металлов» Дж. Скалли. Перевод с английского проф. А.В. Шрейдера. Издательство «Мир», Москва 1978.
- СТБ 1527-2005 «Профили металлические холодногнутые для наружной облицовки фасадов зданий и комплектующие изделия к ним».
- СТБ 1382-2003 «Профили металлические холодногнутые для кровель и комплектующие изделия к ним».
- ГОСТ 7566-2018 «Металлопродукция. Правила приемки, маркировка, упаковка, транспортирование и хранение».
Коррозия металлов — задачи с решениями и примерами
Коррозия металлов. Методы защиты металлов от коррозии
Задача 74Железная пластинка погружается в разбавленный раствор
. Наблюдается выделение водорода с ее поверхности. Если дотронуться до этой пластинки медной проволокой, водород начинает выделяться с поверхности медной проволоки, хотя железо продолжает растворяться, причем более интенсивно. Объяснить это явление. Написать катодный и анодный процессы электрохимической коррозии. Указать продукт коррозии.Решение:
При погружении железной пластинки в раствор
происходит гетерогенная ОВ реакция:При касании железа медью образуется короткозамкнутый гальванический элемент, состоящий из железного и медного электродов, загруженных в раствор электролита. Медный электрод играет роль катода, так как он имеет более высокий электродный потенциал. На катоде должен протекать процесс восстановления, а на аноде — железной пластине — процесс окисления:
Таким образом, железо продолжает растворяться, причем скорость электрохимического процесса выше, чем скорость обычного окислительно-восстановительного процесса.
На катоде происходит деполяризация, т.е. процесс восстановления каких-либо частиц, называемых деполяризатором, избытком электронов.
В кислой среде роль деполяризатора играют катионы водорода:
Таким образом, водород выделяется с поверхности меди, несмотря на отсутствие взаимодействия с ней. Продукт коррозии — . Процессы, происходящие при электрохимической коррозии, представлены на рис. 5.
Задача 75Две пластинки — одна железная, а другая магниевая -погружены раздельно в разбавленную соляную кислоту. Что изменится, если соединить обе пластинки?
Решение:
Обе пластинки, находящиеся раздельно в разбавленной
, будут реагировать с ней с выделением водорода, так как находятся в ряду напряжений до водорода:При объединении пластин образуется короткозамкнутый гальванический элемент, и протекает электрохимическая коррозия. Магний, будучи более активным металлом, играет роль анода. На аноде происходит процесс окисления:
На катоде — железной пластинке — будет происходить водородная деполяризация:
Таким образом, при соприкосновении двух пластин наблюдается усиление выделения водорода с поверхности железа, хотя разрушение железа резко уменьшается, а активизируется процесс разрушения магниевой пластины. Выделение водорода с поверхности магния резко сокращается.
Задача 76Кладут в один стакан, содержащий солевой раствор, кусочек чистого железа, а в другой стакан, содержащий такой же солевой раствор, — кусочек железа, соединенный с кусочком свинца. В оба стакана есть доступ кислороду воздуха. Через несколько дней определяют содержание ионов железа в обоих стаканах. В каком из стаканов концентрация ионов железа будет больше ?
Решение:
Кислород растворяется в водном растворе. Железо, погруженное в солевой раствор, в присутствии растворенного кислорода будет подвергаться коррозии, хотя и медленно, так как оно чистое, а чистые металлы медленно корродируют (обычно присутствие примесей в железе (чугуне) резко увеличивает скорость коррозии).
Процесс коррозии чистого железа может быть представлен следующей схемой:
где
, — один из компонентов ржавчины.Железо в контакте с менее активным свинцом играет роль анода и подвергается электрохимической коррозии с кислородной деполяризацией на свинцовом катоде:
легко окисляется до . Таким образом, продуктом коррозии является :Скорость электрохимической коррозии намного выше скорости химической коррозии, поэтому в стакане, содержащем железо, соединенное со свинцом, концентрация ионов железа
будет выше, чем в стакане с чистым железом.Задача 77Описать процессы электрохимической коррозии, протекающие на оцинкованном железе при наличии трещин в защитном слое:
а) в кислой среде;
б) в нейтральной среде в присутствии кислорода.
Решение:
Покрытие железа цинком относится к анодным покрытиям, так как металл покрытия более активный, чем защищаемый металл, а значит, в случае протекания электрохимической коррозии он играет роль анода.
В кислой среде на поверхности катода, т.е. на поверхности железа, протекает водородная деполяризация (рис.6):
В нейтральной среде в присутствии кислорода на поверхности катода (железа) протекает кислородная деполяризация (рис.7):
Продукт коррозии, образующийся по реакции
— гидроксид цинка.Задача 78Описать процессы электрохимической коррозии,
протекающей на хромированном железе при наличии трещин в защитном слое:
а) в кислой среде;
б) в нейтральной среде в присутствии кислорода.
Решение:
Покрытие железа хромом относится к катодным покрытиям, так как металл покрытия менее активный, чем защищаемый металл, а значит, в случае протекания электрохимической коррозии он играет роль катода.
Защищаемый металл играет роль анода, т.е. подвергается разрушению.
В кислой среде на поверхности катода, т.е. на поверхности хрома, протекает водородная деполяризация (рис.8):
В нейтральной среде в присутствии кислорода на поверхности катода (хрома) протекает кислородная деполяризация (рис.9):
Продукт коррозии, образующийся по реакции
на воздухе окисляется:
Задача 79Объяснить, почему в стальном сосуде застойная зона подвергается интенсивной коррозии (нейтральная среда в присутствии кислорода воздуха), тогда как в цинковом сосуде, наоборот, застойная зона подвергается коррозии в незначительной степени.
Решение:
Интенсивность (скорость) электрохимической коррозии зависит от ЭДС образующегося короткозамкнутого элемента: чем больше величина ЭДС, тем интенсивнее электрохимическая коррозия.
Для электрохимической коррозии ЭДС рассчитывается аналогично расчету ЭДС гальванического элемента:
где
— электродный потенциал электродной полуреакции деполяризации; — электродный потенциал металла, подвергающегося разрушению.Для электродной полуреакции кислородной деполяризации
В зоне, подверженной воздействию кислорода, электродный потенциал катодных участков будет выше, чем в застойной зоне (концентрация кислорода в растворе находится в числителе). Таким образом, в начальный момент ЭДС микрогальваноэлементов в зоне, подверженной воздействию кислорода, будет выше, чем ЭДС микрогальваноэлементов в застойной зоне, а значит, коррозия анодных участков в зонах, подверженных воздействию кислорода, будет значительной. Эта коррозия в начальный момент приводит к накоплению анионов
по реакции , а следовательно, к увеличению pH. Известно, что в щелочной среде железо пассивирует. Таким образом, в следующий момент коррозия в зонах, подверженных воздействию кислорода, прекращается, тогда как в застойных зонах (рис. 10) она продолжается. Вот почему застойные зоны стальных сосудов подвергаются интенсивной коррозии.В сосуде из цинка коррозия зон, подверженных воздействию кислорода, всегда будет очень интенсивной, так как щелочная среда не пассивирует цинк, а наоборот, способствует его разрушению:
Поэтому застойная зона меньше подвергается коррозии, чем аэрируемая.
Задача 80Показать необходимыми расчетами, что платина в контакте с золотом никогда не подвергается электрохимической коррозии, тогда как медь в контакте в золотом подвергается электрохимической коррозии только в присутствии кислорода в щелочной среде.
Решение:
Для процесса кислородной деполяризации
электродный потенциал определяется по формуле Нернста:
В нейтральной среде
В щелочной среде
Для того, чтобы протекала электрохимическая коррозия, необходимо следующее:
Отсюда
Таким образом, электродный потенциал металла (анода) должен быть ниже 0 В в нейтральной среде или ниже 0,401 В в сильно щелочной среде (рН=14). Если находятся в контакте золото и платина, платина играет роль анода, но ее стандартный электродный потенциал
. Хотя в реальных условиях из-за низкой концентрации катионов платины электродный потенциал платины будет ниже, чем ее стандартный потенциал, однако он остается выше, чем 0,401 В, а значит, электрохимической коррозии с кислородной деполяризацией не будет.Медь в контакте с золотом может подвергаться электрохимической коррозии с кислородной деполяризацией, особенно в щелочной среде, так как , а это ниже 0,401 В.
Остается показать отсутствие электрохимической коррозии с водородной деполяризацией для обоих случаев.
Электродный потенциал водородной деполяризации выражается уравнением:
В кислой среде
В слабокислой среде
Таким образом, металлы, имеющие электродный потенциал выше 0 В, в кислой среде не подвергаются электрохимической коррозии с водородной деполяризацией.
Эти задачи взяты со страницы решения задач по неорганической химии:
Задачи с решением по неорганической химии
Возможно эти страницы вам будут полезны:
Коррозия металлов. Виды и особенности. Защита и принцип действия
Коррозия металлов – это процесс разрушения металлической поверхности в результате неблагоприятного воздействия окружающей среды. Ее причиной является термодинамическая неустойчивость материала к влиянию различных веществ, которые с ним контактируют.
Виды коррозии
Разрушение поверхностей наступает вследствие химического или электрохимического взаимодействия неблагоприятной среды. Обе разновидности являются одинаково пагубными для изделий из металла.
Химическая коррозияДанный процесс осуществляется в среде, которая не производит передачу электрического тока. Он наблюдается, например, при нагреве, в результате чего осуществляется образование химических соединений, таких как сульфиды, а также различные виды пленок. Нередко образованные сплошные пленки становятся непроницаемыми и консервируют поверхность, поэтому последующая коррозия металлов останавливается. Такой защитный слой можно встретить на поверхности из алюминия, хрома, никеля и свинца. Пленка на стали или чугуне является непрочной, поэтому ее наличие не останавливает дальнейшее продвижение разрушения вглубь материала.
Химическая коррозия может быть двух видов:
- Газовой.
- Жидкостной.
Газовая возникает в результате действия агрессивной газовой среды или пара на поверхность металла, что сопровождается повышенными температурами. Благодаря горячей среде на поверхности отсутствует конденсат. В качестве газа может применяться кислород, диоксид серы, водяной пар, сероводород и так далее. Подобное коррозийное влияние может вызывать абсолютное разрушение активного металла, за исключением случаев, когда образуется защитная непроницаемая пленка.
Жидкостная коррозия металлов возникает в жидкостных средах, которые не способны передавать электричество. В первую очередь она наблюдается при контакте металлов с сырой нефтью, нефтепродуктами или смазочными маслами. При наличии в таких веществах небольшой доли воды, коррозия переходит в электрохимическую.
В обоих вариантах химической коррозии скорость разрушения является пропорциональной химической реакции, с которой окислитель проникает сквозь созданную оксидную пленку на поверхности.
Электрохимическая коррозия металловЭта разновидность разрушения поверхности металла происходит в среде, которая может передавать электрический ток. В результате данного процесса наблюдается изменение состава металла. Атомы удаляются от кристаллической решетки в результате анодного или катодного воздействия. При анодном влиянии ионы металла переходят в раствор жидкости, которая его окружает. При катодном влиянии получаемые при анодном процессе электроны связываются с окислителем. Наиболее распространенной является электрохимическая коррозия под воздействием водорода или кислорода.
Процесс влияния электрохимической коррозии на металлы зависит от уровня их активности. По данному критерию их разделяют на 4 группы:
- Активные.
- Средней активности.
- Малоактивные.
- Благородные.
Активные имеют высокую нестабильность. Для них характерно возникновение коррозии даже в нейтральной водной среде, которая лишена растворенного кислорода или окислителей. Ярким представителем такого металла является кадмий.
Металлы средней активности располагаются на таблице химических элементов между кадмием и водородом. Они неподвержены началу разрушения в нейтральной жидкостной среде лишенной кислорода, но начинают интенсивно поддаваться коррозии при влиянии кислот.
Малоактивные металлы располагаются в таблице Менделеева между водородом и родием. Они не подвергаются влиянию коррозии при контакте с нейтральными жидкостями и кислой средой. Для активизации процесса их разрушения необходимо наличие кислорода или прочих окислителей.
Благородные металлы отличаются стабильностью, благодаря чему подвержены коррозии только при воздействии кислой среды при условии контакта с сильными окислителями. К перечню благородных металлов относится платина, золото, палладий и иридий.
Электрохимическая коррозия металлов является самой распространенной, поскольку естественные условия, в которых хранятся и эксплуатируются металлические изделия, зачастую подвержены влиянию влажной среды.
Различают следующие виды электрохимической коррозии:
- Электролитная – наблюдается при контакте с растворами солей, кислотами, оснований, в том числе и обычной водой.
- Атмосферная – наблюдается в условиях атмосферы, где содержатся испарения воды. Данный вид является самым распространенным, именно он влияет на практически все металлические изделия.
- Почвенная – наблюдается в результате воздействия влажной почвы, в составе которой могут содержаться различные химические элементы ускоряющие процесс разрушения металла. При воздействии с кислыми почвами процесс коррозии наблюдается наиболее агрессивно. Грунты с песком воздействуют медленней всего.
- Аэрационная – является более редкой и наблюдается в тех случаях, если к разным поверхностям металла оказывается неравномерный доступ воздуха. В результате неоднородного воздействия линии переходов между такими участками начинают разрушаться.
- Морская коррозия металлов подразумевает разрушение от влияния морской воды. Она выделяется в отдельную группу, поскольку данная жидкость отличается высоким содержанием солей и растворенных органических веществ. Это делает ее более агрессивной.
- Биокоррозия – данный вид разрушения возникает при условии воздействия на поверхность металла бактериями, которые в результате жизнедеятельности вырабатывают углекислый газ и прочие вещества.
- Электрокоррозия – такой вид разрушения металла наблюдается при воздействии на него блуждающих токов, что характерно для подземных сооружений, в частности рельсов метрополитена, стержней заземления, трамвайных линий и т.д.
Голая поверхность подавляющего большинства металлов склонна к быстрой коррозии, поэтому для снижения разрушающего воздействия применяются различные способы защиты.
Покрытие изоляционными слоями:
- Другим металлом.
- Цементным раствором.
- Лаками.
- Красками.
- Битумом.
Одним из самых эффективных способов защиты от коррозии является покрытие поверхности одного металла другим, менее склонным к коррозии. Примером такого технического решения является оцинковка, когда сталь защищается слоем цинка. Внутренний металл полностью изолирован до тех пор, пока цинк в результате естественной коррозии, которая протекает очень медленно, полностью не разрушится, оголив сталь. Такой метод защиты является одним из самых эффективных, поскольку покрывной металл полотна удерживается на основании, поэтому его невозможно срывать слоями. Недостаток метода заключается в том, что при механическом воздействии можно сцарапывать тонкую защитную пленку.
Покрытие металла защитным цементным раствором, битумом, лаками и красками является также очень распространенным решением, которое все же уступает оцинковке. Это связано с неоднородностью составов основания и покрытия. В результате низкой адгезии краски готовое покрытие будет отслаиваться. Такая защита может покрываться трещинами, обеспечивая доступ влаги.
Коррозия металлов может быть приостановлена при наличии химического покрытия:
- Оксидирование.
- Фосфатирование.
- Азотирование.
- Воронение.
- Цементация.
Поверхность металла подвергается влиянию различных веществ, фосфатов, азота или оксидов, в результате чего создаются пленки, которые благодаря своей непроницаемости предотвращают разрушение. Такие методы применимы в первую очередь для сталей. Также распространенным решением является воронение стали, когда поверхность металла взаимодействует с органическими веществами. Обработанные таким способом поверхности приобретают темный цвет, напоминающий крыло ворона, за что данный метод и получил свое название. Одним из наиболее эффективных вариантов химического покрытия является цементация, когда на поверхность воздействуют углеродом, в результате чего создается корка вступившего в реакцию металла.
Для защиты от коррозии черных металлов может применяться технология изменения их состава. Добавление различных соединений позволяет получить сплавы, отличающиеся большей устойчивостью к коррозии. Примером такого соединения является нержавеющая сталь.
Самым необычным является протекторная защита, которая подразумевает покрытие сооружений из одного металла пластинами из более активного металла, так называемого протектора. Поскольку он имеет более отрицательный потенциал, то выступает в роли анода. Защищаемая поверхность используется как катод. Они соединяются между собой проводником тока, благодаря чему создаются неблагоприятные условия для протектора. Как следствие разрушению поддается именно он, в то время как ценное сооружение остается целым.
Более редким решение является изменение состав окружающей среды. В таких условиях коррозия металлов замедляется или не происходит. Данный метод подразумевает очистку состава жидкости или газа от кислот и солей, вызывающих разрушение. Такой метод применим далеко не во всех случаях, поскольку отличается техническими сложностями и определенной дороговизной. Его используют в разных механизмах. К примеру, могут применять в определенных средах только те металлы, для которых те не агрессивны.
Похожие темы:
Электрохимическая коррозия — обзор
4.4 Экспериментальные кривые поляризации
В экспериментальных исследованиях электрохимической коррозии для определения скорости и поведения коррозии часто используется потенциостатическая цепь, которая включает в себя поляризационную ячейку, как схематично показано на рисунке 4.12. Рабочий электрод (WE) представляет собой образец коррозии (т. Е. Оцениваемый материал). Вспомогательный электрод (AE) или противоэлектрод в идеале изготовлен из материала, который будет поддерживать реакции электрохимического окисления или восстановления с реагентами в электролите, но сам по себе не будет подвергаться коррозии и тем самым загрязнять электролит.АЭ обычно изготавливают из платины или графита высокой плотности. Электрод сравнения (RE) поддерживает постоянный потенциал, относительно которого измеряется потенциал WE с помощью электрометра, вольтметра с высоким импедансом (> 10 14 Ом), который ограничивает ток, проходящий через электрометр, до чрезвычайно малых значений, которые пренебрежимо малы. влияют на потенциал RE или WE. Потенциостат — это быстродействующий источник постоянного тока (DC), который будет поддерживать потенциал WE относительно RE на постоянном (заданном или заданном) значении, даже если ток внешней цепи, I ex , может изменяться. на несколько порядков.Когда потенциостат отсоединен от образца коррозии (WE), существует состояние разомкнутой цепи или разомкнутой ячейки, WE свободно корродирует, измеренный потенциал представляет собой потенциал коррозии разомкнутой цепи, E corr и, конечно же, , I от = 0.
Рисунок 4.12. Потенциостатическая цепь.
Потенциостат может быть настроен на поляризацию WE либо анодно, и в этом случае итоговая реакция на поверхности WE является окислением (электроны удаляются из WE), либо катодно, и в этом случае итоговая реакция на поверхности WE является восстановлением ( электроны, потребляемые в WE).Что касается потенциостатической цепи на рисунке 4.12, определение поляризационной кривой обычно начинается с первого измерения потенциала коррозии холостого хода, E corr , до тех пор, пока не будет достигнуто установившееся значение (например, изменение менее 1,0 мВ пятиминутный период). Затем потенциостат настраивается на управление на E или Corr и подключается к поляризационной ячейке. Затем уставка потенциала сбрасывается непрерывно или ступенчато для управления историей потенциала-времени WE, пока измеряется I ex .Если заданный потенциал постоянно увеличивается (выше E или ), создается кривая анодной поляризации. И наоборот, если потенциал непрерывно снижается (ниже E или ), создается кривая катодной поляризации.
Интерпретация экспериментально определенной поляризационной кривой, включая понимание информации, полученной из нее, основана на форме поляризационной кривой, которая получается из поляризационных кривых для отдельных реакций анодной и катодной полуэлементов, происходящих на поверхности металла. .Эти отдельные поляризационные кривые, предполагающие поведение Тафеля во всех случаях, показаны на рисунке 4.13 (пунктирные кривые) с обозначениями E corr и I corr . Предполагается, что в рассматриваемом потенциальном диапазоне вклады I ox, X и I red, M в чистые анодные и катодные кривые незначительны. Следовательно, I a = I ox, M и I c = I красный, X . При любом потенциале WE, установленном потенциостатом, экспериментально измеренный внешний ток, I ex , представляет собой разницу между I ox, M и I красный, X .Эта разница в терминах тафелевских выражений для отдельных реакций составляет
Рисунок 4.13. Схематические экспериментальные поляризационные кривые (сплошные кривые), предполагающие тафелевское поведение для индивидуального окисления, и поляризационные кривые восстановления катодного реагента (штриховые кривые).
(4.83) Iex = Iox, M − Ired, X = Io, Me2.3 (E − E′M) βoX, M − Io, Xe2.3 (E − E′x) βred, x
Это Очевидно, что I ex изменяется с положительного на отрицательный, когда I красный, X становится больше, чем I ox, M .Это изменение знака происходит, когда I ex проходит через I ex = 0, в этой точке E = E corr и I ox, M = I красный, X = I corr . Таким образом, можно выделить два диапазона тока: I ex > 0 (в котором преобладает анодная реакция или реакция окисления) и I ex <0 (в котором преобладает катодная реакция или реакция восстановления). Свойства этих двух диапазонов суммированы ниже.
В диапазоне токов, I ex > 0, потенциал WE, установленный потенциостатом, больше, чем E corr .Электроны, произведенные в единицу времени реакцией M → M m + + me, превышают количество электронов, потребляемых в единицу времени реакцией X x + + xe → X, и чистое окисление происходит в WE. Положительный ток соответствует соглашению о знаках, которое присваивает положительное значение току внешней цепи, когда чистое окисление происходит в WE. Для I ex > 0 график зависимости E от log I ex принимает форму верхней сплошной кривой на рисунке 4.13, анодной ветви экспериментальной поляризационной кривой.Когда E достаточно увеличивается выше E corr , чтобы вызвать I красный, X становится незначительным по сравнению с I ox, M (обычно 50–100 мВ),
(4.84) Iex = Iox, M
и I ex становится прямой мерой скорости окисления, I ox, M , металла в этом диапазоне потенциалов. Этот линейный участок экспериментальной кривой показывает тафелевскую кривую анодной реакции металла, а экстраполяция тафелевской кривой на E’M дает оценку из эксперимента плотности тока обмена металла, I o, M / A a , где A a — площадь ЗЕ.
В диапазоне токов, I ex <0, потенциал WE, установленный потенциостатом, меньше, чем E corr . На поверхности металла количество электронов, потребляемых в единицу времени реакцией X x + + xe → X, превышает количество электронов, произведенных в единицу времени реакцией M → M m + + me. Происходит чистое восстановление, и электроны должны поступать в WE по внешней цепи; ток внешней цепи (I ex ) будет отрицательным. График зависимости E от log | I ex | принимает форму нижней сплошной кривой на рисунке 4.13. Когда E уменьшается до уровня ниже E corr , чтобы вызвать I ox, M становится незначительным (обычно 50–100 мВ),
(4,85) Iex = −Ired, X
или
(4,86) | Iex | = Ired, X
и I ex становится прямой мерой скорости катодной реакции, I красный, X , на металле. Этот линейный участок экспериментальной кривой показывает тафелевскую кривую катодной реакции, а экстраполяция тафелевской кривой на E’X дает оценку экспериментальной плотности тока обмена катодной реакции, I o, X / A c , где A c — площадь ЗЕ.
Подчеркивается, что в более общем смысле I ex — это экспериментально измеренный ток, представляющий чистую разницу между суммой всех токов реакций окисления и суммой всех токов реакций восстановления на границе раздела:
(4.87 ) Iex = ΣIox − ΣIred.
Для двух рассматриваемых реакций полуэлементов
(4.88) Iex = (Iox, M + Iox, X) — (Ired, X + Ired, M).
При условии, что I ox, X и I красный, M незначительны,
(4.89) Iex = Iox, M — Ired, X.
Приведенное выше соотношение в равной степени применимо, если кривая скорости окисления металла или кривая скорости восстановления катодного реагента не подчиняется поведению Тафеля. Чтобы проиллюстрировать эту точку зрения, исследуются три дополнительные схематические пары индивидуальных анодных и катодных поляризационных кривых. На рис. 4.14 металл подвергается активному-пассивному окислению, а E corr находится в пассивной области. На рисунке 4.15, где кривая общей скорости восстановления включает восстановление как растворенного кислорода (O 2 + 4H + + 4e → 2H 2 O), так и ионов водорода (2H + + 2e → H 2). ) и их соответствующие предельные токи диффузии, показанный металл проявляет активно-пассивное окислительное поведение, а E corr находится в пассивной области.Для примера на рисунке 4.15 следует отметить, что если бы растворенный кислород был удален из электролита, E corr был бы в активной области, I corr был бы значительно больше, а экспериментальные поляризационные кривые выглядели бы как на рисунке 4.16.
Рисунок 4.14. Схематические экспериментальные поляризационные кривые.
Рисунок 4.15. Схематические экспериментальные поляризационные кривые.
Рисунок 4.16. Схематические экспериментальные поляризационные кривые.
17.6 Коррозия — Химия
Цели обучения
К концу этого раздела вы сможете:
- Определить коррозию
- Перечислите некоторые методы, используемые для предотвращения или замедления коррозии
Коррозия обычно определяется как разложение металлов в результате электрохимического процесса. Образование ржавчины на железе, потускнение серебра и сине-зеленая патина на меди — все это примеры коррозии. Общие затраты на коррозию в Соединенных Штатах значительны и оцениваются более чем в полтриллиона долларов в год.
Статуя Свободы: меняя цвета
Статуя Свободы — достопримечательность, которую признает каждый американец. Статую Свободы легко узнать по ее высоте, положению и уникальному сине-зеленому цвету (рис. 1). Когда эта статуя впервые была доставлена из Франции, она не имела зеленого цвета. Оно было коричневым, цвета его медной «кожи». Так как же Статуя Свободы изменила цвет? Изменение внешнего вида было прямым результатом коррозии. Медь, которая является основным компонентом статуи, медленно подвергалась окислению на воздухе.Окислительно-восстановительные реакции металлической меди в окружающей среде протекают в несколько стадий. Металлическая медь окисляется до оксида меди (I) (Cu 2 O), который имеет красный цвет, а затем до оксида меди (II), который имеет черный цвет
[латекс] \ begin {array} {r @ {{} \ longrightarrow {}} ll} 2 \ text {Cu} (s) \; + \; \ frac {1} {2} \ text {O} _2 (g) & \ text {Cu} _2 \ text {O} (s) & (\ text {red}) \\ [0.5em] \ text {Cu} _2 \ text {O} (s) \; + \ ; \ frac {1} {2} \ text {O} _2 (g) & 2 \ text {CuO} (s) & (\ text {black}) \ end {array} [/ latex]
Уголь, часто содержащий большое количество серы, активно сжигался в начале прошлого века.В результате триоксид серы, диоксид углерода и вода прореагировали с CuO
.[латекс] \ begin {array} {r @ {{} = {}} ll} 2 \ text {CuO} (s) \; + \; \ text {CO} _2 (g) \; + \; \ текст {H} _2 \ text {O} (l) & \ text {Cu} _2 \ text {CO} _3 (\ text {OH}) _ 2 (s) & (\ text {зеленый}) \\ [0.5em ] 3 \ text {CuO} (s) \; + \; 2 \ text {CO} _2 (g) \; + \; \ text {H} _2 \ text {O} (l) & \ text {Cu} _2 (\ text {CO} _3) _2 (\ text {OH}) _ 2 (s) & (\ text {blue}) \\ [0.5em] 4 \ text {CuO} (s) \; + \; \ текст {SO} _3 (g) \; + \; 3 \ text {H} _2 \ text {O} (l) & \ text {Cu} _4 \ text {SO} _4 (\ text {OH}) _ 6 ( s) & (\ text {зеленый}) \ end {array} [/ latex]
Эти три соединения ответственны за характерную сине-зеленую патину, наблюдаемую сегодня.К счастью, патина создала защитный слой на поверхности, предотвращающий дальнейшую коррозию медной пленки. Формирование защитного слоя — это форма пассивации, которая обсуждается далее в следующей главе.
Рис. 1. (a) Статуя Свободы покрыта медной кожей и изначально была коричневой, как показано на этой картине. (б) Воздействие элементов привело к образованию сине-зеленой патины, наблюдаемой сегодня.Пожалуй, самый известный пример коррозии — образование ржавчины на железе.{+} (водн.) [/ латекс]
Количество молекул воды варьируется, поэтому оно представлено как x . В отличие от патины на меди, образование ржавчины не создает защитного слоя, поэтому коррозия железа продолжается, поскольку ржавчина отслаивается и подвергает свежее железо воздействию атмосферы.
Рис. 2. Когда краска поцарапана на окрашенной железной поверхности, возникает коррозия и начинает образовываться ржавчина. Скорость самопроизвольной реакции увеличивается в присутствии электролитов, таких как хлорид натрия, используемый на дорогах для таяния льда и снега или в соленой воде.Один из способов уберечь железо от коррозии — это держать его в краске. Слой краски предотвращает попадание воды и кислорода, необходимых для образования ржавчины, на утюг. Пока краска остается неповрежденной, утюг защищен от коррозии.
Другие стратегии включают сплавление железа с другими металлами. Например, нержавеющая сталь — это в основном железо с небольшим содержанием хрома. Хром имеет тенденцию собираться у поверхности, где он образует оксидный слой, защищающий железо.
Оцинкованное железоили оцинкованное железо использует другую стратегию. Цинк окисляется легче, чем железо, потому что цинк имеет более низкий восстановительный потенциал. Поскольку цинк имеет более низкий восстановительный потенциал, это более активный металл. Таким образом, даже если цинковое покрытие поцарапано, цинк все равно будет окисляться раньше железа. Это говорит о том, что этот подход должен работать с другими активными металлами.
Еще один важный способ защиты металла — это сделать его катодом в гальваническом элементе.Это катодная защита , которая может использоваться не только для железа, но и для других металлов. Например, ржавление подземных резервуаров для хранения железа и труб можно предотвратить или значительно уменьшить, подключив их к более активному металлу, такому как цинк или магний (рис. 3). Это также используется для защиты металлических частей водонагревателей. Более активные металлы (более низкий потенциал восстановления) называются расходуемыми анодами , потому что по мере их использования они коррозируют (окисляются) на аноде.Защищаемый металл служит катодом и поэтому не окисляется (не корродирует). Когда аноды подвергаются надлежащему контролю и периодически заменяются, полезный срок службы резервуара для хранения железа может быть значительно увеличен.
Рис. 3. Одним из способов защиты подземного резервуара для хранения железа является катодная защита. Использование в качестве анода активного металла, такого как цинк или магний, эффективно превращает резервуар для хранения в катод, предотвращая его коррозию (окисление).Коррозия — это разрушение металла, вызванное электрохимическим процессом.Ежегодно тратятся большие суммы денег на устранение последствий или предотвращение коррозии. Некоторые металлы, такие как алюминий и медь, образуют защитный слой при коррозии на воздухе. Тонкий слой, который образуется на поверхности металла, предотвращает контакт кислорода с большим количеством атомов металла и, таким образом, «защищает» оставшийся металл от дальнейшей коррозии. Железо разъедает (образует ржавчину) под воздействием воды и кислорода. Ржавчина, образующаяся на металлическом железе, отслаивается, обнажая свежий металл, который также подвергается коррозии.Один из способов предотвратить или замедлить коррозию — нанести на металл покрытие. Покрытие предотвращает контакт воды и кислорода с металлом. Краска или другие покрытия замедляют коррозию, но они неэффективны после царапин. Оцинкованное или оцинкованное железо использует тот факт, что цинк более склонен к окислению, чем железо. Пока покрытие остается, даже если оно поцарапано, цинк будет окисляться раньше железа. Еще один метод защиты металлов — катодная защита. В этом методе легко окисляемый и недорогой металл, часто цинк или магний (расходуемый анод), электрически соединяется с металлом, который необходимо защищать.Более активный металл — это расходуемый анод, который является анодом в гальванической ячейке. «Защищенный» металл — это катод, и он остается неокисленным. Одним из преимуществ катодной защиты является то, что расходуемый анод можно контролировать и при необходимости заменять.
Упражнения по химии в конце главы
- Какой элемент каждой пары металлов более подвержен коррозии (окислению)?
(а) Mg или Ca
(б) Au или Hg
(c) Fe или Zn
(d) Ag или Pt
- Рассмотрим следующие металлы: Ag, Au, Mg, Ni и Zn.{\ circ} = -0,477 \; \ text {V}) [/ latex], и все же, когда оба подвергаются воздействию окружающей среды, необработанный алюминий имеет очень хорошую коррозионную стойкость, в то время как коррозионная стойкость необработанного железа оставляет желать лучшего. Объясните это наблюдение.
- Если образец железа и образец цинка соприкасаются, цинк разъедает, а железо — нет. Если образец железа соприкасается с образцом меди, железо разъедает, а медь — нет. Объясните этот феномен.
- Предположим, у вас есть три разных металла: A, B и C.{\ circ} = -3.04 \; \ text {V} [/ latex], который, кажется, может защитить все другие металлы, перечисленные в стандартной таблице восстановительного потенциала?
Глоссарий
- катодная защита
- способ защиты металла с помощью расходуемого анода и эффективного получения металла, который нуждается в защите катода, предотвращая его окисление
- коррозия
- Разложение металла в результате электрохимического процесса
- оцинкованное железо
- способ защиты железа путем покрытия его цинком, который окисляется раньше железа; оцинкованное железо
- расходуемый анод
- более активный и недорогой металл, используемый в качестве анода в катодной защите; часто из магния или цинка
Решения
Ответы на упражнения в конце главы по химии
2.Mg и Zn
4. Оба примера включают катодную защиту. (Жертвенный) анод — это металл, который коррозирует (окисляется или вступает в реакцию). В случае железа (-0,447 В) и цинка (-0,7618 В) цинк имеет более отрицательный стандартный восстановительный потенциал и поэтому служит анодом. В случае железа и меди (0,34 В) железо имеет меньший стандартный восстановительный потенциал и поэтому подвергается коррозии (служит анодом).
6. Хотя восстановительный потенциал лития делает его способным защищать другие металлы, этот высокий потенциал также указывает на то, насколько литий реакционноспособен; он будет иметь спонтанную реакцию с большинством веществ.Это означает, что литий будет быстро реагировать с другими веществами, даже с теми, которые не окисляют металл, который он пытается защитить. Такая реактивность означает, что расходуемый анод будет быстро истощаться и его нужно будет часто заменять. (Необязательная дополнительная причина: опасность возгорания в присутствии воды.)
Коррозия | Безграничная химия
Коррозия
Коррозия возникает при разрушении металлов в результате химических процессов.
Цели обучения
Обсудить общие причины коррозии металлической поверхности
Ключевые выводы
Ключевые моменты
- Коррозия — это двухэтапный процесс, для которого требуются три вещи: металлическая поверхность, электролит и кислород.
- В процессе коррозии поверхностные атомы металла растворяются в водном растворе, оставляя металл с избыточным отрицательным зарядом. Образующиеся ионы удаляются подходящим акцептором электронов.
- Коррозия — это металлы, которые самопроизвольно возвращаются в форму своей руды в процессе окисления.
- Электропроводящие свойства металла позволяют окислению и восстановлению происходить на отдельных участках поверхности металла.
Ключевые термины
- коррозия : Химическая эрозия, особенно окисление.
Когда материалы портятся в результате химических процессов, они подвергаются коррозии. Коррозия обычно обсуждается применительно к металлам, которые корродируют электрохимически. — [/ latex]
Коррозия — это неприятность : На этой фотографии железного моста через реку Нанду в Хайнане, Китай, показаны доказательства повреждений, вызванных коррозией.- \ rightarrow \ text {M} (\ text {s}) [/ latex]
На этой катодной ступени M — металл.
Насколько подвержен коррозии тот или иной металл, можно определить по его восстановительному потенциалу. Чем выше восстановительный потенциал металла, тем меньше вероятность его окисления.
Коррозия — обычная неприятность с реальными ударами. Мы видим его последствия в ржавых каркасах автомобилей, прорыве водопровода и разрушении мостов.
Предотвращение коррозии
Предотвращение коррозии снижает как экономический, так и связанный с безопасностью ущерб, связанный с технологическим процессом.
Цели обучения
Обсудите общие профилактические меры, которые можно предпринять против коррозии металлической поверхности
Ключевые выводы
Ключевые моменты
- Для возникновения коррозии необходимы три вещи: электролит, открытая металлическая поверхность и акцептор электронов.
- Коррозию можно предотвратить, сняв одно из этих условий.
- Покрытие металлической поверхности краской или эмалью создает барьер между металлом и влагой окружающей среды.
- Процесс покрытия металлической поверхности другим металлом, который с большей вероятностью окисляется, называется жертвенным покрытием.
Ключевые термины
- электролит : Вещество, которое в растворе или в расплавленном состоянии ионизирует и проводит электричество.
- жертвенное покрытие : металлическое покрытие, которое подвержено окислению с большей вероятностью, чем металл, который оно защищает.
- гальваника : для покрытия тонким слоем металла электрохимическим способом; к гальванике.
Анализ коррозии
Мы узнали, что для анодной и катодной стадий коррозии необходимы три вещи: электролит, открытая металлическая поверхность и акцептор электронов. Отсюда следует, что мы можем предотвратить коррозию, удалив одно из этих важных условий. Самое простое условие для удаления — это оголенная металлическая поверхность.
Создание физического барьера
Покрытие металлической поверхности краской или эмалью создает барьер между металлом и влагой в окружающей среде, тем самым устраняя возможность контакта кислорода и влаги с металлом.
Жертвенные покрытия
Процесс покрытия металлической поверхности другим металлом, который с большей вероятностью окисляется, называется жертвенным покрытием. Сталь из сплава железа, подверженная коррозии, обычно покрывается цинком, более активным металлом, в процессе, известном как цинкование. Коррозия жертвенного цинка приводит к его окислению; железо восстанавливается, что делает его катодным и препятствует его коррозии.
Оцинкованная поверхность : Защита сплавов железа покрытием из более активного металла посредством процесса цинкования предотвращает коррозию сплавов.
Контраст с предыдущим сценарием можно увидеть, когда железо или железный сплав покрывают менее активным металлом, например оловом. Пока оловянное покрытие остается неповрежденным, коррозия невозможна. Однако, если оловянное покрытие ухудшится, обнажая лежащий под ним металл, произойдет коррозия. Это связано с тем, что обнаженное железо подвергается окислению и становится анодным. Олово принимает электроны от окисленного железа, и соблюдаются три критерия коррозии.
Катодная защита
Еще один способ защиты от коррозии — создание постоянного отрицательного электрического заряда на металле.Этот метод называется катодной защитой. Катодная защита воспроизводит эффект жертвенного покрытия, но с более активным металлом. Источником отрицательного заряда обычно является внешний источник постоянного тока. Катодная защита используется, в частности, для защиты подземных топливных баков и трубопроводов.
Пассивация
Пассивация — это процесс, при котором на металлической поверхности образуется тонкая пленка продуктов коррозии, служащая барьером против окисления.На формирование пассивирующего слоя влияют pH окружающей среды, температура и химические условия. Статуя Свободы, например, покрыта сине-зеленой патиной, вызванной несколькими химическими реакциями, которая защищает металлическую медь под ней.
Анодирование
Анодирование — это еще одна обработка поверхности, защищающая от коррозии. Защищаемый металл покрывается специальным веществом, а электрохимические условия регулируются таким образом, чтобы в оксидной пленке металла появлялись однородные поры шириной несколько нанометров.Эти поры позволяют образовываться оксидной пленке, более толстой, чем пассивирующий слой. Полученный защитный слой очень твердый и очень эластичный.
Жертвенная защита анода
По тому же принципу, что и временное пленочное покрытие, расходуемый анод, сделанный из металла, более активного, чем металл, который вы хотите защитить, можно использовать для предотвращения коррозии металлических конструкций, погруженных в воду или заглубленных в землю. Жертвенный анод подвергнется коррозии раньше, чем металл, который он защищает. Однако, как только расходуемый анод подвергнется коррозии, его необходимо заменить; в противном случае металл, который она защищает, тоже начнет разъедать.
Катодная защита предотвращает коррозию : Гальванический расходный анод, прикрепленный к корпусу корабля; Здесь протекторный анод показывает коррозию, а металл, к которому он прикреплен, — нет. Анод, кусок более электрохимически «активного» металла, прикреплен к уязвимой поверхности металла, где он подвергается воздействию электролита; потенциал уязвимой поверхности поляризован, чтобы быть более отрицательным, пока поверхность не будет иметь однородный потенциал. На этом этапе устраняется движущая сила реакции коррозии с защищаемой поверхностью.Гальванический анод продолжает корродировать, расходуя материал анода, пока в конечном итоге его не нужно будет заменить, но катодный материал защищен.
Коррозия представляет реальную угрозу целостности личного имущества, а также мостов, дорог и другой общественной инфраструктуры. Понимание и реализация стратегий предотвращения коррозии уменьшит как экономический ущерб, так и ущерб, связанный с безопасностью, связанный с процессом.
Завод Инжиниринг | Коррозия: электрохимическая
Коррозия окружает нас повсюду, в нашей повседневной жизни, тихо работает и идет своим чередом.Коррозия — это ухудшение свойств материала из-за реакции с окружающей средой. КДЕС определяет коррозию как «разрушение вещества (обычно металла) или его свойств из-за реакции с окружающей средой» 1 Хотя это утверждение верно, оно также указывает на тот факт, что коррозируют не только металлы, бетон, пластмассы, и другие материалы также подвержены коррозии.
Последствия коррозии можно увидеть повсюду: в наших домах, на детских площадках, в наших машинах, зданиях и мостах.Если его не остановить, это может привести к серьезным авариям, таким как обрушившийся 1 августа 2007 года мост Миннеаполис I-35W, в результате которого погибло 13 человек и было ранено 145 человек. фюзеляжа, в результате чего погиб член экипажа и пострадали 65 пассажиров и члены экипажа 3 .
Коррозия также имеет финансовые последствия. В США коррозия вызывает ежегодные убытки в 47,9 миллиарда долларов, в коммунальном хозяйстве — 29 долларов.7 млрд долларов в транспортной отрасли, 22,6 млрд долларов на инфраструктуру, 20,1 млрд долларов на государственные структуры и 17,6 млрд долларов на производство и обрабатывающую промышленность 4 . Это составляет 275,7 миллиардов долларов в год из-за коррозии, при этом самые большие затраты приходятся на питьевую воду и канализационные системы — 36 миллиардов долларов и увеличиваются на 5 .
Исследования коррозии показали нам, что существует два основных механизма коррозии: электрохимическое и химическое окисление.Оба этих типа имеют множество форм и ответвлений, некоторые из которых более выражены, чем другие, но механизм, с помощью которого они разлагают вещество или материал, всегда можно проследить до одного из этих двух типов. В этой части статьи мы рассмотрим механизм электрохимической коррозии и ее наиболее распространенные формы.
Электрохимическая коррозия
Электрохимическая коррозия — это процесс, посредством которого металл возвращается в состояние окисления с наименьшей энергией. Чтобы правильно понять электрохимическую коррозию, нужно понять, как руды находят и превращают в металл.
Необработанные руды добываются в природе, где некоторые из них находятся в химическом соединении с другими элементами в термодинамически стабильном состоянии. Железо, например, содержится, среди прочего, вместе с оксидами, гидратами и сульфидами. Чтобы извлечь или очистить железо, энергия (тепло) нагнетается в руду, чтобы превратить ее в металл. Это приводит к восстановлению железной руды и ее термодинамической нестабильности. Фундаментальные законы термодинамики диктуют, что нестабильная система в конечном итоге возвращается к своей стабильной форме, равновесию.
Некоторые металлы, однако, встречаются в природе уже в металлической форме, например, золото, и поэтому уже стабильны в металлической форме, поэтому золото не подвержено коррозии. Это не означает, что только те металлы, которые встречаются в природе в чистой металлической форме, являются единственными, которые не подвержены коррозии, есть руды, которые при окислении производят металл, который не подвергается коррозии, разница в том, что количество энергия (тепло), необходимая для окисления руды, в этом случае минимальна.
Нестабильные металлы с годами становятся стабильными в результате электрохимической коррозии, если их не защищать.Для того, чтобы произошла электрохимическая коррозия, необходимо наличие коррозионного элемента. Ячейка для защиты от коррозии представляет собой комбинацию четырех элементов, анода, катода, электролита и металлического пути, соединяющего анод и катод. Без любого из этих четырех элементов коррозия не произойдет, все элементы должны присутствовать. Современные исследования показали, что кислород может сильно влиять на коррозию, и эксперты часто считают его очень важным элементом, утверждая, что в некоторых формах коррозии кислород является заключительным завершающим этапом для достижения действительно самого низкого энергетического состояния.
- На аноде происходит фактическая потеря металла. Ионизируя электролит, ионы высвобождают электроны через сложную серию химических реакций с образованием оксида железа (Fe2O3) и кислорода. Оксид железа — это то, что мы обычно называем ржавчиной.
- Катод — чрезвычайно важный элемент коррозионной ячейки, поскольку он определяет скорость коррозии. Электроны от анода перемещаются к катоду и размещаются там. Чем больше электронов может вместить катод, тем быстрее будет коррозия анода.Это первичное соотношение между анодом и катодом в коррозионной ячейке.
- Электролит также является важным элементом коррозионной ячейки, поскольку это раствор, окружающий анод и катод. Электролит также влияет на скорость коррозии, поскольку проводимость электролита либо позволяет электронам свободно перемещаться от анода к катоду, либо ограничивает их поток, тем самым снижая скорость коррозии.
- Metallic Pathway — это то, что некоторые могут назвать внутренней схемой, поскольку она обеспечивается металлом, в котором находятся анод и катод.Металлический путь замыкает контур коррозии.
Кислород считается важным фактором коррозии, поскольку без кислорода коррозия замедляется и в конечном итоге останавливается. Кислород отвечает за реакцию с ионами водорода, которые высвобождаются на катоде из-за аккомодации электронов. В отсутствие кислорода ионы водорода накапливаются на катоде и препятствуют аккомодации электронов, тем самым останавливая процесс коррозии. Это явление называется поляризацией 6 .
Хотя электрохимическая коррозия относится к механизму коррозии, она может проявляться во многих формах. Гальваническая, точечная и щелевая коррозия — самые распространенные.
Гальваническая коррозия
Гальваническая коррозия возникает, когда два разных металла погружаются в раствор и соединяются металлическим путем. Примером может служить железный корабль с алюминиевыми гребными винтами. Электролит — это море, а металлический путь — это настоящая конструкция корабля. Анод и катод определяются путем изучения гальванической серии.В таблице 1 представлена упрощенная гальваническая серия.
Из таблицы 1 видно, что на железном корабле алюминиевые гребные винты будут наиболее активным металлом или анодом и, следовательно, подвержены коррозии. Следует отметить, что чем дальше друг от друга находятся два металла в гальванической цепи, тем быстрее будет скорость коррозии.
В этом конкретном случае также стоит отметить размер анода в зависимости от размера катода. Чем больше катод, тем больше электронов он может принять от анода, заставляя его ионизоваться с большей скоростью, что приводит к гораздо большей коррозии.Это соотношение между ними линейно, чем больше разница в размерах между катодом и анодом, тем быстрее анод будет корродировать. Это применимо только в том случае, если катод больше анода. Если анод больше катода, скорость коррозии снижается. Следовательно, отношения теперь обратные.
Питтинговая коррозия
Точечная коррозия — это форма коррозии, которая часто связана с соотношением размеров между анодом и катодом, описанным выше. Наиболее частая причина питтинга — неоднородность металлов.Иногда металлы непостоянны по своему содержанию, в них могут быть включены горшечные металлы или другие крупинки легко корродируемых металлов. Если в металле есть включения такого рода, которые являются более анодными, чем остальной металл, эти примеси корродируют с большей скоростью и вызывают ямки. Возможно и обратное, примеси могут быть катодными по отношению к остальному металлу, что приведет к образованию ямок в области, окружающей примеси.
Неоднородность — не единственная причина питтинга.Защитные покрытия могут сломаться и обнажить часть подложки, которую она должна была защищать. Это заставляет остальную часть металла с покрытием действовать как катод, а небольшая неоднородность становится анодом. В соответствии с соотношением размеров анода и катода скорость коррозии на этом небольшом аноде будет высокой, что приведет к образованию ямок.
Щелевая коррозия
Это особая форма коррозии, которая возникает в очень маленьких трещинах на металле. Щелевая коррозия — очень интересная форма, потому что в какой-то момент она включает один из двух основных механизмов, электрохимический и химический.Щелевая коррозия часто возникает в местах застаивания электролита. Эти места часто включают соединения внахлестку, под прокладками и под изоляцией. В этих местах щелевая коррозия обычно начинается как электрохимическая коррозия с попаданием электролита в щель. Из-за небольшого размера щели кислород, необходимый для поддержания электрохимической коррозии, быстро истощается, и электролит становится кислым. Это происходит в результате гидролиза ионов металлов, образующихся в результате электрохимической коррозии 7 .На этом этапе тип или механизм коррозии связан с химическим воздействием.
Несмотря на то, что создание ячейки коррозии может показаться трудным процессом, это происходит гораздо проще, чем можно было подумать. Электрохимическая коррозия может происходить повсюду, она может взаимодействовать более чем с одним металлом, а также проникать внутрь бетона и разъедать арматурные стержни. Вся наша инфраструктура подвержена коррозии. Многие другие формы коррозии могут наблюдаться в промышленных условиях, однако, как объяснялось, все эти формы можно проследить до электрохимических.Эти другие формы могут включать нитевидную коррозию, атмосферную коррозию и коррозию прокатной окалины.
Электрохимическая коррозия — наиболее распространенный механизм в современной промышленности, и ее последствия можно измерить с точки зрения экономики, здоровья, безопасности и даже культуры. Этот механизм коррозии может существовать внутри нашего тела, в кардиостимуляторах, он может вызывать падение мостов, разрыв газопроводов и даже такие культурные сооружения, как статуя Свободы, если о них не позаботиться должным образом. Электрохимическая коррозия — это сила, с которой нужно считаться в современном мире, и с ней нужно бороться как с таковой.В следующем выпуске мы расскажем о механизме химического окисления и его наиболее распространенных формах.
См. Также Коррозия: химическое окисление
Цитаты
1 VanDelinder, L.S. изд. Основы коррозии — Введение, Глава 1, Объем и язык коррозии. Национальная ассоциация инженеров-коррозионистов, стр.14, 1984
2 Фроммер, Фредерик и Лоуи, Джоан. «Недостатки конструкции моста могут быть не так редки, как думали» USA Today. 25 декабря 2010 г.
3 Кристофф, Сьюзен. «Усталостный отказ самолета Aloha Flight 243: как циклическая нагрузка и коррозия вызвали отказ в середине полета» Suite 101. 27 декабря 2010 г.
4 Томпсон, Нил. «Стоимость коррозии: в США 276 миллиардов долларов в год». Коррозия Стоимость. 28 декабря 2010 г.
5 Томпсон, Нил. «Стоимость коррозии: в США 276 миллиардов долларов в год». Коррозия Стоимость. 28 декабря 2010 г.
6 Мангер, Чарльз. Предотвращение коррозии с помощью защитных покрытий, Глава 1, Коррозионная ячейка.Национальная ассоциация инженеров-коррозионистов, стр.21, 1984
7 Томпсон, Нил. «Хронология расщелины». Коррозийные врачи. 28 декабря 2010 г.
Исследования электрохимической коррозии для моделирования скорости выброса металлических отходов (технический отчет)
Пуано, Фредерик, и Тамалис, Дмитрий. Исследования электрохимической коррозии для моделирования скорости выброса металлических отходов . США: Н.стр., 2016.
Интернет. DOI: 10,2172 / 1303154.
Пуано, Фредерик и Тамалис, Дмитрий. Исследования электрохимической коррозии для моделирования скорости выброса металлических отходов . Соединенные Штаты. https://doi.org/10.2172/1303154
Пуано, Фредерик, и Тамалис, Дмитрий.Пн.
«Электрохимические исследования коррозии для моделирования скорости выброса металлических отходов». Соединенные Штаты. https://doi.org/10.2172/1303154. https://www.osti.gov/servlets/purl/1303154.
@article {osti_1303154,
title = {Исследования электрохимической коррозии для моделирования скорости выброса металлических отходов},
author = {Пуано, Фредерик и Тамалис, Дмитрий},
abstractNote = {Изотоп 99Tc является важным продуктом деления, образующимся при производстве ядерной энергии.Из-за его длительного периода полураспада (t1 / 2 = 2,13 ∙ 105 лет) и бета-радиотоксичности (β⁻ = 292 кэВ) он представляет собой серьезную проблему при долгосрочном обращении с отработавшим ядерным топливом. В отработавшем ядерном топливе Tc присутствует в виде сплава с Mo, Ru, Rh и Pd, называемого эпсилон-фазой, относительное количество которой увеличивается с выгоранием топлива. В некоторых схемах разделения отработавшего ядерного топлива Tc будет отделен от отработавшего топлива и захоронен в виде долговечных отходов. Рассматриваемые формы отходов технеция включают металлические сплавы, оксидную керамику и боросиликатное стекло.При разработке металлической формы отходов после отделения от отработавшего топлива Tc будет преобразован в металл, включен в сплав, и полученная форма отходов будет храниться в хранилище. Рассматриваемые металлические сплавы включают сплавы Tc – Zr, сплавы Tc – нержавеющая сталь и сплавы Tc – Inconel (Inconel - это сплав Ni, Cr и железа, устойчивый к коррозии). Для прогнозирования долгосрочного поведения металлической формы отходов Tc необходимо понимание коррозионных свойств металла Tc и сплавов Tc в различных химических средах, но усилия по моделированию поведения металлических сплавов Tc ограничены.Одним из параметров, который также следует учитывать при прогнозировании долгосрочного поведения формы отходов Tc, является рост стабильного Ru, который происходит в результате радиоактивного распада 99Tc (99Tc → 99Ru + β⁻). По прошествии геологического периода в Tc будет присутствовать значительное количество Ru, что может повлиять на его коррозионные свойства. Также важно изучить влияние Ru на коррозионное поведение Tc. В связи с этим мы изучили электрохимическое поведение металла Tc, сплавов Tc-Ni (для моделирования сплава Tc-Inconel) и сплавов Tc-Ru в кислых средах.Также было проведено исследование сплавов Tc-U, чтобы лучше понять природу Tc в металлическом отработавшем топливе. Вычислительное моделирование и имитация были выполнены, чтобы пролить свет на экспериментальные результаты и объяснить структурные и кинетические тенденции.},
doi = {10.2172 / 1303154},
url = {https://www.osti.gov/biblio/1303154},
журнал = {},
номер =,
объем =,
place = {United States},
год = {2016},
месяц = {8}
}
Восемь форм коррозии Фонтаны
Восемь форм коррозии
, автор: Fontana & Greene, 1967
Идея описания различных способов, которыми коррозия может повредить металлы своим внешним видом, использовалась многими до того, как Фонтана и Грин стали соавторами своей знаменитой книги в 1967 году.Маккей и Уортингтон уже обсуждали различные формы коррозии в своей книге о коррозии 1936 года. вслед за Аланом Поллиттом в его собственной книге, опубликованной на тринадцать лет раньше, то есть в 1923 году. Однако следующая классификация, похоже, получила самое широкое признание с небольшими различиями между авторами.
Коррозию удобно классифицировать по формам ее проявления, основанием для этой классификации является внешний вид корродированного металла. Каждую форму можно идентифицировать простым визуальным наблюдением.В большинстве случаев достаточно невооруженного глаза, но иногда полезно или требуется увеличение. Ценную информацию для решения проблемы коррозии часто можно получить, внимательно наблюдая за корродированными образцами для испытаний или неисправным оборудованием. Осмотр перед чисткой особенно желателен. Некоторые из восьми форм коррозии уникальны, но все они более или менее взаимосвязаны. К восьми формам относятся: (1) равномерное или общее воздействие, (2) гальваническая коррозия или коррозия двух металлов, (3) щелевая коррозия, (4) точечная коррозия, (5) межкристаллитная коррозия, (6) избирательное выщелачивание или расслоение. , (7) стресс-коррозия.Этот список произвольный, но охватывает практически все повреждения и проблемы, связанные с коррозией. Формы не перечислены в каком-либо определенном порядке важности. Ниже рассматриваются восемь форм коррозии с точки зрения их характеристик, механизмов и профилактических мер. Повреждение водородом, хотя и не является формой коррозии, часто происходит косвенно в результате коррозионного воздействия, и поэтому включено в это обсуждение. ссылка
Униформа Атака
Равномерное разрушение — наиболее распространенная форма коррозии.Обычно он характеризуется химической или электрохимической реакцией, которая равномерно протекает по всей открытой поверхности или на большой площади. Металл становится тоньше и со временем выходит из строя. Например, кусок стали или цинка, погруженный в разбавленную серную кислоту, обычно растворяется с одинаковой скоростью по всей своей поверхности. Крыша из листового железа будет иметь одинаковую степень ржавчины по всей внешней поверхности.
Равномерное разрушение или общая общая коррозия представляет собой наибольшее разрушение металла на тоннажной основе.Однако эта форма коррозии не вызывает особого беспокойства с технической точки зрения, поскольку срок службы оборудования можно точно оценить на основе сравнительно простых испытаний. Часто достаточно просто погрузить образцы в жидкость. Равномерную атаку можно предотвратить или уменьшить с помощью (1) подходящих материалов, включая покрытия, (2) ингибиторов или (3) катодной защиты.
Гальваническая или двухкомпонентная коррозия
Обычно существует разность потенциалов между двумя разнородными металлами, когда они погружены в коррозионный или проводящий раствор.Если эти металлы находятся в контакте (или иначе электрически связаны), эта разность потенциалов создает поток электронов между ними. Коррозия менее стойкого к коррозии металла обычно увеличивается, а воздействие более стойкого материала снижается по сравнению с поведением этих металлов, когда они не контактируют. Менее стойкий металл становится анодным, а более стойкий — катодным. Обычно катод или катодный металл очень мало или совсем не корродируют в парах этого типа.Из-за наличия электрического тока и наличия разнородных металлов эта форма коррозии называется гальванической или двухметаллической. Это электрохимическая коррозия, но для ясности мы ограничим термин «гальваническая» воздействием разнородных металлов.
Щелевая коррозия
Интенсивная локальная коррозия часто возникает в щелях и других экранированных областях на металлических поверхностях, подверженных коррозионным воздействиям. Этот тип атаки обычно связан с небольшими объемами застойного раствора, вызванными отверстиями, поверхностями прокладок, соединениями внахлест, поверхностными отложениями и щелями под головками болтов и заклепок.В результате эту форму коррозии называют щелевой коррозией или, иногда, коррозией отложений или прокладок.
Питтинг
Точечная коррозия — это форма чрезвычайно локализованной атаки, в результате которой в металле образуются дыры. Эти отверстия могут быть маленькими или большими в диаметре, но в большинстве случаев они относительно малы. Ямы иногда изолированы или расположены так близко друг к другу, что выглядят как шероховатая поверхность. Обычно яму можно описать как полость или отверстие с диаметром поверхности, примерно равным глубине или меньшим ее.
Точечная коррозия — одна из самых разрушительных и коварных форм коррозии. Это приводит к отказу оборудования из-за перфорации с незначительной потерей веса всей конструкции. Язвы часто бывает трудно обнаружить из-за их небольшого размера и из-за того, что ямы часто покрыты продуктами коррозии. Кроме того, трудно количественно измерить и сравнить степень ямок из-за разной глубины и количества ямок, которые могут возникнуть в одинаковых условиях.Язвенную коррозию также трудно предсказать с помощью лабораторных тестов. Иногда карьерам требуется много времени — несколько месяцев или год — для того, чтобы они появились в реальной эксплуатации. Точечная коррозия особенно опасна, потому что это локализованная и интенсивная форма коррозии, а отказы часто происходят очень внезапно.
Межкристаллитная коррозия
Эффекты границ зерен практически не имеют значения для большинства применений или применений металлов. Если металл корродирует, это приводит к равномерному разрушению, поскольку границы зерен обычно лишь немного более реактивны, чем матрица.Однако при определенных условиях границы раздела зерен очень реактивны и приводят к межкристаллитной коррозии. Локальное повреждение на границах зерен и рядом с ними при относительно небольшой коррозии зерен — это межкристаллитная коррозия. Сплав распадается (выпадают зерна) и / или теряет прочность.
Межкристаллитная коррозия может быть вызвана примесями на границах зерен, обогащением одного из легирующих элементов или истощением одного из этих элементов в зонах границ зерен.Было показано, что небольшие количества железа в алюминии, в котором растворимость железа низкая, сегрегируют на границах зерен и вызывают межкристаллитную коррозию. Было показано, что, исходя из соображений поверхностного натяжения, содержание цинка в латуни выше на границах зерен. Истощение хрома в областях границ зерен приводит к межкристаллитной коррозии нержавеющих сталей.
Селективное выщелачивание
Селективное выщелачивание — это удаление одного элемента из твердого сплава в результате коррозионных процессов.Наиболее распространенный пример — избирательное удаление цинка из латунных сплавов (децинковка). Подобные процессы происходят в других системах сплавов, в которых алюминий; железо, кобальт, хром и другие элементы удаляются. Селективное выщелачивание — это общий термин для описания этих процессов, и его использование исключает создание таких терминов, как деалюмификация, декобальтификация и т. Д. Разделение — это металлургический термин, который иногда применяется, но выборочное выщелачивание является предпочтительным.
Эрозия Коррозия
Эрозионная коррозия — это ускорение или увеличение скорости разрушения или воздействия на металл из-за относительного движения между агрессивной жидкостью и поверхностью металла.Как правило, это движение довольно быстрое и связано с механическим износом или истиранием. Металл удаляется с поверхности в виде растворенных ионов или образует твердые продукты коррозии, которые механически смываются с поверхности металла. Иногда движение окружающей среды уменьшает коррозию, особенно когда локальное повреждение происходит в застойных условиях, но это не эрозионная коррозия, поскольку износ не увеличивается.
Эрозионная коррозия проявляется в виде бороздок, оврагов, волн, закругленных отверстий и впадин и обычно имеет направленный характер.Во многих случаях отказы из-за эрозионной коррозии происходят за относительно короткое время, и они являются неожиданными в основном потому, что оценочные испытания на коррозию проводились в статических условиях или потому, что эффекты эрозии не учитывались.
Растрескивание от коррозии
Под коррозионным растрескиванием под напряжением понимается растрескивание, вызванное одновременным наличием растягивающего напряжения и определенной коррозионной среды. Многие исследователи классифицируют все отказы от растрескивания, происходящие в коррозионных средах, как коррозионное растрескивание под напряжением, включая отказы из-за водородного охрупчивания.Однако эти два типа отказов от взлома по-разному реагируют на переменные среды. Чтобы проиллюстрировать, катодная защита является эффективным методом предотвращения коррозионного растрескивания под напряжением, в то время как она быстро ускоряет эффекты водородного охрупчивания. Следовательно, важность рассмотрения коррозионного растрескивания под напряжением и водородной хрупкости как отдельных явлений очевидна. По этой причине два явления растрескивания обсуждаются отдельно в этой главе.
Во время коррозионного растрескивания металл или сплав практически не подвергаются атакам на большей части своей поверхности, в то время как мелкие трещины проходят через него.Это явление растрескивания имеет серьезные последствия, поскольку оно может возникать при напряжениях в диапазоне типичных расчетных напряжений. Показано, что воздействие кипящего MgCl2 при 310 ° F (154 ° C) снижает прочностные характеристики примерно до значения, доступного при 1200 ° F.
Два классических случая коррозионного растрескивания — это «сезонное растрескивание» латуни и «каустическое охрупчивание» стали. Оба этих устаревших термина описывают существующие условия окружающей среды, которые привели к коррозионному растрескиванию под напряжением.Сезонное растрескивание относится к разрушению латунных гильз картриджей вследствие коррозионного растрескивания под напряжением. Во время сильных дождей, особенно в тропиках, в латунных гильзах наблюдались трещины в месте опрессовки гильзы на пулю. Позже было обнаружено, что важным экологическим компонентом сезонного крекинга является аммиак, образующийся в результате разложения органических веществ.
В первых паровозах произошло много взрывов клепаных котлов. Исследование этих отказов показало трещины или хрупкие разрушения в отверстиях под заклепки.Эти участки были подвергнуты холодной обработке во время клепки, и анализ белесых отложений, обнаруженных на этих участках, показал, что основным компонентом является едкий натр или гидроксид натрия. Следовательно, хрупкое разрушение в присутствии каустика привело к термину каустическое охрупчивание. В то время как одно только напряжение будет реагировать способами, хорошо известными в механической металлургии (то есть ползучесть, усталость, разрушение при растяжении), а только коррозия будет реагировать, вызывая характерные реакции растворения; одновременное действие обоих иногда приводит к катастрофическим результатам.
Гальваническая коррозия — SSINA
Фотография: Боба Йованович на UnsplashОпределение
Когда два разных металла или сплава погружаются в коррозионный раствор или регулярно соединяются влагой, у каждого из них развивается потенциал коррозии. При наличии условий для гальванической коррозии более благородный металл станет катодом, а более активный металл — анодом. Между анодом и катодом может протекать измеримый ток.Если это произойдет, скорость коррозии анода в рабочей среде будет увеличиваться, а скорость коррозии катода уменьшится. Повышенная коррозия анода называется «гальванической коррозией».
Гальваническая коррозия иногда используется для продления срока службы материалов (например, цинковых покрытий на углеродистой стали и цинковых анодов в водонагревателях), но, если она не будет учтена и существуют правильные условия, она может привести к неожиданным сбоям.
Требования к гальванической коррозии:
Для возникновения гальванической коррозии требуются три элемента.
- Два металла с разными потенциалами коррозии
- Прямой электрический контакт металл-металл
- Проводящий раствор электролита (например, вода) должен регулярно соединять два металла. Раствор электролита создает «токопроводящую дорожку». Это может произойти при регулярном погружении в воду, конденсации, попадании дождя, тумана или других источников влаги, которые увлажняют и соединяют два металла.
Если какой-либо из этих элементов отсутствует, гальваническая коррозия не может возникнуть.Если, например, предотвращается прямой контакт между двумя металлами (пластиковая шайба, лакокрасочная пленка и т. Д.) Или если есть какое-либо другое прерывание на проводящем пути, гальваническая коррозия не может быть гальванической, и каждый металл будет корродировать со своей нормальной скоростью в эта служебная среда. На рисунке 1 показаны примеры условий, которые не соответствуют всем требованиям к гальванической коррозии.
Рисунок 1
Рисунок 1: Примеры биметаллических комбинаций, когда гальваническая коррозия не может возникнутьПримеры биметаллических комбинаций, когда гальваническая коррозия не может возникнуть
Когда два разных металла соединяются вместе в атмосфере или воде, вероятность развития гальванической коррозии можно предсказать с помощью «гальванического ряда.«В специализированных приложениях, например, когда разнородные металлы закладываются в бетон, следует использовать данные о коррозии для этой конкретной среды.
Рисунок 2
На рис. 2 показаны гальванические серии, измеренные в морской воде для некоторых распространенных металлов и сплавов. Когда два металла находятся дальше друг от друга в списке (например, большая разница между двумя числами), движущая сила гальванической коррозии увеличивается. Самые анодные (активные) металлы находятся вверху, а самые катодные (благородные) — внизу.Для нержавеющих сталей показаны как сплошные, так и полые стержни. Полые стержни представляют собой активно корродирующую нержавеющую сталь, которая имеет другой потенциал, чем пассивная (не корродирующая) нержавеющая сталь. В большинстве случаев, когда сочетаются разнородные металлы, для определения положения нержавеющей стали следует использовать пассивный (сплошной) стержень.
Например, если цинк (представьте оцинкованную сталь), который является активным материалом и находится в верхней части списка, и нержавеющая сталь, благородный металл и в нижней части списка находятся в прямом контакте и в присутствии электролита (воды ), гальваническая коррозия произойдет, если они регулярно подвергаются воздействию электролита.
Рисунок 2: Гальванический ряд в морской воде.
 Заземление обеспечивает безопасность использования техники.
Заземление обеспечивает безопасность использования техники. Если проектирование дома выполнено с соблюдением норм и стандартов, подобной проблемы возникнуть не должно, ведь токопроводящие компоненты подвергаются заземлению. Защитные меры способствуют уравниванию потенциалов.
Если проектирование дома выполнено с соблюдением норм и стандартов, подобной проблемы возникнуть не должно, ведь токопроводящие компоненты подвергаются заземлению. Защитные меры способствуют уравниванию потенциалов.