Купрум | это… Что такое Купрум?
Медь / Cuprum (Cu) | |
|---|---|
| Атомный номер | 29 |
| Внешний вид простого вещества | пластичный металл золотисто-розового цвета |
| Свойства атома | |
| Атомная масса (молярная масса) | 63,546 а. е. м. (г/моль) |
| Радиус атома | 128 пм |
| Энергия ионизации (первый электрон) | 745,0 (7,72) кДж/моль (эВ) |
| Электронная конфигурация | [Ar] 3d10 4s1 |
| Химические свойства | |
| Ковалентный радиус | 117 пм |
| Радиус иона | (+2e) 72 (+1e) 96 пм |
| Электроотрицательность (по Полингу) | 1,90 |
| Электродный потенциал | +0,337 В/ +0,521 В |
| Степени окисления | 2, 1 |
| Термодинамические свойства простого вещества | |
| Плотность | 8,96 г/см³ |
| Удельная теплоёмкость | 24,465 Дж/(K·моль) |
| Теплопроводность | 401 Вт/(м·K) |
| Температура плавления | 1356,6 K |
| Теплота плавления | 13,01 кДж/моль |
| Температура кипения | 2840 K |
| Теплота испарения | 304,6 кДж/моль |
| Молярный объём | 7,1 см³/моль |
| Кристаллическая решётка простого вещества | |
| Структура решётки | кубическая гранецентрированая |
| Период решётки | 3,615 Å |
| Отношение c/a | n/a |
| Температура Дебая | 315,00 K |
Медь — химический элемент с атомным номером 29 в периодической системе, обозначается символом Cu (лат. Cuprum от названия острова Кипр где добывали медь), красновато-золотистого цвета (розовый при отсутствии оксидной пленки). Простое вещество медь — это пластичный переходный металл, с давних пор широко применяемый человеком.
Cuprum от названия острова Кипр где добывали медь), красновато-золотистого цвета (розовый при отсутствии оксидной пленки). Простое вещество медь — это пластичный переходный металл, с давних пор широко применяемый человеком.
Содержание
|
История и происхождение названия
Схема атома меди
Из-за сравнительной доступности для получения из руды и малой температуры плавления медь — один из первых металлов, широко освоенных человеком. В древности применялась в основном в виде сплава с оловом — бронзы для изготовления оружия и т. п. (см бронзовый век).
В древности применялась в основном в виде сплава с оловом — бронзы для изготовления оружия и т. п. (см бронзовый век).
Нахождение в природе
Самородная медь
Медь встречается в природе как в соединениях, так и в самородном виде. Промышленное значение имеют халькопирит CuFeS
Большая часть медной руды добывается открытым способом.
Физические свойства
Медь — золотисто-розовый пластичный металл, на воздухе быстро покрывается оксидной плёнкой, которая придаёт ей характерный интенсивный желтовато-красный оттенок. Медь обладает высокой тепло- и электропроводностью (занимает второе место по электропроводности после серебра). Имеет два стабильных изотопа — 63Cu и 65Cu, и несколько радиоактивных изотопов. Самый долгоживущий из них, 64Cu, имеет период полураспада 12,7 ч и два различных варианта распада с различными продуктами.
Плотность — 8,94*10³ кг/м³
Удельная теплоёмкость при 20 °С — 390 Дж/кг*К
Удельное электрическое сопротивление при 20-100 °С — 1,78·10-8 Ом·м
Существует ряд сплавов меди: латунь — сплав меди с цинком, бронза — сплав меди с оловом, мельхиор — сплав меди и никеля, и некоторые другие.
Химические свойства
Хорошо проводит тепло. На воздухе покрывается оксидной плёнкой.
Соединения
Медный купорос
В соединениях медь бывает двух степеней окисления: менее стабильную степень Cu+ и намного более стабильную Cu2+, которая даёт соли синего и сине-зелёного цвета. В необычных условиях можно получить соединения со степенью окисления +3 и даже +5. Последняя встречается в солях купраборанового аниона Cu(B
Карбонат меди(II) имеет зелёную окраску, что является причиной позеленения элементов зданий, памятников и изделий из меди. Сульфат меди(II) при гидратации даёт синие кристаллы медного купороса CuSO4∙5H2O, используется как фунгицид. Также существует нестабильный сульфат меди(I) Существует два стабильных оксида меди — оксид меди(I) Cu2O и оксид меди(II) CuO. Оксиды меди используются для получения оксида иттрия бария меди (YBa Хлорид меди(I) — бесцветные кристаллы (в массе белый порошок) плотностью 4,11 г/см³. В сухом состоянии устойчив. В присутствии влаги легко окисляется кислородом воздуха, приобретая сине-зелёную окраску. Может быть синтезирован восстановлением хлорида меди(II) сульфитом натрия в водном растворе.
Хлорид меди(I) — бесцветные кристаллы (в массе белый порошок) плотностью 4,11 г/см³. В сухом состоянии устойчив. В присутствии влаги легко окисляется кислородом воздуха, приобретая сине-зелёную окраску. Может быть синтезирован восстановлением хлорида меди(II) сульфитом натрия в водном растворе.
Соединения меди(I)
Многие соединения меди(I) имеют белую окраску либо бесцветны. Это объясняется тем, что в ионе меди(I) все пять Зd-орбиталей заполнены парами электронов. Однако оксид Cu
2Cu+(водн.) → Cu2+(водн.) + Cu(тв.)
В то же время медь(I) встречается в форме соединений, которые не растворяются в воде, либо в составе комплексов. Например, дихлорокупрат(I)-ион [CuCl2]— устойчив. Его можно получить, добавляя концентрированную соляную кислоту к хлориду меди(I):
CuCl(тв.) + Cl—(водн.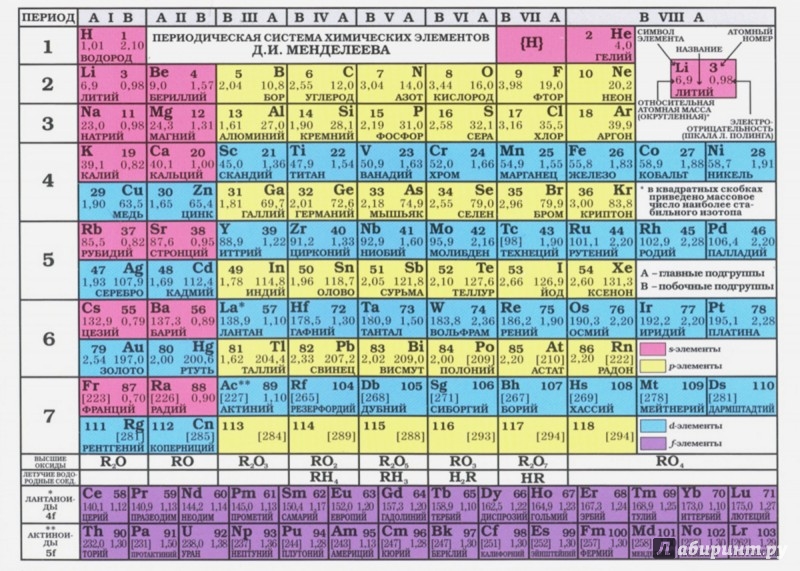 ) → [CuCl]— (водн.)
) → [CuCl]— (водн.)
Хлорид меди(I) — белое нерастворимое твердое вещество. Как и другие галогениды меди(I), он имеет ковалентный характер и более устойчив, чем галогенид меди (II). Хлорид меди(I) можно получить при сильном нагревании хлорида меди(II):
CuCl2(тв.) → 2CuCl(тв.) + Cl2(г.)
Другой способ его получения заключается в кипячении смеси хлорида меди(II) с медью в концентрированной соляной кислоте. В этом случае сначала образуется промежуточное соединение — комплексный дихлорокупрат(I)-ион [CuCl2]—. При выливании раствора, содержащего этот ион, в воду происходит осаждение хлорида меди(I). Хлорид меди(I) реагирует с концентрированным раствором аммиака, образуя комплекс диамминмеди(I) [Cu(NH3)2]+. Этот комплекс не имеет окраски в отсутствие кислорода, но в результате реакции с кислородом превращается в синее соединение.
Аналитическая химия меди
- Традиционно количественное выделение меди из слабокислых растворов проводилось с помощью сероводорода.

- В растворах, при отсутствии мешающих ионов медь может быть определена комплексонометрически или потенциометрически, ионометрически.
- Микроколичества меди в растворах определяют кинетическими методами.
Применение
В электротехнике
Из-за низкого удельного сопротивления (уступает лишь серебру), медь широко применяется в электротехнике для изготовления силовых кабелей, проводов или других проводников, например, при печатном монтаже. Медные провода, в свою очередь, также используются в обмотках энергосберегающих электроприводов (
Теплообмен
Другое полезное качество меди — высокая теплопроводность. Это позволяет применять её в различных теплоотводных устройствах, теплообменниках, к числу которых относятся и широко известные радиаторы охлаждения, кондиционирования и отопления.
Для производства труб
В связи с высокой механической прочностью, но одновременно пригодностью для механической обработки, медные бесшовные трубы круглого сечения получили широкое применение для транспортировки жидкостей и газов: во внутренних системах водоснабжения, отопления, газоснабжения, системах кондиционирования и холодильных агрегатах. В ряде стран трубы из меди являются основным материалом, применяемым для этих целей: во Франции, Великобритании и Австралии для газоснабжения зданий, в Великобритании, США, Швеции и Гонконге для водоснабжения, в Великобритании и Швеции для отопления. В России производство водопроводных труб из меди нормируется национальным стандартом ГОСТ Р 52318-2005 [3], а применение в этом качестве федеральным Сводом Правил СП 40-108-2004. Кроме того, трубопроводы из меди и сплавов меди широко используются в судостроении и энергетике для транспортировки жидкостей и пара.
В ряде стран трубы из меди являются основным материалом, применяемым для этих целей: во Франции, Великобритании и Австралии для газоснабжения зданий, в Великобритании, США, Швеции и Гонконге для водоснабжения, в Великобритании и Швеции для отопления. В России производство водопроводных труб из меди нормируется национальным стандартом ГОСТ Р 52318-2005 [3], а применение в этом качестве федеральным Сводом Правил СП 40-108-2004. Кроме того, трубопроводы из меди и сплавов меди широко используются в судостроении и энергетике для транспортировки жидкостей и пара.
Наиболее распространённые сплавы — бронза и латунь
В разнообразных областях техники широко используются сплавы с использованием меди, самыми широкораспространёнными из которых являются упоминавшиеся выше бронза и латунь. Оба сплава являются общими названиями для целого семейства материалов, куда помимо олова и цинка могут входить никель, висмут и другие металлы. Например, в состав так называемого пушечного металла, который в XVI—XVIII вв. действительно использовался для изготовления артиллерийских орудий, входят все три основных металла — медь, олово, цинк; рецептура менялась от времени и места изготовления орудия. В наше время находит применение в военном деле в кумулятивных боеприпасах благодаря высокой пластичности, большое количество латуни идёт на изготовление оружейных гильз. Медноникелевые сплавы используются для чеканки разменной монеты. Медноникелиевые сплавы, в том числе т. н. «адмиралтейский» сплав широко используются в судостроении и областях применения, связанных с возможностью агрессивного воздействия морской воды из-за образцовой коррозионной устойчивости.
действительно использовался для изготовления артиллерийских орудий, входят все три основных металла — медь, олово, цинк; рецептура менялась от времени и места изготовления орудия. В наше время находит применение в военном деле в кумулятивных боеприпасах благодаря высокой пластичности, большое количество латуни идёт на изготовление оружейных гильз. Медноникелевые сплавы используются для чеканки разменной монеты. Медноникелиевые сплавы, в том числе т. н. «адмиралтейский» сплав широко используются в судостроении и областях применения, связанных с возможностью агрессивного воздействия морской воды из-за образцовой коррозионной устойчивости.
Ювелирные сплавы
В ювелирном деле часто используются сплавы меди с золотом для увеличения прочности изделий к деформациям и истиранию, так как чистое золото очень мягкий металл и нестойко к этим механическим воздействиям.
Соединения меди
Оксиды меди используются для получения оксида иттрия бария меди YBa2Cu3O7-δ, который является основой для получения высокотемпературных сверхпроводников. Медь применяется для производства медно-окисных гальванических элементов, и батарей.
Медь применяется для производства медно-окисных гальванических элементов, и батарей.
Другие сферы применения
Медь самый широкоупотребляемый катализатор полимеризации ацетилена. Из-за этого трубопроводы из меди применять для транспортировки ацетилена можно только при содержании меди в сплаве материала труб не более 64 %.
Широко применяется медь в кровельном деле. Кровли из тонкой листовой меди из-за автозатухания процесса коррозии медного листа служат безаварийно по 100—150 лет. В России использование медного листа для кровель и фасадов нормируется федеральным Сводом Правил СП 31-116-2006 [4]
Прогнозируемым новым массовым применением меди обещает стать ее применение в качестве бактерицидных поверхностей в лечебных учереждениях для снижения внутрибольничного бактериопереноса: дверей, ручек, водозапорной арматуры, перил, поручней кроватей, столешниц — всех поверхностей, к которым прикасается рука человека.
Биологическая роль
Медь является необходимым элементом для всех высших растений и животных. В токе крови медь переносится главным образом белком церулоплазмином. После усваивания меди кишечником она транспортируется к печени с помощью альбумина. Медь встречается в большом количестве ферментов, например, в цитохром-с-оксидазе, в содержащем медь и цинк ферменте супероксид дисмутазе, и в переносящем кислород белке гемоцианине. В крови большинства моллюсков и членистоногих медь используется вместо железа для транспорта кислорода.
В токе крови медь переносится главным образом белком церулоплазмином. После усваивания меди кишечником она транспортируется к печени с помощью альбумина. Медь встречается в большом количестве ферментов, например, в цитохром-с-оксидазе, в содержащем медь и цинк ферменте супероксид дисмутазе, и в переносящем кислород белке гемоцианине. В крови большинства моллюсков и членистоногих медь используется вместо железа для транспорта кислорода.
Предполагается, что медь и цинк конкурируют друг с другом в процессе усваивания в пищеварительном тракте, поэтому избыток одного из этих элементов в пище может вызвать недостаток другого элемента. Здоровому взрослому человеку необходимо поступление меди в количестве 0,9 мг в день.
Токсичность
Некоторые соединения меди могут быть токсичны при превышении ПДК в пище и воде. Содержание меди в питьевой воде не должно превышать 2 мг/л (средняя величина за период из 14 суток), однако недостаток меди в питьевой воде также нежелателен. Всемирная Организация Здравоохранения (ВОЗ) сформулировала в 1998 году это правило так: «Риски для здоровья человека от недостатка меди в организме многократно выше, чем риски от ее избытка».
В 2003 году в результате интенсивных исследований ВОЗ пересмотрела прежние оценки токсичности меди. Было признано, что медь не является причиной расстройств пищеварительного тракта [5].
Существовали опасения, что Гепатоцеребральная дистрофия (болезнь Вильсона — Коновалова) сопровождается накоплением меди в организме, так как она не выделяется печенью в желчь. Эта болезнь вызывает повреждение мозга и печени. Однако причинно-следственная связь между возникновением заболевания и приёмом меди внутрь подтверждения не нашла[1]. Установлена лишь повышенная чувствительность лиц, в отношении которых диагностировано это заболевание к повышенному содержанию меди в пище и воде. Общее число лиц, поражённых заболеванием, например, в США, составляет ок. 35 000 человек, то есть 0,01 % от общего числа водопользователей.
Бактерицидность
Бактерицидные свойства меди и ее сплавов были известны человеку давно. В 2008 году после длительных исследований Федеральное Агентство по Охране Окружающей Среды США (US EPA) [6] официально присвоило меди и нескольким сплавам меди статус веществ с бактерицидной поверхностью [7].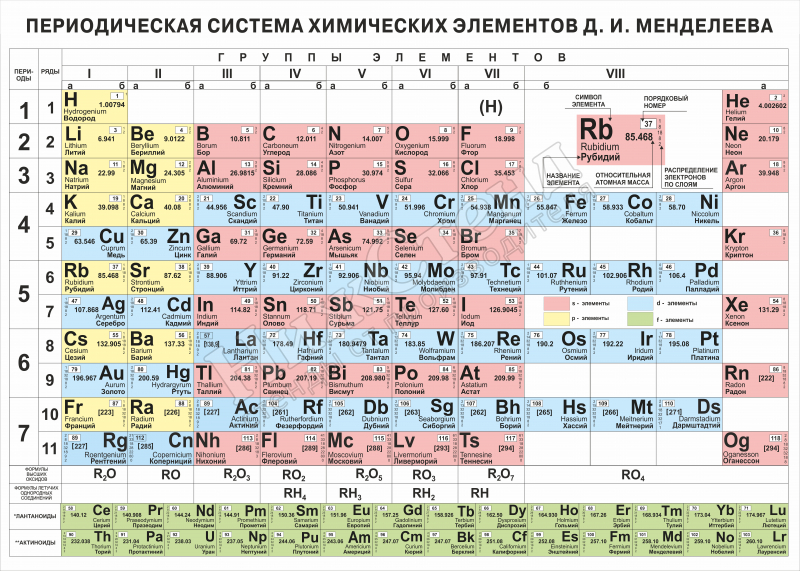 Особено выраженно бактерицидное действие поверхностей медных (и сплавов меди) проявляется в отношении метициллин-устойчивого штамма стафилококка золотистого, извесного как «супермикроб» MRSA [8]:
Особено выраженно бактерицидное действие поверхностей медных (и сплавов меди) проявляется в отношении метициллин-устойчивого штамма стафилококка золотистого, извесного как «супермикроб» MRSA [8]:
Органолептические свойства
Ионы меди придают излишку меди в воде отчётливый «металлический вкус». У разных людей порог органолептического определения меди в воде составляет приблизительно 2-10 мг/л. Естественная способность к такому определению повышенного содержания меди в воде является природным механизмом защиты от приема внутрь воды с излишним содержанием меди.
Производство, добыча и запасы меди
Мировая добыча меди в 2000 году составляла около 15 млн т., a в 2004 году — около 14 млн т. [2][3]. Мировые запасы в 2000 году составляли, по оценке экспертов, 954 млн т., из них 687 млн т. подтверждённые запасы [2], на долю России приходилось 3.2 % общих и 3.1 % подтверждённых мировых запасов [2]. Таким образом, при нынешних темпах потребления запасов меди хватит примерно на 60 лет.
Производство рафинированной меди в России в 2006 году составило 1,009 тыс. тонн, потребление — 714 тыс. тонн[4]. Основными производителями меди в России являются:
| Компания | тыс. тонн | % |
|---|---|---|
| Норильский никель | 425 | 45 % |
| Уралэлектромедь | 351 | 37 % |
| Русская медная компания | 166 | 18 % |
Как добывают медь Этот металл встречается в природе в самородном виде чаще, чем золото, серебро и железо. Нашли однажды самородок, который весил 420 т. Наверняка медь была первым металлом, с которым познакомились древние люди. Первые свои орудия делали они из кремниевой и железной руды, из меди, и уже потом научились изготовлять их из бронзы и железа. Сплав меди с оловом (бронзу) получили впервые за 3000 лет до н.э. на Ближнем Востоке. Бронза привлекала людей прочностью и хорошей ковкостью, что делало ее пригодной для изготовления орудий труда и охоты, посуды, украшений. Все эти предметы находят в археологических раскопах. Добычу меди называют прабабушкой металлургии. Ее добыча и выплавка были налажены еще в Древнем Египте, во времена фараона Рамзеса II (1300—1200 гг. до н.э.). Древние египтяне нагнетали воздух в плавильные печи с помощью мехов, а древесный уголь получали из акации и финиковой пальмы. Они выплавили около 100 т чистой меди. На территории России и сопредельных стран медные рудники появились за два тысячелетия до н.э. Остатки их находят на Урале, в Закавказье, на Украине, в Сибири, на Алтае. В XIII—XIV вв. освоили промышленную выплавку меди. В Москве в XV в. был основан Пушечный двор, где отливали из бронзы орудия разных калибров. О нем напоминает теперешняя Пушечная улица в Москве. Сейчас известно более 170 минералов, содержащих медь, но из них только 14—15 имеют промышленное значение. Это — халькопирит (он же медный колчедан), малахит, встречается и самородная медь. В медных рудах часто в качестве примесей встречаются молибден, никель, свинец, кобальт, реже — золото, серебро.
Все эти предметы находят в археологических раскопах. Добычу меди называют прабабушкой металлургии. Ее добыча и выплавка были налажены еще в Древнем Египте, во времена фараона Рамзеса II (1300—1200 гг. до н.э.). Древние египтяне нагнетали воздух в плавильные печи с помощью мехов, а древесный уголь получали из акации и финиковой пальмы. Они выплавили около 100 т чистой меди. На территории России и сопредельных стран медные рудники появились за два тысячелетия до н.э. Остатки их находят на Урале, в Закавказье, на Украине, в Сибири, на Алтае. В XIII—XIV вв. освоили промышленную выплавку меди. В Москве в XV в. был основан Пушечный двор, где отливали из бронзы орудия разных калибров. О нем напоминает теперешняя Пушечная улица в Москве. Сейчас известно более 170 минералов, содержащих медь, но из них только 14—15 имеют промышленное значение. Это — халькопирит (он же медный колчедан), малахит, встречается и самородная медь. В медных рудах часто в качестве примесей встречаются молибден, никель, свинец, кобальт, реже — золото, серебро. Обычно мед-ные руды обогащаются на фабриках, прежде чем поступают на медеплавильные комбинаты. Богаты медью Казахстан, США, Чили, Канада, африканские страны — Заир, Замбия, Южно-Африканская республика. Очень крупное Удоканское месторождение медной руды сравнительно недавно обнаружено на севере Читинской области.
Обычно мед-ные руды обогащаются на фабриках, прежде чем поступают на медеплавильные комбинаты. Богаты медью Казахстан, США, Чили, Канада, африканские страны — Заир, Замбия, Южно-Африканская республика. Очень крупное Удоканское месторождение медной руды сравнительно недавно обнаружено на севере Читинской области.
Большая часть добываемой меди используется в электротехнике, потому что медь обладает высокой электропроводностью, уступая в этом только серебру, которое, конечно, намного дороже. Миллионы километров проводов опутали земной шар, и большинство из них медные. Медь нужна для производства двигателей, телевизоров, телефонных аппаратов, различных электроприборов, автомобилей, электровозов, холодильников и даже музыкальных инструментов. Ее используют в химической промышленности для борьбы с вредителями садов и огородов, для подкормки растений и животных. Всюду нужна медь. По объему мирового производства и потребления медь занимает третье место после железа и алюминия.
Ссылки
- Медь на Webelements
- Медь в Популярной библиотеке химических элементов
- Медь в месторождениях
- Российский Центр Меди
- Некоммерческий ресурс о меди (eng)
- Химия в действии, М.
 Фримантл, том 2, изд. «Мир», М. 1991
Фримантл, том 2, изд. «Мир», М. 1991
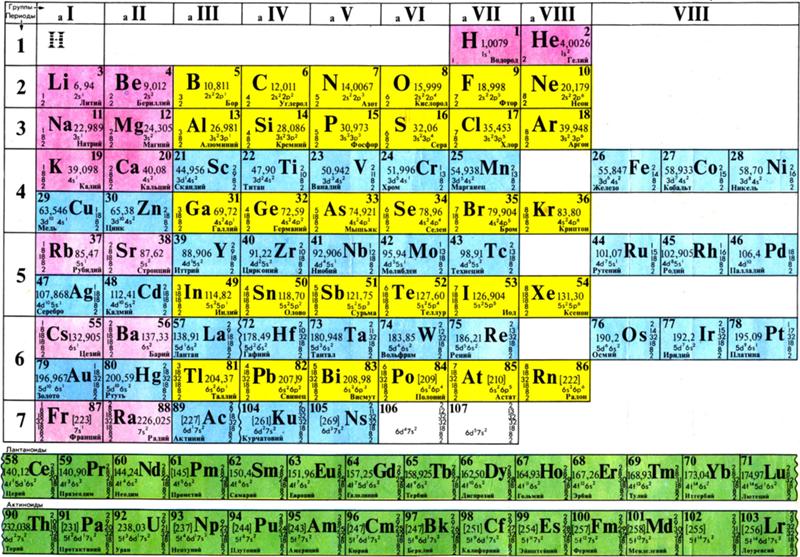
Периодическая система химических элементов Д. И. Менделеева
| H | He | ||||||||||||||||||||||
| Li | Be | B | C | N | O | F | Ne | ||||||||||||||||
| Na | Mg | Al | Si | P | S | Cl | Ar | ||||||||||||||||
| K | Ca | Sc | Ti | V | Cr | Mn | Fe | Co | Ni | Cu | Zn | Ga | Ge | As | Se | Br | Kr | ||||||
| Rb | Sr | Y | Zr | Nb | Mo | Tc | Ru | Rh | Pd | Ag | Cd | In | Sn | Sb | Te | I | Xe | ||||||
| Cs | Ba | * | Hf | Ta | W | Re | Os | Ir | Pt | Au | Hg | Tl | Pb | Bi | Po | At | Rn | ||||||
| Fr | Ra | ** | Rf | Db | Sg | Bh | Hs | Mt | Ds | Rg | Uub | Uut | Uuq | Uup | Uuh | Uus | Uuo | ||||||
| Uue | Ubn | ||||||||||||||||||||||
| * | La | Ce | Pr | Nd | Pm | Sm | Eu | Gd | Tb | Dy | Ho | Er | Tm | Yb | Lu | ||||||||
| ** | Ac | Th | Pa | U | Np | Pu | Am | Cm | Bk | Cf | Es | Fm | Md | No | Lr | ||||||||
Примечания
- ↑ [1]
- ↑ 1 2 3 http://www.
 ecsocman.edu.ru/db/msg/142462.html
ecsocman.edu.ru/db/msg/142462.html - ↑ http://www.metalinfo.ru/ru/news/12150
- ↑ Минпромэнерго РФ, «Стратегия развития металлургической промышленности Российской Федерации на период до 2015 года» [2]
Влияние химических элементов на свойства стали.
Условные обозначения химических элементов:
| хром ( Cr ) — Х никель ( Ni ) — Н молибден ( Mo ) — М титан ( Ti ) — Т медь ( Cu ) — Д ванадий ( V ) — Ф вольфрам ( W ) — В | азот ( N ) — А алюминий ( Аl ) — Ю бериллий ( Be ) — Л бор ( B ) — Р висмут ( Вi ) — Ви галлий ( Ga ) — Гл | иридий ( Ir ) — И кадмий ( Cd ) — Кд кобальт ( Co ) — К кремний ( Si ) — C магний ( Mg ) — Ш марганец ( Mn ) — Г | свинец ( Pb ) — АС ниобий ( Nb) — Б селен ( Se ) — Е углерод ( C ) — У фосфор ( P ) — П цирконий ( Zr ) — Ц |
ВЛИЯНИЕ ПРИМЕСЕЙ НА СТАЛЬ И ЕЕ СВОЙСТВА
Углерод — находится в стали обычно в виде химического соединения Fe3C, называемого цементитом.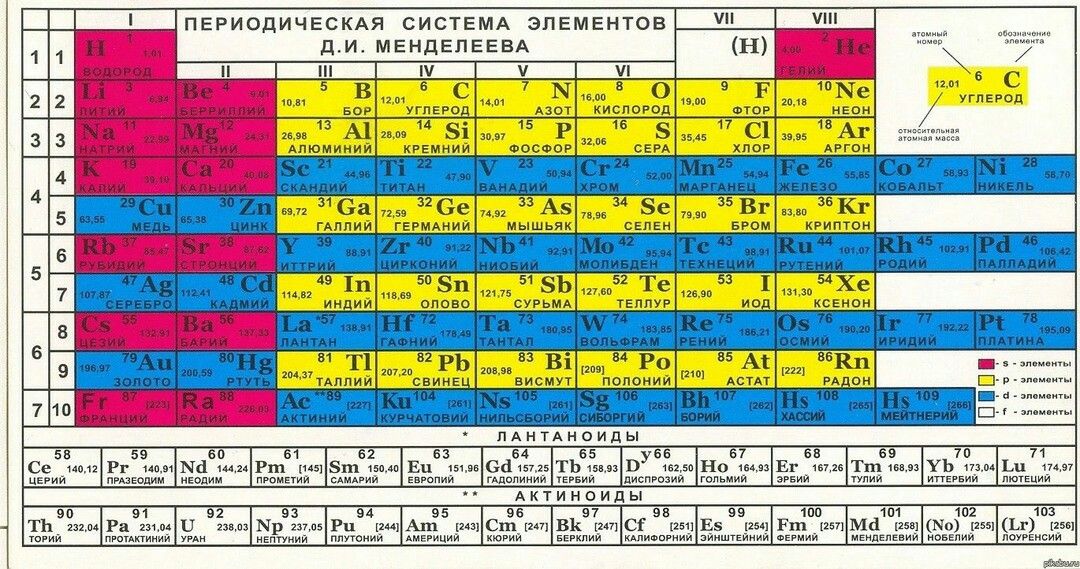 С увеличением содержания углерода до 1,2% твердость, прочность и упругость стали увеличиваются, но пластичность и сопротивление удару понижаются, а обрабатываемость ухудшается, ухудшается и свариваемость.
С увеличением содержания углерода до 1,2% твердость, прочность и упругость стали увеличиваются, но пластичность и сопротивление удару понижаются, а обрабатываемость ухудшается, ухудшается и свариваемость.
Кремний — если он содержится в стали в небольшом количестве, особого влияния на ее свойства не оказывает.(Полезная примесь; вводят в качестве активного раскислителя и остается в стали в кол-ве 0,4%)
Марганец — как и кремний, содержится в обыкновенной углеродистой стали в небольшом количестве и особого влияния на ее свойства также не оказывает. (Полезная примесь; вводят в сталь для раскисления и остается в ней в кол-ве 0,3-0,8%. Марганец уменьшает вредное влияние кислорода и серы.
Сера — является вредной примесью. Она находится в стали главным образом в виде FeS. Это соединение сообщает стали хрупкость при высоких температурах, например при ковке, — свойство, которое называется красноломкостью. Сера увеличивает истираемость стали, понижает сопротивление усталости и уменьшает коррозионную стойкость. В углеродистой стали допускается серы не более 0,06-0,07%. ( От красноломкости сталь предохраняет марганец, который связывает серу в сульфиды MnS).
В углеродистой стали допускается серы не более 0,06-0,07%. ( От красноломкости сталь предохраняет марганец, который связывает серу в сульфиды MnS).
Фосфор — также является вредной примесью. Снижает вязкость при пониженных температурах, то есть вызывает хладноломкость. Обрабатываемость стали фосфор несколько улучшает, так как способствует отделению стружки.
ЛЕГИРУЮЩИЕ ЭЛЕМЕНТЫ И ИХ ВЛИЯНИЕ НА СВОЙСТВА СТАЛИ
Хром (Х) — наиболее дешевый и распространенный элемент. Он повышает твердость и прочность, незначительно уменьшая пластичность, увеличивает коррозионную стойкость; содержание больших количеств хрома делает сталь нержавеющей и обеспечивает устойчивость магнитных сил.
Никель (Н) — сообщает стали коррозионную стойкость, высокую прочность и пластичность, увеличивает прокаливаемость, оказывает влияние на изменение коэффициента теплового расширения. Никель – дорогой металл, его стараются заменить более дешевым.
Вольфрам (В) — образует в стали очень твердые химические соединения – карбиды, резко увеличивающие твердость и красностойкость. Вольфрам препятствует росту зерен при нагреве, способствует устранению хрупкости при отпуске. Это дорогой и дефицитный металл.
Ванадий (Ф) — повышает твердость и прочность, измельчает зерно. Увеличивает плотность стали, так как является хорошим раскислителем, он дорог и дефицитен.
Кремний (С)- в количестве свыше 1% оказывает особое влияние на свойства стали: содержание 1-1,5% Si увеличивает прочность, при этом вязкость сохраняется. При большем содержании кремния увеличивается электросопротивление и магнитопроницаемость. Кремний увеличивает также упругость, кислостойкость, окалиностойкость.
Марганец (Г) — при содержании свыше 1% увеличивает твердость, износоустойчивость, стойкость против ударных нагрузок, не уменьшая пластичности.
Кобальт (К) — повышает жаропрочность, магнитные свойства, увеличивает сопротивление удару.
Молибден (М) — увеличивает красностойкость, упругость, предел прочности на растяжение, антикоррозионные свойства и сопротивление окислению при высоких температурах.
Титан (Т) — повышает прочность и плотность стали, способствует измельчению зерна, является хорошим раскислителем, улучшает обрабатываемость и сопротивление коррозии.
Ниобий (Б) — улучшает кислостойкость и способствует уменьшению коррозии в сварных конструкциях.
Алюминий (Ю) — повышает жаростойкость и окалиностойкость.
Медь (Д) — увеличивает антикоррозионные свойства, она вводится главным образом в строительную сталь.
Церий — повышает прочность и особенно пластичность.
Цирконий (Ц) — оказывает особое влияние на величину и рост зерна в стали, измельчает зерно и позволяет получать сталь с заранее заданной зернистостью.
Лантан, цезий, неодим — уменьшают пористость, способствуют уменьшению содержания серы в стали, улучшают качество поверхности, измельчают зерно.
меди | Использование, свойства и факты
медь
Посмотреть все СМИ
- Ключевые люди:
- Джеймс Дуглас Маркус Дейли Уильям Э. Додж Сэр Честер Битти Йохан Готлиб Ган
- Похожие темы:
- обработка меди солнечная батарея CIGS нейзильбер медная работа медно-порфировое месторождение
Просмотреть весь соответствующий контент →
Резюме
Прочтите краткий обзор этой темы
Следуйте за медью из сырой породы в карьерах для плавки, преобразования и рафинирования в анодные пластины
Просмотреть все видео для этой статьи медь (Cu) , химический элемент, красноватый, чрезвычайно пластичный металл группы 11 ( Ib) таблицы Менделеева, который является необычно хорошим проводником электричества и тепла. Медь встречается в природе в свободном металлическом состоянии. Эта самородная медь была впервые использована (ок. 8000 г. до н.э.) в качестве заменителя камня людьми эпохи неолита (новый каменный век). Металлургия зародилась в Месопотамии, когда медь отливали в формах (ок. 4000 г. до н. э.), превращали в металл из руд с помощью огня и древесного угля и преднамеренно сплавляли с оловом в виде бронзы (ок. 3500 г. до н. э.). Римские поставки меди почти полностью происходили с Кипра. Он был известен как aes Cyprium , «кипрский металл», сокращенный до cyprium , а затем преобразованный в cuprum . См. также бронзу .
8000 г. до н.э.) в качестве заменителя камня людьми эпохи неолита (новый каменный век). Металлургия зародилась в Месопотамии, когда медь отливали в формах (ок. 4000 г. до н. э.), превращали в металл из руд с помощью огня и древесного угля и преднамеренно сплавляли с оловом в виде бронзы (ок. 3500 г. до н. э.). Римские поставки меди почти полностью происходили с Кипра. Он был известен как aes Cyprium , «кипрский металл», сокращенный до cyprium , а затем преобразованный в cuprum . См. также бронзу .
| atomic number | 29 |
|---|---|
| atomic weight | 63.546 |
| melting point | 1,083 °C (1,981 °F) |
| boiling point | 2,567 ° C (4653 °F) |
| плотность | 8.96 at 20 °C (68 °F) |
| valence | 1, 2 |
| electron configuration | 2-8-18-1 or (Ar)3 d 10 4 s 1 |
Самородная медь встречается во многих местах как первичный минерал в базальтовых лавах, а также в виде восстановленных соединений меди, таких как сульфиды, арсениды, хлориды и карбонаты. (О минералогических свойствах меди см. таблица самородных элементов.) Медь встречается в сочетании со многими минералами, такими как халькозин, халькопирит, борнит, куприт, малахит и азурит. Он присутствует в золе водорослей, во многих морских кораллах, в печени человека, во многих моллюсках и членистоногих. Медь играет такую же роль транспорта кислорода в гемоцианине голубокровных моллюсков и ракообразных, как железо в гемоглобине краснокровных животных. Медь, присутствующая в организме человека в качестве микроэлемента, помогает катализировать образование гемоглобина. Медно-порфировое месторождение в Андах Чили является крупнейшим известным месторождением этого минерала. К началу 21 века Чили стала ведущим мировым производителем меди. Другими крупными производителями являются Перу, Китай и США.
(О минералогических свойствах меди см. таблица самородных элементов.) Медь встречается в сочетании со многими минералами, такими как халькозин, халькопирит, борнит, куприт, малахит и азурит. Он присутствует в золе водорослей, во многих морских кораллах, в печени человека, во многих моллюсках и членистоногих. Медь играет такую же роль транспорта кислорода в гемоцианине голубокровных моллюсков и ракообразных, как железо в гемоглобине краснокровных животных. Медь, присутствующая в организме человека в качестве микроэлемента, помогает катализировать образование гемоглобина. Медно-порфировое месторождение в Андах Чили является крупнейшим известным месторождением этого минерала. К началу 21 века Чили стала ведущим мировым производителем меди. Другими крупными производителями являются Перу, Китай и США.
Медь в промышленных масштабах производится в основном путем плавки или выщелачивания, обычно с последующим электроосаждением из сульфатных растворов. Подробное описание производства меди см.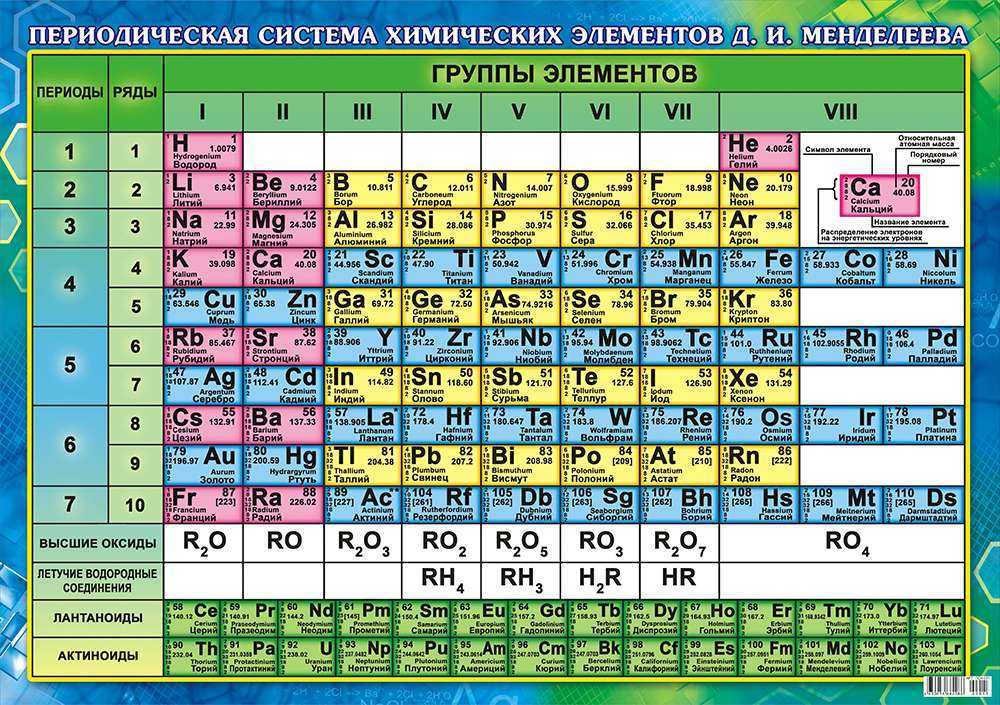 в разделе обработка меди. Большая часть производимой в мире меди используется электротехнической промышленностью; большая часть остатка соединяется с другими металлами, образуя сплавы. (Это также технологически важно в качестве гальванического покрытия.) Важными сериями сплавов, в которых медь является основным компонентом, являются латуни (медь и цинк), бронзы (медь и олово) и мельхиоры (медь, цинк и никель, нет). Серебряный). Есть много полезных сплавов меди и никеля, в том числе монель; два металла полностью смешиваются. Медь также образует важную серию сплавов с алюминием, называемых алюминиевыми бронзами. Бериллиевая медь (2 процента бериллия) — необычный медный сплав, который можно упрочнить термической обработкой. Медь входит в состав многих монетных металлов. Долгое время после того, как бронзовый век перешел в железный век, медь оставалась вторым металлом по использованию и важности после железа. К 19Однако к 60-м годам более дешевый и доступный алюминий отодвинулся на второе место в мировом производстве.
в разделе обработка меди. Большая часть производимой в мире меди используется электротехнической промышленностью; большая часть остатка соединяется с другими металлами, образуя сплавы. (Это также технологически важно в качестве гальванического покрытия.) Важными сериями сплавов, в которых медь является основным компонентом, являются латуни (медь и цинк), бронзы (медь и олово) и мельхиоры (медь, цинк и никель, нет). Серебряный). Есть много полезных сплавов меди и никеля, в том числе монель; два металла полностью смешиваются. Медь также образует важную серию сплавов с алюминием, называемых алюминиевыми бронзами. Бериллиевая медь (2 процента бериллия) — необычный медный сплав, который можно упрочнить термической обработкой. Медь входит в состав многих монетных металлов. Долгое время после того, как бронзовый век перешел в железный век, медь оставалась вторым металлом по использованию и важности после железа. К 19Однако к 60-м годам более дешевый и доступный алюминий отодвинулся на второе место в мировом производстве.
| страна | добыча на руднике в 2016 г. (метрические тонны)* | % мировой добычи полезных ископаемых | доказанные запасы 2016 г. (метрические тонны)* | % мировых доказанных запасов |
|---|---|---|---|---|
| *Оцененный. | ||||
| ** Из-за округления данные не складываются в общую сумму. | ||||
| Источник: Министерство внутренних дел США, Сводные данные о минеральном сырье, 2017 г. | ||||
| Чили | 5 500 000 | 28,4 | 210 000 000 | 29,2 |
| Перу | 2 300 000 | 11,9 | 81 000 000 | 11. 3 3 |
| Китай | 1 740 000 | 9,0 | 28 000 000 | 3,9 |
| Соединенные Штаты | 1 410 000 | 7.3 | 35 000 000 | 4.9 |
| Австралия | 970 000 | 5,0 | 89 000 000 | 12,4 |
| Конго (Киншаса) | 910 000 | 4.7 | 20 000 000 | 2,8 |
| Замбия | 740 000 | 3,8 | 20 000 000 | 7. 4 4 |
| Канада | 720 000 | 3,7 | 11 000 000 | 1,5 |
| Россия | 710 000 | 3,7 | 30 000 000 | 4.2 |
| Мексика | 620 000 | 3.2 | 46 000 000 | 6.4 |
| другие страны | 3 800 000 | 19,6 | 150 000 000 | 20,8 |
| мировой итог | 19 400 000** | 100** | 720 000 000 | 100** |
Медь — один из самых пластичных металлов, не особо прочный и твердый. Прочность и твердость заметно увеличиваются при холодной обработке из-за образования удлиненных кристаллов той же гранецентрированной кубической структуры, которая присутствует в более мягкой отожженной меди. Обычные газы, такие как кислород, азот, двуокись углерода и двуокись серы, растворяются в расплавленной меди и сильно влияют на механические и электрические свойства затвердевшего металла. Чистый металл уступает только серебру по тепло- и электропроводности. Природная медь представляет собой смесь двух стабильных изотопов: меди-63 (690,15%) и меди-65 (30,85%).
Прочность и твердость заметно увеличиваются при холодной обработке из-за образования удлиненных кристаллов той же гранецентрированной кубической структуры, которая присутствует в более мягкой отожженной меди. Обычные газы, такие как кислород, азот, двуокись углерода и двуокись серы, растворяются в расплавленной меди и сильно влияют на механические и электрические свойства затвердевшего металла. Чистый металл уступает только серебру по тепло- и электропроводности. Природная медь представляет собой смесь двух стабильных изотопов: меди-63 (690,15%) и меди-65 (30,85%).
Britannica Викторина
118 Названия и символы периодической таблицы Викторина
Элементарная викторина по фундаментальным вопросам.
Поскольку медь находится ниже водорода в электродвижущем ряду, она не растворяется в кислотах с выделением водорода, хотя будет реагировать с окисляющими кислотами, такими как азотная и горячая концентрированная серная кислота. Медь противостоит действию атмосферы и морской воды. Однако длительное воздействие воздуха приводит к образованию тонкого зеленого защитного покрытия (патины), которое представляет собой смесь гидроксокарбоната, гидроксосульфата и небольшого количества других соединений. Медь является умеренно благородным металлом, не подверженным влиянию неокисляющих или не образующих комплексов разбавленных кислот в отсутствие воздуха. Однако он легко растворяется в азотной и серной кислотах в присутствии кислорода. Он также растворим в водном аммиаке или цианиде калия в присутствии кислорода из-за образования при растворении очень устойчивых цианокомплексов. Металл будет реагировать при красном калении с кислородом с образованием оксида меди CuO, а при более высоких температурах — оксида меди Cu9.0293 2 O. Реагирует при нагревании с серой с образованием сульфида меди Cu 2 S.
Однако длительное воздействие воздуха приводит к образованию тонкого зеленого защитного покрытия (патины), которое представляет собой смесь гидроксокарбоната, гидроксосульфата и небольшого количества других соединений. Медь является умеренно благородным металлом, не подверженным влиянию неокисляющих или не образующих комплексов разбавленных кислот в отсутствие воздуха. Однако он легко растворяется в азотной и серной кислотах в присутствии кислорода. Он также растворим в водном аммиаке или цианиде калия в присутствии кислорода из-за образования при растворении очень устойчивых цианокомплексов. Металл будет реагировать при красном калении с кислородом с образованием оксида меди CuO, а при более высоких температурах — оксида меди Cu9.0293 2 O. Реагирует при нагревании с серой с образованием сульфида меди Cu 2 S.
Факты, символы, свойства, соединения, применение
Факты о меди
Медь — химический элемент или коричневый переходный металл группы 11 или IB периодической таблицы с символом Cu и атомным номером 29.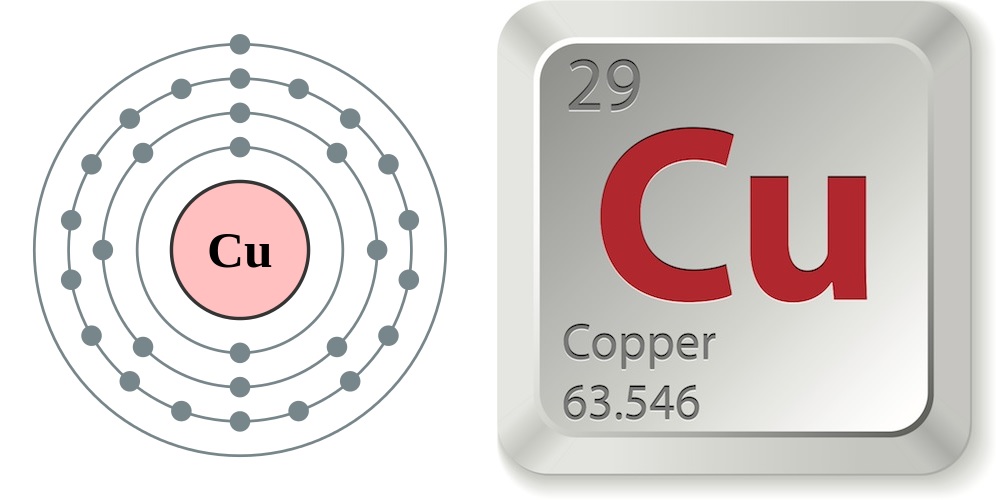 Это мягкий, прочный и блестящий металл с высокой тепло- и электропроводностью. Медь помогает в образовании гемоглобина (переносчика кислорода) в организме животного.
Это мягкий, прочный и блестящий металл с высокой тепло- и электропроводностью. Медь помогает в образовании гемоглобина (переносчика кислорода) в организме животного.
Металл образует гранецентрированную кубическую кристаллическую решетку. Он встречается в нашей среде в виде свободного металлического состояния или легко извлекаемых руд.
Бронза, сплав меди и олова, используется человечеством в истории с бронзового века. Медь содержится в гемоцианине в крови каракатиц и таких растениях, как зеленый горошек.
Кто открыл медь?
Археологическое открытие острова, а именно Кипра в восточной части Средиземного моря, славится своими медными рудниками. Название меди происходит от латинского названия Cuprum через Cyprium.
Свойства меди
В химии физические и химические свойства монет или благородных металлов, таких как Cu, Ag и Au, очень похожи.
| Медь | |||
| Химический символ | Медь | ||
| Дискавери | Историческая эпоха | ||
| Название производное от | Староанглийское слово coper и латинское слово Cyprium aes, означающее металл с Кипра | ||
| Основной изотоп | 29 Медь 63 | ||
| Степени окисления | +1 и +2 | ||
| Номер CAS | 7440-50-8 | ||
| Периодические свойства | |||
| Атомный номер | 29 | ||
| Атомный вес | 63,546 | ||
| Электрон на оболочку | 2, 8, 18, 1 | ||
| Электронная конфигурация | [Ar] 3d 10 4s 1 | ||
| Группа | 11 | ||
| Период | 4 | ||
| Блок | d-блок | ||
| Физические свойства | |||
| Состояние при 20 °C | Твердый | ||
| Место встречи | 1084,6 °С | ||
| Точка кипения | 2560 °С | ||
| Плотность | 8,95 г/см 3 | ||
| Молярная теплоемкость | 24,440 Дж моль -1 К -1 | ||
| Кристаллическая структура | гранецентрированная кубическая (ГЦК) | ||
| Удельное электрическое сопротивление | 16,78 нОм·м | ||
| Атомные свойства | |||
| Атомный радиус (несвязанный) | 1,96 Å | ||
| Ковалентный радиус | 1,22 Å | ||
| Электроотрицательность | 1,90 (шкала Полинга) | ||
| Сродство к электрону | 119,16 кДж моль −1 | ||
| Энергия ионизации (кДж моль −1 ) | 1-й | 2-й | 3-й |
| 745,48 | 1957,92 | 3554,61 | |
Медь в таблице Менделеева
Валютный металл, медь, серебро и золото помещаются в группу-11 или группу-1B периодической таблицы.
Все эти металлы содержат электронную конфигурацию валентной оболочки ns 1 (n−1)d 10 с заполненной d подоболочкой. Из-за наличия не полностью заполненной d-подоболочки в степени окисления +2 или +3 они называются переходными металлами.
Химические свойства
В ранней менделеевской чеканке периодической таблицы такие металлы, как Cu, Ag и Au, помещаются рядом с щелочными металлами. И щелочной металл, и металл для денег или монет имеют один электрон на самой внешней s-орбитали, а +1 является обычной степенью окисления или состоянием.
Физические и химические свойства этих двух семейств сильно различаются. Щелочные металлы представляют собой мягкие низкоплавкие высокоэлектроположительные элементы, в то время как чеканные или благородные металлы представляют собой относительно тугоплавкие и сравнительно менее электроположительные металлы. Поэтому монетные металлы помещены в группу 11 современной периодической таблицы.
Металлы 11 группы имеют высокую энергию первой ионизации и меньшие ионные радиусы. Участие d-электронов в металлической связи влияет на более высокую температуру плавления меди.
Участие d-электронов в металлической связи влияет на более высокую температуру плавления меди.
Ион Cu(II) более стабилен, чем ион Cu(I) в водном растворе. Это связано с небольшим размером и, следовательно, чрезвычайно высокой энергией гидратации Cu (II) по сравнению с Cu (I), которая компенсирует вторую энергию ионизации меди.
Где добывают медь?
Медь присутствует в земной коре в количестве 68 частей на миллион, что немного меньше, чем у никеля.
Самородная медь (минералы базальтовых листьев) и восстановленная форма соединений металлов, таких как сульфиды, карбонаты, арсениды и хлориды, обнаружены в различных местах мира.
В основном встречается в Северной и Южной Америке, Чили (ведущий мировой производитель), Конго и российских округах. В Индии два основных месторождения медной руды находятся в Бихаре (Сингбхум) и Раджастхане (Алвар, Аджмер и Кхетри).
Медные руды
Основные руды металлов указаны ниже в таблице,
| Медная руда | Химическая формула |
| Халькопирит | КуФеС 2 |
| Куприт | Медь 2 О |
| Ковеллит | CuS |
| Халькоцит | Медь 2 С |
| Малахит | [CuCO 3 , Cu(OH) 2 ] |
| Борнит | 2 Cu 2 S, CuS, FeS |
| Дигенит | Медь 9 С 5 |
| Диоптаза | CuSiO 2 (ОН) 2 |
Процесс извлечения меди
Медь извлекается главным образом из сульфидной руды в процессе самовосстановления.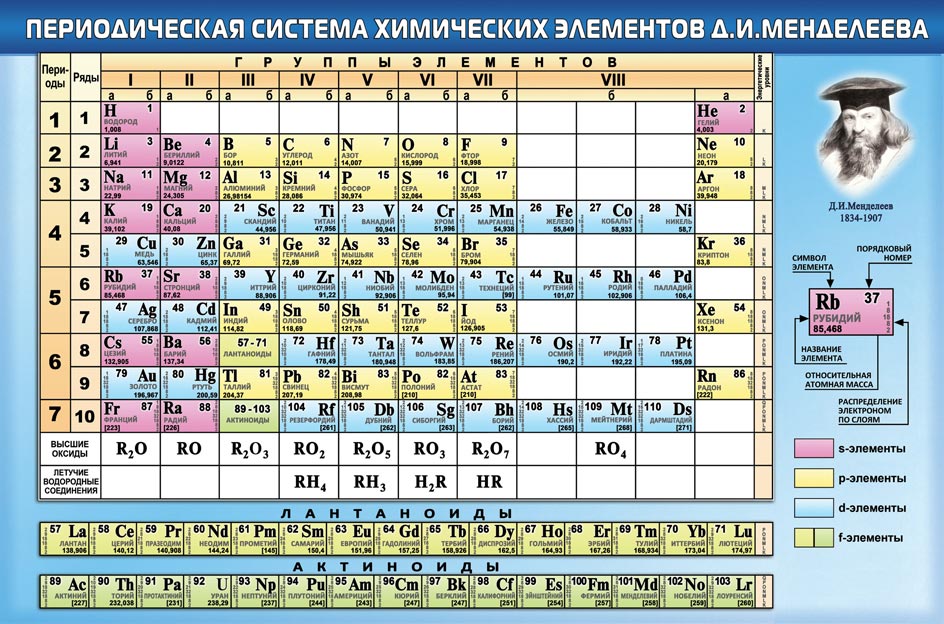 Низкое качество (0,5 процента меди) превращается в высокое качество (15-20 процентов меди) для высокой производительности металла. Для этого используется процесс пенной флотации.
Низкое качество (0,5 процента меди) превращается в высокое качество (15-20 процентов меди) для высокой производительности металла. Для этого используется процесс пенной флотации.
Основными стадиями извлечения меди являются,
Плавка меди
Руда обжигается и плавится (около 1400 °С) с добавлением кремнезема в отражательной печи. FeS предпочтительно окисляется до Cu 2 S из-за более основных свойств железа.
Оксид железа образует заготовку с кремнеземом. Расплавленная масса отделяется для образования верхнего слоя. Нижний слой содержит медный штейн (Cu 2 S и FeS).
Самовосстановление
- Расплавленный штейн дополнительно окисляется воздухом для окисления оставшегося железа.
- Добавляется больше кремнезема, который образует шлак, содержащий оксид железа.
- После удаления шлака сульфид металла окисляется воздухом с образованием Cu 2 O, который в сочетании с оставшейся Cu 2 S образует медь путем самовосстановления.

Cu 2 S + 2 Cu 2 O → 6 Cu + SO 2
Рафинирование меди электролизом
Сырой металл очищают электролизом в ванне с подкисленным раствором сульфата с использованием сырой меди в качестве анода и чистой меди в качестве катода. Примеси из анода используются для извлечения золота, серебра и платины.
Химические соединения
В состояниях +1 или +2 медь образует различные типы оксидов, гидроксидов, галогенидов, сульфатов, карбонатов, нитратов и комплексных соединений.
Степень окисления меди
Степень Cu (II) является основной степенью окисления металлической меди с конфигурацией d 9 . Cu (I) имеет замкнутую конфигурацию 3d 10 и хорошо стабилизируется по обменной энергии.
Твердые соединения в состоянии +1 термодинамически стабильны при умеренной температуре. Следовательно, Cu 2 O образуется при высоких температурах из CuO, а CuBr 2 разлагается при нагревании с образованием CuBr.
Большое количество химических соединений образуется в состояниях +1 и +2 металлической меди.
Cu (III) является изоэлектронным с никелем (II), но в этом состоянии известно лишь несколько соединений.
Оксиды меди
Оксиды меди существуют в двух формах: черный оксид меди (CuO) и красный оксид меди (Cu 2 O) со степенями окисления +2 и +1 соответственно.
- Оксид черного цвета (CuO) образуется при нагревании Cu с кислородом. Термическое разложение карбоната, нитрата или гидроксида — лучший способ получения оксида меди.
- Красный оксид Cu (I) или оксид меди (Cu 2 O) образуется при восстановлении щелочных растворов Cu (II) мягкими восстановителями, такими как глюкоза. Встречается в природе в виде куприта и используется для изготовления рубинового стекла.
Гидроксид меди (II)
Синий осадок гидроксида меди (II) получают добавлением щелочи к водному раствору Cu(II). Осадок темнеет при стоянии из-за дегидратации гидроксида до оксида. Он растворяется в щелочи с образованием [Cu(OH) 4 ] −2 .
Он растворяется в щелочи с образованием [Cu(OH) 4 ] −2 .
В растворе аммиака образует темно-синий цвет [Cu(NH 3 ) 4 (H 2 O) 2 ] +2 . Темно-синий раствор называется реактивом Швейцера. Он используется для растворения целлюлозы и изготовления купраммониевой вискозы.
Галогениды меди
Только белый фторид, желтый хлорид и черный бромид известны в степени окисления +2. Благодаря восстановительным свойствам йод восстанавливает CuI 2 до Cu 2 я 2 .
Гидратированные галогениды получают растворением CuCO 3 или Cu(OH) 2 в галогеноводородах. CuF плохо охарактеризован.
Другие галогениды Cu (I) представляют собой бесцветные твердые вещества, нерастворимые в воде. Хлорид меди получают восстановлением меди (II) металлической медью или диоксидом серы в соляной кислоте.
Сульфат и нитрат
Сульфат меди (CuSO 4 , 5H 2 O) получают растворением металлолома в разбавленной серной кислоте в присутствии воздуха и кристаллизацией.
Нитрат получают в виде темно-синего расплывающегося кристаллического твердого вещества Cu(NO 3 ) 3 , 3H 2 O под действием азотной кислоты в растворе Cu (II).
Соединения меди (III)
Из-за большего размера и более высокого значения суммы первой, второй и третьей энергии ионизации Cu (III) образует несколько химических соединений.
Простых образцов галогенидов нет, но бледно-зеленый K 3 CuF 6 может быть получен действием фтора в смеси хлорида калия и CuCl 2 при 250 °С.
Твердое соединение купрата (III), подобное KCuO 2 , образуется при нагревании смеси CuO с супероксидом щелочного металла в присутствии молекулы кислорода.
Использование меди
- Медь является хорошим проводником электричества и широко используется в производстве проводов, кабелей, генераторов, трансформаторов, двигателей и любого другого электрического оборудования.
- Также используется для изготовления посуды, трубок и денежных монет.

- Медные сплавы, такие как латунь, бронза, константан, манганин и монал, широко используются в различных бытовых и промышленных целях благодаря их высокой механической прочности и коррозионной стойкости.
Использование медных сплавов
Латунь представляет собой сплав меди. Его получают путем сплавления меди с цинком и другими металлами, такими как алюминий, никель и свинец.
Как правило, он содержит от 57 до 97 процентов меди, а остальную часть составляет цинк или другие металлы, которые изменяют механическую прочность и химические свойства.
Латунь в основном используется в бытовом оборудовании, статуях, судовых гребных винтах и подшипниках.
| Медный сплав | |
| Сплав | Состав |
| Латунь | 70 % Cu и 30 % Zn |
| Металл Muntz | 60 % Cu и 40 % Zn |
| Дельта-металл | 55 % Cu, 40 % Zn и 5 % Fe |
Дельта-металл твердый как сталь и устойчив к морской воде.

 Фримантл, том 2, изд. «Мир», М. 1991
Фримантл, том 2, изд. «Мир», М. 1991 ecsocman.edu.ru/db/msg/142462.html
ecsocman.edu.ru/db/msg/142462.html
