Водородный электрод — Справочник химика 21
Для второго из выбранных объектов, т. е. для железа, стандартный электродный потенциал равен —0,44 В. Поэтому здесь, так же как и в случае цинка, следует считаться с реакцией выделения водорода, и, следовательно, условия стационарности будут заданы уравнением (24.2). Однако в отличие от цинка здесь совершенно иное соотношение токов обмена металла и водорода. Ток обмена железа имеет порядок 10 з А-см- , а для водорода на железном электроде в кислых растворах он достигает А-см 2. Можно ожидать поэтому, что стационарный потенциал железа в условиях кислотной коррозии должен заметно отличаться от его обратимого потенциала он будет смещен в сторону положительных значений, г. е. в направлении равновесного потенциала водородного электрода. Этот вывод согласуется с экспериментальными данными и находит дополнительное подтверждение в том, что железо ведет себя в некоторых интервалах pH подобно водородному электроду. Скорость коррозии железа также можно вычислить, если только известны его стационарный потенциал и перенапряжение водорода на нем.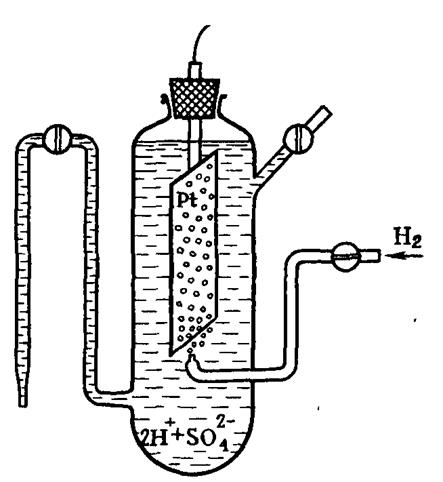
Стандартный потенциал пары Сс1 /Сс1 правей —0,40 в. Какие электрохимические процессы будут происходить при работе гальванического элемента, построенного из этой пары и нормального водородного электрода Составьте общее уравнение реакции. [c.376]
Из выражений (7.44) и (7.45) видно, что потенциал водородного электрода определяется не только активностью водородных ионов, но и парциальным давлением газообразного водорода. Следовательно, водородный электрод (так же как и другие газовые электроды) более сложный, чем электроды первого или второго рода, потенциалы которых зависят непосредственно от активности одного сорта частиц. Согласно определ гнию условной шкалы электродных потенциалов стандартный потенциал водородного электрода н+ 112 температурах принято равным нулю, поэтому
Отрицательным полюсом такого элемента является стандартный водородный электрод, положительным полюсом — платиновый электрод на первом происходит процесс отдачи электронов молекулами Нг платине, т. е. реакция окисления их до Н+
е. реакция окисления их до Н+
Из металлов первой электрохимической группы наиболее полно изучена платина, хотя из-за высокой чувствительности ее водородного потенциала к примесям полученные данные не отличаются хорошей воспроизводимостью. Н( сомненно, что в области положительных потенциалов (не очень удаленных от обратимого потенциала водородного электрода) на поверхности платины всегда присутствует адсорбированный водород. Это установлено измерением мкости, а также другими методами. Так, количество адсорбированного водорода можно найти для каждого значения потенциала при помощи кривых заряжения, т. е. кривых, передающих изменение потенциала электрода с количеством подведенного электричества чли (при постоянной силе тока) с течением времени. При таком кулонометрическом определении количества водорода (или иного электрохимически активного вещества) необходимо, чтобы его выделение (или растворение) совершалось со 100%-ным выходом по току. Все возможные побочные реакции — электровосстановление или выделение кислорода, катодное восстановление или анодное окисление органических веществ и других примесей — должны быть полностью исключены.
Потенциал стандартного водородного электрода условно принят равным нулю. [c.346]
Вели вместо пары РеЗ+/Ре2+ скомбинировать стандартный водородный электрод с парой С12/2С1 , то получится элемент, работу которого можно изобразить схемой [c.347]
В скобках дано значение термического температурного коэффициента потенциала стандартного водородного электрода. [c.180]
Точно так же, поскольку стандартный потенциал редокси-системы Т 2+, Т1 + значительно отрицательнее потенциала водородного электрода ( т 2+, Т1 +=—0,37 В), в водных растворах солей титаиа (II) должио самопроизвольно протекать окисление ионов Т12+ до понов Т1 + с одновременным раз [0жением воды  185]
185]
Элемент составлен из стандартного водородного электрода и пары Ni2+/Ni при концентрации Ni , равной 0,01 г-ион/л, он имеет э. д. с., равную-0,192 в, причем никелевый электрод играет роль отрицательного полюса. Определить стандартный потенциал пары Ni +/Ni. [c.377]
При определении стандартного потенциала какой-либо данной пары, например Fe VFe2+, ее комбинируют со стандартным водородным электродом в гальванический элемент, как показано на рис. 56.
Сдвоенные химические цепи. В сдвоенных химических цепях две простые химические цепи, отличающиеся лишь активностью электролита, имеют один общий электрод и, таким образом, электрически соединены через проводник первого рода в единую цепь. Так, например, простые цепи с хлорсеребряным и водородным электродами можно превратить в сдвоенную цепь с общим водородным электродом [c.204]
Знак плюс показывает, что данная пара играет при комбинировании ее со стандартным водородным электродом роль положительного полюса.
Водородный электрод. Газовый водородный электрод можно представить схемой [c.166]
Измайлов предложил пользоваться для всех растворителей единой водородной шкалой. Он определил разность теплот сольватации иона водорода при переходе от одного растворителя к другому и вычислил разницу в стандартных потенциалах водородного электрода в соответствующих растворителях. Полученные им данные, характеризующие влияние растворителя на потенциалы ряда электродов, приведены в табл. 10.3.
Все электроды с потенциалом более отрицательным, чем потенциал водородного электрода, в водных растворах термодинамически неустойчивы.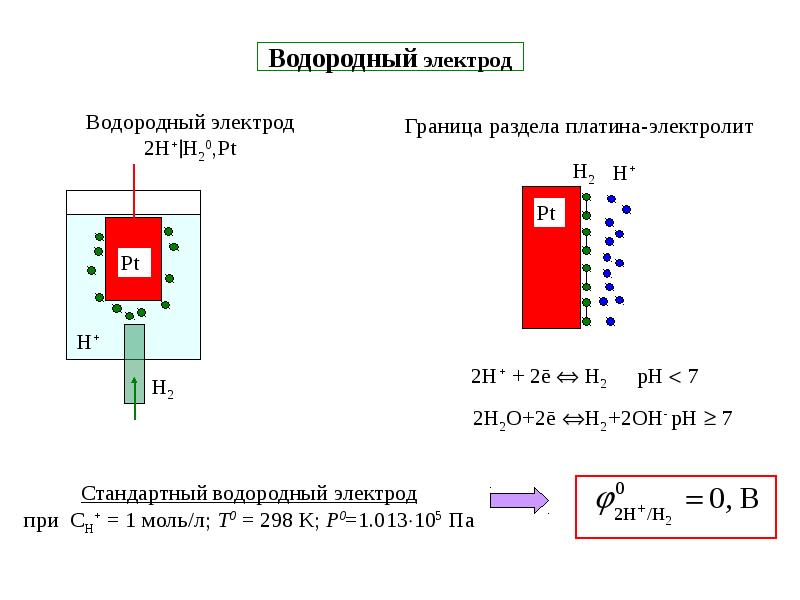 Реакции, отвечающие таким электродам, должны протекать самопроизвольно в стор(Зну нолучения более окисленных [c.184]
Реакции, отвечающие таким электродам, должны протекать самопроизвольно в стор(Зну нолучения более окисленных [c.184]
Обычно в качестве такого условия принимают потенциал какого-либо электрода равным нулю и относят к нему значения потенциалов всех других электродов. В этом случае потенциалы электродов даются в некоторой условной щкале и их значения зависят от природы электрода, выбранного за основу шкалы. Нернст предложил считать таким условным нулем потенциал водородного электрода при концентрации водородных ионов в растворе, равной единице, и давлении водородного газа, равном 101,3 кПа. Эта условная шкала потенциалов называется водородной шкалой. Оствальд выдвинул другую идею взять за основу шкалы потенциал ртутного электрода, находящегося в условиях, прн которых его заряд относительно раствора равен нулю. Полагая, что в этом случае не только заряд, но и потенциал ртутного электрода равен
При эюм предполагается, что другим полуэлементом, расположенным слева, являегся стандартный водородный электрод.
 [c.160]
[c.160] Компромиссный потенциал, который в данном случае называют коррозионным иотеициалом, лежит ноложительнее равновесного цинкового электрода и отрицательнее равновесного потенциала водородного электрода в данных условиях. Таким образом, при компромиссном нотенциале баланс зарядов сохраняется благодаря переносу зарядов цинком и водородом, но баланс вещества оказывается нарушенным, что приводит к некоторому, обычно не очень заметному, дрейфу компромиссного потенциала. Электродная поляризация определяется при этом уравнением, аналогичным
По теории Нернста нормальный потенциал является простой функцией электролитической упругости растворения металла. Его можно было бы вычислить для разных металлов по известным значениям величины Р. Такой расчет провести не удается, поскольку величина Р непосредственно не определяется. Молзначений стандартных потенциалов), как изменяется величина Р при переходе от одного электродного металла к другому. Если, например, принять электролитическую упругость растворения, соответствующую стандартному водородному электроду, а 101,3 кПа, то электролитическая упругость растворения бериллия составит примерно кПа, а меди —
Если, например, принять электролитическую упругость растворения, соответствующую стандартному водородному электроду, а 101,3 кПа, то электролитическая упругость растворения бериллия составит примерно кПа, а меди —
В результате электрохимического акта образуется адсорбированный катодом атомарный водород. При заданной плотности тока доля поверхности электрода, занятая атомами водорода, составляет некоторую величину 0 н. Если поляризация электрода обусловлена только замедленностью электрохимической стадии, то все остальные стадии, в том числе и удаление адсорбированного водорода, совершаются с несравненно большими скоростями, чем перенос заряда, и, следовательно, заполнение при данном токе должно быть равно (или почти равно) заполнению 0н в отсутствие результативного тока, т. е. при равновесном потенциале водородного электрода 0 н = 0н- Степень заполнения поверхности электрода адсорбированным атомарным водородом в условиях его катодного выделения определяется в первую очередь природой металла и для данного металла зависит от потенциала электрода. Она ничтожно мала (0 = 0) на Нд, РЬ, Сс1 и на других мягких или ртутеподобиых металлах. В согласии с этим выделение водорода по реакциям (17.78) и (17.79) может происходить несколькими путями и, соответственно, описываться различными кинетическими уравнениями. [c.361]
Она ничтожно мала (0 = 0) на Нд, РЬ, Сс1 и на других мягких или ртутеподобиых металлах. В согласии с этим выделение водорода по реакциям (17.78) и (17.79) может происходить несколькими путями и, соответственно, описываться различными кинетическими уравнениями. [c.361]
Равновесный потенциал хлорсеребряного электрода в водородной шкале определяется как э. д. с. цепи Р1 Н2]НС1 АдС121А . Цепь I отвечает обратной записи, т. е, в ней потенциал водородного электрода выражен по отношению к хлорсеребряному электроду, что приводит к уравнению (9.23). [c.205]
При замедленной рекомбинации для протекания реакции выделения водорода с заданной скоростью на поверхности металла необходим избыток водородных атомов по сравнению с равновесными условиями. При равновесии, т. е. при обратимом значении потенциала водородного электрода, между всеми стадиями электродной реакции существует детальное равновесие [c.408]
В этом случае потенциал электрода должен изменяться с концентрацией ионов водорода по закону, отличному от того, который был справедлив для равновесного водородного электрода.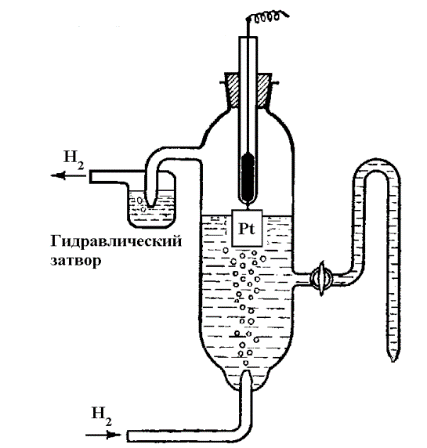 [c.440]
[c.440]
К раствору AgNOa, являющемуся э.пектролитом в одном нз полуэлементов гальванического элемента, состоящего из пары Ag /Ag и стандартного водородного электрода, прибавляют эквивалентное количество НС1. Учитывая величину ПРлвсь укажите, вызовет ли это изменение направления тока в элементе. [c.377]
Пусть имеется цепь, составленная из металла, опущенного в раствор его иоиов, и стандартного водородного электрода. Э. д. с. этой цепи, равную электродному потенциалу металла иН в условной водородной И1кале, можно записать в соответствии с уравнением (97) в следующем виде [c.251]
В частности, определенному парциальному давлению молекулярного водорода р отвечает равновесная поверхностная концентрация атомов водорода Сн(р)- Вместо обычного уравнения для обратимого водородного электрода [c.408]
Иной ТОЧКИ зрения придержизается школа Фрумкина, которая на примере водородного электрода заложила основы теории электрокапиллярных явлений для обратимых электродов.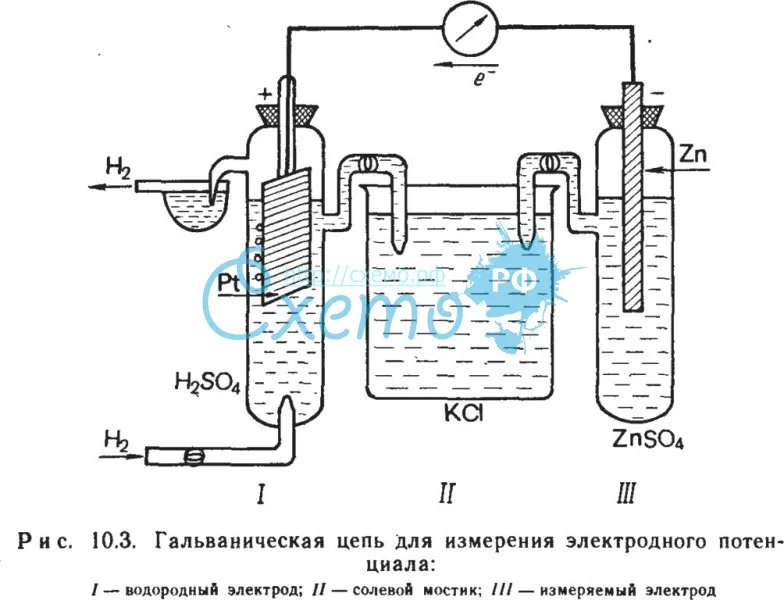 [c.260]
[c.260]
Таким образом, при определенных условиях потенциал водородного электрода дает цепосредственно значение pH. [c.167]
Кривая заряжения платины в кислом растворе представлена на рис. 19,6. Она состоит из участков 1, 2 и 3, отличающихся друг от друга наклоном. На участке 1, начинающемся у обратимого потенциала водородного электрода и лежащем в области наиболее отрицательных потенциалов, происходит постепенное снятие водорода, адсорбированного поверхностью 31лектрода. Здесь ток, подводпмый к электроду, расходуется на заряжение дво1шого слоя и на ионизацию адсорбированных водородных атомов. Электрическая емкость, измеряемая величиной, обратной наклону кривой ё—д, [c.415]
Приложение этих принципов к расчету скорости саморастворения металлов. можно проиллюстрировать на примерах коррозии цинка и железа в растворе с pH О и активностями соответствующих металлических ионов, равными единице. В выбранных условиях потенциал цинка (если считать, чтэ соверщается только обмен его ионами между металлом и раствоэом) должен отвечать его стандартному потенциалу, т. е. величине — 0,76 В. Однако этот процесс не является единственно возможным при таком значении потенциала. Его величина значительно отрицательнее потенциала равновесного водородного электрода, который в растворе при pH, равном нулю, составляет 0,0 В. Поэтому здесь возможно также выделение водорода со скоростью, определяемой кинетикой этой реакции на цинковом электроде. [c.492]
е. величине — 0,76 В. Однако этот процесс не является единственно возможным при таком значении потенциала. Его величина значительно отрицательнее потенциала равновесного водородного электрода, который в растворе при pH, равном нулю, составляет 0,0 В. Поэтому здесь возможно также выделение водорода со скоростью, определяемой кинетикой этой реакции на цинковом электроде. [c.492]
Подстановка значения концентрации одородны.ч атомов из последнего уравнения в формулу Нернста для водородного электрода дает [c.439]
Теперь уже компро.мпссиый потенциал близок к потенциалу водородного электрода в данных условиях (рис. 24.3). Его величина закономерно изменяется с pH раствора и почти не зависит от концентрацни ионов металла. Таким образом, здесь стационарный по- [c.489]
В области потенциалов, лежащих иа участке 1 вблизи участка 2 при наложении катодного толчка тока, возможен разряд ионов водорода с образованием адсорбированн1з1х атомов водорода. Появление молекулярного водорода и выделение его в газообразной форме исключены, так как потенциалы здесь более положительны, чем равновесный потенциал водородного электрода в данном растворе. [c.415]
Появление молекулярного водорода и выделение его в газообразной форме исключены, так как потенциалы здесь более положительны, чем равновесный потенциал водородного электрода в данном растворе. [c.415]
ЧТО возможно, если металл покрыт слоем его труднорастворимого соединения), ни потенциалу водородного электрода. Это будет некоторая компромиссная величина, зависящая от соотношения скоростей всех частных реакций (рис. 24.1), Однако могут быть такие случаи, когда потенциал данного электрода не очень сильно отличается от потенцпала водородного электрода илн от потенциала соответствующего металлического электрода. [c.489]
Общая химия (1984) — [ c.286 ]
Химия (1986) — [ c.233 ]
Неорганическая химия (1987) — [ c.229 ]
Химия для поступающих в вузы 1985 (1985) — [
c. 228
]
228
]
Химия для поступающих в вузы 1993 (1993) — [ c.273 ]
Основы общей химии (1988) — [ c.144 ]
Химия (1978) — [ c.316 ]
Химический энциклопедический словарь (1983) — [ c.0 ]
Химия (2001) — [ c.208 , c.210 ]
Химия Краткий словарь (2002) — [ c.63 ]
Коррозия и защита от коррозии (2002) — [ c.70 ]
Большой энциклопедический словарь Химия изд.2 (1998) — [ c.0 ]
Определение pH теория и практика (1972) — [ c.0 ]
Комплексообразование в растворах (1964) — [
c. 173
,
c.181
]
173
,
c.181
]
Константы ионизации кислот и оснований (1964) — [ c.0 ]
Практическое руководство по неорганическому анализу (1966) — [ c.230 ]
Общая химия (1964) — [ c.212 ]
Курс неорганической химии (1963) — [ c.51 ]
Курс общей химии (1964) — [ c.120 ]
Практикум по теоретической электрохимии (1954) — [ c.13 , c.191 , c.221 , c.222 ]
Краткая химическая энциклопедия Том 1 (1961) — [ c.629 ]
Основы биологической химии (1970) — [
c. 30
,
c.32
]
30
,
c.32
]
Неорганическая химия (1979) — [ c.153 ]
Теоретическая электрохимия (1959) — [ c.0 ]
Качественный химический анализ (1952) — [ c.140 ]
Общая химия 1982 (1982) — [ c.281 , c.282 ]
Технический анализ в производстве промежуточных продуктов и красителей (1958) — [ c.386 ]
Неорганическая химия (1978) — [ c.205 ]
Химия (1975) — [ c.253 ]
Общая химия (1974) — [ c.466 ]
Полумикрометод качественного анализа (1947) — [
c.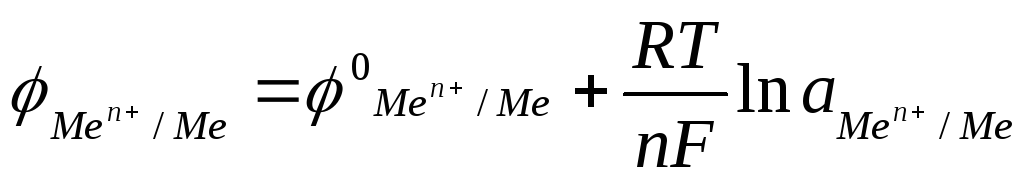 45
]
45
]
Теоретическая электрохимия Издание 3 (1970) — [ c.0 ]
Водный режим и химический контроль на ТЭС Издание 2 (1985) — [ c.33 ]
Технический анализ в производстве промежуточных продуктов и красителей Издание 3 (1958) — [ c.386 ]
Определение концентрации водородных ионов и электротитрование (1947) — [ c.82 , c.120 ]
Определение рН теория и практика (1968) — [ c.0 ]
Химико-технические методы исследования Том 1 (0) — [ c.322 , c.324 ]
Основы физической и коллоидной химии Издание 3 (1964) — [ c.217 ]
Физическая и коллоидная химия (1974) — [
c. 282
,
c.284
]
282
,
c.284
]
Общая химия Издание 18 (1976) — [ c.278 , c.279 ]
Общая химия Издание 22 (1982) — [ c.281 , c.282 ]
Руководство по электрохимии Издание 2 (1931) — [ c.185 ]
Химические источники тока (1948) — [ c.49 ]
Теоретическая электрохимия (1981) — [ c.0 ]
Практикум по физической химии (1950) — [ c.211 ]
Физическая и коллоидная химия (1964) — [ c.255 ]
Физическая и коллоидная химия Учебное пособие для вузов (1976) — [
c.164
,
c. 165
]
165
]
Физическая и коллоидная химия (1954) — [ c.105 ]
Неорганическая химия (1994) — [ c.133 ]
Химия Издание 2 (1988) — [ c.228 ]
Коррозия и защита от коррозии Изд2 (2006) — [ c.70 ]
Практическое руководство по неорганическому анализу (1960) — [ c.210 ]
Краткая химическая энциклопедия Том 1 (1961) — [ c.629 ]
Количественный анализ Издание 5 (1955) — [ c.401 , c.430 ]
Основы общей химии Том 2 Издание 3 (1973) — [ c.206 ]
Курс неорганической химии (1972) — [
c. 47
]
47
]
Потенциал водородный — Справочник химика 21
Потенциал водородного электрода в некотором водном растворе равен —118 мВ, Вычнелить активность ионов Н+ в этом растворе. [c.183]Вычислить потенциал водородного электрода, погруженного в чистую воду в раствор с pH = 3,5 в раствор с pH = 10,7. [c.183]
Чему равен потенциал водородного электрода при pH =10 а) —0,59 В б) —0,30 В в) 0,30 В [c.184]
Пример 3. Вычислить активность ионов Н+ в растворе, а котором потенциал водородного электрода равен —82 мВ. [c.181]
Для второго из выбранных объектов, т. е. для железа, стандартный электродный потенциал равен —0,44 В. Поэтому здесь, так же как и в случае цинка, следует считаться с реакцией выделения водорода, и, следовательно, условия стационарности будут заданы уравнением (24.
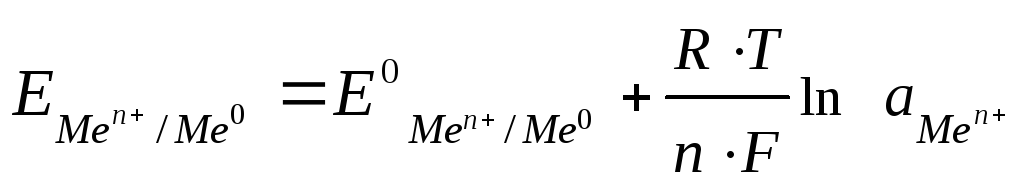 2). Однако в отличие от цинка здесь совершенно иное соотношение токов обмена металла и водорода. Ток обмена железа имеет порядок 10 з А-см- , а для водорода на железном электроде в кислых растворах он достигает А-см 2. Можно ожидать поэтому, что стационарный потенциал железа в условиях кислотной коррозии должен заметно отличаться от его обратимого потенциала он будет смещен в сторону положительных значений, г. е. в направлении равновесного потенциала водородного электрода. Этот вывод согласуется с экспериментальными данными и находит дополнительное подтверждение в том, что железо ведет себя в некоторых интервалах pH подобно водородному электроду. Скорость коррозии железа также можно вычислить, если только известны его стационарный потенциал и перенапряжение водорода на нем. [c.493]
2). Однако в отличие от цинка здесь совершенно иное соотношение токов обмена металла и водорода. Ток обмена железа имеет порядок 10 з А-см- , а для водорода на железном электроде в кислых растворах он достигает А-см 2. Можно ожидать поэтому, что стационарный потенциал железа в условиях кислотной коррозии должен заметно отличаться от его обратимого потенциала он будет смещен в сторону положительных значений, г. е. в направлении равновесного потенциала водородного электрода. Этот вывод согласуется с экспериментальными данными и находит дополнительное подтверждение в том, что железо ведет себя в некоторых интервалах pH подобно водородному электроду. Скорость коррозии железа также можно вычислить, если только известны его стационарный потенциал и перенапряжение водорода на нем. [c.493] Из выражений (7.44) и (7.45) видно, что потенциал водородного электрода определяется не только активностью водородных ионов, но и парциальным давлением газообразного водорода. Следовательно, водородный электрод (так же как и другие газовые электроды) более сложный, чем электроды первого или второго рода, потенциалы которых зависят непосредственно от активности одного сорта частиц.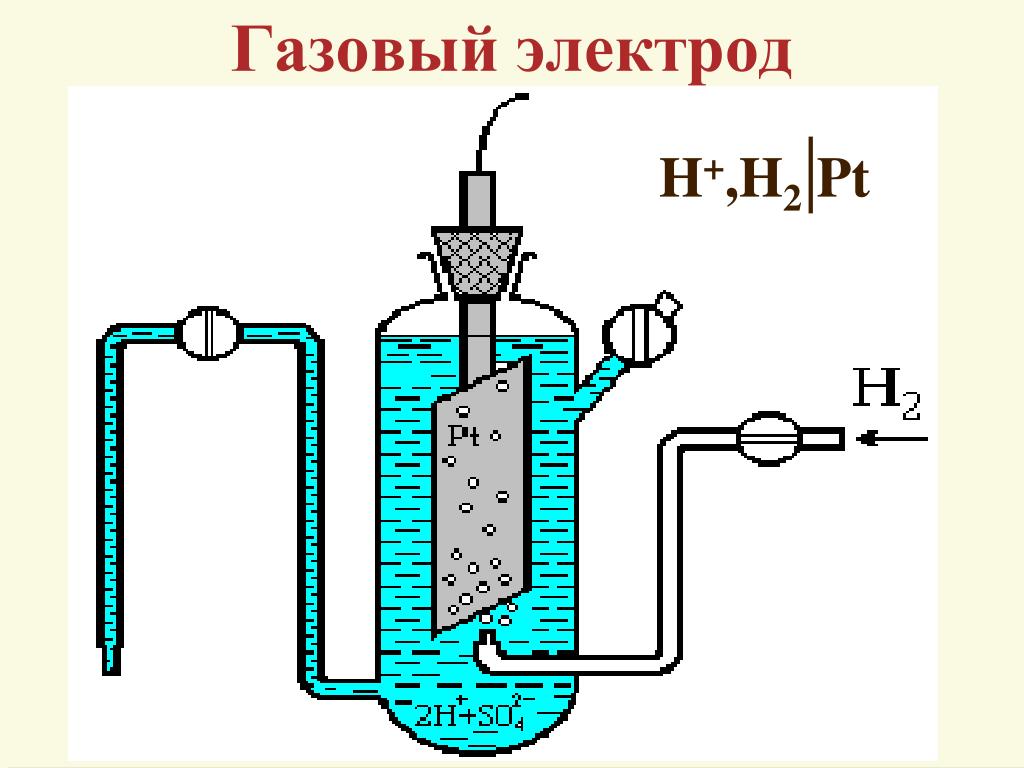 Согласно определ гнию условной шкалы электродных потенциалов стандартный потенциал водородного электрода н+ 112 температурах принято равным нулю, поэтому [c.166]
Согласно определ гнию условной шкалы электродных потенциалов стандартный потенциал водородного электрода н+ 112 температурах принято равным нулю, поэтому [c.166]
Из металлов первой электрохимической группы наиболее полно изучена платина, хотя из-за высокой чувствительности ее водородного потенциала к примесям полученные данные не отличаются хорошей воспроизводимостью. Н( сомненно, что в области положительных потенциалов (не очень удаленных от обратимого потенциала водородного электрода) на поверхности платины всегда присутствует адсорбированный водород. Это установлено измерением мкости, а также другими методами. Так, количество адсорбированного водорода можно найти для каждого значения потенциала при помощи кривых заряжения, т. е. кривых, передающих изменение потенциала электрода с количеством подведенного электричества чли (при постоянной силе тока) с течением времени. При таком кулонометрическом определении количества водорода (или иного электрохимически активного вещества) необходимо, чтобы его выделение (или растворение) совершалось со 100%-ным выходом по току. Все возможные побочные реакции — электровосстановление или выделение кислорода, катодное восстановление или анодное окисление органических веществ и других примесей — должны быть полностью исключены. Этого можно достичь двумя методами. В первом из ннх сила накладываемого на ячейку тока настолько велика, что значительно превосходит предельные токи восстановления и окисления примесей их вредное влияние поэтому не проявляется. Заряжение электрода проводят с большой скоростью, а кривую заряжения регистрируют автомати- [c.414]
Все возможные побочные реакции — электровосстановление или выделение кислорода, катодное восстановление или анодное окисление органических веществ и других примесей — должны быть полностью исключены. Этого можно достичь двумя методами. В первом из ннх сила накладываемого на ячейку тока настолько велика, что значительно превосходит предельные токи восстановления и окисления примесей их вредное влияние поэтому не проявляется. Заряжение электрода проводят с большой скоростью, а кривую заряжения регистрируют автомати- [c.414]
Первый член в сумме уравнения (XX, 23) равен нулю по условию. Таким образом, потенциал водородного электрода уменьшается с повышением давления водорода на электроде. Отклонение давления от нормального на 0,1 атм вызывает изменение потенциала ф на 0,0012 в. При точных измерениях следует вводить поправку на давление водорода (с учетом давления насыщенного пара раствора). [c.548]
Вычислить в милливольтах потенциал водородного электрода в разбавленных растворах сильных кислот а) 0,01 М H IO4 [c.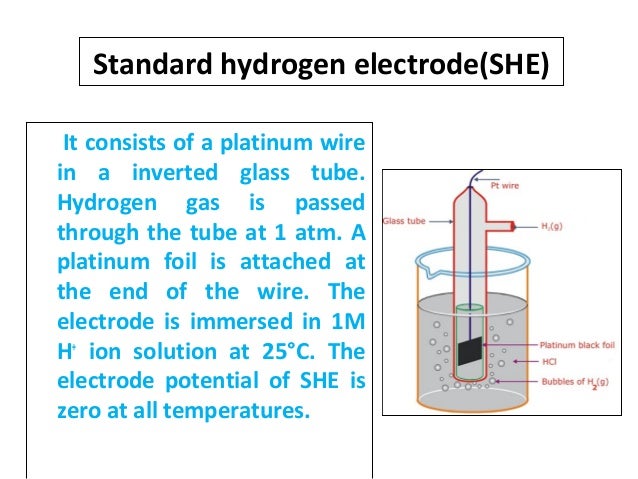 162]
162]
Студентам следует разъяснить, что поскольку принятое правило записывать все полуреакции как восстановительные процессы и выбор потенциала водородного электрода в качестве нулевой точки отсчета произвольны, знак потенциала конкретной полуреакции не имеет решающего значения лишь знак напряжения всего гальваническою элемента (разность между двумя электродными потенциалами) может использоваться для установления направления самопроизвольного протекания реакции. [c.580]
Как изменится активность водородных ионов при уменьшении потенциала водородного электрода от нуля до —100 мВ [c.162]
Так как стандартный потенциал меди гораздо положительнее стандартного потенциала водородного электрода, коррозия медн с водородной деполяризацией не происходит. В отсутствие окислителей медь обладает хорошей стойкостью в водных растворах и в обычных условиях не вытесняет водород из кислот. Процесс электрохимической коррозии меди протекает в окислительных средах (присутствие в растворе кислорода и других окислителей).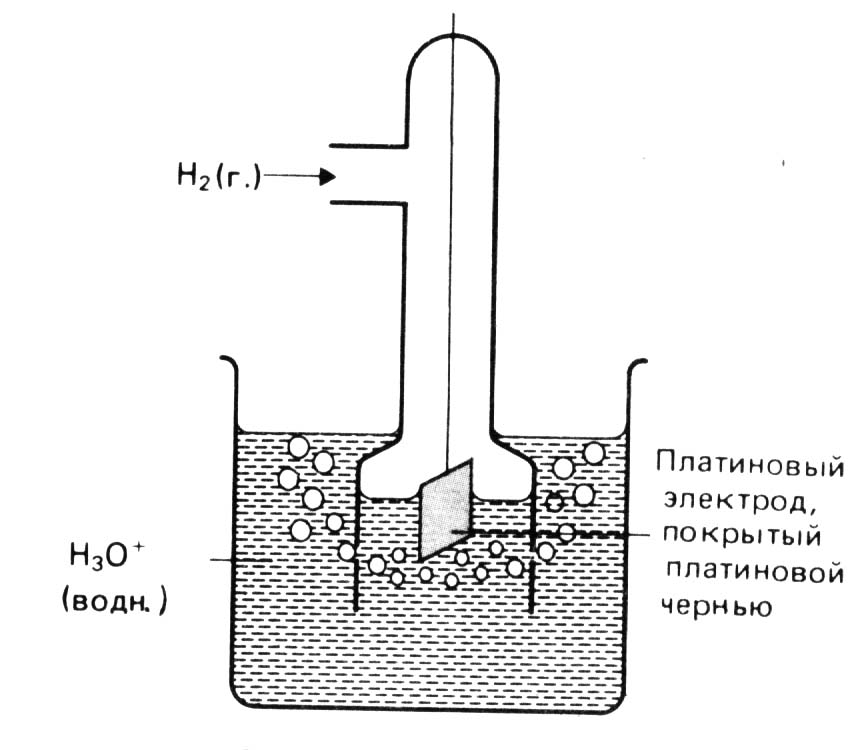 Медь обычно корродирует, переходя в раствор в виде двухвалентных ионов Си +. [c.247]
Медь обычно корродирует, переходя в раствор в виде двухвалентных ионов Си +. [c.247]
Точно так же, поскольку стандартный потенциал редокси-системы Т 2+, Т1 + значительно отрицательнее потенциала водородного электрода ( т 2+, Т1 +=—0,37 В), в водных растворах солей титаиа (II) должио самопроизвольно протекать окисление ионов Т12+ до понов Т1 + с одновременным раз [0жением воды [c.185]
Как ранее было указано, электрохимическая реакция присоединения электрона к иону водорода требует некоторой энергии активации, т. е. для того, чтобы процесс разряда ионов водорода шел на электроде с определенной скоростью, необходимо сообщить ему некоторый избыточный (против равновесного) потенциал, который определяется величиной перенапряжения водорода. Потенциал разряда водородных ионов с определенной скоростью к равен сумме равновесного потенциала водородного электрода и величины перенапряжения водорода, обозначаемой г]. Под величиной перенапряжения водорода понимают сдвиг потенциала катода при данной плотности тока 1п в отрицательную сторону по сравнению с потенциалом водородного электрода в том же растворе, в тех же условиях, но при отсутствии тока в системе. Поэтому расход электрической энергии на получение водорода электролизом больше, чем это определяется термодинамическими подсчетами. [c.42]
Поэтому расход электрической энергии на получение водорода электролизом больше, чем это определяется термодинамическими подсчетами. [c.42]
Все электроды с потенциалом более отрицательным, чем потенциал водородного электрода, в водных растворах термодинамически неустойчивы. Реакции, отвечающие таким электродам, должны протекать самопроизвольно в стор(Зну нолучения более окисленных [c.184]
При замедленной рекомбинации для протекания реакции выделения водорода с заданной скоростью на поверхности металла необходим избыток водородных атомов по сравнению с равновесными условиями. При равновесии, т. е. при обратимом значении потенциала водородного электрода, между всеми стадиями электродной реакции существует детальное равновесие [c.408]
Как отличается потенциал водородного электрода в 1 М растворе НС1 от его потенциала в растворе с активностью ионов водорода, равной единице [c. 98]
98]
Э. д. с. элемента вычисляем по уравнению (XIX. 1). Для этого рассчитаем потенциал водородного электрода по (XIX.5) [c.301]
Компромиссный потенциал, который в данном случае называют коррозионным иотеициалом, лежит ноложительнее равновесного цинкового электрода и отрицательнее равновесного потенциала водородного электрода в данных условиях. Таким образом, при компромиссном нотенциале баланс зарядов сохраняется благодаря переносу зарядов цинком и водородом, но баланс вещества оказывается нарушенным, что приводит к некоторому, обычно не очень заметному, дрейфу компромиссного потенциала. Электродная поляризация определяется при этом уравнением, аналогичным [c.290]
Стандартный потенциал водородного электрода условно (так как в разных растворителях он разный и зависит от температуры) принят равным нулю при любых температурах и в любых растворителях, т. е. [c.170]
Водородная деполяризация термодинамически возможна в тех случаях, когда равновесный потенциал металла отрицательнее равновесного потенциала водородного электрода в данных условиях. В нейтральном растворе с pH 7,1 = 25° С и рм, = = 1,013-10 (1 атм), равновесный потенциал водородного электрода ио формуле Нернста [c.39]
В нейтральном растворе с pH 7,1 = 25° С и рм, = = 1,013-10 (1 атм), равновесный потенциал водородного электрода ио формуле Нернста [c.39]
Обычно в качестве такого условия принимают потенциал какого-либо электрода равным нулю и относят к нему значения потенциалов всех других электродов. В этом случае потенциалы электродов даются в некоторой условной щкале и их значения зависят от природы электрода, выбранного за основу шкалы. Нернст предложил считать таким условным нулем потенциал водородного электрода при концентрации водородных ионов в растворе, равной единице, и давлении водородного газа, равном 101,3 кПа. Эта условная шкала потенциалов называется водородной шкалой. Оствальд выдвинул другую идею взять за основу шкалы потенциал ртутного электрода, находящегося в условиях, прн которых его заряд относительно раствора равен нулю. Полагая, что в этом случае не только заряд, но и потенциал ртутного электрода равен [c.157]
Для пересчета потенциалов в неводных растворах по водородной шкале на водную водородную шкалу следует к их значениям V прибавить значение стандартного обратимого потенциала водородного электрода в данном растворителе относительно стандартного обратимого потенциала водородного электрода в воде (Ун обр. р (табл. 26) [c.175]
р (табл. 26) [c.175]
Равновесный потенциал хлорсеребряного электрода в водородной шкале определяется как э. д. с. цепи Р1 Н2]НС1 АдС121А . Цепь I отвечает обратной записи, т. е, в ней потенциал водородного электрода выражен по отношению к хлорсеребряному электроду, что приводит к уравнению (9.23). [c.205]
Шаг 1. Выбор коррелирующего параметра (функция кислотности, окислительно-восстановительный потенциал, потенциал водородного электрода и т. п.). [c.65]
Обратимый потенциал водородного электрода (1 н,)обр «Р» 25 С и различных значениях pH среды » Рн, [c.249]
При определенном смещении потенциала в отрицательную сторону на катоде может начаться какой-либо новый процесс. В водных растворах таким процессом обычно является разряд водородных ионов, обратимый потенциал которого более чем на 1 В отрицательнее обратимого потенциала процесса ионизации кислорода. При достижении обратимого потенциала водородного электрода в данном растворе (УнЛобр на процесс кислородной деполяризации начинает накладываться процесс водородной деполяризации [кривая (УнЛобр — на рис. 159] и общий процесс катодной деполяризации будет соответствовать кривой (Уо,)обр АСОЕК на рис. 159, которую называют общй кривой катодной поляризации. [c.242]
159] и общий процесс катодной деполяризации будет соответствовать кривой (Уо,)обр АСОЕК на рис. 159, которую называют общй кривой катодной поляризации. [c.242]
Таким образом, при определенных условиях потенциал водородного электрода дает цепосредственно значение pH. [c.167]
Металлы с потенциалами более отрицательными,чем потенциал водородного электрода, называют неблагородными, они растворяются в кислотах с выделением водорода. [c.28]
Эта реакция характерна для водородного электрода. Равновесию между ионами НзО (при а+=1) и мoлeкyляpны газообразным водородом (р=1 атм) соответствует вполне определенный потенциал, условно принимаемый равным нулю. При этом потенциале имеется равновесие динамического характера, т. е. на границе электрод — раствор одновременно протекают как процесс разряда ионов гидроксония, так и процесс ионизации адсорбированного водорода, а на границе электрод газ — процессы адсорбции и десорбции водорода. При этом скорссти про-тизоположных процессов равны. Если поляризовать водородный электрод катодно, т. е. подводить к нему з ектроны, то равновесие нарушится и преимущественно будет происходить разряд ионов гидроксония. Отсюда ясно, что разряд ионов гид )оксония и выделение молекулярного водорода будут наблюдаться лишь по достижении равновесного потенциала водородного электрода, соответствующего активности иока гидроксония в растворе и давлению выделяющегося Нг, (при отсутствии перенапряжения). Этим и определяется предельное значение пол5 ризации катода при электролизе с выделением водорода. [c.613]
При этом скорссти про-тизоположных процессов равны. Если поляризовать водородный электрод катодно, т. е. подводить к нему з ектроны, то равновесие нарушится и преимущественно будет происходить разряд ионов гидроксония. Отсюда ясно, что разряд ионов гид )оксония и выделение молекулярного водорода будут наблюдаться лишь по достижении равновесного потенциала водородного электрода, соответствующего активности иока гидроксония в растворе и давлению выделяющегося Нг, (при отсутствии перенапряжения). Этим и определяется предельное значение пол5 ризации катода при электролизе с выделением водорода. [c.613]
Вычислить в милливольтах потенциал водородного электрода в следующих растворах а) 0,1 М и 1%-ном растворах СНзСООН, А =1,8- 10 б) 0,001 М КОН в) 0.04%-ном NaOH. [c.162]
При использовании уравнения (175.14) для расчета потенциалов газовых электродов активность газов (при небольших давлениях) выражается их парциальным давлением. Активность воды, за исключением очень концентрированных растворов, практически не меняется при протекании электродной реакции и может быть принята равной единице. Потенциал водородного электрода [c.480]
Потенциал водородного электрода [c.480]
Кривая заряжения платины в кислом растворе представлена на рис. 19,6. Она состоит из участков 1, 2 и 3, отличающихся друг от друга наклоном. На участке 1, начинающемся у обратимого потенциала водородного электрода и лежащем в области наиболее отрицательных потенциалов, происходит постепенное снятие водорода, адсорбированного поверхностью 31лектрода. Здесь ток, подводпмый к электроду, расходуется на заряжение дво1шого слоя и на ионизацию адсорбированных водородных атомов. Электрическая емкость, измеряемая величиной, обратной наклону кривой ё—д, [c.415]
Потенциал водородного электрода воспроизводится с очень вь сокой точностью. Поэтому водородный электрод н принят в качс ствё эталона при создании шкалы электродны.х…….потенциалов. [c.282]
В области потенциалов, лежащих иа участке 1 вблизи участка 2 при наложении катодного толчка тока, возможен разряд ионов водорода с образованием адсорбированн1з1х атомов водорода. Появление молекулярного водорода и выделение его в газообразной форме исключены, так как потенциалы здесь более положительны, чем равновесный потенциал водородного электрода в данном растворе. [c.415]
Появление молекулярного водорода и выделение его в газообразной форме исключены, так как потенциалы здесь более положительны, чем равновесный потенциал водородного электрода в данном растворе. [c.415]
Решение. Стандартный электродный потеициая системы Na+ + — = Na (—2,71 В) значительно отрицательнее потенциала водородного электрода в нейтральной водной среде [c.191]
Потенциал водородного электрода связан простыми соотношениями с активностью водородных ионов (XIII, 20) и с водородным показателем среды pH (XIII, 22), что дает возможность определять ан и pH путем измерения э.д.с. соответствующих цепей, содержащих водородный электрод. Наряду с водородным электродом для той же цели может служить и хингидронный электрод ( 180) и некоторые другие электроды, в частности стеклянный и сурьмяный, не рассматривавшиеся в нашем курсе. [c.442]
Для определения электродных потенциалов применяют стандартные электроды сравнения, ноте1Щиалы которых известны. Обычно в качестве стандартного электрода применяют каломельный или водород-иьи» электроды. Условно принимают стандартный потенциал водородного электрода при любой температуре равным нулю. [c.293]
Обычно в качестве стандартного электрода применяют каломельный или водород-иьи» электроды. Условно принимают стандартный потенциал водородного электрода при любой температуре равным нулю. [c.293]
Нормальный электродный потенциал серебра равен 4-0,799 а, т. с. значительно положительнее. потенциала водородного электрода, и по этой причине серебро является термодинамически устойчивым материалом в иеокислительных средах, в том числе в неаэрированных растворах соляной и плавиковой кислот. Наличие в растворах этих кислот окислителей оказывает ускоряющее влияние на коррозию серебра. [c.275]
Потенциал водородного электрода в обнЕем случае определяется уравнением [c.294]
Измерив потенциал водородного электрода против стандартного электрода оравнеиия (каломельный электрод), рассчитывают pH раствора по уравнению [c.294]
Потенциал водородного электрода при различных значениях рН раствора | Задачи 655
Задача 655.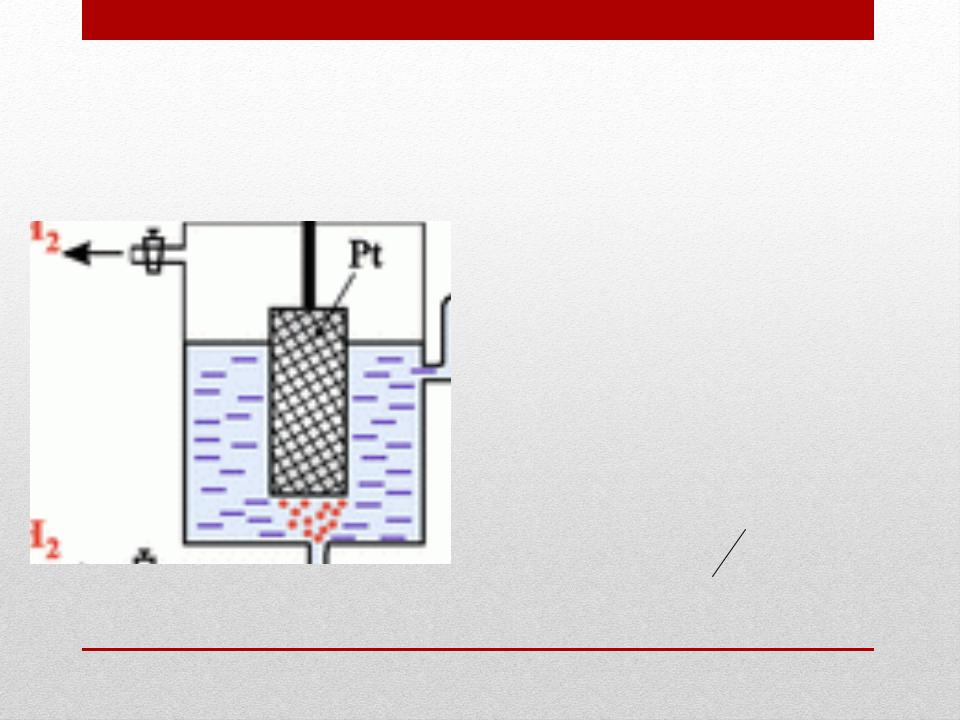
Вычислить потенциал водородного электрода, погруженного: в чистую воду в раствор с рН = 3,5; в раствор с рН = 10,7.
Решение:
Стандартный электродный потенциал водородного электрода при нормальных условиях и концентрации ионов
водорода 1 моль/л (рН = 0), условно принимается 0,00В.
Если рН раствора изменять, т.е. изменять концентрацию ионов водорода в растворе, то потенциал водородного электрода тоже будет изменяться. Потенциал водородного электрода при различных значениях рН раствора можно определить из уравнения Нернста:
Используя это уравнение определим потенциал водородного электрода, погружённого а) в чистую воду; б) в раствор с рН = 3,5; в) в раствор с рН = 10,7:
а) В чистой воде рН = 7, получим:
Еа) = 0,059 . (-7) = -0,41В ;
б) В растворе с рН = 3,5, получим:
Еб) = 0,059 . (-3,5) = -0,21В ;
в) В растворе с рН = 10,7, получим:
Ев)= 0,059 . (-10,7) = -0,63В.
(-10,7) = -0,63В.
Ответ: а) -0,41В; б) -0,21В; в) -0,63В.
Задача 656.
Потенциал водородного электрода в некотором водном растворе равен -118 мВ. Вычислить активность ионов Н+ в этом растворе.
Решение:
Величина потенциала водородного электрода определяется по уравнению Нернста:
где Е0 – стандартный электродный потенциал водорода; n – число электронов, принимающих участие в процессе; [H+] – концентрация ионов водорода.
Из которого вытекает выражение водородного электрода:
где — активность ионов водорода.
Подставляя значения по условию задачи, рассчитаем активность ионов водорода, получим:
Ответ: 0,01моль/л.
Задача 657.
Вычислить потенциал свинцового электрода в насыщенном растворе PbBr2, если [Br—] = 1 молы/л, а ПР(PbBr2) = 9,1 . 10-6.
10-6.
Решение:
E0(Pb2+/Pb) = 0,13B.
Для расчета потенциала используем уравнение Нернста:
Е0 – стандартный электродный потенциал металла; n – число электронов, принимающих участие в процессе; с – концентрация ионов металла в растворе.
Поскольку концентрация [Br—] = 1 молы/л, а ПР(PbBr2) = 9,1 .10-6, то концентрация ионов Рв2+ равна:
Теперь, подставив значения в уравнение, получим:
Ответ: -0,28 В.
Электрод водородный (платино-водородный — Энциклопедия по машиностроению XXL
Эвтектическая кристаллизация 184 Эвтектическая температура 188, 190-192 Эвтектическая точка 188 Эвтектический состав 188, 190-192 Эйлера теорема 124, 147 Эйнштейн А. 18, 71, 272, 312, 341 Эйнштейна формула И, 71, 72, 341 Эйнштейна—Стокса соотношение 271, 272 Экстенсивные переменные 9, 54, 127 Электрод водородный (платино-водородный) 266 [c. 457]
457]
Водородный электрод для измерения потенциала можно получить, погружая пластинку платинированной платины в раствор, насыщенный водородом при давлении 1 ат (рис. 3.2), или, что более удобно, измеряют потенциал с помощью стеклянного электрода, который также обратим по отношению к водородным ионам. Заметим, что потенциал электрода равен нулю, если и активность водородных ионов, и давление газообразного водорода (в атмосферах) равны единице. Это и есть стандартный водородный потенциал. Таким образом, потенциал полуэлемента для любого электрода равен э. д. с. элемента, где в качестве второго электрода использован стандартный водородный электрод. Потенциал полу-элемента для любого электрода, определенный таким образом, называется потенциалом по нормальному стандартному) водородному электроду или по водородной шкале и обозначается или н. в. а- [c.34]
Определение pH растворов с водородным электродом. Водородным электродом обычно служит пластинка платинированной платины, частично погруженная в раствор (содержащий ионы водорода) и омываемая током газообразного водорода. На платине в этом случае протекает обратимый электродный процесс, который можно схематично представить следующим образом
[c.57]
На платине в этом случае протекает обратимый электродный процесс, который можно схематично представить следующим образом
[c.57]
Потенциал железа в деаэрированных растворах линейно зависит от pH [202] от содержания ионов железа таковой зависимости не наблюдается [223]. Значения потенциала в аэрированных растворах колеблются в присутствии воздуха найдена лишь примерно линейная зависимость. По сравнению с платино-водородным электродом кривая зависимости потенциала железа от pH раствора проходит на [c.82]
В качестве вспомогательного электрода использовали платину. Электродом сравнения служил водородный электрод в том же растворе. Очистку водорода производили обычными метода -.ми. В качестве электролитов применяли 0,5 сульфат калия с добавлением буферной смеси (0,05 М карбонат и 0,005 М бикарбонат натрия) с pH раствора 10,6 0,5 н серную кислоту. [c.85]
Для нахождения потенциала какого-либо металла необходимо построить гальванический элемент, в котором один из металлов являлся бы постоянным.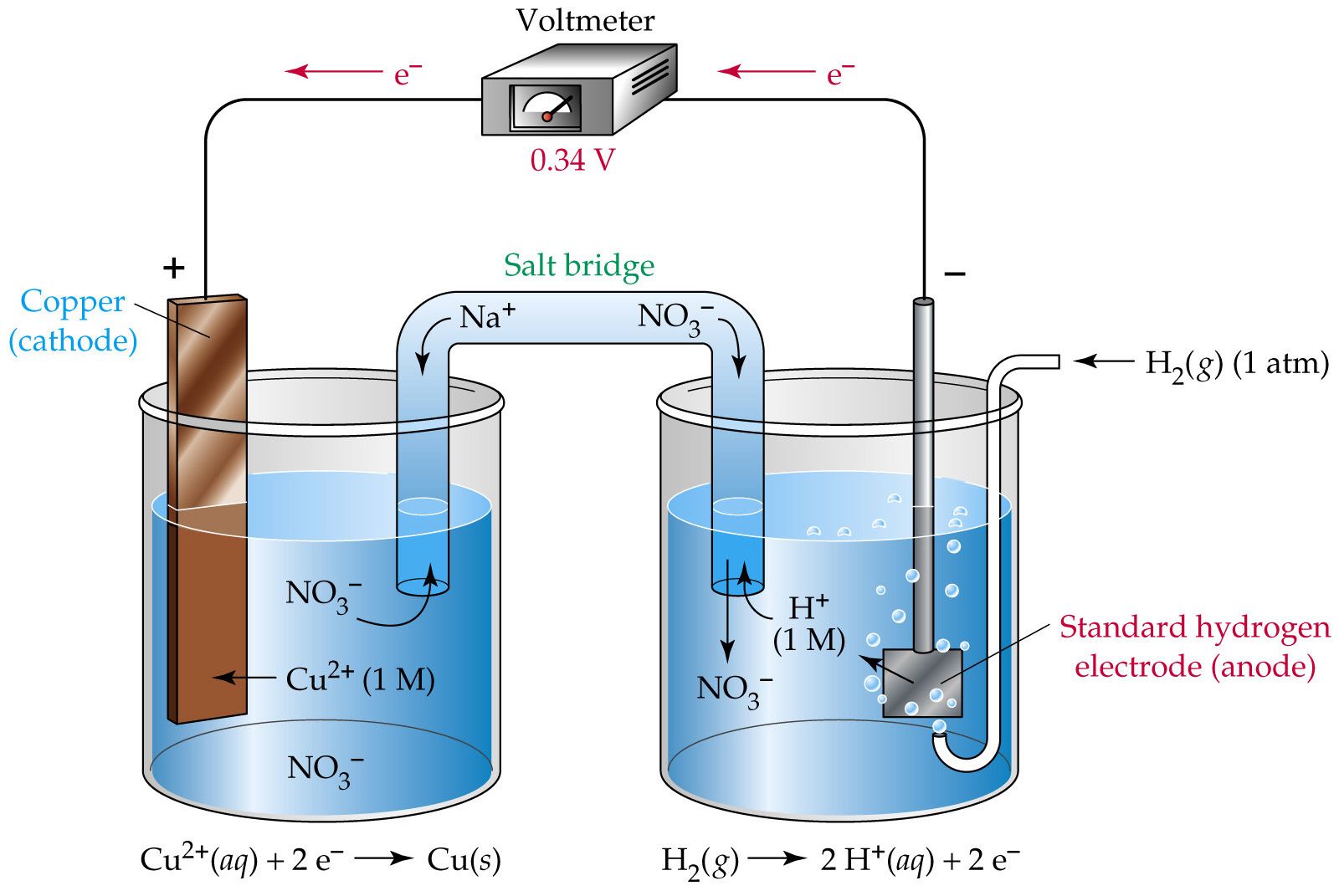 В качестве такого стандартного электрода был принят водородный — платина, насыщенная водородом и погруженная в нормальный раствор серной кислоты.
[c.80]
В качестве такого стандартного электрода был принят водородный — платина, насыщенная водородом и погруженная в нормальный раствор серной кислоты.
[c.80]
Платино-водородный или просто водородный электрод представляет собой платиновую пластинку, покрытую платиновой чернью, погруженную в раствор кислоты, через который пропускают газообразный водород. Если активность ионов водорода равна единице, давление водорода 1 атм (0,101 МПа), то потенциал водородного электрода условно считают нулевым. — Прим. ред. [c.266]
Скоростью, с которой атомы Наде рекомбинируют друг с другом или с Н , образуя Hj, обусловлена каталитическими свойствами поверхности электрода. Если электрод является хорошим катализатором (например, платина или железо), водородное перенапряжение невелико, тогда как для слабых катализаторов (ртуть, свинец) характерны высокие значения перенапряжения.
 При добавлении в электролит какого-либо каталитического яда, например сероводорода или соединений мышьяка или фосфора, уменьшается скорость образования молекулярного Hj и возрастает адсорбция атомов водорода на поверхности электрода . Повышенная концентрация водорода на поверхности металла облегчает проникновение атомов водорода в металлическую решетку, что вызывает водородное охрупчивание (потерю пластичности) и может привести к внезапному растрескиванию (водородное растрескивание) некоторых напряженных высокопрочных сплавов на основе железа (см. разд. 7..4). Каталитические яды увеличивают абсорбцию водорода, выделяющегося на поверхности металла в результате поляризации внешним током или коррозионной реакции. Это осложняет эксплуатацию трубопроводов из низколегированных сталей в некоторых рассолах в буровых скважинах, содержащих сероводород. Небольшая общая коррозия приводит к выделению водорода, который внедряется в напряженную сталь и вызывает водородное растрескивание. В отсутствие сероводорода общая коррозия не сопровождается водородным растрескиванием.
При добавлении в электролит какого-либо каталитического яда, например сероводорода или соединений мышьяка или фосфора, уменьшается скорость образования молекулярного Hj и возрастает адсорбция атомов водорода на поверхности электрода . Повышенная концентрация водорода на поверхности металла облегчает проникновение атомов водорода в металлическую решетку, что вызывает водородное охрупчивание (потерю пластичности) и может привести к внезапному растрескиванию (водородное растрескивание) некоторых напряженных высокопрочных сплавов на основе железа (см. разд. 7..4). Каталитические яды увеличивают абсорбцию водорода, выделяющегося на поверхности металла в результате поляризации внешним током или коррозионной реакции. Это осложняет эксплуатацию трубопроводов из низколегированных сталей в некоторых рассолах в буровых скважинах, содержащих сероводород. Небольшая общая коррозия приводит к выделению водорода, который внедряется в напряженную сталь и вызывает водородное растрескивание. В отсутствие сероводорода общая коррозия не сопровождается водородным растрескиванием. Высокопрочные стали из-за своей ограниченной пластичности более подвержены водородному ра-
[c.58]
Высокопрочные стали из-за своей ограниченной пластичности более подвержены водородному ра-
[c.58]Газовые электроды. Наиболее важное место среди газовых электродов занимает водородный электрод. Выведем здесь полное выражение для потенциала водородного электрода. На границе платины, насыщенной газообразным водородом, и водного раствора, в котором содержатся ионы водорода, устанавливается равновесие [c.35]
Наконец, возможен случай возникновения двойных слоев за счет адсорбции в электролите газов. Примером может служить поведение платины в электролите, содержащем растворенный кислород или водород. Последние, адсорбируясь поверхностью металла, приводят к появлению кислородного или водородного электродов. При кор- [c.13]
Среди окислительно-восстановительных электродов выделяют газовые электроды. Газовый электрод состоит из инертного металла (часто платины), к которому подводится электрохимически активный газ. Молекулы газа адсорбируются на поверхности металла, распадаясь при этом на атомы, а адсорбированные атомы участвуют уже непосредственно в электродной реакции. При записи реакции промежуточное состояние часто опускают. Примером газового электрода служит водородный электрод, на поверхности которого устанавливается равновесие (кислая среда)
[c.294]
При записи реакции промежуточное состояние часто опускают. Примером газового электрода служит водородный электрод, на поверхности которого устанавливается равновесие (кислая среда)
[c.294]
В качестве электрода сравнения принят стандартный водородный электрод (при давлении водорода в 1 атм. и активности ионов водорода в растворе, равной 1). Такой активностью обладает 1,3 н — раствор соляной кислоты. Стандартный электрод представляет собой платиновую пластину, покрытую свеже-осажденной мелкодисперсной платиной, способной поглощать большие количества водорода, погруженную в вышеуказанный раствор и насыщенную водородом при р =1 атм. Возникающий потенциал принят условно за 0. [c.30]
Хотя значение потенциала водородного электрода и принято равным нулю, это отнюдь не значит, что абсолютное значение разности потенциалов в двойном слое, образованном с одной стороны абсорбированным в платине водородом, а со стороны раствора — ионами водорода, равно нулю. Просто ввиду невозможности определения абсолютного потенциала, потенциал водородного электрода, учитывая его хорошую воспроизводимость, принят в качестве эталона сравнения. Это имеет также и историческое значение, так как на первых этапах развития электрохимии способность металла вытеснять водород из раствора являлась мерой его активности. Все металлы, имеющие более электроотрицательный относительно водородного электрода потенциал, вытесняют водород из воды.
[c.18]
Просто ввиду невозможности определения абсолютного потенциала, потенциал водородного электрода, учитывая его хорошую воспроизводимость, принят в качестве эталона сравнения. Это имеет также и историческое значение, так как на первых этапах развития электрохимии способность металла вытеснять водород из раствора являлась мерой его активности. Все металлы, имеющие более электроотрицательный относительно водородного электрода потенциал, вытесняют водород из воды.
[c.18]
В этой таблице значение потенциала водородного электрода равняется нулю. Это не значит, что абсолютное значение разности потенциалов в двойном слое, образованном с одной стороны растворенными в металле молекулами водорода, а со стороны раствора ионами водорода, равно нулю. Просто ввиду невозможности определения.абсолютного потенциала, потенциал водородного электрода, учитывая его хорошую воспроизводимость на платине, принят в качестве эталона сравнения.
 Все металлы, имеющие потенциал более электроотрицательный относительно нормального водородного электрода (НВЭ), вытесняют водород из воды. Невозможность определения абсолютного потенциала не имеет решающего значения при изучении коррозионных процессов, так как в этих случаях достаточно знать только относительные величины электродных потенциалов.
[c.22]
Все металлы, имеющие потенциал более электроотрицательный относительно нормального водородного электрода (НВЭ), вытесняют водород из воды. Невозможность определения абсолютного потенциала не имеет решающего значения при изучении коррозионных процессов, так как в этих случаях достаточно знать только относительные величины электродных потенциалов.
[c.22]Водородный электрод представляет собой пластинку из платинированной платины (платина, покрытая рыхлым слоем платины), погруженную в раствор серной кислоты, через который пропускается водород под давлением 1 атм. Концентрация ионов Н в таком растворе поддерживается постоянной (С = = 1 г-ион л). [c.19]
Только золото и платина устойчивы в обычных атмосферных условиях к коррозии. Приведенные в табл. 12 и 13 данные представляют собой относительные значения нормальных электродных потенциалов, т. е. разность потенциалов между исследуемым электродом и стандартным электродом сравнения (за нуль принят электродный потенциал нормального водородного электрода). Если же стандартный электрод заменим вторым металлом, опустим их в раствор электролита и замкнем цепь, то получим гальванический элемент, электродвижущая сила [c.121]
В этой таблице значение потенциала водородного электрода равно нулю. Это не значит, что абсолютное значение разности потенциалов в двойном слое, образованном растворенными в металле (платине) молекулами водорода и ионами водорода, в растворе электролита равно нулю. Просто ввиду невозможности определения абсолютной разности потенциалов в двойном слое [c.38]
Конструкция электронного потенциостата была описана ранее [3]. Измерения электродного потенциала проводили по отношению к насыщенному каломельному электроду и пересчитывали их относительно водородного электрода. Вспомогательным электродом в термостатируемой ячейке служила платина. Растворы хлористого натрия, имитирующие морскую воду, подкисляли соляной кислотой и использовали в отдельных сериях опытов для сравнительной оценки щелевого эффекта. [c.28]
Таким образом, из анализа этих кривых можно сделать вывод, что Р1 и особенно Рс1, насыщенные водородом, обладают более высоким перенапряжением водорода, чем ненасыщенные (особенно при невысоких плотностях тока). Отсюда следует, что пассивирующее влияние платины и особенно влияние палладия, находящегося в контакте с титаном, будет зависеть от степени насыщения водородом этих контактных материалов. Еще заметнее это может проявиться в условиях, когда потенциал полной пассивации титана будет более положителен, чем потенциал обратимого водородного электрода. [c.298]
Водородный электрод с потенциалом, равным нулю, состоит из платины (покрытой платиновой чернью), погруженной в раствор кислоты, в котором [c.29]
Виды потенциалов. Весьма распространены случаи возникновения двойных слоев в результате адсорбции газов в электролите. Примером может служить поведение платины в электролите, содержащем растворенный кислород или водород. Последний, адсорбируясь поверхностью металла, приводит к появлению кислородного или водородного электрода. При коррозии стали в нейтральной или щелочной воде, содержащей кислород, катодом чаще всего является кислородный электрод в кислой же среде — водородный электрод. [c.9]
Водородный электрод (рис. 20, а) представляет собой металлическую пластинку, впаянную в стеклянную трубку. На поверхность электрода наносится слой металла в тонкодисперсной активной форме, а к трубке подводится газообразный водород. Тонкодисперсный слой металла активно адсорбирует Hj так, что пластинка покрывается полностью слоем водорода. Пластинку изготавливают чаще всего из платины. Потенциал водородного электрода условно принимается за нулевой при любых температурах и в любых растворителях. Воспроизводимость водородного электрода может быть хорошей только при тщательном контроле степени чистоты электролита и водорода, определенной глубине погружения и малых токах нагрузки. Кроме водных растворов, водородный электрод эффективен в спиртах, ацетоне, бензоле, жидком аммиаке. Электрод не применим в растворах, содержащих окислители (нитраты, хлораты, марганцевокислые соли и т. д.) или вещества, способные восстанавливаться (ненасыщенные органические соединения, алкалоиды, некоторые амины и др.) он плохо работает в растворах, содержащих благородные металлы (Au, Ag, Hg). Существенным недостатком электрода является необходимость подачи газообразного водорода. В то же время он не имеет конкурентов в метрологическом аспекте. [c.213]
Рост невидимых пленок на платиновом электроде. Интересное приложение закона роста пленок дал Хор в своем объяснении неправильного поведения так называемого кислородного электрода. Потенциал кислорода имеет особое значение в вопросах коррозии. Если кислородный электрод ведет себя обратимо, его потенциал должен всегда быть на 1,23 V выше потенциала обратимого водородного электрода в той же жидкости. В действительности, чтобы получить свободный кислород на платиновом аноде в обычной электролитической ванне, требуется гораздо более высокий потенциал, нежели соответствующий обратимому значению. При попытке применить кислородный электрод (например платиновый электрод, омываемый кислородом) в качестве катода электрохимического элемента (дающего ток) потенциалы получаются гораздо ниже теоретических значений. Таким образом кислородный электрод в вы>сшей степени необратим. Если вместо платины в качестве основания кислородного электрода применить железо или другой менее благородный металл, получаемые потенциалы гораздо ниже, будучи в действительности не очень далеки от величин, характерных для данного металла, до некоторой степени облагороженного присутствием кислорода. [c.128]
Потенциал нормального водородного электрода — это потенциал платинированной платины, насыщенной водородом при 1 ат давления и погруженной в кислоту с нормальной активностью водородных ионов. В этом случае переход элементарного водорода с электрода в жидкость уравновешивается переходом водородных ионов нз жидкости на электрод. Очевидно, увеличение давления водорода в атмосфере (и отсюда увеличение концентрации водорода на платине) увеличит изменение в первом направлении. [c.334]
Величины электродных потенциалов оказывают большое влияние на характер коррозионного процесса, т. е. необходимо знать значения этих потенциалов и действительную разность потенциалов между металлом и раствором электролита. В настоящее время нет экспериментальных способов измерения и теоретических методов расчета абсолютных значений электродных потенциалов, поэтому измеряют относительные значения потенциалов, используя для этого так называемые электроды сравнения. За основной электрод сравнения принят стандартный водородный электрод (рис. 47), представляющий собой электрод из платинированной (черненой) платины 1, погруженный в раствор кислоты 2 с активностью ионов Н+, равной 1 г-ион/л. [c.86]
Упругостно-электрические ПЭ (УЭПЭ) — это концентрационные газовые гальванические элементы. В них электрический ток возникает в результате самопроизвольного выравнивания концентраций (пропорциональных давлениям) двух растворов одного электролита. Простейшим примером этого типа ПЭ является ком-бпнация двух водородных электродов из платины, работающих при различных давлениях Р2- Платина выполняет роль но- [c.129]
Это предположение было обоснованным, так как многие исследования показали, что присутствие ряда органических веществ, особенно нитро- и нитрозосоединений, перемещает потенциал платино-водородного электрода далеко в положительную сторону [8 91. Помимо того, было доказано, что практически всю анодную поляризационную кривую, приведенную на рис. 17, можно получить путем подбора серии окислителей с широким набором редокс-потен-циалов [85 88]. И. Л. Розенфельд и его сотрудники создали широкую номенклатуру эффективных ингибиторов, в которых сочетаются пас-сивационные и адсорбционные свойства, что способствует защите черных и многих цветных металлов от коррозии. Это достигается в результате перевода металла в пассивное состояние при восстановлении окислительного компонента ингибитора, адсорбция других компонентов ингибитора сокращает активную поверхность и облегчает достижение пассивности. [c.51]
По механизму процесса коррозия разделяется на химическую и электрохимическую. Химическая коррозия заключается в самопроизвольном разрушении металлов вследствие химического взаимодействия с сухими газами или жидкими неэлектролитами нефтью, беизином, керо сином, жидким бромом и др. При химическом взаимодей ствии металла образуются соединения РеО, РеЗ и др Самым распространенным видом химической кoppoзи является газовая коррозия, т. е. коррозия металлов в га зах при высокой температуре. Этому виду коррозии под вергаются детали машин и конструкций, работающие пр1 повышенных температурах (двигатели внутреннего сгорания, газовые турбины и др.). Электрохимическая коррозия заключается в разрушении металлов жидкими электролитами. Распространенным видом электрохимической коррозии является ржавление деталей и конструкции во влажном воздухе, трубопроводов в земле и т. п. Электрохимическая коррозия определяется теми же процессами, что и работа гальванических элементов. При погружении металла в электролит положительно заряженные ионы металла будут переходить в раствор. В результате металл, потеряв часть положительных зарядов, становится заряженным отрицательно, а электролит— положительно и на границе металл — электролит возникает скачок потенциала. Непосредственно этот скачок потенциала не может быть измерен, но можно определить электродвижущую силу между отрицательно заряженным металлом (один электрод) и стандартным водородным электродом, потенциал которого условно принимается за нуль. Эту э. д. с. принято называть электродным потенциалом металла. Водородный электрод представляет собой пластинку платины, погруженную в раствор с заданной концентрацией ионов водорода при определенном давлении газообразного водорода. Металлы могут иметь электродный потенциал как более высокий, так и более низкий, чем у водородного электрода [c.151]
Определение pH растворов с водородным электродом. Водородным электродом обычно служит пластивка платинированной платины . частично погруженаая в раствор, содержащий ионы водорода и омываемый током газообразного водорода. [c.306]
Промышленные кислородомеры на основе полярографического метода применяют в двух модификациях с открытой электродной газопередающей системой типа ИКАР (рис. 5.20) п с закрытой электродной системой — с полимерной мембраной (мембранные кислородомеры). В приборе ИКАР газом-носителем является водород, полученный в водородном электролизе, заполненном раствором КОН. В электрохимической ячейке используют пару электродов — платинированная платина и золото. Платинированная платина в растворе, насыщенном водородом, приобретает свойства водородрого электрода, на котором в буферном растворе (pH 9,2) возникает устойчивый потенциал, равный 0,54 В. Этот потенциал через сопротивление нагрузки ячейки приложен к золотому электроду, на котором происходит вос- [c.239]
Подобно тому как с помощью табличньгх значений свободной энергии Гиббса образования можно рассчитывать константы равновесия химических реакций, пользуясь таблицами стандартных электродных потенциалов, можно рассчитать константы равновесия электрохимических реакций. Каждой электродной реакции приписан определенный потенциал, при этом действует соглашение о том, что потенциал платино-водородного электрода Н ] равен нулю. Иначе говоря, потенциал электродной реакции Н+ -Ь е Н2(г.) на платиновом электроде принят за потенциал сравнеьшя, а потенциалы всех остальных электродных реакций измеряют относительно него . Стандартными электродными потенциалами называются такие потенциалы, у которых активности всех реагентов и продуктов равны единице при Т = 298,15 К. Для любой электрохимической ячейки сумма соответствующих стандартных потенциалов равна ЭДС. Так как такие потенциалы соответствуют ситуации, когда все активности равны единице, из уравнения Нернста следует, что стандартный потенциал элемента равен Уо- [c.266]
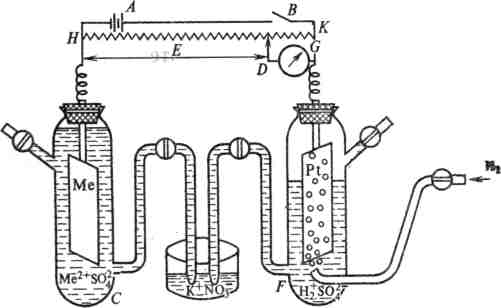
Так как электродные потенциалы играют очень большую роль в коррозионных процессах, то весьма важно знать значения этих потенциалов, а отсюда и действигельную разность потенциалов между металлом и раствором электролита. Однако абсолютные значения потенциалов до сих пор не удалось определить. Нет достаточно надежных методов экспериментального измерения или теоретического вычисления абсолютных значений потенциалов, и вместо абсолютных электродных потенциалов измеряют относительные, пользуясь для этого так называемыми электродами сравнения. Этот принцип определения значений электродных потенциалов основан на том, что если определить э. д. с. коррозионных элементов, составленных последовательно из большинства технических металлов и какого-нибудь одного, одинакового во всех случаях электрода, потенциал которого условно принят за нуль, то измеренные э. д. с. указанных элементов позволят сравнить электрохимическое поведение различных металлов. В качестве основного электрода сравнения принят так называемый стандартный водородный электрод, представляющий собой электрод из черненой (платинированной) платины, погруженный в раствор кислоты с активностью ионов Н+, равной 1 г пон1л. Через раствор продувается водород под давлением 1,01.3-10 н м -. Пузырьки водорода адсорбируются на платине, образуя как бы водородную пластинку, которая, подобно металлу, обменивает с раствором положительные ионы. На рис. 10 показано, как составляется цепь из водородного электрода и другого электрода при измерении относительных электродных потенциалов. [c.23]
В качестве электрода сравнения используют обычно нормапь-ный водородный электрод, потенциал которого условно принят за нуль. Он представляет собой платиновый электрод, погруженный в раствор кислоты с единичной концентрацией (активностью) ионов водорода и контактирующий с газообразным водородом, давление которого постоянно и равно 0,981 10 Па. Температура всей этой системы равна 25 С. На платине в момент измерения потенциала протекает химическая реакция + + e 0,5Hj. [c.18]
Одной из характеристик коррозионного процесса является действующая разность между потенциалами металла и раствора электролита. Поскольку точно эту характеристику определить невозможно, то вместо абсолютных потенциалов определяют относительные. В качестве электрода сравнения при этом используют водородный, каломельный, хлоросеребряный и др. [12]. Основным электродом сравнения принят так называемый стандартный водородный электрод, состоящий из платина-платинированного электрода, помещенного в раствор кислот с активностью ионов Н , равной 1 модь/л. На электрод подается газообразный водород, пузырьки которого адсорбируются на пластине, образуют своего рода «водородную пластину, которая обменивается с раствором положительными ионами. [c.7]
При дальнейшем увеличении плотности тока потенциал значительно смещается в отрицательную сторону. Следует полагать, что в этом случае катодный процесс протекает с диффузионным ограничением. Весьма вероятно, что пленка продуктов коррозии препятствует диффузии реагентов из раствора к поверхности электрода. В связи с этим более значительная по толщине пленка продуктов коррозии, образующаяся в растворе с большей концентрацией кислорода, нивелирует влияние концентрации кислорода на величину предельного диффузионного тока. На платине и нержавеющей стали, как будет показано далее, количество образующихся продуктов коррозии незначительно, и в этом случае величина предельного диффузионного тока возрастает с концентрацией кислорода. В воде, насыщенной воздухом, роль водородной деполяризации вкатодном процессе невелика (см. табл. III-1). Железо в этом случае корродирует в основном с кислородной деполяризацией [111,7]. Однако при уменьшении концентрации кислорода в растворе роль водородной деполяризации возрастает. Например, в растворе сульфита натрия скорости реакций ионизации кислорода и разряда ионов водорода соизмеримы. В деаэрированной воде, содержащей несколько сотых долей миллиграмма кислорода на литр, коррозионный процесс железа протекает почти полностью с водородной деполяризацией. С увеличением температуры скорость реакции разряда иона водорода возрастает. Например, с ростом температуры от 240 до 360° С скорость его увеличивается в 2,5 раза. В соответствии с этим, при температурах около 300° С в нейтральных деаэрированных водных средах, коррозионный процесс железа протекает прак- [c.98]
Нормальный водородный электрод образуется при погружении в раствор кислоты (имеющей концентрацию ионов водорода равную 1 грамм-нона/л) платингфованной платины, омываемой газообразным водородом под давлением в 1 атмосферу. [c.19]
Определение К. в. и. может быть выполнено помощью одного из двух основных методов а,) электрохимического (потенциометрического), б)индикаторного. Электрохимический метод определения К. в. и. основан на измерении эдс концентрационной газовой водородной цепи, т. в. гальванич. элемента, в котором измеряется разность потенциалов между двумя водородными электродами, погруженными в две жидкости с различной величиной К. в.и. Водородные электроды изготовляют из благородного металла (чапда всего платины или золота), который насыщают [c.452]
Потенциал водородного электрода (рис. 8) измеряют при помощи электрода из платинированной платины, погруженной в раствор, насыщенный газообразным водородом при давлении 100 кн1м [c.31]
При измерении pH прикатодного слоя в растворе серной кислоты [208] применяли металловодородный электрод, описанный в работе [210.] В качестве катода использовали черненую платину. Потенциал исследуемого электрода измеряли относительно черненой платины, помещенной в том же растворе серной кислоты. Значение pH прикатодного слоя рассчитывали по формуле водородного электрода pH = /0,058, где Ек — потенциал электрода, найденный по кривой спада через 0,001 с. [c.181]
Стандартный водородный электрод представляет собой платиновую пластинку, покрытую свежеосаждеипой платиновой чернью (мелкодисперсная платина, способная поглощать большие количества водорода), погруженную в вышеуказанный раствор, содержащий ионы водорода, и насыщенную водородом при рнп = 1 стл (760 мм рт. ст.). Между платиновой пластинкой и раствором устанавливается равновесие и потенциал, соответствующий этому равновесию, условно принимают за нуль. Для определения величины электродных потенциалов составляют гальванический элемент, в котором одним электродом является водородный, а другим—металл, потенциал которого измеряют. [c.20]
ФТОР, F, химич. элемент подгруппы галоидов седьмой группы периодич. системы (аналог хлора, брома и иода). Порядковый номер 9 ат. в. 19,00 (Ф. является чистым элементом , изотопы его неизвестны). Элементарный Ф. представляет собой газ бледного желто-зеленого цвета с неприятным резким запахом, напоминающим запах хлора и озона. Вес 1 л Ф. при 0° и давлении 1 atm 1,71 г, плотность по отношению к воздуху 1,31. При сильном охлаждении Ф. превращается в сильно преломляющую свет желтую жидкость уд. в. ок. 1,1, кипящую при-187°. При еще более низкой i° он застывает в бледножелтую кристаллич. массу, плавящуюся при-223°, а при-252 становящуюся бесцветной. Газообразный Ф. состоит из двухатомных молекул. Как и остальные галоиды, Ф. является типичным металлоидом, обнаруживающим большую склонность к образованию отрицательно заряженных ионов, причем в отличие от остальных галоидов Ф. всегда одновалентен и никогда не образует электроположительной составной части соединений. Нормальный потенциал Ф (по отношению к водородному электроду) ра-вен + 2,8. В связи с этим в отношении реакционной способности Ф. среди химич. элементов стоит на первом месте. С водородом он соединяется даже в темноте, причем реакция сопровождается воспламенением или взрывом. Кроме того Ф. соединяется уже на холоду с бромом, иодом, фосфором, серой, мышьяком, сурьмой, бором, кремнием, аморфным углеродом и большинством металлов, причем соответствующие реакции сопровождаются часто явлениями воспламенения или взрыва. При t° красного каления Ф. соединяется даже с графитом, золотом и платиной. Кремнезем и силикаты под действием Ф. разрушаются, причем освобождается фтористый кремний SiFi и выделяется свободный кислород. От сероводорода, галоидоводородов, аммиака и воды Ф. отнимает водород, с к-рым при этом соединяется. [c.199]
В течение опыта электролит не перемешивался и не изолировался от окружающей среды. Вспомогательным электродом для поляризации служила платина, помещенная в том же сосуде, так как изолировать друг от друга катодное и анодное пространство под микроскопом не представлялось возможным. В качестве электрода-эталона применялся каломелевый электрод. Приведенные в работе значения потенциалов подсчитаны по отношению к водородному электроду. [c.14]
Вод од, обогащенный кислородом, пробу лькйвает через фоновый раствор электродного первядного преобразователя 5, вызывая его циркуляцию и обогащение кислородом. В качестве анода в электродном преобразователе 5 используется электрод из платинированной платины, который в фоновом буферном растворе с pH=9,2 представляет собой идеальный водородный электрод, развивающий потенциал 0,54 В. Золотой катод обладает селективностью по отношению к кислороду, и его потенциал зависит только от концентрации кислорода в растворе. [c.204]
До настоящего времени в ходу лабораторная посуда, электрохимические электроды и нерастворимые аноды из платины. Еще не так давно большое количество электрических печей сопротивления изготовлялось с платиновой обмоткой (ныне платиновая обмотка с большим успехом заменяется жаростойкими сплавами на железной основе с хромом и алюминием). До настоящего времени платина довольно часто применяется для термопар и неокисляющихся электроконтактов. В виде сплавО В платина применяется для фильер при производстве искусственного волокна. Используемся платина также в качестве контакта и катализатора при окислении аммиака в азотную кислоту. В некоторых химических производствах применяют обкладку платиновыми листами (толщиной не менее 0,1 мм) аппаратов и отдельных деталей приборов, работающих в наиболее агрессивных средах. Плагина стойка во многих минеральных и во всех органических кислотах и едких щелочах. Однако смесь соляной и азотной кислот, а также смесь соляной кислоты с другими сильными окислителями разрушают платину, хотя и заметно медленнее, чем золото. Чистые галогено-водородные кислоты при нормальных тем пературах почти не действуют на платину, однако при нагреве начинают воздействовать (причем более сильно бромисто-водородная и иодисто-водород-ная). Свободные галогены при высоких температурах также воздейст вуют на платину. Платина не окисляется ори нагреве на воздухе и з кислороде до температуры плавления, однако подвергается разрушению даже при гораздо более низких температурах в атмосферах, содержащих СО, или в контакте с углем, при одновременном наличии хлора или хлористых солей, вследствие способности образовывать летучие карбонил-хлориды платины. [c.577]
1.2 Стандартный водородный электрод. Измерение электродных потенциалов металлов. Уравнение Нернста.
Значения электродных потенциалов определяются относительно некоторого электрода, потенциал которого условно принят за нулевой. Таким эталонным электродом выбран водородный в стандартных условиях.
Стандартный водородный электрод состоит из стеклянного сосуда, заполненного 2Н (двунормальным) раствором H2SO4, в котором активность ионов Н+ равна единице 1 (1 моль/л). В этот раствор погружен электрод из платины, покрытый мелкодисперсной платиновой чернью для увеличения поверхности. При использовании водородного электрода через раствор H2SO4 пропускают химически чистый газообразный водород под давлением 100 кПа при T = 298 K (рисунок 2).
Боковая трубка с краном также заполнена раствором серной кислоты и служит для соединения водородного электрода с другим электродом. Водород хорошо растворяется в платине; при этом молекулы водорода частично распадаются на атомы (пластина катализирует этот распад). На поверхности соприкосновения платины с раствором кислоты может протекать окисление атомов или восстановление ионов водорода. Платина при этом практически не принимает участия в электродных реакциях и играет как бы роль губки, пропитанной атомарным водородом. Адсорбированный водород, взаимодействуя с молекулами воды, переходит в раствор в виде ионов, оставляя в пластине электроны.
При этом пластина заряжается отрицательно, а раствор положительно. Возникает скачек потенциала между пластиной и раствором. Наряду с переходом ионов в раствор идет обратный процесс восстановления ионов Н+ с образованием молекул водорода. Равновесие на электродном водороде можно представить в виде:
Н2 = 2Н+ + 2ē.
Потенциал водородного электрода воспроизводится с очень высокой точностью. Поэтому водородный электрод и принят в качестве эталона при создании шкалы электродных потенциалов.
Рисунок 2 – Рисунок 3 – Установка для определения
Стандартный водородный электрод электродных потенциалов
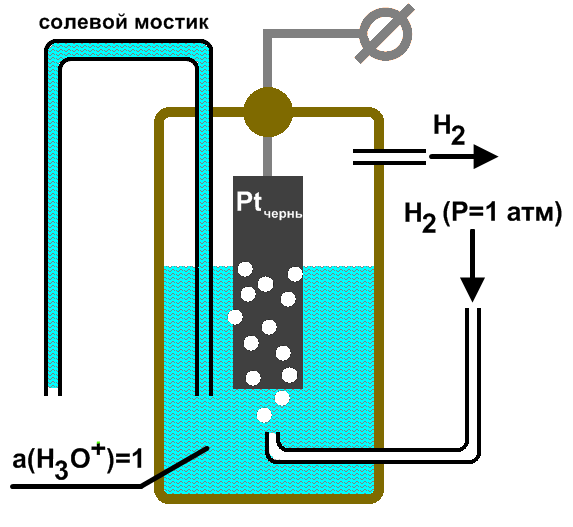
Для определения потенциала того или иного электродного процесса нужно составить гальванический элемент из испытуемого и стандартного водородного электродов и измерить его напряжение (рисунок 3). Поскольку потенциал стандартного водородного электрода равен нулю, то измеренное напряжение будет представлять собою потенциал данного электродного процесса.
Таким образом, стандартным электродным потенциалом Е0 металла называют его электродный потенциал, возникающий при погружении металла в раствор, в котором концентрация (или активность) собственных ионов равна 1 моль/л, измеренный по сравнению со стандартным водородным электродом, потенциал которого при 298 К условно принимается равным нулю.
Величина возникающего в результате этого процесса электродного потенциала определяется по уравнению Нернста:
,
где – электродный потенциал;
– стандартный электродный потенциал;
R – газовая постоянная;
Т – температура;
F – число Фарадея;
n – число электронов, участвующих в электронной реакции;
а – активная концентрация ионов металла в растворе.
Потенциал электрода, как видно из этого уравнения, зависит от активности (концентрации) ионов металла, которые являются потенциалопределяющими, от природы электролита, от природы электрода, от заряда иона и от температуры.
Перейдя от натуральных логарифмов к десятичным и подставив численные значения F, R и T = 298 K, а так же заменив активность на молярную концентрацию, получим удобную для расчетов форму уравнения Нернста:
.
7 Электродный потенциал. Водородная шкала потенциалов. Формула Нернста. Стандартный электродный потенциал
Лекция 7
Электродный потенциал. Водородная шкала потенциалов. Формула Нернста. Стандартный электродный потенциал.
Классификация электродов. Электроды первого и второго рода. Электроды сравнения. Газовые электроды. Амальгамные электроды. Окислительно-восстановительные электроды, правило Лютера. Хингидронный электрод, измерение рН.
ЭЛЕКТРОДНЫЙ ПОТЕНЦИАЛ.
Одна из основных особенностей электрохимической системы состоит в пространственном разделении участников протекающей в ней реакции. Общая реакция распадается здесь на две частные реакции, каждая из которых совершается на отдельном электроде. В соответствии с этим ЭДС электрохимической системы также должен представлять собой сумму двух электродных потенциалов : Е = j1 + j2.
Скачок потенциала на границе электрод-раствор (как и разность потенциалов между двумя точками, находящимися в различных фазах) экспериментально измерить невозможно. Величина такого скачка потенциала может быть рассчитана теоретически, но лишь в том случае, если точно известно строение границы раздела двух фаз. Структура границы между электродом и раствором изучена до сих пор недостаточно.
Экспериментально можно измерить лишь общее значение Е цепи, т.е. только сумму электродных потенциалов. Для устранения неопределённости величин j необходимо ввести дополнительное условие — принять потенциал какого-либо электрода равным 0 и относить к нему значения потенциалов всех других электродов. В этом случае потенциалы электродов даются в некоторой условной шкале и их значения зависят от природы электрода, выбранного за основу шкалы.
Нернст предложил считать условным нулём потенциал водородного электрода при концентрации водородных ионов в растворе, равной 1, и давлении газообразного водорода 1 атм. Эта условная шкала потенциалов называется водородной шкалой. В настоящее время применяется главным образом условная водородная шкала, в которой при всех Т за ноль выбран потенциал стандартного водородного электрода. Она отличается от первоначальной водородной шкалы Нернста тем, что в ней вместо единичных концентраций и давления выбраны единичная активность и летучесть. Это условие позволяет определять потенциалы электродов в водородной шкале при любых Т, однако при каждой Т потенциал водородного электрода может быть иным, то есть условный нуль не будет одним и тем же при разных Т.
Т.о., электродным потенциалом электрода называется ЭДС элемента, составленного из этого электрода (справа) и стандартного водородного электрода (слева), например :
(+) Pt ïH2 ç H+, aq çç Zn2+ ç Zn (-)
ЭДС этого элемента (jZn2+çZn) отрицательна (-0,763 В при активности ионов цинка в растворе, равной 1, — это и есть стандартный электродный потенциал цинка). Чтобы найти электродный потенциал меди, нужно составить элемент:
(-) Pt ïH2 ç H+, aq çç Cu2+ ç Cu (+)
Здесь ЭДС цепи (jCu2+çCu) положительна (+0,337 В при активности ионов меди, равной 1, — стандартный электродный потенциал меди).
Целесообразно в схеме полуэлемента записывать сочетание электрод + раствор иона в том порядке, который имеется в записи элемента, составленного из стандартного водородного электрода и данного; именно для записанного таким образом электрода следует приводить электродный потенциал с соответствующим знаком. При обратной записи следует изменить знак потенциала, например :
(1) Zn2+, aq ç Zn ; j = -0,763 B , (2) Zn ç Zn2+, aq ; j = +0,763 B
Только первый тип записи приводит к тем знакам величин j, которые соответствуют электродным потенциалам. Величины, соответствующие записи (2), не следует называть электродными потенциалами, но ими можно пользоваться при подсчете ЭДС цепи (для электродов, расположение которых в схеме цепи является обратным расположению их в сочетании с водородным электродом), например :
(-) Zn ç Zn2+, aq ç Cu2+, aq ç Cu (+)
+0,763 В +0,337 В
Е = j1 + j2 = 0,763 + 0,337 = 1,110 В
Диффузионный потенциал, возникающий на границе растворов ZnSO4-CuSO4, усложняет расчет.
Диффузионный потенциал возникает на границе двух растворов, отличающихся друг от друга и качественно, и количественно. Причина его возникновения — неодинаковая подвижность ионов электролита и наличие градиента их концентрации.
На границе двух растворов имеется некоторый переходный слой, где состав меняется от раствора I до раствора II и от раствора II до раствора I ; в этом переходном слое локализуется диффузионный потенциал. Ионы, обладающие большей подвижностью, диффундируют в более разбавленный раствор с большей скоростью, и поверхность соприкосновения двух растворов заряжается знаком этих ионов со стороны более разбавленного раствора и обратным знаком — со стороны концентрированного. Образуется диффузный двойной электрический слой с соответствующим скачком потенциала. Возникающая разность потенциалов будет ускорять движение медленно движущегося иона и замедлять движение быстро движущегося, пока не наступит стационарное состояние, при котором скорости диффундирующих ионов сравняются. Дальнейшее взаимное удаление зарядов прекращается ; установившаяся в пограничном слое разность потенциалов и носит название диффузионного потенциала.
Диффузионный потенциал — неравновесный. Точно его рассчитать в общем случае невозможно.
При измерениях невысокой точности можно существенно снизить диффузионный потенциал на границе двух растворов, включив между ними солевой мостик — концентрированный электролит (насыщенный KCl или NH4NO3) с числами переноса ионов, близкими к 0,5. Резкое уменьшение диффузионного потенциала в этом случае связано с тем, что ионы концентрированного раствора проводят практически весь ток в зонах соприкосновения ; один диффузионный потенциал заменяется при введении солевого мостика двумя потенциалами меньшей величины, часто противоположными по знаку.
С этой же целью используется введение индифферентной соли во все растворы цепи.
Зависимость величины электродного потенциала от концентрации (активности) вещества в электролите может быть установлена методами термодинамики. На электроде Мn+çМ с равновесным потенциалом j протекает электрохимическая реакция :
Мn+, aq + ne = М
Это — реакция дегидратации иона металла и включения его в кристаллическую решетку.
Для равновесного процесса при постоянных Р и Т убыль изобарного потенциала равна максимальной полезной работе А¢ — работе электрического тока :
А¢ = -DG = nFj
При переходе 1 г-иона металла из раствора в электрод изменение изобарного потенциала равно разности химических потенциалов вещества в двух фазах : в растворе (m¢) и в электроде (m¢¢) :
DG = m+¢¢ — m+¢
При Р,Т = const в электроде неизменного состава (чистый металл)
m+¢¢ = m+о = const
В растворе m+¢ = m+¢о + RT ln a+
m+¢о — химический потенциал иона в растворе в стандартном состоянии; эта величина при заданной Т постоянна.
DG = m+o — m+¢o — RT ln a+
j = — (m+o — m+¢o)/nF + ln a+
Первый член правой части уравнения при постоянных Р и Т — величина постоянная (для металлического электрода эта величина практически не зависит от давления). Можно обозначить ее символом jо :
j = jо + ln a+ (1)
В разбавленном растворе вместо активностей можно подставить концентрации (а+ ® m+ , c+ , N+) в зависимости от выбора меры концентрации и соответственно стандартного состояния для активности, например :
j = jо + ln m+ (2)
Уравнение (2) было выведено Нернстом (1888) иным путем. Это уравнение, а также более общее уравнение (1) носит название уравнения электродного потенциала Нернста.
jо — это потенциал электрода относительно раствора с активностью соответствующих ионов, равной 1. Он называется стандартным электродным потенциалом и зависит от температуры.
Считая g¢± » g¢+ и m+ » m± , для бинарного одно-одновалентного электролита (n = 1) имеем :
j = jо + ln a± = jо + ln m± + ln g¢±
Подставляя значение F и переходя от натуральных логарифмов к десятичным, получаем для n = 1 и Т = 298 К :
j = jо + 0,0591 lg m±g¢±
СТАНДАРТНЫЙ ЭЛЕКТРОДНЫЙ ПОТЕНЦИАЛ. Значение стандартного электродного потенциала не зависит от активностей участников электродной реакции и представляет собой константу, характерную для данного электрода. Стандартные потенциалы (табличные величины) отнесены к 25оС; их значения при других Т могут быть найдены по температурным коэффициентам, также сведенным в таблицу.
Стандартные потенциалы используются при решении многих проблем, связанных с химическим равновесием в растворах.
Любой электрод, расположенный ниже в ряду стандартных электродных потенциалов (т.е. более положительный), находится в более окисленном состоянии, чем электрод, расположенный выше (пример : элемент Даниэля-Якоби). Если из двух таких электродов составить электрохимическую систему, то на «нижнем» будет протекать реакция восстановления (Cu), а на «верхнем» — реакция окисления (Zn). Процесс идет в том же направлении, если активные вещества обоих электродов находятся в непосредственном контакте друг с другом и реакция протекает по химическому пути. Равновесие в системе наступит в тот момент, когда потенциалы двух электродных реакций сделаются одинаковыми. Такое состояние достигается при определенном соотношении активностей участников реакции, отвечающем константе ее равновесия (примеры : системы Ce3+, Ce4+ и Fe2+, Fe3+ ; Fe2+, Fe3+ и Sn2+, Sn4+ ; ряд активности металлов).
КЛАССИФИКАЦИЯ ЭЛЕКТРОДОВ.
Если на электроде протекает частная реакция
nA A + … + nF = nL L + …
то потенциал электрода определяется уравнением :
j = jо + ln
т.е. при заданных Т и Р определяется (кроме jо, который является константой) активностями веществ, участвующих в электродной реакции. Характер влияния активностей компонентов раствора на значение j связан с природой электродной реакции и лежит в основе классификации электродов. Принято различать электроды первого рода, второго рода, газовые, окислительно-восстановительные и некоторые специальные типы электродов.
ЭЛЕКТРОДЫ ПЕРВОГО РОДА.
Электроды первого рода можно схематически представить в виде Мn+ êМ (если электрод — металл) или в виде Меn— êМе (если электрод — металлоид). Электродную реакцию записывают как
Mn+ + ne ® M или Me + ne ® Men—
= + ln = + 2,303 lg
= + ln = — 2,303 lg
(т.к. активность чистого твердого вещества при заданной Т постоянна и можно принять ее условно равной 1).
Из уравнений следует, что потенциал электрода первого рода зависит от активности лишь одного вида ионов; эти ионы называются потенциалоопределяющими. В случае металлических электродов первого рода такими ионами являются катионы металла, а в случае металлоидных электродов — анионы металлоида. Примеры металлических электродов : металл, погруженный в раствор своей соли (Ag в растворе AgNO3 — Ag+ êAg ; Cu в растворе CuSO4 — Cu2+ êCu). Пример металлоидных электродов первого рода — селеновый электрод Se2- êSe.
Металлические электроды первого рода имеют большое практическое значение и легче реализуются, чем металлоидные.
ЭЛЕКТРОДЫ ВТОРОГО РОДА.
Электроды второго рода представляют собой полуэлементы, состоящие из металла, покрытого слоем его труднорастворимого соединения (соли, оксида, гидроксида) и погруженного в раствор, содержащий тот же анион, что и труднорастворимое соединение электродного металла. Схематически электрод второго рода можно представить как An— êMA êM , а протекающую в нем реакцию
MA + ne = M + An-
= + 2,303 lg = — 2,303 lg
(учитывая, что активности металла и твердого соединения МА постоянны).
Т.о., потенциал электрода второго рода определяется активностью анионов труднорастворимого соединения электродного металла. Однако электроды второго рода обратимы и по отношению к катионам электродного металла :
ПРМА =
= — 2,303 lg ПРМА + 2,303 lg =
+ 2,303 lg =
Из сопоставления потенциалов соответствующих электродов первого и второго рода можно найти ПР труднорастворимых солей.
Потенциалы электродов второго рода легко воспроизводимы и устойчивы, поэтому эти электроды часто применяют в качестве электродов сравнения, по отношению к которым измеряют потенциалы других электродов. Наиболее важны в практическом отношении каломельные, ртутно-сульфатные, хлорсеребряные, ртутнооксидные и сурьмяные электроды.
КАЛОМЕЛЬНЫЙ ЭЛЕКТРОД. Это ртуть, покрытая пастой из смеси каломели со ртутью, находящаяся в контакте с раствором KCl :
Cl— êHg2Cl2 êHg
Электродная реакция : Hg2Cl2 + 2e = Hg + 2 Cl—
jкал = jокал — 2,303 lg
При 25оС jкал = + 0,2678 — 0,059 lg
jкал определяется активностью ионов Cl—. Наиболее часто употребляются каломельные полуэлементы, в которых концентрация KCl — насыщенный раствор, 1.0 М или 0.1 М. Каломельные электроды, особенно насыщенный, удобны тем, что диффузионный потенциал, возникающий на границе данного раствора с насыщенным KCl, незначителен и во многих случаях его можно не принимать во внимание.
РТУТНО—СУЛЬФАТНЫЙ ЭЛЕКТРОД SO42- êHg2SO4 êHg аналогичен каломельному, ртуть покрыта слоем пасты из ртути и сульфата ртути (I), а в качестве раствора используется H2SO4. При 25оС :
jрт.с. = + 0,6156 — 0,0296 lg
ХЛОРСЕРЕБРЯНЫЙ ЭЛЕКТРОД представляет собой систему
Cl— êAgCl êAg
jхс = jохс — 2,303 lg = + 0,2224 — 0,059 lg
Ртутно-сульфатный и хлорсеребряный электроды целесообразно применять в тех случаях, когда исследуемый полуэлемент содержит в качестве электролита либо серную кислоту или сульфаты, либо соляную кислоту или хлориды. Чтобы уменьшить величину диффузионного потенциала, концентрацию этих электролитов в электродах сравнения следует брать такую же, как и в исследуемых полуэлементах.
МЕТАЛЛОКСИДНЫЕ ЭЛЕКТРОДЫ интересны тем, что здесь в роли анионов труднорастворимого соединения электродного металла выступают ионы гидроксида. К ним относятся, например, ртутнооксидный и сурьмяный электроды :
OH— êHgO êHg и OH— êSb2O3 êSb
Уравнения электродных реакций и потенциалов этих электродов :
HgO + H2O + 2e = Hg + 2OH— jрт.окс. = jорт.окс. — 2,303 lg
Sb2O3 + 3H2O + 6e = 2Sb + 6OH— jсурьм. = jосурьм. — 2,303 lg
Уравнения для электродного потенциала получены при допущении, что постоянны активности не только соответствующих металлов и их оксидов, но и воды, также принимающей участие в электродной реакции.
Металлоксидные электрода второго рода, как и металлсолевые электроды второго рода, обратимы по отношению не только к ионам гидроксила, но и к ионам электродного металла. Кроме того, они обратимы и по отношению к ионам водорода, потому что ионное произведение воды при заданной Т постоянно для любого водного раствора электролита.
Металлоксидные электроды можно применять как электроды сравнения в любых растворах кислот и щелочей, однако ртутнооксидный электрод вследствие заметной растворимости оксидов ртути в кислотах можно рекомендовать лишь для растворов с рН > 7. Сурьмяный электрод из-за неустойчивости состава его поверхностного оксида применять как электрод сравнения нельзя; он используется в качестве индикаторного электрода для приближенных определений рН в умеренно кислых и нейтральных растворах.
ГАЗОВЫЕ ЭЛЕКТРОДЫ.
Газовый электрод представляет собой полуэлемент, состоящий из металлического проводника, контактирующего одновременно с соответствующим газом и с раствором, содержащим ионы этого газа. Конструирование газового электрода невозможно без участия проводника с электронной проводимостью. Требования к металлу в газовых электродах : 1) должен ускорять медленно устанавливающееся электродное равновесие, т.е. служить катализатором электродной реакции; 2) потенциал металла в газовом электроде не должен зависеть от активности других ионов раствора, в частности от активности собственных ионов металла; 3) должен быть инертным по отношению к другим возможным реакциям; 4) должен обеспечивать создание максимально развитой поверхности раздела между фазами, на которой могла бы протекать обратимая реакция ионизации газа. Всем этим требованиям лучше всего удовлетворяет платина, электролитически покрытая платиновой чернью (платинированная платина). Газовые электроды очень чувствительны к изменению состояния поверхности платины, особенно к отравлению ее каталитическими ядами.
ВОДОРОДНЫЙ ЭЛЕКТРОД. Схема электрода :
H+ êH2 êPt
Электродная реакция : 2Н+ + 2е = Н2
= + 2,303 lg = 2,303 lg — 2,303 lg
(т.к. при всех Т принят равным нулю)
Потенциал водородного электрода определяется не только активностью ионов Н+, но и парциальным давлением газообразного водорода, следовательно, водородный электрод (как и все газовые электроды) более сложен, чем электроды первого и второго рода, потенциалы которых зависят непосредственно от активности частиц одного сорта.
Когда парциальное давление водорода равно 1 атм, уравнение упрощается : = — 2,303 рН , т.е. при определенных условиях потенциал водородного электрода дает непосредственное значение рН.
КИСЛОРОДНЫЙ ЭЛЕКТРОД. Схема электрода :
ОН— êО2 êPt
Электродная реакция : О2 + 2Н2О + 4е = 4ОН—
= + 2,303 lg =
+ 2,303 lg — 2,303 lg
В величину включена активность воды. При 25оС и = 1 атм
= 0,401 — 0,059 lg
Однако реализовать кислородный электрод на практике весьма трудно. Это обусловлено способностью кислорода окислять металлы, даже платину, поэтому на основную электродную реакцию накладывается реакция, отвечающая металлоксидному электроду второго рода. Кроме того, часть кислорода восстанавливается на электроде не до воды, а до ионов перекиси водорода. Поэтому значения потенциала кислородного электрода, полученные опытным путем, обычно не совпадают с теоретическими.
ХЛОРНЫЙ ЭЛЕКТРОД. Реализация обратимого газового хлорного электрода Cl— êCl2 êPt связана со значительными трудностями. Теоретически электродная реакция здесь проста : Cl2 + 2e = 2Cl— и электродный потенциал можно описать уравнением :
= + 2,303 lg
Однако на основной электродный процесс накладываются побочные реакции с участием хлора. Высокое положительное значение (+ 1,358 В при 25оС) затрудняет подбор устойчивого, не реагирующего с хлором материала электрода. Тем не менее при соблюдении определенных мер удалось получить опытные значения потенциалов хлорного электрода, совпадающие с теоретической величиной.
АМАЛЬГАМНЫЕ ЭЛЕКТРОДЫ.
Это полуэлементы, в которых амальгама какого-либо металла находится в контакте с раствором, содержащим ионы этого металла :
Мn+ êMm, Hg mMn+ + mne ® Mm (Hg)
Ртуть ведет себя как инертная среда, в которой растворен металл, а потенциалоопределяющими являются ионы этого металла :
= + 2,303 lg
т.е. потенциал зависит от активности ионов металла не только в растворе, но и в амальгаме. Если металл находится в ртути в атомарном состоянии (m=1), то можно написать :
= + 2,303 lg
Амальгамные электроды широко применяются в технике и в лабораторной практике. Кадмиевый амальгамный электрод Cd2+ êCd, Hg (Cd2+ + 2e ® Cd (Hg)) в виде амальгамы, содержащей 12,5% Cd, используется для изготовления нормальных элементов Вестона, ЭДС которых практически не изменяется со временем.
ОКИСЛИТЕЛЬНО-ВОССТАНОВИТЕЛЬНЫЕ, или РЕДОКСИ-ЭЛЕКТРОДЫ. Любая электродная реакция связана с изменением окислительно-восстановительного состояния участвующих в ней веществ, и в этом смысле все электроды представляют собой редокси-системы. Однако термин окислительно-восстановительные, или редокси-электроды, употребляется обычно в тех случаях, когда в реакции не участвуют непосредственно металлы или газы. Металл в редокси-электроде, обмениваясь электронами с участниками окислительно-восстановительной реакции, принимает потенциал, отвечающий установившемуся редокси-равновесию. К металлическому проводнику предъявляются здесь те же требования, что и в случае газовых электродов.
Следует различать простые и сложные редокси-электроды. В первом случае электродная реакция сводится к перемене валентности ионов без изменения их состава, например :
Fe3+ + e = Fe2+
Tl3+ + 2e = Tl+
MnO4— + e = MnO42-
Fe (CN)63- + e = Fe (CN)64-
Если обозначить окисленные ионы Ox, а восстановленные Red, то все написанные выше реакции можно выразить одним общим уравнением :
Ox + ne = Red
Простой редокси-электрод записывается в виде схемы :
Red, Ox êPt
а его потенциал дается уравнением
jRed,Ox = joRed,Ox + 2,303 lg
Как видно, потенциал простого редокси-электрода определяется отношением активностей ионов в двух различных степенях окисления. Если элемент образует ионы нескольких валентностей, то ему будет отвечать столько редокси-электродов, сколько можно получить попарных сочетаний (три валентности — три различных редокси-электрода).
Потенциалы простых редокси-электродов можно легко связать с потенциалами соответствующих электродов первого рода. Пусть, например, металл М способен существовать в растворе в виде ионов высшей валентности Мh и низшей валентности Mn. Для него возможны два электрода первого рода MhêM и Mn êM и один редокси-электрод Mn, Mh êM , стандартные потенциалы которых соответственно равны , и . Связь между этими величинами можно найти, проведя мысленно процесс электрохимического растворения металла М с получением ионов высшей валентности Mh либо непосредственно, либо через промежуточное образование ионов низшей валентности Mn. Предполагается, что процесс растворения протекает обратимо и изотермически в бесконечно большом объеме раствора, в котором активности ионов каждого сорта равны 1. Этот процесс можно представить в виде следующего простого цикла :
— hFjoh
M —-® Mh
— nFjon æ ä — (h-n)Fjon,h
Mn
Из цикла следует : hjoh = njon + (h — n)jon,h
Это уравнение известно как правило Лютера ; по нему можно рассчитать стандартный потенциал любого из трех электродов, если известны значения стандартных потенциалов двух других электродов. Уравнение применяется в тех случаях, когда непосредственное определение одного из потенциалов или затруднительно, или невозможно. Так, например, потенциал электрода первого рода Fe3+ | Fe , измерить который непосредственно не удается из-за неустойчивости в этих условиях ионов Fe3+, можно найти из доступных прямому измерению стандартных потенциалов электрода первого рода Fe2+ | Fe и простого редокси-электрода Fe2+, Fe3+| Fe : = +
В сложных редокси-электродах реакция протекает с изменением валентности реагирующих частиц и их состава. В реакциях такого рода участвуют обычно ионы водорода и молекулы воды; участие молекул воды не сказывается на характере уравнений для электродного потенциала, т.к. активность воды в ходе реакции (за исключением очень концентрированных растворов) остается постоянной. Схему сложного редокси-электрода можно записать следующим образом :
Red, Ox, H+ | Pt
Т.о., потенциал сложного редокси-электрода является функцией не только активностей окисленных и восстановленных частиц, но и активности водородных ионов. Например, для системы MnO4— — Mn2+, в которой протекает электродная реакция
MnO4— + 8H+ + 5e = Mn2+ + 4H2O
потенциал электрода передается уравнением :
= + ln =
= + 2,303 lg + 2,303 lg
Сложные редокси-электроды можно использовать как индикаторные электроды при измерении рН. Для этой цели часто применяют электрод, обратимый по отношению к системе хинон-гидрохинон. Для системы хинон-гидрохинон (х, гх) с реакцией
С6Н4О2 + 2Н+ + 2е = С6Н4(ОН)2
потенциалу электрода отвечает уравнение
jх, гх = jох, гх + 2,303 lg = jох, гх + 2,303 lg +
+ 2,303 lg
В раствор, рН которого хотят измерить, вводят эквимолярную смесь хинона и гидрохинона. Если считать, что отношение концентраций равно отношению активностей
= = 1
то уравнение упрощается до
jх, гх = jох, гх + 2,303 lg = jох, гх — 2,303 рН
и потенциал такого электрода, обычно называемого хингидронным , будет определяться непосредственно значением рН раствора. При 25оС jох, гх = 0,6992 В ; температурная зависимость jох, гх хорошо изучена. Хингидронный электрод легко приготовляется и удобен в работе. Хингидронным электродом нельзя пользоваться в щелочных растворах (гидрохинон — слабая кислота, в щелочной среде он сильно диссоциирует и концентрация его в насыщенном растворе не является постоянной), а также в присутствии сильных окислителей или восстановителей.
Потенциал — хингидронный электрод — Большая Энциклопедия Нефти и Газа, статья, страница 3
Потенциал — хингидронный электрод
Cтраница 3
Найти рН раствора, в котором потенциал хингидронного электрода равен 0 400 В. [31]
Она подобна формуле ( 42) потенциала хингидронного электрода. Разница заключается в том, что нормальные потенциалы водородного и хингидронного электродов неодинаковы. Нормальный потенциал водородного электрода, как уже было сказано, условно принят равным нулю. [32]
Из уравнения ( 7) видно, что потенциал хингидронного электрода является линейной функцией величины рН раствора. [33]
Вычислить водородный показатель и активность ионов Н раствора, в котором потенциал хингидронного электрода, измеренный относительно нормального водородного электрода при 18 С, равен 0 400 В. [34]
При измерении рН более щелочных растворов ( рН 8 — 9) потенциал хингидронного электрода становится отрицательнее потенциала каломелевого электрода, поэтому необходимо поменять полюсы электродов. [35]
Отрицательные значения k и АрНс означают, что рН, найденные по потенциалу хингидронного электрода, завышены. В растворах солей общая ошибка приблизительно аддитивна. [36]
Формула показывает, что при увеличении или уменьшении концентрации Н — ионов в 10 раз потенциал хингидронного электрода изменяется в ту же сторону на 59 мв. Это — указанный выше нормальный потенциал хингидронного электрода. [37]
Формула показывает, что при увеличении или уменьшении концентрации Н — ионов в 10 раз потенциал хингидронного электрода изменяется в ту же сторону на 59 мв. Это — приведенный выше нормальный потенциал хингидронного электрода. [39]
Хингидронный электрод представляет собой платиновую пластинку, опускаемую в измеря-емый раствор, в который добавляется особое химическое вещество — хингидрон. Потенциал хингидронного электрода закономерно изменяется с изменением рН раствора. Сравнительным электродом является каломельный или второй хингидронный электрод, погруженный в стандартный раствор. В последнем случае электроды помещают в разные сосуды, которые соединяют сифоном, заполненным раствором хлористого калия. Его нельзя применять для измерений в слабобуферных растворах, проточных растворах или больших емкостях, поэтому он используется только в лабораторных условиях. [40]
Хингндронный электрод представляет собой платиновую пластинку, опускаемую в измеряемый раствор, в который добавляется особое химическое вещество — хингидрон. Потенциал хингидронного электрода закономерно изменяется с изменением рН раствора. [42]
Для определения концентрации водородных ионов или при потенциометрическом титровании кислот достаточно внести небольшое количество хингйдрона в испытуемый раствор и погрузить в этот раствор платиновый электрод. Потенциал хингидронного электрода устанавливается быстро и концентрационно правильно. [43]
Для определения концентрации ионов водорода или при потенцио-метрическом титровании кислот достаточно внести небольшое количество хингидрона в испытуемый раствор и погрузить в этот раствор платиновый электрод. Потенциал хингидронного электрода устанавливается быстро и концентрационно правильно. [44]
При определении рН с хингидронным электродом в мутных жидкостях возможна избирательная адсорбция хинона и гидрохинона на взвеси. Так как в этом случае отношение концентраций хинона и гидрохинона изменится, то и значение рН, вычисленное по изменившемуся потенциалу хингидронного электрода, будет искажено. Для того чтобы уменьшить ошибку, рекомендуется энергичное перемешивание раствора. [45]
Страницы: 1 2 3 4
23.5: Стандартный водородный электрод — Chemistry LibreTexts
Человеческая склонность сравнивать себя с кем-то другим. Могу ли я бежать быстрее тебя? Я выше своего отца? — это относительные сравнения, которые не дают много полезных данных. Когда мы используем стандарт для наших сравнений, одно гораздо более сопоставимо с другим. Один метр — это одинаковое расстояние во всем мире, поэтому 100-метровая трасса в одной стране — это точно такое же расстояние, как 100-метровая трасса в другой стране — это универсальная основа для сравнения времени бега, например.
Стандартный водородный электрод
Ряд активности позволяет нам предсказать относительную реакционную способность различных материалов при использовании в окислительно-восстановительных процессах. Мы также знаем, что можем создать электрический ток с помощью комбинации химических процессов. Но как предсказать ожидаемое количество тока, которое будет проходить через систему? Мы измеряем этот поток как напряжение (электродвижущую силу или разность потенциалов).
Для этого нам нужен способ сравнения степени электронного потока в различных химических системах.0 \), стандартный редукционный потенциал.
Затем мы можем использовать эту систему для измерения потенциалов других электродов в полуячейке. Во втором полуячейке находится металл и одна из его солей (часто используется сульфат). -} \ rightarrow \ ce {H_2} \ left ( g \ right) \: \ left (\ text {катод — уменьшение} \ right) \ end {align} \]
Измеренное напряжение ячейки равно 0.0_ \ text {ячейка} = 0,34 \: \ text {V} \: \ left (\ text {медь} \ right) — \ left (-0,76 \: \ text {V} \: \ text {цинк} \ right ) = 1,10 \: \ text {вольт для ячейки} \]
Водородный электрод
ОНА — термодинамически безупречно! Но . . .
S стандартный H водород E лектрод (SHE) официально является термодинамическим 0,0 В точка отсчета для всех возможных измерений при всех температурах. Это легко определить, но не удобно реализовывать строго.
Сколько кислоты нужно для приготовления раствора с a = 1? Комптон и Сандерс (3) предлагают [H + ] = 1,18 M , но это число будет другим для серной и соляной кислоты. кислоты, так как коэффициенты активности разные.
Все не намного лучше, если подумать о парциальном давлении водорода. Давление водяного пара составляет около 25 мм рт. ст. при комнатной температуре. Итак, даже если барометрический давление 760 мм рт. ст., парциальное давление насыщенного водой водорода всего 735 мм рт.
Используя 1M H + и используя общую давление в одну атмосферу каждый вносит ошибку только около 5 мВ.Ошибки имеют противоположные стороны, поэтому они имеют тенденцию отменяться.
NHE — Синоним?SHE также иногда называют NHE , для N или обычного H водорода. E лектрод. «Нормальный» наводит на мысль о НПП, «Нормальный каломельный электрод», заполненный 1 N KCl. Я подозреваю, что у многих возникла такая ассоциация. К счастью, разность потенциалов между 1 M (или 1 N ) HCl и HCl @ a = 1 маленький.
В таблицах на этом веб-сайте я использовал NHE, потому что именно так в большинстве цитируемых ссылок перечислил потенциалы.
RHE — Практическое руководство!Реверсивный водородный электрод (RHE) — довольно практичный и воспроизводимый электрод «стандарт». Термин относится к водородному электроду, погруженному в электролит. решение фактически использовано. Я бы предположил, что полное давление (, а не парциальное давление водорода) составляет одну атмосферу.Этот электрод является фаворит тех, кто изучает водородный UPD на Pt электродах в H 2 SO 4 . Никакие посторонние ионы не вводятся, а водород должен присутствовать. в любом случае!
Реверсивный водородный электрод доступен в продаже от Гаскатель. Этот продуманный дизайн заполняет внутреннюю часть корпус электрода водородом. Они используют платину на углеродном носителе. катализатор в качестве газодиффузионного электрода, который находится в контакте с водородом с фиксированным давлением атмосфера внутри и решение снаружи.Свяжитесь с производитель для более подробной информации.
Произошла ошибка при настройке пользовательского файла cookie
Этот сайт использует файлы cookie для повышения производительности. Если ваш браузер не принимает файлы cookie, вы не можете просматривать этот сайт.
Настройка вашего браузера для приема файлов cookie
Существует множество причин, по которым cookie не может быть установлен правильно. Ниже приведены наиболее частые причины:
- В вашем браузере отключены файлы cookie.Вам необходимо сбросить настройки вашего браузера, чтобы он принимал файлы cookie, или чтобы спросить вас, хотите ли вы принимать файлы cookie.
- Ваш браузер спрашивает вас, хотите ли вы принимать файлы cookie, и вы отказались. Чтобы принять файлы cookie с этого сайта, нажмите кнопку «Назад» и примите файлы cookie.
- Ваш браузер не поддерживает файлы cookie. Если вы подозреваете это, попробуйте другой браузер.
- Дата на вашем компьютере в прошлом. Если часы вашего компьютера показывают дату до 1 января 1970 г., браузер автоматически забудет файл cookie.Чтобы исправить это, установите правильное время и дату на своем компьютере.
- Вы установили приложение, которое отслеживает или блокирует установку файлов cookie. Вы должны отключить приложение при входе в систему или проконсультироваться с системным администратором.
Почему этому сайту требуются файлы cookie?
Этот сайт использует файлы cookie для повышения производительности, запоминая, что вы вошли в систему, когда переходите со страницы на страницу. Чтобы предоставить доступ без файлов cookie потребует, чтобы сайт создавал новый сеанс для каждой посещаемой страницы, что замедляет работу системы до неприемлемого уровня.
Что сохраняется в файле cookie?
Этот сайт не хранит ничего, кроме автоматически сгенерированного идентификатора сеанса в cookie; никакая другая информация не фиксируется.
Как правило, в файлах cookie может храниться только информация, которую вы предоставляете, или выбор, который вы делаете при посещении веб-сайта. Например, сайт не может определить ваше имя электронной почты, пока вы не введете его. Разрешение веб-сайту создавать файлы cookie не дает этому или любому другому сайту доступа к остальной части вашего компьютера, и только сайт, который создал файл cookie, может его прочитать.
Док Примечания к редакции химии уровня A Brown ТеоретическиеФизические Продвинутый уровень Химическое равновесие Примечания к пересмотру химического равновесия ЧАСТЬ 7.3 7.3 Водород Электрод, стандартный электродный потенциал, стандартные условия и обозначение ячейки Что такое стандартный водород? электрод сконструирован? Стандартный электродный потенциал полуячейка основана на произвольном нуле для иона водорода / водорода газовый полуэлемент.Что такое стандартный электродный потенциал? Что мы имеем в виду по стандартным условиям? Примечания по химическому равновесию, часть 7, индекс 7,3 Водородный электрод, стандартный электродный потенциал и стандартные условия
Рис.4
Рис.5 Рис.1
Примечания по химическому равновесию, часть 7, индекс НАЧАЛО СТРАНИЦЫ Примечания по химическому равновесию, часть 7, индекс |
Стандартный водородный электрод и ЭДС
N После того, как у нас есть стандарт, мы можем найти разность потенциалов цинкового полуэлемента путем сравнения.Тем не мение, Прежде чем подключать внешнюю цепь, запомните, что на каждом электроде происходят следующие равновесные реакции:
H 2 (Pt электрод) 2H + (раствор) + 2 e — (электрод)
Zn (электрод) Zn 2+ (раствор) + 2 e — (электрод)
B потому что цинк имеет большую склонность к ионизации, чем газообразный водород, на цинковом электроде будет установлен более высокий потенциал.Итак, когда мы замыкаем цепь и соединяем провода, электроны потекут. вниз градиент потенциала от цинковой полосы к платиновому электроду. Это разность потенциалов — вот что заставляет электроны течь. В составе В этой большой ячейке цинковый электрод действует как анод :
Zn (электрод) Zn 2+ (раствор) + 2 e — (электрод)
Одновременно на платиновой полоске происходит восстановление иона водорода; этот электрод действует как катод :
2e — (электрод) + 2H + (раствор) H 2 (Pt электрод)
T Разность потенциалов, которая движет потоком электронов от атомов цинка к ионам водорода, называется электродвижущей силой и может быть измерена с помощью вольтметра.Эта сила представляет собой просто сложение потенциалов, генерируемых полуэлементами окисления и восстановления:
E ° нетто = E ° вол + E ° красный
W Если поток электронов спонтанный, E ° net положительный. В этой реакции, поскольку наш стандарт определен как вклад точно 0 В (при стандартных условиях), E ° net будет потенциальным вкладом от реакции окисления, происходящей на цинковом электроде:
E ° нетто = E ° вол + E ° красный
E ° net = E ° Zn + E ° SHE
E ° zn = E ° net — E ° SHE
E ° zn = E ° net — (0) = E ° net
A ctivate Рисунок 4 , чтобы найти потенциал ячейки , измеренный в вольтах, который перемещает электроны между цинковым и стандартным водородным электродами.
Нажмите на рисунок, чтобы найти потенциал клетки.
Хорошо!
восстановление Zn будет иметь такой же потенциал величины, как и окисление.
Помните стандартный потенциал для SHE — 0 В.
B Перед тем, как перейти к следующей странице, вы должны понять, как создается градиент потенциала на одном электроде и между двумя полуячейками.Вы также должны понимать принцип действия и функции стандартного водородного электрода (SHE) .
Стандартный водородный электрод: определение химического состава
Стандартный водородный электрод — это стандартное средство измерения электродного потенциала для термодинамической шкалы окислительно-восстановительных потенциалов. Стандартный водородный электрод часто обозначается аббревиатурой SHE или может называться обычным водородным электродом (NHE). Технически SHE и NHE разные. NHE измеряет потенциал платинового электрода в 1 н. Растворе кислоты, в то время как SHE измеряет потенциал платинового электрода в идеальном растворе (текущий стандарт нулевого потенциала при всех температурах).
Стандарт определяется потенциалом платинового электрода в окислительно-восстановительной полуреакции
2 H + (водн.) + 2 e — → H 2 (г) при 25 ° C.
Строительство
Стандартный водородный электрод состоит из пяти компонентов:
- Платинированный платиновый электрод
- Кислотный раствор с активностью ионов водорода (H + ) 1 моль / дм 3
- Пузырьки газообразного водорода
- Hydroseal для предотвращения воздействия кислорода
- Емкость для крепления второго полуэлемента гальванического элемента.Для предотвращения смешивания можно использовать либо солевой мостик, либо узкую трубку.
На платинированном платиновом электроде происходит окислительно-восстановительная реакция. Когда электрод погружается в кислотный раствор, через него проходят пузырьки газообразного водорода. Концентрация восстановленной и окисленной формы сохраняется, поэтому давление газообразного водорода составляет 1 бар или 100 кПа. Активность ионов водорода равна формальной концентрации, умноженной на коэффициент активности.
Зачем нужна платина?
Платина используется для SHE, поскольку она устойчива к коррозии, катализирует реакцию восстановления протонов, имеет высокую плотность собственного обменного тока и дает воспроизводимые результаты.Платиновый электрод платинирован или покрыт платиновым черным, поскольку это увеличивает площадь поверхности электрода и увеличивает кинетику реакции, поскольку он хорошо адсорбирует водород.
Источники
- Ives, D. J. G .; Янц, Г. Дж. (1961). Электроды сравнения: теория и практика . Академическая пресса.
- Ramette, R. W. (октябрь 1987 г.). «Устаревшая терминология: обычный водородный электрод». Журнал химического образования . 64 (10): 885.
- Sawyer, D. T .; Собковяк, А .; Робертс, Дж. Л., младший (1995). Электрохимия для химиков (2-е изд.). Джон Уайли и сыновья.
стандартных понижающих потенциалов | Безграничная химия
Стандартные понижающие потенциалы
Стандартные восстановительные потенциалы обеспечивают систематическое измерение тенденции к снижению различных молекул.
Цели обучения
Напомним, что положительный потенциал восстановления указывает на термодинамически благоприятную реакцию по сравнению с восстановлением протона до водорода
Основные выводы
Ключевые моменты
- Восстановительный потенциал измеряет тенденцию молекулы к сокращению за счет поглощения новых электронов.
- Стандартный восстановительный потенциал — это восстановительный потенциал молекулы при определенных стандартных условиях.
- Стандартные восстановительные потенциалы могут быть полезны при определении направленности реакции.
- Восстановительный потенциал данного вещества можно рассматривать как отрицательный по отношению к окислительному потенциалу.
Ключевые термины
- уменьшить : добавить электроны / водород или удалить кислород.
- стандартный водородный электрод : окислительно-восстановительный электрод, который составляет основу термодинамической шкалы окислительно-восстановительных потенциалов; используется в качестве стандарта, по которому измеряются другие электроды.
Понижающий потенциал
Восстановительный потенциал (также известный как окислительно-восстановительный потенциал, окислительно-восстановительный потенциал или E h ) измеряет склонность химического вещества приобретать электроны и тем самым уменьшаться. Потенциал восстановления измеряется в вольтах (В) или милливольтах (мВ). У каждого вида есть свой собственный восстановительный потенциал. Чем более положительный потенциал, тем больше у вида сродство к электронам или тем сильнее вид сокращается.
Окисление-восстановление в гальваническом элементе : В этом гальваническом элементе цинк восстанавливает катионы меди.В результате образуются катионы цинка и нейтральная металлическая медь.
Стандартный восстановительный потенциал (E 0 ) измеряется при стандартных условиях:
- 25 ° С
- Концентрация 1 М для каждого иона, участвующего в реакции
- Парциальное давление 1 атм для каждого газа, участвующего в реакции
- Металлы в чистом виде
Стандартный понижающий потенциал
Стандартный восстановительный потенциал определяется относительно электрода сравнения стандартного водородного электрода (SHE), которому произвольно задан потенциал, равный 0.00 вольт. Приведенные ниже значения в скобках представляют собой стандартные потенциалы восстановления для полуреакций, измеренные при 25 ° C, 1 атмосфере и pH 7 в водном растворе.
- CH 3 COOH + 2H + + 2e — → CH 3 CHO + H 2 O (-0,58)
- 2H + + 2 e — → H 2 (0,0)
- O 2 + 2H + + 2e — → H 2 O 2 (+0,7)
- O 2 + 4H + + 4e — → 2H 2 O (+1.64)
Так как потенциал восстановления измеряет внутреннюю тенденцию веществ к восстановлению, сравнение стандартного потенциала восстановления для двух процессов может быть полезно для определения того, как будет протекать реакция.
Исторически многие страны, включая США и Канаду, использовали в своих расчетах стандартные потенциалы окисления, а не восстановительные. Это просто отрицательные значения стандартных восстановительных потенциалов, поэтому на практике это несложно.Однако, поскольку они также могут называться «окислительно-восстановительными потенциалами», IUPAC предпочитает термины «потенциалы восстановления» и «потенциалы окисления». Их можно четко различить, используя символ E 0 r для восстановления и E 0 o для окисления.
Прогнозирование спонтанного направления окислительно-восстановительной реакции
Направление окислительно-восстановительной реакции зависит от относительной силы окислителей и восстановителей в растворе.
Цели обучения
Предсказать направление потока электронов в окислительно-восстановительной реакции с учетом восстановительных потенциалов двух полуреакций
Основные выводы
Ключевые моменты
- Иногда направление окислительно-восстановительной реакции можно определить путем оценки относительной силы восстановителей и окислителей.
- В ситуациях, когда электрохимический ряд недостаточен для абсолютного определения направления окислительно-восстановительной реакции, можно использовать стандартный электродный потенциал E o .
- Отрицательное значение потенциала клетки указывает на восстанавливающую среду, а положительное значение указывает на окислительную среду.
Ключевые термины
- стандартный потенциал электрода : потенциал электрода, измеренный при стандартных условиях (298 K, 1 атм и 1 M).
Прогнозирование полуреакций окислительно-восстановительного потенциала
Обычно направление окислительно-восстановительной реакции зависит от относительной силы окислителей и восстановителей в растворе.В простых ситуациях электрохимическая серия может быть очень полезна для определения направления реакции.
Электрохимический ряд : Чтобы предсказать, будут ли два реагента участвовать в спонтанной окислительно-восстановительной реакции, важно знать, какое место они занимают в электрохимическом ряду.
В представленной таблице наиболее легко восстанавливаемым элементом является Li, а наиболее легко окисляемым — железо. Это означает, что Li будет записан как полуреакция восстановления по сравнению с любым другим элементом в этой таблице.С другой стороны, Fe будет записан как полуреакция окисления по сравнению с любым другим элементом в этой таблице.
Некоторые реакции нельзя «наблюдать» таким образом. Эти реакции требуют более математического метода определения направления. Чтобы понять это, важно учитывать стандартный электродный потенциал, который является мерой движущей силы реакции. Знак стандартного потенциала электрода указывает, в каком направлении должна протекать реакция, чтобы достичь равновесия.\ text {o} = 0,00 \ V [/ латекс]
E o = 0,76 В
Положительное значение E o указывает, что на STP эта реакция должна идти вправо, чтобы достичь равновесия. Другими словами, положительное значение E o указывает на то, что реакция имеет константы равновесия, которые благоприятствуют продуктам.
Что происходит со стандартным потенциалом электрода, когда реакция записывается в обратном направлении? Ни относительная сила окислителя или восстановителя, ни величина потенциала не изменятся.\ text {o} = -0.76 \ text {V} [/ latex]), потенциал ячейки меняется на противоположный.
Относительные реакционные способности различных полуреакций можно сравнивать, чтобы предсказать направление потока электронов. Уравнения полуреакции можно объединить, если обратиться к окислению таким образом, чтобы нейтрализовать электроны.
Прогнозирование растворения металла в кислоте
Металл растворим в кислоте, если он вытесняет H 2 из раствора, что определяется стандартным восстановительным потенциалом металла.
Цели обучения
Предсказать, будет ли металл растворяться в кислоте, учитывая его восстановительный потенциал
Основные выводы
Ключевые моменты
- Некоторые металлы обладают более сильной «замещающей» способностью, чем другие, что указывает на то, что они с большей вероятностью уменьшатся.
- Хотя H 2 не является металлом, его все же можно «заменить» некоторыми сильно восстанавливающими металлами.
- Тенденция металла «вытеснять» газообразный водород из кислого раствора определяет его растворимость; если металл не может вытеснить водород, он не будет окисляться и останется нерастворимым.
- Вы можете определить, будет ли металл растворяться в кислоте, сравнив стандартный восстановительный потенциал металла с потенциалом газообразного водорода.
Ключевые термины
- уменьшить : добавить электроны / водород или удалить кислород.
- окислить : Увеличить валентность (положительный заряд) элемента за счет удаления электронов.
Деятельность металлов
Некоторые металлы можно считать более «активными», чем другие, в том смысле, что более активный металл может заменить менее активный из раствора его соли.{2+} + \ text {Cu} (\ text {s}) [/ latex]
Здесь цинк более активен, чем медь, потому что он может заменять медь в растворе. Если погрузить кусок металлического цинка в раствор медного купороса, поверхность цинка быстро покроется слоем мелкодисперсной меди. Синий цвет раствора уменьшается по мере замещения иона меди (II).
Подобные сравнения других металлов позволили расположить их в порядке увеличения их электронодонирующей или понижающей мощности.Эта последовательность известна как электродвижущая или активная серия металлов.
- Уровень активности 1 (высший): Li, K, Ca, Na
- Уровень активности 2: Mg, Al, Mn, Zn, Fe
- Уровень активности 3: Ni, Sn, Pb
- Уровень активности 4 (самый низкий): Cu, Ag, Pt, Au
Серия действий
Ряд активности долгое время использовался для предсказания направления окислительно-восстановительных реакций. Рассмотрим, например, упомянутое выше окисление меди металлическим цинком.{2+} + \ text {Cu} (\ text {s}) [/ latex]
Старомодный способ выразить это — сказать, что «цинк заменит медь из раствора».
Обратите внимание, что в таблице также учтена замена водорода (H 2 ). Хотя H 2 не является металлом, его все же можно «заменить» некоторыми сильно восстанавливающими металлами. Тенденция металла «заменять» газообразный водород из кислого раствора будет определять его растворимость в этом растворе.
Редукционные потенциалы
Каждая полуячейка связана с разностью потенциалов, величина которой зависит от природы конкретной электродной реакции и от концентраций растворенных веществ.- \ rightarrow \ text {Zn} (\ text {s}) [/ latex]
В ячейке Zn (s) | Zn 2+ (водн.) || Cu 2+ (водн.) | Cu (s), цинк появляется слева, указывая на то, что он окисляется, а не восстанавливается. По этой причине разность потенциалов, вносимая левой полуячейкой, имеет знак, противоположный ее обычному восстановительному потенциалу полуячейки. Эти значения могут быть определены с использованием стандартных потенциалов восстановления, которые часто можно найти. Используя стандартные восстановительные потенциалы реакции, можно определить, насколько вероятно, что данный металл будет принимать или отдавать электроны.\ text {o} = 0,00 \ V [/ латекс]
Сложение двух полуреакций дает общее уравнение и положительное значение для E 0 . Это означает, что реакция происходит самопроизвольно, и Zn растворяется в HCl.
Термодинамика окислительно-восстановительных реакций
Термодинамика окислительно-восстановительных реакций может быть определена с использованием их стандартных восстановительных потенциалов и уравнения Нернста.
Цели обучения
Перевести между константой равновесия / коэффициентом реакции, стандартным восстановительным потенциалом и изменением свободной энергии Гиббса для данной окислительно-восстановительной реакции
Основные выводы
Ключевые моменты
- Окислительно-восстановительные реакции — это реакции, при которых электроны переносятся между частицами.
- Уравнение Нернста позволяет рассчитать восстановительный потенциал окислительно-восстановительной реакции в «нестандартных» условиях.
- Когда система находится в состоянии равновесия, уравнение Нернста можно упростить и записать в терминах константы равновесия K, которая, в свою очередь, позволяет вывести уравнение для определения изменения свободной энергии Гиббса ([латекс] \ Delta \ text {G} [/ latex]) реакции.
Ключевые термины
- Свободная энергия Гиббса : термодинамический потенциал, который измеряет «полезную» или инициирующую процесс работу, получаемую от термодинамической системы при постоянной температуре и давлении.
- стандартный восстановительный потенциал : восстановительный потенциал реакции, измеренный при стандартных условиях: 25 ° C, концентрация 1 M для каждого участвующего иона, парциальное давление 1 атм для каждого газа и металлы в чистом состоянии.
Понижающий потенциал
Для расчета термодинамических величин, таких как изменение свободной энергии Гиббса [латекс] \ Delta \ text {G} [/ latex] для общей окислительно-восстановительной реакции, необходимо использовать уравнение, называемое уравнением Нернста.Вальтер Нернст был немецким химиком и физиком, который в начале 20 века разработал уравнение, связывающее восстановительный потенциал, температуру, концентрацию и количество переносимых электронов.
