Что такое электрод сварочный, и его назначение
Сварочный электрод представляет собой стержень из электропроводного материала (металлического или неметаллического), который предназначен для подачи напряжения к свариваемой детали. Сегодня на рынке имеется более двухсот различных марок электродов, причем большая часть выпускаемого ассортимента приходится на плавящиеся электроды, которые предназначены для ручной дуговой сварки.
Что такое электрод, и из какого материала он изготавливается
Сварочные электроды изготавливают из электропроводного материала, а в зависимости от материала они разделяются на виды:
- металлические – стальные, чугунные, латунные, медные, бронзовые, вольфрамовые и другие;
- металлические плавящиеся электроды – покрытые и комбинированные, сварочные пластины, а также ленты сплошного сечения;
- металлические неплавящиеся электроды – вольфрамовые электродные стержни, электроды для контактной сварки;
- неплавящиеся неметаллические электроды – графитовые и угольные.

Электроды, покрытые для ручной дуговой сварки
- Электроды, покрытые для ручной дуговой сварки, изготавливаются в виде стержней, как правило, длиной от 250 до 700 мм из сварочной проволоки с нанесением на нее слоя покрытия. На одном конце электрода длиной 20-30 мм покрытие не наносится для его закрепления в держателе.
- Длина электрода зависит от химического состава стержня и его диаметра. Например, стержни с небольшим диаметром, состоящие из высоколегированных сталей, изготавливают более короткими для уменьшения сопротивления электрическому току и, соответственно, нагрева при сварке, а стержни небольшого диаметра из низкоуглеродистых сталей имеют высокую электропроводность и, следовательно, могут быть длиннее.
Сварочные электроды должны обеспечивать:
- устойчивость горения дуги, равномерность плавления металла и стабильность переноса его в сварочную ванну;
- защиту металла сварочной ванны и расплавленного металла электрода от воздуха;
- получение требуемых механических свойств и химического состава металла шва;
- минимальные потери на разбрызгивание, угар и хорошее формирование шва;
- по возможности высокую производительность сварочного процесса;
- хорошую отделимость и удаляемость шлака с поверхности шва;
- достаточную стойкость покрытия механическим повреждениям;
- минимальную токсичность выделяющихся при сварке газов, соблюдение санитарно-гигиенических норм;
Что такое электроды сварочные
В процессе электродуговой сварки электрод служит проводником электрического тока непосредственно к предмету сварки. Электроды имеют довольно узкую специализацию, но, несмотря на это, типов и марок электродов насчитывается огромное множество. Электроды должны соответствовать некоторым условиям:
Электроды имеют довольно узкую специализацию, но, несмотря на это, типов и марок электродов насчитывается огромное множество. Электроды должны соответствовать некоторым условиям:
- дуга горения должна быть неизменной;
- образование качественного шва;
- определённый химический состав металла в сварном шве;
- при наименьшем уровне разбрызгивания металла электрода, должна поддерживаться высокая производительность сварки;
- лёгкость отделения образований шлака в результате сварке;
- сохранение химических, технологических и физических характеристик при дальнейшем хранении;
- минимальная токсичность при сварке;
Устройство электрода
Для изготовления электродов применяют металлические стержни или сварочную проволоку, которые проводят электрический ток, их химический состав влияет на качество электродов.
Применение электродов с кислым покрытием препятствует образованию пор в сварном шве. Единственным минусом при такой сварке является возможность появления на шве горячих трещин. Основное покрытие представляет собой
Основное покрытие представляет собой
Главным преимуществом рутилового покрытия является то, что при минимальном разбрызгивании металла образуется качественный шов. Но ударная вязкость и пластичность, в отличие от основного покрытия, намного ниже, что обусловлено наличием включений оксида кремния.
Целлюлозный тип покрытия включает в себя большое количество органических компонентов (до 50%). С применением односторонней сварки на весу можно добиться получения равномерного обратного шовного валика.
ХиМиК.ru — ЭЛЕКТРОДЫ — Химическая энциклопедия
ЭЛЕКТРОДЫ в электрохимии, электронно-проводящие
фазы, контактирующие с ионным проводником (электролитом). Часто под электродом
понимают лишь одну электронно-проводящую фазу. При пропускании тока от
внеш. источника через систему из двух электродов, соединенных друг с другом
через электролит, на электродах протекают два процесса: заряжение двойного электрического
слоя и электрохим. р-ция. В отличие от фазовых контактов металл-металл,
металл-полупроводник, полупроводник-полупроводник и т. п. на границе фаз,
составляющих электрохим. систему, вид носителей тока меняется, т. к. в
электролите ток переносится ионами, а в электронно-проводящей фазе — электронами.
Непрерывность прохождения тока через границу фаз в этом случае обеспечивается
электродной р-цией.
Классификация электродов проводится по природе
окислителей и восстановителей, к-рые участвуют в электродном процессе. Электродом 1-го рода наз. металл (или неметалл), погруженный в электролит, содержащий
ионы этого же элемента. Металл электрода является восстановленной формой в-ва,
а его окисленной формой — простые или комплексные ионы этого же металла
(см. Электрохимическая кинетика). Напр., для системы Сu
Сu
где E° — стандартный потенциал при
т-ре Т;-
термодинамич. активность ионов Сu2+; F — постоянная Фарадея; R -
газовая постоянная. К электродам 1-го рода относятся амальгамные электроды, т. к. для
них восстановленная форма — амальгама металла, а окисленная — ионы этого
же металла. Напр., для амальгамы таллия устанавливается равновесие: Tl
активность ионов Сu2+; F — постоянная Фарадея; R -
газовая постоянная. К электродам 1-го рода относятся амальгамные электроды, т. к. для
них восстановленная форма — амальгама металла, а окисленная — ионы этого
же металла. Напр., для амальгамы таллия устанавливается равновесие: Tl
где aтl, — термодинамич. активность
таллия в амальгаме.
Электроды 2-го рода- системы из металла М, покрытого
слоем его же труднорастворимой соли
(или оксида) и погруженного в р-р, содержащий анионы этой соли (для оксида
-ионы ОН—). Окисленной формой является соль
а восстановленная форма представлена металлом М и анионом A
гдеz
— зарядовое число иона. В системе устанавливается равновесие между
атомами М и анионами Az-в р-ре, к-рое включает два «парциальных»
равновесия: между металлом и катионом соли и между анионом соли в ее твердой
фазе и анионом в р-ре. Такие электроды наз. обратимыми по аниону.
Такие электроды наз. обратимыми по аниону.
Ур-ние Нернста имеет вид:
К электродам 2-го рода относятся многие электроды
сравнения, напр. каломельный, хлорсеребряный, оксидно-ртутный.
Электроды 3-го рода- системы из металла, контактирующего
с двумя труднорастворимыми солями. В результате электрохим. р-ции на электроде
менее растворимая соль превращается в более растворимую, а потенциал электрода
определяется термодинамич. активностью катионов более растворимой соли.
Так, в системе Рb2+| РbС12, AgCl, процесс Ag происходит
Металл электрода может не участвовать в р-циях,
а служить лишь передатчиком электронов от восстановленной формы в-ва к
окисленной; такие электроды наз. окислительно-восстановительными или редокс-электродами.
Напр., платиновый электрод в р-ре, содержащем ионы [Fe(CN)6]4-
и [Fe(CN)6]3-, осуществляет перенос электронов между
этими ионами в качестве передатчика (медиатора). Среди окислит.-восстановит.
электродов выделяют газовые электроды, состоящие из химически инертного металла (обычно
Pt), к к-рому подводится электрохимически активный газ (напр., Н2
или С12). Молекулы газа адсорбируются на пов-сти металла, распадаясь
на адсорбиров. атомы, к-рые непосредственно участвуют в переносе электронов
через границу раздела фаз. Наиб. распространен водородный электрод,на пов-сти
к-рого образуются адсорбир. атомы Надс и устанавливается равновесие:
Н2
2Надс
2Н+ + 2е. Разл. типы электродов можно объединить в рамках т. наз. концепции
электронного равновесия на границе металл-электролит, согласно к-рой каждому
равновесному электродному потенциалу соответствует определенная термодинамич.
активность электронов в электролите.
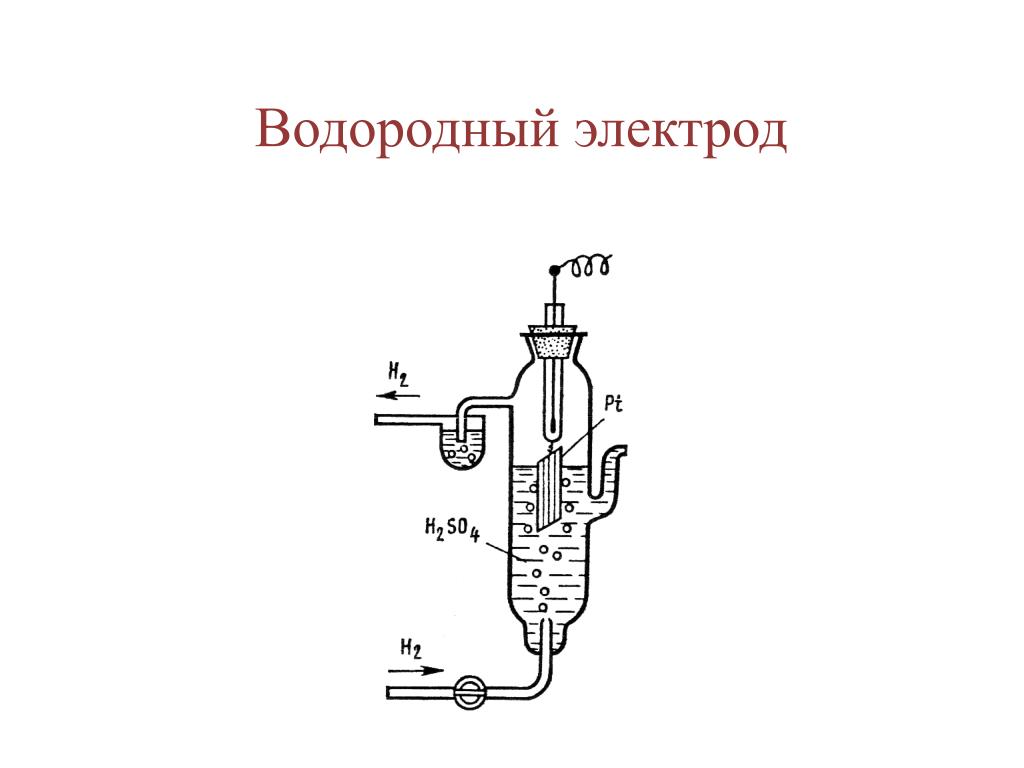
Среди окислит.-восстановит.
электродов выделяют газовые электроды, состоящие из химически инертного металла (обычно
Pt), к к-рому подводится электрохимически активный газ (напр., Н2
или С12). Молекулы газа адсорбируются на пов-сти металла, распадаясь
на адсорбиров. атомы, к-рые непосредственно участвуют в переносе электронов
через границу раздела фаз. Наиб. распространен водородный электрод,на пов-сти
к-рого образуются адсорбир. атомы Надс и устанавливается равновесие:
Н2
2Надс
2Н+ + 2е. Разл. типы электродов можно объединить в рамках т. наз. концепции
электронного равновесия на границе металл-электролит, согласно к-рой каждому
равновесному электродному потенциалу соответствует определенная термодинамич.
активность электронов в электролите.
Электроды наз. идеально поляризуемым, если вследствие
термодинамич. или кинетич. причин переход электронов через межфазную границу
невозможен. При изменении потенциала такого электрода происходит только изменение
строения двойного электрич. слоя, что сопровождается протеканием тока заряжения,
спадающего до нуля, когда перестройка двойного электрич. слоя заканчивается
(см. Ток обмена). Для неполяризуемых, или обратимых, электродов переход
электронов через границу фаз, напротив, незаторможен, и при пропускании
тока через такой электрод его потенциал практически не изменяется.
При изменении потенциала такого электрода происходит только изменение
строения двойного электрич. слоя, что сопровождается протеканием тока заряжения,
спадающего до нуля, когда перестройка двойного электрич. слоя заканчивается
(см. Ток обмена). Для неполяризуемых, или обратимых, электродов переход
электронов через границу фаз, напротив, незаторможен, и при пропускании
тока через такой электрод его потенциал практически не изменяется.
По функциям в электрохим. системе электроды подразделяют
на рабочие, вспомогательные и электроды сравнения. Рабочим наз. электрод, на
к-ром происходит исследуемый электрохим. процесс. Вспомогат. электрод (или противоэлектрод)
обеспечивает возможность пропускания тока через электрохим. ячейку, а электрод
сравнения — возможность измерения потенциала рабочего электрода. Специфика широко
используемых в электрохимии жидких электродов (ртуть, амальгамы, галлий, жидкие
сплавы на основе Ga -галламы, расплавы металлов и т. п.) связана с идеальной
гладкостью их пов-сти, истинная площадь к-рой совпадает с ее геом. величиной,
а также с энергетич. однородностью и изотропностью св-в пов-сти электродов и возможностью
растворения выделяющихся металлов в материале электрода.
п.) связана с идеальной
гладкостью их пов-сти, истинная площадь к-рой совпадает с ее геом. величиной,
а также с энергетич. однородностью и изотропностью св-в пов-сти электродов и возможностью
растворения выделяющихся металлов в материале электрода.
На практике электроды классифицируют по хим.
природе материала (металлические, неметаллические, оксидные, электроды из соед.
с ковалентной связью, углеграфитовые и т.д.), форме (сферические, плоские,
цилиндрические, дисковые и т. д.), условиям функционирования (неподвижные,
вращающиеся и т. п.), размерам (микро- и ультрамикроэлектроды), пористости,
гидрофильности, участию электродного материала в электродном процессе (расходуемые
и нерасходуемые) и др. признакам. Использование капельного ртутного электрода
лежит в основе полярографии. Вращающийся дисковый электрод представляет
интерес как система, для к-рой существует строгое решение диффузионной
кинетич. задачи. К особо практически важным электродам следует отнести каталитически
активные и высоко коррозионностойкие оксидные рутениево-титановые аноды
(ОРТА), применение к-рых революционизировало самое широкомасштабное электрохим. произ-во — электролитич. получение хлора и щелочей.
произ-во — электролитич. получение хлора и щелочей.
Модифицирование электроды, получившее широкое
распространение в электрокатализе, произ-ве химических источников
тока, электрохимических сенсоров и т. п., основано как на физических
(ионная имплантация, разрыхление пов-сти, выращивание монокристаллич. граней,
создание монокристаллич. структур, физ. адсорбция ионов и молекул и др.),
так и хим. методах. В частности, химически модифицированные электроды представляют
собой проводящий или полупроводниковый материал, покрытый мономолекулярными
(в т. ч. субатомными), полимолекулярными, ионными, полимерными слоями,
в результате чего электрод проявляет хим., электрохим. и/или оптич. св-ва слоя.
Хим. модифицирование достигается хемосорбцией на пов-сти электрода ионов и молекул,
ковалентным связыванием разл. агентов с поверхностными атомными группами,
покрытием пов-сти орг., металлорг. или неорг. полимерными слоями, созданием
композитов из электродного материала и в-ва -модификатора.
Микроэлектроды имеют по крайней
мере один из размеров настолько малый, что св-ва электродов оказываются размерно
зависимыми. Размеры микроэлектродов лсжат в интервале 0,1-50 мкм, миним.
площадь составляет 10-14 м2 (ультрамикроэлектроды),
тогда как в большинстве электроаналит. экспериментов применяют электроды с площадью
5 х 10-5м2, в лаб. электросинтезе — 10-2
м2. Осн. преимущество микроэлектродов — возможность снизить
с их помощью диффузионные ограничения скорости электродного процесса и,
следовательно, изучать кинетику очень быстрых электродных р-ций. Из-за
малой величины токов электрохим. ячейки с микроэлектродами характеризуются
незначительным омич. падением потенциала, что позволяет изучать системы
с высокими концентрациями реагирующих частиц, обычно используемые в технол.
процессах, применять высокие скорости сканирования потенциала при вольтамперометрич. измерениях, проводить работы в плохо проводящих средах и т. п. Микроэлектроды
используют для анализа ультрамалых проб, исследования процессов в живых
организмах, в клинич. целях. Ультрамикроэлектроды применяют в туннельной
сканирующей микроскопии и в электрохим. нанотехнологии.
измерениях, проводить работы в плохо проводящих средах и т. п. Микроэлектроды
используют для анализа ультрамалых проб, исследования процессов в живых
организмах, в клинич. целях. Ультрамикроэлектроды применяют в туннельной
сканирующей микроскопии и в электрохим. нанотехнологии.
См. также Ионоселективные электроды,
Псевдоожиженный электрод, Суспензионный электрод.
Лит.: Дамаскин Б.Б., Петрий О. А., Электрохимия, М., 1987; Багоцкий B.C., Основы электрохимии, М., 1988.
О.А. Петрий.
ЭЛЕКТРОД — это… Что такое ЭЛЕКТРОД?
ЭЛЕКТРОД — ЭЛЕКТРОД, электрода, муж. (от слова электричество и греч. hodos дорога) (физ.). Часть проводника (обыкн. в виде пластинки), через которую электрический ток вводится в жидкость или газ. Положительный электрод (анод). Отрицательный электрод (катод) … Толковый словарь Ушакова
электрод — а, м. électrode f. <гр. elektron смола, янтарь + hodos дорога, путь. 1. Проводник в виде пластинки, стержня, шара и т. п., через который электрический ток вводится в жидкость или газ. БАС 1. Электроды. Точки, через которые электрический ток… … Исторический словарь галлицизмов русского языка
1. Проводник в виде пластинки, стержня, шара и т. п., через который электрический ток вводится в жидкость или газ. БАС 1. Электроды. Точки, через которые электрический ток… … Исторический словарь галлицизмов русского языка
электрод — антикатод, катод, анод, динод Словарь русских синонимов. электрод сущ., кол во синонимов: 10 • анод (1) • антикатод … Словарь синонимов
электрод — полупроводникового прибора; электрод Элемент полупроводникового прибора, обеспечивающий электрическую связь между определенной областью прибора и соответствующим выводом. Примечание. Под выводом понимается электрически соединенный с электродом… … Политехнический терминологический толковый словарь
электрод — Токопроводящая деталь, назначение которой контактировать со средой с различной удельной проводимостью. [РД 01.120.00 КТН 228 06] электрод [IEV number 151 13 01] EN electrode conductive part in electric contact with a medium of lower conductivity… … Справочник технического переводчика
ЭЛЕКТРОД — (от электро. .. и греческого hodos путь), конструктивный элемент электронного или электротехнического прибора (установки, устройства), служащий для гальванической связи участка электрической цепи, приходящегося на рабочую среду прибора (вакуум,… … Современная энциклопедия
.. и греческого hodos путь), конструктивный элемент электронного или электротехнического прибора (установки, устройства), служащий для гальванической связи участка электрической цепи, приходящегося на рабочую среду прибора (вакуум,… … Современная энциклопедия
ЭЛЕКТРОД — (от электро… и греч. hodos путь) конструктивный элемент электронного или электротехнического прибора (установки, устройства), служащий для гальванической связи участка электрической цепи, приходящегося на рабочую среду прибора (вакуум, газ,… … Большой Энциклопедический словарь
ЭЛЕКТРОД — ЭЛЕКТРОД, а, м. (спец.). Толковый словарь Ожегова. С.И. Ожегов, Н.Ю. Шведова. 1949 1992 … Толковый словарь Ожегова
ЭЛЕКТРОД — (Electrode) часть проводника (обычно в виде пластинки, проволоки или сетки), через которую ток вводится в данную жидкость или газ. См. Анод и Катод. Самойлов К. И. Морской словарь. М. Л.: Государственное Военно морское Издательство НКВМФ Союза… … Морской словарь
Электрод — – в сварке металлический или неметаллический стержень из электропроводящего материала, предназначенный для подвода тока к свариваемому изделию. Сварочные электроды делятся на плавящиеся и неплавящиеся. Неплавящиеся изготовляют из… … Энциклопедия терминов, определений и пояснений строительных материалов
Сварочные электроды делятся на плавящиеся и неплавящиеся. Неплавящиеся изготовляют из… … Энциклопедия терминов, определений и пояснений строительных материалов
Какие электроды бывают | Что такое электрод
Какие электроды лучше для инвертора
Для Вашего инвертора мы рекомендуем использовать сварочные электроды ООО Ватра. Электроды выпускаются на заводе уже с 1992 года их состав постоянно совершенствуется.
В выпускаемой линейке вы найдете все электроды для ручной дуговой сварки с разным покрытием. Низкие цены, полный ассортимент и использование мировых производственных компаний наших электродов –это несомненно конкурентное преимущество на рынке.
У нас на сайте вы можете оставить заказ на пробную пачку для испытаний. Мы всегда открыты для наших клиентов.
Как правильно выбрать ток при сварке
Для правильного выбора сварочного тока можно воспользоваться таблицей в которой приведен расчет по формуле:
Ток = 1 мм диаметра электрода * от 30 до 40 А сварочного тока
Имеем электроды диаметром 3 мм, то диапазон сварочного тока будет равен от 90 до 120 А.
Для того, чтобы варить электродом 3 мм сварочный аппарат должен иметь максимальный ток не менее 120 А.
Важно: при сварке вертикальных и потолочных швов, силу тока уменьшают на 10-20%
|
Диаметр электрода, мм |
Сварочный ток, А |
|
1,6 |
35-60 |
|
2,0 |
30-80 |
|
2,5 |
50-110 |
|
3,0 |
70-130 |
|
3,2 |
80-140 |
|
4,0 |
110-170 |
|
5,0 |
150-220 |
Как правильно выбрать электроды
При подборе электродов специалист по продажам Вам задаст несколько вопросов от которых зависит выбор того или иного сварочного материала.
Выбор электрода и его диаметра напрямую зависит от свариваемого материала. Электрод –это металлический стержень с нанесенным на него электродным покрытием. Состав стержня электрода должен быть похож по составу на свариваемый материал. А толщина электрода зависит от толщины свариваемого изделия. В таблице вы найдете рекомендации по выбору электрода.
|
Толщина металла, мм |
Диаметр электрода, мм |
|
2-3 |
1,6 / 2,0 |
|
3-5 |
2,0 / 2,5 / 3,0 / 3,2 / 4,0 |
|
5-8 |
3,0 / 3,2 / 4,0 / 5,0 |
Какие методы сварки бывают
При выборе сварочных материалов и аппарата для сварки немаловажную роль играет требования, которые будут предъявляться к качеству шва, производительность, мобильность оборудования. Для этого надо разобраться в методах сварки и выбрать подходящий именно Вам изучив выгоды и преимущества каждого.
Для этого надо разобраться в методах сварки и выбрать подходящий именно Вам изучив выгоды и преимущества каждого.Сварочный процесс делится на несколько видов сварки: ММА сварка, MIG/MAG, TIG.
1. ММА сварка – это ручная дуговая сварка штучным электродом с разным покрытием и применением инверторного аппарата. Именно эта сварка самая распространенная из-за своих выгод в использовании.Выгоды ММА сварки:
- Доступный процесс сварки даже для новичка.
- Экономный вариант.
- Сварка во всех положениях.
- Быстрая смена электрода и свариваемого материала.
- Отсутствие газовых баллонов.
Минусы ММА сварки:
- Невысокая производительность.
- Удаление шлака с детали.
При такой сварке необходимо следить за рекомендациями на упаковке электродов и правильно подключать полярность. Если полярность будет не соблюдена, то на выходе получим плохую дугу.

2. MIG/MAG сварка – это сварка в среде защитного газа. Применяется аргон, гелий, или смеси.
Сварка происходит на постоянном токе прямой и обратной полярности. Для сварки используют сварочную проволоку.
Достоинства:
- Большая производительность.
- Сварка тонкого металла.
Недостатки:
- Наличие газового баллона.
- Дорогие расходники.
3.Сварка TIG- это сварка неплавящимся вольфрамовым электродам в защитной газовой среде. Применяют для сварки цветных металлов и нержавейки.
Преимущества:
- Аккуратный сварной шов.
- Сварка без брызг.
- Для металлов от 0,8 мм.
Недостатки:
- Необходим опыт при проведении сварочных работ.
-
Ограниченная производительность.

Слово ЭЛЕКТРОД — Что такое ЭЛЕКТРОД?
Слово состоит из 8 букв: первая э, вторая л, третья е, четвёртая к, пятая т, шестая р, седьмая о, последняя д,
Слово электрод английскими буквами(транслитом) — elektrod
Значения слова электрод. Что такое электрод?
Электрод
Электрод (Электро- + греч. hodos путь, направление) в медицине — конструктивный элемент электронного или электротехнического диагностического прибора, физиотерапевтического или хирургического аппарата (установки)…
Медицинская эциклопедия
Электрод — в ЭЭГ — датчик, с помощью которого осуществляется отведение биоэлектрической активности от различных мозговых структур.
glossary.ruЭлектрод фиксируются на голове с помощью специальных шлемов или резиновых полос.
Электроды
ЭЛЕКТРОДЫ в электрохимии, электронно-проводящие фазы, контактирующие с ионным проводником (электролитом). Часто под электродом понимают лишь одну электронно-проводящую фазу. При пропускании тока от внеш. источника через систему из двух электродов…
Химическая энциклопедия
Электроды* — Электродами называют части проводников гальванической цепи, погруженные в вещества (см. Электролит), подвергаемые действию гальванического тока.
Энциклопедический словарь Ф.А. Брокгауза и И.А. Ефрона. — 1890-1907
Электродом называют проводники, имеющие электронную проводимость (проводники 1-го рода) и находящиеся в контакте с ионным проводником.
ru.wikipedia.orgВ электрохимии — часть электрохимической системы…
Электрод сравнения
ЭЛЕКТРОДЫ СРАВНЕНИЯ, электрохим. системы, предназначенные для измерения электродных потенциалов. Необходимость их использования обусловлена невозможностью измерения абс. величины потенциала отдельного электрода.
Химическая энциклопедия
ЭЛЕКТРОДЫ СРАВНЕНИЯ — электрохим. системы, предназначенные для измерения электродных потенциалов. Необходимость их использования обусловлена невозможностью измерения абс. величины потенциала отдельного электрода.
Химическая энциклопедия. — 1988
Электроды сравнения — электрохимические системы, предназначенные для измерения электродных потенциалов. Необходимость их использования обусловлена невозможностью измерения величины потенциала отдельного электрода.
ru.wikipedia.org
Активный электрод
Электрод активный. 1) Э. электрокардиографа, предназначенный для регистрации разности потенциалов между данной точкой тела и объединенным Э.; используется при записи однополюсных и усиленных однополюсных отведений электрокардиограммы; 2) Э.
Большой медицинский словарь. — 2000
Активный электрод — электрод, находящийся непосредственно над мозговыми структурами или внедренный в мозг.
glossary.ru
ДИСКОВЫЙ ЭЛЕКТРОД
ДИСКОВЫЙ ЭЛЕКТРОД вращающийся, особая форма твердого электрода, применяемого для электрохим. и электроаналит. исследований. На его использовании основан соответствующий метод исследования.
Химическая энциклопедия
ДИСКОВЫЙ ЭЛЕКТРОД — вращающийся, особая форма твердого электрода, применяемого для электрохим.
Химическая энциклопедия. — 1988и электроаналит. исследований. На его использовании основан соответствующий метод исследования.
Каломельный электрод
Каломельный электрод — электрод, использующийся в качестве электрода сравнения в гальванических элементах. Каломельный электрод состоит из платиновой проволочки, погружённой в каплю ртути…
ru.wikipedia.org
КАЛОМЕЛЬНЫЙ ЭЛЕКТРОД, см. Электроды сравнения. === Исп. литература для статьи «КАЛОМЕЛЬНЫЙ ЭЛЕКТРОД»: нет данных. Страница «КАЛОМЕЛЬНЫЙ ЭЛЕКТРОД» подготовлена по материалам химической энциклопедии…
Химическая энциклопедия
КАЛОМЕЛЬНЫЙ ЭЛЕКТРОД — электрод сравнения, изготовленный с использованием ртути Hg, каломели Hg 2Cl 2 и вод. р-ра хлорида калия КС1.
Словарь естествознанияПотенциал насыщенного (по КС1) К. э при 25 0С равен 0,2412 В.
СУСПЕНЗИОННЫЙ ЭЛЕКТРОД
СУСПЕНЗИОННЫЙ ЭЛЕКТРОД, электрохим. электрод в виде взвешенных в электролите токопроводящих частиц. В отличие от псевдоожиженного электрода, представляет собой разбавленную суспензию сравнительно мелких частиц…
Химическая энциклопедия
СУСПЕНЗИОННЫЙ ЭЛЕКТРОД , электрохим. электрод в виде взвешенных в электролите токопроводящих частиц. В отличие от псевдоожиженного электрода, представляет собой разбавленную суспензию сравнительно мелких частиц…
Химическая энциклопедия. — 1988
ПСЕВДООЖИЖЕННЫЙ ЭЛЕКТРОД
ПСЕВДООЖИЖЕННЫЙ ЭЛЕКТРОД, электрохим. электрод из порошкообразного материала, взвешенного в электролите.
Химическая энциклопедияПредставляет собой подвижную концентрированную (дисперсная фаза составляет неск. десятков % по объему)…
ПСЕВДООЖИЖЕННЫЙ ЭЛЕКТРОД , электрохим. электрод из порошкообразного материала, взвешенного в электролите. Представляет собой подвижную концентрированную (дисперсная фаза составляет неск. десятков % по объему)…
Химическая энциклопедия. — 1988
ИОНОСЕЛЕКТИВНЫЕ ЭЛЕКТРОДЫ
ИОНОСЕЛЕКТИВНЫЕ ЭЛЕКТРОДЫ, электрохим. электроды, равновесный потенциал к-рых в р-ре электролита, содержащем определенные ионы, обратимо и избирательно зависит от концентрации этих ионов.
Химическая энциклопедия
ИОНОСЕЛЕКТИВНЫЕ ЭЛЕКТРОДЫ — электрохим. электроды, равновесный потенциал к-рых в р-ре электролита, содержащем определенные ионы, обратимо и избирательно зависит от концентрации этих ионов.
Химическая энциклопедия. — 1988
Русский язык
Электро́д, -а.
Орфографический словарь. — 2004
Примеры употребления слова электрод
Если до реконструкции при плавке слитка вовлекалось не более 15% отходов, то помолодевшая «жаровня» способна вплавить в электрод до 35% стружки от общей массы слитка.
Так как с помощью данного метода можно отделить только один электрод, то и дает он всего одну точку и исследователям пришлось собрать данные около 20 тысяч отдельных электронов различных атомов чтобы вывести усредненное изображение электронных оболочек.
В требуемую для терапии область головного мозга хирургическим путем вводится электрод, который представляет собой длинный, тонкий изолированный провод, соединенный другим проводом с электронейростимулятором, который, как правило, имплантируется в область ключицы.
- электродрель
- электродренаж
- электродуговой
- электрод
- электроемкий
- электроемкость
- электрозаводский
Что такое электрод?
А Вы знаете, что такое электрод?
Что такое электрод?Электрод
Электрод представляет собой проводник, который пропускает электрический ток от одной среды к другой, обычно от источника питания до устройства или материала. Он может принимать различные формы, включая проволоку, пластину или стержень, и чаще всего изготавливается из металла, такого как медь, серебро, свинец или цинк, но может также быть изготовлен из неметаллического вещества который проводит электричество, такое как графит. Электроды используются в сварке, гальванике, батареях, медицине и в промышленности для процессов, связанных с электролизом.
Аноды и катоды
Человек сдает ЭКГ. В ЭКГ электроды размещаются на коже для обнаружения электрической активности сердца.
В ЭКГ электроды размещаются на коже для обнаружения электрической активности сердца.В случае прямого (постоянного) тока электроды попадают парами и известны как аноды и катоды. Для батареи или другого источника постоянного тока катод определяется как электрод, из которого выходит ток, и анод в качестве точки, где он возвращается. По причинам, которые являются историческими, а не научными, электричество в цепи, по соглашению, изображается как движение от положительного к отрицательному, так что оно рассматривается как поток положительного заряда из катода и в анод. Электрический ток, однако, состоит из потока крошечных отрицательно заряженных частиц, называемых электронами, поэтому этот поток фактически находится в противоположном направлении.
В этом контексте, вероятно, лучше думать просто с точки зрения положительных и отрицательных терминалов.
Приварная сварка использует расходуемый электрод, покрытый флюсом, чтобы уложить борт.
Внутри батареи или электрохимической ячейки электроды изготовлены из разных материалов, одна из которых дает электроны легче, чем другие. Они содержатся в контакте с проводящим химическим веществом, которое может расщепляться на положительно и отрицательно заряженные ионы. Когда цепь завершена, другими словами, когда аккумулятор подключен к электрическому устройству, например лампочке, в ячейке происходит окислительно-восстановительная реакция. Это означает, что проводящий химикат получает электроны на одном электроде — процесс, известный как редукция, — и теряет их в другом — процесс, называемый окислением, — в результате электроны текут как ток вокруг контура. Редукция всегда происходит на катоде и окисление на аноде.
Они содержатся в контакте с проводящим химическим веществом, которое может расщепляться на положительно и отрицательно заряженные ионы. Когда цепь завершена, другими словами, когда аккумулятор подключен к электрическому устройству, например лампочке, в ячейке происходит окислительно-восстановительная реакция. Это означает, что проводящий химикат получает электроны на одном электроде — процесс, известный как редукция, — и теряет их в другом — процесс, называемый окислением, — в результате электроны текут как ток вокруг контура. Редукция всегда происходит на катоде и окисление на аноде.
В перезаряжаемой батарее этот процесс отменяется во время зарядки аккумулятора. Электрический ток от другого источника используется для питания окислительно-восстановительной реакции в противоположном направлении, что означает, что анод становится катодом и наоборот. По-прежнему происходит восстановление на катоде и окисление на аноде, но направление тока меняется на противоположное, поэтому электрод отрицателен и положителен, зависит от того, подает ли аккумулятор ток или подзарядка. Иногда клетки соединяются друг с другом электродом, который действует как анод для одной ячейки, а катод — для другого. Это известно как биполярный электрод.
Иногда клетки соединяются друг с другом электродом, который действует как анод для одной ячейки, а катод — для другого. Это известно как биполярный электрод.
В случае переменного (переменного) тока не существует различия между анодом и катодом. Это связано с тем, что ток постоянно меняет направление, много раз в секунду. Поэтому электрод, использующий этот тип тока, постоянно переключается между отрицательным и положительным.
Электролиз
Электрические импульсы мозга появляются как волнистые линии на записи ЭЭГ.Для получения данного элемента ионное соединение этого элемента может быть электролизовано.
Примером может служить производство металлического натрия из расплавленной соли или хлорида натрия.
Когда ток течет, положительно заряженные ионы натрия притягиваются к отрицательному электроду или катоду, где они получают электроны, образуя металл натрия.
Отрицательно заряженные ионы хлорида притягиваются к аноду, где они теряют электроны, образуя газообразный хлор, который также собирается в виде побочного продукта.
Гальванопокрытие
В этом процессе металлический предмет покрыт другим металлом для улучшения его коррозионной стойкости или внешнего вида. Объект, который должен быть покрыт, образует катод в процессе электролиза путем погружения в раствор растворимого соединения металла, который образует покрытие, причем анод также изготавливается из этого металла. Когда ток течет, положительные ионы металлов из раствора притягиваются к катоду и образуют на нем осадок. Когда ионы в растворе израсходованы, они заменяются ионами, которые образуются из анода. Иногда анод изготавливается из другого материала, который не используется; в этом методе ионы металлов должны быть заменены пополнением раствора.
Электроды ЭЭГ размещаются вокруг головы, чтобы собирать электрические импульсы из мозга и направлять их на тип машины, который используется в качестве диагностического инструмента для анализа активности мозга.Другие виды использования
Врач может заказать ЭЭГ для пациентов, страдающих головными болями.
Электроды используются в дуговой сварке, метод соединения двух металлических частей с использованием большого электрического тока. Расходный электрод расплавляется и обеспечивает материал, который соединяет металлы.
Не расходуемый тип изготавливается из материала с очень высокой температурой плавления, такого как вольфрам, и просто обеспечивает тепло для расплавления другого материала, который образует соединение.
В медицине электроды могут использоваться в чрезвычайной ситуации для применения электрического тока к сердцу в технике, известной как дефибрилляция. Они также используются для регистрации электрической активности в головном мозге во время электроэнцефалограммы (ЭЭГ).
Электроэнцефалограмма — или ЭЭГ — машина измеряет электрическую импульсную активность в головном мозге и может помочь диагностировать такие состояния, как эпилепсия.Определение электрода по Merriam-Webster
электрод | \ i-ˈlek-ˌtrōd \ 1 : проводник, используемый для установления электрического контакта с неметаллической частью цепи. 2 : элемент в полупроводниковом устройстве (например, транзисторе), который излучает или собирает электроны или дырки или контролирует их движение.
2 : элемент в полупроводниковом устройстве (например, транзисторе), который излучает или собирает электроны или дырки или контролирует их движение.Что такое электрод? | USESI
Электрод — это точка, в которой ток входит в электролит и выходит из него. Когда ток покидает электрод, он называется катодом, а когда он входит, он известен как анод. Электроды переносят электроны от одной половины ячейки к другой, создавая электрический заряд. Заряд измеряется с помощью стандартной электродной системы (SHE) с опорным потенциалом 0 вольт, который служит средой для любого расчета потенциала ячейки. Электроны — жизненно важные компоненты электрохимических ячеек.
Когда ток покидает электрод, он называется катодом, а когда он входит, он известен как анод. Электроды переносят электроны от одной половины ячейки к другой, создавая электрический заряд. Заряд измеряется с помощью стандартной электродной системы (SHE) с опорным потенциалом 0 вольт, который служит средой для любого расчета потенциала ячейки. Электроны — жизненно важные компоненты электрохимических ячеек.
Механика электрода
Электрод — это металл, и его поверхность служит местом, где устанавливается окислительно-восстановительное равновесие между металлом и раствором, каким бы он ни был.Если электрод является анодом, он получает ток или электроны от смеси электролитов и окисляется. Когда атомы или молекулы приближаются к поверхности электрода, раствор, в котором находится электрод, отдает электроны, в результате чего атомы становятся положительными ионами.
Из чего сделан электрод?
Электроды обычно состоят из металлов, но их тип зависит от того, участвует ли он в реакции. Для некоторых реакций требуется инертный электрод, который не участвует. Для других реакций требуются твердые формы реагентов, что делает их электродами.Обычно используемые инертные электроды могут быть изготовлены из графита, платины, золота или родия. Реактивные электроды могут быть из меди, цинка, свинца или серебра.
Для некоторых реакций требуется инертный электрод, который не участвует. Для других реакций требуются твердые формы реагентов, что делает их электродами.Обычно используемые инертные электроды могут быть изготовлены из графита, платины, золота или родия. Реактивные электроды могут быть из меди, цинка, свинца или серебра.
Стандартный водородный электрод
Стандартный водородный электрод используется учеными для справки по всем реакциям с половинным потенциалом ячейки. Стандартный потенциал электрода равен нулю, что составляет основу, необходимую для расчета потенциалов ячеек с использованием электродов различной концентрации. Стандартный водородный электрод состоит из 1.0 M раствор H +, содержащий квадратный кусок платинированной платины внутри трубки.
Электроды в действии
Электроды служат местом удержания электронов. Вы можете соединить электроны с помощью терминала, но ничего не произойдет, пока вы не установите солевой мостик между двумя контейнерами. Обычно это полая U-образная трубка, заполненная солью. Это позволит ионам перемещаться из одного контейнера в другой, сохраняя нейтралитет раствора.
Обычно это полая U-образная трубка, заполненная солью. Это позволит ионам перемещаться из одного контейнера в другой, сохраняя нейтралитет раствора.
Как только электроны начинают течь, цинк окисляется и высвобождает электроны, которые проходят через провод к медному электроду, где их можно использовать для образования медных металлов.Ионы меди из раствора сульфата меди осаждаются на медном электроде, в то время как цинковый электрод расходуется.
Катионы в солевом мостике перемещаются по контейнеру, а медные электроды заменяют ионы меди, пока они потребляются, в то время как анионы в солевом мостике мигрируют в сторону цинка, где они сохраняют раствор, содержащий вновь образованные катионы цинка, электрически нейтральным.
В этом случае цинковый электрод работает как анод, где происходит окисление, и помечен знаком «-», в то время как медный электрод работает как катод, где происходит восстановление, и может быть помечен знаком «-». Знак «+».
Трехэлектродная система
Трехэлектродная система — важная часть вольтамперометрии, электрохимического метода, который измеряет ток, возникающий в электрохимической ячейке в условиях, когда напряжение превышает прогнозируемое.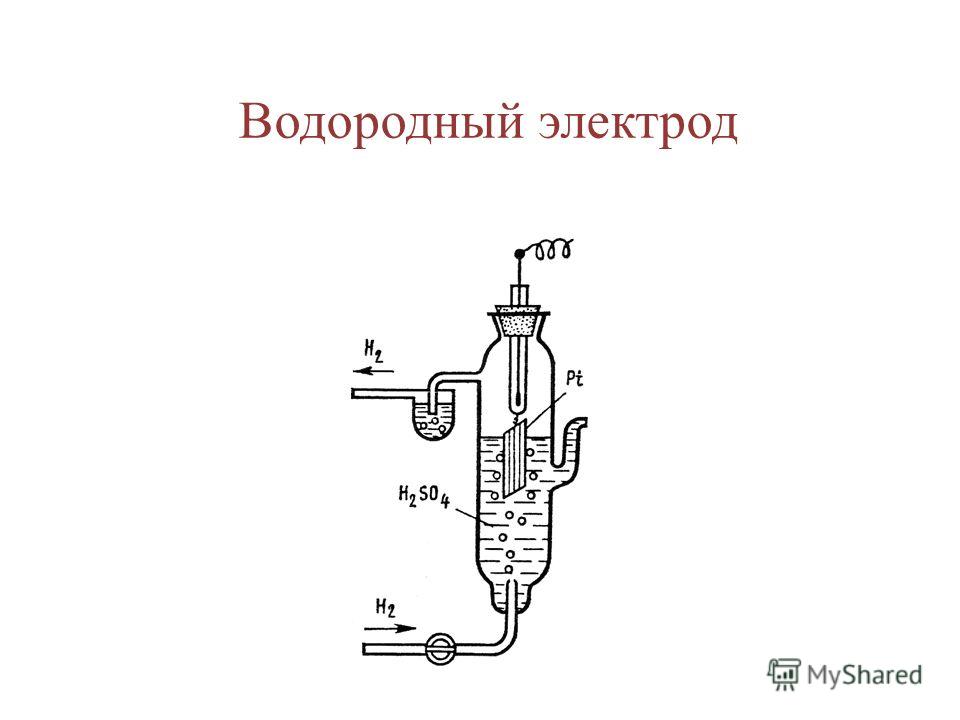 Три электрода в этой системе — это рабочий электрод, электрод сравнения и вспомогательный электрод. Электрод сравнения имеет установленный электродный потенциал. В электрохимической ячейке электрод сравнения может использоваться как полуячейка.Это позволяет обнаружить электродный потенциал другой половины ячейки.
Три электрода в этой системе — это рабочий электрод, электрод сравнения и вспомогательный электрод. Электрод сравнения имеет установленный электродный потенциал. В электрохимической ячейке электрод сравнения может использоваться как полуячейка.Это позволяет обнаружить электродный потенциал другой половины ячейки.
Вспомогательный электрод предназначен для предотвращения прохождения тока через ячейку сравнения. Он гарантирует, что ток равен току рабочего электрода. Рабочий электрод переносит электроны к присутствующим веществам и от них.
Вот некоторые примеры эталонных ячеек:
Каломелевый электрод: он состоит из молекул ртути и хлорида ртути, его проще изготавливать и обслуживать, чем SHE.Необходимо, чтобы раствор был насыщенным, чтобы активность могла фиксироваться хлоридом калия, чтобы напряжение было ниже и ближе к SHE. Насыщение также позволит обмену ионами хлора происходить внутри солевого мостика.
Электрод серебро-хлорид серебра: этот электрод осаждает соль в растворе, который используется в электродной реакции. Он состоит из твердого серебра и его осажденной соли. Это широко используемый электрод сравнения, поскольку он недорог и не так токсичен, как каломельный электрод, содержащий ртуть.Его получают, взяв твердую серебряную оболочку и закодировав ее в AgCl, а затем поместив в раствор KCl и AgCl. Ионы будут образовываться по мере того, как электроны входят в систему электродов и выходят из нее.
Он состоит из твердого серебра и его осажденной соли. Это широко используемый электрод сравнения, поскольку он недорог и не так токсичен, как каломельный электрод, содержащий ртуть.Его получают, взяв твердую серебряную оболочку и закодировав ее в AgCl, а затем поместив в раствор KCl и AgCl. Ионы будут образовываться по мере того, как электроны входят в систему электродов и выходят из нее.
Электроды — важная часть работы электричества. Интересно узнать больше о науке, стоящей за ними, и о том, как они действуют в электрическом процессе. Те, кто заинтересован, должны быть поощрены, чтобы узнать больше об электрическом процессе и о том, как электроды участвуют в простых функциях, которые мы видим каждый день.
Определение и значение электрода | Словарь английского языка Коллинза
Примеры ‘электрод’ в предложении
электрод
Эти примеры были выбраны автоматически и могут содержать конфиденциальный контент.Подробнее… Затем они прикрепили электроды к основным мышцам.
Times, Sunday Times (2016)
Цель заключалась в том, чтобы проверить, могут ли инвалиды использовать электроды для перемещения искусственной руки.Times, Sunday Times (2013)
Итак, в его доме установлена камера, а на голове установлены электроды для наблюдения за мозговой активностью.The Sun (2008)
Некоторые электроды затем использовались для записи сигналов, а некоторые — для подачи данных извне.Times, Sunday Times (2011)
Они также поместили электроды на кожу цыплят, чтобы определить точные движения мышц, лежащие в основе каждого этапа кормления.Times, Sunday Times (2014)
Солдаты будут слышать сообщение либо в микрофон, либо через электроды, помещенные в слуховую кору их мозга.The Times Literary Supplement (2014)
Считается, что одной из причин может быть то, что в имплантатах используются жесткие электроды, которые со временем могут повредить ткань мозга.Times, Sunday Times (2008)
Они использовали электроды, имплантированные в черепа грызунов, чтобы измерить, как препарат влияет на электрическую активность сотен нейронов.
Times, Sunday Times (2011)
Парализованный мужчина снова начал ходить благодаря электронному устройству, которое подключало сигналы его мозга к электродам, прикрепленным к его ногам.Times, Sunday Times (2015)
Никаких наркотиков, только электроды, прикрепленные к нерву, который проходит по шее.Times, Sunday Times (2011)
Подробнее…
Во время операции к его мышцам были прикреплены электроды, позволяющие интуитивно контролировать движения.Times, Sunday Times (2014)
Итак — обычная практика — в его мозг втыкают электроды, чтобы пробудить память.Times, Sunday Times (2008)
Небольшие электрические импульсы доставляются к телу через электроды, размещенные на коже, и считается, что они влияют на путь, которым болевые сигналы достигают мозга.Times, Sunday Times (2007)
В рамках калифорнийской программы электроды вводили в мозг взрослых зеленых июньских жуков рядом с клетками мозга, которые управляют полетом.The Sun (2008)
Это также очень серьезное вмешательство, требующее размещения электродов внутри мозга с проводами, выходящими из черепа.
Times, Sunday Times (2016)
У нее также есть рюкзак на плечах и брезентовые ремни, свисающие с ее ног, — верный признак того, что электроды прикреплены к обеим икрам.Times, Sunday Times (2007)
ЖЕНЩИНЕ ввели электроды в мозг во время экспериментальной операции, чтобы попытаться вылечить ее анорексию.The Sun (2015)
Electrode — Energy Education
Рисунок 1.Упрощенная схема гальванического элемента с цинковыми и медными электродами для замыкания цепи через неметаллическую среду.
Электрод — это проводник, который используется для контакта с неметаллической частью цепи. [1] Электроды обычно используются в электрохимических ячейках (см. Рис. 1), полупроводниках, таких как диоды, и в медицинских устройствах.
Электрод классифицируется как катод или анод в зависимости от того, течет ли ток в электрод или из него.Обычный ток течет в устройство через его анод и покидает устройство через катод. [2]
Анод и катод
Рисунок 2. Упрощенная схема, показывающая анод и катод топливного элемента. Обратите внимание, что стрелки на диаграмме показывают поток электронов. Обычный ток будет в обратном направлении.
Упрощенная схема, показывающая анод и катод топливного элемента. Обратите внимание, что стрелки на диаграмме показывают поток электронов. Обычный ток будет в обратном направлении.Путаница возникает при определении анодов и катодов из-за неоднозначности термина «ток». Электронный поток — это правильный способ представить себе ток, при котором отрицательно заряженные электроны движутся по цепи.Однако до того, как было установлено, что отрицательные носители заряда ответственны за ток, предполагалось, что положительные заряды движутся, создавая ток. [3] . Поскольку нет практических различий в двух способах описания тока, традиционное определение сохранилось для некоторых технических терминов схемы. Вот почему катод определяется как электрод, с помощью которого обычный ток покидает устройство, а анод — как электрод, с помощью которого обычный ток возвращается к нему (см. Рисунок 2). [2]
Аноды и катоды используются в поляризованных электрических компонентах, включая батареи, [[фотоэлектрические элементы]], электролитические элементы, диоды и топливные элементы.
Ячейки электрохимические
В гальванических и электролитических элементах катод — это электрод, на котором происходит восстановление, а на аноде происходит окисление. Этот способ определения катодов и анодов более широко используется в химии. [4] Любые анионы или катионы в ячейке также будут притягиваться к аноду и катоду соответственно (см. Рисунок 1).
Список литературы
Электрод— Введение, типы и применение
Электроды являются хорошими проводниками электричества. Электроды используются для контакта между неметаллическими частями цепи, такими как электролит, полупроводники, воздух и т. Д. Слово «электрод» состоит из двух греческих слов «электрон», что означает «янтарь», и «ходос», что означает «путь». Слово электрод было придумано Уильямом Уэвеллом.
Что такое электрод?
Электрод можно определить как точку, в которой ток входит или выходит из электролита или цепи. Когда ток покидает электрод, он известен как катод, а когда ток входит в электрод, он известен как анод.
Когда ток покидает электрод, он известен как катод, а когда ток входит в электрод, он известен как анод.
Электроды являются основным компонентом электрохимических ячеек. Электрод обязательно должен хорошо проводить электричество. Хотя существует и инертный электрод, который в реакции не участвует. Электрод может быть из золота, платины, углерода, графита, металла и т. Д. Электрод обеспечивает поверхность для окислительно-восстановительных реакций в ячейках.
Катод и анод в электрохимических ячейках
В электрохимической ячейке электрод называют катодом или анодом. Анод может быть определен как электрод, на котором электроны покидают ячейку и происходит окисление, в то время как катод может быть определен как электрод, на котором электроны входят в ячейку и происходит восстановление. Любой из двух электродов может стать анодом или катодом в зависимости от направления тока через ячейку. Электрод, который может функционировать как анод в одной ячейке, а катод в другой, называется биполярным электродом.
Первичные ячейки — это те электрохимические ячейки, в которых происходят необратимые реакции, поэтому в этих тождествах катода и анода фиксируются. В этих ячейках анод всегда будет отрицательным или при этом всегда будет происходить окисление. Катод всегда будет положительным или при этом всегда будет происходить уменьшение. Примером первичного элемента является гальванический элемент.
Вторичные элементы или электролитические элементы являются перезаряжаемыми, это означает, что в этих элементах происходят обратимые химические реакции.В этих ячейках анод всегда положительный, а катод всегда отрицательный.
Типы электродов
Электроды в основном бывают двух типов — реактивные электроды и инертные электроды
Реактивные электроды — это те электроды, которые участвуют в реакции, происходящей в ячейке, и могут растворяться в электролите. Пример реактивного электрода — медный электрод, серебряный электрод, цинковый электрод, медный электрод и т. Д. Они в основном используются в потенциометрической работе.
Инертные электроды — это электроды, которые не участвуют в реакции. Примеры инертного электрода — угольный электрод, платиновый электрод и т. Д.
Использование электродов
Электроды используются для обеспечения контакта между неметаллическими компонентами цепи в ячейке.
Электроды используются для измерения проводимости.
Они используются в топливных элементах транспортных средств.
Они используются в медицинских целях, таких как ЭЭГ, ЭКГ, ЭСТ и дефибриллятор.
Они используются для электрофизиологических методов в биомедицинских исследованиях.
Используются в исполнении электрического стула.
Используются для гальваники.
Используются для дуговой сварки.
Используются для заземления.
Применяются в электрохимии.
Используются для химического анализа веществ.
Они используются в сборке мембранных электродов.
Применяются в электрошоковом оружии.
Вы также можете прочитать другие статьи по теме, доступные на Vedantu, такие как Cathode and Anode, Electrochemical cell и т.д. для класса 6-10 IITJEE & NEET.
терминология — Что такое электрод?
Учитывая это определение, означает ли это, что каждый электрический компонент, имеющий электроды (т.е.е. анод или катод), это неметаллическая часть?
Согласно этому определению, чтобы иметь электроды, компонент должен иметь неметаллические части. Но он не может быть полностью неметаллическим, поскольку электроды являются частью компонента, и они металлические. Например, вакуумная трубка обычно изготавливается из металла, стекла и пустого пространства (вакуума). Он имеет как металлические, так и неметаллические компоненты.
А в чем конкретно польза электрода? Он просто используется для обозначения полярности?
Электроды обычно представляют собой путь, по которому ток течет в компонент и выходит из него.Точный используемый металл может повлиять на характеристики детали, например, в диоде Шоттки.
Название электрода зависит от полярности: электрод, через который ток протекает к компоненту, называется анодом , , а электрод, через который протекает ток, называется катодом , . В случае стабилитронов этими определениями несколько злоупотребляют.
Существуют ли другие типы помимо анода или катода?
Устройство с более чем двумя электродами (например, транзистор или триод, тетрод или пентодная вакуумная лампа) обязательно имеет электроды, которые не называются анодом или катодом.
В электронных лампах обычно есть анод, катод и один или несколько электродов с сеткой .
В транзисторе нет анода или катода, только база , эмиттер и коллектор для BJT или затвор , сток и исток для MOSFET.
Могу ли я использовать электрод как синоним полюса?
Я не знаю ни одного случая, когда это имело бы смысл. Обычно мы говорим о магнитах, имеющих полюса , и электронных устройствах с электродами , выводами , выводами , выводами , контактами , выводами и т. Д.
, если электрод зависит от пути, по которому ток течет в компонент и выходит из него, то означает ли это, что катод может переключать контакты компонента, если ток меняется на противоположное?
В принципе, это правда. На практике мы выбираем один терминал устройства для вызова катода, а другой — для вызова анода, исходя из «нормальных» условий использования, и мы не меняем имена при изменении направления тока. В случае стабилитронов мы даже называем катод и анод в соответствии с тем, как они были бы, если бы часть была выпрямительным диодом, но обычно мы используем стабилитрон с током, протекающим через клемму, которую мы называем «катодом».
электрохимических ячеек | Химия [Магистр]
Гальванические элементы
Гальванический элемент — это устройство, которое вырабатывает электрический ток из энергии, выделяющейся в результате спонтанной окислительно-восстановительной реакции в двух полуячейках.
Цели обучения
Напомним, что восстановление происходит на катоде, а окисление происходит на аноде в гальваническом элементе
Основные выводы
Ключевые моменты
- Окисление описывает потерю электронов молекулой, атомом или ионом.
- Редукция описывает усиление электронов молекулой, атомом или ионом.
- Электроны всегда текут от анода к катоду.
- Полуячейки соединены солевым мостиком, который позволяет ионам в растворе перемещаться из одной полуячейки в другую, так что реакция может продолжаться.
Ключевые термины
- редокс : обратимая химическая реакция, в которой одна реакция является окислением, а обратная — восстановлением.
- полуэлемент : любая из двух частей электрохимической ячейки, содержащая электрод и электролит.
- гальванический элемент : Элемент, например аккумулятор, в котором в результате необратимой химической реакции вырабатывается электричество; аккумулятор, который нельзя перезарядить.
Электрохимическая ячейка — это устройство, вырабатывающее электрический ток из энергии, выделяющейся в результате спонтанной окислительно-восстановительной реакции. Этот вид ячейки включает гальваническую или гальваническую ячейку, названную в честь Луиджи Гальвани и Алессандро Вольта.Эти ученые провели несколько экспериментов с химическими реакциями и электрическим током в конце 18 века.
Электрохимические ячейки имеют два токопроводящих электрода, которые называются анодом и катодом. Анод определяется как электрод, на котором происходит окисление. Катод — это электрод, на котором происходит восстановление. Электроды могут быть изготовлены из любых достаточно проводящих материалов, таких как металлы, полупроводники, графит и даже проводящие полимеры. Между этими электродами находится электролит, содержащий ионы, которые могут свободно перемещаться.
В гальванической ячейке используются два разных металлических электрода, каждый в растворе электролита. Анод подвергнется окислению, а катод — восстановлению. Металл анода окислится, переходя от степени окисления 0 (в твердой форме) к положительной степени окисления, и он станет ионом. На катоде ион металла в растворе будет принимать один или несколько электронов от катода, и степень окисления иона снизится до 0. Это образует твердый металл, который откладывается на катоде.Два электрода должны быть электрически соединены друг с другом, чтобы обеспечить поток электронов, который покидает металл анода и проходит через это соединение к ионам на поверхности катода. Этот поток электронов представляет собой электрический ток, который можно использовать для работы, например, для поворота двигателя или включения света.
Пример реакции
Принцип действия гальванического элемента — это одновременная реакция окисления и восстановления, называемая окислительно-восстановительной реакцией. Эта окислительно-восстановительная реакция состоит из двух полуреакций.В типичном гальваническом элементе окислительно-восстановительная пара — это медь и цинк, представленные в следующих полуэлементных реакциях:
Цинковый электрод (анод): Zn (s) → Zn 2+ (водн.) + 2 e —
Медный электрод (катод): Cu 2+ (водн.) + 2 e — → Cu (s)
Ячейки построены в отдельных стаканах. — [/ latex]), которые проходят через провод к медному катоду.- \ rightarrow \ text {Cu} [/ latex]). Во время реакции будет использоваться цинковый электрод, и металл будет уменьшаться в размерах, в то время как медный электрод станет больше из-за осажденной меди, которая образуется. Солевой мостик необходим, чтобы заряд не проходил через ячейку. Без солевого мостика электроны, образующиеся на аноде, будут накапливаться на катоде, и реакция прекратится.
Гальванические элементы обычно используются в качестве источника электроэнергии. По своей природе они производят постоянный ток.Батарея — это набор гальванических элементов, соединенных параллельно. Например, свинцово-кислотная батарея имеет элементы, аноды которых состоят из свинца, а катоды — из диоксида свинца.
Ячейки электролитические
Электролиз использует электрическую энергию, чтобы вызвать химическую реакцию, которая затем протекает в электролитической ячейке.
Цели обучения
Вспомните три компонента, необходимые для создания электролитической ячейки
Основные выводы
Ключевые моменты
- Электрометаллургия — это процесс восстановления металлов из металлических соединений для получения металла в чистой форме с помощью электролиза.
- Электролиз иногда можно рассматривать как запуск несамопроизвольного гальванического элемента.
- Электроды из металла, графита и полупроводников широко используются в электролизе.
- Другие системы, в которых используется электролитический процесс, используются для производства металлического натрия и калия, газообразного хлора, гидроксида натрия и хлората калия и натрия.
Ключевые термины
- электролиз : химическое изменение, возникающее при пропускании электрического тока через проводящий раствор или расплав соли.
- электролитический : Относящийся к электролизу или использующий его.
В химии и производстве электролиз — это метод использования постоянного электрического тока (DC) для запуска в противном случае не спонтанной химической реакции. Электролиз является коммерчески важным этапом в процессе отделения элементов из природных источников, таких как руда.
Электролиз — это прохождение постоянного электрического тока через ионное вещество, которое либо расплавлено, либо растворено в подходящем растворителе, что приводит к химическим реакциям на электродах и разделению материалов.
Электролиз иногда можно рассматривать как работу гальванического элемента, не являющегося самопроизвольным. В зависимости от того, насколько свободно элементы отдают электроны (окисление) и насколько энергетически выгодно элементам получать электроны (восстановление), реакция может не быть спонтанной. Путем подачи извне энергии для преодоления энергетического барьера спонтанной реакции желаемая реакция «разрешается» протекать при особых обстоятельствах.
Основные компоненты, необходимые для проведения электролиза:
- Электролит: вещество, содержащее свободные ионы, переносящие электрический ток.Если ионы неподвижны, как в твердой соли, то электролиз не может происходить.
- Источник постоянного тока (DC): обеспечивает энергию, необходимую для создания или разряда ионов в электролите. Электрический ток переносится электронами во внешней цепи.
- Два электрода: электрический проводник, который обеспечивает физический интерфейс между электрической цепью, обеспечивающей энергию, и электролитом.
Типичная электролизная ячейка : Ячейка, используемая в элементарных химических экспериментах для получения газа в качестве продукта реакции и для измерения его объема.
Широко используются электроды из металла, графита и полупроводников. Выбор подходящего электрода зависит от химической активности электрода и электролита, а также от стоимости производства.
Другие системы, в которых используется электролитический процесс, используются для производства металлического натрия и калия, газообразного хлора, гидроксида натрия и хлората калия и натрия.
Обозначение электрохимической ячейки
Обозначение ячейки — это сокращение, которое выражает определенную реакцию в электрохимической ячейке.
Цели обучения
Создание соответствующей записи электрохимической ячейки для данной электрохимической реакции
Основные выводы
Ключевые моменты
- Анод и катод ячейки (полуэлементы) разделены двумя полосами или косыми чертами, которые представляют собой солевой мостик.
- Анод расположен слева, а катод — справа.
- Отдельные твердые, жидкие или водные фазы в каждой полуячейке написаны разделенными одной полосой.
- Концентрации растворенных веществ могут быть указаны в скобках после обозначения фазы (s, l, g или aq).
Ключевые термины
- полуэлемент : любая из двух частей электрохимической ячейки, содержащая электрод и электролит.
- электрод : Клемма, через которую электрический ток проходит между металлическими и неметаллическими частями электрической цепи. При электролизе электроды помещают в раствор отдельно.\ text {o} _ {\ text {окисление}} [/ latex]
Обозначения ячеек — это сокращенное описание гальванических или гальванических (спонтанных) ячеек. Условия реакции (давление, температура, концентрация и т. Д.), Анод, катод и компоненты электрода описаны в этом уникальном сокращении.
Напомним, что окисление происходит на аноде, а восстановление происходит на катоде. Когда анод и катод соединены проволокой, электроны текут от анода к катоду.
Типичный гальванический элемент : Типичное расположение полуэлементов, соединенных в гальванический элемент.- \ rightleftharpoons 2 \ text {Ag} (\ text {s}) [/ latex]
Правила обозначения ячеек
1. Сначала описывается анодный полуэлемент; следует катодная полуячейка. В пределах данной полуячейки сначала указываются реагенты, а последними — продукты. Описание реакции окисления идет первым, а реакция восстановления — последним; когда вы ее читаете, ваши глаза движутся в направлении потока электронов. Ионы зрителя не включены.
2. Одна вертикальная линия (|) проведена между двумя химическими веществами, которые находятся в разных фазах, но находятся в физическом контакте друг с другом (например,г., твердый электрод | жидкость с электролитом). Двойная вертикальная линия (||) представляет собой солевой мостик или пористую мембрану, разделяющую отдельные полуячейки.


 Электрод фиксируются на голове с помощью специальных шлемов или резиновых полос.
Электрод фиксируются на голове с помощью специальных шлемов или резиновых полос. В электрохимии — часть электрохимической системы…
В электрохимии — часть электрохимической системы…
 и электроаналит. исследований. На его использовании основан соответствующий метод исследования.
и электроаналит. исследований. На его использовании основан соответствующий метод исследования. Потенциал насыщенного (по КС1) К. э при 25 0С равен 0,2412 В.
Потенциал насыщенного (по КС1) К. э при 25 0С равен 0,2412 В. Представляет собой подвижную концентрированную (дисперсная фаза составляет неск. десятков % по объему)…
Представляет собой подвижную концентрированную (дисперсная фаза составляет неск. десятков % по объему)…